Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Гидросульфит натрия
Брутто-формула:
HNaO3S
CAS# 7631-90-5
Категории:
Неорганические соли
, Кислые соли
, Консерванты
PubChem CID: 23665763
| CHEBI:26709
| ChemSpider ID: 571016
Названия
Русский:
- Гидросульфит натрия
- Е222
- Сернистокислый натрий кислый
- бисульфит натрия
English:
- E222
- Sodium bisulfite
- Sodium bisulphite
- Sodium hydrogen sulfite
- Sulfurous acid, monosodium salt
- sodium hydrogensulfite
- sodium;hydrogen sulfite(IUPAC)
Варианты формулы:
NaHSO3
Na(+1)H(+1)S(+4)O(-2)3
HO/S`|O|O^-/0Na^+
H-O-S<`||O>-O-Na
H/OS|O`|/O^-hNa^+
Na^+O//S<_(A75)O^->_(A15)OH
Вещества, имеющие отношение…
Анион:
Гидросульфиты
Химический состав
Реакции, в которых участвует Гидросульфит натрия
-
4NaHSO3 «0^oC,e-«—> 2Na2S2O4 + O2″|^» + 2H2O
-
2Na2S2O4 + H2O «T»-> 2NaHSO3 + Na2SO3S
-
2Na2S2O4 + HCl + H2O «20^oC»—> 3NaHSO3 + S»|v» + NaCl
-
2Na2S2O4 + O2 + 2H2O -> 4NaHSO3
-
4NaHSO3 + Zn «20^oC»—> Na2S2O4 + Na2SO3 + ZnSO3 + 2H2O
И ещё 8 реакций…
| Гидросульфит натрия | |
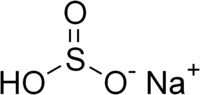 |
|
| Общие | |
|---|---|
| Систематическое наименование | Гидросульфит натрия |
| Сокращения | консервант E222 |
| Химическая формула | NaHSO3 |
| Физические свойства | |
| Состояние (ст. усл.) | Бесцветное кристаллическое вещество с сероватым оттенком |
| Молярная масса | 104.061 г/моль |
| Плотность | 1.48 г/см³ |
| Термические свойства | |
| Температура плавления | 150 °C |
| Температура вспышки | негорюч °C |
| Химические свойства | |
| Растворимость в воде | хорошо растворим в воде |
| Классификация | |
| Рег. номер CAS | 7631-90-5 |
| RTECS | VZ2000000 |
| Безопасность | |
| Токсичность |
1 2 2 |
Гидросульфит натрия (sodium hydrogen sulphite, sodium bisulphite) — антиоксидант и консервант (E222). Химическая формула — NaHSO3.
Свойства
Обладает отбеливающими свойствами; хорошо растворим в воде.
Получение
Если взять только 1 моль основания — то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль — гидросульфит натрия:
Применение
Натрия гидросульфит применяют в легкой, химической и других отраслях промышленности. В пищевой промышленности применяется как консервант или антиокислитель.
Гидросульфит натрия используется почти во всех идущих на экспорт винах для предотвращения окисления и сохранения вкуса. При консервировании фруктов применяется для предотвращения потемнения и для борьбы с микробами. В очень больших концентрациях может вызывать серьёзные аллергические реакции. Используется как консервирующее средство, при белении и крашении тканей.
С 1980х годов гидросульфит натрия запрещён в США к использованию на сырых овощах и фруктах после серии летальных исходов.[1] Вызывает заболевания желудочно-кишечного тракта.
Примечания
- ↑ van der Leun, Justine What’s In Your Food?. AOL Health (July 2009). Архивировано из первоисточника 19 апреля 2012. Проверено 1 августа 2009.
См. также
- Тетраалкиаммониевые соли (формула NR4HSO3)
|
Соединения натрия |
|---|
|
Азид натрия (NaN3) • Альгинат натрия • Алюминат натрия (NaAlO2) • Амид натрия (NaNH2) • Арсенат натрия (Na3AsO4) • Бензилнатрий (NaCH2C6H5) • Бензоат натрия (NaC6H5CO2) • Борогидрид натрия (NaBH4) • Бромат натрия (NaBrO3) • Бромид натрия (NaBr) • Висмутат натрия (NaBiO3) • Вольфрамат натрия (Na2WO4) • Гексагидроксостаннат(IV) натрия (Na2[Sn(OH)6]) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексанитрокобальтат(III) натрия (Na3[Co(NO2)6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гексафторосиликат натрия (Na2[SiF6]) • Гексафторостибат натрия (Na[SbF6]) • Гексафторофосфат(V) натрия (Na[PF6]) • Гексахлороиридат(III) натрия (Na3[IrCl6]) • Гексахлорородат(III) натрия (Na3[RhCl6]) • Германат натрия (Na2GeO3) • Гидрид натрия (NaH) • Гидрокарбонат натрия (NaHCO3) • Гидроксид натрия (NaOH) • Гидросульфат натрия (NaHSO4) • Гидросульфид натрия (NaHS) • Гидросульфит натрия (NaHSO3) • Гидрофосфат натрия (Na2HPO4) • Гипонитрит натрия (Na2N2O2) • Гипофосфит натрия (Na(PH2O2)) • Гипохлорит натрия (NaOCl) • Глутамат натрия (C5H8NNaO4) • Дигидропирофосфат натрия (Na2H2P2O7) • Дигидроортопериодат натрия (Na3H2IO6) • Дигидрофосфат натрия (NaH2PO4) • Диоксоферрат(III) натрия (NaFeO2) • Дитионат натрия (Na2S2O6) • Дитионит натрия (Na2S2O4) • Дихромат натрия (Na2Cr2O7) • Диэтилдитиокарбамат натрия (C5H10NS2Na) • Инозинат натрия (C10H11N2Na2O8P) • Иодат натрия (NaIO3) • Иодид натрия (NaI) • Карбонат натрия (Na2CO3) • Лаурилсульфат натрия (C12H25SO4Na) • Метаарсенит натрия (NaAsO2) • Метаборат натрия (NaBO2) • Метаванадат натрия (NaVO3) • Метадисульфит натрия (Na2S2O5) • Метасиликат натрия (Na2SiO3) • Метафосфат натрия (NaPO3) • Надпероксид натрия (NaO2) • Нитрат натрия (NaNO3) • Нитрид натрия (Na3N) • Нитрит натрия (NaNO2) • Нонагидридоренат(VII) натрия (Na2[ReH9]) • Оксид натрия (Na2O) • Ортованадат натрия (Na3VO4) • Ортосиликат натрия (Na4SiO4) • Ортотеллурат натрия (Na6TeO6) • Ортофосфат натрия (Na3PO4) • Пентаборат натрия (NaB5O8) • Периодат натрия (NaIO4) • Перманганат натрия (NaMnO4) • Пероксид натрия (Na2O2) • Перосмат натрия (Na2[OsO2(OH)4]) • Пиросульфат натрия (Na2S2O7) • Пирофосфат натрия (Na4P2O7) • Полисульфид натрия (Na2Sn) • Сегнетова соль (KNaC4H4O6•4H2O) • Селенат натрия (Na2SeO4) • Селенид натрия (Na2Se) • Селенит натрия (Na2SeO3) • Тиоантимонат натрия (Na3[SbS4]•9H2O) • Сульфат натрия (Na2SO4) • Сульфид натрия (Na2S) • Сульфит натрия (Na2SO3) • Тартрат натрия (Na2C4H4O6) • Теллурит натрия (Na2TeO3) • Теллурид натрия (Na2Te) • Тетраборат натрия (Na2B4O7) • Тетрагидроксоцинкат(II) натрия (Na2[Zn(OH)4]) • Тетраоксоманганат(V) натрия (Na3MnO4) • Тетратиоарсенат натрия (Na3[AsS4]) • Тиосульфат натрия (Na2S2O3) • Тиоцианат натрия (NaSCN) • Тритиостибат натрия (Na3[SbS3]) • Трифосфат натрия (Na5P3O10) • Фенилнатрий (NaC6H5) • Формиат натрия (HCOONa) • Фосфид натрия (Na3P) • Фосфит натрия (Na2(PHO2)) • Фторид натрия (NaF) • Хлорид натрия (NaCl) • Хлорат натрия (NaClO3) • Хлорит натрия (NaClO2) • Цианат натрия (NaNCO) • Этилнатрий (NaC2H5) |
Бисульфит натрия
ГОСТ 902-36
NaHSO3
Гидросульфит натрия или бисульфит натрия — химическое соединение, кислая соль натрия и сернистой кислоты с химической формулой NaHSO3. Антиоксидант и консервант (E222).
Натрий бисульфит — это кристаллический порошок белого или желтоватого цвета, имеет резкий запах.
Свойства
- Обладает отбеливающими свойствами; хорошо растворим в воде.
- Взаимодействует с хлоратом калия (автокатализ) с бурным выделением сернистого газа:
| Физические свойства | |
|---|---|
| Состояние | Бесцветное кристаллическое вещество с сероватым оттенком |
| Молярная масса | 104.061 г/моль |
| Плотность | 1.48 г/см³ |
| Термические свойства | |
| Т. плав. | 150 °C |
| Т. всп. | негорюч °C |
| Химические свойства | |
| Растворимость в воде | хорошо растворим в воде 39.77(22.8°C), 49.06(97.2°C) |
Получение:
Чтобы получить натрий бисульфит кристаллический карбонат натрия или гидрокарбонат заливают водой до прикрытия верхних кристаллов, после чего пропускают диоксид серы до того, как кристаллы практически полностью растворятся. Получается раствор зеленовато-желтого цвета, который хранится в какой-нибудь стеклянной емкости с плотно притертой пробкой. В дальнейшем раствор подвергается очистке и выпариванию в вакуумных условиях, таким образом, получается натрий бисульфит.
Применение
Гидросульфит натрия применяют в легкой, химической и других отраслях промышленности. В пищевой промышленности применяется как консервант или антиокислитель.
Гидросульфит натрия используется почти во всех идущих на экспорт винах для предотвращения окисления и сохранения вкуса. При консервировании фруктов применяется для предотвращения потемнения и для борьбы с микробами. В очень больших концентрациях может вызывать серьёзные аллергические реакции.
Используется как консервирующее средство, при белении и крашении тканей. При крашении натуральным индиго гидросульфит натрия используется как восстановитель для перевода его так называемый лейкоиндиго (восстановленную растворимую форму); после вымачивания ткани в растворе лейкоиндиго и дальнейшей сушки на воздухе под действием кислорода она приобретает синий цвет (лейкоиндиго окисляется до синего индиго).
С 1980-х годов гидросульфит натрия запрещён в США к использованию на сырых овощах и фруктах после серии летальных исходов. Вызывает заболевания желудочно-кишечного тракта.
Натрий бисульфит имеет широкий круг применения и в пищевой и в химической и фармацевтической промышленности. В пищевой он применяется как антиоксидант, консервант, разрыхлитель и отбеливатель, при производстве фруктовых соков, вина, пива, сладостей. Фармацевтической практике необходим при фильтрации воды, для дезинфекции оборудования, как наполнитель для таблетированных препаратов. В сельском хозяйстве, с помощью этого вещества удаляют пни.

Гидросульфит натрия или бисульфит натрия — химическое соединение, кислая соль натрия и сернистой кислоты с химической формулой NaHSO3.Антиоксидант и консервант.
| Гидросульфит натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидросульфит натрия |
| Сокращения | консервант E222 |
| Хим. формула | NaHSO3 |
| Физические свойства | |
| Состояние | Бесцветное кристаллическое вещество с сероватым оттенком |
| Молярная масса | 104.061 г/моль |
| Плотность | 1.48 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 150 °C |
| • вспышки | негорюч °C |
| Химические свойства | |
| Растворимость | |
| • в воде | хорошо растворим в воде 39.77(22.8°C), 49.06(97.2°C) |
| Классификация | |
| Рег. номер CAS | 7631-90-5 |
| PubChem | 656672 |
| Рег. номер EINECS | 231-548-0 |
| SMILES |
[Na+].[O-]S(=O)O |
| InChI |
1S/Na.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 DWAQJAXMDSEUJJ-UHFFFAOYSA-M |
| Кодекс Алиментариус | E222 |
| RTECS | VZ2000000 |
| ChEBI | 26709 |
| ChemSpider | 571016 |
| Безопасность | |
| Пиктограммы ECB |  |
| NFPA 704 |
Свойства
- Обладает отбеливающими свойствами; хорошо растворим в воде.
- Взаимодействует с хлоратом калия (автокатализ) с бурным выделением сернистого газа при большом избытке гидросульфита:
(разб.)
(разб.)
, при комнатной температуре
С 1980-х годов гидросульфит натрия запрещён в США к использованию на сырых овощах и фруктах после серии летальных исходов. Вызывает заболевания желудочно-кишечного тракта.
 |
|
 |
|
 |
|
| Имена | |
|---|---|
| Другие имена D-Ox. Гидролин. Редуктон. Гидросульфит натрия. Сульфоксилат натрия. Сульфоксилат. Ватролит. Virtex L | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.991 |
| Номер EC |
|
| PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
| Номер ООН | 1384 |
| CompTox Панель управления (EPA ) |
|
InChI
|
|
УЛЫБКА
|
|
| Pro perties | |
| Химическая формула | Na2S2O4 |
| Молярная масса | 174,107 г / моль (безводный). 210,146 г / моль (дигидрат) |
| Внешний вид | кристаллический порошок от белого до сероватого цвета. светлый — хлопья лимонного цвета |
| Запах | слабый запах серы |
| Плотность | 2,38 г / см (безводный). 1,58 г / см (дигидрат) |
| Точка плавления | 52 ° C ( 126 ° F; 325 K) |
| Температура кипения | Разлагается |
| Растворимость в воде | 18,2 г / 100 мл (безводный, 20 ° C). 21,9 г / 100 мл (дигидрат, 20 ° C) |
| Растворимость | мало растворим в спирте |
| Опасности | |
| Классификация ЕС (DSD) (устарело) | Вредно (Xn) |
| R-фразы (устарело) | R7, R22, R31 |
| S-фразы (устарело) | (S2), S7 / 8, S26, S28, S43 |
| NFPA 704 (огненный алмаз) |  3 2 1 3 2 1 |
| Температура вспышки | 100 ° C (212 ° F; 373 K) |
| Температура самовоспламенения. | 200 ° C (392 ° F; 473 K) |
| Родственные соединения | |
| Другие анионы | Сульфит натрия. Сульфат натрия |
| Родственные соединения | Тиосульфат натрия. Бисульфит натрия. Метабисульфит натрия. Натрий бисульфат |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Дитионит натрия (также известный как гидросульфит натрия ) представляет собой белый кристаллический порошок r со слабым сернистым запахом. Хотя он стабилен в отсутствие воздуха, он разлагается в горячей воде и в кислых растворах.
.
- 1 Структура
- 2 Получение
- 3 Свойства и реакции
- 3.1 Гидролиз
- 3.2 Окислительно-восстановительные реакции
- 3.3 С органическими карбонилами
- 4 Области применения
- 4.1 Промышленность
- 4.2 Биологические наук
- 4.3 Науки о Земле
- 4.4 Фотография
- 4.5 Начало
- 4.6 Лаборатория
- 5 См. также
- 6 Ссылки
- 7 Внешние ссылки
Структура
Рамановская спектроскопия и исследования дифракции рентгеновских лучей на монокристаллах показывают, что геометрия дитионит-аниона является гибкой. Дианион дитионита имеет симметрию C. 2с почти затмеваемым углом кручения 16 ° O-S-S-O. В дигидратированной форме (Na. 2S. 2O. 4· 2H. 2O) дитионитовый анион имеет более короткую длину связи SS и крутильный угол гош 56 ° OSSO.
На слабую связь SS указывает расстояние SS, равное 239 пм. Поскольку эта связь является хрупкой, дитионитовый анион диссоциирует в растворе на анион-радикал [SO 2 ], что было подтверждено спектроскопией ЭПР. Также наблюдается, что S подвергается быстрому обмену между S 2O4и SO 2 в нейтральном или кислотном растворе, что соответствует слабой связи SS в анионе.
Получение
Дитионит натрия получают промышленным способом путем восстановления диоксида серы. Используют несколько методов, включая восстановление цинковым порошком, борогидридом натрия и формиатом. В 1990 году было произведено около 300 000 тонн.
Свойства и реакции
Гидролиз
Дитионит натрия стабилен в сухом состоянии, но водные растворы портятся из-за следующей реакции:
- 2 S 2O4+ H 2 O → S 2O3+ 2 HSO 3
Такое поведение согласуется с нестабильностью дитионовой кислоты. Таким образом, растворы дитионита натрия нельзя хранить в течение длительного периода времени.
Безводный дитионит натрия разлагается на сульфат натрия и диоксид серы при температуре выше 90 ° C в воздух. В отсутствие воздуха он быстро разлагается при температуре выше 150 ° C до сульфита натрия, тиосульфата натрия, диоксида серы и следовых количеств серы.
Окислительно-восстановительные реакции
Дитионит натрия является восстановителем. При pH = 7 потенциал составляет -0,66 В относительно NHE. Редокс происходит с образованием сульфита:
- S2O4+ 2 H 2 O → 2 HSO 3 + 2 e + 2 H
Дитионит натрия реагирует с кислородом:
- Na2S2O4+ O 2 + H 2 O → NaHSO 4 + NaHSO 3
Эти реакции демонстрируют сложное рН-зависимое равновесие с участием бисульфита, тиосульфата и диоксида серы.
С органическими карбонилами
В присутствии альдегидов дитионит натрия реагирует либо с образованием α-гидроксисульфинатов при комнатной температуре, либо с восстановлением альдегида до соответствующего спирта при температуре выше 85 ° С. С. Некоторые кетоны также восстанавливаются в аналогичных условиях.
Применения
Промышленность
Это соединение представляет собой водорастворимую соль и может использоваться в качестве восстановителя в водные растворы. Он используется как таковой в некоторых промышленных процессах окрашивания, в первую очередь тех, которые включают серные красители и кубовые красители, где нерастворимый в воде краситель может быть преобразован в водорастворимый соль щелочного металла (например, краситель индиго ). Восстановительные свойства дитионита натрия также устраняют избыток красителя, остаточного оксида и нежелательных пигментов, тем самым улучшая общее качество цвета.
Дитионит натрия также может использоваться для водоподготовки, газоочистки, очистки и отпарки. Его также можно использовать в промышленных процессах в качестве сульфирующего агента или источника ионов натрия. Помимо текстильной промышленности, этот состав используется в отраслях, связанных с кожей, продуктами питания, полимерами, фотографией и многими другими. Его широкое использование связано с его низкой токсичностью LD50 при 5 г / кг и, следовательно, с его широким спектром применения. Он также используется в качестве обесцвечивающего агента в органических реакциях.
Биологические науки
Дитионит натрия часто используется в физиологических экспериментах как средство снижения окислительно-восстановительного потенциала растворов (E -0,66 V vs SHE при pH 7). Феррицианид калия обычно используется в качестве окисляющего химического вещества в таких экспериментах (E ~ 0,436 V при pH 7). Кроме того, дитионит натрия часто используется в опытах химии почвы для определения количества железа, которое не входит в состав первичных силикатных минералов. Следовательно, железо, экстрагированное дитионитом натрия, также называют «свободным железом». Сильное сродство дитионит-иона к двух- и трехвалентным катионам металлов (M, M) позволяет ему повышать растворимость железа, и, следовательно, дитионит является полезным хелатирующим агентом.
Geosciences
Натрий дитионит использовался в химическом увеличении нефтеотдачи для стабилизации полиакриламидных полимеров против радикального разложения в присутствии железа. Он также использовался в экологических приложениях для распространения фронта с низким E h в геологической среде с целью снижения таких компонентов, как хром.
Фотография
Используется в проявителе тумана Kodak, FD-70. Это используется на втором этапе обработки черно-белых позитивных изображений для создания слайдов. Он является частью оборудования Kodak Direct Positive Film Developing Outfit.
Дом
В основном дитионит натрия в домашних условиях используется в качестве обесцвечивающего средства для белого белья, когда на него случайно попали пятна. окрашенного предмета, переходящего в цикл стирки при высокой температуре. Обычно он выпускается в 5-граммовых пакетиках, которые называются гидросульфитом после устаревшего названия соли.
Лаборатория
Водные растворы дитионита натрия когда-то использовались для производства «раствора Физера для удаления кислорода из газового потока. Пиритион может быть получен двухстадийным синтезом из 2-бромпиридина путем окисления до N-оксида подходящей надкислотой с последующим замещением с использованием дитионита натрия для введения тиол функциональная группа.
См. также
- Дитионит
Ссылки
Внешние ссылки
- Дитионит натрия — ipcs inchem
- ^«Дитионит натрия — ipcs inchem » (PDF). www.inchem.org. Berliln, Germany. 2004. Дата обращения 15 июня 2018.
Гидросульфит натрия — неорганическое соединение, 
В природе не встречается. Получают его в результате воздействия газообразной двуокиси серы на водный раствор карбоната или гидрокарбоната (сода) натрия. Полученный раствор потом подвергается кристаллизации.
Свойства
Кристаллическое вещество белого цвета, иногда с легким желтоватым или сероватым оттенком. С резким запахом двуокиси серы. Водорастворимо. Не растворяется в спиртах, маслах, жирах. Водный раствор имеет светло-желтый цвет, иногда с коричневым оттенком. Горит, не взрывается. При нагревании выше +65 °С разлагается с выделением ядовитого сернистого ангидрида.
Проявляет выраженные восстанавливающие свойства, легко окисляется. Взаимодействует с хлоратом калия, кислотами с выделением ядовитого сернистого газа; водой, бромом, производными брома. Реагирует с альдегидами, кетонами, ацетоном, многими другими органическими соединениями.
Меры предосторожности
Относится к веществам 3-го класса опасности. Не взрывается, но пыль образует с воздухом взрывоопасные смеси. Может воспламениться от искры, загореться от пламени, в зоне пожара нагревается и выделяет токсичный диоксид серы. Пожароопасен при одновременном воздействии воды и кислорода воздуха. В этом случае происходит экзотермическая реакция с резким выделением тепла, разложением реактива, образованием серы и ее возгоранием.
Опасен при проглатывании и попадании в глаза (действует аналогично серной кислоте). Высокие дозы вызывают отравление, вялость, рвоту, желудочные заболевания, нарушения кровообращения и сердцебиения, аллергические реакции.
Если пыль бисульфита натрия попала в глаза, то их следует сразу же тщательно промыть водой. При проглатывании необходимо обеспечить пострадавшему свежий воздух, тепло, покой, срочно обратиться за врачебной помощью.
Рабочее место должно быть оснащено приточной вентиляцией. В местах возможного пылеобразования устанавливают аспирационные отсосы. Работникам нужно использовать средства защиты: спецодежду, резиновые перчатки, респираторы, защитные очки. Необходим постоянный мониторинг содержания вещества в воздухе рабочей зоны.
Возгорания тушат мелкораспыленной водой, пенными огнетушителями. Проливы нейтрализуют щелочными растворами (известковое молоко, раствор кальцинированной соды).
Хранят гидросульфит натрия отдельно от кислот и сильных окислителей; вдали от источников тепла; в герметичных контейнерах и бочках из стали марки Ст3; в лабораториях — в стеклянных герметично укупоренных склянках. Допускается упаковка из других материалов, устойчивых к воздействию бисульфита натрия, например, герметично запаянные полиэтиленовые мешки, вставленные в стальные барабаны. Перевозить можно любым транспортом, кроме самолетов.
Применение
- В пищепроме — добавка Е222, консервант, антиоксидант, разрыхлитель. Запрещен для использования в сырых фруктах и овощах (в США было несколько смертельных случаев). Используется при изготовлении вин, соков, пива, фруктовых консервов и сушеных фруктов, джемов. Существенно увеличивает их срок хранения, сохраняет вкус, цвет, предотвращает образование уксуса. Такой эффект объясняется выраженной противомикробной активностью. Применяется при производстве колбас, мороженого, мясных, рыбных, картофельных, грибных полуфабрикатов.
- В текстильпроме — реагент, участвующий в отбеливании и крашении тканей. Вспомогательное вещество при окраске тканей и волокон в ярко-синий цвет натуральным индиго. Нейтрализует остатки хлора после отбеливания.
- В фармацевтической отрасли используется при фильтрации
воды для производства медикаментов, для стерилизации оборудования. Как наполнитель таблеток; как восстановитель при синтезе лекарств.
- В кожевенном деле — при дублении кож.
- В биохимии реагент востребован для обеспечения безвоздушной среды в реакторе.
- В сельском хозяйстве — для обработки пней перед удалением.








 воды для производства медикаментов, для стерилизации оборудования. Как наполнитель таблеток; как восстановитель при синтезе лекарств.
воды для производства медикаментов, для стерилизации оборудования. Как наполнитель таблеток; как восстановитель при синтезе лекарств.