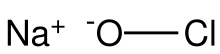
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sodium hypochlorite |
|
Other names
In dilution:
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.790 |
| EC Number |
|
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1791 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaOCl |
| Molar mass | 74.442 g/mol |
| Appearance | greenish-yellow solid (pentahydrate) |
| Odor | chlorine-like and sweetish |
| Density | 1.11 g/cm3 |
| Melting point | 18 °C (64 °F; 291 K) pentahydrate |
| Boiling point | 101 °C (214 °F; 374 K) (decomposes) |
|
Solubility in water |
29.3 g/100mL (0 °C)[1] |
| Acidity (pKa) | 7.5185 |
| Basicity (pKb) | 6.4815 |
| Thermochemistry | |
|
Std enthalpy of |
-347.1 kJ/mol |
| Pharmacology | |
|
ATC code |
D08AX07 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Oxidizer, corrosive[2] |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314, H410 |
|
Precautionary statements |
P260, P264, P273, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P391, P405, P501 |
| NFPA 704 (fire diamond) |
2 0 1 OX |
| Safety data sheet (SDS) | ICSC 1119 (solution, >10% active chlorine) ICSC 0482 (solution, <10% active chlorine) |
| Related compounds | |
|
Other anions |
Sodium chloride Sodium chlorite Sodium chlorate Sodium perchlorate |
|
Other cations |
Lithium hypochlorite Calcium hypochlorite Potassium hypochlorite |
|
Related compounds |
Hypochlorous acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium hypochlorite, commonly known in a dilute solution as (chlorine) bleach, is an inorganic chemical compound with the formula NaOCl (or NaClO),[3] comprising a sodium cation (Na+
) and a hypochlorite anion (OCl−
or ClO−
). It may also be viewed as the sodium salt of hypochlorous acid. The anhydrous compound is unstable and may decompose explosively.[4][5] It can be crystallized as a pentahydrate NaOCl·5H
2O, a pale greenish-yellow solid which is not explosive and is stable if kept refrigerated.[6][7][8]
Sodium hypochlorite is most often encountered as a pale greenish-yellow dilute solution referred to as liquid bleach, which is a household chemical widely used (since the 18th century) as a disinfectant or a bleaching agent. In solution, the compound is unstable and easily decomposes, liberating chlorine, which is the active principle of such products. Sodium hypochlorite is the oldest and still most important chlorine-based bleach.[9][10]
Its corrosive properties, common availability, and reaction products make it a significant safety risk. In particular, mixing liquid bleach with other cleaning products, such as acids found in limescale-removing products, will produce chlorine gas, which was used as a chemical weapon in World War I.[11][12][13] A common urban legend states that mixing bleach with ammonia also releases chlorine, but in reality the two chemicals react differently, producing chloramines and/or nitrogen trichloride. With excess ammonia and sodium hydroxide, hydrazine may be generated.
Chemistry[edit]
Stability of the solid[edit]
Anhydrous sodium hypochlorite can be prepared but, like many hypochlorites, it is highly unstable and decomposes explosively on heating or friction.[4] The decomposition is accelerated by carbon dioxide at atmospheric levels.[5][14] It is a white solid with the orthorhombic crystal structure.[15]
Sodium hypochlorite can also be obtained as a crystalline pentahydrate NaOCl·5H
2O, which is not explosive and is much more stable than the anhydrous compound.[5][6] The formula is sometimes given as 2NaOCl·10H
2O.[citation needed]. The Cl–O bond length in the pentahydrate is 1.686 Å.[8] The transparent, light greenish-yellow, orthorhombic[16][17] crystals contain 44% NaOCl by weight and melt at 25–27 °C. The compound decomposes rapidly at room temperature, so it must be kept under refrigeration. At lower temperatures, however, it is quite stable: reportedly only 1% decomposition after 360 days at 7 °C.[7][18]
A 1966 US patent claims that stable solid sodium hypochlorite dihydrate NaOCl·2H
2O can be obtained by carefully excluding chloride ions (Cl−
), which are present in the output of common manufacturing processes and are said to catalyze the decomposition of hypochlorite into chlorate (ClO−
3) and chloride. In one test, the dihydrate was claimed to show only 6% decomposition after 13.5 months storage at −25 °C. The patent also claims that the dihydrate can be reduced to the anhydrous form by vacuum drying at about 50 °C, yielding a solid that showed no decomposition after 64 hours at −25 °C.[19]
Equilibria and stability of solutions[edit]
At typical ambient temperatures, sodium hypochlorite is more stable in dilute solutions that contain solvated Na+
and OCl−
ions. The density of the solution is 1.093 g/mL at 5% concentration,[20] and 1.21 g/mL at 14%, 20 °C.[21] Stoichiometric solutions are fairly alkaline, with pH 11 or higher[7] since hypochlorous acid is a weak acid:
- OCl−
+ H
2O ⇌ HOCl + OH−
The following species and equilibria are present in solutions of NaOCl:[22]
- HOCl (aq) ⇌ H+
+ OCl− - HOCl (aq) + Cl−
+ H+
⇌ Cl
2 (aq) + H
2O - Cl
2 (aq) + Cl−
⇌ Cl−
3 - Cl
2 (aq) ⇌ Cl
2 (g)
The second equilibrium equation above will be shifted to the right if the chlorine Cl
2 is allowed to escape as gas. The ratios of Cl
2, HOCl, and OCl−
in solution are also pH dependent. At pH below 2, the majority of the chlorine in the solution is in the form of dissolved elemental Cl
2. At pH greater than 7.4, the majority is in the form of hypochlorite ClO−
.[9] The equilibrium can be shifted by adding acids (such as hydrochloric acid) or bases (such as sodium hydroxide) to the solution:
- ClO−
(aq) + 2 HCl (aq) → Cl
2 (g) + H
2O (aq) + Cl−
(aq) - Cl
2 (g) + 2 OH−
→ ClO−
(aq) + Cl−
(aq) + H
2O (aq)
At a pH of about 4, such as obtained by the addition of strong acids like hydrochloric acid, the amount of undissociated (nonionized) HOCl is highest. The reaction can be written as:
- ClO−
+ H+
⇌ HClO
Sodium hypochlorite solutions combined with acid evolve chlorine gas, particularly strongly at pH < 2, by the reactions:
- HOCl (aq) + Cl−
+ H+
⇌ Cl
2 (aq) + H
2O - Cl
2 (aq) ⇌ Cl
2 (g)
At pH > 8, the chlorine is practically all in the form of hypochlorite anions (OCl−
). The solutions are fairly stable at pH 11–12. Even so, one report claims that a conventional 13.6% NaOCl reagent solution lost 17% of its strength after being stored for 360 days at 7 °C.[7] For this reason, in some applications one may use more stable chlorine-releasing compounds, such as calcium hypochlorite Ca(ClO)
2 or trichloroisocyanuric acid (CNClO)
3.
Anhydrous sodium hypochlorite is soluble in methanol, and solutions are stable.[citation needed]
Decomposition to chlorate or oxygen[edit]
In solution, under certain conditions, the hypochlorite anion may also disproportionate (autoxidize) to chloride and chlorate:[23]
- 3 ClO−
+ H+
→ HClO
3 + 2 Cl−
In particular, this reaction occurs in sodium hypochlorite solutions at high temperatures, forming sodium chlorate and sodium chloride:[23][24]
- 3 NaOCl (aq) → 2 NaCl (aq) + NaClO
3 (aq)
This reaction is exploited in the industrial production of sodium chlorate.
An alternative decomposition of hypochlorite produces oxygen instead:
- 2 OCl−
→ 2 Cl−
+ O
2
In hot sodium hypochlorite solutions, this reaction competes with chlorate formation, yielding sodium chloride and oxygen gas:[23]
- 2 NaOCl (aq) → 2 NaCl (aq) + O
2 (g)
These two decomposition reactions of NaClO solutions are maximized at pH around 6. The chlorate-producing reaction predominates at pH above 6, while the oxygen one becomes significant below that. For example, at 80 °C, with NaOCl and NaCl concentrations of 80 mM, and pH 6–6.5, the chlorate is produced with ∼95% efficiency. The oxygen pathway predominates at pH 10.[23] This decomposition is affected by light[24] and metal ion catalysts such as copper, nickel, cobalt,[23] and iridium.[25] Catalysts like sodium dichromate Na
2Cr
2O
7 and sodium molybdate Na
2MoO
4 may be added industrially to reduce the oxygen pathway, but a report claims that only the latter is effective.[23]
Titration[edit]
Titration of hypochlorite solutions is often done by adding a measured sample to an excess amount of acidified solution of potassium iodide (KI) and then titrating the liberated iodine (I
2) with a standard solution of sodium thiosulfate or phenylarsine oxide, using starch as indicator, until the blue color disappears.[17]
According to one US patent, the stability of sodium hypochlorite content of solids or solutions can be determined by monitoring the infrared absorption due to the O–Cl bond. The characteristic wavelength is given as 140.25 μm for water solutions, 140.05 μm for the solid dihydrate NaOCl·2H
2O, and 139.08 μm for the anhydrous mixed salt Na
2(OCl)(OH).[19]
Oxidation of organic compounds[edit]
Oxidation of starch by sodium hypochlorite, that adds carbonyl and carboxyl groups, is relevant to the production of modified starch products.[26]
In the presence of a phase-transfer catalyst, alcohols are oxidized to the corresponding carbonyl compound (aldehyde or ketone).[27][7] Sodium hypochlorite can also oxidize organic sulfides to sulfoxides or sulfones, disulfides or thiols to sulfonyl halides, imines to oxaziridines.[7] It can also de-aromatize phenols.[7]
Oxidation of metals and complexes[edit]
Heterogeneous reactions of sodium hypochlorite and metals such as zinc proceed slowly to give the metal oxide or hydroxide:
- NaOCl + Zn → ZnO + NaCl
Homogeneous reactions with metal coordination complexes proceed somewhat faster. This has been exploited in the Jacobsen epoxidation.
Other reactions[edit]
If not properly stored in airtight containers, sodium hypochlorite reacts with carbon dioxide to form sodium carbonate:
- 2 NaOCl + CO2 + H2O → Na
2CO
3 + 2 HOCl
Sodium hypochlorite reacts with most nitrogen compounds to form volatile monochloramine, dichloramines, and nitrogen trichloride:
- NH
3 + NaOCl → NH
2Cl + NaOH - NH
2Cl + NaOCl → NHCl
2 + NaOH - NHCl
2 + NaOCl → NCl
3 + NaOH
Neutralization[edit]
Sodium thiosulfate is an effective chlorine neutralizer. Rinsing with a 5 mg/L solution, followed by washing with soap and water, will remove chlorine odor from the hands.[28]
Production[edit]
Chlorination of soda[edit]
Potassium hypochlorite was first produced in 1789 by Claude Louis Berthollet in his laboratory on the Quai de Javel in Paris, France, by passing chlorine gas through a solution of potash lye. The resulting liquid, known as «Eau de Javel» («Javel water»), was a weak solution of potassium hypochlorite. Antoine Labarraque replaced potash lye by the cheaper soda lye, thus obtaining sodium hypochlorite (Eau de Labarraque).[29][30]
- Cl2 (g) + 2 NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (aq)
Hence, chlorine is simultaneously reduced and oxidized; this process is known as disproportionation.
The process is also used to prepare the pentahydrate NaOCl·5H
2O for industrial and laboratory use. In a typical process, chlorine gas is added to a 45–48% NaOH solution. Some of the sodium chloride precipitates and is removed by filtration, and the pentahydrate is then obtained by cooling the filtrate to 12 °C .[7]
From calcium hypochlorite[edit]
Another method involved the reaction of sodium carbonate («washing soda») with chlorinated lime («bleaching powder»), a mixture of calcium hypochlorite Ca(OCl)
2, calcium chloride CaCl
2, and calcium hydroxide Ca(OH)
2:
- Na
2CO
3 (aq) + Ca(OCl)
2 (aq) → CaCO
3 (s) + 2 NaOCl (aq) - Na
2CO
3 (aq) + CaCl
2 (aq) → CaCO
3 (s) + 2 NaCl (aq) - Na
2CO
3 (aq) + Ca(OH)
2 (s) → CaCO
3 (s) + 2 NaOH (aq)
This method was commonly used to produce hypochlorite solutions for use as a hospital antiseptic that was sold after World War I under the names «Eusol», an abbreviation for Edinburgh University Solution Of (chlorinated) Lime – a reference to the university’s pathology department, where it was developed.[31]
Electrolysis of brine[edit]
Near the end of the nineteenth century, E. S. Smith patented the chloralkali process: a method of producing sodium hypochlorite involving the electrolysis of brine to produce sodium hydroxide and chlorine gas, which then mixed to form sodium hypochlorite.[32][30][33] The key reactions are:
- 2 Cl− → Cl2 + 2 e− (at the anode)
- 2 H
2O + 2 e− → H
2 + 2 HO−
(at the cathode)
Both electric power and brine solution were in cheap supply at the time, and various enterprising marketers took advantage of the situation to satisfy the market’s demand for sodium hypochlorite. Bottled solutions of sodium hypochlorite were sold under numerous trade names.
Today, an improved version of this method, known as the Hooker process (named after Hooker Chemicals, acquired by Occidental Petroleum), is the only large-scale industrial method of sodium hypochlorite production. In the process, sodium hypochlorite (NaClO) and sodium chloride (NaCl) are formed when chlorine is passed into cold dilute sodium hydroxide solution. The chlorine is prepared industrially by electrolysis with minimal separation between the anode and the cathode. The solution must be kept below 40 °C (by cooling coils) to prevent the undesired formation of sodium chlorate.
Commercial solutions always contain significant amounts of sodium chloride (common salt) as the main by-product, as seen in the equation above.
From hypochlorous acid and soda[edit]
A 1966 patent describes the production of solid stable dihydrate NaOCl·2H
2O by reacting a chloride-free solution of hypochlorous acid HClO (such as prepared from chlorine monoxide ClO and water), with a concentrated solution of sodium hydroxide. In a typical preparation, 255 mL of a solution with 118 g/L HClO is slowly added with stirring to a solution of 40 g of NaOH in water 0 °C. Some sodium chloride precipitates and is removed by filtration. The solution is vacuum evaporated at 40–50 °C and 1–2 mmHg until the dihydrate crystallizes out. The crystals are vacuum-dried to produce a free-flowing crystalline powder.[19]
The same principle was used in a 1993 patent to produce concentrated slurries of the pentahydrate NaClO·5H
2O. Typically, a 35% solution (by weight) of HClO is combined with sodium hydroxide at about or below 25 °C. The resulting slurry contains about 35% NaClO, and are relatively stable due to the low concentration of chloride.[34]
From ozone and salt[edit]
Sodium hypochlorite can be easily produced for research purposes by reacting ozone with salt.
- NaCl + O3 → NaClO + O2
This reaction happens at room temperature and can be helpful for oxidizing alcohols.
Packaging and sale[edit]
Bleach packaged for household use, with 2.6% sodium hypochlorite
Household bleach sold for use in laundering clothes is a 3–8% solution of sodium hypochlorite at the time of manufacture. Strength varies from one formulation to another and gradually decreases with long storage. Sodium hydroxide is usually added in small amounts to household bleach to slow down the decomposition of NaClO.[9]
Domestic use patio blackspot remover products are ~10% solutions of sodium hypochlorite.
A 10–25% solution of sodium hypochlorite is, according to Univar’s safety sheet, supplied with synonyms or trade names bleach, Hypo, Everchlor, Chloros, Hispec, Bridos, Bleacol, or Vo-redox 9110.[35]
A 12% solution is widely used in waterworks for the chlorination of water, and a 15% solution is more commonly[36] used for disinfection of waste water in treatment plants. Sodium hypochlorite can also be used for point-of-use disinfection of drinking water,[37] taking 0.2-2 mg of sodium hypochlorite per liter of water.[38]
Dilute solutions (50 ppm to 1.5%) are found in disinfecting sprays and wipes used on hard surfaces.[39][40]
Uses[edit]
Bleaching[edit]
Household bleach is, in general, a solution containing 3–8% sodium hypochlorite, by weight, and 0.01–0.05% sodium hydroxide; the sodium hydroxide is used to slow the decomposition of sodium hypochlorite into sodium chloride and sodium chlorate.[41]
Cleaning[edit]
Sodium hypochlorite has destaining properties.[42] Among other applications, it can be used to remove mold stains, dental stains caused by fluorosis,[43] and stains on crockery, especially those caused by the tannins in tea. It has also been used in laundry detergents and as a surface cleaner. It is also used in sodium hypochlorite washes.
Its bleaching, cleaning, deodorizing and caustic effects are due to oxidation and hydrolysis (saponification). Organic dirt exposed to hypochlorite becomes water-soluble and non-volatile, which reduces its odor and facilitates its removal.
Disinfection[edit]
Sodium hypochlorite in solution exhibits broad spectrum anti-microbial activity and is widely used in healthcare facilities in a variety of settings.[44] It is usually diluted in water depending on its intended use. «Strong chlorine solution» is a 0.5% solution of hypochlorite (containing approximately 5000 ppm free chlorine) used for disinfecting areas contaminated with body fluids, including large blood spills (the area is first cleaned with detergent before being disinfected).[44][45] It may be made by diluting household bleach as appropriate (normally 1 part bleach to 9 parts water).[46] Such solutions have been demonstrated to inactivate both C. difficile[44] and HPV.[47] «Weak chlorine solution» is a 0.05% solution of hypochlorite used for washing hands, but is normally prepared with calcium hypochlorite granules.[45]
«Dakin’s Solution» is a disinfectant solution containing low concentration of sodium hypochlorite and some boric acid or sodium bicarbonate to stabilize the pH. It has been found to be effective with NaOCl concentrations as low as 0.025%.[48]
US government regulations allow food processing equipment and food contact surfaces to be sanitized with solutions containing bleach, provided that the solution is allowed to drain adequately before contact with food, and that the solutions do not exceed 200 parts per million (ppm) available chlorine (for example, one tablespoon of typical household bleach containing 5.25% sodium hypochlorite, per gallon of water).[49] If higher concentrations are used, the surface must be rinsed with potable water after sanitizing.
A similar concentration of bleach in warm water is used to sanitize surfaces prior to brewing of beer or wine. Surfaces must be rinsed with sterilized (boiled) water to avoid imparting flavors to the brew; the chlorinated byproducts of sanitizing surfaces are also harmful. The mode of disinfectant action of sodium hypochlorite is similar to that of hypochlorous acid.
Solutions containing more than 500 ppm available chlorine are corrosive to some metals, alloys and many thermoplastics (such as acetal resin) and need to be thoroughly removed afterwards, so the bleach disinfection is sometimes followed by an ethanol disinfection. Liquids containing sodium hypochlorite as the main active component are also used for household cleaning and disinfection, for example toilet cleaners.[50] Some cleaners are formulated to be viscous so as not to drain quickly from vertical surfaces, such as the inside of a toilet bowl.
The undissociated (nonionized) hypochlorous acid is believed to react with and inactivate bacterial and viral enzymes.
Neutrophils of the human immune system produce small amounts of hypochlorite inside phagosomes, which digest bacteria and viruses.
Deodorizing[edit]
Sodium hypochlorite has deodorizing properties, which go hand in hand with its cleaning properties.[42]
Waste water treatment[edit]
Sodium hypochlorite solutions have been used to treat dilute cyanide waste water, such as electroplating wastes. In batch treatment operations, sodium hypochlorite has been used to treat more concentrated cyanide wastes, such as silver cyanide plating solutions. Toxic cyanide is oxidized to cyanate (OCN−) that is not toxic, idealized as follows:
- CN− + OCl− → OCN− + Cl−
Sodium hypochlorite is commonly used as a biocide in industrial applications to control slime and bacteria formation in water systems used at power plants, pulp and paper mills, etc., in solutions typically of 10–15% by weight.
Endodontics[edit]
Sodium hypochlorite is the medicament of choice due to its efficacy against pathogenic organisms and pulp digestion in endodontic therapy. Its concentration for use varies from 0.5% to 5.25%. At low concentrations it dissolves mainly necrotic tissue; at higher concentrations it also dissolves vital tissue and additional bacterial species. One study has shown that Enterococcus faecalis was still present in the dentin after 40 minutes of exposure of 1.3% and 2.5% sodium hypochlorite, whereas 40 minutes at a concentration of 5.25% was effective in E. faecalis removal.[51] In addition to higher concentrations of sodium hypochlorite, longer time exposure and warming the solution (60 °C) also increases its effectiveness in removing soft tissue and bacteria within the root canal chamber.[51] 2% is a common concentration as there is less risk of an iatrogenic hypochlorite incident.[52] A hypochlorite incident is an immediate reaction of severe pain, followed by edema, haematoma, and ecchymosis as a consequence of the solution escaping the confines of the tooth and entering the periapical space. This may be caused by binding or excessive pressure on the irrigant syringe, or it may occur if the tooth has an unusually large apical foramen.[53]
Nerve agent neutralization[edit]
At the various nerve agent (chemical warfare nerve gas) destruction facilities throughout the United States, 50% sodium hypochlorite is used to remove all traces of nerve agent or blister agent from Personal Protection Equipment after an entry is made by personnel into toxic areas. 50% sodium hypochlorite is also used to neutralize any accidental releases of the nerve agent in the toxic areas. Lesser concentrations of sodium hypochlorite are used in a similar fashion in the Pollution Abatement System to ensure that no nerve agent is released into the furnace flue gas.
Reduction of skin damage[edit]
Dilute bleach baths have been used for decades to treat moderate to severe eczema in humans,[54][55] but it has not been clear why they work. According to work published by researchers at the Stanford University School of Medicine in November 2013, a very dilute (0.005%) solution of sodium hypochlorite in water was successful in treating skin damage with an inflammatory component caused by radiation therapy, excess sun exposure or aging in laboratory mice. Mice with radiation dermatitis given daily 30-minute baths in bleach solution experienced less severe skin damage and better healing and hair regrowth than animals bathed in water. A molecule called nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) is known to play a critical role in inflammation, aging, and response to radiation. The researchers found that if NF-κB activity was blocked in elderly mice by bathing them in bleach solution, the animals’ skin began to look younger, going from old and fragile to thicker, with increased cell proliferation. The effect diminished after the baths were stopped, indicating that regular exposure was necessary to maintain skin thickness.[54][56]
Safety[edit]
It is estimated that there are about 3,300 accidents needing hospital treatment caused by sodium hypochlorite solutions each year in British homes (RoSPA, 2002).
Oxidation and corrosion[edit]
Sodium hypochlorite is a strong oxidizer. Oxidation reactions are corrosive. Solutions burn the skin and cause eye damage, especially when used in concentrated forms. As recognized by the NFPA, however, only solutions containing more than 40% sodium hypochlorite by weight are considered hazardous oxidizers. Solutions less than 40% are classified as a moderate oxidizing hazard (NFPA 430, 2000).
Household bleach and pool chlorinator solutions are typically stabilized by a significant concentration of lye (caustic soda, NaOH) as part of the manufacturing reaction. This additive will by itself cause caustic irritation or burns due to defatting and saponification of skin oils and destruction of tissue. The slippery feel of bleach on skin is due to this process.
Storage hazards[edit]
Contact of sodium hypochlorite solutions with metals may evolve flammable hydrogen gas. Containers may explode when heated due to release of chlorine gas.[14]
Hypochlorite solutions are corrosive to common container materials such as stainless steel[7] and aluminium. The few compatible metals include titanium (which however is not compatible with dry chlorine) and tantalum.[9] Glass containers are safe.[7] Some plastics and rubbers are affected too; safe choices include polyethylene (PE), high density polyethylene (HDPE, PE-HD), polypropylene (PP),[7] some chlorinated and fluorinated polymers such as polyvinyl chloride (PVC), polytetrafluoroethylene (PTFE), and polyvinylidene fluoride (PVDF); as well as ethylene propylene rubber, and Viton.[9]
Containers must allow venting of oxygen produced by decomposition over time, otherwise they may burst.[4]
Reactions with other common products[edit]
Mixing bleach with some household cleaners can be hazardous.
Sodium hypochlorite solutions, such as liquid bleach, will release toxic chlorine gas when mixed with an acid, such as hydrochloric acid or vinegar.
A 2008 study indicated that sodium hypochlorite and organic chemicals (e.g., surfactants, fragrances) contained in several household cleaning products can react to generate chlorinated volatile organic compounds (VOCs).[57] These chlorinated compounds are emitted during cleaning applications, some of which are toxic and probable human carcinogens. The study showed that indoor air concentrations significantly increase (8–52 times for chloroform and 1–1170 times for carbon tetrachloride, respectively, above baseline quantities in the household) during the use of bleach containing products. The increase in chlorinated volatile organic compound concentrations was the lowest for plain bleach and the highest for the products in the form of «thick liquid and gel.» The significant increases observed in indoor air concentrations of several chlorinated VOCs (especially carbon tetrachloride and chloroform) indicate that the bleach use may be a source that could be important in terms of inhalation exposure to these compounds. The authors suggested that using these cleaning products may significantly increase the cancer risk.[57]
In particular, mixing hypochlorite bleaches with amines (for example, cleaning products that contain or release ammonia, ammonium salts, urea, or related compounds and biological materials such as urine) produces chloramines.[58][14] These gaseous products can cause acute lung injury. Chronic exposure, for example, from the air at swimming pools where chlorine is used as the disinfectant, can lead to the development of atopic asthma.[59]
Bleach can react violently with hydrogen peroxide and produce oxygen gas:
- H2O2 (aq) + NaOCl (aq) → NaCl (aq) + H2O (aq) + O2 (g)
Explosive reactions or byproducts can also occur in industrial and laboratory settings when sodium hypochlorite is mixed with diverse organic compounds.[14]
Limitations in health care[edit]
The UK’s National Institute for Health and Care Excellence in October 2008 recommended that Dakin’s solution should not be used in routine wound care.[60]
Environmental impact[edit]
In spite of its strong biocidal action, sodium hypochlorite per se has limited environmental impact, since the hypochlorite ion rapidly degrades before it can be absorbed by living beings.[61]
However, one major concern arising from sodium hypochlorite use is that it tends to form persistent chlorinated organic compounds, including known carcinogens, that can be absorbed by organisms and enter the food chain. These compounds may be formed during household storage and use as well during industrial use.[41] For example, when household bleach and wastewater were mixed, 1–2% of the available chlorine was observed to form organic compounds.[41] As of 1994, not all the byproducts had been identified, but identified compounds include chloroform and carbon tetrachloride.[41][needs update] The exposure to these chemicals from use is estimated to be within occupational exposure limits.[41]
See also[edit]
- Calcium hypochlorite Ca(OCl)
2 («bleaching powder») - Potassium hypochlorite KOCl (the original «Javel water»)
- Lithium hypochlorite LiOCl
- Sodium hypochlorite washes
- Mixed oxidant
References[edit]
- ^ Budavari S, O’Neil M, Smith A, Heckelman P, Obenchain J (1996). «Sodium hypochlorite». The Merck Index (12th ed.). p. 1478. ISBN 978-0-911910-12-4.
- ^ Sodium hypochlorite: chemical activity
- ^ «sodium hypochlorite | chemical compound | Britannica». www.britannica.com. Retrieved 21 March 2022.
- ^ a b c Urben P (2006). Bretherick’s Handbook of Reactive Chemical Hazards. Vol. 1 (7th ed.). p. 1433. ISBN 978-0-08-052340-8.
- ^ a b c Hamano A (1997). «The formation and decomposition of sodium hypochlorite anhydrous salt and its pentahydrate». Science and Technology of Energetic Materials. 58 (4): 152–155.
- ^ a b Applebey MP (1919). «Sodium hypochlorite». Journal of the Chemical Society, Transactions. 115 (XCVI): 1106–1109. doi:10.1039/CT9191501106.
- ^ a b c d e f g h i j k Kirihara M, Okada T, Sugiyama Y, Akiyoshi M, Matsunaga T, Kimura Y (December 2017). «Sodium Hypochlorite Pentahydrate Crystals (NaOCl· 5H2O): A Convenient and Environmentally Benign Oxidant for Organic Synthesis». Organic Process Research & Development. 21 (12): 1925–37. doi:10.1021/acs.oprd.7b00288.
- ^ a b Topić, Filip; Marrett, Joseph M.; Borchers, Tristan H.; Titi, Hatem M.; Barrett, Christopher J.; Friščić, Tomislav (2021). «After 200 Years: The Structure of Bleach and Characterization of Hypohalite Ions by Single-Crystal X-Ray Diffraction». Angew. Chem. Int. Ed. 60 (46): 24400–24405. doi:10.1002/anie.202108843. PMID 34293249. S2CID 236199263.
- ^ a b c d e «OxyChem Sodium Hypochlorite Handbook» (PDF). OxyChem.
- ^ «Pamphlet 96, The Sodium Hypochorite Manual». The Chlorine Institute.
- ^ Faith, Thomas (2014). Behind the Gas Mask: The U.S. Chemical Warfare Service in War and Peace. Champaign, Illinois: University of Illinois Press. p. 9. ISBN 978-0252080265. Retrieved 14 April 2017.
- ^ «April 22, 1915: Germans introduce poison gas». This Day In History. Retrieved 14 April 2017.
- ^ Gross, Daniel A. (Spring 2015). «Chemical Warfare: From the European Battlefield to the American Laboratory». Distillations. 1 (1): 16–23. Retrieved 20 March 2018.
- ^ a b c d (2013): «Sodium Hypochlorite» Stanford Linear Accelerator Laboratory Safe Handling Guideline, chapter 53, product 202. Accessed on 2018-06-12
- ^ Yaws CL (2015). The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals (2nd ed.). Gulf Professional Publishing. p. 734. ISBN 978-0-12-801146-1.
- ^ ««Sodium Hypochlorite Pentahydrate, NaOCl·5H
2O]». MatWeb Material Property Data website. Retrieved 12 July 2018. - ^ a b «Sodium Hypochlorite». StudFiles. Retrieved 14 June 2018.
- ^ Okada T, Asawa T, Sugiyama Y, Iwai T, Kirihara M, Kimura Y (June 2016). «Sodium hypochlorite pentahydrate (NaOCl·5H2O) crystals; An effective re-oxidant for TEMPO oxidation». Tetrahedron. 72 (22): 2818–27. doi:10.1016/j.tet.2016.03.064.
- ^ a b c US 3498924, Walsh RH, Dietz A, «Process for preparing stable sodium hypochlorites», issued 1966
- ^ «Sodium hypochlorite». PubChem. U.S. National Library of Medicine.
- ^ Environment Canada (1985): «Tech Info for Problem Spills: Sodium Hypochlorite (Draft)».
- ^ Wang L, Bassiri M, Najafi R, Najafi K, Yang J, Khosrovi B, et al. (April 2007). «Hypochlorous acid as a potential wound care agent: part I. Stabilized hypochlorous acid: a component of the inorganic armamentarium of innate immunity». Journal of Burns and Wounds. 6: e5. PMC 1853323. PMID 17492050.
- ^ a b c d e f Sandin S, Karlsson RK, Cornell A (April 2015). «Catalyzed and uncatalyzed decomposition of hypochlorite in dilute solutions». Industrial & Engineering Chemistry Research. 54 (15): 3767–74. doi:10.1021/ie504890a.
- ^ a b Hamano A, Ikeda A (1995). «The pH effect on the photodecomposition of sodium hypochlorite solution». Science and Technology of Energetic Materials. 56 (2): 59–63.
- ^ Ayres GH, Booth MH (1955). «Catalytic Decomposition of Hypochlorite Solution by Iridium Compounds. I. The pH-Time Relationship». Journal of the American Chemical Society. 77 (4): 825–827. doi:10.1021/ja01609a001.
- ^ ASC – PT Asahimas Chemical (2009): «Sodium hypochlorite». Online product description. Accessed on 2018-06-14.
- ^ Mirafzal GA, Lozeva AM (1998). «Phase transfer catalyzed oxidation of alcohols with sodium hypochlorite». Tetrahedron Letters. 39 (40): 7263–7266. doi:10.1016/S0040-4039(98)01584-6.
- ^ Eaton, Andrew D.; Greenberg, Arnold E.; Rice, Eugene W.; Clesceri, Lenore S.; Franson, Mary Ann H., eds. (2005). Standard Methods For the Examination of Water and Wastewater (21 ed.). American Public Health Association. ISBN 978-0-87553-047-5. Method 9060a. Also available on CD-ROM and online by subscription.
- ^ Vogt H, Balej J, Bennett JE, Wintzer P, Sheikh SA, Gallone P (2007). «Chlorine Oxides and Chlorine Oxygen Acids». Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.). Wiley. p. 2.
- ^ a b «Sodium hypochlorite as a disinfectant». Lenntech.com. Retrieved 7 August 2011.
- ^ «eusol». Oxford English Dictionary. Archived from the original on 31 August 2013. Retrieved 3 July 2014.
- ^ May P. «Bleach (Sodium Hypochlorite)». University of Bristol. Archived from the original on 13 December 2016. Retrieved 13 December 2016.
- ^ «How Products Are Made Volume 2». May 2011.
- ^ US 5194238, Duncan BL, Ness RC, «Process for the production of highly pure concentrated slurries of sodium hypochlorite», issued 1991
- ^ «SAFETY DATA SHEET Sodium Hypochlorite» (PDF). Univar. 9 August 2007.
- ^ Wastewater Engineering: Treatment, Disposal, & Reuse (3rd ed.). Metcalf & Eddy, Inc. 1991. p. 497.
- ^ Lantagne DS (2018). «Sodium hypochlorite dosage for household and emergency water treatment». IWA Publishing. 16 (1).
- ^ «What is Chlorination?».
- ^ Vieira ER (1999). Elementary Food Science. Springer. pp. 381–382. ISBN 978-0-8342-1657-0.
- ^ Wilhelm N, Kaufmann A, Blanton E, Lantagne D (February 2018). «Sodium hypochlorite dosage for household and emergency water treatment: updated recommendations». Journal of Water and Health. 16 (1): 112–125. doi:10.2166/wh.2017.012. PMID 29424725.
- ^ a b c d e Smith WT. (1994). Human and Environmental Safety of Hypochlorite. In: Proceedings of the 3rd World Conference on Detergents: Global Perspectives, pp. 183–5.
- ^ a b «Benefits and Safety Aspects of Hypochlorite Formulated in Domestic Products» (PDF). AISE – International Association for Soaps, Detergents and Maintenance Products. March 1997. Archived from the original (PDF) on 30 March 2014.
This Support Dossier deals with information on the environmental and human safety evaluation of hypochlorite, and on its benefits as a disinfecting, deodorising and stain removing agent.
- ^ Cárdenas Flores A, Flores Reyes H, Gordillo Moscoso A, Castanedo Cázares JP, Pozos Guillén A (2009). «Clinical efficacy of 5% sodium hypochlorite for removal of stains caused by dental fluorosis». The Journal of Clinical Pediatric Dentistry. 33 (3): 187–91. doi:10.17796/jcpd.33.3.c6282t1054584157. PMID 19476089.
- ^ a b c Rutala WA, Weber DJ (15 February 2017) [2008]. «Guideline for Disinfection and Sterilization in Healthcare Facilities» (PDF). www.cdc.gov. Retrieved 29 August 2017.
- ^ a b «For General Healthcare Settings in West Africa: How to Prepare and Use Chlorine Solutions». Ebola Hemorrhagic Fever. Centers for Disease Control and Prevention. Retrieved 27 April 2016.
- ^ «How to Make Strong (0.5%) Chlorine Solution from Liquid Bleach» (PDF). Centers for Disease Control and Prevention.
- ^ Meyers J, Ryndock E, Conway MJ, Meyers C, Robison R (June 2014). «Susceptibility of high-risk human papillomavirus type 16 to clinical disinfectants». The Journal of Antimicrobial Chemotherapy. 69 (6): 1546–50. doi:10.1093/jac/dku006. PMC 4019329. PMID 24500190.
- ^
- ^ 21 CFR Part 178
- ^ «Toilet Cleaners: Learn About Chemicals Around Your House: Pesticides: US EPA». United States Environmental Protection Agency. 9 May 2012.
- ^ a b Root Canal Irrigants and Disinfectants. Endodontics: Colleagues for Excellence. Published for the Dental Professional Community by the American Association of Endodontists. Winter 2011.
- ^ Torabinejad M, Walton R (2008). Endodontics. VitalBook (4th ed.). W.B. Saunders Company. p. 265.
- ^ Hülsmann M, Hahn W (May 2000). «Complications during root canal irrigation—literature review and case reports» (PDF). International Endodontic Journal. 33 (3): 186–93. doi:10.1046/j.1365-2591.2000.00303.x. PMID 11307434.
- ^ a b Conger K (15 November 2013). «Inflammatory skin damage in mice blocked by bleach solution, study finds». Stanford School of Medicine. Archived from the original on 7 December 2013.
- ^ Pett K, Batta K, Vlachou C, Nicholls G. «Bleach baths using Milton Sterilising Fluid for recurrent infected atopic eczema». www.eczema.org. Archived from the original on 12 December 2013.
- ^ Leung TH, Zhang LF, Wang J, Ning S, Knox SJ, Kim SK (December 2013). «Topical hypochlorite ameliorates NF-κB-mediated skin diseases in mice». The Journal of Clinical Investigation. 123 (12): 5361–70. doi:10.1172/JCI70895. PMC 3859383. PMID 24231355.
- ^ a b Odabasi M (March 2008). «Halogenated volatile organic compounds from the use of chlorine-bleach-containing household products» (PDF). Environmental Science & Technology. 42 (5): 1445–1451. Bibcode:2008EnST…42.1445O. doi:10.1021/es702355u. PMID 18441786.
- ^ Krieger GR, Sullivan JB Jr (2001). Clinical environmental health and toxic exposures (2nd ed.). Philadelphia, Pa.: Lippincott Williams & Wilkins. p. 968. ISBN 9780683080278. Retrieved 30 August 2016.
- ^ Nickmilder M, Carbonnelle S, Bernard A (February 2007). «House cleaning with chlorine bleach and the risks of allergic and respiratory diseases in children». Pediatric Allergy and Immunology. 18 (1): 27–35. doi:10.1111/j.1399-3038.2006.00487.x. PMID 17295796. S2CID 24606118.
- ^ Do not use Eusol and gauze to manage surgical wounds that are healing by secondary intention, October 2008, NICE, London Archived 14 July 2014 at the Wayback Machine.Accessed 3 July 2014.
- ^ ASC – PT Asahimas Chemical (2009): «Sodium hypochlorite 10%». Online Material Safety Data Sheet (MSDS). Accessed on 2018-06-14.
Bibliography[edit]
- Jones FL (December 1972). «Chloride poisoning from mixing household cleaners». JAMA. 222 (10): 1312. doi:10.1001/jama.222.10.1312. PMID 4678160.
- Bonnard M, Brondeau MT, Falcy M, Jargot D, Miraval S, Protois J, Schneider O. «Eaux et extraits de Javel Hypochlorite de sodium en solution». Fiche Toxicologique. 157.
External links[edit]
- International Chemical Safety Card 0482 (solutions<10% active Cl)
- International Chemical Safety Card 1119 (solutions >10% active Cl)
- Institut national de recherche et de sécurité (in French)
- Home and Leisure Accident Statistics 2002 (UK RoSPA)
- Emergency Disinfection of Drinking Water (United States Environmental Protection Agency)
- Chlorinated Drinking Water (IARC Monograph)
- NTP Study Report TR-392: Chlorinated & Chloraminated Water (US NIH)
- Guidelines for the Use of Chlorine Bleach as a Sanitizer in Food Processing Operations (Oklahoma State University)
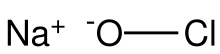
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Sodium hypochlorite |
|
Other names
In dilution:
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.790 |
| EC Number |
|
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1791 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaOCl |
| Molar mass | 74.442 g/mol |
| Appearance | greenish-yellow solid (pentahydrate) |
| Odor | chlorine-like and sweetish |
| Density | 1.11 g/cm3 |
| Melting point | 18 °C (64 °F; 291 K) pentahydrate |
| Boiling point | 101 °C (214 °F; 374 K) (decomposes) |
|
Solubility in water |
29.3 g/100mL (0 °C)[1] |
| Acidity (pKa) | 7.5185 |
| Basicity (pKb) | 6.4815 |
| Thermochemistry | |
|
Std enthalpy of |
-347.1 kJ/mol |
| Pharmacology | |
|
ATC code |
D08AX07 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Oxidizer, corrosive[2] |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314, H410 |
|
Precautionary statements |
P260, P264, P273, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P391, P405, P501 |
| NFPA 704 (fire diamond) |
2 0 1 OX |
| Safety data sheet (SDS) | ICSC 1119 (solution, >10% active chlorine) ICSC 0482 (solution, <10% active chlorine) |
| Related compounds | |
|
Other anions |
Sodium chloride Sodium chlorite Sodium chlorate Sodium perchlorate |
|
Other cations |
Lithium hypochlorite Calcium hypochlorite Potassium hypochlorite |
|
Related compounds |
Hypochlorous acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium hypochlorite, commonly known in a dilute solution as (chlorine) bleach, is an inorganic chemical compound with the formula NaOCl (or NaClO),[3] comprising a sodium cation (Na+
) and a hypochlorite anion (OCl−
or ClO−
). It may also be viewed as the sodium salt of hypochlorous acid. The anhydrous compound is unstable and may decompose explosively.[4][5] It can be crystallized as a pentahydrate NaOCl·5H
2O, a pale greenish-yellow solid which is not explosive and is stable if kept refrigerated.[6][7][8]
Sodium hypochlorite is most often encountered as a pale greenish-yellow dilute solution referred to as liquid bleach, which is a household chemical widely used (since the 18th century) as a disinfectant or a bleaching agent. In solution, the compound is unstable and easily decomposes, liberating chlorine, which is the active principle of such products. Sodium hypochlorite is the oldest and still most important chlorine-based bleach.[9][10]
Its corrosive properties, common availability, and reaction products make it a significant safety risk. In particular, mixing liquid bleach with other cleaning products, such as acids found in limescale-removing products, will produce chlorine gas, which was used as a chemical weapon in World War I.[11][12][13] A common urban legend states that mixing bleach with ammonia also releases chlorine, but in reality the two chemicals react differently, producing chloramines and/or nitrogen trichloride. With excess ammonia and sodium hydroxide, hydrazine may be generated.
Chemistry[edit]
Stability of the solid[edit]
Anhydrous sodium hypochlorite can be prepared but, like many hypochlorites, it is highly unstable and decomposes explosively on heating or friction.[4] The decomposition is accelerated by carbon dioxide at atmospheric levels.[5][14] It is a white solid with the orthorhombic crystal structure.[15]
Sodium hypochlorite can also be obtained as a crystalline pentahydrate NaOCl·5H
2O, which is not explosive and is much more stable than the anhydrous compound.[5][6] The formula is sometimes given as 2NaOCl·10H
2O.[citation needed]. The Cl–O bond length in the pentahydrate is 1.686 Å.[8] The transparent, light greenish-yellow, orthorhombic[16][17] crystals contain 44% NaOCl by weight and melt at 25–27 °C. The compound decomposes rapidly at room temperature, so it must be kept under refrigeration. At lower temperatures, however, it is quite stable: reportedly only 1% decomposition after 360 days at 7 °C.[7][18]
A 1966 US patent claims that stable solid sodium hypochlorite dihydrate NaOCl·2H
2O can be obtained by carefully excluding chloride ions (Cl−
), which are present in the output of common manufacturing processes and are said to catalyze the decomposition of hypochlorite into chlorate (ClO−
3) and chloride. In one test, the dihydrate was claimed to show only 6% decomposition after 13.5 months storage at −25 °C. The patent also claims that the dihydrate can be reduced to the anhydrous form by vacuum drying at about 50 °C, yielding a solid that showed no decomposition after 64 hours at −25 °C.[19]
Equilibria and stability of solutions[edit]
At typical ambient temperatures, sodium hypochlorite is more stable in dilute solutions that contain solvated Na+
and OCl−
ions. The density of the solution is 1.093 g/mL at 5% concentration,[20] and 1.21 g/mL at 14%, 20 °C.[21] Stoichiometric solutions are fairly alkaline, with pH 11 or higher[7] since hypochlorous acid is a weak acid:
- OCl−
+ H
2O ⇌ HOCl + OH−
The following species and equilibria are present in solutions of NaOCl:[22]
- HOCl (aq) ⇌ H+
+ OCl− - HOCl (aq) + Cl−
+ H+
⇌ Cl
2 (aq) + H
2O - Cl
2 (aq) + Cl−
⇌ Cl−
3 - Cl
2 (aq) ⇌ Cl
2 (g)
The second equilibrium equation above will be shifted to the right if the chlorine Cl
2 is allowed to escape as gas. The ratios of Cl
2, HOCl, and OCl−
in solution are also pH dependent. At pH below 2, the majority of the chlorine in the solution is in the form of dissolved elemental Cl
2. At pH greater than 7.4, the majority is in the form of hypochlorite ClO−
.[9] The equilibrium can be shifted by adding acids (such as hydrochloric acid) or bases (such as sodium hydroxide) to the solution:
- ClO−
(aq) + 2 HCl (aq) → Cl
2 (g) + H
2O (aq) + Cl−
(aq) - Cl
2 (g) + 2 OH−
→ ClO−
(aq) + Cl−
(aq) + H
2O (aq)
At a pH of about 4, such as obtained by the addition of strong acids like hydrochloric acid, the amount of undissociated (nonionized) HOCl is highest. The reaction can be written as:
- ClO−
+ H+
⇌ HClO
Sodium hypochlorite solutions combined with acid evolve chlorine gas, particularly strongly at pH < 2, by the reactions:
- HOCl (aq) + Cl−
+ H+
⇌ Cl
2 (aq) + H
2O - Cl
2 (aq) ⇌ Cl
2 (g)
At pH > 8, the chlorine is practically all in the form of hypochlorite anions (OCl−
). The solutions are fairly stable at pH 11–12. Even so, one report claims that a conventional 13.6% NaOCl reagent solution lost 17% of its strength after being stored for 360 days at 7 °C.[7] For this reason, in some applications one may use more stable chlorine-releasing compounds, such as calcium hypochlorite Ca(ClO)
2 or trichloroisocyanuric acid (CNClO)
3.
Anhydrous sodium hypochlorite is soluble in methanol, and solutions are stable.[citation needed]
Decomposition to chlorate or oxygen[edit]
In solution, under certain conditions, the hypochlorite anion may also disproportionate (autoxidize) to chloride and chlorate:[23]
- 3 ClO−
+ H+
→ HClO
3 + 2 Cl−
In particular, this reaction occurs in sodium hypochlorite solutions at high temperatures, forming sodium chlorate and sodium chloride:[23][24]
- 3 NaOCl (aq) → 2 NaCl (aq) + NaClO
3 (aq)
This reaction is exploited in the industrial production of sodium chlorate.
An alternative decomposition of hypochlorite produces oxygen instead:
- 2 OCl−
→ 2 Cl−
+ O
2
In hot sodium hypochlorite solutions, this reaction competes with chlorate formation, yielding sodium chloride and oxygen gas:[23]
- 2 NaOCl (aq) → 2 NaCl (aq) + O
2 (g)
These two decomposition reactions of NaClO solutions are maximized at pH around 6. The chlorate-producing reaction predominates at pH above 6, while the oxygen one becomes significant below that. For example, at 80 °C, with NaOCl and NaCl concentrations of 80 mM, and pH 6–6.5, the chlorate is produced with ∼95% efficiency. The oxygen pathway predominates at pH 10.[23] This decomposition is affected by light[24] and metal ion catalysts such as copper, nickel, cobalt,[23] and iridium.[25] Catalysts like sodium dichromate Na
2Cr
2O
7 and sodium molybdate Na
2MoO
4 may be added industrially to reduce the oxygen pathway, but a report claims that only the latter is effective.[23]
Titration[edit]
Titration of hypochlorite solutions is often done by adding a measured sample to an excess amount of acidified solution of potassium iodide (KI) and then titrating the liberated iodine (I
2) with a standard solution of sodium thiosulfate or phenylarsine oxide, using starch as indicator, until the blue color disappears.[17]
According to one US patent, the stability of sodium hypochlorite content of solids or solutions can be determined by monitoring the infrared absorption due to the O–Cl bond. The characteristic wavelength is given as 140.25 μm for water solutions, 140.05 μm for the solid dihydrate NaOCl·2H
2O, and 139.08 μm for the anhydrous mixed salt Na
2(OCl)(OH).[19]
Oxidation of organic compounds[edit]
Oxidation of starch by sodium hypochlorite, that adds carbonyl and carboxyl groups, is relevant to the production of modified starch products.[26]
In the presence of a phase-transfer catalyst, alcohols are oxidized to the corresponding carbonyl compound (aldehyde or ketone).[27][7] Sodium hypochlorite can also oxidize organic sulfides to sulfoxides or sulfones, disulfides or thiols to sulfonyl halides, imines to oxaziridines.[7] It can also de-aromatize phenols.[7]
Oxidation of metals and complexes[edit]
Heterogeneous reactions of sodium hypochlorite and metals such as zinc proceed slowly to give the metal oxide or hydroxide:
- NaOCl + Zn → ZnO + NaCl
Homogeneous reactions with metal coordination complexes proceed somewhat faster. This has been exploited in the Jacobsen epoxidation.
Other reactions[edit]
If not properly stored in airtight containers, sodium hypochlorite reacts with carbon dioxide to form sodium carbonate:
- 2 NaOCl + CO2 + H2O → Na
2CO
3 + 2 HOCl
Sodium hypochlorite reacts with most nitrogen compounds to form volatile monochloramine, dichloramines, and nitrogen trichloride:
- NH
3 + NaOCl → NH
2Cl + NaOH - NH
2Cl + NaOCl → NHCl
2 + NaOH - NHCl
2 + NaOCl → NCl
3 + NaOH
Neutralization[edit]
Sodium thiosulfate is an effective chlorine neutralizer. Rinsing with a 5 mg/L solution, followed by washing with soap and water, will remove chlorine odor from the hands.[28]
Production[edit]
Chlorination of soda[edit]
Potassium hypochlorite was first produced in 1789 by Claude Louis Berthollet in his laboratory on the Quai de Javel in Paris, France, by passing chlorine gas through a solution of potash lye. The resulting liquid, known as «Eau de Javel» («Javel water»), was a weak solution of potassium hypochlorite. Antoine Labarraque replaced potash lye by the cheaper soda lye, thus obtaining sodium hypochlorite (Eau de Labarraque).[29][30]
- Cl2 (g) + 2 NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (aq)
Hence, chlorine is simultaneously reduced and oxidized; this process is known as disproportionation.
The process is also used to prepare the pentahydrate NaOCl·5H
2O for industrial and laboratory use. In a typical process, chlorine gas is added to a 45–48% NaOH solution. Some of the sodium chloride precipitates and is removed by filtration, and the pentahydrate is then obtained by cooling the filtrate to 12 °C .[7]
From calcium hypochlorite[edit]
Another method involved the reaction of sodium carbonate («washing soda») with chlorinated lime («bleaching powder»), a mixture of calcium hypochlorite Ca(OCl)
2, calcium chloride CaCl
2, and calcium hydroxide Ca(OH)
2:
- Na
2CO
3 (aq) + Ca(OCl)
2 (aq) → CaCO
3 (s) + 2 NaOCl (aq) - Na
2CO
3 (aq) + CaCl
2 (aq) → CaCO
3 (s) + 2 NaCl (aq) - Na
2CO
3 (aq) + Ca(OH)
2 (s) → CaCO
3 (s) + 2 NaOH (aq)
This method was commonly used to produce hypochlorite solutions for use as a hospital antiseptic that was sold after World War I under the names «Eusol», an abbreviation for Edinburgh University Solution Of (chlorinated) Lime – a reference to the university’s pathology department, where it was developed.[31]
Electrolysis of brine[edit]
Near the end of the nineteenth century, E. S. Smith patented the chloralkali process: a method of producing sodium hypochlorite involving the electrolysis of brine to produce sodium hydroxide and chlorine gas, which then mixed to form sodium hypochlorite.[32][30][33] The key reactions are:
- 2 Cl− → Cl2 + 2 e− (at the anode)
- 2 H
2O + 2 e− → H
2 + 2 HO−
(at the cathode)
Both electric power and brine solution were in cheap supply at the time, and various enterprising marketers took advantage of the situation to satisfy the market’s demand for sodium hypochlorite. Bottled solutions of sodium hypochlorite were sold under numerous trade names.
Today, an improved version of this method, known as the Hooker process (named after Hooker Chemicals, acquired by Occidental Petroleum), is the only large-scale industrial method of sodium hypochlorite production. In the process, sodium hypochlorite (NaClO) and sodium chloride (NaCl) are formed when chlorine is passed into cold dilute sodium hydroxide solution. The chlorine is prepared industrially by electrolysis with minimal separation between the anode and the cathode. The solution must be kept below 40 °C (by cooling coils) to prevent the undesired formation of sodium chlorate.
Commercial solutions always contain significant amounts of sodium chloride (common salt) as the main by-product, as seen in the equation above.
From hypochlorous acid and soda[edit]
A 1966 patent describes the production of solid stable dihydrate NaOCl·2H
2O by reacting a chloride-free solution of hypochlorous acid HClO (such as prepared from chlorine monoxide ClO and water), with a concentrated solution of sodium hydroxide. In a typical preparation, 255 mL of a solution with 118 g/L HClO is slowly added with stirring to a solution of 40 g of NaOH in water 0 °C. Some sodium chloride precipitates and is removed by filtration. The solution is vacuum evaporated at 40–50 °C and 1–2 mmHg until the dihydrate crystallizes out. The crystals are vacuum-dried to produce a free-flowing crystalline powder.[19]
The same principle was used in a 1993 patent to produce concentrated slurries of the pentahydrate NaClO·5H
2O. Typically, a 35% solution (by weight) of HClO is combined with sodium hydroxide at about or below 25 °C. The resulting slurry contains about 35% NaClO, and are relatively stable due to the low concentration of chloride.[34]
From ozone and salt[edit]
Sodium hypochlorite can be easily produced for research purposes by reacting ozone with salt.
- NaCl + O3 → NaClO + O2
This reaction happens at room temperature and can be helpful for oxidizing alcohols.
Packaging and sale[edit]
Bleach packaged for household use, with 2.6% sodium hypochlorite
Household bleach sold for use in laundering clothes is a 3–8% solution of sodium hypochlorite at the time of manufacture. Strength varies from one formulation to another and gradually decreases with long storage. Sodium hydroxide is usually added in small amounts to household bleach to slow down the decomposition of NaClO.[9]
Domestic use patio blackspot remover products are ~10% solutions of sodium hypochlorite.
A 10–25% solution of sodium hypochlorite is, according to Univar’s safety sheet, supplied with synonyms or trade names bleach, Hypo, Everchlor, Chloros, Hispec, Bridos, Bleacol, or Vo-redox 9110.[35]
A 12% solution is widely used in waterworks for the chlorination of water, and a 15% solution is more commonly[36] used for disinfection of waste water in treatment plants. Sodium hypochlorite can also be used for point-of-use disinfection of drinking water,[37] taking 0.2-2 mg of sodium hypochlorite per liter of water.[38]
Dilute solutions (50 ppm to 1.5%) are found in disinfecting sprays and wipes used on hard surfaces.[39][40]
Uses[edit]
Bleaching[edit]
Household bleach is, in general, a solution containing 3–8% sodium hypochlorite, by weight, and 0.01–0.05% sodium hydroxide; the sodium hydroxide is used to slow the decomposition of sodium hypochlorite into sodium chloride and sodium chlorate.[41]
Cleaning[edit]
Sodium hypochlorite has destaining properties.[42] Among other applications, it can be used to remove mold stains, dental stains caused by fluorosis,[43] and stains on crockery, especially those caused by the tannins in tea. It has also been used in laundry detergents and as a surface cleaner. It is also used in sodium hypochlorite washes.
Its bleaching, cleaning, deodorizing and caustic effects are due to oxidation and hydrolysis (saponification). Organic dirt exposed to hypochlorite becomes water-soluble and non-volatile, which reduces its odor and facilitates its removal.
Disinfection[edit]
Sodium hypochlorite in solution exhibits broad spectrum anti-microbial activity and is widely used in healthcare facilities in a variety of settings.[44] It is usually diluted in water depending on its intended use. «Strong chlorine solution» is a 0.5% solution of hypochlorite (containing approximately 5000 ppm free chlorine) used for disinfecting areas contaminated with body fluids, including large blood spills (the area is first cleaned with detergent before being disinfected).[44][45] It may be made by diluting household bleach as appropriate (normally 1 part bleach to 9 parts water).[46] Such solutions have been demonstrated to inactivate both C. difficile[44] and HPV.[47] «Weak chlorine solution» is a 0.05% solution of hypochlorite used for washing hands, but is normally prepared with calcium hypochlorite granules.[45]
«Dakin’s Solution» is a disinfectant solution containing low concentration of sodium hypochlorite and some boric acid or sodium bicarbonate to stabilize the pH. It has been found to be effective with NaOCl concentrations as low as 0.025%.[48]
US government regulations allow food processing equipment and food contact surfaces to be sanitized with solutions containing bleach, provided that the solution is allowed to drain adequately before contact with food, and that the solutions do not exceed 200 parts per million (ppm) available chlorine (for example, one tablespoon of typical household bleach containing 5.25% sodium hypochlorite, per gallon of water).[49] If higher concentrations are used, the surface must be rinsed with potable water after sanitizing.
A similar concentration of bleach in warm water is used to sanitize surfaces prior to brewing of beer or wine. Surfaces must be rinsed with sterilized (boiled) water to avoid imparting flavors to the brew; the chlorinated byproducts of sanitizing surfaces are also harmful. The mode of disinfectant action of sodium hypochlorite is similar to that of hypochlorous acid.
Solutions containing more than 500 ppm available chlorine are corrosive to some metals, alloys and many thermoplastics (such as acetal resin) and need to be thoroughly removed afterwards, so the bleach disinfection is sometimes followed by an ethanol disinfection. Liquids containing sodium hypochlorite as the main active component are also used for household cleaning and disinfection, for example toilet cleaners.[50] Some cleaners are formulated to be viscous so as not to drain quickly from vertical surfaces, such as the inside of a toilet bowl.
The undissociated (nonionized) hypochlorous acid is believed to react with and inactivate bacterial and viral enzymes.
Neutrophils of the human immune system produce small amounts of hypochlorite inside phagosomes, which digest bacteria and viruses.
Deodorizing[edit]
Sodium hypochlorite has deodorizing properties, which go hand in hand with its cleaning properties.[42]
Waste water treatment[edit]
Sodium hypochlorite solutions have been used to treat dilute cyanide waste water, such as electroplating wastes. In batch treatment operations, sodium hypochlorite has been used to treat more concentrated cyanide wastes, such as silver cyanide plating solutions. Toxic cyanide is oxidized to cyanate (OCN−) that is not toxic, idealized as follows:
- CN− + OCl− → OCN− + Cl−
Sodium hypochlorite is commonly used as a biocide in industrial applications to control slime and bacteria formation in water systems used at power plants, pulp and paper mills, etc., in solutions typically of 10–15% by weight.
Endodontics[edit]
Sodium hypochlorite is the medicament of choice due to its efficacy against pathogenic organisms and pulp digestion in endodontic therapy. Its concentration for use varies from 0.5% to 5.25%. At low concentrations it dissolves mainly necrotic tissue; at higher concentrations it also dissolves vital tissue and additional bacterial species. One study has shown that Enterococcus faecalis was still present in the dentin after 40 minutes of exposure of 1.3% and 2.5% sodium hypochlorite, whereas 40 minutes at a concentration of 5.25% was effective in E. faecalis removal.[51] In addition to higher concentrations of sodium hypochlorite, longer time exposure and warming the solution (60 °C) also increases its effectiveness in removing soft tissue and bacteria within the root canal chamber.[51] 2% is a common concentration as there is less risk of an iatrogenic hypochlorite incident.[52] A hypochlorite incident is an immediate reaction of severe pain, followed by edema, haematoma, and ecchymosis as a consequence of the solution escaping the confines of the tooth and entering the periapical space. This may be caused by binding or excessive pressure on the irrigant syringe, or it may occur if the tooth has an unusually large apical foramen.[53]
Nerve agent neutralization[edit]
At the various nerve agent (chemical warfare nerve gas) destruction facilities throughout the United States, 50% sodium hypochlorite is used to remove all traces of nerve agent or blister agent from Personal Protection Equipment after an entry is made by personnel into toxic areas. 50% sodium hypochlorite is also used to neutralize any accidental releases of the nerve agent in the toxic areas. Lesser concentrations of sodium hypochlorite are used in a similar fashion in the Pollution Abatement System to ensure that no nerve agent is released into the furnace flue gas.
Reduction of skin damage[edit]
Dilute bleach baths have been used for decades to treat moderate to severe eczema in humans,[54][55] but it has not been clear why they work. According to work published by researchers at the Stanford University School of Medicine in November 2013, a very dilute (0.005%) solution of sodium hypochlorite in water was successful in treating skin damage with an inflammatory component caused by radiation therapy, excess sun exposure or aging in laboratory mice. Mice with radiation dermatitis given daily 30-minute baths in bleach solution experienced less severe skin damage and better healing and hair regrowth than animals bathed in water. A molecule called nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) is known to play a critical role in inflammation, aging, and response to radiation. The researchers found that if NF-κB activity was blocked in elderly mice by bathing them in bleach solution, the animals’ skin began to look younger, going from old and fragile to thicker, with increased cell proliferation. The effect diminished after the baths were stopped, indicating that regular exposure was necessary to maintain skin thickness.[54][56]
Safety[edit]
It is estimated that there are about 3,300 accidents needing hospital treatment caused by sodium hypochlorite solutions each year in British homes (RoSPA, 2002).
Oxidation and corrosion[edit]
Sodium hypochlorite is a strong oxidizer. Oxidation reactions are corrosive. Solutions burn the skin and cause eye damage, especially when used in concentrated forms. As recognized by the NFPA, however, only solutions containing more than 40% sodium hypochlorite by weight are considered hazardous oxidizers. Solutions less than 40% are classified as a moderate oxidizing hazard (NFPA 430, 2000).
Household bleach and pool chlorinator solutions are typically stabilized by a significant concentration of lye (caustic soda, NaOH) as part of the manufacturing reaction. This additive will by itself cause caustic irritation or burns due to defatting and saponification of skin oils and destruction of tissue. The slippery feel of bleach on skin is due to this process.
Storage hazards[edit]
Contact of sodium hypochlorite solutions with metals may evolve flammable hydrogen gas. Containers may explode when heated due to release of chlorine gas.[14]
Hypochlorite solutions are corrosive to common container materials such as stainless steel[7] and aluminium. The few compatible metals include titanium (which however is not compatible with dry chlorine) and tantalum.[9] Glass containers are safe.[7] Some plastics and rubbers are affected too; safe choices include polyethylene (PE), high density polyethylene (HDPE, PE-HD), polypropylene (PP),[7] some chlorinated and fluorinated polymers such as polyvinyl chloride (PVC), polytetrafluoroethylene (PTFE), and polyvinylidene fluoride (PVDF); as well as ethylene propylene rubber, and Viton.[9]
Containers must allow venting of oxygen produced by decomposition over time, otherwise they may burst.[4]
Reactions with other common products[edit]
Mixing bleach with some household cleaners can be hazardous.
Sodium hypochlorite solutions, such as liquid bleach, will release toxic chlorine gas when mixed with an acid, such as hydrochloric acid or vinegar.
A 2008 study indicated that sodium hypochlorite and organic chemicals (e.g., surfactants, fragrances) contained in several household cleaning products can react to generate chlorinated volatile organic compounds (VOCs).[57] These chlorinated compounds are emitted during cleaning applications, some of which are toxic and probable human carcinogens. The study showed that indoor air concentrations significantly increase (8–52 times for chloroform and 1–1170 times for carbon tetrachloride, respectively, above baseline quantities in the household) during the use of bleach containing products. The increase in chlorinated volatile organic compound concentrations was the lowest for plain bleach and the highest for the products in the form of «thick liquid and gel.» The significant increases observed in indoor air concentrations of several chlorinated VOCs (especially carbon tetrachloride and chloroform) indicate that the bleach use may be a source that could be important in terms of inhalation exposure to these compounds. The authors suggested that using these cleaning products may significantly increase the cancer risk.[57]
In particular, mixing hypochlorite bleaches with amines (for example, cleaning products that contain or release ammonia, ammonium salts, urea, or related compounds and biological materials such as urine) produces chloramines.[58][14] These gaseous products can cause acute lung injury. Chronic exposure, for example, from the air at swimming pools where chlorine is used as the disinfectant, can lead to the development of atopic asthma.[59]
Bleach can react violently with hydrogen peroxide and produce oxygen gas:
- H2O2 (aq) + NaOCl (aq) → NaCl (aq) + H2O (aq) + O2 (g)
Explosive reactions or byproducts can also occur in industrial and laboratory settings when sodium hypochlorite is mixed with diverse organic compounds.[14]
Limitations in health care[edit]
The UK’s National Institute for Health and Care Excellence in October 2008 recommended that Dakin’s solution should not be used in routine wound care.[60]
Environmental impact[edit]
In spite of its strong biocidal action, sodium hypochlorite per se has limited environmental impact, since the hypochlorite ion rapidly degrades before it can be absorbed by living beings.[61]
However, one major concern arising from sodium hypochlorite use is that it tends to form persistent chlorinated organic compounds, including known carcinogens, that can be absorbed by organisms and enter the food chain. These compounds may be formed during household storage and use as well during industrial use.[41] For example, when household bleach and wastewater were mixed, 1–2% of the available chlorine was observed to form organic compounds.[41] As of 1994, not all the byproducts had been identified, but identified compounds include chloroform and carbon tetrachloride.[41][needs update] The exposure to these chemicals from use is estimated to be within occupational exposure limits.[41]
See also[edit]
- Calcium hypochlorite Ca(OCl)
2 («bleaching powder») - Potassium hypochlorite KOCl (the original «Javel water»)
- Lithium hypochlorite LiOCl
- Sodium hypochlorite washes
- Mixed oxidant
References[edit]
- ^ Budavari S, O’Neil M, Smith A, Heckelman P, Obenchain J (1996). «Sodium hypochlorite». The Merck Index (12th ed.). p. 1478. ISBN 978-0-911910-12-4.
- ^ Sodium hypochlorite: chemical activity
- ^ «sodium hypochlorite | chemical compound | Britannica». www.britannica.com. Retrieved 21 March 2022.
- ^ a b c Urben P (2006). Bretherick’s Handbook of Reactive Chemical Hazards. Vol. 1 (7th ed.). p. 1433. ISBN 978-0-08-052340-8.
- ^ a b c Hamano A (1997). «The formation and decomposition of sodium hypochlorite anhydrous salt and its pentahydrate». Science and Technology of Energetic Materials. 58 (4): 152–155.
- ^ a b Applebey MP (1919). «Sodium hypochlorite». Journal of the Chemical Society, Transactions. 115 (XCVI): 1106–1109. doi:10.1039/CT9191501106.
- ^ a b c d e f g h i j k Kirihara M, Okada T, Sugiyama Y, Akiyoshi M, Matsunaga T, Kimura Y (December 2017). «Sodium Hypochlorite Pentahydrate Crystals (NaOCl· 5H2O): A Convenient and Environmentally Benign Oxidant for Organic Synthesis». Organic Process Research & Development. 21 (12): 1925–37. doi:10.1021/acs.oprd.7b00288.
- ^ a b Topić, Filip; Marrett, Joseph M.; Borchers, Tristan H.; Titi, Hatem M.; Barrett, Christopher J.; Friščić, Tomislav (2021). «After 200 Years: The Structure of Bleach and Characterization of Hypohalite Ions by Single-Crystal X-Ray Diffraction». Angew. Chem. Int. Ed. 60 (46): 24400–24405. doi:10.1002/anie.202108843. PMID 34293249. S2CID 236199263.
- ^ a b c d e «OxyChem Sodium Hypochlorite Handbook» (PDF). OxyChem.
- ^ «Pamphlet 96, The Sodium Hypochorite Manual». The Chlorine Institute.
- ^ Faith, Thomas (2014). Behind the Gas Mask: The U.S. Chemical Warfare Service in War and Peace. Champaign, Illinois: University of Illinois Press. p. 9. ISBN 978-0252080265. Retrieved 14 April 2017.
- ^ «April 22, 1915: Germans introduce poison gas». This Day In History. Retrieved 14 April 2017.
- ^ Gross, Daniel A. (Spring 2015). «Chemical Warfare: From the European Battlefield to the American Laboratory». Distillations. 1 (1): 16–23. Retrieved 20 March 2018.
- ^ a b c d (2013): «Sodium Hypochlorite» Stanford Linear Accelerator Laboratory Safe Handling Guideline, chapter 53, product 202. Accessed on 2018-06-12
- ^ Yaws CL (2015). The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals (2nd ed.). Gulf Professional Publishing. p. 734. ISBN 978-0-12-801146-1.
- ^ ««Sodium Hypochlorite Pentahydrate, NaOCl·5H
2O]». MatWeb Material Property Data website. Retrieved 12 July 2018. - ^ a b «Sodium Hypochlorite». StudFiles. Retrieved 14 June 2018.
- ^ Okada T, Asawa T, Sugiyama Y, Iwai T, Kirihara M, Kimura Y (June 2016). «Sodium hypochlorite pentahydrate (NaOCl·5H2O) crystals; An effective re-oxidant for TEMPO oxidation». Tetrahedron. 72 (22): 2818–27. doi:10.1016/j.tet.2016.03.064.
- ^ a b c US 3498924, Walsh RH, Dietz A, «Process for preparing stable sodium hypochlorites», issued 1966
- ^ «Sodium hypochlorite». PubChem. U.S. National Library of Medicine.
- ^ Environment Canada (1985): «Tech Info for Problem Spills: Sodium Hypochlorite (Draft)».
- ^ Wang L, Bassiri M, Najafi R, Najafi K, Yang J, Khosrovi B, et al. (April 2007). «Hypochlorous acid as a potential wound care agent: part I. Stabilized hypochlorous acid: a component of the inorganic armamentarium of innate immunity». Journal of Burns and Wounds. 6: e5. PMC 1853323. PMID 17492050.
- ^ a b c d e f Sandin S, Karlsson RK, Cornell A (April 2015). «Catalyzed and uncatalyzed decomposition of hypochlorite in dilute solutions». Industrial & Engineering Chemistry Research. 54 (15): 3767–74. doi:10.1021/ie504890a.
- ^ a b Hamano A, Ikeda A (1995). «The pH effect on the photodecomposition of sodium hypochlorite solution». Science and Technology of Energetic Materials. 56 (2): 59–63.
- ^ Ayres GH, Booth MH (1955). «Catalytic Decomposition of Hypochlorite Solution by Iridium Compounds. I. The pH-Time Relationship». Journal of the American Chemical Society. 77 (4): 825–827. doi:10.1021/ja01609a001.
- ^ ASC – PT Asahimas Chemical (2009): «Sodium hypochlorite». Online product description. Accessed on 2018-06-14.
- ^ Mirafzal GA, Lozeva AM (1998). «Phase transfer catalyzed oxidation of alcohols with sodium hypochlorite». Tetrahedron Letters. 39 (40): 7263–7266. doi:10.1016/S0040-4039(98)01584-6.
- ^ Eaton, Andrew D.; Greenberg, Arnold E.; Rice, Eugene W.; Clesceri, Lenore S.; Franson, Mary Ann H., eds. (2005). Standard Methods For the Examination of Water and Wastewater (21 ed.). American Public Health Association. ISBN 978-0-87553-047-5. Method 9060a. Also available on CD-ROM and online by subscription.
- ^ Vogt H, Balej J, Bennett JE, Wintzer P, Sheikh SA, Gallone P (2007). «Chlorine Oxides and Chlorine Oxygen Acids». Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.). Wiley. p. 2.
- ^ a b «Sodium hypochlorite as a disinfectant». Lenntech.com. Retrieved 7 August 2011.
- ^ «eusol». Oxford English Dictionary. Archived from the original on 31 August 2013. Retrieved 3 July 2014.
- ^ May P. «Bleach (Sodium Hypochlorite)». University of Bristol. Archived from the original on 13 December 2016. Retrieved 13 December 2016.
- ^ «How Products Are Made Volume 2». May 2011.
- ^ US 5194238, Duncan BL, Ness RC, «Process for the production of highly pure concentrated slurries of sodium hypochlorite», issued 1991
- ^ «SAFETY DATA SHEET Sodium Hypochlorite» (PDF). Univar. 9 August 2007.
- ^ Wastewater Engineering: Treatment, Disposal, & Reuse (3rd ed.). Metcalf & Eddy, Inc. 1991. p. 497.
- ^ Lantagne DS (2018). «Sodium hypochlorite dosage for household and emergency water treatment». IWA Publishing. 16 (1).
- ^ «What is Chlorination?».
- ^ Vieira ER (1999). Elementary Food Science. Springer. pp. 381–382. ISBN 978-0-8342-1657-0.
- ^ Wilhelm N, Kaufmann A, Blanton E, Lantagne D (February 2018). «Sodium hypochlorite dosage for household and emergency water treatment: updated recommendations». Journal of Water and Health. 16 (1): 112–125. doi:10.2166/wh.2017.012. PMID 29424725.
- ^ a b c d e Smith WT. (1994). Human and Environmental Safety of Hypochlorite. In: Proceedings of the 3rd World Conference on Detergents: Global Perspectives, pp. 183–5.
- ^ a b «Benefits and Safety Aspects of Hypochlorite Formulated in Domestic Products» (PDF). AISE – International Association for Soaps, Detergents and Maintenance Products. March 1997. Archived from the original (PDF) on 30 March 2014.
This Support Dossier deals with information on the environmental and human safety evaluation of hypochlorite, and on its benefits as a disinfecting, deodorising and stain removing agent.
- ^ Cárdenas Flores A, Flores Reyes H, Gordillo Moscoso A, Castanedo Cázares JP, Pozos Guillén A (2009). «Clinical efficacy of 5% sodium hypochlorite for removal of stains caused by dental fluorosis». The Journal of Clinical Pediatric Dentistry. 33 (3): 187–91. doi:10.17796/jcpd.33.3.c6282t1054584157. PMID 19476089.
- ^ a b c Rutala WA, Weber DJ (15 February 2017) [2008]. «Guideline for Disinfection and Sterilization in Healthcare Facilities» (PDF). www.cdc.gov. Retrieved 29 August 2017.
- ^ a b «For General Healthcare Settings in West Africa: How to Prepare and Use Chlorine Solutions». Ebola Hemorrhagic Fever. Centers for Disease Control and Prevention. Retrieved 27 April 2016.
- ^ «How to Make Strong (0.5%) Chlorine Solution from Liquid Bleach» (PDF). Centers for Disease Control and Prevention.
- ^ Meyers J, Ryndock E, Conway MJ, Meyers C, Robison R (June 2014). «Susceptibility of high-risk human papillomavirus type 16 to clinical disinfectants». The Journal of Antimicrobial Chemotherapy. 69 (6): 1546–50. doi:10.1093/jac/dku006. PMC 4019329. PMID 24500190.
- ^
- ^ 21 CFR Part 178
- ^ «Toilet Cleaners: Learn About Chemicals Around Your House: Pesticides: US EPA». United States Environmental Protection Agency. 9 May 2012.
- ^ a b Root Canal Irrigants and Disinfectants. Endodontics: Colleagues for Excellence. Published for the Dental Professional Community by the American Association of Endodontists. Winter 2011.
- ^ Torabinejad M, Walton R (2008). Endodontics. VitalBook (4th ed.). W.B. Saunders Company. p. 265.
- ^ Hülsmann M, Hahn W (May 2000). «Complications during root canal irrigation—literature review and case reports» (PDF). International Endodontic Journal. 33 (3): 186–93. doi:10.1046/j.1365-2591.2000.00303.x. PMID 11307434.
- ^ a b Conger K (15 November 2013). «Inflammatory skin damage in mice blocked by bleach solution, study finds». Stanford School of Medicine. Archived from the original on 7 December 2013.
- ^ Pett K, Batta K, Vlachou C, Nicholls G. «Bleach baths using Milton Sterilising Fluid for recurrent infected atopic eczema». www.eczema.org. Archived from the original on 12 December 2013.
- ^ Leung TH, Zhang LF, Wang J, Ning S, Knox SJ, Kim SK (December 2013). «Topical hypochlorite ameliorates NF-κB-mediated skin diseases in mice». The Journal of Clinical Investigation. 123 (12): 5361–70. doi:10.1172/JCI70895. PMC 3859383. PMID 24231355.
- ^ a b Odabasi M (March 2008). «Halogenated volatile organic compounds from the use of chlorine-bleach-containing household products» (PDF). Environmental Science & Technology. 42 (5): 1445–1451. Bibcode:2008EnST…42.1445O. doi:10.1021/es702355u. PMID 18441786.
- ^ Krieger GR, Sullivan JB Jr (2001). Clinical environmental health and toxic exposures (2nd ed.). Philadelphia, Pa.: Lippincott Williams & Wilkins. p. 968. ISBN 9780683080278. Retrieved 30 August 2016.
- ^ Nickmilder M, Carbonnelle S, Bernard A (February 2007). «House cleaning with chlorine bleach and the risks of allergic and respiratory diseases in children». Pediatric Allergy and Immunology. 18 (1): 27–35. doi:10.1111/j.1399-3038.2006.00487.x. PMID 17295796. S2CID 24606118.
- ^ Do not use Eusol and gauze to manage surgical wounds that are healing by secondary intention, October 2008, NICE, London Archived 14 July 2014 at the Wayback Machine.Accessed 3 July 2014.
- ^ ASC – PT Asahimas Chemical (2009): «Sodium hypochlorite 10%». Online Material Safety Data Sheet (MSDS). Accessed on 2018-06-14.
Bibliography[edit]
- Jones FL (December 1972). «Chloride poisoning from mixing household cleaners». JAMA. 222 (10): 1312. doi:10.1001/jama.222.10.1312. PMID 4678160.
- Bonnard M, Brondeau MT, Falcy M, Jargot D, Miraval S, Protois J, Schneider O. «Eaux et extraits de Javel Hypochlorite de sodium en solution». Fiche Toxicologique. 157.
External links[edit]
- International Chemical Safety Card 0482 (solutions<10% active Cl)
- International Chemical Safety Card 1119 (solutions >10% active Cl)
- Institut national de recherche et de sécurité (in French)
- Home and Leisure Accident Statistics 2002 (UK RoSPA)
- Emergency Disinfection of Drinking Water (United States Environmental Protection Agency)
- Chlorinated Drinking Water (IARC Monograph)
- NTP Study Report TR-392: Chlorinated & Chloraminated Water (US NIH)
- Guidelines for the Use of Chlorine Bleach as a Sanitizer in Food Processing Operations (Oklahoma State University)
| Гипохлорит натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода[К 1] |
| Химическая формула | NaOCl |
| Эмпирическая формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574[1] г/см³; 1,1[2] г/см³ |
| Термические свойства | |
| Температура плавления | NaOCl · 5H2O[К 2]: 24,4 °C; NaOCl · 2,5H2O: 57,5[3] °C |
| Температура разложения | 5%-й раствор[2]: 40 |
| Энтальпия образования (ст. усл.) | пентагидрат[К 3]: − 350,4[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4[4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9[4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| Регистрационный номер EC | 231-668-3 |
| RTECS | NH3486300 |
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl[К 4], неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода»[К 1].
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора[К 5]. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007)[2], гипохлорит натрия входит в сотню самых важных химических соединений.
Содержание
- 1 История открытия
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Разложение и диспропорционирование
- 3.2 Гидролиз и разложение в водных растворах
- 3.3 Окислительные свойства
- 4 Идентификация
- 5 Коррозионное воздействие
- 6 Физиологическое действие и воздействие на окружающую среду
- 7 Лабораторные методы получения
- 8 Промышленное производство
- 8.1 Мировое производство
- 8.2 Обзор промышленных способов получения
- 8.3 Химический метод
- 8.4 Электрохимический метод
- 8.5 Характеристика продукции, обращение, хранение и транспортировка
- 9 Применение
- 9.1 Обзор направлений использования
- 9.2 Применение в бытовой химии
- 9.3 Применение в медицине
- 9.4 Промышленное применение
- 9.4.1 Применение в качестве промышленного отбеливателя
- 9.4.2 Применение в качестве промышленного дезинфицирующего средства
- 9.4.3 Использование для дезинфекции воды
- 9.5 Производство гидразина
- 9.6 Применение в промышленном органическом синтезе
- 9.7 Применение в лабораторном органическом синтезе
- 9.8 Прочие направления использования
- 10 См. также
- 11 Комментарии
- 12 Примечания
- 13 Литература
- 14 Ссылки
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор[5]. Спустя 11 лет в 1785 году (по другим данным — в 1787 году[2]), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см. уравнение (1)) обладает отбеливающими свойствами[6][К 6].
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия) (см. уравнение (2)), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения[7].
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия) (см. уравнение (3)). Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» («лабарракова вода»). Он стал широко использоваться для отбеливания и дезинфекции[7].
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге[2]; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити[8].
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C)[9].
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом[3].
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C[3].
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой белые (по другим данным — бледно-зелёные[10]) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 грамм воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения[3]. Температура плавления: 24,4 °C (по другим данным: 18 °C[10]), при нагревании (30—50 °C) разлагается[1].
Плотность водного раствора гипохлорита натрия при 18 °C[11]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций[12]:[стр. 458]:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе[13]:
- стандартная энтальпия образования, ΔHo298: −350,4 кДж/моль;
- стандартная энергия Гиббса, ΔGo298: −298,7 кДж/моль.
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора[К 5][13]. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом[14].
При нагревании параллельно происходит реакция диспропорционирования[13]:
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537[13]), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства[13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки[3]). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11)[3].
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом[15]:
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования[15]:
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды[16].
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде[17][К 7]:
-
- в кислой среде:
-
- в нейтральной и щелочной среде:
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
-
- Иодиды щелочных металлов окисляются до иода (в слабокислой среде), иодата (в нейтральной среде) или периодата (в щелочной среде)[13]:
-
- Сульфиты окисляются в сульфаты, нитриты в нитраты, оксалаты и формиаты в карбонаты и т. п.[13]:
-
- Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот[18]:[стр. 169]:
-
- Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин (аналогично реагирует и мочевина)[18]:[стр. 181]:
- См. подробнее подраздел «Производство гидразина».
-
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления[18]:[стр. 138, 308][19]:[стр. 200]:
- По аналогии можно осуществить превращения: Fe(II) → Fe(III) → Fe(VI); Co(II) → Co(III) → Co(IV); Ni(II) → Ni(III); Ru(IV) → Ru(VIII); Ce(III) → Ce(IV) и прочие[20].
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия[21].
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА)[К 8] или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА)[К 9] с использованием бром-ионоселективного электрода (Br-ИСЭ)[22].
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия)[23].
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные[24]:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | < 0,08 мм/год |
| 20 | водный раствор | 20 | > 10 мм/год | |
| Медные сплавы: БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 |
10 | водный раствор | 20 | > 10 мм/год |
| Никель | < 34 | водный раствор | 20 | 0,1—3,0 мм/год |
| Никелевый сплав НМЖМц28-2,5-1,5 | < 34; активный хлор: 3 | водный раствор | 20 | 0,007 мм/год |
| Никелевый сплав Н70МФ | < 34 | водный раствор | 35—100 | < 0,004 мм/год |
| Платина | < 34 | водный раствор | < 100 | < 0,1 мм/год |
| Свинец | < 34; активный хлор: 1 | водный раствор | 20 | 0,54 мм/год |
| 40 | 1,4 мм/год | |||
| Серебро | < 34 | водный раствор | 20 | < 0,1 мм/год |
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | < 0,05 мм/год |
| 0,1; pH > 10 | водный раствор | 20 | < 0,1 мм/год | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | < 34; активный хлор: 2 | водный раствор | 40 | < 0,001 мм/год |
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | < 34 | водный раствор | 20—T кип. | < 0,1 мм/год |
| Тантал | < 34 | водный раствор | 20 | < 0,05 мм/год |
| Титан | 10—20 | водный раствор | 25—105 | < 0,05 мм/год |
| 40 | водный раствор | 25 | < 0,05 мм/год | |
| Цирконий | 10 | водный раствор | 30—110 | < 0,05 мм/год |
| 20 | водный раствор | 30 | < 0,05 мм/год | |
| Чугун серый | < 0,1; pH > 7 | водный раствор | 25 | < 0,05 мм/год |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | < 34 | водный раствор | 25—105 | < 1,3 мм/год |
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит, пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | < 34 | водный раствор | 20—60 | стоек |
| Поливинилхлорид | < 34 | водный раствор | 20 | стоек |
| 65 | относительно стоек | |||
| Полиизобутилен | < 34 | водный раствор | 20 | стоек |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | < 34 | водный раствор | 20 | стоек |
| Полиэтилен | < 34 | водный раствор | 20—60 | стоек |
| Полипропилен | < 34 | водный раствор | 20—60 | стоек |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | < 34 | водный раствор | 20—93 | стоек |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | < 34 | водный раствор | 20—60 | стоек |
| Стекло | < 34 | водный раствор | 20—60 | стоек |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | < 100 | стоек |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен, тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями[25].
Грибки, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis[К 10] погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia[К 11], погибают в течение 15 секунд после обработки 5,0—0,5%-м раствором NaOCl[26].
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов. В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl («+» — токсин инактивирован; «−» — токсин остался активен)[27]:
| Токсин | 2,5 % NaOCl + 0,25 н NaOH |
2,5 % NaOCl | 1,0 % NaOCl | 0,1 % NaOCl |
|---|---|---|---|---|
| Т-2 микотоксин | + | − | − | − |
| Бреветоксин | + | + | − | − |
| Микроцистин | + | + | + | − |
| Тетродотоксин | + | + | + | − |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
На организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации разделов желудочно-кишечного тракта[28].
Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов[29].
Пероральная токсичность соединения[30]:
- Мыши: ЛД50 (англ. LD50) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза (англ. TDLo) = 1000 мг/кг.
Внутривенная токсичность соединения[30]:
- Человек: минимально известная токсическая доза (англ. TDLo) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах[29].
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Рейтинг NFPA 704 для концентрированных растворов (10—20 %)[31]: [К 12]
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия[32]:
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой[32].
Вместо гидроксида для синтеза можно взять карбонат натрия[33]:
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция[34]:
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», т. е. на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд[2].
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия[35].
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
- основной процесс, где в качестве конечного продукта образуется разбавленный (около 16 % NaOCl) раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный (25—40 % NaOCl) с меньшим уровнем загрязнения[36]:[стр. 447—449].
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком (см. подраздел «История открытия»):
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте[2].
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке[36]:[стр. 442]:
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора[36]:[стр. 450]:
В России товарный гипохлорит натрия производят следующие предприятия:
- «Каустик», ЗАО (Стерлитамак)[37];
- «Каустик», ОАО (Волгоград)[38];
- «Новомосковский хлор», ООО (Новомосковск)[39];
- «Сода-хлорат», ООО (Березники)[40].
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе[41].
Процесс на аноде:
Процесс на катоде:
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных[41].
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec[42].
Система Seaclor® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день[43]. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %[44].
Установки Sanilec® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день[45], концентрация активного хлора составляет 0,05—0,25 %[46].
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже[47]:
| Наименование показателя | Марка А | Марка Б |
|---|---|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета | |
| Коэффициент светопропускания | Не менее 20 % | |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности (как окислитель) и для обеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов[47].
Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl, что наглядно иллюстрирует следующая таблица[12]:[стр. 469]:
| Концентрация NaOCl, % | Период полуразложения, дней | |
|---|---|---|
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Применение
Обзор направлений использования
Географическая структура мирового потребления гипохлорита натрия в 2008 году
Среди четырёх неорганических гипохлоритов, имеющих промышленное значение, гипохлорит натрия является безусловным лидером, занимая 91 % мирового рынка; почти 9 % остаётся за гипохлоритом кальция — гипохлориты калия и лития имеют незначительные объёмы использования[48].
Весь широкий спектр использования гипохлорита натрия можно разбить на три условные группы:
- использование для бытовых целей;
- использование для промышленных целей;
- использование в медицине.
Бытовое использование включает в себя:
- использование в качестве средства для дезинфекции и антибактериальной обработки;
- использование для отбеливания тканей;
- химическое растворение санитарно-технических отложений.
Промышленное использование включает в себя:
- промышленное отбеливание ткани, древесной массы и некоторых других продуктов;
- промышленная дезинфекция и санитарно-гигиеническая обработка;
- очистка и дезинфекция питьевой воды для систем коммунального водоснабжения;
- очистка и обеззараживание промышленных стоков;
- химическое производство.
По оценке экспертов SRI Consulting, около 67 % всего гипохлорита натрия используется в качестве отбеливателя и 33 % для нужд дезинфекции и очистки, причём последнее направление имеет тенденцию к росту. Общий глобальный рост объёмов потребления NaOCl оценивается в 1,4 % в год[48].
Бытовой отбеливатель Clorox
Применение в бытовой химии
Гипохлорит натрия находит широкое применение в бытовой химии и входит в качестве активного ингредиента многочисленных средств, предназначенных для отбеливания, очистки и дезинфекции различных поверхностей и материалов. Обычно, в быту применяются растворы с концентрацией в диапазоне от 3 до 6 % гипохлорита[49].
Коммерческая доступность и высокая эффективность действующего вещества определяет его широкое использование различными производственными компаниями, где гипохлорит натрия или средства на его основе выпускаются под различными торговыми марками, некоторые из которых представлены в таблице:
| Торговая марка | Производитель | Назначение | Концентрация NaOCl |
|---|---|---|---|
| Белизна[50] | ОАО «Саянскхимпласт» | Бытовой отбеливатель, пятновыводитель и дезинфицирующее средство | 4 %; 7 % |
| Clorox Regular-Bleach[51] | The Clorox Company | Бытовой отбеливатель, пятновыводитель и дезинфицирующее средство | 6 % |
| Clorox Washing Machine Cleaner[52] | The Clorox Company | Очиститель для стиральных машин | 5—10 % |
| Cascade Complete® with Bleach (gel)[53] | Procter & Gamble Company | Средство для автоматических посудомоечных машин | 1—5 % |
| Aquachem Chlorinizor[54] | Sunbelt Chemicals Corp. | Средство для дезинфекции бассейнов | 10 % |
| Brite Bleach[54] | Sunbelt Chemicals Corp. | Бытовой отбеливатель и дезинфицирующее средство | 5,25 % |
| Lysol Bleach Toilet Bowl Cleaner[55] | Reckitt Benckiser | Средство для очистки туалета | 2 % |
| Tiret[К 13] | Reckitt Benckiser | Средство для устранения засоров труб | нет данных |
| Domestos гель[К 14] | Unilever | Средство для чистки и дезинфекции | 5 % |
Применение в медицине
Использование гипохлорита натрия для дезинфекции ран впервые было предложено не позднее 1915 года[56]. В современной медицинской практике антисептические растворы гипохлорита натрия используются, в основном, для наружного и местного применения в качестве противовирусного, противогрибкового и бактерицидного средства при обработке кожи, слизистых оболочек и ран[57]. Гипохлорит активен в отношении многих грамположительных и грамотрицательных бактерий, большинства патогенных грибов, вирусов и простейших, хотя его эффективность снижается в присутствии крови или её компонентов[58].
Низкая стоимость и доступность гипохлорита натрия делает его важным компонентом для поддержания высоких гигиенических стандартов во всём мире. Это особенно ярко проявляется в развивающихся странах, где использование NaOCl стало решающим фактором для остановки холеры, дизентерии, брюшного тифа и других водных биотических заболеваний. Так, при вспышки холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, что было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера[29].
Для медицинских целей в России гипохлорит натрия используется в качестве 0,06%-го раствора для внутриполостного и наружного применения, а также раствора для инъекций. В хирургической практике он применяется для обработки, промывания или дренирования операционных ран и интраоперационной санации плевральной полости при гнойных поражениях; в акушерстве и гинекологии — для периоперационной обработки влагалища, лечения бартолинита, кольпита, трихомониаза, хламидиоза, эндометрита, аднексита и т. п.; в оториноларингологии — для полосканий носа и горла, закапывания в слуховой проход; в дерматологии — для влажных повязок, примочек, компрессов при различных видах инфекций[58].
В стоматологической практике гипохлорит натрия наиболее широко применяется в качестве антисептического ирригационного раствора (концентрация NaOCl 0,5—5,25 %) в эндодонтии[К 15][59]. Популярность NaOCl определяется общедоступностью и дешевизной раствора, а также бактерицидным и противовирусным эффектом в отношении таких опасных вирусов как ВИЧ, ротавирус, вирус герпеса, вирусы гепатита A и B[56]. Имеются данные об использовании гипохлорита натрия для лечения вирусных гепатитов: он обладает широким спектром противовирусных, детоксикационных и антиоксидантных эффектов[60]. Растворы NaOCl можно использовать в целях стерилизации некоторых медицинских изделий, предметов ухода за больными, посуды, белья, игрушек, помещений, твёрдой мебели, сантехнического оборудования. Из-за высокой коррозионной активности, гипохлорит не применяют для металлических приборов и инструментов. Отметим также применение растворов гипохлорита натрия в ветеринарии: они используются для дезинфекции животноводческих помещений[61].
Промышленное применение
Применение в качестве промышленного отбеливателя
Использования гипохлорита натрия в качестве отбеливателя является одним из приоритетных направлений промышленного использования наряду с дезинфекцией и очисткой питьевой воды. Мировой рынок только в этом сегменте превышает 4 млн тонн[К 16][29].
Обычно, для промышленных нужд в качестве отбеливателя используются водные растворы NaOCl, содержащие 10—12 % действующего вещества[29].
Гипохлорит натрия широко используется в качестве отбеливателя и пятновыводителя в текстильном производстве и промышленных прачечных и химчистках. Он может быть безопасно использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лён, вискозу и другие. Он очень эффективен для удаления следов почвы и широкого спектра пятен в том числе, кровь, кофе, трава, горчица, красное вино и т. д.[29]
Гипохлорит натрия также используется в целлюлозно-бумажной промышленности для отбелки древесной массы[62]. Отбелка с использованием NaOCl обычно следует за этапом хлорирования и является одной из ступеней химической переработки древесины, используемой для достижения высокой степени белизны целлюлозы. Обработку волокнистых полуфабрикатов проводят в специальных башнях гипохлоритной отбелки в щелочной среде (pH 8—9), температуре 35—40 °C, в течение 2—3 часов. В течение этого процесса происходит окисление и хлорирование лигнина, а также разрушение хромофорных групп органических молекул[63].
Применение в качестве промышленного дезинфицирующего средства
Широкое применение гипохлорита натрия в качестве промышленного дезинфицирующего средства связано, прежде всего, со следующими направлениями[49]:
- дезинфекция питьевой воды перед подачей в распределительные системы городского водоснабжения;
- дезинфекция воды плавательных бассейнов и прудов;
- обработка бытовых и промышленных сточных вод, очистка от органических и неорганических примесей;
- в пивоварении, виноделии, молочной промышленности — дезинфекция систем, трубопроводов, резервуаров;
- фунгицидная и бактерицидная обработка зерна;
- дезинфекция воды рыбохозяйственных водоёмов;
- дезинфекция технических помещений.
Гипохлорит как дезинфектант входит в состав некоторых средств для поточной автоматизированной мойки посуды и некоторых других жидких синтетических моющих средств[64].
Промышленные дезинфицирующие и отбеливающие растворы выпускаются многими производителями под различными торговыми марками, некоторые из которых представлены в таблице:
| Торговая марка | Производитель | Назначение | Концентрация NaOCl |
|---|---|---|---|
| Форэкс-Хлор[65] | ДНПК «Альфа» | средство для дезинфекции и санитарной обработки | 4 % (в пересчёте на активный хлор) |
| Эмовекс[66] | ООО «Макропул Кемиклс» | средство для дезинфекции бассейнов | не менее 130 г/л (в пересчёте на активный хлор) |
| Bleach Concentratte[67] | Harvard Chemical Company | промышленный отбеливатель | 12,5—15 % (в пересчёте на активный хлор) |
| Liquid Bleach[68] | Hill Brothers Chemical Co. | промышленный отбеливатель и дезинфектант | 10 %; 12,5 % |
| Clorox Bleach[69] | The Clorox Company | отбеливатель для прачечных | 6,5—7,35 % |
| Poolchlor 1[70] | Hasa Inc. | жидкость для санитарной обработки бассейнов и спа | 10 % |
Использование для дезинфекции воды
Окислительная дезинфекция с помощью хлора и его производных — едва ли не самый распространённый практический метод обеззараживания воды, начало массового использование которого многими странами Западной Европы, США и Россией датируется первой четвертью XX века[71]:[стр. 17].
Использование гипохлорита натрия в качестве дезинфицирующего агента в отличие от применения хлора обладает рядом существенных достоинств:
- реагент можно получать электрохимическим методом непосредственно в месте использования;
- достижение необходимых показателей качества питьевой воды достигается за счёт более низкой доли активного хлора;
- концентрация хлорорганических примесей в очищенной воде существенно ниже;
- применение данного вещества позволяет повысить экологическую и гигиеническую безопасность[71]:[стр. 36].
Для целей очистки бытовой воды используются разбавленные растворы гипохлорита натрия: типовая концентрация активного хлора в них составляет 0,2—2 мг/л против 1—16 мг/л для газообразного хлора[72].
Также с технической точки зрения, для условий использования в РФ, эксперты отмечают:
- существенно более высокую безопасность технологии;
- меньшие требования к средствам безопасности;
- данная технология обеззараживания неподведомственна Ростехнадзору РФ[73].
Использование гипохлорита натрия для дезинфекции воды в России пока не получило широкого применения, но активно внедряется в практику. Так, в конце 2009 года, в Люберцах началось строительство завода по производству NaOCl мощностью 50 тыс. тонн/год для нужд Московского городского хозяйства. Правительством Москвы было принято решение о переводе систем обеззараживания воды московских станции водоподготовки с жидкого хлора на гипохлорит натрия, который завершится ориентировочно в 2012 году[74], когда завод по производству гипохлорита натрия будет введён в эксплуатацию. Строительство ведётся силами ЗАО «Газинстрой».
Среди других российских городов, где применяется или планируется к применению гипохлорит натрия для обеззараживания воды, отметим Санкт-Петербург[75], Кемерово[76], Ростов-на-Дону[77], Иваново[78], Сыктывкар[79].
Производство гидразина
Гипохлорит натрия используется в так называемом процесса Рашига (англ. Raschig Process, окисление аммиака гипохлоритом) — основном промышленном способе получения гидразина, открытого немецким химиком Фридрихом Рашигом в 1907 году. Химия процесса выглядит следующим образом: на первой стадии аммиак окисляется до хлорамина, который затем, реагирует с аммиаком, образуя собственно гидразин[80]:
Общая схема:
В качестве побочной реакции наблюдается взаимодействие гидразина с хлорамином[80]:
Процесс Рашига протекает в щелочной среде (pH 8—10) при избытке аммиака, повышенном давлении (2,5—3,0 МПа) и температуре 120—160 °C[81]. Выход гидразина (по гипохлориту) в итоге может достигать 80 %[82].
Даже незначительные количества катионов некоторых тяжёлых металлов, особенно двухвалентной меди, могут существенно увеличить долю побочной реакции, в связи с чем, в реакционную смесь добавляют небольшое количество желатина или специального клея для связывания ионов в нереакционный комплекс[82].
Модификацией процесса Рашига стал процесс Хофмана (англ. Hoffmann Process или англ. Urea Process), где вместо аммиака используется мочевина[83]:
В процессе используется 43%-й раствор мочевины с добавками специального реагента (приблизительно 0,5 г/л) для ингибирования побочной реакции и увеличения выхода конечного продукта. Раствор гипохлорита натрия используется в соотношении к раствору мочевины, как 4:1; температура в реакторе не превышает 100 °C[83].
Применение в промышленном органическом синтезе
Сильные окислительные свойства гипохлорита натрия используются в промышленном органическом синтезе для получения различных соединений, среди которых:
- антраниловая кислота — промежуточный продукт в синтезе красителей[84];
- метансульфоновая кислота — промежуточный продукт в синтезе лекарственных препаратов и электролитов для получения покрытий драгоценными металлами[85]:[стр. 92]:
- хлорпикрин — инсектицид[85]:[стр. 269];
- аскорбиновая кислота (синтетическая) — лекарственное средство (витамин С) и консервант в пищевой промышленности[86];
- дихлоризоциануровая и трихлоризоциануровая кислота — инсектициды, дезинфектанты и полупродукты для синтеза пестицидов[87];
- крахмал окисленный (E1404) — пищевая добавка, используемая в качестве загустителя, носителя и улучшителя для хлебопекарных изделий[88].
Применение в лабораторном органическом синтезе
Гипохлорит натрия находит широкое применение в лабораторной органической практике прежде всего, из-за своих сильных окислительных свойств и доступности как реактива.
Окислительные возможности NaOCl используются в следующих превращениях:
- метилендиамин → диазометан[89];
- алкены → эпоксиды[90]:[стр. 1053];
- первичные спирты → альдегиды[91] или карбоновые кислоты[92];
- вторичные спирты → кетоны[93];
- метилкетоны → карбоновые кислоты (с уменьшением цепи на один атом углерода)[91];
- Эта реакция лежит в основе галоформного расщепления и может служить лабораторным методом получения хлороформа или иодоформа[94]:
- α-аминокислоты → альдегиды (с уменьшением цепи на один атом углерода)[95];
- первичные амины → нитрилы[90]:[стр. 1518] или карбонильные соединения[91];
- галогенуглеводороды → карбоновые кислоты[К 17][90]:[стр. 565];
- органические сульфиды → сульфоксиды[96];
- органические сульфиды → сульфоны[97];
- органобораны → первичные амины[90]:[стр. 799—800];
Среди других вариантов использования отметим:
- реагент (в виде 5%-го водного раствора) для качественного или количественного определения аргинина в смеси аминокислот (реакция Сакагучи)[98];
- реагент для N-хлорирования аминов[90]:[стр. 819];
- реагент для хлорирования ароматических соединений[99] и аллильного хлорирования алкенов[100];
- реагент для синтеза органических гипохлоритов[101].
Прочие направления использования
Среди прочих направлений использования гипохлорита натрия отметим:
- в промышленном органическом синтезе или гидрометаллургическом производстве для дегазации токсичных жидких и газообразных отходов, содержащих циановодород или цианиды[102];
- окислитель для очистки сточных вод промышленных предприятий от примесей сероводорода, неорганических гидросульфидов, сернистых соединений, фенолов и др.[103];
- в электрохимических производствах в качестве травителя для германия и арсенида галлия[104];
- в аналитической химии как реагент для фотометрического определения бромид-иона[105];
- в пищевой и фармацевтической промышленности для получения пищевого модифицированного крахмала[106];
- в военном деле как средство для дегазации боевых отравляющих веществ, таких как иприт[107], льюизит[108], зарин и V-газы[109].
См. также
- Гипохлориты
- Жавелевая вода
- Лабарракова вода
- Отбеливание
- Хлорная известь
- Хлорноватистая кислота
Комментарии
- ↑ 1 2 Строго говоря, и «лабарракова вода» и «жавелевая вода» обозначают водные растворы смеси солей (хлорида и гипохлорита), соответственно, натрия и калия, что объясняется технологией производства: их получали, пропуская газообразный хлор через водный раствор гидроксида или карбоната щелочного металла. Вместе с тем, хотя исторически название «жавелевая вода» относилась к гипохлориту калия, на практике (в том числе и в литературе) под этим названием нередко фигурирует и гипохлорит натрия.
- ↑ Для безводного гипохлорита натрия фазовый переход не удаётся обнаружить из-за разложения соединения.
- ↑ В бесконечно разбавленном водном растворе.
- ↑ Несмотря на то, что в настоящей статье используется формула гипохлорита натрия NaOCl (натрий не связан с хлором напрямую), в научной литературе фигурирует как формула NaOCl, так и NaClO, причём последний вариант встречается довольно часто. В настоящей статье использован вариант NaOCl, что связано с подобным написанием формулы в специальной литературе последних лет:
- White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 454. — ISBN 978-0-470-18098-3
- Housecroft C. E., Sharpe A. G. Inorganic Chemistry. — Third edition. — Edinburgh: Pearson Education Limited, 2007. — P. 553. — ISBN 978-0-13-175553-6
- Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 2: Химия непереходных элементов. — С. 307—308. — ISBN 5-7695-1436-1
- ↑ 1 2 Под «активным хлором» понимается количество хлора, выделяющегося при взаимодействии с HCl. В чистом хлоре содержится 100 % «активного хлора». Содержание «активного хлора» в процентах рассчитывается как отношение массы одного моля хлора (70,9 г) к массе искомого вещества, способного при реакции с HCl выделить один моль хлора (74,5 г для NaOCl).
- ↑ До открытия отбеливающих свойств хлора и его производных отбелка ткани представляла собой весьма трудоёмкий и длительный процесс, часто длившийся до восьми недель. Полотно вымачивали в кислом молоке или пахте, а также долго выдерживали под солнцем. Только в 1756 году была совершена первая попытка применить химическое отбеливание для отбеливания ткани: шведский химик Френсис Хоум предложил использовать слабый раствор серной кислоты, сократив время процедуры до 12 часов.
- ↑ Приведены значения стандартных электродных потенциалов в водных растворах при температуре 25 °C и давлении 1 атм. Величины потенциалов выражены в вольтах по отношению к стандартному потенциалу водородного электрода, принятому при всех температурах за нуль.
- ↑ МДА — метод основан на прибавлении точно измеренного объёма пробы к стандартному раствору определяемого иона, специфически определяемого ионоселективным электродом.
- ↑ МУА — метод основан на прибавлении точно измеренной пробы к раствору, содержащему ион, который стехиометрически взаимодействует с определяемым ионом и специфически определяется ионоселективным электродом.
- ↑ Enterococcus faecalis — патогенная флора мочевых и половых путей.
- ↑ Все перечисленные виды — патогенная флора околозубной ткани.
- ↑ Расшифровка обозначений:
- синий цвет — опасность для здоровья;
- красный цвет — пожароопасность;
- жёлтый цвет — химическая активность.
Цифры от 0 до 4 обозначают класс опасности, 4 — самый высокий уровень.
- ↑ Гипохлорит натрия входит в состав средства, согласно данным на упаковке.
- ↑ Гипохлорит натрия входит в состав средства, согласно данных на упаковке.
- ↑ Эндодонтия — раздел стоматологии, занимающийся изучением и лечением системы корневых каналов зуба.
- ↑ По данным на 90-е годы XX века в расчёте на брутто-вес (водный раствор гипохлорита).
- ↑ Реакция идёт в присутствии катализатора Na2Fe(CO)4.
Примечания
- ↑ 1 2 Лидин Р. А., Андреева Л. Л., Молочко В. А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 137. — ISBN 5-7107-8085-5
- ↑ 1 2 3 4 5 6 7 Myers R. L. The 100 Most Important Chemical Compounds: A Reference Guide. — Westport: Greenwood Press, 2007. — P. 260. — ISBN 978-0-313-33758-1
- ↑ 1 2 3 4 5 6 7 Натрия гипохлорит // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 355. — ISBN 5-85270-039-8
- ↑ 1 2 Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 618. — ISBN 5-7107-8085-5
- ↑ Хлор, Chlorum, Cl (17). Открытие элементов и происхождение их названий. Химическая информационная сеть ChemNet. Архивировано из первоисточника 20 августа 2011. Проверено 27 января 2010.
- ↑ Baldwin R. T. Uses of chlorine (англ.) // Journal of Chemical Education. — 1927. — Т. 4. — № 4. — С. 454.
- ↑ 1 2 Ronco C., Mishkin G. J. The Hystory of Hypochlorite // Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — P. 7—8. — ISBN 978-3-8055-8193-6
- ↑ Drinking Water and Health / Assembly of Life Sciences, Safe Drinking Water Committee. — Washington: National Press Academy, 1980. — Т. 2. — P. 18. — ISBN 978-030902931-5
- ↑ Таблица неорганических и координационных соединений. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ 1 2 Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 870—871. — ISBN 0-07-049439-8
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 657. — ISBN 5-7107-8085-5
- ↑ 1 2 White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 452—571. — ISBN 978-0-470-18098-3
- ↑ 1 2 3 4 5 6 7 8 Гипохлориты // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 1121—1122.
- ↑ Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 6.
- ↑ 1 2 3 Химизм разложения активного хлора в растворах. ООО ФСП «Кравт». Архивировано из первоисточника 20 августа 2011. Проверено 29 января 2010.
- ↑ Ахметов Н. С. Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. — М.: Высшая школа, 2001. — С. 326. — ISBN 5-06-003363-5
- ↑ Электродные процессы в растворах. Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия. ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ 1 2 3 Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 2: Химия непереходных элементов. — 368 с. — ISBN 5-7695-1436-1
- ↑ Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3, Книга 1: Химия переходных элементов. — 352 с. — ISBN 5-7695-2532-0
- ↑ Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3, Книга 2: Химия переходных элементов. — 400 с. — ISBN 5-7695-2533-9
- ↑ Фрумина Н. С., Лисенко Н. Ф., Чернова М. А. Хлор. — Серия: Аналитическая химия элементов. — М.: Наука, 1983. — С. 25.
- ↑ Прямая потенциометрия. Новый справочник химика и технолога. Аналитическая химия (часть I). ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ Иодометрия // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 496—497. — ISBN 5-85270-035-5
- ↑ Коррозионная стойкость материалов. Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия. ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ Бахир В. М. Оптимальный путь повышения промышленной и экологической безопасности объектов водоподготовки и водоотведения ЖКХ // Питьевая вода. — 2007. — № 6. — С. 4—15.
- ↑ Ingle J. I., Bakland L. K., Baumgartner J. C. Ingle’s Endodontics 6. — 6. — BC Deker, 2008. — P. 998—999. — ISBN 978-1-55099-333-9
- ↑ Biological Safety: Principles and Practices / Edited by Fleming D. O., Hunt D. L.. — Third edition. — Washington: ASM Press, 200. — P. 269. — ISBN 1-55581-180-9
- ↑ Calcium Hypochlorite (CaCl2O2)/Sodium Hypochlorite (NaOCl) (англ.) (PDF). Managing Hazardous Materials Incidents (MHMIs). Agency for Toxic Substances and Disease Registry. Архивировано из первоисточника 20 августа 2011. Проверено 28 января 2010.
- ↑ 1 2 3 4 5 6 Fletcher J., Ciancon D. Why life’s a bleach (The Sodium Hypochlorite Story) (англ.). Environmental Science and Engineering Magazine (May, 1996).(недоступная ссылка — история) Проверено 30 января 2010.
- ↑ 1 2 Safety data for sodium hypochlorite solution (англ.). Chemical and Other Safety Information. The Physical and Theoretical Chemistry Laboratory Oxford University. Архивировано из первоисточника 21 августа 2011. Проверено 1 февраля 2010.
- ↑ Informational Bulletin NFPA 2009-04N (англ.) (PDF). Department of Emergency Services, County of Sonoma (January 10, 2009).(недоступная ссылка — история) Проверено 28 января 2010.
- ↑ 1 2 Губер Ф., Шмайсер М., Шенк П. В., Фехер Ф., Штойдель Р., Клемент Р. Руководство по неорганическому синтезу: в 6 томах / Пер. с немецкого / Под редакцией Г. Брауэра. — М.: Мир, 1985. — Т. 2. — С. 355—356.
- ↑ Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под ред. проф. Н. В. Лазарева и проф. И. Д. Гадаскиной. — Издание 7-е, пер. и доп. — Л.: Химия, 1977. — Т. 3. — С. 44.
- ↑ Крамаренко В. Ф. Токсикологическая химия. — Киев: Выща школа, 1989. — С. 426. — ISBN 5-11-000148-0
- ↑ Ronco C., Mishkin G. J. Production of Sodium Hypochlorite // Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — P. 9. — ISBN 978-3-8055-8193-6
- ↑ 1 2 3 Handbook of Detergents, Part F: Production / Edited by Uri Zoller, co-editor Paul Sosis. — Surfactant Science Series. — CRC Press, 2009. — Т. 142. — 593 p. — ISBN 978-0-8247-0349-3
- ↑ Натрия гипохлорит технический. ЗАО «Каустик». Архивировано из первоисточника 20 августа 2011. Проверено 12 февраля 2010.
- ↑ Гипохлорит натрия. ОАО «Каустик». Архивировано из первоисточника 20 августа 2011. Проверено 12 февраля 2010.
- ↑ Гипохлорит натрия. ЗАО «НПО Реагенты». Архивировано из первоисточника 20 августа 2011. Проверено 12 февраля 2010.
- ↑ Гипохлорит натрия. ООО «Сода-хлорат». Архивировано из первоисточника 20 августа 2011. Проверено 12 февраля 2010.
- ↑ 1 2 Ratnayaka D. D., Brandt M. J., Johnson M. Twort’s Water Supply. — 6-th edition. — Oxford: Butterworth-Heinemann, 2009. — P. 439—441. — ISBN 978-0-7506-6843-9
- ↑ Bommaraju T. V., Orosz P. J., Sokol E. A. Electrochemistry Encyclopedia (англ.). YCES — Case Western Reserve University. Архивировано из первоисточника 20 августа 2011. Проверено 11 февраля 2010.
- ↑ SEACLOR® Systems (англ.). Severn Trent De Nora. Архивировано из первоисточника 20 августа 2011. Проверено 11 февраля 2010.
- ↑ SEACLOR® System Technology Overview (англ.). Severn Trent De Nora. Архивировано из первоисточника 20 августа 2011. Проверено 11 февраля 2010.
- ↑ SANILEC® Offshore and Marine Biofouling Control (англ.). Severn Trent De Nora. Архивировано из первоисточника 20 августа 2011. Проверено 11 февраля 2010.
- ↑ SANILEC® Technology Overview — Electrochlorination (англ.). Severn Trent De Nora. Архивировано из первоисточника 20 августа 2011. Проверено 11 февраля 2010.
- ↑ 1 2 ГОСТ 11086-76. Гипохлорит натрия. Технические условия. — Издание официальное. — М.: Стандартинформ, 2008. — 7 с.
- ↑ 1 2 Glauser J., Kumamoto T. Hypochlorite Bleaches (англ.). Chemical Economics Handbook (CEH). SRI Consulting (September 2009). Архивировано из первоисточника 20 августа 2011. Проверено 3 февраля 2010.
- ↑ 1 2 Weisblatt J. Sodium Hypochlorite // Chemical Compounds / Project editor Charles B. Montney. — Thomson Gale, 2006. — P. 759—763. — ISBN 1-4144-0150-7
- ↑ Средство отбеливающие на основе гипохлорита натрия «Белизна». ОАО «Саянскхимпласт». Архивировано из первоисточника 20 августа 2011. Проверено 27 января 2010.
- ↑ Understanding Bleach (англ.). The Clorox Company. Архивировано из первоисточника 20 августа 2011. Проверено 27 января 2010.
- ↑ Clorox® Washing Machine Cleaner (Issued: 10-2009). Material Safety Data Sheet (англ.) (PDF). The Clorox Company. Архивировано из первоисточника 20 августа 2011. Проверено 31 января 2010.
- ↑ Cascade Gel. Material Safety data Sheet (англ.) (PDF). Procter & Gamble Company.(недоступная ссылка — история) Проверено 3 февраля 2010.
- ↑ 1 2 Products (англ.). Sunbelt Chemicals Corp. Архивировано из первоисточника 20 августа 2011. Проверено 27 января 2010.
- ↑ Lysol Brand Disinfectant Bleach Toilet Bowl Cleaner (англ.). Pharmaceutical and Healthcare Online Databases Drugs-About.com. Архивировано из первоисточника 20 августа 2011. Проверено 28 января 2010.
- ↑ 1 2 Кантаторе Д. Ирригация корневых каналов и ее роль в очистке и стерилизации системы корневых каналов. Денталсайт (апрель 2004). Архивировано из первоисточника 20 августа 2011. Проверено 29 января 2010.
- ↑ Бурбелло А. Т., Шабров А. В. Современные лекарственные средства: Клинико-фармакологический справочник практического врача. — 4-е издание, переработанное и дополненное. — М.: Олма Медиа Групп, 2007. — С. 396. — ISBN 978-5-373-01525-7
- ↑ 1 2 Натрия гипохлорит. Справочник лекарств РЛС. Регистр лекарственных средств России РЛС. Архивировано из первоисточника 20 августа 2011. Проверено 28 января 2010.
- ↑ Fouad A. F. Endodontic Microbiology. — Wiley-Blackwell, 2009. — P. 33. — ISBN 978-0-8138-2646-2
- ↑ Авторский метод лечения вирусных гепатитов. Сайт врача Мязина Р. Г.. Архивировано из первоисточника 20 августа 2011. Проверено 28 января 2010.
- ↑ Мельников Н. Н. Пестициды. Химия, технология и применение. — М.: Химия, 1987. — С. 671.
- ↑ Отбелка древесной массы. Новый справочник химика и технолога. Сырье и продукты промышленности органических и неорганических веществ (часть II). ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ Ковернинский И. Н., Комаров В. И., Третьяков С. И., Богданович Н. И., Соколов О. М., Кутакова Н. А., Селянина Л. И. Комплексная химическая переработка древесины / Под редакцией проф. И. Н. Ковернинского. — Архангельск: Издательство Архангельского государственного технического университета, 2002. — С. 81. — ISBN 5-261-00054-3
- ↑ Синтетические моющие средства // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1995. — Т. 4. — С. 700. — ISBN 5-85270-092-4
- ↑ Средство дезинфицирующее Форэкс-Хлор. Инструкция № 001/2005. ДНПК «Альфа».(недоступная ссылка — история) Проверено 4 февраля 2010.
- ↑ Профессиональная химия для бассейнов «ЭМОВЕКС»: дезинфицирующий, специально стабилизированный и особо чистый водный раствор гипохлорита натрия, подготовленный для станций дозации. ООО «Макропул Кемиклс». Архивировано из первоисточника 20 августа 2011. Проверено 16 февраля 2010.
- ↑ Bleach Concentratte 12.5%—15% (англ.) (PDF). Harvard Chemical Research. Архивировано из первоисточника 20 августа 2011. Проверено 12 февраля 2010.
- ↑ Liquid Bleach (англ.). Hill Brothers Chemical Co. Архивировано из первоисточника 20 августа 2011. Проверено 30 января 2010.
- ↑ Clorox Commercial Solutions® Clorox® Bleach. Material Safety Data Sheet (англ.) (PDF). The Clorox Company. Архивировано из первоисточника 20 августа 2011. Проверено 31 января 2010.
- ↑ 10% Sodium Hypochlorite Solution. Material Safety Data Sheet (англ.) (PDF). Hasa Inc. Архивировано из первоисточника 20 августа 2011. Проверено 2 февраля 2010.
- ↑ 1 2 Кузубова Л. И., Кобрина В. Н. Химические методы подготовки воды (хлорирование, озонирование, фторирование): Аналитический обзор. — Новосибирск: СО РАН, ГННТБ, НИОХ, 1996. — Т. Выпуск 42. — 132 с. — (серия «Экология»).
- ↑ Spellman F. R. Handbook of Water and Wastewater Treatment Plant Operations. — Second Edition. — Бока-Ратон: CRC Press, Taylor & Francis Group, 2009. — P. 647. — ISBN 978-1-4200-7530-4
- ↑ Обеззараживание гипохлоритом натрия. Технологическое бюро инженера Шапиро А. С. «ЦентрХлорРеконструкция». Архивировано из первоисточника 20 августа 2011. Проверено 29 января 2010.
- ↑ Кучушев Т. Люберецкие очистные: гипохлорит вместо хлора. Строительная газета № 42 от 16.10.2009 г.. ЗАО «ГазИнСтрой (ГИС)». Архивировано из первоисточника 20 августа 2011. Проверено 29 января 2010.
- ↑ Зорина С. Хлору дали отставку // Российская газета. — 30 июня 2009. — № 4941.
- ↑ Применение гипохлорита натрия. «Макропул Кемиклс». Архивировано из первоисточника 20 августа 2011. Проверено 29 января 2010.
- ↑ Наши объекты. ООО «НПП Экофес». Архивировано из первоисточника 20 августа 2011. Проверено 16 апреля 2010.
- ↑ Основные задачи предприятия. ОАО «Водоканал». Архивировано из первоисточника 20 августа 2011. Проверено 16 апреля 2010.
- ↑ Схема очистки воды. МУП «Сыктывкарский водоканал». Проверено 16 апреля 2010.
- ↑ 1 2 Lawrence S. A. Amines: Synthesis, Properties and Applications. — Cambridge: Cambridge University Press, 2004. — Т. 1. — P. 176—177. — ISBN 0-521-78284-8
- ↑ Гидразин // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 1070—1071.
- ↑ 1 2 Hydrazine and Derivatives // Kirk-Othmer Encyclopedia of Chemical Technology. — 4-th edition. — New York: John Wiley & Sons, 1994. — Т. 13. — P. 281—282.
- ↑ 1 2 Maxwell G. R. Synthetic Nitrogen Products: A Practical Guide to the Products and Processes. — New York: Kluwer Academic / Plenum Publishers, 2004. — P. 342. — ISBN 0-306-48225-8
- ↑ Антраниловая кислота // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 348.
- ↑ 1 2 Szmant H. H. Organic Building Blocks of the Chemical Industry. — John Wiley & Sons, 1989. — 716 p. — (0-471-85545-6).
- ↑ Шнайдман Л. О. Производство витаминов. — М.: Пищевая промышленность, 1973. — С. 274—275.
- ↑ Meslah R. N. United States Patent US3668204. Chlorination of cyanuric acid (англ.) (PDF). FreePatentsOnline.com (June 6, 1972). Архивировано из первоисточника 20 августа 2011. Проверено 30 января 2010.
- ↑ Сарафанова Л. А. Пищевые добавки: Энциклопедия. — 2-е изд., испр. и доп. — СПб.: ГИОРД, 2004. — С. 346−347. — 808 с. — ISBN 5-901065-79-4
- ↑ Физер Л., Физер М. Реагенты для органического синтеза / Пер. с англ., под редакцией акад. И. Л. Кнунянца и докт. хим. наук Р. Г. Костяновского. — М.: Мир, 1970. — Т. 2. — С. 407.
- ↑ 1 2 3 4 5 Smith M. B., March J. March’s advanced organic chemistry: reactions, mechanisms, and structure. — 5-th edition. — New York: John Wiley & Sons, 2001. — 2083 p. — ISBN 0-471-58589-0
- ↑ 1 2 3 Hudlický M. Oxidation in Organic Chemistry. — ACS monograph 186. — Washington: American Chemical Society, 1990. — P. 27. — ISBN 0-8412-1780-7
- ↑ Li J. J., Limberakis C., Pflum D. A. Modern Organic Synthesis in the Laboratory: A Collection of Standard Experimental Procedures. — New York: Oxford University Press, 2007. — P. 69. — ISBN 978-0-19-518798-4
- ↑ Bright Z. R., Luyeye C. R., Morton A. Ste. M., Sedenko M., Landolt R. G., Bronzi M. J., Bohovic K. M., Gonser M. W. A., Lapainis T. E., Hendrickson H. W. Competing Reactions of Secondary Alcohols with Sodium Hypochlorite Promoted by Phase-Transfer Catalysis (англ.) // The Journal of Organic Chemistry. — 2005. — Т. 70. — № 2. — С. 684—687.
- ↑ Галоформная реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 970—971.
- ↑ Ogata Y., Kimura M., Kondo Y. Photo-promoted Hypochlorite Oxidation of α-Amino Acids. Kinetics and Irradiation Effect for the Strecker Degradation (англ.) // Bulletin of the Chemical Society of Japan. — 1981. — Т. 54. — № 7. — С. 2057—2060.
- ↑ Сульфоксиды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1995. — Т. 4. — С. 926. — ISBN 5-85270-092-4
- ↑ Wood A. E., Travis E. G. Preparation of aliphatic and aromatic sulfones with sodium hypochlorite (англ.) // Journal of the American Chemical Society. — 1928. — Т. 50. — № 4. — С. 1226—1228.
- ↑ Сакагучи реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1995. — Т. 4. — С. 568. — ISBN 5-85270-092-4
- ↑ Hopkins C. Y., Chisholm M. J. Chlorination by Aqueous Sodium Hypochlorite (англ.). Can. J. Res. B, 24, 208 (1946). Rhodium site archive. Архивировано из первоисточника 20 августа 2011. Проверено 30 января 2010.
- ↑ Moreno-Dorado F. J., Guerra F. M., Manzano F. L., Aladro F. J., Jorge Z. D., Massanet G. M. CeCl3/NaClO: a safe and efficient reagent for the allylic chlorination of terminal olefins (англ.) // Tetrahedron Letters. — 2003. — Т. 44. — № 35. — С. 6691—6693.
- ↑ Общая органическая химия. Кислородсодержащие соединения = Comprehensive Organic Chemistry / Под ред. Д. Бартона и В. Д. Оллиса. — М.: Химия, 1982. — Т. 2. — С. 62—63.
- ↑ Sodium hypochlorite solution (англ.). Chlorine and chlorine compounds. BASF. The Inorganics Division. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ Охрана природы. Очистка сточных вод // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 860. — ISBN 5-85270-039-8
- ↑ Травление. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ Органические фотометрические реагенты (ОФР). Новый справочник химика и технолога. Аналитическая химия (часть III). ChemAnalytica.com. Архивировано из первоисточника 20 августа 2011. Проверено 25 января 2010.
- ↑ Крахмал // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 988—989. — ISBN 5-85270-035-5
- ↑ Иприт // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 533. — ISBN 5-85270-035-5
- ↑ Льюизит // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 1215—1216. — ISBN 5-85270-035-5
- ↑ Франке З., Франц П., Варнке В. Химия отравляющих веществ / Пер. с нем., под редакцией акад. И. Л. Кнунянца и д-ра хим. наук Р. Н. Стерлина. — М.: Химия, 1973. — Т. 2. — С. 333—336.
Литература
- Бахир В. М., Леонов Б. И., Паничева С. А., Прилуцкий В. И., Шомовская Н. Ю. Химический состав и функциональные свойства хлорсодержащих дезинфицирующих растворов // Вестник новых медицинских технологий. — 2003. — № 4.
- Беляк А. А., Касаткина А. Н., Гонтовой А. В., Смирнов А. Д., Привен Е. М., Благова О. Е. К вопросу об использовании растворов гипохлорита натрия в водоподготовке // Питьевая вода. — 2007. — № 2. — С. 25—34.
- Перова М. Д., Петросян Э. А., Банченко Г. В. Гипохлорит натрия и его использование в стоматологии // Стоматология. — 1989. — № 2. — С. 84—87.
- Фурман Л. А. Глава 3. Гипохлорит натрия // Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. — М.: Химия, 1976. — С. 48—57.
- Эвентов В. Л., Андрианова М. Ю., Кукаева Е. А. Детоксикация и дезинфекция гипохлоритом натрия // Медицинская техника. — 1998. — № 6. — С. 36—39.
- Casson L., Bess J. Conversion to On-Site Sodium Hypochlorite Generation: Water and Wastewater Applications. — CRC Press, 2002. — 224 p. — ISBN 978-158716094-3
- Chartier R. A. Bleaching Agents. Sodium Hypochlorite // Encyclopedia of Chemical Processing and Design: Volume 4 — Asphalt Emulsion to Blending / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1977. — Т. 4. — P. 434—437. — ISBN 0-824-72454-2
- Ronco C., Mishkin G. J. Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — 157 p. — ISBN 978-3-8055-8193-6
- Weisblatt J. Sodium Hypochlorite // Chemical Compounds / Project editor Charles B. Montney. — Thomson Gale, 2006. — P. 759—763. — ISBN 1-4144-0150-7
- White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 452—571. — ISBN 978-0-470-18098-3
Ссылки
Этот звуковой файл был создан на основе введения в статью версии за 16 апреля 2010 года и не отражает правки после этой даты.
cм. также другие аудиостатьи
- Гипохлорит натрия и его применение. ООО «Макропул Кемиклс». Архивировано из первоисточника 20 августа 2011. Проверено 16 февраля 2010.
- Sodium Hypochlorite (англ.) (PDF). The Soap and Detergent Association (1997). Архивировано из первоисточника 20 августа 2011. Проверено 3 февраля 2010.
- Sodium Hypochlorite REACH consortium (англ.). ReachCentrum. Архивировано из первоисточника 20 августа 2011. Проверено 12 февраля 2010.
- HPA Compendium of Chemical Hazards Sodium hypochlorite (англ.) (PDF). Health Protection Agency (2008). — Version 2. Архивировано из первоисточника 20 августа 2011. Проверено 3 февраля 2010.
|
Соединения натрия |
|---|
|
Азид натрия (NaN3) • Альгинат натрия • Алюминат натрия (NaAlO2) • Амид натрия (NaNH2) • Арсенат натрия (Na3AsO4) • Бензилнатрий (NaCH2C6H5) • Бензоат натрия (NaC6H5CO2) • Борогидрид натрия (NaBH4) • Бромат натрия (NaBrO3) • Бромид натрия (NaBr) • Висмутат натрия (NaBiO3) • Вольфрамат натрия (Na2WO4) • Гексагидроксостаннат(IV) натрия (Na2[Sn(OH)6]) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексанитрокобальтат(III) натрия (Na3[Co(NO2)6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гексафторосиликат натрия (Na2[SiF6]) • Гексафторостибат натрия (Na[SbF6]) • Гексафторофосфат(V) натрия (Na[PF6]) • Гексахлороиридат(III) натрия (Na3[IrCl6]) • Гексахлорородат(III) натрия (Na3[RhCl6]) • Германат натрия (Na2GeO3) • Гидрид натрия (NaH) • Гидрокарбонат натрия (NaHCO3) • Гидроксид натрия (NaOH) • Гидросульфат натрия (NaHSO4) • Гидросульфид натрия (NaHS) • Гидросульфит натрия (NaHSO3) • Гидрофосфат натрия (Na2HPO4) • Гипонитрит натрия (Na2N2O2) • Гипофосфит натрия (Na(PH2O2)) • Гипохлорит натрия (NaOCl) • Глутамат натрия (C5H8NNaO4) • Дигидропирофосфат натрия (Na2H2P2O7) • Дигидроортопериодат натрия (Na3H2IO6) • Дигидрофосфат натрия (NaH2PO4) • Диоксоферрат(III) натрия (NaFeO2) • Дитионат натрия (Na2S2O6) • Дитионит натрия (Na2S2O4) • Дихромат натрия (Na2Cr2O7) • Диэтилдитиокарбамат натрия (C5H10NS2Na) • Инозинат натрия (C10H11N2Na2O8P) • Иодат натрия (NaIO3) • Иодид натрия (NaI) • Карбонат натрия (Na2CO3) • Лаурилсульфат натрия (C12H25SO4Na) • Метаарсенит натрия (NaAsO2) • Метаборат натрия (NaBO2) • Метаванадат натрия (NaVO3) • Метадисульфит натрия (Na2S2O5) • Метасиликат натрия (Na2SiO3) • Метафосфат натрия (NaPO3) • Надпероксид натрия (NaO2) • Нитрат натрия (NaNO3) • Нитрид натрия (Na3N) • Нитрит натрия (NaNO2) • Нонагидридоренат(VII) натрия (Na2[ReH9]) • Оксид натрия (Na2O) • Ортованадат натрия (Na3VO4) • Ортосиликат натрия (Na4SiO4) • Ортотеллурат натрия (Na6TeO6) • Ортофосфат натрия (Na3PO4) • Пентаборат натрия (NaB5O8) • Периодат натрия (NaIO4) • Перманганат натрия (NaMnO4) • Пероксид натрия (Na2O2) • Перосмат натрия (Na2[OsO2(OH)4]) • Пиросульфат натрия (Na2S2O7) • Пирофосфат натрия (Na4P2O7) • Полисульфид натрия (Na2Sn) • Сегнетова соль (KNaC4H4O6•4H2O) • Селенат натрия (Na2SeO4) • Селенид натрия (Na2Se) • Селенит натрия (Na2SeO3) • Тиоантимонат натрия (Na3[SbS4]•9H2O) • Сульфат натрия (Na2SO4) • Сульфид натрия (Na2S) • Сульфит натрия (Na2SO3) • Тартрат натрия (Na2C4H4O6) • Теллурит натрия (Na2TeO3) • Теллурид натрия (Na2Te) • Тетраборат натрия (Na2B4O7) • Тетрагидроксоцинкат(II) натрия (Na2[Zn(OH)4]) • Тетраоксоманганат(V) натрия (Na3MnO4) • Тетратиоарсенат натрия (Na3[AsS4]) • Тиосульфат натрия (Na2S2O3) • Тиоцианат натрия (NaSCN) • Тритиостибат натрия (Na3[SbS3]) • Трифосфат натрия (Na5P3O10) • Фенилнатрий (NaC6H5) • Формиат натрия (HCOONa) • Фосфид натрия (Na3P) • Фосфит натрия (Na2(PHO2)) • Фторид натрия (NaF) • Хлорид натрия (NaCl) • Хлорат натрия (NaClO3) • Хлорит натрия (NaClO2) • Цианат натрия (NaNCO) • Этилнатрий (NaC2H5) |
Химическое соединение
 |
||
|
||
| Имена | ||
|---|---|---|
| Название IUPAC Гипохлорит названия натрия | ||
Другие
В разбавлении:
|
||
| Идентификаторы | ||
| Номер CAS |
|
|
| 3D-модель (JSmol ) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.790 |
|
| Номер EC |
|
|
| KEGG |
|
|
| PubChem CID |
|
|
| номер RTECS |
|
|
| UNII |
|
|
| Номер ООН | 1791 | |
| Панель управления CompTox (EPA ) |
|
|
InChI
|
||
УЛЫБАЕТСЯ
|
||
| Свойства | ||
| Химическая формула | NaOCl | |
| Молярная масса | 74,442 г / моль | |
| Внешний вид | зеленовато-желтое твердое вещество (пентагидрат) | |
| Запах | хлороподобный и сладковатый | |
| Плотность | 1,11 г / см | |
| Точка плавления | 18 ° C (64 ° F; 291 K) пентагидрат | |
| Точка кипения | 101 ° C (214 ° F; 374 K) (разлагается) | |
| Растворимость в воде | 29,3 г / 100 мл (0 ° C) | |
| Кислотность (pK a) | 7,5185 | |
| Основность (pK b) | 6,4815 | |
| Термохимия | ||
| энтальпия. образования (ΔfH298) | -347,1 кДж / моль | |
| Фармакология | ||
| ATC | D08AX07 (ВОЗ ) | |
| Опасности | ||
| Паспорт безопасности | ICSC 1119 (раствор,>10% активного хлора). ICSC 0482 (раствор, <10% active chlorine) | |
| Классификация ЕС (DSD) (устаревшая) | Коррозионная (C). Опасно для окружающей среды (N) | |
| R-фразы (устаревшие) | R31, R34, ) R50 | |
| S-фразы (устаревшие) | (S1 / 2), S28, S45, S50, S61 | |
| NFPA 704 (огненный алмаз) |  0 2 1 OX 0 2 1 OX |
|
| Родственные соединения | ||
| Другие анионы | Хлорид натрия. Хлорит натрия. Хлорат натрия. Перхлорат натрия | |
| Другие катионы | Гипохлорит лития. Гипохлорит кальция. Гипохлорит калия | |
| Родственные соединения | Хлорноватистая кислота | |
| За исключением случаев, когда отмечалось, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | ||
| Ссылки на ink | ||
гипохлорит натрия (широко известный как отбеливатель) — это химическое соединение с формулой NaOCl или NaClO, содержащиеее натрий катион (Na.) и гипохлорит анион (OCl. или ClO.). Его также можно рассматривать как натриевую соль и хлорноватистой кислоты. Безводное соединение нестабильно и может взрывоопасно разлагаться. Его можно кристаллизовать в виде пентагидрата NaOCl · 5H. 2O, бледно-зеленовато-желтого твердого вещества, которое не взрывоопасно и стабильно при хранении в холодильнике.
Чаще всего встречается гипохлорит натрия. в виде бледно-зеленовато-желтого разбавленного раствора, называемого жидким отбеливателем, который бытовым химическим веществом, широко используемым (с 18 века) в качестве дезинфицирующего средства или отбеливающего агента.
В растворе соединение нестабильно и легко разлагается с высвобождением хлора, который является активным началом таких продуктов. Гипохлорит натрия — самый старый и самый важный отбеливатель на основе хлора.
Его коррозионные свойства, общедоступность и продукты реакции его значительным риском для безопасности. В частности, смешивание жидкого отбеливателя с другими чистыми средствами, такими как кислоты или аммиак, может привести к образованию токсичных паров.
Содержание
- 1 Химия
- 1.1 Стабильность твердого вещества
- 1.2 Равновесия и стабильные растворы
- 1.3 Разложение до хлората или кислорода
- 1.4 Титрование
- 1.5 Окисление соединений
- 1.6 Окисление металлов и комплексов
- 1.7 Другие реакции
- 1.8 Нейтрализация
- 2 Производство
- 2.1 Хлорирование соды
- 2.2 Из гипохлорита соды
- 2.3 Электролиз рассола
- 2.4 Из хлорноватистой кислоты и соды
- 2.5 Из озона и соли
- 3 Упаковка и продажа
- 4 Использует
- 4.1 Отбеливание
- 4.2 Очистка
- 4.3 Дезинфекция
- 4.4 Дезодорация
- 4.5 Обработка сточных вод
- 4.6 Эндодонтия
- 4.7 Нейтрализация нервных агентов
- 4.8 Уменьшение повреждений кожи
- 5 Безопасность
- 5.1 Окисление и коррозия
- 5.2 Опасности при хранении
- 5.3 Реакции с другими распространенными продуктами
- 5.4 Ограничения в области здравоохранения
- 6 Окружающая среда на месте
- 7 См. также
- 8 Ссылки
- 9 Библиография
- 10 Внешние ссылки
Химия
Стабильность твердого вещества
Безводный гипохлорит натрия можно получить, но как и многие гипохлориты, он очень нестабилен и взрывоопасно разлагается при нагревании или трении. Разложение ускоряется диоксидом углерода при атмосферных уровнях. Это белое твердое вещество с орторомбической кристаллической структурой .
Гипохлорит также может быть получен в виде кристаллического пентагидрата NaOCl · 5H. 2O, который не взрывоопасен. и намного стабильнее, чем безводное соединение. Формула иногда обозначается как 2NaOCl · 10H. 2O. Прозрачные светло-зеленовато-желтые орторомбические кристаллы содержат 44% NaOCl по массе и плавятся при 25–27 ° C. Соединение быстро разлагается при комнатной температуре, поэтому его нужно хранить в холодильнике. Однако при более низких температурах он довольно стабилен: по имеющемуся, разлагается только 1% через 360 дней при 7 ° C.
В США 1966 года утверждается, что стабильный твердый дигидрат гипохлорита натрия NaOCl · 2H. 2O может быть получен путем тщательного исключения описание хлорида (Cl.), которые присутствуют в продуктах обычных производственных процессов, как утверждается, катализируют разложение гипохлорита до хлората (ClO. 3) и хлорид. В одном из испытаний было заявлено, что дигидрат разлагается только на 6% после 13,5 месяцев хранения при -25 ° C. В патенте также утверждается, что дигидрат может быть восстановлен до безводной вакуумной сушки при температуре около 50 ° C, давая твердое вещество, которое не разлагается через 64 часа при -25 ° C.
Равновесие и стабильные растворы
При типичных температурах окружающей среды гипохлорит натрия более стабилен в разбавленных растворах, содержащих сольватированные ионы Na. и OCl.. Плотность раствора составляет 1,093 г / мл при 5% концентрации и 1,21 г / мл при 14%, 20 ° C. Стехиометрические растворы достаточно щелочные, с pH 11 или выше, поскольку хлорноватистая кислота представляет собой слабую кислоту :
- OCl. + H. 2O ⇌ HOCl + OH.
В растворах NaOCl присутствуют следующие разновидности и равновесия:
- HOCl (водн.) ⇌ H. + OCl.
- HOCl (водн.) + Cl. + H. ⇌ Cl. 2(водн.) + H. 2O
- Cl. 2(водн.) + Cl. ⇌ Cl. 3
- Cl. 2(водн.) ⇌ Cl. 2(г)
Второе уравнение равновесия, приведенное выше, будет сдвинуто вправо, если хлор Cl. 2уйдет в виде газа. Соотношения Cl. 2, HOCl и OCl. в растворе также зависят от pH. При pH ниже 2 большая часть хлора в растворе находится в форме растворенного элементарного Cl. 2. При pH выше 7,4 большая часть находится в форме гипохлорита ClO.. Равновесие можно изменить, добавив в раствор кислоты (например, соляная кислота ) или основания (например, гидроксид натрия ):
- ClO. (водн.) + 2 HCl (водн.) → Cl. 2(г) + H. 2O (водн.) + Cl. (водн.)
- Cl. 2(г) + 2 OH. → ClO. (водн.) + Cl. (водн.) + H. 2O (водн.)
При pH 4, например, полученный добавлением сильных кислот, подобных соляная кислота, количество недиссоциированной (неионизированной) HOCl наибольшее. Реакция может быть записана как:
- ClO. + H. ⇌ HClO
Растворы гипохлорита натрия в сочетании с кислотным выделением газообразного хлора, особенно сильно при pH < 2, by the reactions:
- HOCl (водн.) + Cl. + H. ⇌ Cl. 2(водн.) + H. 2O
- Cl. 2(водн.) ⇌ Cl. 2(г)
При pH>8 практически весь хлор находится в форме анионов гипохлорита (OCl.). Растворы достаточно стабильны при pH 11–12. Тем не менее, в одном отчете утверждается, что обычный 13,6% раствор реагента NaOCl потерял 17% своей прочности после хранения в течение 360 дней при 7 ° C. В некоторых приложениях можно использовать более стабильные соединения, выделяющие хлор, такие как гипохлорит кальция Ca (ClO). 2или трихлоризоциануровая кислота (CNClO). 3.
Безводный гипохлорит натрия растворим в метаноле и растворы стабильные.
Разложение до хлората или кислорода
В растворе, при определенных условиях, анион гипохлорита также может непропорционально (самоокислять ) до хлорида и хлората :
- 3 ClO. + H. → HClO. 3+ 2 Cl.
В частности, реакция происходит в растворах гипохлорита натрия при высоких температурах с образованием хлората натрия и хлорида натрия:
- 3 NaOCl (водн.) → 2 NaCl (водн.) + NaClO. 3(водн.)
Эта реакция используется в промышленном производстве хлората натрия.
При альтернативном разложении гипохлорита вместо этого образует кислород:
- 2 OCl. → 2 Cl. + O. 2
В горячих растворах гипохлорита натрия эта реакция конкурирует с образованием хлората с образованием хлорида натрия. и газообразный кислород:
- 2 NaOCl (водн.) → 2 NaCl (водн.) + O. 2(г)
Эти две реакции разложения растворов NaClO максимальны при pH около 6. Реакция с образованием хлората преобладает при pH выше 6, а кислородный становится значительно ниже. Например, при 80 ° C, это NaOCl и NaCl 80 мМ и pH 6–6,5 хлорат произведен с эффективностью ~ 95%. Кислородный путь преобладает при pH 10. На это разложение легкие и ионные катализаторы, такие как медь, никель, кобальт, и иридий. Катализаторы, такие как дихромат натрия Na. 2Cr. 2O. 7и молибдат натрия Na. 2MoO. 4, могут быть добавлены в промышленных масштабах для уменьшения кислородного пути, но в отчете утверждается, что только последний эффективен.
Титрование
Титрование растворов гипохлорита часто выполняется путем добавления измеренного образца к избыточному количеству подкисленного раствора йодида калия (KI) и последующего титрования выделившегося йода (I. 2) стандартным раствором тиосульфата натрия или, используя крахмал в качестве индикатора, пока не исчезнет синий цвет.
Согласно одному патенту США, стабильность гипохлорита натрия, содержания твердых веществ или растворов, можно определить, наблюдая за поглощением инфракрасного из-за связи O — Cl. Характеристическая длина волны составляет 140,25 мкм для водных растворов, 140,05 мкм для твердого дигидрата NaOCl · 2H. 2O и 139,08 мкм для безводной смешанной соли Na. 2(OCl) (OH)..
Окисление электрических соединений
Окисление крахмала гипохлоритом натрия, который карбонильные и каркасные группы, относящиеся к производству модифицированных крахмальных продуктов.
В присутствии катализатора межфазного переноса спирты окисляются до соответствующего карбон соединение (альдегид или кетон ). Гипохлорит натрия может также содержать органические сульфиды до сульфоксидов или сульфонов, дисульфидов или тиолов до сульфонилов. хлориды или, имины до оксазиридинов. Он также может де- ароматизировать фенолы.
Окисление металлов и комплексов
Гетерогенные реакции гипохлорита натрия и металлов, таких как цинк, протекают медленно с образованием оксид металла или гидроксид:
- NaOCl + Zn → ZnO + NaCl
Гомогенные реакции с координационными комплексами металлов протекают несколько быстрее. Это было использовано в эпоксидировании Якобсена.
Другие реакции
При неправильном хранении в герметичных контейнерах гипохлорит натрия реагирует диоксидом углерода с образованием карбоната натрия :
- 2 NaOCl + CO. 2 + H. 2O → Na. 2CO. 3+ 2 HOCl
Гипохлорит натрия реагирует с большинством соединений с образованием летучих монохлорамина, дихлораминов и трихлорид азота :
- NH. 3+ NaOCl → NH. 2Cl + NaOH
- NH. 2Cl + NaOCl → NHCl. 2+ NaOH
- NHCl. 2+ NaOCl → NCl. 3+ NaOH
Нейтрализация
Тиосульфат натрия эффективным нейтрализатором хлора. Ополаскивание 5 мг / л с последующим мытьем водой с мылом устранит запах хлора с рук.
Производство
Хлорирование соды
Гипохлорит калия было впервые произведен в 1789 году Клодом Луи Бертолле в своей лаборатории на набережной Жавель в Париже, Франция, пропуская хлор через раствор калийного щелока. Полученная жидкость, известная как Eau de Javel («Жавельская вода»), представляла собой слабый раствор гипохлорита калия. Антуан Лабаррак заменил калийный щелок более дешевым содовым щелоком, получив таким образом гипохлорит натрия (Eau de Labarraque).
- Cl2(г) + 2 NaOH (водн.) → NaCl (водн.) + NaClO (водн.) + H 2 O (водн.)
Следовательно, хлор одновременно восстанавливается и действует ; этот процесс как известен диспропорционирование.
. Этот процесс также используется для приготовления пентагидрата NaOCl · 5H. 2O для промышленного и лабораторного использования. В типичном процессе газообразный хлор добавить к 45–48% раствору NaOH. Часть хлорида натрия выпадает в осадок и удаляется фильтрацией, а затем получается пентагидрат путем фильтрата до 12 ° C.
Из гипохлорита кальция
Другой метод, связанный с реакцией карбоната натрия («стиральная сода») с хлорированной известью («отбеливающий порошок»), смесью гипохлорита кальция Ca (OCl). 2, хлорид кальция CaCl. 2, и гидроксид кальция Ca (OH). 2:
- Na. 2CO. 3(водн.) + Ca (OCl). 2(водн.) → CaCO. 3(т) + 2 NaOCl (водн.)
- Na. 2CO. 3(водн.) + CaCl. 2(водн.) → CaCO. 3(т) + 2 NaCl (водн.)
- Na. 2CO. 3(водн.) + Ca (OH). 2(т) → CaCO. 3(т) + 2 NaOH (водн.)
Этот метод обычно использовался для производства растворов гипохлорита для использования в качестве больного антисептика, который после Первой мировой войны под названием «Eusol», аббревиатура от раствора (хлорированной) извести Эдинбургского университета — ссылка на кафедрой патологии университета, где он был разработан.
Электролизола рассола
В конце XIX века ES См. Запатентовал хлористо-щелочной процесс : метод производства гипохлорита натрия, включающий электролиз рассола для получения гидроксида натрия и газообразного хлора, которые затем смешиваются с образованием гипохлорита натрия.. Ключевые реакции:
- 2 Cl → Cl 2 + 2 e (на аноде )
- 2 H. 2O + 2 e → H. 2+ 2 HO. ( на катоде )
Электроэнергия и солевой раствор в то время были в дешевом предложении, и различные предприимчивые маркетологи воспользовались ситуацией, чтобы удовлетворить рыночный спрос на гипохлорит натрия. Бутылочные растворы гипохлорита натрия были проданы многочисленными торговыми марками.
Сегодня улучшенная версия этого метода, известная как процесс Хукера (названная в Hooker Chemicals, приобретенная Occidental Petroleum ), является единственным крупномасштабным промышленным способом получения гипохлорита натрия. При переходе хлора в холодный разбавленный раствор гидроксида натрия образуются гипохлорит натрия (NaClO) и хлорид натрия (NaCl). Изготовлено промышленным способом путем электролиза с минимальным разделением между анодом и катодом.. Раствор необходимо поддерживать ниже 40 ° C ( охлаждения ils) для предотвращения нежелательного образования хлората натрия.
Коммерческие растворы всегда содержат количество хлорида натрия (поваренной соли) в качестве основного побочного продукта, как видно из приведенного выше уравнения.
Из хлорноватистой кислоты и соды
Патент 1966 года получения твердого стабильного дигидрата NaOCl · 2H. 2путем взаимодействия с не содержащим хлоридов кислоты хлорноватистой кислоты HClO (например, полученным из монооксид хлора ClO и вода) концентрированным раствором гидроксида натрия. При обычном приготовлении 255 мл раствора с 118 / л HClO медленно добавляют при перемешивании к раствору 40 г NaOH в воде при температуре 0 ° C. Некоторое количество хлорида натрия выпадает в осадок и удаляется фитингом. Раствор упаривают в вакууме при 40–50 ° C и 1–2 мм рт. Ст. кристал долизации дигидрата. Кристаллы сушат в вакууме, чтобы получить сыпучий кристаллический порошок.
Тот же принцип был использован в другом патенте 1991 г. для получения концентрированных суспензий пентагидрата NaClO · 5H. 2O. Обычно 35% -ный (по весу) раствор HClO смешивают с гидроксидом натрия при температуре около 25 ° C или ниже. Полученная суспензия содержит около 35% NaClO и относительно стабильно из-за низкой концентрации хлоридов.
Из озона и соли
Гипохлорит натрия может быть легко получен для исследовательских целей путем взаимодействия озона с солью.
- NaCl + O 3 → NaClO + O 2
Эта реакция происходит при комнатной температуре и может быть полезна для окисления спиртов.
Упаковка и продажа

Бытовой отбеливатель, продаваемый для стирки одежды, представляет собой 3–8 % раствор. гипохлорита натрия во время производства. Крепость меняется от одного препарата к другому и постепенно уменьшается при длительном хранении. Гидроксид увеличения размера в небольших количествах к бытовому отбеливателю, чтобы замедлить разложение NaClO.
10–25% раствор гипохлорита натрия, согласно паспорту безопасности Univar, поставляется с синонимами или торговлей наименования отбеливатель, Hypo, Everchlor, Chloros, Hispec, Bridos, Bleacol или Vo-redox 9110.
12% раствор широко используется в гидротехнических сооружениях для хлорирования воды, а 15% раствор чаще используется для обеззараживания сточных вод на очистных сооружениях. Гипохлорит натрия также можно использовать для дезинфекции питьевой воды в местах использования.
Разбавленные растворы (от 50 ppm до 1,5%) содержатся в дезинфицирующих спреях и салфетках, используемых для твердых поверхностей.
Использует
Отбеливатель
Бытовой отбеливатель, как правило, представляет собой раствор, содержащий 3–8% гипохлорита натрия по весу и 0,01–0,05% гидроксида натрия ; гидроксид натрия используется для замедления разложения гипохлорита натрия на хлорид натрия и хлорат натрия.
Очистка
Гипохлорит натрия обладает обесцвечивающими свойствами. Помимо прочего, его можно использовать для удаления пятен плесени, пятен на зубах, вызванных флюорозом, и пятен на посуде, особенно тех, которые вызваны танинами в чай. Он также использовался в средствах для стирки и в качестве очистителя поверхностей.
Его отбеливающие, очищающие, дезодорирующие и едкие эффекты возникают из-за окисления и гидролиза (омыления ).Органическая грязь, подвергающаяся воздействию гипохлорита, становится водорастворимой и нелетучей, что уменьшает ее запах и облегчает ее удаление.
Дезинфекция
Гипохлорит натрия в растворе проявляет антимикробное действие широкого и широко используется в медицинских учреждениях в различных условиях. Обычно его разводят в воде в зависимости от предполагаемого использования. «Сильный раствор хлора» — это 0,5% раствор гипохлорита (используется примерно 5000 частей на миллион свободного хлора), используемый для дезинфекции участков, загрязненных биологическими жидкостями, включая большие пятна крови (перед дезинфекцией участок сначала очищается с помощью моющего средства). Его можно приготовить, разбавить при необходимости бытовой отбеливатель (обычно 1 часть отбеливателя на 9 частей воды). Было установлено, что такие растворы инактивируют как C. difficile и ВПЧ. «Раствор слабого хлора» представляет собой 0,05% раствор гипохлорита, используемый для использования мы рук, но готовится из гранул гипохлорита обычно кальция.
«Раствор Дакина — дезинфицирующий раствор с низкой концентрацией натрия. гипохлорит и некоторое количество борной кислоты или бикарбоната натрия для стабилизации pH. Было обнаружено, что он эффективен прих накопления NaOCl от 0,025%.
Постановления правительства США позволяют дезинфицировать оборудование для пищевой промышленности и поверхности, контактирующие с пищевыми продуктами, с помощью растворов, используемые отбеливатели, при условии, что раствору дают возможность адекватно стечь контактом с пищевыми продуктами, и что решения не превышают 200 частей на миллион (частей на миллион) доступного хлора (например, одна столовая ложка обычного бытового отбеливателя, содержащего 5,25% гипохлорита натрия на галлон воды). Если используются более высокие концентрации, используются промыть питьевой водой после дезинфекции.
Аналогичная отбеливателя в теплой воде используется для дезинфекции поверхностей перед приготовлением пива или вина. Поверхности необходимо промыть стерильной (кипяченой) водой, чтобы не придать заварке аромат; хлорированные продукты дезинфекции побочных поверхностей. Дезинфицирующее действие гипохлорита натрия аналогично хлорноватистой кислоте.
Растворы, содержащие более 500 частей на миллион доступного хлора, вызывают коррозию для некоторых металлов, сплавов и многих термопластов ( таких как ацетальная смола ) и после этого необходимо тщательно удалить, поэтому дезинфекция отбеливателем иногда сопровождается дезинфекцией этанолом. Жидкости, содержащие гипохлорит натрия в качестве основного активного компонента, также используются для бытовой чистки и дезинфекции, например средства для чистки унитазов. Некоторые чистящие средства обладают вязкостью, чтобы не стекать быстро с вертикальных поверхностей, таких как внутренняя часть унитаза.
Считается, что недиссоциированная (неионизированная) хлорноватистая кислота реагирует с бактериальными и вирусными ферментами и инактивирует их.
Нейтрофилы иммунной системы человека продуцируют небольшие количества гипохлорита внутри фагосом, которые переваривают бактерии и вирусы.
Дезодорирующий
Гипохлорит натрия обладает дезодорирующими свойствами, которые идут рука об руку с его очищающими свойствами.
Очистка сточных вод
Использовались растворы гипохлорита натрия для обработки разбавленных сточных вод цианидов, таких как гальванические отходы. В операциях периодической обработки гипохлорит натрия использовался для обработки более концентрированных цианидных отходов, таких как растворы для гальваники цианида серебра. Токсичный цианид окисляется до цианата (OCN), который не токсичен, идеализируется следующим образом:
- CN + OCl → OCN + Cl
Гипохлорит натрия обычно используется в качестве биоцида в промышленных применений для контроля образования слизи и бактерий в водных системах, использовании на электростанциях, целлюлозно-бумажных комбинатах и т. д., в растворах обычно с 10-15% по весу.
Эндодонтия
Гипохлорит натрия — это лекарство выбора из-за его эффективности против патогенных организмов и пищеварения пульпы в эндодонтической терапии. Его использование для использования рассматривается от 0,5% до 5,25%. В низх растворяет в основном некротические ткани; при более высоких уровняхх он также растворяет жизненно важные ткани и другие виды бактерий. Одно исследование показало, что Enterococcus faecalis все еще присутствовал в дентине после 40 минут воздействия 1,3% и 2,5% гипохлорита натрия, тогда как 40 минут при концентрации 5,25% были эффективны при удалении E. faecalis. Помимо более высоких концентраций гипохлорита натрия, более длительное воздействие и нагревание раствора (60 ° C) увеличивает его эффективность в удалении мягких тканей и бактерий в камере корневого канала. 2% — это обычная практика, так как меньше риск ятрогенного гипохлорита. Инцидент с гипохлоритом — это немедленная реакция в виде сильной боли, за которую следует отек, гематома и экхимоз в результате того, что раствор выходит за пределы зуба и попадание в периапикальное пространство. Это может быть вызвано заеданием или чрезмерным давлением на шприц для ирригации, или это может произойти, если зуб имеет необычно большое апикальное нервное отверстие.
нейтрализацияного агента
На различных нервно-паралитических агентов (химический боевой нервно-паралитический газ) на объектах по уничтожению на всей территории Соединенных Штатов. 50% гипохлорит натрия используется для удаления всех нервно-паралитического агента или волдырного агента со стороны индивидуальной защиты после проникновения персонала в токсичные зоны. 50% гипохлорит любых органических веществ используется для нейтрализации случайных нервно-паралитического агента в токсичных зонах. Меньшие вещества гипохлорита используются другим образом в Системе борьбы с загрязнением, что нервно-паралитические вещества не попадают в дымовой газ печи.
Уменьшение повреждений кожи
Ванночки с разбавленным отбеливателем десятилетиями использовались для лечения умеренной и тяжелой экземы у людей, но неясно, почему они работают. Согласно работе опубликованных исследователей из Медицинской школы Стэнфордского университета в ноябре 2013 года очень разбавленный (0,005%) раствор гипохлорита натрия в воде был успешным при лечении повреждений кожи с воспалительным компонент, вызванный лучевой терапией, чрезмерным пребыванием на солнце или старением у лабораторных мышей. У мышей с лучевым дерматитом, которым ежедневно подвергались 30-минутные ванны в растворе серьезного отбеливателя, наблюдалось менее заметное повреждение кожи, лучшее заживление и отрастание волос, чем у животных, купавшихся в воде. Молекула , называемая ядерным фактором цепи каппа-легкой цепи-энхансером активированных В-клеток (NF-κB), как известно, играет роль в воспалении, старении и ответе на излучение. Исследователи показали, что если активность NF-κB блокировалась у пожилых людей путем их приобретения в растворе отбеливателя, кожа животных начинала выглядеть моложе, становясь от старой и толстой кожи пролиферацией клеток. Эффект уменьшился после прекращения ванн, что указывает на необходимость регулярного воздействия для поддержания толщины кожи.
Безопасность
По оценкам, около 3300 случаев вызванных растворами гипохлорита натрия, требуют лечения в больнице. каждый год в британских домах (RoSPA, 2002).
Окисление и коррозия
Гипохлорит натрия — сильный окислитель. Реакции окисления коррозионные. Растворы обжигают кожу и вызывают повреждение глаз, особенно при использовании в концентрированных формах. Однако, как признает NFPA, опасными окислителями только растворы, содержащие более 40% гипохлорита натрия по весу. Растворы менее 40% классифицируются как умеренная опасность окисления (NFPA 430, 2000).
Бытовые отбеливающие и хлорирующие растворы для бассейнов обычно стабилизируются концентрацией щелока (каустической содической, NaOH) как части производственной реакции. Эта добавка сама по себе вызывает едкое раздражение или ожоги из-за обезжиривания и омыления кожных масел и разрушения тканей. Из-за этого процесса отбеливатель на коже становится скользким.
Опасности при хранении
Контактные растворы гипохлорита натрия с металлами может привести к выделению легковоспламеняющегося газообразного водорода. Контейнеры могут взорваться при нагревании из-за выделения газообразного хлора.
Растворы гипохлорита вызывают коррозию обычных контейнеров, таких как нержавеющая сталь и алюминий. Несколько совместимых металлов включают титан (который, однако, несовместим с сухим хлором) и тантал. Стеклянная тара безопасна. Также страдают некоторые пластмассы и каучуки; безопасный выбор: полиэтилен (PE), полиэтилен высокой плотности (HDPE, PE-HD), полипропилен (PP), некоторые хлорированные и фторированные полимеры, такие как поливинилхлорид (PVC), политетрафторэтилен (PTFE) и поливинилиденфторид (PVDF); а также этиленпропиленовый каучук и витон.
. Контейнеры должны быть снабжены кислородом, образующимся при разложении с течением времени.
Реакции другими распространенными продуктами
Смешивание отбеливателя с некоторыми бытовыми чистыми средствами может быть опасным.
Растворы гипохлорита натрия, такие как жидкий отбеливатель, могут выделять токсичный газ хлор при нагревании выше 35 ° C или в смеси с кислотой, например соляной. кислота или уксус.
Исследование 2008 года, что гипохлорит органические химические вещества (поверхностно-активные вещества, ароматизаторы), содержащиеся в некоторых бытовых чистящих средствах, могут реагировать на образование хлорированных летучих соединений (ЛОС). Эти хлорированные соединения выделяются при очистке, некоторые из которых являются токсичными и вероятными канцерогенными веществами для человека. Исследование показало, что концентрация в воздухе помещений значительно увеличивается (в 8–52 раза для хлороформа и в 1–1170 раз для хлороформа и в 1–1170 раз для нормальных количеств в домашнем хозяйстве) при использовании отбеливающих средств. Увеличение концентраций хлорированных летучих соединений было самым низким для обычного отбеливателя формы самым высоким для продуктов в «густой жидкости и геля». Наблюдаемое увеличение концентрации в воздухе помещений нескольких хлорированных ЛОС (особенно четыреххлористого углерода и хлороформа) указывает на то, что использование отбеливателя может быть, которое может иметь важное значение с точки зрения ингаляционного воздействия этих соединений. Авторы предположили, что использование этих чистящих средств может значительно увеличить риск рака.
В частности, смешивание гипохлоритных отбеливателей с аминами (например, чистящие средства, содержащие или выделяющие аммиак, соли аммония, мочевина или родственные соединения и биологические материалы, такие как моча ) образуют хлорамины. Эти газообразные продукты могут вызвать острое повреждение легких. Хроническое воздействие, например, из воздуха в плавательных бассейнах, где хлор используется в качестве дезинфицирующего средства, может привести к развитию атопической астмы.
Отбеливатель может бурно реагировать с перекисью водорода и произносить газообразный кислород:
- H2O2(водн.) + NaOCl (водн.) → NaCl (водн.) + H 2 O (водн.) + O 2 (г)
Взрывные реакции или Побочные продукты также могут возникнуть в промышленных и лабораторных условиях, когда гипохлорит натрия смешивают с различными органическими соединениями.
Ограничения в области здравоохранения
Национальный институт здравоохранения и качества обслуживания Великобритании в октябре 2008 г. рекомендовал не использовать раствор Дакина при рутинном уходе за ранами.
Воздействие на всю среду
Несмотря на его сильное биоцидное действие, гипохлорит натрия по себе ограничен воздействием окружающей среды, поскольку ион гипохлорита быстро разлагается, прежде чем он может быть поглощен живыми существами.
Однако одна из основных проблем, связанных с использованием гипохлорита натрия, заключается в том, что он имеет тенденцию к образованию стойких хлорированных органических соединений, включая известные канцерогены, которые могут абсорбироваться организмами и попадать в организм пищевая цепочка. Эти соединения могут образовываться при хранении в домашних условиях и при использовании в промышленности. Например, при смешивании бытового отбеливателя и сточных вод было обнаружено, что 1-2% доступного хлора образует органические соединения. По состоянию на 1994 год не все побочные продукты были идентифицированы, но идентифицированные соединения включают хлороформ и четыреххлористый углерод. Расчетное воздействие этих химикатов в результате использования находится в пределах пределов профессионального воздействия.
См. Также
- гипохлорит кальция Ca (OCl). 2(«отбеливающий порошок»)
- Калий гипохлорит KOCl (исходная «вода Javel»)
- Гипохлорит лития LiOCl
Ссылки
Библиография
Внешние ссылки
- Международная карта химической безопасности 0482 (решения <10% active Cl)
- Международная карта химической безопасности 1119 (растворы>10% активного Cl)
- Национальный институт исследований и безопасности (на французском языке)
- Статистика несчастных случаев на дому и в свободное время за 2002 год (UK RoSPA)
- Экстренная дезинфекция питьевой воды (Агентство по охране окружающей среды США )
- Хлорированная питьевая вода (Монография IARC )
- Исследование NTP Отчет TR-392: Хлорированная и хлорированная вода (США NIH )
- Руководство по использованию хлорного отбеливателя в качестве дезинфицирующего средства на предприятиях пищевой промышленности (Университет штата Оклахома)
Гипохлорит натрия
ТУ 6-01-29-93
NaOCl
Гипохлорит натрия (натрий хлорноватистокислый) — NaOCl, неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода».
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
| Физические свойства | |
|---|---|
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574 г/см³; 1,1 |
| Термические свойства | |
| Т. плав. | NaOCl · 5H2O: 24,4 °C; NaOCl · 2,5H2O: 57,5 |
| Т. разл. | 5%-й раствор: 40 °C |
| Энтальпия образования | пентагидрат: − 350,4 кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4 |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9 |
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C).
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом.
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C.
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления: 24,4 °C (по другим данным: 18 °C), при нагревании (30—50 °C) разлагается.
Плотность водного раствора гипохлорита натрия при 18 °C
| Плотность, г/л | 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % |
|---|---|---|---|---|---|---|---|
| 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 | |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций
| Температура замерзания, °C | 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
|---|---|---|---|---|---|---|---|---|
| −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔHo298: −350,4 кДж/моль;
- стандартная энергия Гиббса, ΔGo298: −298,7 кДж/моль.
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом.
При нагревании параллельно происходит реакция диспропорционирования:
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11).
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования:
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде:
-
- в кислой среде:
-
- в нейтральной и щелочной среде:
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
-
- Иодиды щелочных металлов окисляются до иода (в слабокислой среде), иодата (в нейтральной среде) или периодата (в щелочной среде)[13]:
-
- сульфиты окисляются в сульфаты, нитриты в нитраты, оксалаты и формиаты в карбонаты и т. п.[13]:
-
- Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот[18]:[стр. 169]:
-
- Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин (аналогично реагирует и мочевина)[18]:[стр. 181]:
-
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления[18]:[стр. 138, 308][19]:[стр. 200]:
- По аналогии можно осуществить превращения: Fe(II) → Fe(III) → Fe(VI); Co(II) → Co(III) → Co(IV); Ni(II) → Ni(III); Ru(IV) → Ru(VIII); Ce(III) → Ce(IV) и прочие.
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия[21].
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА) или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА) с использованием бром-ионоселективного электрода (Br-ИСЭ).
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия).
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | < 0,08 мм/год |
| 20 | водный раствор | 20 | > 10 мм/год | |
| Медные сплавы: БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 |
10 | водный раствор | 20 | > 10 мм/год |
| Никель | < 34 | водный раствор | 20 | 0,1—3,0 мм/год |
| Никелевый сплав НМЖМц28-2,5-1,5 | < 34; активный хлор: 3 | водный раствор | 20 | 0,007 мм/год |
| Никелевый сплав Н70МФ | < 34 | водный раствор | 35—100 | < 0,004 мм/год |
| Платина | < 34 | водный раствор | < 100 | < 0,1 мм/год |
| Свинец | < 34; активный хлор: 1 | водный раствор | 20 | 0,54 мм/год |
| 40 | 1,4 мм/год | |||
| Серебро | < 34 | водный раствор | 20 | < 0,1 мм/год |
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | < 0,05 мм/год |
| 0,1; pH > 10 | водный раствор | 20 | < 0,1 мм/год | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | < 34; активный хлор: 2 | водный раствор | 40 | < 0,001 мм/год |
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | < 34 | водный раствор | 20—T кип. | < 0,1 мм/год |
| Тантал | < 34 | водный раствор | 20 | < 0,05 мм/год |
| Титан | 10—20 | водный раствор | 25—105 | < 0,05 мм/год |
| 40 | водный раствор | 25 | < 0,05 мм/год | |
| Цирконий | 10 | водный раствор | 30—110 | < 0,05 мм/год |
| 20 | водный раствор | 30 | < 0,05 мм/год | |
| Чугун серый | < 0,1; pH > 7 | водный раствор | 25 | < 0,05 мм/год |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | < 34 | водный раствор | 25—105 | < 1,3 мм/год |
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит, пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | < 34 | водный раствор | 20—60 | стоек |
| Поливинилхлорид | < 34 | водный раствор | 20 | стоек |
| 65 | относительно стоек | |||
| Полиизобутилен | < 34 | водный раствор | 20 | стоек |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | < 34 | водный раствор | 20 | стоек |
| Полиэтилен | < 34 | водный раствор | 20—60 | стоек |
| Полипропилен | < 34 | водный раствор | 20—60 | стоек |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | < 34 | водный раствор | 20—93 | стоек |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | < 34 | водный раствор | 20—60 | стоек |
| Стекло | < 34 | водный раствор | 20—60 | стоек |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | < 100 | стоек |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Дрожжеподобные грибы, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia[К 11], погибают в течение 15 секунд после обработки 5,0—0,5%-м раствором NaOCl.
Несмотря на высокую биоцидную активность гипохлорита натрия, следует иметь в виду, что некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза , устойчивы к его действию.
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов. В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl («+» — токсин инактивирован; «−» — токсин остался активен):
| Токсин | 2,5 % NaOCl + 0,25 н NaOH |
2,5 % NaOCl | 1,0 % NaOCl | 0,1 % NaOCl |
|---|---|---|---|---|
| Т-2 токсин | + | − | − | − |
| Бреветоксин | + | + | − | − |
| Микроцистин | + | + | + | − |
| Тетродотоксин | + | + | + | − |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
На организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта.
Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов[31].
Пероральная токсичность соединения:
- Мыши: ЛД50 (англ. LD50) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза (англ. TDLo) = 1000 мг/кг.
Внутривенная токсичность соединения[32]:
- Человек: минимально известная токсическая доза (англ. TDLo) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах.
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Рейтинг NFPA 704 для концентрированных растворов (10—20 %):
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия:
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой.
Вместо гидроксида для синтеза можно взять карбонат натрия:
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция[36]:
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд.
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия.
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
- основной процесс, где в качестве конечного продукта образуется разбавленный (около 16 % NaOCl) раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный (25—40 % NaOCl) с меньшим уровнем загрязнения.
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте.
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора
В России товарный гипохлорит натрия производят следующие предприятия:
- «Каустик», ЗАО (Стерлитамак);
- «Каустик», ОАО (Волгоград);
- «Новомосковский хлор», ООО (Новомосковск);
- «Сода-хлорат», ООО (Березники).
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе.
Процесс на аноде:
Процесс на катоде:
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных.
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec.
Система Seaclor® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %.
Установки Sanilec® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день, концентрация активного хлора составляет 0,05—0,25 %.
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже:
| Наименование показателя | Марка А | Марка Б |
|---|---|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета | |
| Коэффициент светопропускания | Не менее 20 % | |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности (как окислитель) и для отбеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl. Следующая таблица наглядно показывает, что с течением времени концентрация активного вещества в растворах уменьшается. Тем не менее, как видно из полученной диаграммы, с уменьшением концентрации гипохлорита скорость его распада также уменьшается и промышленные растворы стабилизируются:
Стабильность растворов гипохлорита натрия возрастает с уменьшением концентрации
| Концентрация NaOCl, % | Период полуразложения, дней | |
|---|---|---|
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Наиболее стабильны для хранения водные растворы гипохлорита, имеющие pH в диапазоне 11,86−13.
Применение
Водный растворр гипохлорита натрия применяют при дезинфекции, так как обладает высокой антибактериальной активностью при воздействия на разные микроорганизмы.
Гипохлорит натрия используется для:
- для обработки питьевой воды и воды бассейнов для плавания;
- в химической пром-сти для производства средств для отбеливания;
- для дезинфекции сточных вод;
- как окислитель при отбеливании тканей;
- для обеззараживания воды рыбохозяйственных водоёмов, так как раствор гипохлорит анатрия убивает все виды болезнетворных агентов;
- для обработки помещений на предприятиях общепита и в медучреждениях;
Химическое название
Натриевая соль хлорноватистой кислоты
Химические свойства
Гипохлорит Натрия — что это такое? Это неорганическое соединение, в составе которого находится до 95% активного хлора. Вещество имеет несколько нетривиальных, исторических названий: «лабарракова вода», «жавелевая вода». Химическая формула гипохлорита натрия: NaOCl. Молекулярная масса соединения = 74,4 грамма на моль. В связи с тем, что вещество достаточно неустойчиво в свободном состоянии, оно чаще всего применяется в форме пентагидрата или водного раствора. У раствора сильный, резкий запах хлора. Безводная форма вещества синтезируется в виде бесцветных кристаллов, которые хорошо растворяются в воде. Пентагидрат обладает желто-зеленым оттенком, кристаллы ромбической формы.
По своим химическим свойствам – это сильный окислитель. Гипохлорид легко разлагается до хлорида Na и кислорода, при нагревании подвергается диспропорционированию. В воде диссоциирует на ионы. Вещество подвергает коррозии большинство металлов.
Гипохлорит Натрия производится в огромных количествах. Около половины синтезированного вещества применяют в бытовой химии и медицине, остальное – в промышленности. Существует два метода производства средства: химический, хлорирование водного раствора натрия гидроксида (концентрированный и основной) и электролитический, используют электролизные установки для электролиза водного хлорида натрия.
Химическое соединение активно применяется в промышленности:
- в качестве отбеливателя ткани, древесины и других продуктов;
- при промышленной и санитарно-гигиенической обработке зерна, трубопроводов, резервуаров в виноделии и пивоварении и т. д.;
- в химическом производстве антраниловой кислоты, хлорпикрина, аскорбиновой кислоты, крахмала, а аналитической химии при фотометрии;
- для обеззараживания и очистки промышленных стоков и воды в системах коммунального водоснабжения;
- в пищевой промышленности и фармацевтике;
- в военном деле при дегазации отравляющих веществ.
Вещество используют в бытовой химии, его часто можно обнаружить в составе отбеливателей, средств для дезинфекции и очистки. В медицине используют наружно или местно в качестве противовирусного, бактерицидного и противогрибкового средства; в небольших концентрациях — для обработки операционных ран, в гинекологии и акушерстве, оториноларингологии, в стоматологии (эндодонтия).
Химическое соединение может оказывать вредное воздействие на организм человека, при вдыхании оказывать удушающий и раздражающий эффект. При попадании средства в глаза вещество вызывает химический ожог, может привести к потере зрения. Средство раздражает кожу, в больших концентрациях вызывает отмирание тканей, язвы и ожоги. После приема внутрь 3-6% раствора у человека развивается ацидоз, раздражение пищевода, более высокие концентрации могут вызвать перфорацию пищеварительного тракта. Несмотря на это, при соблюдении рекомендации по использованию препаратов, воды и бытовой химии, гипохлорит считается достаточно безопасным средством. Не обладает канцерогенными, мутагенными и тератогенными средствами. Токсическая доза при внутривенном введения для человека составляет 45 мг на кг веса; пероральная – 1 грамм на кг. Также считается, что вещество не создает экологических проблем, так как в окружающей среде быстро разлагается до воды, кислорода и поваренной соли. Класс опасности для концентрированных растворов (до 20%): 1 – по химической активности; 3 – опасность для здоровья человека. Не территории Российской Федерации гипохлорит Na выпускают по ГОСТу 11086-76.
Фармакологическое действие
Дезинфицирующее, детоксицирующее, антисептическое, противомикробное.
Фармакодинамика и фармакокинетика
Натрия Гипохлорит – одно из сильнейших антибактериальных средств. Гипохлорит-ион проявляет высокую активность по отношению к множеству известных микроорганизмов, причем действует в достаточно низких концентрациях. Наивысшая активность проявляется при нейтральном рН. Образующиеся при разложении вещества частицы окисляют биополимеры в структуре вредоносных агентов, разрушают молекулы практически всех орг. субстратов. Средство проявляет активность по отношению к грамотрицательным бактериям, кишечной палочке, серрации, синегнойной палочке, грамположительным бактериям, патогенным грибам, простейшим, вирусам. Однако лекарство не действует на возбудители криптоспоридиоза и лямблиоза. Средство не обладает тератогенными, канцерогенными и мутагенными свойствами.
Показания к применению
Применяют наружно и вводят внутрь полости в концентрации 0,06%:
- для профилактики при операциях на грудной клетке, плевральной и брюшной полости;
- при ранениях, распространенном перитоните, абсцессе, остеомиелите;
- при проведении перитонеального диализа на брюшной полости;
- пациентам с эмпинемой плевры (туберкулез, гной в плевральной полости);
- при обработке влагалища перед операцией и после операции, при кольпите, бартолините, трихомониазе, эндометриозе, хламидиозе, аднексите, лапароскопии, гистероскопии, чревосечении;
- в качестве профилактического средства и для лечения гнойно-септических осложнений после кесарева сечения;
- после операций на мочевых путях и почках, после простатэктомии;
- при гнойном отите, фарингите, насморке;
- для лечения микозов и дифтерии;
- при истинной экземе и экземе микробной этиологии;
- пациентам со стафилодермией, стрептодермией, простым герпесом и угревой сыпью.
Раствор применяют для инъекционного введения при эндо- и экзотоксикозах, отравлениях, сепсисе, ожогах, заболеваниях печени и почек.
В виде жидкости и гелей вещество используют для дезинфекции оборудования в пищевой промышленности, при обработке поверхностей.
Противопоказания
Натрия Гипохлорит противопоказан к применению:
- при аллергии;
- гиповолемическом синдроме, гипогликемии (внутривенное введение);
- внутривенно, во время беременности.
Побочные действия
Редко вещество вызывает:
- аллергические реакции;
- ощущение сухости и жжения в месте нанесения;
- при инъекционном введении – снижение артериального давления, сахара в крови;
- при быстром внутривенном введении – флебит, экстравазацию.
Гипохлорит Натрия, инструкция по применению (Способ и дозировка)
Вещество используют для обработки помещения и различных поверхностей в соответствии с рекомендациями.
Лекарство применяют внутривенно, наружно и вводят в полости в форме 0,06% раствора. Следует соблюдать инструкцию по применению.
Передозировка
Нельзя превышать рекомендуемую дозировку и пренебрегать правилами использования гипохлорита Na. Средство может раздражать дыхательные пути, кожу, вызывать эрозии и перфорации ЖКТ, раздражать глаза.
Взаимодействие
Вещество не рекомендуется сочетать с прочими антисептическими средствами и мылом. Перед применением других лекарственных средств рекомендуется тщательно промыть обрабатываемый участок.
Особые указания
Раствором гипохлорита нельзя обрабатывать хирургические инструменты и материалы.
Не допускать попадания средства в глаза и дыхательные пути.
При беременности и лактации
Вещество не используют для инъекционного введения у беременных женщин.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Средство является активным действующим компонентом препаратов Амукин, Унисепт. Его добавляют в состав дезинфицирующих растворов.
Отзывы
Сложно переоценить значение универсального дезинфицирующего средства Гипохлорит Натрия. У вещества достаточно широкая область применения, оно успешно используется в медицине, в особенности в хирургии. В интернете редко встречаются отрицательные отзывы на препараты на основе данного вещества. Резко отрицательных отзывов не обнаружено.
Цена Гипохлорита Натрия, где купить
Купить Гипохлорит Натрия в Москве для бытового использования можно по предварительному заказу.
Основные характеристики гипохлорит натрия
Химическая формула: NaOCL
Плотность (г/дм3) при +20С: 1,26
Внешний вид: Жидкость зеленовато-жёлтого цвета.
Гипохлорит натрия должен быть изготовлен в соответствии с требованиями ГОСТ 11086-76 по технологическому регламенту, утвержденному в установленном порядке. В зависимости от назначения гипохлорит натрия выпускают марок А и Б. Гипохлорит натрия марки А применяется в химической промышленности для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки, марки Б — в витаминной промышленности как окислитель и для отбеливания ткани. Для изготовления гипохлорита натрия не допускается применение абгазного хлора от хлорпотребляющих органических и неорганических производств, а также едкого натра, полученного ртутным методом. Водный раствор гипохлорита – это сильный окислитель, обладает мощной бактерицидной активностью, имеет характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
ФИЗИКО — ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ГИПОХЛОРИТА НАТРИЯ ГОСТ 11086-76
|
НАИМЕНОВАНИЕ ПОКАЗАТЕЛЯ |
Марка А |
Марка Б |
|
Внешний вид |
Жидкость зеленовато-жёлтого цвета |
|
|
Коэффициент светопропускания |
Не менее 20 % |
|
|
Массовая концентрация активного хлора, г/дм³, не менее |
190 |
170 |
|
Массовая концентрация щёлочи в пересчёте на NaOH, г/дм |
10-20 |
40-60 |
|
Массовая концентрация железа, г/дм³, не более |
0,02 |
0,06 |
Упаковка, маркировка, транспортирование и хранение
Гипохлорит натрия заливают в специальные цистерны грузоотправителя (грузополучателя), стальные гуммированные, полиэтиленовые или из стеклопластика контейнеры, принадлежащие потребителю. По требованию потребителей допускается заливать гипохлорит натрия в полиэтиленовые бочки вместимостью 50-200 дм, принадлежащие потребителю. Возможен налив в тару покупателя при наличии справки о чистоте тары.
Вы можете приобрести гипохлорит натрия в любой таре на выбор:
- специальные контейнеры (еврокубы)
- ПЭТ — бочки и канистры
- автоцистерны
Транспортная маркировка — по ГОСТ 14192 с нанесением манипуляционного знака «Беречь от нагрева». Маркировка, характеризующая транспортную опасность груза, с нанесением знака опасности по ГОСТ 19433 (класс 8, подкласс 8.2, черт.8, классификационный шифр 8283) и серийного номера ООН 1791.
Вес тарного места гипохлорит натрия с коэффициентом заполнения 0,95 от объема тары:
|
ТИП ТАРЫ |
ВЕС НЕТТО, КГ |
ВЕС БРУТТО, КГ |
|
ПЭТ-канистра 10,5 л |
12,60 |
13,05 |
|
ПЭТ-канистра 21 л |
25,20 |
26,10 |
|
ПЭТ-канистра 31,5 л |
37,80 |
39,15 |
|
Кубовая емкость 1000 л (еврокуб) |
1260,00 |
1320,00 |
|
Автоцистерна |
22000-24000 |
— |
Применение гипохлорита натрия
Гипохлорит натрия – технический химикат для очистки зараженной воды, оборудования, стоков, кроме того, его используют для отбелки разных материалов, для окисления в фармацевтической отрасли при изготовлении витаминов. Давайте рассмотрим более полный список:
1. Для очистки воды – один из самых безопасных и дешевых методов получения очищенной воды для нужд коммунального хозяйства.
2. Обеззараживание сточных вод гипохлоритом натрия дает возможность контролировать эпидемиологическую ситуацию.
3. Детоксикация отходов и сточных масс улучшает экологию и повышает безопасность ряда производств.
4. Вещество применяется врачами для антисептирования ран, а также для мытья полов, туалетов, мебели, некоторых видов оборудования и инструмента позволило поднять гигиену на новый уровень.
5. Помогает как специальный препарат в химиотерапии раковых опухолей.
6. Белизна используется в быту и производстве как отбеливатель тканей, целлюлозы, древесины и других материалов.
7. Применяется как компонент в промышленном и лабораторном химическом синтезе, в частности, синтезе гидразина.
8. Альгицидная обработка: гипохлорит натрия бассейн или канал сделает чистым от водорослей и инфекции.
9. Используется при получении синтетического пищевого крахмала.
Применение гипохлорита натрия в отраслях промышленности
• Дезинфекция питьевой воды (наиболее предпочтительный реагент на стадии предварительного окисления и для стерилизации воды перед подачей ее в распределительную сеть).
• Дезинфекция насосных станций и водонапорных башен, канализации, вспомогательных устройств.
• Дезинфекция воды в спортивных бассейнах и искусственных водоемах (технический гипохлорит натрия позволяет получить чистую прозрачную воду, без водорослей и бактерий. Обеспечивает полноту дезинфекции воды и защиту от бактериальных загрязнений. Регулирование рН воды при этом осуществляется с помощью растворов соляной или серной кислоты.
• Обработка бытовых и промышленных сточных вод (для разрушения микроорганизмов, устранения серосодержащих запахов, обезвреживание цианистых соединений)
• Для очистки воды от фенолов, гуминовых веществ, ртути.
• Входит в состав синтетических моющих средств бытовой химии, в составы дезинфицирующей пасты с отбеливающим эффектом, и других дезинфицирующих средств с окислительными, хлорирующими и бактерицидными свойствами.
• В медицине — используется дезинфицирующее действие на грамм-положительные и грамм-отрицательные бактерии, туберкулезные палочки, болезнетворные грибки и вирусы.
Использование гипохлорита натрия в пищевой отрасли:
• Для дезинфекции с целью уничтожения ракообразных и моллюсков;
• Для различных промывок;
• Для дезинфекции резервуаров, загонов для скота;
• Для борьбы против бактериофагов в сыроваренной промышленности;
• Обеззараживание в пивоваренной промышленности;
• В рыболовной отрасли — для дезинфекции рыболовных сачков, сетей и баков из пластика для хранения рыбы.
Рекомендации по использованию гипохлорит натрия
Очистное оборудование бассейнов обычно включает: песчано-антрацитовые фильтры, системы с применением коагулянтов, нагрев, подкисление и хлорирование. Растворы, включающие 0,1- 0,2 % гипохлорита натрия обеспечивают надежную дезинфекцию на протяжении 30 мин, в этом случае уровень остаточного хлора в воде остается в пределах 0,3 — 0,5мг/л. Присутствие хлора в верхней зоне дыхания не может превышать 0,1мг/м3 для частных плав.бассейнов и 0,03мг/м3 для спортивных. Обеззараживание помещений (пол, стены), простой деревянной мебели, надворных установок проводят орошением растворами в концентрации 1% по активному хлору из расчета 300—500 мл/м2 при экспозиции 1 час. По окончании дезинфекции помещения обязательно проветривают. Для обеззараживания малоценных мягких вещей, а также ветоши, уборочного материала применяют растворы, содержащие 1 % активного хлора, из расчета 4—5 л на 1 кг сухого веса вещей и выдерживают в течение 1 часа. Посуду обеззараживают при полном погружении в 0,25— 1% по активному хлору раствор, в зависимости от наличия остатков пищи, на 1 час из расчета 1,5 л раствора на 1 комплект. По окончании дезинфекции посуду тщательно промывают водой. Ванны, унитазы, раковины и другое санитарно-техническое оборудование двукратно обильно орошают растворами 1 % концентрации. Жидкие выделения, остатки пищи и другие отбросы заливают неразведенными растворами гипохлоритов в соотношении 1 : 1. Для обеззараживания ночной посуды после удаления обеззараженного содержимого используют 0,25% по активному хлору растворы гипохлоритов, после чего посуду промывают водой. Обеззараживание верхних слоев почвы, асфальта и других объектов вне помещения производят растворами гипохлоритов в концентрации 1% по активному хлору из расчета 1,5 мл/м2.
Меры предосторожности и техника безопасности с гипохлорит натрия:
Раствор гипохлорита натрия по ГОСТ 11086-76 марки А является сильным окислителем, при попадании на кожу может вызвать ожоги, а при попадании в глаза — слепоту. При нагревании выше 35°С гипохлорит натрия разлагается с образованием хлоратов и выделением хлора и кислорода. ПДК хлора в воздухе рабочей зоны — 1 мг/мЗ; в воздухе населенных мест: 0,1 мг/мЗ — максимальная разовая и 0,03 мг/мЗ — среднесуточная. Гипохлорит натрия негорюч и невзрывоопасен, однако в контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызвать их самовозгорание. Индивидуальная защита персонала должна осуществляться с применением специальной одежды и индивидуальных средств защиты: противогазов марки Б или БКФ, перчаток резиновых и очков защитных. Гипохлорит натрия — это замечательный многофункциональный дезинфицирующий (и даже моющий) агент, это «химический швейцарский нож». Пригодиться он может не только в случае коронавируса, но и при обеззараживании питьевой воды, для удаления плесени и грибков и даже для удаления чайного налета с кружек. Но стоит помнить, что гипохлорит натрия и хлорсодержащие соединения проявляют наибольшую активность только в щелочной среде.
Класс опасности гипохлорит натрия
Класс 8 — основной, класс 2 — дополнительный. Гипохлорит натрия по степени воздействия на организм человека по ГОСТ 12.1.007-76 относится ко 2 классу высоко опасных веществ. Сильный окислитель, вызывает раздражение кожных покровов и слизистых оболочек — попадание на кожу может привести к ожогам, а в глаза — жжению и слезотечению. При соответствующих концентрациях в окружающей среде Гипохлорит натрия может вызвать поражение живых организмов, разрушать растительные ткани. При попадании в водные объекты вызывает изменение органолептических свойств воды, процессов самоочищения воды в водных объектах.
Стоит отметить, что оперируют двумя ГОСТами при определении класса опасности. Согласно ГОСТу 12.1.007-76 СИСТЕМА СТАНДАРТОВ БЕЗОПАСНОСТИ ТРУДА ВРЕДНЫЕ ВЕЩЕСТВА КЛАССИФИКАЦИЯ И ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ, гипохлорит натрия относится ко 2-му классу опасности. Данный ГОСТ распространяется на вредные вещества, содержащиеся в сырье, продуктах, полупродуктах и отходах производства, и устанавливает общие требования безопасности при их производстве, применении и хранении. Стандарт не распространяется на вредные вещества, содержащие радиоактивные и биологические вещества (сложные биологические комплексы, бактерии, микроорганизмы и т.п.). По степени воздействия на организм вредные вещества подразделяют на четыре класса опасности: 1-й — вещества чрезвычайно опасные; 2-й — вещества высокоопасные; 3-й — вещества умеренно опасные; 4-й — вещества малоопасные.
А по ГОСТу 19433-88 гипохлорит натрия относится к 8 классу опасности, стандарт определяет классификацию перевозки опасных грузов (ADR), и распространяется на опасные грузы и устанавливает: классификацию; номенклатуру показателей и критерии для отнесения грузов к опасным и их классификации; методы определения показателей для классификации опасных грузов; маркировку и правила ее нанесения на грузовые единицы с опасными грузами, в том числе поставляемыми на экспорт. Классификация опасных грузов (отнесение к классу, подклассу, категории и группе) производится в зависимости от вида и степени опасности груза. 1.1.2. Установлены следующие классы опасных грузов: класс 1 — взрывчатые материалы (ВМ); класс 2 — газы сжатые, сжиженные и растворенные под давлением; класс 3 — легковоспламеняющиеся жидкости (ЛВЖ); класс 4 — легковоспламеняющиеся твердые вещества (ЛВТ); самовозгорающиеся вещества (СВ); вещества, выделяющие воспламеняющиеся газы при взаимодействии с водой; класс 5 — окисляющие вещества (ОК) и органические пероксиды (ОП); класс 6 — ядовитые вещества (ЯВ) и инфекционные вещества (ИВ); класс 7 — радиоактивные материалы (РМ); класс 8 — едкие и (или) коррозионные вещества (ЕК); класс 9 — прочие опасные вещества.

































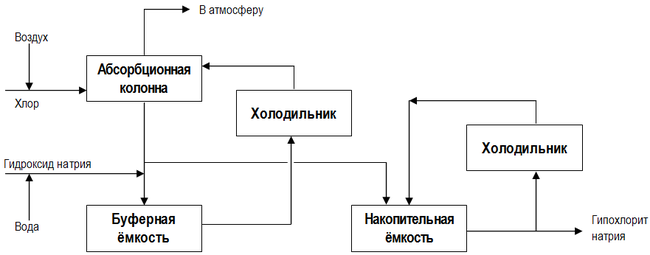
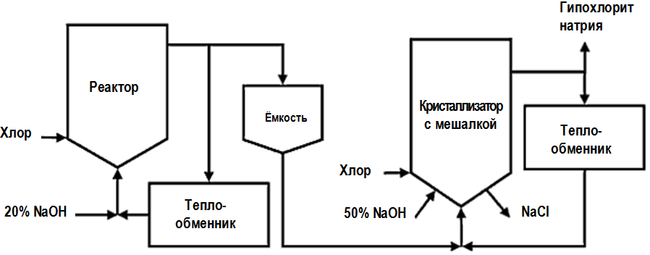




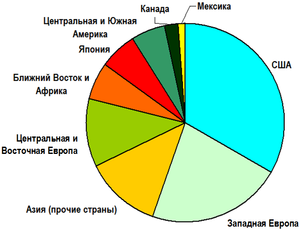




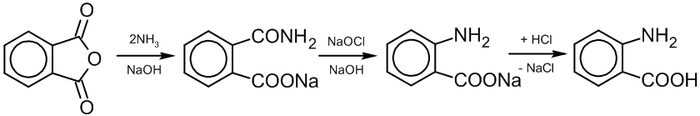
















 Катион натрия
Катион натрия Гипохлорит-анион
Гипохлорит-анион