Грипп – это острое, тяжелое заболевание, вызываемое вирусной инфекцией. Вирус гриппа входит в группу ОРВИ
(острых респираторных вирусных инфекций), но ввиду тяжести протекания, как правило, рассматривается отдельно. Грипп поражает верхние дыхательные пути, трахею, бронхи, а иногда и легкие, вызывая насморк, кашель, токсикоз; заболевание может приводить к серьёзным осложнениям и даже летальному исходу. В наибольшей степени грипп опасен для тех, чей организм ослаблен. Дети, люди пожилого возраста, лица, страдающие хроническими заболеваниями, переносят грипп особенно тяжело.
Есть вопросы?
Оставьте телефон –
и мы Вам перезвоним
Причины гриппа
Грипп вызывается вирусной инфекцией. Было выделено три типа вируса гриппа.
Вирус типа А способен поражать как людей, так и животных. «Птичий грипп», «свиной грипп» — это разновидности вируса типа А. Вирус данного типа вызывает заболевания средней или сильной тяжести, приобретающие эпидемический характер. Эпидемии гриппа А происходят с периодичностью в 2-3 года. Коварность вируса заключается в том, что он способен мутировать – менять свою антигенную структуру.
Вирус типа B передается только от человека к человеку. Хотя данный тип также видоизменяется, он не вызывает столь тяжких эпидемий. Вспышки гриппа B носят, как правило, локальный характер. Периодичность таких вспышек 4-6 лет. Они могут предшествовать эпидемиям гриппа типа А или накладываться на них.
Вирус типа C мало изучен. Он также передается только от человека к человеку, но не вызывает тяжелых симптомов (в некоторых случаях инфицирование вообще не вызывает симптомов).
Основной путь передачи инфекции – воздушно-капельный. Однако также возможен и бытовой путь – через предметы обихода. Вирус попадает в воздушную среду с частичками слизи, слюны или мокроты, выбрасываемых при кашле или чихании. Зона, в которой риск заражения достаточно высок, обычно составляет 2-3 м. вокруг больного. На большем расстоянии концентрация аэрозольных частиц незначительна и не представляет угрозы.
Осложнения гриппа
Грипп опасен, в частности, осложнениями, которые он может вызвать. Поэтому так важно осуществлять лечение гриппа под контролем врача. Обычно назначаемый курс лечения и диагностические процедуры направлены как раз на то, чтобы исключить возможность развития осложнений. Иногда именно опыт и квалификация врача помогают вовремя обнаружить осложнение и начать соответствующее лечение.
Наиболее частыми осложнениями гриппа являются:
- пневмония (воспаление легких);
- гайморит;
- воспаление оболочек головного мозга (менингит, арахноидит);
- другие осложнения со стороны нервной системы (полиневрит, радикулит, невралгия);
- осложнения со стороны сердечно-сосудистой системы (перикардит, миокардит);
- осложнения со стороны почек.
Симптомы гриппа
Инкубационный период гриппа составляет около 2-х суток. Заболевание начинается остро: поднимается температура, начинает болеть голова (это симптомы интоксикации), проявляются катаральные признаки заболевания. Высокая температура и другие проявления интоксикации держатся, как правило, до 5 дней. Если температура не спадает через 5 дней, следует предполагать бактериальные осложнения.
Катаральные явления продолжаются чуть дольше – до 7-10 дней После их исчезновения больной считается выздоровевшим, однако ещё в течение 2-3 недель могут наблюдаться последствия перенесенного заболевания: слабость, раздражительность, головная боль, возможно, бессонница.
При заболевании гриппом обязательно нужно вызвать врача. Проводить лечение гриппа без обращения к специалисту опасно, можно пропустить развитие осложнений. А при тяжелом течении заболевания своевременная профессиональная медицинская помощь абсолютно необходима, иногда это – просто вопрос сохранения жизни.
На тяжелое или осложненное течение гриппа указывают следующие симптомы:
- температура выше 40°C;
- сохранение высокой температуры более 5-ти дней;
- сильная головная боль, не снимающаяся обычными болеутоляющими средствами;
- одышка или неправильное дыхание;
- судороги, нарушения сознания;
- появление геморрагической сыпи.
Симптомы интоксикации
Интоксикация при гриппе проявляется, прежде всего, как:
- высокая температура. При легком течении гриппа температура может не подниматься выше 38°C, но для гриппа средней тяжести типична температура 39-40°C, а при тяжелом течении заболевания может быть ещё выше;
- озноб;
- слабость;
- головная боль (преимущественно в области лба и глаз);
- суставные и мышечные боли;
- в некоторых случаях – тошнота и рвота.
Катаральные симптомы
Типичные катаральные симптомы при гриппе это:
- насморк;
- сухость и боль в горле (осмотр выявляет покраснение горла);
- кашель. При неосложнённом течении гриппа наблюдается, как правило, сухой горловой кашель. Но в некоторых случаях инфекция может спуститься ниже и вызвать воспаление бронхов (бронхит) и легких (пневмонию). К подобному течению болезни предрасположены курильщики, люди с ослабленным иммунитетом, а также больные, страдающие бронхиальной астмой и легочными заболеваниями;
- слезотечение, резь в глазах.
Геморрагические явления
Геморрагические явления при гриппе наблюдаются в 5-10% случаях. Это:
- кровоизлияния в слизистых (глаз, рта);
- носовые кровотечения;
- кровоизлияния на коже (при тяжелом течении заболевания).
Методы лечения гриппа
Лечение гриппа, протекающего без осложнений, осуществляется в домашних условиях. Как правило, при лечении гриппа назначаются:
- обильное питье;
- жаропонижающие средства;
- средства, поддерживающие иммунитет;
- средства, снимающие катаральные симптомы (сосудосуживающие для облегчения носового дыхание, противокашлевые);
- антигистаминные препараты при угрозе аллергической реакции.
Однако лечение гриппа должно осуществляться по назначению врача, поскольку многое зависит от стадии заболевания, его тяжести, состояния организма и т.д.
Консультация специалиста
При проявлении симптомов гриппа (в первую очередь, обращает на себя внимание высокая температура), к больному следует вызвать врача. Обратившись в АО «Семейный доктор», Вы можете вызвать на дом к взрослому – терапевта, а к ребенку – педиатра.
Профилактика гриппа
Профилактика гриппа, прежде всего, предполагает ограничение контакта с заболевшими людьми. Необходимо не допускать попадания вируса на слизистые оболочки носа, рта или глаз. При касании предметов, на которых может оказаться вирус (предметы обихода больного), следует тщательно вымыть руки.
Укрепление иммунитета снижает риск заболевания гриппом и другими ОРВИ. Этому способствуют правильное питание, размеренный образ жизни, физические упражнения, прогулки на свежем воздухе, исключение стрессов, здоровый сон. Так как курение снижает иммунитет, желательно бросить курить.
В случае вспышки гриппа в коллективе или эпидемической угрозы целесообразен профилактический прием противовирусных средств. Однако прежде чем начинать прием необходимо посоветоваться с врачом.
Вакцинация против гриппа
Вакцинацию не следует рассматривать в качестве экстренной меры при угрозе заражения, так как иммунитет к заболеванию формируется в течение недели после прививки. Поэтому прививку необходимо делать заранее. Если Ваша профессия связана с работой с людьми, Ваш риск заболеть выше. Всемирная организация здравоохранения рекомендует вакцинацию от гриппа также тем группам населения, для которых грипп является наиболее опасным (предрасположенным к заболеванию ОРВИ, страдающими хроническими заболеваниями сердца, легких, почек, печени, эндокринной и нервной систем, детям, посещающим детские учреждения и т.п.).
Каждой год состав прививки от гриппа меняется, следуя за изменчивостью самого вируса. Есть сложность в том, чтобы предсказать, какой штамм вируса вызовет эпидемию в данном году. При удачном прогнозе эффективность прививки оказывается высокой. Если точный прогноз сделать не удалось, то прививка всё равно снижает восприимчивость организма к вирусу, так как содержит некоторые его общие составляющие. Однако гарантировать, что человек, которому сделана вакцинация, не заболеет, нельзя.
В «Семейном докторе» для вакцинации против гриппа используются наиболее эффективные и безопасные вакцины. Вакцинацию предшествует консультация врача, призванная минимизировать риск возможных осложнений. В некоторых случаях вакцинацию делать нельзя (при непереносимости компонентов вакцины, при острых заболеваниях или хронических в стадии обострения и т.п.)
Записаться на прием
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Похожие заболевания
Все заболевания

Грипп — одно из самых распространенных вирусных заболеваний в мире, и все же мало кто знает, что за это заболевание могут быть ответственны целых три вируса: A, B и C. Вирус типа A является наиболее опасным, он может вызывать эпидемии и пандемии. Вирус B вызывает более легкое заболевание, а инфицирование вирусом C может даже протекать бессимптомно. Узнайте, что вам нужно знать о вирусах гриппа.
Вирус гриппа поражает людей всех возрастов, и, хотя инфекция обычно протекает в легкой форме, для некоторых групп людей, особенно людей старше 65 лет, а также людей с хроническими заболеваниями и маленьких детей, грипп может вызвать серьезные осложнения и даже летальные исходы.
Заражение вирусом гриппа передается воздушно-капельным путем при контакте с больным человеком, который при кашле или чихании разбрызгивает капельки выделений из дыхательных путей, содержащих вирусы. Гриппом также можно заразиться при контакте с инфицированными предметами.
ВИРУС ГРИППА ТИПА А
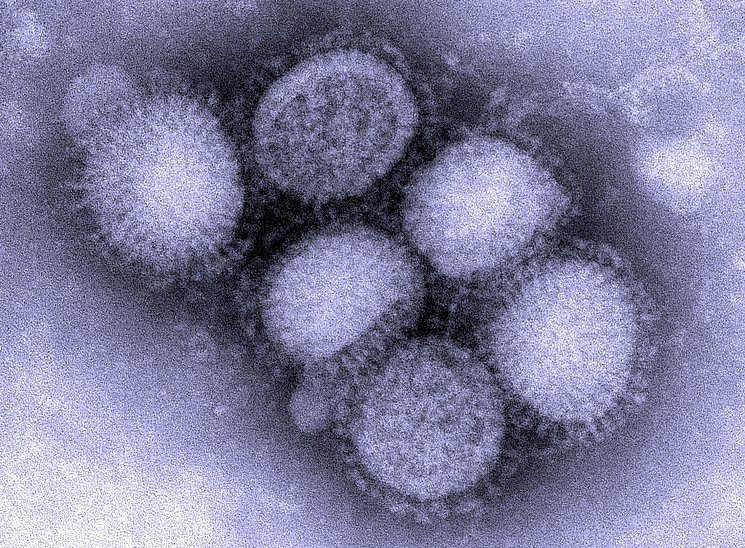
Вирус А как фактор, ответственный за развитие гриппа у людей, был впервые выделен в 1933 году. Вирус типа А встречается у птиц, млекопитающих и людей.
Вирус гриппа А является причиной самых тяжелых случаев гриппа. В зависимости от тяжести инфекции она может принять форму эпидемии или даже пандемии. Этот вирус способен относительно быстро изменять белковую структуру своей оболочки, благодаря чему антитела людей, которые однажды уже болели гриппом, не могут распознать новый штамм вируса как угрозу.
Болезни человека чаще всего вызывают следующие подтипы: H1N1, H3N2, H1N2. Вирус гриппа А был причиной испанского, птичьего и свиного гриппа.
ВЛИЯНИЕ ВИРУСА ТИПА B
Вирус гриппа B был выделен в 1940 году. Он только нападает на людей. Заражение вирусом гриппа B протекает гораздо легче, чем инфекция гриппа A, хотя иногда может возникнуть «полная» клиническая картина и осложнения, характерные для заражения гриппом A.
ВИРУС ГРИППА ТИПА С

Вирус гриппа С был выделен в 1949 году. Тип C встречается у людей и свиней. Он вызывает только незначительные инфекции (например, конъюнктивит) и не вызывает эпидемий. Инфекция часто протекает бессимптомно.
Сезонный грипп

Сезонный грипп — это грипп, который возникает ежегодно в период эпидемии в так называемый сезон гриппа.
Пик заболеваемости гриппом обычно приходится на первый квартал календарного года. В последние годы наибольшее количество случаев гриппа было зарегистрировано в феврале и марте.
Сезонный грипп чаще всего вызывается подтипами вируса A: H1N1 и H3N2, в некоторые сезоны H1N2 и, в меньшей степени, вирусом гриппа B.
Пандемический грипп
Пандемический грипп — это термин, относящийся к заболеваниям, возникающим каждые несколько лет или несколько десятков лет в форме глобальных эпидемий или пандемий, вызываемых новыми, до сих пор неизвестными для людей подтипами или вариантами вируса. Примером пандемии гриппа является преобладание испанки в 1920-х годах.
Защита от вирусов гриппа
Лучший способ избежать заражения вирусом гриппа — использовать вакцину против гриппа, которая содержит антигены трех штаммов вируса гриппа (два вируса А и один вирус В). Поскольку вирус гриппа подвержен антигенным изменениям, необходимо ежегодно повторять вакцинацию обновленными вакцинами.
Вакцинация против гриппа рекомендуется перед каждым сезоном эпидемии для всех лиц с риском развития осложнений от гриппа и с риском тяжелого течения гриппа.

Источник: https://bit.ly/3nKV56c
Грипп эпидемического сезона 2022/2023: причины появления, симптомы, диагностика и способы лечения.
Определение
По данным Всемирной организации здравоохранения, ежегодно гриппом и ОРВИ переболевают в той или иной форме 10% населения планеты. В России вместе с наступлением холодов традиционно начала расти заболеваемость этими острыми инфекциями. Продолжительность эпидемий гриппа в крупных городах в среднем составляет 8 недель. В течение 2020-2021 годов вирусы гриппа на какое-то время отступили – их вытеснил коронавирус SARS-CoV-2.
В текущем сезоне эпидемиологи ожидают значительного подъема заболеваемости гриппом, в частности, в связи с ослаблением ограничительных мер, введенных во время предыдущих волн пандемии COVID-19, и низкой долей населения, которое вакцинировано от гриппа или переболело им за последние 2 года.
Причины появления гриппа
Грипп входит в группу острых респираторных вирусных инфекций с воздушно-капельным, воздушно-пылевым и контактно-бытовым путями передачи возбудителя. Грипп очень заразное заболевание. Источником инфекции является больной человек в остром периоде заболевания (первые 5-7 дней болезни), в том числе с легкой или бессимптомной формой. Вирус передается с невидимыми капельками слюны или слизи, которые выделяются во время чихания, кашля и даже во время разговора. Кроме того, передача возможна через грязные руки, если на них есть засохшие капельки инфицированной биологической жидкости больного человека.
Грипп вызывают РНК-содержащие вирусы трех типов (A, B и C) из семейства Orthomyxoviridae, род Influenza virus. Для вирусов гриппа линии А (в меньшей степени линии В) характерна постоянная изменчивость, что ежегодно приводит к появлению новых вариантов этих вирусов. После перенесенного гриппа человек приобретает стойкий иммунитет к определенному антигенному варианту. Новые подвиды гриппа по серотипу повторяют предыдущие варианты, но поскольку вирус мутирует, выработанный к прошлым штаммам иммунитет становится неэффективным.
Вирусы гриппа обладают относительно невысокой устойчивостью – в воздушной среде они выживают до 4 часов. На поверхностях вирусы сохраняют жизнеспособность до 12 суток, в комнатной пыли – до 5 недель.
Влажная уборка с применением любых дезинфицирующих средств полностью обеззараживает помещение.
Все известные пандемии гриппа были вызваны вариантами вируса гриппа А, имеющими антигенные формулы: A(H1N1), A(H2N2) и A(H3N2). В сезоне 2022/2023 к нам вернулся свиной грипп A(H1N1), который «прославился» на весь мир в 2009 году. Этот штамм содержит часть генома свиньи, часть генома птицы и часть генома человека. Он опасен тем, что чаще вызывает синдром легочного повреждения и другие осложнения, особенно у беременных женщин. Второй уже обнаруженный в России подвид А(H3N2) – это азиатский вариант, встречавшийся и ранее. Обычно эти два штамма гриппа А распространяются совместно с гриппом В двух линий – Victoria или Yamagata.
Тяжелые формы заболевания регистрируются в период разгара эпидемии, что обусловлено чрезвычайно высокой активностью циркуляции вирусов гриппа. Причем вирус гриппа может сочетаться с COVID-19.
Особенно тяжело переносят заболевание гриппом пожилые люди, больные сахарным диабетом, онкологическими и сердечно-сосудистыми заболеваниями, беременные и дети. Для этих групп очень опасны осложнения, которые могут развиться во время и после заболевания.
Классификация заболевания
Различают несколько основных форм гриппа. Они зависят от интенсивности симптомов:
- легкая степень тяжести;
- средняя степень тяжести;
- тяжелая степень тяжести;
- очень тяжелая степень тяжести (гипертоксическая).
В зависимости от степени тяжести заболевания лечение проводится либо в дома, либо в стационаре.
По течению заболевания выделяют:
- типичное (манифестное);
- атипичное (бессимптомное, стертое).
По характеру течения гриппа рассматривают:
- неосложненное;
- осложненное:
- специфические осложнения (вирус-ассоциированные),
- неспецифические осложнения (бактериальные осложнения; обострение или декомпенсация хронических заболеваний).
Симптомы гриппа сезона 2022/2023
Инкубационный период, как правило, продолжается от 10–12 часов до 7 суток.
Заболевание характеризуется острым началом, сопровождающимся лихорадкой, общей интоксикацией и поражением дыхательных путей. Таким образом, для гриппа характерны:
- высокая температура (38-40°С);
- заложенность носа, затрудненное дыхание;
- трахеит (заложенность, саднение за грудиной, сухой кашель), першение и несильная боль в горле;
- озноб, общее недомогание, слабость;
- головокружение, головная боль, локализующаяся в лобной части – особенно в области надбровных дуг;
- боль при движении глазных яблок, резь в глазах (конъюнктивит);
- ломота в суставах и боль в мышцах;
- диспепсический синдром (отсутствие аппетита, тошнота, рвота, тяжесть в животе («переполненный желудок»), боль и жжение в эпигастрии, у детей иногда отмечается диарея).
Температура может нарастать постепенно, достигая максимальных значений на 2-3-й день заболевания. Кожа лица у больного обычно бледная с румянцем на щеках, глаза блестят. Кожной сыпи при данной форме гриппа не бывает. Нарастает резкий лающий кашель, чувство заложенности в груди. Однако в ряде случаев симптомы «обычной» простуды (насморк и кашель) отсутствуют. Геморрагический синдром проявляется в виде носовых кровотечений (иногда обильных, повторных, продолжительных) и кровохарканья.
Диагностика гриппа
При подозрении на грипп, а также с целью выявления возбудителя и осложнений заболевания выполняют следующие лабораторный исследования:
- качественное определение РНК вирусов гриппа А/B;
К каким врачам обращаться
При появлении первых симптомов заболевания следует немедленно обратиться к врачу: взрослым пациентам – к
врачу-терапевту
или врачу общей практики, детям – к
врачу-педиатру
. При подозрении на осложнения пациентам могут быть рекомендованы консультации смежных специалистов:
- врача-невролога – при явлениях менингоэнцефалита,
- врача-пульмонолога – при наличии признаков пневмонии,
- врача-гематолога – при выраженных гематологических изменениях и геморрагическом синдроме,
- врача-кардиолога – при присоединении симптомов миокардита, острой сердечно-сосудистой недостаточности,
- врача-акушера-гинеколога – при развитии гриппа на фоне беременности для определения дальнейшей тактики ведения пациентки.
Лечение гриппа
Заболевший человек должен оставаться дома и не создавать угрозу заражения для окружающих. Лечение заболевания проводится под контролем врача, который после осмотра пациента назначает схему лечения и дает другие рекомендации. Больной гриппом должен соблюдать постельный режим, включить в рацион богатые витаминами фрукты и овощи, рекомендуется обильное питье.
Начинать лечение необходимо сразу при появлении первых симптомов заболевания.
Обычно терапия на начальной стадии (первые 36 часов после манифестации болезни) включает препараты прямого противовирусного действия, позволяющие остановить репликацию вируса. В настоящее время существуют средства однократного приема внутрь, обладающие новым механизмом действия. Их применение целесообразно и допустимо для профилактики и лечения гриппа у пациентов в возрасте 12 лет и старше, у которых симптомы гриппа отмечаются на протяжении не более 48 часов.
Не рекомендуются принимать препараты адамантанового ряда из-за их резистентности их большинству штаммов гриппа.
Температуру у взрослых нужно снижать только при ее повышении выше 38,5°С, у детей – выше 38°С. Препараты с парацетамолом снимают симптомы, но не борются с вирусами. Нужно быть крайне осторожными с приемом препаратов ацетилсалициловой кислоты, чтобы избежать риска развития геморрагического синдрома.
Для разжижжения и улучшения отхождения мокроты пациентам с влажным кашлем назначают отхаркивающие средства. Пациентам с сухим, непродуктивным, надсадным кашлем для подавления кашлевого рефлекса показаны противокашлевые средства.
Одновременное применение отхаркивающих и противокашлевых средств недопустимо – такое сочетание может способствовать застою мокроты за счет подавления кашлевого рефлекса!
При выделениях или заложенности носа назначают сосудосуживающие капли в нос и промывание слизистой носа солевым раствором.
Принимать антибиотики в первые дни заболевания гриппом – большая ошибка. Антибактериальные препараты никак не воздействуют на вирус, зато убивают нормальную микрофлору и ослабляют иммунитет.
Антибиотики назначает врач только в случае развития осложнений, вызванных присоединением бактериальной инфекции.
Эффективность иммуномодуляторов (иммуностимуляторов), гомеопатических препаратов и т.п. для профилактики и лечения гриппа не доказана международными клиническими исследованиями.
В случае развития осложнений либо тяжелого течения заболевания пациента госпитализируют в стационар.
Осложнения
Самое частое и опасное осложнение гриппа – вирусная или бактериальная пневмония. При тяжелом течении гриппа могут развиться серьезные поражения сердечно-сосудистой системы, дыхательных органов, центральной нервной системы. Распространенными осложнениями являются синуситы, бронхиты, отиты, обострение хронических патологий.
Нарушения работы иммунной системы и агрессия в отношении собственных органов лежит в основе миокардита, сахарного диабета 1-го типа, аутоиммунного тиреоидита, заболеваний почек, печени и др.
Повышение проницаемости сосудистой стенки приводит к возникновению геморрагического синдрома – при тяжелом течении гриппа возможны кровоизлияния в головной мозг, в альвеолы, может развиться синдром инфекционно-токсической энцефалопатии и геморрагический токсический отек легких.
Сепсис представляет собой тяжелейшее осложнение, когда присоединяется бактериальная инфекция и переносится по всему организму с током крови. Данное состояние резко ухудшает прогноз жизни пациента.
У беременных грипп может приводить к прерыванию беременности, а также к инфицированию и патологии развития плода.
Летальные исходы при гриппе, как правило, связаны не с самим заболеванием, а с развитием осложнений, которые чаще всего возникают у пожилых людей и лиц с хроническими заболеваниями.
Профилактика гриппа сезона 2022/2023
Наиболее эффективным и доступным средством защиты от гриппа и его осложнений в настоящее время является вакцинация. Постоянно меняющаяся генетическая структура вирусов гриппа обусловливает необходимость регулярного пересмотра антигенного состава противогриппозных вакцин. На сезон 2022/2023 гг. для стран Северного полушария Всемирная организация здравоохранения рекомендовала следующий штаммовый состав противогриппозных вакцин:
- A/Victoria/2570/2019 (H1N1) pdm09;
- A/Darwin/9/2021 (H3N2);
- B/Austria/1359417/2021 (линия B/Victoria);
- B/Phuket/3073/2013 (линия B/Yamagata).
Трехвалентные вакцины будут содержать первые 3 штамма, последний штамм включен в четырехвалетные вакцины. В этом эпидемическом сезоне прогнозируется доминирование линии Victoria, так что и трех-, и четырехкомпонентные вакцины будут эффективны.
Прививочная кампания в Москве и других регионах России началась 5 сентября 2022. Прививку можно сделать в любой поликлинике после обращения к терапевту или дежурному врачу. Ближайшие пункты вакцинации, время их работы, а также другую подробную информацию можно найти на сайте Департамента здравоохранения Москвы и региональных министерств и ведомств. Доступные вакцины: «Флю-М», «Флю-М Тетра», «Инфлювак», «Сивигрипп», «Гриппол плюс», «Гриппол Квадривалент», «Ультрикс».
Вакцина «Ультрикс Квадри» вызывает формирование высокого уровня специфического иммунитета против гриппа.
Вакцинация не обеспечивает 100% защиты. Вместе с тем она значительно снижает риск тяжелого течения гриппа и развития осложнений, препятствует широкому распространению заболевания.
Иммунитету после прививки необходимо от двух до четырех недель, чтобы выработать защиту от гриппа. Чем ближе к эпидемическому сезону проводят вакцинацию, тем выше риск, что иммунный ответ не успеет выработаться.
Профилактика гриппа также заключается в полноценном питании, закаливании, прогулках на свежем воздухе, мытье рук, проветривании помещения. В период эпидемии желательно избегать посещения мест с большим скоплением людей.
Источники:
- Роспотребнадзор. О мерах по профилактике гриппа в сезон 2022–2023 гг.
- Клинические рекомендации «Грипп у взрослых». Разраб.: Национальное научное общество инфекционистов, Российское научное медицинское общество терапевтов (РНМОТ). – 2021.
- Литусов Н.В. Вирусы гриппа. Илл. уч. пособие / Екатеринбург: УГМУ, 2018. – 22 с.
- Амбетова Р.М. Осложнения и последствия гриппа по данным клинико-статистического анализа // Международный студенческий научный вестник. – 2017. – № 4-2.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Периодически эпидемия этой болезни покрывает большую часть планеты. Грипп с кодовым названием «Испанка», который длился с 1918 по 1919 год, погубил вдвое больше людей, чем за весь период Первой мировой войны. Поэтому, если кто-то считает данное заболевание простой простудой, тот сильно заблуждается. Грипп разделяют на три вида: А, Б и С. Вирус Б может передаваться только от человека к человеку. Данный вид способен видоизменяться, тем не менее, он не распространяется до уровня эпидемий и чаще всего имеет локальный характер. В группе риска находятся те пациенты, чей иммунитет ослаблен, а именно, дети и пожилые, беременные, а также люди с хроническими патологиями.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обратиться к профильному специалисту.
Симптомы заболевания
Как правило, инкубационный период гриппа длится примерно двое суток. Недуг проявляется быстро и остро. У пациента поднимается температура, проявляются катаральные симптомы гриппа Б и признаки его интоксикации. Человек испытывает:
- жар в течение 5 дней;
- миальгию;
- одышку;
- судороги;
- геморрагическую сыпь.
Геморрагические проявления болезни встречаются редко, приблизительно в 5-10 % случаев. Во время патологии пациент страдает от кровотечений из носа, кровоизлияния во рту и глазах, а также на кожном покрове. Помимо перечисленных симптомов, больной испытывает катаральные симптомы:
- боль в горле;
- насморк;
- кашель;
- слезотечение;
- рези в глазах.
Врачи отмечают, что также могут наблюдаться раздражительность и бессонница. Если признаки сходятся, тогда нужно немедленно вызвать врача. Своевременное обращение к специалисту может предотвратить серьезные осложнения. Грипп B может вызвать даже летальный исход.
Причины
Источники заболевания практически ничем не отличаются от обычного гриппа. Как правило, самым частым видом заражения считается воздушно-капельный путь. Тесный контакт с больным в большинстве случаев вызывает недуг. Наибольшее количество бактерий пациент распространяет в первые 6 дней болезни. Причинами могут быть:
- несоблюдение личной гигиены;
- контакт с зараженными предметами;
- аэрозольный путь передачи.
Также грипп группы Б особо опасен в замкнутых и непроветриваемых помещениях, в которых находится много людей, например, офисы, школы, детские сады и общественный транспорт. Грипп типа А во многом схож с предыдущим видом, но скорость его распространения намного выше. К данному виду относят следующие причины заражения:
- контакт с мертвыми животными;
- употребление мяса больной птицы или свиньи;
- воздушно — пылевой способ.
Заражение вирусом из-за пищи случается довольно редко. Термальная обработка таких продуктов, как яйца, мясо птицы или свинины, способны полностью уничтожить источник болезни.
К какому врачу обратиться?
Терапия заболевания у всех возрастных категорий проводится по одинаковому принципу. Если у пациента подтверждаются перечисленные симптомы гриппа А и Б, его лечением займется:
Наши специалисты

83%
удовлетворены результатом лечения

80%
удовлетворены результатом лечения

98%
удовлетворены результатом лечения

98%
удовлетворены результатом лечения

98%
удовлетворены результатом лечения

98%
удовлетворены результатом лечения

98%
удовлетворены результатом лечения
Если больной не в состоянии самостоятельно прийти в медучреждение, тогда нужно вызвать врача на дом. В том случае, когда человек решается поехать в больницу, ему следует нанести оксолиновую мазь на слизистую оболочку носа или надеть марлевую повязку. Независимо от места проведения осмотра, терапевт:
- выслушает жалобы;
- изучит историю болезни;
- прослушает грудную клетку;
- осмотрит горло и ротовую полость;
- измерит артериальное давление.
Если недуг проходит без осложнений, тогда будет назначено амбулаторное лечение. В другом случае терапевт выпишет направление к профильным специалистам, которые займутся дальнейшей терапией.
Лечение вирусов гриппа A и B
В первую очередь врач назначает больному постельный режим. Обычно грипп B протекает в легкой и средней форме, и лечение проводят на дому. Тяжелобольным необходим стационар. Обычно врачи назначают:
- противовирусные лекарства;
- иммуномодулирующие препараты;
- антигистаминные средства;
- капли для сужения сосудов в носу;
- сироп от кашля.
Помимо медикаментозной терапии, пациенту важно потреблять большое количество жидкости. Когда у человека вирус гриппа B, нужно часто пить минеральную воду и натуральные соки. Полезный гомеопатический эффект окажут отвары из трав и некрепкий чай.
Грипп типа А
Вирус такого типа может поражать людей и животных. Самыми известными из них являются «птичий грипп» и «свиной». Грипп А имеет тяжелую и среднюю форму тяжести и, как правило, он разрастается до пандемии. Такие вспышки случаются раз в 2-3 года. Грипп типа А — самый опасный вид. Это заключается в том, что вирус ежегодно мутирует и меняет антигенный состав. За последние несколько лет пандемия гриппа А охватывает большую часть Земли. Наблюдается высокий уровень заболеваемости населения (до 40 %) с одинаковым поражением всех возрастных категорий.
Грипп – это одно из наиболее распространённых острых инфекционных заболеваний, для которого характерно поражение верхних дыхательных путей, сильная интоксикация и лихорадка.
Опасно это заболеваание периодически возникающим эпидемическим распространением (эпидемии, пандемии), а также тяжёлыми и часто смертельными осложнениями.
Человечество никогда не было застраховано от пандемии гриппа. Из-за отсутствия вакцинопрофилактики и специфического лечения пандемия так называемого испанского гриппа в 1918-1919 годов забрала жизни около 50 млн человек, то есть около 5,3 % населения Земли. Это практически каждый двадцатый житель планеты.
По данным Всемирной организации здравоохранения последняя пандемия произошла в 2009 году и была вызвана вирусом гриппа А (H1N1). В глобальном масштабе, по оценкам, эта пандемия стала причиной от 100 тыс до 400 тыс случаев смерти только за первый год.
Пандемия
2009
Вирус гриппа
А(H1N1)
Случаев смерти до
400’000
в первый год
Пандемия возникает, когда вирус гриппа, который ранее не циркулировал среди людей и к которому большинство людей не имеют иммунитета, появляется и передаётся среди людей. Эти вирусы могут появляться, циркулировать и вызывать большие вспышки вне привычного сезона гриппа. Поскольку у большинства населения нет иммунитета к этим вирусам, доля особей в популяции, которые заразились, может быть довольно большой.
Во время эпидемических вспышек инфицируется 30-50% населения региона, что составляет существенные экономические потери проживающих на определённой територии. Ежегодно на лечение гриппа в мире расходуется свыше 15 млрд долларов.
Существуют три типа вирусов гриппа – A, B и C. Также они подразделяются на подтипы в зависимости от конкретного сорта и комбинации двух белков, которые встречаются на поверхности вируса, гемагглютинина (Н-белка) и нейраминидазы (N-белка).
В настоящее время грипп A (H1N1) и A (H3N2) являются подтипами вируса сезонного гриппа A. К тому же, существует два типа вирусов типа B, которые также распространяются как сезонные вирусы гриппа. Вирус типа C вызывает более мягкие инфекции и связан со спорадическими (редко возникающими) случаями и незначительными локализованными вспышками. Поскольку грипп C вызывает гораздо меньшее количество заболеваний, чем грипп A и B, только последние два включены в сезонные вакцины против гриппа.
Люди также могут быть инфицированы вирусами, которые обычно циркулируют среди животных, таких как подтипы вируса птичьего гриппа A (H5N1) и A (H9N2) и подтипы вируса гриппа свиней A (H1N1) и (H3N2). Другие виды, включая лошадей и собак, также имеют свои собственные разновидности. Эти вирусы не так легко передаются между людьми. Однако некоторые могут иногда заражать людей и вызывают заболевания от лёгкого конъюнктивита до тяжёлой пневмонии и даже смерти.
За последние десятилетия было много случаев спорадической передачи вирусов гриппа между животными и людьми. Когда вирусы подтипа A (H3N2), циркулирующие у свиней, начали заражать людей в США в 2011 году, они были обозначены как «вариант» (с «V», обозначение ставилось после названия вируса), чтобы отличить их от человеческих вирусов того же подтипа.
Изучение типов вирусов гриппа имеет глобальную ценность. На основании данных исследований Национальных центров гриппа, в зависимости от того, какой тип вируса будет циркулировать на определённой территории, производится вакцина соответствующего состава для формирования иммунитета у населения конкретно против вируса, который будет циркулировать в течении предстоящего сезона.
Актуальность гриппа
В октябре 2017 года Всемирная организация здравоохранения (ВОЗ) даёт информацию о том, что активность гриппа до начала сезона этого заболевания оставалась на низком уровне. Во всем мире вирусы гриппа A (H3N2) и B были причиной большинства случаев обнаружения гриппа.
Процентное соотношение образцов из респираторного тракта, которые дали положительный результат на определённых территориях (по данным ВОЗ)
Национальные центры гриппа и другие национальные лаборатории по гриппу из 85 стран, районов и территорий сообщили данные за период с 18 сентября 2017 года по 01 октября 2017 года. В течение этого периода в лабораториях GISRS ВОЗ было проверено более 56528 образцов. 3496 были положительными для вирусов гриппа, из которых 2566 (73,4%) были введены в качестве гриппа A и 930 (26,6%) в качестве гриппа B. Из подтипов вирусов гриппа A 260 (15,1%) были гриппом А(H1N1), который вызвал пандемию 2009 года, и 1460 (84,9%) были гриппом A (H3N2). Из охарактеризованных вирусов B 192 (81%) принадлежали линии B-Yamagata и 45 (19%) к линии B-Victoria.
Была сделаны соответствующие рекомендации для создания вакцин для разных стран на сезон гриппа в 2017-2018 годах.
Сезонные вирусы гриппа развиваются непрерывно, а это означает, что люди могут инфицироваться несколько раз на протяжении всей их жизни. Поэтому компоненты вакцины сезонного гриппа часто пересматриваются (в настоящее время раз в два года) и периодически обновляются, чтобы обеспечить продолжающуюся эффективность вакцин.
Особенности заражения вирусом и клиника гриппа
Источником инфекции при гриппе является больной человек и в некоторых случаях – животные (например, птичий грипп). Опасность инфицированного человека составляет количество вируса в слизистых верхних дыхательных путей и выраженность катарального синдрома (насморк, кашель, чихание, покраснение горла). Инфицированная доза составляет около 0,0001 мл назального секрета.
Наиболее опасными являются больные, которые имеют незначительно выраженный интоксикационный синдром (невысокая температура тела, незначительная общая слабость, отсутствие недомогания, сохраненный аппетит), но при этом имеют частый кашель, насморк, чихание.
Это связанно с тем, что такие больные чаще всего не изолированы от общества, а продолжают ходить на работу, ездить в общественном транспорте, дети ходят в садик и школу и продолжают заражать вирусом гриппа всех окружающих. Но то, что у них имунная система среагировала подобным образом, не значит, что у тех, кто контактировал с таким больным, не может развиться тяжёлая форма заболевания, в том числе и с осложнениями.
Передается эта инфекция воздушно-капельным путем. При кашле и чихании возбудитель распространяется на растояние до 3,5 метров. Возможно также оседания вируса на бытовых предметах (посуда, полотенца, мебель). Вирусы гриппа быстро разрушаются в окружающей среде. При комнатной температуре они погибают за несколько часов. Но стоит заметить, что этого времени вполне достаточно для заражения всех, кто находится в помещении.
Восприятие к вирусу гриппа очень высоко, особенно у людей с повышенным риском заражения. К ним относятся дети, пожилые, люди с ослабленным иммунитетом и с хроническими патологиями, особенно в стадии декомпенсации.
Клинически на первый план выходят признаки интоксикации: высокая лихорадка (до 39-40⁰С, озноб, выраженная головная боль преимущественно в лобной области, ломота в теле и мышцах, боль во время движения в глазах.
Менее выраженным является катаральный синдром: заложенность носа, першение в горле, боль или дискомфорт за грудиной (признак трахеита), грубым надсадным кашлем, иногда приступообразным с небольшим количеством мокроты (признак трахеобронхита), слезотечение (признак коньюнктивита).
Опасен вирус гриппа возможными тяжелыми осложнениями: острые бронхиты, вирусные и бактериальные пневмонии, отёк легких, абсцесс лёгких или гангрена плевры, а также гаймориты, фронтиты, отиты, обострение хронических заболеваний и другие.
Особенно опасен грипп для беременных женщин, который может привести к мертворождению, выкидышу и врожденным порокам плода.
По данным мировой литературы летальность от гриппа колеблется от 0,002% среди лиц без отягчающих факторов до 0,48% среди лиц с комбинированной сопутствующей патологией (сахарный диабет в сочетании с заболеваниями сердечно-сосудистой или дыхательной систем).
Диагностика гриппа
Диагноз гриппа подтверждается с помощью специфических методов исследования. Исследуют смывы с носа и горла, коньюнктивы, мокроту. Вирусы либо культивируют на куриных эмбрионах, либо используют реакцию имунофлюоресценции, либо серологические методы.
Эти методы диагностики трудоёмкие и их невозможно провести в домашних условиях. Поэтому в последнее время стали широко использоваться экспресс-тесты на грипп в виде тест-кассет, с помощью которых можно определить вирусы гриппа в назальном секрете в течение 10-15 минут в домашних условиях.
Экспресс-тест на грипп А+В
Лечение гриппа
На данный момент существуют две группы препаратов, которые направленны непосредственно на сам вирус гриппа. Первая группа препаратов – это адамантани (препарат римантадин). Их недостатком является то, что они не действуют на вирусы типа В и С. А также с 2003 года установленна быстро распространяющаяся резистентность (невосприимчивость) к этой группе препаратов.
Вторая группа препаратов – это ингибиторы нейраминидазы (препараты осельтамивир и занамивир). Их действие направленно на вирусы гриппа типов А и В. Но стоит учесть, что эти препараты эффективны только при назначении в первые 2 суток болезни.
Таким образом, наиболее оправданной является профилактика гриппа.
Профилактика гриппа
Одним из наиболее важных профилактических мероприятий является изоляция больного от здоровых людей. Но в реалиях социальной жизни этот пункт для современного человека одним из самых трудноисполнимых. Население планеты стремиться к финансовой стабильности и самостоятельности, поэтому не выйти на работу, пропустить коллегию, совещание, деловую встречу – совсем не вариант. Как следствие больной человек идёт и заражает в коллективе всех восприимчивых к вирусу людей.
Конечно, неплохим вариантом может стать профилактика специфическими противовирусными препаратами. Но они имеют свои недостатки, о чём было сказано выше, в разделе «Лечение гриппа». Кроме того не факт, что социализированный человек заподозрит в первые два дня то, что у него грипп, а не просто какое-то ОРЗ. А по прошествии двух дней препарат уже неэффективен.
Таким образом, самым доказательным методом профилактики является вакцинация. В своем составе вакцины могут содержать живой, но ослабленный вирус гриппа, либо инактивированный (убитый) вирус или его компоненты (антигены). Живая вакцина создает самый стойкий иммунитет, но практически не используется в связи с тем, что тяжело переносится организмом, противопоказана при снижении иммунитета и имеет множество противопоказаний.
Вакцинация — самое эффективное медицинское вмешательство, когда либо изобретённое человеком
Сегодня для профилактики гриппа используются инактивированные гриппозные вакцины – Гриппол плюс, Инфлювак, Ультрикс, Ваксигрипп – препараты, которые имеют в своем составе антигены вирусов гриппа актуальных подтипов (в данный момент тип А – штам Н1N1, тип А – штам Н3N2 и один антиген вируса гриппа В).
Инактивированные вакцины легко переносятся организмом и разрешены для использования при снижении иммунитета. Используют три вида инактивированных гриппозных вакцин: цельновирусные, сплит-вакцины (расщеплённые) и субъединичные вакцины. В среднем эффект после инактивированной вакцины наступает через 10 дней и сохраняется около года.
WHO: Influenza, an Unpredictable Threat
Использованные материалы
- http://www.who.int/influenza/human_animal_interface/virology_laboratories_and_vaccines/influenza_virus_infections_humans_feb14.pdf – общин данные ВОЗ о гриппе.
- http://apps.who.int/iris/bitstream/10665/259233/1/WER9241.pdf Резюме 9-го совещания рабочей группы РТ-ПЦР ВОЗ по выявлению и подтипированию вирусов гриппа.
- http://www.who.int/influenza/surveillance_monitoring/updates/2017_10_16_surveillance_update_300.pdf – исследования Национальных центров гриппа.
- http://www.who.int/influenza/vaccines/virus/recommendations/201709_qanda_recommendation.pdf – рекомендуемый ВОЗ состав вакцин на 2018 год.
- http://www.who.int/influenza/vaccines/virus/201709_zoonotic_vaccinevirusupdate.pdf – антигенная характеристика зоонозных вариантов гриппа.
- Возианова Ж. И. Инфекционные и паразитарные болезни: В 3 т. – К.: Здоровье, 2000. – Т. 1. – 904 с.
- Голубовская О. А. Инфекционные болезни. – К.: ВСВ «Медицина», 2012. – 728 с. + 12 с. цвет. вкл.
Абстракт: Вирусы гриппа А – зоонозные патогены, которые продолжительно циркулируют и изменяются в некоторых животных-носителях, включая птиц, свиней, лошадей и людей. Имеет высокую вероятность появление новых штаммов вируса, способных стать причиной эпидемий или пандемий у человека. Здесь мы обсудим значение наблюдения и характеристики природного вируса гриппа и рассмотрим вопрос о влиянии новых лабораторных разработок, направленных на понимание нами тропности хозяина и вирулентности вируса. Мы так же пересмотрим уроки, извлеченные из вирусных пандемий за последние 100 лет.
Вирусы гриппа А постоянно циркулируют во многих животных-носителях, таких как люди, птицы, лошади, собаки и свиньи. Сезонные вирусные инфекции гриппа у людей вызывают ежегодные эпидемии, результатом которых является заражение миллионов людей во всем мире и которые важны для бремени болезней и экономического бремени. Пандемии гриппа так же могут иметь истребляющий эффект на глобальном уровне, приводя к многочисленным смертям. Вирус гриппа А имеет сегментированный геном – восемь одноцепочечных молекул РНК, которые как правило кодируют 11 или 12 вирусных белков, включая N40, недавно идентифицированный белок, который экспрессируется сегментом РВ1 (рис. 1а). Хорошо известно, что одновременное инфицирование одной клетки двумя различными вирусами гриппа А может привести к смешению генов или рекомбинации, которая может стать результатом образования нового штамма вируса гриппа и считается, что большинство вирусных пандемий человека возникло в этой манере.
Вирусы гриппа А разделяются на подтипы в соответствии с антигенными характеристиками их гликопротеинов – гемагглютинина (ГА) и нейраминидазы (НА). ГА играет важную роль в определении тропности хозяина, связываясь с рецепторами клеток носителя, которые содержат компоненты терминально α‑2,6-сцепленных или α‑2,3-сцепленных сиаловых кислот (α‑2,6‑SA или α‑2,3‑SA). Он так же содержит участок рестрикции, который может расщеплять протеазы клеток хозяина. Аминокислотная последовательность этого участка рестрикции модулирует тканевой тропизм и системное распространение, воздействуя на тяжесть заболевания (обсуждается ниже). Активность нейраминидазы имеет решающее значение, для разрушения SA-содержащих рецепторов хозяина и вирусной мембраны, процесса, который требуется для правильного почкования и отделения дочерних вирионов с поверхности клетки хозяина. В настоящее время штаммы вируса образованные 16 подтипами ГА и девятью подтипами НА циркулируют в птицах, и штаммы двух подтипов вируса циркулируют в людях: H1N1 и H3N2 (штаммы H2N2 так же циркулировали в людях с 1957 по 1968). В целом, подтипы ГА делятся на две группы (или линии) на основании их антигенных свойств и основных структурных особенностей (рис. 1б). Группа 1 заключает в себе филогенетические ветви H1a, H1b и H9, которые включают подтип Н1, содержащийся в обоих пандемических штаммах H1N1 1918 и 2009 гг и сезонных штаммах H1N1 человека, и подтип ГА H5, который содержат высоко патогенные штаммы птичьего гриппа (HPAI) H5N1. Группа 2 состоит из филогенетических ветвей Н3 и Н7, которые содержат штаммы H3N2 человека и HPAI H7N7 соответственно (рис. 1б). Антигенная эволюция сезонных вирусов гриппа А человека происходит посредством антигенного дрейфа и характеризуется сезонной селекцией новых штаммов, ГА и НА которых содержат аминокислотные замены. Эти изменения частично преодолевают ранее существовавший иммунитет человека и главным образом эти новые штаммы содействуют сезонным эпидемиям гриппа. Более выраженные изменения в подтипе ГА, обусловленные антигенной изменчивостью, традиционно связывались с появлением пандемических вирусов, хотя эту точку зрения оспаривает пандемия H1N1 2009 года (обсуждается ниже). Таким образом ГА не только играет важную роль в жизненном цикле вируса гриппа (рис 1с), но также, через изменения в его генотипе, является определяющим фактором восприимчивости хозяина и патогенеза.
Зоонозный источник пандемий гриппа человека хорошо описан и привлекает внимание общественности увеличением числа летальных исходов у людей инфицированных вирусами HPAI H5N1, которые распространены в домашних птицах на всем протяжении Восточной и Юго-Восточной Азии, Ближнем Востоке, Африке и Европе. К счастью, эти антигенно новые вирусы до сих пор не поддерживают передачу от человека к человеку и потому не в состоянии привести к потенциально гибельной пандемии. Напротив, сюрпризом для сообщества исследователей вируса гриппа стал новый, происходящий от свиней вирус гриппа H1N1 (SOIV), который возник в 2009 году и привел к первой пандемии гриппа человека в двадцать первом веке. В течение 1 года, этот вирус распространился на 214 стран и стал причиной> 18000 подтвержденных смертей по всему миру. Считается, что к апрелю 2010 года, в одних только Соединенных Штатах от 43 млн до 89 млн человек были инфицированы этим вирусом.
В связи с распространением в 2009 году пандемического H1N1 SOIV, с целью охарактеризовать геномную последовательность и патогенность и исследовать способность к передаче, антигенные характеристики и чувствительность к противовирусным препаратам были незамедлительно развернуты современные системы наблюдения, а также недавно созданные экспериментальные инструменты и модели на животных. Выдающаяся совместная работа множества лабораторий во всем мире послужила гарантией того, что пандемия была преодолена как можно быстрее. В течение этого периода был отмечен несомненный прогресс в различных областях современных исследований вируса гриппа, который значительно улучшил нашу компетенцию в быстроте реагирования. Тем не менее, так же было очевидно, что пандемия застала мир врасплох и что специфические аспекты плана действий по готовности к пандемии все еще нуждаются в улучшениях. В обзоре обсуждаются последние достижения и будущие потребности в полном и систематическом наблюдении животных и человека, уточнении оценки вирулентности новых штаммов для людей и улучшения понимания вирусной тропности, которые лежат в основе механизмов патогенеза.
Источник: журнал Nature
Репликация и антигенная классификация вирусов гриппа А.
a | Геном вируса гриппа А состоит из восьми одноцепочечных РНК, которые кодируют 11 или 12 белков. Белок ядерного экспорта (NEP; так же известный как NS2) и противовирусный ответ хозяина антагонисты неструктурного белка 1 (NS1), который кодируется на сегменте NS; матричный белок М1 и ионный канал М2, которые кодируются сегментом М; рецептор-связывающий белок гемагглютинин (ГА), разрушающий сиаловую кислоту фермент нейраминидаза (НА), нуклеопротеин(NP) и компоненты комплеса РНК-зависимой РНК-полимеразы (PB1, PB2 и PA), все экспрессируются соответствующими сегментами геном; и недавно идентифицированный белок N40, который экспрессируется сегментом РВ1 и имеет неизвестную функцию. Кроме того, некоторые вирусы экспрессируют про-апоптотический белок PB1‑F2, который кодируется второй ORF сегмента РВ1. Внутри вириона, каждый восьмой вирусный сегмент формирует комплекс вирусного рибонуклеопротеина (РНП); вирусная РНК обернута вокруг NP и эта структура затем связывается с комплексом вирусной полимеразы.
b | Антигенные характеристики ГА позволяют классифицировать вирусы гриппа А в две главные группы, 1 и 2, которые классифицируются на 5 филогенетических ветвей и 16 подтипов.
c | На начальных стадиях репликации вируса гриппа А, вирусная ГА присоединяется к рецепторам клетки-хозяина содержащим терминальные фрагменты α‑2,6-связанных и α‑2,3-связанных сиаловых кислот (α‑2,6‑SA илиα‑2,3‑SA) и вирус проникает в клетку путем рецепторно-опосредованного эндоцитоза. Расщепление ГА клеточными протеазами необходимо для экспозиции пептида ГА, который отвечает за слияние вирусной оболочки и мембраны эндосомы (см. ниже). Закисление везикул эндоцитоза открывает ионный канал М2, в результате чего закисляется внутренняя часть вириона, процесс, который необходим для правильного раздевания комплексов РНП, содержащих вирусный геном. Закислениеэндосомы так же вызывает pH-зависимый шаг слияния, который опосредуется ГА и приводит к выпуску комплексов РНП в цитоплазму. Они перемещаются в ядро, где РНК-зависимая РНК-полимераза транскрибирует и реплицирует негативную вирусную РНК ((-) вРНК), что приводит к формированию трех типов молекул РНК: комплиментарная позитивная РНК ((+кРНК), которая используется им для генерации большего количества вРНК; негативные маленькие вирусные РНК (мвРНК), которые, как полагают, регулируют переход от транскрипции к репликации; и вирусные мРНК, которые экспортируются в цитоплазму для трансляции. Вирусные белки, необходимые в репликации и транскрипции транслоцируются обратно к ядру и потомство РНП затем экспортируется в цитоплазму для распаковки, при содействии М1 и NEP. Вирусные ГА, НА и М2 транспортируются секреторным путем через комплекс Гольджи и зрелые белки приходят к плазматической мембране, где М1 способствует образованию вирусных частиц. Затем происходит почкование и высвобождение из клетки хозяина опосредованное нейраминидазной активностью НА, которая разрушает сиаловые кислоты клеточных и вирусных гликопротеинов, которые могли бы сохранить новые вирионы на поверхности клетки.
Штаммы гриппа А двадцать первого века
Пандемический потенциал вируса HPAI H5N1, как и многочисленные вспышки, вызванные подтипами вирусов Н5, Н7 и Н9 у диких птиц, послужили толчком к наблюдениям за вирусами гриппа птичьих видов в различных регионах по всему миру. Тем не менее, появление пандемического H1N1 от свиней в 2009 году пролило свет на недостаток систематического наблюдения за другими восприимчивыми хозяевами. Широкомасштабное усиленное наблюдение способствовало разработке ряда ключевых технологий, в том числе технических средств с высокой пропускной способностью и глубоко-секвенирующих (которые использовались для получения полных последовательностей вирусного генома из полевых и клинических изолятов), баз данных выделенных последовательностей и филогенетических усложнений и инструментов коалесцентных анализов. Эти инструменты делают возможными быстрые, более полные эпидемиологические исследования вирусов гриппа в человеке и натуральных резервуарах.
Наблюдение за птичьими вирусами.
Вирусы HPAI H5N1 вероятно возникли в результате мутаций участка рестрикции ГА, путем внедрения низко патогенного птичьего вируса H5N1 от диких птиц к домашним птицам. Несколько крупных вспышек вирусов HPAI H5N1 происходили у домашних птиц, а первый случай инфицирования человека HPAI H5N1 был задокументирован в 1997 году. В целом, до сведения ВОЗ были доведены 562 случая заболевания людей из разных стран со смертельным исходом ~59% (329 смертей), и, на сегодняшний день, большинство случаев были ассоциированы с непосредственным контактом человека с инфицированными видами птиц. Наблюдение за дикими птицами – ключ к пониманию происхождения, патогенеза, эволюции и распространенности этих вирусов в мире. Начиная с 2002 года, генотип Z (который содержит небольшие делеции в генах, кодирующих белки НА и NS1) был преобладающим генотипом H5N1 в южной части Китая. Тем не менее, на сегодняшний день, были идентифицированы десять различных, хорошо развитых филогенетических ветвей вируса HPAI H5N1, что наглядно показывает комплексную и динамическую эволюцию этих вирусов в природе. Комплексные геномные исследования разнообразной выборки вирусов птичьего гриппа продемонстрировали наибольшую изменчивость в белках ГА, НА и NS1, и привели к открытию предполагаемого доменного лиганда PDZ карбоксильного конца NS1, который может быть замешан в вирулентности. Наблюдение за дикими птицами Северной Америки показало, что штаммы Евразии и Америки редко смешиваются, и не обнаружило никаких свидетельств вирусов HPAI H5N1. Тем не менее, изоляты AIV из США продемонстрировали высокий уровень степени рекомбинаций среди циркулирующих штаммов, хотя не было найдено совершенного соответствия характерных участков среди сегментов РНК (то есть, видимо, для пар или групп рекомбинирующихся сегментов не существует никаких требований). Это скорее наводит на мысль о постоянном смешении геномов AIV, чем о постоянном распространении ограниченного и стабильного набора сегментов, которые характеризуют адаптацию млекопитающих к вирусам гриппа А.
В 2005 году вирус HPAI H5N1 был ответственен за вспышку среди водоплавающих птиц на озере Цинхай, на западе Китая, результатом чего стала высокая смертность птиц и повышение обеспокоенности возможностью непрерывной передачи вирусов HPAI H5N1 среди перелетных птиц. В последствии, генетически и антигенно различные филогенетические ветви HPAI H5N1 появились на протяжении широкого географического ареала в Юго-Восточной Азии и стали эндемичными у домашних птиц. Совсем недавно, приводя к селекции вирусов, способных инфицировать множество птиц переносчиков и обеспечивая возможность трансмиссии в другие географические регионы,в результате рекомбинации с эндемичными вирусами, которые присутствуют у местных водоплавающих птиц, возникли вирусные линии HPAI H5N1. Оба транспорта, от домашних и мигрирующих птиц, кажется, играют важную роль в распространении вирусов HPAI H5N1 на дальние дистанции и, возможно, объясняют вспышки в Европе, на ближнем Востоке и в Африке. Тем не менее, отсутствие дальнейшей рекомбинации этих вирусов после их экспорта из Китая указывает, что различные факторы, влияющие на эпидемиологию AIV могут существовать в других областях мира.
В дополнение к вызванным вирусами HPAI H5N1 вспышкам у диких птиц и болезни человека, в последние два десятилетия наблюдались вспышки у домашних птиц, а также зоонозное инфицирование людей вирусами подтипов Н7 и Н9 в Европе, Азии и Америке. Эти вспышки мотивировали усилить наблюдения, чтобы лучше понять экологию, геномные характеристики и глобальную циркуляцию этих и других AIV. Широкомасштабные филогенетические анализы вирусов H9N2 выявили явные географические и хозяин-специфические паттерны, которые отражают сложную эволюцию этих вирусов. В южном Китае, долгосрочное становление множества линий AIV, таких как линии H9N2 и H5N1, как полагают, способствует высокому уровню рекомбинаций наблюдаемых в этом регионе, таким образом, приводя к возникновению большого генетического разнообразия этих вирусов. Интересно, что у вирусов AIV и HPAI H5N1, являющихся изолятами человеческих вирусов эндемичных в Китае, которые изучались в течение 2007 и, видимо, на протяжении 13 лет подвергались положительной селекции, но не подвергались рекомбинации, были найдены гены, аналогичные генам, кодирующим внутренние белки вирусов H9N2 (PB2, PB1, PA, NP, M и NS). Обширные сегментарные рекомбинации также наблюдались у вирусов Н7, которые имеют несколько подтипов НА, что связывались и оказывали поддержку специфическим белкам Н7 – ГА, на протяжении различных географических регионов (к примеру, вирусы Н7 в Австралии образуют монофилетическую ветвь, основанную на их белке ГА, который может сочетаться с подтипами N2, N3, N4, N6 и N7). Последние вирусы Н7, которые были изолированы в результате наблюдения за дикими птицами в Европе были тесно связаны с вирусами Н7, которые вызвали вспышку среди домашней птицы в Италии (1999-2000) и Нидерландах (2003), что подчеркивает значение систематического усиленного наблюдения направленного на обнаружение птичьих вирусов, потенциально опасных для человека.
Вирус гриппа А H1N1 2009 года, возможно, появился в апреле 2009 года путем одиночного внедрения в людей в Северной Америке (скорее всего, в Мексике). Его геном не имеет ни одного из известных ранее маркеров адаптации человека, и его предшественники, возможно, некоторое время циркулировали незамеченными в свиньях, предполагается, что рекомбинация предшествующих свиных линий вероятно происходила годы до момента обнаружения вируса у людей. Ранние эпидемиологические данные показали, что базовое число репродукций (R0; мера передачи от человека к человеку) составляла примерно 1,2, походя на нижний предел оценок R0 во время предыдущих пандемий гриппа, и у детей <15 лет скорость клинической атаки была вдвое выше, чем у взрослых. Антигенные анализы подтвердили сходство этого вируса со свиными вирусами, циркулирующими в Северной Америке и его отличие от сезонных вирусов H1N1. Вскоре после начала всемирной вспышки, динамика распространения вируса была быстро отслежена и отображена на карте. Вспышки характеризовались многочисленным внедрением новых штаммов в многих регионах. Глобальное географическое распространение произошло в три этапа: во-первых, распространение из Мексики в США; во-вторых, устойчивая передача в Северную Америку и начало распространения в другие части мира; и в-третьих, непрерывное распространение по всему миру и вторичные вспышки за пределами Северной и Южной Америк. Основанные на коалесценции исследования показали, что вирус циркулировал в человеческой популяции в период равный или меньше трех месяцев, прежде чем он был впервые идентифицирован (дата первоначального заражения человека (то есть, дата последнего предка) по оценкам была между 29 декабря 2008 и 22 февраля 2009), напоминая своим распространением эпидемиологическую динамику сезонных вирусов гриппа. Следует отметить, что во время пандемии 2009 года множественное внедрение вируса в домашних свиней было обнаружено в различных частях мира, и исследования в Гонконге сообщили о наличии свиного рекомбинантного изолята содержащего белок НА сходный с таковым пандемического вируса H1N1. Комплексное динамическое исследование, проводившееся в южном Китае показало, что обширные рекомбинации между циркулирующими свиным и человеческо-птичьей линиями (к примеру, такими как показанные на рис. 1б) привело к появлению антигенно и генетически различных вирусов свиного гриппа за 2007 год. Потенциал для дальнейшей рекомбинации пандемического вируса гриппа H1N1 2009 года требует дальнейшего систематического и всестороннего наблюдения свиней по всему миру для того, чтобы охарактеризовать и выявить циркулирующие штаммы вируса потенциально опасные для людей.
Молекулярная эпидемиология сезонных вирусов
Сезонные вирусы H1N1 и H2N3 распространяются среди людей с 1977 года. Несмотря на то, что оба этих подтипа имеют различную эволюционную динамику, при более медленном дрейфе подтипа H1N1, они все часто подвергаются рекомбинации линий, связывающей их в подтипы. Таким образом, многочисленные линии распространяются совместно, и случайные внутрилиниевые рекомбинации вносят вклад в развитие общего вирусного генетического пула сезона.Масштабный анализ последовательностей вирусов H1N1 и H3N2 привели к созданию модели «sink-source», объясняющей происхождения ежегодных сезонных вспышек. Согласно этой модели популяция тропиков подвергается сильной антигенной селекции и служит «источником» эпидемий вируса гриппа таким образом, что вирусы переносятся линейно из этого источника в «sink»-популяции в Северном и Южном полушариях. Строго однонаправленная суть глобальных эпидемий также была показана при генетическом и антигенном анализе сезонных вирусов H3N2 2002-2007 годов. Это исследование показало, что географически перекрывающиеся эпидемии в Восточной и Юго-восточной Азии создают продолжительное распространение вирусов influenza H3N2 в пределах этого региона, из которого затем вирусы переносятся (посредством путешествий и торговых путей) в Океанию, Северную Америку, Европу и, в дальнейшем, Южную Америку.
Следовательно, пристальное наблюдение (строгий надзор) за вирусом гриппа в Восточной и Юго-восточной Азии могут помочь определить антигенные характеристики вирусов, которые в дальнейшем могут циркулировать в других частях мира. В связи с полученными данными, появление вирусов гриппа, которые вызывают сезонные эпидемии, во многом находятся под влиянием глобальной миграции вирусов и не являются результатом скрытого нахождения вирусов гриппа в организме хозяина, реактивированных во время зимы. Сухость, холод, зимние условия способствуют эффективной передаче и распространению вирусов гриппа. Однако, пандемия вируса H1N1 в 2009, образовавшаяся во время весны в Северном Полушарии, распространялась в течение лета и произвела большую повторную волну инфекций, чем пик прошлой осени, показывающую, что не смотря на климатические условия, влияющие на эпидемиологию вируса гриппа А, его передача и распространение может эффективно происходить в простых районах, независимо от сезонности, и что это распространение может быть смодулированно другими факторами, такими как тесные контакты восприимчивого населения.
Появление пандемического вируса гриппа H1N1 в 2009 году.
Несмотря на повышенное сосредоточение на контроле вирусов HPAI H5N1 в Юго-Восточной Азии, появление в апреле 2009 пандемии H1N1 SOIV стало в значительной степени неожиданным. К счастью, несколько лет скоординированных международных мер, направленных на предотвращение возможной пандемии H5N1 сделали возможным быстрое обнаружение и непрерывный надзор за новым пандемическим штаммом H1N1 который распространился по всему миру (BOX 1). Беспрецедентные меры, использующие современные эпидемиологические и молекулярные инструменты, позволяют быстро охарактеризовать скорость передачи человеку и определить потенциальную патогенность, последовательность оснований и происхождение нового вируса H1N1. Тем не менее, точность и значение оценки патогенеза раннего течения пандемии остается спорным вопросом. К примеру, ограниченные эпидемиологические данные, которые были доступны в начале вспышки в Мексике, привели к переоценке степени тяжести нового пандемического вируса. Тем не менее, ранние генетические и эволюционные анализы выявили, что этот вирус содержит сложный набор генов, которые берут начало от вирусов, заражающих птиц, людей и свиней (Рис. 2), и что они, скорее всего, происходят от вирусов, циркулировавших в популяции свиней и не обнаруживавшихся, приблизительно, в течении десятилетия. Поэтому, появление пандемического вируса гриппа H1N1 в 2009 году подчеркнуло важность наблюдения за животными и людьми, в понимании, ответном реагировании и повторном возникновении патогенов.
Источник: журнал Nature
Появление «антигенно замороженного» пандемического вируса H1N1 2009 года. Вирусы гриппа, подобные пандемическому вирусу H1N1 1918 года стали возникать в домашних свиньях между 1918 и 1920; эта линия объясняется как классическая свиная линия. В 1979 году особый Евразийский «птичье-подобный» вирус H1N1 возник в Европейских свиньях и с тех пор циркулирует совместно с классическими свиными вирусами H1N1. Вирусы H1N1 SOIV имеют различные штаммы и подтипы (к примеру, H3N2 и H1N2) появившиеся и ставшие доминирующими среди поголовья североамериканских свиней в 1990 году. Все эти вирусы обеспечили генетический пул для генеза в 2009 пандемического H1N1 SOIV, в последующем может быть рекомбинация у свиней. Таким образом, пандемический вирус H1N1 состоит из РВ2 и РА сегментов североамериканских птичьих вирусов, сегмента РВ1 человеческих вирусов H3N2, гемагглютинина (ГА; подтип Н1), нуклеопротеина (NP) исегментов NS, происходящих от классических свиных вирусов H1N1 и нейраминидазы (НА; подтип N1) и сегментов М евразийских «подобных птичьему» свиных вирусов. Секвенирование и антигенный анализ пандемического вируса H1N1 2009 года показали, что имеется сходство между ГА этих вирусов и что человеческие вирусы H1N1 1918 года циркулировали некоторое время между 1918 и 1950 гг. Антигенные сходства между пандемическими вирусами H1N1 1918 и 2009 ггпредставлены в моделях кристаллической структуры трехмерной конфигурации шаровидной головки белка ГА, как видно из показанного выше. Антигенные сайты белков ГА показаны светло синим, не-антигенные сайты показаны темно синим. Сайты, которые различны между белками ГА 1918 и 2009 показаны красным.
Новые концепции в тропности хозяина.
Большинство подтипов вируса гриппа ограничивается определенными хозяевами, но некоторые производят впечатление более неразборчивых и циркулируют в нескольких видах (к примеру, вирусы H1N1 и H3N2 являются эндемичными для человека, птиц и свиней). С 1918 года подтипы H1N1, H2N2 и H3N2 положили начало пандемиям гриппа у людей. Тот факт, что наблюдались только спорадические инфекции (у людей, которые находились в непосредственном контакте с видами птиц, инфицированных вирусами HPAI H5N1) особенно подчеркивает представление о том, что факторы хозяина ограничивают инфицирование вирусом гриппа новых видов (см. Обзор 51). Тем не менее, пандемия H1N1 2009 года и предыдущие пандемии напоминают, что некоторые вирусы могут без труда обходить ограничительные барьеры хозяина.
Тканевой тропизм и рецепторная специфичность.
Белки ГА сезонных подтипов Н1 и Н3 вируса человека в основном распознают рецепторы с концевыми фрагментами α‑2,6—SA, которые находятся на бронхиальных эпителиальных клетках верхних дыхательных путей (ВДП) человека. В отличие от этого, AIV связываются преимущественно с галактозой, сопряженной с α‑2,3—SA, которые находятся в изобилии на эпителиальных клетках в кишечнике птиц и в нижних дыхательных путях (НДП) людей (Рис. 3). Свиньи имеют рецепторы в трахее, содержащие как α‑2,3—SA, так и α‑2,6—SA и, по этой причине, были представлены, как «смесительный сосуд» (см. обзор 57) для рекомбинации человеческого и птичьего вирусов, приводящей к возможному порождению пандемических вирусов. Точно так же, фазаны, индейки, перепела и цесарки имеют оба типа рецепторов в дыхательных путях и кишечнике, и могут так же служить «смесительными сосудами». Интересно, что были опубликованы данные о том, что H1N1 SOIV, ответственный за пандемию в 2009, может связываться с α‑2,6—SA и, в ограниченной степени, с α‑2,3—SA и инфицировать клетки ВДП и НДП. Фиксация на НДП, предположительно, индуцирует вирусную пневмонию, которая наблюдается у лиц, инфицированных вирусами HPAI и происходила в некоторых тяжелых случаях во время пандемии 2009 года. Вместе с тем, вирусы HPAI H5N1 могут так же инфицировать и реплицироваться в клетках эпителия носоглотки и ротоглотки и, таким образом, использовать другие рецепторы для заражения клеток ВДП. Птичьи вирусы специфичны для рецепторов, содержащих α‑2,3—SA, которые большей частью представлены у человека в ВДП, что, вероятно, способствует ограниченной вирусной трансмиссии от птицы к человеку, хотя обмен поверхностных гликопротеинов вируса HPAI H5N1, в том числе с ВДП, не обеспечивает контагиозность способного к передаче сезонного вируса. Таким образом, в дополнение к ГА-рецепторной специфичности, другие вирусные факторы, факторы хозяина и окружающей среды, вероятно влияют на приспособляемость и передачу вирусов гриппа у различных хозяев.
Тем не менее, специфичность и аффинность ГА для этих рецепторов – это один из решающих факторов тропизма хозяина и передачи (Рис. 3). К примеру, передача по воздуху вируса гриппа H1N1 пандемического в 1918 году в модели хорька модулируется аминокислотами в ГА в положениях 190 и 225 (для стандартизации используется нумерация Н3). Варианты D225G снижают аффинность α‑2,3 связанных SA, в результате чего ослабляется фиксация на бокаловидных клетках человеческой трахеи (которые экспрессируют α‑2,6 содержащие рецепторы) и снижается передача у хорьков. Вариант D225G в комбинации с измененным D190E, которым подходят согласованные аминокислоты, находящиеся у птичьих штаммов H1N1, приводит к предпочтительной фиксации на рецепторах, содержащих α‑2,3—SA. Хотя этот вирус может эффективно реплицироваться в ВДП хорька, его контагиозность это аннулирует. Продуктивная передача вирусов HPAI H5N1 от человека к человеку не происходит успешно в природе или в экспериментальных моделях передачи на млекопитающих. Таким образом, для успешного заражения и передачи может понадобиться специфическая адаптация. Мутации G225D и E190D снижают авидность вируса HPAI H5N1 к α‑2,3—SA, но специфичность к α‑2,6—SA не пользуется преимуществом, указывая, что различные аминокислотные остатки ответственны за рецептор-связывающую специфичность вирусов H5N1 (рис. 3, таблица 1). Кроме того, различные остатки, расположенные вокруг рецептор-связывающего сайта, причастны к рецептор-связывающим особенностям других птичьих и пандемических вирусов (таблица 1), что указывает на дифференциальное модулирование рецепторной специфичности в различных подтипах ГА. Важно отметить, что изоляты вирусов H1N1 SOIV которые были найдены во время пандемии 2009 года, содержали мутации D225G ассоциированные с тяжелой болезнью человека и смертью. Эти изоляты проявляют повышенную связь с α‑2,3—SA, так что эта мутация дарует двойную рецепторную специфичность. Способность H1N1 SOIV, ответственного за пандемию 2009 года, частично связываться с α‑2,3—SA контрастирует с сезонными вирусами H1N1 человека, которые существовали ранее 2009 года и которые связывают преимущественно α‑2,6—SA и, возможно, отражают годы адаптации человека. Интересно, что эти вирусы человека имеют более высокую аффинность для длинных, чем для коротких сахаров, содержащих α‑2,6—СА, предполагается, что топология гликана так же может модулировать аффинность связывания с ГА и адаптацию вирусных рецепторов. Небольшие различия в рецепторной специфичности пандемического штамма 2009 года могут частично объяснить повышенную репликацию, передачу и патогенез, которые наблюдались на животных моделях для этого вируса в сравнении с сезонными вирусами. Следует отметить, что тяжесть заболевания, индуцируемого пандемическим в 2009 году вирусом H1N1 в общей человеческой популяции не резко отличалась от наблюдаемой во время сезонного гриппа, предполагается, что дополнительные факторы, такие как ранее существовавший иммунитет и адаптация хозяина (обсуждается ниже), модулируют патогенный потенциал вирусов гриппа А у людей.
Компетентность репликации.
Афинность рецепторов не гарантирует успешное заражение и репликацию в хозяине, а общая вирусная приспособляемость имеет решающее значение, для роста вируса гриппа. Вирусная полимераза дарит хозяин-специфическую адаптацию, которая повышает эффективность репликации. Остаток K627 РНК-зависимой РНК-полимеразы белка РВ2 уже давно признан как определяющий круг хозяев, придающий способность заражать людей и присутствующий в большинстве человеческих вирусов H1N1 и H3N2, но в немногих птичьих вирусах. Вирусы, содержащие остаток К627 могут расти при температуре 33С и эффективно реплицироваться в ВДП мышей, указывая, что они могут легко реплицироваться в ВДП людей (рис 3). К627 коррелирует с повышенной вирулентностью изолятов человеческого HPAI H5N1 и был найден в смертельном случае инфицирования человека вирусом HPAI H7N7 во время вспышки в Нидерландах в 2003. Вирусы, которые были изолированы от птиц во время вспышки на озере Цинхай в Китае так же обладали замещенным К627, это указывает что данный остаток может эволюционировать в природе без предварительной селекции в людях. Мутация D701N в РВ2 так же была вовлечена в адаптацию AIV к росту в клетках млекопитающих и вариабельность передачи была показано в моделях на морских свинках и хорьках. Удивительно, но пандемический штамм H1N1 2009 года может эффективно реплицироваться и передаваться, и даже может вытеснять сезонные, адаптированные к человеку штаммы, не смотря на то, что его РВ2 не имеет адаптаций ни К627, ни N701. Недавно было установлено, что остаток R591, который присутствует в пандемическом штамме 2009 года, может обеспечивать эффективную репликацию у млекопитающих и компенсирует отсутствие адаптаций K627 и N701. Другие недавние исследования показали, что ГА, НА, РВ2 и РА (другой белок РНК-зависимой РНК-полимеразы) способствуют компетентной репликации вирусов H7N7 в клетках человека. Точно так же, человек-адаптирующие белки РВ2 и ГА в моделях на хорьках были найдены как обеспечивающие компетентность репликации и контагиозность некоторым AIV. Таким образом, адаптации в белках полимеразы и ГА обеспечивает успешную фиксацию вируса, внедрение и репликацию в соответствующих клетках дыхательных путей человека.
Источник: журнал Nature
Тропизм вируса гриппа А. Анатомическая экспрессия паттернов вирусных рецепторов у различных хозяев ограничивает инфицирование и репликацию вирусов гриппа А. Трахея свиньи содержит рецепторы, имеющие α-2,3-связанные и α-2,6-связанные фрагменты сиаловых кислот, которые позволяют связывать как птичьи, так и человеческие вирусы, что привело к мысли о том, что свиньи могут служить «смесительным сосудом» в котором происходит рекомбинация птичьих и свиных вирусов. Птичьи вирусы связываются преимущественно с α-2,3-SA, которые найдены на рецепторах в кишечнике и дыхательных путях птиц. Напротив, адаптированные к человеку вирусы (к примеру, сезонные вирусы H1N1, H3N2 и пандемический H1N1 2009 года) имеют высокое сродство с α-2,6-SA, которые экспрессируются в больших количествах в дыхательных путях людей. Заражение человека вирусом не адаптированным к человеку – редкость и обычно является результатом передачи при прямом контакте. Вирусные белки и их специфические остатки, которые влияют на связывание с рецептором и были созданы как адаптирующие к носительству человеком – перечислены; вариации белка гемагглютинина Н1, Н3 и Н5 и РВ2 – компонент РНК-зависимой РНК-полимеразы.
Факторы хозяина, которые влияют на заражение вирусом гриппа.
Источник: журнал Nature
CPSF30 — расщепленный и полиаденилированый фактор специфичности, субъединица 30 кДа ; HA — гемагглютинин; HPAI — высоко патогенный птичий грипп; NA — нейраминидаза; NS1 — неструктурный белок 1;
*некоторые варианты вируса 1918 года имеют отличные рецепторные связи, обеспечивающие двойную связь со специфическими сиаловыми кислотами α-2,6-SA и α-2,3-SA (см. основной текст для уточнения деталей).
‡ Некоторые ранние изоляты вирусов человека содержат связанные с α-2,3-SA остатки Q226 и Q228. Остатки D190 и D225 необходимы для связывания α-2,6-SA. Связывание α-2,3-SA ограничено; однако, мутация аминокислоты D225G, которая найдена в небольшой выборке изолятов пандемического H1N1 2009 года в некоторых тяжелых случаях наделяет повышенной α-2,3-SA-связывающей специфичностью.
|| Вирусы Н7 так же показывают умеренную связь остатка К193 с α-2,6-SA
¶ Для белка НА аминокислотные позиции соответствуют нумерации Н3.
# Часть из положительно заряженного «забора лизина” на базе рецептор связывающего сайта (определяется с помощью структурных прогнозирующих моделей) позволяет связываться с α-2,3-SA и компенсирует отсутствие птичьего Е190. **Прогнозируется из анализа аминокислотной последовательности и кристаллической структуры H7N3 HA в комплексе с аналогами рецептора.
‡‡Последние вирусы содержат либо V (1996-2002гг), либо I (2003-2011гг) в позиции 226.
§ Природные варианты вируса могут содержать S или N.
|||| Найден в адаптированном мышином H7N, в некоторых птичьих изолятах H7N7 и в некоторых птичьих и человеческих изолятах H5N1.
¶¶ Привязка к домену PDZ, общему структурному домену 80-90 аминокислот, который найден в сигнальных белках различных организмов и был вовлечен в вирулентность: (K/E)(S/P)EV — сильный связывающий мотив, RS(E/K)V отображает слабую или отсутствующую связь.
## Некоторые варианты имеют слабые связи.
***Прогнозируемая связь, не подтверждена экспериментально.
‡‡‡ Найдены в вирусах, которые были изолированы в ходе вспышки H5N1 1997 года.
§§Птичий и человеческий изоляты H5N1, которые были выделены и существуют в природе, содержащие резистентный остаток N31 или чувствительный остаток S31.
|||||| Устойчивые вирусы иногда могут появляться у пациентов, перенесших лечение или профилактику.
Последние полногеномные методики определили различные факторы хозяина, которые необходимы для эффективной репликации вируса гриппа (см. обзор 98). Они включают в себя факторы хозяина, которые участвуют во встраивании и сбрасывании оболочки вируса; транспорт комплексов вирусного РНП в ядро; репликацию, транскрипцию и трансляцию вирусного генома; экспорт комплексов вирусного РНП из ядра, а, так же, сборку и размножение вируса. Некоторые из необходимых факторов хозяина, существенно снижают интенсивность вирусной инфекции. Например, вакуолярная АТФаза ATP6V0D1, которая участвует в пути эндоцитоза, необходима для встраивания вируса гриппа, и малое интерферирующее РНК-опосредованное истощение мРНК ATP6V0D1 в клетках человека НЕК-294 специфически снижает репликацию вирусов H1N1 и H5N1. Другими найденными белками, которые требуются для оптимальной репликации вируса гриппа А были: CAMK2B – рецептор к кальцию, который повсеместно экспрессируется и участвует в регуляции некоторых клеточных процессов; CLK1 который участвует в регуляции альтернативного сплайсинга в клетках млекопитающих; и р27 (также известный как CDKN1B) регулятор клеточного цикла. Различные исследования выявили некоторые физические и регуляторные взаимодействия между белками вируса и факторами хозяина, которые сопоставляются с новыми клеточными путями и которые влияют на репликацию вируса гриппа. Например, удаление компонентов пути WNT увеличивает вирусную репликацию и снижает продукцию интерферона (ИНФ), указывает что этот путь регулирует инфицирование вирусом гриппа посредством все еще неизвестных механизмов. Кроме того, два независимых исследования сообщили, что ИФН-индуцированный трансмембранный протеин 3 (IFITM3) ограничивает раннюю стадию репликации вируса гриппа. Дополнительные исследования, для изучения штамм-специфичных эффектов этих факторов хозяина не только помогут нащему пониманию взаимодействия вирус гриппа-хозяин, но, так же, возможно приведут к развитию новых, повсеместно распространенных противовирусных подходов. Ингибирование определенных факторов хозяина (не затрагивая хозяин-специфичных функций) может быть успешно использовано в качестве фармакологического вмешательства в борьбу с вирусами гриппа и может свести к минимуму развитие резистентных штаммов вируса.
Новые представления о патогенезе вируса гриппа.
Генетические манипуляции с вирусом гриппа позволили идентифицировать некоторые вирусные маркеры, которые связаны с вирулентностью и патогенезом (таблица 1). В частности, реконструкция вируса гриппа H1N1 ответственного за пандемию гриппа в Испании в 1918 года и исследования вирусов гриппа HPAI H5N1 четко установили сложность и мультигенную характеристику патогенеза вируса гриппа. Кроме того, системы моделей на животных разработаны и широко используются для объяснения многих взаимодействий вирус-хозяин и факторов хозяина, которые способствуют патогенезу (рис. 4). Точно так же, пандемия H1N1 в 2009 году расширила наше понимание основных факторов риска и молекулярных механизмов, которые приводят к тяжелым заболеваниям у людей.
Конституциональный иммунитет и патогенез. Как уже говорилось выше, антигенные свойства ГА гриппа являются главной детерминантой патогенеза. Главной беспокойство об антигенной изменчивости – то, что она может создать пандемический человеческий вирус относящийся к подтипу ГА, к которой человеческая популяция интактна. Тем не менее, новая концепция пандемии H1N1 в 2009 годы заключается в том, что изменения подтипа ГА не достаточны для генерации вирусной пандемии у человека, тогда как младшие члены популяции иммунологически интактны и, таким образом, восприимчивы к штаммам, действию которых постоянно подвергалось старшее поколение и обрело защиту от них (рис. 2). Во время пандемии H1N1 в 1918 году, вирус H1N1 создал независимые линии у людей и свиней. Постоянный антигенный дрейф вирусов H1N1 у людей привел к возникновению сезонных вирусов H1N1, которые значительно отличаются по антигенам от оригинального, родительского вируса 1918 года. Тем не менее, ГА свиного вируса H1N1, который сформировался во время пандемии 1918 года, стал производным для нового пандемического вируса H1N1, не подвергаясь обширному дрейфу и таким образом поддерживался «антигенно замороженным» в свиньях. Это может быть связано с короткой продолжительностью жизни домашних свиней, которые не подвергаются нескольким заражениям вирусом гриппа в течении жизни и, следовательно, не находятся под давлением главной гуморальной селекции, стимулирующей антигенный дрейф. Кроме того, давление хозяин-специфической иммунной селекции может приводить к антигенному дрейфу у свиней в сайтах отличных от тех, которые важны для иммуногенности у людей. Оба процесса могут привести к «антигенной заморозке» ГА. Таким образом, учитывая правильные условия (к примеру, зоонозные передачи большой иммунологически интактной человеческой популяции), избыток встреч с вирусом, который может циркулировать некоторое время в свиньях, приводя к возникновению нового пандемического человеческого вируса, содержащего ГА из ранее циркулирующего подтипа.
Ранние эпидемиологические данные, собранные во время пандемии 2009 года, показали, что молодые (65 лет). В сыворотках пожилых людей были обнаружены перекрестно-реагирующие антитела к новому штамму, что наводит на размышления о предыдущем воздействии антигенно подобных вирусов. Примечательно, что иммунизация мышей вирусоподобными частицами H1N1 1918 года, вирусами H1N1 человека, которые циркулировали до 1947 или классическими свиными вирусами H1N1 привела к выработке перекрестно-реагирующих антител и присвоила защиту от вируса H1N1 2009 года, что демонстрирует тесное антигенное сходство этих вирусов. Самое высокое антигенное сходство между новым и старым пандемическими вирусами 2009 и 1918гг, которые имеют высокое сходство в антигенных сайтах (названных Sa, Sb, Ca1, Ca2 и Cb ) шаровидной головки белка ГА, в частности, на сайте Sa82. Вакцинация людей новым вакцинным штаммом H1N1 2009 года вызывает значительный уровень перекрестных антител против вируса H1N1 1918 года, что подтверждает их антигенное сходство, и лечение мышей человеческой сывороткой, которая была положительна по этим антителам, защищала мышей зараженных вирусом H1N1 1918 года от летального исхода. Безграничное глобальное распространение вируса H1N1 в 2009 году, которое привело к миллионам спонтанных инфекций и широкому распространению иммунизации вакцинным штаммом H1N1 2009 года показывают, что большая часть мирового населения теперь имеет антитела, которые перекрестны к вирусу 1918 года, что является непредвиденным преимуществом текущего вакцинного штамма. В противоположность этому, вакцины против сезонных вирусов гриппа H1N1 имеют низкую перекрестную реактивность к вирусу 1918 года. Это связано с накоплением мутаций в антигенных сайтах ГА в течении антигенного дрейфа и приобретением гликозилированных сайтов в белке шаровидной головки, которая может защищать антигенно соответствующие области; в целом, эти изменения приводят к радикальным антигенным различиям между сезонными штаммами и пандемическими вирусами 1918 и 2009 годов. Таким образом, молодые люди, которые были подвержены только современным сезонным вирусам H1N1 иммунологически интактны пандемическому вирусу H1N1 2009 года, что частично объясняет более высокую частоту развития у них тяжелой болезни, вызванной пандемическим вирусом 2009 года.
Источник: журнал Nature
Сводный обзор факторов вируса и хозяина, которые влияют на патогенез вируса гриппа А. Взаимодействия вирус-хозяин затрагивают вирусную репликацию. Изменения во многих белках вируса гриппа А способствуют патогенезу и фикторы хозяина могут так же влиять на восприимчивость к инфекции и прогрессирование заболевания. Факторы риска – ожирение и диабет были определены во время пандемии H1N1 2009 года. ГА – гемагглютинин, НА – нейраминидаза, NP – нуклеопротеин, NS1 – неструктурный белок 1.
Вирусные детерминанты патогенеза.
Последовательность на участке рестрикции ГА, является основным фактором, определяющим тяжесть заболевания. Участок рестрикции ГА самых низкопатогенных штаммов вируса гриппа содержит одиночную аминокислоту аргинин, которая распознается специфическими трипсиноподобными внеклеточными протеазами (например, сериновые протеазы, такие как трансмембранная протеаза человека серин 2 (TMPRSS2) и трипсиноподобные протеазы эпителия дыхательных путей человека), которые представлены в организме хозяина только в слизистой оболочке кишечника и дыхательных путей. Тем не менее, белки ГА вирусов Н5 и Н7 HPAI характеризуются наличием многоосновного участка рестрикции, который расщепляется встречающимися повсюду внутриклеточными протеазами, что находятся в различных органах, такими как субтилизин-подобные протеазы фурин и конвертаза пропротеина субтилизин-кексин типа 6. Это может приводить к системной инфекции и повышать вирулентность, особенно у птиц и мелких млекопитающих. У людей, заражение вирусом HPAI H5N1 так же характеризуется наличием вирусной РНК вне респираторной ткани и высокой летальностью в результате полиорганной недостаточности. Тем не менее, не смотря на то, что пандемический вирус H1N1 лишен многоосновного участка рестрикции ГА, результатами инфицирования этим вирусом животных моделей были высокий уровень вирусной репликации и индукция провоспалительных цитокинов, которые приводят к тяжелой болезни. Рекомбинантные вирусы экспрессирующие только нуклеопротеин (НП) и белки РНК-зависимой РНК-полимеразы РВ1, РВ2 и РА вируса 1918 года, вместе с сезонной ГА, продемонстрировали эффективную репликацию в ВДП и НДП хорьков. Кроме того, белки ГА, НА и РВ1 вируса 1918 года так же являются критическими факторами, определяющими вирулентность у мышей. Недавно определенным фактором вирулентности является белок PB1‑F2, который локализуется в митохондриях инфицированных клеток, индуцирует растворение митохондриальной мембраны и приводит к апоптозу. Пандемический вирус 1918 года необычен тем, что он содержит остаток S66 в PB1‑F2, который представлен только в различных изолятах вирусов HPAI H5N1. Наиболее распространенный остаток, найденный в этой позиции в PB1‑F2 других штаммов – это N, и замена S66N резко снижает вирулентность вируса 1918 года и других вирусов, которые содержат сегмент HPAI PB1. Также PB1‑F2 способствует возникновению и повышает патогенез вторичной инфекционной пневмонии. Совсем недавно было обнаружено, что PB1‑F2 взаимодействует с вирусным белком ингибируя интерфероновый ответ хозяина. Тем не менее, в некоторых вирусах, в частности в свином и современном человеческом изолятах H1N1 (включая пандемический штамм H1N1 2009 года), стоп кодоны в PB1‑F2 приводят к экспрессии процессированного белка, но восстановление кодирующей емкости PB1‑F2 только минимально влияет на вирулентность, вероятно из-за дополнительных требований последовательности в PB1‑F2 (см. обзор 120). Другой детерминантой вирулентности вируса гриппа является многофункциональный белок NS1 (см. обзор 121), который является антагонистом противовирусной ИФН-опосредованной реакции хозяина и модулятором приобретенного иммунного ответа, и может ингибировать всеобщую экспрессию генов хозяина посредством его взаимодействия с дробящимся ядерным белком и субъединицей полиаденилированного фактора специфичности размером 30 кДа (CPSF30, так же известный как CPSF4). NS1, вероятно, вносит вклад в дизрегуляцию цитокинов, которая наблюдалась у макак, зараженных вирусом 1918 года и людей, которые поддались вирусной инфекции HPAI H5N1. Остаток Е92 вирусного NS1 вируса HPAI H5N1 так же был вовлечен в вирулентность. Белок NS1 пандемического штамма H1N1 2009 года содержит оба вида мутаций, ликвидирующую CPSF30-связывающие свойства и 11 делеций аминокислот карбоксильного конца, и, следовательно, ему не хватает PDZ-связывающего домена, который ранее был замешан в вирулентности. Неожиданно, но когда эти функции появлялись вновь, они не оказывали серьезного влияния на репликацию, патогенез или передачу пандемического вируса 2009 года, предполагается, что некоторые функции NS1 не являются необходимыми, для успешного заражения человека.
Детерминанты патогенеза хозяина. .
У людей, вирусы HPAI могут приводить к повышению плазменного уровня ИФНγ-индуцированного белка до 10 кДа (IP10, так же известный, как CXCL10), моноцитарного хемоаттрактантного белка 1 (MCP1, так же известный как CCL2), интерлейкина-8 (ИЛ-8), ИЛ-6, ИЛ-10 и других провоспалительных цитокинов, которые коррелируют с повышением вирусной нагрузки в глотке и увеличением частоты смертельных случаев вирусной пневмонии (см. обзор 125). Модели млекопитающих инфицированных вирусами H1N1 1918 года и HPAI H5N1 продемонстрировали высокую и скорую активацию генов иммунного ответа хозяина. Заражение вирусом H1N1 1918 года, в сравнении с инфицированием современным штаммом H1N1, ассоциировано с тяжелой легочной патологией. Эти модели заражения так же показывают индукцию инфильтрации макрофагами и нейтрофилами для обоих штаммов (вирусов HPAI H5N1 и H1N1 1918 года), результатом которой являются острое воспаление легких и дерегуляция противовирусных ответов, недостаточных для защиты и, возможно, вносят вклад в патогенез. Тяжесть заболевания, в результате заражения вирусом 1918 года коррелирует с устойчивой патологией, развивающейся вследствие активации воспаления и гибели генов клетки. Аналогично, повышенная и длительная транскрипция 1 типа ИФН, воспаление и индукция врожденного иммунитета видны во время заражения вирусом HPAI H5N1, результатом которого являются апоптоз дендритных клеток и тяжелая патология легких. Кроме того, заражение вирусом гриппа мышей с дефицитом ИЛ-15 (см. 133), ИЛ-17 (см. 134) или сигнальных рецепторов 2 СС-хемокинов (CCR2) и мышей, которые испытывают недостаток фактора некроза опухоли (TNF) и рецепторов к ИЛ-1 приводит к увеличению выживаемости и/или задержке летальности по сравнению с наблюдаемыми у инфицированных мышей дикого типа, в следствие снижения уровня лейкоцитарной, нейтрофильной или макрофагальной инфильтрации. Инфекции у ИЛ-10-отключенных мышей могут вызывать увеличение продукции антител в легких в сравнении с уровнем у инфицированных мышей дикого типа, что приводит к снижению титра вируса и увеличению выживаемости. Тем не менее, различные исследования показали, что CD8+ эффекторные Т-клетки, производя ИЛ-10, могут контролировать воспаление легких и травмы, которые индуцируются во время острого заражения вирусом гриппа. Таким образом, для определения роли ИЛ-10, необходимо дальнейшее исследование, в частности, в контексте высоко вирулентных штаммов вируса гриппа. Кроме того, мыши которые дефицитны по TNF, ИЛ-6 или рецептору СС-хемокина 2 (CCL2) поддаются заражению вирусом HPAI H5N1 так же, как и мыши дикого типа, указывая, что хотя острая иммунная реакция хозяина может способствовать патогенезу, эллиминация некоторых про-воспалительных сигналов не предотвращает тяжесть заболевания. Новый инструмент, направленный на выяснение кинетики и клеточного тропизма при заражении вирусом гриппа in vivo, обеспечивает развитие способных к репликации флуоресцентно меченных вирусов гриппа А. Этот инструмент показал, что клетки натуральных киллеров, В-клетки и антиген-представляющие клетки так же восприимчивы к инфекции, в дополнение к эпителиальным клеткам. Такие системы моделей позволяют исследовать в дальнейшем специфические клетки хозяина, которые вносят вклад в патогенез и восстановление от болезни.
Во время пандемии H1N1 2009 года, у подгруппы индивидов развивалась быстрая и тяжелая вирусная пневмония, которая часто ассоциировалась с недостаточностью других органов и приводила к значительным ухудшениям, лежащим в основе астмы или хронической обструктивной болезни дыхательных путей. Наивысшие риски тяжелой или смертельной болезни были обнаружены у беременных женщин (особенно в третьем триместре беременности), детей младше двух лет и людей с хроническими заболеваниями легких, включая астму. Ожирение и сахарных диабет были снова установлены, как факторы риска тяжести инфекции пандемическим вирусом H1N1 2009 года. У некоторых здоровых людей так же наблюдалась тяжелое инфицирование этим вирусом. Тем не менее, основная причина тяжести до сих пор неизвестна, внимательное наблюдение за клиническим течением и быстрое ведение лиц с тяжелой болезнью остаются основными подходами для снижения летальности. Интересно, что недавнее исследование сообщило о высокой корреляции для иммунокомплексно-опосредованного заболевания и тяжести симптомов у взрослых, после заражения вирусом H1N1 2009 года. Тяжесть заболевания была ассоциирована с высоким уровнем низко-авидных, не-протективных антител и иммунокомплекс-опосредованного комплимента, активирующегося в дыхательных путях инфицированных взрослых, раскрывая новейший механизм, который может объяснить повышенную тяжесть заболевания, наблюдавшуюся у индивидов среднего возраста во время пандемии H1N1 2009 года. Дополнительные исследования, расширяющие эти наблюдения на животных моделях стали бы важным шагом на пути к пониманию тяжести заболевания, вызванного пандемическими вирусами гриппа А.
Что ожидает в будущем?
Штамм H1N1 2009 года кардинально изменил динамику циркуляции предыдущих сезонных штаммов вируса гриппа (с момента появления пандемического, сезонные H1N1 почти не обнаруживались по всему миру). Иммунное давление отбора вероятно станет причиной того, что вирус H1N1 подвергнется изменению антигенных характеристик (то есть, произойдет антигенный дрейф). Воздействие современных сезонных вирусов, иммунизация текущими вакцинными штаммами и уже существующий иммунитет к прошлым вирусам H1N1 вместе сформировали сложный спектр иммунитета в популяции и это, вероятно, способствует отбору ранее невиданных вариантов дрейфа, отражающих пластичность антигенной эволюции белка ГА вируса гриппа. Высокая пропускная способность полногеномного секвенирования, для оригинальных клинических изолятов позволит систематически наблюдать вирусы гриппа человека в реальном времени, чтобы установить варианты дрейфа и генетические изменения, которые могут быть эпидемиологически востребованы.
Дополнительный акцент так же должен быть поставлен на изучении вирусов гриппа от людей и от диких и домашних животных в географических регионах, которые в настоящее время скудно представлены или не представлены в геномных базах данных (к примеру латинская Америка и Африка). Непрерывное и усиленное наблюдение за дикими хозяевами, которые переносят вирусы гриппа не только позволяет обнаружить новые штаммы, но также способствует нашему пониманию экологии вируса гриппа (путем наложения на карту мира «горячих точек» вируса гриппа А), видов, которые переносят эти вирусы и степени, в которой природная миграция птиц и/или локализация сообществ птиц модулирует генерацию рекомбинантных вирусов. Дополнительное вирусное секвенирование так же может содействовать в уточнении современных моделей эволюции вируса гриппа, усовершенствовать наше умение оценивать лежащую в основе молекулярную базу вирулентности и помочь в разработке усиленного наблюдения по всему миру, более эффективного в долгосрочной перспективе.
В настоящее время, для лечения инфекции вирусом гриппа человека используется два семейства противовирусных препаратов. Оцельтамивир(Тамифлю; Roche) и Занамавир (Реленза; GlaxoSmithKline) ингибируют нейраминидазную активность белка НА, таким образом блокируя высвобождение вновь сформированных вирионов из зараженных клеток. Адамантаны (амантадин и римантадин) ингибируют способность к обмену H+ вирусного белка М2 ионного канала необходимую для снижения pH внутри вируса, шага, который необходим для раздевания вируса в момент вступления в клетку хозяина. Хотя эти противовирусные терапии являются эффективными против текущих штаммов вируса гриппа, их использование может привести к селекции устойчивых вирусов и резистентных штаммов, встречающихся в природе (таблица 1). Это подчеркивает большую необходимость в дополнительных терапевтических подходах широкого спектра. Препараты, нацеленные на различные вирусы или хозяина и различные стадии репликации вируса гриппа будут представлять внушительные средства борьбы с инфекцией путем нескольких подходов и минимизируют развитие резистентных вирусов.
Комплексная динамика вирусов гриппа беспрерывно испытывает барьеры видов-хозяев и, потому, возникновение новых вирулентных штаммов вируса у людей постоянно вероятно. Чтобы получить полное представление о механизме, с помощью которого возникают рекомбинантные вирусы, необходимы дальнейшие исследования, для выявления требуемых специфических рецепторов и специфических типов клеток, или типов и сайта (органа), где такое событие может иметь место. Кроме того, выявление молекулярных требований к рекомбинации на уровнях вирусного фактора и факторов хозяина может значительна помочь нам понять, как эти вирусы возникают в природе и, следовательно, должны привести к дополнительным и расширенным противовирусным вмешательствам. Более того, в этом комплексном взаимодействии между хозяином и вирусом гриппа, факторы хозяина играют важную роль в тяжести заболевания и исходе, и исследования, фокусирующиеся на идентификации факторов предрасположенности человека, следовательно, ключ к пониманию детерминант патогенеза вируса гриппа у хозяина. Современные системы модели на животных лишь частично воспроизводят человеческий грипп, так, дополнительно, с большой осторожностью разработаны клинические исследования необходимые для обоснования таких моделей и поиска генетических факторов предрасположенности и полиморфизма, а также лежащих в основе, специфических условий, которые модулируют исход заболевания у людей.
Оригинал статьи
Перевод: Елена Лисицына
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Грипп и ОРВИ
Версия: Клинические протоколы МЗ РК — 2019 (Казахстан)
Категории МКБ:
Грипп, вирус не идентифицирован (J11), Грипп, вызванный идентифицированным вирусом гриппа (J10), Острые инфекции верхних дыхательных путей множественной и неуточненной локализации (J06), Острый ларингит и трахеит (J04), Острый назофарингит (насморк) (J00), Острый тонзиллит неуточненный (J03.9), Острый тонзиллит, вызванный другими уточненными возбудителями (J03.8), Острый фарингит неуточненный (J02.9), Острый фарингит, вызванный другими уточненными возбудителями (J02.8)
Разделы медицины:
Инфекционные и паразитарные болезни
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «19» апреля 2019 года
Протокол №63
Грипп — острая высоко контагиозная респираторная вирусная инфекция с воздушно-капельным механизмом передачи, вызываемая вирусами гриппа типа А, В и С (семейство Orthomyxoviridae, род Influenzavirus). Данная инфекция имеет склонность к эпидемическому распространению, поражает все возрастные группы населения в различных географических условиях. Заболевание характеризуется коротким инкубационным периодом, быстрым циклическим течением, наличием интоксикационного и катарального синдромов с преимущественным поражением эпителия слизистой оболочки верхних дыхательных путей. Тяжелое течение гриппа сопровождается поражением нижних дыхательных путей с признаками дыхательной недостаточности, отека легких, сосудистого коллапса, отека мозга, геморрагического синдрома и присоединением вторичных бактериальных осложнений. [1].
Острые респираторные вирусные инфекции – группа острых инфекционных болезней с воздушно-капельным механизмом передачи, различающиеся по этиологии (известно более 300 вирусов), клинически характеризующиеся интоксикацией разной степени выраженности и поражением слизистой оболочки верхних и нижних дыхательных путей в зависимости от тропности возбудителя [1].
При отсутствии этиологической расшифровки, для принятия решения тактики ведения пациентов следует различать:
Тяжелые острые респираторные инфекции – заболевания, возникшие в течение предшествующих десяти календарных дней, характеризующиеся высокой температурой в анамнезе или лихорадкой ≥ 38 градусов Цельсия (далее – °С), кашлем, одышкой и требующего немедленной госпитализации (Стандартное определение случая, ВОЗ) [2];
Гриппоподобные заболевания – случаи острых респираторных вирусных заболеваний, возникшие в течение предшествующих семи календарных дней, характеризующегося лихорадкой ≥38 °C и кашлем (Стандартное определение случая, ВОЗ) [2].
——————————————————
——————————————————
* ИНФОРМАЦИЯ ПАРТНЕРОВ «МЕДЭЛЕМЕНТ»
МаксиГриппин – симптоматическое лечение простуды и гриппа
МаксиГриппин
состоит из трех компонентов: парацетамол, хлорфенамин, аскорбиновая кислота (витамин С). Есть взрослые и детские формы (для детей с 3 лет). Детские таблетки без сахара, но обладают сладким приятным вкусом. Разнообразие вкусов и форм выпуска.
200 мг и 50 мг витамина С
В каждой таблетке/пакетике МаксиГриппина для взрослых содержится 200 мг и в детской форме 50 мг аскорбиновой кислоты.
Таблетки шипучие со вкусом малины, для взрослых и детей не содержат сахар.
Перед назначением и применением внимательно прочтите инструкцию по медицинскому применению. Самолечение может быть вредным для вашего здоровья.
——————————————————
——————————————————
ВВОДНАЯ ЧАСТЬ
Название протокола: Грипп и ОРВИ
Код МКБ 10:
| Код | Название |
| J00- J06 | Острые респираторные инфекции верхних дыхательных путей |
| J00 | Острый назофарингит (насморк) |
| J02.8 | Острый фарингит, вызванный другими уточненными возбудителями |
| J02.9 | Острый фарингит, не уточненный |
| J03.8 | Острый тонзиллит, вызванный другими уточненными возбудителями |
| J03.9 | Острый тонзиллит, не уточненный |
| J04 | Острый ларингит и трахеит |
| J04.0 | Острый ларингит |
| J04.1 | Острый трахеит |
| J04.2 | Острый ларинготрахеит |
| J06 | Острые респираторные инфекции верхних дыхательных путей множественной и неуточненной локализации |
| J06.0 | Острый ларингофарингит |
| J06.8 | Другие острые инфекции верхних дыхательных путей множественной локализации |
| J06 | Острая инфекция верхних дыхательных путей неуточненная |
| J10- J18 | Грипп и пневмония |
| J10 | Грипп, вызванный идентифицированным вирусом гриппа |
| J11 | Грипп, вирус не идентифицирован |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2019 г.)
Сокращения, используемые в протоколе:
| БА | – | бронхиальная астма |
| ВОП | – | врач общей практики |
| ДВС | – | диссеминированное внутрисосудистое свертывание |
| ДЭН | – | дозорный эпидемиологический надзор |
| ГПЗ | – | гриппоподобные заболевания |
| ИФА | – | иммуноферментный анализ |
| КУБ | – | кислотоустойчивые бактерии |
| МНО | – | международное нормализованное отношение |
| НПВП | – | нестероидные противовоспалительные препараты |
| ОРВИ | – | острая респираторная вирусная инфекция |
| ОРДС | – | острый респираторный дистресс синдром |
| ОРЗ | – | острое респираторное заболевание |
| ОРИ | – | острая респираторная инфекция |
| ПВ | – | протромбиновое время |
| ПМСП | – | первичная медико-санитарная помощь |
| ПЦР | – | полимеразная цепная реакция |
| РЭН | – | рутинный эпидемиологический надзор |
| СОЭ | – | скорость оседания эритроцитов |
| ТОРИ | – | тяжелая острая респираторная инфекция |
| ХОБЛ | – | хроническая обструктивная болезнь легкого |
| ЭКГ | – | электрокардиография |
Пользователи протокола: терапевты, врачи общей практики, врачи/фельдшеры скорой медицинской помощи, инфекционисты, неврологи, пульмонологи, акушер-гинекологи, анестезиологи-реаниматологи, организаторы здравоохранения.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Таблица 1- Соотношение между степенью убедительности доказательств и видом научных исследований
| А |
Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP |
Наилучшая клиническая практика |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Клиническая классификация гриппа и других острых респираторных вирусных инфекций:
1.1. Этиология.
1.1.1. Грипп типа А.
1.1.2. Грипп типа В.
1.1.3. Грипп типа С.
1.1.4. Парагриппозная инфекция.
1.1.5. Аденовирусная инфекция.
1.1.6. Респираторно-синцитиальная инфекция.
1.1.7. Риновирусная инфекция.
1.1.8. Коронавирусная инфекция.
1.1.9 Бокавирусная инфекция
1.1.10 Метаневмовирусная инфекция
1.2. Форма клинического течения.
1.2.1. Легкая.
1.2.2. Среднетяжелая.
1.2.3. Тяжелая.
1.2.4. Крайне-тяжелая.
Осложнения
| 1.Состояния, патогенетически обусловленные действием вируса гриппа |
|
Вирусное поражение легких Состояние обусловлено распространенным воспалительным процессом в нижних отделах дыхательных путей. Клинически проявляется (на фоне течения гриппозной инфекции) дыхательной недостаточностью и возможным развитием острого респираторного дистресс-синдрома. |
|
Острый респираторный дистресс-синдром Состояние обусловлено повреждением капилляров альвеолярных перепонок, воспалительными изменениями, развитием интерстициального и альвеолярного отека, последующим развитием интерстициального фиброза. Клинически проявляется развитием токсического геморрагического отека легких, острой прогрессирующей дыхательной недостаточности. |
|
Токсический геморрагический отек легких Клинически проявляется (на фоне выраженной интоксикации) одышкой, цианозом, расстройством дыхания, появлением примеси крови в мокроте, развитием острой дыхательной недостаточности. |
|
Ложный круп Состояние обусловлено отеком голосовых связок, рефлекторным спазмом мышц гортани. Клинически проявляется внезапным появлением приступа удушья, сопровождаемым тревогой, тахикардией с последующим развитием острой дыхательной недостаточности. |
|
Острая дыхательная недостаточность Состояние обусловлено: 1. В случае развития вирусной пневмонии: сокращением дыхательной поверхности легких, обструкцией бронхиального дерева; 2. Редукцией функционирующих участков легких (ателектаз, коллапс); 3. Неполноценной функцией дыхательных мышц; 4. Нарушением в системе сурфактанта; 5. Нарушением функции дыхательного центра или блокадой афферентных звеньев регуляции дыхательных мышц; 6. Несоответствием между вентиляцией и перфузией; 7. Ларингоспазмом. Клинически проявляется одышкой, акроцианозом, потливостью, тахикардией, нарушением ритма дыхания и нервно-психического статуса. |
|
Острая циркуляторная недостаточность, инфекционно-токсический шок Состояние обусловлено нарушением регуляции периферического кровообращения, нарушением микроциркуляции в жизненно важных органах, за счет действия вирусно-бактериальных токсинов. Клинически проявляется снижением АД, тахикардией, гипотермией, гипоксией, нарушениями гемостаза, отеком головного мозга, полиорганной недостаточностью. |
|
Инфекционно-токсическая энцефалопатия Состояние обусловлено выраженными расстройствами гемо- и ликвородинамики в головном мозге и повышением внутричерепного давления. Клинически проявляется сильной головной болью, рвотой, оглушенностью, возможно психомоторное возбуждение, расстройство сознания. Опасно развитием отека головного мозга, расстройства дыхания, комы. |
|
Отек головного мозга Состояние обусловлено гипоксией мозговой ткани, гиперкапнией, метаболическим ацидозом, гипертермией. Клинически проявляется сильной диффузной головной болью, головокружением, тошнотой, рвотой, наличием менингеальных знаков, застойными явлениями в глазном дне, потерей сознания, судорогами, брадикардией и олигопноэ с развитием острой дыхательной недостаточности. |
|
Острая иммуносупрессия (острая иммуносупрессия беременных) Состояние обусловлено физиологической иммуносупрессией беременных и действием иммуносупрессивного домена в структуре белков вируса гриппа. |
| Неврологические осложнения (Менингит, энцефалит, арахноидит, энцефаломиелит, энцефаломиелополирадикулоневрит, моно- и полиневриты, синдром Гийена-Барре, радикулиты, невриты) |
| Синдром Рея |
| Осложнения со стороны сердечно-сосудистой системы (миокардит) |
| 2. Вторичные осложнения гриппа |
|
Вторичная пневмония Состояние обусловлено присоединением бактериальной или грибковой флоры. |
|
Септический шок Состояние обусловлено присоединением бактериальной или грибковой флоры. |
| Осложнения со стороны ЛОР-органов (гаймориты, отиты, фронтиты, синуситы, тубоотиты, лакунарная и фоликулярная ангина) |
| Декомпенсация сопутствующих хронических заболеваний (бронхиальная астма, ХОБЛ, хроническая сердечная недостаточность, заболевания печени и почек) |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез, в том числе эпидемиологический
Грипп, вызванный сезонными штаммами [1]:
- острое начало с развитием симптомов интоксикации в 1-е сутки, высокая лихорадка с ознобом;
- общая продолжительность лихорадочного периода 4-5 дней;
- головная боль с типичной локализацией в области лба, надбровных дуг, глазных яблок;
- слабость, адинамия;
- ноющие боли в костях, мышцах, вялость, «разбитость»;
- гиперестезия.
Грипп, вызванный пандемическим штаммом
- Чаще болеют молодые люди
- Удлинение инкубацинного периода до 7 дней
- начало заболевания с кашля
- быстро прогрессирующее течение с поражением нижних отделов дыхательных путей с развитием ранних (в первую неделю) вирусных пневмоний;
- высокий риск развития ОРДС;
- раннее развитие дыхательной недостаточности (усиление цианоза при кашле, ЧД > 30 мин-1, SaO2<90%; PaO2<60 мм.рт.ст.);
- деструктивный и некротический процессы в лёгких
- диарея;
- прогрессирующая лейкопения, тромбоцитопения, лимфопения
- Длительная вирусемия (вирус обнаруживался на 39 день болезни и более)
- Бактериальная флора присоединялись значительно позднее (формировались гиалиновые гиалиновые мембраны)
- частота тяжёлых форм гриппа у беременных и лиц с избыточной массой тела (индекс массы тела > 30 кг/м2)
Парагрипп:
- начало болезни может быть постепенным;
- интоксикация выражена слабо;
- боли и першение в горле, заложенность носа, обильное отделяемое из носа, сухой «лающий кашель», осиплость голоса;
- в случае присоединения вторичной бактериальной инфекции состояние больного ухудшается, повышается температура, нарастают явления интоксикации.
Аденовирусная инфекция:
- начало болезни острое;
- насморк и заложенность носа, затем присоединяются обильные слизистые выделения из носа;
- могут быть чувство першения или боли в горле, влажный кашель;
- явления конъюнктивита – боли в глазах, слезотечение.
Респираторно-синцитиальная инфекция:
- постепенное начало;
- субфебрильная температура;
- упорный кашель, сначала сухой, затем продуктивный, часто приступообразный;
- характерна одышка.
Риновирусная инфекция:
- умеренная интоксикация;
- начало острое;
- чихание, выделения из носа, затрудненное дыхание, чувство саднения в горле, покашливание;
- недомогание, снижение аппетита, чувство тяжести в голове.
Короновирусная инфекция:
- острое начало с ознобом, головной болью, болью в мышцах, общей слабостью, головокружением, повышением температуры тела, выделения из носа;
- боли в горле, гиперемия слизистой оболочки неба и задней стенки глотки, кашель;
- возможны тошнота, одно-двукратная рвота, боли в животе, жидкий стул;
- через 3-7 дней возможно повторное повышение температуры тела и появление упорного непродуктивного кашля, одышки, затрудненного дыхания.
Метапневмовирусная инфекция:
- острое начало;
- выраженный интоксикационный синдром;
- катаральные явления (кашель, ринорея, отек слизистой носа);
- развитие бронхита, бронхиолита, пневмонии;
- нередко диарейный синдром.
Бокавирусная инфекция:
- острое начало болезни;
- комбинация респираторного синдрома, интоксикации и диспепсии;
- характерны кашель, насморк, увеличение и гиперемия миндалин;
- продолжительность лихорадки – 4–6 дней.
Эпидемиологический анамнез:
- контакт с больными гриппом и ОРВИ (на работе, дома, в местах скопления людей);
- контакт с лихорадящими больными с катаральными проявлениями.
Физикальное обследование:
Объективные симптомы, характерные для гриппа и ОРВИ:
- повышение температуры тела;
- заложенность носа, нарушение носового дыхания, чихание, отделение слизи из носа (острый ринит);
- гиперемия слизистой ротоглотки, першение и сухость в горле, болезненность при глотании (острый фарингит);
- гиперемия и отечность миндалин, небных дужек, язычка, задней стенки глотки (острый тонзиллит);
- сухой лающий кашель, осиплость голоса (ларингит);
- саднение за грудиной, сухой кашель (трахеит);
- кашель (в начале заболевания сухой, через несколько дней влажный с увеличивающимся количеством мокроты); мокрота чаще имеет слизистый характер, на 2-й неделе может приобретать зеленоватый оттенок; кашель может сохраняться в течение 2 недель и дольше (до 1 месяца при аденовирусной и респираторно-синтициально-вирусной инфекциях).
Таблица 2- Синдромы поражения дыхательных путей в зависимости от вида вируса.
| Возбудители | Основные синдромы поражения дыхательных путей |
| Вирусы гриппа | Трахеит, ринофарингит, бронхит, вирусная пневмония (при гриппе, вызванном пандемическим штаммом), диарея (при гриппе В) |
| Вирусы парагриппа | Ларингит, ринофарингит, ложный круп |
| Респираторно-синцитиальный вирус | Бронхит, бронхиолит |
| Аденовирусы | Фарингит, тонзиллит, ринит |
| Риновирусы | Ринит, ринофарингит, бронхообструктивный синдром (при тяжелом течении) |
| Коронавирусы человека | Ринофарингит, бронхит |
| Коронавирус ТОРС | Бронхит, бронхиолит, респираторный дистресс-синдром |
| Метапневмовирус | Бронхит, бронхиолит, респираторный дистресс-синдром |
| Бокавирус | Ринит, ринофарингит |
Объективные симптомы, характерные для гриппа [1]:
- температура 38,5-39,5 0С;
- частота пульса соответствует повышению температуры;
- дыхание учащено;
- умеренно выраженные катаральные явления (насморк, сухой кашель);
- гиперемия лица и шеи, инъекция сосудов склер, повышенное потоотделение, разлитая гиперемия и зернистость слизистой оболочки зева;
При тяжелой форме:
- лихорадка, нарушение сознания, явления менингизма, одышка, тахикардия, глухость сердечных тонов, слабость пульса, артериальная гипотензия, акроцианоз и цианоз (появляющийся и/или усиливающийся при кашле);
- носовые кровотечения, геморрагическая сыпь на коже и слизистых вследствие развития ДВС-синдрома;
Признаки острой дыхательной недостаточности у больных тяжелым гриппом:
- приступообразный звонкий кашель, свистящее стридорозное дыхание, инспираторная одышка, исчезновение голоса, цианоз и акроцианоз, тахикардия, слабый пульс, ослабление тонов сердца, артериальная гипотония;
Признаки острой сосудистой недостаточности:
- снижение температуры тела, бледность кожных покровов, холодный липкий пот, адинамия с потерей сознания, цианоз и акроцианоз, тахикардия, слабый нитевидный пульс, глухость тонов сердца, артериальная гипотония, прекращение мочеотделения;
Признаки отека и набухания вещества мозга:
- психомоторное возбуждение и нарушение сознания, патологический тип дыхания, брадикардия, сменяющаяся тахикардией, гиперемия лица, рвота, не приносящая облегчения, судороги, очаговые неврологические знаки, менингеальные синдромы, лабильность артериального давления, гиперестезия, гиперкаузия;
Признаки отека легких:
- нарастание одышки и удушья, цианоз и акроцианоз, появление пенистой и кровянистой мокроты, снижение температуры тела, слабый частый пульс, множество сухих и влажных разнокалиберных хрипов в легких.
Критерии степени тяжести гриппа и ОРВИ (оцениваются по выраженности симптомов интоксикации):
- легкая степень – повышение температуры тела не более 38°С; умеренная головная боль; пульс менее 90 уд/мин; систолическое артериальное давление 115–120 мм рт. ст; частота дыхания менее 24 в 1 мин.
- средняя степень – температура тела в пределах 38,1–40°С; выраженная головная боль; гиперестезия; пульс 90–120 уд/мин; систолическое артериальное давление менее 110 мм рт.ст.; частота дыхания более 24 в 1 мин.
- тяжелая степень – острейшее начало, высокая температура (более 40°) с резко выраженными симптомами интоксикации (сильной головной болью, ломотой во всем теле, бессонницей, бредом, анорексией, тошнотой, рвотой); пульс более 120 уд/мин, слабого наполнения, нередко аритмичен; систолическое артериальное давление менее 90 мм рт.ст.; тоны сердца глухие; частота дыхания более 28 в 1 мин.
- очень тяжелая степень – молниеносное течение с бурно развивающимися симптомами интоксикации, с возможным развитием ОРДС, ДВС-синдрома.
Группа риска по осложненному течению гриппа (ВОЗ) [4]:
- беременные женщины;
- лица любого возраста с хронической болезнью легких (астмой, ХОБЛ и др.);
- лица любого возраста с хронической болезнью сердца;
- лица с нарушениями обмена веществ (диабет, ожирение);
- лица с хроническим заболеванием почек, хроническим гепатитом, неврологическими состояниями, гемоглобинопатиями и иммунодепрессией;
- лица в возрасте 65 лет и старше.
Таблица 3 — Диагностика ОДН [4]
| Степень ОДН | Диагностические признаки |
| Первая | Жалобы на ощущение недостатка воздуха, беспокойство, эйфория. Кожа влажная, бледная, с легким акроцианозом. Нарастающая одышка (25-30 дыханий в минуту), умеренное повышение АД. PaO2 снижено до 70 мм.рт.ст., PaCO2 повышено до 50 мм.рт.ст. |
| Вторая | Бред, возбуждение, галлюцинации, профузный пот, цианоз, одышка (35-40 дыханий в минуту), тахикардия, артериальная гипертензия. PaO2 снижено до 60 мм.рт.ст., PaCO2 повышено до 60 мм.рт.ст. |
| Третья | Кома с клоническими и тоническими судорогами, зрачки широкие, |
Таблица 4 — Диагностика ОРДС [5]
| Период | Диагностические критерии |
| 1. Скрытый или период действия этиологического фактора (длится около 24 часов) | Нет никаких клинических и рентгенологических проявлений. Может наблюдаться тахипноэ (число дыханий более 20 в минуту) |
| 2. Начальных изменений (1-2 сутки) | Умеренно выраженная одышка, тахикардия. При аускультации легких выслушивается жесткое везикулярное дыхание и рассеянные сухие хрипы. На рентгенограмме легких отмечается усиление сосудистого рисунка, преимущественно в периферических отделах. Газовый состав крови без отклонений от нормы. |
| 3. Выраженных клинических проявлений (3-10 сутки) | Выраженная одышка с участием в акте дыхания вспомогательной мускулатуры, выраженный диффузный цианоз. При аускультации сердца отмечается тахикардия и глухость сердечных тонов, значительно снижается артериальное давление. При перкуссии легких выявляется притупление перкуторного звука, аускультативно – жесткое дыхание. Появление влажных хрипов и крепитации указывает на появление жидкости в альвеолах (развитие альвеолярного отека легких). На рентгенограмме легких выявляется выраженный интерстициальный отек легких, а также двусторонние инфильтративные тени неправильной облаковидной формы, которые сливаются с корнем легких и друг с другом. Очень часто в краевых отделах средней и нижней долей на фоне усиленного сосудистого рисунка появляются очаговоподобные тени. При анализе газового состава крови отмечается значительное снижение парциального давления кислорода (менее 50 мм.рт.ст. несмотря на ингаляции кислорода). |
|
4. Терминальный (7-10 сутки и более) |
Осмотр: выраженная одышка и цианоз; профузная потливость. Сердечно-сосудистая система: изменения со стороны ССС характеризуются развитием синдрома острого легочного сердца, резким падением артериального давления вплоть до коллапса. При аускультации сердца — тахикардия, глухость сердечных тонов (нередко аритмии), расщепление и акцент 2 тона над легочной артерией. ЭКГ признаки – высокие шпилевые зубцы P в отведениях 2, 3, aVL, V1-2, выраженное отклонение электрической оси сердца вправо. Рентгенологические признаки повышения давления в легочной артерии, выпячивание ее конуса. Дыхательная система: изменения со стороны ДС характеризуются развитием признаков нарастающей легочной гипертензии и дыхательной недостаточности. Отмечается кашель с выделением пенистой мокроты розового цвета. При аускультации легких – большое количество влажных хрипов разного калибра, обильная крепитация. Исследование газового состава крови выявляет глубокую артериальную гипоксемию, гиперкапнию. Исследование кислотно-щелочного равновесия (КЩР) – метаболический ацидоз. Полиорганная недостаточность: характеризуется нарушением функции почек (олигоанурия, протеинурия, цилиндрурия, микрогематурия, повышение содержания в крови мочевины, креатинина), нарушением функции печени (желтушность кожных покровов и видимых слизистых, значительного повышения содержания в крови АЛТ, фруктозо-1-фосфатальдолазы, лактатдегидрогеназы), нарушением функций головного мозга (заторможенность, головная боль, головокружение, клинические признаки нарушения мозгового кровообращения и отека головного мозга) |
Таблица 5 — Дифференциальная диагностика пневмоний вирусной и бактериальной этиологии
| Критерий | Специфическое гриппозное поражение легких | Бактериальное поражение легких |
| Патогенез | Эпителио-_ангио- и пневмотропность | Развитие иммунодефицита |
| Сроки развития | Период разгара | Период разгара или реконвалесценции |
| Лихорадка | Одноволновая | Двухволновая |
| Распространенность воспаления | Распространенное | Очаговое |
| Характер воспаления | геморрагический | Гнойный |
| Клинический анализ крови | Лейкопения, лимфоцитоз, тромбоцитопения |
Лейкоцитоз, нейтрофилез Ускоренная СОЭ |
| Клеточная инфильтрация | Серозно-десквамативная | Нейтрофильная (надо уточнить) |
| Прогноз | Неблагоприятный | Относительно благоприятный |
Лабораторные исследования:
Неспецифическая лабораторная диагностика:
- общий анализ крови: нормоцитоз, лейкопения; относительный лимфоцитоз; относительный моноцитоз; в случае присоединения бактериальной суперинфекции;
- лейкоцитоз и/или «сдвиг формулы влево»[6].
- специфическая лабораторная диагностика: положительные результаты ИФА/ ПЦР.
Инструментальные исследования:
- рентгенография органов дыхания: признаки пневмонии, отека легкого.
Показания для консультаций узких специалистов:
- пульмонолога – при наличии признаков пневмонии;
- гематолога – при выраженных гематологических изменениях и геморрагическом синдроме;
- кардиолога – при присоединении симптомов миокардита, острой сердечно-сосудистой недостаточности;
- акушера-гинеколога – при развитии гриппа и ОРВИ на фоне беременности.
Диагностический алгоритм:
Рисунок 1- ДИАГНОСТИКА ОРВИ
Рисунок 2- Клинический алгоритм дифференциальной диагностики ОРВИ и гриппа
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
Таблица -6 Критерии дифференциальной диагностики гриппа
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Конго-Крымская геморрагическая лихорадка |
Острое начало, лихорадка, миалгии, артралгии, диарея геморрагический синдром |
Обнаружение -специфических антител в РСК, ИФА; — РНК вируса (кровь) в ПЦР |
В геморрагический период: выраженная интоксикация при отсутствии катаральных явлений, кровотечения, полиморфная геморрагическая сыпь |
| Менингококковая инфекция. Менингококковый назофарингит |
Острое начало, лихорадка.
|
Мазок из носа — бактериологически обнаружение менингококка, ОАК – лейкоцитоз. |
Умеренная интоксикация, Заложенность носа |
| Серозные менингиты | Острое начало, выраженная интоксикация, положительные менингиальные симптомы |
В смж –лимфоцитарный плеоцитоз |
Интоксикация, Развитие истинного серозного менингита с лимфоцитарным плеоцитозом |
Таблица 7- Критерии дифференциальной диагностики острых респираторных вирусных инфекционных заболеваний [1]
| Признаки | Грипп | Короновирусная инфекция | Парагрипп | Респираторно-синцитиальная инфекция | Аденовирусная инфекция | Риновирусная инфекция |
| Возбудитель | Вирусы гриппа: 3 серотипа (А, В, С) | Коронавирус новой группы | Вирусы парагриппа: 5 серотипов (1-5) | Респираторно-синтициальный вирус: 1 серотип | Аденовирусы: 49 серотипов (1-49) | Риновирусы: 114 серотипов (1-114) |
| Инкубационный период | От нескольких часов до 1,5 сут | 2-7 сут, иногда до 10 сут | 2-7 сут, чаще 3-4 сут | 3-6 сут | 4-14 сут | 23 сут |
| Начало | Острое | Острое | Постепенное | Постепенное | Постепенное | Острое |
| Течение | Острое | Острое | Подострое | Подострое, иногда затяжное | Затяжное, волнообразное | Острое |
| Ведущий клинический синдром | Интоксикация | Дыхательная недостаточность | Катаральный | Катаральный, дыхательная недостаточность | Катаральный | Катаральный |
| Выраженность интоксикации | Сильная | Сильно выраженная | Слабая или умеренная | Умеренная или слабая | Умеренная | Слабая |
| Длительность интоксикации | 2-5 сут | 5-10 сут | 1-3 сут | 2-7 сут | 8-10 сут | 1-2 сут |
| Температура тела | Чаще 390С и выше, но может быть субфебрильная | 380С и выше | 37-380С, может длительно сохраняться | Субфебрильная, иногда нормальная | Фебрильная или субфебрильная | Нормальная или субфебрильная |
| Катаральные проявления | Умеренно выражены, присоединяются позднее | Умеренно выражены, экссудация слабая | Выражены с первого дня течения заболевания. Осиплость голоса | Выражены, постепенно нарастают | Сильно выражены с первого дня течения заболевания | Выражены с первого дня течения заболевания. |
| Ринит | Затруднение носового дыхания, заложенность носа. Серозные, слизистые или сукровичные выделения в 50% случаев | Возможен в начале заболевания | Затруднение носового дыхания, заложенность носа | Заложенность носа, необильноесерозное отделяемое | Обильное слизисто-серозное отделяемое, резкое затруднение носового дыхания | Обильное серозное отделяемое, носовое дыхание затруднено или отсутствует |
| Кашель | Сухой, мучительный, надсадный, с болями за грудиной, на 3 сут. влажный, до 7-10 сут. течения заболевания | Сухой, умеренно выраженный | Сухой, лающий может сохранятся длительное время (иногда до 12-21 сут) | Сухой приступообразный (до 3 нед.), сопровождающийся болями за грудиной | Влажный | Сухой, першение в глотке |
| Изменения слизистых оболочек | Слизистая оболочка глотки и миндалин синюшная, умеренно гиперемирована; инъекция сосудов. | Слабая или умеренная гиперемия слизистых оболочек | Слабая или умеренная гиперемия зева, мягкого неба, задней стенки глотки | Слабая гиперемия слизистых оболочек | Умеренная гиперемия, отечность, гиперплазия фолликул миндалин и задней стенки глотки | Слабая гиперемия слизистых оболочек |
| Физикальные признаки поражения легких | Отсутствуют, при наличии бронхита – сухие рассеянные хрипы | С 3-5-х сут течения заболевания часто выявляют признаки интерстициальной пневмонии | Отсутствуют | Рассеянные сухие и редко влажные среднепузырчатые хрипы, признаки пневмонии | Отсутствуют. При наличии бронхита – сухие, рассеянные хрипы. | Отсутствуют |
| Ведущий синдром респираторных поражений | Трахеит | Бронхит, острый респираторный дистресс синдром | Ларингит, ложный круп выявляют крайне редко | Бронхит, бронхиолит, возможен бронхоспазм | Ринофарингоконъюнктивит или тонзиллит | Ринит |
| Увеличение лимфатических узлов | Отсутствует | Отсутствует | Заднешейные, реже – подмышечные лимфатические лимфоузлы увеличены и умеренно болезненные | Отсутствует | Может быть полиаденит | Отсутствует |
| Увеличение печени и селезенки | Отсутствует | Выявляют | Отсутствует | Симптомы токсического гепатита | Выражено | Отсутствует |
| Поражение глаз | Инъекция сосудов склер | Редко | Отсутствует | Отсутствует | Конъюнктивит, кератоконъюнктивит | Инъекция сосудов склер, век, слезотечение, конъюнктивит |
| Поражение других органов | Отсутствует | Часто в начале заболевания развивается диарея | Отсутствует | Отсутствует | Может быть экзантема, иногда диарея | Отсутствует |
Лечение
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Немедикаментозное лечение:
- режим постельный на период лихорадки с последующим расширением по мере купирования симптомов интоксикации;
- диета — легкоусвояемая пища и обильное питье из расчета 20-40 мл/кг массы тела в сутки в виде чая, фруктовых и овощных соков, морсов, питьевой воды.
Медикаментозное лечение:
Перечень основных лекарственных средств (имеющих 100% вероятность применения) следует назначить в первые 36- 48 часов от начала заболевания один из нижеперечисленных представленных в таблице 8 (только для беременных).
Таблица 8- Перечень основных лекарственных средств для лечения гриппа
| Лекарственная группа | Лекарственные средства | Способ применения |
Уровень доказатель ности |
|
Лекарственный препарат для лечения гриппа Беременным – при невозможности госпитализации |
Осельтамивир* |
75 мг х 2 раза в сутки в течение 5 дней. |
А |
Перечень дополнительных лекарственных средств (менее 100% вероятность применения) представлен в таблице 9.
——————————————————
——————————————————
* ИНФОРМАЦИЯ ПАРТНЕРОВ «МЕДЭЛЕМЕНТ»
Для лечения гриппа и ОРВИ врачи часто назначают Нобазит. В дозировке 500 мг (Нобазит® Форте) прием препарата в 4 раза снижает риск развития осложнений, требующих назначения антибиотиков.
Нобазит действует комплексно: не позволяет вирусам проникать сквозь мембраны клеток и снимает симптомы вирусной интоксикации. Наибольшая противовирусная эффективность препарата проявляется при приеме в первые 48 часов с начала заболевания, поскольку в этот период времени вирусы размножаются сильнее всего. При более позднем начале лечения Нобазит проявляет противовоспалительное, анальгезирующее и жаропонижающее действия, что способствует сокращению длительности заболевания.
Препарат рекомендован взрослым и детям старше 12 лет для лечения гриппа и других ОРВИ. Курс лечения — 5-7 дней.
** Нобазит РУ: ЛП-003508 / РУ: ЛП-006416
*** Размещено ООО «МедЭлемент-Р»
——————————————————
——————————————————
Таблица 9- Перечень дополнительных лекарственных средств
| Лекарственная группа | Лекарственные средства | Способ применения |
Уровень доказатель ности |
| НПВС. Анальгетики-антипиретики другие. Анилиды (при отсутствии поражения печени) | парацетамол, таблетки 500 мг; | Перорально, не более 2.0 г в сут. | В |
Хирургическое вмешательство: нет
Дальнейшее ведение: нет
Индикаторы эффективности лечения:
- купирование симптомов интоксикации;
- купирование катарального синдрома.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента – карта стационарного больного
Схема 1 — Маршрутизация пациента
Примечание:
Факторы риска [6]:
Для гриппа: переохлаждение, курение, контакт с больными гриппом (на работе, дома), эпидемия гриппа и других вирусов, осенне-зимняя сезонность, неблагоприятные жилищные условия (скученность, антисанитария и т.д.), воздействие неблагоприятных метеофакторов, хронические интеркуррентные заболевания сердца, сахарный диабет и др.
Для ОРЗ: наличие очагов хронической инфекции (тонзиллит, ринофарингит, бронхит); простудные факторы (переохлаждение и др.)
Немедикаментозное лечение:
Режим: постельный на период лихорадки с последующим расширением по мере купирования симптомов интоксикации;
Диета: легкоусвояемая пища и обильное питье из расчета 20-40 мл/кг массы тела в сутки в виде чая, фруктовых и овощных соков, морсов, питьевой воды.
Медикаментозное лечение:
Перечень основных лекарственных средств (имеющих 100% вероятность применения) представлен в таблице 7. назначить в первые 36 — 48 часов от начала заболевания один из нижеперечисленных:
Таблица -7 – Перечень основных лекарственных средств
| Лекарственная группа | Лекарственные средства | Способ применения |
Уровень доказатель ности |
| Лекарственное средств, обладающее прямой противовирусной активностью против вируса гриппа (при отсутствии бронхообструктивного синдрома в анамнезе) | Занамивир 5 мг | ингаляионно | А |
| Лекарственное средств, обладающее прямой противовирусной активностью против вируса гриппа | Осельтамивир* 75 мг |
перорально |
А |
Осельтамивир* 75 мг х 2 раза в сутки в течение 5 дней (лицам с повышенным риском осложнений и беременным); при тяжелых формах по 150 мг х 2 раза в сутки в течение 10 дней;
Перечень дополнительных лекарственных средств (менее 100% вероятность применения) представлен в Таблице 8.
Таблица -8 – Перечень дополнительных лекарственных средств
| Лекарственная группа | Лекарственные средства | Способ применения |
Уровень доказатель ности |
| НПВС. Анальгетики-антипиретики другие. Анилиды. | парацетамол, таблетки 500 мг; | перорально | В |
Патогенетическое и симптоматическое лечение – по показаниям:
1. Дезинтоксикационная терапия:
- при средних степенях тяжести процесса больным назначается обильное питье из расчета 40 мл/кг массы тела в сутки в виде чая, фруктовых и овощных соков, морсов, питьевой воды;
Респираторная поддержка: кислород ингалируют через маску или же носовой катетер со скоростью 5-7 литров в минуту, при необходимости увеличивая до 10 литров в минуту. Перед назначением ингаляции определяют SpO2 и в последующем через 10-15 минут повторно производят измерение. Положительный терапевтический эффект проявляется в повышении SpO2 на 2 и более процентов (PaO2 более 60 мм.рт.ст., SpO2 выше 92%)[2] .
2. Неинвазивная вентиляция легких
Показания:
- тахипноэ (более 25 движений в минуту) — не исчезает после снижения температуры тела;
- PaO2 < 60 мм.рт.ст. либо PaO2/FiO2 < 300;
- PaCO2 > 45 мм.рт.ст.;
- pH< 7,35; — Vt< 4 мл/кг (дыхательный объем (мл) / масса тела (кг) больного); — SpO2 < 92%.
Абсолютные противопоказания:
- отсутствие полной кооперации с больным (выраженная энцефалопатия, отсутствие сознания);
- аномалии и деформации лицевого скелета, препятствующие наложению маски.
Описание метода: неинвазивная масочная вентиляция легких, как правило, проводится в триггерных вспомогательных режимах, большинство из которых реализовано на многих современных аппаратах ИВЛ: Biphasic Positive Airway Pressure (BiPAP), Pressure Support Ventilation (PSV), Proportional Assist Ventilation (PAV), Continuous Positive Airway Pressure (CPAP). Рекомендуется сочетание неинвазивной вентиляции легких с назначением лекарственных средств через небулайзер. К таким лекарственным средствам можно отнести теплый физиологический раствор.
3. Искусственная вентиляция легких
Показания:
- неэффективность проведения неинвазивной вентиляции легких;
- невозможность проведения неинвазивной вентиляции легких (остановка дыхания, нарушение сознания, психики больного);
- нарастающая одышка, тахипноэ (более 35 движений в минуту) — не исчезает после снижения температуры тела;
- PaO2 < 60 мм.рт.ст. либо PaO2/FiO2 < 200;
- PaCO2 > 60 мм.рт.ст.;
- pH< 7,25;
- Vt< 4 мл/кг (дыхательный объем (мл) / масса тела (кг) больного);
- SpO2 < 92%.
Рекомендуемые особенности проведения ИВЛ:
- положение больного – с приподнятым головным концом кровати на 30;
- удлинение фазы вдоха (Ti:e 1:1 – 1,5:1);
- инспираторная пауза («плато») не меньше 15% от длительности вдоха;
- P пиковое < 35 см.вод.ст.;
- P плато < 30 см.вод.ст.;
- уровень ПДКВ регулируется по величине SpO2 (минимально достаточно – 93%) и параметрам гемодинамики. Алгоритм: 5-8-10 см.вод.ст.;
- возможно применение периодического раздувания легких (Sigh);
- если, несмотря на проводимые мероприятия, SpO2 ниже 93%, необходимо применение увеличенного FiO2 (до 0,6);
- если гипоксемия не поддается устранениию традиционными и специальными методами ИВЛ, целесообразно использование пронального положения (прон-позиции) (до 12 ч/сут);
- необходимая минутная вентиляция поддерживается увеличением частоты дыхания при установлении минимального дыхательного объема, исключающего гипоксию (6 мл/кг идеальной массы тела).
Рекомендуемые значения анализируемых параметров:
- PaO2 (> 60 мм.рт.ст.);
- PaCO2 (35-45 мм.рт.ст.);
- SpO2 (> 93%);
- pH (> 7,25);
- PvO2 (> 30 мм.рт.ст.).
Безусловные критерии возможности прекращения респираторной поддержки:
- четкая положительная динамика по основному заболеванию;
- спонтанная дыхательная активность;
- достаточный мышечный тонус.
Дополнительные критерии возможности прекращения респираторной поддержки:
- отсутствие или значительный регресс воспалительных изменений в легких;
- отсутствие признаков SIRS (синдром системного воспалительного ответа);
- стабильная гемодинамика, ЧСС < 120;
- адекватный диурез;
- компенсированные сдвиги гемостаза;
- при FiO2 не более 0,3 в течение суток SpO2 по пульсоксиметру не ниже 90%, PaO2 не ниже 80 мм.рт.ст. (PaO2/FiO2 не менее 250); — Восстановление кашлевого рефлекса и кашлевого толчка.
4. Симптоматическое лечение: при повышении температуры выше 38,5С — жаропонижающие препараты (НПВП), при катаральных явлениях — сосудосуживающие назальные капли и спреи, противокашлевые и отхаркивающие средства.
5. При развитии бактериальных осложнений назначается антибактериальная терапия с включением пенициллинов, макролидов, цефалоспоринов II-IV поколения, карбапенемов и фторхинолонов, при идентификации возбудителя MRS антибактериальным препаратом выбора является ванкомицин [6].
Особые указания по противовирусной терапии у беременных [6,9]
1. При подозрении на грипп и/или ТОРИ лечение должно быть начато как можно раньше: в течение 36 часов от начала заболевания.
2. При лечении не следует ожидать лабораторного подтверждения гриппа.
3. Осельтамивир – препарат выбора из группы ингибиторов нейраминидазы — 75 мг (1 капсула) 2 раза в день в течение 5 дней, при тяжелых/осложненных формах гриппа, доза может быть увеличена до 150 мг х 2 раза в день.
4. Лечение противовирусными препаратами беременных с тяжелым или прогрессирующим течением заболевания при позднем их обращении необходимо проводить и в более поздние сроки.
5. При развитии бактериальных осложнений применение антибактериальных препаратов у беременных возможно лишь в тех случаях, когда ожидаемый эффект терапии превышает потенциальный риск для плода. У госпитализированных пациенток выбор пути введения определяется тяжестью состояния и особенностями препарата: при среднетяжелых инфекциях возможно пероральное назначение антибиотика, при тяжелом течении заболевания пациенты должны получать антибактериальный препарат парентерально.
Хирургическое вмешательство: нет.
Дальнейшее ведение: нет.
Индикаторы эффективности лечения:
- купирование признаков интоксикации и катарального синдрома;
- купирование симптомов осложнений (при их наличии).
Профилактические мероприятия:
- сезонная вакцинация против вируса гриппа.
- противоэпидемические мероприятия в соответствие с действующими санитарными нормами РК.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: нет
Показания для экстренной госпитализации:
- больные ТОРИ, с тяжелыми и осложненными формами гриппа и ОРВИ;
- пациенты с тяжелой сопутствующей патологией, независимо от формы тяжести гриппа и ОРВИ;
- лица старше 65 лет со среднетяжелым и тяжелым течением гриппа и ОРВИ;
- беременные женщины со среднетяжелым и тяжелым течением гриппа и ОРВИ, с ТОРИ: сроком до 30 недель госпитализируются в инфекционный стационар, более 30 недель – в роддом/перинатальный центр, а при наличии внебольничной пневмонии бактериальной этиологии – в пульмонологическое отделение (определяющим для профиля госпитализации является течение беременности, оцененное акушером-гинекологом).
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2019
- 1) Грипп у взрослых: диагностика, лечение, способы и методы неспецифической профилактики. -под редакцией: Васина А.В, Сологуб Т.В., Санкт-Петербург 2016 — 83С. 2) Об утверждении Санитарных правил «Санитарно – эпидемиологические требования к организации и проведению санитарно – противоэпидемических, санитарно – профилактических мероприятий по предупреждению инфекционных заболеваний» Приказ и.о. Министра здравоохранения Республики Казахстан от 27 марта 2018 года № 126. Зарегистрирован в Министерстве юстиции Республики Казахстан 23 апреля 2018 года № 16793. 3) Руководство Европейского регионального бюро ВОЗ по дозорному эпиднадзору за гриппом среди людей. 2011. 4) Clinical management of human infection with pandemic (H1N1) 2009: revised guidance.Geneva, World Health Organization. Клинические рекомендации. 5) «Грипп у беременных». Москва, 2015г. 6) КП «Пневмония у взрослых (внебольничная пневмония)» Одобрен Объединенной комиссией по качеству медицинских услуг Министерства здравоохранения Республики Казахстан от «5» октября 2017 года, протокол №29. Электронные ресурсы: 7) https://www.acog.org/Clinical-Guidance-and-Publications/Committee-Opinions/Immunization-Infectious-Disease-and-Public-Health-Preparedness-Expert-Work-Group/Assessment-and-Treatment-of-Pregnant-Women-With-Suspected-or-Confirmed-Influenza;
http://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) 9) Influenza Antiviral Medications: Summary for Clinicians https://www.cdc.gov/flu/pdf/professionals/antivirals/antiviral-summary-clinician.pdf; 10) https://www.cdc.gov/mmwr/preview/mmwrhtml/rr6001a1.htm.
- 1) Грипп у взрослых: диагностика, лечение, способы и методы неспецифической профилактики. -под редакцией: Васина А.В, Сологуб Т.В., Санкт-Петербург 2016 — 83С. 2) Об утверждении Санитарных правил «Санитарно – эпидемиологические требования к организации и проведению санитарно – противоэпидемических, санитарно – профилактических мероприятий по предупреждению инфекционных заболеваний» Приказ и.о. Министра здравоохранения Республики Казахстан от 27 марта 2018 года № 126. Зарегистрирован в Министерстве юстиции Республики Казахстан 23 апреля 2018 года № 16793. 3) Руководство Европейского регионального бюро ВОЗ по дозорному эпиднадзору за гриппом среди людей. 2011. 4) Clinical management of human infection with pandemic (H1N1) 2009: revised guidance.Geneva, World Health Organization. Клинические рекомендации. 5) «Грипп у беременных». Москва, 2015г. 6) КП «Пневмония у взрослых (внебольничная пневмония)» Одобрен Объединенной комиссией по качеству медицинских услуг Министерства здравоохранения Республики Казахстан от «5» октября 2017 года, протокол №29. Электронные ресурсы: 7) https://www.acog.org/Clinical-Guidance-and-Publications/Committee-Opinions/Immunization-Infectious-Disease-and-Public-Health-Preparedness-Expert-Work-Group/Assessment-and-Treatment-of-Pregnant-Women-With-Suspected-or-Confirmed-Influenza;
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
- Кошерова Бахыт Нургалиевна – доктор медицинских наук, профессор, проректор по клинической работе и непрерывному профессиональному развитию НАО «Медицинский университет Караганды», высшая квалификационная категория.
- Абуова Гульжан Наркеновна – кандидат медицинских наук, заведующая кафедрой инфекционных болезней и дерматовенерологии АО «Южно-Казахстанская медицинская академия», профессор.
- Дуйсенова Амангуль Куандыковна — доктор медицинских наук, заведующая кафедрой инфекционных болезней с курсом дерматовенерологии, АО «Национальный медицинский университет», профессор, высшая квалификационная категория;
- Ким Антонина Аркадьевна –кандидат медицинских наук, профессор кафедры эпидемиологии и инфекционных болезней НАО «Медицинский университет Караганды»
Указание на отсутствие конфликтов интересов: нет.
Рецензенты:
- Баешева Динагуль Аяпбековна – заведующая кафедрой детских инфекционных болезней АО «Медицинский университет Астана», председатель РОО «Общество врачей инфекционистов»;
- Кулжанова Шолпан Адлгазыевна – доктор медицинских наук, профессор, заведующая кафедрой инфекционных болезней АО «Медицинский университет Астана».
Указание условий пересмотра протокола: пересмотр протокола через 5 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.

































 http://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) 9) Influenza Antiviral Medications: Summary for Clinicians https://www.cdc.gov/flu/pdf/professionals/antivirals/antiviral-summary-clinician.pdf; 10) https://www.cdc.gov/mmwr/preview/mmwrhtml/rr6001a1.htm.
http://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) 9) Influenza Antiviral Medications: Summary for Clinicians https://www.cdc.gov/flu/pdf/professionals/antivirals/antiviral-summary-clinician.pdf; 10) https://www.cdc.gov/mmwr/preview/mmwrhtml/rr6001a1.htm.