Формула воздуха
ОПРЕДЕЛЕНИЕ
Воздух — это естественная смесь газов (главным образом азота и кислорода), которая образует атмосферу земли.
Газовый состав воздуха
От уровня моря до высоты около 11 000 м (слой тропосферы) газовый состав воздуха остается практически неизменным и выглядит следующим образом:
(
begin{array}{|c|c|c|c|}
hline
Вещество& Формула&Объемная,доля&Массовая,доля\ hline
Азот&mathrm{N}_{2}&78,08&75,5\ hline
Кислород&mathrm{O}_{2}&20,95&23,1\ hline
Аргон&text { Ar }&0,93&1,29\ hline
Углекислый, газ&mathrm{CO}_{2}&0,034&0,046\ hline
Неон&text { Ne }&0,0018&0,0014\ hline
Гелий&text { He }&0,000524&0,000073\ hline
Метан&mathrm{CH}_{4}&0,0002&0,000084\ hline
Криптон&mathrm{Kr}&0,0001&0,003\ hline
Водород&mathrm{H}_{2}&0,00005&0,00008\ hline
Ксенон&text { Xe }&0,000008&0,00004\ hline
end{array}
)
Средняя молярная масса воздуха: 29,16 г / моль
Воздух в тропосфере почти всегда содержит несколько водяных паров. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно варьироваться в зависимости от географического положения, времени года, времени суток. В крупных городах, как правило, высокий уровень углекислого газа. В горах наблюдается более низкое содержание кислорода из-за того, что кислород тяжелее азота, поэтому его плотность уменьшается с высотой быстрее.
В нижних слоях атмосферы могут быть приостановлены определенные количества мелких частиц пыли и золы, которые образуются в процессе сжигания различных видов топлива или в результате вулканических извержений. Присутствие этих мелких частиц в воздухе связано с цветом восходов и закатов из-за рассеяния солнечного света на них.
Примеры решения задач по «воздушной формуле»
ПРИМЕР 1
Плотность некоторого газа в воздухе равна 2. Какова масса этого газа с объемом 5,6 литра (ну)?
Раствор Молекулярная масса воздуха составляет 29 г / моль.
Рассчитайте молекулярную массу этого газа:
(
M(газ) = M(воздух)cdot D(газ) =29 cdot 2=58 г/моль
)
Согласно результату закона Авогадро молярный объем газа в нормальных условиях составляет 22,4 л.
Составьте пропорцию и рассчитайте массу 5,6 литров газа:
58 г газа занимает 22,4 литра
xg-газ занимает 5,6 литров
Отсюда
(
x=58 cdot 5,6 / 22,4=14,5g
)
Масса 5,6 литров газа будет равна 14,5 г.
ПРИМЕР 2
Во время сгорания 5.36 г определенного гомолога бензола потреблялось 56,7 литра воздуха (NU). Определите формулу исходного соединения.
Напишите уравнение для реакции горения:
(
C_{n} H_{2 n-6}+left(frac{3 n-3}{2}right) O_{2}=n C O_{2}+(n-3) H_{2} O
)
Содержание кислорода в воздухе составляет 21%. Рассчитайте объем потребляемого в процессе сгорания кислорода:
(
Vleft(O_{2}right)=V(воздух) cdotomegaleft(O_{2}right) / 100=56,7 cdot 21 / 100=11,9л
)
Количество кислородного вещества будет равно:
(
nleft(O_{2}right)=Vleft(O_{2}right) / V_{M}=11,9 / 22,4=0,531моль
)
Согласно уравнению реакции
(
1моль mathrm{CnH} 2 mathrm{n}-6-(3 mathrm{n}-3) / 2 моль O2
)
(
x моль mathrm{CnH} 2 mathrm{n}-6-0.531 моль O2
)
Следовательно, количество вещества бензольного гомолога, входящего в реакцию, будет равно:
(
x=nleft(C_{n} H_{2 pi-6}right)=frac{2 cdot 0,531}{3 n-3}
)
Молярная масса (
mathrm{CnH} 2 mathrm{n}-6
) равна:
(
Mleft(C_{n} H_{2 n-6}right)=12 n+2 n-6=14 n-6
)
(
nleft(C_{n} H_{2 n-6}right)=frac{mleft(C_{n} H_{2 n-6}right)}{Mleft(C_{n} H_{2 n-6}right)}=frac{5,36}{14 n-6}=frac{2 cdot 0,531}{3 n-3}
)
(
1,062(14 n-6)=5,36(3 n-3)
)
(
1,212 n=9,708
)
(
n=8
)
Следовательно, формула вещества (
mathrm{C} 8 mathrm{H} 10
)
составная формула — (
mathrm{C} 8 mathrm{H} 10
)
Содержание:
- Воздух
- Средства защиты атмосферы
- Горение
- Медленное окисление
- Условия возникновения и прекращения горения
- Образование основных и кислотных оксидов
Химический состав. Воздух состоит из смеси примерно двадцати семи различных газов. Примерно на 99% — это смесь кислорода и азота. В составе оставшегося процента: водяной пар, углекислый газ, метан, водород, озон, инертные газы (аргон, ксенон, неон, гелий, криптон) и другие.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Воздух
Молекулярная и химическая формула воздуха, в основном азот N₂ и кислород О₂. Воздух – естественная смесь газов, образующая атмосферу Земли.
В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов: азота и кислорода, содержание азота составляет 4/5 и 1/5 кислорода (по объему).
Качественный состав воздуха можно доказать посредством следующего опыта. Заполненный воздухом колокол опускают в воду. В железную ложечку помешают кусочек фосфора, его зажигают и вносят под колокол. При этом вода в колоколе поднимается на 1/5, так как при горении фосфора расходуется только кислород. Газ, оставшийся под колоколом — азот, он в реакцию не вступает (рис. 16).
Рис. 16. Сжигание фосфора пои колоколом: а — горение фосфора; б — уровень волы поднялся на 1/5 объема
В конце XIX в. было установлено, что в состав воздуха, кроме кислорода и азота, входят пять газообразных веществ: аргон (Аr), ксенон (Хе), криптон (Кг), гелий (Не), неон (Ne). Эти газы называются благородными из-за их химической неактивности.
Кроме того, в воздухе содержатся оксид углерода (IV) и водяные пары. Примерный состав воздуха показан в табл. 6.
Антуан Лоран Лавуазье (1743—1794)
Французский ученый в 1774 г. установил состав воздуха, ввел понятия «химический элемент» и «химическое соединение». Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии».
Содержание углекислого газа (СО2) и водяных паров изменяется в зависимости от условий. Например, при сырой и теплой погоде в воздухе содержится больше водяных паров, а при сухой и прохладной — меньше. Процессы горения увеличивают долю оксида углерода (IV) и уменьшают содержание кислорода.
Таблица 6
Состав воздуха
| Составные части | Содержание газов (в %) | |
| по объему | по массе | |
| Азот | 78,08 | 75,50 |
| Кислород | 20,95 | 23,10 |
| Благородные газы (в основном аргон) | 0,94 | 1,30 |
| Оксид углерода (IV) | 0,03 | 0,046 |
В результате природных явлений и деятельности человека (при землетрясении, вулканических извержениях, при сгорании топлива и выбросах из заводских труб) в атмосферу поступают такие газы, как оксиды азота — NO и NO2, оксиды серы — SO2 и SO3, сероводород — H2S.
В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в мегаполисах. В среднем при пробеге 15 тыс. км в год каждый автомобиль сжигает 2 т топлива и около 26—30 т воздуха, в том числе 4,5 т кислорода, что в 50 раз больше потребностей человека.
Атмосферный воздух является одним из основных жизненно важных элементов окружающей среды.
Средства защиты атмосферы
Средства защиты атмосферы должны ограничивать наличие вредных веществ в воздухе на уровне не выше ПДК (предельно допустимой концентрации).
Для очистки газов от частиц широко применяют сухие пылеуловители — циклоны различных типов.
Один из наиболее совершенных видов очистки газов от взвешенных в них частиц пыли и тумана — электрическая очистка (электрофильтр).
Для высокоэффективной очистки выбросов применяют аппараты многоступенчатой очистки.
В крупных городах для снижения вредного влияния загрязнения воздуха на человека применяют специальные градостроительные мероприятия. Построены и строятся автомагистрали в обход городов, принявшие весь поток транзитного транспорта, который раньше нескончаемой лентой тянулся по городским улицам.
Предприятия или их отдельные здания и сооружения, технологические процессы которых являются источником выделения в атмосферный воздух неприятно пахнущих веществ, отделяют от жилой застройки санитарно-защитными зонами.
Для повышения эффективности санитарно-защитных зон на их территории высаживают древесно-кустарниковую и травянистую растительность, снижающую концентрацию промышленной пыли и газов.
Знаешь ли ты?
Атмосфера земного шара весит 5 300 000 000 000 000 т. Если бы, например, потребовалось перевезти из Астаны в Алматы груз, равный весу земной атмосферы, и если бы каждый поезд имел 100 вагонов и проходил весь путь за 10 ч, на перевозку этого груза было бы потрачено почти 4 млрд. лет.
Самое важное
В воздухе содержится (по объему) 78% азота, 21% кислорода, 1% инертных и других газов. Кроме вышеприведенных простых веществ, в составе воздуха находятся углекислым газ и водяные пары, содержание которых может изменяться в зависимости от условии.
Горение
В повседневной жизни мы часто наблюдаем, как горит такое топливо, как природный газ. дрова, уголь. Знаете ли вы, что горение происходит с участием кислорода, входящего в состав воздуха? Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называются реакциями горения. При горении атомы простых веществ соединяются с атомами кислорода и образуются оксиды. Общая схема взаимодействия простых веществ с кислородом такова:
простое вещество + кислород = оксид
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Реакции взаимодействия веществ с кислородом называются окислением , а их продукты — оксидами.
Оксиды — это сложные вещества, которые состоят из двух элементов, один из которых кислород. При горении веществ в воздухе образуются те же продукты, т. е. оксиды. Однако горение веществ в воздухе происходит медленнее, чем в кислороде, так как последнего в воздухе содержится примерно в пять раз меньше.
Если опустить в сосуд с кислородом О2, тлеющий уголек (рис. 17а), то он раскаляется добела и сгорает, образуя оксид углерода (IV) СО2 (углекислый газ):
углерод — кислород = оксид углерода (IV)
Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
В железную ложечку поместим кусочек серы и подожжем над пламенем спиртовки, затем внесем в сосуд с кислородом. Сера S горит в кислороде О2 ярким синим пламенем (рис. 17 б) с образованием газа с резким запахом оксида серы (IV) (опыт проводится под тягой):
сера + кислород = оксид серы (IV)
Фосфор Р сгорает в кислороде О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V) (рис. 17 в):
фосфор + кислород = оксид фосфора (V)
В кислороде горят и такие вещества (рис. 17 г), которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. Реакцию горения железа в кислороде можно выразить следующим уравнением:
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, хотя эти реакции не всегда сопровождаются горением. Если сильно нагреть медь в кислороде, она, не сгорая, превратится в черный порошок — оксид меди (II):
| медь — кислород | оксид меди (II) |
Рис. 17. Горение в кислороде: а — угля; б — серы; в — фосфора; г — железа
Вам уже известно, что при горении простых веществ образуются оксиды, теперь выясним, как происходит горение сложных веществ. При горении парафиновой свечи в химическом стакане на его стенках появляются капельки воды. Если в стакан налить известковую воду, то она мутнеет, что доказывает наличие оксида углерода. Таким образом, при горении сложного вещества образовались оксиды тех элементов, которые входят в состав сложного вещества. Парафин состоит из двух элементов — углерода и водорода.
Медленное окисление
Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением.
Это явление наблюдается довольно часто. Например, в процессе гниения (окисления) навоза выделяется теплота, которая может использоваться в парниках.
♦ Вещества, при горении которых выделяется большое количество теплоты, называют топливом. На практике используют топливо трех видов: твердое, жидкое и газообразное.
К твердому топливу относятся антрацит, каменный уголь, бурый уголь, торф и дрова; к жидкому — продукты переработки нефти: бензин, керосин, мазут и др.; к газообразному — природный и попутный нефтяной газы, а также другие промышленные газы.
Условия возникновения и прекращения горения
Огонь возникает, когда есть три составляющие (схема 5). Первая — это топливо, которым может служить дерево, бумага, спирт, газ и т. д Второе, что необходимо, — это кислород, который взаимодействует с топливом, результатом чего является горение. Третья необходимая составляющая — это тепло. Только нагретое до определенной температуры топливо будет гореть в воздухе. Для того чтобы погасить огонь, необходимо или перекрыть доступ кислорода, или максимально понизить температуру, или устранить источник возгорания (то, что горит).
При тушении огня на пламя направляют углекислый газ или пену, которые затрудняют доступ воздуха к горючему веществу. Небольшие очаги пожара можно потушить, накрыв их сверху брезентом или одеялом. Можно также использовать песок. Для тушения угля или горящей древесины используют воду. Она охлаждает их, а образующиеся водяные пары затрудняют доступ воздуха.
Схема 5
Самое важное
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Горение веществ в воздухе происходит медленнее, чем в кислороде. При горении простых и сложных веществ образуются оксиды. Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
оксид кальция + вода 
Таким образом, оксидам металлов соответствуют основания. Растворимые основания называются щелочами .
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота. Это подтверждает изменение окраски лакмуса на красную. Как видим, оксидам неметаллов соответствует кислота. Таким образом, оксиды неметаллов являются кислотными оксидами. Схема реакции:
оксид фосфора (V) + вода 
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Компоненты воздуха в процентах
Итак, основной состав атмосферного воздуха представлен двумя веществами: кислородом (O2) и азотом (N2), с преобладающей долей азота около 78%. На кислород приходится около 21%. Все остальные компоненты содержатся в малых количествах – это инертные газы — аргон (Ar), ксенон (Xe, 8.7*10-6), гелий (He, 4,6*10-4), метан (СН4, 1,7*10-4), водород (Н2, 5*10 -5) и т.д. Представленное процентное соотношение азота и кислорода – оптимально для нормальной деятельности живых организмов. Интересен тот факт, что в составе воздуха присутствует, хотя и в малых количествах, (около 0,03%), углекислый газ CO2. Это химическое соединение, содержащееся в выдыхаемом человеком и живыми организмами воздухе, но необходимое для процесса фотосинтеза в растениях. Азот – один из важных компонентов, входящих в состав аминокислот, белковых молекул. Кислород – основа биохимических процессов и синтезов в природе и организме, входит в состав воды (Рис. 1.).
Смесь воздуха в разных климатических условиях
Следует отметить, что состав воздуха не везде одинаков. Например:
- Высоко в горах, разряженный воздух, с пониженным содержанием кислорода. Поэтому в условиях высокогорья дышится тяжелее, и альпинисты, совершая восхождения на горные вершины, используют кислородные маски. Но в то же время люди, живущие в предгорьях и вдыхающие свежий горный воздух, меньше болеют и дольше живут.
- Морской воздух, с постоянно пополняющимся химическим составом, за счет испарения морской воды содержит фитонциды, отрицательно заряженные аэроны, среди которых ионы йода и другие жизненно важные элементы. Морской воздух полезен тем, кто имеет заболевания дыхательных путей (туберкулез, бронхит и т.д.). Заряженные частицы – ионы, входящие в состав воздуха играют важную роль в процессах обмена веществ, причем наиболее важны отрицательно заряженные частицы. Русский ученый А. Л. Чижевский провел серию экспериментов и определил положительное действие этих частиц на здоровье человека.
- Лесной воздух богат компонентами на основе трав, цветов, эфирных масел сосны, пихты и т.д. Помимо общеукрепляющего действия, он обладает бактерицидным действием. Когда мы дышим в лесу, получаем “порцию лекарства”.
Важно! Следовательно, не существует универсальной формулы химического состава воздуха. Для каждой климатической зоны она будет индивидуальна.
Негативные последствия загрязненного воздуха для человека
Развитие промышленности, побочные продукты технологического цикла заводов и фабрик, уничтожение лесов, автовыбросы и другие сопутствующие факторы оказывают негативное влияние на состав воздуха, как следствие — на организм человека (Рис. 2). Применение в производственных процессах технологий, которые не контролируют выбросы в атмосферу таких компонентов, как оксиды азота, углерода, сероводород, не только видоизменяют состав воздуха, но и способствуют развитию онкологических, сердечно-сосудистых, легочных и других серьезных заболеваний. Традиционно в крупных мегаполисах и промышленных зонах, вблизи оживленных автомагистралей нормы предельно допустимых концентраций (ПДК) указанных веществ превышены в несколько раз.
Негативные последствия грязного воздуха для Земли
Выброс в атмосферу фреонов также негативно влияет на озоновый слой земли, который защищает все живое на планете от ультрафиолетовых солнечных лучей. Попадая в верхние слои атмосферы, они вступают в реакцию с озоном и образуют кислород, тем самым разрушая защитный слой с образованием озоновых дыр.
Меры защиты и профилактики загрязнения воздуха
Чтобы решить проблему загрязнения воздуха:
- Вблизи дорог и предприятий высаживаются лесополосы, на производствах устанавливают специальные фильтры и очистные сооружения.
- В безветренную погоду снижают мощности или останавливают, насколько это возможно, производственные процессы.
- Специальные экологические комиссии постоянно проводят мониторинг воздуха над особо опасными по выбросам зонами.
Но проблема загрязнения окружающей среды в мировом масштабе и воздуха в частности, стоит достаточно остро. Необходимо осуществлять переход на экологически безопасные виды топлива, производства и т.д., беречь здоровье жителей планеты.
Рекомендуем посмотреть интересное видео о составе воздуха:
>
Содержание:
- Воздух
- Средства защиты атмосферы
- Горение
- Медленное окисление
- Условия возникновения и прекращения горения
- Образование основных и кислотных оксидов
Химический состав. Воздух состоит из смеси примерно двадцати семи различных газов. Примерно на 99% — это смесь кислорода и азота. В составе оставшегося процента: водяной пар, углекислый газ, метан, водород, озон, инертные газы (аргон, ксенон, неон, гелий, криптон) и другие.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Воздух
Молекулярная и химическая формула воздуха, в основном азот N₂ и кислород О₂. Воздух – естественная смесь газов, образующая атмосферу Земли.
В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов: азота и кислорода, содержание азота составляет 4/5 и 1/5 кислорода (по объему).
Качественный состав воздуха можно доказать посредством следующего опыта. Заполненный воздухом колокол опускают в воду. В железную ложечку помешают кусочек фосфора, его зажигают и вносят под колокол. При этом вода в колоколе поднимается на 1/5, так как при горении фосфора расходуется только кислород. Газ, оставшийся под колоколом — азот, он в реакцию не вступает (рис. 16).
Рис. 16. Сжигание фосфора пои колоколом: а — горение фосфора; б — уровень волы поднялся на 1/5 объема
В конце XIX в. было установлено, что в состав воздуха, кроме кислорода и азота, входят пять газообразных веществ: аргон (Аr), ксенон (Хе), криптон (Кг), гелий (Не), неон (Ne). Эти газы называются благородными из-за их химической неактивности.
Кроме того, в воздухе содержатся оксид углерода (IV) и водяные пары. Примерный состав воздуха показан в табл. 6.
Антуан Лоран Лавуазье (1743—1794)
Французский ученый в 1774 г. установил состав воздуха, ввел понятия «химический элемент» и «химическое соединение». Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии».
Содержание углекислого газа (СО2) и водяных паров изменяется в зависимости от условий. Например, при сырой и теплой погоде в воздухе содержится больше водяных паров, а при сухой и прохладной — меньше. Процессы горения увеличивают долю оксида углерода (IV) и уменьшают содержание кислорода.
Таблица 6
Состав воздуха
| Составные части | Содержание газов (в %) | |
| по объему | по массе | |
| Азот | 78,08 | 75,50 |
| Кислород | 20,95 | 23,10 |
| Благородные газы (в основном аргон) | 0,94 | 1,30 |
| Оксид углерода (IV) | 0,03 | 0,046 |
В результате природных явлений и деятельности человека (при землетрясении, вулканических извержениях, при сгорании топлива и выбросах из заводских труб) в атмосферу поступают такие газы, как оксиды азота — NO и NO2, оксиды серы — SO2 и SO3, сероводород — H2S.
В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в мегаполисах. В среднем при пробеге 15 тыс. км в год каждый автомобиль сжигает 2 т топлива и около 26—30 т воздуха, в том числе 4,5 т кислорода, что в 50 раз больше потребностей человека.
Атмосферный воздух является одним из основных жизненно важных элементов окружающей среды.
Средства защиты атмосферы
Средства защиты атмосферы должны ограничивать наличие вредных веществ в воздухе на уровне не выше ПДК (предельно допустимой концентрации).
Для очистки газов от частиц широко применяют сухие пылеуловители — циклоны различных типов.
Один из наиболее совершенных видов очистки газов от взвешенных в них частиц пыли и тумана — электрическая очистка (электрофильтр).
Для высокоэффективной очистки выбросов применяют аппараты многоступенчатой очистки.
В крупных городах для снижения вредного влияния загрязнения воздуха на человека применяют специальные градостроительные мероприятия. Построены и строятся автомагистрали в обход городов, принявшие весь поток транзитного транспорта, который раньше нескончаемой лентой тянулся по городским улицам.
Предприятия или их отдельные здания и сооружения, технологические процессы которых являются источником выделения в атмосферный воздух неприятно пахнущих веществ, отделяют от жилой застройки санитарно-защитными зонами.
Для повышения эффективности санитарно-защитных зон на их территории высаживают древесно-кустарниковую и травянистую растительность, снижающую концентрацию промышленной пыли и газов.
Знаешь ли ты?
Атмосфера земного шара весит 5 300 000 000 000 000 т. Если бы, например, потребовалось перевезти из Астаны в Алматы груз, равный весу земной атмосферы, и если бы каждый поезд имел 100 вагонов и проходил весь путь за 10 ч, на перевозку этого груза было бы потрачено почти 4 млрд. лет.
Самое важное
В воздухе содержится (по объему) 78% азота, 21% кислорода, 1% инертных и других газов. Кроме вышеприведенных простых веществ, в составе воздуха находятся углекислым газ и водяные пары, содержание которых может изменяться в зависимости от условии.
Горение
В повседневной жизни мы часто наблюдаем, как горит такое топливо, как природный газ. дрова, уголь. Знаете ли вы, что горение происходит с участием кислорода, входящего в состав воздуха? Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называются реакциями горения. При горении атомы простых веществ соединяются с атомами кислорода и образуются оксиды. Общая схема взаимодействия простых веществ с кислородом такова:
простое вещество + кислород = оксид
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Реакции взаимодействия веществ с кислородом называются окислением , а их продукты — оксидами.
Оксиды — это сложные вещества, которые состоят из двух элементов, один из которых кислород. При горении веществ в воздухе образуются те же продукты, т. е. оксиды. Однако горение веществ в воздухе происходит медленнее, чем в кислороде, так как последнего в воздухе содержится примерно в пять раз меньше.
Если опустить в сосуд с кислородом О2, тлеющий уголек (рис. 17а), то он раскаляется добела и сгорает, образуя оксид углерода (IV) СО2 (углекислый газ):
углерод — кислород = оксид углерода (IV)
Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
В железную ложечку поместим кусочек серы и подожжем над пламенем спиртовки, затем внесем в сосуд с кислородом. Сера S горит в кислороде О2 ярким синим пламенем (рис. 17 б) с образованием газа с резким запахом оксида серы (IV) (опыт проводится под тягой):
сера + кислород = оксид серы (IV)
Фосфор Р сгорает в кислороде О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V) (рис. 17 в):
фосфор + кислород = оксид фосфора (V)
В кислороде горят и такие вещества (рис. 17 г), которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. Реакцию горения железа в кислороде можно выразить следующим уравнением:
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, хотя эти реакции не всегда сопровождаются горением. Если сильно нагреть медь в кислороде, она, не сгорая, превратится в черный порошок — оксид меди (II):
| медь — кислород | оксид меди (II) |
Рис. 17. Горение в кислороде: а — угля; б — серы; в — фосфора; г — железа
Вам уже известно, что при горении простых веществ образуются оксиды, теперь выясним, как происходит горение сложных веществ. При горении парафиновой свечи в химическом стакане на его стенках появляются капельки воды. Если в стакан налить известковую воду, то она мутнеет, что доказывает наличие оксида углерода. Таким образом, при горении сложного вещества образовались оксиды тех элементов, которые входят в состав сложного вещества. Парафин состоит из двух элементов — углерода и водорода.
Медленное окисление
Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением.
Это явление наблюдается довольно часто. Например, в процессе гниения (окисления) навоза выделяется теплота, которая может использоваться в парниках.
♦ Вещества, при горении которых выделяется большое количество теплоты, называют топливом. На практике используют топливо трех видов: твердое, жидкое и газообразное.
К твердому топливу относятся антрацит, каменный уголь, бурый уголь, торф и дрова; к жидкому — продукты переработки нефти: бензин, керосин, мазут и др.; к газообразному — природный и попутный нефтяной газы, а также другие промышленные газы.
Условия возникновения и прекращения горения
Огонь возникает, когда есть три составляющие (схема 5). Первая — это топливо, которым может служить дерево, бумага, спирт, газ и т. д Второе, что необходимо, — это кислород, который взаимодействует с топливом, результатом чего является горение. Третья необходимая составляющая — это тепло. Только нагретое до определенной температуры топливо будет гореть в воздухе. Для того чтобы погасить огонь, необходимо или перекрыть доступ кислорода, или максимально понизить температуру, или устранить источник возгорания (то, что горит).
При тушении огня на пламя направляют углекислый газ или пену, которые затрудняют доступ воздуха к горючему веществу. Небольшие очаги пожара можно потушить, накрыв их сверху брезентом или одеялом. Можно также использовать песок. Для тушения угля или горящей древесины используют воду. Она охлаждает их, а образующиеся водяные пары затрудняют доступ воздуха.
Схема 5
Самое важное
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Горение веществ в воздухе происходит медленнее, чем в кислороде. При горении простых и сложных веществ образуются оксиды. Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
оксид кальция + вода 
Таким образом, оксидам металлов соответствуют основания. Растворимые основания называются щелочами .
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота. Это подтверждает изменение окраски лакмуса на красную. Как видим, оксидам неметаллов соответствует кислота. Таким образом, оксиды неметаллов являются кислотными оксидами. Схема реакции:
оксид фосфора (V) + вода 
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Воздух, свойства и химический состав.
Воздух – смесь газов главным образом из азота и кислорода – 98-99 % в сумме, а также аргона, углекислого газа, водорода, образующая земную атмосферу.
Воздух, роль и значение воздуха
Свойства воздуха
Химический состав воздуха. Из чего состоит воздух? Компоненты воздуха
Физические свойства воздуха
Воздух, роль и значение воздуха:
Воздух – смесь газов главным образом из азота и кислорода – 98-99 % в сумме, а также аргона, углекислого газа, водорода, образующая земную атмосферу.
В России действует Федеральный закон от 04.05.1999 № 96-ФЗ «Об охране атмосферного воздуха», которым дано понятие атмосферного воздуха.
Атмосферный воздух – жизненно важный компонент окружающей среды, представляющий собой естественную смесь газов атмосферы, находящуюся за пределами жилых, производственных и иных помещений. Атмосферный воздух является жизненно важным компонентом окружающей среды, неотъемлемой частью среды обитания человека, растений и животных.
Воздух окружает планету Земля, образуя атмосферу планеты. Он удерживается гравитацией Земли. Атмосфера Земли защищает жизнь на земле, создавая давление, позволяющее жидкой воде существовать на поверхности Земли, поглощая вредное ультрафиолетовое солнечное излучение, нагревая поверхность за счет удержания тепла (парниковый эффект) и уменьшая перепады температур между днем и ночью (суточное изменение температуры).
Воздух необходим для нормального существования на Земле живых организмов. Без воздуха невозможна жизнь человека. Для человека жизненно важной составной частью воздуха является кислород. Кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы).
Если без еды человек может продержаться несколько недель, без воды – несколько дней, то без воздуха – только несколько минут (1 минуту – обычный человек и 5 минут – тренированные ныряльщики).
Общая масса воздуха на Земле составляет 5,13․1015 т и оказывает на поверхность Земли давление, равное на уровне моря в среднем 1,0333 кг на 1 см3.
Свойства воздуха:
Воздух не имеет цвета, вкуса и запаха. Полностью прозрачен.
Воздух сжимаем и упруг.
Теплый воздух легче холодного. Воздух сжимается при охлаждении и расширяется при нагревании.
Воздух сохраняет тепло и практически не пропускает его.
Он всегда заполняет весь объём и содержится везде, где есть пустое пространство.
Воздух необходим для процессов горения.
Химический состав воздуха. Из чего состоит воздух? Компоненты воздуха:
То, что воздух является смесью газов, а не простым веществом, было впервые экспериментально доказано в 1754 году Джозефом Блэком.
| Химическое вещество | Обозначение вещества | По объему*, % | По массе*,% |
| Азот | N2 | 78,084 | 75,5 |
| Кислород | O2 | 20,9476 | 23,15 |
| Аргон | Ar | 0,934 | 1,292 |
| Углекислый газ | CO2 | 0,0314 | 0,046 |
| Неон | Ne | 0,001818 | 0,0014 |
| Метан | CH4 | 0,0002 | 0,000084 |
| Гелий | He | 0,000524 | 0,000073 |
| Криптон | Kr | 0,000114 | 0,003 |
| Водород | H2 | 0,00005 | 0,00008 |
| Ксенон | Xe | 0,0000087 | 0,00004 |
| Водяной пар** | H2O | от 0,0001 до 5 | 0,25*** |
Примечание:
* в пересчете на сухой воздух (без водяного пара).
** концентрация водяного пара значительно варьируется от примерно 0,0001 % по объему в самых холодных частях атмосферы до 5% по объему в горячих, влажных воздушных массах (в пересчете на сухой воздух).
*** водяной пар составляет около 0,25% по массе от массы всей атмосферы.
Многие вещества природного происхождения также могут присутствовать в воздухе в локально и сезонно изменяющихся малых количествах в виде аэрозолей. К ним относятся пыль, состоящая из различных минеральных и органических веществ (например, серы и сернистых соединений: сероводорода, диоксида серы и пр.), пыльца и споры, морские брызги и вулканический пепел.
Кроме того, различные промышленные загрязнители (сера, хлор и их соединения, пр.) могут присутствовать в воздухе в виде газов или аэрозолей.
Состав воздуха может меняться в небольших пределах: в крупных городах содержание углекислого газа немного выше, чем в лесах; в высокогорье и на больших высотах концентрация кислорода немного ниже вследствие того, что молекулы кислорода тяжелее молекул азота, и поэтому концентрация кислорода с высотой уменьшается быстрее.
Азот – основной компонент воздуха (78,084 % по объему и 75,5 % по массе) и один из самых распространённых элементов на Земле.
Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16-18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле – около 2,5 % (четвёртое место после водорода, углерода и кислорода).
Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха. Химически весьма инертен.
Разделяя воздух на составные компоненты, получают промышленный азот. Более ¾ промышленного азота идёт на синтез аммиака, а остальная ¼ применяется в промышленности как инертная среда для множества технологических процессов. Жидкий азот используется как хладагент.
Кислород – второй по распространенности после азота компонент воздуха. В воздухе его содержится 20,9476 % по объему и 23,15 % по массе. Вместе с азотом эти два газа образуют порядка 99% всего атмосферного воздуха.
С начала кембрийского периода (кембрия) – 540 миллионов лет назад – содержание кислорода в воздухе колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
В дальнейшем содержание кислорода в воздухе уменьшилось до современных объемов и стабилизировалось.
Кроме того, кислород – это также самый распространённый в земной коре элемент, на его долю (в составе более 1500 соединений различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода – 85,82 % (по массе).
Кислород – химически активный неметалл. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (химическая формула O2).
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. Он входит в состав белков, жиров, углеводов, аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. По числу атомов в живых клетках он составляет около 25 %, по массовой доле – около 65 %.
Биологическая роль кислорода заключается в том, что большинство живых организмов дышат кислородом. Молекулярный кислород используется живыми организмами для процессов синтеза энергии.
Переход кислорода из атмосферного воздуха в кровь и из крови в ткани зависит от разницы в его парциальном давлении, поэтому биологическое значение имеет парциальное давление кислорода, а не процентное содержание его в воздухе. На уровне моря парциальное давление кислорода равно 160 мм. При снижении его до 140 мм у человека появляются первые признаки гипоксии. Снижение парциального давления до 50-60 мм опасно для жизни.
Кислород постоянно пополняется в атмосфере Земли путем его фотосинтеза растениями, цианобактериями и зелеными водорослями. По некоторым оценкам, зеленые водоросли и цианобактерии в морской среде обеспечивают около 70% свободного кислорода, вырабатываемого на Земле, а остальная часть производится наземными растениями и деревьями.
Аргон – третий по распространенности после азота и кислорода компонент воздуха. В воздухе его содержится 0,934 % по объему и 1,292 % по массе.
Простое вещество аргон – инертный одноатомный газ без цвета, вкуса и запаха. Химически инертен.
Аргон не играет никакой заметной биологической роли. Вместе с тем вдыхание аргона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Углекислый газ (диоксид углерода, двуокись углерода) – бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом – запахом газированной воды). Концентрация углекислого газа в атмосфере 0,0314 % по объему и 0,046 % по массе. Тяжелее воздуха приблизительно в 1,5 раза.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Углекислый газ образуется в качестве одного из конечных продуктов метаболизма в клетках тканей живых организмов. Далее углекислый газ переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ участвует в процессах фотосинтеза. Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль – повышается.
Углекислый газ нетоксичен. Но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам. По ГОСТу 8050-85 углекислота относится к 4-му классу опасности.
Углекислый газ – возбудитель дыхательного центра. При его концентрации в воздухе 0,5% и выше отмечается увеличение легочной вентиляции. Незначительные повышения концентрации, вплоть до 2-4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7-10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с очень высокими концентрациями углекислого газа, несмотря на большую концентрацию кислорода в воздухе, смерть наступает очень быстро от удушья, вызванного гипоксией.
Неон – инертный одноатомный газ без цвета и запаха. Концентрация неона в воздухе 0,001818 % по объему и 0,0014 % по массе.
Заметной биологической роли не играет. Вместе с тем вдыхание неона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Неон наряду с гелием в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Метан – простейший по составу предельный углеводород, при нормальных условиях бесцветный газ без вкуса и запаха.
Концентрация метана в воздухе 0,0002 % по объему и 0,000084 % по массе. Метан почти в два раза легче воздуха.
Метан в смеси с воздухом или кислородом горюч и взрывоопасен.
Метан является парниковым газом, более сильным в этом отношении, чем углекислый газ. Его вклад в парниковый эффект составляет 4-9 %. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объёма метана составит 21-25 единиц.
Метан по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Гелий – инертный одноатомный газ без цвета, вкуса и запаха.
Концентрация гелия в воздухе 0,000524 % по объему и 0,000073 % по массе.
Гелий не несёт какой-либо биологической функции. Вместе с тем вдыхание гелия может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Криптон – инертный одноатомный газ без цвета, вкуса и запаха.
Концентрация криптона в воздухе 0,000114 % по объему и 0,0003 % по массе.
Криптон не несёт какой-либо биологической функции. Вместе с тем вдыхание криптона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Водород – самый лёгкий из элементов периодической таблицы химических элементов Д.И. Менделеева. Концентрация водорода в воздухе 0,00005 % по объему и 0,00008 % по массе.
При стандартных температуре и давлении водород – бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и взрывоопасен.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений. Лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере.
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.
Поэтому значение водорода в химических процессах, происходящих на Земле и в живых организмах, почти так же велико, как и кислорода.
Будучи компонентом воздуха водород (как компонент воздуха) заметной биологической роли не играет.Ксенон – инертный одноатомный газ без цвета, вкуса и запаха.
Концентрация ксенона в воздухе 0,0000087 % по объему и 0,00004 % по массе.
Ксенон не несёт какой-либо биологической функции. Вместе с тем вдыхание ксенона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Водяной пар – один из компонентов воздуха. Его концентрация значительно варьируется от примерно 0,0001 % по объему в самых холодных частях атмосферы до 5% по объему в горячих, влажных воздушных массах (в пересчете на сухой воздух). Водяной пар составляет около 0,25% по массе от массы всей атмосферы.
Концентрация водяного пара в воздухе зависит от температуры, влажности, времени года и климата. Так, при температуре 0 °C 1 м³ воздуха может содержать максимально 5 г воды, а при температуре +10 °C – уже 10 г.
Вода (оксид водорода) – это бинарное неорганическое соединение с химической формулой H2O. Молекула воды состоит из двух атомов водорода и одного – кислорода, которые соединены между собой ковалентной связью. При нормальных условиях вода представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии вода называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном – водяным паром.
Физические свойства воздуха:
| Наименование параметра | Значение |
| Цвет | бесцветный |
| Вкус | без вкуса |
| Запах | без запаха |
| Прозрачность | полностью прозрачен |
| Средняя молярная масса (средняя масса одного моля вещества), г/моль | 28,98 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C , кг/м3 | 1,292 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C , г/см3 | 0,001292 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 20 °C , кг/м3 | 1,2041 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 20 °C , г/см3 | 0,0012041 |
| Температура кипения воздуха при нормальном атмосферном давлении, оС | -192 |
| Температура плавления воздуха при нормальном атмосферном давлении, оС | -213 |
| Средняя удельная теплоемкость при постоянном давлении (101 325 Па или 1 атм.), кДж / (кг·К) | 1,006 |
| Средняя удельная теплоемкость при постоянном объеме (при нормальном атмосферном давлении), кДж/(кг·К) | 0,717 |
| Показатель адиабаты воздуха (отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме) (при нормальном атмосферном давлении) | 1,40 |
| Теплопроводность воздуха при 0 ℃ и нормальном атмосферном давлении, Вт / (м·К) | 0,0243 |
| Скорость звука в воздухе при нормальных условиях, м/с (км/ч) | 331 (1193) |
| Средний коэффициент теплового расширения воздуха в интервале температур 0-100°C (изменение объема при постепенном увеличении температуры при постоянном нормальном атмосферном давлении), 1/К | 3,67·10−3 |
| Коэффициент динамической вязкости воздуха при нормальных условиях и нормальном атмосферном давлении (динамическая вязкость – внутреннее сопротивление молекул движению внутри вещества согласно закону Ньютона), мкПа·с | 17,2 |
| Растворимость воздуха в воде, см3/л | 29,18 |
| Показатель преломления воздуха при нормальных условиях и нормальном атмосферном давлении (показатель преломления означает изменение угла движения световых и любых других волн в веществе) | 1,0002926 |
| Коэффициент изменения показателя преломления (при нормальных условиях и нормальном атмосферном давлении), 1/Pa | 2,8·10−9 |
| Средняя поляризуемость молекулы (при нормальных условиях и нормальном атмосферном давлении) | 1,7·10−30 |
Источник: https://ru.wikipedia.org/wiki/Воздух
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
9 365
В уроке 15 «Воздух как смесь газов» из курса «Химия для чайников» мы выясним из чего состоит воздух; узнаем о получении, собирании и хранении газов, а также об их герметичности.
Вы уже знаете, что вещества могут находиться в различных агрегатных состояниях: газообразном, жидком и твердом.
В окружающей нас природе многие вещества при обычных условиях находятся в газообразном состоянии. Прежде всего, это компоненты воздушной оболочки Земли — атмосферы. Очень много газов растворено в водах Мирового океана. Во время извержения вулканов в атмосферу также выбрасывается большое количество вулканических газов. В недрах нашей планеты хранятся огромные запасы природного газа.
Атмосфере принадлежит важнейшая роль в жизни человека, животных и растений. Ее исследованиям были посвящены труды многих ученых прошлого. С давних времен был известен лишь один вид газа — воздух. При этом он изучался в основном физиками и интереса у химиков не вызывал. Лишь во второй половине XVIII в. было установлено, что воздух представляет собой смесь газов.
Состав воздуха
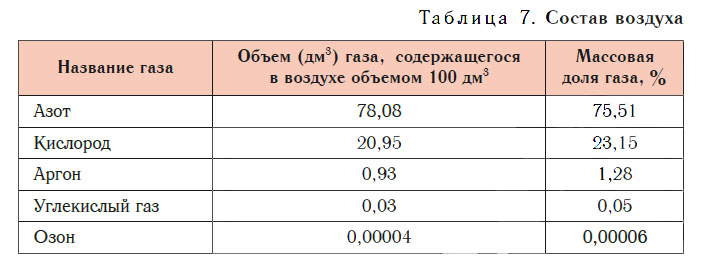
Основные компоненты воздуха — азот и кислород. При нормальных условиях в воздухе объемом 100 дм3 содержится азот объемом около 78 дм3 и кислород объемом около 21 дм3, а на долю всех остальных газов приходится около 1 дм3. В заметных количествах в воздухе присутствуют аргон, углекислый газ, озон и другие газы (табл. 7).
Для решения некоторых задач и проведения расчетов в физике, химии, технике очень удобно рассматривать воздух не как смесь газов, а как одно газообразное вещество. Экспериментальным путем можно установить, что при нормальных условиях масса воздуха объемом 22,4 дм3 равна 29 г. Поскольку такой объем при н. у. занимает любой газ химическим количеством 1 моль, то молярную массу воздуха можно условно считать равной 29 г/моль:
Все газы, молярная масса которых меньше 29 г/моль, принято называть газами легче воздуха (например, водород H2, аммиак NH3, угарный газ CO, метан CH4), а газы, у которых она больше 29 г/моль — газами тяжелее воздуха (например, кислород O2, озон O3, углекислый газ CO2).
Получение, собирание и хранение газов
Газы имеют важное значение в жизни и деятельности человека. Поэтому необходимо уметь их получать, собирать и хранить.
В химической лаборатории небольшие объемы газов можно получать различными способами. Например, газы выделяются при нагревании некоторых твердых веществ (рис. 66).
Газообразные вещества могут образовываться при действии некоторых жидких веществ на твердые. Так, при действии уксуса на мрамор или мел выделяется углекислый газ (рис. 67).
В промышленности используют значительно большие, чем в химических лабораториях, количества различных газов. Большие объемы кислорода и азота получают из воздуха. Позднее вы узнаете, как это делается.
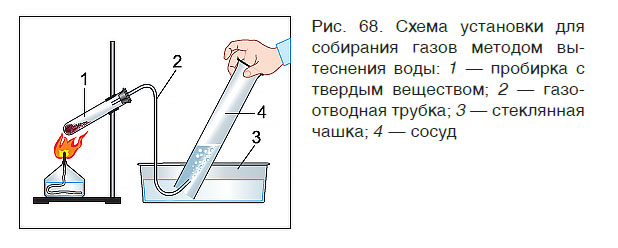
В лабораторных условиях собрать газ в сосуд можно двумя способами: вытеснением воды (рис. 68) и вытеснением воздуха. Первый способ применяют для собирания только нерастворимых в воде газов (кислород, азот, водород). Вто-
рой — для собирания как растворимых (аммиак, углекислый газ), так и нерастворимых в воде газов.
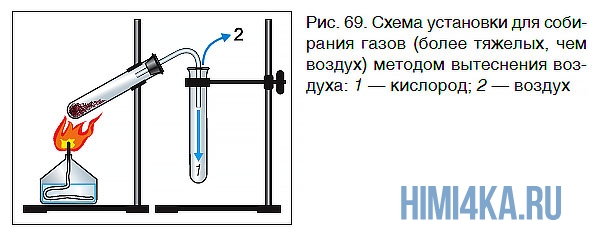
Для собирания газов, которые легче воздуха, сосуд для сбора газа следует закрепить дном вверх, а для газов, которые тяжелее воздуха, — дном вниз (рис. 69)
Для хранения газов следует использовать сосуды, не сообщающиеся с окружающей средой. Такие сосуды называют герметичными (т. е. не имеющими отверстий для выхода газа из сосуда наружу). В быту примером герметичного сосуда является бутылка с плотной пробкой, завязанный воздушный шарик или накачанная камера от велосипедного колеса, в химической лаборатории — пробирка, плотно закрытая пробкой, газометр.
Из курса физики вы знаете, что при нагревании газы расширяются. Это свойство можно использовать для проверки прибора для получения газов на герметичность (рис. 70). Для этого после сборки прибора следует погрузить конец газоотводной трубки в воду, а пробирку на несколько секунд зажать в ладони. Нагреваясь от тепла руки, воздух в пробирке расширяется и выходит из газоотводной трубки в виде пузырьков. Если пузырьки не наблюдаются, то это свидетельствует о том, что прибор собран негерметично и для газа имеется другой выход, кроме газоотводной трубки.
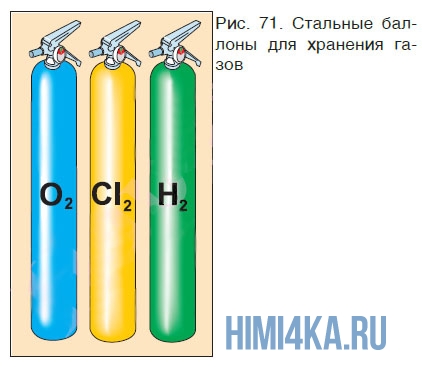
В промышленности для хранения газов чаще всего используют более прочные сосуды — баллоны (рис. 71), в которых сжатые газы находятся под большим давлением; для предупреждения разрушения баллона сжатым газом его стенки делают из толстой стали. Узнать, какой газ содержится в баллоне, можно по окраске баллона, цвету надписи на нем и цвету полосы. Например, баллон с кислородом должен быть окрашен в голубой цвет и иметь черную надпись «Кислород», баллон с азотом должен быть окрашен в черный цвет, иметь желтую надпись «Азот» и коричневую полосу, баллон с очень чистым аргоном должен быть окрашен в серый цвет, иметь зеленую надпись «Аргон» и зеленую полосу.
Краткие выводы урока:
- Вещества могут находиться в газообразном, жидком или твердом агрегатном состоянии.
- Воздух представляет собой смесь газов. Основными компонентами воздуха являются азот и кислород.
- При нормальных условиях в воздухе объемом 100 дм3 содержится азот объемом около 78 дм3 и кислород объемом около 21 дм3.
- Воздух можно условно рассматривать как газ, молярная масса которого равна 29 г/моль.
Надеюсь урок 15 «Воздух как смесь газов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.