Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Метан
Брутто-формула:
CH4
CAS# 74-82-8
Категории:
Алканы
PubChem CID: 297
| ChemSpider ID: 291
| CB9374483
Названия
Русский:
- Метан(IUPAC) [Wiki]
English:
- Methane(IUPAC) [Wiki]
- Tetrahydridocarbon
Варианты формулы:
CH4
H-C-H; H|#C|H
H|C<`/H><_(A65,w+)H>_(A20,d+)H
Вещества, имеющие отношение…
Следущий гомолог:
Этан
Химический состав
Реакции, в которых участвует Метан
-
CH4 + H2O <=> CO + 3H2
-
2CH4 + O2 <=> 2CO + 4H2
-
2CH4 + 2NH3 + 3O2 -> 2HCN + 6H2O
-
CH4 + O2 -> HCHO + H2O
-
Al4C3 + 12H2O -> 4Al(OH)3 + 3CH4
И ещё 22 реакции…
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
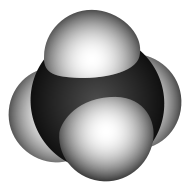
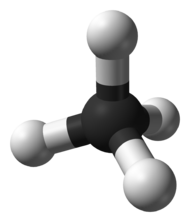
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
CH4 + HNO3 = CH3NO2 + H2O
2. Реакции разложения метана (дегидрирование, пиролиз)
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
3. Окисление метана
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
Получение метана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории для получения метана.
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить метан:
CO + 4H2 = CH4 + 2H2O
5. Получение метана в промышленности
В промышленности метан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
| Метан | |
 |
|
  |
|
| Общие | |
|---|---|
| Химическая формула | CH4 |
| Физические свойства | |
| Молярная масса | 16,04 г/моль |
| Плотность | газ (0 °C, 1013 гПа) 0,72 кг/м³; жидкость (−161,6 °C) 0,42 г/см³ |
| Термические свойства | |
| Температура плавления | -182,5 °C |
| Температура кипения | -161,6 °C |
| Химические свойства | |
| Растворимость в воде | 0,35[1] г/100 мл |
| Классификация | |
| Рег. номер CAS | 74-82-8 |
| SMILES | C |
| Безопасность | |
| Токсичность |
4 1 0 |
У этого термина существуют и другие значения, см. Метан (значения).
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[2], химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[3]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[4]. Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %[5]. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[6].
Содержание
- 1 Источники
- 2 Получение
- 3 Химические свойства
- 4 Соединения включения
- 5 Применение метана
- 6 Физиологическое действие
- 6.1 Хроническое действие метана
- 7 Метан и экология
- 8 Ссылки
- 9 Примечания
Источники
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано[источник не указан 27 дней]-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[7]:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:
Выше 1400 °C разлагается по реакции:
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, сходные с горной болезнью.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом, от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Метан и экология
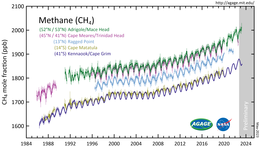
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу[8].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3[9].
Ссылки
- Чем метан лучше пропана
- Термодинамические свойства метана.
- Свойства метана
Примечания
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ Статья «Метан» на сайте «Химик»
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане «Органическая химия», М. «Химия», 1979, стр. 203.
- ↑ Куценко С. А. Основы токсикологии / С.А. Куценко. — СПб.: Фолиант, 2004.
- ↑ ГОСТ Р 52136-2003
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 3 February 2009 (англ.)
- ↑ Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
| |
|
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан … |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен … |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |

- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
115 элемент таблицы Менделеева — московий (moscovium) — сверхтяжелый синтетический элемент с символом Mc и атомным номером 115. Он был впервые получен в 2003 году совместной командой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
Характеристика
115 элемент таблицы Менделеева является чрезвычайно радиоактивным веществом: его наиболее стабильный известный изотоп, moscovium-290 имеет период полураспада всего 0,8 секунды. Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Согласно расчетам, элемент обладает некоторыми свойствами, схожими с более легкими гомологами: азотом, фосфором, мышьяком, сурьмой и висмутом. При этом демонстрирует несколько существенных отличий от них. На сегодня синтезировано около 100 атомов московия, которые имеют массовые числа от 287 до 290.
Физические свойства
Валентные электроны 115 элемента таблицы Менделеева московия делятся на три подоболочки: 7s (два электрона), 7p 1/2 (два электрона) и 7p 3/2 (один электрон). Первые два из них релятивистски стабилизируются и, следовательно, ведут себя, как инертные газы, а последние релятивистски дестабилизируются и могут легко участвовать в химических взаимодействиях. Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 .
Предполагаемые расчетные характеристики:
- Фаза: твердая.
- Температура плавления: 400°С (670°К, 750°F).
- Точка кипения: 1100°С (1400°К, 2000°F).
- Удельная теплота плавления: 5,90-5,98 кДж/моль.
- Удельная теплота парообразования и конденсации: 138 кДж/моль.
Химические свойства
115-й элемент таблицы Менделеева стоит третьим в ряду химических элементов 7p и является самым тяжелым членом группы 15 в периодической таблице, располагаясь ниже висмута. Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc + и Mc 3+ . Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc 2 CO 3), оксалат (Mc 2 C 2 O 4) и фторид (McF) должны растворяться в воде. Сульфид (Мс 2 S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) — слаборастворимые соединения.
Фторид московия (III) (McF 3) и тиозонид (McS 3), предположительно, нерастворимы в воде (аналогично соответствующим соединениям висмута). В то время, как хлорид (III) (McCl 3), бромид (McBr 3) и иодид (McI 3) должны быть легко растворимы и легко гидролизованы с образованием оксогалогенидов, таких как McOCl и McOBr (также аналогично висмуту). Оксиды московия (I) и (III) обладают схожими состояниями окисления, и их относительная стабильность в значительной степени зависит от того, с какими элементами они взаимодействуют.
Неопределенность
Вследствие того, что 115 элемент таблицы Менделеева синтезируется единичными экспериментально его точные характеристики проблематично. Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.
В 2011 году были проведены эксперименты по созданию изотопов нихония, флеровия и московия в реакциях между «ускорителями» (кальцием-48) и «мишенями» (америцием-243 и плутонием-244) для исследования их свойств. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Открытие
Первым успешным синтезом 115 элемента таблицы Менделеева была совместная работа российских и американских ученых в августе 2003 года в ОИЯИ в Дубне. В команду во главе с физиком-ядерщиком Юрием Оганесяном, помимо отечественных специалистов, вошли коллеги из Ливерморской национальной лаборатории Лоуренса. Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287 Mc и три ядра 288 Mc). Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Первоначально IUPAC не могла утвердить открытие нового элемента. Требовалось подтверждение из других источников. В течение следующих нескольких лет была проведена еще одна оценка более поздних экспериментов, и еще раз выдвинуто заявление дубненской команды об открытии 115-го элемента.
В августе 2013 года группа исследователей из Университета Лунда и Института тяжелых ионов в Дармштадте (Германия) объявили, что они повторили эксперимент 2004 года, подтвердив результаты, полученные в Дубне. Еще одно подтверждение было опубликовано командой ученых, работавших в Беркли в 2015 году. В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.
Название
115 элемент таблицы Менделеева в 1979 году согласно рекомендации IUPAC было решено назвать «унунпентий» и обозначать соответствующим символом UUP. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли — элемент №115 или E115.
30 декабря 2015 года обнаружение нового элемента было признано Международным союзом чистой и прикладной химии. Согласно новым правилам, первооткрыватели имеют право предложить собственное название нового вещества. Сначала предполагалось назвать 115 элемент таблицы Менделеева «лангевиний» в честь физика Поля Ланжевена. Позднее команда ученых из Дубны, как вариант, предложила наименование «московий» в честь Московской области, где и было совершено открытие. В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
Эфир в таблице Менделеева
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит — ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир — это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, — альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем — один из пяти элементов бытия (по Аристотелю) — пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Предисловие.
У Менделеева было два фундаментальных научных открытия:
1 — Открытие Периодического закона в субстанции химии,
2 — Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир — частицы вещества размером ~ 10-100 метра (фактически — «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 — не видно, 2 — и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира — то же самое, что человечество без детей — прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача — эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева — это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения?
Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира
. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире — роль крови мировой экономики — их не вдохновляла.
Не вдохновляло это и прочих олигархов — угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» — из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто — солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому
против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева — его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности»
(«Попытка химического понимания мирового эфира». 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
1 , , ,
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами — фононами в кристаллах.
Эфир — это дифференцированная материя, так сказать, атомы в разобранном состоянии или правильней сказать, элементарные частицы, из которых формируются будущие атомы. Поэтому ему нет места в таблице Менделеева, так как логика построения данной системы не предполагает включать в её состав не целостные структуры,которыми являются сами атомы. В противном случае, так можно и для кварков найти место, где-нибудь в минус первом периоде.
Сам эфир имеет более сложную многоуровневую структуру проявления в мировом бытии, нежели об этом знает современная наука. Как только она раскроет первые тайны этого неуловимого эфира, тогда и будут изобретены новые двигатели для всевозможных машин на абсолютно новых принципах.
Действительно,Тесла едва ли не единственный, кто был близок к разгадке тайны, так называемого эфира,но ему сознательно мешали осуществить свои замыслы. Вот так до сегодняшнего дня ещё не родился тот гений, который продолжит дело великого изобретателя и расскажет всем нам, что же на самом деле представляет из себя таинственный эфир и на какой пьедестал его можно будет поставить.
См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским… … Википедия
Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Книги
- Японско-англо-русский словарь по монтажу промышленного оборудования. Около 8 000 терминов , Попова И.С.. Словарь предназначен для широкого круга пользователей и прежде всего для переводчиков и технических специалистов, занимающихся поставками и внедрением промышленного оборудования из Японии или…
Периодическая система химических элементов (таблица Менделеева)
— классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Таблица МенделееваОдна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» — для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA — это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» — после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру — «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность, это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме — возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке — с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок — D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок — F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
В природе существует очень много повторяющихся последовательностей:
- времена года;
- время суток;
- дни недели…
В середине 19 века Д.И.Менделеев заметил, что химические свойства элементов также имеют определенную последовательность (говорят, что эта идея пришла ему во сне). Итогом чудесных сновидений ученого стала Периодическая таблица химических элементов, в которой Д.И. Менделеев выстроил химические элементы по возрастанию атомной массы. В современной таблице химические элементы выстроены по возрастанию атомного номера элемента (количество протонов в ядре атома).
Атомный номер изображен над символом химического элемента, под символом — его атомная масса (сумма протонов и нейтронов). Обратите внимание, что атомная масса у некоторых элементов является нецелым числом! Помните об изотопах!
Атомная масса — это средневзвешенное от всех изотопов элемента, встречающихся в природе в естественных условиях.
Под таблицей расположены лантаноиды и актиноиды.
Металлы, неметаллы, металлоиды
Расположены в Периодической таблице слева от ступенчатой диагональной линии, которая начинается с Бора (В) и заканчивается полонием (Po) (исключение составляют германий (Ge) и сурьма (Sb). Нетрудно заметить, что металлы занимают бОльшую часть Периодической таблицы. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны.
Элементы, расположенные справа от ступенчатой диагонали B-Po, называются неметаллами
. Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
Металлоиды
Между металлами и неметаллами находятся полуметаллы
(металлоиды). Для них характерны свойства как металлов, так и неметаллов. Основное применение в промышленности полуметаллы нашли в производстве полупроводников, без которых немыслима ни одна современная микросхема или микропроцессор.
Периоды и группы
Как уже говорилось выше, периодическая таблица состоит из семи периодов. В каждом периоде атомные номера элементов увеличиваются слева направо.
Свойства элементов в периодах изменяются последовательно: так натрий (Na) и магний (Mg), находящиеся в начале третьего периода, отдают электроны (Na отдает один электрон: 1s 2 2s 2 2p 6 3s 1 ; Mg отдает два электрона: 1s 2 2s 2 2p 6 3s 2). А вот хлор (Cl), расположенный в конце периода, принимает один элемент: 1s 2 2s 2 2p 6 3s 2 3p 5 .
В группах же, наоборот, все элементы обладают одинаковыми свойствами. Например, в группе IA(1) все элементы, начиная с лития (Li) и заканчивая францием (Fr), отдают один электрон. А все элементы группы VIIA(17), принимают один элемент.
Некоторые группы настолько важны, что получили особые названия. Эти группы рассмотрены ниже.
Группа IA(1)
. Атомы элементов этой группы имеют во внешнем электронном слое всего по одному электрону, поэтому легко отдают один электрон.
Наиболее важные щелочные металлы — натрий (Na) и калий (K), поскольку играют важную роль в процессе жизнедеятельности человека и входят в состав солей.
Электронные конфигурации:
- Li
— 1s 2 2s 1 ; - Na
— 1s 2 2s 2 2p 6 3s 1 ; - K
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Группа IIA(2)
. Атомы элементов этой группы имеют во внешнем электронном слое по два электрона, которые также отдают во время химических реакций. Наиболее важный элемент — кальций (Ca) — основа костей и зубов.
Электронные конфигурации:
- Be
— 1s 2 2s 2 ; - Mg
— 1s 2 2s 2 2p 6 3s 2 ; - Ca
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
Группа VIIA(17)
. Атомы элементов этой группы обычно получают по одному электрону, т.к. на внешнем электронном слое находится по пять элементов и до «полного комплекта» как раз не хватает одного электрона.
Наиболее известные элементы этой группы: хлор (Cl) — входит в состав соли и хлорной извести; йод (I) — элемент, играющий важную роль в деятельности щитовидной железы человека.
Электронная конфигурация:
- F
— 1s 2 2s 2 2p 5 ; - Cl
— 1s 2 2s 2 2p 6 3s 2 3p 5 ; - Br
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
Группа VIII(18).
Атомы элементов этой группы имеют полностью «укомплектованный» внешний электронный слой. Поэтому им «не надо» принимать электроны. И отдавать их они «не хотят». Отсюда — элементы этой группы очень «неохотно» вступают в химические реакции. Долгое время считалось, что они вообще не вступают в реакции (отсюда и название «инертный», т.е. «бездействующий»). Но химик Нейл Барлетт открыл, что некоторые из этих газов при определенных условиях все же могут вступать в реакции с другими элементами.
Электронные конфигурации:
- Ne
— 1s 2 2s 2 2p 6 ; - Ar
— 1s 2 2s 2 2p 6 3s 2 3p 6 ; - Kr
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
У щелочных металлов — по 1 валентному электрону:
- Li
— 1s 2 2s 1
; - Na
— 1s 2 2s 2 2p 6 3s 1
; - K
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
У щелочноземельных металлов — по 2 валентных электрона:
- Be
— 1s 2 2s 2
; - Mg
— 1s 2 2s 2 2p 6 3s 2
; - Ca
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
У галогенов — по 7 валентных электронов:
- F
— 1s 2 2s 2
2p 5
; - Cl
— 1s 2 2s 2 2p 6 3s 2
3p 5
; - Br
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
3d 10 4p 5
У инертных газов — по 8 валентных электронов:
- Ne
— 1s 2 2s 2
2p 6
; - Ar
— 1s 2 2s 2 2p 6 3s 2
3p 6
; - Kr
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
3d 10 4p 6
Дополнительную информацию см. в статье Валентность и в Таблице электронных конфигураций атомов химических элементов по периодам .
Обратим теперь свое внимание на элементы, расположенные в группах с символов В
. Они расположены в центре периодической таблицы и называются переходными металлами
.
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали
:
- Sc
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 ; - Ti
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Отдельно от основной таблицы расположены лантаноиды
и актиноиды
— это, так называемые, внутренние переходные металлы
. В атомах этих элементов электроны заполняют f-орбитали
:
- Ce
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 5s 2 5p 6 4f 1 5d 1 6s 2 ; - Th
— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 2 6p 6 6d 2 7s 2
Эфир в таблице Менделеева
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит — ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир — это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, — альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем — один из пяти элементов бытия (по Аристотелю) — пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Предисловие.
У Менделеева было два фундаментальных научных открытия:
1 — Открытие Периодического закона в субстанции химии,
2 — Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир — частицы вещества размером ~ 10-100 метра (фактически — «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 — не видно, 2 — и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира — то же самое, что человечество без детей — прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача — эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева — это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения?
Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира
. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире — роль крови мировой экономики — их не вдохновляла.
Не вдохновляло это и прочих олигархов — угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» — из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто — солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому
против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева — его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности»
(«Попытка химического понимания мирового эфира». 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
1 , , ,
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами — фононами в кристаллах.
Эфир — это дифференцированная материя, так сказать, атомы в разобранном состоянии или правильней сказать, элементарные частицы, из которых формируются будущие атомы. Поэтому ему нет места в таблице Менделеева, так как логика построения данной системы не предполагает включать в её состав не целостные структуры,которыми являются сами атомы. В противном случае, так можно и для кварков найти место, где-нибудь в минус первом периоде.
Сам эфир имеет более сложную многоуровневую структуру проявления в мировом бытии, нежели об этом знает современная наука. Как только она раскроет первые тайны этого неуловимого эфира, тогда и будут изобретены новые двигатели для всевозможных машин на абсолютно новых принципах.
Действительно,Тесла едва ли не единственный, кто был близок к разгадке тайны, так называемого эфира,но ему сознательно мешали осуществить свои замыслы. Вот так до сегодняшнего дня ещё не родился тот гений, который продолжит дело великого изобретателя и расскажет всем нам, что же на самом деле представляет из себя таинственный эфир и на какой пьедестал его можно будет поставить.
Эфир в таблице Менделеева
О
фициально преподаваемая в школах и ВУЗах таблица химических элементов Менделеева- фальсификат. Сам Менделеев в работе под названием «Попытка химического понимания мирового эфира» привёл несколько иную таблицу (Политехнический музей, Москва):
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание). Отличия видны: нулевая группа перенесена в 8-ю, а элемент легче водорода, с которой должна начинаться таблица и который условно назван Ньютонием (эфир),- вообще исключён.
Эта же таблица увековечена «кровавым тираном» тов. Сталиным в Санкт-Петербурге, Московский просп. 19. ВНИИМ им. Д. И. Менделеева (Всероссийский научно-исследовательский институт метрологии)
Памятник-таблица Периодическая система химических элементов Д.И. Менделеева выполнен мозаикой под руководством профессора Академии художеств В.А. Фролова (архитектурное оформление Кричевского). В основу памятника положена таблица из последнего прижизненного 8-го издания (1906 г.) Основ химии Д.И. Менделеева. Элементы, открытые при жизни Д.И. Менделеева обозначены красным цветом. Элементы, открытые с 1907 по 1934 гг. , обозначены синим цветом. Высота памятника-таблицы — 9 м. общая площадь 69 кв. м
Почему и как случилось, что нам столь открыто лгут?
Место и роль мирового эфира в истинной таблице Д.И. Менделеева
1. Suprema lex – salus populi
Многие слышали о Дмитрии Ивановиче Менделееве и об открытом им в 19-м веке (1869 г.) «Периодическом законе изменения свойств химических элементов по группам и рядам» (авторское название таблицы — «Периодическая система элементов по группам и рядам»).
Многие слышали также, что Д.И. Менделеев был организатором и бессменным руководителем (1869-1905 гг.) российского общественного научного объединения под названием «Русское Химическое Общество» (с 1872 года — «Русское Физико-Химическое Общество»), издававшее во всё время своего существования всемирно известный журнал ЖРФХО, вплоть до момента ликвидации Академией Наук СССР в 1930 году — и Общества, и его журнала.
Но мало тех, кто знает, что Д.И. Менделеев был одним из последних всемирно известных русских учёных конца 19-го века, кто отстаивал в мировой науке идею эфира как всемирной субстанциональной сущности, кто придавал ей фундаментальное научное и прикладное значение в раскрытии тайн Бытия и для улучшения народнохозяйственной жизни людей.
Ещё меньше тех, кто знает, что после скоропостижной (!!?) смерти Д.И. Менделеева (27.01.1907), признанного тогда выдающимся учёным всеми научными сообществами во всём мире кроме одной только Петербургской Академии Наук, его главное открытие — «Периодический закон» — было умышленно и повсеместно фальсифицировано мировой академической наукой.
И уж совсем мало тех, кто знает, что всё выше перечисленное связано воедино нитью жертвенного служения лучших представителей и носителей бессмертной Русской Физической Мысли благу народов, общественной пользе, вопреки нараставшей волне безответственности в высших слоях общества того времени.
В сущности, всестороннему развитию последнего тезиса и посвящена настоящая диссертация, ибо в подлинной науке любое пренебрежение существенными факторами всегда приводит к ложным результатам. Итак,- вопрос: почему учёные врут?
2. Psy-faktor: ni foi, ni loi
Это только сейчас, с конца 20-го века, общество начинает понимать (да и то робко) на практических примерах, что выдающийся и высококвалифицированный, но безответственный, циничный, безнравственный учёный с «мировым именем» не менее опасен для людей, чем выдающийся, но безнравственный политик, военный, юрист или в лучшем случае — «выдающийся» бандит с большой дороги.
Обществу внушили мысль, будто мировая академическая научная среда — это каста небожителей, монахов, святых отцов, которые дённо и нощно пекутся о благе народов. А простые смертные должны попросту смотреть в рот своим благодетелям, безропотно финансируя и реализуя все их “научные” прожекты, прогнозы и предписания по переустройству своей общественной и частной жизни.
На самом деле уголовно-преступного элемента в мировой научной среде ничуть не меньше, нежели в среде тех же политиков. Кроме того, — преступные, анти-общественные деяния политиков чаще всего видны сразу, а вот преступная и вредная, но «научно обоснованная» деятельность «видных» и «авторитетных» учёных распознаётся обществом далеко не сразу, а спустя годы, а то и десятилетия, на своей собственной «общественной шкуре».
Продолжим далее наше исследование этого чрезвычайно интересного (и засекреченного!) психофизиологического фактора научной деятельности (назовём его условно пси-фактором), в результате которого апостериори получается неожиданный (?!) отрицательный результат: «хотели как лучше для людей, а получилось как всегда, т.е. во вред». Ведь в науке отрицательный результат — это тоже результат, безусловно требующий всестороннего научного осмысления.
Рассматривая корреляцию между пси-фактором и основной целевой функцией (ОЦФ) государственного финансирующего органа, мы приходим к любопытному выводу: так называемая чистая, большая наука прошлых веков к настоящему моменту времени выродилась в касту неприкасаемых, т.е. в закрытую ложу придворных знахарей, блестяще освоивших науку обмана, блестяще владеющих наукой преследования инакомыслящих и наукой прислужничества перед своими власть имущими финансистами.
При этом необходимо иметь в виду, что, во-первых, во всех т.н. «цивилизованных странах» их т.н. «национальные академии наук» формально имеют статус государственных организаций с правами ведущего научного экспертного органа соответствующего правительства. Во-вторых, все эти национальные академии наук объединены между собой в единую жёсткую иерархическую структуру (подлинного названия которой мир не знает), вырабатывающую единую для всех национальных академий наук стратегию поведения в мире и единую т.н. научную парадигму, стержнем которой является отнюдь не раскрытие закономерностей бытия, а пси-фактор: осуществляя в качестве «придворных знахарей» так называемое «научное» прикрытие (для солидности) всех неблаговидных деяний власть имущих в глазах общества, стяжать себе славу жрецов и пророков, влияющих подобно демиургу на сам ход движения истории человечества.
Всё выше изложенное в этом разделе, включая и введённый нами термин «пси-фактор», было с большой точностью, обоснованно, предсказано Д.И. Менделеевым более 100 лет тому назад (см. например его аналитическую статью 1882 года «Какая же Академия нужна в России?», в которой Дмитрий Иванович фактически даёт развёрнутую характеристику пси-фактора и в которой им предлагалась программа радикальной реорганизации замкнутой учёной корпорации членов Российской Академии Наук, рассматривавших Академию исключительно лишь как кормушку для удовлетворения своих шкурных интересов.
В одном из своих писем 100-летней давности профессору Киевского университета П.П. Алексееву Д.И. Менделеев откровенно признался, что «готов хоть сам себя кадить, чтобы чёрта выкурить, иначе сказать, — чтобы основы академии преобразовать во что-нибудь новое, русское, своё, годное для всех вообще и, в частности, для научного движения в России».
Как мы видим, истинно великому учёному, гражданину и патриоту своей Родины по силам даже сложнейшие долгосрочные научные прогнозы. Рассмотрим теперь исторический аспект изменения этого пси-фактора, открытого Д.И. Менделеевым в конце 19 века.
3. Fin de siecle
Со второй половины 19-го века в Европе на волне «либерализма» произошёл бурный численный рост интеллигенции, научно-технических кадров и количественный рост теорий, идей и научно-технических проектов, предлагаемых этими кадрами обществу.
К концу 19 века в их среде резко обострилась конкуренция за «место под Солнцем», т.е. за звания, почести и награды, и как следствие этой конкуренции — усилилась поляризация научных кадров по нравственному критерию. Это способствовало взрывной активизации пси-фактора.
Революционный задор молодых, честолюбивых и беспринципных учёных и интеллигенции, опьянённых своей скорой учёностью и нетерпеливым желанием прославиться любой ценой в научном мире, парализовал не только представителей более ответственного и более честного круга учёных, но и всё научное сообщество в целом, с его инфраструктурой и устоявшимися традициями, которые противодействовали раньше безудержному росту пси-фактора.
Интеллигенты-революционеры 19-го века, ниспровергатели тронов и государственного уклада в странах Европы, распространили бандитские методы своей идеологической и политической борьбы со «старым порядком» при помощи бомб, револьверов, ядов и заговоров) также и в область научно-технической деятельности. В студенческих аудиториях, лабораториях и на научных симпозиумах они осмеивали отжившее якобы здравомыслие, устаревшие якобы понятия формальной логики — непротиворечивости суждений, их обоснованность. Таким образом, в начале 20-го века в моду научных диспутов вместо метода убеждения вошёл (точнее — ворвался, с визгом и грохотом) метод тотального подавления своих оппонентов, путём психического, физического и морального насилия над ними. При этом, естественно, значение пси-фактора достигло крайне высокого уровня, испытав в 30-ые годы свой экстремум.
В итоге — в начале 20 века «просвещённая» интеллигенция, фактически насильственным, т.е. революционным, путём сменила истинно научную парадигму гуманизма, просветительства и общественной пользы в естествознании на свою парадигму перманентного релятивизма, придав ей псевдонаучную форму теории всеобщей относительности (цинизма!).
Первая парадигма опиралась на опыт и его всестороннюю оценку ради поиска истины, поиска и осмысления объективных законов природы. Вторая парадигма делала упор на лицемерие и беспринципность; и не для поиска объективных законов природы, а ради своих эгоистических групповых интересов в ущерб обществу. Первая парадигма работала на общественную пользу, в то время как вторая — этого не предполагала.
Начиная с 30-х годов по настоящее время пси-фактор стабилизировался, оставаясь на порядок выше того его значения, которое было в начале и середине 19-го века.
Для более объективной и ясной оценки реального, а не мифического, вклада деятельности мирового научного сообщества (в лице всех национальных академий наук) в общественную и частную жизнь людей, введём понятие нормированного пси-фактора.
Нормированному значению пси-фактора, равному единице, соответствует стопроцентная вероятность получения такого отрицательного результата (т.е. такого общественного вреда) от внедрения в практику научных разработок, декларировавших априори положительный результат (т.е. определённую общественную пользу) за единичный исторический промежуток времени (смена одного поколения людей, порядка 25 лет), при котором всё человечество полностью погибает или вырождается не более чем за 25 лет с момента внедрения определённого блока научных программ.
4. Kill with kindness
Жестокая и грязная победа релятивизма и воинствующего атеизма в умонастроениях всемирного научного сообщества в начале 20-го века — главная причина всех бед человеческих в этом «атомном», «космическом» веке так называемого «научно-технического прогресса». Оглянемся назад,- какие нам нужны ещё доказательства сегодня, чтобы понять очевидное: в 20-ом веке не было ни одного общественно-полезного деяния всемирного братства учёных в области естествознания и общественных науках, которое бы укрепляло популяцию хомо сапиенс, филогенетически и нравственно. А есть как раз обратное: безжалостное калечение, разрушение и уничтожение психо-соматической природы человека, здорового образа его жизни и среды его обитания под разными благовидными предлогами.
В самом начале 20-го века все ключевые академические посты управления ходом исследований, тематикой, финансированием научно-технической деятельности и пр. были оккупированы «братством единомышленников», исповедующих двуединую религию цинизма и эгоизма. В этом — драматизм нашего времени.
Именно воинствующий атеизм и циничный релятивизм, стараниями своих адептов, опутал сознание всех без исключения высших государственных деятелей на нашей Планете. Именно этот двуглавый фетиш антропоцентризма породил и внедрил в сознание миллионов так называемую научную концепцию «всеобщего принципа деградации материи-энергии», т.е. вселенского распада ранее возникших — не весть как — объектов в природе. На место абсолютной фундаментальной сущности (всемирной субстанциональной среды) была поставлена псевдонаучная химера всеобщего принципа деградации энергии, с её мифическим атрибутом — «энтропией».
5. Littera contra littere
По представлениям таких корифеев прошлого как Лейбниц, Ньютон, Торричелли, Лавуазье, Ломоносов, Остроградский, Фарадей, Максвелл, Менделеев, Умов, Дж. Томсон, Кельвин, Г. Герц, Пирогов, Тимирязев, Павлов, Бехтерев и многих, многих других – Всемирная среда – это абсолютная фундаментальная сущность (= субстанция мира = мировой эфир = вся материя Вселенной = «квинтэссенция» Аристотеля), заполняющая изотропно и без остатка всё бесконечное мировое пространство и являющаяся Источником и Носителем всех видов энергии в природе,- неистребимых «сил движения», «сил действия».
В противовес этому, по ныне господствующему в мировой науке представлению,- абсолютной фундаментальной сущностью провозглашена математическая фикция «энтропия», да ещё некая «информация», которую на полном серьёзе мировые академические светилы провозгласили недавно т.н. «Вселенской фундаментальной сущностью», не удосужившись дать этому новому термину развёрнутого определения.
По научной парадигме первых — в мире царит гармония и порядок вечной жизни Вселенной, через постоянные локальные обновления (череду смертей–рождений) отдельных материальных образований разного масштаба.
По псевдонаучной парадигме вторых — мир, непостижимым образом однажды сотворённый, движется в пропасти всеобщей деградации, выравнивания температур ко всеобщей, вселенской смерти под неусыпным контролем некоего Всемирного суперкомпьютера, владеющего и распоряжающегося некоей «информацией».
Одни видят вокруг торжество вечной жизни, а другие видят вокруг распад и смерть, контролируемые неким Всемирным информационным банком.
Борьба этих двух диаметрально противоположных мировоззренческих концепций за господство в умах миллионов людей — центральный пункт биографии человечества. И ставка в этой борьбе — степени наивысшей.
И совершенно не случайно, что весь 20 век мировой научный истеблишмент занят внедрением (якобы как единственно возможных и перспективных) топливной энергетики, теории взрывчатых веществ, синтетических ядов и наркотиков, отравляющих веществ, генной инженерии с клонированием биороботов, с вырождением расы людей до уровня примитивных олигофренов, даунов и психопатов. И эти программы и планы сейчас даже не скрываются от общественности.
Правда жизни такова: наиболее процветающими и могущественными в глобальном масштабе сферами человеческой деятельности, созданными в 20 веке по последнему слову научной мысли, стали: порно- , нарко- , фарма-бизнес, торговля оружием, включая глобальные информационные и психотронные технологии. Их доля в мировом объёме всех финансовых потоков значительно превышает 50%.
Далее. Обезобразив за 1,5 века природу на Земле, мировое академическое братство торопится сейчас «колонизировать» и «покорить» околоземное пространство, имея намерения и научные проекты превращения этого пространства в свалку мусора своих «высоких» технологий. Этих господ-академиков буквально распирает от вожделенной сатанинской идеи похозяйничать и в околосолнечном пространстве, а не только на Земле.
Таким образом, в основании парадигмы всемирного академического братства вольных каменщиков положен камень крайне субъективного идеализма (антропоцентризма), а само здание их т.н. научной парадигмы держится на перманентном и циничном релятивизме и воинствующем атеизме.
Но поступь истинного прогресса неумалима. И, как всё живое на Земле тянется к Светилу, так и разум определённой части современных учёных и естествоиспытателей, не обременённых клановыми интересами всемирного братства,- тянется к солнцу вечной Жизни, вечного движения во Вселенной, через познание фундаментальных истин Бытия и поиска основной целевой функции существования и эволюции вида xomo sapiens. Теперь, рассмотрев природу пси-фактора, займёмся Таблицей Дмитрия Ивановича Менделеева.
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная фальшивка.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание).
И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации настоящей диссертации в журнале ЖРФМ Русского Физического Общества. Подлинная, нефальсифицированная Таблица Д.И. Менделеева «Периодическая система элементов по группам и рядам» (Д. И. Менделеев. Основы химии. VIII издание, СПб., 1906 г.)
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева – сын друга и соратника Д.И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в одиночку — он лишь выполнял заказ. Ведь новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д.И. Менделеева был фальсифицирован.
Главное искажение Таблицы – перенос «нулевой группы». Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент “Х” (по Менделееву — “Ньютоний”), — т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент “Х” есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«…Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую… Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими…
Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через “y”. Ему, очевидно, будут принадлежать коренные свойства аргоновых газов… “Короний”, плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром. Этот элемент “у”, однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу “х”, который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его “Ньютонием” — в честь бессмертного Ньютона… Задачу тяготения и задачи всей энергетики (!!!) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом” (“Попытка химического понимания мирового эфира”. 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше (!!!) элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!!) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года…» (“Основы химии”. VIII изд., 1906 г., стр. 613 и след.).
7. Punctum soliens
Из этих цитат совершенно определённо вытекает нижеследующее.
- Элементы нулевой группы начинают каждый ряд других элементов, располагаясь в левой части Таблицы, «…что составляет строго логическое следствие понимания периодического закона» — Менделеев.
- Особо важное и даже исключительное по смыслу периодического закона место принадлежит элементу “х”,- “Ньютонию”, — мировому эфиру. И располагаться этот особый элемент должен в самом начале всей Таблицы, в так называемой “нулевой группе нулевого ряда”. Более того, — являясь системообразующим элементом (точнее — системообразующей сущностью) всех элементов Таблицы Менделеева, мировой эфир — это субстанциональный аргумент всего многообразия элементов Таблицы Менделеева. Сама же Таблица, в этой связи, выступает в роли закрытого функционала этого самого аргумента.
Теперь обратимся к трудам первых фальсификаторов Таблицы Менделеева.
8. Corpus delicti
Чтобы вытравить из сознания всех последующих поколений учёных идею исключительной роли мирового эфира (а этого как раз и требовала новая парадигма релятивизма), специально были перенесены элементы нулевой группы из левой части Таблицы Менделеева в правую часть, сместив на ряд ниже соответствующие элементы и совместив нулевую группу с т.н. «восьмой». Разумеется, ни элементу “у”, ни элементу “х” в фальсифицированной таблице места не осталось.
Но и этого показалось мало братству релятивистов. С точностью до наоборот искажена основополагающая мысль Д.И. Менделеева об особо важной роли мирового эфира. В частности, в предисловии к первому фальсифицированному варианту Периодического закона Д.И. Менделеева, нисколько не смущаясь, Б.М. Меншуткин заявляет, что Менделеев якобы всегда выступал против особой роли мирового эфира в природных процессах. Вот выдержка из бесподобной по цинизму статьи Б.Н. Меншуткина:
«Таким образом (?!) мы снова возвращаемся к тому воззрению, против которого (?!) всегда (?!!!) выступал Д. И. Менделеев, которое с самых древних времён существовало среди философов, считавших все видимые и известные вещества и тела составленными из одного и того же первичного вещества греческих философов (“протэюлэ” греческих философов, prima materia – римских). Эта гипотеза всегда находила себе приверженцев в силу своей простоты и в учениях философов называлась гипотезой единства материи или гипотезой унитарной материи
». (Б.Н. Меншуткин. “Д. И. Менделеев. Периодический закон”. Под редакцией и со статьёй о современном положении периодического закона Б. Н. Меншуткина. Государственное Издательство, М-Л., 1926).
9. In rerum natura
Оценивая взгляды Д. И. Менделеева и его недобросовестных оппонентов, необходимо заметить следующее.
Скорее всего, Менделеев невольно ошибался в том, что «мировой эфир»- это «элементарное вещество» (т.е. «химический элемент» — в современном смысле этого термина). Скорее всего, «мировой эфир» — это истинная субстанция; и как таковая, в строгом смысле — не «вещество»; и она не обладает «элементарным химизмом» т.е. не обладает «предельно малым атомным весом» с «чрезвычайно быстрым собственным частичным движением».
Пусть Д.И. Менделеев ошибался в «вещественности», «химизме» эфира. В конце концов это терминологический просчёт великого учёного; и в его время это простительно, ибо тогда эти термины были ещё достаточно размыты, только входя в научный оборот. Но совершенно ясно другое: Дмитрий Иванович был совершенно прав в том, что «мировой эфир» это всё образующая сущность,- квинтэссенция, субстанция, из которой состоит весь мир вещей (вещественный мир) и в которой все вещественные образования пребывают. Прав Дмитрий Иванович и в том, что эта субстанция передаёт энергию на расстояния и не обладает никакой химической активностью. Последнее обстоятельство только подтверждает нашу мысль о том, что Д.И. Менделеев сознательно выделил элемент “х”, как исключительную сущность.
Итак, «мировой эфир», т.е. субстанция Вселенной, — изотропен, не имеет частичного строения, а является абсолютной (т.е. предельной, основополагающей, фундаментальной всеобщей) сущностью Мироздания, Вселенной. И именно потому, как правильно подметил Д.И. Менделеев,- мировой эфир «не способен к химическим взаимодействиям», а значит и не является “химическим элементом”, т.е. «элементарным веществом» — в современном смысле этих терминов.
Прав был Дмитрий Иванович и в том, что мировой эфир — переносчик энергии на расстояния. Скажем больше: мировой эфир, как субстанция Мира, не только переносчик, но и «хранитель», и «носитель» всех видов энергии (“сил действия”) в природе.
Из глубины веков Д.И. Менделееву вторит другой выдающийся учёный — Торричелли (1608 — 1647): «Энергия — есть квинтэссенция такой тонкой природы, что она не может содержаться ни в каком другом сосуде, как только в самой сокровенной субстанции материальных вещей».
Итак, по Менделееву и Торричелли мировой эфир это
самая сокровенная субстанция материальных вещей
. Именно поэтому менделеевский «Ньютоний» — не просто в нулевом ряду нулевой группы его периодической системы, а это — своеобразная «корона» всей его таблицы химических элементов. Корона, которая образует все химические элементы в мире, т.е. всё вещество. Эта Корона (“Матерь”, “Материя-субстанция” всякого вещества) есть Природная среда, приводимая в движение и побуждаемая к изменениям — по нашим расчётам — другой (второй) абсолютной сущностью, которую мы назвали «Субстанциональным потоком первичной фундаментальной информации о формах и способах движения Материи во Вселенной». Подробнее об этом — в журнале “Русская Мысль”, 1-8, 1997, стр. 28-31.
Математическим символом мирового эфира мы выбрали “О”, ноль, а семантическим – «лоно». В свою очередь математическим символом Субстанционального потока мы выбрали “1”, единицу, а семантическим — «один». Таким образом, исходя из вышеуказанной символики, появляется возможность лаконично выразить в одном математическом выражении совокупность всех возможных форм и способов движения материи в природе:
Это выражение математически определяет т.н. открытый интервал пересечения двух множеств, — множества “О” и множества “1”, в то время как семантическое определение этого выражения — «один в лоно» или иначе: Субстанциональный поток первичной фундаментальной информации о формах и способах движения Материи-субстанции полностью пронизывает эту Материю-субстанцию, т.е. мировой эфир.
В религиозных доктринах этот «открытый интервал» облечён в образную форму Вселенского акта творения Богом всего вещества в Мире из Материи-субстанции, с Которой Он непрерывно пребывает в состоянии плодоносного совокупления.
Автор данной статьи отдаёт себе отчёт в том, что эта математическая конструкция была в своё время навеяна ему опять же, как не покажется странным,- идеями незабвенного Д.И. Менделеева, высказанными им в его работах (см., например, статью «Попытка химического понимания мирового эфира»). Теперь настала пора подвести итог нашим исследованиям, изложенным в данной диссертации.
10. Errata: ferro et igni
Безапелляционное и циничное игнорирование мировой наукой места и роли мирового эфира в природных процессах (и в Таблице Менделеева!) как раз и породило всю гамму проблем человечества в нашем технократическом веке.
Главная из этих проблем — топливно-энергетическая.
Именно игнорирование роли мирового эфира позволяет учёным делать ложный (и лукавый – одновременно) вывод, будто добывать полезную энергию для своих повседневных нужд человек может лишь сжигая, т.е. безвозвратно разрушая вещество (топливо). Отсюда и ложный тезис об отсутствии у нынешней топливной энергетики реальной альтернативы. А раз так, то остаётся, якобы, только одно: плодить атомную (экологически самую грязную!) энергетику и газо-нефте-угле-добычу, засоряя и отравляя безмерно собственную среду обитания.
Именно игнорирование роли мирового эфира толкает всех современных учёных-ядерщиков на лукавый поиск «спасения» в расщеплении атомов и элементарных частиц на специальных дорогостоящих синхротронных ускорителях. В ходе этих чудовищных и чрезвычайно опасных по своим последствиям экспериментов хотят обнаружить и в дальнейшем использовать якобы «во благо» т.н. «кварк-глюонную плазму», по их ложным представлениям — как бы «пред-материю» (термин самих ядерщиков), согласно их ложной космологической теории т.н. «Большого взрыва Вселенной».
Достойно замечания, по нашим расчётам, что если эта т.н. «самая сокровенная мечта всех современных физиков-ядерщиков» ненароком будет достигнута, то это будет скорее всего рукотворным концом всякой жизни на земле и концом самой планеты земля,- воистину «Большим взрывом» в глобальном масштабе, но только не понарошку, а взаправду.
Поэтому нужно как можно быстрее остановить это безумное экспериментирование мировой академической науки, которая с головы до ног поражена ядом пси-фактора и которая, похоже, даже не представляет себе возможных катастрофических последствий этих своих безумных паранаучных затей.
Прав оказался Д. И. Менделеев, – «Задачу тяготения и задачи всей энергетики нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояниях».
Прав оказался Д. И. Менделеев и в том, что “когда-нибудь догадаются, что вручать дела данной промышленности лицам, ею живущим, не ведёт к наилучшим следствиям, хотя послушать таких лиц преполезно”.
«Основной смысл сказанного лежит в том, что интересы общие, вечные и прочные зачастую не совпадают с личными и временными, даже нередко одни другим противоречат, и, на мой взгляд, предпочитать надо — если помирить уже нельзя — первые, а не вторые. В этом и драматизм нашего времени
». Д. И. Менделеев. “Мысли к познанию России”. 1906 г.
Итак, мировой эфир есть субстанция всякого химического элемента и значит — всякого вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир – это исток и венец всей подлинной Таблицы Менделеева, её начало и конец,- альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
Вероятно, все вы видели периодическую таблицу элементов. Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Периодическая таблица (или ПТ, как мы будем периодически называть её в этой статье), а также те элементы, которые входят в неё, обладают чертами, о которых вы, возможно, никогда не догадывались. Вот десять фактов, начиная от создания таблицы и до внесения в неё последних элементов, которые большинству людей не известны.
10. Менделееву помогали
Периодическая таблица стала использоваться, начиная с 1869 года, когда она была составлена заросшим густой бородой Димитрием Менделеевым. Большинство людей думает, что Менделеев был единственным, кто работал над этой таблицей, и благодаря этому он стал самым гениальным химиком столетия. Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.
Менделеев широко известен как отец периодической таблицы, но, когда он её составлял, ещё не все элементы таблицы были уже открыты. Как такое стало возможно? Учёные славятся своим безумием…
9. Последние добавленные элементы
Верьте или нет, периодическая таблица не сильно менялась с 1950-х годов. Однако 2 декабря 2016 года было добавлено сразу четыре новых элемента: нихоний (элемент №113), московий (элемент №115), тенессин (элемент №117) и оганесон (элемент №118). Эти новые элементы получили свои названия только в июне 2016 года, так как потребовалась пятимесячная экспертиза, прежде чем их официально добавили в ПТ.
Три элемента получили свои названия в честь городов или государств, в которых их удалось получить, а оганесон был назван в честь российского физика-ядерщика Юрия Оганесяна за его вклад в получение этого элемента.
8. Какой буквы нет в таблице?
В латинском алфавите есть 26 букв, и каждая из них важна. Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Говорят, что «единица» — это цифра одиноких. Так, может, стоило бы назвать букву «J» буквой одиноких? Но вот забавный факт: большинство мальчиков, родившихся в США в 2000 году, получили имена, начинавшиеся с этой буквы. Таким образом, эта буква не осталась без должного внимания.
7. Синтезированные элементы
Как вы, возможно, уже знаете, на сегодняшний день в периодической таблице присутствует 118 элементов. Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.
Вам кажется, что 28 искусственно созданных элементов — это много? Ну, просто поверьте на слово. Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
6. 137-й элемент
В середине 20-го века известный учёный по имени Ричард Фейнман сделал довольно громкое заявление, которое повергло в изумление весь научный мир нашей планеты. По его словам, если мы когда-нибудь обнаружим 137-й элемент, то мы не сможем определить количество в нём протонов и нейтронов. Число 1/137 примечательно тем, что это значение константы тонкой структуры, которая описывает вероятность поглощения или излучения электроном фотона. Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света. Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.
Вы ещё не устали от физики? Возможно, вам будет интересно узнать, что число 137 объединяет три важнейших области физики: теорию о скорости света, квантовую механику и электромагнетизм. С начала 1900-х годов физики предполагают, что цифра 137 может быть основой Великой единой теории, в которую войдут все три вышеуказанных области. По общему признанию, это звучит так же невероятно, как легенды о НЛО и о Бермудском треугольнике.
5. Что можно сказать о названиях?
Почти все названия элементов имеют какой-то смысл, хотя он и не сразу понятен. Названия новым элементам даются не произвольно. Я бы назвал элемент просто первым пришедшим мне в голову словом. Например, «керфлумп». По-моему, неплохо.
Как правило, названия элементов относятся к одной из пяти основных категорий. Первая — это имена известных учёных, классический вариант — эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
И, наконец, есть названия, описывающие свойства элементов. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «медленный». Из названия следует предположение, что этот газ не отличается активностью. Бром — это ещё один элемент, название которого происходит от греческого слова. «Бромос» означает «зловоние», и это довольно точно описывает запах брома.
4. Было ли создание таблицы «озарением»
Если вы любите карточные игры, то этот факт для вас. Менделееву требовалось каким-то образом упорядочить все элементы и найти систему для этого. Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Многие не могут сложить и обычный пасьянс, так что этот пасьянс впечатляет. Что будет дальше? Наверное, кто-нибудь с помощью шахмат сделает переворот в астрофизике или создаст ракету, способную долететь до окраин галактики. Представляется, что в этом не будет ничего необычного, если учесть, что Менделеев сумел получить такой гениальный результат всего лишь с помощью колоды обычных игральных карт.
3. Невезучие инертные газы
Помните, как мы классифицировали аргон как самый «ленивый» и «медленный» элемент в истории нашей вселенной? Похоже, что Менделеевым овладели такие же чувства. Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Ещё более поразительно, что аргон был не единственным элементом, который изначально постигла эта судьба. Помимо аргона, без классификации остались ещё пять других элементов. Это коснулось радона, неона, криптона, гелия и ксенона — и все отрицали их существование просто потому, что Менделеев не смог найти для них места в таблице. После нескольких лет перегруппировки и переклассификации этим элементам (названных инертными газами) всё-таки посчастливилось присоединиться к достойному клубу признанных реально существующими.
2. Атомная любовь
Совет для всех тех, кто считает себя романтиком. Возьмите бумажную копию периодической таблицы и вырежьте из неё все сложные и относительно ненужные средние столбцы так, чтобы у вас осталось 8 колонок (вы получите «короткую» форму таблицы). Сложите её посредине IV группы — и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Элементы, которые «целуются» при складывании, способны образовывать стабильные соединения. Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой — тогда я не знаю, что такое любовь.
1. Углерод рулит
Углерод пытается быть в центре игры. Вы думаете, что всё знаете об углероде, но это не так, он занимает намного более важное место, чем вы это себе представляете. Знаете ли вы, что он присутствует более чем в половине всех известных соединений? И как насчёт того факта, что 20 процентов веса всех живых организмов приходится на углерод? Это действительно странно, но приготовьтесь: каждый атом углерода в вашем теле был когда-то частью фракции углекислого газа в атмосфере. Углерод является не только суперэлементом нашей планеты, он четвёртый по численности элемент во всей Вселенной.
Если периодическую таблицу сравнить с вечеринкой, то углерод — её главный ведущий. И кажется, что он единственный знает, как нужно всё правильно организовать. Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка
– этап формулирования основной задачи и первые попытки её решения; - Инкубация
– этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне; - Озарение
– этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации; - Проверка
– этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева
бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы
в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева
все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева
систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона
химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов
.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)
.
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами
называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом
называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера
химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами
называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , R 2 O 7 , RO 4 , где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R 2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO 2 , R 2 O 5 , RO 3 , R 2 O 7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH 4 , RH 3 , RH 2 , RH.
Соединения RH 4 имеют нейтральный характер; RH 3 — слабоосновный; RH 2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом
называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы
из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы
из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды
— это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды
занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены
представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах
все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
Переходные металлы
Переходные металлы
занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды
занимают группы 13-16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
Постпереходными металлами
Элементы, называемые постпереходными металлами
, относятся к группам 13-15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Флеровий Fl 114 Унунсептий Uus 117
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Эфир в таблице Менделеева
О
фициально преподаваемая в школах и ВУЗах таблица химических элементов Менделеева- фальсификат. Сам Менделеев в работе под названием «Попытка химического понимания мирового эфира» привёл несколько иную таблицу (Политехнический музей, Москва):
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание). Отличия видны: нулевая группа перенесена в 8-ю, а элемент легче водорода, с которой должна начинаться таблица и который условно назван Ньютонием (эфир),- вообще исключён.
Эта же таблица увековечена «кровавым тираном» тов. Сталиным в Санкт-Петербурге, Московский просп. 19. ВНИИМ им. Д. И. Менделеева (Всероссийский научно-исследовательский институт метрологии)
Памятник-таблица Периодическая система химических элементов Д.И. Менделеева выполнен мозаикой под руководством профессора Академии художеств В.А. Фролова (архитектурное оформление Кричевского). В основу памятника положена таблица из последнего прижизненного 8-го издания (1906 г.) Основ химии Д.И. Менделеева. Элементы, открытые при жизни Д.И. Менделеева обозначены красным цветом. Элементы, открытые с 1907 по 1934 гг. , обозначены синим цветом. Высота памятника-таблицы — 9 м. общая площадь 69 кв. м
Почему и как случилось, что нам столь открыто лгут?
Место и роль мирового эфира в истинной таблице Д.И. Менделеева
1. Suprema lex – salus populi
Многие слышали о Дмитрии Ивановиче Менделееве и об открытом им в 19-м веке (1869 г.) «Периодическом законе изменения свойств химических элементов по группам и рядам» (авторское название таблицы — «Периодическая система элементов по группам и рядам»).
Многие слышали также, что Д.И. Менделеев был организатором и бессменным руководителем (1869-1905 гг.) российского общественного научного объединения под названием «Русское Химическое Общество» (с 1872 года — «Русское Физико-Химическое Общество»), издававшее во всё время своего существования всемирно известный журнал ЖРФХО, вплоть до момента ликвидации Академией Наук СССР в 1930 году — и Общества, и его журнала.
Но мало тех, кто знает, что Д.И. Менделеев был одним из последних всемирно известных русских учёных конца 19-го века, кто отстаивал в мировой науке идею эфира как всемирной субстанциональной сущности, кто придавал ей фундаментальное научное и прикладное значение в раскрытии тайн Бытия и для улучшения народнохозяйственной жизни людей.
Ещё меньше тех, кто знает, что после скоропостижной (!!?) смерти Д.И. Менделеева (27.01.1907), признанного тогда выдающимся учёным всеми научными сообществами во всём мире кроме одной только Петербургской Академии Наук, его главное открытие — «Периодический закон» — было умышленно и повсеместно фальсифицировано мировой академической наукой.
И уж совсем мало тех, кто знает, что всё выше перечисленное связано воедино нитью жертвенного служения лучших представителей и носителей бессмертной Русской Физической Мысли благу народов, общественной пользе, вопреки нараставшей волне безответственности в высших слоях общества того времени.
В сущности, всестороннему развитию последнего тезиса и посвящена настоящая диссертация, ибо в подлинной науке любое пренебрежение существенными факторами всегда приводит к ложным результатам. Итак,- вопрос: почему учёные врут?
2. Psy-faktor: ni foi, ni loi
Это только сейчас, с конца 20-го века, общество начинает понимать (да и то робко) на практических примерах, что выдающийся и высококвалифицированный, но безответственный, циничный, безнравственный учёный с «мировым именем» не менее опасен для людей, чем выдающийся, но безнравственный политик, военный, юрист или в лучшем случае — «выдающийся» бандит с большой дороги.
Обществу внушили мысль, будто мировая академическая научная среда — это каста небожителей, монахов, святых отцов, которые дённо и нощно пекутся о благе народов. А простые смертные должны попросту смотреть в рот своим благодетелям, безропотно финансируя и реализуя все их “научные” прожекты, прогнозы и предписания по переустройству своей общественной и частной жизни.
На самом деле уголовно-преступного элемента в мировой научной среде ничуть не меньше, нежели в среде тех же политиков. Кроме того, — преступные, анти-общественные деяния политиков чаще всего видны сразу, а вот преступная и вредная, но «научно обоснованная» деятельность «видных» и «авторитетных» учёных распознаётся обществом далеко не сразу, а спустя годы, а то и десятилетия, на своей собственной «общественной шкуре».
Продолжим далее наше исследование этого чрезвычайно интересного (и засекреченного!) психофизиологического фактора научной деятельности (назовём его условно пси-фактором), в результате которого апостериори получается неожиданный (?!) отрицательный результат: «хотели как лучше для людей, а получилось как всегда, т.е. во вред». Ведь в науке отрицательный результат — это тоже результат, безусловно требующий всестороннего научного осмысления.
Рассматривая корреляцию между пси-фактором и основной целевой функцией (ОЦФ) государственного финансирующего органа, мы приходим к любопытному выводу: так называемая чистая, большая наука прошлых веков к настоящему моменту времени выродилась в касту неприкасаемых, т.е. в закрытую ложу придворных знахарей, блестяще освоивших науку обмана, блестяще владеющих наукой преследования инакомыслящих и наукой прислужничества перед своими власть имущими финансистами.
При этом необходимо иметь в виду, что, во-первых, во всех т.н. «цивилизованных странах» их т.н. «национальные академии наук» формально имеют статус государственных организаций с правами ведущего научного экспертного органа соответствующего правительства. Во-вторых, все эти национальные академии наук объединены между собой в единую жёсткую иерархическую структуру (подлинного названия которой мир не знает), вырабатывающую единую для всех национальных академий наук стратегию поведения в мире и единую т.н. научную парадигму, стержнем которой является отнюдь не раскрытие закономерностей бытия, а пси-фактор: осуществляя в качестве «придворных знахарей» так называемое «научное» прикрытие (для солидности) всех неблаговидных деяний власть имущих в глазах общества, стяжать себе славу жрецов и пророков, влияющих подобно демиургу на сам ход движения истории человечества.
Всё выше изложенное в этом разделе, включая и введённый нами термин «пси-фактор», было с большой точностью, обоснованно, предсказано Д.И. Менделеевым более 100 лет тому назад (см. например его аналитическую статью 1882 года «Какая же Академия нужна в России?», в которой Дмитрий Иванович фактически даёт развёрнутую характеристику пси-фактора и в которой им предлагалась программа радикальной реорганизации замкнутой учёной корпорации членов Российской Академии Наук, рассматривавших Академию исключительно лишь как кормушку для удовлетворения своих шкурных интересов.
В одном из своих писем 100-летней давности профессору Киевского университета П.П. Алексееву Д.И. Менделеев откровенно признался, что «готов хоть сам себя кадить, чтобы чёрта выкурить, иначе сказать, — чтобы основы академии преобразовать во что-нибудь новое, русское, своё, годное для всех вообще и, в частности, для научного движения в России».
Как мы видим, истинно великому учёному, гражданину и патриоту своей Родины по силам даже сложнейшие долгосрочные научные прогнозы. Рассмотрим теперь исторический аспект изменения этого пси-фактора, открытого Д.И. Менделеевым в конце 19 века.
3. Fin de siecle
Со второй половины 19-го века в Европе на волне «либерализма» произошёл бурный численный рост интеллигенции, научно-технических кадров и количественный рост теорий, идей и научно-технических проектов, предлагаемых этими кадрами обществу.
К концу 19 века в их среде резко обострилась конкуренция за «место под Солнцем», т.е. за звания, почести и награды, и как следствие этой конкуренции — усилилась поляризация научных кадров по нравственному критерию. Это способствовало взрывной активизации пси-фактора.
Революционный задор молодых, честолюбивых и беспринципных учёных и интеллигенции, опьянённых своей скорой учёностью и нетерпеливым желанием прославиться любой ценой в научном мире, парализовал не только представителей более ответственного и более честного круга учёных, но и всё научное сообщество в целом, с его инфраструктурой и устоявшимися традициями, которые противодействовали раньше безудержному росту пси-фактора.
Интеллигенты-революционеры 19-го века, ниспровергатели тронов и государственного уклада в странах Европы, распространили бандитские методы своей идеологической и политической борьбы со «старым порядком» при помощи бомб, револьверов, ядов и заговоров) также и в область научно-технической деятельности. В студенческих аудиториях, лабораториях и на научных симпозиумах они осмеивали отжившее якобы здравомыслие, устаревшие якобы понятия формальной логики — непротиворечивости суждений, их обоснованность. Таким образом, в начале 20-го века в моду научных диспутов вместо метода убеждения вошёл (точнее — ворвался, с визгом и грохотом) метод тотального подавления своих оппонентов, путём психического, физического и морального насилия над ними. При этом, естественно, значение пси-фактора достигло крайне высокого уровня, испытав в 30-ые годы свой экстремум.
В итоге — в начале 20 века «просвещённая» интеллигенция, фактически насильственным, т.е. революционным, путём сменила истинно научную парадигму гуманизма, просветительства и общественной пользы в естествознании на свою парадигму перманентного релятивизма, придав ей псевдонаучную форму теории всеобщей относительности (цинизма!).
Первая парадигма опиралась на опыт и его всестороннюю оценку ради поиска истины, поиска и осмысления объективных законов природы. Вторая парадигма делала упор на лицемерие и беспринципность; и не для поиска объективных законов природы, а ради своих эгоистических групповых интересов в ущерб обществу. Первая парадигма работала на общественную пользу, в то время как вторая — этого не предполагала.
Начиная с 30-х годов по настоящее время пси-фактор стабилизировался, оставаясь на порядок выше того его значения, которое было в начале и середине 19-го века.
Для более объективной и ясной оценки реального, а не мифического, вклада деятельности мирового научного сообщества (в лице всех национальных академий наук) в общественную и частную жизнь людей, введём понятие нормированного пси-фактора.
Нормированному значению пси-фактора, равному единице, соответствует стопроцентная вероятность получения такого отрицательного результата (т.е. такого общественного вреда) от внедрения в практику научных разработок, декларировавших априори положительный результат (т.е. определённую общественную пользу) за единичный исторический промежуток времени (смена одного поколения людей, порядка 25 лет), при котором всё человечество полностью погибает или вырождается не более чем за 25 лет с момента внедрения определённого блока научных программ.
4. Kill with kindness
Жестокая и грязная победа релятивизма и воинствующего атеизма в умонастроениях всемирного научного сообщества в начале 20-го века — главная причина всех бед человеческих в этом «атомном», «космическом» веке так называемого «научно-технического прогресса». Оглянемся назад,- какие нам нужны ещё доказательства сегодня, чтобы понять очевидное: в 20-ом веке не было ни одного общественно-полезного деяния всемирного братства учёных в области естествознания и общественных науках, которое бы укрепляло популяцию хомо сапиенс, филогенетически и нравственно. А есть как раз обратное: безжалостное калечение, разрушение и уничтожение психо-соматической природы человека, здорового образа его жизни и среды его обитания под разными благовидными предлогами.
В самом начале 20-го века все ключевые академические посты управления ходом исследований, тематикой, финансированием научно-технической деятельности и пр. были оккупированы «братством единомышленников», исповедующих двуединую религию цинизма и эгоизма. В этом — драматизм нашего времени.
Именно воинствующий атеизм и циничный релятивизм, стараниями своих адептов, опутал сознание всех без исключения высших государственных деятелей на нашей Планете. Именно этот двуглавый фетиш антропоцентризма породил и внедрил в сознание миллионов так называемую научную концепцию «всеобщего принципа деградации материи-энергии», т.е. вселенского распада ранее возникших — не весть как — объектов в природе. На место абсолютной фундаментальной сущности (всемирной субстанциональной среды) была поставлена псевдонаучная химера всеобщего принципа деградации энергии, с её мифическим атрибутом — «энтропией».
5. Littera contra littere
По представлениям таких корифеев прошлого как Лейбниц, Ньютон, Торричелли, Лавуазье, Ломоносов, Остроградский, Фарадей, Максвелл, Менделеев, Умов, Дж. Томсон, Кельвин, Г. Герц, Пирогов, Тимирязев, Павлов, Бехтерев и многих, многих других – Всемирная среда – это абсолютная фундаментальная сущность (= субстанция мира = мировой эфир = вся материя Вселенной = «квинтэссенция» Аристотеля), заполняющая изотропно и без остатка всё бесконечное мировое пространство и являющаяся Источником и Носителем всех видов энергии в природе,- неистребимых «сил движения», «сил действия».
В противовес этому, по ныне господствующему в мировой науке представлению,- абсолютной фундаментальной сущностью провозглашена математическая фикция «энтропия», да ещё некая «информация», которую на полном серьёзе мировые академические светилы провозгласили недавно т.н. «Вселенской фундаментальной сущностью», не удосужившись дать этому новому термину развёрнутого определения.
По научной парадигме первых — в мире царит гармония и порядок вечной жизни Вселенной, через постоянные локальные обновления (череду смертей–рождений) отдельных материальных образований разного масштаба.
По псевдонаучной парадигме вторых — мир, непостижимым образом однажды сотворённый, движется в пропасти всеобщей деградации, выравнивания температур ко всеобщей, вселенской смерти под неусыпным контролем некоего Всемирного суперкомпьютера, владеющего и распоряжающегося некоей «информацией».
Одни видят вокруг торжество вечной жизни, а другие видят вокруг распад и смерть, контролируемые неким Всемирным информационным банком.
Борьба этих двух диаметрально противоположных мировоззренческих концепций за господство в умах миллионов людей — центральный пункт биографии человечества. И ставка в этой борьбе — степени наивысшей.
И совершенно не случайно, что весь 20 век мировой научный истеблишмент занят внедрением (якобы как единственно возможных и перспективных) топливной энергетики, теории взрывчатых веществ, синтетических ядов и наркотиков, отравляющих веществ, генной инженерии с клонированием биороботов, с вырождением расы людей до уровня примитивных олигофренов, даунов и психопатов. И эти программы и планы сейчас даже не скрываются от общественности.
Правда жизни такова: наиболее процветающими и могущественными в глобальном масштабе сферами человеческой деятельности, созданными в 20 веке по последнему слову научной мысли, стали: порно- , нарко- , фарма-бизнес, торговля оружием, включая глобальные информационные и психотронные технологии. Их доля в мировом объёме всех финансовых потоков значительно превышает 50%.
Далее. Обезобразив за 1,5 века природу на Земле, мировое академическое братство торопится сейчас «колонизировать» и «покорить» околоземное пространство, имея намерения и научные проекты превращения этого пространства в свалку мусора своих «высоких» технологий. Этих господ-академиков буквально распирает от вожделенной сатанинской идеи похозяйничать и в околосолнечном пространстве, а не только на Земле.
Таким образом, в основании парадигмы всемирного академического братства вольных каменщиков положен камень крайне субъективного идеализма (антропоцентризма), а само здание их т.н. научной парадигмы держится на перманентном и циничном релятивизме и воинствующем атеизме.
Но поступь истинного прогресса неумалима. И, как всё живое на Земле тянется к Светилу, так и разум определённой части современных учёных и естествоиспытателей, не обременённых клановыми интересами всемирного братства,- тянется к солнцу вечной Жизни, вечного движения во Вселенной, через познание фундаментальных истин Бытия и поиска основной целевой функции существования и эволюции вида xomo sapiens. Теперь, рассмотрев природу пси-фактора, займёмся Таблицей Дмитрия Ивановича Менделеева.
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная фальшивка.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание).
И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации настоящей диссертации в журнале ЖРФМ Русского Физического Общества. Подлинная, нефальсифицированная Таблица Д.И. Менделеева «Периодическая система элементов по группам и рядам» (Д. И. Менделеев. Основы химии. VIII издание, СПб., 1906 г.)
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева – сын друга и соратника Д.И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в одиночку — он лишь выполнял заказ. Ведь новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д.И. Менделеева был фальсифицирован.
Главное искажение Таблицы – перенос «нулевой группы». Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент “Х” (по Менделееву — “Ньютоний”), — т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент “Х” есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«…Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую… Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими…
Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через “y”. Ему, очевидно, будут принадлежать коренные свойства аргоновых газов… “Короний”, плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром. Этот элемент “у”, однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу “х”, который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его “Ньютонием” — в честь бессмертного Ньютона… Задачу тяготения и задачи всей энергетики (!!!) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом” (“Попытка химического понимания мирового эфира”. 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше (!!!) элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!!) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года…» (“Основы химии”. VIII изд., 1906 г., стр. 613 и след.).
7. Punctum soliens
Из этих цитат совершенно определённо вытекает нижеследующее.
- Элементы нулевой группы начинают каждый ряд других элементов, располагаясь в левой части Таблицы, «…что составляет строго логическое следствие понимания периодического закона» — Менделеев.
- Особо важное и даже исключительное по смыслу периодического закона место принадлежит элементу “х”,- “Ньютонию”, — мировому эфиру. И располагаться этот особый элемент должен в самом начале всей Таблицы, в так называемой “нулевой группе нулевого ряда”. Более того, — являясь системообразующим элементом (точнее — системообразующей сущностью) всех элементов Таблицы Менделеева, мировой эфир — это субстанциональный аргумент всего многообразия элементов Таблицы Менделеева. Сама же Таблица, в этой связи, выступает в роли закрытого функционала этого самого аргумента.
Теперь обратимся к трудам первых фальсификаторов Таблицы Менделеева.
8. Corpus delicti
Чтобы вытравить из сознания всех последующих поколений учёных идею исключительной роли мирового эфира (а этого как раз и требовала новая парадигма релятивизма), специально были перенесены элементы нулевой группы из левой части Таблицы Менделеева в правую часть, сместив на ряд ниже соответствующие элементы и совместив нулевую группу с т.н. «восьмой». Разумеется, ни элементу “у”, ни элементу “х” в фальсифицированной таблице места не осталось.
Но и этого показалось мало братству релятивистов. С точностью до наоборот искажена основополагающая мысль Д.И. Менделеева об особо важной роли мирового эфира. В частности, в предисловии к первому фальсифицированному варианту Периодического закона Д.И. Менделеева, нисколько не смущаясь, Б.М. Меншуткин заявляет, что Менделеев якобы всегда выступал против особой роли мирового эфира в природных процессах. Вот выдержка из бесподобной по цинизму статьи Б.Н. Меншуткина:
«Таким образом (?!) мы снова возвращаемся к тому воззрению, против которого (?!) всегда (?!!!) выступал Д. И. Менделеев, которое с самых древних времён существовало среди философов, считавших все видимые и известные вещества и тела составленными из одного и того же первичного вещества греческих философов (“протэюлэ” греческих философов, prima materia – римских). Эта гипотеза всегда находила себе приверженцев в силу своей простоты и в учениях философов называлась гипотезой единства материи или гипотезой унитарной материи
». (Б.Н. Меншуткин. “Д. И. Менделеев. Периодический закон”. Под редакцией и со статьёй о современном положении периодического закона Б. Н. Меншуткина. Государственное Издательство, М-Л., 1926).
9. In rerum natura
Оценивая взгляды Д. И. Менделеева и его недобросовестных оппонентов, необходимо заметить следующее.
Скорее всего, Менделеев невольно ошибался в том, что «мировой эфир»- это «элементарное вещество» (т.е. «химический элемент» — в современном смысле этого термина). Скорее всего, «мировой эфир» — это истинная субстанция; и как таковая, в строгом смысле — не «вещество»; и она не обладает «элементарным химизмом» т.е. не обладает «предельно малым атомным весом» с «чрезвычайно быстрым собственным частичным движением».
Пусть Д.И. Менделеев ошибался в «вещественности», «химизме» эфира. В конце концов это терминологический просчёт великого учёного; и в его время это простительно, ибо тогда эти термины были ещё достаточно размыты, только входя в научный оборот. Но совершенно ясно другое: Дмитрий Иванович был совершенно прав в том, что «мировой эфир» это всё образующая сущность,- квинтэссенция, субстанция, из которой состоит весь мир вещей (вещественный мир) и в которой все вещественные образования пребывают. Прав Дмитрий Иванович и в том, что эта субстанция передаёт энергию на расстояния и не обладает никакой химической активностью. Последнее обстоятельство только подтверждает нашу мысль о том, что Д.И. Менделеев сознательно выделил элемент “х”, как исключительную сущность.
Итак, «мировой эфир», т.е. субстанция Вселенной, — изотропен, не имеет частичного строения, а является абсолютной (т.е. предельной, основополагающей, фундаментальной всеобщей) сущностью Мироздания, Вселенной. И именно потому, как правильно подметил Д.И. Менделеев,- мировой эфир «не способен к химическим взаимодействиям», а значит и не является “химическим элементом”, т.е. «элементарным веществом» — в современном смысле этих терминов.
Прав был Дмитрий Иванович и в том, что мировой эфир — переносчик энергии на расстояния. Скажем больше: мировой эфир, как субстанция Мира, не только переносчик, но и «хранитель», и «носитель» всех видов энергии (“сил действия”) в природе.
Из глубины веков Д.И. Менделееву вторит другой выдающийся учёный — Торричелли (1608 — 1647): «Энергия — есть квинтэссенция такой тонкой природы, что она не может содержаться ни в каком другом сосуде, как только в самой сокровенной субстанции материальных вещей».
Итак, по Менделееву и Торричелли мировой эфир это
самая сокровенная субстанция материальных вещей
. Именно поэтому менделеевский «Ньютоний» — не просто в нулевом ряду нулевой группы его периодической системы, а это — своеобразная «корона» всей его таблицы химических элементов. Корона, которая образует все химические элементы в мире, т.е. всё вещество. Эта Корона (“Матерь”, “Материя-субстанция” всякого вещества) есть Природная среда, приводимая в движение и побуждаемая к изменениям — по нашим расчётам — другой (второй) абсолютной сущностью, которую мы назвали «Субстанциональным потоком первичной фундаментальной информации о формах и способах движения Материи во Вселенной». Подробнее об этом — в журнале “Русская Мысль”, 1-8, 1997, стр. 28-31.
Математическим символом мирового эфира мы выбрали “О”, ноль, а семантическим – «лоно». В свою очередь математическим символом Субстанционального потока мы выбрали “1”, единицу, а семантическим — «один». Таким образом, исходя из вышеуказанной символики, появляется возможность лаконично выразить в одном математическом выражении совокупность всех возможных форм и способов движения материи в природе:
Это выражение математически определяет т.н. открытый интервал пересечения двух множеств, — множества “О” и множества “1”, в то время как семантическое определение этого выражения — «один в лоно» или иначе: Субстанциональный поток первичной фундаментальной информации о формах и способах движения Материи-субстанции полностью пронизывает эту Материю-субстанцию, т.е. мировой эфир.
В религиозных доктринах этот «открытый интервал» облечён в образную форму Вселенского акта творения Богом всего вещества в Мире из Материи-субстанции, с Которой Он непрерывно пребывает в состоянии плодоносного совокупления.
Автор данной статьи отдаёт себе отчёт в том, что эта математическая конструкция была в своё время навеяна ему опять же, как не покажется странным,- идеями незабвенного Д.И. Менделеева, высказанными им в его работах (см., например, статью «Попытка химического понимания мирового эфира»). Теперь настала пора подвести итог нашим исследованиям, изложенным в данной диссертации.
10. Errata: ferro et igni
Безапелляционное и циничное игнорирование мировой наукой места и роли мирового эфира в природных процессах (и в Таблице Менделеева!) как раз и породило всю гамму проблем человечества в нашем технократическом веке.
Главная из этих проблем — топливно-энергетическая.
Именно игнорирование роли мирового эфира позволяет учёным делать ложный (и лукавый – одновременно) вывод, будто добывать полезную энергию для своих повседневных нужд человек может лишь сжигая, т.е. безвозвратно разрушая вещество (топливо). Отсюда и ложный тезис об отсутствии у нынешней топливной энергетики реальной альтернативы. А раз так, то остаётся, якобы, только одно: плодить атомную (экологически самую грязную!) энергетику и газо-нефте-угле-добычу, засоряя и отравляя безмерно собственную среду обитания.
Именно игнорирование роли мирового эфира толкает всех современных учёных-ядерщиков на лукавый поиск «спасения» в расщеплении атомов и элементарных частиц на специальных дорогостоящих синхротронных ускорителях. В ходе этих чудовищных и чрезвычайно опасных по своим последствиям экспериментов хотят обнаружить и в дальнейшем использовать якобы «во благо» т.н. «кварк-глюонную плазму», по их ложным представлениям — как бы «пред-материю» (термин самих ядерщиков), согласно их ложной космологической теории т.н. «Большого взрыва Вселенной».
Достойно замечания, по нашим расчётам, что если эта т.н. «самая сокровенная мечта всех современных физиков-ядерщиков» ненароком будет достигнута, то это будет скорее всего рукотворным концом всякой жизни на земле и концом самой планеты земля,- воистину «Большим взрывом» в глобальном масштабе, но только не понарошку, а взаправду.
Поэтому нужно как можно быстрее остановить это безумное экспериментирование мировой академической науки, которая с головы до ног поражена ядом пси-фактора и которая, похоже, даже не представляет себе возможных катастрофических последствий этих своих безумных паранаучных затей.
Прав оказался Д. И. Менделеев, – «Задачу тяготения и задачи всей энергетики нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояниях».
Прав оказался Д. И. Менделеев и в том, что “когда-нибудь догадаются, что вручать дела данной промышленности лицам, ею живущим, не ведёт к наилучшим следствиям, хотя послушать таких лиц преполезно”.
«Основной смысл сказанного лежит в том, что интересы общие, вечные и прочные зачастую не совпадают с личными и временными, даже нередко одни другим противоречат, и, на мой взгляд, предпочитать надо — если помирить уже нельзя — первые, а не вторые. В этом и драматизм нашего времени
». Д. И. Менделеев. “Мысли к познанию России”. 1906 г.
Итак, мировой эфир есть субстанция всякого химического элемента и значит — всякого вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир – это исток и венец всей подлинной Таблицы Менделеева, её начало и конец,- альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
Все химические элементы можно охарактеризовать в зависимости от строения их атомов, а также по их положению в Периодической системе Д.И. Менделеева. Обычно характеристику химического элемента дают по следующему плану:
- указывают символ химического элемента, а также его название;
- исходя из положения элемента в Периодической системе Д.И. Менделеева указывают его порядковый, номер периода и группы (тип подгруппы), в которых находится элемент;
- исходя из строения атома указывают заряд ядра, массовое число, число электронов, протонов и нейтронов в атоме;
- записывают электронную конфигурацию и указывают валентные электроны;
- зарисовывают электронно-графические формулы для валентных электронов в основном и возбужденном (если оно возможно) состояниях;
- указывают семейство элемента, а также его тип (металл или неметалл);
- указывают формулы высших оксидов и гидроксидов с кратким описанием их свойств;
- указывают значения минимальной и максимальной степеней окисления химического элемента.
Характеристика химического элемента на примере ванадия (V)
Рассмотрим характеристику химического элемента на примере ванадия (V) согласно плану, описанному выше:
1. V – ванадий.
2. Порядковый номер – 23. Элемент находится в 4 периоде, в V группе, А (главной) подгруппе.
3. Z=23 (заряд ядра), M=51 (массовое число), e=23 (число электронов), p=23 (число протонов), n=51-23=28 (число нейтронов).
4. 23 V 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 – электронная конфигурация, валентные
электроны 3d 3 4s 2 .
5. Основное состояние
Возбужденное состояние
6. d-элемент, металл.
7. Высший оксид – V 2 O 5 — проявляет амфотерные свойства, с преобладанием кислотных:
V 2 O 5 + 2NaOH = 2NaVO 3 + H 2 O
V 2 O 5 + H 2 SO 4 = (VO 2) 2 SO 4 + H 2 O (рН
Ванадий образует гидроксиды следующего состава V(OH) 2 , V(OH) 3 , VO(OH) 2 . Для V(OH) 2 и V(OH) 3
характерны основные свойства (1, 2), а VO(OH) 2 обладает амфотерными свойствами (3, 4):
V(OH) 2 + H 2 SO 4 = VSO 4 + 2H 2 O (1)
2 V(OH) 3 + 3 H 2 SO 4 = V 2 (SO 4) 3 + 6 H 2 O (2)
VO(OH) 2 + H 2 SO 4 = VOSO 4 + 2 H 2 O (3)
4 VO(OH) 2 + 2KOH = K 2 + 5 H 2 O (4)
8. Минимальная степень окисления «+2», максимальная – «+5»
Примеры решения задач
ПРИМЕР 1
| Задание | Охарактеризуйте химический элемент фосфор |
| Решение | 1. P – фосфор.
2. Порядковый номер – 15. Элемент находится в 3 периоде, в V группе, А (главной) подгруппе. 3. Z=15 (заряд ядра), M=31 (массовое число), e=15 (число электронов), p=15 (число протонов), n=31-15=16 (число нейтронов). 4. 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 – электронная конфигурация, валентные электроны 3s 2 3p 3 . 5. Основное состояние Возбужденное состояние 6. p-элемент, неметалл. 7. Высший оксид – P 2 O 5 — проявляет кислотные свойства: P 2 O 5 + 3Na 2 O = 2Na 3 PO 4 Гидроксид, соответствующий высшему оксиду – H 3 PO 4 , проявляет кислотные свойства: H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O 8. Минимальная степень окисления «-3», максимальная – «+5» |
ПРИМЕР 2
| Задание | Охарактеризуйте химический элемент калий |
| Решение | 1. K – калий.
2. Порядковый номер – 19. Элемент находится в 4 периоде, в I группе, А (главной) подгруппе. |
Эфир в таблице Менделеева
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит — ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир — это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, — альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем — один из пяти элементов бытия (по Аристотелю) — пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Предисловие.
У Менделеева было два фундаментальных научных открытия:
1 — Открытие Периодического закона в субстанции химии,
2 — Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир — частицы вещества размером ~ 10-100 метра (фактически — «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 — не видно, 2 — и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира — то же самое, что человечество без детей — прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача — эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева — это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения?
Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира
. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире — роль крови мировой экономики — их не вдохновляла.
Не вдохновляло это и прочих олигархов — угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» — из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто — солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому
против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева — его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности»
(«Попытка химического понимания мирового эфира». 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
1 , , ,
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами — фононами в кристаллах.
Эфир — это дифференцированная материя, так сказать, атомы в разобранном состоянии или правильней сказать, элементарные частицы, из которых формируются будущие атомы. Поэтому ему нет места в таблице Менделеева, так как логика построения данной системы не предполагает включать в её состав не целостные структуры,которыми являются сами атомы. В противном случае, так можно и для кварков найти место, где-нибудь в минус первом периоде.
Сам эфир имеет более сложную многоуровневую структуру проявления в мировом бытии, нежели об этом знает современная наука. Как только она раскроет первые тайны этого неуловимого эфира, тогда и будут изобретены новые двигатели для всевозможных машин на абсолютно новых принципах.
Действительно,Тесла едва ли не единственный, кто был близок к разгадке тайны, так называемого эфира,но ему сознательно мешали осуществить свои замыслы. Вот так до сегодняшнего дня ещё не родился тот гений, который продолжит дело великого изобретателя и расскажет всем нам, что же на самом деле представляет из себя таинственный эфир и на какой пьедестал его можно будет поставить.
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы
. Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера
. Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной
. В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов
. Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы
, обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах
. Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства
. Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы
. А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами
.
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии
, необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы
, чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ
. По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости
того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов
может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.

считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы
– короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы
, отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Зная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану.
I. Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д.И. Менделеева:
- порядковый номер;
- номер периода;
- номер группы;
- подгруппа (главная или побочная).
III. Строение атома химического элемента:
- заряд ядра атома;
- относительная атомная масса химического элемента;
- число протонов;
- число электронов;
- число нейтронов;
- число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
V. Тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой.
VIII. Максимальная и минимальная степень окисления атома.
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строению атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Р.
II. Охарактеризуем положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16). Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная формула атома фосфора: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 .
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление), на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление).
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
V. Определяем тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P 2 O 5 , проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H 3 PO 4 , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
P 2 O 5 + 3 Na 2 O = 2Na 3 PO 4
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
VIII. Определяем максимальную и минимальную степень окисления атома фосфора.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
For the emergency service protocol, see ETHANE.
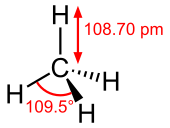
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Methane[1] |
||
| Systematic IUPAC name
Carbane (never recommended[1]) |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1718732 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.739 |
|
| EC Number |
|
|
|
Gmelin Reference |
59 | |
| KEGG |
|
|
| MeSH | Methane | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1971 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CH4 | |
| Molar mass | 16.043 g·mol−1 | |
| Appearance | Colorless gas | |
| Odor | Odorless | |
| Density |
|
|
| Melting point | −182.456 °C (−296.421 °F; 90.694 K)[3] | |
| Boiling point | −161.5 °C (−258.7 °F; 111.6 K)[3] | |
| Critical point (T, P) | 190.56 K (−82.59 °C; −116.66 °F), 4.5992 megapascals (45.391 atm) | |
|
Solubility in water |
22.7 mg·L−1[4] | |
| Solubility | Soluble in ethanol, diethyl ether, benzene, toluene, methanol, acetone and insoluble in water | |
| log P | 1.09 | |
|
Henry’s law |
14 nmol·Pa−1·kg−1 | |
| Conjugate acid | Methanium | |
| Conjugate base | Methyl anion | |
|
Magnetic susceptibility (χ) |
−17.4×10−6 cm3·mol−1[5] | |
| Structure | ||
|
Point group |
Td | |
|
Molecular shape |
Tetrahedron | |
|
Dipole moment |
0 D | |
| Thermochemistry[6] | ||
|
Heat capacity (C) |
35.7 J·(K·mol)−1 | |
|
Std molar |
186.3 J·(K·mol)−1 | |
|
Std enthalpy of |
−74.6 kJ·mol−1 | |
|
Gibbs free energy (ΔfG⦵) |
−50.5 kJ·mol−1 | |
|
Std enthalpy of |
−891 kJ·mol−1 | |
| Hazards[7] | ||
| GHS labelling: | ||
|
Pictograms |

|
|
|
Signal word |
Danger | |
|
Hazard statements |
H220 | |
|
Precautionary statements |
P210 | |
| NFPA 704 (fire diamond) |
2 4 0 SA |
|
| Flash point | −188 °C (−306.4 °F; 85.1 K) | |
|
Autoignition |
537 °C (999 °F; 810 K) | |
| Explosive limits | 4.4–17% | |
| Related compounds | ||
|
Related alkanes |
|
|
| Supplementary data page | ||
| Methane (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Methane ( MEH-thayn, MEE-thayn) is a chemical compound with the chemical formula CH4 (one carbon atom bonded to four hydrogen atoms). It is a group-14 hydride, the simplest alkane, and the main constituent of natural gas. The relative abundance of methane on Earth makes it an economically attractive fuel, although capturing and storing it poses technical challenges due to its gaseous state under normal conditions for temperature and pressure.
Naturally occurring methane is found both below ground and under the seafloor and is formed by both geological and biological processes. The largest reservoir of methane is under the seafloor in the form of methane clathrates. When methane reaches the surface and the atmosphere, it is known as atmospheric methane.[9] The Earth’s atmospheric methane concentration has increased by about 150% since 1750, and it accounts for 20% of the total radiative forcing from all of the long-lived and globally mixed greenhouse gases.[10] It has also been detected on other planets, including Mars, which has implications for astrobiology research.[11]
Properties and bonding[edit]
Methane is a tetrahedral molecule with four equivalent C–H bonds. Its electronic structure is described by four bonding molecular orbitals (MOs) resulting from the overlap of the valence orbitals on C and H. The lowest-energy MO is the result of the overlap of the 2s orbital on carbon with the in-phase combination of the 1s orbitals on the four hydrogen atoms. Above this energy level is a triply degenerate set of MOs that involve overlap of the 2p orbitals on carbon with various linear combinations of the 1s orbitals on hydrogen. The resulting «three-over-one» bonding scheme is consistent with photoelectron spectroscopic measurements.
Methane is an odorless gas and appears to be colorless.[12] It does absorb visible light especially at the red end of the spectrum due to overtone bands, but the effect is only noticeable if the light path is very long. This is what gives Uranus and Neptune their blue or bluish-green colors, as light passes through their atmospheres containing methane and is then scattered back out.[13]
The familiar smell of natural gas as used in homes is achieved by the addition of an odorant, usually blends containing tert-butylthiol, as a safety measure. Methane has a boiling point of −161.5 °C at a pressure of one atmosphere.[3] As a gas, it is flammable over a range of concentrations (5.4–17%) in air at standard pressure.
Solid methane exists in several modifications. Presently nine are known.[14] Cooling methane at normal pressure results in the formation of methane I. This substance crystallizes in the cubic system (space group Fm3m). The positions of the hydrogen atoms are not fixed in methane I, i.e. methane molecules may rotate freely. Therefore, it is a plastic crystal.[15]
Chemical reactions[edit]
The primary chemical reactions of methane are combustion, steam reforming to syngas, and halogenation. In general, methane reactions are difficult to control.
Selective oxidation[edit]
Partial oxidation of methane to methanol, a more convenient, liquid fuel, is challenging because the reaction typically progresses all the way to carbon dioxide and water even with an insufficient supply of oxygen. The enzyme methane monooxygenase produces methanol from methane, but cannot be used for industrial-scale reactions.[16] Some homogeneously catalyzed systems and heterogeneous systems have been developed, but all have significant drawbacks. These generally operate by generating protected products which are shielded from overoxidation. Examples include the Catalytica system, copper zeolites, and iron zeolites stabilizing the alpha-oxygen active site.[17]
One group of bacteria catalyze methane oxidation with nitrite as the oxidant in the absence of oxygen, giving rise to the so-called anaerobic oxidation of methane.[18]
Acid–base reactions[edit]
Like other hydrocarbons, methane is an extremely weak acid. Its pKa in DMSO is estimated to be 56.[19] It cannot be deprotonated in solution, but the conjugate base is known in forms such as methyllithium.
A variety of positive ions derived from methane have been observed, mostly as unstable species in low-pressure gas mixtures. These include methenium or methyl cation CH+
3, methane cation CH+
4, and methanium or protonated methane CH+
5. Some of these have been detected in outer space. Methanium can also be produced as diluted solutions from methane with superacids. Cations with higher charge, such as CH2+
6 and CH3+
7, have been studied theoretically and conjectured to be stable.[20]
Despite the strength of its C–H bonds, there is intense interest in catalysts that facilitate C–H bond activation in methane (and other lower numbered alkanes).[21]
Combustion[edit]
Methane bubbles can be burned on a wet hand without injury.
Methane’s heat of combustion is 55.5 MJ/kg.[22] Combustion of methane is a multiple step reaction summarized as follows:
- (ΔH = −891 k J/mol, at standard conditions)
Peters four-step chemistry is a systematically reduced four-step chemistry that explains the burning of methane.
Methane radical reactions[edit]
Given appropriate conditions, methane reacts with halogen radicals as follows:
where X is a halogen: fluorine (F), chlorine (Cl), bromine (Br), or iodine (I). This mechanism for this process is called free radical halogenation. It is initiated when UV light or some other radical initiator (like peroxides) produces a halogen atom. A two-step chain reaction ensues in which the halogen atom abstracts a hydrogen atom from a methane molecule, resulting in the formation of a hydrogen halide molecule and a methyl radical (CH3•). The methyl radical then reacts with a molecule of the halogen to form a molecule of the halomethane, with a new halogen atom as byproduct.[23] Similar reactions can occur on the halogenated product, leading to replacement of additional hydrogen atoms by halogen atoms with dihalomethane, trihalomethane, and ultimately, tetrahalomethane structures, depending upon reaction conditions and the halogen-to-methane ratio.
Uses[edit]
Methane is used in industrial chemical processes and may be transported as a refrigerated liquid (liquefied natural gas, or LNG). While leaks from a refrigerated liquid container are initially heavier than air due to the increased density of the cold gas, the gas at ambient temperature is lighter than air. Gas pipelines distribute large amounts of natural gas, of which methane is the principal component.
Fuel[edit]
Methane is used as a fuel for ovens, homes, water heaters, kilns, automobiles,[24][25] turbines, etc. Activated carbon is used to store methane. Refined liquid methane is used as a rocket fuel,[26] when combined with liquid oxygen, as in the BE-4 and Raptor engines.[27]
As the major constituent of natural gas, methane is important for electricity generation by burning it as a fuel in a gas turbine or steam generator. Compared to other hydrocarbon fuels, methane produces less carbon dioxide for each unit of heat released. At about 891 kJ/mol, methane’s heat of combustion is lower than that of any other hydrocarbon, but the ratio of the heat of combustion (891 kJ/mol) to the molecular mass (16.0 g/mol, of which 12.0 g/mol is carbon) shows that methane, being the simplest hydrocarbon, produces more heat per mass unit (55.7 kJ/g) than other complex hydrocarbons. In many cities, methane is piped into homes for domestic heating and cooking. In this context it is usually known as natural gas, which is considered to have an energy content of 39 megajoules per cubic meter, or 1,000 BTU per standard cubic foot. Liquefied natural gas (LNG) is predominantly methane (CH4) converted into liquid form for ease of storage or transport.
As a liquid rocket fuel, methane offers the advantage over kerosene of producing small exhaust molecules. This deposits less soot on the internal parts of rocket motors, reducing the difficulty of booster re-use. The lower molecular weight of the exhaust also increases the fraction of the heat energy which is in the form of kinetic energy available for propulsion, increasing the specific impulse of the rocket. Liquid methane also has a temperature range (91–112 K) nearly compatible with liquid oxygen (54–90 K).
Chemical feedstock[edit]
Natural gas, which is mostly composed of methane, is used to produce hydrogen gas on an industrial scale. Steam methane reforming (SMR), or simply known as steam reforming, is the standard industrial method of producing commercial bulk hydrogen gas. More than 50 million metric tons are produced annually worldwide (2013), principally from the SMR of natural gas.[28] Much of this hydrogen is used in petroleum refineries, in the production of chemicals and in food processing. Very large quantities of hydrogen are used in the industrial synthesis of ammonia.
At high temperatures (700–1100 °C) and in the presence of a metal-based catalyst (nickel), steam reacts with methane to yield a mixture of CO and H2, known as «water gas» or «syngas»:
This reaction is strongly endothermic (consumes heat, ΔHr = 206 kJ/mol).
Additional hydrogen is obtained by the reaction of CO with water via the water-gas shift reaction:
This reaction is mildly exothermic (produces heat, ΔHr = −41 kJ/mol).
Methane is also subjected to free-radical chlorination in the production of chloromethanes, although methanol is a more typical precursor.[29]
Hydrogen can also be produced via the direct decomposition of methane, also known as methane Pyrolysis. Unlike steam reforming, the methane pyrolysis reaction itself does not produce greenhouse gases. The heat needed for the reaction can be GHG emission free, too, e.g. from concentrated sunlight, renewable electricity or burning some of the produced hydrogen. If the methane is from biogas then the process can be a carbon sink. Temperatures in excess of 1200 °C are required to break the bonds of methane to produce Hydrogen gas and solid carbon. However, through the use of a suitable catalyst the reaction temperature can be reduced to between 600 °C — 1000 °C depending on the chosen catalyst.[30] The reaction is moderately endothermic as shown in the reaction equation below.[31]
- (ΔH° = 74.8 kJ/mol)
Generation[edit]
Geological routes[edit]
The two main routes for geological methane generation are (i) organic (thermally generated, or thermogenic) and (ii) inorganic (abiotic).[11] Thermogenic methane occurs due to the breakup of organic matter at elevated temperatures and pressures in deep sedimentary strata. Most methane in sedimentary basins is thermogenic; therefore, thermogenic methane is the most important source of natural gas. Thermogenic methane components are typically considered to be relic (from an earlier time). Generally, formation of thermogenic methane (at depth) can occur through organic matter breakup, or organic synthesis. Both ways can involve microorganisms (methanogenesis), but may also occur inorganically. The processes involved can also consume methane, with and without microorganisms.
The more important source of methane at depth (crystalline bedrock) is abiotic. Abiotic means that methane is created from inorganic compounds, without biological activity, either through magmatic processes or via water-rock reactions that occur at low temperatures and pressures, like serpentinization.[32][33]
Biological routes[edit]
Most of Earth’s methane is biogenic and is produced by methanogenesis,[34][35] a form of anaerobic respiration only known to be conducted by some members of the domain Archaea.[36] Methanogens occupy landfills and other soils,[37] ruminants (for example, cattle),[38] the guts of termites, and the anoxic sediments below the seafloor and the bottom of lakes. Rice fields also generate large amounts of methane during plant growth.[39] This multistep process is used by these microorganisms for energy. The net reaction of methanogenesis is:
The final step in the process is catalyzed by the enzyme methyl coenzyme M reductase (MCR).[40]
Testing Australian sheep for exhaled methane production (2001), CSIRO
This image represents a ruminant, specifically a sheep, producing methane in the four stages of hydrolysis, acidogenesis, acetogenesis, and methanogenesis.
Ruminants[edit]
Ruminants, such as cattle, belch methane, accounting for about 22% of the U.S. annual methane emissions to the atmosphere.[41] One study reported that the livestock sector in general (primarily cattle, chickens, and pigs) produces 37% of all human-induced methane.[42] A 2013 study estimated that livestock accounted for 44% of human-induced methane and about 15% of human-induced greenhouse gas emissions.[43] Many efforts are underway to reduce livestock methane production, such as medical treatments and dietary adjustments,[44][45] and to trap the gas to use its combustion energy.[46]
Seafloor sediments[edit]
Most of the subseafloor is anoxic because oxygen is removed by aerobic microorganisms within the first few centimeters of the sediment. Below the oxygen-replete seafloor, methanogens produce methane that is either used by other organisms or becomes trapped in gas hydrates.[36] These other organisms that utilize methane for energy are known as methanotrophs (‘methane-eating’), and are the main reason why little methane generated at depth reaches the sea surface.[36] Consortia of Archaea and Bacteria have been found to oxidize methane via anaerobic oxidation of methane (AOM); the organisms responsible for this are anaerobic methanotrophic Archaea (ANME) and sulfate-reducing bacteria (SRB).[47]
Industrial routes[edit]
Given its cheap abundance in natural gas, there is little incentive to produce methane industrially. Methane can be produced by hydrogenating carbon dioxide through the Sabatier process. Methane is also a side product of the hydrogenation of carbon monoxide in the Fischer–Tropsch process, which is practiced on a large scale to produce longer-chain molecules than methane.
An example of large-scale coal-to-methane gasification is the Great Plains Synfuels plant, started in 1984 in Beulah, North Dakota as a way to develop abundant local resources of low-grade lignite, a resource that is otherwise difficult to transport for its weight, ash content, low calorific value and propensity to spontaneous combustion during storage and transport. A number of similar plants exist around the world, although mostly these plants are targeted towards the production of long chain alkanes for use as gasoline, diesel, or feedstock to other processes.
Power to methane is a technology that uses electrical power to produce hydrogen from water by electrolysis and uses the Sabatier reaction to combine hydrogen with carbon dioxide to produce methane. As of 2021, this is mostly under development and not in large-scale use. Theoretically, the process could be used as a buffer for excess and off-peak power generated by highly fluctuating wind turbines and solar arrays. However, as currently very large amounts of natural gas are used in power plants (e.g. CCGT) to produce electric energy, the losses in efficiency are not acceptable.
Laboratory synthesis[edit]
Methane can be produced by protonation of methyl lithium or a methyl Grignard reagent such as methylmagnesium chloride. It can also be made from anhydrous sodium acetate and dry sodium hydroxide, mixed and heated above 300 °C (with sodium carbonate as byproduct).[citation needed] In practice, a requirement for pure methane can easily be fulfilled by steel gas bottle from standard gas suppliers.
Occurrence[edit]
Methane was discovered and isolated by Alessandro Volta between 1776 and 1778 when studying marsh gas from Lake Maggiore. It is the major component of natural gas, about 87% by volume. The major source of methane is extraction from geological deposits known as natural gas fields, with coal seam gas extraction becoming a major source (see coal bed methane extraction, a method for extracting methane from a coal deposit, while enhanced coal bed methane recovery is a method of recovering methane from non-mineable coal seams). It is associated with other hydrocarbon fuels, and sometimes accompanied by helium and nitrogen. Methane is produced at shallow levels (low pressure) by anaerobic decay of organic matter and reworked methane from deep under the Earth’s surface. In general, the sediments that generate natural gas are buried deeper and at higher temperatures than those that contain oil.
Methane is generally transported in bulk by pipeline in its natural gas form, or by LNG carriers in its liquefied form; few countries transport it by truck.
Atmospheric methane[edit]
Methane (CH4) measured by the Advanced Global Atmospheric Gases Experiment (AGAGE) in the lower atmosphere (troposphere) at stations around the world. Abundances are given as pollution free monthly mean mole fractions in parts-per-billion.
In 2010, methane levels in the Arctic were measured at 1850 nmol/mol. This level is over twice as high as at any time in the last 400,000 years. Historic methane concentrations in the world’s atmosphere have ranged between 300 and 400 nmol/mol during glacial periods commonly known as ice ages, and between 600 and 700 nmol/mol during the warm interglacial periods. The Earth’s oceans are a potential important source of Arctic methane.[48]
Methane is an important greenhouse gas with a global warming potential of 34 compared to CO2 (potential of 1) over a 100-year period, and 72 over a 20-year period.[49][50]
The Earth’s atmospheric methane concentration has increased by about 150% since 1750, and it accounts for 20% of the total radiative forcing from all of the long-lived and globally mixed greenhouse gases. The AR6 of the IPCC states: «Observed increases in well-mixed greenhouse gas (GHG) concentrations since around 1750 are unequivocally caused by human activities. Since 2011 (measurements reported in AR5), concentrations have continued to increase in the atmosphere, reaching annual averages of 410 ppm for carbon dioxide (CO2), 1866 ppb for methane (CH4), and 332 ppb for nitrous oxide (N2O) in 2019. (…) In 2019, atmospheric CO2 concentrations were higher than at any time in at least 2 million years (high confidence), and concentrations of CH4 and N2O were higher than at any time in at least 800,000 years (very high confidence). Since 1750, increases in CO2 (47%) and CH4 (156%) concentrations far exceed, and increases in N2O (23%) are similar to, the natural multi-millennial changes between glacial and interglacial periods over at least the past 800,000 years (very high confidence)».[10]
From 2015 to 2019 sharp rises in levels of atmospheric methane have been recorded.[51][52] In February 2020, it was reported that fugitive emissions and gas venting from the fossil fuel industry may have been significantly underestimated.[53]
Climate change can increase atmospheric methane levels by increasing methane production in natural ecosystems, forming a Climate change feedback.[36][54] Another explanation for the rise in methane emissions could be a slowdown of the chemical reaction that removes methane from the atmosphere.[55]
Clathrates[edit]
Methane clathrates (also known as methane hydrates) are solid cages of water molecules that trap single molecules of methane. Significant reservoirs of methane clathrates have been found in arctic permafrost and along continental margins beneath the ocean floor within the gas clathrate stability zone, located at high pressures (1 to 100 MPa; lower end requires lower temperature) and low temperatures (< 15 °C; upper end requires higher pressure).[56] Methane clathrates can form from biogenic methane, thermogenic methane, or a mix of the two. These deposits are both a potential source of methane fuel as well as a potential contributor to global warming.[57][58] The global mass of carbon stored in gas clathrates is still uncertain and has been estimated as high as 12,500 Gt carbon and as low as 500 Gt carbon.[59] The estimate has declined over time with a most recent estimate of ~1800 Gt carbon.[60] A large part of this uncertainty is due to our knowledge gap in sources and sinks of methane and the distribution of methane clathrates at the global scale. For example, a source of methane was discovered relatively recently in an ultraslow spreading ridge in the Arctic.[61] Some climate models suggest that today’s methane emission regime from the ocean floor is potentially similar to that during the period of the Paleocene–Eocene Thermal Maximum (PETM) around 55.5 million years ago, although there are no data indicating that methane from clathrate dissociation currently reaches the atmosphere.[60] Arctic methane release from permafrost and seafloor methane clathrates is a potential consequence and further cause of global warming; this is known as the clathrate gun hypothesis.[62][63][64][65] Data from 2016 indicate that Arctic permafrost thaws faster than predicted.[66]
[edit]
Interstellar medium[edit]
Methane is abundant in many parts of the Solar System and potentially could be harvested on the surface of another solar-system body (in particular, using methane production from local materials found on Mars[67] or Titan), providing fuel for a return journey.[26][68]
Mars[edit]
Methane has been detected on all planets of the Solar System and most of the larger moons.[citation needed] With the possible exception of Mars, it is believed to have come from abiotic processes.[69][70]
Methane (CH4) on Mars – potential sources and sinks
The Curiosity rover has documented seasonal fluctuations of atmospheric methane levels on Mars. These fluctuations peaked at the end of the Martian summer at 0.6 parts per billion.[71][72][73][74][75][76][77][78]
Methane has been proposed as a possible rocket propellant on future Mars missions due in part to the possibility of synthesizing it on the planet by in situ resource utilization.[79] An adaptation of the Sabatier methanation reaction may be used with a mixed catalyst bed and a reverse water-gas shift in a single reactor to produce methane from the raw materials available on Mars, utilizing water from the Martian subsoil and carbon dioxide in the Martian atmosphere.[67]
Methane could be produced by a non-biological process called serpentinization[a] involving water, carbon dioxide, and the mineral olivine, which is known to be common on Mars.[80]
History[edit]
In November 1776, methane was first scientifically identified by Italian physicist Alessandro Volta in the marshes of Lake Maggiore straddling Italy and Switzerland. Volta was inspired to search for the substance after reading a paper written by Benjamin Franklin about «flammable air».[81] Volta collected the gas rising from the marsh, and by 1778 had isolated pure methane.[82] He also demonstrated that the gas could be ignited with an electric spark.[82]
Following the Felling mine disaster of 1812 in which 92 men perished, Sir Humphry Davy established that the feared firedamp was in fact largely methane.[83]
The name «methane» was coined in 1866 by the German chemist August Wilhelm von Hofmann.[84][85] The name was derived from methanol.
Etymology[edit]
Etymologically, the word methane is coined from the chemical suffix «-ane«, which denotes substances belonging to the alkane family; and the word methyl, which is derived from the German methyl (1840) or directly from the French méthyle, which is a back-formation from the French méthylène (corresponding to English «methylene»), the root of which was coined by Jean-Baptiste Dumas and Eugène Péligot in 1834 from the Greek μέθυ methy (wine) (related to English «mead») and ὕλη hyle (meaning «wood»). The radical is named after this because it was first detected in methanol, an alcohol first isolated by distillation of wood. The chemical suffix -ane is from the coordinating chemical suffix -ine which is from Latin feminine suffix -ina which is applied to represent abstracts. The coordination of «-ane», «-ene», «-one», etc. was proposed in 1866 by German chemist August Wilhelm von Hofmann.[86]
Abbreviations[edit]
The abbreviation CH4-C can mean the mass of carbon contained in a mass of methane, and the mass of methane is always 1.33 times the mass of CH4-C.[87][88] CH4-C can also mean the methane-carbon ratio, which is 1.33 by mass.[89] Methane at scales of the atmosphere is commonly measured in teragrams (Tg CH4) or millions of metric tons (MMT CH4), which mean the same thing.[90] Other standard units are also used, such as nanomole (nmol, one billionth of a mole), mole (mol), kilogram, and gram.
Safety[edit]
Methane is nontoxic, yet it is extremely flammable and may form explosive mixtures with air. Methane is also an asphyxiant if the oxygen concentration is reduced to below about 16% by displacement, as most people can tolerate a reduction from 21% to 16% without ill effects. The concentration of methane at which asphyxiation risk becomes significant is much higher than the 5–15% concentration in a flammable or explosive mixture. Methane off-gas can penetrate the interiors of buildings near landfills and expose occupants to significant levels of methane. Some buildings have specially engineered recovery systems below their basements to actively capture this gas and vent it away from the building.
Methane gas explosions are responsible for many deadly mining disasters.[91] A methane gas explosion was the cause of the Upper Big Branch coal mine disaster in West Virginia on April 5, 2010, killing 29.[92] Natural gas accidental release has also been a major focus in the field of safety engineering, due to past accidental releases that concluded in the formation of jet fire disasters. [93][94]
See also[edit]
- 2007 Zasyadko mine disaster
- Abiogenic petroleum origin
- Aerobic methane production
- Anaerobic digestion
- Anaerobic respiration
- Arctic methane emissions
- Biogas
- Coal Oil Point seep field
- Energy density
- Fugitive gas emissions
- Global Methane Initiative
- Thomas Gold
- Halomethane, halogenated methane derivatives.
- Hydrogen Cycle
- Industrial gas
- Lake Kivu (more general: limnic eruption)
- List of straight-chain alkanes
- Methanation
- Methane emissions
- Methane on Mars:
- atmosphere
- climate
- Methanogen, archaea that produce methane.
- Methanogenesis, microbes that produce methane.
- Methanotroph, bacteria that grow with methane.
- Methyl group, a functional group related to methane.
Explanatory notes[edit]
- ^ There are many serpentinization reactions. Olivine is a solid solution between forsterite and fayalite whose general formula is (Fe,Mg)2SiO4. The reaction producing methane from olivine can be written as: Forsterite + Fayalite + Water + Carbonic acid → Serpentine + Magnetite + Methane , or (in balanced form): 18 Mg2SiO4 + 6 Fe2SiO4 + 26 H2O + CO2 → 12 Mg3Si2O5(OH)4 + 4 Fe3O4 + CH4
Citations[edit]
- ^ a b «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 3–4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Methane is a retained name (see P-12.3) that is preferred to the systematic name ‘carbane’, a name never recommended to replace methane, but used to derive the names ‘carbene’ and ‘carbyne’ for the radicals H2C2• and HC3•, respectively.
- ^ «Gas Encyclopedia». Archived from the original on December 26, 2018. Retrieved November 7, 2013.
- ^ a b c d Haynes, p. 3.344
- ^ Haynes, p. 5.156
- ^ Haynes, p. 3.578
- ^ Haynes, pp. 5.26, 5.67
- ^ «Safety Datasheet, Material Name: Methane» (PDF). USA: Metheson Tri-Gas Incorporated. December 4, 2009. Archived from the original (PDF) on June 4, 2012. Retrieved December 4, 2011.
- ^ NOAA Office of Response and Restoration, US GOV. «METHANE». noaa.gov. Archived from the original on January 9, 2019. Retrieved March 20, 2015.
- ^ Khalil, M. A. K. (1999). «Non-Co2 Greenhouse Gases in the Atmosphere». Annual Review of Energy and the Environment. 24: 645–661. doi:10.1146/annurev.energy.24.1.645.
- ^ a b «Climate Change 2021. The Physical Science Basis. Summary for Policymakers. Working Group I contribution to the WGI Sixth Assessment Report of the Intergovernmental Panel on Climate Change». IPCC. The Intergovernmental Panel on Climate Change. Archived from the original on August 22, 2021. Retrieved August 22, 2021.
- ^ a b Etiope, Giuseppe; Lollar, Barbara Sherwood (2013). «Abiotic Methane on Earth». Reviews of Geophysics. 51 (2): 276–299. Bibcode:2013RvGeo..51..276E. doi:10.1002/rog.20011. S2CID 56457317.
- ^ Hensher, David A.; Button, Kenneth J. (2003). Handbook of transport and the environment. Emerald Group Publishing. p. 168. ISBN 978-0-08-044103-0. Archived from the original on March 19, 2015. Retrieved February 22, 2016.
- ^ P.G.J Irwin; et al. (January 12, 2022). «Hazy Blue Worlds: A Holistic Aerosol Model for Uranus and Neptune, Including Dark Spots». Journal of Geophysical Research: Planets. 127 (6): e2022JE007189. arXiv:2201.04516. doi:10.1029/2022JE007189. PMC 9286428. PMID 35865671. S2CID 245877540.
- ^ Bini, R.; Pratesi, G. (1997). «High-pressure infrared study of solid methane: Phase diagram up to 30 GPa». Physical Review B. 55 (22): 14800–14809. Bibcode:1997PhRvB..5514800B. doi:10.1103/physrevb.55.14800.
- ^ Wendelin Himmelheber. «Crystal structures». Archived from the original on February 12, 2020. Retrieved December 10, 2019.
- ^ Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. (2003). «Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase». Chemical Reviews. 103 (6): 2385–419. doi:10.1021/cr950244f. PMID 12797835.
- ^ Snyder, Benjamin E. R.; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (December 19, 2017). «Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes». Chemical Reviews. 118 (5): 2718–2768. doi:10.1021/acs.chemrev.7b00344. PMID 29256242.
- ^
Reimann, Joachim; Jetten, Mike S.M.; Keltjens, Jan T. (2015). «Chapter 7 Metal Enzymes in «Impossible» Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane«. In Peter M.H. Kroneck and Martha E. Sosa Torres (ed.). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Vol. 15. Springer. pp. 257–313. doi:10.1007/978-3-319-12415-5_7. ISBN 978-3-319-12414-8. PMID 25707470. - ^ Bordwell, Frederick G. (1988). «Equilibrium acidities in dimethyl sulfoxide solution». Accounts of Chemical Research. 21 (12): 456–463. doi:10.1021/ar00156a004.
- ^ Rasul, G.; Surya Prakash, G.K.; Olah, G.A. (2011). «Comparative study of the hypercoordinate carbonium ions and their boron analogs: A challenge for spectroscopists». Chemical Physics Letters. 517 (1): 1–8. Bibcode:2011CPL…517….1R. doi:10.1016/j.cplett.2011.10.020.
- ^ Bernskoetter, W. H.; Schauer, C. K.; Goldberg, K. I.; Brookhart, M. (2009). «Characterization of a Rhodium(I) σ-Methane Complex in Solution». Science. 326 (5952): 553–556. Bibcode:2009Sci…326..553B. doi:10.1126/science.1177485. PMID 19900892. S2CID 5597392.
- ^ Energy Content of some Combustibles (in MJ/kg) Archived January 9, 2014, at the Wayback Machine. People.hofstra.edu. Retrieved on March 30, 2014.
- ^ March, Jerry (1968). Advance Organic Chemistry: Reactions, Mechanisms and Structure. New York: McGraw-Hill Book Company. pp. 533–534.
- ^ «Lumber Company Locates Kilns at Landfill to Use Methane – Energy Manager Today». Energy Manager Today. September 23, 2015. Archived from the original on July 9, 2019. Retrieved March 11, 2016.
- ^ Cornell, Clayton B. (April 29, 2008). «Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country». Archived from the original on January 20, 2019. Retrieved July 25, 2009.
Compressed natural gas is touted as the ‘cleanest burning’ alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline
- ^ a b
Thunnissen, Daniel P.; Guernsey, C. S.; Baker, R. S.; Miyake, R. N. (2004). «Advanced Space Storable Propellants for Outer Planet Exploration» (PDF). American Institute of Aeronautics and Astronautics (4–0799): 28. Archived from the original (PDF) on March 10, 2016. - ^ «Blue Origin BE-4 Engine». Archived from the original on October 1, 2021. Retrieved June 14, 2019.
We chose LNG because it is highly efficient, low cost and widely available. Unlike kerosene, LNG can be used to self-pressurize its tank. Known as autogenous repressurization, this eliminates the need for costly and complex systems that draw on Earth’s scarce helium reserves. LNG also possesses clean combustion characteristics even at low throttle, simplifying engine reuse compared to kerosene fuels.
- ^ Report of the Hydrogen Production Expert Panel: A Subcommittee of the Hydrogen & Fuel Cell Technical Advisory Committee Archived February 14, 2020, at the Wayback Machine. United States Department of Energy (May 2013).
- ^ Rossberg, M. et al. (2006) «Chlorinated Hydrocarbons» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2.
- ^ Lumbers, Brock (2022). «Mathematical modelling and simulation of the thermo-catalytic decomposition of methane for economically improved hydrogen production». International Journal of Hydrogen Energy. 47 (7): 4265–4283. doi:10.1016/j.ijhydene.2021.11.057. S2CID 244814932. Retrieved June 15, 2022.
- ^ Lumbers, Brock (2022). «Low-emission hydrogen production via the thermo-catalytic decomposition of methane for the decarbonisation of iron ore mines in Western Australia». International Journal of Hydrogen Energy. 47 (37): 16347–16361. doi:10.1016/j.ijhydene.2022.03.124. S2CID 248018294. Retrieved July 10, 2022.
- ^ Kietäväinen and Purkamo (2015). «The origin, source, and cycling of methane in deep crystalline rock biosphere». Front. Microbiol. 6: 725. doi:10.3389/fmicb.2015.00725. PMC 4505394. PMID 26236303.
- ^ Cramer and Franke (2005). «Indications for an active petroleum system in the Laptev Sea, NE Siberia». Journal of Petroleum Geology. 28 (4): 369–384. Bibcode:2005JPetG..28..369C. doi:10.1111/j.1747-5457.2005.tb00088.x. Archived from the original on October 1, 2021. Retrieved May 23, 2017.
- ^ Lessner, Daniel J. (Dec 2009) Methanogenesis Biochemistry. In: eLS. John Wiley & Sons Ltd, Chichester. http://www.els.net Archived May 13, 2011, at the Wayback Machine
- ^ Thiel, Volker (2018), «Methane Carbon Cycling in the Past: Insights from Hydrocarbon and Lipid Biomarkers», in Wilkes, Heinz (ed.), Hydrocarbons, Oils and Lipids: Diversity, Origin, Chemistry and Fate, Handbook of Hydrocarbon and Lipid Microbiology, Springer International Publishing, pp. 1–30, doi:10.1007/978-3-319-54529-5_6-1, ISBN 9783319545295, S2CID 105761461
- ^ a b c d Dean, Joshua F.; Middelburg, Jack J.; Röckmann, Thomas; Aerts, Rien; Blauw, Luke G.; Egger, Matthias; Jetten, Mike S. M.; de Jong, Anniek E. E.; Meisel, Ove H. (2018). «Methane Feedbacks to the Global Climate System in a Warmer World». Reviews of Geophysics. 56 (1): 207–250. Bibcode:2018RvGeo..56..207D. doi:10.1002/2017RG000559. hdl:1874/366386.
- ^ Serrano-Silva, N.; Sarria-Guzman, Y.; Dendooven, L.; Luna-Guido, M. (2014). «Methanogenesis and methanotrophy in soil: a review». Pedosphere. 24 (3): 291–307. doi:10.1016/s1002-0160(14)60016-3.
- ^ Sirohi, S. K.; Pandey, Neha; Singh, B.; Puniya, A. K. (September 1, 2010). «Rumen methanogens: a review». Indian Journal of Microbiology. 50 (3): 253–262. doi:10.1007/s12088-010-0061-6. PMC 3450062. PMID 23100838.
- ^ IPCC. Climate Change 2013: The physical Science Basis Archived October 3, 2018, at the Wayback Machine. United Nations Environment Programme, 2013: Ch. 6, p. 507 IPCC.ch
- ^ Lyu, Zhe; Shao, Nana; Akinyemi, Taiwo; Whitman, William B. (2018). «Methanogenesis». Current Biology. 28 (13): R727–R732. doi:10.1016/j.cub.2018.05.021. PMID 29990451.
- ^ «Inventory of U.S. Greenhouse Gas Emissions and Sinks: 1990–2014». 2016. Archived from the original on April 12, 2019. Retrieved April 11, 2019. [page needed]
- ^ FAO (2006). Livestock’s Long Shadow–Environmental Issues and Options. Rome, Italy: Food and Agriculture Organization of the United Nations (FAO). Archived from the original on July 26, 2008. Retrieved October 27, 2009.
- ^ Gerber, P.J.; Steinfeld, H.; Henderson, B.; Mottet, A.; Opio, C.; Dijkman, J.; Falcucci, A. & Tempio, G. (2013). «Tackling Climate Change Through Livestock». Rome: Food and Agriculture Organization of the United Nations (FAO). Archived from the original on July 19, 2016. Retrieved July 15, 2016.
- ^ Roach, John (May 13, 2002). «New Zealand Tries to Cap Gaseous Sheep Burps». National Geographic. Archived from the original on June 4, 2011. Retrieved March 2, 2011.
- ^ Roque, Breanna M.; Venegas, Marielena; Kinley, Robert D.; Nys, Rocky de; Duarte, Toni L.; Yang, Xiang; Kebreab, Ermias (March 17, 2021). «Red seaweed (Asparagopsis taxiformis) supplementation reduces enteric methane by over 80 percent in beef steers». PLOS ONE. 16 (3): e0247820. Bibcode:2021PLoSO..1647820R. doi:10.1371/journal.pone.0247820. ISSN 1932-6203. PMC 7968649. PMID 33730064.
- ^ Silverman, Jacob (July 16, 2007). «Do cows pollute as much as cars?». HowStuffWorks.com. Archived from the original on November 4, 2012. Retrieved November 7, 2012.
- ^ Knittel, K.; Wegener, G.; Boetius, A. (2019), McGenity, Terry J. (ed.), «Anaerobic Methane Oxidizers», Microbial Communities Utilizing Hydrocarbons and Lipids: Members, Metagenomics and Ecophysiology, Handbook of Hydrocarbon and Lipid Microbiology, Springer International Publishing, pp. 1–21, doi:10.1007/978-3-319-60063-5_7-1, ISBN 9783319600635
- ^ «Study Finds Surprising Arctic Methane Emission Source». NASA. April 22, 2012. Archived from the original on August 4, 2014. Retrieved March 30, 2014.
- ^ IPCC Fifth Assessment Report, Table 8.7, Chap. 8, p. 8–58 Archived November 1, 2013, at the Wayback Machine (PDF; 8,0 MB)
- ^ Shindell, D. T.; Faluvegi, G.; Koch, D. M.; Schmidt, G. A.; Unger, N.; Bauer, S. E. (2009). «Improved Attribution of Climate Forcing to Emissions». Science. 326 (5953): 716–718. Bibcode:2009Sci…326..716S. doi:10.1126/science.1174760. PMID 19900930. S2CID 30881469. Archived from the original on August 7, 2020. Retrieved August 25, 2020.
- ^ Nisbet, E.G. (February 5, 2019). «Very Strong Atmospheric Methane Growth in the 4 Years 2014–2017: Implications for the Paris Agreement». Global Biogeochemical Cycles. 33 (3): 318–342. Bibcode:2019GBioC..33..318N. doi:10.1029/2018GB006009.
- ^ McKie, Robin (February 2, 2017). «Sharp rise in methane levels threatens world climate targets». The Observer. ISSN 0029-7712. Archived from the original on July 30, 2019. Retrieved July 14, 2019.
- ^ Chelsea Harvey Methane Emissions from Oil and Gas May Be Significantly Underestimated; Estimates of methane coming from natural sources have been too high, shifting the burden to human activities Archived February 24, 2020, at the Wayback Machine E&E News via Scientific American February 21, 2020
- ^ Carrington, Damian (July 21, 2020) First active leak of sea-bed methane discovered in Antarctica Archived July 22, 2020, at the Wayback Machine, The Guardian
- ^ Ravilious, Kate (July 5, 2022). «Methane much more sensitive to global heating than previously thought – study». The Guardian. Retrieved July 5, 2022.
- ^ Bohrmann, Gerhard; Torres, Marta E. (2006), Schulz, Horst D.; Zabel, Matthias (eds.), «Gas Hydrates in Marine Sediments», Marine Geochemistry, Springer Berlin Heidelberg, pp. 481–512, doi:10.1007/3-540-32144-6_14, ISBN 9783540321446
- ^ Miller, G. Tyler (2007). Sustaining the Earth: An Integrated Approach. U.S.A.: Thomson Advantage Books, p. 160. ISBN 0534496725
- ^ Dean, J. F. (2018). «Methane feedbacks to the global climate system in a warmer world». Reviews of Geophysics. 56 (1): 207–250. Bibcode:2018RvGeo..56..207D. doi:10.1002/2017RG000559. hdl:1874/366386.
- ^ Boswell, Ray; Collett, Timothy S. (2011). «Current perspectives on gas hydrate resources». Energy Environ. Sci. 4 (4): 1206–1215. doi:10.1039/c0ee00203h.
- ^ a b Ruppel and Kessler (2017). «The interaction of climate change and methane hydrates». Reviews of Geophysics. 55 (1): 126–168. Bibcode:2017RvGeo..55..126R. doi:10.1002/2016RG000534. Archived from the original on February 7, 2020. Retrieved September 16, 2019.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ «New source of methane discovered in the Arctic Ocean». phys.org. May 1, 2015. Archived from the original on April 10, 2019. Retrieved April 10, 2019.
- ^ «Methane Releases From Arctic Shelf May Be Much Larger and Faster Than Anticipated» (Press release). National Science Foundation (NSF). March 10, 2010. Archived from the original on August 1, 2018. Retrieved April 6, 2018.
- ^ Connor, Steve (December 13, 2011). «Vast methane ‘plumes’ seen in Arctic ocean as sea ice retreats». The Independent. Archived from the original on December 25, 2011. Retrieved September 4, 2017.
- ^ «Arctic sea ice reaches lowest extent for the year and the satellite record» (Press release). The National Snow and Ice Data Center (NSIDC). September 19, 2012. Archived from the original on October 4, 2012. Retrieved October 7, 2012.
- ^ «Frontiers 2018/19: Emerging Issues of Environmental Concern». UN Environment. Archived from the original on March 6, 2019. Retrieved March 6, 2019.
- ^ Reuters (June 18, 2019). «Scientists shocked by Arctic permafrost thawing 70 years sooner than predicted». The Guardian. ISSN 0261-3077. Archived from the original on October 6, 2019. Retrieved July 14, 2019.
- ^ a b Zubrin, R. M.; Muscatello, A. C.; Berggren, M. (2013). «Integrated Mars in Situ Propellant Production System». Journal of Aerospace Engineering. 26: 43–56. doi:10.1061/(ASCE)AS.1943-5525.0000201.
- ^ «Methane Blast». NASA. May 4, 2007. Archived from the original on November 16, 2019. Retrieved July 7, 2012.
- ^ Chang, Kenneth (November 2, 2012). «Hope of Methane on Mars Fades». The New York Times. Archived from the original on June 8, 2019. Retrieved November 3, 2012.
- ^ Atreya, Sushil K.; Mahaffy, Paul R.; Wong, Ah-San (2007). «Methane and related trace species on Mars: origin, loss, implications for life, and habitability». Planetary and Space Science. 55 (3): 358–369. Bibcode:2007P&SS…55..358A. doi:10.1016/j.pss.2006.02.005. hdl:2027.42/151840.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Brown, Dwayne; Wendel, JoAnna; Steigerwald, Bill; Jones, Nancy; Good, Andrew (June 7, 2018). «Release 18-050 – NASA Finds Ancient Organic Material, Mysterious Methane on Mars». NASA. Archived from the original on June 7, 2018. Retrieved June 7, 2018.
- ^ NASA (June 7, 2018). «Ancient Organics Discovered on Mars – video (03:17)». NASA. Archived from the original on June 7, 2018. Retrieved June 7, 2018.
- ^ Wall, Mike (June 7, 2018). «Curiosity Rover Finds Ancient ‘Building Blocks for Life’ on Mars». Space.com. Archived from the original on June 7, 2018. Retrieved June 7, 2018.
- ^ Chang, Kenneth (June 7, 2018). «Life on Mars? Rover’s Latest Discovery Puts It ‘On the Table’ – The identification of organic molecules in rocks on the red planet does not necessarily point to life there, past or present, but does indicate that some of the building blocks were present». The New York Times. Archived from the original on June 8, 2018. Retrieved June 8, 2018.
- ^ Voosen, Paul (June 7, 2018). «NASA rover hits organic pay dirt on Mars». Science. doi:10.1126/science.aau3992. S2CID 115442477.
- ^ ten Kate, Inge Loes (June 8, 2018). «Organic molecules on Mars». Science. 360 (6393): 1068–1069. Bibcode:2018Sci…360.1068T. doi:10.1126/science.aat2662. PMID 29880670. S2CID 46952468.
- ^ Webster, Christopher R.; et al. (June 8, 2018). «Background levels of methane in Mars’ atmosphere show strong seasonal variations». Science. 360 (6393): 1093–1096. Bibcode:2018Sci…360.1093W. doi:10.1126/science.aaq0131. PMID 29880682.
- ^ Eigenbrode, Jennifer L.; et al. (June 8, 2018). «Organic matter preserved in 3-billion-year-old mudstones at Gale crater, Mars». Science. 360 (6393): 1096–1101. Bibcode:2018Sci…360.1096E. doi:10.1126/science.aas9185. PMID 29880683.
- ^ Richardson, Derek (September 27, 2016). «Elon Musk Shows Off Interplanetary Transport System». Spaceflight Insider. Archived from the original on October 1, 2016. Retrieved October 3, 2016.
- ^ Oze, C.; Sharma, M. (2005). «Have olivine, will gas: Serpentinization and the abiogenic production of methane on Mars». Geophysical Research Letters. 32 (10): L10203. Bibcode:2005GeoRL..3210203O. doi:10.1029/2005GL022691. S2CID 28981740.
- ^ Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta … Sull’ Aria Inflammable Nativa Delle Paludi Archived November 6, 2018, at the Wayback Machine [Letters of Signor Don Alessandro Volta … on the flammable native air of the marshes], Milan, Italy: Giuseppe Marelli.
- ^ a b Methane. BookRags. Archived from the original on March 3, 2016. Retrieved January 26, 2012.
- ^ Holland, John (1841). The history and description of fossil fuel, the collieries, and coal trade of Great Britain. London, Whittaker and Co. pp. 271–272. Retrieved May 16, 2021.
- ^ Hofmann, A. W. (1866). «On the action of trichloride of phosphorus on the salts of the aromatic monoamines». Proceedings of the Royal Society of London. 15: 55–62. JSTOR 112588. Archived from the original on May 3, 2017. Retrieved June 14, 2016.; see footnote on pp. 57–58
- ^ McBride, James Michael (1999) «Development of systematic names for the simple alkanes». Chemistry Department, Yale University (New Haven, Connecticut). Archived March 16, 2012, at the Wayback Machine
- ^ Harper, Douglas. «methane». Online Etymology Dictionary.
- ^ Jayasundara, Susantha (December 3, 2014). «Is there is any difference in expressing greenhouse gases as CH4Kg/ha and CH4-C Kg/ha?». ResearchGate. Archived from the original on October 1, 2021. Retrieved August 26, 2020.
- ^ «User’s Guide For Estimating Carbon Dioxide, Methane, And Nitrous Oxide Emissions From Agriculture Using The State Inventory Tool» (PDF). US EPA. November 26, 2019. Archived (PDF) from the original on October 1, 2021. Retrieved August 26, 2020.
- ^ «What does CH4-C mean? – Definition of CH4-C – CH4-C stands for Methane-carbon ratio». acronymsandslang.com. Archived from the original on April 11, 2015. Retrieved August 26, 2020.
- ^ Office of Air and Radiation, US EPA (October 7, 1999). «U.S. Methane Emissions 1990–2020: Inventories, Projections, and Opportunities for Reductions (EPA 430-R-99-013)» (PDF). ourenergypolicy.org. Archived (PDF) from the original on October 26, 2020. Retrieved August 26, 2020.
- ^ Dozolme, Philippe. «Common Mining Accidents». About.com. Archived from the original on November 11, 2012. Retrieved November 7, 2012.
- ^ Messina, Lawrence & Bluestein, Greg (April 8, 2010). «Fed official: Still too soon for W.Va. mine rescue». News.yahoo.com. Archived from the original on April 8, 2010. Retrieved April 8, 2010.
- ^ OSMAN, Karim; GENIAUT, Baptiste; HERCHIN, Nicolas; BLANCHETIERE, Vincent (2015). «A review of damages observed after catastrophic events experienced in the mid-stream gas industry compared to consequences modelling tools» (PDF). Symposium Series. 160 (25). Retrieved July 1, 2022.
- ^ Casal, Joaquim; Gómez-Mares, Mercedes; Muñoz, Miguel; Palacios, Adriana (2012). «Jet Fires: a «Minor» Fire Hazard?» (PDF). Chemical Engineering Transactions. 26: 13–20. doi:10.3303/CET1226003. Retrieved July 1, 2022.
Cited sources[edit]
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. ISBN 9781498754293.
External links[edit]
Wikimedia Commons has media related to Methane.
Look up methane in Wiktionary, the free dictionary.
- Methane at The Periodic Table of Videos (University of Nottingham)
- International Chemical Safety Card 0291
- Gas (Methane) Hydrates – A New Frontier – United States Geological Survey
- Lunsford, Jack H. (2000). «Catalytic conversion of methane to more useful chemicals and fuels: A challenge for the 21st century». Catalysis Today. 63 (2–4): 165–174. doi:10.1016/S0920-5861(00)00456-9.
- CDC – Handbook for Methane Control in Mining
For the emergency service protocol, see ETHANE.
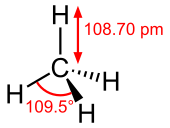
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Methane[1] |
||
| Systematic IUPAC name
Carbane (never recommended[1]) |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1718732 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.739 |
|
| EC Number |
|
|
|
Gmelin Reference |
59 | |
| KEGG |
|
|
| MeSH | Methane | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1971 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CH4 | |
| Molar mass | 16.043 g·mol−1 | |
| Appearance | Colorless gas | |
| Odor | Odorless | |
| Density |
|
|
| Melting point | −182.456 °C (−296.421 °F; 90.694 K)[3] | |
| Boiling point | −161.5 °C (−258.7 °F; 111.6 K)[3] | |
| Critical point (T, P) | 190.56 K (−82.59 °C; −116.66 °F), 4.5992 megapascals (45.391 atm) | |
|
Solubility in water |
22.7 mg·L−1[4] | |
| Solubility | Soluble in ethanol, diethyl ether, benzene, toluene, methanol, acetone and insoluble in water | |
| log P | 1.09 | |
|
Henry’s law |
14 nmol·Pa−1·kg−1 | |
| Conjugate acid | Methanium | |
| Conjugate base | Methyl anion | |
|
Magnetic susceptibility (χ) |
−17.4×10−6 cm3·mol−1[5] | |
| Structure | ||
|
Point group |
Td | |
|
Molecular shape |
Tetrahedron | |
|
Dipole moment |
0 D | |
| Thermochemistry[6] | ||
|
Heat capacity (C) |
35.7 J·(K·mol)−1 | |
|
Std molar |
186.3 J·(K·mol)−1 | |
|
Std enthalpy of |
−74.6 kJ·mol−1 | |
|
Gibbs free energy (ΔfG⦵) |
−50.5 kJ·mol−1 | |
|
Std enthalpy of |
−891 kJ·mol−1 | |
| Hazards[7] | ||
| GHS labelling: | ||
|
Pictograms |

|
|
|
Signal word |
Danger | |
|
Hazard statements |
H220 | |
|
Precautionary statements |
P210 | |
| NFPA 704 (fire diamond) |
2 4 0 SA |
|
| Flash point | −188 °C (−306.4 °F; 85.1 K) | |
|
Autoignition |
537 °C (999 °F; 810 K) | |
| Explosive limits | 4.4–17% | |
| Related compounds | ||
|
Related alkanes |
|
|
| Supplementary data page | ||
| Methane (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Methane ( MEH-thayn, MEE-thayn) is a chemical compound with the chemical formula CH4 (one carbon atom bonded to four hydrogen atoms). It is a group-14 hydride, the simplest alkane, and the main constituent of natural gas. The relative abundance of methane on Earth makes it an economically attractive fuel, although capturing and storing it poses technical challenges due to its gaseous state under normal conditions for temperature and pressure.
Naturally occurring methane is found both below ground and under the seafloor and is formed by both geological and biological processes. The largest reservoir of methane is under the seafloor in the form of methane clathrates. When methane reaches the surface and the atmosphere, it is known as atmospheric methane.[9] The Earth’s atmospheric methane concentration has increased by about 150% since 1750, and it accounts for 20% of the total radiative forcing from all of the long-lived and globally mixed greenhouse gases.[10] It has also been detected on other planets, including Mars, which has implications for astrobiology research.[11]
Properties and bonding[edit]
Methane is a tetrahedral molecule with four equivalent C–H bonds. Its electronic structure is described by four bonding molecular orbitals (MOs) resulting from the overlap of the valence orbitals on C and H. The lowest-energy MO is the result of the overlap of the 2s orbital on carbon with the in-phase combination of the 1s orbitals on the four hydrogen atoms. Above this energy level is a triply degenerate set of MOs that involve overlap of the 2p orbitals on carbon with various linear combinations of the 1s orbitals on hydrogen. The resulting «three-over-one» bonding scheme is consistent with photoelectron spectroscopic measurements.
Methane is an odorless gas and appears to be colorless.[12] It does absorb visible light especially at the red end of the spectrum due to overtone bands, but the effect is only noticeable if the light path is very long. This is what gives Uranus and Neptune their blue or bluish-green colors, as light passes through their atmospheres containing methane and is then scattered back out.[13]
The familiar smell of natural gas as used in homes is achieved by the addition of an odorant, usually blends containing tert-butylthiol, as a safety measure. Methane has a boiling point of −161.5 °C at a pressure of one atmosphere.[3] As a gas, it is flammable over a range of concentrations (5.4–17%) in air at standard pressure.
Solid methane exists in several modifications. Presently nine are known.[14] Cooling methane at normal pressure results in the formation of methane I. This substance crystallizes in the cubic system (space group Fm3m). The positions of the hydrogen atoms are not fixed in methane I, i.e. methane molecules may rotate freely. Therefore, it is a plastic crystal.[15]
Chemical reactions[edit]
The primary chemical reactions of methane are combustion, steam reforming to syngas, and halogenation. In general, methane reactions are difficult to control.
Selective oxidation[edit]
Partial oxidation of methane to methanol, a more convenient, liquid fuel, is challenging because the reaction typically progresses all the way to carbon dioxide and water even with an insufficient supply of oxygen. The enzyme methane monooxygenase produces methanol from methane, but cannot be used for industrial-scale reactions.[16] Some homogeneously catalyzed systems and heterogeneous systems have been developed, but all have significant drawbacks. These generally operate by generating protected products which are shielded from overoxidation. Examples include the Catalytica system, copper zeolites, and iron zeolites stabilizing the alpha-oxygen active site.[17]
One group of bacteria catalyze methane oxidation with nitrite as the oxidant in the absence of oxygen, giving rise to the so-called anaerobic oxidation of methane.[18]
Acid–base reactions[edit]
Like other hydrocarbons, methane is an extremely weak acid. Its pKa in DMSO is estimated to be 56.[19] It cannot be deprotonated in solution, but the conjugate base is known in forms such as methyllithium.
A variety of positive ions derived from methane have been observed, mostly as unstable species in low-pressure gas mixtures. These include methenium or methyl cation CH+
3, methane cation CH+
4, and methanium or protonated methane CH+
5. Some of these have been detected in outer space. Methanium can also be produced as diluted solutions from methane with superacids. Cations with higher charge, such as CH2+
6 and CH3+
7, have been studied theoretically and conjectured to be stable.[20]
Despite the strength of its C–H bonds, there is intense interest in catalysts that facilitate C–H bond activation in methane (and other lower numbered alkanes).[21]
Combustion[edit]
Methane bubbles can be burned on a wet hand without injury.
Methane’s heat of combustion is 55.5 MJ/kg.[22] Combustion of methane is a multiple step reaction summarized as follows:
- (ΔH = −891 k J/mol, at standard conditions)
Peters four-step chemistry is a systematically reduced four-step chemistry that explains the burning of methane.
Methane radical reactions[edit]
Given appropriate conditions, methane reacts with halogen radicals as follows:
where X is a halogen: fluorine (F), chlorine (Cl), bromine (Br), or iodine (I). This mechanism for this process is called free radical halogenation. It is initiated when UV light or some other radical initiator (like peroxides) produces a halogen atom. A two-step chain reaction ensues in which the halogen atom abstracts a hydrogen atom from a methane molecule, resulting in the formation of a hydrogen halide molecule and a methyl radical (CH3•). The methyl radical then reacts with a molecule of the halogen to form a molecule of the halomethane, with a new halogen atom as byproduct.[23] Similar reactions can occur on the halogenated product, leading to replacement of additional hydrogen atoms by halogen atoms with dihalomethane, trihalomethane, and ultimately, tetrahalomethane structures, depending upon reaction conditions and the halogen-to-methane ratio.
Uses[edit]
Methane is used in industrial chemical processes and may be transported as a refrigerated liquid (liquefied natural gas, or LNG). While leaks from a refrigerated liquid container are initially heavier than air due to the increased density of the cold gas, the gas at ambient temperature is lighter than air. Gas pipelines distribute large amounts of natural gas, of which methane is the principal component.
Fuel[edit]
Methane is used as a fuel for ovens, homes, water heaters, kilns, automobiles,[24][25] turbines, etc. Activated carbon is used to store methane. Refined liquid methane is used as a rocket fuel,[26] when combined with liquid oxygen, as in the BE-4 and Raptor engines.[27]
As the major constituent of natural gas, methane is important for electricity generation by burning it as a fuel in a gas turbine or steam generator. Compared to other hydrocarbon fuels, methane produces less carbon dioxide for each unit of heat released. At about 891 kJ/mol, methane’s heat of combustion is lower than that of any other hydrocarbon, but the ratio of the heat of combustion (891 kJ/mol) to the molecular mass (16.0 g/mol, of which 12.0 g/mol is carbon) shows that methane, being the simplest hydrocarbon, produces more heat per mass unit (55.7 kJ/g) than other complex hydrocarbons. In many cities, methane is piped into homes for domestic heating and cooking. In this context it is usually known as natural gas, which is considered to have an energy content of 39 megajoules per cubic meter, or 1,000 BTU per standard cubic foot. Liquefied natural gas (LNG) is predominantly methane (CH4) converted into liquid form for ease of storage or transport.
As a liquid rocket fuel, methane offers the advantage over kerosene of producing small exhaust molecules. This deposits less soot on the internal parts of rocket motors, reducing the difficulty of booster re-use. The lower molecular weight of the exhaust also increases the fraction of the heat energy which is in the form of kinetic energy available for propulsion, increasing the specific impulse of the rocket. Liquid methane also has a temperature range (91–112 K) nearly compatible with liquid oxygen (54–90 K).
Chemical feedstock[edit]
Natural gas, which is mostly composed of methane, is used to produce hydrogen gas on an industrial scale. Steam methane reforming (SMR), or simply known as steam reforming, is the standard industrial method of producing commercial bulk hydrogen gas. More than 50 million metric tons are produced annually worldwide (2013), principally from the SMR of natural gas.[28] Much of this hydrogen is used in petroleum refineries, in the production of chemicals and in food processing. Very large quantities of hydrogen are used in the industrial synthesis of ammonia.
At high temperatures (700–1100 °C) and in the presence of a metal-based catalyst (nickel), steam reacts with methane to yield a mixture of CO and H2, known as «water gas» or «syngas»:
This reaction is strongly endothermic (consumes heat, ΔHr = 206 kJ/mol).
Additional hydrogen is obtained by the reaction of CO with water via the water-gas shift reaction:
This reaction is mildly exothermic (produces heat, ΔHr = −41 kJ/mol).
Methane is also subjected to free-radical chlorination in the production of chloromethanes, although methanol is a more typical precursor.[29]
Hydrogen can also be produced via the direct decomposition of methane, also known as methane Pyrolysis. Unlike steam reforming, the methane pyrolysis reaction itself does not produce greenhouse gases. The heat needed for the reaction can be GHG emission free, too, e.g. from concentrated sunlight, renewable electricity or burning some of the produced hydrogen. If the methane is from biogas then the process can be a carbon sink. Temperatures in excess of 1200 °C are required to break the bonds of methane to produce Hydrogen gas and solid carbon. However, through the use of a suitable catalyst the reaction temperature can be reduced to between 600 °C — 1000 °C depending on the chosen catalyst.[30] The reaction is moderately endothermic as shown in the reaction equation below.[31]
- (ΔH° = 74.8 kJ/mol)
Generation[edit]
Geological routes[edit]
The two main routes for geological methane generation are (i) organic (thermally generated, or thermogenic) and (ii) inorganic (abiotic).[11] Thermogenic methane occurs due to the breakup of organic matter at elevated temperatures and pressures in deep sedimentary strata. Most methane in sedimentary basins is thermogenic; therefore, thermogenic methane is the most important source of natural gas. Thermogenic methane components are typically considered to be relic (from an earlier time). Generally, formation of thermogenic methane (at depth) can occur through organic matter breakup, or organic synthesis. Both ways can involve microorganisms (methanogenesis), but may also occur inorganically. The processes involved can also consume methane, with and without microorganisms.
The more important source of methane at depth (crystalline bedrock) is abiotic. Abiotic means that methane is created from inorganic compounds, without biological activity, either through magmatic processes or via water-rock reactions that occur at low temperatures and pressures, like serpentinization.[32][33]
Biological routes[edit]
Most of Earth’s methane is biogenic and is produced by methanogenesis,[34][35] a form of anaerobic respiration only known to be conducted by some members of the domain Archaea.[36] Methanogens occupy landfills and other soils,[37] ruminants (for example, cattle),[38] the guts of termites, and the anoxic sediments below the seafloor and the bottom of lakes. Rice fields also generate large amounts of methane during plant growth.[39] This multistep process is used by these microorganisms for energy. The net reaction of methanogenesis is:
The final step in the process is catalyzed by the enzyme methyl coenzyme M reductase (MCR).[40]
Testing Australian sheep for exhaled methane production (2001), CSIRO
This image represents a ruminant, specifically a sheep, producing methane in the four stages of hydrolysis, acidogenesis, acetogenesis, and methanogenesis.
Ruminants[edit]
Ruminants, such as cattle, belch methane, accounting for about 22% of the U.S. annual methane emissions to the atmosphere.[41] One study reported that the livestock sector in general (primarily cattle, chickens, and pigs) produces 37% of all human-induced methane.[42] A 2013 study estimated that livestock accounted for 44% of human-induced methane and about 15% of human-induced greenhouse gas emissions.[43] Many efforts are underway to reduce livestock methane production, such as medical treatments and dietary adjustments,[44][45] and to trap the gas to use its combustion energy.[46]
Seafloor sediments[edit]
Most of the subseafloor is anoxic because oxygen is removed by aerobic microorganisms within the first few centimeters of the sediment. Below the oxygen-replete seafloor, methanogens produce methane that is either used by other organisms or becomes trapped in gas hydrates.[36] These other organisms that utilize methane for energy are known as methanotrophs (‘methane-eating’), and are the main reason why little methane generated at depth reaches the sea surface.[36] Consortia of Archaea and Bacteria have been found to oxidize methane via anaerobic oxidation of methane (AOM); the organisms responsible for this are anaerobic methanotrophic Archaea (ANME) and sulfate-reducing bacteria (SRB).[47]
Industrial routes[edit]
Given its cheap abundance in natural gas, there is little incentive to produce methane industrially. Methane can be produced by hydrogenating carbon dioxide through the Sabatier process. Methane is also a side product of the hydrogenation of carbon monoxide in the Fischer–Tropsch process, which is practiced on a large scale to produce longer-chain molecules than methane.
An example of large-scale coal-to-methane gasification is the Great Plains Synfuels plant, started in 1984 in Beulah, North Dakota as a way to develop abundant local resources of low-grade lignite, a resource that is otherwise difficult to transport for its weight, ash content, low calorific value and propensity to spontaneous combustion during storage and transport. A number of similar plants exist around the world, although mostly these plants are targeted towards the production of long chain alkanes for use as gasoline, diesel, or feedstock to other processes.
Power to methane is a technology that uses electrical power to produce hydrogen from water by electrolysis and uses the Sabatier reaction to combine hydrogen with carbon dioxide to produce methane. As of 2021, this is mostly under development and not in large-scale use. Theoretically, the process could be used as a buffer for excess and off-peak power generated by highly fluctuating wind turbines and solar arrays. However, as currently very large amounts of natural gas are used in power plants (e.g. CCGT) to produce electric energy, the losses in efficiency are not acceptable.
Laboratory synthesis[edit]
Methane can be produced by protonation of methyl lithium or a methyl Grignard reagent such as methylmagnesium chloride. It can also be made from anhydrous sodium acetate and dry sodium hydroxide, mixed and heated above 300 °C (with sodium carbonate as byproduct).[citation needed] In practice, a requirement for pure methane can easily be fulfilled by steel gas bottle from standard gas suppliers.
Occurrence[edit]
Methane was discovered and isolated by Alessandro Volta between 1776 and 1778 when studying marsh gas from Lake Maggiore. It is the major component of natural gas, about 87% by volume. The major source of methane is extraction from geological deposits known as natural gas fields, with coal seam gas extraction becoming a major source (see coal bed methane extraction, a method for extracting methane from a coal deposit, while enhanced coal bed methane recovery is a method of recovering methane from non-mineable coal seams). It is associated with other hydrocarbon fuels, and sometimes accompanied by helium and nitrogen. Methane is produced at shallow levels (low pressure) by anaerobic decay of organic matter and reworked methane from deep under the Earth’s surface. In general, the sediments that generate natural gas are buried deeper and at higher temperatures than those that contain oil.
Methane is generally transported in bulk by pipeline in its natural gas form, or by LNG carriers in its liquefied form; few countries transport it by truck.
Atmospheric methane[edit]
Methane (CH4) measured by the Advanced Global Atmospheric Gases Experiment (AGAGE) in the lower atmosphere (troposphere) at stations around the world. Abundances are given as pollution free monthly mean mole fractions in parts-per-billion.
In 2010, methane levels in the Arctic were measured at 1850 nmol/mol. This level is over twice as high as at any time in the last 400,000 years. Historic methane concentrations in the world’s atmosphere have ranged between 300 and 400 nmol/mol during glacial periods commonly known as ice ages, and between 600 and 700 nmol/mol during the warm interglacial periods. The Earth’s oceans are a potential important source of Arctic methane.[48]
Methane is an important greenhouse gas with a global warming potential of 34 compared to CO2 (potential of 1) over a 100-year period, and 72 over a 20-year period.[49][50]
The Earth’s atmospheric methane concentration has increased by about 150% since 1750, and it accounts for 20% of the total radiative forcing from all of the long-lived and globally mixed greenhouse gases. The AR6 of the IPCC states: «Observed increases in well-mixed greenhouse gas (GHG) concentrations since around 1750 are unequivocally caused by human activities. Since 2011 (measurements reported in AR5), concentrations have continued to increase in the atmosphere, reaching annual averages of 410 ppm for carbon dioxide (CO2), 1866 ppb for methane (CH4), and 332 ppb for nitrous oxide (N2O) in 2019. (…) In 2019, atmospheric CO2 concentrations were higher than at any time in at least 2 million years (high confidence), and concentrations of CH4 and N2O were higher than at any time in at least 800,000 years (very high confidence). Since 1750, increases in CO2 (47%) and CH4 (156%) concentrations far exceed, and increases in N2O (23%) are similar to, the natural multi-millennial changes between glacial and interglacial periods over at least the past 800,000 years (very high confidence)».[10]
From 2015 to 2019 sharp rises in levels of atmospheric methane have been recorded.[51][52] In February 2020, it was reported that fugitive emissions and gas venting from the fossil fuel industry may have been significantly underestimated.[53]
Climate change can increase atmospheric methane levels by increasing methane production in natural ecosystems, forming a Climate change feedback.[36][54] Another explanation for the rise in methane emissions could be a slowdown of the chemical reaction that removes methane from the atmosphere.[55]
Clathrates[edit]
Methane clathrates (also known as methane hydrates) are solid cages of water molecules that trap single molecules of methane. Significant reservoirs of methane clathrates have been found in arctic permafrost and along continental margins beneath the ocean floor within the gas clathrate stability zone, located at high pressures (1 to 100 MPa; lower end requires lower temperature) and low temperatures (< 15 °C; upper end requires higher pressure).[56] Methane clathrates can form from biogenic methane, thermogenic methane, or a mix of the two. These deposits are both a potential source of methane fuel as well as a potential contributor to global warming.[57][58] The global mass of carbon stored in gas clathrates is still uncertain and has been estimated as high as 12,500 Gt carbon and as low as 500 Gt carbon.[59] The estimate has declined over time with a most recent estimate of ~1800 Gt carbon.[60] A large part of this uncertainty is due to our knowledge gap in sources and sinks of methane and the distribution of methane clathrates at the global scale. For example, a source of methane was discovered relatively recently in an ultraslow spreading ridge in the Arctic.[61] Some climate models suggest that today’s methane emission regime from the ocean floor is potentially similar to that during the period of the Paleocene–Eocene Thermal Maximum (PETM) around 55.5 million years ago, although there are no data indicating that methane from clathrate dissociation currently reaches the atmosphere.[60] Arctic methane release from permafrost and seafloor methane clathrates is a potential consequence and further cause of global warming; this is known as the clathrate gun hypothesis.[62][63][64][65] Data from 2016 indicate that Arctic permafrost thaws faster than predicted.[66]
[edit]
Interstellar medium[edit]
Methane is abundant in many parts of the Solar System and potentially could be harvested on the surface of another solar-system body (in particular, using methane production from local materials found on Mars[67] or Titan), providing fuel for a return journey.[26][68]
Mars[edit]
Methane has been detected on all planets of the Solar System and most of the larger moons.[citation needed] With the possible exception of Mars, it is believed to have come from abiotic processes.[69][70]
Methane (CH4) on Mars – potential sources and sinks
The Curiosity rover has documented seasonal fluctuations of atmospheric methane levels on Mars. These fluctuations peaked at the end of the Martian summer at 0.6 parts per billion.[71][72][73][74][75][76][77][78]
Methane has been proposed as a possible rocket propellant on future Mars missions due in part to the possibility of synthesizing it on the planet by in situ resource utilization.[79] An adaptation of the Sabatier methanation reaction may be used with a mixed catalyst bed and a reverse water-gas shift in a single reactor to produce methane from the raw materials available on Mars, utilizing water from the Martian subsoil and carbon dioxide in the Martian atmosphere.[67]
Methane could be produced by a non-biological process called serpentinization[a] involving water, carbon dioxide, and the mineral olivine, which is known to be common on Mars.[80]
History[edit]
In November 1776, methane was first scientifically identified by Italian physicist Alessandro Volta in the marshes of Lake Maggiore straddling Italy and Switzerland. Volta was inspired to search for the substance after reading a paper written by Benjamin Franklin about «flammable air».[81] Volta collected the gas rising from the marsh, and by 1778 had isolated pure methane.[82] He also demonstrated that the gas could be ignited with an electric spark.[82]
Following the Felling mine disaster of 1812 in which 92 men perished, Sir Humphry Davy established that the feared firedamp was in fact largely methane.[83]
The name «methane» was coined in 1866 by the German chemist August Wilhelm von Hofmann.[84][85] The name was derived from methanol.
Etymology[edit]
Etymologically, the word methane is coined from the chemical suffix «-ane«, which denotes substances belonging to the alkane family; and the word methyl, which is derived from the German methyl (1840) or directly from the French méthyle, which is a back-formation from the French méthylène (corresponding to English «methylene»), the root of which was coined by Jean-Baptiste Dumas and Eugène Péligot in 1834 from the Greek μέθυ methy (wine) (related to English «mead») and ὕλη hyle (meaning «wood»). The radical is named after this because it was first detected in methanol, an alcohol first isolated by distillation of wood. The chemical suffix -ane is from the coordinating chemical suffix -ine which is from Latin feminine suffix -ina which is applied to represent abstracts. The coordination of «-ane», «-ene», «-one», etc. was proposed in 1866 by German chemist August Wilhelm von Hofmann.[86]
Abbreviations[edit]
The abbreviation CH4-C can mean the mass of carbon contained in a mass of methane, and the mass of methane is always 1.33 times the mass of CH4-C.[87][88] CH4-C can also mean the methane-carbon ratio, which is 1.33 by mass.[89] Methane at scales of the atmosphere is commonly measured in teragrams (Tg CH4) or millions of metric tons (MMT CH4), which mean the same thing.[90] Other standard units are also used, such as nanomole (nmol, one billionth of a mole), mole (mol), kilogram, and gram.
Safety[edit]
Methane is nontoxic, yet it is extremely flammable and may form explosive mixtures with air. Methane is also an asphyxiant if the oxygen concentration is reduced to below about 16% by displacement, as most people can tolerate a reduction from 21% to 16% without ill effects. The concentration of methane at which asphyxiation risk becomes significant is much higher than the 5–15% concentration in a flammable or explosive mixture. Methane off-gas can penetrate the interiors of buildings near landfills and expose occupants to significant levels of methane. Some buildings have specially engineered recovery systems below their basements to actively capture this gas and vent it away from the building.
Methane gas explosions are responsible for many deadly mining disasters.[91] A methane gas explosion was the cause of the Upper Big Branch coal mine disaster in West Virginia on April 5, 2010, killing 29.[92] Natural gas accidental release has also been a major focus in the field of safety engineering, due to past accidental releases that concluded in the formation of jet fire disasters. [93][94]
See also[edit]
- 2007 Zasyadko mine disaster
- Abiogenic petroleum origin
- Aerobic methane production
- Anaerobic digestion
- Anaerobic respiration
- Arctic methane emissions
- Biogas
- Coal Oil Point seep field
- Energy density
- Fugitive gas emissions
- Global Methane Initiative
- Thomas Gold
- Halomethane, halogenated methane derivatives.
- Hydrogen Cycle
- Industrial gas
- Lake Kivu (more general: limnic eruption)
- List of straight-chain alkanes
- Methanation
- Methane emissions
- Methane on Mars:
- atmosphere
- climate
- Methanogen, archaea that produce methane.
- Methanogenesis, microbes that produce methane.
- Methanotroph, bacteria that grow with methane.
- Methyl group, a functional group related to methane.
Explanatory notes[edit]
- ^ There are many serpentinization reactions. Olivine is a solid solution between forsterite and fayalite whose general formula is (Fe,Mg)2SiO4. The reaction producing methane from olivine can be written as: Forsterite + Fayalite + Water + Carbonic acid → Serpentine + Magnetite + Methane , or (in balanced form): 18 Mg2SiO4 + 6 Fe2SiO4 + 26 H2O + CO2 → 12 Mg3Si2O5(OH)4 + 4 Fe3O4 + CH4
Citations[edit]
- ^ a b «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 3–4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Methane is a retained name (see P-12.3) that is preferred to the systematic name ‘carbane’, a name never recommended to replace methane, but used to derive the names ‘carbene’ and ‘carbyne’ for the radicals H2C2• and HC3•, respectively.
- ^ «Gas Encyclopedia». Archived from the original on December 26, 2018. Retrieved November 7, 2013.
- ^ a b c d Haynes, p. 3.344
- ^ Haynes, p. 5.156
- ^ Haynes, p. 3.578
- ^ Haynes, pp. 5.26, 5.67
- ^ «Safety Datasheet, Material Name: Methane» (PDF). USA: Metheson Tri-Gas Incorporated. December 4, 2009. Archived from the original (PDF) on June 4, 2012. Retrieved December 4, 2011.
- ^ NOAA Office of Response and Restoration, US GOV. «METHANE». noaa.gov. Archived from the original on January 9, 2019. Retrieved March 20, 2015.
- ^ Khalil, M. A. K. (1999). «Non-Co2 Greenhouse Gases in the Atmosphere». Annual Review of Energy and the Environment. 24: 645–661. doi:10.1146/annurev.energy.24.1.645.
- ^ a b «Climate Change 2021. The Physical Science Basis. Summary for Policymakers. Working Group I contribution to the WGI Sixth Assessment Report of the Intergovernmental Panel on Climate Change». IPCC. The Intergovernmental Panel on Climate Change. Archived from the original on August 22, 2021. Retrieved August 22, 2021.
- ^ a b Etiope, Giuseppe; Lollar, Barbara Sherwood (2013). «Abiotic Methane on Earth». Reviews of Geophysics. 51 (2): 276–299. Bibcode:2013RvGeo..51..276E. doi:10.1002/rog.20011. S2CID 56457317.
- ^ Hensher, David A.; Button, Kenneth J. (2003). Handbook of transport and the environment. Emerald Group Publishing. p. 168. ISBN 978-0-08-044103-0. Archived from the original on March 19, 2015. Retrieved February 22, 2016.
- ^ P.G.J Irwin; et al. (January 12, 2022). «Hazy Blue Worlds: A Holistic Aerosol Model for Uranus and Neptune, Including Dark Spots». Journal of Geophysical Research: Planets. 127 (6): e2022JE007189. arXiv:2201.04516. doi:10.1029/2022JE007189. PMC 9286428. PMID 35865671. S2CID 245877540.
- ^ Bini, R.; Pratesi, G. (1997). «High-pressure infrared study of solid methane: Phase diagram up to 30 GPa». Physical Review B. 55 (22): 14800–14809. Bibcode:1997PhRvB..5514800B. doi:10.1103/physrevb.55.14800.
- ^ Wendelin Himmelheber. «Crystal structures». Archived from the original on February 12, 2020. Retrieved December 10, 2019.
- ^ Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. (2003). «Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase». Chemical Reviews. 103 (6): 2385–419. doi:10.1021/cr950244f. PMID 12797835.
- ^ Snyder, Benjamin E. R.; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (December 19, 2017). «Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes». Chemical Reviews. 118 (5): 2718–2768. doi:10.1021/acs.chemrev.7b00344. PMID 29256242.
- ^
Reimann, Joachim; Jetten, Mike S.M.; Keltjens, Jan T. (2015). «Chapter 7 Metal Enzymes in «Impossible» Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane«. In Peter M.H. Kroneck and Martha E. Sosa Torres (ed.). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Vol. 15. Springer. pp. 257–313. doi:10.1007/978-3-319-12415-5_7. ISBN 978-3-319-12414-8. PMID 25707470. - ^ Bordwell, Frederick G. (1988). «Equilibrium acidities in dimethyl sulfoxide solution». Accounts of Chemical Research. 21 (12): 456–463. doi:10.1021/ar00156a004.
- ^ Rasul, G.; Surya Prakash, G.K.; Olah, G.A. (2011). «Comparative study of the hypercoordinate carbonium ions and their boron analogs: A challenge for spectroscopists». Chemical Physics Letters. 517 (1): 1–8. Bibcode:2011CPL…517….1R. doi:10.1016/j.cplett.2011.10.020.
- ^ Bernskoetter, W. H.; Schauer, C. K.; Goldberg, K. I.; Brookhart, M. (2009). «Characterization of a Rhodium(I) σ-Methane Complex in Solution». Science. 326 (5952): 553–556. Bibcode:2009Sci…326..553B. doi:10.1126/science.1177485. PMID 19900892. S2CID 5597392.
- ^ Energy Content of some Combustibles (in MJ/kg) Archived January 9, 2014, at the Wayback Machine. People.hofstra.edu. Retrieved on March 30, 2014.
- ^ March, Jerry (1968). Advance Organic Chemistry: Reactions, Mechanisms and Structure. New York: McGraw-Hill Book Company. pp. 533–534.
- ^ «Lumber Company Locates Kilns at Landfill to Use Methane – Energy Manager Today». Energy Manager Today. September 23, 2015. Archived from the original on July 9, 2019. Retrieved March 11, 2016.
- ^ Cornell, Clayton B. (April 29, 2008). «Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country». Archived from the original on January 20, 2019. Retrieved July 25, 2009.
Compressed natural gas is touted as the ‘cleanest burning’ alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline
- ^ a b
Thunnissen, Daniel P.; Guernsey, C. S.; Baker, R. S.; Miyake, R. N. (2004). «Advanced Space Storable Propellants for Outer Planet Exploration» (PDF). American Institute of Aeronautics and Astronautics (4–0799): 28. Archived from the original (PDF) on March 10, 2016. - ^ «Blue Origin BE-4 Engine». Archived from the original on October 1, 2021. Retrieved June 14, 2019.
We chose LNG because it is highly efficient, low cost and widely available. Unlike kerosene, LNG can be used to self-pressurize its tank. Known as autogenous repressurization, this eliminates the need for costly and complex systems that draw on Earth’s scarce helium reserves. LNG also possesses clean combustion characteristics even at low throttle, simplifying engine reuse compared to kerosene fuels.
- ^ Report of the Hydrogen Production Expert Panel: A Subcommittee of the Hydrogen & Fuel Cell Technical Advisory Committee Archived February 14, 2020, at the Wayback Machine. United States Department of Energy (May 2013).
- ^ Rossberg, M. et al. (2006) «Chlorinated Hydrocarbons» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2.
- ^ Lumbers, Brock (2022). «Mathematical modelling and simulation of the thermo-catalytic decomposition of methane for economically improved hydrogen production». International Journal of Hydrogen Energy. 47 (7): 4265–4283. doi:10.1016/j.ijhydene.2021.11.057. S2CID 244814932. Retrieved June 15, 2022.
- ^ Lumbers, Brock (2022). «Low-emission hydrogen production via the thermo-catalytic decomposition of methane for the decarbonisation of iron ore mines in Western Australia». International Journal of Hydrogen Energy. 47 (37): 16347–16361. doi:10.1016/j.ijhydene.2022.03.124. S2CID 248018294. Retrieved July 10, 2022.
- ^ Kietäväinen and Purkamo (2015). «The origin, source, and cycling of methane in deep crystalline rock biosphere». Front. Microbiol. 6: 725. doi:10.3389/fmicb.2015.00725. PMC 4505394. PMID 26236303.
- ^ Cramer and Franke (2005). «Indications for an active petroleum system in the Laptev Sea, NE Siberia». Journal of Petroleum Geology. 28 (4): 369–384. Bibcode:2005JPetG..28..369C. doi:10.1111/j.1747-5457.2005.tb00088.x. Archived from the original on October 1, 2021. Retrieved May 23, 2017.
- ^ Lessner, Daniel J. (Dec 2009) Methanogenesis Biochemistry. In: eLS. John Wiley & Sons Ltd, Chichester. http://www.els.net Archived May 13, 2011, at the Wayback Machine
- ^ Thiel, Volker (2018), «Methane Carbon Cycling in the Past: Insights from Hydrocarbon and Lipid Biomarkers», in Wilkes, Heinz (ed.), Hydrocarbons, Oils and Lipids: Diversity, Origin, Chemistry and Fate, Handbook of Hydrocarbon and Lipid Microbiology, Springer International Publishing, pp. 1–30, doi:10.1007/978-3-319-54529-5_6-1, ISBN 9783319545295, S2CID 105761461
- ^ a b c d Dean, Joshua F.; Middelburg, Jack J.; Röckmann, Thomas; Aerts, Rien; Blauw, Luke G.; Egger, Matthias; Jetten, Mike S. M.; de Jong, Anniek E. E.; Meisel, Ove H. (2018). «Methane Feedbacks to the Global Climate System in a Warmer World». Reviews of Geophysics. 56 (1): 207–250. Bibcode:2018RvGeo..56..207D. doi:10.1002/2017RG000559. hdl:1874/366386.
- ^ Serrano-Silva, N.; Sarria-Guzman, Y.; Dendooven, L.; Luna-Guido, M. (2014). «Methanogenesis and methanotrophy in soil: a review». Pedosphere. 24 (3): 291–307. doi:10.1016/s1002-0160(14)60016-3.
- ^ Sirohi, S. K.; Pandey, Neha; Singh, B.; Puniya, A. K. (September 1, 2010). «Rumen methanogens: a review». Indian Journal of Microbiology. 50 (3): 253–262. doi:10.1007/s12088-010-0061-6. PMC 3450062. PMID 23100838.
- ^ IPCC. Climate Change 2013: The physical Science Basis Archived October 3, 2018, at the Wayback Machine. United Nations Environment Programme, 2013: Ch. 6, p. 507 IPCC.ch
- ^ Lyu, Zhe; Shao, Nana; Akinyemi, Taiwo; Whitman, William B. (2018). «Methanogenesis». Current Biology. 28 (13): R727–R732. doi:10.1016/j.cub.2018.05.021. PMID 29990451.
- ^ «Inventory of U.S. Greenhouse Gas Emissions and Sinks: 1990–2014». 2016. Archived from the original on April 12, 2019. Retrieved April 11, 2019. [page needed]
- ^ FAO (2006). Livestock’s Long Shadow–Environmental Issues and Options. Rome, Italy: Food and Agriculture Organization of the United Nations (FAO). Archived from the original on July 26, 2008. Retrieved October 27, 2009.
- ^ Gerber, P.J.; Steinfeld, H.; Henderson, B.; Mottet, A.; Opio, C.; Dijkman, J.; Falcucci, A. & Tempio, G. (2013). «Tackling Climate Change Through Livestock». Rome: Food and Agriculture Organization of the United Nations (FAO). Archived from the original on July 19, 2016. Retrieved July 15, 2016.
- ^ Roach, John (May 13, 2002). «New Zealand Tries to Cap Gaseous Sheep Burps». National Geographic. Archived from the original on June 4, 2011. Retrieved March 2, 2011.
- ^ Roque, Breanna M.; Venegas, Marielena; Kinley, Robert D.; Nys, Rocky de; Duarte, Toni L.; Yang, Xiang; Kebreab, Ermias (March 17, 2021). «Red seaweed (Asparagopsis taxiformis) supplementation reduces enteric methane by over 80 percent in beef steers». PLOS ONE. 16 (3): e0247820. Bibcode:2021PLoSO..1647820R. doi:10.1371/journal.pone.0247820. ISSN 1932-6203. PMC 7968649. PMID 33730064.
- ^ Silverman, Jacob (July 16, 2007). «Do cows pollute as much as cars?». HowStuffWorks.com. Archived from the original on November 4, 2012. Retrieved November 7, 2012.
- ^ Knittel, K.; Wegener, G.; Boetius, A. (2019), McGenity, Terry J. (ed.), «Anaerobic Methane Oxidizers», Microbial Communities Utilizing Hydrocarbons and Lipids: Members, Metagenomics and Ecophysiology, Handbook of Hydrocarbon and Lipid Microbiology, Springer International Publishing, pp. 1–21, doi:10.1007/978-3-319-60063-5_7-1, ISBN 9783319600635
- ^ «Study Finds Surprising Arctic Methane Emission Source». NASA. April 22, 2012. Archived from the original on August 4, 2014. Retrieved March 30, 2014.
- ^ IPCC Fifth Assessment Report, Table 8.7, Chap. 8, p. 8–58 Archived November 1, 2013, at the Wayback Machine (PDF; 8,0 MB)
- ^ Shindell, D. T.; Faluvegi, G.; Koch, D. M.; Schmidt, G. A.; Unger, N.; Bauer, S. E. (2009). «Improved Attribution of Climate Forcing to Emissions». Science. 326 (5953): 716–718. Bibcode:2009Sci…326..716S. doi:10.1126/science.1174760. PMID 19900930. S2CID 30881469. Archived from the original on August 7, 2020. Retrieved August 25, 2020.
- ^ Nisbet, E.G. (February 5, 2019). «Very Strong Atmospheric Methane Growth in the 4 Years 2014–2017: Implications for the Paris Agreement». Global Biogeochemical Cycles. 33 (3): 318–342. Bibcode:2019GBioC..33..318N. doi:10.1029/2018GB006009.
- ^ McKie, Robin (February 2, 2017). «Sharp rise in methane levels threatens world climate targets». The Observer. ISSN 0029-7712. Archived from the original on July 30, 2019. Retrieved July 14, 2019.
- ^ Chelsea Harvey Methane Emissions from Oil and Gas May Be Significantly Underestimated; Estimates of methane coming from natural sources have been too high, shifting the burden to human activities Archived February 24, 2020, at the Wayback Machine E&E News via Scientific American February 21, 2020
- ^ Carrington, Damian (July 21, 2020) First active leak of sea-bed methane discovered in Antarctica Archived July 22, 2020, at the Wayback Machine, The Guardian
- ^ Ravilious, Kate (July 5, 2022). «Methane much more sensitive to global heating than previously thought – study». The Guardian. Retrieved July 5, 2022.
- ^ Bohrmann, Gerhard; Torres, Marta E. (2006), Schulz, Horst D.; Zabel, Matthias (eds.), «Gas Hydrates in Marine Sediments», Marine Geochemistry, Springer Berlin Heidelberg, pp. 481–512, doi:10.1007/3-540-32144-6_14, ISBN 9783540321446
- ^ Miller, G. Tyler (2007). Sustaining the Earth: An Integrated Approach. U.S.A.: Thomson Advantage Books, p. 160. ISBN 0534496725
- ^ Dean, J. F. (2018). «Methane feedbacks to the global climate system in a warmer world». Reviews of Geophysics. 56 (1): 207–250. Bibcode:2018RvGeo..56..207D. doi:10.1002/2017RG000559. hdl:1874/366386.
- ^ Boswell, Ray; Collett, Timothy S. (2011). «Current perspectives on gas hydrate resources». Energy Environ. Sci. 4 (4): 1206–1215. doi:10.1039/c0ee00203h.
- ^ a b Ruppel and Kessler (2017). «The interaction of climate change and methane hydrates». Reviews of Geophysics. 55 (1): 126–168. Bibcode:2017RvGeo..55..126R. doi:10.1002/2016RG000534. Archived from the original on February 7, 2020. Retrieved September 16, 2019.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ «New source of methane discovered in the Arctic Ocean». phys.org. May 1, 2015. Archived from the original on April 10, 2019. Retrieved April 10, 2019.
- ^ «Methane Releases From Arctic Shelf May Be Much Larger and Faster Than Anticipated» (Press release). National Science Foundation (NSF). March 10, 2010. Archived from the original on August 1, 2018. Retrieved April 6, 2018.
- ^ Connor, Steve (December 13, 2011). «Vast methane ‘plumes’ seen in Arctic ocean as sea ice retreats». The Independent. Archived from the original on December 25, 2011. Retrieved September 4, 2017.
- ^ «Arctic sea ice reaches lowest extent for the year and the satellite record» (Press release). The National Snow and Ice Data Center (NSIDC). September 19, 2012. Archived from the original on October 4, 2012. Retrieved October 7, 2012.
- ^ «Frontiers 2018/19: Emerging Issues of Environmental Concern». UN Environment. Archived from the original on March 6, 2019. Retrieved March 6, 2019.
- ^ Reuters (June 18, 2019). «Scientists shocked by Arctic permafrost thawing 70 years sooner than predicted». The Guardian. ISSN 0261-3077. Archived from the original on October 6, 2019. Retrieved July 14, 2019.
- ^ a b Zubrin, R. M.; Muscatello, A. C.; Berggren, M. (2013). «Integrated Mars in Situ Propellant Production System». Journal of Aerospace Engineering. 26: 43–56. doi:10.1061/(ASCE)AS.1943-5525.0000201.
- ^ «Methane Blast». NASA. May 4, 2007. Archived from the original on November 16, 2019. Retrieved July 7, 2012.
- ^ Chang, Kenneth (November 2, 2012). «Hope of Methane on Mars Fades». The New York Times. Archived from the original on June 8, 2019. Retrieved November 3, 2012.
- ^ Atreya, Sushil K.; Mahaffy, Paul R.; Wong, Ah-San (2007). «Methane and related trace species on Mars: origin, loss, implications for life, and habitability». Planetary and Space Science. 55 (3): 358–369. Bibcode:2007P&SS…55..358A. doi:10.1016/j.pss.2006.02.005. hdl:2027.42/151840.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Brown, Dwayne; Wendel, JoAnna; Steigerwald, Bill; Jones, Nancy; Good, Andrew (June 7, 2018). «Release 18-050 – NASA Finds Ancient Organic Material, Mysterious Methane on Mars». NASA. Archived from the original on June 7, 2018. Retrieved June 7, 2018.
- ^ NASA (June 7, 2018). «Ancient Organics Discovered on Mars – video (03:17)». NASA. Archived from the original on June 7, 2018. Retrieved June 7, 2018.
- ^ Wall, Mike (June 7, 2018). «Curiosity Rover Finds Ancient ‘Building Blocks for Life’ on Mars». Space.com. Archived from the original on June 7, 2018. Retrieved June 7, 2018.
- ^ Chang, Kenneth (June 7, 2018). «Life on Mars? Rover’s Latest Discovery Puts It ‘On the Table’ – The identification of organic molecules in rocks on the red planet does not necessarily point to life there, past or present, but does indicate that some of the building blocks were present». The New York Times. Archived from the original on June 8, 2018. Retrieved June 8, 2018.
- ^ Voosen, Paul (June 7, 2018). «NASA rover hits organic pay dirt on Mars». Science. doi:10.1126/science.aau3992. S2CID 115442477.
- ^ ten Kate, Inge Loes (June 8, 2018). «Organic molecules on Mars». Science. 360 (6393): 1068–1069. Bibcode:2018Sci…360.1068T. doi:10.1126/science.aat2662. PMID 29880670. S2CID 46952468.
- ^ Webster, Christopher R.; et al. (June 8, 2018). «Background levels of methane in Mars’ atmosphere show strong seasonal variations». Science. 360 (6393): 1093–1096. Bibcode:2018Sci…360.1093W. doi:10.1126/science.aaq0131. PMID 29880682.
- ^ Eigenbrode, Jennifer L.; et al. (June 8, 2018). «Organic matter preserved in 3-billion-year-old mudstones at Gale crater, Mars». Science. 360 (6393): 1096–1101. Bibcode:2018Sci…360.1096E. doi:10.1126/science.aas9185. PMID 29880683.
- ^ Richardson, Derek (September 27, 2016). «Elon Musk Shows Off Interplanetary Transport System». Spaceflight Insider. Archived from the original on October 1, 2016. Retrieved October 3, 2016.
- ^ Oze, C.; Sharma, M. (2005). «Have olivine, will gas: Serpentinization and the abiogenic production of methane on Mars». Geophysical Research Letters. 32 (10): L10203. Bibcode:2005GeoRL..3210203O. doi:10.1029/2005GL022691. S2CID 28981740.
- ^ Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta … Sull’ Aria Inflammable Nativa Delle Paludi Archived November 6, 2018, at the Wayback Machine [Letters of Signor Don Alessandro Volta … on the flammable native air of the marshes], Milan, Italy: Giuseppe Marelli.
- ^ a b Methane. BookRags. Archived from the original on March 3, 2016. Retrieved January 26, 2012.
- ^ Holland, John (1841). The history and description of fossil fuel, the collieries, and coal trade of Great Britain. London, Whittaker and Co. pp. 271–272. Retrieved May 16, 2021.
- ^ Hofmann, A. W. (1866). «On the action of trichloride of phosphorus on the salts of the aromatic monoamines». Proceedings of the Royal Society of London. 15: 55–62. JSTOR 112588. Archived from the original on May 3, 2017. Retrieved June 14, 2016.; see footnote on pp. 57–58
- ^ McBride, James Michael (1999) «Development of systematic names for the simple alkanes». Chemistry Department, Yale University (New Haven, Connecticut). Archived March 16, 2012, at the Wayback Machine
- ^ Harper, Douglas. «methane». Online Etymology Dictionary.
- ^ Jayasundara, Susantha (December 3, 2014). «Is there is any difference in expressing greenhouse gases as CH4Kg/ha and CH4-C Kg/ha?». ResearchGate. Archived from the original on October 1, 2021. Retrieved August 26, 2020.
- ^ «User’s Guide For Estimating Carbon Dioxide, Methane, And Nitrous Oxide Emissions From Agriculture Using The State Inventory Tool» (PDF). US EPA. November 26, 2019. Archived (PDF) from the original on October 1, 2021. Retrieved August 26, 2020.
- ^ «What does CH4-C mean? – Definition of CH4-C – CH4-C stands for Methane-carbon ratio». acronymsandslang.com. Archived from the original on April 11, 2015. Retrieved August 26, 2020.
- ^ Office of Air and Radiation, US EPA (October 7, 1999). «U.S. Methane Emissions 1990–2020: Inventories, Projections, and Opportunities for Reductions (EPA 430-R-99-013)» (PDF). ourenergypolicy.org. Archived (PDF) from the original on October 26, 2020. Retrieved August 26, 2020.
- ^ Dozolme, Philippe. «Common Mining Accidents». About.com. Archived from the original on November 11, 2012. Retrieved November 7, 2012.
- ^ Messina, Lawrence & Bluestein, Greg (April 8, 2010). «Fed official: Still too soon for W.Va. mine rescue». News.yahoo.com. Archived from the original on April 8, 2010. Retrieved April 8, 2010.
- ^ OSMAN, Karim; GENIAUT, Baptiste; HERCHIN, Nicolas; BLANCHETIERE, Vincent (2015). «A review of damages observed after catastrophic events experienced in the mid-stream gas industry compared to consequences modelling tools» (PDF). Symposium Series. 160 (25). Retrieved July 1, 2022.
- ^ Casal, Joaquim; Gómez-Mares, Mercedes; Muñoz, Miguel; Palacios, Adriana (2012). «Jet Fires: a «Minor» Fire Hazard?» (PDF). Chemical Engineering Transactions. 26: 13–20. doi:10.3303/CET1226003. Retrieved July 1, 2022.
Cited sources[edit]
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. ISBN 9781498754293.
External links[edit]
Wikimedia Commons has media related to Methane.
Look up methane in Wiktionary, the free dictionary.
- Methane at The Periodic Table of Videos (University of Nottingham)
- International Chemical Safety Card 0291
- Gas (Methane) Hydrates – A New Frontier – United States Geological Survey
- Lunsford, Jack H. (2000). «Catalytic conversion of methane to more useful chemicals and fuels: A challenge for the 21st century». Catalysis Today. 63 (2–4): 165–174. doi:10.1016/S0920-5861(00)00456-9.
- CDC – Handbook for Methane Control in Mining
👋 Привет Лёва
Середнячок
40/250
Задать вопрос

jaksilikovaaig
+10
Решено
8 лет назад
Химия
1 — 4 классы
Как пишется химический элемент Метан?
Смотреть ответ
1
Комментарии

IrVB
Метан — это вещество, формула CH4

Жан2000ель
CH4

jaksilikovaaig
спасиб

Ответ
4
(4 оценки)
5
21MASTER12
8 лет назад
Светило науки — 18 ответов — 0 раз оказано помощи
Правильно пишеться не элемент, а формула СН4
(4 оценки)
https://vashotvet.com/task/1865013













![mathsf{2NaOH + CH_3COOH xrightarrow[]{^ot} Na_2CO_3 + CH_4uparrow}](https://dic.academic.ru/dic.nsf/ruwiki/bcae9a4124f50c5773de5a35119055ef.png)






![mathsf{CH_4 + 3[O] rightarrow HCOOH + H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/b9197a58ace7166a10fcfc978f341774.png)

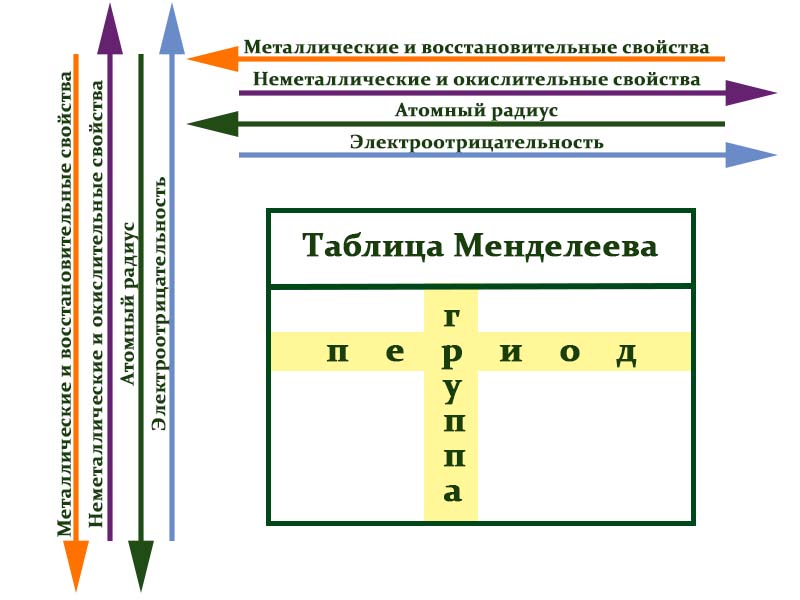
















.jpg)