калия хлорат
- калия хлорат
- ка́лия хлора́т
(бертолетова соль), KClO3, бесцветные кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном производстве и пиротехнике. Ядовит.
* * *
КАЛИЯ ХЛОРАТ
КА́ЛИЯ ХЛОРА́Т (бертолетова соль), KClO3, бесцветные кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном производстве и пиротехнике. Ядовит.
Энциклопедический словарь.
2009.
Смотреть что такое «калия хлорат» в других словарях:
-
КАЛИЯ ХЛОРАТ — (бертоллетова соль) KClO3, бесцветные кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном производстве и пиротехнике. Ядовит … Большой Энциклопедический словарь
-
калия хлорат — kalio chloratas statusas T sritis chemija formulė KClO₃ atitikmenys: angl. potassium chlorate rus. бертолетовая соль; калий хлорноватокислый; калия хлорат ryšiai: sinonimas – kalio trioksochloratas sinonimas – Bertoleto druska … Chemijos terminų aiškinamasis žodynas
-
КАЛИЯ ХЛОРАТ — (Kalii chloras), бертолетова соль, бесцветные блестящие кристаллы. Растворим в воде. Разлагаясь в водных р рах с образованием хлорида калия, действует подобно перекиси водорода, но значительно слабее. В комбинации с тальком (1 : 10) применяют… … Ветеринарный энциклопедический словарь
-
КАЛИЯ ХЛОРАТ — (бертолетова соль), КС1О3, бесцв. кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном произ ве и пиротехнике. Ядовит … Естествознание. Энциклопедический словарь
-
Калиум хлорикум — Kalium chloricum, Калия хлорат — KClO3 калия хлорат, бертолетова соль, в виде бесцветных, прозрачных ромбических пластинок с перламутровым блеском; растворима в воде, взрывается при ударе, трении. Хранится в закрытых стеклянных сосудах. В прошлом употреблялась при цинге,… … Справочник по гомеопатии
-
Хлорат калия — Хлорат калия … Википедия
-
Хлорат кальция — Общие Эмпирическая формула Ca(ClO3)2 Физические свойства Молярная масса 206.98 г/моль Плотность 2.71 г/см³ … Википедия
-
Хлорат меди(II) — Общие Систематическое наименование Хлорат меди(II) Традиционные названия Хлорноватокислая медь Химическая формула Cu(ClO3)2 Физические свойства … Википедия
-
Хлорат бария — Общие Систематическое наименование Хлорат бария Химическая формула Ba(ClO3)2 Физические свойства Состояние (ст. усл.) твердый … Википедия
-
Хлорат серебра — Общие Систематическое наименование Хлорат серебра Традиционные названия Хлорноватокислое серебро Химическая формула AgClO3 Физические свойства … Википедия
| Хлорат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Хлорат калия |
| Традиционные названия | Бертолетова соль |
| Хим. формула | KClO3 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 122.55 г/моль |
| Плотность | 2,32 г/см³ |
| Температура | |
| • плавления | 356 °C |
| • разложения | ~ 400 |
| Энтальпия | |
| • образования | -391,204 кДж/моль |
| Растворимость | |
| • в воде при 0°C | 3,25 г/100 мл |
| • в воде при 20°C | 7,3 г/100 мл |
| • в воде при 100°C | 56,2 г/100 мл |
| • в воде при 104,2°C | 61,5 г/100 мл |
| Рег. номер CAS | [3811-04-9] |
| PubChem | 6426889 |
| Рег. номер EINECS | 223-289-7 |
| SMILES |
[O-]Cl(=O)=O.[K+] |
| InChI |
1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 VKJKEPKFPUWCAS-UHFFFAOYSA-M |
| RTECS | FO0350000 |
| Номер ООН | 1485 |
| ChemSpider | 18512 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
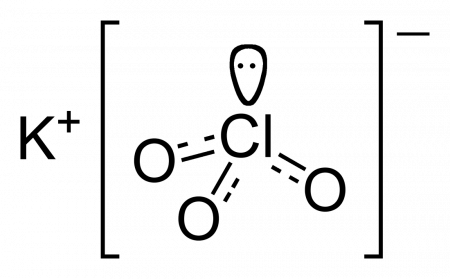
Хлорат калия (бертолетова соль, калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
Содержание
- 1 История
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 4.1 Взрывчатые вещества
- 4.2 В медицине
- 4.3 Для получения кислорода
- 4.4 Для получения диоксида хлора
- 5 Токсичность
История
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
-
- 6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
-
- Cl2 + 2OH− → ClO− + Cl− + H2O
-
- 3ClO− → ClO3− + 2Cl−
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на хлорат калия и исходный хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем хлорат калия, и, таким образом, удобнее для фильтрации.
Химические свойства
- При температуре ~ 400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
-
- 4KClO3 →400oC 3KClO4 + KCl
-
- KClO4 →550−620oC KCl + 2O2
- В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C).
-
- 2KClO3 →150−300 2KCl + 3O2
- Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:
-
- (NH4)2SO4 + 2KClO3 → 2NH4ClO3 + K2SO4
Применение
Взрывчатые вещества
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов, входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.
Для получения диоксида хлора
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
-
- 2KClO3 + H2C2O4 + H2SO4 → K2SO4 + 2ClO2 + 2CO2 + 2H2O
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
-
- 2KClO3 + H2C2O4 → K2CO3 + CO2 + 2ClO2 + H2O
Токсичность
Токсичен. Смертельная доза хлората калия составляет 1 г/кг.
From Wikipedia, the free encyclopedia
|
||

|
||
| Names | ||
|---|---|---|
| Other names
Potassium chlorate(V), Potcrate, Berthollet salt |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.021.173 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1485 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
KClO3 | |
| Molar mass | 122.55 g mol−1 | |
| Appearance | white crystals or powder | |
| Density | 2.32 g/cm3 | |
| Melting point | 356 °C (673 °F; 629 K) | |
| Boiling point | 400 °C (752 °F; 673 K) decomposes[1] | |
|
Solubility in water |
3.13 g/100 mL (0 °C) 4.46 g/100 mL (10 °C) 8.15 g/100 mL (25 °C) 13.21 g/100 mL (40 °C) 53.51 g/100 mL (100 °C) 183 g/100 g (190 °C) 2930 g/100 g (330 °C)[2] |
|
| Solubility | soluble in glycerol negligible in acetone and liquid ammonia[1] |
|
| Solubility in glycerol | 1 g/100 g (20 °C)[1] | |
|
Magnetic susceptibility (χ) |
−42.8·10−6 cm3/mol | |
|
Refractive index (nD) |
1.40835 | |
| Structure | ||
|
Crystal structure |
monoclinic | |
| Thermochemistry | ||
|
Heat capacity (C) |
100.25 J/mol·K[1] | |
|
Std molar |
142.97 J/mol·K[3][1] | |
|
Std enthalpy of |
−391.2 kJ/mol[3][1] | |
|
Gibbs free energy (ΔfG⦵) |
-289.9 kJ/mol[1] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
   [4] [4]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H271, H302, H332, H411[4] | |
|
Precautionary statements |
P220, P273[4] | |
| NFPA 704 (fire diamond) |
2 0 3 OX |
|
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[5] | |
| Safety data sheet (SDS) | ICSC 0548 | |
| Related compounds | ||
|
Other anions |
Potassium bromate Potassium iodate Potassium nitrate |
|
|
Other cations |
Ammonium chlorate Sodium chlorate Barium chlorate |
|
|
Related compounds |
Potassium chloride Potassium hypochlorite Potassium chlorite Potassium perchlorate |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium chlorate is a compound containing potassium, chlorine and oxygen, with the molecular formula KClO3. In its pure form, it is a white crystalline substance. After sodium chlorate, it is the second most common chlorate in industrial use. It is a strong oxidizing agent and its most important application is in safety matches.[6] In other applications it is mostly obsolete and has been replaced by safer alternatives in recent decades. It has been used
- in fireworks, propellants and explosives,
- to prepare oxygen, both in the lab and in chemical oxygen generators,
- as a disinfectant, for example in medical mouthwashes,
- in agriculture as an herbicide.
Production[edit]
On the industrial scale, potassium chlorate is produced by the salt metathesis reaction of sodium chlorate and potassium chloride:
- NaClO3 + KCl → NaCl + KClO3
The reaction is driven by the low solubility of potassium chlorate in water. The equilibrium of the reaction is shifted to the right hand side by the continuous precipitation of the product (Le Chatelier’s Principle). The precursor sodium chlorate is produced industrially in very large quantities by electrolysis of sodium chloride, common table salt.[6]
The direct electrolysis of KCl in aqueous solution is also used sometimes, in which elemental chlorine formed at the anode reacts with KOH in situ. The low solubility of KClO3 in water causes the salt to conveniently isolate itself from the reaction mixture by simply precipitating out of solution.
Potassium chlorate can be produced in small amounts by disproportionation in a sodium hypochlorite solution followed by metathesis reaction with potassium chloride:[7]
- 3 NaOCl(aq) → 2 NaCl(s) + NaClO3(aq)
- KCl(aq) + NaClO3(aq) → NaCl(aq) + KClO3(s)
It can also be produced by passing chlorine gas into a hot solution of caustic potash:[8]
- 3 Cl2(g) + 6 KOH(aq) → KClO3(aq) + 5 KCl(aq) + 3 H2O(l)
Uses[edit]
Potassium chlorate burning sugar
Potassium chlorate was one key ingredient in early firearms percussion caps (primers). It continues in that application, where not supplanted by potassium perchlorate.
Chlorate-based propellants are more efficient than traditional gunpowder and are less susceptible to damage by water. However, they can be extremely unstable in the presence of sulfur or phosphorus and are much more expensive. Chlorate propellants must be used only in equipment designed for them; failure to follow this precaution is a common source of accidents. Potassium chlorate, often in combination with silver fulminate, is used in trick noise-makers known as «crackers», «snappers», «pop-its», or «bang-snaps», a popular type of novelty firework.
Another application of potassium chlorate is as the oxidizer in a smoke composition such as that used in smoke grenades. Since 2005, a cartridge with potassium chlorate mixed with lactose and rosin is used for generating the white smoke signaling the election of new pope by a papal conclave.[9]
Potassium chlorate is often used in high school and college laboratories to generate oxygen gas.[citation needed] It is a far cheaper source than a pressurized or cryogenic oxygen tank. Potassium chlorate readily decomposes if heated while in contact with a catalyst, typically manganese(IV) dioxide (MnO2). Thus, it may be simply placed in a test tube and heated over a burner. If the test tube is equipped with a one-holed stopper and hose, warm oxygen can be drawn off. The reaction is as follows:
Heating it in the absence of a catalyst converts it into potassium perchlorate:[8]
With further heating, potassium perchlorate decomposes to potassium chloride and oxygen:
The safe performance of this reaction requires very pure reagents and careful temperature control. Molten potassium chlorate is an extremely powerful oxidizer and spontaneously reacts with many common materials such as sugar. Explosions have resulted from liquid chlorates spattering into the latex or PVC tubes of oxygen generators, as well as from contact between chlorates and hydrocarbon sealing greases. Impurities in potassium chlorate itself can also cause problems. When working with a new batch of potassium chlorate, it is advisable to take a small sample (~1 gram) and heat it strongly on an open glass plate. Contamination may cause this small quantity to explode, indicating that the chlorate should be discarded.
Potassium chlorate is used in chemical oxygen generators (also called chlorate candles or oxygen candles), employed as oxygen-supply systems of e.g. aircraft, space stations, and submarines, and has been responsible for at least one plane crash. A fire on the space station Mir was traced to oxygen generation candles that use a similar lithium perchlorate. The decomposition of potassium chlorate was also used to provide the oxygen supply for limelights.
Potassium chlorate is used also as a pesticide. In Finland it was sold under trade name Fegabit.
Potassium chlorate can react with sulfuric acid to form a highly reactive solution of chloric acid and potassium sulfate:
- 2 KClO3 + H2SO4 → 2 HClO3 + K2SO4
The solution so produced is sufficiently reactive that it spontaneously ignites if combustible material (sugar, paper, etc.) is present.
In schools, molten potassium chlorate is used in the dramatic screaming jelly babies, Gummy bear, Haribo, and Trolli candy demonstration where the candy is dropped into the molten salt.
In chemical labs it is used to oxidize HCl and release small amounts of gaseous chlorine.
Insurgents in Afghanistan also use potassium chlorate extensively as a key component in the production of improvised explosive devices. When significant effort was made to reduce the availability of ammonium nitrate fertilizer in Afghanistan, IED makers started using potassium chlorate as a cheap and effective alternative. In 2013, 60% of IEDs in Afghanistan used potassium chlorate, making it the most common ingredient used in IEDs.[10]
Potassium chlorate was also the main ingredient in the car bomb used in 2002 Bali bombings that killed 202 people.
Potassium chlorate is used to force the blossoming stage of the longan tree, causing it to produce fruit in warmer climates.[11]
Safety[edit]
Potassium chlorate should be handled with care. It reacts vigorously, and in some cases spontaneously ignites or explodes, when mixed with many combustible materials. It burns vigorously in combination with virtually any combustible material, even those normally only slightly flammable (including ordinary dust and lint). Mixtures of potassium chlorate and a fuel can ignite by contact with sulfuric acid, so it should be kept away from this reagent.
Sulfur should be avoided in pyrotechnic compositions containing potassium chlorate, as these mixtures are prone to spontaneous deflagration. Most sulfur contains trace quantities of sulfur-containing acids, and these can cause spontaneous ignition — «Flowers of sulfur» or «sublimed sulfur», despite the overall high purity, contains significant amounts of sulfur acids. Also, mixtures of potassium chlorate with any compound with ignition promoting properties (ex. antimony(III) sulfide) are very dangerous to prepare, as they are extremely shock sensitive.
See also[edit]
- Chloric acid
References[edit]
- ^ a b c d e f g «potassium chlorate». Retrieved 9 July 2015.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Retrieved 2014-05-29.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b c «Potassium chlorate». Retrieved 14 February 2022.
- ^ Michael Chambers. «ChemIDplus — 3811-04-9 — VKJKEPKFPUWCAS-UHFFFAOYSA-M — Potassium chlorate — Similar structures search, synonyms, formulas, resource links, and other chemical information». Retrieved 9 July 2015.
- ^ a b Vogt, Helmut; Balej, Jan; Bennett, John E.; Wintzer, Peter; Sheikh, Saeed Akbar; Gallone, Patrizio (June 15, 2000). «Chlorine Oxides and Chlorine Oxygen Acids». In Ullmann (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag. doi:10.1002/14356007.a06_483. ISBN 9783527303854.
- ^ Anne Marie Helmenstine, Ph.D. «Potassium Chlorate Synthesis (Substitute) Formula». About.com Education. Retrieved 9 July 2015.
- ^ a b Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Daniel J. Wakin and Alan Cowell (March 13, 2013). «New Round of Voting Fails to Name a Pope». The New York Times. Retrieved March 13, 2013.
- ^ «Afghan bomb makers shifting to new explosives for IEDs». USAToday.com. June 25, 2013. Retrieved 2013-06-25.
- ^ Manochai, P.; Sruamsiri, P.; Wiriya-alongkorn, W.; Naphrom, D.; Hegele, M.; Bangerth, F. (February 12, 2005). «Year around off season flower induction in longan (Dimocarpus longan, Lour.) trees by KClO3 applications: potentials and problems». Scientia Horticulturae. Department of Horticulture, Maejo University, Chiang Mai, Thailand; Department of Horticulture, Chiang Mai University, Chiang Mai, Thailand; Institute of Special Crops and Crop Physiology, University of Hohenheim, 70593 Stuttgart, Germany. 104 (4): 379–390. doi:10.1016/j.scienta.2005.01.004. Retrieved November 28, 2010.
{{cite journal}}: CS1 maint: location (link)
- «Chlorate de potassium. Chlorate de sodium», Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.
- Continuous process for the manufacture of potassium chlorate by coupling with a sodium chlorate production plant
External links[edit]
From Wikipedia, the free encyclopedia
|
||

|
||
| Names | ||
|---|---|---|
| Other names
Potassium chlorate(V), Potcrate, Berthollet salt |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.021.173 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1485 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
KClO3 | |
| Molar mass | 122.55 g mol−1 | |
| Appearance | white crystals or powder | |
| Density | 2.32 g/cm3 | |
| Melting point | 356 °C (673 °F; 629 K) | |
| Boiling point | 400 °C (752 °F; 673 K) decomposes[1] | |
|
Solubility in water |
3.13 g/100 mL (0 °C) 4.46 g/100 mL (10 °C) 8.15 g/100 mL (25 °C) 13.21 g/100 mL (40 °C) 53.51 g/100 mL (100 °C) 183 g/100 g (190 °C) 2930 g/100 g (330 °C)[2] |
|
| Solubility | soluble in glycerol negligible in acetone and liquid ammonia[1] |
|
| Solubility in glycerol | 1 g/100 g (20 °C)[1] | |
|
Magnetic susceptibility (χ) |
−42.8·10−6 cm3/mol | |
|
Refractive index (nD) |
1.40835 | |
| Structure | ||
|
Crystal structure |
monoclinic | |
| Thermochemistry | ||
|
Heat capacity (C) |
100.25 J/mol·K[1] | |
|
Std molar |
142.97 J/mol·K[3][1] | |
|
Std enthalpy of |
−391.2 kJ/mol[3][1] | |
|
Gibbs free energy (ΔfG⦵) |
-289.9 kJ/mol[1] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
   [4] [4]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H271, H302, H332, H411[4] | |
|
Precautionary statements |
P220, P273[4] | |
| NFPA 704 (fire diamond) |
2 0 3 OX |
|
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[5] | |
| Safety data sheet (SDS) | ICSC 0548 | |
| Related compounds | ||
|
Other anions |
Potassium bromate Potassium iodate Potassium nitrate |
|
|
Other cations |
Ammonium chlorate Sodium chlorate Barium chlorate |
|
|
Related compounds |
Potassium chloride Potassium hypochlorite Potassium chlorite Potassium perchlorate |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium chlorate is a compound containing potassium, chlorine and oxygen, with the molecular formula KClO3. In its pure form, it is a white crystalline substance. After sodium chlorate, it is the second most common chlorate in industrial use. It is a strong oxidizing agent and its most important application is in safety matches.[6] In other applications it is mostly obsolete and has been replaced by safer alternatives in recent decades. It has been used
- in fireworks, propellants and explosives,
- to prepare oxygen, both in the lab and in chemical oxygen generators,
- as a disinfectant, for example in medical mouthwashes,
- in agriculture as an herbicide.
Production[edit]
On the industrial scale, potassium chlorate is produced by the salt metathesis reaction of sodium chlorate and potassium chloride:
- NaClO3 + KCl → NaCl + KClO3
The reaction is driven by the low solubility of potassium chlorate in water. The equilibrium of the reaction is shifted to the right hand side by the continuous precipitation of the product (Le Chatelier’s Principle). The precursor sodium chlorate is produced industrially in very large quantities by electrolysis of sodium chloride, common table salt.[6]
The direct electrolysis of KCl in aqueous solution is also used sometimes, in which elemental chlorine formed at the anode reacts with KOH in situ. The low solubility of KClO3 in water causes the salt to conveniently isolate itself from the reaction mixture by simply precipitating out of solution.
Potassium chlorate can be produced in small amounts by disproportionation in a sodium hypochlorite solution followed by metathesis reaction with potassium chloride:[7]
- 3 NaOCl(aq) → 2 NaCl(s) + NaClO3(aq)
- KCl(aq) + NaClO3(aq) → NaCl(aq) + KClO3(s)
It can also be produced by passing chlorine gas into a hot solution of caustic potash:[8]
- 3 Cl2(g) + 6 KOH(aq) → KClO3(aq) + 5 KCl(aq) + 3 H2O(l)
Uses[edit]
Potassium chlorate burning sugar
Potassium chlorate was one key ingredient in early firearms percussion caps (primers). It continues in that application, where not supplanted by potassium perchlorate.
Chlorate-based propellants are more efficient than traditional gunpowder and are less susceptible to damage by water. However, they can be extremely unstable in the presence of sulfur or phosphorus and are much more expensive. Chlorate propellants must be used only in equipment designed for them; failure to follow this precaution is a common source of accidents. Potassium chlorate, often in combination with silver fulminate, is used in trick noise-makers known as «crackers», «snappers», «pop-its», or «bang-snaps», a popular type of novelty firework.
Another application of potassium chlorate is as the oxidizer in a smoke composition such as that used in smoke grenades. Since 2005, a cartridge with potassium chlorate mixed with lactose and rosin is used for generating the white smoke signaling the election of new pope by a papal conclave.[9]
Potassium chlorate is often used in high school and college laboratories to generate oxygen gas.[citation needed] It is a far cheaper source than a pressurized or cryogenic oxygen tank. Potassium chlorate readily decomposes if heated while in contact with a catalyst, typically manganese(IV) dioxide (MnO2). Thus, it may be simply placed in a test tube and heated over a burner. If the test tube is equipped with a one-holed stopper and hose, warm oxygen can be drawn off. The reaction is as follows:
Heating it in the absence of a catalyst converts it into potassium perchlorate:[8]
With further heating, potassium perchlorate decomposes to potassium chloride and oxygen:
The safe performance of this reaction requires very pure reagents and careful temperature control. Molten potassium chlorate is an extremely powerful oxidizer and spontaneously reacts with many common materials such as sugar. Explosions have resulted from liquid chlorates spattering into the latex or PVC tubes of oxygen generators, as well as from contact between chlorates and hydrocarbon sealing greases. Impurities in potassium chlorate itself can also cause problems. When working with a new batch of potassium chlorate, it is advisable to take a small sample (~1 gram) and heat it strongly on an open glass plate. Contamination may cause this small quantity to explode, indicating that the chlorate should be discarded.
Potassium chlorate is used in chemical oxygen generators (also called chlorate candles or oxygen candles), employed as oxygen-supply systems of e.g. aircraft, space stations, and submarines, and has been responsible for at least one plane crash. A fire on the space station Mir was traced to oxygen generation candles that use a similar lithium perchlorate. The decomposition of potassium chlorate was also used to provide the oxygen supply for limelights.
Potassium chlorate is used also as a pesticide. In Finland it was sold under trade name Fegabit.
Potassium chlorate can react with sulfuric acid to form a highly reactive solution of chloric acid and potassium sulfate:
- 2 KClO3 + H2SO4 → 2 HClO3 + K2SO4
The solution so produced is sufficiently reactive that it spontaneously ignites if combustible material (sugar, paper, etc.) is present.
In schools, molten potassium chlorate is used in the dramatic screaming jelly babies, Gummy bear, Haribo, and Trolli candy demonstration where the candy is dropped into the molten salt.
In chemical labs it is used to oxidize HCl and release small amounts of gaseous chlorine.
Insurgents in Afghanistan also use potassium chlorate extensively as a key component in the production of improvised explosive devices. When significant effort was made to reduce the availability of ammonium nitrate fertilizer in Afghanistan, IED makers started using potassium chlorate as a cheap and effective alternative. In 2013, 60% of IEDs in Afghanistan used potassium chlorate, making it the most common ingredient used in IEDs.[10]
Potassium chlorate was also the main ingredient in the car bomb used in 2002 Bali bombings that killed 202 people.
Potassium chlorate is used to force the blossoming stage of the longan tree, causing it to produce fruit in warmer climates.[11]
Safety[edit]
Potassium chlorate should be handled with care. It reacts vigorously, and in some cases spontaneously ignites or explodes, when mixed with many combustible materials. It burns vigorously in combination with virtually any combustible material, even those normally only slightly flammable (including ordinary dust and lint). Mixtures of potassium chlorate and a fuel can ignite by contact with sulfuric acid, so it should be kept away from this reagent.
Sulfur should be avoided in pyrotechnic compositions containing potassium chlorate, as these mixtures are prone to spontaneous deflagration. Most sulfur contains trace quantities of sulfur-containing acids, and these can cause spontaneous ignition — «Flowers of sulfur» or «sublimed sulfur», despite the overall high purity, contains significant amounts of sulfur acids. Also, mixtures of potassium chlorate with any compound with ignition promoting properties (ex. antimony(III) sulfide) are very dangerous to prepare, as they are extremely shock sensitive.
See also[edit]
- Chloric acid
References[edit]
- ^ a b c d e f g «potassium chlorate». Retrieved 9 July 2015.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Retrieved 2014-05-29.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b c «Potassium chlorate». Retrieved 14 February 2022.
- ^ Michael Chambers. «ChemIDplus — 3811-04-9 — VKJKEPKFPUWCAS-UHFFFAOYSA-M — Potassium chlorate — Similar structures search, synonyms, formulas, resource links, and other chemical information». Retrieved 9 July 2015.
- ^ a b Vogt, Helmut; Balej, Jan; Bennett, John E.; Wintzer, Peter; Sheikh, Saeed Akbar; Gallone, Patrizio (June 15, 2000). «Chlorine Oxides and Chlorine Oxygen Acids». In Ullmann (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag. doi:10.1002/14356007.a06_483. ISBN 9783527303854.
- ^ Anne Marie Helmenstine, Ph.D. «Potassium Chlorate Synthesis (Substitute) Formula». About.com Education. Retrieved 9 July 2015.
- ^ a b Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Daniel J. Wakin and Alan Cowell (March 13, 2013). «New Round of Voting Fails to Name a Pope». The New York Times. Retrieved March 13, 2013.
- ^ «Afghan bomb makers shifting to new explosives for IEDs». USAToday.com. June 25, 2013. Retrieved 2013-06-25.
- ^ Manochai, P.; Sruamsiri, P.; Wiriya-alongkorn, W.; Naphrom, D.; Hegele, M.; Bangerth, F. (February 12, 2005). «Year around off season flower induction in longan (Dimocarpus longan, Lour.) trees by KClO3 applications: potentials and problems». Scientia Horticulturae. Department of Horticulture, Maejo University, Chiang Mai, Thailand; Department of Horticulture, Chiang Mai University, Chiang Mai, Thailand; Institute of Special Crops and Crop Physiology, University of Hohenheim, 70593 Stuttgart, Germany. 104 (4): 379–390. doi:10.1016/j.scienta.2005.01.004. Retrieved November 28, 2010.
{{cite journal}}: CS1 maint: location (link)
- «Chlorate de potassium. Chlorate de sodium», Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.
- Continuous process for the manufacture of potassium chlorate by coupling with a sodium chlorate production plant
External links[edit]
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Хлорат калия
Из Википедии — свободной энциклопедии
| Хлорат калия | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Хлорат калия | |
| Традиционные названия | Бертолетова соль | |
| Хим. формула | KClO3 | |
| Физические свойства | ||
| Состояние | Бесцветные кристаллы | |
| Молярная масса | 122,55 г/моль | |
| Плотность | 2,32 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 356 °C | |
| • разложения | ~400 °C | |
| Энтальпия | ||
| • образования | −391,204 кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде при 0 °C | 3,25 г/100 мл | |
| • в воде при 20 °C | 7,3 г/100 мл | |
| • в воде при 100 °C | 56,2 г/100 мл | |
| • в воде при 104,2 °C | 61,5 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | [3811-04-9] | |
| PubChem | 6426889 | |
| Рег. номер EINECS | 223-289-7 | |
| SMILES |
[O-]Cl(=O)=O.[K+] |
|
| InChI |
InChI=1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 VKJKEPKFPUWCAS-UHFFFAOYSA-M |
|
| RTECS | FO0350000 | |
| Номер ООН | 1485 | |
| ChemSpider | 18512 | |
| Безопасность | ||
| NFPA 704 |
0 2 3 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
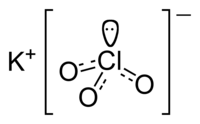
Хлорат калия (бертолетова соль[1], калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
История
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на хлорат калия и исходный хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем хлорат калия, и, таким образом, удобнее для фильтрации.
Химические свойства
Применение

KClO3 + C
Взрывчатые вещества
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов и в зарядах хлопушек (взрыв происходит при протаскивании грубой нити через пиротехнический состав), входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода
В начале XX века бертолетова соль использовалась для лабораторного получения кислорода, но из-за малой доступности её перестали применять.
Для получения диоксида хлора
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
Токсичность
Токсичен. Смертельная доза хлората калия составляет 1 г/кг[3].
Примечания
- ↑ Бертолетова соль // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ М. Баудлер, Г. Брауэр, Ф. Губер и др. Руководство по неорганическому синтезу: В 6 томах. — М.: Мир, 1985. — Т. 2. — С. 348. — 362 с.
- ↑ Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с.
Литература
- Вуколов, С. П., Менделеев Д. И. Хлорноватые соли // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Эта страница в последний раз была отредактирована 10 февраля 2023 в 19:48.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Хлорат калия
Брутто-формула:
ClKO3
CAS# 3811-04-9
Категории:
Неорганические соли
PubChem CID: 6426889
| ChemSpider ID: 18512
Названия
Русский:
- Хлорат калия [Wiki]
- бертолетова соль
- калиевая соль хлорноватой кислоты
English:
- Anforstan
- Berthollet salt
- Berthollet’s salt
- Chlorate of potash
- Chloric acid (HClO3) potassium salt
- Chloric acid potassium salt (KClO3)
- Chloric acid, potassium salt
- Chloricacid, potassium salt (8CI,9CI)
- EINECS:223-289-7
- Fekabit
- Potassium chlorate [Wiki]
- Potassium chlorate(V)
- Potassium oxymuriate
- Potcrate
- Salt of tarter
- potassium;chlorate
German:
- Chlorsaures Kali
- Kalium chloricum
- Kaliumchlorat [Wiki]
- Kaliumsalz der Chlorsäure
العربية:
- كلورات البوتاسيوم [Wiki]
Español:
- Clorato de potasio [Wiki]
- Clorato potásico
- Trioxoclorato (V) de potasio(IUPAC)
French:
- Chlorate de potassium(IUPAC) [Wiki]
Italiano:
- Clorato di potassio [Wiki]
日本語:
- 塩素(V)酸カリウム(IUPAC)
- 塩素酸カリウム [Wiki]
中文:
- 氯酸钾 [Wiki]
Варианты формулы:
KClO3
K(+1)Cl(+5)O(-2)3
O\Cl|O`|/O^-K^+
K^+O//$dots(U)Cl<_(A75,N2)O>_(A15)O^-
Химический состав
Реакции, в которых участвует Хлорат калия
-
I2 + 2KClO3 + 12HCl -> 2K[ICl4] + 6H2O + 3Cl2″|^»
-
I2 + 2KClO3 -> 2KIO3 + Cl2″|^»
-
KI + KClO3 → KIO3 + KCl
-
{M}2CO3 + 2H{X} -> 2{M}{X} + CO2″|^» + H2O
, где M =
Na K Li Rb Cs (NH4); X =
Cl F Br I NO3 IO3 ClO3 ClO4 N3 -
{M}2SO4 + Ba({X})2 -> 2{M}{X} + BaSO4″|v»
, где M =
Na K Li Rb Cs; X =
NO3 ClO2 ClO3 ClO4
И ещё 7 реакций…
| Хлорат калия | ||||
|
||||
 |
||||
| Стакан наполнен кристаллами хлората калия. | ||||
| Идентификация | ||||
|---|---|---|---|---|
| Название ИЮПАК | Хлорат калия | |||
| Н о CAS | 3811-04-9 | |||
| N о ИК | 100 021 173 | |||
| N о ЕС | 223-289-7 | |||
| Улыбки | ||||
| ИнЧИ | ||||
| Появление | бесцветные кристаллы или белый порошок. | |||
| Химические свойства | ||||
| Грубая формула | KClO 3 | |||
| Молярная масса | 122,55 ± 0,003 г / моль Cl 28,93%, K 31,9%, O 39,17%, |
|||
| Физические свойства | ||||
| Т ° плавления | 368 ° С | |||
| T ° кипения | Разлагается ниже точки кипения при 400 ° C | |||
| Растворимость | в воде: 73 г · л -1 | |||
| Объемная масса | 2,3 г · см -3 | |||
| Кристаллография | ||||
| Символ Пирсона |
 |
|||
| Кристаллический класс или космическая группа | P2 1 / м (№ 11) | |||
| Strukturbericht | G0 6 | |||
| Меры предосторожности | ||||
| SGH | ||||
|
H271, H302, H332, H411 , |
||||
| WHMIS | ||||
 ПРОТИВ, |
||||
| Транспорт | ||||
|
||||
|
|
||||
| Единицы СИ и STP, если не указано иное. | ||||
Хлорат калия представляет собой химическое соединение формулы KClO 3 . В чистом виде это белое кристаллическое вещество. Это самый распространенный хлорат в промышленности. Он используется, в частности:
- Как окислитель
- Как дезинфицирующее средство
- Во взрывчатке и фейерверках
История
Хлорат калия использовался в экспериментах по элементной химии.
Опыт химии XIX — го века: разложение хлората.
Рекомендации
- ↑ a b c d и e ХЛОРАТ КАЛИЯ , паспорт (-ы) безопасности Международной программы по химической безопасности , проверено 9 мая 2009 г.
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ a b и c « Структура KClO3 (G06) » , на http://cst-www.nrl.navy.mil/ (по состоянию на 17 декабря 2009 г. )
- ↑ a и b Внесение номера CAS «3811-04-9» в химическую базу данных GESTIS IFA (немецкий орган, отвечающий за безопасность и гигиену труда) ( немецкий , английский ), доступ открыт 27 ноября 2008 г. (требуется JavaScript)
- ↑ Индексный номер 017-004-00-3 в таблице 3.1 приложения VI постановления ЕС № 1272/2008 (16 декабря 2008 г.)
- ↑ « Калия хлорат » в базе данных химических веществ Reptox в CSST (организации Квебека , ответственного за охрану труда и здоровья), доступ к 25 апреля 2009










![{displaystyle {ce {2 KClO3(s) ->[Delta][MnO_2] 3 O2(g) + 2 KCl(s)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bce0d11cf57ee2802e42385013f05fe6f1c58e3)