Хлорид фосфора – это неорганическое соединение, фосфорная соль соляной кислоты. Существует два вида вещества, которые отличаются степенью окисления фосфора: +3 либо +5, им соответствуют хлорид III (трихлорид) и хлорид V (пентахлорид). Основная сфера потребления этих солей – химическая промышленность. Они используются для изготовления красок, пестицидов, в качестве реагента. В фармацевтике хлорид фосфора имеет важное значение, поскольку служит сырьём для разработки действующих компонентов лекарственных препаратов.
Хлорид фосфора (V) (пентахлорид фосфора)
Содержание
- Что такое хлорид фосфора, формула, виды
- Физические свойства, внешний вид
- Реакции со хлоридом фосфора и химические свойства
- Получение и производство
- Воздействие на организм
- Применение
- Применение хлоридов фосфора в химической промышленности
- Где купить и сколько стоит
- Токсичность, меры предосторожности
- Заключение
Что такое хлорид фосфора, формула, виды
Хлорид фосфора представляет собой соединение фосфора и остатка хлорводородной кислоты, относится к классу солей. Атом фосфора может проявлять разную степень окисления. Окислительное число обозначает условный заряд элемента, который он приобретает после перемещения электронов. Оно может быть как положительным (при отдаче электронов), так и отрицательным (при принятии электронов). При взаимодействии с металлами и водородом фосфор находится в отрицательной степени окисления -3, с более сильными окислителями он показывает положительное окислительное число, т.к. отдаёт электроны. Поэтому с хлором может образовываться две разновидности соединений:
- хлорид фосфора (V), другие названия: пентахлорид фосфора, хлорангидрид фосфорной кислоты; фосфор находится в максимальной степени окисления +5, хлор забирает все его неспаренные электроны; химическая формула: PCl5;
- хлорид фосфора (III) (трёххлористый фосфор либо трихлорид фосфора), фосфор имеет степень окисления +3, формула вещества PCl3.
Хлорид фосфора (III) (трихлорид фосфора)
Оба варианта солей были открыты британским химиком Гэмфри Дэви, который одновременно синтезировал и пентахлорид, выделившийся в виде кристаллов, и трихлорид, образовавшийся в виде жидкости. Они проявляют различные физико-химические свойства, что связано с разным набором атомов и состоянием их электронных полей.
Физические свойства, внешний вид
Хлорид фосфора (V) при нормальных условиях имеет вид порошка зеленовато-жёлтых или беловатых кристаллов без запаха, низкой плотности, рассыпчатых. Может существовать в жидком и газообразном состоянии, при этом пары очень тяжёлые, в 7,2 раз плотнее воздуха. Температура плавления – 160 °С. Переходит из твёрдого вещества в газообразное, минуя жидку фазу, при 159 °С. Термическое разложение происходит при температурном режиме, достигающем 300 °С. Вступает в реакцию с водой, растворяется в органических растворителях: бензол, хлоруглеродистые соединения, сероуглерод.
Хлорид фосфора (III) представляет собой жидкость, не имеющую цвета. Она источает резкий неприятный запах, обладает слезоточивыми свойствами. При высокой влажности дымится. Плавится при отрицательной температуре, порядка -93,6 °С, кипит при нагревании до 76,1 °С.
Реакции со хлоридом фосфора и химические свойства
Хлорангидрид фосфорной кислоты проявляет свойства, типичные для других солей. За счет мощного остатка соляной кислоты (Cl) и кислотных свойств фосфора активно вступает в реакции окисления, особенно окислительного хлорирования:
PCl5 + 2NO2 → PCl3↑+ NO2Cl↑
При этом образуется смесь газов: пары трихлорида фосфора и хлорида нитрозила. При взаимодействии с водой происходит неполный гидролиз – разложение вещества с образованием хлорокиси фосфора и соляной кислоты:
PCl5 + H2O → POCl3 + 2HCl
При подогревании гидролиз идёт до конца и образуется ортофосфорная кислота и хлороводород:
PCl5 + 4H2O → H3PO4 + 5HCl
Пентахлорид фосфора может вступать в реакцию с сильными кислотами, при этом формируются их хлорангидриды. Например, при реагировании с концентрированной серной кислотой продуктом реакции является монохлорангидрид серной кислоты, также выделяется фосфорилхлорид и хлороводород:
PCl5 + H2SO4 → ClSO3OH + POCl3 + HCl
Хлорид фосфора (V) может вступать в реакцию полимеризации, при этом образуется полимер фосфонилхлорид. Взаимодействие с хлоридом аммония идёт при нагревании:
PCl5 + NH4Cl → (PNCl2)n + 4HCl
Фосфонилхлорид является неорганической заменой каучука, обладает эластичностью, выдерживает нагревание до высоких температур, прозрачен. Его существенный недостаток – подверженность гидролизу и быстрое разложение.
Хлорангидрид фосфорной кислоты вступает в реакции хлорирования. Хлорирование заключается в перенесении хлора из вещества на субстрат. Хлорирование неорганических веществ приводит к образованию хлоридов:
PCl5 + 6LiF → LiPF6 + 5LiCl
Хлорирование органических соединений связано с отщеплением атома водорода и замещением его хлором, либо заменой гидроксильной группировки (-OH). При пониженном температурном режиме хлорид фосфора (V) реагирует с уксусной кислотой:
PCl5 + CH3COOH → СH3COCl + POCl3 + HCl
Пентахлорид фосфора – ценное сырьё для получения реактива Вильсмайера. Вступая в реакцию с диметилформамидом, он приводит к образованию хлорида диметилхлорметиленаммония:
PCl5 + C3H7NO → [(CH3)2NCHCl]Cl
Данный реактив необходим для модификаций ароматических соединений, введения в их структуру альдегидных группировок (-CHO). Хлорид фосфора (V) является кислотой Льюиса, т.е. он притягивает электронную пару, образуя продукт прямого присоединения молекул друг к другу.
Трихлорид фосфора же, напротив, является основанием Льюиса. Вещества такого типа легче отдают электронную пару акцепторам (кислотам), чем принимают сами, это доноры электронов, проявляющие восстановительные свойства.
Хлорид фосфора (III) – предшественник других фосфорсодержащих соединений, он легко переходит в пентахлорид, оксихлорид и тиофосфорилхлорид фосфора. Вещество легко реагирует со спиртами, аминами и фенолами. Для него характерны реакции замещения – взаимодействия, при которых одна функциональная группировка замещается другой (в данном случае – хлором).
Трихлорид фосфора разлагается при смешивании с водой, при этом образуется фосфористая кислота, реакция идёт интенсивно:
PCl3 + H2O → H3PO3 + 3HCl
При реагировании с фенолами происходит образование фосфатов и фосфитов – солей фосфорной кислоты. Так, при взаимодействии с фенолом и другими соединениями фенольного ряда трихлорид фосфора даёт трифенилфосфит:
PCl3 + C6H5OH → P(С6H5O)3 + 3HCl
Со спиртами реакция протекает по схожему принципу при щелочном значении водородного показателя (в присутствии третичного амина):
PCl3 + C2H5OH + С6H9N → P(C2H5O)3 + C6H10NCl
Если не вносить в реакционную смесь амин, продукты получаются иные: диэтилфосфат, а также хлорид и соляная кислота:
PCl3 + C2H5OH → С2H5POH + 2HCl + C2H5Cl
Трихлорид фосфора может вступать в реакции с аминами и давать промышленно значимые вещества. Его способность реагировать с азотосодержащими реактивами используется для получения аминофосфонатов при добавлении формальдегида:
PCl3 + CH2O + СH3-NH2 → CH2PO(OH)2NCH3 + HCl
В ходе реакции образуется фосфорный аналог метиламина (первичная аминокислота), который применяется для производства гербицидов, агентов, способствующих очищению воды от примесей.
Хлорид фосфора (III) реагирует с щелочами, в результате образуется две соли: монофторофосфат натрия и хлорид натрия.
PCl3 + NaOH → Na2HPO3 + 3NaCl + 2H2O
Получение и производство
Хлорид фосфора (V) в лабораторных условиях получают путём окисления трихлорида фосфора хлором в газообразном состоянии:
PCl3 + Cl2 → PCl5
В промышленном получении используется эта же реакция, но при этом процесс идёт в несколько стадий и со сложным оборудованием:
- В реактор загружают хлорбензол и четырёххлористый углерод. Реактор снабжён холодильником, барботёром и мешалкой, что необходимо не только для протекания взаимодействия, но и для его интенсификации.
- Внутрь запускают газообразный хлор, повышают температуру среды до 45 °С. Образуются хлорфосфозены (соединения, в которых между азотом и фосфором имеется двойная связь).
- В реакторе повышают давление, оставляя смесь на 6-7 часов. В это время идёт образование трихлорида фосфора из загруженных ранее реагентов, он сразу же взаимодействует с хлором, преобразуясь в пентахлорид. Когда анализ проб покажет содержание хлорида фосфора (III) не менее 1%, прекращают внесение хлора.
- Под большим напором внутрь подают азот, продувают им смесь.
- Полученный хлорид фосфора (V) фильтруют и отправляют на щадящую сушку.
Ежегодно производят около 10 тысяч тонн пентахлорида. Трихлорида выпускается порядка 1/3 миллиона тонн. Несмотря на это, процесс получения трихлорида фосфора сложен в технологическом отношении в связи с его высокой реакционной способностью и быстрым переходом в пентахлорид. Основа лабораторного и производственного получения – взаимодействие белого фосфора с газообразным хлором:
P4 + 6Cl2 → 4PCl3
В промышленности добычу вещества осложняет необходимость постоянно забирать из реакционной смеси продукт, чтобы предотвратить его преобразование в пентахлорид. На некоторых заводах организована особая система производства, которая заключается в использовании аппарата, разделяющего реагенты. В нём есть отдельный сосуд, в который подают фосфор и труба для слива хлорида фосфора (III).
Промышленное производство трихлорида строго контролируется законодательством, поскольку соединение может быть использовано для производства химического оружия: иприта – боевого отравляющего вещества.
Воздействие на организм
Хлориды фосфора являются опасными ядами и крайне отрицательно воздействуют на здоровье человека. Трихлорид фосфора – удушливый газ, вызывающий обильное слезоотделение и раздражение слизистых оболочек. Пентахлорид – сильный неорганический яд, порошок при попадании на кожу вызывает глубокие химические ожоги за счёт мощных окислительных свойств.
При вдыхании паров хлоридов возникает рефлекторное сокращения гладкой дыхательной мускулатуры, появляется кашель с большим количеством мокроты, бронхоспазм, отёк лёгких. Случайное проглатывание приводит к отравлению, которое сопровождается рвотой, диареей, сильными режущими болями живота. Может наблюдаться поражение сердечно-сосудистой системы. При этом снижается частота сердечных сокращений, резко возрастает и падает артериальное давление. Возможно поражение центральной нервной системы, возникают судороги, параличи, кома.
Применение
Основная сфера применения хлоридов фосфора – химическая промышленность. Они используются для получения фосфорорганических соединений, необходимых для синтеза удобрений, пестицидов, гербицидов, лекарств. Эти соединения – незаменимые предшественники различных пластификаторов, масляных добавок. Хлориды применяются для получения углеводородов в органическом синтезе.
Применение хлоридов фосфора в химической промышленности
Хлорангидрид фосфорной кислоты – мощный хлорирующий агент. Он применяется в качестве осушающего вещества, т.к. проявляет дегидратирующие свойства. Хлорид фосфора (V) может быть использован для преобразования лекарственных средств. Некоторые синтетические препараты содержат его производные или технология их получения подразумевает применение пентахлорида для создания необходимой среды.
Назначение хлорида фосфора (III) более широкое, что связано с его большей реактивной способностью. Трихлорид применяется:
- при изготовлении лакокрасочных материалов;
- для производства реакционных смесей;
- как сырьё и реактив для реакций органического синтеза;
- для придания нужных свойств пластификаторам;
- в производстве антипиренов.
Поскольку трихлорид фосфора ядовит, на его основе создают средства, уничтожающие сорные растения (гербициды), препараты для избавления от возбудителей опасных заболеваний растений (пестициды), а также продукты для борьбы с насекомыми – инсектициды. Один из таких – диазинон, опасное фосфорсодержащее средство, использующееся как для борьбы с домашними насекомыми (тараканы, клопы, моль), так и для уничтожения вредителей сельского хозяйства: тля, муравьи, жуки.
Где купить и сколько стоит
Приобрести хлорид фосфора может только юридическое лицо с официальным разрешением, поскольку оборот его ограничен законодательно. Трёххлористый фосфор продают заводы-производители от 135 рублей за 1 кг. Пентахлорид продаётся не только оптом, но и в розницу в магазинах, специализирующихся на химических реактивах. Стоимость существенно отличается. Цена 1 кг вещества порядка 5500 рублей, в то время как 100 грамм можно купить за 800 рублей. Оптовая стоимость составляет около 120 руб/кг.
Токсичность, меры предосторожности
Хлорид фосфора – это крайне токсичное соединение. Оба вида относятся ко 2 классу опасности – высокоопасные вещества. 600 промилле (либо в концентрации 140 мгм3) трихлорида фосфора – летальная доза, убивающая человека за несколько минут. Симптомы отравления при вдыхании могут проявиться не сразу, но действие яда на организм комплексное, т.е. поражаются сразу несколько систем органов. Пентахлорид приводит к серьёзным ожогам кожи и слизистых оболочек, провоцирует некроз и отмирание тканей, при попадании внутрь – расплавление органов. Предельно допустимая концентрация хлоридов фосфора в воздухе – 0,2 мг/м3.
Меры предосторожности заключаются в крайне аккуратном обращении с хлоридами фосфора. Необходимо надевать защитную одежду, покрывающую всё тело, а также носить респиратор, в котором регулярно менять фильтр. При предположительном отравлении необходимо немедленно обратиться к врачу. На производстве нужно соблюдать все требования техники безопасности.
Заключение
Хлорид фосфора – это неорганическая фосфорная соль соляной кислоты. В зависимости от степени окисления фосфора возможно существование двух разновидностей: пентахлорид и трихлорид. Они отличаются физико-химическими свойствами. Пентахлорид более стабилен, в то время как трёххлористый фосфор – более активен за счёт свободной электронной пары. Он легко преобразуется в другие фосфорсодержащие соединения, поэтому важен для органического синтеза и многих других реакций. Хлориды фосфора крайне опасны и смертельны для человека, других животных и даже бактерий. За счёт этого они применяются для изготовления пестицидов, инсектицидов и гербицидов. Кроме того, фосфорные соли соляной кислоты применяются для получения пластификаторов, красок, лекарственных препаратов.
Читайте также:
- Хлорид калия: описание, свойства инструкция, применение
- Хлорид магния Е511: описание, применение, инструкция, польза и вред
- Хлорид аммония (нашатырь, Е510): описание, реакции, применение
- Формальдегид: опасность, влияние на организм, где содержится
Загрузка…
From Wikipedia, the free encyclopedia

|
||
|
||

|
||
| Names | ||
|---|---|---|
| IUPAC names
Phosphorus pentachloride |
||
| Other names
Pentachlorophosphorane |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.030.043 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1806 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Cl5P | |
| Molar mass | 208.22 g·mol−1 | |
| Appearance | yellowish white crystals | |
| Odor | pungent, unpleasant[1] | |
| Density | 2.1 g/cm3 | |
| Melting point | 160.5 °C (320.9 °F; 433.6 K) | |
| Boiling point | 166.8 °C (332.2 °F; 439.9 K) sublimation | |
|
Solubility in water |
reacts | |
| Solubility | soluble in CS2, chlorocarbons, benzene | |
| Vapor pressure | 1.11 kPa (80 °C) 4.58 kPa (100 °C)[2] |
|
| Structure | ||
|
Crystal structure |
tetragonal | |
|
Coordination geometry |
D3h (trigonal bipyramidal) | |
|
Dipole moment |
0 D | |
| Thermochemistry | ||
|
Heat capacity (C) |
111.5 J/mol·K[2] | |
|
Std molar |
364.2 J/mol·K[2] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
   [3] [3]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H302, H314, H330, H373[3] | |
|
Precautionary statements |
P260, P280, P284, P305+P351+P338, P310[3] | |
| NFPA 704 (fire diamond) |
3 0 2
|
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
660 mg/kg (rat, oral)[4] | |
|
LC50 (median concentration) |
205 mg/m3 (rat)[4] | |
|
LCLo (lowest published) |
1020 mg/m3 (mouse, 10 min)[4] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[1] | |
|
REL (Recommended) |
TWA 1 mg/m3[1] | |
|
IDLH (Immediate danger) |
70 mg/m3[1] | |
| Safety data sheet (SDS) | ICSC 0544 | |
| Related compounds | ||
|
Related phosphorus pentahalides |
Phosphorus pentafluoride Phosphorus pentabromide Phosphorus pentaiodide |
|
|
Related compounds |
Phosphorus trichloride Phosphoryl chloride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphorus pentachloride is the chemical compound with the formula PCl5. It is one of the most important phosphorus chlorides, others being PCl3 and POCl3. PCl5 finds use as a chlorinating reagent. It is a colourless, water-sensitive and moisture-sensitive solid, although commercial samples can be yellowish and contaminated with hydrogen chloride.
Structure[edit]
The structures for the phosphorus chlorides are invariably consistent with VSEPR theory. The structure of PCl5 depends on its environment. Gaseous and molten PCl5 is a neutral molecule with trigonal bipyramidal geometry and (D3h) symmetry. The hypervalent nature of this species (as well as of PCl−
6, see below) can be explained with the inclusion of non-bonding molecular orbitals (molecular orbital theory) or resonance (valence bond theory). This trigonal bipyramidal structure persists in nonpolar solvents, such as CS2 and CCl4.[5] In the solid state PCl5 is an ionic compound, formulated PCl+
4PCl−
6.[6]
Structure of solid phosphorus pentachloride, illustrating its autoionization at higher concentrations.[7]
In solutions of polar solvents, PCl5 undergoes self-ionization.[8] Dilute solutions dissociate according to the following equilibrium:
- PCl5 ⇌ PCl+
4 + Cl−
At higher concentrations, a second equilibrium becomes more prevalent:
- 2 PCl5 ⇌ PCl+
4 + PCl−
6
The cation PCl+
4 and the anion PCl−
6 are tetrahedral and octahedral, respectively. At one time, PCl5 in solution was thought to form a dimeric structure, P2Cl10, but this suggestion is not supported by Raman spectroscopic measurements.
[edit]
AsCl5 and SbCl5 also adopt trigonal bipyramidal structures. The relevant bond distances are 211 pm (As−Cleq), 221 pm (As−Clax), 227 pm (Sb−Cleq), and 233.3 pm (Sb−Clax).[9] At low temperatures, SbCl5 converts to the dimer, dioctahedral Sb2Cl10, structurally related to niobium pentachloride.
Preparation[edit]
PCl5 is prepared by the chlorination of PCl3.[10] This reaction is used to produce around 10,000 tonnes of PCl5 per year (as of 2000).[6]
- PCl3 + Cl2 ⇌ PCl5 (ΔH = −124 kJ/mol)
PCl5 exists in equilibrium with PCl3 and chlorine, and at 180 °C the degree of dissociation is about 40%.[6] Because of this equilibrium, samples of PCl5 often contain chlorine, which imparts a greenish coloration.
Reactions[edit]
Hydrolysis[edit]
In its most characteristic reaction, PCl5 reacts upon contact with water to release hydrogen chloride and give phosphorus oxides. The first hydrolysis product is phosphorus oxychloride:
- PCl5 + H2O → POCl3 + 2 HCl
In hot water, hydrolysis proceeds completely to orthophosphoric acid:
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Lewis acidity[edit]
Phosphorus pentachloride is a Lewis acid. This property underpins many of its characteristic reactions, autoionization, chlorinations, hydrolysis. A well studied adduct is PCl5(pyridine).[11]
Chlorination of organic compounds[edit]
In synthetic chemistry, two classes of chlorination are usually of interest: oxidative chlorinations and substitutive chlorinations. Oxidative chlorinations entail the transfer of Cl2 from the reagent to the substrate. Substitutive chlorinations entail replacement of O or OH groups with chloride. PCl5 can be used for both processes.
Upon treatment with PCl5, carboxylic acids convert to the corresponding acyl chloride.[12] The following mechanism has been proposed:[13]
It also converts alcohols to alkyl chlorides. Thionyl chloride is more commonly used in the laboratory because the resultant sulfur dioxide is more easily separated from the organic products than is POCl3.
PCl5 reacts with a tertiary amides, such as dimethylformamide (DMF), to give dimethylchloromethyleneammonium chloride, which is called the Vilsmeier reagent, [(CH3)2N=CClH]Cl. More typically, a related salt is generated from the reaction of DMF and POCl3. Such reagents are useful in the preparation of derivatives of benzaldehyde by formylation and for the conversion of C−OH groups into C−Cl groups.[14]
It is especially renowned for the conversion of C=O groups to CCl2 groups.[15] For example, benzophenone and phosphorus pentachloride react to give the diphenyldichloromethane:[16]
- (C6H5)2CO + PCl5 → (C6H5)2CCl2 + POCl3
The electrophilic character of PCl5 is highlighted by its reaction with styrene to give, after hydrolysis, phosphonic acid derivatives.[17]
[edit]
Both PCl3 and PCl5 convert R3COH groups to the chloride R3CCl. The pentachloride is however a source of chlorine in many reactions. It chlorinates allylic and benzylic CH bonds. PCl5 bears a greater resemblance to SO2Cl2, also a source of Cl2. For oxidative chlorinations on the laboratory scale, sulfuryl chloride is often preferred over PCl5 since the gaseous SO2 by-product is readily separated.
Chlorination of inorganic compounds[edit]
As for the reactions with organic compounds, the use of PCl5 has been superseded by SO2Cl2. The reaction of phosphorus pentoxide and PCl5 produces POCl3 :[18][page needed]
- 6 PCl5 + P4O10 → 10 POCl3
PCl5 chlorinates nitrogen dioxide to form unstable nitryl chloride:
- PCl5 + 2 NO2 → PCl3 + 2 NO2Cl
- 2 NO2Cl → 2 NO2 + Cl2
PCl5 is a precursor for lithium hexafluorophosphate, LiPF6. Lithium hexafluorophosphate is a commonly employed salt in electrolytes in lithium ion batteries.[19] LiPF
6 is produced by the reaction of PCl
5 with lithium fluoride, with lithium chloride as a side product:
- PCl5 + 6 LiF → LiPF6 + 5 LiCl
Safety[edit]
PCl5 is a dangerous substance as it reacts violently with water. It is also corrosive when in contact with skin and can be fatal when inhaled.
History[edit]
Phosphorus pentachloride was first prepared in 1808 by the English chemist Humphry Davy.[20] Davy’s analysis of phosphorus pentachloride was inaccurate;[21] the first accurate analysis was provided in 1816 by the French chemist Pierre Louis Dulong.[22]
See also[edit]
- Phosphorus halides
- Phosphorus trichloride
- Phosphoryl chloride
- Phosphorus trifluorodichloride
References[edit]
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0509». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Phosphorus pentachloride in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-05-15)
- ^ a b c Phosphorus pentachloride
- ^ a b c «Phosphorus pentachloride». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Corbridge, D. E. C. (1995). Phosphorus: An outline of its chemistry, biochemistry, and uses. Elsevier Science. ISBN 0-444-89307-5.
- ^ a b c Holleman, A. F.; Wiber, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- ^ Finch, A.; Fitch, A.N.; Gates, P.N. (1993). «Crystal and Molecular structure of a metastable modification of phosphorus pentachloride». Journal of the Chemical Society, Chemical Communications (11): 957–958. doi:10.1039/C39930000957.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Suter, R. W.; Knachel, H. C.; Petro, V. P.; Howatson, J. H. & Shore, S. G. (1978). «Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents». Journal of the American Chemical Society. 95 (5): 1474–1479. doi:10.1021/ja00786a021.
- ^ Haupt, S.; Seppelt, K. (2002). «Solid State Structures of AsCl5 and SbCl5«. Zeitschrift für anorganische und allgemeine Chemie. 628 (4): 729–734. doi:10.1002/1521-3749(200205)628:4<729::AID-ZAAC729>3.0.CO;2-E.
- ^ Maxson, R. N. (1939). «Phosphorus Pentachloride». Inorganic Syntheses. Inorganic Syntheses. Vol. 1. pp. 99–100. doi:10.1002/9780470132326.ch34. ISBN 9780470132326.
- ^ Wong, Chih Y.; Kennepohl, Dietmar K.; Cavell, Ronald G. (1996). «Neutral Six-Coordinate Phosphorus». Chemical Reviews. 96 (6): 1917–1952. doi:10.1021/cr9410880. PMID 11848816.
- ^ Adams, R.; Jenkins, R. L. (1941). «p-Nitrobenzoyl chloride». Organic Syntheses.; Collective Volume, vol. 1, p. 394
- ^ Clayden, Jonathan (2005). Organic chemistry (Reprinted ed.). Oxford: Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Burks Jr., J. E. (2004). «Phosphorus(V) chloride». In Paquette, L. (ed.). Encyclopedia of Reagents for Organic Synthesis. New York, NY: J. Wiley & Sons. doi:10.1002/047084289X.rp158. ISBN 0471936235.
- ^ Gross, H.; Rieche, A.; Höft, E.; Beyer, E. (1973). «Dichloromethyl methyl ether». Organic Syntheses.; Collective Volume, vol. 5, p. 365
- ^ Spaggiari, A.; Vaccari, D.; Davoli, P.; Torre, G.; Prati, F. (2007). «A Mild Synthesis of Vinyl Halides and gem-Dihalides Using Triphenyl Phosphite−Halogen-Based Reagents». The Journal of Organic Chemistry. 72 (6): 2216–2219. doi:10.1021/jo061346g. ISSN 0022-3263. PMID 17295542.
- ^ Schmutzler, R. (1973). «Styrylphosphonic dichloride». Organic Syntheses.; Collective Volume, vol. 5, p. 1005
- ^ Cotton, Frank Albert (1999). Advanced Inorganic Chemistry. Wiley-Interscience. ISBN 978-0-471-19957-1.
- ^ Bushkova, O. V.; Yaroslavtseva, T. V.; Dobrovolsky, Yu. A. (4 August 2017). «New lithium salts in electrolytes for lithium-ion batteries (Review)». Russian Journal of Electrochemistry. 53 (7): 677–699. doi:10.1134/S1023193517070035. S2CID 103854243.
- ^ Davy, Humphry (1809). «The Bakerian Lecture. An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed; with some general observations on chemical theory». Philosophical Transactions of the Royal Society of London. 99: 39–104. doi:10.1098/rstl.1809.0005. S2CID 98814859. On pp. 94–95, Davy mentioned that when he burned phosphorus in chlorine gas («oxymuriatic acid gas»), he obtained a clear liquid (phosphorus trichloride) and a white solid (phosphorus pentachloride).
- ^ Davy, Humphry (1810). «Researches on the oxymuriatic acid [i.e., chlorine], its nature and combinations; and on the elements of the muriatic acid [i.e., hydrogen chloride]. With some experiments on sulphur and phosphorus, made in the laboratory of the Royal Institution». Philosophical Transactions of the Royal Society of London. 100: 231–257. doi:10.1098/rstl.1810.0016. On p. 257, Davy presented his empirical formula for phosphorus pentachloride: 1 portion of phosphorus to 3 portions of «oxymuriatic gas» (chlorine).
- ^ Dulong (1816). «Extrait d’un mémoire sur les combinaisons du phosphore avec l’oxigène» [Extract from a memoir on the compounds of phosphorus with oxygen]. Annales de Chimie et de Physique. 2nd series (in French). 2: 141–150. On p. 148, Dulong presented the correct analysis of phosphorus pentachloride (which is 14.9% phosphorus and 85.1% chlorine by weight, vs. Dulong’s values of 15.4% and 84.6%, respectively).
External links[edit]
- The period 3 chlorides
- International Chemical Safety Card 0544
- CDC — NIOSH Pocket Guide to Chemical Hazards
From Wikipedia, the free encyclopedia

|
||
|
||

|
||
| Names | ||
|---|---|---|
| IUPAC names
Phosphorus pentachloride |
||
| Other names
Pentachlorophosphorane |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.030.043 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1806 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Cl5P | |
| Molar mass | 208.22 g·mol−1 | |
| Appearance | yellowish white crystals | |
| Odor | pungent, unpleasant[1] | |
| Density | 2.1 g/cm3 | |
| Melting point | 160.5 °C (320.9 °F; 433.6 K) | |
| Boiling point | 166.8 °C (332.2 °F; 439.9 K) sublimation | |
|
Solubility in water |
reacts | |
| Solubility | soluble in CS2, chlorocarbons, benzene | |
| Vapor pressure | 1.11 kPa (80 °C) 4.58 kPa (100 °C)[2] |
|
| Structure | ||
|
Crystal structure |
tetragonal | |
|
Coordination geometry |
D3h (trigonal bipyramidal) | |
|
Dipole moment |
0 D | |
| Thermochemistry | ||
|
Heat capacity (C) |
111.5 J/mol·K[2] | |
|
Std molar |
364.2 J/mol·K[2] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
   [3] [3]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H302, H314, H330, H373[3] | |
|
Precautionary statements |
P260, P280, P284, P305+P351+P338, P310[3] | |
| NFPA 704 (fire diamond) |
3 0 2
|
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
660 mg/kg (rat, oral)[4] | |
|
LC50 (median concentration) |
205 mg/m3 (rat)[4] | |
|
LCLo (lowest published) |
1020 mg/m3 (mouse, 10 min)[4] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[1] | |
|
REL (Recommended) |
TWA 1 mg/m3[1] | |
|
IDLH (Immediate danger) |
70 mg/m3[1] | |
| Safety data sheet (SDS) | ICSC 0544 | |
| Related compounds | ||
|
Related phosphorus pentahalides |
Phosphorus pentafluoride Phosphorus pentabromide Phosphorus pentaiodide |
|
|
Related compounds |
Phosphorus trichloride Phosphoryl chloride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphorus pentachloride is the chemical compound with the formula PCl5. It is one of the most important phosphorus chlorides, others being PCl3 and POCl3. PCl5 finds use as a chlorinating reagent. It is a colourless, water-sensitive and moisture-sensitive solid, although commercial samples can be yellowish and contaminated with hydrogen chloride.
Structure[edit]
The structures for the phosphorus chlorides are invariably consistent with VSEPR theory. The structure of PCl5 depends on its environment. Gaseous and molten PCl5 is a neutral molecule with trigonal bipyramidal geometry and (D3h) symmetry. The hypervalent nature of this species (as well as of PCl−
6, see below) can be explained with the inclusion of non-bonding molecular orbitals (molecular orbital theory) or resonance (valence bond theory). This trigonal bipyramidal structure persists in nonpolar solvents, such as CS2 and CCl4.[5] In the solid state PCl5 is an ionic compound, formulated PCl+
4PCl−
6.[6]
Structure of solid phosphorus pentachloride, illustrating its autoionization at higher concentrations.[7]
In solutions of polar solvents, PCl5 undergoes self-ionization.[8] Dilute solutions dissociate according to the following equilibrium:
- PCl5 ⇌ PCl+
4 + Cl−
At higher concentrations, a second equilibrium becomes more prevalent:
- 2 PCl5 ⇌ PCl+
4 + PCl−
6
The cation PCl+
4 and the anion PCl−
6 are tetrahedral and octahedral, respectively. At one time, PCl5 in solution was thought to form a dimeric structure, P2Cl10, but this suggestion is not supported by Raman spectroscopic measurements.
[edit]
AsCl5 and SbCl5 also adopt trigonal bipyramidal structures. The relevant bond distances are 211 pm (As−Cleq), 221 pm (As−Clax), 227 pm (Sb−Cleq), and 233.3 pm (Sb−Clax).[9] At low temperatures, SbCl5 converts to the dimer, dioctahedral Sb2Cl10, structurally related to niobium pentachloride.
Preparation[edit]
PCl5 is prepared by the chlorination of PCl3.[10] This reaction is used to produce around 10,000 tonnes of PCl5 per year (as of 2000).[6]
- PCl3 + Cl2 ⇌ PCl5 (ΔH = −124 kJ/mol)
PCl5 exists in equilibrium with PCl3 and chlorine, and at 180 °C the degree of dissociation is about 40%.[6] Because of this equilibrium, samples of PCl5 often contain chlorine, which imparts a greenish coloration.
Reactions[edit]
Hydrolysis[edit]
In its most characteristic reaction, PCl5 reacts upon contact with water to release hydrogen chloride and give phosphorus oxides. The first hydrolysis product is phosphorus oxychloride:
- PCl5 + H2O → POCl3 + 2 HCl
In hot water, hydrolysis proceeds completely to orthophosphoric acid:
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Lewis acidity[edit]
Phosphorus pentachloride is a Lewis acid. This property underpins many of its characteristic reactions, autoionization, chlorinations, hydrolysis. A well studied adduct is PCl5(pyridine).[11]
Chlorination of organic compounds[edit]
In synthetic chemistry, two classes of chlorination are usually of interest: oxidative chlorinations and substitutive chlorinations. Oxidative chlorinations entail the transfer of Cl2 from the reagent to the substrate. Substitutive chlorinations entail replacement of O or OH groups with chloride. PCl5 can be used for both processes.
Upon treatment with PCl5, carboxylic acids convert to the corresponding acyl chloride.[12] The following mechanism has been proposed:[13]
It also converts alcohols to alkyl chlorides. Thionyl chloride is more commonly used in the laboratory because the resultant sulfur dioxide is more easily separated from the organic products than is POCl3.
PCl5 reacts with a tertiary amides, such as dimethylformamide (DMF), to give dimethylchloromethyleneammonium chloride, which is called the Vilsmeier reagent, [(CH3)2N=CClH]Cl. More typically, a related salt is generated from the reaction of DMF and POCl3. Such reagents are useful in the preparation of derivatives of benzaldehyde by formylation and for the conversion of C−OH groups into C−Cl groups.[14]
It is especially renowned for the conversion of C=O groups to CCl2 groups.[15] For example, benzophenone and phosphorus pentachloride react to give the diphenyldichloromethane:[16]
- (C6H5)2CO + PCl5 → (C6H5)2CCl2 + POCl3
The electrophilic character of PCl5 is highlighted by its reaction with styrene to give, after hydrolysis, phosphonic acid derivatives.[17]
[edit]
Both PCl3 and PCl5 convert R3COH groups to the chloride R3CCl. The pentachloride is however a source of chlorine in many reactions. It chlorinates allylic and benzylic CH bonds. PCl5 bears a greater resemblance to SO2Cl2, also a source of Cl2. For oxidative chlorinations on the laboratory scale, sulfuryl chloride is often preferred over PCl5 since the gaseous SO2 by-product is readily separated.
Chlorination of inorganic compounds[edit]
As for the reactions with organic compounds, the use of PCl5 has been superseded by SO2Cl2. The reaction of phosphorus pentoxide and PCl5 produces POCl3 :[18][page needed]
- 6 PCl5 + P4O10 → 10 POCl3
PCl5 chlorinates nitrogen dioxide to form unstable nitryl chloride:
- PCl5 + 2 NO2 → PCl3 + 2 NO2Cl
- 2 NO2Cl → 2 NO2 + Cl2
PCl5 is a precursor for lithium hexafluorophosphate, LiPF6. Lithium hexafluorophosphate is a commonly employed salt in electrolytes in lithium ion batteries.[19] LiPF
6 is produced by the reaction of PCl
5 with lithium fluoride, with lithium chloride as a side product:
- PCl5 + 6 LiF → LiPF6 + 5 LiCl
Safety[edit]
PCl5 is a dangerous substance as it reacts violently with water. It is also corrosive when in contact with skin and can be fatal when inhaled.
History[edit]
Phosphorus pentachloride was first prepared in 1808 by the English chemist Humphry Davy.[20] Davy’s analysis of phosphorus pentachloride was inaccurate;[21] the first accurate analysis was provided in 1816 by the French chemist Pierre Louis Dulong.[22]
See also[edit]
- Phosphorus halides
- Phosphorus trichloride
- Phosphoryl chloride
- Phosphorus trifluorodichloride
References[edit]
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0509». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Phosphorus pentachloride in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-05-15)
- ^ a b c Phosphorus pentachloride
- ^ a b c «Phosphorus pentachloride». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Corbridge, D. E. C. (1995). Phosphorus: An outline of its chemistry, biochemistry, and uses. Elsevier Science. ISBN 0-444-89307-5.
- ^ a b c Holleman, A. F.; Wiber, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- ^ Finch, A.; Fitch, A.N.; Gates, P.N. (1993). «Crystal and Molecular structure of a metastable modification of phosphorus pentachloride». Journal of the Chemical Society, Chemical Communications (11): 957–958. doi:10.1039/C39930000957.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Suter, R. W.; Knachel, H. C.; Petro, V. P.; Howatson, J. H. & Shore, S. G. (1978). «Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents». Journal of the American Chemical Society. 95 (5): 1474–1479. doi:10.1021/ja00786a021.
- ^ Haupt, S.; Seppelt, K. (2002). «Solid State Structures of AsCl5 and SbCl5«. Zeitschrift für anorganische und allgemeine Chemie. 628 (4): 729–734. doi:10.1002/1521-3749(200205)628:4<729::AID-ZAAC729>3.0.CO;2-E.
- ^ Maxson, R. N. (1939). «Phosphorus Pentachloride». Inorganic Syntheses. Inorganic Syntheses. Vol. 1. pp. 99–100. doi:10.1002/9780470132326.ch34. ISBN 9780470132326.
- ^ Wong, Chih Y.; Kennepohl, Dietmar K.; Cavell, Ronald G. (1996). «Neutral Six-Coordinate Phosphorus». Chemical Reviews. 96 (6): 1917–1952. doi:10.1021/cr9410880. PMID 11848816.
- ^ Adams, R.; Jenkins, R. L. (1941). «p-Nitrobenzoyl chloride». Organic Syntheses.; Collective Volume, vol. 1, p. 394
- ^ Clayden, Jonathan (2005). Organic chemistry (Reprinted ed.). Oxford: Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Burks Jr., J. E. (2004). «Phosphorus(V) chloride». In Paquette, L. (ed.). Encyclopedia of Reagents for Organic Synthesis. New York, NY: J. Wiley & Sons. doi:10.1002/047084289X.rp158. ISBN 0471936235.
- ^ Gross, H.; Rieche, A.; Höft, E.; Beyer, E. (1973). «Dichloromethyl methyl ether». Organic Syntheses.; Collective Volume, vol. 5, p. 365
- ^ Spaggiari, A.; Vaccari, D.; Davoli, P.; Torre, G.; Prati, F. (2007). «A Mild Synthesis of Vinyl Halides and gem-Dihalides Using Triphenyl Phosphite−Halogen-Based Reagents». The Journal of Organic Chemistry. 72 (6): 2216–2219. doi:10.1021/jo061346g. ISSN 0022-3263. PMID 17295542.
- ^ Schmutzler, R. (1973). «Styrylphosphonic dichloride». Organic Syntheses.; Collective Volume, vol. 5, p. 1005
- ^ Cotton, Frank Albert (1999). Advanced Inorganic Chemistry. Wiley-Interscience. ISBN 978-0-471-19957-1.
- ^ Bushkova, O. V.; Yaroslavtseva, T. V.; Dobrovolsky, Yu. A. (4 August 2017). «New lithium salts in electrolytes for lithium-ion batteries (Review)». Russian Journal of Electrochemistry. 53 (7): 677–699. doi:10.1134/S1023193517070035. S2CID 103854243.
- ^ Davy, Humphry (1809). «The Bakerian Lecture. An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed; with some general observations on chemical theory». Philosophical Transactions of the Royal Society of London. 99: 39–104. doi:10.1098/rstl.1809.0005. S2CID 98814859. On pp. 94–95, Davy mentioned that when he burned phosphorus in chlorine gas («oxymuriatic acid gas»), he obtained a clear liquid (phosphorus trichloride) and a white solid (phosphorus pentachloride).
- ^ Davy, Humphry (1810). «Researches on the oxymuriatic acid [i.e., chlorine], its nature and combinations; and on the elements of the muriatic acid [i.e., hydrogen chloride]. With some experiments on sulphur and phosphorus, made in the laboratory of the Royal Institution». Philosophical Transactions of the Royal Society of London. 100: 231–257. doi:10.1098/rstl.1810.0016. On p. 257, Davy presented his empirical formula for phosphorus pentachloride: 1 portion of phosphorus to 3 portions of «oxymuriatic gas» (chlorine).
- ^ Dulong (1816). «Extrait d’un mémoire sur les combinaisons du phosphore avec l’oxigène» [Extract from a memoir on the compounds of phosphorus with oxygen]. Annales de Chimie et de Physique. 2nd series (in French). 2: 141–150. On p. 148, Dulong presented the correct analysis of phosphorus pentachloride (which is 14.9% phosphorus and 85.1% chlorine by weight, vs. Dulong’s values of 15.4% and 84.6%, respectively).
External links[edit]
- The period 3 chlorides
- International Chemical Safety Card 0544
- CDC — NIOSH Pocket Guide to Chemical Hazards
У этого термина существуют и другие значения, см. Хлорид фосфора.
| Хлорид фосфора(V) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Хлорид фосфора(V) |
| Химическая формула | PCl5 |
| Физические свойства | |
| Состояние (ст. усл.) | белый порошок |
| Отн. молек. масса | 208.22 а. е. м. |
| Молярная масса | 208.22 г/моль |
| Плотность | 1.6 г/см³ |
| Термические свойства | |
| Температура плавления | 160 °C |
| Температура кипения | возгоняется при 159 °C |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| Рег. номер CAS | 10026-13-8 |
| SMILES | ClP(Cl)(Cl)(Cl)Cl |
Пентахлор́ид фо́сфора (хлорид фосфора(V), хлорангидрид фо́сфорной кислоты, пятихлористый фосфор) — соединение фосфора и хлора с формулой PCl5.
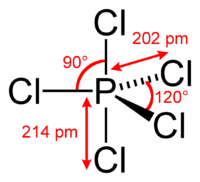
Молекула PCl5 в газообразном или жидком состояниях имеет конфигурацию тригональной бипирамиды с атомом фосфора в основании. Твёрдый пентахлорид фосфора состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]− (d P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные)).
Свойства
При нагревании выше 300 °C, полностью разлагается на PCl3 и Cl2.
Пентахлорид фосфора типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора (V):
- PCl5 + H2O → POCl3 + 2 HCl
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Для РCl5 характерны реакции окислительного хлорирования:
- PCl5 + 2 NO2 → PCl3 + 2NO2Cl
C концентрированой серной кислотой образует хлорсульфоновую кислоту:
- PCl5 + H2SO4 → ClSO2OH + POCl3 + HCl
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
-
- nPCl5 + nNH4Cl → (PNCl2)n + 4nHCl
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. К сожалению, фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов Cl на органические радикалы можно получить водоустойчивые полимеры.
Получение
Получают действием избытка хлора на хлорид фосфора(III):
- PCl3 + Cl2
PCl5 ΔH = −124 кДж/моль
Применение
PCl5 — сильный хлорирующий агент, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей.
Токсичность
Токсичен, ПДК 0,2 мг/м3.
Литература
- Н. С. Ахметов, «Общая и неорганическая химия». — М.: Высшая школа, 2001.
- Г. Реми, «Курс неорганической химии». — М.: Иностранная литература, 1963.
- Ф. Коттон, Дж. Уилкинсон, «Современная неорганическая химия». — М.: Мир, 1969.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Хлорид фосфора(V)
Брутто-формула:
Cl5P
CAS# 10026-13-8
Категории:
Бинарные соединения
PubChem CID: 24819
| ChemSpider ID: 23204
| CHEBI:30335
| CHEMBL1465793
Названия
Русский:
- Пентахлорид фосфора
- Хлорид фосфора(V) [Wiki]
- пятихлористый фосфор
- хлорангидрид фосфорной кислоты
English:
- PCl5
- Pentachlorophosphorane
- Phosphorus pentachloride(IUPAC) [Wiki]
- Phosphorus(V) chloride(IUPAC)
- UN 1806
- pentachloro-λ5-phosphane(IUPAC)
- pentachloro-λ5-phosphane(IUPAC)
German:
- Phosphor(V)-chlorid
- Phosphorpentachlorid [Wiki]
Español:
- Cloruro de fósforo (V)(IUPAC) [Wiki]
- Pentacloruro de fósforo
French:
- Pentachlorure de phosphore [Wiki]
Italiano:
- Pentacloruro di fosforo(IUPAC) [Wiki]
- cloruro di fosforo(V)
- pentacloro-λ5-fosfano(IUPAC)
- pentacloruro di fosforo
日本語:
- 五塩化リン [Wiki]
- 塩化リン(V)
中文:
- 五氯化磷 [Wiki]
- 氯化磷(V)(IUPAC)
Варианты формулы:
PCl5
Cl|P<`-Cl><|Cl><wCl></dCl>
Cl|P<_(a36)Cl><_(a-36)Cl><_(a108)Cl>_(a-108)Cl
Cl|P</Cl><Cl><`Cl>`/Cl
Химический состав
Реакции, в которых участвует Хлорид фосфора(V)
-
PCl3 + Cl2 <=> PCl5
-
PCl5 + 4H2O -> H3PO4 + 5HCl
-
SO2 + PCl5 «50-60^oC»—> SOCl2 + POCl3
-
P4O10 + 6PCl5 «150-175^oC»—> 10POCl3
-
2PCl5 + CaSO3 «50-60^oC»—> 2POCl3 + SCl2O + CaCl2
И ещё 9 реакций…
| Хлорид фосфора | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Хлорид фосфора(V) |
| Хим. формула | PCl5 |
| Физические свойства | |
| Состояние | белый порошок |
| Молярная масса | 208.22 г/моль |
| Плотность | 1.6 г/см³ |
| Термические свойства | |
| Т. плав. | 160 °C |
| Т. субл. | 324 ± 1 градус Фаренгейта[1] |
| Т. кип. | возгоняется при 159 °C |
| Давление пара | 1 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость в воде | реагирует |
| Классификация | |
| Рег. номер CAS | 10026-13-8 |
| PubChem | 24819 |
| Рег. номер EINECS | 233-060-3 |
| SMILES |
ClP(Cl)(Cl)(Cl)Cl |
| InChI |
1S/Cl5P/c1-6(2,3,4)5 UHZYTMXLRWXGPK-UHFFFAOYSA-N |
| RTECS | TB6125000 |
| ChEBI | 30335 |
| Номер ООН | 1806 |
| ChemSpider | 23204 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Пентахлори́д фо́сфора (хлорид фосфора(V), хлорангидрид фо́сфорной кислоты, пятихлористый фосфор) — соединение фосфора и хлора с формулой PCl5.
Молекула PCl5 в газообразном или жидком состояниях имеет конфигурацию тригональной бипирамиды с атомом фосфора в основании. Твёрдый пентахлорид фосфора состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]− (d P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные)).
Свойства
При нагревании выше 300 °C полностью разлагается на PCl3 и Cl2.
Пентахлорид фосфора — типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора (V):
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
Для РCl5 характерны реакции окислительного хлорирования:
C концентрированной серной кислотой образует хлорсульфоновую кислоту:
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. Однако фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов хлора на органические радикалы можно получить водоустойчивые полимеры.
Получение
Получают действием избытка хлора на хлорид фосфора(III):
Применение
PCl5 — сильный хлорирующий агент, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей.
Токсичность
Токсичен, ПДК 0,2 мг/м3.
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0509.html
Литература
- Н. С. Ахметов, «Общая и неорганическая химия». — М.: Высшая школа, 2001.
- Г. Реми, «Курс неорганической химии». — М.: Иностранная литература, 1963.
- Ф. Коттон, Дж. Уилкинсон, «Современная неорганическая химия». — М.: Мир, 1969.
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
Содержание
- Физические свойства
- Химические свойства
- Основные сферы применения
- Физиологические свойства
- История
Пентахлорид фосфора, хлорангидрид фосфорной кислоты, пятихлористый фосфор) — высший хлорид фосфора, бинарное неорганическое химическое соединение фосфора и хлора с формулой PCl5. Зеленовато-белые или желтоватые кристаллы тетрагональной сингонии с неприятным раздражающим запахом.
| Хлорид фосфора(V) | |
|---|---|
| Общие | |
| Систематическое наименование |
Хлорид фосфора(V) |
| Хим. формула | PCl5 |
| Рац. формула | PCl5 |
| Физические свойства | |
| Состояние | зеленовато-белый или желтоватый порошок |
| Молярная масса | 208,22 г/моль |
| Плотность | 2,11 |
| Термические свойства | |
| Температура | |
| • плавления | 160 |
| • сублимации | 159 °C |
| Мол. теплоёмк. | 113,32 (газ) Дж/(моль·К) |
| Энтальпия | |
| • образования | −376,0 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость | |
| • в воде | реагирует |
| Классификация | |
| Рег. номер CAS | 10026-13-8 |
| PubChem | 24819 |
| Рег. номер EINECS | 233-060-3 |
| SMILES |
ClP(Cl)(Cl)(Cl)Cl |
| InChI |
1S/Cl5P/c1-6(2,3,4)5 UHZYTMXLRWXGPK-UHFFFAOYSA-N |
| RTECS | TB6125000 |
| ChEBI | 30335 |
| Номер ООН | 1806 |
| ChemSpider | 23204 |
| Безопасность | |
| ЛД50 | 100 мг/кг |
| Токсичность | ядовит, сильный окислитель |
| NFPA 704 |
Физические свойства
Молекула PCl5 в газообразном или жидком состояниях, а также в неполярных растворителях имеет конфигурацию тригональной бипирамиды (двух треугольных пирамид, соединённых основаниями) с атомом фосфора в основании. Основание является равносторонним треугольником с атомами хлора в вершинах, расстояние между которыми 0,349 нм, а длина связи между ними и атомом фосфора равна 0,202 нм; длина связи P-Cl для двух атомов хлора в вершинах пирамиды (апикальных) равна 0,214 нм. Твёрдый пентахлорид фосфора является ионным кристаллом, он состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]−; длина связи P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В полярных растворителях PCl5 диссоциирует на ионы [PCl4]+ и Cl− при низких концентрациях, [PCl4]+ и [РCl6]− при высоких концентрациях
При температуре сублимации плотность паров в 7,2 раза больше плотности воздуха. Давление паров при 20°C равно 1,6 Па (0,012 мм рт.ст.).
Энтальпия сублимации при 390 К равна 67,4 ± 2,3 кДж/моль, при стандартных условиях 71,1 ± 5,0 кДж/моль.
Хорошо растворяется в тетрахлоруглероде, несколько хуже — в сероуглероде.
Химические свойства
При нагревании выше 300 °C практически полностью разлагается на PCl3 и Cl2. Степень диссоциации при 182 °C равна 41,7%, при 200°C 48,5%, при 250°C 80,0%, при 300°C 97,3%.
Пентахлорид фосфора — типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора(V):
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
Для РCl5 характерны реакции окислительного хлорирования:
C концентрированной серной кислотой образует хлорсульфоновую кислоту:
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
-
(ΔH = 129,7 кДж/моль).
Мировой химической промышленностью, по данным на 2000 год, ежегодно производилось около 10 000 тонн пентахлорида фосфора
Обратная реакция с полным разложением на хлор и трихлорид фосфора происходит при нагревании PCl5 до температуры выше 300 °C.
Основные сферы применения
Пятихлористый фосфор является хлорирующим агентом, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве красителей и лекарств.
Физиологические свойства
Хлорид фосфора(V) PCl5 является токсичным веществом (сильный неорганический яд) и мощным окислителем. Вызывает ожоги кожи.
ПДК в воздухе 0,2 мг/м3. Класс опасности — 2.
История
Пентахлорид фосфора был впервые синтезирован в 1808 году британским химиком Хэмфри Дэви, который, сжигая фосфор в хлоре, получил прозрачную жидкость (трихлорид фосфора) и белое твёрдое вещество (пентахлорид фосфора)






 PCl5 ΔH = −124 кДж/моль
PCl5 ΔH = −124 кДж/моль




