Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород[1]) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Максимальная концентрация при 20 °C равна 38% по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль. Соли соляной кислоты называются хлоридами
- ХЛОРОВОДОРОДНАЯ КИСЛОТА
-
то же, что соляная кислота.
Естествознание. Энциклопедический словарь.
Смотреть что такое «ХЛОРОВОДОРОДНАЯ КИСЛОТА» в других словарях:
-
Хлороводородная кислота — (хлористоводородная кислота) то же, что соляная кислота … Российская энциклопедия по охране труда
-
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что (см.) … Большая политехническая энциклопедия
-
Хлороводородная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
-
хлороводородная кислота — то же, что соляная кислота … Энциклопедический словарь
-
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота), р р хлороводорода в воде; сильная кислота. Бесцв., дымящая на воздухе жидкость (техн. С. к. желтоватая из за примесей Fe, Сl2 и др.). макс. концентрация (при 20 °С) 38% по массе, плотность такого р ра 1,19 г/см3.… … Естествознание. Энциклопедический словарь
-
соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
-
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
-
Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
-
СОЛЯНАЯ КИСЛОТА — (хлористоводородная к та, хлороводородная к та), р р НС1 в воде бесцв. жидкость с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол. м. 36,461 ) бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина связи HЧС1 … Химическая энциклопедия
-
Список кислот и ангидридов — … Википедия
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород[1]) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Максимальная концентрация при 20 °C равна 38% по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль. Соли соляной кислоты называются хлоридами
Элемент
Полуреакция
Е0,
В
Ag
Ag+
+ e = Ag
+0,7994
As
H3AsO4
+ 2H++2e=HAsO2+2H2O
+0,56
AsO43-+2H2O+2e=AsO2—
+4OH—
-0,71
Al
H2AlO3—
+ H2O
+
3e = Al + 4OH—
-2,33
Al3+
+3e = Al
-1,662
Br
Br2
+2e = 2Br—
+1,087
2BrO3—+12H+
+10e = Br2
+ 6H2O
+1,52
2BrO3—+6H2
O +10e = Br2
+ 12OH—
+0,50
C
CO2
+ 2H++2e
= HCOOH
-0,20
2CO2
+ 2H++2e
= H2
C2
O4
-0,49
Ca
Ca2+
+2e = Ca
-2,79
Cl
Cl2
+2e = 2Cl—
+1,359
2HOCl
+2H++2e
= Cl2
+ H2O
+1,63
2ClO—
+2H2O
+2e = Cl2
+ 4OH—
+0,40
HClO
+ H+
+2e = Cl—
+H2O
+1,50
ClO—
+ H2O
+2e = Cl—
+2OH—
+0,88
ClO2—
+ H2O
+ 2e = ClO—
+ 2OH—
+0,66
ClO2—
+ H2O
+ 4e = Cl—
+ 4OH—
+0,77
ClO3—
+ H2O
+ 2e = ClO2
—
+ 2OH—
+0,33
ClO3—
+ 3H+
+
2e = HClO2
+ H2O
+1,21
ClO3—
+ 2H+
+
e = ClO2
+ H2O
+1,15
ClO3—
+ 6H+
+
6e = Cl—
+3 H2O
+1,45
ClO3—
+ 3H2O
+ 6e = Cl—
+ 6OH—
+0,63
ClO4—
+2H+
+
2e = ClO3—
+ H2O
+1,19
ClO4—
+H2O
+
2e = ClO3—
+ 2OH—
+0,36
2ClO4—
+16H+
+
14e = Cl2
+ 8H2O
+1,39
ClO4—
+8H+
+
8e = Cl—
+ 4H2O
+1,38
ClO4—
+4H2O
+
8e = Cl—
+ 8OH—
+0,56
Co
Co3+
+
e = Co2+
+1,95
Co2+
+2e = Co
-0,29
Cr
Cr3+
+ e = Cr2+
-0,41
Cr3+
+ 3e = Cr
-0,74
Cr2O72-
+ 14H+
+6e = 2Cr3+
+7H2O
+1,33
CrO42-
+ 4H2O
+3e = Cr(OH)3
+ 5OH—
-0,13
Cu
Cu2+
+ 2e = Cu
+0,345
Cu+
+ e = Cu
+0,531
Cu2+
+ e = Cu+
+0,159
F
F2
+2e = 2F—
+2,77
Fe
Fe3+
+e = Fe2+
+0,771
Fe3+
+3e = Fe
-0,058
Fe2+
+ 2e = Fe
-0,473
H
2H+
+2e = H2
0,000
2H2O
+ 2e = H2
+2OH—
-0,828
H2O2
+ 2H+
+2e = 2H2O
+1,77
HO2—
+ H2O
+ 2e = 3OH—
+0,88
Hg
2Hg2+
+2e = Hg22+
+0,907
Hg2+
+2e = Hg
+0,850
Hg2
2+
+2e = Hg
+0,792
I
I2
+2e = 2I—
+0,536
Mn
Mn3+
+
e = Mn2+
+1,51
Mn2+
+
e = Mn
-1,17
Mn(OH)3
+ e = Mn(OH)2
+ OH—
+0,1
MnO2
+ 4H+
+ 2e = Mn2+
+ 2H2O
+1,23
MnO42-
+2H2O
+ 2e = MnO2
+ 4OH—
+0,58
MnO4—
+ e = MnO42-
+0,558
MnO4—
+4H+
+
3e = MnO2
+2H2O
+1,69
MnO4—
+2H2O
+ 3e = MnO2
+ 4OH—
+0,60
MnO4—
+ 8H+
+
5e = Mn2+
+
4H2O
+1,51
N
N2
+ 8H+
+6e = 2NH4+
+0,26
N2
+ 8H2O
+ 6e = 2NH4OH
+ 6OH—
-0,74
N2H4
+4H2O
+2e = 2NH4OH
+ 2OH—
+0,1
HNO2
+ H+
+e = NO + H2O
+0,98
NO2—
+ H2O
+ e = NO + 2OH—
-0,46
2HNO2
+ 4H+
+4e = N2O
+ 3H2O
+1,29
2HNO2
+ 6H+
+4e = N2
+ 4H2O
+1,44
2NO2—
+ 4H2O
+6 e = N2
+ 8OH—
+0,41
HNO2
+ 7H+
+6e = NH4+
+ 2H2O
+0,86
N
NO2—
+ 6H2O
+6 e = NH4OH
+ 7OH—
-0,15
N2O
+ 2H+
+2e = N2
+ H2O
+1,77
N2O
+ 2H2O
+2e = N2
+ 2OH—
+0,94
2NO
+ 4H+
+4e = N2
+ 2H2O
+1,68
2NO
+ 2H2O
+4e = N2
+ 4OH—
+0,85
N2O4
+ 2H+
+
2e = 2HNO2
+1,07
N2O4+
2e = 2NO2—
+0,88
N2O4
+ 8H+
+
8e = N2
+ 4H2O
+1,35
N2O4
+ 4H2O+
8e = N2
+8OH—
+0,53
NO3—
+ 3H+
+2e = HNO2
+ H2O
+0,94
NO3—
+ H2O
+2e = NO2
—
+
2OH—
+0,01
NO3—
+ 2H+
+e = NO2
+ H2O
+0,80
NO3—
+ H2O
+e = NO2
+ 2OH—
-0,86
NO3—
+ 4H+
+3e = NO +2 H2O
+0,96
NO3—
+ 2H2O
+3e = NO + 4OH—
-0,14
2NO3—
+ 12H+
+10e = N2
+ 6 H2O
+1,24
NO3—
+ 8H+
+6e = NH2OH*H
+2 H2O
+0,73
2NO3—
+ 17H+
+ 14e = N2
H4*H+
+ 6H2O
+0,84
NO3—
+ 10H+
+8e = NH4+
+ 3H2O
+0,87
NO3—
+ 7H2O
+8e = NH4OH
+ 9OH—
-0,12
O
O2
+ 4H+
+ 4e = 2H2O
+1,229
O2
+ 2H2O
+4e = 4OH—
+0,401
O2
+ 2H+
+ 2e = H2O2
+0,682
O2
+ H2O
+ 2e = HO2—
+ OH—
-0,076
H2O2
+ 2H+
+ 2e = 2H2O
+1,77
HO2
—
+ H2O
+ 2e = 3OH—
+0,88
O3
+ 2H+
+ 2e = H2O
+O2
+2,07
O3
+ H2O
+ 2e =2 OH—
+O2
+0,02
P
P
+ 3H+
+3e = PH3
+0,06
P
+ 3H2O
+3e = PH3
+3OH—
-0,89
HPO32-
+2H2O
+2e = H2PO2—
+ 3OH—
-1,57
PO43-
+ 2H2O
+2e = HPO32-
+3OH—
-1,12
Pb
Pb2+
+ 2e = Pb
-0,126
Pb4+
+
2e = Pb2+
+1,66
Pb4+
+
4e = Pb
+0,77
PbO2
+ H2O
+2e = PbO + 2OH—
+0,28
PbO2
+ 4H+
+ 2e = Pb2+
+ 2H2O
+1,455
S
S
+2e = S2-
-0,476
S2O32-
+6H+
+ 4e = S + 3H2O
+0,5
SO42-
+ 4H+
+2e = H2SO3
+ H2O
+0,17
SO42-
+ H2O+2e
= SO3
2-
+ 2OH—
-0,93
2SO42-
+ 10H+
+8e
= S2
O3
2-
+ 5H2O
+0,29
2SO42-
+ 5H2O+8e
= S2
O3
2-
+ 10OH—
-0,76
SO42-
+ 8H++6e
= S + 4H2O
+0,36
SO42-
+ 4H2O+6e
= S + 8OH—
-0,75
2SO32-
+ 3H2O+4e
= S2
O3
2-
+ 6OH—
-0,571
Si
SiO32-
+ 3H2O
+4e = Si + 6OH—
-1,7
Sn
Sn2+
+
2e = Sn
-0,140
Sn4+
+
2e = Sn2+
+0,15
Sn4+
+
2e = Sn
+0,01
Zn
Zn2+
+ 2e = Zn
-0,764
Zn(OH)2
+ 2e = Zn + 2OH—
-1,245
This article is about the aqueous solution. For the gas, see hydrogen chloride.
|
||
|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Chlorane[3] |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.210.665 |
|
| EC Number |
|
|
| E number | E507 (acidity regulators, …) | |
|
PubChem CID |
|
|
| UNII |
|
|
| UN number | 1789 | |
| Properties | ||
|
Chemical formula |
HCl(aq) | |
| Appearance | Colorless, transparent liquid, fumes in air if concentrated | |
| Odor | Pungent characteristic | |
| Melting point | Concentration-dependent – see table | |
| Boiling point | Concentration-dependent – see table | |
| log P | 0.00[4] | |
| Acidity (pKa) | −5.9 (HCl gas)[5] | |
| Pharmacology | ||
|
ATC code |
A09AB03 (WHO) B05XA13 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger[6] | |
|
Hazard statements |
H290, H314, H335[6] | |
|
Precautionary statements |
P260, P280, P303+P361+P353, P305+P351+P338[6] | |
| NFPA 704 (fire diamond) |
3 0 1 ACID |
|
| Related compounds | ||
|
Related compounds |
|
|
| Supplementary data page | ||
| Hydrochloric acid (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Hydrochloric acid, also known as muriatic acid, is an aqueous solution of hydrogen chloride. It is a colorless solution with a distinctive pungent smell. It is classified as a strong acid. It is a component of the gastric acid in the digestive systems of most animal species, including humans. Hydrochloric acid is an important laboratory reagent and industrial chemical.[7][8]
History[edit]
In the early tenth century, the Persian physician and alchemist Abu Bakr al-Razi (c. 865–925, Latin: Rhazes) conducted experiments with sal ammoniac (ammonium chloride) and vitriol (hydrated sulfates of various metals), which he distilled together, thus producing the gas hydrogen chloride.[9] In doing so, al-Razi may have stumbled upon a primitive method for producing hydrochloric acid,[10] as perhaps manifested in the following recipe from his Kitāb al-Asrār («The Book of Secrets»):
Take equal parts of sweet salt, Bitter salt, Ṭabarzad salt, Andarānī salt, Indian salt, salt of Al-Qilī, and salt of Urine. After adding an equal weight of good crystallised Sal-ammoniac, dissolve by moisture, and distil (the mixture). There will distil over a strong water, which will cleave stone (sakhr) instantly.[11]
However, it appears that in most of his experiments al-Razi disregarded the gaseous products, concentrating instead on the color changes that could be effected in the residue.[12] According to Robert P. Multhauf, hydrogen chloride was produced many times without clear recognition that, by dissolving it in water, hydrochloric acid may be produced.[13]
Drawing on al-Razi’s experiments, the De aluminibus et salibus («On Alums and Salts»), an eleventh- or twelfth century Arabic text falsely attributed to al-Razi and translated into Latin by Gerard of Cremona (1144–1187), described the heating of metals with various salts, which in the case of mercury resulted in the production of mercury(II) chloride (corrosive sublimate).[14] In this process, hydrochloric acid actually started to form, but it immediately reacted with the mercury to produce corrosive sublimate. Thirteenth-century Latin alchemists, for whom the De aluminibus et salibus was one of the main reference works, were fascinated by the chlorinating properties of corrosive sublimate, and they soon discovered that when the metals are eliminated from the process of heating vitriols, alums, and salts, strong mineral acids can directly be distilled.[15]
One important invention that resulted from the discovery of the mineral acids is aqua regia, a mixture of nitric acid and hydrochloric acid in a 1:3 proportion, capable of dissolving gold. This was first described in pseudo-Geber’s De inventione veritatis («On the Discovery of Truth», after c. 1300), where aqua regia was prepared by adding ammonium chloride to nitric acid.[16] However, the production of hydrochloric acid itself (i.e., as an isolated substance rather than as already mixed with nitric acid) depended on the use of more efficient cooling apparatus, which would only develop in subsequent centuries.[17] Thus, recipes for the production of hydrochloric acid only appear in the late sixteenth century, the earliest being found in Giovanni Battista Della Porta’s (1535–1615) Magiae naturalis («Natural Magic») and in the works of other contemporary chemists like Andreas Libavius (c. 1550–1616), Jean Beguin (1550–1620), and Oswald Croll (c. 1563– 1609).[18] The knowledge of mineral acids such as hydrochloric acid would be of key importance to seventeenth-century chemists like Daniel Sennert (1572–1637) and Robert Boyle (1627–1691), who used their capability to rapidly dissolve metals in their demonstrations of the composite nature of bodies.[19]
Etymology[edit]
Because it was produced from rock salt according to the methods of Johann Rudolph Glauber, hydrochloric acid was historically called by European alchemists spirits of salt or acidum salis (salt acid). Both names are still used, especially in other languages, such as German: Salzsäure, Dutch: Zoutzuur, Swedish: Saltsyra, Spanish: Salfumán, Turkish: Tuz Ruhu, Polish: kwas solny, Hungarian: sósav and Czech: kyselina solná
Gaseous HCl was called marine acid air. The name muriatic acid has the same origin (muriatic means «pertaining to brine or salt», hence muriate means hydrochloride), and this name is still sometimes used.[1][20] The name hydrochloric acid was coined by the French chemist Joseph Louis Gay-Lussac in 1814.[21]
Industrial developments[edit]
During the Industrial Revolution in Europe, demand for alkaline substances increased. A new industrial process developed by Nicolas Leblanc of Issoudun, France enabled cheap large-scale production of sodium carbonate (soda ash). In this Leblanc process, common salt is converted to soda ash, using sulfuric acid, limestone, and coal, releasing hydrogen chloride as a by-product. Until the British Alkali Act 1863 and similar legislation in other countries, the excess HCl was often vented into the air. An early exception was the Bonnington Chemical Works where, in 1830, the HCl began to be captured and the hydrochloric acid produced was used in making sal ammoniac (ammonium chloride).[22] After the passage of the act, soda ash producers were obliged to absorb the waste gas in water, producing hydrochloric acid on an industrial scale.[23][24]
In the 20th century, the Leblanc process was effectively replaced by the Solvay process without a hydrochloric acid by-product. Since hydrochloric acid was already fully settled as an important chemical in numerous applications, the commercial interest initiated other production methods, some of which are still used today. After 2000, hydrochloric acid is mostly made by absorbing by-product hydrogen chloride from industrial organic compounds production.[23][24][7]
Chemical properties[edit]
Gaseous hydrogen chloride is a molecular compound with a covalent bond between the hydrogen and chlorine atoms. In aqueous solutions dissociation is complete, with the formation of chloride ions and hydrated hydrogen ions (hydronium ions).[25] A combined IR, Raman, X-ray, and neutron diffraction study of concentrated hydrochloric acid showed that the hydronium ion forms hydrogen bonded complexes with other water molecules.[26] (See Hydronium for further discussion of this issue.)
The pKa value of hydrochloric acid in aqueous solution is estimated theoretically to be −5.9.[5] A solution of hydrogen chloride in water behaves as a strong acid: the concentration of HCl molecules is effectively zero.
Physical properties[edit]
| Mass fraction |
Concentration | Density | Molarity | pH | Viscosity | Specific heat |
Vapour pressure |
Boiling point |
Melting point |
|
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m3 | Baumé | kg/L | mol/L | mPa·s | kJ/(kg·K) | kPa | °C | °C | |
| 10% | 104.80 | 6.6 | 1.048 | 2.87 | −0.5 | 1.16 | 3.47 | 1.95 | 103 | −18 |
| 20% | 219.60 | 13 | 1.098 | 6.02 | −0.8 | 1.37 | 2.99 | 1.40 | 108 | −59 |
| 30% | 344.70 | 19 | 1.149 | 9.45 | −1.0 | 1.70 | 2.60 | 2.13 | 90 | −52 |
| 32% | 370.88 | 20 | 1.159 | 10.17 | −1.0 | 1.80 | 2.55 | 3.73 | 84 | −43 |
| 34% | 397.46 | 21 | 1.169 | 10.90 | −1.0 | 1.90 | 2.50 | 7.24 | 71 | −36 |
| 36% | 424.44 | 22 | 1.179 | 11.64 | −1.1 | 1.99 | 2.46 | 14.5 | 61 | −30 |
| 38% | 451.82 | 23 | 1.189 | 12.39 | −1.1 | 2.10 | 2.43 | 28.3 | 48 | −26 |
| The reference temperature and pressure for the above table are 20 °C and 1 atmosphere (101.325 kPa). Vapour pressure values are taken from the International Critical Tables and refer to the total vapour pressure of the solution. |
Melting temperature as a function of HCl concentration in water[27][28]
Physical properties of hydrochloric acid, such as boiling and melting points, density, and pH, depend on the concentration or molarity of HCl in the aqueous solution. They range from those of water at very low concentrations approaching 0% HCl to values for fuming hydrochloric acid at over 40% HCl.[29][30][31]
Hydrochloric acid as the binary (two-component) mixture of HCl and H2O has a constant-boiling azeotrope at 20.2% HCl and 108.6 °C (381.8 K; 227.5 °F). There are four constant-crystallization eutectic points for hydrochloric acid, between the crystal form of [H3O]Cl (68% HCl), [H5O2]Cl (51% HCl), [H7O3]Cl (41% HCl), [H3O]Cl·5H2O (25% HCl), and ice (0% HCl). There is also a metastable eutectic point at 24.8% between ice and the [H7O3]Cl crystallization.[31] They are all Hydronium salts.
Production[edit]
Hydrochloric acid is usually prepared industrially by dissolving hydrogen chloride in water. Hydrogen chloride can be generated in many ways, and thus several precursors to hydrochloric acid exist. The large-scale production of hydrochloric acid is almost always integrated with the industrial scale production of other chemicals, such as in the chloralkali process which produces hydroxide, hydrogen, and chlorine, the latter of which can be combined to produce HCl.[29][30]
Hydrogen chloride is produced by combining chlorine and hydrogen:
- Cl2 + H2 → 2 HCl
As the reaction is exothermic, the installation is called an HCl oven or HCl burner. The resulting hydrogen chloride gas is absorbed in deionized water, resulting in chemically pure hydrochloric acid. This reaction can give a very pure product, e.g. for use in the food industry.
Industrial market[edit]
Hydrochloric acid is produced in solutions up to 38% HCl (concentrated grade). Higher concentrations up to just over 40% are chemically possible, but the evaporation rate is then so high that storage and handling require extra precautions, such as pressurization and cooling. Bulk industrial-grade is therefore 30% to 35%, optimized to balance transport efficiency and product loss through evaporation. In the United States, solutions of between 20% and 32% are sold as muriatic acid. Solutions for household purposes in the US, mostly cleaning, are typically 10% to 12%, with strong recommendations to dilute before use. In the United Kingdom, where it is sold as «Spirits of Salt» for domestic cleaning, the potency is the same as the US industrial grade.[23] In other countries, such as Italy, hydrochloric acid for domestic or industrial cleaning is sold as «Acido Muriatico», and its concentration ranges from 5% to 32%.
Major producers worldwide include Dow Chemical at 2 million tonnes annually (Mt/year), calculated as HCl gas, Georgia Gulf Corporation, Tosoh Corporation, Akzo Nobel, and Tessenderlo at 0.5 to 1.5 Mt/year each. Total world production, for comparison purposes expressed as HCl, is estimated at 20 Mt/year, with 3 Mt/year from direct synthesis, and the rest as secondary product from organic and similar syntheses. By far, most hydrochloric acid is consumed captively by the producer. The open world market size is estimated at 5 Mt/year.[23]
Applications[edit]
Hydrochloric acid is a strong inorganic acid that is used in many industrial processes such as refining metal. The application often determines the required product quality.[23] Hydrogen chloride, not hydrochloric acid, is used more widely in industrial organic chemistry, e.g. for vinyl chloride and dichloroethane.[8]
Pickling of steel[edit]
One of the most important applications of hydrochloric acid is in the pickling of steel, to remove rust or iron oxide scale from iron or steel before subsequent processing, such as extrusion, rolling, galvanizing, and other techniques.[23][7] Technical quality HCl at typically 18% concentration is the most commonly used pickling agent for the pickling of carbon steel grades.
- Fe3O4 + Fe + 8 HCl → 4 FeCl2 + 4 H2O
The spent acid has long been reused as iron(II) chloride (also known as ferrous chloride) solutions, but high heavy-metal levels in the pickling liquor have decreased this practice.
The steel pickling industry has developed hydrochloric acid regeneration processes, such as the spray roaster or the fluidized bed HCl regeneration process, which allow the recovery of HCl from spent pickling liquor. The most common regeneration process is the pyrohydrolysis process, applying the following formula:[23]
- 4 FeCl2 + 4 H2O + O2 → 8 HCl + 2 Fe2O3
By recuperation of the spent acid, a closed acid loop is established.[7] The iron(III) oxide by-product of the regeneration process is valuable, used in a variety of secondary industries.[23]
Production of inorganic compounds[edit]
Akin to its use for pickling, hydrochloric acid is used to dissolve many metals, metal oxides and metal carbonates. The conversion are often depicted in simplified equations:
- Zn + 2 HCl → ZnCl2 + H2
- NiO + 2 HCl → NiCl2 + H2O
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
These processes are used to produce metal chlorides for analysis or further production.[29][30][7]
pH control and neutralization[edit]
Hydrochloric acid can be used to regulate the acidity (pH) of solutions.
- HO− + HCl → H2O + Cl−
In industry demanding purity (food, pharmaceutical, drinking water), high-quality hydrochloric acid is used to control the pH of process water streams. In less-demanding industry, technical quality hydrochloric acid suffices for neutralizing waste streams and swimming pool pH control.[7]
Regeneration of ion exchangers[edit]
High-quality hydrochloric acid is used in the regeneration of ion exchange resins. Cation exchange is widely used to remove ions such as Na+ and Ca2+ from aqueous solutions, producing demineralized water. The acid is used to rinse the cations from the resins.[23] Na+ is replaced with H+ and Ca2+ with 2 H+.
Ion exchangers and demineralized water are used in all chemical industries, drinking water production, and many food industries.[23]
Laboratory use[edit]
Of the common strong mineral acids in chemistry, hydrochloric acid is the monoprotic acid least likely to undergo an interfering oxidation-reduction reaction. It is one of the least hazardous strong acids to handle; despite its acidity, it contains the non-reactive and non-toxic chloride ion. Intermediate-strength hydrochloric acid solutions are quite stable upon storage, maintaining their concentrations over time. These attributes, plus the fact that it is available as a pure reagent, make hydrochloric acid an excellent acidifying reagent. It is also inexpensive.
Hydrochloric acid is the preferred acid in titration for determining the amount of bases. Strong acid titrants give more precise results due to a more distinct endpoint. Azeotropic, or «constant-boiling», hydrochloric acid (roughly 20.2%) can be used as a primary standard in quantitative analysis, although its exact concentration depends on the atmospheric pressure when it is prepared.[32]
Other[edit]
Hydrochloric acid is used for a large number of small-scale applications, such as leather processing, household cleaning,[33] and building construction.[7] Oil production may be stimulated by injecting hydrochloric acid into the rock formation of an oil well, dissolving a portion of the rock, and creating a large-pore structure. Oil well acidizing is a common process in the North Sea oil production industry.[23]
Hydrochloric acid has been used for dissolving calcium carbonate, e.g. such things as de-scaling kettles and for cleaning mortar off brickwork. When used on brickwork the reaction with the mortar only continues until the acid has all been converted, producing calcium chloride, carbon dioxide, and water:
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Many chemical reactions involving hydrochloric acid are applied in the production of food, food ingredients, and food additives. Typical products include aspartame, fructose, citric acid, lysine, hydrolyzed vegetable protein as food enhancer, and in gelatin production. Food-grade (extra-pure) hydrochloric acid can be applied when needed for the final product.[23][7]
Presence in living organisms[edit]
Diagram of alkaline mucous layer in stomach with mucosal defense mechanisms
Gastric acid is one of the main secretions of the stomach. It consists mainly of hydrochloric acid and acidifies the stomach content to a pH of 1 to 2.[34][35] Chloride (Cl−) and hydrogen (H+) ions are secreted separately in the stomach fundus region at the top of the stomach by parietal cells of the gastric mucosa into a secretory network called canaliculi before it enters the stomach lumen.[36]
Gastric acid acts as a barrier against microorganisms to prevent infections and is important for the digestion of food. Its low pH denatures proteins and thereby makes them susceptible to degradation by digestive enzymes such as pepsin. The low pH also activates the enzyme precursor pepsinogen into the active enzyme pepsin by self-cleavage. After leaving the stomach, the hydrochloric acid of the chyme is neutralized in the duodenum by bicarbonate.[34]
The stomach itself is protected from the strong acid by the secretion of a thick mucus layer, and by secretin induced buffering with sodium bicarbonate. Heartburn or peptic ulcers can develop when these mechanisms fail. Drugs of the antihistaminic and proton pump inhibitor classes can inhibit the production of acid in the stomach, and antacids are used to neutralize excessive existing acid.[34][37]
Safety[edit]



Being a strong acid, hydrochloric acid is corrosive to living tissue and to many materials, but not to rubber. Typically, rubber protective gloves and related protective gear are used when handling concentrated solutions.[8]
| Mass fraction |
Classification[38] | List of H-phrases |
|---|---|---|
| 10% ≤ C < 25% | Causes skin irritation, Causes serious eye irritation, | H315, H319 |
| C ≥ 10% | May cause respiratory irritation | H335 |
| C ≥ 25% | Causes severe skin burns and eye damage | H314 |
Legal status[edit]
Hydrochloric acid has been listed as a Table II precursor under the 1988 United Nations Convention Against Illicit Traffic in Narcotic Drugs and Psychotropic Substances because of its use in the production of heroin, cocaine, and methamphetamine.[39][40]
See also[edit]
- Chloride, inorganic salts of hydrochloric acid
- Hydrochloride, organic salts of hydrochloric acid
- Aqua regia
References[edit]
- ^ a b «Hydrochloric Acid». Archived from the original on 15 October 2010. Retrieved 16 September 2010.
- ^ «spirits of salt». Retrieved 29 May 2012.
- ^ Favre HA, Powell WH, eds. (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Cambridge: The Royal Society of Chemistry. p. 131.
- ^ «Hydrochloric acid». www.chemsrc.com.
- ^ a b Trummal A, Lipping L, Kaljurand I, Koppel IA, Leito I (May 2016). «Acidity of Strong Acids in Water and Dimethyl Sulfoxide». The Journal of Physical Chemistry A. 120 (20): 3663–9. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918. S2CID 29697201.
- ^ a b c Sigma-Aldrich Co., Hydrochloric acid.
- ^ a b c d e f g h Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 946–48. ISBN 978-0-08-037941-8.
- ^ a b c Austin, Severin; Glowacki, Arndt (2000). Hydrochloric Acid. doi:10.1002/14356007.a13_283. ISBN 3527306730.
- ^ Multhauf 1966, pp. 141–142.
- ^ Stapleton, Henry E.; Azo, R.F.; Hidayat Husain, M. (1927). «Chemistry in Iraq and Persia in the Tenth Century A.D.» Memoirs of the Asiatic Society of Bengal. VIII (6): 317–418. OCLC 706947607. p. 333.
- ^ Stapleton, Azo & Hidayat Husain 1927, p. 333 (for a glossary of the terms used in this recipe, see p. 322). German translation of the same passage in Ruska, Julius (1937). Al-Rāzī’s Buch Geheimnis der Geheimnisse. Mit Einleitung und Erläuterungen in deutscher Übersetzung. Quellen und Studien zur Geschichte der Naturwissenschaften und der Medizin. Vol. VI. Berlin: Springer. p. 182, §5. An English translation of Ruska 1937’s translation can be found in Taylor, Gail Marlow (2015). The Alchemy of Al-Razi: A Translation of the «Book of Secrets». CreateSpace Independent Publishing Platform. ISBN 9781507778791. pp. 139–140.
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. OCLC 977570829. pp. 141–142.
- ^ Multhauf 1966, p. 142. Multhauf refers to a number of recipes from the Kitāb al-Asrār translated by Ruska 1937, pp. 103–110, but does not seem to have noted the existence of the recipe in Ruska 1937, p. 182, §5 quoted above.
- ^ Multhauf 1966, pp. 160–162.
- ^ Multhauf 1966, pp. 162–163.
- ^ Karpenko, Vladimír; Norris, John A. (2002). «Vitriol in the History of Chemistry». Chemické listy. 96 (12): 997–1005. p. 1002.
- ^ Multhauf 1966, p. 204.
- ^ Multhauf 1966, p. 208, note 29; cf. p. 142, note 79.
- ^ Newman, William R. (2006). Atoms and Alchemy: Chymistry and the Experimental Origins of the Scientific Revolution. Chicago: University of Chicago Press. ISBN 978-0226576961. p. 98.
- ^ «Muriatic Acid» (PDF). PPG Industries. 2005. Archived from the original (PDF) on 2 July 2015. Retrieved 10 September 2010.
- ^ Gay-Lussac (1814) «Mémoire sur l’iode» (Memoir on iodine), Annales de Chemie, 91 : 5–160. From page 9: » … mais pour les distinguer, je propose d’ajouter au mot spécifique de l’acide que l’on considère, le mot générique de hydro; de sorte que le combinaisons acide de hydrogène avec le chlore, l’iode, et le soufre porteraient le nom d’acide hydrochlorique, d’acide hydroiodique, et d’acide hydrosulfurique; … « (… but in order to distinguish them, I propose to add to the specific suffix of the acid being considered, the general prefix hydro, so that the acidic combinations of hydrogen with chlorine, iodine, and sulfur will bear the name hydrochloric acid, hydroiodic acid, and hydrosulfuric acid; …)
- ^ Ronalds BF (2019). «Bonnington Chemical Works (1822-1878): Pioneer Coal Tar Company». International Journal for the History of Engineering & Technology. 89 (1–2): 73–91. doi:10.1080/17581206.2020.1787807. S2CID 221115202.
- ^ a b c d e f g h i j k l «Hydrochloric Acid». Chemicals Economics Handbook. SRI International. 2001. pp. 733.4000A–733.3003F.
- ^ a b Aftalion F (1991). A History of the International Chemical Industry. Philadelphia: University of Pennsylvania Press. ISBN 978-0-8122-1297-6.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General chemistry: principles and modern applications. Prentice Hall. pp. 668–669. ISBN 978-0-13-014329-7.
- ^ Agmon N (January 1998). «Structure of Concentrated HCl Solutions». The Journal of Physical Chemistry A. 102 (1): 192–199. Bibcode:1998JPCA..102..192A. CiteSeerX 10.1.1.78.3695. doi:10.1021/jp970836x. ISSN 1089-5639.
- ^ «Systemnummer 6 Chlor». Gmelins Handbuch der Anorganischen Chemie. Chemie Berlin. 1927.
- ^ «Systemnummer 6 Chlor, Ergänzungsband Teil B – Lieferung 1». Gmelins Handbuch der Anorganischen Chemie. Chemie Weinheim. 1968.
- ^ a b c Lide D (2000). CRC Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 978-0-8493-0481-1.
- ^ a b c Perry R, Green D, Maloney J (1984). Perry’s Chemical Engineers’ Handbook (6th ed.). McGraw-Hill Book Company. ISBN 978-0-07-049479-4.
- ^ a b Aspen Properties. binary mixtures modeling software (calculations by Akzo Nobel Engineering ed.). Aspen Technology. 2002–2003.
- ^ Mendham J, Denney RC, Barnes JD, Thomas MJ, Denney RC, Thomas MJ (2000). Vogel’s Quantitative Chemical Analysis (6th ed.). New York: Prentice Hall. ISBN 978-0-582-22628-9.
- ^ Simhon R (13 September 2003). «Household plc: really filthy bathroom». The Daily Telegraph. London. Archived from the original on 23 February 2009. Retrieved 31 March 2010.
- ^ a b c Maton A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ Haas E (6 December 2000). «Digestive Aids: Hydrochloric acid». healthy.net.
- ^ Arthur C, Guyton MD, Hall JE (2000). Textbook of Medical Physiology (10th ed.). W.B. Saunders Company. ISBN 978-0-7216-8677-6.
- ^ Bowen R (18 March 2003). «Control and Physiologic Effects of Secretin». Colorado State University. Retrieved 16 March 2009.
- ^ «Regulation (EC) No 1272/2008 of the European Parliament and of Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006». EUR-lex. Retrieved 16 December 2008.
- ^ List of precursors and chemicals frequently used in the illicit manufacture of narcotic drugs and psychotropic substances under international control (PDF) (Eleventh ed.). International Narcotics Control Board. January 2007. Archived from the original (PDF) on 2008-02-27.
- ^ Chemicals Required for the Illicit Manufacture of Drugs (PDF) (Report). UNDOC. 1998. Retrieved July 20, 2022.
External links[edit]
This audio file was created from a revision of this article dated 23 April 2005, and does not reflect subsequent edits.
- NIST WebBook, general link
- Hydrochloric Acid – Part One and Hydrochloric Acid – Part Two at The Periodic Table of Videos (University of Nottingham)
- Calculators: surface tensions, and densities, molarities and molalities of aqueous HCl
- General safety information
- EPA Hazard Summary
- Hydrochloric acid MSDS by Georgia Institute of Technology
- NIOSH Pocket Guide to Chemical Hazards
- Pollution information
- National Pollutant Inventory – Hydrochloric Acid Fact Sheet
This article is about the aqueous solution. For the gas, see hydrogen chloride.

|
||
|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Chlorane[3] |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.210.665 |
|
| EC Number |
|
|
| E number | E507 (acidity regulators, …) | |
|
PubChem CID |
|
|
| UNII |
|
|
| UN number | 1789 | |
| Properties | ||
|
Chemical formula |
HCl(aq) | |
| Appearance | Colorless, transparent liquid, fumes in air if concentrated | |
| Odor | Pungent characteristic | |
| Melting point | Concentration-dependent – see table | |
| Boiling point | Concentration-dependent – see table | |
| log P | 0.00[4] | |
| Acidity (pKa) | −5.9 (HCl gas)[5] | |
| Pharmacology | ||
|
ATC code |
A09AB03 (WHO) B05XA13 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger[6] | |
|
Hazard statements |
H290, H314, H335[6] | |
|
Precautionary statements |
P260, P280, P303+P361+P353, P305+P351+P338[6] | |
| NFPA 704 (fire diamond) |
3 0 1 ACID |
|
| Related compounds | ||
|
Related compounds |
|
|
| Supplementary data page | ||
| Hydrochloric acid (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Hydrochloric acid, also known as muriatic acid, is an aqueous solution of hydrogen chloride. It is a colorless solution with a distinctive pungent smell. It is classified as a strong acid. It is a component of the gastric acid in the digestive systems of most animal species, including humans. Hydrochloric acid is an important laboratory reagent and industrial chemical.[7][8]
History[edit]
In the early tenth century, the Persian physician and alchemist Abu Bakr al-Razi (c. 865–925, Latin: Rhazes) conducted experiments with sal ammoniac (ammonium chloride) and vitriol (hydrated sulfates of various metals), which he distilled together, thus producing the gas hydrogen chloride.[9] In doing so, al-Razi may have stumbled upon a primitive method for producing hydrochloric acid,[10] as perhaps manifested in the following recipe from his Kitāb al-Asrār («The Book of Secrets»):
Take equal parts of sweet salt, Bitter salt, Ṭabarzad salt, Andarānī salt, Indian salt, salt of Al-Qilī, and salt of Urine. After adding an equal weight of good crystallised Sal-ammoniac, dissolve by moisture, and distil (the mixture). There will distil over a strong water, which will cleave stone (sakhr) instantly.[11]
However, it appears that in most of his experiments al-Razi disregarded the gaseous products, concentrating instead on the color changes that could be effected in the residue.[12] According to Robert P. Multhauf, hydrogen chloride was produced many times without clear recognition that, by dissolving it in water, hydrochloric acid may be produced.[13]
Drawing on al-Razi’s experiments, the De aluminibus et salibus («On Alums and Salts»), an eleventh- or twelfth century Arabic text falsely attributed to al-Razi and translated into Latin by Gerard of Cremona (1144–1187), described the heating of metals with various salts, which in the case of mercury resulted in the production of mercury(II) chloride (corrosive sublimate).[14] In this process, hydrochloric acid actually started to form, but it immediately reacted with the mercury to produce corrosive sublimate. Thirteenth-century Latin alchemists, for whom the De aluminibus et salibus was one of the main reference works, were fascinated by the chlorinating properties of corrosive sublimate, and they soon discovered that when the metals are eliminated from the process of heating vitriols, alums, and salts, strong mineral acids can directly be distilled.[15]
One important invention that resulted from the discovery of the mineral acids is aqua regia, a mixture of nitric acid and hydrochloric acid in a 1:3 proportion, capable of dissolving gold. This was first described in pseudo-Geber’s De inventione veritatis («On the Discovery of Truth», after c. 1300), where aqua regia was prepared by adding ammonium chloride to nitric acid.[16] However, the production of hydrochloric acid itself (i.e., as an isolated substance rather than as already mixed with nitric acid) depended on the use of more efficient cooling apparatus, which would only develop in subsequent centuries.[17] Thus, recipes for the production of hydrochloric acid only appear in the late sixteenth century, the earliest being found in Giovanni Battista Della Porta’s (1535–1615) Magiae naturalis («Natural Magic») and in the works of other contemporary chemists like Andreas Libavius (c. 1550–1616), Jean Beguin (1550–1620), and Oswald Croll (c. 1563– 1609).[18] The knowledge of mineral acids such as hydrochloric acid would be of key importance to seventeenth-century chemists like Daniel Sennert (1572–1637) and Robert Boyle (1627–1691), who used their capability to rapidly dissolve metals in their demonstrations of the composite nature of bodies.[19]
Etymology[edit]
Because it was produced from rock salt according to the methods of Johann Rudolph Glauber, hydrochloric acid was historically called by European alchemists spirits of salt or acidum salis (salt acid). Both names are still used, especially in other languages, such as German: Salzsäure, Dutch: Zoutzuur, Swedish: Saltsyra, Spanish: Salfumán, Turkish: Tuz Ruhu, Polish: kwas solny, Hungarian: sósav and Czech: kyselina solná
Gaseous HCl was called marine acid air. The name muriatic acid has the same origin (muriatic means «pertaining to brine or salt», hence muriate means hydrochloride), and this name is still sometimes used.[1][20] The name hydrochloric acid was coined by the French chemist Joseph Louis Gay-Lussac in 1814.[21]
Industrial developments[edit]
During the Industrial Revolution in Europe, demand for alkaline substances increased. A new industrial process developed by Nicolas Leblanc of Issoudun, France enabled cheap large-scale production of sodium carbonate (soda ash). In this Leblanc process, common salt is converted to soda ash, using sulfuric acid, limestone, and coal, releasing hydrogen chloride as a by-product. Until the British Alkali Act 1863 and similar legislation in other countries, the excess HCl was often vented into the air. An early exception was the Bonnington Chemical Works where, in 1830, the HCl began to be captured and the hydrochloric acid produced was used in making sal ammoniac (ammonium chloride).[22] After the passage of the act, soda ash producers were obliged to absorb the waste gas in water, producing hydrochloric acid on an industrial scale.[23][24]
In the 20th century, the Leblanc process was effectively replaced by the Solvay process without a hydrochloric acid by-product. Since hydrochloric acid was already fully settled as an important chemical in numerous applications, the commercial interest initiated other production methods, some of which are still used today. After 2000, hydrochloric acid is mostly made by absorbing by-product hydrogen chloride from industrial organic compounds production.[23][24][7]
Chemical properties[edit]
Gaseous hydrogen chloride is a molecular compound with a covalent bond between the hydrogen and chlorine atoms. In aqueous solutions dissociation is complete, with the formation of chloride ions and hydrated hydrogen ions (hydronium ions).[25] A combined IR, Raman, X-ray, and neutron diffraction study of concentrated hydrochloric acid showed that the hydronium ion forms hydrogen bonded complexes with other water molecules.[26] (See Hydronium for further discussion of this issue.)
The pKa value of hydrochloric acid in aqueous solution is estimated theoretically to be −5.9.[5] A solution of hydrogen chloride in water behaves as a strong acid: the concentration of HCl molecules is effectively zero.
Physical properties[edit]
| Mass fraction |
Concentration | Density | Molarity | pH | Viscosity | Specific heat |
Vapour pressure |
Boiling point |
Melting point |
|
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m3 | Baumé | kg/L | mol/L | mPa·s | kJ/(kg·K) | kPa | °C | °C | |
| 10% | 104.80 | 6.6 | 1.048 | 2.87 | −0.5 | 1.16 | 3.47 | 1.95 | 103 | −18 |
| 20% | 219.60 | 13 | 1.098 | 6.02 | −0.8 | 1.37 | 2.99 | 1.40 | 108 | −59 |
| 30% | 344.70 | 19 | 1.149 | 9.45 | −1.0 | 1.70 | 2.60 | 2.13 | 90 | −52 |
| 32% | 370.88 | 20 | 1.159 | 10.17 | −1.0 | 1.80 | 2.55 | 3.73 | 84 | −43 |
| 34% | 397.46 | 21 | 1.169 | 10.90 | −1.0 | 1.90 | 2.50 | 7.24 | 71 | −36 |
| 36% | 424.44 | 22 | 1.179 | 11.64 | −1.1 | 1.99 | 2.46 | 14.5 | 61 | −30 |
| 38% | 451.82 | 23 | 1.189 | 12.39 | −1.1 | 2.10 | 2.43 | 28.3 | 48 | −26 |
| The reference temperature and pressure for the above table are 20 °C and 1 atmosphere (101.325 kPa). Vapour pressure values are taken from the International Critical Tables and refer to the total vapour pressure of the solution. |
Melting temperature as a function of HCl concentration in water[27][28]
Physical properties of hydrochloric acid, such as boiling and melting points, density, and pH, depend on the concentration or molarity of HCl in the aqueous solution. They range from those of water at very low concentrations approaching 0% HCl to values for fuming hydrochloric acid at over 40% HCl.[29][30][31]
Hydrochloric acid as the binary (two-component) mixture of HCl and H2O has a constant-boiling azeotrope at 20.2% HCl and 108.6 °C (381.8 K; 227.5 °F). There are four constant-crystallization eutectic points for hydrochloric acid, between the crystal form of [H3O]Cl (68% HCl), [H5O2]Cl (51% HCl), [H7O3]Cl (41% HCl), [H3O]Cl·5H2O (25% HCl), and ice (0% HCl). There is also a metastable eutectic point at 24.8% between ice and the [H7O3]Cl crystallization.[31] They are all Hydronium salts.
Production[edit]
Hydrochloric acid is usually prepared industrially by dissolving hydrogen chloride in water. Hydrogen chloride can be generated in many ways, and thus several precursors to hydrochloric acid exist. The large-scale production of hydrochloric acid is almost always integrated with the industrial scale production of other chemicals, such as in the chloralkali process which produces hydroxide, hydrogen, and chlorine, the latter of which can be combined to produce HCl.[29][30]
Hydrogen chloride is produced by combining chlorine and hydrogen:
- Cl2 + H2 → 2 HCl
As the reaction is exothermic, the installation is called an HCl oven or HCl burner. The resulting hydrogen chloride gas is absorbed in deionized water, resulting in chemically pure hydrochloric acid. This reaction can give a very pure product, e.g. for use in the food industry.
Industrial market[edit]
Hydrochloric acid is produced in solutions up to 38% HCl (concentrated grade). Higher concentrations up to just over 40% are chemically possible, but the evaporation rate is then so high that storage and handling require extra precautions, such as pressurization and cooling. Bulk industrial-grade is therefore 30% to 35%, optimized to balance transport efficiency and product loss through evaporation. In the United States, solutions of between 20% and 32% are sold as muriatic acid. Solutions for household purposes in the US, mostly cleaning, are typically 10% to 12%, with strong recommendations to dilute before use. In the United Kingdom, where it is sold as «Spirits of Salt» for domestic cleaning, the potency is the same as the US industrial grade.[23] In other countries, such as Italy, hydrochloric acid for domestic or industrial cleaning is sold as «Acido Muriatico», and its concentration ranges from 5% to 32%.
Major producers worldwide include Dow Chemical at 2 million tonnes annually (Mt/year), calculated as HCl gas, Georgia Gulf Corporation, Tosoh Corporation, Akzo Nobel, and Tessenderlo at 0.5 to 1.5 Mt/year each. Total world production, for comparison purposes expressed as HCl, is estimated at 20 Mt/year, with 3 Mt/year from direct synthesis, and the rest as secondary product from organic and similar syntheses. By far, most hydrochloric acid is consumed captively by the producer. The open world market size is estimated at 5 Mt/year.[23]
Applications[edit]
Hydrochloric acid is a strong inorganic acid that is used in many industrial processes such as refining metal. The application often determines the required product quality.[23] Hydrogen chloride, not hydrochloric acid, is used more widely in industrial organic chemistry, e.g. for vinyl chloride and dichloroethane.[8]
Pickling of steel[edit]
One of the most important applications of hydrochloric acid is in the pickling of steel, to remove rust or iron oxide scale from iron or steel before subsequent processing, such as extrusion, rolling, galvanizing, and other techniques.[23][7] Technical quality HCl at typically 18% concentration is the most commonly used pickling agent for the pickling of carbon steel grades.
- Fe3O4 + Fe + 8 HCl → 4 FeCl2 + 4 H2O
The spent acid has long been reused as iron(II) chloride (also known as ferrous chloride) solutions, but high heavy-metal levels in the pickling liquor have decreased this practice.
The steel pickling industry has developed hydrochloric acid regeneration processes, such as the spray roaster or the fluidized bed HCl regeneration process, which allow the recovery of HCl from spent pickling liquor. The most common regeneration process is the pyrohydrolysis process, applying the following formula:[23]
- 4 FeCl2 + 4 H2O + O2 → 8 HCl + 2 Fe2O3
By recuperation of the spent acid, a closed acid loop is established.[7] The iron(III) oxide by-product of the regeneration process is valuable, used in a variety of secondary industries.[23]
Production of inorganic compounds[edit]
Akin to its use for pickling, hydrochloric acid is used to dissolve many metals, metal oxides and metal carbonates. The conversion are often depicted in simplified equations:
- Zn + 2 HCl → ZnCl2 + H2
- NiO + 2 HCl → NiCl2 + H2O
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
These processes are used to produce metal chlorides for analysis or further production.[29][30][7]
pH control and neutralization[edit]
Hydrochloric acid can be used to regulate the acidity (pH) of solutions.
- HO− + HCl → H2O + Cl−
In industry demanding purity (food, pharmaceutical, drinking water), high-quality hydrochloric acid is used to control the pH of process water streams. In less-demanding industry, technical quality hydrochloric acid suffices for neutralizing waste streams and swimming pool pH control.[7]
Regeneration of ion exchangers[edit]
High-quality hydrochloric acid is used in the regeneration of ion exchange resins. Cation exchange is widely used to remove ions such as Na+ and Ca2+ from aqueous solutions, producing demineralized water. The acid is used to rinse the cations from the resins.[23] Na+ is replaced with H+ and Ca2+ with 2 H+.
Ion exchangers and demineralized water are used in all chemical industries, drinking water production, and many food industries.[23]
Laboratory use[edit]
Of the common strong mineral acids in chemistry, hydrochloric acid is the monoprotic acid least likely to undergo an interfering oxidation-reduction reaction. It is one of the least hazardous strong acids to handle; despite its acidity, it contains the non-reactive and non-toxic chloride ion. Intermediate-strength hydrochloric acid solutions are quite stable upon storage, maintaining their concentrations over time. These attributes, plus the fact that it is available as a pure reagent, make hydrochloric acid an excellent acidifying reagent. It is also inexpensive.
Hydrochloric acid is the preferred acid in titration for determining the amount of bases. Strong acid titrants give more precise results due to a more distinct endpoint. Azeotropic, or «constant-boiling», hydrochloric acid (roughly 20.2%) can be used as a primary standard in quantitative analysis, although its exact concentration depends on the atmospheric pressure when it is prepared.[32]
Other[edit]
Hydrochloric acid is used for a large number of small-scale applications, such as leather processing, household cleaning,[33] and building construction.[7] Oil production may be stimulated by injecting hydrochloric acid into the rock formation of an oil well, dissolving a portion of the rock, and creating a large-pore structure. Oil well acidizing is a common process in the North Sea oil production industry.[23]
Hydrochloric acid has been used for dissolving calcium carbonate, e.g. such things as de-scaling kettles and for cleaning mortar off brickwork. When used on brickwork the reaction with the mortar only continues until the acid has all been converted, producing calcium chloride, carbon dioxide, and water:
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Many chemical reactions involving hydrochloric acid are applied in the production of food, food ingredients, and food additives. Typical products include aspartame, fructose, citric acid, lysine, hydrolyzed vegetable protein as food enhancer, and in gelatin production. Food-grade (extra-pure) hydrochloric acid can be applied when needed for the final product.[23][7]
Presence in living organisms[edit]
Diagram of alkaline mucous layer in stomach with mucosal defense mechanisms
Gastric acid is one of the main secretions of the stomach. It consists mainly of hydrochloric acid and acidifies the stomach content to a pH of 1 to 2.[34][35] Chloride (Cl−) and hydrogen (H+) ions are secreted separately in the stomach fundus region at the top of the stomach by parietal cells of the gastric mucosa into a secretory network called canaliculi before it enters the stomach lumen.[36]
Gastric acid acts as a barrier against microorganisms to prevent infections and is important for the digestion of food. Its low pH denatures proteins and thereby makes them susceptible to degradation by digestive enzymes such as pepsin. The low pH also activates the enzyme precursor pepsinogen into the active enzyme pepsin by self-cleavage. After leaving the stomach, the hydrochloric acid of the chyme is neutralized in the duodenum by bicarbonate.[34]
The stomach itself is protected from the strong acid by the secretion of a thick mucus layer, and by secretin induced buffering with sodium bicarbonate. Heartburn or peptic ulcers can develop when these mechanisms fail. Drugs of the antihistaminic and proton pump inhibitor classes can inhibit the production of acid in the stomach, and antacids are used to neutralize excessive existing acid.[34][37]
Safety[edit]



Being a strong acid, hydrochloric acid is corrosive to living tissue and to many materials, but not to rubber. Typically, rubber protective gloves and related protective gear are used when handling concentrated solutions.[8]
| Mass fraction |
Classification[38] | List of H-phrases |
|---|---|---|
| 10% ≤ C < 25% | Causes skin irritation, Causes serious eye irritation, | H315, H319 |
| C ≥ 10% | May cause respiratory irritation | H335 |
| C ≥ 25% | Causes severe skin burns and eye damage | H314 |
Legal status[edit]
Hydrochloric acid has been listed as a Table II precursor under the 1988 United Nations Convention Against Illicit Traffic in Narcotic Drugs and Psychotropic Substances because of its use in the production of heroin, cocaine, and methamphetamine.[39][40]
See also[edit]
- Chloride, inorganic salts of hydrochloric acid
- Hydrochloride, organic salts of hydrochloric acid
- Aqua regia
References[edit]
- ^ a b «Hydrochloric Acid». Archived from the original on 15 October 2010. Retrieved 16 September 2010.
- ^ «spirits of salt». Retrieved 29 May 2012.
- ^ Favre HA, Powell WH, eds. (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Cambridge: The Royal Society of Chemistry. p. 131.
- ^ «Hydrochloric acid». www.chemsrc.com.
- ^ a b Trummal A, Lipping L, Kaljurand I, Koppel IA, Leito I (May 2016). «Acidity of Strong Acids in Water and Dimethyl Sulfoxide». The Journal of Physical Chemistry A. 120 (20): 3663–9. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918. S2CID 29697201.
- ^ a b c Sigma-Aldrich Co., Hydrochloric acid.
- ^ a b c d e f g h Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 946–48. ISBN 978-0-08-037941-8.
- ^ a b c Austin, Severin; Glowacki, Arndt (2000). Hydrochloric Acid. doi:10.1002/14356007.a13_283. ISBN 3527306730.
- ^ Multhauf 1966, pp. 141–142.
- ^ Stapleton, Henry E.; Azo, R.F.; Hidayat Husain, M. (1927). «Chemistry in Iraq and Persia in the Tenth Century A.D.» Memoirs of the Asiatic Society of Bengal. VIII (6): 317–418. OCLC 706947607. p. 333.
- ^ Stapleton, Azo & Hidayat Husain 1927, p. 333 (for a glossary of the terms used in this recipe, see p. 322). German translation of the same passage in Ruska, Julius (1937). Al-Rāzī’s Buch Geheimnis der Geheimnisse. Mit Einleitung und Erläuterungen in deutscher Übersetzung. Quellen und Studien zur Geschichte der Naturwissenschaften und der Medizin. Vol. VI. Berlin: Springer. p. 182, §5. An English translation of Ruska 1937’s translation can be found in Taylor, Gail Marlow (2015). The Alchemy of Al-Razi: A Translation of the «Book of Secrets». CreateSpace Independent Publishing Platform. ISBN 9781507778791. pp. 139–140.
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. OCLC 977570829. pp. 141–142.
- ^ Multhauf 1966, p. 142. Multhauf refers to a number of recipes from the Kitāb al-Asrār translated by Ruska 1937, pp. 103–110, but does not seem to have noted the existence of the recipe in Ruska 1937, p. 182, §5 quoted above.
- ^ Multhauf 1966, pp. 160–162.
- ^ Multhauf 1966, pp. 162–163.
- ^ Karpenko, Vladimír; Norris, John A. (2002). «Vitriol in the History of Chemistry». Chemické listy. 96 (12): 997–1005. p. 1002.
- ^ Multhauf 1966, p. 204.
- ^ Multhauf 1966, p. 208, note 29; cf. p. 142, note 79.
- ^ Newman, William R. (2006). Atoms and Alchemy: Chymistry and the Experimental Origins of the Scientific Revolution. Chicago: University of Chicago Press. ISBN 978-0226576961. p. 98.
- ^ «Muriatic Acid» (PDF). PPG Industries. 2005. Archived from the original (PDF) on 2 July 2015. Retrieved 10 September 2010.
- ^ Gay-Lussac (1814) «Mémoire sur l’iode» (Memoir on iodine), Annales de Chemie, 91 : 5–160. From page 9: » … mais pour les distinguer, je propose d’ajouter au mot spécifique de l’acide que l’on considère, le mot générique de hydro; de sorte que le combinaisons acide de hydrogène avec le chlore, l’iode, et le soufre porteraient le nom d’acide hydrochlorique, d’acide hydroiodique, et d’acide hydrosulfurique; … « (… but in order to distinguish them, I propose to add to the specific suffix of the acid being considered, the general prefix hydro, so that the acidic combinations of hydrogen with chlorine, iodine, and sulfur will bear the name hydrochloric acid, hydroiodic acid, and hydrosulfuric acid; …)
- ^ Ronalds BF (2019). «Bonnington Chemical Works (1822-1878): Pioneer Coal Tar Company». International Journal for the History of Engineering & Technology. 89 (1–2): 73–91. doi:10.1080/17581206.2020.1787807. S2CID 221115202.
- ^ a b c d e f g h i j k l «Hydrochloric Acid». Chemicals Economics Handbook. SRI International. 2001. pp. 733.4000A–733.3003F.
- ^ a b Aftalion F (1991). A History of the International Chemical Industry. Philadelphia: University of Pennsylvania Press. ISBN 978-0-8122-1297-6.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General chemistry: principles and modern applications. Prentice Hall. pp. 668–669. ISBN 978-0-13-014329-7.
- ^ Agmon N (January 1998). «Structure of Concentrated HCl Solutions». The Journal of Physical Chemistry A. 102 (1): 192–199. Bibcode:1998JPCA..102..192A. CiteSeerX 10.1.1.78.3695. doi:10.1021/jp970836x. ISSN 1089-5639.
- ^ «Systemnummer 6 Chlor». Gmelins Handbuch der Anorganischen Chemie. Chemie Berlin. 1927.
- ^ «Systemnummer 6 Chlor, Ergänzungsband Teil B – Lieferung 1». Gmelins Handbuch der Anorganischen Chemie. Chemie Weinheim. 1968.
- ^ a b c Lide D (2000). CRC Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 978-0-8493-0481-1.
- ^ a b c Perry R, Green D, Maloney J (1984). Perry’s Chemical Engineers’ Handbook (6th ed.). McGraw-Hill Book Company. ISBN 978-0-07-049479-4.
- ^ a b Aspen Properties. binary mixtures modeling software (calculations by Akzo Nobel Engineering ed.). Aspen Technology. 2002–2003.
- ^ Mendham J, Denney RC, Barnes JD, Thomas MJ, Denney RC, Thomas MJ (2000). Vogel’s Quantitative Chemical Analysis (6th ed.). New York: Prentice Hall. ISBN 978-0-582-22628-9.
- ^ Simhon R (13 September 2003). «Household plc: really filthy bathroom». The Daily Telegraph. London. Archived from the original on 23 February 2009. Retrieved 31 March 2010.
- ^ a b c Maton A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ Haas E (6 December 2000). «Digestive Aids: Hydrochloric acid». healthy.net.
- ^ Arthur C, Guyton MD, Hall JE (2000). Textbook of Medical Physiology (10th ed.). W.B. Saunders Company. ISBN 978-0-7216-8677-6.
- ^ Bowen R (18 March 2003). «Control and Physiologic Effects of Secretin». Colorado State University. Retrieved 16 March 2009.
- ^ «Regulation (EC) No 1272/2008 of the European Parliament and of Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006». EUR-lex. Retrieved 16 December 2008.
- ^ List of precursors and chemicals frequently used in the illicit manufacture of narcotic drugs and psychotropic substances under international control (PDF) (Eleventh ed.). International Narcotics Control Board. January 2007. Archived from the original (PDF) on 2008-02-27.
- ^ Chemicals Required for the Illicit Manufacture of Drugs (PDF) (Report). UNDOC. 1998. Retrieved July 20, 2022.
External links[edit]
This audio file was created from a revision of this article dated 23 April 2005, and does not reflect subsequent edits.
- NIST WebBook, general link
- Hydrochloric Acid – Part One and Hydrochloric Acid – Part Two at The Periodic Table of Videos (University of Nottingham)
- Calculators: surface tensions, and densities, molarities and molalities of aqueous HCl
- General safety information
- EPA Hazard Summary
- Hydrochloric acid MSDS by Georgia Institute of Technology
- NIOSH Pocket Guide to Chemical Hazards
- Pollution information
- National Pollutant Inventory – Hydrochloric Acid Fact Sheet
Морфемный разбор слова:
Однокоренные слова к слову:
Соляная Кислота
Химическое название
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует хлорид натрия и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. Карбонат кальция и карбонат натрия будут образовывать после реакции с HCl хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца, перманганатом калия: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O. Вещество реагирует с аммиаком, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца: MnO2+4HCl=Cl2+MnO2+2H2O (реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра выпадает белый осадок хлорида серебра и образуется азотная к-та. Уравнение реакции взаимодействия метиламина с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl.
Вещество реагирует со слабым основанием анилином. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин (хлорид фениламмония): (С6Н5NH3)Cl. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3. Уравнение реакции карбоната калия с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде. Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота). При производстве данного химического соединения применяют ГОСТ 3118 77 – на реактивы и ГОСТ 857 95 – для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия или магния. Во время реакции могут образоваться оксихлориды переменного состава. Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду. Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия и прочими окислителями, то образуется токсичный газ — хлор. На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Фармакологическое действие
Повышает кислотность желудочного сока.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые витамины и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН. Активирует пепсиноген, переводит его в активный фермент пепсин. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, изжога и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Показания к применению
Вещество входит в состав синтетических моющих средств, концентрата для полоскания ротовой полости ухода за контактными линзами. Разбавленная Соляная Кислота назначается при заболеваниях желудка, сопровождающихся пониженной кислотностью, при гипохромной анемии в сочетании с препаратами железа.
Противопоказания
Лекарство нельзя применять при аллергии на синтетическое вещество, при болезнях пищеварительного тракта, ассоциированных с повышенной кислотностью, при остром гастрите.
Побочные действия
Концентрированная Соляная Кислота при попадании на кожу, в глаза и дыхательные пути может вызывать сильные ожоги. В составе различных лек. препаратов используют разбавленное вещество, при длительном применении больших дозировок может возникнуть ацидоз, ухудшение состояния эмали зубов.
Инструкция по применению (Способ и дозировка)
Хлороводородную кислоту применяют в соответствии с инструкцией.
Внутрь лекарство назначают, предварительно растворив в воде. Обычно используют 10-15 капель препарата на пол стакана жидкости. Лекарство принимают во время еды, 2-4 раза в день. Максимальная разовая дозировка составляет 2 мл (около 40 капель). Суточная доза – 6 мл (120 капель).
Передозировка
Случаи передозировки не описаны. При бесконтрольном приеме вещества внутрь в больших количествах возникают язвы и эрозии в пищеварительном тракте. Следует обратиться за помощью к врачу.
Взаимодействие
Вещество часто используют в комбинации с пепсином и прочими лек. препаратами. Химическое соединение в пищеварительном тракте вступает во взаимодействие с основаниями и некоторыми веществами (см. химические свойства).
Особые указания
При лечении препаратами Соляной Кислоты необходимо четко придерживаться рекомендаций в инструкции.
Источник
Описание соляной кислоты: формула, свойства и применение
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
Специфические свойства соляной кислоты:
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
Источник
Хлороводородная кислота
Соля́на́я (хлороводоро́дная, хлористоводоро́дная, — хлори́дная) кислота́, хлористый водород — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
Конц. (вес)
c : кг HCl/кг
Конц. (г/л)
c : кг HCl/м³
Плотность
ρ : кг/л
Молярность
M
Вязкость
η : мПа·с
Удельная
теплоемкость
s : кДж/(кг·К)
Давление
пара
PHCl : Па
Т
кипения
т.кип.
Т
плавления
т.пл.
Соляная кислота
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре. В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии крепкой серной кислоты на поваренную соль:
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
Хлороводород прекрасно растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
Медицина
Особенности обращения
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Источник
ХЛОРОВОДОРОДНАЯ КИСЛОТА
Смотреть что такое «ХЛОРОВОДОРОДНАЯ КИСЛОТА» в других словарях:
Хлороводородная кислота — (хлористоводородная кислота) то же, что соляная кислота … Российская энциклопедия по охране труда
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что (см.) … Большая политехническая энциклопедия
Хлороводородная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
хлороводородная кислота — то же, что соляная кислота … Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота), р р хлороводорода в воде; сильная кислота. Бесцв., дымящая на воздухе жидкость (техн. С. к. желтоватая из за примесей Fe, Сl2 и др.). макс. концентрация (при 20 °С) 38% по массе, плотность такого р ра 1,19 г/см3.… … Естествознание. Энциклопедический словарь
соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
СОЛЯНАЯ КИСЛОТА — (хлористоводородная к та, хлороводородная к та), р р НС1 в воде бесцв. жидкость с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол. м. 36,461 ) бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина связи HЧС1 … Химическая энциклопедия
Источник
хлороводородная кислота
Смотреть что такое «хлороводородная кислота» в других словарях:
Хлороводородная кислота — (хлористоводородная кислота) то же, что соляная кислота … Российская энциклопедия по охране труда
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что (см.) … Большая политехническая энциклопедия
Хлороводородная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что соляная кислота … Естествознание. Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота), р р хлороводорода в воде; сильная кислота. Бесцв., дымящая на воздухе жидкость (техн. С. к. желтоватая из за примесей Fe, Сl2 и др.). макс. концентрация (при 20 °С) 38% по массе, плотность такого р ра 1,19 г/см3.… … Естествознание. Энциклопедический словарь
соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
СОЛЯНАЯ КИСЛОТА — (хлористоводородная к та, хлороводородная к та), р р НС1 в воде бесцв. жидкость с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол. м. 36,461 ) бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина связи HЧС1 … Химическая энциклопедия
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется хлороводородная кислота, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется хлороводородная кислота», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Хлороводородная кислота
- Хлороводородная кислота
-
Модель молекулы соляной кислоты
Соля́ная (или соляна́я) кислота (хлористоводоро́дная кислота) (Hydrochloric acid) — HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.). Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см3. Слабые растворы соляной кислоты (до 0,4 %) имеют специфический терпко-кислый вкус, более концентрированные вызывают ожоги полости рта. Соли соляной кислоты называются хлоридами.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Производство
- 4 Применение
- 4.1 Промышленность
- 4.2 Медицина
- 5 Особенности обращения
- 6 Ссылки
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
Конц. (вес)
c : кг HCl/кгКонц. (г/л)
c : кг HCl/м³Плотность
ρ : кг/лМолярность
MpH Вязкость
η : мПа·сУдельная
теплоемкость
s : кДж/(кг·К)Давление
пара
PHCl : ПаТ
кипения
т.кип.Т
плавления
т.пл.10 % 104,80 1,048 2,87 M −0,5 1,16 3,47 0,527 103 °C −18 °C 20 % 219,60 1,098 6,02 M −0,8 1,37 2,99 27,3 108 °C −59 °C 30 % 344,70 1,149 9,45 M −1,0 1,70 2,60 1,410 90 °C −52 °C 32 % 370,88 1,159 10,17 M −1,0 1,80 2,55 3,130 84 °C −43 °C 34 % 397,46 1,169 10,90 M −1,0 1,90 2,50 6,733 71 °C −36 °C 36 % 424,44 1,179 11,64 M −1,1 1,99 2,46 14,100 61 °C −30 °C 38 % 451,82 1,189 12,39 M −1,1 2,10 2,43 28,000 48 °C −26 °C При 20 °C, 1 атм (101 kPa)
При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
Производство
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород может быть получен путём взаимодействия концентрированной серной кислоты на хлорид натрия, или сжиганием водорода в атмосфере хлора.
Применение
Промышленность
- Применяют в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована в качестве регулятора кислотности, пищевой добавки E507. Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Составная часть желудочного сока; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Особенности обращения
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Ссылки
- «Соляная кислота» на www.xumuk.ru
- Е-507. Соляная кислота, как пищевая добавка
- Соляная кислота — Применение в производстве.
Основные хлорсодержащие неорганические кислоты Хлороводород(HCl)
Хлорноватистая кислота (HClO)
Хлористая кислота (HClO2)
Хлорноватая кислота (HClO3)
Хлорная кислота (HClO4)
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Хлороводородная кислота» в других словарях:
-
Хлороводородная кислота — (хлористоводородная кислота) то же, что соляная кислота … Российская энциклопедия по охране труда
-
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что (см.) … Большая политехническая энциклопедия
-
хлороводородная кислота — то же, что соляная кислота … Энциклопедический словарь
-
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что соляная кислота … Естествознание. Энциклопедический словарь
-
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота), р р хлороводорода в воде; сильная кислота. Бесцв., дымящая на воздухе жидкость (техн. С. к. желтоватая из за примесей Fe, Сl2 и др.). макс. концентрация (при 20 °С) 38% по массе, плотность такого р ра 1,19 г/см3.… … Естествознание. Энциклопедический словарь
-
соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
-
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
-
Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
-
СОЛЯНАЯ КИСЛОТА — (хлористоводородная к та, хлороводородная к та), р р НС1 в воде бесцв. жидкость с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол. м. 36,461 ) бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина связи HЧС1 … Химическая энциклопедия
-
Список кислот и ангидридов — … Википедия
Раствор хлорводорода в воде, который является бесцветной прозрачной жидкостью.
Из-за присутствия единственного элемента (односоставной примеси) в воде считается едкой в силу своих химических свойств. При соприкосновении с воздухом исходит «дымок».
Формула
HCl
Техническая кислота (Cl – H) имеет такую же формулу, но отличается по цвету – из-за примесей железа и хлора отдает желтоватым оттенком. Концентрация раствора зависит от температурного режима хранения, и при 20 градусах она составляет 38% с плотностью 1,18 г/см3. Соль раствора называется хлоридом.
Альтернативные названия
Хлористоводородная кислота или хлористый водород.
Получение соляной кислоты
Соляную кислоту получают путём растворения газообразного хлороводорода в воде. Его сжигают в хлоре, в результате чего на выходе имеется синтетическая кислота. Также получение возможно из побочных газов при хлорировании углеводорода. В первом случае она будет иметь меньше примесей, а второй необходим в промышленности, когда спрос на абгазную кислоту увеличивается.
В лабораторных условиях используют серную кислоту и поваренную соль:
- При температуре в 550 градусов и выше поваренная соль дает избыток.
- При проведении гидролиза магния и алюминия хлоридов (нагревание гидратированной соли).
- При получении оксихлоридов, когда происходит неполное растворение солей (реакция не завершается).
Чем выше температура окружающей среды, тем ниже способность к растворению. Поэтому на практике используют 36%-ую кислоту, хотя при 0-1 градусе кислород поглотит больше половины примесей, что равно 45%-ой кислоте.
Свойства соляной кислоты
Физические свойства
Физические свойства кислоты зависят от степени концентрации растворенного хлороводорода. При повышении наблюдается:
• Увеличение плотности раствора;
• Увеличение молярности;
• Снижение водородного показателя (pH);
• Увеличение вязкости вещества;
• Снижение удельной теплоёмкости;
• Увеличение давления пара;
• Снижение температуры кипения;
• Вариации температуры плавления.
Последние меняются так: при минимальной и максимальной концентрации плавление достигает максимальных показателей. Средняя концентрация поддаётся плавлению в минимальных температурах. Затвердевшее вещество даёт кристаллогидраты – HCl·H2O, HCl·6H2O, HCl·3H2O, HCl·2H2O.
Химические свойства
- Взаимодействует с металлами (Ме) электрохимических потенциалов:
Mg+2HCl = MgCl2+H2.
Образуется соль с выделением водорода.
- Взаимодействует с оксидами Ме:
Na2O+2HCl = 2NaCl+H2O
с образованием соли и воды.
- Реакция нейтрализации с гидроксидами Ме:
NaOH+HCl = NaCl+H2O
с образованием растворимой соли и воды.
Также вступает в реакцию с солями Ме, окислителями с выделением хлорного газа и аммиаком с выделением густого белого дыма из кристаллов аммония хлорида.
Применение соляной кислоты
Применение широко распространено в сферах гидрометаллургии и гальванопластике. Проводится очистка поверхностей металлов при помощи кислот; для получения цинковых хлоридов. Иногда техническая соляная кислота необходима для чистки керамики и металлических изделий. Для этого берётся ингибированная кислота, предназначенная специально для дезинфекций.
В пищевой промышленности она необходима для урегулирования кислотности продуктов. Зарегистрировано вещество под кодом пищевой добавки Е507. Чаще всего используется при изготовлении зельтерской воды (содовая).
В фармацевтической промышленности соляная кислота нужна для изготовления лекарственных препаратов, предназначенных для смеси с ферментами пепсинов. При недостатке естественной кислоты в желудочном соке в концентрации 0,5% назначается приемом внутрь.
Тест по теме «Соляная кислота»
Модель молекулы соляной кислоты
Соляная кислота (также хлороводородная кислота, химическая формула — HCl) — химическое соединение водорода и хлора, растворённое в воде; сильная неорганическая кислота.
Описание
Стеклянная ёмкость с концентрированной соляной кислотой
Физические свойства
Соляная кислота — бесцветная жидкость с резким запахом, представляющая из себя раствор хлороводорода в воде различных концентраций — при температуре 20 °C массовое содержание HCl в растворе может доходить до 42,02 %; при этом растворение хлороводорода в воде — сильно экзотермический процесс. В водном растворе хлороводород полностью ионизируется, что обуславливает химические свойства кислоты[1][2][3]. Сам хлороводород может выделяться из раствора при нормальных условиях в газообразном виде[4][5], при этом вещество «дымит», так как выделяющийся хлороводород образует с водяным паром, содержащимся в атмосфере туман из соляной кислоты[6].
Многие физические свойства, такие как температура кипения, плотность, теплоёмкость и температура кристаллизации зависят от концентрации хлороводорода в растворе[6].
Химические свойства
Соляная кислота обладает высокой химической активностью: она растворяет с выделением водорода все металлы, обладающие отрицательным электродным потенциалом (то есть стоящие в ряду активности до водорода), при этом образуются хлориды этих металлов. Также кислота может образовывать хлориды, выделяя свободные кислоты из солей более слабых кислот: силикатов, фосфатов, карбонатов, боратов и других. При взаимодействии кислоты с сильными окислителями выделяется газообразный хлор[1]. Газообразный хлороводород проявляет аналогичные химические свойства, но только в присутствии атмосферной или какой-либо другой влаги. Полностью сухой хлороводород имеет весьма низкую химическую активность[4].
Соли соляной кислоты — хлориды — за редким исключением хорошо растворимы в воде[6].
История
Достоверно неизвестно кто и когда впервые получил соляную кислоту. Самый ранний из известных случаев обнаружения соединения относится к концу XV века — в записях алхимика Василия Валентина имеются упоминания его опытов с поваренной солью: он прокаливал её с квасцами и получил в результате грязную, но соляную кислоту, которую назвал «кислым спиртом». Следующим в конце XVI века «кислый спирт» таким же методом получил Андреас Либавий. Первый промышленный способ получения соляной кислоты представил в 1658 году Иоганн Глаубер, предложивший прокаливать поваренную соль в присутствии серной кислоты, а выделявшиеся хлороводородные пары улавливать водой. Результат Глаубер назвал «соляным спиртом». Этот способ хоть и не позволяет получать кислоту в промышленных масштабах, используется в лабораториях и в XXI веке[7].
В 1772 году Джозеф Пристли повторил получение соляной кислоты по методу Глаубера и подробно описал её химические и физические свойства. Двумя годами позже Карл Шееле проводя опыты с соляной кислотой открыл реакцию её окисления до хлористой кислоты, но ввиду господствовавшей тогда теории флогистона назвал её «дефлогистированным соляным спиртом». Реальное значение его открытия было объяснено позже Гэмфри Дэви, который в 1790 году получил соляную кислоту взаимодействием чистых водорода и хлора, открыв, таким образом, её химический состав[7]. Дальнейшее развитие метод получил при открытии им же получения хлора путём электролиза раствора поваренной соли[8].
В XXI веке соляную кислоту для химических реакций получают из хлороводорода, производимого взаимодействием водорода и хлора в графитовых печах с последующей адсорбцией дистиллированной водой. Также практикуется получение технической соляной кислоты из газообразных отходов химического производства (хлорирования, дегидрохлорирования, пиролиза хлорсодержащих соединений и т.п.), но такая соляная кислота имеет примеси[1][5][9].
Применение
Соляную кислоту применяют для получения хлоридов различных металлов, травления металлических поверхностей для гальванопластики, обработки металлических руд. Также её используют для очистки стеклянных сосудов, нефтяных и газовых скважин от карбонатных осадков. Применяется кислота и для производства органических химических соединений (например, уксусной кислоты), активированного угля, а также хлорорганических соединений[1][4][5][6][10].
В силу своей высокой активности соляная кислота используется в составе некоторых бытовых моющих средств: в первую очередь в средствах для чистки сантехники[10].
Соляная кислота содержится в желудочном соке млекопитающих, в том чиле человека, что обусловило её применение в медицине при недостаточной кислотности желудочного сока[1][4][6][9][10].
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 БРЭ, 2015.
- ↑ ЭСБЕ, 1903.
- ↑ Hydrochloric acid (англ.). Britannica (22 сентября 2022). Дата обращения: 19 февраля 2023.
- ↑ 4,0 4,1 4,2 4,3 Hydrogen chloride (англ.). Britannica (11 февраля 2023). Дата обращения: 19 февраля 2023.
- ↑ 5,0 5,1 5,2 Кислота соляная — производство и применение. Max Petroleum Services (25 октября 2018). Дата обращения: 19 февраля 2023.
- ↑ 6,0 6,1 6,2 6,3 6,4 Соляная кислота: влияние на экологию и здоровье человека. Справка. РИА Новости (11 февраля 2010). Дата обращения: 19 февраля 2023.
- ↑ 7,0 7,1 Кошель П. А. Открытие соляной кислоты и хлора // Химия : журнал. — М., 2005. — № 14.
- ↑ Austin, Glowacki, 2000, p. 191.
- ↑ 9,0 9,1 Соляная кислота. Интерхимзащита (7 декабря 2018). Дата обращения: 19 февраля 2023.
- ↑ 10,0 10,1 10,2 О соляной кислоте. Нижегородхим. Дата обращения: 19 февраля 2023.
Литература
- Вуколов С. П., Δ. Хлористоводородная кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1903. — Т. XXXVII.
- Austin S., Glowacki A. Hydrochloric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a13_283.
- Соляная кислота / Ю. А. Трегер // Сен-Жерменский мир 1679 — Социальное обеспечение. — М. : Большая российская энциклопедия, 2015. — С. 681—682. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 30). — ISBN 978-5-85270-367-5.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело!








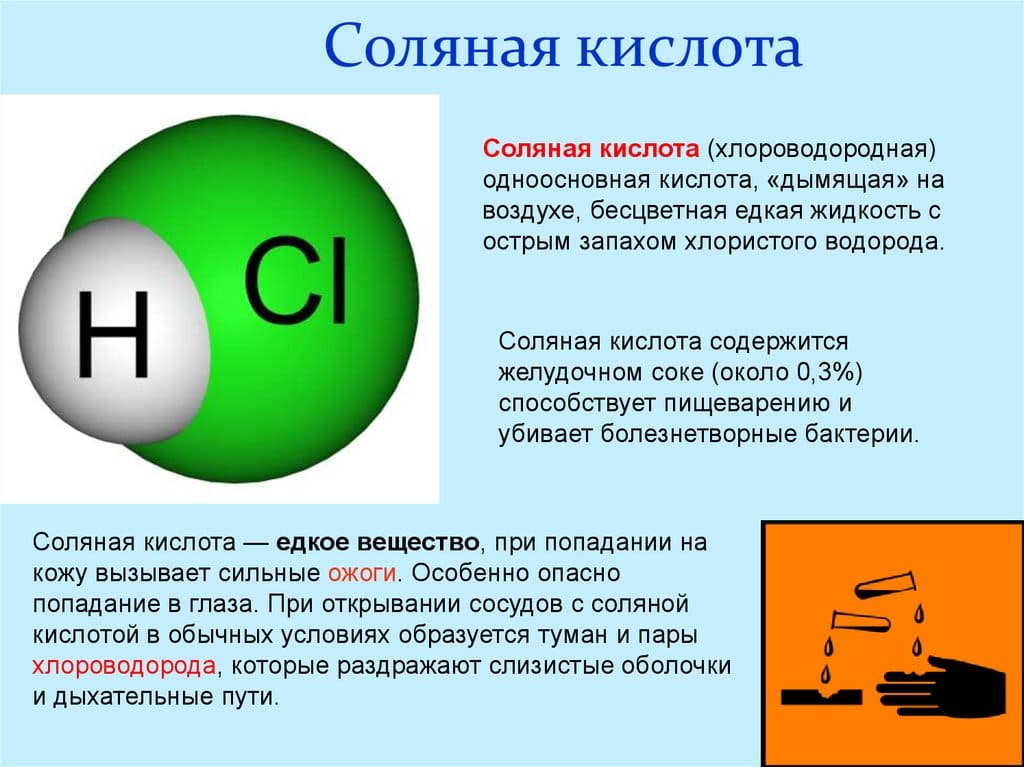
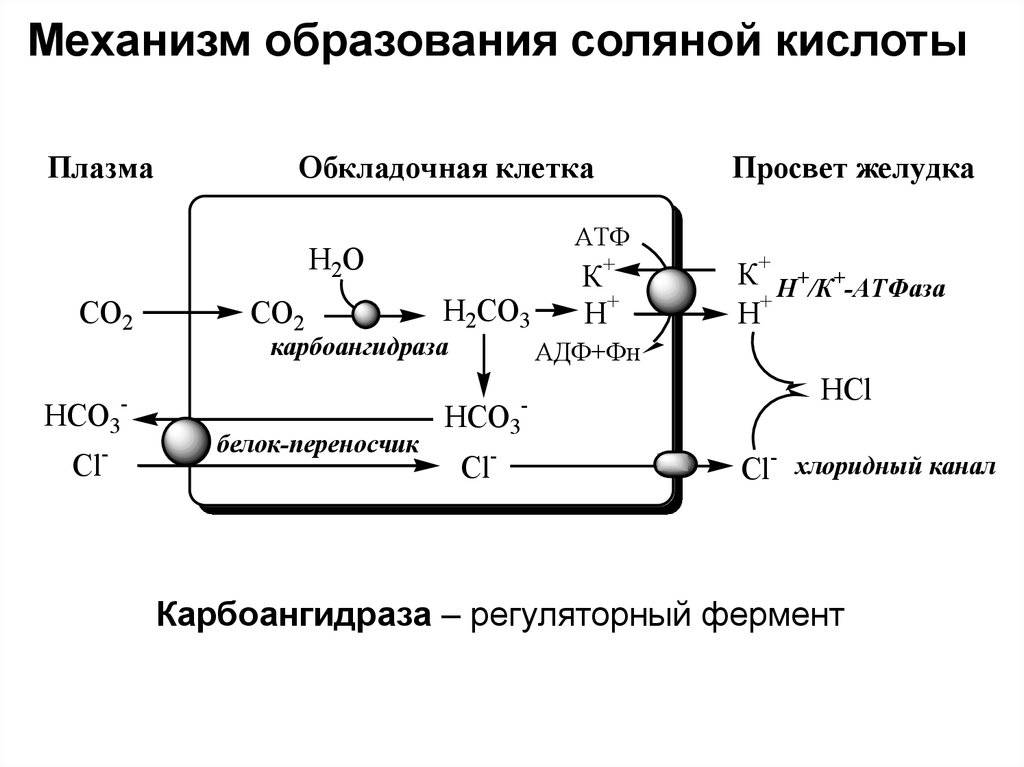

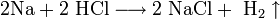
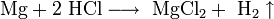
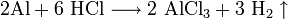
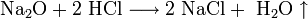
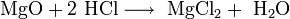
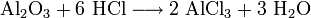
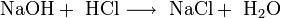
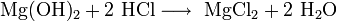
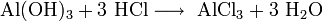
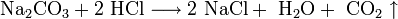
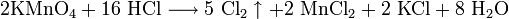

 Хлорная кислота (HClO4)
Хлорная кислота (HClO4)
