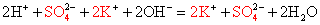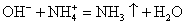Загрузить PDF
Загрузить PDF
Ионные уравнения являются неотъемлемой частью химии. В них представлены лишь те компоненты, которые изменяются в ходе химической реакции. Чаще всего ионные уравнения используют для описания окислительно-восстановительных реакций, реакций обмена и нейтрализации.[1]
Чтобы записать ионное уравнение, необходимо выполнить три основных шага: сбалансировать молекулярное уравнение химической реакции, перевести его в полное ионное уравнение (то есть записать компоненты в том виде, в каком они существуют в растворе) и, наконец, записать краткое ионное уравнение.
-
1
Поймите разницу между молекулярными и ионными соединениями. Для записи ионного уравнения первым делом следует определить участвующие в реакции ионные соединения. Ионными называют те вещества, которые в водных растворах диссоциируют (распадаются) на заряженные ионы.[2]
Молекулярные соединения не распадаются на ионы. Они состоят из двух неметаллических элементов, и иногда их называют ковалентными соединениями.[3]
- Ионные соединения могут возникать между металлом и неметаллом, металлом и многоатомными ионами, либо между несколькими многоатомными ионами.
- Если вы сомневаетесь, к какой группе принадлежит то или иное соединение, посмотрите на свойства составляющих его элементов в таблице Менделеева.[4]
-
2
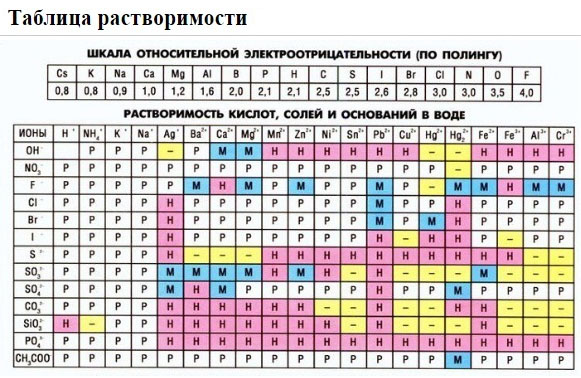
Определите растворимость соединения. Не все ионные соединения растворяются в водных растворах, то есть не все из них диссоциируют на отдельные ионы. Прежде чем приступить к записи уравнения, следует найти растворимость каждого соединения. Ниже приведены краткие правила растворимости. Более подробные сведения и исключения из правил можно найти в таблице растворимости.[5]
- Следуйте правилам в том порядке, в котором они приведены ниже:
- все соли Na+, K+ и NH4+ растворяются;
- все соли NO3—, C2H3O2—, ClO3— и ClO4— растворимы;
- все соли Ag+, Pb2+ и Hg22+ нерастворимы;
- все соли Cl—, Br— и I— растворяются;
- соли CO32-, O2-, S2-, OH—, PO43-, CrO42-, Cr2O72- и SO32- нерастворимы (за некоторыми исключениями);
- соли SO42- растворимы (за некоторыми исключениями).
-
3
Определите катион и анион соединения. Катионами называют положительно заряженные ионы (обычно это металлы). Анионы имеют отрицательный заряд, как правило это ионы неметаллов. Некоторые неметаллы могут образовывать не только анионы, но и катионы, в то время как атомы металлов всегда выступают в роли катионов.[6]
- Например, в соединении NaCl (поваренная соль) Na является положительно заряженным катионом, поскольку это металл, а Cl представляет собой отрицательно заряженный анион, так как это неметалл.
-
4
Определите участвующие в реакции многоатомные (сложные) ионы. Такие ионы представляют собой заряженные молекулы, между атомами которых существует такая сильная связь, что они не диссоциируют при химических реакциях.[7]
Необходимо выявить многоатомные ионы, поскольку они обладают своим зарядом и не распадаются на отдельные атомы. Многоатомные ионы могут иметь как положительный, так и отрицательный заряд.- При изучении общего курса химии вам, скорее всего, понадобится запомнить некоторые из наиболее распространенных многоатомных ионов.
- К наиболее распространенным многоатомным ионам относятся CO32-, NO3—, NO2—, SO42-, SO32-, ClO4— и ClO3—.[8]
- Существует множество других многоатомных ионов, которые можно найти в учебнике химии или интернете.[9]
Реклама
-
1
Сбалансируйте полное молекулярное уравнение. Прежде чем приступить к записи ионного уравнения, следует сбалансировать исходное молекулярное уравнение. Для этого необходимо расставить соответствующие коэффициенты перед соединениями, так чтобы число атомов каждого элемента в левой части равнялось их количеству в правой части уравнения.
- Запишите число атомов каждого элемента по обе стороны уравнения.
- Добавьте перед элементами (кроме кислорода и водорода) коэффициенты, так чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаковым.
- Сбалансируйте атомы водорода.
- Сбалансируйте атомы кислорода.
- Пересчитайте количество атомов каждого элемента по обе стороны уравнения и убедитесь, что оно одинаково.
- Например, после балансировки уравнения Cr + NiCl2 —> CrCl3 + Ni получаем 2Cr + 3NiCl2 —> 2CrCl3 + 3Ni.
-
2
Определите, в каком состоянии находится каждое вещество, которое участвует в реакции. Часто об этом можно судить по условию задачи. Есть определенные правила, которые помогают определить, в каком состоянии находится элемент или соединение.[10]
- Если в условии задачи не указано состояние того или иного элемента, используйте для его определения таблицу Менделеева.
- Если в условии сказано, что соединение находится в растворе, отметьте это (р-р).
- Если в уравнение входит вода, определите по таблице растворимости, диссоциирует ли данное ионное соединение.[11]
В случае высокой растворимости соединение диссоциирует в воде (р-р). Если соединение имеет низкую растворимость, оно останется в твердом виде (тв). - Если в реакции не участвует вода, ионное соединение останется в твердом виде (тв).
- Если в задаче фигурирует кислота или основание, они будут растворены в воде (р-р).
- В качестве примера рассмотрим реакцию 2Cr + 3NiCl2 —> 2CrCl3 + 3Ni. В чистом виде элементы Cr и Ni находятся в твердой фазе. NiCl2 и CrCl3 представляют собой растворимые ионные соединения, то есть они находятся в растворе. Таким образом, данное уравнение можно переписать в следующем виде: 2Cr(тв) + 3NiCl2(р-р) —> 2CrCl3(р-р) + 3Ni(тв).
-
3
Определите, какие соединения диссоциируют (разделяются на катионы и анионы) в растворе. При диссоциации соединение распадается на положительный (катион) и отрицательный (анион) компоненты. Эти компоненты затем войдут в ионное уравнение химической реакции.
- Не диссоциируют твердые тела, жидкости, газы, молекулярные соединения, ионные соединения с низкой растворимостью, многоатомные ионы и слабые кислоты.
- Полностью диссоциируют ионные соединения с высокой растворимостью (используйте таблицу растворимости) и сильные кислоты (HCl(р-р), HBr(р-р), HI(р-р), H2SO4(р-р), HClO4(р-р) и HNO3(р-р)).[12]
- Учтите, что хотя многоатомные ионы не диссоциируют, они могут входить в состав ионного соединения и отделиться от него в растворе.
-
4
Посчитайте заряд каждого диссоциировавшего иона. При этом помните, что металлы образуют положительно заряженные катионы, а атомы неметаллов превращаются в отрицательные анионы. Определите заряды элементов по таблице Менделеева. Необходимо также сбалансировать все заряды в нейтральных соединениях.
- В приведенном выше примере NiCl2 диссоциирует на Ni2+ и Cl—, а CrCl3 распадается на Cr3+ и Cl—.
- Ион никеля имеет заряд 2+, поскольку он соединен с двумя ионами хлора, каждый из которых имеет единичный отрицательный заряд. При этом один ион Ni должен сбалансировать два отрицательно заряженных иона Cl. Ион Cr имеет заряд 3+, так как он должен нейтрализовать три отрицательно заряженных иона Cl.
- Помните о том, что многоатомные ионы имеют свои собственные заряды.[13]
-
5
Перепишите уравнение так, чтобы все растворимые соединения были разделены на отдельные ионы. Все что диссоциирует или ионизируется (например, сильные кислоты) распадется на два отдельных иона. При этом вещество останется в растворенном состоянии (р-р). Проверьте, чтобы уравнение было сбалансировано.
- Твердые вещества, жидкости, газы, слабые кислоты и ионные соединения с низкой растворимостью не изменят своего состояния и не разделятся на ионы. Оставьте их в прежнем виде.
- Молекулярные соединения просто рассеются в растворе, и их состояние изменится на растворенное (р-р). Есть три молекулярных соединения, которые не перейдут в состояние (р-р), это CH4(г), C3H8(г) и C8H18(ж).
- Для рассматриваемой реакции полное ионное уравнение запишется в следующем виде: 2Cr(тв) + 3Ni2+(р-р) + 6Cl—(р-р) —> 2Cr3+(р-р) + 6Cl—(р-р) + 3Ni(тв). Если хлор не входит в состав соединения, он распадается на отдельные атомы, поэтому мы умножили количество ионов Cl на 6 с обеих сторон уравнения.
-
6
Сократите одинаковые ионы в левой и правой части уравнения. Можно вычеркнуть лишь те ионы, которые полностью идентичны с обеих сторон уравнения (имеют одинаковые заряды, нижние индексы и так далее). Перепишите уравнение без этих ионов.
- В нашем примере обе части уравнения содержат 6 ионов Cl—, которые можно вычеркнуть. Таким образом, получаем краткое ионное уравнение: 2Cr(тв) + 3Ni2+(р-р) —> 2Cr3+(р-р) + 3Ni(тв).
- Проверьте результат. Суммарные заряды левой и правой частей ионного уравнения должны быть равны.
Реклама
Советы
- Приучите себя всегда записывать агрегатное состояние всех компонентов во всех уравнениях химических реакций.
Реклама
Об этой статье
Эту страницу просматривали 66 303 раза.
Была ли эта статья полезной?
Статьи
Основное общее образование
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
06 июня 2019
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).

Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
Купить
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

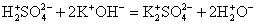
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.

АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
-
Записываем молекулярное уравнение химического процесса.
H2SO4 + KOH = K2SO4 + H2O
-
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
H2SO4 + 2KOH = K2SO4 + 2H2O
-
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
-
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
-
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
-
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
2H + 2OH = 2H2O
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
-
Записываем молекулярное уравнение, проверяем коэффициенты.
KOH + NH4Cl = KCl + NH4OH
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
KOH (p) + NH4Cl (p) = KCl (p) + NH3↑+ H2O
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
-
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
-
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
-
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Что происходит?
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
-
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
-
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
-
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
#ADVERTISING_INSERT#
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

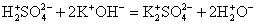
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Например, нитрат серебра взаимодействует с бромидом калия
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
Например, взаимодействие сульфида цинка и серной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
Например, взаимодействие гидрокарбоната натрия и гидроксида натрия
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
источники:
http://rosuchebnik.ru/material/ionnye-uravneniya/
http://chemege.ru/reakcii-ionnogo-obmena/
Ионные химические реакции
02-Фев-2014 | комментария 3 | Лолита Окольнова
Ионные реакции — реакции между ионами в растворе
Давайте разберем основные ионные химические реакции неорганической и некоторые реакции органической химии.
Очень часто в различных заданиях по химии просят написать не только химические уравнения в молекулярной форме, но и в ионной (полные и сокращенные). Как уже было замечено, ионные химические реакции идут в растворах. Зачастую, вещества распадаются на ионы именно в воде.
Полное ионное уравнение химической реакции: все соединения — электролиты, переписываем в ионном виде с учетом коэффициентов:
2NaOH + H2SO4 = Na2SO4 + 2H2O — молекулярное уравнение реакции
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O — полное ионное уравнение реакции
Сокращенное ионное уравнение химической реакции: сокращаем одинаковые составляющие:
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O
OH— + H+ = H2O — сокращенное ионное уравнение реакции
По результатам этого сокращения одинаковых ионов видно, какие ионы образовали то, что нерастворимо или малорастворимо — газообразные продукты или реагенты, осадки или малодиссоциирующие вещества.
Не раскладывают на ионы в ионных химических реакциях вещества:
1. нерастворимые в воде соединения (или малорастворимые) (см. ТАБЛИЦЫ);
Ca(NO3)2 + 2NaOH = Ca(OH)2↓ + 2NaNO3
Сa2+ + 2NO3— + 2Na+ +2OH— = Ca(OH)2 + 2Na+ +2NO3— — полное ионное уравнение реакции
Сa2+ + 2OH— = Ca(OH)2 — сокращенное ионное уравнение реакции
2. газообразные вещества, например, O2, Cl2, NO и т.д.:
Na2S + 2HCl = 2NaCl + H2S
2Na+ + S-2 + 2H+ +2Cl— = 2Na+ + 2Cl— + H2S — полное ионное уравнение реакции
S-2 + 2H+ = H2S — сокращенное ионное уравнение реакции
3. малодиссоциирующие вещества (H2O, NH4OH);
реакция нейтрализации
OH— + H+ = H2O — сокращенное ионное уравнение реакции
4. оксиды (все: и образованные металлами, и неметаллами);
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
2Ag+ + 2NO3— + 2Na+ + 2OH— = Ag2O + 2NO3— + 2Na+ + H2O — полное ионное уравнение реакции
2Ag+ + 2OH— = Ag2O + H2O — сокращенное ионное уравнение реакции
5. органические вещества (органические кислоты относят к малодиссоциирующим веществам)
CH3COOH + NaOH = CH3COONa + H2O
CH3COOH + Na+ + OH— = CH3COO— + Na+ + H2O — полное ионное уравнение реакции
CH3COOH + OH— = CH3COO— + H2O — сокращенное ионное уравнение реакции
Зачастую ионные химические реакции — это реакции обмена.
Если все участвующие в реакции вещества находятся в виде ионов, то связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Отличительной особенностью химических реакций ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
- в ЕГЭ это вопрос А23 — Реакции ионного обмена
- в ГИА (ОГЭ) это А8 — Реакции ионного обмена
Обсуждение: «Ионные химические реакции»
(Правила комментирования)
Как писать ионные уравнения
С точки зрения теории электролитической диссоциации, растворы некоторых соединений способны проводить электрический ток, так как распадаются на положительные и отрицательные частицы – ионы. Такие вещества называются электролитами, к которым можно отнести соли, кислоты, основания. Большинство химических реакций протекает в растворах, а значит, между ионами, потому нужно уметь правильно писать ионные уравнения.

Вам понадобится
- — таблица растворимости солей, кислот, оснований.
Инструкция
Прежде чем приступать к написанию ионных уравнений, необходимо усвоить некоторые правила. Нерастворимые в воде, газообразные и малодиссоциирующие вещества (например, вода) на ионы не распадаются, а значит, записывайте их в молекулярном виде. Также сюда относятся слабые электролиты, такие как H2S, H2CO3, H2SO3, NH4OH. Растворимость соединений можно узнать по таблице растворимости, которая является разрешенным справочным материалом на всех видах контроля. Там же указаны все заряды, которые присущи катионам и анионам. Для полноценного выполнения задания необходимо написать молекулярное, ионное полное и ионное сокращенное уравнения.
Пример № 1. Напишите реакцию нейтрализации между серной кислотой и гидроксидом калия, рассмотрите ее с точки зрения ТЭД (теории электролитической диссоциации). Сначала запишите уравнение реакции в молекулярном виде и расставьте коэффициенты.H2SO4 + 2KOH = K2SO4 + 2H2OПроанализируйте полученные вещества на их растворимость и диссоциацию. Все соединения растворимы в воде, а значит диссоциируют на ионы. Исключение только вода, которая на ионы не распадается, следовательно, останется в молекулярном виде.Напишите ионное полное уравнение, найдите одинаковые ионы в левой и правой части и подчеркните. Чтобы сократить одинаковые ионы, зачеркните их.2H+ +SO4 2- +2K+ +2OH- = 2K+ +SO4 2- + 2H2OВ результате получится ионное сокращенное уравнение:2H+ +2OH- = 2H2OКоэффициенты в виде двоек также можно сократить:H+ +OH- = H2O
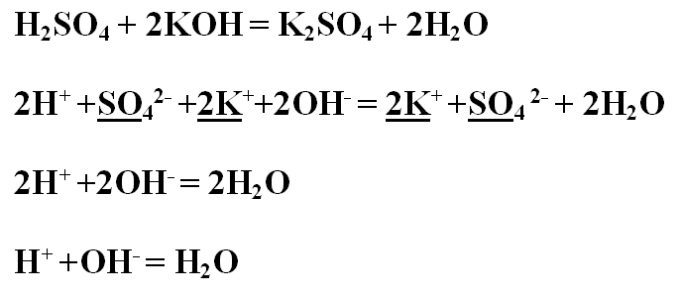
Пример № 2. Напишите реакцию обмена между хлоридом меди и гидроксидом натрия, рассмотрите ее с точки зрения ТЭД. Запишите уравнение реакции в молекулярном виде и расставьте коэффициенты. В результате, образовавшийся гидроксид меди выпал в осадок голубого цвета. CuCl2 + 2NaOH = Cu(OH) 2↓ +2NaClПроанализируйте все вещества на их растворимость в воде – растворимы все, кроме гидроксида меди, который на ионы диссоциировать не будет. Запишите ионное полное уравнение, подчеркните и сократите одинаковые ионы:Cu2+ +2Cl- + 2Na+ +2OH- = Cu(OH) 2↓+2Na+ +2Cl-Остается ионное сокращенное уравнение:Cu2+ +2OH- = Cu(OH) 2↓
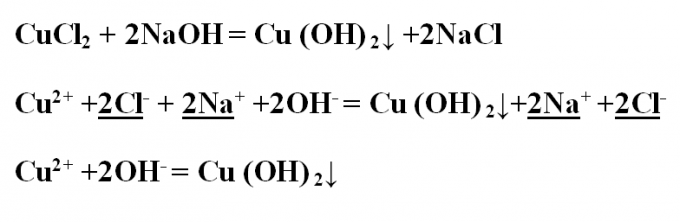
Пример № 3. Напишите реакцию обмена между карбонатом натрия и соляной кислотой, рассмотрите ее с точки зрения ТЭД. Запишите уравнение реакции в молекулярном виде и расставьте коэффициенты. В результате реакции образуется хлорид натрия и выделяется газообразное вещество СО2 (углекислый газ или оксид углерода (IV)). Оно образуется за счет разложения слабой угольной кислоты, распадающейся на оксид и воду. Na2CO3 + 2HCl = 2NaCl + CO2↑+H2OПроанализируйте все вещества на их растворимость в воде и диссоциацию. Углекислый газ уходит из системы, как газообразное соединение, вода – это малодиссоциирующее вещество. Все остальные вещества на ионы распадаются. Запишите ионное полное уравнение, подчеркните и сократите одинаковые ионы:2Na+ +СO3 2- +2H+ +2Cl- =2Na+ +2Cl- +CO2↑+H2OОстается ионное сокращенное уравнение:СO3 2- +2H+ =CO2↑+H2O
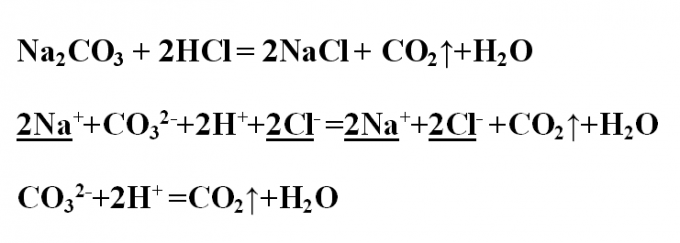
Видео по теме
Обратите внимание
Чтобы правильно определить количество ионов, нужно коэффициент, стоящий перед формулой, умножить на индекс.
Полезный совет
В уравнениях реакций обязательно проверяйте коэффициенты.
Источники:
- как составить уравнения на реакции ионного обмена
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Многие химические реакции протекают в водных растворах. Если в этих реакциях участвуют электролиты, то нужно учитывать, что эти вещества находятся в водном растворе в диссоциированном состоянии, то есть в виде ионов (сильные электролиты) или частично в виде ионов (слабые электролиты).
Таким образом, реакции между водными растворами электролитов — это реакции, в которых участвуют ионы. Поэтому такие реакции называются ионными реакциями.
Химические реакции между ионами называют ионными реакциями.
Ионные реакции возможны только в том случае, если между ионами происходит химическое взаимодействие, т. е. какие-либо ионы одного электролита и какие-либо ионы другого электролита связываются друг с другом и образуют:
- нерастворимое вещество, выпадающее в виде осадка;
- газообразное вещество;
- молекулы малодиссоциирующего вещества (слабого электролита).
Уравнения ионных реакций называют ионными уравнениями.
При составлении ионных уравнений формулы малодиссоциирующих, нерастворимых и газообразных веществ записываются в молекулярном виде.
Если в ходе реакции выпадает осадок, то рядом с формулой вещества (справа) его обозначают в виде стрелки, направленной вниз (
↓
).
Если в ходе реакции выделяется газообразное вещество, то рядом с формулой вещества (справа) его обозначают в виде стрелки, направленной вверх (
↑
).