From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium hydroxide |
|
| Other names
Caustic potash, Lye, Potash lye, Potassia, Potassium hydrate, KOH |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.802 |
| EC Number |
|
| E number | E525 (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1813 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
KOH |
| Molar mass | 56.11 g mol−1 |
| Appearance | white solid, deliquescent |
| Odor | odorless |
| Density | 2.044 g/cm3 (20 °C)[1] 2.12 g/cm3 (25 °C)[2] |
| Melting point | 360[3] °C (680 °F; 633 K) |
| Boiling point | 1,327 °C (2,421 °F; 1,600 K) |
|
Solubility in water |
85 g/100 mL (-23.2 °C) 97 g/100 mL (0 °C) 121 g/100 mL (25 °C) 138.3 g/100 mL (50 °C) 162.9 g/100 mL (100 °C)[1][4] |
| Solubility | soluble in alcohol, glycerol insoluble in ether, liquid ammonia |
| Solubility in methanol | 55 g/100 g (28 °C)[2] |
| Solubility in isopropanol | ~14 g / 100 g (28 °C) |
| Acidity (pKa) | 14.7[5] |
|
Magnetic susceptibility (χ) |
−22.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.409 (20 °C) |
| Structure | |
|
Crystal structure |
rhombohedral |
| Thermochemistry | |
|
Heat capacity (C) |
65.87 J/mol·K[2] |
|
Std molar |
79.32 J/mol·K[2][6] |
|
Std enthalpy of |
-425.8 kJ/mol[2][6] |
|
Gibbs free energy (ΔfG⦵) |
-380.2 kJ/mol[2] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  [7] [7]
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314[7] |
|
Precautionary statements |
P280, P305+P351+P338, P310[7] |
| NFPA 704 (fire diamond) |
3 0 0 ALK |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
273 mg/kg (oral, rat)[9] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[8] |
|
REL (Recommended) |
C 2 mg/m3[8] |
|
IDLH (Immediate danger) |
N.D.[8] |
| Safety data sheet (SDS) | ICSC 0357 |
| Related compounds | |
|
Other anions |
Potassium hydrosulfide Potassium amide |
|
Other cations |
Lithium hydroxide Sodium hydroxide Rubidium hydroxide Caesium hydroxide |
|
Related compounds |
Potassium oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium hydroxide is an inorganic compound with the formula KOH, and is commonly called caustic potash.
Along with sodium hydroxide (NaOH), KOH is a prototypical strong base. It has many industrial and niche applications, most of which exploit its caustic nature and its reactivity toward acids. An estimated 700,000 to 800,000 tonnes were produced in 2005. KOH is noteworthy as the precursor to most soft and liquid soaps, as well as numerous potassium-containing chemicals. It is a white solid that is dangerously corrosive.[10]
Properties and structure[edit]
KOH exhibits high thermal stability. Because of this high stability and relatively low melting point, it is often melt-cast as pellets or rods, forms that have low surface area and convenient handling properties. These pellets become tacky in air because KOH is hygroscopic. Most commercial samples are ca. 90% pure, the remainder being water and carbonates.[10] Its dissolution in water is strongly exothermic. Concentrated aqueous solutions are sometimes called potassium lyes. Even at high temperatures, solid KOH does not dehydrate readily.[11]
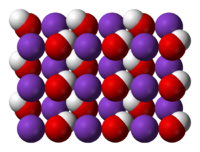
Structure[edit]
At higher temperatures, solid KOH crystallizes in the NaCl crystal structure. The OH group is either rapidly or randomly disordered so that the OH− group is effectively a spherical anion of radius 1.53 Å (between Cl− and F− in size). At room temperature, the OH− groups are ordered and the environment about the K+ centers is distorted, with K+−OH− distances ranging from 2.69 to 3.15 Å, depending on the orientation of the OH group. KOH forms a series of crystalline hydrates, namely the monohydrate KOH · H2O, the dihydrate KOH · 2H2O and the tetrahydrate KOH · 4H2O.[12]
Reactions[edit]
Solubility and desiccating properties[edit]
About 121 g of KOH dissolve in 100 mL water at room temperature, which contrasts with 100 g/100 mL for NaOH. Thus on a molar basis, NaOH is slightly more soluble than KOH. Lower molecular-weight alcohols such as methanol, ethanol, and propanols are also excellent solvents. They participate in an acid-base equilibrium. In the case of methanol the potassium methoxide (methylate) forms:
[13]
- KOH + CH3OH → CH3OK + H2O
Because of its high affinity for water, KOH serves as a desiccant in the laboratory. It is often used to dry basic solvents, especially amines and pyridines.
As a nucleophile in organic chemistry[edit]
KOH, like NaOH, serves as a source of OH−, a highly nucleophilic anion that attacks polar bonds in both inorganic and organic materials. Aqueous KOH saponifies esters:
- KOH + RCOOR’ → RCOOK + R’OH
When R is a long chain, the product is called a potassium soap. This reaction is manifested by the «greasy» feel that KOH gives when touched; fats on the skin are rapidly converted to soap and glycerol.
Molten KOH is used to displace halides and other leaving groups. The reaction is especially useful for aromatic reagents to give the corresponding phenols.[14]
Reactions with inorganic compounds[edit]
Complementary to its reactivity toward acids, KOH attacks oxides. Thus, SiO2 is attacked by KOH to give soluble potassium silicates. KOH reacts with carbon dioxide to give potassium bicarbonate:
- KOH + CO2 → KHCO3
Manufacture[edit]
Historically, KOH was made by adding potassium carbonate to a strong solution of calcium hydroxide (slaked lime). The salt metathesis reaction results in precipitation of solid calcium carbonate, leaving potassium hydroxide in solution:
- Ca(OH)2 + K2CO3 → CaCO3 + 2 KOH
Filtering off the precipitated calcium carbonate and boiling down the solution gives potassium hydroxide («calcinated or caustic potash»). This method of producing potassium hydroxide remained dominant until the late 19th century, when it was largely replaced by the current method of electrolysis of potassium chloride solutions.[10] The method is analogous to the manufacture of sodium hydroxide (see chloralkali process):
- 2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Hydrogen gas forms as a byproduct on the cathode; concurrently, an anodic oxidation of the chloride ion takes place, forming chlorine gas as a byproduct. Separation of the anodic and cathodic spaces in the electrolysis cell is essential for this process.[15]
Uses[edit]
KOH and NaOH can be used interchangeably for a number of applications, although in industry, NaOH is preferred because of its lower cost.
Catalyst for hydrothermal gasification process[edit]
In industry, KOH is a good catalyst for hydrothermal gasification process. In this process, it is used to improve the yield of gas and amount of hydrogen in process. For example, production of coke (fuel) from coal often produces much coking wastewater. In order to degrade it, supercritical water is used to convert it to the syngas containing carbon monoxide, carbon dioxide, hydrogen and methane. Using pressure swing adsorption, we could separate various gases and then use power-to-gas technology to convert them to fuel.[16] On the other hand, the hydrothermal gasification process could degrade other waste such as sewage sludge and waste from food factories.
Precursor to other potassium compounds[edit]
Many potassium salts are prepared by neutralization reactions involving KOH. The potassium salts of carbonate, cyanide, permanganate, phosphate, and various silicates are prepared by treating either the oxides or the acids with KOH.[10] The high solubility of potassium phosphate is desirable in fertilizers.
Manufacture of soft soaps[edit]
The saponification of fats with KOH is used to prepare the corresponding «potassium soaps», which are softer than the more common sodium hydroxide-derived soaps. Because of their softness and greater solubility, potassium soaps require less water to liquefy, and can thus contain more cleaning agent than liquefied sodium soaps.[17]
As an electrolyte[edit]
Potassium carbonate, formed from the hydroxide solution leaking from an alkaline battery
Aqueous potassium hydroxide is employed as the electrolyte in alkaline batteries based on nickel-cadmium, nickel-hydrogen, and manganese dioxide-zinc. Potassium hydroxide is preferred over sodium hydroxide because its solutions are more conductive.[18] The nickel–metal hydride batteries in the Toyota Prius use a mixture of potassium hydroxide and sodium hydroxide.[19] Nickel–iron batteries also use potassium hydroxide electrolyte.
Food industry[edit]
In food products, potassium hydroxide acts as a food thickener, pH control agent and food stabilizer. The FDA considers it generally safe as a direct food ingredient when used in accordance with Good Manufacturing Practices.[20] It is known in the E number system as E525.
Niche applications[edit]
Like sodium hydroxide, potassium hydroxide attracts numerous specialized applications, virtually all of which rely on its properties as a strong chemical base with its consequent ability to degrade many materials. For example, in a process commonly referred to as «chemical cremation» or «resomation», potassium hydroxide hastens the decomposition of soft tissues, both animal and human, to leave behind only the bones and other hard tissues.[21] Entomologists wishing to study the fine structure of insect anatomy may use a 10% aqueous solution of KOH to apply this process.[22]
In chemical synthesis, the choice between the use of KOH and the use of NaOH is guided by the solubility or keeping quality of the resulting salt.
The corrosive properties of potassium hydroxide make it a useful ingredient in agents and preparations that clean and disinfect surfaces and materials that can themselves resist corrosion by KOH.[15]
KOH is also used for semiconductor chip fabrication (for example anisotropic wet etching).
Potassium hydroxide is often the main active ingredient in chemical «cuticle removers» used in manicure treatments.
Because aggressive bases like KOH damage the cuticle of the hair shaft, potassium hydroxide is used to chemically assist the removal of hair from animal hides. The hides are soaked for several hours in a solution of KOH and water to prepare them for the unhairing stage of the tanning process. This same effect is also used to weaken human hair in preparation for shaving. Preshave products and some shave creams contain potassium hydroxide to force open the hair cuticle and to act as a hygroscopic agent to attract and force water into the hair shaft, causing further damage to the hair. In this weakened state, the hair is more easily cut by a razor blade.
Potassium hydroxide is used to identify some species of fungi. A 3–5% aqueous solution of KOH is applied to the flesh of a mushroom and the researcher notes whether or not the color of the flesh changes. Certain species of gilled mushrooms, boletes, polypores, and lichens[23] are identifiable based on this color-change reaction.[24]
Safety[edit]
Potassium hydroxide and its solutions are severe irritants to skin and other tissue.[25]
See also[edit]
- Potash
- Soda lime
- Saltwater soap – sailors’ soap
References[edit]
- ^ a b Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 4-80. ISBN 0-8493-0486-5.
- ^ a b c d e f «potassium hydroxide». chemister.ru. Archived from the original on 18 May 2014. Retrieved 8 May 2018.
- ^ «A18854 Potassium hydroxide». Alfa Aesar. Thermo Fisher Scientific. Archived from the original on 19 October 2015. Retrieved 26 October 2015.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Retrieved 2014-05-29.
- ^ Popov, K.; et al. (2002). «7Li, 23Na, 39K and 133Cs NMR comparative equilibrium study of alkali metal cation hydroxide complexes in aqueous solutions. First numerical value for CsOH formation». Inorganic Chemistry Communications. 3 (5): 223–225. doi:10.1016/S1387-7003(02)00335-0. ISSN 1387-7003. Retrieved October 20, 2018.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b c Sigma-Aldrich Co., Potassium hydroxide. Retrieved on 2014-05-18.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0523». National Institute for Occupational Safety and Health (NIOSH).
- ^ Chambers, Michael. «ChemIDplus — 1310-58-3 — KWYUFKZDYYNOTN-UHFFFAOYSA-M — Potassium hydroxide [JAN:NF] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 12 August 2014. Retrieved 8 May 2018.
- ^ a b c d Schultz, Heinz; Bauer, Günter; Schachl, Erich; Hagedorn, Fritz; Schmittinger, Peter (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 978-3-527-30673-2.
- ^ Holleman, A. F; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Wells, A.F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 978-0-19-855370-0.
- ^ Platonov, Andrew Y.; Kurzin, Alexander V.; Evdokimov, Andrey N. (2009). «Composition of Vapor and Liquid Phases in the Potassium Hydroxide + Methanol Reaction System at 25 °С». J. Solution Chem. 39 (3): 335–342. doi:10.1007/s10953-010-9505-1. S2CID 97177429.
- ^ W. W. Hartman (1923). «p-Cresol». Organic Syntheses. 3: 37. doi:10.15227/orgsyn.003.0037.; Collective Volume, vol. 1, p. 175
- ^ a b Römpp Chemie-Lexikon, 9th Ed. (in German)
- ^ Chen, Fu; Li, Xiaoxiao; Qu, Junfeng; Ma, Jing; Zhu, Qianlin; Zhang, Shaoliang (2020-01-13). «Gasification of coking wastewater in supercritical water adding alkali catalyst». International Journal of Hydrogen Energy. 45 (3): 1608–1614. doi:10.1016/j.ijhydene.2019.11.033. ISSN 0360-3199. S2CID 213336330.
- ^ K. Schumann; K. Siekmann (2005). «Soaps». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_247. ISBN 978-3527306732.
- ^ D. Berndt; D. Spahrbier (2005). «Batteries». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_343. ISBN 978-3527306732.
- ^ «Toyota Prius Hybrid 2010 Model Emergency Response Guide» (PDF). Toyota Motor Corporation. 2009. Archived from the original (PDF) on 2012-03-20.
- ^ «Compound Summary for CID 14797 — Potassium Hydroxide». PubChem.
- ^ Green, Margaret (January 1952). «A RAPID METHOD FOR CLEARING AND STAINING SPECIMENS FOR THE DEMONSTRATION OF BONE». The Ohio Journal of Science. 52 (1): 31–33. hdl:1811/3896.
- ^ Thomas Eisner (2003). For the Love of Insects. Harvard University Press. p. 71.
- ^ Elix, J.A.; Stocker-Wörgötter, Elfie (2008). «Chapter 7: Biochemistry and secondary metabolites». In Nash III, Thomas H. (ed.). Lichen Biology (2nd ed.). New York: Cambridge University Press. pp. 118–119. ISBN 978-0-521-69216-8.
- ^ Testing Chemical Reactions Archived 2009-10-15 at the Wayback Machine at MushroomExpert.com
- ^ Potassium hydroxide, SIDS Initial Assessment Report For SIAM 13. Bern, Switzerland, 6-9 November 2001. Archived 3 January 2018 at the Wayback Machine By Dr. Thaly LAKHANISKY. Date of last Update: February 2002
External links[edit]
- Newscientist article dn10104
- MSDS from JTBaker
- CDC — NIOSH Pocket Guide to Chemical Hazards
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium hydroxide |
|
| Other names
Caustic potash, Lye, Potash lye, Potassia, Potassium hydrate, KOH |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.802 |
| EC Number |
|
| E number | E525 (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1813 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
KOH |
| Molar mass | 56.11 g mol−1 |
| Appearance | white solid, deliquescent |
| Odor | odorless |
| Density | 2.044 g/cm3 (20 °C)[1] 2.12 g/cm3 (25 °C)[2] |
| Melting point | 360[3] °C (680 °F; 633 K) |
| Boiling point | 1,327 °C (2,421 °F; 1,600 K) |
|
Solubility in water |
85 g/100 mL (-23.2 °C) 97 g/100 mL (0 °C) 121 g/100 mL (25 °C) 138.3 g/100 mL (50 °C) 162.9 g/100 mL (100 °C)[1][4] |
| Solubility | soluble in alcohol, glycerol insoluble in ether, liquid ammonia |
| Solubility in methanol | 55 g/100 g (28 °C)[2] |
| Solubility in isopropanol | ~14 g / 100 g (28 °C) |
| Acidity (pKa) | 14.7[5] |
|
Magnetic susceptibility (χ) |
−22.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.409 (20 °C) |
| Structure | |
|
Crystal structure |
rhombohedral |
| Thermochemistry | |
|
Heat capacity (C) |
65.87 J/mol·K[2] |
|
Std molar |
79.32 J/mol·K[2][6] |
|
Std enthalpy of |
-425.8 kJ/mol[2][6] |
|
Gibbs free energy (ΔfG⦵) |
-380.2 kJ/mol[2] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  [7] [7]
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314[7] |
|
Precautionary statements |
P280, P305+P351+P338, P310[7] |
| NFPA 704 (fire diamond) |
3 0 0 ALK |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
273 mg/kg (oral, rat)[9] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[8] |
|
REL (Recommended) |
C 2 mg/m3[8] |
|
IDLH (Immediate danger) |
N.D.[8] |
| Safety data sheet (SDS) | ICSC 0357 |
| Related compounds | |
|
Other anions |
Potassium hydrosulfide Potassium amide |
|
Other cations |
Lithium hydroxide Sodium hydroxide Rubidium hydroxide Caesium hydroxide |
|
Related compounds |
Potassium oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium hydroxide is an inorganic compound with the formula KOH, and is commonly called caustic potash.
Along with sodium hydroxide (NaOH), KOH is a prototypical strong base. It has many industrial and niche applications, most of which exploit its caustic nature and its reactivity toward acids. An estimated 700,000 to 800,000 tonnes were produced in 2005. KOH is noteworthy as the precursor to most soft and liquid soaps, as well as numerous potassium-containing chemicals. It is a white solid that is dangerously corrosive.[10]
Properties and structure[edit]
KOH exhibits high thermal stability. Because of this high stability and relatively low melting point, it is often melt-cast as pellets or rods, forms that have low surface area and convenient handling properties. These pellets become tacky in air because KOH is hygroscopic. Most commercial samples are ca. 90% pure, the remainder being water and carbonates.[10] Its dissolution in water is strongly exothermic. Concentrated aqueous solutions are sometimes called potassium lyes. Even at high temperatures, solid KOH does not dehydrate readily.[11]
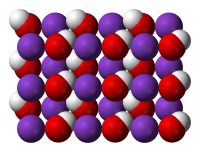
Structure[edit]
At higher temperatures, solid KOH crystallizes in the NaCl crystal structure. The OH group is either rapidly or randomly disordered so that the OH− group is effectively a spherical anion of radius 1.53 Å (between Cl− and F− in size). At room temperature, the OH− groups are ordered and the environment about the K+ centers is distorted, with K+−OH− distances ranging from 2.69 to 3.15 Å, depending on the orientation of the OH group. KOH forms a series of crystalline hydrates, namely the monohydrate KOH · H2O, the dihydrate KOH · 2H2O and the tetrahydrate KOH · 4H2O.[12]
Reactions[edit]
Solubility and desiccating properties[edit]
About 121 g of KOH dissolve in 100 mL water at room temperature, which contrasts with 100 g/100 mL for NaOH. Thus on a molar basis, NaOH is slightly more soluble than KOH. Lower molecular-weight alcohols such as methanol, ethanol, and propanols are also excellent solvents. They participate in an acid-base equilibrium. In the case of methanol the potassium methoxide (methylate) forms:
[13]
- KOH + CH3OH → CH3OK + H2O
Because of its high affinity for water, KOH serves as a desiccant in the laboratory. It is often used to dry basic solvents, especially amines and pyridines.
As a nucleophile in organic chemistry[edit]
KOH, like NaOH, serves as a source of OH−, a highly nucleophilic anion that attacks polar bonds in both inorganic and organic materials. Aqueous KOH saponifies esters:
- KOH + RCOOR’ → RCOOK + R’OH
When R is a long chain, the product is called a potassium soap. This reaction is manifested by the «greasy» feel that KOH gives when touched; fats on the skin are rapidly converted to soap and glycerol.
Molten KOH is used to displace halides and other leaving groups. The reaction is especially useful for aromatic reagents to give the corresponding phenols.[14]
Reactions with inorganic compounds[edit]
Complementary to its reactivity toward acids, KOH attacks oxides. Thus, SiO2 is attacked by KOH to give soluble potassium silicates. KOH reacts with carbon dioxide to give potassium bicarbonate:
- KOH + CO2 → KHCO3
Manufacture[edit]
Historically, KOH was made by adding potassium carbonate to a strong solution of calcium hydroxide (slaked lime). The salt metathesis reaction results in precipitation of solid calcium carbonate, leaving potassium hydroxide in solution:
- Ca(OH)2 + K2CO3 → CaCO3 + 2 KOH
Filtering off the precipitated calcium carbonate and boiling down the solution gives potassium hydroxide («calcinated or caustic potash»). This method of producing potassium hydroxide remained dominant until the late 19th century, when it was largely replaced by the current method of electrolysis of potassium chloride solutions.[10] The method is analogous to the manufacture of sodium hydroxide (see chloralkali process):
- 2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Hydrogen gas forms as a byproduct on the cathode; concurrently, an anodic oxidation of the chloride ion takes place, forming chlorine gas as a byproduct. Separation of the anodic and cathodic spaces in the electrolysis cell is essential for this process.[15]
Uses[edit]
KOH and NaOH can be used interchangeably for a number of applications, although in industry, NaOH is preferred because of its lower cost.
Catalyst for hydrothermal gasification process[edit]
In industry, KOH is a good catalyst for hydrothermal gasification process. In this process, it is used to improve the yield of gas and amount of hydrogen in process. For example, production of coke (fuel) from coal often produces much coking wastewater. In order to degrade it, supercritical water is used to convert it to the syngas containing carbon monoxide, carbon dioxide, hydrogen and methane. Using pressure swing adsorption, we could separate various gases and then use power-to-gas technology to convert them to fuel.[16] On the other hand, the hydrothermal gasification process could degrade other waste such as sewage sludge and waste from food factories.
Precursor to other potassium compounds[edit]
Many potassium salts are prepared by neutralization reactions involving KOH. The potassium salts of carbonate, cyanide, permanganate, phosphate, and various silicates are prepared by treating either the oxides or the acids with KOH.[10] The high solubility of potassium phosphate is desirable in fertilizers.
Manufacture of soft soaps[edit]
The saponification of fats with KOH is used to prepare the corresponding «potassium soaps», which are softer than the more common sodium hydroxide-derived soaps. Because of their softness and greater solubility, potassium soaps require less water to liquefy, and can thus contain more cleaning agent than liquefied sodium soaps.[17]
As an electrolyte[edit]
Potassium carbonate, formed from the hydroxide solution leaking from an alkaline battery
Aqueous potassium hydroxide is employed as the electrolyte in alkaline batteries based on nickel-cadmium, nickel-hydrogen, and manganese dioxide-zinc. Potassium hydroxide is preferred over sodium hydroxide because its solutions are more conductive.[18] The nickel–metal hydride batteries in the Toyota Prius use a mixture of potassium hydroxide and sodium hydroxide.[19] Nickel–iron batteries also use potassium hydroxide electrolyte.
Food industry[edit]
In food products, potassium hydroxide acts as a food thickener, pH control agent and food stabilizer. The FDA considers it generally safe as a direct food ingredient when used in accordance with Good Manufacturing Practices.[20] It is known in the E number system as E525.
Niche applications[edit]
Like sodium hydroxide, potassium hydroxide attracts numerous specialized applications, virtually all of which rely on its properties as a strong chemical base with its consequent ability to degrade many materials. For example, in a process commonly referred to as «chemical cremation» or «resomation», potassium hydroxide hastens the decomposition of soft tissues, both animal and human, to leave behind only the bones and other hard tissues.[21] Entomologists wishing to study the fine structure of insect anatomy may use a 10% aqueous solution of KOH to apply this process.[22]
In chemical synthesis, the choice between the use of KOH and the use of NaOH is guided by the solubility or keeping quality of the resulting salt.
The corrosive properties of potassium hydroxide make it a useful ingredient in agents and preparations that clean and disinfect surfaces and materials that can themselves resist corrosion by KOH.[15]
KOH is also used for semiconductor chip fabrication (for example anisotropic wet etching).
Potassium hydroxide is often the main active ingredient in chemical «cuticle removers» used in manicure treatments.
Because aggressive bases like KOH damage the cuticle of the hair shaft, potassium hydroxide is used to chemically assist the removal of hair from animal hides. The hides are soaked for several hours in a solution of KOH and water to prepare them for the unhairing stage of the tanning process. This same effect is also used to weaken human hair in preparation for shaving. Preshave products and some shave creams contain potassium hydroxide to force open the hair cuticle and to act as a hygroscopic agent to attract and force water into the hair shaft, causing further damage to the hair. In this weakened state, the hair is more easily cut by a razor blade.
Potassium hydroxide is used to identify some species of fungi. A 3–5% aqueous solution of KOH is applied to the flesh of a mushroom and the researcher notes whether or not the color of the flesh changes. Certain species of gilled mushrooms, boletes, polypores, and lichens[23] are identifiable based on this color-change reaction.[24]
Safety[edit]
Potassium hydroxide and its solutions are severe irritants to skin and other tissue.[25]
See also[edit]
- Potash
- Soda lime
- Saltwater soap – sailors’ soap
References[edit]
- ^ a b Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 4-80. ISBN 0-8493-0486-5.
- ^ a b c d e f «potassium hydroxide». chemister.ru. Archived from the original on 18 May 2014. Retrieved 8 May 2018.
- ^ «A18854 Potassium hydroxide». Alfa Aesar. Thermo Fisher Scientific. Archived from the original on 19 October 2015. Retrieved 26 October 2015.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Retrieved 2014-05-29.
- ^ Popov, K.; et al. (2002). «7Li, 23Na, 39K and 133Cs NMR comparative equilibrium study of alkali metal cation hydroxide complexes in aqueous solutions. First numerical value for CsOH formation». Inorganic Chemistry Communications. 3 (5): 223–225. doi:10.1016/S1387-7003(02)00335-0. ISSN 1387-7003. Retrieved October 20, 2018.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b c Sigma-Aldrich Co., Potassium hydroxide. Retrieved on 2014-05-18.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0523». National Institute for Occupational Safety and Health (NIOSH).
- ^ Chambers, Michael. «ChemIDplus — 1310-58-3 — KWYUFKZDYYNOTN-UHFFFAOYSA-M — Potassium hydroxide [JAN:NF] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 12 August 2014. Retrieved 8 May 2018.
- ^ a b c d Schultz, Heinz; Bauer, Günter; Schachl, Erich; Hagedorn, Fritz; Schmittinger, Peter (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 978-3-527-30673-2.
- ^ Holleman, A. F; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Wells, A.F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 978-0-19-855370-0.
- ^ Platonov, Andrew Y.; Kurzin, Alexander V.; Evdokimov, Andrey N. (2009). «Composition of Vapor and Liquid Phases in the Potassium Hydroxide + Methanol Reaction System at 25 °С». J. Solution Chem. 39 (3): 335–342. doi:10.1007/s10953-010-9505-1. S2CID 97177429.
- ^ W. W. Hartman (1923). «p-Cresol». Organic Syntheses. 3: 37. doi:10.15227/orgsyn.003.0037.; Collective Volume, vol. 1, p. 175
- ^ a b Römpp Chemie-Lexikon, 9th Ed. (in German)
- ^ Chen, Fu; Li, Xiaoxiao; Qu, Junfeng; Ma, Jing; Zhu, Qianlin; Zhang, Shaoliang (2020-01-13). «Gasification of coking wastewater in supercritical water adding alkali catalyst». International Journal of Hydrogen Energy. 45 (3): 1608–1614. doi:10.1016/j.ijhydene.2019.11.033. ISSN 0360-3199. S2CID 213336330.
- ^ K. Schumann; K. Siekmann (2005). «Soaps». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_247. ISBN 978-3527306732.
- ^ D. Berndt; D. Spahrbier (2005). «Batteries». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_343. ISBN 978-3527306732.
- ^ «Toyota Prius Hybrid 2010 Model Emergency Response Guide» (PDF). Toyota Motor Corporation. 2009. Archived from the original (PDF) on 2012-03-20.
- ^ «Compound Summary for CID 14797 — Potassium Hydroxide». PubChem.
- ^ Green, Margaret (January 1952). «A RAPID METHOD FOR CLEARING AND STAINING SPECIMENS FOR THE DEMONSTRATION OF BONE». The Ohio Journal of Science. 52 (1): 31–33. hdl:1811/3896.
- ^ Thomas Eisner (2003). For the Love of Insects. Harvard University Press. p. 71.
- ^ Elix, J.A.; Stocker-Wörgötter, Elfie (2008). «Chapter 7: Biochemistry and secondary metabolites». In Nash III, Thomas H. (ed.). Lichen Biology (2nd ed.). New York: Cambridge University Press. pp. 118–119. ISBN 978-0-521-69216-8.
- ^ Testing Chemical Reactions Archived 2009-10-15 at the Wayback Machine at MushroomExpert.com
- ^ Potassium hydroxide, SIDS Initial Assessment Report For SIAM 13. Bern, Switzerland, 6-9 November 2001. Archived 3 January 2018 at the Wayback Machine By Dr. Thaly LAKHANISKY. Date of last Update: February 2002
External links[edit]
- Newscientist article dn10104
- MSDS from JTBaker
- CDC — NIOSH Pocket Guide to Chemical Hazards
Определение и формула
Неорганическое соединение.
Альтернативное название
Едкое кали, калия гидроокись
Формула
KOHKOH
Свойства гидроксида калия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Белая гигроскопичная масса |
| Молярная масса | 56,11 г/моль |
| Плотность | при 25°С – 2,044 г/см3 |
| Температура плавления | 405°C |
| Температура кипения | 1325°C |
Химические свойства
В водном растворе диссоциирует на ионы:
KOH⟶OH−+K+KOH longrightarrow OH^- + K^+
Среда раствора сильно щелочная.
При взаимодействии с кислотами происходит нейтрализация:
2KOH+H2SO4=2H2O+K2SO42KOH + H_2SO_4 =2H_2O + K_2SO_4
Гидроксид калия вступает в реакции обмена с образованием нерастворимых гидроксидов или оксидов:
2KOH+2AgNO3=Ag2O↓+H2O+2KNO32KOH + 2AgNO_3 = Ag_2O↓ + H_2O + 2KNO_3,
2KOH+FeCl3=Fe(OH)3↓+3KCl2KOH + FeCl_3 = Fe(OH)_3↓ + 3KCl
Расплавленный KOHKOH реагирует с BeBe, AlAl, GaGa, ZnZn, SnSn, PbPb, SbSb и их оксидами и гидроксидами с образованием солей (напр., KAlO2KAlO_2, K2ZnO2K_2ZnO_2) и выделением соответственно H2H_2 или H2OH_2O:
2KOH+Sn=K2SnO2+H2↑2KOH + Sn = K_2SnO_2 + H_2↑,
2KOH+Al2O3=2KAlO2+H2O2KOH + Al_2O_3 = 2KAlO_2 + H_2O,
2KOH+Be(OH)2=K2BeO2+2H2O2KOH + Be(OH)_2 = K_2BeO_2 + 2H_2O.
В водных растворах образуются гидроксокомплексы:
2KOH+Sn+2H2O=K2[Sn(OH)4]+H2↑2KOH + Sn + 2H_2O = K2[Sn(OH)4] + H2↑,
2KOH+Al2O3+2H2O=2K[Al(OH)4]2KOH + Al_2O_3 + 2H_2O = 2K[Al(OH)_4],
2KOH+Be(OH)2=K2[Be(OH)4]2KOH + Be(OH)_2 = K_2[Be(OH)_4].
Водные растворы KOHKOH и его расплав взаимодействует с BB, SiSi, GeGe и их оксидами и кислотами с образованием соотв. KBO2KBO_2, K[B(OH)4]K[B(OH)_4], K2B4O7K_2B_4O_7, полисиликатов и полигерманатов:
2KOH+2B=2KBO2+H2↑2KOH + 2B = 2KBO_2 + H_2↑ (расплав);
2KOH+B+2H2O=K2[B(OH)4].+H2↑2KOH + B + 2H_2O= K_2[B(OH)_4]. + H_2↑ (водный р-р);
2KOH+2SiO2=K2Si2O5+H2O2KOH + 2SiO_2 = K_2Si_2O_5 + H_2O (водный р-р).
При взаимодействии с углекислым и сернистым газом образуются гидрокарбонаты и гидросульфиты:
KOH+CO2=KHCO3KOH + CO_2 =KHCO_3,
KOH+SO2=KHSO3KOH + SO_2 = KHSO_3.
При взаимодействии с диоксидом азота образуется смесь нитрита и нитрата калия:
KOH+2NO2=KNO2+KNO3+H2OKOH + 2NO_2 = KNO_2 + KNO_3 + H_2O.
При взаимодействии с угарным газом образуется формиат калия:
KOH+CO=HCOOKKOH + CO = HCOOK
Определить присутствие ионов калия можно по фиолетовому окрашиванию пламени, правда, обычно перебивает цвет всегда присутствующий рядом натрий. Тогда пламя нужно рассматривать через синий светофильтр.
Получение
Получение в лаборатории
Гидроксид калия в лаборатории получают пропусканием раствора сульфата калия через анионит или взаимодействием раствора поташа K2CO3K_2CO_3 и известковой воды Ca(OH)2Ca(OH)_2:
K2CO3+Ca(OH)2=CaCO3↓+2KOHK_2CO_3 + Ca(OH)_2 = CaCO_3↓ + 2KOH.
Получение в промышленности
Калия гидроксид получают электролизом водных растворов KClKCl или K2CO3K_2CO_3 с железным катодом:
KCl+H2O=KOH+HCl.KCl + H_2O = KOH + HCl.
Также его производят взаимодействием раствора поташа K2CO3K_2CO_3 и известковой воды Ca(OH)2Ca(OH)_2:
K2CO3+Ca(OH)2=CaCO3↓+2KOHK_2CO_3 + Ca(OH)_2 = CaCO_3↓ + 2KOH
Применение
Гидроксид калия применяют:
● для производства жидкого мыла и соединений калия;
● для очистки газов от COCO, CO2CO_2, SO2SO_2, NO2NO_2, H2SH_2S;
● для осушения NH3NH_3, PH3PH_3, N2ON_2O;
● в щелочных аккумуляторах.
Пример решения задачи
Сколько водорода выделится при растворении избытка цинка в 1 л 50% раствора гидроксида калия (ρ=1,516rho=1,516 г/см3)?
Решение
Вес раствора
mp=ρV=1,516⋅1000=1516m_p= rho V =1,516cdot1000 =1516 г.
Вес KOHKOH
mKOH=1516⋅50%/100%=758m_{KOH}=1516cdot50%/100% =758 г
758758 гtext{г} — xx лtext{л}
2KOH+Zn+2H2O=K2[Zn(OH)4]+H2↑2KOH + Zn + 2H_2O = K_2[Zn(OH)_4] + H_2↑
2 моля — 1 моль
2⋅56,112cdot56,11 гtext{г} — 22,422,4 лtext{л}
112,22112,22 гtext{г} — 22,422,4 лtext{л}
Составляем пропорцию:
112,22112,22 гtext{г} KOHKOH — 22,422,4 лtext{л} H2H_2,
758758 гtext{г} KOHKOH — xx лtext{л} H2H_2.
Отсюда
x=758∗22,4112,22=567x=frac{758ast22,4}{112,22} = 567 г.
1 моль KOHKOH – 74,55574,555 гtext{г},
xx молей KOHKOH – 567567 гtext{г}.
Отсюда
x=567∗174,555=151,3x=frac{567ast1}{74,555} = 151,3 л.
Ответ: 151,3151,3 л.text{л}.
Тест по теме «Гидроксид калия»
калия гидроксид
- калия гидроксид
- ка́лия гидрокси́д
(кали едкое), KOH, сильное основание (щёлочь). Бесцветные кристаллы (технический продукт — белая непрозрачная масса). На воздухе расплывается, поглощая Н2О и СО2. Легко и с сильным разогреванием растворяется в воде. Применяют в производстве жидкого мыла, в щелочных аккумуляторах, как абсорбент и осушающий агент для газов. Вызывает ожоги кожи; особенно опасно попадание в глаза.
* * *
КАЛИЯ ГИДРОКСИД
КА́ЛИЯ ГИДРОКСИ́Д (кали едкое), KOH, сильное основание (щелочь). Бесцветные кристаллы (технический продукт — белая непрозрачная масса). На воздухе расплывается, поглощая H2O и CO2. Легко и с сильным разогреванием растворяется в воде. Применяют в производстве жидкого мыла, в щелочных аккумуляторах, как абсорбент и осушающий агент для газов. Вызывает ожоги кожи; особенно опасно попадание в глаза.
Энциклопедический словарь.
2009.
Смотреть что такое «калия гидроксид» в других словарях:
-
Калия гидроксид — Гидроксид калия Общие Систематическое наименование Гидроксид калия Традиционные названия … Википедия
-
Калия гидроксид — КАЛИЯ ГИДРОКСИД, KOH, кристаллы, tпл 405°C. Сильное основание, относится к щелочам. Применяют калий гидроксид в производстве жидкого мыла, при обработке хлопка, в щелочных аккумуляторах, как поглотитель газов и осушающий агент и др. Вызывает… … Иллюстрированный энциклопедический словарь
-
КАЛИЯ ГИДРОКСИД — (кали едкое) KOH, сильное основание (щелочь). Бесцветные кристаллы (технический продукт белая непрозрачная масса). На воздухе расплывается, поглощая H2O и CO2. Легко и с сильным разогреванием растворяется в воде. Применяют в производстве жидкого… … Большой Энциклопедический словарь
-
КАЛИЯ ГИДРОКСИД, KOH — КАЛИЯ ГИДРОКСИД, KOH, кристаллы, tпл 405шC. Сильное основание, относится к щелочам. Применяют калий гидроксид в производстве жидкого мыла, при обработке хлопка, в щелочных аккумуляторах, как поглотитель газов и осушающий агент и др. Вызывает… … Современная энциклопедия
-
КАЛИЯ ГИДРОКСИД — КОН бесцветные кристаллы, плотн. 2120 кг/м3, tпл 405 °С, tкип 1324 °С. В 100 г воды растворяется 112 г КОН (при 20 °С). Сильное основание, разрушает кожу, бумагу, шерсть, вызывает сильные ожоги на коже человека. К. г. получают электролизом р ров… … Большой энциклопедический политехнический словарь
-
КАЛИЯ ГИДРОКСИД — КОН, бесцв. кристаллы; до 247 °С устойчива моноклинная модификация, выше 247 °С кубическая типа NaCl ( а =0,533 нм, z = 4, пространств. группа Fm3m); DH0 перехода 5,6 кДж/моль; т. кип. 1325°С; плотн. 2,044 г/см 3 (см. также табл.).… … Химическая энциклопедия
-
КАЛИЯ ГИДРОКСИД — (кали едкое), КОН, сильное основание (щёлочь). Бесцв. кристаллы (техн. продукт белая непрозрачная масса). На воздухе расплывается, поглощая Н2О и СО2. Легко и с сильным разогреванием растворяется в воде. Применяют в произ ве жидкого мыла, в… … Естествознание. Энциклопедический словарь
-
Калиум гидроксидатум — Kalium hydroxidatum, Калия гидроксид — КОН калия гидроксид, едкое кали, белый кристаллический порошок, растворяется в воде, в спирте. Поглощает СО2 и Н2О из воздуха, поэтому хранится в плотно закрытой стеклянной посуде. Получается электролизом концентрированных растворов хлористого… … Справочник по гомеопатии
-
Гидроксид калия — Гидроксид калия … Википедия
-
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
Физические свойства
Гидроксид калия KOH — неорганическое соединение. Белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 56,11; относительная плотность для тв. и ж. состояния d = 2, 044; tпл = 404º C; tкип = 1324º C
Способы получения
1. Гидроксид калия получают электролизом раствора хлорида калия:
2KCl + 2H2O → 2KOH + H2 + Cl2
2. При взаимодействии калия, оксида калия, гидрида калия и пероксида калия с водой также образуется гидроксид калия:
2K + 2H2O → 2KOH + H2
K2O + H2O → 2KOH
2KH + 2H2O → 2KOH + H2
K2O2 + H2O → 2KOH + H2O2
3. Карбонат калия при взаимодействии с гидроксидом кальция образует гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Качественная реакция
Качественная реакция на гидроксид калия — окрашивание фенолфталеина в малиновый цвет.
Химические свойства
1. Гидроксид калия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксид калия реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2KOH(избыток) + CO2 → K2CO3 + H2O
KOH + CO2 (избыток) → KHCO3
3. Гидроксид калия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2KOH + Al2O3 → 2KAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2KOH + Al2O3 + 3H2O → 2K[Al(OH)4]
4. С кислыми солями гидроксид калия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
KOH + KHCO3 → K2CO3 + H2O
5. Гидроксид калия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и выделяется водород:
2KOH + Si + H2O → K2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4KOH + 2F2 → 4KF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида калия:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с гидроксидом калия только при нагревании:
6KOH + 3S = 2K2S + K2SO3 + 3H2O
6. Гидроксид калия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2KOH + 2Al + 6Н2О = 2K[Al(OH)4] + 3Н2
7. Гидроксид калия вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом калия с образованием хлорида калия и осадка гидроксида меди (II):
2KOH + CuCl2 = Cu(OH)2↓+ 2KCl
Также с гидроксидом калия взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида калия образуются хлорид калия, аммиак и вода:
NH4Cl + KOH = NH3 + H2O + KCl
8. Гидроксид калия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
KOH ↔ K+ + OH—
9. Гидроксид калия в расплаве подвергается электролизу. При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4KOH → 4K + O2 + 2H2O
| Гидроксид калия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
Гидроксид калия |
| Традиционные названия |
Кали едкое[1], каустический поташ |
| Хим. формула | KOH |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 56,1056 г/моль |
| Плотность | 2,044−2,12 г/см³ [2] |
| Термические свойства | |
| Т. плав. | 380−406 °C [2] |
| Т. кип. | 1327 °C |
| Энтальпия образования | −425,8 кДж/моль |
| Энтальпия плавления | 7,5 кДж/моль |
| Энтальпия кипения | 128,9 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст.[3] |
| Химические свойства | |
| Растворимость в воде | 117,9 г/100 мл [2] |
| Растворимость в спирте | 38,7 (28 °C) |
| Оптические свойства | |
| Показатель преломления | 1.409 |
| Классификация | |
| Рег. номер CAS | 1310-58-3 |
| PubChem | 14797 |
| Рег. номер EINECS | 215-181-3 |
| SMILES |
[K+].[OH-] |
| InChI |
1S/K.H2O/h;1H2/q+1;/p-1 KWYUFKZDYYNOTN-UHFFFAOYSA-M |
| Кодекс Алиментариус | E525 |
| RTECS | TT2100000 |
| ChEBI | 32035 |
| Номер ООН | 1813 |
| ChemSpider | 14113 |
| Безопасность | |
| Пиктограммы СГС |
  |
| NFPA 704 |
0 3 0 ALK |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Гидрокси́д ка́лия (лат. Kalii hydroxidum) — неорганическое соединение с формулой KOH.
Тривиальные названия: едкое кали[1], каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь[4], калиевый щёлок.
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Химические свойства
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с кислотными оксидами с образованием соли и воды:
- Взаимодействие с некоторыми непереходными металлами в растворе с образованием комплексной соли и водорода:
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов:
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- щелочные элементы,
- катализ
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- переработка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук[4].
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами расщепляется и омыливает при этом масла.
В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Также применяется в ресомации — альтернативном способе «захоронения» тел.
5 % раствор гидроксида калия используется в медицине для лечения бородавок[5].
В фотографии используется как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов[6].
Производство
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
- электролиз с твердым асбестовым катодом (диафрагменный метод производства),
- электролиз с полимерным катодом (мембранный метод производства),
- электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути. Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
- исключается стадия сжижения и испарения хлора,
- водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется ртутным (ЗП КЧХК) и диафрагменным (Сода-Хлорат) методами.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду. Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется. При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.[4]
Опасность
Очень сильная щёлочь. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.
См. также
- Щёлочи
- Пищевые добавки
Примечания
- ↑ 1 2 Кали едкое — статья из Большой советской энциклопедии.
- ↑ 1 2 3 Гидроксид калия на XuMuK.Ru
- ↑ http://www.cdc.gov/niosh/npg/npgd0523.html
- ↑ 1 2 3 ГИДРОКСИД КАЛИЯ: свойства и применение. newchemistry.ru. Проверено 13 мая 2016.
- ↑ Сравнительное исследование эффективности 5% раствора гидроксида калия и криотерапии в лечении генитальных бородавок | Дерматология в России. www.dermatology.ru. Проверено 13 мая 2016.
- ↑ Гурлев, 1988, с. 288.
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
| Гидроксид калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Гидроксид калия |
| Традиционные названия | Кали едкое, каустический поташ |
| Хим. формула | KOH |
| Состояние | твёрдое |
| Молярная масса | 56,1056 г/моль |
| Плотность | 2,044−2,12 г/см³ |
| Т. плав. | 380−406 °C |
| Т. кип. | 1327 °C |
| Энтальпия образования | −425,8 кДж/моль |
| Энтальпия плавления | 7,5 кДж/моль |
| Энтальпия кипения | 128,9 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | 117,9 г/100 мл |
| Растворимость в спирте | 38,7 (28 °C) |
| Показатель преломления | 1.409 |
| Рег. номер CAS | ГОСТ 24363-80 ГОСТ 9285-78 |
| Рег. номер CAS | 1310-58-3 |
| PubChem | 14797 |
| Рег. номер EINECS | 215-181-3 |
| SMILES |
[K+].[OH-] |
| InChI |
1S/K.H2O/h;1H2/q+1;/p-1 KWYUFKZDYYNOTN-UHFFFAOYSA-M |
| Кодекс Алиментариус | E525 |
| RTECS | TT2100000 |
| ChEBI | 32035 |
| Номер ООН | 1813 |
| ChemSpider | 14113 |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Гидроксид калия (лат. Kalii hydroxidum) — неорганическое соединение с формулой KOH.
Тривиальные названия: едкое кали, каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь, калиевый щёлок.
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Химические свойства
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
-
- KOH + HCl ⟶ KCl + H2O
-
- 2KOH + H2SO4 ⟶ K2SO4 + 2H2O
- Взаимодействие с кислотными оксидами с образованием соли и воды:
-
- 2KOH + CO2 ⟶ K2CO3 + H2O
-
- 2KOH + SO3 ⟶ K2SO4 + H2O
- Взаимодействие с некоторыми непереходными металлами в растворе с образованием комплексной соли и водорода:
-
- 2Al + 2KOH + 6H2O ⟶ 2K[Al(OH)4] + 3H2↑
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов:
-
- 2KCl + 2H2O ⟶ 2KOH + H2↑ + Cl2↑
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- щелочные элементы,
- катализ
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- переработка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами расщепляется и омыливает при этом масла.
В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Также применяется в ресомации — альтернативном способе «захоронения» тел.
5 % раствор гидроксида калия используется в медицине для лечения бородавок.
В фотографии используется как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов.
Производство
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
- электролиз с твердым асбестовым катодом (диафрагменный метод производства),
- электролиз с полимерным катодом (мембранный метод производства),
- электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути. Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
- исключается стадия сжижения и испарения хлора,
- водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется мембранным (ООО «Сода-Хлорат») методом.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду. Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется. При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.
Опасность
Очень сильная щёлочь. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.








![{mathsf {2Al+2KOH+6H_{2}Olongrightarrow 2K[Al(OH)_{4}]+3H_{2}uparrow }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a11523f576df15240faad56120b016d9a682eefe)


