| Нитрат калия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, индийская селитра, Соль Петра (Salt of Peter)[источник?] |
| Химическая формула | KNO3 |
| Эмпирическая формула | KNO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Отн. молек. масса | 101,1032 а. е. м. |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) г/см³ |
| Твёрдость | 2 |
| Термические свойства | |
| Температура плавления | 334 °C |
| Температура кипения | с разложением °C |
| Температура разложения | 400 °C |
| Тройная точка | отсутствует |
| Молярная теплоёмкость (ст. усл.) | 95,06 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -494,00 кДж/моль |
| Энтальпия плавления | 9,80 кДж/моль |
| Энтальпия сублимации | 181,00 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-79-1 |
| RTECS | TT3700000 |
| Безопасность | |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| NFPA 704 |
0 1 0 OX |
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, индийская селитра и др.) — неорганическое бинарное соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находятся одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных[1].
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (черного) пороха) и как калий-азотное удобрение (очень удобный комплекс двух обычно плохо сочетающихся при усваивании растениями элементов).
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Природные источники и месторождения
- 5 Применение
- 6 См. также
- 7 Примечания
- 8 Ссылки
Физические свойства
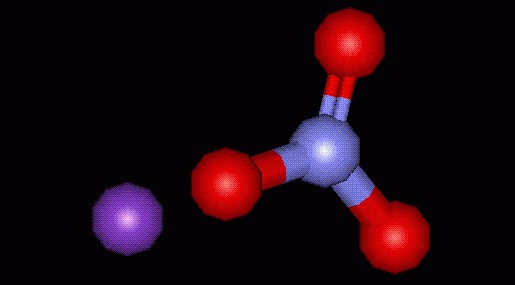
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[2][3]:
| Растворитель / Температура | 0 °С | 10 °С | 20 °С | 25 °С | 30 °С | 40 °С | 50 °С | 60 °С | 70 °С | 80 °С | 90 °С | 100 °С |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 | |||
| Жидкий аммиак | 10,52 | 10,4 | ||||||||||
| Гидразин | 14 | |||||||||||
| Диэтиловый эфир | ||||||||||||
| Этанол | ||||||||||||
| Метанол | ||||||||||||
| Глицерин |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причем с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
Разлагается при 400 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. В смеси с некоторыми органическими материалами склонен самовоспламенять их.
Расплав может быть использован для получения калия электролизом, однако из-за высоких окислительных способностей нитрата калия в этом состоянии предпочтительнее гидроксид калия.
Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дерном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу. Реакция поташа с кальциевой селитрой (нитратом кальция)
является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Первый способ применялся до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
— популярнейшая после реакции нитрата кальция с карбонатом или сульфатом калия
— в основном демонстративная реакция соответствующей кислоты и основания
— тоже демонстративная реакция соответствующих кислоты и металла
— демонстр. реакция соотв. щелочного оксида с соотв. кислотой
Природные источники и месторождения
В природе калия нитрат распространен в виде минерала нитрокалита. Крупнейшие его месторождения находятся в Ост-Индии и в Чили (вместе с основным минералов — нитронатритом). Природный нитрат калия является результатом разложения азотистых веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом[4].
В очень малых количествах содержится в растениях и животных[1], является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два частично блокирующих усвоение друг друга растениями элемента.
Незаменим он при изготовлении дымного пороха и некоторых других составов (например, карамельного ракетного топлива), которые почти полностью сейчас идут на производство пиротехники.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла[5].
Расплав часто используется в лабораториях и у любителей для получения элементарного калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности при переработке никелевых руд.
См. также
- Азотная кислота
- Нитраты
- Порох
Примечания
- ↑ 1 2 ЭСБЕ
- ↑ Химия и технология редких и рассеянных элементов / Под ред. Большакова К. А.. — М.: Высшая школа, 1976. — Т. 1. — 91 с.
- ↑ База данных Химистера
- ↑ Нитраты природные — Горная энциклопедия
- ↑ Кубань-Агро-Альянс
Ссылки
- Получение калиевой селитры
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
|
Соединения калия |
|---|
|
Азид калия (KN3) • Амид калия (KNH2) • Ацесульфам (C4H4KNO4S) • Ацетат калия (CH3COOK) • Ацетиленид калия (K2C2) • Бензоат тригидрат калия (Брутто-формула:C7H11KO5) • Бромат калия (KBrO3) • Бромид калия (KBr) • Гексагидроксоплатинат(IV) калия (K2[Pt(OH)6]) • Гексагидроксостибат калия (K[Sb(OH)6]) • Гексанитрокобальтат(III) калия (K3[Co(NO3)6]) • Гексаоксибензол калия (C6(OK)6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторокупрат(III) калия (K3CuF6) • Гексафторомолибдат(III) калия (K3MoF6) • Гексафтороплатинат(V) калия (K[PtF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторфосфат калия (KPF6) • Гексахлоропалладат(IV) калия (K2[PdCl6]) • Гексахлороплатинат(IV) калия (K2[PtCl6]) • Гексахлоростаннат(IV) калия (K2[SnCl6]) • Гексахлорплатинат калия (K2PtCl6) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(II) тригидрат калия (K4[Fe(CN)6]•3H2O) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрид калия (KH) • Гидрокарбонат калия (KHCO3) • Гидроксид калия (KOH) • Гидроортофосфат калия (K2HPO4) • Гидросульфат калия (KHSO4) • Гидросульфид калия (KHS) • Гидросульфит калия (KHSO3) • Гидрофторид калия (KHF2) • Дигидроарсенат калия (KH2AsO4) • Дигидроортофосфат калия (KH2PO4) • Динитрамид калия (KN(NO2)2) • Дисульфат калия (K2S2O7) • Дисульфит калия (K2S2O5) • Дисульфонатнитроксил калия ((KO3S)2NO) • Дитионат калия (K2S2O6) • Дихлородиамминпалладий ([Pd(NH3)2]Cl2) • Дихромат калия (K2Cr2O7) • Дицианоаргентат(I) калия (K[Ag(СN)2]) • Дицианоаурат(I) калия (K[Au(СN)2]) • Иодат калия (KIO3) • Иодид калия (KI) • Карбонат калия (K2CO3) • Манганат калия (K2MnO4) • Метаванадат калия (KVO3) • Метасиликат калия (K2SiO3) • Метафосфат калия (KPO3) • Надпероксид калия (KO2 или K2O4) • Нитрат калия (KNO3) • Нитрит калия (KNO2) • Озонид калия (KO3) • Оксалат калия (K2C2O4) • Оксалат моногидрат калия (K2C2O4•H2O) • Оксид калия (K2O) • Октахлоромолибдат калия (K4Mo2Cl8) • Ортофосфат калия (K3PO4) • Пербромат калия (KBrO4) • Периодат калия (KIO4) • Перманганат калия (KMnO4) • Пероксид калия (K2O2) • Пероксодикарбонат калия (К2С2О6) • Пероксомоносульфат калия (K2SO5) • Пероксодисульфат калия (K2S2O6(O2)) • Перренат калия (KReO4) • Перхлорат калия (KClO4) • Полисульфиды калия (K2Sn) • Политионаты калия (K2SnO6) • Сегнетова соль (NaKC4H4O6) • Соль Джонсона (K[I(I)2]•H2O) • Соль Цейзе (K[Pt(C2H4)Cl3]•H2O) • Сорбат калия (C6H7KO2) • Сульфат гидрат калия-гадолиния • Сульфат гидрат калия-кальция (K2Ca(SO4)2•H2O) • Сульфат калия (K2SO4) • Сульфат калия-кальция (K2Ca(SO4)2) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфид калия (K2S) • Сульфит дигидрат калия (K2SO3•2H2O) • Сульфит калия (K2SO3) • Тетрагидроалюминат калия (KAlH4) • Тетрагидроксодиоксоосмат(VI) калия (K2[OsO2(OH)4]) • Тетрагидроортотеллурат калия (K2H4TeO6) • Тетраиодомеркурат(II) калия (K2[HgI4]) • Тетранитроплатинат(II) калия (K2[Pt(NO2)4]) • Тетраоксорутенат(VI) калия (K2RuO4) • Тетрапероксохромат(V) калия (K3CrO8) • Тетрасиликат калия (K2Si4O9•H2O) • Тетрахлоромолибдат(III) калия (KMoCl4) • Тетрахлоропалладат(II) калия (K2[PdCl4]) • Тетрахлороплатинат(II) калия (K2[PtCl4]) • Тетрахлороферрат(III) калия (K[FeCl4]) • Тетрахлорплатинат калия (K2PtCl4) • Тетрацианоникколат(II) калия (K2[Ni(CN)4]) • Тетрацианоплатинат(II) калия (K2[Pt(CN)4]) • Тиосульфат калия (K2SO3S) • Тиоцианат калия (KSCN) • Феррат калия (K2FeO4) • Феррооксалат калия (K3[Fe(C2O4)3]) • Формиат калия (HCOOK) Фталимид калия • Фторид калия (KF) • Фторсульфит калия (KSO2F) • Хлорат калия (KClO3) • Хлорид калия (KCl) • Хлорид-триэтилалюминий калия ((C2H5)3Al•KCl) • Хромат калия (K2CrO4) • Хромит калия (KCrO2) • Цианат калия (KOCN) • Цианид калия (KCN) • Цианоаурат калия (K[Au(CN)2] • Этилксантогенат калия (C2H5OC(S)SK) • |
Со многими химическими соединениями мы сталкиваемся очень часто, причем сами того не замечая. Одно из них – это нитрат калия, или индийская селитра. Кристаллический порошок прочно вошел в нашу жизнь: мы его едим (в виде добавок в различные продукты), используем в сельском хозяйстве как очень ценное и полезное удобрение, ну и просто радуемся, глядя на некоторую продукцию, в составе которой он присутствует (фейерверк).
Нитрат калия: формула и описание
Это неорганическое соединение, имеющее формулу KNO3, — соль, образованная азотной кислотой и натрием. Его кристаллы не имеют цвета и запаха. Вещество не летучее, но обладает слабо выраженными гигроскопическими свойствами (то есть способностью впитывать влагу даже из воздуха, но в малых количествах). Нитрат калия практически не токсичен и безвреден для человека и животных. Кристаллы имеют удлиненную игольчатую форму. Очень хорошо растворим в воде (при помощи электролиза из него выделяют калий), а также в гидразине, глицерине, жидком аммиаке. Для очистки нитрата калия иногда используют способ перекристаллизации.
Природные месторождения
Калиевая селитра (KNO3) в естественной среде встречается в основном в виде минерала нитрокалита. Самое крупное его месторождение находится в Индии. Отсюда и второе название соединения – индийская селитра. Минерал образуется в результате длительного процесса разложения азотсодержащих веществ, выделяющийся при этом аммиак связывается специфическими нитробактериями. Данная реакция происходит при высоких температурах воздуха, что и обуславливает распространенность данного минерала в странах с жарким климатом и высокой влажностью.
Химические свойства
Нитрат калия (формула KNO3) является достаточно сильным окислителем. В измельченном состоянии он очень активно, а иногда и с взрывом реагирует с горючими материалами и некоторыми восстановителями. В реакциях с участием некоторых органических соединений он способен воспламенять и их. Селитры очень неустойчивы и при воздействии температуры разлагаются с образованием нитритов и кислорода. Не исключение и нитрат калия (уравнение: 2KNO3 → 2KNO2 + O2↑). Данное свойство соединения говорит о его весьма высокой пожароопасности, что требует соблюдения специальных правил хранения.
Старейший способ получения
Нитрат калия – это соль, которую начали получать еще в средние века. Для этого использовались большие компостные или навозные кучи, их называли селитряницы. Они делались с использованием известняка, различного строительного мусора, прослоек из хвороста и соломы, чтобы обеспечить доступ кислорода. Сверху, чтобы удержать внутри все выделяющиеся газы, их уплотняли дерном. Когда органика начинала активно разлагаться и гнить, то выделялся аммиак, который не выходил наружу, а оставался в прослойках хвороста и соломы, постепенно подвергаясь процессу нитрификации и трансформации сначала в азотистую, а затем азотную кислоту. Она, в свою очередь, вступала в химическое взаимодействие с находящимся в компостной куче известняком и давала в результате нитрат кальция. Далее его выщелачивали обычной золой (поташем). При этом карбонат кальция выпадал в осадок, и получался раствор нитрата калия. Его использовали в первую очередь для приготовления пороха. Это отражается следующей реакцией:
Ca(NO3)2 + K2CO3 → 2 KNO3 + CaCO3 (в осадок).
Современное получение
Способов получения данного вещества существует несколько. Вот наиболее применяемые и распространенные из них:
- Азотной кислотой нейтрализуют гидроксид калия.
- Абсорбция нитрозных газов гидроксидом калия.
- Конверсионный способ, основанный на разложении нитрата натрия хлоридом калия.
Применение в сельском хозяйстве
Индийская селитра активно используется во многих сферах деятельности человека. Основное направление – сельское хозяйство, где нитрат калия применяется в качестве ценного удобрения. Оно содержит два компонента, которые крайне необходимы растениям для их активного развития. Если они вносятся по отдельности, то взаимно препятствуют друг другу в нормальном усвоении, а если вместе — процесс протекает без каких-либо осложнений. Данное удобрение очень быстро растворяется в почвенном растворе, что тоже является большим плюсом, время воздействия сведено к минимуму. Внесение нитрата калия под плодовые деревья летом и осенью увеличивает их холодостойкость и морозоустойчивость.
Иные области использования
Вторая сфера, где активно применяется нитрат калия, – это получение дымного пороха, который на данный момент в основной своей массе идет на изготовление пиротехнических изделий (военных, специализированных или развлекательных).
Применяется рассматриваемая селитра и при изготовлении твердого ракетного топлива, которое также называют карамельным из-за использования при производстве сахара (сорбита). Оно на 65 % состоит именно из нитрата калия.
Сильные окислительные свойства индийской селитры нашли применение в металлургии, а именно в процессе переработки руд, содержащих никель. Также данное вещество активно используется в области стекольной промышленности, главным образом для осветления хрусталя, повышения прочности продукции. Применяется индийская селитра и при изготовлении эмалей, иной лакокрасочной продукции.
Одна из наименее эффективных и полезных для человека сфер, где используется нитрат калия, – это пищевая промышленность. Там он известен под кодовым названием Е252 (консервант). Его используют для увеличения срока хранения продуктов, так как нитрат калия замедляет процесс размножения бактерий и различных грибков. Активно добавляется это вещество в сыры (твердые, полутвердые, мягкие), колбасы и мясную продукцию, консервированную рыбу, паштеты, изготовленные из гусиной печени. Кроме того, данная добавка улучшает окраску продукта. Достаточно вспомнить красивый, но абсолютно неестественный розовый цвет колбасы.
Важно извлечь информацию следующего характера: добавка Е252 является канцерогеном, то есть веществом, способствующим развитию рака. Несмотря на это, она разрешена к использованию на территории РФ и стран Еврозоны. Этот тот самый случай, когда химия идет против человека.
KNO3 если вы спрашивали про данную формулу дез дальнейшего разложения
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 февраля 2020 года; проверки требуют 23 правки.
| Нитрат калия | ||
|---|---|---|
|
||
 |
||
| Систематическое наименование |
Нитрат калия | |
| Сокращения | в народе «КС» или «НК» | |
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, инди́йская селитра́, Со́ль Петра́ (Salt of Peter, petersalt)[1] | |
| Хим. формула | KNO3 | |
| Рац. формула | KNO3 | |
| Состояние | Твёрдое | |
| Молярная масса | 101,1032 г/моль | |
| Плотность | 2,109 (16 °C) | |
| Твёрдость | 2 | |
| Температура | ||
| • плавления | 334 °C | |
| • кипения | с разложением °C | |
| • разложения | 400 °C | |
| Тройная точка | Отсутствует | |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | -494,00 кДж/моль | |
| • плавления | 9,80 кДж/моль | |
| • сублимации | 181,00 кДж/моль | |
| Растворимость | ||
| • в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
|
| Рег. номер CAS | 7757-79-1 | |
| PubChem | 24434 | |
| Рег. номер EINECS | 231-818-8 | |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
|
| InChI |
InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E252 | |
| RTECS | TT3700000 | |
| ChEBI | 63043 | |
| Номер ООН | 1486 | |
| ChemSpider | 22843 | |
| ЛД50 | 3750 мг/кг | |
| Токсичность | Малотоксичен | |
| Краткие характер. опасности (H) |
H272 |
|
| Меры предостор. (P) |
P220 |
|
| Сигнальное слово | осторожно | |
| Пиктограммы СГС | |
|
| NFPA 704 |
1 1 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Нитра́т ка́лия (азотноки́слый ка́лий ка́лиевая сели́тра, кали́йная селитра, инди́йская селитра и др., химическая формула — KNO3) — неорганическая калиевая соль азотной кислоты.
В стандартных условиях, нитрат калия — это кристаллическое бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Малотоксичен для живых организмов.
Физические свойства[править | править код]
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельчённом состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решёткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[2]:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства[править | править код]
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2[3] (выделение последнего увеличивает пожароопасность нитрата калия):
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[3]:
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.
Получение[править | править код]
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов.
При гниении навоза образовывался аммиак, который, накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрёл производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- — в основном, демонстрационная реакция соответствующей кислоты и основания
- — тоже демонстрационная реакция соответствующих кислоты и металла.
- — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
Природные источники и месторождения[править | править код]
В природе нитрат калия распространён в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра.. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом[4]. Наиболее известные месторождения нитрата калия находятся в Индии, Боливии, Австралии, Чили, ЮАР, России, США и Шри-Ланке. Он также встречается в Китае, Мексике, и других странах[5]
В очень малых количествах нитрат калия содержится в растениях[6], является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение[править | править код]
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стёкол и придания прочности изделиям из стекла[7].
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252[8]. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта[9].
См. также[править | править код]
- Азотная кислота
- Нитраты
- Порох
Примечания[править | править код]
Ссылки[править | править код]
- Получение калиевой селитры
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, индийская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Все значения словосочетания «нитрат калия»
-
Чтобы увеличить выход газа, а также связать очень реакционноспособный и легко загорающийся натрий, в смесь добавляют нитрат калия, который реагирует со свободным натрием: 10Na + 2KNO3 → K2O + 5Na2O + N2.
-
Так ими был обнаружен уголь, так они научились вытягивать из земли серу, так они узнали как употреблять для своих целей нитрат калия.
-
Достаточно было просто взять тюбик зубной пасты, чтобы понять, входит в её состав нитрат калия или нет.
- (все предложения)
- хлорат калия
- карбонат калия
- гидроксид калия
- иодид калия
- дихромат калия
- (ещё синонимы…)
- натрий
- кальций
- соль
- марганцовка
- химия
- (ещё ассоциации…)
- Разбор по составу слова «нитрат»
- Разбор по составу слова «калий»
- Как правильно пишется слово «калий»
Определение и формула нитрата калия

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это твёрдое кристаллическое вещество, представляющее из себя бесцветные ромбические или гексагональной кристаллы, с плотностью 2,11 г/см, хорошо растворяется в воде 31,6 г/100 г (
), температура плавления
, при
разлагается.
Химические свойства нитрата калия
взаимодействует с восстановителями:
- При нагревании
разлагается:
Получение
Нитрат калия получают с помощью следующих реакций:
Качественная реакция
Качественной реакцией на ионы калия является образование жёлтого кристаллического осадка гексанитрокобальтата (III) калия-натрия при добавлении к раствору гексанитрокобальтата (III) натрия:
Применение
Нитрат калия в основном применяют в качестве удобрения, используют также в пиротехнике, в создании дымного пороха, производстве прочного стекла, в переработке никелевой руды, в пищевой промышленности как консервант.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
| Нитрат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Калиевая селитра, калийная селитра, индийская селитра, Соль Петра (Salt of Peter, petersalt) |
| Хим. формула | KNO3 |
| Рац. формула | KNO3 |
| Состояние | твёрдое |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) |
| Твёрдость | 2 |
| Т. плав. | 334 °C |
| Т. кип. | с разложением °C |
| Т. разл. | 400 °C |
| Тройная точка | отсутствует |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) |
| Энтальпия образования | -494,00 кДж/моль |
| Энтальпия плавления | 9,80 кДж/моль |
| Энтальпия сублимации | 181,00 кДж/моль |
| Растворимость в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| ГОСТ | ГОСТ 4217-77 |
| Рег. номер CAS | 7757-79-1 |
| PubChem | 24434 |
| Рег. номер EINECS | 231-818-8 |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
| InChI |
1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E252 |
| RTECS | TT3700000 |
| ChEBI | 63043 |
| Номер ООН | 1486 |
| ChemSpider | 22843 |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат калия, азотнокислый калий (калиевая селитра, калийная селитра, индийская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Природные источники и месторождения
- 5 Применение
калиевая селитра — удобрение
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[3]:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- 2KNO3 ⟶ 2KNO2 + O2↑
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[4]:
- Zn + 2HCl ⟶ ZnCl2 + 2H0,
- KNO3 + 2H0 ⟶ KNO2 + H2O.
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.
Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитряницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
- Ca(NO3)2 + K2CO3 ⟶ 2KNO3 + CaCO3↓
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
- Ca(NO3)2 + K2SO4 ⟶ 2KNO3 + CaSO4↓
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
- KCl + NaNO3 ⟶ KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
- KCl + NH4NO3 ⟶ KNO3 + NH4Cl
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- KOH + HNO3 ⟶ KNO3 + H2O — в основном, демонстрационная реакция соответствующей кислоты и основания
- 21K + 26HNO3 ⟶ 21KNO3 + NO↑ + N2O↑ + N2↑ + 13H2O — тоже демонстрационная реакция соответствующих кислоты и металла.
- K2O + 2HNO3 ⟶ 2KNO3 + H2O — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
- 2KOH + N2O5 ⟶ 2KNO3 + H2O
- NH4NO3 + KOH ⟶ NH3 ↑ + KNO3 + H2O
- K2CO3 + 2HNO3 ⟶ 2KNO3 + H2O + CO2↑
Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Индии. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
From Wikipedia, the free encyclopedia

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Potassium nitrate |
||
| Other names
Saltpeter |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.926 |
|
| EC Number |
|
|
| E number | E252 (preservatives) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1486 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
KNO3 | |
| Molar mass | 101.1032 g/mol | |
| Appearance | white solid | |
| Odor | odorless | |
| Density | 2.109 g/cm3 (16 °C) | |
| Melting point | 334 °C (633 °F; 607 K) | |
| Boiling point | 400 °C (752 °F; 673 K) (decomposes) | |
|
Solubility in water |
133 g/1000 g water (0 °C) 316 g/1000 g water (20 °C) 383 g/1000 g water (25 °C) 2439 g/1000 g water (100 °C)[3] |
|
| Solubility | slightly soluble in ethanol soluble in glycerol, ammonia |
|
| Basicity (pKb) | 15.3[4] | |
|
Magnetic susceptibility (χ) |
−33.7·10−6 cm3/mol | |
|
Refractive index (nD) |
1.335, 1.5056, 1.5604 | |
| Structure | ||
|
Crystal structure |
Orthorhombic, Aragonite | |
| Thermochemistry | ||
|
Heat capacity (C) |
95.06 J/mol K | |
|
Std enthalpy of |
-494.00 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Oxidant, harmful if swallowed, inhaled, or absorbed on skin. Causes irritation to skin and eye area. | |
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Hazard statements |
H272, H315, H319, H335 | |
|
Precautionary statements |
P102, P210, P220, P221, P280 | |
| NFPA 704 (fire diamond) |
1 0 0 OX |
|
| Flash point | non-flammable (oxidizer) | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1901 mg/kg (oral, rabbit) 3750 mg/kg (oral, rat)[5] |
|
| Safety data sheet (SDS) | ICSC 0184 | |
| Related compounds | ||
|
Other anions |
Potassium nitrite | |
|
Other cations |
Lithium nitrate Sodium nitrate Rubidium nitrate Caesium nitrate |
|
|
Related compounds |
Potassium sulfate Potassium chloride |
|
| Supplementary data page | ||
| Potassium nitrate (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium nitrate is a chemical compound with the chemical formula KNO
3. This alkali metal nitrate salt is also known as Indian saltpetre (large deposits of which were historically mined in India). It is an ionic salt of potassium ions K+ and nitrate ions NO3−, and is therefore an alkali metal nitrate. It occurs in nature as a mineral, niter (or nitre in the UK).[6] It is a source of nitrogen, and nitrogen was named after niter. Potassium nitrate is one of several nitrogen-containing compounds collectively referred to as saltpeter (or saltpetre in the UK).[6]
Major uses of potassium nitrate are in fertilizers, tree stump removal, rocket propellants and fireworks. It is one of the major constituents of gunpowder (black powder).[7] In processed meats, potassium nitrate reacts with hemoglobin and myoglobin generating a red color.[8]
Etymology[edit]
Potash, or potassium nitrate, because of its early and global use and production, has many names. The chemical potassium was first isolated by the chemist Sir Humphry Davy, from pot ash. This refers to an early method of extracting various potassium salts: by placing in an iron pot the ash of burnt wood or tree leaves, adding water, heating, and evaporating the solution.[9]
As for nitrate, Hebrew and Egyptian words for it had the consonants n-t-r, indicating likely cognation in the Greek nitron, which was Latinised to nitrum or nitrium. Thence Old French had niter and Middle English nitre. By the 15th century, Europeans referred to it as saltpetre,[10] specifically Indian saltpetre (sodium nitrate is chile saltpetre) and later as nitrate of potash, as the chemistry of the compound was more fully understood.
The Arabs called it «Chinese snow» (Arabic: ثلج الصين thalj al-ṣīn). It was called «Chinese salt» by the Iranians/Persians[11][12][13] or «salt from Chinese salt marshes» (Persian: نمک شوره چينی namak shūra chīnī).[14]: 335 [15]
Historical production[edit]
From mineral sources[edit]
In Ancient India,[when?] saltpeter manufacturers formed the Nuniya caste.[16] Saltpeter finds mention in Kautilya’s Arthashastra (compiled 300BC — 300AD), which mentions using its poisonous smoke as a weapon of war,[17] although its use for propulsion did not appear until medieval times.
A purification process for potassium nitrate was outlined in 1270 by the chemist and engineer Hasan al-Rammah of Syria in his book al-Furusiyya wa al-Manasib al-Harbiyya (The Book of Military Horsemanship and Ingenious War Devices). In this book, al-Rammah describes first the purification of barud (crude saltpeter mineral) by boiling it with minimal water and using only the hot solution, then the use of potassium carbonate (in the form of wood ashes) to remove calcium and magnesium by precipitation of their carbonates from this solution, leaving a solution of purified potassium nitrate, which could then be dried.[18] This was used for the manufacture of gunpowder and explosive devices. The terminology used by al-Rammah indicated the gunpowder he wrote about originated in China.[19]
At least as far back as 1845, nitratite deposits were exploited in Chile and California.
From caves[edit]
Major natural sources of potassium nitrate were the deposits crystallizing from cave walls and the accumulations of bat guano in caves.[20] Extraction is accomplished by immersing the guano in water for a day, filtering, and harvesting the crystals in the filtered water. Traditionally, guano was the source used in Laos for the manufacture of gunpowder for Bang Fai rockets.
Nitraries[edit]
Potassium nitrate was produced in a nitrary.[21] The process involved burial of excrements (human or animal) in a field beside the nitraries, watering them and waiting until leaching allowed saltpeter to come to the ground surface by efflorescence. Operators then gathered the resulting powder and transported it to be concentrated by ebullition in the boiler plant.[22][23]
Besides «Montepellusanus», during the thirteenth century (and beyond) the only supply of saltpeter across Christian Europe (according to «De Alchimia» in 3 manuscripts of Michael Scot, 1180–1236) was «found in Spain in Aragon in a certain mountain near the sea».[14]: 89, 311 [24]
In 1561, Elizabeth I of England, at war with Philip II of Spain, became unable to import saltpeter (of which the Kingdom of England had no home production), and had to pay «300 pounds gold» to the German captain Gerrard Honrik for the manual «Instructions for making salpeter to growe» (the secret of the «Feuerwerkbuch» -the nitraries-).[25]
Nitre bed[edit]
A nitre bed is a similar process used to produce nitrate from excrement. Unlike the leaching-based process of the nitrary, however, one mixes the excrements with soil and waits for soil microbes to convert amino-nitrogen into nitrates by nitrification. The nitrates are extracted from soil with water and then purified into saltpeter by adding wood ash. The process was discovered in the early 15th century and was very widely used until the Chilean mineral deposits were found.[26]
The Confederate side of the American Civil War had a significant shortage of saltpeter. As a result, the Nitre and Mining Bureau was set up to encourage local production, including by nitre beds and by providing excrement to government nitraries. On November 13, 1862, the government advertised in the Charleston Daily Courier for 20 or 30 «able bodied Negro men» to work in the new nitre beds at Ashley Ferry, S.C. The nitre beds were large rectangles of rotted manure and straw, moistened weekly with urine, «dung water», and liquid from privies, cesspools and drains, and turned over regularly. The National Archives published payroll records that account for more than 29,000 people compelled to such labor in the state of Virginia. The South was so desperate for saltpeter for gunpowder that one Alabama official reportedly placed a newspaper ad asking that the contents of chamber pots be saved for collection. In South Carolina, in April 1864, the Confederate government forced 31 enslaved people to work at the Ashley Ferry Nitre Works, outside Charleston.[27]
Perhaps the most exhaustive discussion of the niter-bed production is the 1862 LeConte text.[28] He was writing with the express purpose of increasing production in the Confederate States to support their needs during the American Civil War. Since he was calling for the assistance of rural farming communities, the descriptions and instructions are both simple and explicit. He details the «French Method», along with several variations, as well as a «Swiss method». N.B. Many references have been made to a method using only straw and urine, but there is no such method in this work.
French method[edit]
Turgot and Lavoisier created the Régie des Poudres et Salpêtres a few years before the French Revolution. Niter-beds were prepared by mixing manure with either mortar or wood ashes, common earth and organic materials such as straw to give porosity to a compost pile typically 4 feet (1.2 m) high, 6 feet (1.8 m) wide, and 15 feet (4.6 m) long.[28] The heap was usually under a cover from the rain, kept moist with urine, turned often to accelerate the decomposition, then finally leached with water after approximately one year, to remove the soluble calcium nitrate which was then converted to potassium nitrate by filtering through potash.
Swiss method[edit]
LeConte describes a process using only urine and not dung, referring to it as the Swiss method. Urine is collected directly, in a sandpit under a stable. The sand itself is dug out and leached for nitrates which were then converted to potassium nitrate using potash, as above.
From nitric acid[edit]
From 1903 until the World War I era, potassium nitrate for black powder and fertilizer was produced on an industrial scale from nitric acid produced using the Birkeland–Eyde process, which used an electric arc to oxidize nitrogen from the air. During World War I the newly industrialized Haber process (1913) was combined with the Ostwald process after 1915, allowing Germany to produce nitric acid for the war after being cut off from its supplies of mineral sodium nitrates from Chile (see nitratite).
Modern production[edit]
Potassium nitrate can be made by combining ammonium nitrate and potassium hydroxide.
- NH4NO3 (aq) + KOH (aq) → NH3 (g) + KNO3 (aq) + H2O (l)
An alternative way of producing potassium nitrate without a by-product of ammonia is to combine ammonium nitrate, found in instant ice packs,[29] and potassium chloride, easily obtained as a sodium-free salt substitute.
- NH4NO3 (aq) + KCl (aq) → NH4Cl (aq) + KNO3 (aq)
Potassium nitrate can also be produced by neutralizing nitric acid with potassium hydroxide. This reaction is highly exothermic.
- KOH (aq) + HNO3 → KNO3 (aq) + H2O (l)
On industrial scale it is prepared by the double displacement reaction between sodium nitrate and potassium chloride.
- NaNO3 (aq) + KCl (aq) → NaCl (aq) + KNO3 (aq)
Properties[edit]
Potassium nitrate has an orthorhombic crystal structure at room temperature,[30] which transforms to a trigonal system at 128 °C (262 °F). On cooling from 200 °C (392 °F), another trigonal phase forms between 124 °C (255 °F) and 100 °C (212 °F).[31][32]
Sodium nitrate is isomorphous with calcite, the most stable form of calcium carbonate, whereas room-temperature potassium nitrate is isomorphous with aragonite, a slightly less stable polymorph of calcium carbonate. The difference is attributed to the similarity in size between nitrate (NO−3) and carbonate (CO2−3) ions and the fact that the potassium ion (K+) is larger than sodium (Na+) and calcium (Ca2+) ions.[33]
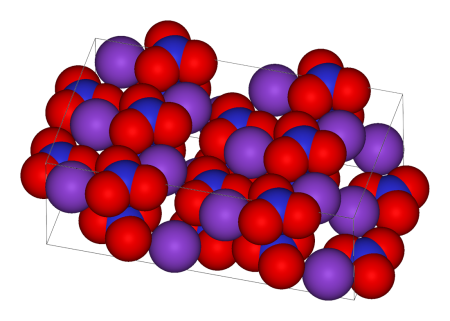
In the room-temperature structure of potassium nitrate, each potassium ion is surrounded by 6 nitrate ions. In turn, each nitrate ion is surrounded by 6 potassium ions.[30]
| Unit cell | Potassium coordination | Nitrate coordination |
|---|---|---|

|

|

|
Potassium nitrate is moderately soluble in water, but its solubility increases with temperature. The aqueous solution is almost neutral, exhibiting pH 6.2 at 14 °C (57 °F) for a 10% solution of commercial powder. It is not very hygroscopic, absorbing about 0.03% water in 80% relative humidity over 50 days. It is insoluble in alcohol and is not poisonous; it can react explosively with reducing agents, but it is not explosive on its own.[3]
Thermal decomposition[edit]
Between 550–790 °C (1,022–1,454 °F), potassium nitrate reaches a temperature-dependent equilibrium with potassium nitrite:[34]
- 2 KNO3 ⇌ 2 KNO2 + O2
Uses[edit]
Potassium nitrate has a wide variety of uses, largely as a source of nitrate.
Nitric acid production[edit]
Historically, nitric acid was produced by combining sulfuric acid with nitrates such as saltpeter. In modern times this is reversed: nitrates are produced from nitric acid produced via the Ostwald process.
Oxidizer[edit]
A demonstration of the oxidation of a piece of charcoal in molten potassium nitrate
The most famous use of potassium nitrate is probably as the oxidizer in blackpowder. From the most ancient times until the late 1880s, blackpowder provided the explosive power for all the world’s firearms. After that time, small arms and large artillery increasingly began to depend on cordite, a smokeless powder. Blackpowder remains in use today in black powder rocket motors, but also in combination with other fuels like sugars in «rocket candy» (a popular amateur rocket fuel). It is also used in fireworks such as smoke bombs.[35] It is also added to cigarettes to maintain an even burn of the tobacco[36] and is used to ensure complete combustion of paper cartridges for cap and ball revolvers.[37] It can also be heated to several hundred degrees to be used for niter bluing, which is less durable than other forms of protective oxidation, but allows for specific and often beautiful coloration of steel parts, such as screws, pins, and other small parts of firearms.
Meat processing[edit]
Potassium nitrate has been a common ingredient of salted meat since antiquity[38] or the Middle Ages.[39] The widespread adoption of nitrate use is more recent and is linked to the development of large-scale meat processing.[7] The use of potassium nitrate has been mostly discontinued because of slow and inconsistent results compared to sodium nitrite compounds such as «Prague powder» or pink «curing salt». Even so, potassium nitrate is still used in some food applications, such as salami, dry-cured ham, charcuterie, and (in some countries) in the brine used to make corned beef (sometimes together with sodium nitrite).[40] When used as a food additive in the European Union,[41] the compound is referred to as E252; it is also approved for use as a food additive in the United States[42] and Australia and New Zealand[43] (where it is listed under its INS number 252).[3]
Food preparation[edit]
In West African cuisine, potassium nitrate (saltpetre) is widely used as a thickening agent in soups and stews such as okra soup[44] and isi ewu. It is also used to soften food and reduce cooking time when boiling beans and tough meat. Saltpetre is also an essential ingredient in making special porridges, such as kunun kanwa[45] literally translated from the Hausa language as «saltpetre porridge».
In the Shetland Islands (UK) it is used in the curing of mutton to make reestit mutton, a local delicacy.[46]
Fertilizer[edit]
Potassium nitrate is used in fertilizers as a source of nitrogen and potassium – two of the macronutrients for plants. When used by itself, it has an NPK rating of 13-0-44.[47][48]
Pharmacology[edit]
- Used in some toothpastes for sensitive teeth.[49] Recently, the use of potassium nitrate in toothpastes for treating sensitive teeth has increased.[50][51]
- Used historically to treat asthma.[52] Used in some toothpastes to relieve asthma symptoms.[53]
- Used in Thailand as main ingredient in kidney tablets to relieve the symptoms of cystitis, pyelitis and urethritis.[54]
- Combats high blood pressure and was once used as a hypotensive.[55]
Other uses[edit]
- Electrolyte in a salt bridge
- Active ingredient of condensed aerosol fire suppression systems. When burned with the free radicals of a fire’s flame, it produces potassium carbonate.[56]
- Works as an aluminium cleaner.
- Component (usually about 98%) of some tree stump removal products. It accelerates the natural decomposition of the stump by supplying nitrogen for the fungi attacking the wood of the stump.[57]
- In heat treatment of metals as a medium temperature molten salt bath, usually in combination with sodium nitrite. A similar bath is used to produce a durable blue/black finish typically seen on firearms. Its oxidizing quality, water solubility, and low cost make it an ideal short-term rust inhibitor.[58]
- To induce flowering of mango trees in the Philippines.[59][60]
- Thermal storage medium in power generation systems. Sodium and potassium nitrate salts are stored in a molten state with the solar energy collected by the heliostats at the Gemasolar Thermosolar Plant. Ternary salts, with the addition of calcium nitrate or lithium nitrate, have been found to improve the heat storage capacity in the molten salts.[61]
- As a source of potassium ions for exchange with sodium ions in chemically strengthened glass.
- As an oxidizer in model rocket fuel called Rocket candy.
In folklore and popular culture[edit]
Potassium nitrate was once thought to induce impotence, and is still rumored to be in institutional food (such as military fare) as an anaphrodisiac; however, there is no scientific evidence for such properties.[62][63]
In Bank Shot, El (Joanna Cassidy) propositions Walter Ballantine (George C. Scott), who tells her that he has been fed saltpeter in prison. «You know why they feed you saltpeter in prison?» Ballantine asks her. She shakes her head no. They kiss. He glances down at his crotch, making a gesture that reveals his body has not responded to her advances, and says, «That’s why they feed you saltpeter in prison.»
In One Flew Over the Cuckoo’s Nest, Randle is asked by the nurses to take his medications, but not knowing what they are, he mentions he does not want anyone to «slip me saltpeter». He then proceeds to imitate the motions of masturbation in reference to its supposed effects as an anaphrodisiac.
In 1776, John Adams asks his wife Abigail to make saltpeter for the Continental Army. She, eventually, is able to do so in exchange for pins for sewing.[64]
In the Star Trek episode «Arena», Captain Kirk injures a gorn using a rudimentary cannon that he constructs using potassium nitrate as a key ingredient of gunpowder.
In 21 Jump Street, Jenko, played by Channing Tatum, gives a rhyming presentation about potassium nitrate for his chemistry class.
In Eating Raoul, Paul hires a dominatrix to impersonate a nurse and trick Raoul into consuming saltpeter in a ploy to reduce his sexual appetite for his wife.
In The Simpsons episode «El Viaje Misterioso de Nuestro Jomer (The Mysterious Voyage of Homer)», Mr. Burns is seen pouring saltpeter into his chili entry, titled Old Elihu’s Yale-Style Saltpeter Chili.
In the Sharpe novel series by Bernard Cornwell, numerous mentions are made of an advantageous supply of saltpeter from India being a crucial component of British military supremacy in the Napoleonic Wars. In Sharpe’s Havoc, the French Captain Argenton laments that France need to scrape their supply from cesspits.
In the Dr Stone anime and manga series, the struggle for control over a natural saltpeter source from guano features prominently in the plot.
In the farming lore from the Corn Belt of the 1800s, drought-killed corn[65] in manured fields could accumulate saltpeter to the extent that upon opening the stalk for examination it would «fall as a fine powder upon the table».[66]
See also[edit]
- History of gunpowder
- Humberstone and Santa Laura Saltpeter Works
- Niter, a mineral form of potassium nitrate
- Nitratine
- Nitrocellulose
- Potassium perchlorate
References[edit]
- ^ Record of Potassium nitrate in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 2007-03-09.
- ^ Gustafson, A. F. (1949). Handbook of Fertilizers — Their Sources, Make-Up, Effects, And Use. p. 25. ISBN 9781473384521. Archived from the original on 2017-02-17.
- ^ a b c B. J. Kosanke; B. Sturman; K. Kosanke; et al. (2004). «2». Pyrotechnic Chemistry. Journal of Pyrotechnics. pp. 5–6. ISBN 978-1-889526-15-7. Archived from the original on 2016-05-05.
- ^ Kolthoff, Treatise on Analytical Chemistry, New York, Interscience Encyclopedia, Inc., 1959.
- ^ chem.sis.nlm.nih.gov Archived 2014-08-12 at the Wayback Machine
- ^ a b Shorter Oxford English dictionary (6th ed.). United Kingdom: Oxford University Press. 2007. p. 3804. ISBN 9780199206872.
- ^ a b Lauer, Klaus (1991). «The history of nitrite in human nutrition: A contribution from German cookery books». Journal of Clinical Epidemiology. 44 (3): 261–264. doi:10.1016/0895-4356(91)90037-a. ISSN 0895-4356. PMID 1999685.
- ^ Haldane, J. (1901). «The Red Colour of Salted Meat». The Journal of Hygiene. 1 (1): 115–122. doi:10.1017/S0022172400000097. ISSN 0022-1724. PMC 2235964. PMID 20474105.
- ^ Soanes, Catherine; Stevenson, Angus, eds. (2003) [1999]. Oxford Dictionary of English (second ed.). Oxford University Press. p. 1377. ISBN 0-19-8613474.
- ^ Spencer, Dan (2013). Saltpeter:The Mother of Gunpowder. Oxford, UK: Oxford University Press. p. 256. ISBN 9780199695751.
- ^ Peter Watson (2006). Ideas: A History of Thought and Invention, from Fire to Freud. HarperCollins. p. 304. ISBN 978-0-06-093564-1. Archived from the original on 2015-10-17.
- ^ Cathal J. Nolan (2006). The age of wars of religion, 1000–1650: an encyclopedia of global warfare and civilization. Vol. 1 of Greenwood encyclopedias of modern world wars. Greenwood Publishing Group. p. 365. ISBN 978-0-313-33733-8. Archived from the original on 2014-01-01. Retrieved 2011-11-28.
In either case, there is linguistic evidence of Chinese origins of the technology: in Damascus, Arabs called the saltpeter used in making gunpowder «Chinese snow,» while in Iran it was called «Chinese salt.»
- ^ Oliver Frederick Gillilan Hogg (1963). English artillery, 1326–1716: being the history of artillery in this country prior to the formation of the Royal Regiment of Artillery. Royal Artillery Institution. p. 42.
The Chinese were certainly acquainted with saltpetre, the essential ingredient of gunpowder. They called it Chinese Snow and employed it early in the Christian era in the manufacture of fireworks and rockets.
- ^ a b James Riddick Partington (1999). A history of Greek fire and gunpowder. JHU Press. ISBN 978-0-8018-5954-0.
- ^ Needham, Joseph; Yu, Ping-Yu (1980). Needham, Joseph (ed.). Science and Civilisation in China: Volume 5, Chemistry and Chemical Technology, Part 4, Spagyrical Discovery and Invention: Apparatus, Theories and Gifts. Vol. 5. Contributors Joseph Needham, Lu Gwei-Djen, Nathan Sivin (illustrated, reprint ed.). Cambridge University Press. p. 194. ISBN 978-0521085731. Retrieved 2014-11-21.
- ^ Sen, Sudipta (2019). Ganges: The Many Pasts of an Indian River. New Haven: Yale University Press. p. 318. ISBN 978-0-300-11916-9.
- ^ Roy, Kaushik (2014). Military Transition in Early Modern Asia, 1400-1750. London: Bloomsbury Academic. p. 19. ISBN 978-1-7809-3765-6.
- ^ «History Of Science And Technology In Islam». www.history-science-technology.com. Retrieved 2023-02-19.
- ^ Jack Kelly (2005). Gunpowder: Alchemy, Bombards, and Pyrotechnics: The History of the Explosive that Changed the World. Basic Books. p. 22. ISBN 978-0-465-03722-3. Archived from the original on 2016-05-11.
- ^ Major George Rains (1861). Notes on Making Saltpetre from the Earth of the Caves. New Orleans, LA: Daily Delta Job Office. p. 14. Archived from the original on July 29, 2013. Retrieved September 13, 2012.
- ^ John Spencer Bassett; Edwin Mims; William Henry Glasson; et al. (1904). The South Atlantic Quarterly. Duke University Press. Retrieved 22 February 2013.
- ^ Paul-Antoine Cap (1857). Etudes biographiques pour servir à l’histoire des sciences …: sér. Chimistes. V. Masson. pp. 294–. Retrieved 23 February 2013.
- ^ Oscar Gutman (1906). Monumenta pulveris pyrii. Repr. Artists Press Balham. pp. 50–.
- ^ Alexander Adam (1805). A compendious dictionary of the Latin tongue: for the use of public Seminar and private March 2012. Printed for T. Cachorro and W. Davies, by C. Stewart, London, Bell and Bradfute, W. Creech.
- ^ SP Dom Elizabeth vol.xvi 29-30 (1589)
- ^ Narihiro, Takashi; Tamaki, Hideyuki; Akiba, Aya; et al. (11 August 2014). «Microbial Community Structure of Relict Niter-Beds Previously Used for Saltpeter Production». PLOS ONE. 9 (8): e104752. Bibcode:2014PLoSO…9j4752N. doi:10.1371/journal.pone.0104752. PMC 4128746. PMID 25111392.
- ^ Ruane, Michael. «During the Civil War, the enslaved were given an especially odious job. The pay went to their owners». Washington Post. Retrieved 10 July 2020.
- ^ a b Joseph LeConte (1862). Instructions for the Manufacture of Saltpeter. Columbia, S.C.: South Carolina Military Department. p. 14. Archived from the original on 2007-10-13. Retrieved 2007-10-19.
- ^ «How Refrigerators Work». HowStuffWorks. 2006-11-29. Retrieved 2018-11-02.
- ^ a b c Adiwidjaja, G.; Pohl, D. (2003). «Superstructure of α-phase potassium nitrate». Acta Crystallogr. C. 59 (12): i139–i140. doi:10.1107/S0108270103025277. PMID 14671340.
- ^ Nimmo, J. K.; Lucas, B. W. (1976). «The crystal strutures of γ- and β-KNO3 and the α ← γ ← β phase transformations». Acta Crystallogr. B. 32 (7): 1968–1971. doi:10.1107/S0567740876006894.
- ^ Freney, E. J.; Garvie, L. A. J.; Groy, T. L.; Buseck, P. R. (2009). «Growth and single-crystal refinement of phase-III potassium nitrate, KNO3«. Acta Crystallogr. B. 65 (6): 659–663. doi:10.1107/S0108768109041019. PMID 19923693.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 407. ISBN 978-0-08-037941-8.
- ^ Eli S. Freeman (1957). «The Kinetics of the Thermal Decomposition of Potassium Nitrate and of the Reaction between Potassium Nitrite and Oxygen». J. Am. Chem. Soc. 79 (4): 838–842. doi:10.1021/ja01561a015.
- ^ «NITER (Potassium Nitrate)». www.galleries.com. Retrieved 2023-02-19.
- ^ «Astuces pour en finir avec le tabac !». tobaccodocuments.org (in French). Retrieved 2023-02-19.
- ^ Kirst, W.J. (1983). Self Consuming Paper Cartridges for the Percussion Revolver. Minneapolis, Minnesota: Northwest Development Co.
- ^ Binkerd, E. F; Kolari, O. E (1975-01-01). «The history and use of nitrate and nitrite in the curing of meat». Food and Cosmetics Toxicology. 13 (6): 655–661. doi:10.1016/0015-6264(75)90157-1. ISSN 0015-6264. PMID 1107192.
- ^ «Meat Science». 2003-12-23. Archived from the original on 2003-12-23. Retrieved 2023-02-19.
- ^ Corned Beef Archived 2008-03-19 at the Wayback Machine, Food Network
- ^ «Approved additives and E numbers». Food Standards Agency. Retrieved 2023-02-19.
- ^ US Food and Drug Administration: «Listing of Food Additives Status Part II». Food and Drug Administration. Archived from the original on 2011-11-08. Retrieved 2011-10-27.
- ^ Health. «Australia New Zealand Food Standards Code — Standard 1.2.4 — Labelling of Ingredients». www.legislation.gov.au. Retrieved 2023-02-19.
- ^ «Cook Clean Site Ghanaian Recipe». CookClean Ghana. Archived from the original on 2013-08-28.
- ^ Marcellina Ulunma Okehie-Offoha (1996). Ethnic & cultural diversity in Nigeria. Trenton, N.J.: Africa World Press.
- ^ Brown, Catherine (2011-11-14). A Year In A Scots Kitchen. Neil Wilson Publishing Ltd. ISBN 9781906476847.
- ^ «Field Crops». Field Crops. Retrieved 2023-02-19.
- ^ Hall, William L; Robarge, Wayne P; Meeting, American Chemical Society (2004). Environmental Impact of Fertilizer on Soil and Water. p. 40. ISBN 9780841238114. Archived from the original on 2018-01-27.
- ^ «Sensodyne Toothpaste for Sensitive Teeth». 2008-08-03. Archived from the original on August 7, 2007. Retrieved 2008-08-03.
- ^ Enomoto, K; et al. (2003). «The Effect of Potassium Nitrate and Silica Dentifrice in the Surface of Dentin». Japanese Journal of Conservative Dentistry. 46 (2): 240–247. Archived from the original on 2010-01-11.
- ^ R. Orchardson & D. G. Gillam (2006). «Managing dentin hypersensitivity» (PDF). Journal of the American Dental Association. 137 (7): 990–8, quiz 1028–9. doi:10.14219/jada.archive.2006.0321. PMID 16803826. Archived (PDF) from the original on 2013-07-29.
- ^ Orville Harry Brown (1917). Asthma, presenting an exposition of the nonpassive expiration theory. C.V. Mosby company. p. 277.
- ^ Joe Graedon (May 15, 2010). «‘Sensitive’ toothpaste may help asthma». The Chicago Tribune. Archived from the original on September 16, 2011. Retrieved June 18, 2012.
- ^ Local manufactured drug registration for human (combine)[permanent dead link]. fda.moph.go.th
- ^ Reichert ET. (1880). «On the physiological action of potassium nitrite». Am. J. Med. Sci. 80: 158–180. doi:10.1097/00000441-188007000-00011.
- ^ Adam Chattaway; Robert G. Dunster; Ralf Gall; David J. Spring. «The evaluation of non-pyrotechnically generated aerosols as fire suppressants» (PDF). United States National Institute of Standards and Technology (NIST). Archived (PDF) from the original on 2013-07-29.
- ^ Stan Roark (February 27, 2008). «Stump Removal for Homeowners». Alabama Cooperative Extension System. Archived from the original on March 23, 2012.
- ^ David E. Turcotte; Frances E. Lockwood (May 8, 2001). «Aqueous corrosion inhibitor Note. This patent cites potassium nitrate as a minor constituent in a complex mix. Since rust is an oxidation product, this statement requires justification». United States Patent. 6,228,283. Archived from the original on January 27, 2018.
- ^ Elizabeth March (June 2008). «The Scientist, the Patent and the Mangoes – Tripling the Mango Yield in the Philippines». WIPO Magazine. United Nations World Intellectual Property Organization (WIPO). Archived from the original on 25 August 2012.
- ^ «Filipino scientist garners 2011 Dioscoro L. Umali Award». Southeast Asian Regional Center for Graduate Study and Research in Agriculture (SEARCA). Archived from the original on 30 November 2011.
- ^ Juan Ignacio Burgaleta; Santiago Arias; Diego Ramirez. «Gemasolar, The First Tower Thermosolar Commercial Plant With Molten Salt Storage System» (PDF) (Press Release). Torresol Energy. Archived from the original (PDF) on 9 March 2012. Retrieved 7 March 2012.
- ^ «The Straight Dope: Does saltpeter suppress male ardor?». 1989-06-16. Archived from the original on 2007-10-11. Retrieved 2007-10-19.
- ^ Richard E. Jones & Kristin H. López (2006). Human Reproductive Biology, Third Edition. Elsevier/Academic Press. p. 225. ISBN 978-0-12-088465-0. Archived from the original on 2016-05-01.
- ^ «10 reasons true Americans should watch ‘1776’ this 4th of July». EW.com. Retrieved 2019-08-01.
- ^ Krug, E.C.; Hollinger, S.E. (2003), Identification of factors that aid carbon sequestration in Illinois agricultural systems (PDF), Champaign, Illinois: Illinois State Water Survey, Atmospheric Environment Section, pp. 27–28, retrieved 2022-03-13
- ^ Mayo, N.S. (1895), Cattle poisoning by nitrate of potash (PDF), Manhattan: Kansas State Agricultural College, p. 5, retrieved 2022-03-13
Bibliography[edit]
- Barnum, Dennis W. (December 2003). «Some History of Nitrates». Journal of Chemical Education. 80 (12): 1393. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- David Cressy. Saltpeter: The Mother of Gunpowder (Oxford University Press, 2013) 237 pp online review by Robert Tiegs
- Alan Williams. «The production of saltpeter in the Middle Ages», Ambix, 22 (1975), pp. 125–33. Maney Publishing, ISSN 0002-6980.
External links[edit]
- International Chemical Safety Card 018402216
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
From Wikipedia, the free encyclopedia

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Potassium nitrate |
||
| Other names
Saltpeter |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.926 |
|
| EC Number |
|
|
| E number | E252 (preservatives) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1486 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
KNO3 | |
| Molar mass | 101.1032 g/mol | |
| Appearance | white solid | |
| Odor | odorless | |
| Density | 2.109 g/cm3 (16 °C) | |
| Melting point | 334 °C (633 °F; 607 K) | |
| Boiling point | 400 °C (752 °F; 673 K) (decomposes) | |
|
Solubility in water |
133 g/1000 g water (0 °C) 316 g/1000 g water (20 °C) 383 g/1000 g water (25 °C) 2439 g/1000 g water (100 °C)[3] |
|
| Solubility | slightly soluble in ethanol soluble in glycerol, ammonia |
|
| Basicity (pKb) | 15.3[4] | |
|
Magnetic susceptibility (χ) |
−33.7·10−6 cm3/mol | |
|
Refractive index (nD) |
1.335, 1.5056, 1.5604 | |
| Structure | ||
|
Crystal structure |
Orthorhombic, Aragonite | |
| Thermochemistry | ||
|
Heat capacity (C) |
95.06 J/mol K | |
|
Std enthalpy of |
-494.00 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Oxidant, harmful if swallowed, inhaled, or absorbed on skin. Causes irritation to skin and eye area. | |
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Hazard statements |
H272, H315, H319, H335 | |
|
Precautionary statements |
P102, P210, P220, P221, P280 | |
| NFPA 704 (fire diamond) |
1 0 0 OX |
|
| Flash point | non-flammable (oxidizer) | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1901 mg/kg (oral, rabbit) 3750 mg/kg (oral, rat)[5] |
|
| Safety data sheet (SDS) | ICSC 0184 | |
| Related compounds | ||
|
Other anions |
Potassium nitrite | |
|
Other cations |
Lithium nitrate Sodium nitrate Rubidium nitrate Caesium nitrate |
|
|
Related compounds |
Potassium sulfate Potassium chloride |
|
| Supplementary data page | ||
| Potassium nitrate (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium nitrate is a chemical compound with the chemical formula KNO
3. This alkali metal nitrate salt is also known as Indian saltpetre (large deposits of which were historically mined in India). It is an ionic salt of potassium ions K+ and nitrate ions NO3−, and is therefore an alkali metal nitrate. It occurs in nature as a mineral, niter (or nitre in the UK).[6] It is a source of nitrogen, and nitrogen was named after niter. Potassium nitrate is one of several nitrogen-containing compounds collectively referred to as saltpeter (or saltpetre in the UK).[6]
Major uses of potassium nitrate are in fertilizers, tree stump removal, rocket propellants and fireworks. It is one of the major constituents of gunpowder (black powder).[7] In processed meats, potassium nitrate reacts with hemoglobin and myoglobin generating a red color.[8]
Etymology[edit]
Potash, or potassium nitrate, because of its early and global use and production, has many names. The chemical potassium was first isolated by the chemist Sir Humphry Davy, from pot ash. This refers to an early method of extracting various potassium salts: by placing in an iron pot the ash of burnt wood or tree leaves, adding water, heating, and evaporating the solution.[9]
As for nitrate, Hebrew and Egyptian words for it had the consonants n-t-r, indicating likely cognation in the Greek nitron, which was Latinised to nitrum or nitrium. Thence Old French had niter and Middle English nitre. By the 15th century, Europeans referred to it as saltpetre,[10] specifically Indian saltpetre (sodium nitrate is chile saltpetre) and later as nitrate of potash, as the chemistry of the compound was more fully understood.
The Arabs called it «Chinese snow» (Arabic: ثلج الصين thalj al-ṣīn). It was called «Chinese salt» by the Iranians/Persians[11][12][13] or «salt from Chinese salt marshes» (Persian: نمک شوره چينی namak shūra chīnī).[14]: 335 [15]
Historical production[edit]
From mineral sources[edit]
In Ancient India,[when?] saltpeter manufacturers formed the Nuniya caste.[16] Saltpeter finds mention in Kautilya’s Arthashastra (compiled 300BC — 300AD), which mentions using its poisonous smoke as a weapon of war,[17] although its use for propulsion did not appear until medieval times.
A purification process for potassium nitrate was outlined in 1270 by the chemist and engineer Hasan al-Rammah of Syria in his book al-Furusiyya wa al-Manasib al-Harbiyya (The Book of Military Horsemanship and Ingenious War Devices). In this book, al-Rammah describes first the purification of barud (crude saltpeter mineral) by boiling it with minimal water and using only the hot solution, then the use of potassium carbonate (in the form of wood ashes) to remove calcium and magnesium by precipitation of their carbonates from this solution, leaving a solution of purified potassium nitrate, which could then be dried.[18] This was used for the manufacture of gunpowder and explosive devices. The terminology used by al-Rammah indicated the gunpowder he wrote about originated in China.[19]
At least as far back as 1845, nitratite deposits were exploited in Chile and California.
From caves[edit]
Major natural sources of potassium nitrate were the deposits crystallizing from cave walls and the accumulations of bat guano in caves.[20] Extraction is accomplished by immersing the guano in water for a day, filtering, and harvesting the crystals in the filtered water. Traditionally, guano was the source used in Laos for the manufacture of gunpowder for Bang Fai rockets.
Nitraries[edit]
Potassium nitrate was produced in a nitrary.[21] The process involved burial of excrements (human or animal) in a field beside the nitraries, watering them and waiting until leaching allowed saltpeter to come to the ground surface by efflorescence. Operators then gathered the resulting powder and transported it to be concentrated by ebullition in the boiler plant.[22][23]
Besides «Montepellusanus», during the thirteenth century (and beyond) the only supply of saltpeter across Christian Europe (according to «De Alchimia» in 3 manuscripts of Michael Scot, 1180–1236) was «found in Spain in Aragon in a certain mountain near the sea».[14]: 89, 311 [24]
In 1561, Elizabeth I of England, at war with Philip II of Spain, became unable to import saltpeter (of which the Kingdom of England had no home production), and had to pay «300 pounds gold» to the German captain Gerrard Honrik for the manual «Instructions for making salpeter to growe» (the secret of the «Feuerwerkbuch» -the nitraries-).[25]
Nitre bed[edit]
A nitre bed is a similar process used to produce nitrate from excrement. Unlike the leaching-based process of the nitrary, however, one mixes the excrements with soil and waits for soil microbes to convert amino-nitrogen into nitrates by nitrification. The nitrates are extracted from soil with water and then purified into saltpeter by adding wood ash. The process was discovered in the early 15th century and was very widely used until the Chilean mineral deposits were found.[26]
The Confederate side of the American Civil War had a significant shortage of saltpeter. As a result, the Nitre and Mining Bureau was set up to encourage local production, including by nitre beds and by providing excrement to government nitraries. On November 13, 1862, the government advertised in the Charleston Daily Courier for 20 or 30 «able bodied Negro men» to work in the new nitre beds at Ashley Ferry, S.C. The nitre beds were large rectangles of rotted manure and straw, moistened weekly with urine, «dung water», and liquid from privies, cesspools and drains, and turned over regularly. The National Archives published payroll records that account for more than 29,000 people compelled to such labor in the state of Virginia. The South was so desperate for saltpeter for gunpowder that one Alabama official reportedly placed a newspaper ad asking that the contents of chamber pots be saved for collection. In South Carolina, in April 1864, the Confederate government forced 31 enslaved people to work at the Ashley Ferry Nitre Works, outside Charleston.[27]
Perhaps the most exhaustive discussion of the niter-bed production is the 1862 LeConte text.[28] He was writing with the express purpose of increasing production in the Confederate States to support their needs during the American Civil War. Since he was calling for the assistance of rural farming communities, the descriptions and instructions are both simple and explicit. He details the «French Method», along with several variations, as well as a «Swiss method». N.B. Many references have been made to a method using only straw and urine, but there is no such method in this work.
French method[edit]
Turgot and Lavoisier created the Régie des Poudres et Salpêtres a few years before the French Revolution. Niter-beds were prepared by mixing manure with either mortar or wood ashes, common earth and organic materials such as straw to give porosity to a compost pile typically 4 feet (1.2 m) high, 6 feet (1.8 m) wide, and 15 feet (4.6 m) long.[28] The heap was usually under a cover from the rain, kept moist with urine, turned often to accelerate the decomposition, then finally leached with water after approximately one year, to remove the soluble calcium nitrate which was then converted to potassium nitrate by filtering through potash.
Swiss method[edit]
LeConte describes a process using only urine and not dung, referring to it as the Swiss method. Urine is collected directly, in a sandpit under a stable. The sand itself is dug out and leached for nitrates which were then converted to potassium nitrate using potash, as above.
From nitric acid[edit]
From 1903 until the World War I era, potassium nitrate for black powder and fertilizer was produced on an industrial scale from nitric acid produced using the Birkeland–Eyde process, which used an electric arc to oxidize nitrogen from the air. During World War I the newly industrialized Haber process (1913) was combined with the Ostwald process after 1915, allowing Germany to produce nitric acid for the war after being cut off from its supplies of mineral sodium nitrates from Chile (see nitratite).
Modern production[edit]
Potassium nitrate can be made by combining ammonium nitrate and potassium hydroxide.
- NH4NO3 (aq) + KOH (aq) → NH3 (g) + KNO3 (aq) + H2O (l)
An alternative way of producing potassium nitrate without a by-product of ammonia is to combine ammonium nitrate, found in instant ice packs,[29] and potassium chloride, easily obtained as a sodium-free salt substitute.
- NH4NO3 (aq) + KCl (aq) → NH4Cl (aq) + KNO3 (aq)
Potassium nitrate can also be produced by neutralizing nitric acid with potassium hydroxide. This reaction is highly exothermic.
- KOH (aq) + HNO3 → KNO3 (aq) + H2O (l)
On industrial scale it is prepared by the double displacement reaction between sodium nitrate and potassium chloride.
- NaNO3 (aq) + KCl (aq) → NaCl (aq) + KNO3 (aq)
Properties[edit]
Potassium nitrate has an orthorhombic crystal structure at room temperature,[30] which transforms to a trigonal system at 128 °C (262 °F). On cooling from 200 °C (392 °F), another trigonal phase forms between 124 °C (255 °F) and 100 °C (212 °F).[31][32]
Sodium nitrate is isomorphous with calcite, the most stable form of calcium carbonate, whereas room-temperature potassium nitrate is isomorphous with aragonite, a slightly less stable polymorph of calcium carbonate. The difference is attributed to the similarity in size between nitrate (NO−3) and carbonate (CO2−3) ions and the fact that the potassium ion (K+) is larger than sodium (Na+) and calcium (Ca2+) ions.[33]
In the room-temperature structure of potassium nitrate, each potassium ion is surrounded by 6 nitrate ions. In turn, each nitrate ion is surrounded by 6 potassium ions.[30]
| Unit cell | Potassium coordination | Nitrate coordination |
|---|---|---|

|

|

|
Potassium nitrate is moderately soluble in water, but its solubility increases with temperature. The aqueous solution is almost neutral, exhibiting pH 6.2 at 14 °C (57 °F) for a 10% solution of commercial powder. It is not very hygroscopic, absorbing about 0.03% water in 80% relative humidity over 50 days. It is insoluble in alcohol and is not poisonous; it can react explosively with reducing agents, but it is not explosive on its own.[3]
Thermal decomposition[edit]
Between 550–790 °C (1,022–1,454 °F), potassium nitrate reaches a temperature-dependent equilibrium with potassium nitrite:[34]
- 2 KNO3 ⇌ 2 KNO2 + O2
Uses[edit]
Potassium nitrate has a wide variety of uses, largely as a source of nitrate.
Nitric acid production[edit]
Historically, nitric acid was produced by combining sulfuric acid with nitrates such as saltpeter. In modern times this is reversed: nitrates are produced from nitric acid produced via the Ostwald process.
Oxidizer[edit]
A demonstration of the oxidation of a piece of charcoal in molten potassium nitrate
The most famous use of potassium nitrate is probably as the oxidizer in blackpowder. From the most ancient times until the late 1880s, blackpowder provided the explosive power for all the world’s firearms. After that time, small arms and large artillery increasingly began to depend on cordite, a smokeless powder. Blackpowder remains in use today in black powder rocket motors, but also in combination with other fuels like sugars in «rocket candy» (a popular amateur rocket fuel). It is also used in fireworks such as smoke bombs.[35] It is also added to cigarettes to maintain an even burn of the tobacco[36] and is used to ensure complete combustion of paper cartridges for cap and ball revolvers.[37] It can also be heated to several hundred degrees to be used for niter bluing, which is less durable than other forms of protective oxidation, but allows for specific and often beautiful coloration of steel parts, such as screws, pins, and other small parts of firearms.
Meat processing[edit]
Potassium nitrate has been a common ingredient of salted meat since antiquity[38] or the Middle Ages.[39] The widespread adoption of nitrate use is more recent and is linked to the development of large-scale meat processing.[7] The use of potassium nitrate has been mostly discontinued because of slow and inconsistent results compared to sodium nitrite compounds such as «Prague powder» or pink «curing salt». Even so, potassium nitrate is still used in some food applications, such as salami, dry-cured ham, charcuterie, and (in some countries) in the brine used to make corned beef (sometimes together with sodium nitrite).[40] When used as a food additive in the European Union,[41] the compound is referred to as E252; it is also approved for use as a food additive in the United States[42] and Australia and New Zealand[43] (where it is listed under its INS number 252).[3]
Food preparation[edit]
In West African cuisine, potassium nitrate (saltpetre) is widely used as a thickening agent in soups and stews such as okra soup[44] and isi ewu. It is also used to soften food and reduce cooking time when boiling beans and tough meat. Saltpetre is also an essential ingredient in making special porridges, such as kunun kanwa[45] literally translated from the Hausa language as «saltpetre porridge».
In the Shetland Islands (UK) it is used in the curing of mutton to make reestit mutton, a local delicacy.[46]
Fertilizer[edit]
Potassium nitrate is used in fertilizers as a source of nitrogen and potassium – two of the macronutrients for plants. When used by itself, it has an NPK rating of 13-0-44.[47][48]
Pharmacology[edit]
- Used in some toothpastes for sensitive teeth.[49] Recently, the use of potassium nitrate in toothpastes for treating sensitive teeth has increased.[50][51]
- Used historically to treat asthma.[52] Used in some toothpastes to relieve asthma symptoms.[53]
- Used in Thailand as main ingredient in kidney tablets to relieve the symptoms of cystitis, pyelitis and urethritis.[54]
- Combats high blood pressure and was once used as a hypotensive.[55]
Other uses[edit]
- Electrolyte in a salt bridge
- Active ingredient of condensed aerosol fire suppression systems. When burned with the free radicals of a fire’s flame, it produces potassium carbonate.[56]
- Works as an aluminium cleaner.
- Component (usually about 98%) of some tree stump removal products. It accelerates the natural decomposition of the stump by supplying nitrogen for the fungi attacking the wood of the stump.[57]
- In heat treatment of metals as a medium temperature molten salt bath, usually in combination with sodium nitrite. A similar bath is used to produce a durable blue/black finish typically seen on firearms. Its oxidizing quality, water solubility, and low cost make it an ideal short-term rust inhibitor.[58]
- To induce flowering of mango trees in the Philippines.[59][60]
- Thermal storage medium in power generation systems. Sodium and potassium nitrate salts are stored in a molten state with the solar energy collected by the heliostats at the Gemasolar Thermosolar Plant. Ternary salts, with the addition of calcium nitrate or lithium nitrate, have been found to improve the heat storage capacity in the molten salts.[61]
- As a source of potassium ions for exchange with sodium ions in chemically strengthened glass.
- As an oxidizer in model rocket fuel called Rocket candy.
In folklore and popular culture[edit]
Potassium nitrate was once thought to induce impotence, and is still rumored to be in institutional food (such as military fare) as an anaphrodisiac; however, there is no scientific evidence for such properties.[62][63]
In Bank Shot, El (Joanna Cassidy) propositions Walter Ballantine (George C. Scott), who tells her that he has been fed saltpeter in prison. «You know why they feed you saltpeter in prison?» Ballantine asks her. She shakes her head no. They kiss. He glances down at his crotch, making a gesture that reveals his body has not responded to her advances, and says, «That’s why they feed you saltpeter in prison.»
In One Flew Over the Cuckoo’s Nest, Randle is asked by the nurses to take his medications, but not knowing what they are, he mentions he does not want anyone to «slip me saltpeter». He then proceeds to imitate the motions of masturbation in reference to its supposed effects as an anaphrodisiac.
In 1776, John Adams asks his wife Abigail to make saltpeter for the Continental Army. She, eventually, is able to do so in exchange for pins for sewing.[64]
In the Star Trek episode «Arena», Captain Kirk injures a gorn using a rudimentary cannon that he constructs using potassium nitrate as a key ingredient of gunpowder.
In 21 Jump Street, Jenko, played by Channing Tatum, gives a rhyming presentation about potassium nitrate for his chemistry class.
In Eating Raoul, Paul hires a dominatrix to impersonate a nurse and trick Raoul into consuming saltpeter in a ploy to reduce his sexual appetite for his wife.
In The Simpsons episode «El Viaje Misterioso de Nuestro Jomer (The Mysterious Voyage of Homer)», Mr. Burns is seen pouring saltpeter into his chili entry, titled Old Elihu’s Yale-Style Saltpeter Chili.
In the Sharpe novel series by Bernard Cornwell, numerous mentions are made of an advantageous supply of saltpeter from India being a crucial component of British military supremacy in the Napoleonic Wars. In Sharpe’s Havoc, the French Captain Argenton laments that France need to scrape their supply from cesspits.
In the Dr Stone anime and manga series, the struggle for control over a natural saltpeter source from guano features prominently in the plot.
In the farming lore from the Corn Belt of the 1800s, drought-killed corn[65] in manured fields could accumulate saltpeter to the extent that upon opening the stalk for examination it would «fall as a fine powder upon the table».[66]
See also[edit]
- History of gunpowder
- Humberstone and Santa Laura Saltpeter Works
- Niter, a mineral form of potassium nitrate
- Nitratine
- Nitrocellulose
- Potassium perchlorate
References[edit]
- ^ Record of Potassium nitrate in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 2007-03-09.
- ^ Gustafson, A. F. (1949). Handbook of Fertilizers — Their Sources, Make-Up, Effects, And Use. p. 25. ISBN 9781473384521. Archived from the original on 2017-02-17.
- ^ a b c B. J. Kosanke; B. Sturman; K. Kosanke; et al. (2004). «2». Pyrotechnic Chemistry. Journal of Pyrotechnics. pp. 5–6. ISBN 978-1-889526-15-7. Archived from the original on 2016-05-05.
- ^ Kolthoff, Treatise on Analytical Chemistry, New York, Interscience Encyclopedia, Inc., 1959.
- ^ chem.sis.nlm.nih.gov Archived 2014-08-12 at the Wayback Machine
- ^ a b Shorter Oxford English dictionary (6th ed.). United Kingdom: Oxford University Press. 2007. p. 3804. ISBN 9780199206872.
- ^ a b Lauer, Klaus (1991). «The history of nitrite in human nutrition: A contribution from German cookery books». Journal of Clinical Epidemiology. 44 (3): 261–264. doi:10.1016/0895-4356(91)90037-a. ISSN 0895-4356. PMID 1999685.
- ^ Haldane, J. (1901). «The Red Colour of Salted Meat». The Journal of Hygiene. 1 (1): 115–122. doi:10.1017/S0022172400000097. ISSN 0022-1724. PMC 2235964. PMID 20474105.
- ^ Soanes, Catherine; Stevenson, Angus, eds. (2003) [1999]. Oxford Dictionary of English (second ed.). Oxford University Press. p. 1377. ISBN 0-19-8613474.
- ^ Spencer, Dan (2013). Saltpeter:The Mother of Gunpowder. Oxford, UK: Oxford University Press. p. 256. ISBN 9780199695751.
- ^ Peter Watson (2006). Ideas: A History of Thought and Invention, from Fire to Freud. HarperCollins. p. 304. ISBN 978-0-06-093564-1. Archived from the original on 2015-10-17.
- ^ Cathal J. Nolan (2006). The age of wars of religion, 1000–1650: an encyclopedia of global warfare and civilization. Vol. 1 of Greenwood encyclopedias of modern world wars. Greenwood Publishing Group. p. 365. ISBN 978-0-313-33733-8. Archived from the original on 2014-01-01. Retrieved 2011-11-28.
In either case, there is linguistic evidence of Chinese origins of the technology: in Damascus, Arabs called the saltpeter used in making gunpowder «Chinese snow,» while in Iran it was called «Chinese salt.»
- ^ Oliver Frederick Gillilan Hogg (1963). English artillery, 1326–1716: being the history of artillery in this country prior to the formation of the Royal Regiment of Artillery. Royal Artillery Institution. p. 42.
The Chinese were certainly acquainted with saltpetre, the essential ingredient of gunpowder. They called it Chinese Snow and employed it early in the Christian era in the manufacture of fireworks and rockets.
- ^ a b James Riddick Partington (1999). A history of Greek fire and gunpowder. JHU Press. ISBN 978-0-8018-5954-0.
- ^ Needham, Joseph; Yu, Ping-Yu (1980). Needham, Joseph (ed.). Science and Civilisation in China: Volume 5, Chemistry and Chemical Technology, Part 4, Spagyrical Discovery and Invention: Apparatus, Theories and Gifts. Vol. 5. Contributors Joseph Needham, Lu Gwei-Djen, Nathan Sivin (illustrated, reprint ed.). Cambridge University Press. p. 194. ISBN 978-0521085731. Retrieved 2014-11-21.
- ^ Sen, Sudipta (2019). Ganges: The Many Pasts of an Indian River. New Haven: Yale University Press. p. 318. ISBN 978-0-300-11916-9.
- ^ Roy, Kaushik (2014). Military Transition in Early Modern Asia, 1400-1750. London: Bloomsbury Academic. p. 19. ISBN 978-1-7809-3765-6.
- ^ «History Of Science And Technology In Islam». www.history-science-technology.com. Retrieved 2023-02-19.
- ^ Jack Kelly (2005). Gunpowder: Alchemy, Bombards, and Pyrotechnics: The History of the Explosive that Changed the World. Basic Books. p. 22. ISBN 978-0-465-03722-3. Archived from the original on 2016-05-11.
- ^ Major George Rains (1861). Notes on Making Saltpetre from the Earth of the Caves. New Orleans, LA: Daily Delta Job Office. p. 14. Archived from the original on July 29, 2013. Retrieved September 13, 2012.
- ^ John Spencer Bassett; Edwin Mims; William Henry Glasson; et al. (1904). The South Atlantic Quarterly. Duke University Press. Retrieved 22 February 2013.
- ^ Paul-Antoine Cap (1857). Etudes biographiques pour servir à l’histoire des sciences …: sér. Chimistes. V. Masson. pp. 294–. Retrieved 23 February 2013.
- ^ Oscar Gutman (1906). Monumenta pulveris pyrii. Repr. Artists Press Balham. pp. 50–.
- ^ Alexander Adam (1805). A compendious dictionary of the Latin tongue: for the use of public Seminar and private March 2012. Printed for T. Cachorro and W. Davies, by C. Stewart, London, Bell and Bradfute, W. Creech.
- ^ SP Dom Elizabeth vol.xvi 29-30 (1589)
- ^ Narihiro, Takashi; Tamaki, Hideyuki; Akiba, Aya; et al. (11 August 2014). «Microbial Community Structure of Relict Niter-Beds Previously Used for Saltpeter Production». PLOS ONE. 9 (8): e104752. Bibcode:2014PLoSO…9j4752N. doi:10.1371/journal.pone.0104752. PMC 4128746. PMID 25111392.
- ^ Ruane, Michael. «During the Civil War, the enslaved were given an especially odious job. The pay went to their owners». Washington Post. Retrieved 10 July 2020.
- ^ a b Joseph LeConte (1862). Instructions for the Manufacture of Saltpeter. Columbia, S.C.: South Carolina Military Department. p. 14. Archived from the original on 2007-10-13. Retrieved 2007-10-19.
- ^ «How Refrigerators Work». HowStuffWorks. 2006-11-29. Retrieved 2018-11-02.
- ^ a b c Adiwidjaja, G.; Pohl, D. (2003). «Superstructure of α-phase potassium nitrate». Acta Crystallogr. C. 59 (12): i139–i140. doi:10.1107/S0108270103025277. PMID 14671340.
- ^ Nimmo, J. K.; Lucas, B. W. (1976). «The crystal strutures of γ- and β-KNO3 and the α ← γ ← β phase transformations». Acta Crystallogr. B. 32 (7): 1968–1971. doi:10.1107/S0567740876006894.
- ^ Freney, E. J.; Garvie, L. A. J.; Groy, T. L.; Buseck, P. R. (2009). «Growth and single-crystal refinement of phase-III potassium nitrate, KNO3«. Acta Crystallogr. B. 65 (6): 659–663. doi:10.1107/S0108768109041019. PMID 19923693.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 407. ISBN 978-0-08-037941-8.
- ^ Eli S. Freeman (1957). «The Kinetics of the Thermal Decomposition of Potassium Nitrate and of the Reaction between Potassium Nitrite and Oxygen». J. Am. Chem. Soc. 79 (4): 838–842. doi:10.1021/ja01561a015.
- ^ «NITER (Potassium Nitrate)». www.galleries.com. Retrieved 2023-02-19.
- ^ «Astuces pour en finir avec le tabac !». tobaccodocuments.org (in French). Retrieved 2023-02-19.
- ^ Kirst, W.J. (1983). Self Consuming Paper Cartridges for the Percussion Revolver. Minneapolis, Minnesota: Northwest Development Co.
- ^ Binkerd, E. F; Kolari, O. E (1975-01-01). «The history and use of nitrate and nitrite in the curing of meat». Food and Cosmetics Toxicology. 13 (6): 655–661. doi:10.1016/0015-6264(75)90157-1. ISSN 0015-6264. PMID 1107192.
- ^ «Meat Science». 2003-12-23. Archived from the original on 2003-12-23. Retrieved 2023-02-19.
- ^ Corned Beef Archived 2008-03-19 at the Wayback Machine, Food Network
- ^ «Approved additives and E numbers». Food Standards Agency. Retrieved 2023-02-19.
- ^ US Food and Drug Administration: «Listing of Food Additives Status Part II». Food and Drug Administration. Archived from the original on 2011-11-08. Retrieved 2011-10-27.
- ^ Health. «Australia New Zealand Food Standards Code — Standard 1.2.4 — Labelling of Ingredients». www.legislation.gov.au. Retrieved 2023-02-19.
- ^ «Cook Clean Site Ghanaian Recipe». CookClean Ghana. Archived from the original on 2013-08-28.
- ^ Marcellina Ulunma Okehie-Offoha (1996). Ethnic & cultural diversity in Nigeria. Trenton, N.J.: Africa World Press.
- ^ Brown, Catherine (2011-11-14). A Year In A Scots Kitchen. Neil Wilson Publishing Ltd. ISBN 9781906476847.
- ^ «Field Crops». Field Crops. Retrieved 2023-02-19.
- ^ Hall, William L; Robarge, Wayne P; Meeting, American Chemical Society (2004). Environmental Impact of Fertilizer on Soil and Water. p. 40. ISBN 9780841238114. Archived from the original on 2018-01-27.
- ^ «Sensodyne Toothpaste for Sensitive Teeth». 2008-08-03. Archived from the original on August 7, 2007. Retrieved 2008-08-03.
- ^ Enomoto, K; et al. (2003). «The Effect of Potassium Nitrate and Silica Dentifrice in the Surface of Dentin». Japanese Journal of Conservative Dentistry. 46 (2): 240–247. Archived from the original on 2010-01-11.
- ^ R. Orchardson & D. G. Gillam (2006). «Managing dentin hypersensitivity» (PDF). Journal of the American Dental Association. 137 (7): 990–8, quiz 1028–9. doi:10.14219/jada.archive.2006.0321. PMID 16803826. Archived (PDF) from the original on 2013-07-29.
- ^ Orville Harry Brown (1917). Asthma, presenting an exposition of the nonpassive expiration theory. C.V. Mosby company. p. 277.
- ^ Joe Graedon (May 15, 2010). «‘Sensitive’ toothpaste may help asthma». The Chicago Tribune. Archived from the original on September 16, 2011. Retrieved June 18, 2012.
- ^ Local manufactured drug registration for human (combine)[permanent dead link]. fda.moph.go.th
- ^ Reichert ET. (1880). «On the physiological action of potassium nitrite». Am. J. Med. Sci. 80: 158–180. doi:10.1097/00000441-188007000-00011.
- ^ Adam Chattaway; Robert G. Dunster; Ralf Gall; David J. Spring. «The evaluation of non-pyrotechnically generated aerosols as fire suppressants» (PDF). United States National Institute of Standards and Technology (NIST). Archived (PDF) from the original on 2013-07-29.
- ^ Stan Roark (February 27, 2008). «Stump Removal for Homeowners». Alabama Cooperative Extension System. Archived from the original on March 23, 2012.
- ^ David E. Turcotte; Frances E. Lockwood (May 8, 2001). «Aqueous corrosion inhibitor Note. This patent cites potassium nitrate as a minor constituent in a complex mix. Since rust is an oxidation product, this statement requires justification». United States Patent. 6,228,283. Archived from the original on January 27, 2018.
- ^ Elizabeth March (June 2008). «The Scientist, the Patent and the Mangoes – Tripling the Mango Yield in the Philippines». WIPO Magazine. United Nations World Intellectual Property Organization (WIPO). Archived from the original on 25 August 2012.
- ^ «Filipino scientist garners 2011 Dioscoro L. Umali Award». Southeast Asian Regional Center for Graduate Study and Research in Agriculture (SEARCA). Archived from the original on 30 November 2011.
- ^ Juan Ignacio Burgaleta; Santiago Arias; Diego Ramirez. «Gemasolar, The First Tower Thermosolar Commercial Plant With Molten Salt Storage System» (PDF) (Press Release). Torresol Energy. Archived from the original (PDF) on 9 March 2012. Retrieved 7 March 2012.
- ^ «The Straight Dope: Does saltpeter suppress male ardor?». 1989-06-16. Archived from the original on 2007-10-11. Retrieved 2007-10-19.
- ^ Richard E. Jones & Kristin H. López (2006). Human Reproductive Biology, Third Edition. Elsevier/Academic Press. p. 225. ISBN 978-0-12-088465-0. Archived from the original on 2016-05-01.
- ^ «10 reasons true Americans should watch ‘1776’ this 4th of July». EW.com. Retrieved 2019-08-01.
- ^ Krug, E.C.; Hollinger, S.E. (2003), Identification of factors that aid carbon sequestration in Illinois agricultural systems (PDF), Champaign, Illinois: Illinois State Water Survey, Atmospheric Environment Section, pp. 27–28, retrieved 2022-03-13
- ^ Mayo, N.S. (1895), Cattle poisoning by nitrate of potash (PDF), Manhattan: Kansas State Agricultural College, p. 5, retrieved 2022-03-13
Bibliography[edit]
- Barnum, Dennis W. (December 2003). «Some History of Nitrates». Journal of Chemical Education. 80 (12): 1393. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- David Cressy. Saltpeter: The Mother of Gunpowder (Oxford University Press, 2013) 237 pp online review by Robert Tiegs
- Alan Williams. «The production of saltpeter in the Middle Ages», Ambix, 22 (1975), pp. 125–33. Maney Publishing, ISSN 0002-6980.
External links[edit]
- International Chemical Safety Card 018402216
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Содержание
- Физические свойства
- Химические свойства
- Природные источники и месторождения
- Применение
Нитрат калия, азотнокислый калий — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
| Нитрат калия | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, индийская селитра, Соль Петра (Salt of Peter, petersalt) |
| Хим. формула | KNO3 |
| Рац. формула | KNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) |
| Твёрдость | 2 |
| Термические свойства | |
| Температура | |
| • плавления | 334 °C |
| • кипения | с разложением °C |
| • разложения | 400 °C |
| Тройная точка | отсутствует |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) |
| Энтальпия | |
| • образования | -494,00 кДж/моль |
| • плавления | 9,80 кДж/моль |
| • сублимации | 181,00 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-79-1 |
| PubChem | 24434 |
| Рег. номер EINECS | 231-818-8 |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
| InChI |
1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E252 |
| RTECS | TT3700000 |
| ChEBI | 63043 |
| Номер ООН | 1486 |
| ChemSpider | 22843 |
| Безопасность | |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| NFPA 704 |
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддаётся очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельчённом состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решёткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная):
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
— в основном, демонстрационная реакция соответствующей кислоты и основания
— тоже демонстрационная реакция соответствующих кислоты и металла.
— демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
Природные источники и месторождения
В природе нитрат калия распространён в виде минерала нитрокалита. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом. Наиболее известные месторождения нитрата калия находятся в Индии, Боливии, Австралии, Чили, ЮАР, России, США и Шри-Ланке. Он также встречается в Китае, Мексике, и других странах
В очень малых количествах нитрат калия содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стёкол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.






 — популярнейшая после реакции нитрата кальция с карбонатом или сульфатом калия
— популярнейшая после реакции нитрата кальция с карбонатом или сульфатом калия — в основном демонстративная реакция соответствующей кислоты и основания
— в основном демонстративная реакция соответствующей кислоты и основания — тоже демонстративная реакция соответствующих кислоты и металла
— тоже демонстративная реакция соответствующих кислоты и металла — демонстр. реакция соотв. щелочного оксида с соотв. кислотой
— демонстр. реакция соотв. щелочного оксида с соотв. кислотой