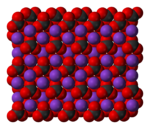
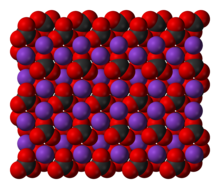
Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
4KO2 + 2CO2 = 2K2CO3 + 3O2
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
2KO2 + CO = K2CO3 + O2
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
2KOH + СO2 = K2СO3 + H2O
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
4KO2 + 3C = 2K2CO3 + CO2
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
2KHCO3 = K2CO3 + CO2 + H2O
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
KHCO3 + KOH = K2CO3 + H2O
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
K2CO3 + H2SO4 = 2K2SO4 + CO2↑ +H2O.
1. Карбонат калия может реагировать с простыми веществами:
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2↑
K2CO3 + 3Br2 = 5KBr + KBrO3 + 3CO2↑
K2CO3 + 3I2 = 5KI + KIO3 + 3CO2↑
2. Карбонат калия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
K2CO3 + H2O + CO2 ↔ 2KHCO3↓
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓
2.3. Карбонат калия способен реагировать с кислотами:
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ +H2O
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
K2CO3 + 2HClO4 = 2KClO4↓ + H2O + CO2↑
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + 3CO2↑
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой. В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
K2CO3 + 2HF = 2KF + H2O + CO2↑,
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
K2CO3 + 4HF = 2K(HF2) + H2O + CO2↑
2.5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы. При этом образуются карбонат калия и углекислый газ:
K2CO3 + SO2 = K2SO3 + CO2↑.
30 August 2012
Автор КакПросто!
При выполнении заданий по химии, которые включают в себя тестирование, решение расчетных задач, практическую работу или лабораторный опыт могут понадобиться умения и навыки при написании формул солей. Таблица растворимости, в которой указаны значения зарядов ионов металлов и кислотных остатков, а также знание принципа ее использования поможет верно написать формулы и других веществ.

Вам понадобится
- — таблица растворимости солей, кислот, оснований
Инструкция
Карбонаты – это соли, состоящие из атомов металла и кислотного остатка, который имеет один атом углерода и три атома кислорода — СO3. Соли могут быть как средними — карбонаты, так и кислыми — гидрокарбонаты. Чтобы правильно написать формулу, необходимо воспользоваться таблицей растворимости кислот, солей и оснований, являющейся справочным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Карбонат-ион имеет заряд 2-. Чтобы формула соли была написана правильно, найдите, какой заряд имеет металл, который входит в состав карбоната. В любом случае, суммарное число положительных зарядов ионов должно равняться суммарному числу отрицательных. При этом необходимо обязательно учитывать индексы, стоящие внизу справа от химического символа. Значение заряда иона и индекса, стоящего у этого же иона, перемножаются.
Пример № 1. Напишите формулу карбоната калия.
В таблице растворимости посмотрите на кислотный остаток и на металл, входящий в состав соли. Кислотный остаток — СO3 имеет заряд 2-, а ион калия имеет заряд + (считается +1, но единица не пишется).
Напишите формулу, учитывая, что металл всегда стоит на первом месте: КСO3.
Если сравнить количество зарядов, то отрицательных получилось два (2-), а положительных только один (+). Значит, в формуле должно быть 2 атома калия, которые дадут два положительных заряда (2+), так как значение заряда и индекса перемножается. Следовательно, и молекула будет электронейтральна: К2СO3. Полученная соль называется карбонат калия.
Пример № 2. Напишите формулу карбоната кальция.
Кислотный остаток тот же, то есть — СO3 с зарядом (2-). В таблице растворимости найдите металл кальций и его заряд, который равен 2+ . Напишите формулу, имеющую вид: СаСO3. В итоге получилось одинаковое количество отрицательных (2-) и положительных 2(+) зарядов. Следовательно, формула написана правильно, так как в целом она электронейтральна. Полученная соль называется карбонат кальция, она знакома как мел или известняк.
Пример № 3. Напишите формулу гидрокарбоната калия.
Гидрокарбонат-иона в таблице растворимости нет, а потому следует запомнить, что он имеет вид — НСO3 и у него заряд, равный (-). Ион калия имеет противоположный заряд (+), поэтому формула будет выглядеть таким образом:
КНСO3.
Полученное соединение называется гидрокарбонат калия, которое представляет собой кислую соль.
Источники:
- карбонат кальция формула
From Wikipedia, the free encyclopedia
|
|
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium carbonate |
|
| Other names
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood. |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K 2CO 3 |
| Molar mass | 138.205 g/mol |
| Appearance | White, hygroscopic solid |
| Density | 2.43 g/cm3 |
| Melting point | 891 °C (1,636 °F; 1,164 K) |
| Boiling point | Decomposes |
|
Solubility in water |
110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) |
| Solubility |
|
| Acidity (pKa) | 10.25 |
|
Magnetic susceptibility (χ) |
−59.0·10−6 cm3/mol |
| Thermochemistry[1] | |
|
Heat capacity (C) |
114.4 J·mol−1·K−1 |
|
Std molar |
155.5 J·mol−1·K−1 |
|
Std enthalpy of |
−1151.0 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1063.5 kJ·mol−1 |
|
Enthalpy of fusion (ΔfH⦵fus) |
27.6 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H315, H319, H335 |
|
Precautionary statements |
P261, P305+P351+P338 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[2] |
| Safety data sheet (SDS) | ICSC 1588 |
| Related compounds | |
|
Other anions |
Potassium bicarbonate |
|
Other cations |
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
|
Related compounds |
Ammonium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium carbonate is the inorganic compound with the formula K2CO3. It is a white salt, which is soluble in water and forms a strongly alkaline solution. It is deliquescent, often appearing as a damp or wet solid. Potassium carbonate is mainly used in the production of soap and glass.[3]
History[edit]
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
Production[edit]
Potassium carbonate is prepared commercially by the reaction of potassium hydroxide with carbon dioxide:[3]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O («potash hydrate»). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications[edit]
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is used in some types of Chinese noodles and mooncakes, as well as Asian grass jelly and Japanese ramen. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called «Dutching» (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References[edit]
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ Chambers, Michael. «ChemIDplus — 584-08-7 — BWHMMNNQKKPAPP-UHFFFAOYSA-L — Potassium carbonate [USP] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 2014-08-12.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ See references to «pearl ash» in «American Cookery» by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. «Advanced Practical Organic Chemistry» 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. «The American Frugal Housewife» 1832
Bibliography[edit]
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). «Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol». Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links[edit]
- International Chemical Safety Card 1588
From Wikipedia, the free encyclopedia

|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium carbonate |
|
| Other names
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood. |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K 2CO 3 |
| Molar mass | 138.205 g/mol |
| Appearance | White, hygroscopic solid |
| Density | 2.43 g/cm3 |
| Melting point | 891 °C (1,636 °F; 1,164 K) |
| Boiling point | Decomposes |
|
Solubility in water |
110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) |
| Solubility |
|
| Acidity (pKa) | 10.25 |
|
Magnetic susceptibility (χ) |
−59.0·10−6 cm3/mol |
| Thermochemistry[1] | |
|
Heat capacity (C) |
114.4 J·mol−1·K−1 |
|
Std molar |
155.5 J·mol−1·K−1 |
|
Std enthalpy of |
−1151.0 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1063.5 kJ·mol−1 |
|
Enthalpy of fusion (ΔfH⦵fus) |
27.6 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H315, H319, H335 |
|
Precautionary statements |
P261, P305+P351+P338 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[2] |
| Safety data sheet (SDS) | ICSC 1588 |
| Related compounds | |
|
Other anions |
Potassium bicarbonate |
|
Other cations |
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
|
Related compounds |
Ammonium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium carbonate is the inorganic compound with the formula K2CO3. It is a white salt, which is soluble in water and forms a strongly alkaline solution. It is deliquescent, often appearing as a damp or wet solid. Potassium carbonate is mainly used in the production of soap and glass.[3]
History[edit]
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
Production[edit]
Potassium carbonate is prepared commercially by the reaction of potassium hydroxide with carbon dioxide:[3]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O («potash hydrate»). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications[edit]
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is used in some types of Chinese noodles and mooncakes, as well as Asian grass jelly and Japanese ramen. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called «Dutching» (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References[edit]
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ Chambers, Michael. «ChemIDplus — 584-08-7 — BWHMMNNQKKPAPP-UHFFFAOYSA-L — Potassium carbonate [USP] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 2014-08-12.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ See references to «pearl ash» in «American Cookery» by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. «Advanced Practical Organic Chemistry» 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. «The American Frugal Housewife» 1832
Bibliography[edit]
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). «Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol». Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links[edit]
- International Chemical Safety Card 1588
КАЛИЯ КАРБОНАТ
- КАЛИЯ КАРБОНАТ
- (поташ) К 2 СО 3, бесцв. кристаллы моноклинной сингонии (а= 0,564 нм, b =0,980 нм, с =0,688 нм, b = 98,8°, z = 4, пространств. группа P21/c}; плотн. 2,44 г/см , при 420 °С переходит в гексагoн. модификацию (при 425 °С а =0,571 нм, с= 0,717 нм, плотн. 2,27 г/см 3); т. пл. 891 °С; С° р114,43 Дж/(моль. К); DH0 пл 30,5 кДж/моль, DH0 обр Ч 1151,5 кДж/моль; S0298 . 155,50 Дж/(моль. К). Р-римость в воде (г в 100 г): 105,5 (0 о С), 110,5 (20 °С), 155,7 (100 °С); d42510%-, 20%-, 30%-, 40%- и 50%-ных водных р-ров соотв. 1,0904, 1,1898, 1,2756, 1,4141 и 1,5404. Образует гидраты с 5, 1,5 и 0,5 молекулами воды, полностью обезвоживающиеся при 150-160°С. К. к. в водных р-рах реагирует с СО 2, давая КНСО 3, с SO2 образует KHSO3 и СО 2. Производят К. к. карбонизацией р-ров КОН (получаемых электролитически) или суспензии MgCO3 в р-ре КСl, а также как побочный продукт при переработке нефелина в глинозем, в значит. кол-вах К 2 СО 3 содержится в растит. золе. К. к. — компонент шихты в произ-ве оптич. стекла, поглотитель H2S при очистке газов, обезвоживающий агент. Гидрокарбонат КНСО 3 — бесцв. кристаллы моноклинной сингонии; плотн. 2,17 г/см 3. Р-римость в воде 33,3 г в 100 г при 20 °С. При 100-120°С или кипячении водных р-ров разлагается на К 2 СО 3 и СО 2. Получают взаимод. СО 2 с р-рами К 2 СО 3. Компонент жидких моющих ср-в, источник СО 2 в огнетушащих составах и при произ-ве безалкогольных напитков. Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 2, Л., 1974. В. И. Ксензенко, Д. С. Стасиневич.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Полезное
Смотреть что такое «КАЛИЯ КАРБОНАТ» в других словарях:
-
КАЛИЯ КАРБОНАТ — (поташ), K2CO3, кристаллы, tпл 891шC. Калия карбонат компонент шихты в производстве оптического стекла, поглотитель сероводорода, осушающий агент. Используют в фотографии, производстве жидких моющих средств, безалкогольных напитков, огнетушащих… … Современная энциклопедия
-
Калия карбонат — (поташ), K2CO3, кристаллы, tпл 891°C. Калия карбонат компонент шихты в производстве оптического стекла, поглотитель сероводорода, осушающий агент. Используют в фотографии, производстве жидких моющих средств, безалкогольных напитков, огнетушащих… … Иллюстрированный энциклопедический словарь
-
КАЛИЯ КАРБОНАТ — Kalii carbonas. Синонимы: углекалиевая соль, поташ. Свойства. Белый сухой зернистый порошок, гигроскопичен. Хорошо растворяется в воде (1:1), водные растворы сильнощелочной реакции. Получают из золы стеблей и лузги подсолнечника. Хранят в деревя … Отечественные ветеринарные препараты
-
КАЛИЯ КАРБОНАТ — (поташ) K2CO3, бесцветные кристаллы. Очень гигроскопичен. Хорошо растворим в воде. Применяют в производстве жидкого мыла, тугоплавкого и хрустального стекла … Большой Энциклопедический словарь
-
калия карбонат — (поташ), K2СО3, бесцветные кристаллы. Очень гигроскопичен. Хорошо растворим в воде. Применяют в производстве жидкого мыла, тугоплавкого и хрустального стекла. * * * КАЛИЯ КАРБОНАТ КАЛИЯ КАРБОНАТ (поташ), K2CO3, бесцветные кристаллы. Очень… … Энциклопедический словарь
-
калия карбонат — kalio karbonatas statusas T sritis chemija formulė K₂CO₃ atitikmenys: angl. potash; potassium carbonate rus. калий углекислый; калия карбонат; поташ ryšiai: sinonimas – dikalio trioksokarbonatas sinonimas – potašas … Chemijos terminų aiškinamasis žodynas
-
Калия карбонат — Поташ Карбонат калия (углекислый калий, поташ) K2CO3 средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Старое традиционное название соли поташ, оно связано с латинским наименованием калия … … Википедия
-
Калия карбонат — углекислый калий, поташ, K2CO3, соль; бесцветные кристаллы, плотность 2,3 г/см3, tпл 89,4 °С. К. к. очень гигроскопичен. Растворимость 113,5 г на 100 г H2O при 20 °С, 156 г при 100 °С, раствор имеет щелочную реакцию. Поташ с древних… … Большая советская энциклопедия
-
КАЛИЯ КАРБОНАТ — поташ, K2CO3 белый порошок, tnл 900 оС, хорошо растворим в воде. Получают действием диоксида углерода СО2 на гидроксид калия КОН. Применяют при производстве оптич. стекла, жидкого мыла, пигментов, при крашении и т. д … Большой энциклопедический политехнический словарь
-
КАЛИЯ КАРБОНАТ — (поташ), К2СО3, бесцв. кристаллы. Очень гигроскопичен. Хорошо растворим в воде. Применяют в произ ве жидкого мыла, тугоплавкого и хрустального стекла … Естествознание. Энциклопедический словарь
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Карбонат калия
Брутто-формула:
CK2O3
CAS# 584-08-7
Названия
Русский:
- Карбонат калия(IUPAC) [Wiki]
- калия карбонат
- поташ
- углекислый калий
English:
- EINECS:209-529-3
- Potash
- Potassium carbonate(IUPAC) [Wiki]
- pearl ash
Варианты формулы:
Реакции, в которых участвует Карбонат калия
-
{M}2O + {X}O2 -> {M}2{X}O3
, где M =
Na K Li Rb Cs; X =
C S Si -
4KO2 + 3C -> 2K2CO3 + CO2″|^»
-
4KO2 + 2CO2 «H2O»—> 2K2CO3 + 3O2″|^»
-
2{M}2CO3 + 2I2 + HCHO -> 4{M}I + 3CO2″|^» + H2O
, где M =
Li Na K -
ZnSO4 + 4KHCO3 -> ZnCO3″|v» + K2SO4 + K2CO3 + 2CO2 + 2H2O
Как научиться писать формулу карбоната
При выполнении заданий по химии, которые включают в себя тестирование, решение расчетных задач, практическую работу или лабораторный опыт могут понадобиться умения и навыки при написании формул солей. Таблица растворимости, в которой указаны значения зарядов ионов металлов и кислотных остатков, а также знание принципа ее использования поможет верно написать формулы и других веществ.

Вам понадобится
- — таблица растворимости солей, кислот, оснований
Инструкция
Карбонаты – это соли, состоящие из атомов металла и кислотного остатка, который имеет один атом углерода и три атома кислорода — СO3. Соли могут быть как средними — карбонаты, так и кислыми — гидрокарбонаты. Чтобы правильно написать формулу, необходимо воспользоваться таблицей растворимости кислот, солей и оснований, являющейся справочным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Карбонат-ион имеет заряд 2-. Чтобы формула соли была написана правильно, найдите, какой заряд имеет металл, который входит в состав карбоната. В любом случае, суммарное число положительных зарядов ионов должно равняться суммарному числу отрицательных. При этом необходимо обязательно учитывать индексы, стоящие внизу справа от химического символа. Значение заряда иона и индекса, стоящего у этого же иона, перемножаются.
Пример № 1. Напишите формулу карбоната калия.
В таблице растворимости посмотрите на кислотный остаток и на металл, входящий в состав соли. Кислотный остаток — СO3 имеет заряд 2-, а ион калия имеет заряд + (считается +1, но единица не пишется).
Напишите формулу, учитывая, что металл всегда стоит на первом месте: КСO3.
Если сравнить количество зарядов, то отрицательных получилось два (2-), а положительных только один (+). Значит, в формуле должно быть 2 атома калия, которые дадут два положительных заряда (2+), так как значение заряда и индекса перемножается. Следовательно, и молекула будет электронейтральна: К2СO3. Полученная соль называется карбонат калия.
Пример № 2. Напишите формулу карбоната кальция.
Кислотный остаток тот же, то есть — СO3 с зарядом (2-). В таблице растворимости найдите металл кальций и его заряд, который равен 2+ . Напишите формулу, имеющую вид: СаСO3. В итоге получилось одинаковое количество отрицательных (2-) и положительных 2(+) зарядов. Следовательно, формула написана правильно, так как в целом она электронейтральна. Полученная соль называется карбонат кальция, она знакома как мел или известняк.
Пример № 3. Напишите формулу гидрокарбоната калия.
Гидрокарбонат-иона в таблице растворимости нет, а потому следует запомнить, что он имеет вид — НСO3 и у него заряд, равный (-). Ион калия имеет противоположный заряд (+), поэтому формула будет выглядеть таким образом:
КНСO3.
Полученное соединение называется гидрокарбонат калия, которое представляет собой кислую соль.
Видео по теме
Источники:
- карбонат кальция формула
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
(Redirected from Potassium arbonate)
Potassium carbonate

|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium carbonate |
|
| Other names
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood. |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K 2CO 3 |
| Molar mass | 138.205 g/mol |
| Appearance | White, hygroscopic solid |
| Density | 2.43 g/cm3 |
| Melting point | 891 °C (1,636 °F; 1,164 K) |
| Boiling point | Decomposes |
|
Solubility in water |
110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−59.0·10−6 cm3/mol |
| Thermochemistry[1] | |
|
Heat capacity (C) |
114.4 J·mol−1·K−1 |
|
Std molar |
155.5 J·mol−1·K−1 |
|
Std enthalpy of |
−1151.0 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1063.5 kJ·mol−1 |
|
Enthalpy of fusion (ΔfH⦵fus) |
27.6 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H315, H319, H335 |
|
Precautionary statements |
P261, P305+P351+P338 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[2] |
| Safety data sheet (SDS) | ICSC 1588 |
| Related compounds | |
|
Other anions |
Potassium bicarbonate |
|
Other cations |
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
|
Related compounds |
Ammonium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium carbonate is the inorganic compound with the formula K2CO3. It is a white salt, which is soluble in water. It is deliquescent, often appearing as a damp or wet solid. Potassium carbonate is mainly used in the production of soap and glass.[3]
History[edit]
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
Production[edit]
Potassium carbonate is prepared commercially by the reaction of potassium hydroxide with carbon dioxide:[3]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O («potash hydrate»). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications[edit]
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is an ingredient in the production of grass jelly, a food consumed in Chinese and Southeast Asian cuisines, as well as Chinese hand-pulled noodles and mooncakes. It is also used to tenderize tripe. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn. Use of potassium carbonate must be limited to a certain amount to prevent harm, and should not be used without guidance.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called «Dutching» (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References[edit]
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ Chambers, Michael. «ChemIDplus — 584-08-7 — BWHMMNNQKKPAPP-UHFFFAOYSA-L — Potassium carbonate [USP] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 2014-08-12.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ See references to «pearl ash» in «American Cookery» by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. «Advanced Practical Organic Chemistry» 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. «The American Frugal Housewife» 1832
Bibliography[edit]
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). «Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol». Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links[edit]
- International Chemical Safety Card 1588
(Redirected from Potassium arbonate)
Potassium carbonate

|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium carbonate |
|
| Other names
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood. |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K 2CO 3 |
| Molar mass | 138.205 g/mol |
| Appearance | White, hygroscopic solid |
| Density | 2.43 g/cm3 |
| Melting point | 891 °C (1,636 °F; 1,164 K) |
| Boiling point | Decomposes |
|
Solubility in water |
110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−59.0·10−6 cm3/mol |
| Thermochemistry[1] | |
|
Heat capacity (C) |
114.4 J·mol−1·K−1 |
|
Std molar |
155.5 J·mol−1·K−1 |
|
Std enthalpy of |
−1151.0 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1063.5 kJ·mol−1 |
|
Enthalpy of fusion (ΔfH⦵fus) |
27.6 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H315, H319, H335 |
|
Precautionary statements |
P261, P305+P351+P338 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[2] |
| Safety data sheet (SDS) | ICSC 1588 |
| Related compounds | |
|
Other anions |
Potassium bicarbonate |
|
Other cations |
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
|
Related compounds |
Ammonium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium carbonate is the inorganic compound with the formula K2CO3. It is a white salt, which is soluble in water. It is deliquescent, often appearing as a damp or wet solid. Potassium carbonate is mainly used in the production of soap and glass.[3]
History[edit]
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
Production[edit]
Potassium carbonate is prepared commercially by the reaction of potassium hydroxide with carbon dioxide:[3]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O («potash hydrate»). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications[edit]
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is an ingredient in the production of grass jelly, a food consumed in Chinese and Southeast Asian cuisines, as well as Chinese hand-pulled noodles and mooncakes. It is also used to tenderize tripe. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn. Use of potassium carbonate must be limited to a certain amount to prevent harm, and should not be used without guidance.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called «Dutching» (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References[edit]
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ Chambers, Michael. «ChemIDplus — 584-08-7 — BWHMMNNQKKPAPP-UHFFFAOYSA-L — Potassium carbonate [USP] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 2014-08-12.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ See references to «pearl ash» in «American Cookery» by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. «Advanced Practical Organic Chemistry» 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. «The American Frugal Housewife» 1832
Bibliography[edit]
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). «Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol». Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links[edit]
- International Chemical Safety Card 1588
Формула карбоната калия
Определение и формула карбоната калия

Формула –
Молярная масса равна г/моль.
Физические свойства – соль белого цвета растворимая в воде, но не растворимая в этиловом спирте, образует растворы с сильно щелочной реакцией.
Плавится без разложения, при более глубоком нагревании разлагается.
Очень хорошо растворяется в воде (сильный гидролиз по аниону):
Карбонат калия является основным компонентом калийных удобрений. Исторически сложилось так, что карбонат калия получали при спекании поташа из золы растений в печи для удаления примесей. Мелкий белый оставшийся порошок являлся поташем. Первый патент, выданный патентным ведомством США был присужден Сэмюэлю Хопкинсу в 1790 году для улучшенного способа изготовления поташа из золы растений и карбоната калия.
В конце 18-го века в Северной Америке, до развития разрыхлителей, поташ использовался в качестве разрыхлителя в быстрых хлебах.
Химические свойства карбоната калия
- При нагревании до температуры выше
карбонат калия разлагается на оксид калия и углекислый газ:
- Реагирует с кислотами-неокислителями:
- Взаимодействует с основаниями:
- Реагирует с углеродом при высокой температуре:
- Вступает в реакцию с
с образованием гидросульфита калия:
Получение
В настоящее время, карбонат калия получают в промышленных масштабах путем электролиза хлорида калия. Полученный гидроксид калия приводят во взаимодействие с диоксидом углерода с образованием карбоната калия, который часто используется для получения других соединений калия:
Применение
Исторически карбонат калия использовался для производства мыла, стекла, фарфора. В качестве мягкого сушильного агента, где другие влагопоглощающие вещества, такие как хлорид кальция и сульфат магния, нельзя применить. Он не подходит для кислотных соединений, но может быть полезен для сушки органической фазы, если есть небольшое количество кислотных примесей. Он также может быть использован для сушки некоторых кетонов, спиртов и аминов перед перегонкой.
Используется в производстве порошка какао, чтобы сбалансировать натуральных какао-бобов (это также помогает улучшить аромат).
Примеры решения задач
Физические свойства
Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
Способ получения
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
4KO2 + 2CO2 = 2K2CO3 + 3O2
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
2KO2 + CO = K2CO3 + O2
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
2KOH + СO2 = K2СO3 + H2O
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
4KO2 + 3C = 2K2CO3 + CO2
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
2KHCO3 = K2CO3 + CO2 + H2O
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
KHCO3 + KOH = K2CO3 + H2O
Качественная реакция
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
K2CO3 + H2SO4 = 2K2SO4 + CO2↑ +H2O.
Химические свойства
1. Карбонат калия может реагировать с простыми веществами:
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2↑
K2CO3 + 3Br2 = 5KBr + KBrO3 + 3CO2↑
K2CO3 + 3I2 = 5KI + KIO3 + 3CO2↑
2. Карбонат калия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
K2CO3 + H2O + CO2 ↔ 2KHCO3↓
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓
2.3. Карбонат калия способен реагировать с кислотами:
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ +H2O
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
K2CO3 + 2HClO4 = 2KClO4↓ + H2O + CO2↑
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + 3CO2↑
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой. В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
K2CO3 + 2HF = 2KF + H2O + CO2↑,
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
K2CO3 + 4HF = 2K(HF2) + H2O + CO2↑
2.5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы. При этом образуются карбонат калия и углекислый газ:
K2CO3 + SO2 = K2SO3 + CO2↑.
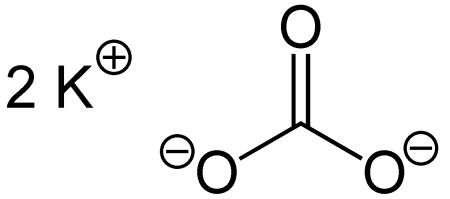
| Карбонат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Карбонат калия |
| Традиционные названия | поташ |
| Хим. формула | CK₂O₃ |
| Состояние | кристаллическое |
| Молярная масса | 138,205 г/моль |
| Плотность | 2,44 г/см³ |
| Т. плав. | 891 °C |
| Растворимость в воде | 110,5 г/100мл (20 °C) |
| ГОСТ | ГОСТ 4221-76 ГОСТ 10690-73 |
| Рег. номер CAS | 584-08-7 |
| PubChem | 11430 |
| Рег. номер EINECS | 209-529-3 |
| SMILES |
C(=O)([O-])[O-].[K+].[K+] |
| InChI |
1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 BWHMMNNQKKPAPP-UHFFFAOYSA-L |
| Кодекс Алиментариус | E501(i) |
| RTECS | TS7750000 |
| ChEBI | 131526 |
| ChemSpider | 10949 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
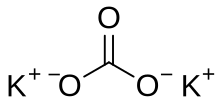
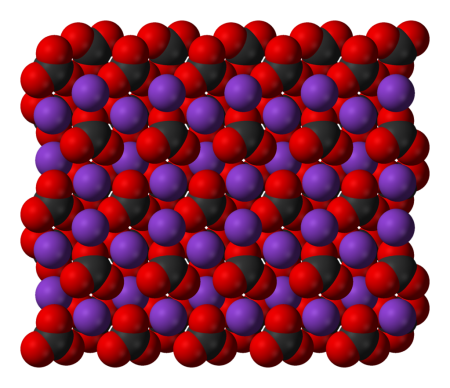
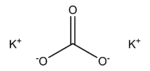
Карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
Старое название соли — поташ из нидерл. рotasсh напрямую или через нем. Pottasche, фр. potasse.
История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где вода предельно жёсткая).
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу». С целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков» то есть вторичная переработка.
Физические и химические свойства
Выглядит как бесцветные или белые кристаллы, имеющие моноклинную сингонию, переходит в гексагональную при 420 °C. Плотность моноклинной модификации 2,44 г/см3, гексагональной 2,27 г/см3. Температура плавления — 891 °C. Растворим в воде: 105,5/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C). Гигроскопичен.
Образует несколько различных гидратов с 5, 1,5 и 0,5 молекулами воды, гидрат с 1,5·H2O образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия. С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Получение
Карбонат калия получают:
- как побочный продукт получается при переработке нефелинов.
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия:
- 2KOH + CO2 → K2CO3 + H2O
- воздействием CO2 на раствор гидроксида калия.
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Применение
Карбонат калия применяют:
- для изготовления жидкого мыла;
- для производства пигментов;
- для производства хрустального, оптического или тугоплавкого стекла;
- крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей;
- в качестве добавки в строительный раствор и бетон для уменьшения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия;
- как поглотитель сероводорода при очистке газов;
- как обезвоживающий агент;
- зарегистрирован в качестве пищевой добавки E501.
| Карбонат калия | |
|---|---|
|
|
| Общие свойства | |
| Молекулярная формула | K2CO3 |
| SMILES | |
| Молярная масса | 138,205 г/моль |
| Внешний вид | Белый порошок |
| Номер CAS | 584-08-7 |
| Свойства | |
| Плотность и агрегатное состояние |
2290 кг/м³ |
| Растворимость в воде | 110,5г/100мл (при 20 °C) |
| Температура плавления | 891 °C (1163 K) |
| Опасность (в том числе токсическая) | |
| Температура вспышки |
|
| Температура самовоспламенения |
|
| Пределы взрываемости | |
| Класс опасности | |
| Родственные соединения | |
| Другие соединения | Бикарбонат калия Карбонат натрия Карбонат лития |
Карбонат калия (углекислый калий, пота́ш) K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде.
- Старое название соли — пота́ш, от лат. potassa, через нем. Pottasche, фр. potasse.
История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но в основном в России и Северной Америке.
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу»
Получение
Его легко получить из щелочи при выщелачивании водой золы из злаков или водорослей, так как именно калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Как побочный продукт получается при переработке нефелинов. Сегодня карбонат калия получается путем электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия.
- 2KOH + CO2 → K2CO3 + H2O
Применение
Поташ применяют для изготовления жидкого мыла, хрустального или тугоплавкого стекла, крашения, выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений), для фотодела, в качестве добавки в строительный раствор для уменьшения температуры замерзания (правда, потом могут выделяться белые пятна, поэтому сейчас появляются специальные противоморозные присадки, не дающие разводов).
Зарегистрирован в качестве пищевой добавки E501.
См. также
- Калий
- Сульфит калия
- Соляной рыбный двор
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения калия |
|---|
|
Азид калия (KN3) • Амид калия (KNH2) • Ацесульфам (C4H4KNO4S) • Ацетат калия (CH3COOK) • Ацетиленид калия (K2C2) • Бензоат тригидрат калия (Брутто-формула:C7H11KO5) • Бромат калия (KBrO3) • Бромид калия (KBr) • Гексагидроксоплатинат(IV) калия (K2[Pt(OH)6]) • Гексагидроксостибат калия (K[Sb(OH)6]) • Гексанитрокобальтат(III) калия (K3[Co(NO3)6]) • Гексаоксибензол калия (C6(OK)6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторокупрат(III) калия (K3CuF6) • Гексафторомолибдат(III) калия (K3MoF6) • Гексафтороплатинат(V) калия (K[PtF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторфосфат калия (KPF6) • Гексахлоропалладат(IV) калия (K2[PdCl6]) • Гексахлороплатинат(IV) калия (K2[PtCl6]) • Гексахлоростаннат(IV) калия (K2[SnCl6]) • Гексахлорплатинат калия (K2PtCl6) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(II) тригидрат калия (K4[Fe(CN)6]•3H2O) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрид калия (KH) • Гидрокарбонат калия (KHCO3) • Гидроксид калия (KOH) • Гидроортофосфат калия (K2HPO4) • Гидросульфат калия (KHSO4) • Гидросульфид калия (KHS) • Гидросульфит калия (KHSO3) • Гидрофторид калия (KHF2) • Дигидроарсенат калия (KH2AsO4) • Дигидроортофосфат калия (KH2PO4) • Динитрамид калия (KN(NO2)2) • Дисульфат калия (K2S2O7) • Дисульфит калия (K2S2O5) • Дисульфонатнитроксил калия ((KO3S)2NO) • Дитионат калия (K2S2O6) • Дихлородиамминпалладий ([Pd(NH3)2]Cl2) • Дихромат калия (K2Cr2O7) • Дицианоаргентат(I) калия (K[Ag(СN)2]) • Дицианоаурат(I) калия (K[Au(СN)2]) • Иодат калия (KIO3) • Иодид калия (KI) • Карбонат калия (K2CO3) • Манганат калия (K2MnO4) • Метаванадат калия (KVO3) • Метасиликат калия (K2SiO3) • Метафосфат калия (KPO3) • Надпероксид калия (KO2 или K2O4) • Нитрат калия (KNO3) • Нитрит калия (KNO2) • Озонид калия (KO3) • Оксалат калия (K2C2O4) • Оксалат моногидрат калия (K2C2O4•H2O) • Оксид калия (K2O) • Октахлоромолибдат калия (K4Mo2Cl8) • Ортофосфат калия (K3PO4) • Пербромат калия (KBrO4) • Периодат калия (KIO4) • Перманганат калия (KMnO4) • Пероксид калия (K2O2) • Пероксодикарбонат калия (К2С2О6) • Пероксомоносульфат калия (K2SO5) • Пероксодисульфат калия (K2S2O6(O2)) • Перренат калия (KReO4) • Перхлорат калия (KClO4) • Полисульфиды калия (K2Sn) • Политионаты калия (K2SnO6) • Сегнетова соль (NaKC4H4O6) • Соль Джонсона (K[I(I)2]•H2O) • Соль Цейзе (K[Pt(C2H4)Cl3]•H2O) • Сорбат калия (C6H7KO2) • Сульфат гидрат калия-гадолиния • Сульфат гидрат калия-кальция (K2Ca(SO4)2•H2O) • Сульфат калия (K2SO4) • Сульфат калия-кальция (K2Ca(SO4)2) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфид калия (K2S) • Сульфит дигидрат калия (K2SO3•2H2O) • Сульфит калия (K2SO3) • Тетрагидроалюминат калия (KAlH4) • Тетрагидроксодиоксоосмат(VI) калия (K2[OsO2(OH)4]) • Тетрагидроортотеллурат калия (K2H4TeO6) • Тетраиодомеркурат(II) калия (K2[HgI4]) • Тетранитроплатинат(II) калия (K2[Pt(NO2)4]) • Тетраоксорутенат(VI) калия (K2RuO4) • Тетрапероксохромат(V) калия (K3CrO8) • Тетрасиликат калия (K2Si4O9•H2O) • Тетрахлоромолибдат(III) калия (KMoCl4) • Тетрахлоропалладат(II) калия (K2[PdCl4]) • Тетрахлороплатинат(II) калия (K2[PtCl4]) • Тетрахлороферрат(III) калия (K[FeCl4]) • Тетрахлорплатинат калия (K2PtCl4) • Тетрацианоникколат(II) калия (K2[Ni(CN)4]) • Тетрацианоплатинат(II) калия (K2[Pt(CN)4]) • Тиосульфат калия (K2SO3S) • Тиоцианат калия (KSCN) • Феррат калия (K2FeO4) • Феррооксалат калия (K3[Fe(C2O4)3]) • Формиат калия (HCOOK) Фталимид калия • Фторид калия (KF) • Фторсульфит калия (KSO2F) • Хлорат калия (KClO3) • Хлорид калия (KCl) • Хлорид-триэтилалюминий калия ((C2H5)3Al•KCl) • Хромат калия (K2CrO4) • Хромит калия (KCrO2) • Цианат калия (KOCN) • Цианид калия (KCN) • Цианоаурат калия (K[Au(CN)2] • Этилксантогенат калия (C2H5OC(S)SK) • |
Как научиться писать формулу карбоната
При выполнении заданий по химии, которые включают в себя тестирование, решение расчетных задач, практическую работу или лабораторный опыт могут понадобиться умения и навыки при написании формул солей. Таблица растворимости, в которой указаны значения зарядов ионов металлов и кислотных остатков, а также знание принципа ее использования поможет верно написать формулы и других веществ.

Вам понадобится
- — таблица растворимости солей, кислот, оснований
Инструкция
Карбонаты – это соли, состоящие из атомов металла и кислотного остатка, который имеет один атом углерода и три атома кислорода — СO3. Соли могут быть как средними — карбонаты, так и кислыми — гидрокарбонаты. Чтобы правильно написать формулу, необходимо воспользоваться таблицей растворимости кислот, солей и оснований, являющейся справочным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Карбонат-ион имеет заряд 2-. Чтобы формула соли была написана правильно, найдите, какой заряд имеет металл, который входит в состав карбоната. В любом случае, суммарное число положительных зарядов ионов должно равняться суммарному числу отрицательных. При этом необходимо обязательно учитывать индексы, стоящие внизу справа от химического символа. Значение заряда иона и индекса, стоящего у этого же иона, перемножаются.
Пример № 1. Напишите формулу карбоната калия.
В таблице растворимости посмотрите на кислотный остаток и на металл, входящий в состав соли. Кислотный остаток — СO3 имеет заряд 2-, а ион калия имеет заряд + (считается +1, но единица не пишется).
Напишите формулу, учитывая, что металл всегда стоит на первом месте: КСO3.
Если сравнить количество зарядов, то отрицательных получилось два (2-), а положительных только один (+). Значит, в формуле должно быть 2 атома калия, которые дадут два положительных заряда (2+), так как значение заряда и индекса перемножается. Следовательно, и молекула будет электронейтральна: К2СO3. Полученная соль называется карбонат калия.
Пример № 2. Напишите формулу карбоната кальция.
Кислотный остаток тот же, то есть — СO3 с зарядом (2-). В таблице растворимости найдите металл кальций и его заряд, который равен 2+ . Напишите формулу, имеющую вид: СаСO3. В итоге получилось одинаковое количество отрицательных (2-) и положительных 2(+) зарядов. Следовательно, формула написана правильно, так как в целом она электронейтральна. Полученная соль называется карбонат кальция, она знакома как мел или известняк.
Пример № 3. Напишите формулу гидрокарбоната калия.
Гидрокарбонат-иона в таблице растворимости нет, а потому следует запомнить, что он имеет вид — НСO3 и у него заряд, равный (-). Ион калия имеет противоположный заряд (+), поэтому формула будет выглядеть таким образом:
КНСO3.
Полученное соединение называется гидрокарбонат калия, которое представляет собой кислую соль.
Видео по теме
Источники:
- карбонат кальция формула
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание
- История
- Физические и химические свойства
- Получение
- Применение
Карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
| Карбонат калия | |
|---|---|
| Общие | |
| Систематическое наименование |
Карбонат калия |
| Традиционные названия | поташ |
| Хим. формула | K2CO3 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 138,205 г/моль |
| Плотность | 2,44 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 891 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 110,5 г/100мл (20 °C) |
| Классификация | |
| Рег. номер CAS | 584-08-7 |
| PubChem | 11430 |
| Рег. номер EINECS | 209-529-3 |
| SMILES |
C(=O)([O-])[O-].[K+].[K+] |
| InChI |
1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 BWHMMNNQKKPAPP-UHFFFAOYSA-L |
| Кодекс Алиментариус | E501(i) и E501 |
| RTECS | TS7750000 |
| ChEBI | 131526 |
| ChemSpider | 10949 |
| Безопасность | |
| NFPA 704 |
Старое название соли — поташ из нидерл. рotasсh напрямую или через нем. Pottasche, фр. potasse.
История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где вода предельно жёсткая).
В России Петр I в 1721 году установил монополию на производство поташа: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу» — с целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков»[значимость факта?].
Физические и химические свойства
При нормальных условиях выглядит как бесцветные или белые кристаллы (моноклинная модификация), плотностью 2,44 г/см3. При 420 °C переходит в гексагональную модификацию плотностью 2,27 г/см3. Плавится при 891 °C.
При нагревании до 1200 °C разлагается на углекислый газ и оксид калия:
Хорошо растворим в воде: 105,5 г/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C), гигроскопичен. Образует несколько кристаллогидратов: K2CO3·5H2O, K2CO3·1,5H2O и K2CO3·0,5H2O, второй из них образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия.
С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Получение
Карбонат калия получают:
- как побочный продукт получается при переработке нефелинов.
- воздействием CO2 на раствор гидроксида калия:
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия .
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Применение
Карбонат калия применяют:
- для изготовления жидкого мыла;
- для производства пигментов;
- для производства хрустального, оптического или тугоплавкого стекла;
- крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей;
- в качестве добавки в строительный раствор и бетон для уменьшения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия;
- как поглотитель сероводорода при очистке газов;
- как обезвоживающий агент;
- зарегистрирован в качестве пищевой добавки E501.