Если вы или ваш близкий человек получили заключение биопсии и ждете консультации онколога, вам важно знать, как обозначается рак в медицине, как правильно расшифровать онкологический диагноз и что делать дальше, если коды гистологии говорят о злокачественной опухоли. Помните, что от точности анализа зависят тактика лечения и прогноз вашего выздоровления. В нашей статье вы узнаете, что означают результаты биопсии и как можно уточнить диагноз ⇊
- Как обозначаются стадии рака: клиническая классификация
- Примеры расшифровки диагноза “рак”
- Где получить второе медицинское мнение по онкологическому диагнозу?
- Что делать, если биопсия показала рак?
- Уточняющие и дополнительные онкологические коды в классификации ТNM
- Часто задаваемые вопросы по классификации онкологических заболеваний

Как обозначаются стадии рака: клиническая классификация
Классификация рака по стадиям была принята в 1956 году и до сих пор используется для быстрой оценки состояния пациента. Эта система указывает на размеры опухоли и наличие метастазов. Она помогает онкологу оценить риски и назначить вам адекватное лечение. Стадии рака расшифровываются так:
- 0 стадия — опухоль расположена в одном слое — “in situ”, и не прорастает за его пределы. Эту степень выделяют не для всех типов рака.
- 1 стадия — ограниченный очаг (до 2 см). Для некоторых органов размеры могут быть до 5 см.
- 2 стадия — опухоль имеет те же размеры, но поразила регионарный лимфоузел (ближайший к очагу).
- 3 стадия — размер новообразования увеличивается до 5 и более см, прорастает в окружающие ткани и дает множественные метастазы в лимфоузлы.
- 4 стадия — опухоль любого размера, которая имеет как минимум один метастаз в отдаленном органе, или прорастает в соседние органы.
Необходимо понимать, что стадии рака кожи, желудка, простаты, груди, щитовидной железы, лимфатической системы и любых других опухолевых новообразований определяются на основании разных критериев. Классификация выше описывает лишь общий принцип. Как расшифровывается диагноз “рак” в конкретном случае, зависит от его вида.
Многие типы опухолей могут иметь размер более 5 см, однако эффективно излечиваются. При этом, небольшие раковые образования (до 1 см) могут крайне быстро распространяться по организму (например, меланома) и тяжело поддаваться терапии. Поэтому особенно важно пройти полную диагностику оперативно и сразу приступить к лечению рака, а расшифровка диагноза в таком случае даст вам возможность сориентироваться в тактике, предложенной врачом.
Как обозначают диагноз “рак” на латыни?
Врачи пишут диагноз “рак” с использованием аббревиатур онкологии на латыни:
- Диагноз Ca — рак, карцинома (от лат. carcinoma).
- Диагноз Cr — рак (от лат. cancer).
- T-r — опухоль, рак (от лат. tumor).
Международная клиническая классификация ТNM
TNM, или cTNM-классификация, точно описывает распространенность онкологического процесса. Именно поэтому врачи применяют ее, чтобы определить вид и объем хирургического вмешательства, типы медикаментов, способ и дозы лучевого воздействия. С помощью TNM-системы онкологи делают прогноз выздоровления и оценивают эффективность проведенного лечения.
- Т — размеры первичной опухоли (от лат. Tumor, «уплотнение»);
- N — поражение лимфатических узлов (от лат. Nodus, «узел»);
- М — метастазы в отдаленные органы и/или ткани (от лат. Metastasis, «метастазы»).
Как врачи обозначают рак по системе TNM?
Для максимальной точности, по системе TNM буквы в диагнозе “рак” дополняются цифрами.
Tumor (опухоль)
- Tx — первичную (основную) опухоль невозможно оценить, данных о ее размере нет.
- T0 — нет признаков изначального очага.
- Tis — рак in situ, “на месте”, когда новообразование находится в ограниченном слое ткани.
- T1-T4 — увеличение размера опухоли.
Nodes (лимфоузлы)
- Nx — нельзя проверить регионарные лимфоузлы.
- N0 — новообразование не поразило ближайшие лимфоузлы.
- N1-N4 — увеличение количества вовлеченных лимфоузлов.
Metastasis (вторичный рак)
- M0 — нет отдаленных метастазов.
- M1 — рак поразил как минимум один отдаленный орган.

|
Орган |
Обозначение |
|---|---|
|
Головной мозг |
Bra |
|
Лимфоузлы |
Lym |
|
Легкие |
Pul |
|
Плевра |
Ple |
|
Кости |
Oss |
|
Печень |
Hep |
|
Костный мозг |
Mar |
|
Брюшина |
Per |
|
Надпочечники |
Adr |
|
Кожа |
Ski |
|
Другие ткани и органы |
Ott |
Соответствие клинических стадий рака и данных TNM
|
Стадия |
TNM-классификация |
|---|---|
|
0 (рак in situ) |
Tis, N0, M0 |
|
I |
T1, N0, M0 |
|
II |
T0-1, N1, M0 T2, N0, M0 T2, N1, M0 |
|
III |
T3, N0, M0 T1-T3, N1-2, M0 |
|
IV |
T любой, N любой, M1 T4, N любой, M любой (опухоль имеет большой размер, может прорастать в соседние ткани и органы) |
Распределение стадий по TNM зависит от того, какой именно рак диагностирован.
Для детализации стадии онкологи могут использовать подкатегории:
- доп. Т — множественные опухоли в конкретной части тела;
- У — указывает на то, что стадию определили сразу после интенсивной химиотерапии или операции;
- V — рецидив или венозная инвазия, т. е. поражение крупных вен;
- L — поражение лимфатических путей, Lx — возможное, L0 — отсутствует;
- Рn — наличие периневральной инвазии (опухолевые клетки проникли в нерв, что характерно для рака головы, шеи, а также простаты и кишечника).
Примеры расшифровки стадий рака
- Т1N0M0
Это рак, при котором первичная опухоль имеет небольшой размер (точные параметры зависят от вида онкологии), лимфоузлы не поражены (“чистые”) и нет метастазов. Так врачи шифруют рак 1 стадии.
- Т1N1M0
Опухоль все так же имеет небольшой размер, но она уже распространилась (дала метастаз) в ближайший к ней лимфоузел. Врач также указывает в заключении, какой именно лимфоузел спровоцирован (поражен). Расшифровка диагноза соответствует 2 стадии рака.
- T2N1M0
В этом примере опухоль имеет значительный размер (больше, чем при T1), один лимфоузел поражен, но метастазов нет. Означает 2 стадию.
- Т0N3M1
В этом примере первичную опухоль не обнаружили, что бывает при быстро прогрессирующем раке. Скопление злокачественных клеток дало метастазы в лимфоузлы и отдаленный орган (чаще всего в легкие или печень), которые и были обнаружены врачом. Эта расшифровка онкологического заболевания соответствует 4 стадии.
- T2N1M1
Расшифровка значит, что рак метастазировал в ближайший на пути оттока лимфы узел и распространился в отдаленный орган — это 4 стадия.
- TxNxM1
Диагноз означает рак 4 стадии с как минимум одним отдаленным метастазом. Оценить первичную опухоль и лимфоузлы невозможно.
- T3N1M0
Расшифровка говорит о раке 3 стадии с одним вовлеченным лимфоузлом.
- T3NxM0
Расшифровка: рак 2-3 стадии без отдаленных метастазов. Вовлечение лимфатических узлов оценить невозможно.
- T3N0M0
Расшифровка: рак 2-3 стадии (в зависимости от его вида).
- T3N1M1
Расшифровка: рак 4 стадии.
- ПМСР онкология молочной железыТ2N1M0
Расшифровка означает первично-множественный рак. Такой диагноз ставят, если у пациента есть одновременно несколько раковых опухолей в одном или разных органах, в данном случае — в грудной железе. Поражение лимфоузла, размер очага и отсутствие метастазов по организму говорят о том, что это 3 стадия.
- Аденокарцинома желудка T1N0M0
Расшифровка означает диагноз “рак желудка” в железистом эпителии на 1 стадии, лимфоузлы и отдаленные органы не поражены.
Где получить второе мнение по онкологическому диагнозу?
Второе мнение — это консультация с опытным доктором, которая помогает подтвердить, опровергнуть или пересмотреть серьезный диагноз. С помощью Bookimed вы можете получить второе мнение по диагнозу “рак” у лучших зарубежных онкологов на заочной консультации. Она проходит дистанционно, поэтому вам не нужно беспокоиться о поездке за границу.
Профессор Офер Меримский
Медицинский центр им. Сураски, Израиль
Онколог, около 40 лет опыта
Профессор Офер Меримский специализируется на лечении рака мягких тканей и костей, всех видов сарком, метастазов в печени и легких. Он возглавляет ассоциацию клинических онкологов Израиля. Прошел обучение в Париже и США.
Все отзывы прошли проверку
Медицинский центр им. Сураски (Ихилов) — крупнейший медицинский центр Израиля. Основная специализация клиники — онкология, нейрохирургия, кардиология, ортопедия. Ежегодно клиника принимает около 1 800 000 пациентов. Более 400 000 из них проходят лечение.
Журнал Newsweek включил Сураски в ТОП-10 самых популярных клиник для медицинского туризма в мире. Врачи Ихилов входят в ТОП-5 лучших специалистов по версии Forbes.
Каждый год врачи Ихилов проводят около 34 000 хирургических вмешательств разного профиля.
Читать подробнее
| Пересадка почки | $100000 — $120000 |

Клиника Нордвест, Германия
Онколог, более 35 лет опыта
Профессор Эльке Йегер — эксперт Европейской организации по исследованию и лечению рака, директор американского института Людвига по исследованию рака. Профессор Йегер специализируется на химиотерапии и иммунотерапии. Она ведет исследования в области терапевтических индивидуальных противоопухолевых вакцин и успешно применяет их. Входит в ТОП лучших врачей Германии от журнала Focus. Рейтинг основан на мнении пациентов и докторов. Получила звание лучшего онколога по версии пациентов и
Все отзывы прошли проверку
Клиника Нордвест (Nordwest) — крупная многопрофильная больница во Франкфурте-на-Майне, Германия.
Специализация — онкология, неврология, нейрохирургия и ортопедия.
В 2019 году Нордвест вошел в ТОП немецких госпиталей по эффективности радиотерапии и успешности лечения рака толстого кишечника.
Ежегодно в медицинский центр обращаются свыше 25 000 пациентов.
| Химиотерапия | $2663 — $4580 |
Доктор Бартоломе Оливер
Медицинский центр Текнон
Нейроонколог, нейрохирург, более 45 лет опыта
Доктор Бартоломе Оливер специализируется на удалении злокачественных новообразований мозга через небольшие разрезы, под микроскопом. Ежегодно проводит более 200 нейрохирургических операций. Бартоломе Оливер возглавляет нейрохирургическое сообщество Каталонии. Он проходил обучение и стажировку в Швеции, Швейцарии, Канаде и США. Получил звание «Лучший нейрохирург» по мнению пациентов и экспертов в рамках награды Bookimed Awards.
Все отзывы прошли проверку
Клиника Текнон в Барселоне (Centro Medico Teknon) — частный медицинский центр Испании, в котором практикуют всемирно известные врачи.
Специализация Текнона — онкология, кардиохирургия, нейрохирургия и лечение эпилепсии. За качество и безопасность лечения госпиталь сертифицирован американской организацией JCI и европейской EFQM.
В Текноне проходят лечение звезды шоу-бизнеса, спортсмены и политики мирового масштаба. Здесь принимали роды у певицы Шакиры, оперировали футболиста ФК “Барселона” Андреса Иньесту и чемпиона Олимпийских игр по метанию копья Томаса Рёлера.
Читать подробнее
| Мастэктомия | $17040 — $21300 |
| Ринопластика (пластика носа) | $8520 — $10118 |
| Химиотерапия | $2663 — $3728 |
| Резекция щитовидной железы | $17040 — $19170 |
Профессор Себастиан Мельхиор
Клиника Бремен-Митте, Германия
Онкоуролог, хирург, более 25 лет опыта
Профессор Себастиан Мельхиор специализируется на роботизированных урологических операциях. Он исследует новые методы лечения в онкологии мочеполовой системы и публикует научные работы по теме. Проходил обучение в США. По версии журнала Focus, входит в ТОП лучших урологов Германии, который составлен на мнении пациентов и врачей. Получил награду Bookimed Awards и звание лучшего специалиста по раку простаты.
Все отзывы прошли проверку
Бремен-Митте — многопрофильная клиника в городе Бремене (Германия), которая входит в сеть медицинских центров Nord Klinik Allianz (Норд Клиник Альянс).
Специализация Бремен-Митте — онкология, ортопедия, хирургия, неврология и нейрохирургия.
В 2015-2016 гг. журнал Focus включил клинику в ТОП ведущих медицинских учреждений Германии. Рейтинг основан на отзывах пациентов и квалификации докторов.
Ежегодно в Бремен-Митте проходят лечение 40 000 пациентов.
Читать подробнее
| Замена сердечного клапана | $21300 — $31951 |
| Ринопластика (пластика носа) | $7455 — $10118 |
| Липосакция | $10650 — $26625 |
| Пересадка почки | $79876 — $101177 |
| Резекция щитовидной железы | $6710 — $7988 |
Что делать, если биопсия показала рак?
Если вы расшифровали результаты биопсии, и она показала, что у вас или у вашего близкого человека рак, вашей первой реакцией могут быть отрицание, страх, паника. Это нормально, но вам нужно взять себя в руки и продумать план выздоровления.
Помните, тестов на онкомаркеры недостаточно для постановки диагноза “рак”.
По данным Bookimed, диагнозы 40% пациентов из СНГ, которые обращаются за рубеж, неверны или неточны. От точности зависит, подберут ли вам эффективное лечение, а значит — и выздоровеете ли вы. Не рискуйте своим здоровьем, получите второе мнение у топовых зарубежных специалистов. Тем более, сейчас для этого необязательно ехать за границу. Узнайте больше о дистанционной консультации
На поздних стадиях рак победить сложнее, поэтому методы лечения агрессивны и влияют на здоровые органы, в т. ч. половые. Если вы планируете в будущем иметь детей, сообщите об этом врачу. При необходимости перед терапией вы пройдете консультацию репродуктолога и сможете заморозить яйцеклетки или сперму.
- Сообщите родным и заручитесь их поддержкой. Необходимо сосредоточиться на том, что вы выздоровеете. Каждый переживает этот период по-своему — кто-то крайне деятельно подходит к лечению, а кто-то впадает в апатию или даже депрессию. Обратитесь к психологу, а лучше — к онкопсихологу, чтобы настроиться на борьбу с заболеванием.
- Убедитесь, что вы прошли полную диагностику. Биопсия определяет тип клеток и вид онкологии. Это самый точный способ определить, есть ли у вас эта болезнь и на какой она стадии. Но для уточнения доктор назначит вам и другие тесты (ПЭТ-КТ для поиска очагов опухоли в организме, сцинтиграфию, чтобы обследовать кости скелета и т. п.).
- Получите второе мнение. Соберите все выписки, анализы и обратитесь к другому онкологу для консультации. Не бойтесь обидеть своего лечащего врача: во всем мире “second opinion” — это нормальная практика. Она уберегла уже тысячи пациентов от неправильного диагноза и лечения, которое не помогает.
- “Включитесь” в процесс лечения. Задайте вопросы врачу, убедитесь, что он может аргументировать выбор того или иного метода, а вы понимаете, что и зачем вы будете проходить.
- Обсудите план процедур с доктором. Зачастую протокол включает удаление опухоли, и на ранних стадиях операции может быть достаточно, чтобы вы выздоровели. Если рак прогрессирует, или новообразование удалить нельзя, онколог включает в ваш план медикаменты— химио-, таргетную или иммунную терапию, и облучение.
- Следуйте предписаниям врача, не тратьте время на сомнительные народные методы — они не помогают. Не сдавайтесь и настройтесь на то, что вы поправитесь. Возможно, для вашего диагноза появились новые, более эффективные и безопасные методы, пока недоступные в СНГ. Оставьте обращение, чтобы получить консультацию по доступным вариантам лечения.
Уточняющие коды онкологических диагнозов
Для уточнения диагноза онкологи могут использовать дополнительные обозначения. Они необязательны и относятся не ко всем разновидностям онкологии.
Критерий, описывающий прорастание опухоли (для полых органов)
- Р1 — образование в пределах слизистой;
- Р2 — патологические клетки выходят в подслизистый слой;
- Р3 — рак проникает в мышечный слой;
- Р4 — процесс вышел за пределы полого органа.
Классификация для сторожевых лимфоузлов
Сторожевыми или регионарными называют первые лимфоузлы на пути оттока лимфы от пораженного опухолью участка. Другими словами, врачам известны типичные пути распространения рака, и они оценивают состояние определенных лимфоузлов. Доктора используют такие обозначения:
- pN 1(sn) — лимфоузел поражен онкопроцессом;
- pNO(sn) — изменения не выявлены;
- pNX(sn) — узел не может быть оценен (по техническим причинам).
Степень злокачественности
Чем примитивнее и мельче клетки, тем они опаснее: низкодифференцированная опухоль быстро распространяется и образует множественные метастазы. Врачи измеряют это в уровнях дифференциации, или степени злокачественности (англ. Grade, «градус»), и обозначают буквой G:
- G1 — высокодифференцированный рак, который редко метастазирует, что улучшает прогноз лечения;
- G2 — умеренно-дифференцированный рак;
- G3-4 — низкодифференцированный и недифференцированный рак, высокий уровень злокачественности;
- Gx — невозможно определить градус (степень) злокачественности.
С-фактор, или классификация по достоверности
Учитывая количество спорных ситуаций, онкологи договорились в сложных случаях указывать предполагаемую точность диагноза — С-фактор:
- С1 — на злокачественную опухоль указывают внешние признаки и стандартные исследования: осмотр, опрос, рентгенография, эндоскопия. Врач учитывает характерные жалобы и симптомы (кровотечения, снижение массы тела и т. д.);
- С2 — данные С1 подтверждаются специальной диагностикой: МРТ, ПЭТ-КТ, ангиографией, прицельным УЗИ, сцинтиграфией и т. п.;
- С3 — вышеперечисленное обследование дополняется биопсией с цитологией;
- С4 — биопсию взяли в процессе хирургического вмешательства и провели цитологическое исследование;
- С5 — данные получены вследствие аутопсии (вскрытия).
Классификация постоперационных опухолей — категория R
Категория R — критерий эффективности лечения, который описывает наличие опухоли после операции:
- R0 — рак отсутствует;
- R1 — микроскопия выявила остаточное образование;
- R2 — новообразование обнаружено без микроскопии;
- RX — оценить наличие или отсутствие опухоли невозможно.
Часто задаваемые вопросы
 Как ставят окончательный диагноз “рак”? Достаточно ли биопсии для постановки диагноза?
Как ставят окончательный диагноз “рак”? Достаточно ли биопсии для постановки диагноза?
Помните, что такой серьезный диагноз нельзя поставить на основании повышенных онкомаркеров — на их уровень влияет множество факторов. Данных УЗИ, КТ, МРТ тоже недостаточно: доктор может лишь заподозрить наличие опухоли и предположить ее вид. То, какие клетки формируют это новообразование, определяет только гистологическое исследование после биопсии. Без ее данных поставить окончательный диагноз невозможно. Спросите у врача, прошли ли вы обследование, достаточное для принятия решений о лечении.
 Может ли биопсия спровоцировать рак?
Может ли биопсия спровоцировать рак?
Институт рака США опровергает это: во время биопсии и операций врачи предпринимают все необходимые действия (например, УЗИ-контроль, использование разных хирургических инструментов), чтобы избежать распространения опухолевых клеток при заборе материала.
 Какие вопросы вам следует задать своему онкологу?
Какие вопросы вам следует задать своему онкологу?
Ваш лечащий онколог — это человек, с которым вам придется в ближайшие месяцы тесно сотрудничать, чтобы вылечиться. Убедитесь, что его опыт и квалификация не вызывают у вас сомнений, а общаться с ним комфортно — ваш психологический настрой не менее важен, чем процесс лечения. Не бойтесь причинить беспокойство врачу своими вопросами, ведь вы доверяете ему свою жизнь.
Спросите у доктора:
- О диагнозе и прогнозе
- Какие это стадия и тип рака? Поразил ли он лимфатические узлы или отдаленные органы?
- Сколько в среднем живут пациенты с этой стадией? Каков мой предполагаемый прогноз?
- Можно ли вылечить рак в моем случае? Насколько эффективно лечение остановит рост опухоли?
- О результатах обследования
- Что означают результаты моего обследования?
- Какую еще диагностику мне нужно будет пройти?
- Нужно ли мне пройти дополнительные тесты (например, иммуногистохимическое исследование биоптата, ИГХ для подбора иммуно- или таргетного препарата)?
- О вашем лечении
- Какие методики будут эффективными в моем случае? Каковы преимущества и недостатки каждого метода? Какие у них побочные эффекты?
- Будет ли эффективным в моем случае прием иммунопрепаратов или таргетных препаратов? Какие лекарства мне подойдут? Доступны ли они в нашей стране?
- Есть ли новые, менее травматичные/более безопасные методы в мире? Где они доступны?
- Как я должен подготовиться к лечению? Как долго оно будет длиться?
- Об опыте врача
- Как много пациентов с таким же диагнозом вы лечили? Сколько из них выздоровели?
- Сколько процедур, которые вы рекомендуете, вы уже провели? Сколько из них были успешными?
- Сверяетесь ли вы с международными протоколами лечения (NCCN, ESMO) для составления плана лечения?
- Что делать дальше (после лечения)?
- Как быстро я смогу вернуться к нормальной жизни?
- Есть ли вероятность рецидива? На какие признаки следует обратить внимание?
- Как часто мне следует посещать врача?
 Что означают буквы в диагнозе “рак”?
Что означают буквы в диагнозе “рак”?
Это медицинские коды онкологических заболеваний. Воспользуйтесь таблицей выше, чтобы расшифровать рак и понять характеристики опухоли. В случае сомнений по поводу диагноза проконсультируйтесь со своим врачом или запросите второе мнение у зарубежного специалиста.

Что означает диагноз CR в медицине?
Врачи пишут диагноз “рак” с помощью обозначения CR, что значит “cancer” — онкология на латыни.
Как расшифровывается болезнь рак?
Слово “рак” как болезнь не расшифровывается — это не медицинская аббревиатура, а перевод латинского слова “cancer”.
Что такое рак БДУ?
В онкологических диагнозах БДУ означает “без дополнительного уточнения” — данных недостаточно.
 Есть ли вероятность ошибки в диагнозе?
Есть ли вероятность ошибки в диагнозе?
Наши врачи-координаторы регулярно сталкиваются с ошибками — до 40% пациентов, которые едут на диагностику или лечение за рубеж, получают там другой диагноз. Вот лишь несколько примеров:
- Женщина, 28 лет, недавно родила. Врачи в России диагностировали рак груди и назначили удаление молочной железы. За рубежом при таком заболевании могут сохранить грудь, поэтому пациентка решила ехать в Испанию. Но там диагностика онкологию не подтвердила — вместо опухоли испанский врач обнаружил застой молока.
- Пациенту-мужчине на родине поставили диагноз “рак горла” и назначили химиотерапию. Он решил обратиться к зарубежному специалисту, и мы организовали ему лечение в Израиле. Но у врача наш пациент пробыл не более 5 минут — именно столько времени понадобилось доктору, чтобы понять: дома за опухоль на снимках приняли рыбную косточку.
Мы не поручимся, что в вашем случае произошла такая же чудовищная ошибка, но удостовериться в диагнозе вы обязаны — от этого зависит ваше здоровье.
 Где лучше лечить рак?
Где лучше лечить рак?
Есть специализированные клиники с мощной технической и исследовательской базой и “звездные” доктора с огромным опытом. При выборе медицинского центра важно учитывать:
- квалификацию доктора и опыт в лечении конкретного вида опухоли, международные сертификации и членство в профильных онкологических организациях, научную деятельность;
- доступ к самым новым методам лечения, одобренным FDA, наличие оборудования и лекарств последнего поколения;
- международные аккредитации медицинского центра, которые подтверждают безопасность и качество лечения;
- отзывы других пациентов с таким же диагнозом.
 На какой стадии рака появляются метастазы?
На какой стадии рака появляются метастазы?
На 3 стадии рак метастазирует в ближайшие к нему лимфатические узлы. На 4 стадии раковые клетки с током крови и лимфы разносятся по организму и формируют вторичные образования в легких, печени, головном мозге и др. органах.
 Можно ли вылечить рак, если пошли метастазы?
Можно ли вылечить рак, если пошли метастазы?
Это зависит от вида и конкретного типа опухоли: некоторые из них крайне агрессивны, но многие поддаются терапии. Если метастазы можно удалить хирургически, вам назначат операцию, если нет — медикаменты и облучение.
Каждые несколько лет на рынок выходят новые, более эффективные препараты, которые дают шанс на продление жизни больных раком и сохранение ее качества. Изначально они доступны только за рубежом, и лишь после череды длительных сертификаций появляются в СНГ.
При неоперабельном раке и метастазах в жизненно важных органах пациентам также назначают паллиативную терапию. Она не лечит рак, а облегчает боль и улучшает самочувствие.
Не ставьте на себе или на своем близком крест. Если вам назначают паллиативную терапию без лечения, получите второе мнение. Вы либо убедитесь, что другие опции недоступны, либо получите возможность остановить развитие рака.
 Убивает ли химиотерапия метастазы?
Убивает ли химиотерапия метастазы?
Задача химиотерапии — уничтожить все раковые клетки в организме. Есть множество химиопрепаратов, которые воздействуют на конкретные типы опухолей. Их эффективность зависит от двух факторов:
- Правильный подбор. Для этого необходимо тщательно проверить ткань опухоли на чувствительность к действующим веществам. Если препарат подходит, очаг уменьшается в размерах. Чтобы рак не стал устойчивым к воздействию, онкологи подбирают несколько лекарств в разной комбинации.
- Качество самих препаратов.Так, клиники в Европе строго его контролируют и не допускают применения просроченных медикаментов или подделок.
 Сколько живут после химиотерапии?
Сколько живут после химиотерапии?
Прогноз для пациента может сделать только онколог, знакомый со всеми особенностями его случая.
 Сколько стоит диагностика рака за границей?
Сколько стоит диагностика рака за границей?
С ценами на диагностику и лечение рака в топовых клиниках мира вы можете ознакомиться в наших каталогах клиник. Оставьте обращение на сайте, чтобы получить консультацию по вашему диагнозу и получить индивидуальную программу процедур.
 Сколько длится диагностика?
Сколько длится диагностика?
Это зависит от конкретной клиники и от объема обследования. В среднем сама диагностика длится от 2 до 5 дней. Больше всего времени занимает ожидание результатов биопсии — 7-10 дней, когда ткани опухоли изучают в специализированной лаборатории.
 Как быстро меня смогут принять в клинике за рубежом?
Как быстро меня смогут принять в клинике за рубежом?
Клиники Европы, Израиля, Турции зачастую дают ответ на ваше обращение в течение 1-3 дней, в отдельных больницах Германии, Южной Кореи срок увеличивается до 5-7 дней. После согласования даты вашего приезда мы помогаем вам организовать поездку (приобрести билеты, забронировать жилье при необходимости) в кратчайшие сроки.
Ежемесячно в Bookimed обращается более 6 000 человек, и для каждого из них мы стараемся найти лучшие варианты клиник и врачей. Оставьте обращение, чтобы узнать, какие медицинские центры за границей могут помочь в вашем случае.
Читайте истории и отзывы наших пациентов
Как Bookimed может помочь вам или вашим близким?
➤ Врачи-координаторы Bookimed подберут для вас клинику и опытного доктора, который специализируются на лечении вашего типа рака. Мы учтем особенности медицинского случая, ваши потребности и пожелания. Вы получите индивидуальную программу процедур со стоимостью и сможете заранее спланировать бюджет поездки.
➤ Bookimed — международный сервис по подбору медицинских решений и организации лечения в 40 странах. Каждый месяц наши врачи-координаторы помогают 9 000 пациентам. Наша миссия — предоставить каждому необходимое медицинское решение и оказать помощь на всех этапах: от выбора клиники и организации поездки до возвращения домой.
➤ Услуги Bookimed для пациентов бесплатны. Подбор решения и организация поездки не влияют на ваш счет за лечение.
В настоящее время врачи ведущих клиник мира применяют инновационные методы лечения рака, которые повышают выживаемость пациентов с метастазами. Успехов в лечении метастатического рака достигли онкологи Юсуповской больницы. В больнице применяются современные методики терапии и диагностики, благодаря чему количество больных, которым удалось продлить жизнь и повысить её качество, за последние годы увеличилось. Врачи Юсуповской больницы применяют комплексное лечение, учитывая общее состояние пациента, локализацию опухоли и активность ее метастазирования.
Проблема метастатического рака
В настоящее время в России большинству пациентов ставится первичный диагноз «рак III-IV стадии». Это значит, что у пациента есть отдаленные метастазы. Им необходимо лечение, которое позволит улучшить состояние и увеличит продолжительность жизни. В Юсуповской больнице лечат пациентов с метастазами, тем самым увеличивая продолжительность жизни.
Что собой представляют метастазы рака
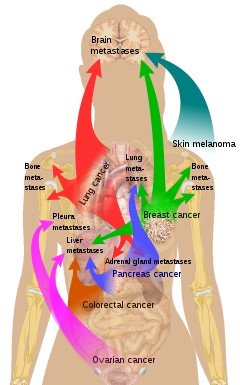
Рак бывает первичным, когда опухоль образуется в органе, и метастатическим (Metastasis по гречески означает перемещение), когда опухолевые клетки поражают другие органы. Независимо от размеров первичной опухоли, наличие отдаленных метастазов говорит о IV стадии рака.
Довольно часто врачи впервые определяют метастазы, не диагностировав первичную опухоль. Это случается в случае таких видов онкологической патологии:
- рак молочной железы;
- меланома кожи;
- рак шейки матки;
- рак простаты
- рак желудка
- рак предстательной железы
- рак поджелудочной железы
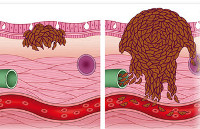
Как атипичные клетки, из которых состоит раковая опухоль, попадают из одного органа в другой? Известны 3 пути метастазирования рака: лимфогенный, с током лимфы, гематогенный, с кровью и имплантационный.
Попадая в кровь или лимфу, раковые клетки разносятся по всему организму, оседая в различных органах. Там они начинают быстро делиться и образуют метастазы. Эпителиальный рак преимущественно метастазирует по лимфатическим сосудам. Для меланомы и различного вида сарком характерный гематогенный путь метастазирования. Метастазы при раке желудка выявляют по путям оттока лимфы.
На процесс распространения метастаз влияют иммунные и биологические процессы. Одни из них способствуют распространению атипичных клеток, а другие блокируют их. В связи с этим процесс метастазирования может быть или активным, или замедленным. Это во многом зависит от степени злокачественности опухолевых клеток.
Скорость распространения метастаз зависит от многих факторов:
- кровоснабжения органа;
- путей лимфооттока;
- степени злокачественности атипичных клеток;
- состояние иммунной системы.
- Возраст пациента
На интенсивность метастазирования также влияют вирусные инфекции, интоксикация, употребление алкоголя, неправильное питание. Противораковый иммунитет ослабляет хронический нервный стресс и нарушение кровоснабжения (облитерация периферических сосудов).
Метастазируют опухоли независимо от локализации в любой орган. Наиболее часто поражаются метастазами:
- печень;
- почки;
- лёгкие;
- центральная нервная система;
- костная система (позвоночник, рёбра, кости черепа, таза и конечностей, грудина);
- яичники
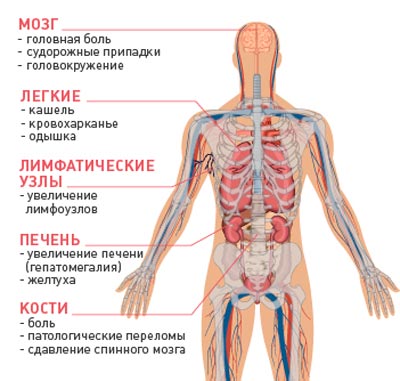
Симптомы метастатического рака
При наличии метастаз речь идёт о запущенной стадии заболевания. Она проявляется такими общими признаками:
- нарушение сна;
- снижение массы тела;
- ухудшение аппетита;
- головные боли;
- выраженная или общая слабость;
- анемия;
- повышение температуры тела.
- Лихорадка, озноб
- диарея, запоры
- тошнота, рвота
Как выглядят метастазы? Местные симптомы зависят от локализации метастаз. При наличии метастатических очагов в лёгких пациентов беспокоит кашель, боль в грудной клетке и одышка. Метастазы в мягких тканях выявляют при меланоме. Когда диагностированы метастазы в печени, симптомы будут следующие:
- боль в правом подреберье;
- увеличение живота в объеме;
- желтушность кожных покровов и сслизистых
- горечь во рту
- зуд кожи
В печень может метастазировать рак кишечника, желудка, молочной железы и другие. Метастазы Крукенберга – это злокачественные клетки, которые «оседают» в яичниках и формируют вторичную опухоль. При метастазах в костях человек чувствует постоянные боли, не купирующиеся анальгетиками, появляются патологические переломы.
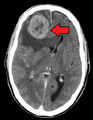
Могут быть метастазы в поджелудочной железе. Когда имеется рак почки, метастазы выявляют в печени, лёгких, головном мозге. Головные боли, головокружение, периодическая рвота, приступы судорог, расстройства чувствительности, памяти, речи, слуха и зрения – это признаки метастазов в головной мозг.
Особо коварные метастазы в позвоночник. Сначала они имеют симптомы, сходные с признаками остеохондроза, не вызывая у больного опасения. Люди не знают, как отличить остеохондроз от метастазов. И только после того, как появляется слабость мышц конечностей, возникают парезы и параличи, врачи обнаруживают значительные изменения в позвонках и признаки сдавления спинного мозга.
Метастазы. Диагностика
В Юсуповской больнице врачи диагностируют метастатический рак, применяя современные методы исследования:
- томографические (МРТ, КТ, ПЭТ-КТ);
- сцинтиграфию костей скелета;
- Ультразвуковое исследование;
- различные диагностические пункции под визуальным контролем томографа;
- полное лабораторное исследование, в том числе определение уровня онкомаркеров в биологических жидкостях, иммунологическое и молекулярно-генетическое;
- эндоскопическую (гастроскопию, бронхоскопию, колоноскопию) диагностику с биопсией;
Лечение метастаз
При лечении метастазов сегодня применяются новейшие достижения молекулярной биологии. Созданы медикаменты, замедляющие рост и уничтожающие клетки метастаз. Врачи Юсуповской больницы применяют комплексное лечение, учитывающее общее состояние здоровья пациента, локализацию основной, вторичной опухоли и их активность метастазирования.
Онкологи Юсуповской больницы применяют индивидуальный подход в лечении пациентов: разрабатывают схему лечения, подбирают максимально подходящие препараты, в зависимости от стадии развития патологического процесса и места расположения злокачественных образований, а также степени поражения здоровых тканей и органов.
В Юсуповской больнице применяются новейшие методики лечения метастаз. Звоните по телефону или запишитесь на прием через форму обратной связи на сайте. Врач-координатор ответит на все ваши вопросы.
| Metastasis | |
|---|---|
| Other names | metastatic disease |
 |
|
| Illustration showing hematogenous metastasis | |
| Pronunciation |
|
| Specialty | Oncology |
Metastasis is a pathogenic agent’s spread from an initial or primary site to a different or secondary site within the host’s body;[1] the term is typically used when referring to metastasis by a cancerous tumor.[2] The newly pathological sites, then, are metastases (mets).[3][4] It is generally distinguished from cancer invasion, which is the direct extension and penetration by cancer cells into neighboring tissues.[5]
Cancer occurs after cells are genetically altered to proliferate rapidly and indefinitely. This uncontrolled proliferation by mitosis produces a primary heterogeneic tumour. The cells which constitute the tumor eventually undergo metaplasia, followed by dysplasia then anaplasia, resulting in a malignant phenotype. This malignancy allows for invasion into the circulation, followed by invasion to a second site for tumorigenesis.
Some cancer cells known as circulating tumor cells acquire the ability to penetrate the walls of lymphatic or blood vessels, after which they are able to circulate through the bloodstream to other sites and tissues in the body.[6] This process is known (respectively) as lymphatic or hematogenous spread. After the tumor cells come to rest at another site, they re-penetrate the vessel or walls and continue to multiply, eventually forming another clinically detectable tumor.[citation needed] This new tumor is known as a metastatic (or secondary) tumor. Metastasis is one of the hallmarks of cancer, distinguishing it from benign tumors.[7] Most cancers can metastasize, although in varying degrees. Basal cell carcinoma for example rarely metastasizes.[7]
When tumor cells metastasize, the new tumor is called a secondary or metastatic tumor, and its cells are similar to those in the original or primary tumor.[8] This means that if breast cancer metastasizes to the lungs, the secondary tumor is made up of abnormal breast cells, not of abnormal lung cells. The tumor in the lung is then called metastatic breast cancer, not lung cancer. Metastasis is a key element in cancer staging systems such as the TNM staging system, where it represents the «M». In overall stage grouping, metastasis places a cancer in Stage IV. The possibilities of curative treatment are greatly reduced, or often entirely removed when a cancer has metastasized.
Signs and symptoms[edit]
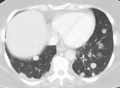
Initially, nearby lymph nodes are struck early.[9] The lungs, liver, brain, and bones are the most common metastasis locations from solid tumors.[9]
- In lymph node metastasis, a common symptom is lymphadenopathy
- Lung metastasis: cough, hemoptysis and dyspnea[9] (shortness of breath)
- Liver metastasis: hepatomegaly (enlarged liver), nausea[9] and jaundice[9]
- Bone metastasis: bone pain,[9] fracture of affected bones[9]
- Brain metastasis: neurological symptoms such as headaches,[9] seizures,[9] and vertigo[9]
Although advanced cancer may cause pain, it is often not the first symptom.
Some patients, however, do not show any symptoms.[9]
When the organ gets a metastatic disease it begins to shrink until its lymph nodes burst, or undergo lysis.
Pathophysiology[edit]
Metastatic tumors are very common in the late stages of cancer. The spread of metastasis may occur via the blood or the lymphatics or through both routes. The most common sites of metastases are the lungs, liver, brain, and the bones.[10]
Currently, three main theories have been proposed to explain the metastatic pathway of cancer: the epithelial-mesenchymal transition (EMT) and mesenchymal-epithelial transition (MET) hypothesis (1), the cancer stem cell hypothesis (2), and the macrophage–cancer cell fusion hybrid hypothesis (3). Some new hypotheses were suggested as well, i.e., under the effect of particular biochemical and/or physical stressors, cancer cells can undergo nuclear expulsion with subsequent macrophage engulfment and fusion, with the formation of cancer fusion cells (CFCs).[11]
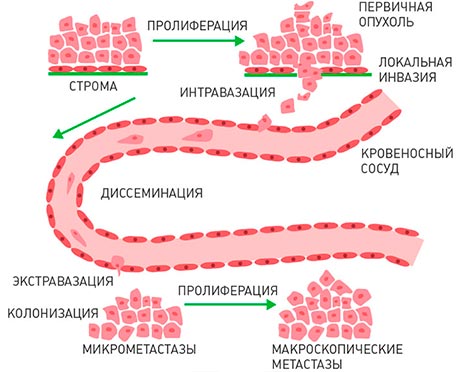
Factors involved[edit]
Metastasis involves a complex series of steps in which cancer cells leave the original tumor site and migrate to other parts of the body via the bloodstream, via the lymphatic system, or by direct extension. To do so, malignant cells break away from the primary tumor and attach to and degrade proteins that make up the surrounding extracellular matrix (ECM), which separates the tumor from adjoining tissues. By degrading these proteins, cancer cells are able to breach the ECM and escape. The location of the metastases is not always random, with different types of cancer tending to spread to particular organs and tissues at a rate that is higher than expected by statistical chance alone.[12] Breast cancer, for example, tends to metastasize to the bones and lungs. This specificity seems to be mediated by soluble signal molecules such as chemokines[13] and transforming growth factor beta.[14] The body resists metastasis by a variety of mechanisms through the actions of a class of proteins known as metastasis suppressors, of which about a dozen are known.[15]
Human cells exhibit different kinds of motion: collective motility, mesenchymal-type movement, and amoeboid movement. Cancer cells often opportunistically switch between different kinds of motion. Some cancer researchers hope to find treatments that can stop or at least slow down the spread of cancer by somehow blocking some necessary step in one or more kinds of motion.[16][17]
All steps of the metastatic cascade involve a number of physical processes. Cell migration requires the generation of forces, and when cancer cells transmigrate through the vasculature, this requires physical gaps in the blood vessels to form.[18] Besides forces, the regulation of various types of cell-cell and cell-matrix adhesions is crucial during metastasis.
The metastatic steps are critically regulated by various cell types, including the blood vessel cells (endothelial cells), immune cells or stromal cells. The growth of a new network of blood vessels, called tumor angiogenesis,[19] is a crucial hallmark of cancer. It has therefore been suggested that angiogenesis inhibitors would prevent the growth of metastases.[7] Endothelial progenitor cells have been shown to have a strong influence on metastasis and angiogenesis.[20][21] Endothelial progenitor cells are important in tumor growth, angiogenesis and metastasis, and can be marked using the Inhibitor of DNA Binding 1 (ID1). This novel finding meant that investigators gained the ability to track endothelial progenitor cells from the bone marrow to the blood to the tumor-stroma and even incorporated in tumor vasculature. Endothelial progenitor cells incorporated in tumor vasculature suggests that this cell type in blood-vessel development is important in a tumor setting and metastasis. Furthermore, ablation of the endothelial progenitor cells in the bone marrow can lead to a significant decrease in tumor growth and vasculature development. Therefore, endothelial progenitor cells are important in tumor biology and present novel therapeutic targets.[22] The immune system is typically deregulated in cancer and affects many stages of tumor progression, including metastasis.
Epigenetic regulation also plays an important role in the metastatic outgrowth of disseminated tumor cells. Metastases display alterations in histone modifications, such as H3K4-methylation and H3K9-methylation, when compared to matching primary tumors.[23] These epigenetic modifications in metastases may allow the proliferation and survival of disseminated tumor cells in distant organs.[24]
A recent study shows that PKC-iota promotes melanoma cell invasion by activating Vimentin during EMT. PKC-iota inhibition or knockdown resulted in an increase in E-cadherin and RhoA levels while decreasing total Vimentin, phosphorylated Vimentin (S39) and Par6 in metastatic melanoma cells. These results suggested that PKC-ι is involved in signaling pathways which upregulate EMT in melanoma thereby directly stimulates metastasis.[25]
Recently, a series of high-profile experiments suggests that the co-option of intercellular cross-talk mediated by exosome vesicles is a critical factor involved in all steps of the invasion-metastasis cascade.[26]
Routes[edit]
Metastasis occurs by the following four routes:
Transcoelomic[edit]
The spread of a malignancy into body cavities can occur via penetrating the surface of the peritoneal, pleural, pericardial, or subarachnoid spaces. For example, ovarian tumors can spread transperitoneally to the surface of the liver.
Lymphatic spread[edit]
Lymphatic spread allows the transport of tumor cells to regional lymph nodes near the primary tumor and ultimately, to other parts of the body. This is called nodal involvement, positive nodes, or regional disease. «Positive nodes» is a term that would be used by medical specialists to describe regional lymph nodes that tested positive for malignancy. It is common medical practice to test by biopsy at least one lymph node near a tumor site when carrying out surgery to examine or remove a tumor. This lymph node is then called a sentinel lymph node.
Lymphatic spread is the most common route of initial metastasis for carcinomas.[7] In contrast, it is uncommon for a sarcoma to metastasize via this route. Localized spread to regional lymph nodes near the primary tumor is not normally counted as a metastasis, although this is a sign of a worse outcome.
The lymphatic system does eventually drain from the thoracic duct and right lymphatic duct into the systemic venous system at the venous angle and into the brachiocephalic veins, and therefore these metastatic cells can also eventually spread through the haematogenous route.
Lymph node with almost complete replacement by metastatic melanoma. The brown pigment is focal deposition of melanin
Hematogenous spread[edit]
This is typical route of metastasis for sarcomas, but it is also the favored route for certain types of carcinoma, such as renal cell carcinoma originating in the kidney and follicular carcinomas of the thyroid. Because of their thinner walls, veins are more frequently invaded than are arteries, and metastasis tends to follow the pattern of venous flow. That is, hematogenous spread often follows distinct patterns depending on the location of the primary tumor. For example, colorectal cancer spreads primarily through the portal vein to the liver.
Canalicular spread[edit]
Some tumors, especially carcinomas may metastasize along anatomical canalicular spaces. These spaces include for example the bile ducts, the urinary system, the airways and the subarachnoid space. The process is similar to that of transcoelomic spread. However, often it remains unclear whether simultaneously diagnosed tumors of a canalicular system are one metastatic process or in fact independent tumors caused by the same agent (field cancerization).
Organ-specific targets[edit]
Main sites of metastases for some common cancer types. Primary cancers are denoted by «…cancer» and their main metastasis sites are denoted by «…metastases«.[27]
There is a propensity for certain tumors to seed in particular organs. This was first discussed as the «seed and soil» theory by Stephen Paget in 1889.[28] The propensity for a metastatic cell to spread to a particular organ is termed ‘organotropism’. For example, prostate cancer usually metastasizes to the bones. In a similar manner, colon cancer has a tendency to metastasize to the liver. Stomach cancer often metastasises to the ovary in women, when it is called a Krukenberg tumor.
According to the «seed and soil» theory, it is difficult for cancer cells to survive outside their region of origin, so in order to metastasize they must find a location with similar characteristics.[29] For example, breast tumor cells, which gather calcium ions from breast milk, metastasize to bone tissue, where they can gather calcium ions from bone. Malignant melanoma spreads to the brain, presumably because neural tissue and melanocytes arise from the same cell line in the embryo.[30]
In 1928, James Ewing challenged the «seed and soil» theory and proposed that metastasis occurs purely by anatomic and mechanical routes. This hypothesis has been recently utilized to suggest several hypotheses about the life cycle of circulating tumor cells (CTCs) and to postulate that the patterns of spread could be better understood through a ‘filter and flow’ perspective.[31] However, contemporary evidences indicate that the primary tumour may dictate organotropic metastases by inducing the formation of pre-metastatic niches at distant sites, where incoming metastatic cells may engraft and colonise.[26] Specifically, exosome vesicles secreted by tumours have been shown to home to pre-metastatic sites, where they activate pro-metastatic processes such as angiogenesis and modify the immune contexture, so as to foster a favourable microenvironment for secondary tumour growth.[26]
Metastasis and primary cancer[edit]
It is theorized that metastasis always coincides with a primary cancer, and, as such, is a tumor that started from a cancer cell or cells in another part of the body. However, over 10% of patients presenting to oncology units will have metastases without a primary tumor found. In these cases, doctors refer to the primary tumor as «unknown» or «occult,» and the patient is said to have cancer of unknown primary origin (CUP) or unknown primary tumors (UPT).[32] It is estimated that 3% of all cancers are of unknown primary origin.[33] Studies have shown that, if simple questioning does not reveal the cancer’s source (coughing up blood—»probably lung», urinating blood—»probably bladder»), complex imaging will not either.[33] In some of these cases a primary tumor may appear later.
The use of immunohistochemistry has permitted pathologists to give an identity to many of these metastases. However, imaging of the indicated area only occasionally reveals a primary. In rare cases (e.g., of melanoma), no primary tumor is found, even on autopsy. It is therefore thought that some primary tumors can regress completely, but leave their metastases behind. In other cases, the tumor might just be too small and/or in an unusual location to be diagnosed.
Diagnosis[edit]
Pulmonary metastases shown on Chest X-Ray
The cells in a metastatic tumor resemble those in the primary tumor. Once the cancerous tissue is examined under a microscope to determine the cell type, a doctor can usually tell whether that type of cell is normally found in the part of the body from which the tissue sample was taken.
For instance, breast cancer cells look the same whether they are found in the breast or have spread to another part of the body. So, if a tissue sample taken from a tumor in the lung contains cells that look like breast cells, the doctor determines that the lung tumor is a secondary tumor. Still, the determination of the primary tumor can often be very difficult, and the pathologist may have to use several adjuvant techniques, such as immunohistochemistry, FISH (fluorescent in situ hybridization), and others. Despite the use of techniques, in some cases the primary tumor remains unidentified.
Metastatic cancers may be found at the same time as the primary tumor, or months or years later. When a second tumor is found in a patient that has been treated for cancer in the past, it is more often a metastasis than another primary tumor.
It was previously thought that most cancer cells have a low metastatic potential and that there are rare cells that develop the ability to metastasize through the development of somatic mutations.[34] According to this theory, diagnosis of metastatic cancers is only possible after the event of metastasis. Traditional means of diagnosing cancer (e.g. a biopsy) would only investigate a subpopulation of the cancer cells and would very likely not sample from the subpopulation with metastatic potential.[35]
The somatic mutation theory of metastasis development has not been substantiated in human cancers. Rather, it seems that the genetic state of the primary tumor reflects the ability of that cancer to metastasize.[35] Research comparing gene expression between primary and metastatic adenocarcinomas identified a subset of genes whose expression could distinguish primary tumors from metastatic tumors, dubbed a «metastatic signature.»[35] Up-regulated genes in the signature include: SNRPF, HNRPAB, DHPS and securin. Actin, myosin and MHC class II down-regulation was also associated with the signature. Additionally, the metastatic-associated expression of these genes was also observed in some primary tumors, indicating that cells with the potential to metastasize could be identified concurrently with diagnosis of the primary tumor.[36] Recent work identified a form of genetic instability in cancer called chromosome instability (CIN) as a driver of metastasis.[37] In aggressive cancer cells, loose DNA fragments from unstable chromosomes spill in the cytosol leading to the chronic activation of innate immune pathways, which are hijacked by cancer cells to spread to distant organs.
Expression of this metastatic signature has been correlated with a poor prognosis and has been shown to be consistent in several types of cancer. Prognosis was shown to be worse for individuals whose primary tumors expressed the metastatic signature.[35] Additionally, the expression of these metastatic-associated genes was shown to apply to other cancer types in addition to adenocarcinoma. Metastases of breast cancer, medulloblastoma and prostate cancer all had similar expression patterns of these metastasis-associated genes.[35]
The identification of this metastasis-associated signature provides promise for identifying cells with metastatic potential within the primary tumor and hope for improving the prognosis of these metastatic-associated cancers. Additionally, identifying the genes whose expression is changed in metastasis offers potential targets to inhibit metastasis.[35]
-
Cut surface of a humerus sawn lengthwise, showing a large cancerous metastasis (the whitish tumor between the head and the shaft of the bone)
-
-
Metastatic cancer in the lungs
-
Metastases from the lungs to the brain
-
Metastases from the lungs to the pancreas
Management[edit]
Treatment and survival is determined, to a great extent, by whether or not a cancer remains localized or spreads to other locations in the body. If the cancer metastasizes to other tissues or organs it usually dramatically increases a patient’s likelihood of death. Some cancers—such as some forms of leukemia, a cancer of the blood, or malignancies in the brain—can kill without spreading at all.
Once a cancer has metastasized it may still be treated with radiosurgery, chemotherapy, radiation therapy, biological therapy, hormone therapy, surgery, or a combination of these interventions («multimodal therapy»). The choice of treatment depends on many factors, including the type of primary cancer, the size and location of the metastases, the patient’s age and general health, and the types of treatments used previously. In patients diagnosed with CUP it is often still possible to treat the disease even when the primary tumor cannot be located.
Current treatments are rarely able to cure metastatic cancer though some tumors, such as testicular cancer and thyroid cancer, are usually curable.
Palliative care, care aimed at improving the quality of life of people with major illness, has been recommended as part of management programs for metastasis.[38] Results from a systematic review of the literature on radiation therapy for brain metastases found that there is little evidence to inform comparative effectiveness and patient-centered outcomes on quality of life, functional status, and cognitive effects.[39]
Research[edit]
Although metastasis is widely accepted to be the result of the tumor cells migration, there is a hypothesis saying that some metastases are the result of inflammatory processes by abnormal immune cells.[40] The existence of metastatic cancers in the absence of primary tumors also suggests that metastasis is not always caused by malignant cells that leave primary tumors.[41]
The research done by Sarna’s team proved that heavily pigmented melanoma cells have Young’s modulus about 4.93, when in non-pigmented ones it was only 0.98.[42] In another experiment they found that elasticity of melanoma cells is important for its metastasis and growth: non-pigmented tumors were bigger than pigmented and it was much easier for them to spread. They shown that there are both pigmented and non-pigmented cells in melanoma tumors, so that they can both be drug-resistant and metastatic.[42]
History[edit]
The first physician to report the possibility of local metastasis from a primary cancerous source to nearby tissues was Ibn Sina. He described a case of breast cancer and metastatic condition in The Canon of Medicine. His hypothesis was based on clinical course of the patient.[43][44]
In March 2014 researchers discovered the oldest complete example of a human with metastatic cancer. The tumors had developed in a 3,000-year-old skeleton found in 2013 in a tomb in Sudan dating back to 1200 BC. The skeleton was analyzed using radiography and a scanning electron microscope. These findings were published in the Public Library of Science journal.[45][46][47]
Etymology[edit]
Metastasis is a Greek word meaning «displacement», from μετά, meta, «next», and στάσις, stasis, «placement».
See also[edit]
- Abscopal effect
- Brain metastasis
- Brown-Séquard syndrome (Sections on cavernous malformation, germinoma, renal cell carcinoma and lung cancer)
- Collective cell migration
- Contact normalization
- Disseminated disease
- Micrometastasis
- Mouse models of breast cancer metastasis
- Positron emission tomography (PET)
- Urogenital pelvic malignancy
References[edit]
- ^ «Metastasis», Merriam–Webster online, accessed 20 Aug 2017.
- ^ «What is Metastasis?». Cancer.Net. 2 February 2016.
- ^ Klein CA (September 2008). «Cancer. The metastasis cascade». Science. 321 (5897): 1785–7. doi:10.1126/science.1164853. PMID 18818347. S2CID 206515808.
- ^ Chiang AC, Massagué J (December 2008). «Molecular basis of metastasis». The New England Journal of Medicine. 359 (26): 2814–23. doi:10.1056/NEJMra0805239. PMC 4189180. PMID 19109576.
- ^ «Invasion and metastasis». Cancer Australia. 2014-12-16. Retrieved 2018-10-26.
- ^ Maheswaran S, Haber DA (February 2010). «Circulating tumor cells: a window into cancer biology and metastasis». Current Opinion in Genetics & Development. 20 (1): 96–9. doi:10.1016/j.gde.2009.12.002. PMC 2846729. PMID 20071161.
- ^ a b c d Kumar V, Abbas AK, Fausto N, Robbins SL, Cotran RS (2005). Robbins and Cotran pathologic basis of disease (7th ed.). Philadelphia: Elsevier Saunders. ISBN 978-0-7216-0187-8.
- ^ «O que é a metástase?» (in Brazilian Portuguese). Dr. Felipe Ades MD PhD—Oncologista. 2018-07-24. Retrieved 2018-10-23.
- ^ a b c d e f g h i j k National Cancer Institute: Metastatic Cancer: Questions and Answers. Retrieved on<rc-c2d-number> 2008-11-01</rc-c2d-number>
- ^ «Metastatic Cancer: Questions and Answers». National Cancer Institute. Retrieved 2008-08-28.
- ^ Olteanu G-E, Mihai I-M, Bojin F, Gavriliuc O, Paunescu V. The natural adaptive evolution of cancer: The metastatic ability of cancer cells. Bosn J of Basic Med Sci [Internet]. 2020Feb.3;. Available from: https://www.bjbms.org/ojs/index.php/bjbms/article/view/4565
- ^ Nguyen DX, Massagué J (May 2007). «Genetic determinants of cancer metastasis». Nature Reviews. Genetics. 8 (5): 341–52. doi:10.1038/nrg2101. PMID 17440531. S2CID 17745552.
- ^ Zlotnik A, Burkhardt AM, Homey B (August 2011). «Homeostatic chemokine receptors and organ-specific metastasis». Nature Reviews. Immunology. 11 (9): 597–606. doi:10.1038/nri3049. PMID 21866172. S2CID 34438005.
- ^ Drabsch Y, ten Dijke P (June 2011). «TGF-β signaling in breast cancer cell invasion and bone metastasis». Journal of Mammary Gland Biology and Neoplasia. 16 (2): 97–108. doi:10.1007/s10911-011-9217-1. PMC 3095797. PMID 21494783.
- ^ Yoshida BA, Sokoloff MM, Welch DR, Rinker-Schaeffer CW (November 2000). «Metastasis-suppressor genes: a review and perspective on an emerging field». Journal of the National Cancer Institute. 92 (21): 1717–30. doi:10.1093/jnci/92.21.1717. PMID 11058615.
- ^
Matteo Parri, Paola Chiarugi.
«Rac and Rho GTPases in cancer cell motility control» 2010 - ^ Friedl P, Wolf K (May 2003). «Tumour-cell invasion and migration: diversity and escape mechanisms». Nature Reviews. Cancer. 3 (5): 362–74. doi:10.1038/nrc1075. PMID 12724734. S2CID 5547981.
- ^ Escribano J, Chen MB, Moeendarbary E, Cao X, Shenoy V, Garcia-Aznar JM, et al. (May 2019). «Balance of mechanical forces drives endothelial gap formation and may facilitate cancer and immune-cell extravasation». PLOS Computational Biology. 15 (5): e1006395. arXiv:1811.09326. Bibcode:2019PLSCB..15E6395E. doi:10.1371/journal.pcbi.1006395. PMC 6497229. PMID 31048903.
- ^ Weidner N, Semple JP, Welch WR, Folkman J (January 1991). «Tumor angiogenesis and metastasis—correlation in invasive breast carcinoma». The New England Journal of Medicine. 324 (1): 1–8. doi:10.1056/NEJM199101033240101. PMID 1701519.
- ^ Gao D, Nolan DJ, Mellick AS, Bambino K, McDonnell K, Mittal V (January 2008). «Endothelial progenitor cells control the angiogenic switch in mouse lung metastasis». Science. 319 (5860): 195–8. Bibcode:2008Sci…319..195G. doi:10.1126/science.1150224. PMID 18187653. S2CID 12577022.
- ^ Nolan DJ, Ciarrocchi A, Mellick AS, Jaggi JS, Bambino K, Gupta S, et al. (June 2007). «Bone marrow-derived endothelial progenitor cells are a major determinant of nascent tumor neovascularization». Genes & Development. 21 (12): 1546–58. doi:10.1101/gad.436307. PMC 1891431. PMID 17575055.
- ^ Mellick AS, Plummer PN, Nolan DJ, Gao D, Bambino K, Hahn M, et al. (September 2010). «Using the transcription factor inhibitor of DNA binding 1 to selectively target endothelial progenitor cells offers novel strategies to inhibit tumor angiogenesis and growth». Cancer Research. 70 (18): 7273–82. doi:10.1158/0008-5472.CAN-10-1142. PMC 3058751. PMID 20807818.
- ^ Franci C, Zhou J, Jiang Z, Modrusan Z, Good Z, Jackson E, Kouros-Mehr H (2013). «Biomarkers of residual disease, disseminated tumor cells, and metastases in the MMTV-PyMT breast cancer model». PLOS ONE. 8 (3): e58183. Bibcode:2013PLoSO…858183F. doi:10.1371/journal.pone.0058183. PMC 3592916. PMID 23520493.
- ^ Lujambio A, Esteller M (February 2009). «How epigenetics can explain human metastasis: a new role for microRNAs». Cell Cycle. 8 (3): 377–82. doi:10.4161/cc.8.3.7526. PMID 19177007.
- ^ Ratnayake WS, Apostolatos AH, Ostrov DA, Acevedo-Duncan M (November 2017). «Two novel atypical PKC inhibitors; ACPD and DNDA effectively mitigate cell proliferation and epithelial to mesenchymal transition of metastatic melanoma while inducing apoptosis». International Journal of Oncology. 51 (5): 1370–1382. doi:10.3892/ijo.2017.4131. PMC 5642393. PMID 29048609.
- ^ a b c Syn N, Wang L, Sethi G, Thiery JP, Goh BC (July 2016). «Exosome-Mediated Metastasis: From Epithelial-Mesenchymal Transition to Escape from Immunosurveillance». Trends in Pharmacological Sciences. 37 (7): 606–617. doi:10.1016/j.tips.2016.04.006. PMID 27157716.
- ^ List of included entries and references is found on main image page in Commons: Commons:File:Metastasis sites for common cancers.svg#Summary
- ^ Ribatti D, Mangialardi G, Vacca A (December 2006). «Stephen Paget and the ‘seed and soil’ theory of metastatic dissemination». Clinical and Experimental Medicine. 6 (4): 145–149. doi:10.1007/s10238-006-0117-4. PMID 17191105. S2CID 26736196.
- ^ Hart IR (1982). «‘Seed and soil’ revisited: mechanisms of site-specific metastasis». Cancer and Metastasis Reviews. 1 (1): 5–16. doi:10.1007/BF00049477. PMID 6764375. S2CID 19573769.
- ^ Weinberg RA (2007). The Biology of Cancer. New York: Taylor & Francis. ISBN 978-0-8153-4076-8. quoted in Angier N (3 April 2007). «Basics: A mutinous group of cells on a greedy, destructive task». The New York Times.
- ^ Scott J, Kuhn P, Anderson AR (July 2012). «Unifying metastasis—integrating intravasation, circulation and end-organ colonization». Nature Reviews. Cancer. 12 (7): 445–6. doi:10.1038/nrc3287. PMC 4533867. PMID 22912952.
- ^ Ettinger DS, Agulnik M, Cates JM, Cristea M, Denlinger CS, Eaton KD, et al. (December 2011). «NCCN Clinical Practice Guidelines Occult primary». Journal of the National Comprehensive Cancer Network. 9 (12): 1358–95. doi:10.6004/jnccn.2011.0117. PMID 22157556.
- ^ a b Briasoulis E, Pavlidis N (1997). «Cancer of Unknown Primary Origin». The Oncologist. 2 (3): 142–152. doi:10.1634/theoncologist.2-3-142. PMID 10388044.
- ^ Poste G, Fidler IJ (January 1980). «The pathogenesis of cancer metastasis». Nature. 283 (5743): 139–46. Bibcode:1980Natur.283..139P. CiteSeerX 10.1.1.553.5472. doi:10.1038/283139a0. PMID 6985715. S2CID 4302076.
- ^ a b c d e f Ramaswamy S, Ross KN, Lander ES, Golub TR (January 2003). «A molecular signature of metastasis in primary solid tumors». Nature Genetics. 33 (1): 49–54. doi:10.1038/ng1060. PMID 12469122. S2CID 12059602.
- ^ van ‘t Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AA, Mao M, et al. (January 2002). «Gene expression profiling predicts clinical outcome of breast cancer». Nature. 415 (6871): 530–6. doi:10.1038/415530a. hdl:1874/15552. PMID 11823860. S2CID 4369266.
- ^ Bakhoum SF, Ngo B, Laughney AM, Cavallo JA, Murphy CJ, Ly P, et al. (January 2018). «Chromosomal instability drives metastasis through a cytosolic DNA response». Nature. 553 (7689): 467–472. Bibcode:2018Natur.553..467B. doi:10.1038/nature25432. PMC 5785464. PMID 29342134.
- ^ Irwin KE, Greer JA, Khatib J, Temel JS, Pirl WF (February 2013). «Early palliative care and metastatic non-small cell lung cancer: potential mechanisms of prolonged survival». Chronic Respiratory Disease. 10 (1): 35–47. doi:10.1177/1479972312471549. PMID 23355404. S2CID 6743524.
- ^ Garsa A, Jang JK, Baxi S, Chen C, Akinniranye O, Hall O, et al. (2021). «Radiation Therapy for Brain Metastases: A Systematic Review». Practical Radiation Oncology. 11 (5): 354–365. doi:10.1016/j.prro.2021.04.002. PMID 34119447.
- ^ Shahriyari L (2016). «A new hypothesis: some metastases are the result of inflammatory processes by adapted cells, especially adapted immune cells at sites of inflammation». F1000Research. 5: 175. doi:10.12688/f1000research.8055.1. PMC 4847566. PMID 27158448.
- ^ López-Lázaro M (2015-01-01). «The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis». Oncoscience. 2 (5): 467–75. doi:10.18632/oncoscience.159. PMC 4468332. PMID 26097879.
- ^ a b Sarna M, Krzykawska-Serda M, Jakubowska M, Zadlo A, Urbanska K (June 2019). «Melanin presence inhibits melanoma cell spread in mice in a unique mechanical fashion». Scientific Reports. 9 (1): 9280. Bibcode:2019NatSR…9.9280S. doi:10.1038/s41598-019-45643-9. PMC 6594928. PMID 31243305.
- ^ Zarshenas MM, Mohammadi-Bardbori A (February 2017). «A medieval description of metastatic breast cancer; from Avicenna’s view point». Breast. 31: 20–21. doi:10.1016/j.breast.2016.10.019. PMID 27810694.
- ^ Kardeh S, Kardeh B (2019-01-01). «Avicenna’s Concepts on Cancer Metastasis from the 11th Century». Galen Medical Journal. 8: e1292. doi:10.31661/gmj.v8i0.1292. PMC 8344088. PMID 34466487.
- ^ Kelland K (17 March 2014). «Archaeologists discover earliest example of human with cancer». Reuters. Retrieved 18 March 2014.
- ^ Ghosh P (18 March 2014). «Ancient skeleton is the earliest case of cancer yet detected». BBC. Retrieved 18 March 2014.
- ^ Ross P (17 March 2014). «Possible Oldest Cancer Found In 3,000-Year-Old Skeleton Could Reveal ‘Evolution’ Of Modern Disease». International Business Times. Retrieved 18 March 2014.
External links[edit]
Look up metastasis in Wiktionary, the free dictionary.
Wikimedia Commons has media related to Metastases.
- Q&A: Metastatic Cancer—from the National Cancer Institute
- How does cancer spread — the route by TED-Ed
| Metastasis | |
|---|---|
| Other names | metastatic disease |
 |
|
| Illustration showing hematogenous metastasis | |
| Pronunciation |
|
| Specialty | Oncology |
Metastasis is a pathogenic agent’s spread from an initial or primary site to a different or secondary site within the host’s body;[1] the term is typically used when referring to metastasis by a cancerous tumor.[2] The newly pathological sites, then, are metastases (mets).[3][4] It is generally distinguished from cancer invasion, which is the direct extension and penetration by cancer cells into neighboring tissues.[5]
Cancer occurs after cells are genetically altered to proliferate rapidly and indefinitely. This uncontrolled proliferation by mitosis produces a primary heterogeneic tumour. The cells which constitute the tumor eventually undergo metaplasia, followed by dysplasia then anaplasia, resulting in a malignant phenotype. This malignancy allows for invasion into the circulation, followed by invasion to a second site for tumorigenesis.
Some cancer cells known as circulating tumor cells acquire the ability to penetrate the walls of lymphatic or blood vessels, after which they are able to circulate through the bloodstream to other sites and tissues in the body.[6] This process is known (respectively) as lymphatic or hematogenous spread. After the tumor cells come to rest at another site, they re-penetrate the vessel or walls and continue to multiply, eventually forming another clinically detectable tumor.[citation needed] This new tumor is known as a metastatic (or secondary) tumor. Metastasis is one of the hallmarks of cancer, distinguishing it from benign tumors.[7] Most cancers can metastasize, although in varying degrees. Basal cell carcinoma for example rarely metastasizes.[7]
When tumor cells metastasize, the new tumor is called a secondary or metastatic tumor, and its cells are similar to those in the original or primary tumor.[8] This means that if breast cancer metastasizes to the lungs, the secondary tumor is made up of abnormal breast cells, not of abnormal lung cells. The tumor in the lung is then called metastatic breast cancer, not lung cancer. Metastasis is a key element in cancer staging systems such as the TNM staging system, where it represents the «M». In overall stage grouping, metastasis places a cancer in Stage IV. The possibilities of curative treatment are greatly reduced, or often entirely removed when a cancer has metastasized.
Signs and symptoms[edit]
Initially, nearby lymph nodes are struck early.[9] The lungs, liver, brain, and bones are the most common metastasis locations from solid tumors.[9]
- In lymph node metastasis, a common symptom is lymphadenopathy
- Lung metastasis: cough, hemoptysis and dyspnea[9] (shortness of breath)
- Liver metastasis: hepatomegaly (enlarged liver), nausea[9] and jaundice[9]
- Bone metastasis: bone pain,[9] fracture of affected bones[9]
- Brain metastasis: neurological symptoms such as headaches,[9] seizures,[9] and vertigo[9]
Although advanced cancer may cause pain, it is often not the first symptom.
Some patients, however, do not show any symptoms.[9]
When the organ gets a metastatic disease it begins to shrink until its lymph nodes burst, or undergo lysis.
Pathophysiology[edit]
Metastatic tumors are very common in the late stages of cancer. The spread of metastasis may occur via the blood or the lymphatics or through both routes. The most common sites of metastases are the lungs, liver, brain, and the bones.[10]
Currently, three main theories have been proposed to explain the metastatic pathway of cancer: the epithelial-mesenchymal transition (EMT) and mesenchymal-epithelial transition (MET) hypothesis (1), the cancer stem cell hypothesis (2), and the macrophage–cancer cell fusion hybrid hypothesis (3). Some new hypotheses were suggested as well, i.e., under the effect of particular biochemical and/or physical stressors, cancer cells can undergo nuclear expulsion with subsequent macrophage engulfment and fusion, with the formation of cancer fusion cells (CFCs).[11]
Factors involved[edit]
Metastasis involves a complex series of steps in which cancer cells leave the original tumor site and migrate to other parts of the body via the bloodstream, via the lymphatic system, or by direct extension. To do so, malignant cells break away from the primary tumor and attach to and degrade proteins that make up the surrounding extracellular matrix (ECM), which separates the tumor from adjoining tissues. By degrading these proteins, cancer cells are able to breach the ECM and escape. The location of the metastases is not always random, with different types of cancer tending to spread to particular organs and tissues at a rate that is higher than expected by statistical chance alone.[12] Breast cancer, for example, tends to metastasize to the bones and lungs. This specificity seems to be mediated by soluble signal molecules such as chemokines[13] and transforming growth factor beta.[14] The body resists metastasis by a variety of mechanisms through the actions of a class of proteins known as metastasis suppressors, of which about a dozen are known.[15]
Human cells exhibit different kinds of motion: collective motility, mesenchymal-type movement, and amoeboid movement. Cancer cells often opportunistically switch between different kinds of motion. Some cancer researchers hope to find treatments that can stop or at least slow down the spread of cancer by somehow blocking some necessary step in one or more kinds of motion.[16][17]
All steps of the metastatic cascade involve a number of physical processes. Cell migration requires the generation of forces, and when cancer cells transmigrate through the vasculature, this requires physical gaps in the blood vessels to form.[18] Besides forces, the regulation of various types of cell-cell and cell-matrix adhesions is crucial during metastasis.
The metastatic steps are critically regulated by various cell types, including the blood vessel cells (endothelial cells), immune cells or stromal cells. The growth of a new network of blood vessels, called tumor angiogenesis,[19] is a crucial hallmark of cancer. It has therefore been suggested that angiogenesis inhibitors would prevent the growth of metastases.[7] Endothelial progenitor cells have been shown to have a strong influence on metastasis and angiogenesis.[20][21] Endothelial progenitor cells are important in tumor growth, angiogenesis and metastasis, and can be marked using the Inhibitor of DNA Binding 1 (ID1). This novel finding meant that investigators gained the ability to track endothelial progenitor cells from the bone marrow to the blood to the tumor-stroma and even incorporated in tumor vasculature. Endothelial progenitor cells incorporated in tumor vasculature suggests that this cell type in blood-vessel development is important in a tumor setting and metastasis. Furthermore, ablation of the endothelial progenitor cells in the bone marrow can lead to a significant decrease in tumor growth and vasculature development. Therefore, endothelial progenitor cells are important in tumor biology and present novel therapeutic targets.[22] The immune system is typically deregulated in cancer and affects many stages of tumor progression, including metastasis.
Epigenetic regulation also plays an important role in the metastatic outgrowth of disseminated tumor cells. Metastases display alterations in histone modifications, such as H3K4-methylation and H3K9-methylation, when compared to matching primary tumors.[23] These epigenetic modifications in metastases may allow the proliferation and survival of disseminated tumor cells in distant organs.[24]
A recent study shows that PKC-iota promotes melanoma cell invasion by activating Vimentin during EMT. PKC-iota inhibition or knockdown resulted in an increase in E-cadherin and RhoA levels while decreasing total Vimentin, phosphorylated Vimentin (S39) and Par6 in metastatic melanoma cells. These results suggested that PKC-ι is involved in signaling pathways which upregulate EMT in melanoma thereby directly stimulates metastasis.[25]
Recently, a series of high-profile experiments suggests that the co-option of intercellular cross-talk mediated by exosome vesicles is a critical factor involved in all steps of the invasion-metastasis cascade.[26]
Routes[edit]
Metastasis occurs by the following four routes:
Transcoelomic[edit]
The spread of a malignancy into body cavities can occur via penetrating the surface of the peritoneal, pleural, pericardial, or subarachnoid spaces. For example, ovarian tumors can spread transperitoneally to the surface of the liver.
Lymphatic spread[edit]
Lymphatic spread allows the transport of tumor cells to regional lymph nodes near the primary tumor and ultimately, to other parts of the body. This is called nodal involvement, positive nodes, or regional disease. «Positive nodes» is a term that would be used by medical specialists to describe regional lymph nodes that tested positive for malignancy. It is common medical practice to test by biopsy at least one lymph node near a tumor site when carrying out surgery to examine or remove a tumor. This lymph node is then called a sentinel lymph node.
Lymphatic spread is the most common route of initial metastasis for carcinomas.[7] In contrast, it is uncommon for a sarcoma to metastasize via this route. Localized spread to regional lymph nodes near the primary tumor is not normally counted as a metastasis, although this is a sign of a worse outcome.
The lymphatic system does eventually drain from the thoracic duct and right lymphatic duct into the systemic venous system at the venous angle and into the brachiocephalic veins, and therefore these metastatic cells can also eventually spread through the haematogenous route.
Lymph node with almost complete replacement by metastatic melanoma. The brown pigment is focal deposition of melanin
Hematogenous spread[edit]
This is typical route of metastasis for sarcomas, but it is also the favored route for certain types of carcinoma, such as renal cell carcinoma originating in the kidney and follicular carcinomas of the thyroid. Because of their thinner walls, veins are more frequently invaded than are arteries, and metastasis tends to follow the pattern of venous flow. That is, hematogenous spread often follows distinct patterns depending on the location of the primary tumor. For example, colorectal cancer spreads primarily through the portal vein to the liver.
Canalicular spread[edit]
Some tumors, especially carcinomas may metastasize along anatomical canalicular spaces. These spaces include for example the bile ducts, the urinary system, the airways and the subarachnoid space. The process is similar to that of transcoelomic spread. However, often it remains unclear whether simultaneously diagnosed tumors of a canalicular system are one metastatic process or in fact independent tumors caused by the same agent (field cancerization).
Organ-specific targets[edit]
Main sites of metastases for some common cancer types. Primary cancers are denoted by «…cancer» and their main metastasis sites are denoted by «…metastases«.[27]
There is a propensity for certain tumors to seed in particular organs. This was first discussed as the «seed and soil» theory by Stephen Paget in 1889.[28] The propensity for a metastatic cell to spread to a particular organ is termed ‘organotropism’. For example, prostate cancer usually metastasizes to the bones. In a similar manner, colon cancer has a tendency to metastasize to the liver. Stomach cancer often metastasises to the ovary in women, when it is called a Krukenberg tumor.
According to the «seed and soil» theory, it is difficult for cancer cells to survive outside their region of origin, so in order to metastasize they must find a location with similar characteristics.[29] For example, breast tumor cells, which gather calcium ions from breast milk, metastasize to bone tissue, where they can gather calcium ions from bone. Malignant melanoma spreads to the brain, presumably because neural tissue and melanocytes arise from the same cell line in the embryo.[30]
In 1928, James Ewing challenged the «seed and soil» theory and proposed that metastasis occurs purely by anatomic and mechanical routes. This hypothesis has been recently utilized to suggest several hypotheses about the life cycle of circulating tumor cells (CTCs) and to postulate that the patterns of spread could be better understood through a ‘filter and flow’ perspective.[31] However, contemporary evidences indicate that the primary tumour may dictate organotropic metastases by inducing the formation of pre-metastatic niches at distant sites, where incoming metastatic cells may engraft and colonise.[26] Specifically, exosome vesicles secreted by tumours have been shown to home to pre-metastatic sites, where they activate pro-metastatic processes such as angiogenesis and modify the immune contexture, so as to foster a favourable microenvironment for secondary tumour growth.[26]
Metastasis and primary cancer[edit]
It is theorized that metastasis always coincides with a primary cancer, and, as such, is a tumor that started from a cancer cell or cells in another part of the body. However, over 10% of patients presenting to oncology units will have metastases without a primary tumor found. In these cases, doctors refer to the primary tumor as «unknown» or «occult,» and the patient is said to have cancer of unknown primary origin (CUP) or unknown primary tumors (UPT).[32] It is estimated that 3% of all cancers are of unknown primary origin.[33] Studies have shown that, if simple questioning does not reveal the cancer’s source (coughing up blood—»probably lung», urinating blood—»probably bladder»), complex imaging will not either.[33] In some of these cases a primary tumor may appear later.
The use of immunohistochemistry has permitted pathologists to give an identity to many of these metastases. However, imaging of the indicated area only occasionally reveals a primary. In rare cases (e.g., of melanoma), no primary tumor is found, even on autopsy. It is therefore thought that some primary tumors can regress completely, but leave their metastases behind. In other cases, the tumor might just be too small and/or in an unusual location to be diagnosed.
Diagnosis[edit]
Pulmonary metastases shown on Chest X-Ray
The cells in a metastatic tumor resemble those in the primary tumor. Once the cancerous tissue is examined under a microscope to determine the cell type, a doctor can usually tell whether that type of cell is normally found in the part of the body from which the tissue sample was taken.
For instance, breast cancer cells look the same whether they are found in the breast or have spread to another part of the body. So, if a tissue sample taken from a tumor in the lung contains cells that look like breast cells, the doctor determines that the lung tumor is a secondary tumor. Still, the determination of the primary tumor can often be very difficult, and the pathologist may have to use several adjuvant techniques, such as immunohistochemistry, FISH (fluorescent in situ hybridization), and others. Despite the use of techniques, in some cases the primary tumor remains unidentified.
Metastatic cancers may be found at the same time as the primary tumor, or months or years later. When a second tumor is found in a patient that has been treated for cancer in the past, it is more often a metastasis than another primary tumor.
It was previously thought that most cancer cells have a low metastatic potential and that there are rare cells that develop the ability to metastasize through the development of somatic mutations.[34] According to this theory, diagnosis of metastatic cancers is only possible after the event of metastasis. Traditional means of diagnosing cancer (e.g. a biopsy) would only investigate a subpopulation of the cancer cells and would very likely not sample from the subpopulation with metastatic potential.[35]
The somatic mutation theory of metastasis development has not been substantiated in human cancers. Rather, it seems that the genetic state of the primary tumor reflects the ability of that cancer to metastasize.[35] Research comparing gene expression between primary and metastatic adenocarcinomas identified a subset of genes whose expression could distinguish primary tumors from metastatic tumors, dubbed a «metastatic signature.»[35] Up-regulated genes in the signature include: SNRPF, HNRPAB, DHPS and securin. Actin, myosin and MHC class II down-regulation was also associated with the signature. Additionally, the metastatic-associated expression of these genes was also observed in some primary tumors, indicating that cells with the potential to metastasize could be identified concurrently with diagnosis of the primary tumor.[36] Recent work identified a form of genetic instability in cancer called chromosome instability (CIN) as a driver of metastasis.[37] In aggressive cancer cells, loose DNA fragments from unstable chromosomes spill in the cytosol leading to the chronic activation of innate immune pathways, which are hijacked by cancer cells to spread to distant organs.
Expression of this metastatic signature has been correlated with a poor prognosis and has been shown to be consistent in several types of cancer. Prognosis was shown to be worse for individuals whose primary tumors expressed the metastatic signature.[35] Additionally, the expression of these metastatic-associated genes was shown to apply to other cancer types in addition to adenocarcinoma. Metastases of breast cancer, medulloblastoma and prostate cancer all had similar expression patterns of these metastasis-associated genes.[35]
The identification of this metastasis-associated signature provides promise for identifying cells with metastatic potential within the primary tumor and hope for improving the prognosis of these metastatic-associated cancers. Additionally, identifying the genes whose expression is changed in metastasis offers potential targets to inhibit metastasis.[35]
-
Cut surface of a humerus sawn lengthwise, showing a large cancerous metastasis (the whitish tumor between the head and the shaft of the bone)
-
-
Metastatic cancer in the lungs
-
Metastases from the lungs to the brain
-
Metastases from the lungs to the pancreas
Management[edit]
Treatment and survival is determined, to a great extent, by whether or not a cancer remains localized or spreads to other locations in the body. If the cancer metastasizes to other tissues or organs it usually dramatically increases a patient’s likelihood of death. Some cancers—such as some forms of leukemia, a cancer of the blood, or malignancies in the brain—can kill without spreading at all.
Once a cancer has metastasized it may still be treated with radiosurgery, chemotherapy, radiation therapy, biological therapy, hormone therapy, surgery, or a combination of these interventions («multimodal therapy»). The choice of treatment depends on many factors, including the type of primary cancer, the size and location of the metastases, the patient’s age and general health, and the types of treatments used previously. In patients diagnosed with CUP it is often still possible to treat the disease even when the primary tumor cannot be located.
Current treatments are rarely able to cure metastatic cancer though some tumors, such as testicular cancer and thyroid cancer, are usually curable.
Palliative care, care aimed at improving the quality of life of people with major illness, has been recommended as part of management programs for metastasis.[38] Results from a systematic review of the literature on radiation therapy for brain metastases found that there is little evidence to inform comparative effectiveness and patient-centered outcomes on quality of life, functional status, and cognitive effects.[39]
Research[edit]
Although metastasis is widely accepted to be the result of the tumor cells migration, there is a hypothesis saying that some metastases are the result of inflammatory processes by abnormal immune cells.[40] The existence of metastatic cancers in the absence of primary tumors also suggests that metastasis is not always caused by malignant cells that leave primary tumors.[41]
The research done by Sarna’s team proved that heavily pigmented melanoma cells have Young’s modulus about 4.93, when in non-pigmented ones it was only 0.98.[42] In another experiment they found that elasticity of melanoma cells is important for its metastasis and growth: non-pigmented tumors were bigger than pigmented and it was much easier for them to spread. They shown that there are both pigmented and non-pigmented cells in melanoma tumors, so that they can both be drug-resistant and metastatic.[42]
History[edit]
The first physician to report the possibility of local metastasis from a primary cancerous source to nearby tissues was Ibn Sina. He described a case of breast cancer and metastatic condition in The Canon of Medicine. His hypothesis was based on clinical course of the patient.[43][44]
In March 2014 researchers discovered the oldest complete example of a human with metastatic cancer. The tumors had developed in a 3,000-year-old skeleton found in 2013 in a tomb in Sudan dating back to 1200 BC. The skeleton was analyzed using radiography and a scanning electron microscope. These findings were published in the Public Library of Science journal.[45][46][47]
Etymology[edit]
Metastasis is a Greek word meaning «displacement», from μετά, meta, «next», and στάσις, stasis, «placement».
See also[edit]
- Abscopal effect
- Brain metastasis
- Brown-Séquard syndrome (Sections on cavernous malformation, germinoma, renal cell carcinoma and lung cancer)
- Collective cell migration
- Contact normalization
- Disseminated disease
- Micrometastasis
- Mouse models of breast cancer metastasis
- Positron emission tomography (PET)
- Urogenital pelvic malignancy
References[edit]
- ^ «Metastasis», Merriam–Webster online, accessed 20 Aug 2017.
- ^ «What is Metastasis?». Cancer.Net. 2 February 2016.
- ^ Klein CA (September 2008). «Cancer. The metastasis cascade». Science. 321 (5897): 1785–7. doi:10.1126/science.1164853. PMID 18818347. S2CID 206515808.
- ^ Chiang AC, Massagué J (December 2008). «Molecular basis of metastasis». The New England Journal of Medicine. 359 (26): 2814–23. doi:10.1056/NEJMra0805239. PMC 4189180. PMID 19109576.
- ^ «Invasion and metastasis». Cancer Australia. 2014-12-16. Retrieved 2018-10-26.
- ^ Maheswaran S, Haber DA (February 2010). «Circulating tumor cells: a window into cancer biology and metastasis». Current Opinion in Genetics & Development. 20 (1): 96–9. doi:10.1016/j.gde.2009.12.002. PMC 2846729. PMID 20071161.
- ^ a b c d Kumar V, Abbas AK, Fausto N, Robbins SL, Cotran RS (2005). Robbins and Cotran pathologic basis of disease (7th ed.). Philadelphia: Elsevier Saunders. ISBN 978-0-7216-0187-8.
- ^ «O que é a metástase?» (in Brazilian Portuguese). Dr. Felipe Ades MD PhD—Oncologista. 2018-07-24. Retrieved 2018-10-23.
- ^ a b c d e f g h i j k National Cancer Institute: Metastatic Cancer: Questions and Answers. Retrieved on<rc-c2d-number> 2008-11-01</rc-c2d-number>
- ^ «Metastatic Cancer: Questions and Answers». National Cancer Institute. Retrieved 2008-08-28.
- ^ Olteanu G-E, Mihai I-M, Bojin F, Gavriliuc O, Paunescu V. The natural adaptive evolution of cancer: The metastatic ability of cancer cells. Bosn J of Basic Med Sci [Internet]. 2020Feb.3;. Available from: https://www.bjbms.org/ojs/index.php/bjbms/article/view/4565
- ^ Nguyen DX, Massagué J (May 2007). «Genetic determinants of cancer metastasis». Nature Reviews. Genetics. 8 (5): 341–52. doi:10.1038/nrg2101. PMID 17440531. S2CID 17745552.
- ^ Zlotnik A, Burkhardt AM, Homey B (August 2011). «Homeostatic chemokine receptors and organ-specific metastasis». Nature Reviews. Immunology. 11 (9): 597–606. doi:10.1038/nri3049. PMID 21866172. S2CID 34438005.
- ^ Drabsch Y, ten Dijke P (June 2011). «TGF-β signaling in breast cancer cell invasion and bone metastasis». Journal of Mammary Gland Biology and Neoplasia. 16 (2): 97–108. doi:10.1007/s10911-011-9217-1. PMC 3095797. PMID 21494783.
- ^ Yoshida BA, Sokoloff MM, Welch DR, Rinker-Schaeffer CW (November 2000). «Metastasis-suppressor genes: a review and perspective on an emerging field». Journal of the National Cancer Institute. 92 (21): 1717–30. doi:10.1093/jnci/92.21.1717. PMID 11058615.
- ^
Matteo Parri, Paola Chiarugi.
«Rac and Rho GTPases in cancer cell motility control» 2010 - ^ Friedl P, Wolf K (May 2003). «Tumour-cell invasion and migration: diversity and escape mechanisms». Nature Reviews. Cancer. 3 (5): 362–74. doi:10.1038/nrc1075. PMID 12724734. S2CID 5547981.
- ^ Escribano J, Chen MB, Moeendarbary E, Cao X, Shenoy V, Garcia-Aznar JM, et al. (May 2019). «Balance of mechanical forces drives endothelial gap formation and may facilitate cancer and immune-cell extravasation». PLOS Computational Biology. 15 (5): e1006395. arXiv:1811.09326. Bibcode:2019PLSCB..15E6395E. doi:10.1371/journal.pcbi.1006395. PMC 6497229. PMID 31048903.
- ^ Weidner N, Semple JP, Welch WR, Folkman J (January 1991). «Tumor angiogenesis and metastasis—correlation in invasive breast carcinoma». The New England Journal of Medicine. 324 (1): 1–8. doi:10.1056/NEJM199101033240101. PMID 1701519.
- ^ Gao D, Nolan DJ, Mellick AS, Bambino K, McDonnell K, Mittal V (January 2008). «Endothelial progenitor cells control the angiogenic switch in mouse lung metastasis». Science. 319 (5860): 195–8. Bibcode:2008Sci…319..195G. doi:10.1126/science.1150224. PMID 18187653. S2CID 12577022.
- ^ Nolan DJ, Ciarrocchi A, Mellick AS, Jaggi JS, Bambino K, Gupta S, et al. (June 2007). «Bone marrow-derived endothelial progenitor cells are a major determinant of nascent tumor neovascularization». Genes & Development. 21 (12): 1546–58. doi:10.1101/gad.436307. PMC 1891431. PMID 17575055.
- ^ Mellick AS, Plummer PN, Nolan DJ, Gao D, Bambino K, Hahn M, et al. (September 2010). «Using the transcription factor inhibitor of DNA binding 1 to selectively target endothelial progenitor cells offers novel strategies to inhibit tumor angiogenesis and growth». Cancer Research. 70 (18): 7273–82. doi:10.1158/0008-5472.CAN-10-1142. PMC 3058751. PMID 20807818.
- ^ Franci C, Zhou J, Jiang Z, Modrusan Z, Good Z, Jackson E, Kouros-Mehr H (2013). «Biomarkers of residual disease, disseminated tumor cells, and metastases in the MMTV-PyMT breast cancer model». PLOS ONE. 8 (3): e58183. Bibcode:2013PLoSO…858183F. doi:10.1371/journal.pone.0058183. PMC 3592916. PMID 23520493.
- ^ Lujambio A, Esteller M (February 2009). «How epigenetics can explain human metastasis: a new role for microRNAs». Cell Cycle. 8 (3): 377–82. doi:10.4161/cc.8.3.7526. PMID 19177007.
- ^ Ratnayake WS, Apostolatos AH, Ostrov DA, Acevedo-Duncan M (November 2017). «Two novel atypical PKC inhibitors; ACPD and DNDA effectively mitigate cell proliferation and epithelial to mesenchymal transition of metastatic melanoma while inducing apoptosis». International Journal of Oncology. 51 (5): 1370–1382. doi:10.3892/ijo.2017.4131. PMC 5642393. PMID 29048609.
- ^ a b c Syn N, Wang L, Sethi G, Thiery JP, Goh BC (July 2016). «Exosome-Mediated Metastasis: From Epithelial-Mesenchymal Transition to Escape from Immunosurveillance». Trends in Pharmacological Sciences. 37 (7): 606–617. doi:10.1016/j.tips.2016.04.006. PMID 27157716.
- ^ List of included entries and references is found on main image page in Commons: Commons:File:Metastasis sites for common cancers.svg#Summary
- ^ Ribatti D, Mangialardi G, Vacca A (December 2006). «Stephen Paget and the ‘seed and soil’ theory of metastatic dissemination». Clinical and Experimental Medicine. 6 (4): 145–149. doi:10.1007/s10238-006-0117-4. PMID 17191105. S2CID 26736196.
- ^ Hart IR (1982). «‘Seed and soil’ revisited: mechanisms of site-specific metastasis». Cancer and Metastasis Reviews. 1 (1): 5–16. doi:10.1007/BF00049477. PMID 6764375. S2CID 19573769.
- ^ Weinberg RA (2007). The Biology of Cancer. New York: Taylor & Francis. ISBN 978-0-8153-4076-8. quoted in Angier N (3 April 2007). «Basics: A mutinous group of cells on a greedy, destructive task». The New York Times.
- ^ Scott J, Kuhn P, Anderson AR (July 2012). «Unifying metastasis—integrating intravasation, circulation and end-organ colonization». Nature Reviews. Cancer. 12 (7): 445–6. doi:10.1038/nrc3287. PMC 4533867. PMID 22912952.
- ^ Ettinger DS, Agulnik M, Cates JM, Cristea M, Denlinger CS, Eaton KD, et al. (December 2011). «NCCN Clinical Practice Guidelines Occult primary». Journal of the National Comprehensive Cancer Network. 9 (12): 1358–95. doi:10.6004/jnccn.2011.0117. PMID 22157556.
- ^ a b Briasoulis E, Pavlidis N (1997). «Cancer of Unknown Primary Origin». The Oncologist. 2 (3): 142–152. doi:10.1634/theoncologist.2-3-142. PMID 10388044.
- ^ Poste G, Fidler IJ (January 1980). «The pathogenesis of cancer metastasis». Nature. 283 (5743): 139–46. Bibcode:1980Natur.283..139P. CiteSeerX 10.1.1.553.5472. doi:10.1038/283139a0. PMID 6985715. S2CID 4302076.
- ^ a b c d e f Ramaswamy S, Ross KN, Lander ES, Golub TR (January 2003). «A molecular signature of metastasis in primary solid tumors». Nature Genetics. 33 (1): 49–54. doi:10.1038/ng1060. PMID 12469122. S2CID 12059602.
- ^ van ‘t Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AA, Mao M, et al. (January 2002). «Gene expression profiling predicts clinical outcome of breast cancer». Nature. 415 (6871): 530–6. doi:10.1038/415530a. hdl:1874/15552. PMID 11823860. S2CID 4369266.
- ^ Bakhoum SF, Ngo B, Laughney AM, Cavallo JA, Murphy CJ, Ly P, et al. (January 2018). «Chromosomal instability drives metastasis through a cytosolic DNA response». Nature. 553 (7689): 467–472. Bibcode:2018Natur.553..467B. doi:10.1038/nature25432. PMC 5785464. PMID 29342134.
- ^ Irwin KE, Greer JA, Khatib J, Temel JS, Pirl WF (February 2013). «Early palliative care and metastatic non-small cell lung cancer: potential mechanisms of prolonged survival». Chronic Respiratory Disease. 10 (1): 35–47. doi:10.1177/1479972312471549. PMID 23355404. S2CID 6743524.
- ^ Garsa A, Jang JK, Baxi S, Chen C, Akinniranye O, Hall O, et al. (2021). «Radiation Therapy for Brain Metastases: A Systematic Review». Practical Radiation Oncology. 11 (5): 354–365. doi:10.1016/j.prro.2021.04.002. PMID 34119447.
- ^ Shahriyari L (2016). «A new hypothesis: some metastases are the result of inflammatory processes by adapted cells, especially adapted immune cells at sites of inflammation». F1000Research. 5: 175. doi:10.12688/f1000research.8055.1. PMC 4847566. PMID 27158448.
- ^ López-Lázaro M (2015-01-01). «The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis». Oncoscience. 2 (5): 467–75. doi:10.18632/oncoscience.159. PMC 4468332. PMID 26097879.
- ^ a b Sarna M, Krzykawska-Serda M, Jakubowska M, Zadlo A, Urbanska K (June 2019). «Melanin presence inhibits melanoma cell spread in mice in a unique mechanical fashion». Scientific Reports. 9 (1): 9280. Bibcode:2019NatSR…9.9280S. doi:10.1038/s41598-019-45643-9. PMC 6594928. PMID 31243305.
- ^ Zarshenas MM, Mohammadi-Bardbori A (February 2017). «A medieval description of metastatic breast cancer; from Avicenna’s view point». Breast. 31: 20–21. doi:10.1016/j.breast.2016.10.019. PMID 27810694.
- ^ Kardeh S, Kardeh B (2019-01-01). «Avicenna’s Concepts on Cancer Metastasis from the 11th Century». Galen Medical Journal. 8: e1292. doi:10.31661/gmj.v8i0.1292. PMC 8344088. PMID 34466487.
- ^ Kelland K (17 March 2014). «Archaeologists discover earliest example of human with cancer». Reuters. Retrieved 18 March 2014.
- ^ Ghosh P (18 March 2014). «Ancient skeleton is the earliest case of cancer yet detected». BBC. Retrieved 18 March 2014.
- ^ Ross P (17 March 2014). «Possible Oldest Cancer Found In 3,000-Year-Old Skeleton Could Reveal ‘Evolution’ Of Modern Disease». International Business Times. Retrieved 18 March 2014.
External links[edit]
Look up metastasis in Wiktionary, the free dictionary.
Wikimedia Commons has media related to Metastases.
- Q&A: Metastatic Cancer—from the National Cancer Institute
- How does cancer spread — the route by TED-Ed
Оглавление
Ключевые слова
- Метастазы злокачественных опухолей без выявленного первичного очага
- Метастазирование
- Системная химиотерапия
Список сокращений
АФП — альфа-фетопротеин
ВПО – выявленный первичный очаг
КТ – компьютерная томография
ЛДГ — лактатдегидрогеназа
МРТ — магниторезонансная томография
ПСА — простат-специфический антиген
ПЭТ — позитронно-эмиссионная томография
ПЭТ-КТ – позитронно-эмиссионная томография, совмещенная с КТ
РЭА — раково-эмбриональный антиген
УЗИ — ультразвуковое исследование
ХГЧ — хорионический гонадотропин человека
Термины и определения
Новые термины и определения в рекомендациях не используются.
1. Краткая информация
1.1 Определение
Метастазы злокачественной опухоли без выявленного первичного очага (ВПО) – заболевание, проявляющееся метастатическими опухолями, в то время как первичный очаг невозможно установить ни на основании анамнеза, ни при обследовании [13].
1.2 Этиология и патогенез
В связи с большой гетерогенностью опухоли обычно не удается выделить, какой клон клеток явился источником метастазирования, так как теряется набор морфологических признаков, позволяющих отличить клетки по органопринадлежности [1, 2,3]. В среднем идентификация первичного источника осуществляется при жизни только у 25% больных. В 15-20% случаев первичный очаг не находят даже на аутопсии [4, 5]. Хотя метастазы без ВПО отличаются своим происхождением из разных органов, биологическое поведение их приблизительно одинаково. Зачастую они характеризуются случайной, нетипичной локализацией, (то есть поражением не регионарных лимфатических узлов), а также быстрым прогрессированием процесса на самых ранних этапах развития.
1.3 Эпидемиология
По данным различных авторов пациенты с метастазами без ВПО составляют от 3 до 5% онкологических больных, обратившихся за медицинской помощью [6, 7, 8]. Опухоли без ВПО занимают 7 место по частоте встречаемости и 4 место в структуре смертности среди всех злокачественных новообразований [5, 9, 10].
У мужчин и женщин опухоли без ВПО встречаются приблизительно с одинаковой частотой. С увеличением возраста кривая заболеваемости резко поднимается вверх, достигая пика к 65 годам [4, 7, 11].
1.4 Кодирование по МКБ 10
Злокачественные новообразования неточно обозначенных, вторичных и неуточненных локализаций (C76-C80):
Злокачественное новообразование других и неточно обозначенных локализаций (C76):
C76.0 — Головы, лица и шеи;
C76.1 — Грудной клетки;
C76.2 — Живота;
C76.3 — Таза;
C76.4 — Верхней конечности;
C76.5 — Нижней конечности;
C76.7 — Других неуточненных локализаций;
C76.8 — Поражение других и неточно обозначенных локализаций, выходящее за пределы одной и более вышеуказанных локализаций.
Вторичное и неуточненное злокачественное новообразование лимфатических узлов (C77):
C77.0 — Лимфатических узлов головы, лица и шеи;
C77.1 — Внутригрудных лимфатических узлов;
C77.2 — Внутрибрюшных лимфатических узлов;
C77.3 — Лимфатических узлов подмышечной впадины и верхней конечности грудных лимфатических узлов;
C77.4 — Лимфатических узлов паховой области и нижней конечности;
C77.5 — Внутритазовых лимфатических узлов;
C77.8 — Лимфатических узлов множественных локализаций;
C77.9 — Лимфатических узлов неуточненной локализации;
Вторичное злокачественное новообразование органов дыхания и пищеварения (C78):
C78.0 — Вторичное злокачественное новообразование легкого;
C78.1 — Вторичное злокачественное новообразование средостения;
C78.2 — Вторичное злокачественное новообразование плевры;
C78.3 — Вторичное злокачественное новообразование других и не уточненных органов дыхания;
C78.4 — Вторичное злокачественное новообразование тонкого кишечника;
C78.5 — Вторичное злокачественное новообразование толстого кишечника и прямой кишки;
C78.6 — Вторичное злокачественное новообразование забрюшинного пространства и брюшины;
C78.7 — Вторичное злокачественное новообразование печени;
C78.8 — Вторичное злокачественное новообразование других и неуточненных органов пищеварения;
Вторичное злокачественное новообразование других локализаций (C79):
C79.0 — Вторичное злокачественное новообразование почки и почечных лоханок;
C79.1 — Вторичное злокачественное новообразование мочевого пузыря, других и неуточненных мочевых органов;
C79.2 — Вторичное злокачественное новообразование кожи;
C79.3 — Вторичное злокачественное новообразование головного мозга и мозговых оболочек;
C79.4 — Вторичное злокачественное новообразование других и неуточненных отделов нервной системы;
C79.5 — Вторичное злокачественное новообразование костей и костного мозга;
C79.6 — Вторичное злокачественное новообразование яичника;
C79.7 Вторичное злокачественное новообразование надпочечника;
C79.8 — Вторичное злокачественное новообразование других уточненных локализаций;
Злокачественное новообразование без уточнения локализации (C80).
1.5 Классификация
Для всех злокачественных опухолей характерны терминологическая определенность, наличие общепризнанных классификаций — как отечеcтвенных, так и по системе TNM. При метастазах без первичного очага аналогичных классификаций нет, так как больные с метастазами без ВПО представляют чрезвычайно «пеструю» группу — как по локализации и распространенности опухолевого процесса, так и по морфологическому строению метастазов.
В соответствии с гистологическим строением опухоли ВПО, согласно рекомендациям ESMO (2015г), целесообразно разделять на следующие группы [12]:
1) высокодифференцированные и умеренно дифференцированные аденокарциномы;
2) низкодифференцированные карциномы;
3) плоскоклеточный рак;
4) недифференцированная опухоль;
5) рак с нейроэндокринной дифференцировкой.
Стадирование.
Так как заболевание на первых этапах проявляется метастазами, можно говорить о первично генерализованном процессе, который к моменту обращения пациента за медицинской помощью, как правило, выходит за пределы органа. Более конкретизированного общепринятого стадирования метастазов злокачественной опухоли без ВПО в настоящее время не существует.
В зависимости от локализации и распространенности метастатического поражения больных делят на группы [13]:
1. Пациенты с изолированным поражением лимфоузлов (единичным или множественным в пределах одного коллектора) — шейных, подмышечных, паховых, медиастинальных, забрюшинных;
2. Пациенты с изолированным поражением органов и тканей (единичным или множественным) — костей, легких, печени, мягких тканей, головного мозга и др.;
3. Пациенты с поражением нескольких коллекторов лимфоузлов, сочетанное поражение лимфоузлов и/или органов.
2. Диагностика
Диагностический алгоритм у больных с метастатическим поражением без ВПО включает четыре направления: предварительная дифференцировка и оценка общего состояния, оценка распространенности опухолевого поражения, получение материала для морфологического исследования, поиск первичного очага.
Следует отметить, что важным фактором в выборе диагностической тактики является общее состояние больного. Очевидно, что пациенту в тяжелом состоянии не имеет смысла проводить обследование в полном объеме, так как в большинстве случаев не приходится надеяться на эффективное лечение, а в особо тяжелых случаях следует обсудить вопрос о симптоматической терапии без обследования.
2.1 Жалобы и анамнез
- Рекомендуется тщательный сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения [6, 7, 12, 13, 17, 24].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIb)
2.2 Физикальное обследование
- Рекомендуется выполнять тщательный физикальный осмотр, включающий осмотр всех кожных покровов и видимых слизистых, пальпацию всех доступных групп лимфатических узлов, щитовидной железы, молочных желез, органов брюшной полости, пальцевое ректальное исследование, осмотр гинекологом (женщины), исследование наружных половых органов, пальпация яичек (мужчины), оценка нутритивного статуса [6, 13].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — IV)
Комментарии: при обращении пациентов за медицинской помощью часто встречаются следующие изменения: наличие опухолевого образования, боль, увеличение печени, боли в костях, патологические переломы, респираторные нарушения, потеря веса, неврологические расстройства. Клинические проявления заболевания неспецифичны и зависят от локализации очагов метастатического поражения и распространенности опухолевого процесса. Первым симптомом чаще всего является увеличение размеров периферических лимфатических узлов. Общие проявления: слабость, потливость, похудание, гипертермия более характерны при поражении органов — легких, печени.
2.3 Лабораторная диагностика
- Рекомендуется выполнять развернутые клинический и биохимический анализы крови, исследование свёртывающей системы крови, анализ мочи [7, 13, 18, 20].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – IIb)
- Рекомендуется выполнять анализы крови на онкомаркеры PSA (мужчины старше 40 лет), СА-125 (женщины), альфа-фетопротеин (АФП), хорионический гонадотропин (ХГЧ), раково-эмбриональный антиген (РЭА), СА 19.9, NCE, S100.
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – IIb)
Комментарии: определение опухолевых маркеров в сыворотке крови в ряде случаев оказывает большую помощь в поиске первичного очага, при этом необходимо определять панель, поскольку отсутствие значения даже одного из опухолевых маркеров может отрицательно повлиять на правильную интерпретацию результатов. Определения практически любого из опухолевых маркеров изолированно не несет точной информации, за исключением случаев с их очень высокими значениями. Так, РЭА, в силу недостаточной специфичности, может быть умеренно повышенным при многих заболеваниях, но, если одновременно повышен уровень СА15.3, можно предположить локализацию первичной опухоли в молочной железе, NCE – в легком, СА 19,9 – в пищеварительном тракте. СА125 может быть связан не только с диагнозом: рак яичников, но и с наличием асцита или гидроторакса любой этиологии. Также специфичными являются PSA — простатический антиген (специфичность 85-90% при раке предстательной железы у мужчин), АФП – маркер неэпителиальных опухолей яичка, герминогенных опухолей, маркер первичного рака печени (высокая репрезентативность – 96% при дифференциальной диагностике между метастатическим поражением печени и гепатоцеллюлярной карциномой), ХГ – хорионический гонадотропин – маркер герминогенных опухолей, S100 — может указывать на возможную метастатическую меланому [14, 15].
2.4 Инструментальная диагностика
- Рекомендуется выполнить рентгенографию органов грудной клетки [2, 6, 7, 12, 13, 17, 24].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — IV)
- Рекомендуется выполнить ультразвуковое исследование (УЗИ) органов брюшной полости, забрюшинного пространства, малого таза, периферических лимфатических узлов [6, 7, 12, 13, 17, 20].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — IV)
- Рекомендуется выполнить остеосцинтиграфию при подозрении на метастатическое поражение костей [13, 14, 20].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — IV)
- Рекомендуется выполнить цитологическое исследование пунктатов метастазов
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — IV)
Комментарии: при цитологическом исследовании метастазов без ВПО наиболее часто встречаются: умеренно дифференцированная или высокодифференцированная аденокарцинома в 50% случаях, низкодифференцированная или недифференцированная аденокарцинома или рак в 30%, плоскоклеточный рак у 15% больных и недифференцированная опухоль – 5% [16, 17]. Реже выявляют опухоли с нейроэндокринной дифференцировкой, меланому, лимфомы, герминогенные опухоли, саркомы, эмбриональный рак.
- Рекомендуется выполнить идентификацию гистогенетической принадлежности опухоли путем морфологического исследования материала, полученного при пункции или биопсии.
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – IIb)
Комментарии: морфологическое исследование является наиболее значимым и должно выполняться как можно раньше. Полученные данные позволяют подтвердить злокачественность процесса, определить гистогенез опухоли, степень дифференцировки клеток, а иногда и предположительную локализацию первичной опухоли, что значительно облегчает поиск первичного очага и сокращает количество диагностических манипуляций. На этом этапе пациенты распределяются на группы: нет признаков злокачественного роста; метастазы рака; лимфома; метастазы меланомы; метастазы злокачественной опухоли без уточнения гистогенеза. Больные первой группы из дальнейшего исследования исключаются. При выявлении лимфомы дальнейшее обследование и лечение проводится гематологом.
В соответствии с гистологическим строением опухоли без ВПО, согласно рекомендациям ESMO (2015г), целесообразно разделять на следующие группы: высокодифференцированные и умеренно дифференцированные аденокарциномы; низкодифференцированные карциномы; плоскоклеточный рак; недифференцированная опухоль; рак с нейроэндокринной дифференцировкой. Подобная дифференцировка пациентов позволяет в последующем выработать оптимальную схему лечения пациента [12].
- Рекомендуется выполнить иммуногистохимический метод [18, 19, 20].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – IIb)
Комментарии: иммуногистохимический метод повышает точность патологоанатомического исследования за счёт более корректного определения или уточнения гистогенеза, направления клеточной дифференцировки и органной принадлежности первичной опухоли. У пациентов с метастазами без чётких морфологических признаков железистой (аденогенной), нейроэндокринной или плоскоклеточной дифференцировки главной задачей дополнительных методов исследования является уточнение гистогенеза опухоли (точнее установление направления дифференцировки опухолевых клеток).
2.5 Дополнительная диагностика
- Рекомендуется выполнить компьютерную томографию (КТ) органов грудной клетки, брюшной полости с внутривенным контрастированием [12, 18, 21, 23].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — IV)
- Рекомендуется выполнить КТ/магниторезонансную томографию (МРТ) головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга [12, 17, 24].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить позитронно-эмиссионную томографию, совмещенную с КТ (ПЭТ-КТ) при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения [21, 22, 23].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
Комментарии: применение ПЭТ-КТ при множественных метастазах иногда не дает желаемого результата, так как трудно отличить первичную опухоль от метастазов. Низкая метаболическая активность для 19F-ФДГ характерна также для бронхоальвеолярного рака, гепатоцеллюлярной карциномы, рака почки, карциноида, низкодифференцированных и некоторых других опухолей. По рекомендациям NCCN от 2016 года ПЭТ-КТ не рекомендуется в качестве первичного диагностического теста [18]. Однако существуют благоприятные подгруппы для данного вида исследования: это немногочисленные или единичные метастазы, а также метастазы плоскоклеточного рака в шейных лимфатических узлах. У таких пациентов ПЭТ-КТ может изменить тактику лечения в 30-35% случаев.
- Рекомендуется выполнить рентгенографию костей в зонах накопления радиофармпрепарата при сканировании [13, 14, 20].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить маммографию [12, 13, 18].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить МРТ молочных желез [12, 13, 18].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить ЛОР обследование [6, 13, 15, 22].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить эндоскопические исследования: эпифарингоскопию, фибробронхоскопию, фиброэзофагогастродуоденоскопию, фиброколоноскопию [6, 13, 18, 12].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – IIb)
Комментарии: эндоскопические методы исследования выполняются в зависимости от жалоб, симптоматики и результатов лабораторных анализов.
- Рекомендуется выполнить биопсию под контролем УЗИ/КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения [1, 2, 3, 6, 10, 12, 13, 17, 24].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить видеолапароскопию [6, 13, 18].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
- Рекомендуется выполнить видеоторакоскопию [6, 13, 18].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
Комментарии: получение материала для морфологического исследования не представляет трудности при поражении периферических лимфатических узлов. В случае поражения медиастинальных или забрюшинных лимфатических узлов выполняется чрезкожная пункция под контролем УЗТ или КТ. Если материала недостаточно для всестороннего гистологического исследования, может обсуждаться вопрос о торакоскопии или лапароскопии с биопсией. Аналогичная тактика оправдана и при поражении органов грудной и брюшной полостей, плевры, брюшины, органов и тканей забрюшинного пространства. Если метастазы локализуются в костях, последовательность диагностических процедур такова: пункция, трепанобиопсия, открытая биопсия пораженной кости.
3. Лечение
Поскольку первичный очаг остается неизвестным, любое проведенное лечение можно обозначить «радикальным» только условно. Поэтому выбор лечебной тактики у данной категории больных представляет собой проблему, разрешаемую в каждом конкретном случае в индивидуальном порядке. Лечебная тактика определяется, в первую очередь, с учетом общего состояния больного, локализации метастазов, распространенности опухолевого процесса, морфологического строения метастатической опухоли, предполагаемой локализации первичного очага.
В последнее время осуществляются программы по выработке лечебной тактики не на основании предполагаемой локализации первичного очага, а на основании биологических характеристик опухоли, что позволит индивидуализировать лечение и шире использовать таргетную терапию. Доказано, что средняя продолжительность жизни пациентов, получавших специальное лечение, достоверно выше, чем у лиц, лечение которых ограничилось симптоматической терапией. Лучшие результаты пятилетней выживаемости отмечены у больных с изолированными метастазами в паховых, подмышечных, шейных лимфатических узлах, получавших специальное лечение.
Хирургический метод лечения у больных с метастазами злокачественной опухоли без ВПО не является радикальным и может быть использован при изолированном поражении лимфоузлов доступной удалению группы и в некоторых случаях изолированного поражения органа; возможна лимфаденэктомия или удаление метастаза с резекцией органа. Также оперативное вмешательство возможно с симптоматической целью.
Лучевая терапия при невозможности применения хирургического метода может быть показана при изолированном поражении лимфатических узлов или органа при потенциальной чувствительности опухоли к облучению. Возможно применение ЛТ и с симптоматической целью.
Так как опухоль невыясненной первичной локализации предполагает диссеминированный процесс, основным методом лечения является лекарственная терапия. Лечение осуществляется персонализировано на основе всех имеющихся клинико-морфологических данных. Решающее значение имеют морфологические характеристики опухоли и потенциальная чувствительность к тем или иным препаратам. При выявлении в опухоли соответствующих мутаций возможно применение таргетной терапии. В случаях изолированного поражения комбинация химиотерапии с хирургическим и лучевым методами позволяет добиться достоверно лучших результатов.
В рекомендациях Российского профессионального общества онкологов-химиотерапевтов (RUSSCO) и Европейского общества медицинской онкологии (ESMO) в каждом конкретном случае предлагается определить пациента в ту или иную группу в зависимости от распространенности опухолевого поражения и морфологической структуры опухоли, которые соответствуют заболеванию с известной локализацией первичной опухоли [12,24].
3.1 Метастазы плоскоклеточного рака в лимфатических узлах головы и шеи без выявленного первичного очага
- Рекомендована в случае локального поражения лимфатических узлов лимфаденэктомия с последующей химиотерапией в соответствии со стандартами для лечения плоскоклеточного рака с локализацией первичного очага в органах и тканях головы и шеи (паклитаксел 175 мг/м2 в/в в день 1, цисплатин 100мг/м2 в/в в день 1, фторурацил 500 мг/м2 в/в в 1-5 дни или доцетаксел 75 мг/ м2 внутривенно в день 1, цисплатин 75 мг/м2 внутривенно в 1 день, фторурацил 750 мг/м2 в/в в 1-5дни) [6, 13, 24].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIa)
- Рекомендована при невозможности «радикального» удаления пораженных метастазами лимфоузлов химиолучевая терапия [6, 12, 13, 18, 24].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIa)
3.2 Метастазы рака в подмышечных лимфатических узлах у женщин
- Рекомендована подмышечная лимфаденэктомия [6, 7, 13, 18, 20, 24].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIa)
- Рекомендована лучевая терапия [6, 12, 13, 18, 24].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIa)
Комментарии: при сомнительной радикальности лимфаденэктомии или невозможности её выполнения из-за распространенности опухолевого поражения показана лучевая терапия на аксиллярную и шейно-над-подключичную зоны.
3.3 Канцероматоз брюшины у женщин
- Рекомендована терапия согласно алгоритмам лечения рака яичников поздних стадий [6, 13, 18, 24]:
- циторедуктивные операции;
- химиотерапия: паклитаксел + карбоплатин ± бевацизумаб ± в/брюшинная химиотерапия.
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIa)
Комментарии: как правило, течение заболевания соответствует раку яичников, поэтому лекарственное лечение проводится по аналогичным схемам.
3.4 Метастазы недифференцированной/низкодифференцированной карциномы с преимущественным поражением лимфатических узлов осевой локализации (шейные, медиастинальные, забрюшинные)
- Рекомендована терапия согласно алгоритмам лечения герминогенных опухолей – химиотерапия на основе препаратов платины [12, 18].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIb)
Комментарии: заболевание по течению соответствует герминогенным опухолям. Необходимо обратить внимание на уровни АФП, ХГЧ, лактатдегидрогеназы (ЛДГ).
3.5 Метастазы низкодифференцированной нейроэндокринной карциномы
Течение заболевания у пациентов этой группы соответствует мелкоклеточному раку легкого.
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIb)
3.6 Метастазы высокодифференцированной нейроэндокринной карциномы с низкой пролиферативной активностью
- Рекомендована терапия согласно алгоритмам лечения нейроэндокринного рака [18].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIb)
Комментарии: заболевание по течению наиболее соответствует нейроэндокринным опухолям желудочно-кишечного тракта, поэтому лечение проводится по аналогичным схемам, предложенным для терапии больных опухолями этой локализации.
3.7 Остеобластические метастазы аденокарциномы в скелет у мужчин
- Рекомендована терапия согласно алгоритмам лечения диссеминированного рака предстательной железы [18].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIb)
3.8 Метастатическое поражение, не соответствующее вышеперечисленным группам
Как правило, речь идет о диссеминированном опухолевом процессе. Назначение лекарственного лечения возможно пациентам в удовлетворительном состоянии.
- Рекомендовано применение наименее токсичных, легко переносимых схем химиотерапии. Выбор препаратов основан на предполагаемой у данного пациента локализации первичного очага либо на наиболее часто встречающихся скрытых локализациях первичной опухоли в легких и органах желудочно-кишечного тракта. Целесообразна симптоматическая терапия [6, 12, 13, 18, 24].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — IV)
Комментарии: во всех группах оценка эффективности лечения проводится через 6-8 недель. Терапия продолжается до достижения максимального эффекта плюс 2 закрепляющих эффект цикла. Лучевое воздействие у больных без ВПО может быть применено при невозможности радикального хирургического удаления опухоли или конгломерата лимфатических узлов с паллиативной или радикальной целью с применением стандартной или стереотаксической лучевой терапии.
4. Реабилитация
- Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии [6, 18].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств – IV)
5. Профилактика и диспансерное наблюдение
- Больным с метастазами злокачественной опухоли без АПО рекомендовано диспансерное наблюдение с периодичностью в 3 — 6 месяцев. При динамическом наблюдении возможно выявление первичной опухоли, что позволит более целенаправленно проводить лечебные мероприятия [6, 12, 13, 18, 24]. Объем обследования:
- Анамнез и физикальное обследование;
- Анализ крови на онкомаркеры (если были повышены исходно) каждые 3 месяца первые 2 года и далее каждые 6 месяцев в последующие 3 года;
- УЗИ органов брюшной полости и малого таза каждые 3-6 месяцев в зависимости от риска прогрессирования;
- Рентгенография органов грудной клетки каждые 6 месяцев;
- КТ органов грудной и брюшной полости с внутиривенным контрастированием каждые 6 месяцев.
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — IIa)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов и рецидивных опухолей, а также выявление первичного очага.
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
|
1. |
Выполнено хирургическое вмешательство |
IV |
C |
|
2. |
Выполнена анестезия в соответствии с объемом оперативного вмешательства и тяжестью состояния пациента |
IV |
C |
|
3. |
Отсутствие повторных хирургических вмешательств в период госпитализации |
IV |
C |
|
4. |
Выполнено морфологическое исследование препарата удаленных тканей (при хирургическом вмешательстве |
IV |
C |
|
5. |
Выполнена периоперационная антибиотикопрофилактики (у больных, кому выполнено хирургическое лечение) |
Ia |
A |
|
6. |
Отсутствие тромбоэмболических осложнений в период госпитализации (при хирургическом вмешательстве) |
Ia |
A |
|
7. |
Отсутствие кровотечения в раннем послеоперационном периоде (при хирургическом вмешательстве) |
IV |
C |
|
8. |
Выполнен 1 курс адъювантной химиотерапии не позднее 28 дня от момента хирургического и при отсутствии медицинских противопоказаний |
IIb |
B |
Список литературы
-
- Abeloff MD, Armitage JO, Lichter AS et al. Unknown primary in clinical oncology. Churchill Livingstone. NY 1995; p1833-1845;
- Leonard RJ, Nystrom JS. Diagnostic evaluation of patients with carcinoma of unknown primary site. Semin Oncol 1993; 20:244-250;
- Nystrom JS, Weiner JM, Heffelfinger-Juttner J. Metastatic and histologic presentation in unknown primary cancer. Semin Oncol 1997;4:53-58
- Hillen HF. Unknown primary tumours review. Postgrad Med J 2000; 76: 690-3.
- Pentheroudakis G, Briasoulis E, Pavlidis N. Cancer of unknown primary site: missing primary or missing biology. Oncologist 2007; 12:418-425
- Рак без выявленного первичного очага. – В кн.: Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO). Москва 2010, Издательская группа РОНЦ им. Н. Н. Блохина РАМН, с 348-353
- Bugat R, Bataillard A, Lesimple T et al. Summary of the standards, options and recommendations for the management of patients with carcinoma of unknown primary site (2002). Br J Cancer 2003; 89 (Suppl 1): S59–S66
- Blaszyk H, Hartmann A, Bjornsson J. Cancer of unknown primary: clinicopathologic correlations. APMIS 2003;111:1089-1094.
- Pavlidis N, Fizazi K. Carcinoma of unknown primary. Crit Rev Oncol Hematol 2009;69:271-278
- Pavlidis N, Pentheroudakis G. Cancer of unknown primary site: 20 questions to be answered. Ann Oncol 2010; 21(7):303-307
- Siegel R., Naishadham D., Jemal A. Cancer statistics, 2012. CA Cancer J Clin 2012;62:10-29.
- Fizazi K., Greco F. A., Pavlidis N., Daugaard G., K. Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol (2015) 26 (suppl 5): v133-v138.
- Комаров И.Г., Комов Д.В. Метастазы злокачественных опухолей без выявленного первичного очага Вкн.: Онкология: справочник практического врача. Под ред. И.В. Поддубной М.: МЕДпресс-информ, 2009, с750-757
- Foggi P. Cancer of unknown primary site//Clin. Ter., 1999, № 50, Р.301-306
- Haskell C.M., Cochran A.J., Barsky S.H., Steckel R.J. Metastasis of unknown origin. //Curr. Probl. Cancer, 1999, № 12, P.5-58.
- Chorost MI, Lee MC, Yeoh CB. Unknown primary. J Surg Oncol 2004;87:191-203
- Varadbachary GR, Abbruzzese JL, Lenz R. Diagnostic strategies for unknown primary cancer. Cancer 2004; 100:1776-1785
- Ettinger DS, Varadhary GR, Bowles DW. Occult Primary (Cancer of unknown primary). Version 1.2017- September 21, 2016. NCCN. Org.
- Bender RA, Erlander MG. Molecular classification of unknown primary cancer. Semin Oncol 2009;36:38-43.
- Varadhachary GR, Raber MN. Cancer of unknown primary site. N Engl J Med 2014; 371:757-765.
- Kwee TC, Kwee RM. Combined FDG-PET/CT for the detection of unknown primary tumors: systematic review and meta-analysis. Eur Radiol 2009;19:731-744.
- Zhu L, Wang N. 18F-fluorodeoxyglucose positron emission tomography-computed tomography as a diagnostic tool in patients with cervical nodal metastases of unknown primary site: a meta-analysis. Surg Oncol 2013;22:190-194.
- Ambrosini V, Nanni C, Rubello D, et al. 18F-FDG PET/CT in the assessment of carcinoma of unknown primary origin. Radiol Med 2006;111:1146-1155.
- Опухоли невыявленной первичной локализации — В кн.: Практические рекомендации по лекарственному лечению злокачественных опухолей RUSSCO 2013 с185-192
Приложение А1. Состав рабочей группы
- Комаров И.Г., профессор, д.м.н., главный научный сотрудник отделения хирургического N2 диагностики опухолей ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
- Комов Д.В., профессор, д.м.н., руководитель отделения хирургического N2 диагностики опухолей ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
- Слетина С.Ю., к.м.н., врач-хирург отделения хирургического N2 диагностики опухолей ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
- Гуторов С.Л., д.м.н ведущий научный сотрудник отделения химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
- Трофимова О.П., д.м.н., ведущий научный сотрудник радиологического отделения радиационной онкологии ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России.
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи –онкологи;
- Врачи-хирурги;
- Врачи-радиологи;
- Врачи-химиотерапевты;
- Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 – Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
|
Уровни достоверности доказательств |
Описание |
|
Ia |
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований |
|
Ib |
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном |
|
IIa |
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании |
|
IIb |
Доказательность, основанная как минимум на одном квазиэксперементальном исследовании с хорошим дизайном |
|
III |
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль |
|
IV |
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов |
Таблица П2 – Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
|
Уровень убедительности рекомендации |
Уровни достоверности доказательств |
Описание |
|
A |
Ia, Ib |
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном |
|
B |
IIa, IIb, III |
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях |
|
C |
IV |
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества |
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с РБ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение Б. Алгоритмы ведения пациента
- Схема 1. Блок-схема диагностики и лечения больного с метастазами злокачественных опухолей без выявленного первичного очага
Приложение В. Информация для пациентов
Рекомендации при осложнениях химиотерапии — связаться с химиотерапевтом.
1) При повышении температуры тела 38°C и выше:
- Начать прием антибиотиков: по рекомендации химиотерапевта.
2) При стоматите
- Диета – механическое, термическое щажение;
- Частое полоскание рта (каждый час) – ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации химиотерапевта.
3) При диарее
- Диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- Принимать препараты по рекомендации химиотерапевта.
4) При тошноте
- Принимать препараты по рекомендации химиотерапевта.
- Метастазы: что это?
- Почему возникают метастазы?
- Врачи клиники «Евроонко» о стадиях рака, рецидиве и метастазах
- Что влияет на скорость распространения метастазов в организме?
- Особенности метастазирования разных типов рака
- В чем опасность метастазов?
- Основные разновидности метастазов, в зависимости от локализации
- Симптомы метастазов рака
- Диагностика метастатического рака
- Можно ли вылечить пациента, если у него рак с метастазами?
- Где лучше лечиться при раке с метастазами?
Метастазы: что это?
Метастазы – это вторичные опухолевые очаги, которые располагаются на удалении от первичной опухоли: в других органах, лимфатических узлах. Они образованы злокачественными клетками, отделившимися от первичного новообразования, мигрировавшими с током крови или лимфы и осевшими в различных органах.
Пациенты спрашивают – мы отвечаем:
Если есть метастазы – какая это стадия заболевания?
Рак с отдаленными метастазами – это всегда рак IV стадии. Но не всякий рак IV стадии сопровождается метастазированием. Это зависит от классификации при конкретной злокачественной опухоли.
Как выглядят метастазы?
В виде опухолевых очагов – так же, как и первичная опухоль. Иногда даже не удается сразу разобраться, что представляет собой обнаруженное новообразование: первичную опухоль или метастаз.
Метастазы могут располагаться в разных местах. Это зависит от типа рака – у каждого есть свои «излюбленные» локализации. Чаще всего вторичные очаги появляются в легких, печени, брюшине, костях, надпочечниках. Некоторые метастазы весьма специфичны и имеют собственные названия – например, метастаз Вирхова при раке желудка.
Интересный факт.
Слово «метастазы» греческого происхождения, и буквально оно означает «перемещение».
Теперь, когда мы разобрались, что такое метастазы, поговорим о том, как они возникают. В соответствии с современными представлениями, метастазирование – процесс, который зачастую начинается почти сразу с момента возникновения злокачественной опухоли. Некоторые клетки отделяются от первичного очага и проникают в просвет лимфатических или кровеносных сосудов. Они перемещаются в организме с током лимфы или крови, а потом оседают в определенных органах и дают там начало новым очагам. Эти пути метастазирования называются, соответственно, лимфогенным и гематогенным.
На первых порах метастазирование происходит очень медленно, его сложно обнаружить. Иммунная система уничтожает раковые клетки, мигрирующие в организме, а первичная опухоль подавляет рост вторичных очагов.
Если же во время обследования уже обнаруживаются отдаленные метастазы, то у пациента диагностируют метастатический рак. Этот диагноз соответствует злокачественной опухоли IV стадии.
Итак, метастазы это простыми словами опухолевые очаги, которые образуются в разных органах, помимо первичной опухоли. Способность метастазировать – одно из ключевых свойств злокачественных опухолей, отличающее их от доброкачественных новообразований. Зачастую именно метастазы становятся причиной смерти онкологического больного.
Почему возникают метастазы?
Итак, все злокачественные опухоли обладают способностью к метастазированию. Вероятность того, что это произойдет, зависит от ряда факторов:
- тип рака;
- скорость роста опухоли;
- степень дифференцировки злокачественных клеток – насколько они утратили черты нормальных;
- стадия, на которой диагностировано онкологическое заболевание и др.
Иммунная система какое-то время эффективно сдерживает рост и распространение злокачественных клеток, но однажды ее ресурсов не хватает. Опухоль «прорывает» иммунную защиту.
Даже после того, как раковые клетки распространились в организме, они еще какое-то время не растут или размножаются очень медленно. Может пройти несколько лет, прежде чем начнется активный рост вторичных очагов. Почему и как это происходит – пока не до конца изучено. В некоторых случаях возникают метастазы после удаления опухоли и спустя некоторое время после завершения лечения из оставшихся «спящих» раковых клеток.
Когда вторичный очаг растет, число раковых клеток в нем увеличивается, и они начинают вырабатывать особые вещества – факторы роста. Эти соединения активируют рост новых кровеносных сосудов. Образуется капиллярная сеть, которая обеспечивает опухоль кислородом и необходимыми веществами. При этом опухолевые очаги как бы «обкрадывают» здоровые органы и ткани.
Процесс метастазирования можно разделить на несколько стадий:
- Раковые клетки отделяются от первичной опухоли и проникают в лимфатический или кровеносный сосуд, который находится поблизости.
- Происходит миграция злокачественных клеток в различные органы и ткани.
- Достигнув определенного сосуда, раковая клетка выходит через его стенку в окружающие ткани.
- В течение некоторого времени опухолевые клетки «спят» в тканях и не проявляют себя.
- На последней стадии начинается быстрый рост метастазов.
На каждой из этих стадий многие раковые клетки гибнут. Вторичным очагам дают начало те, которые в конечном итоге выживают.
Врачи клиники «Евроонко» о стадиях рака, рецидиве и метастазах
Что влияет на скорость распространения метастазов в организме?
Как уже упоминалось выше, скорость метастазирования в первую очередь зависит от двух факторов: типа рака и степени дифференцировки:
- В высокодифференцированных опухолях клетки и ткань сильно напоминают нормальные. Такие новообразования ведут себя менее агрессивно, распространяются в организме реже и позже.
- В низкодифференцированных опухолях клетки практически утрачивают черты нормальных. Такой рак более агрессивен, быстрее и с большей вероятностью образует метастазы.
В большинстве случаев метастазы возникают спустя 1–2 года после того, как появляется первичная опухоль. Но иногда это происходит очень быстро, если рак агрессивен. Иногда вторичные очаги обнаруживают спустя многие годы после операции. В таких случаях говорят о латентных («дремлющих») метастазах.
«Можно ли предотвратить метастазирование после операции по удалению первичной опухоли?»
Да, такие способы существуют. Например, адъювантная (то есть проводимая после операции) химиотерапия и лучевая терапия. Химиопрепараты и облучение уничтожают злокачественные клетки, которые могли остаться в организме пациента, и предотвращают рецидив рака, в том числе в виде отдаленных метастазов.
Особенности метастазирования разных типов рака
В некоторых органах вторичные очаги при различных типах рака обнаруживаются очень часто, а другие поражаются редко. Это зависит от особенностей кровоснабжения и некоторых других факторов:
- Чаще всего метастазы обнаруживаются в лимфоузлах, легких и печени.
- Несколько реже рак распространяется в кости, головной и спинной мозг, почки, надпочечники.
- Очень редко метастатические очаги можно выявить в сердечной мышце, коже, скелетной мускулатуре, поджелудочной железе, селезенке.
Некоторые метастазы являются «именными». Они настолько специфичны, что получили собственные названия:
Метастаз Вирхова – поражение левого надключичного лимфатического узла. Свое название он получил по фамилии немецкого патолога Рудольфа Вирхова, которым был открыт в 1848 году. Как правило, такая локализация вторичного очага характерна для рака желудка. Также метастаз Вирхова встречается при злокачественных опухолях других органов пищеварительного тракта, аденокарциноме легкого, раке предстательной железы, яичников, лимфоме.
Левый надключичный узел становится местом метастазирования злокачественных опухолей, потому что он играет важную роль в лимфатической системе, принимает лимфу от левой части головы, шеи, грудной клетки, живота, области таза, обеих нижних конечностей. Метастаз Вирхова не только свидетельствует о том, что рак распространился, но и может сам по себе вызывать некоторые симптомы, сдавливая соседние нервы и кровеносные сосуды.
Метастаз Крукенберга обнаруживается в яичниках. По частоте встречаемости он составляет треть от всех метастазов в этом органе и назван по фамилии открывшего его гинеколога – Фридриха Крукенберга. Отличительная особенность таких вторичных очагов в том, что они состоят из клеток специфической формы в виде перстня, то есть представляют собой перстневидно-клеточный рак.
Метастаз сестры Марии Джозеф получил свое название в честь сестры Мэри Джозеф Демпси, которая ассистировала американскому хирургу Уильяму Мэйо, впервые описавшему это явление. Это метастаз в пупок, который встречается довольно редко: при 1–3% злокачественных новообразований брюшной полости и таза. Чаще всего метастаз сестры Марии Джозеф обнаруживается при раке органов пищеварительного тракта (в 35–65% случаев) и мочеполовой системы (в 12–35% случаев).
Наиболее частые места метастазирования при различных типах рака указаны в таблице:
Важно знать
Метастазы всегда обозначают по названию первичной опухоли. Например, если рак толстой кишки метастазировал в печень, то его по-прежнему называют раком кишки с метастазами, а не раком печени. Однако, клетки в первичной опухоли и вторичных очагах могут различаться по своим молекулярно-генетическим характеристикам.
В чем опасность метастазов?
Если у онкологического пациента обнаружены метастазы – этого говорит о том, что его организм не в состоянии бороться с опухолевым процессом. Ресурсы исчерпаны. Метастазы нарушают работу всех органов и систем. Зачастую именно это становится причиной гибели больного.
Кроме того, метастазы сильно ухудшают общее состояние. Они становятся причиной истощения, плохого самочувствия, мучительных болей, из-за которых нужно постоянное обезболивание.
Основные разновидности метастазов, в зависимости от локализации
Злокачественные опухоли способны метастазировать в разные органы, но чаще всего очаги обнаруживаются в легких, костях, печени, центральной нервной системе. Также раковые клетки могут распространяться по поверхности серозных оболочек, выстилающих грудную и брюшную полость.
Метастазы в легких
Метастазировать в легкие могут практически любые злокачественные опухоли, но чаще всего это происходит при раке толстой кишки, молочной железы, простаты, мочевого пузыря, саркомах, нейробластомах, опухолях Вильмса.
Метастазы в легочной ткани проявляются в виде таких симптомов, как упорный кашель, примесь крови в мокроте, одышка, боли в груди, слабость, беспричинная потеря веса. Для диагностики применяют компьютерную томографию грудной клетки, бронхоскопию, различные виды биопсии, цитологическое исследование мокроты, жидкости, эвакуированной из плевральной полости.
При метастазах рака в легких хирургическое лечение обычно нецелесообразно, потому что опухолевых очагов, как правило, много, они имеют микроскопические размеры, не визуализируются на снимках, и полностью их удалить невозможно. Показана химиотерапия. Выживаемость пациентов несколько лучше при раке яичников и лимфомах.
Метастазы в печени
Чаще всего в печень метастазируют злокачественные опухоли толстой и прямой кишки. Согласно статистике, в 70% случаях при колоректальном раке, рано или поздно, обнаруживаются печеночные метастазы. Это связано с тем, что кровь от толстой кишки оттекает в печень по воротной вене. Для обнаружения вторичных очагов применяют КТ, МРТ, ПЭТ/КТ-сканирование, биопсию.
Основные проявления метастазов в печени: повышение температуры тела более 38 градусов, анорексия, желтуха, боль в правой верхней части живота, тошнота, потливость, беспричинная потеря веса.
Лечение зависит от количества, размеров очагов, состояния печеночной функции. В некоторых случаях пораженную часть органа можно удалить хирургически. При небольших очагах применяют малоинвазивные методики: радиочастотную, микроволновую аблацию. Проводят системную, а также интраартериальную химиотерапию, химиоэмболизацию. При механической желтухе выполняют дренирование, устанавливают стенты.
Метастазы в костях
Метастазы в костях встречаются намного чаще, чем первичные злокачественные опухоли. Чаще всего в кости распространяется рак молочной железы, почек, легких, простаты, щитовидной железы, яичников, меланома. В первую очередь это приводит к боли. Постепенно она становится постоянной, мучительной, усиливается в покое, по ночам, мешает спать. Впоследствии могут возникать некоторые осложнения:
- Патологические переломы в результате ослабления костной ткани.
- Сдавление спинного мозга при патологических переломах позвонков. Проявляется в виде сильной боли в спине, пояснице, онемения кожи ног, живота, парезов (слабости и нарушения движений) в мышцах ног, утраты контроля над мочеиспусканиями и дефекацией. Требуется экстренное хирургическое вмешательство, иначе эти нарушения станут необратимыми.
- Гиперфосфатемия – повышение уровня кальция и фосфатов в крови в результате разрушения костной ткани. Проявляется в виде частых мочеиспусканий, запоров, жажды, сонливости, боли и слабости в мышцах. В тяжелых случаях возникает спутанность сознания, кома.
Для уменьшения опухолевых очагов и облегчения болей в костях применяют химиопрепараты, лучевую терапию, обезболивающие средства (в том числе наркотические анальгетики). Чтобы предотвратить разрушение костей и патологические переломы, назначают бифосфонаты. В некоторых случаях кости необходимо укрепить с помощью винтов, скоб, пластин или иных конструкций.
Метастазы в головном мозге
Метастатическое поражение головного мозга чаще всего обнаруживается при раке легких, молочной железы, почек, толстой кишки и при меланоме. При этом беспокоят частые головные боли, которые могут сопровождаться тошнотой и рвотой. Возникают проблемы с памятью, вниманием, мышлением, неврологические симптомы в виде слабости мышц, нарушения движений. Могут возникать судороги, потери сознания.
Для диагностики метастазов в мозге применяют МРТ, биопсию. В некоторых случаях опухолевые очаги можно удалить хирургически. Применяют лучевую терапию, стереотаксическую хирургию (Гамма-нож, КиберНож), проводят курсы противоопухолевой терапии. Для борьбы с симптомами назначают глюкокортикостероиды (уменьшают воспаление вокруг опухолевых очагов), противосудорожные препараты.
Канцероматоз плевры
Раковое поражение плевры проявляется в виде экссудативного плеврита – скопления жидкости в плевральной полости вокруг легких. При этом возникает тяжесть в грудной клетке, одышка, боли, слабость, невозможность сделать глубокий вдох. Таким больным показана плевральная пункция и торакоцентез – выведение жидкости из плевральной полости. Это одновременно и диагностическая, и лечебная процедура. Проводят системную химиотерапию – она помогает уменьшить опухолевые очаги. Чтобы предотвратить дальнейшее скопление жидкости, выполняют плевродез – вмешательство, направленное на склеивание листков плевры.
Канцероматоз брюшины
Канцероматоз брюшины – распространение раковых клеток по поверхности серозной оболочки, выстилающей стенки брюшной полости и покрывающей внутренние органы. При этом в брюшной полости скапливается жидкость. Когда ее становится много, она ограничивает подвижность диафрагмы и затрудняет дыхание, нарушает работу внутренних органов. Жидкость из брюшной полости выводят через прокол во время процедуры, которая называется лапароцентезом. Выполняют различные хирургические вмешательства, проводят системную и внутрибрюшинную химиотерапию. Существенно улучшить состояние и продлить жизнь пациентов с канцероматозом брюшины помогает современный метод лечения, который применяется в клинике «Евроонко» – гипертермическая интраперитонеальная химиотерапия (ИГХТ, HIPEC).
Симптомы метастазов рака
Симптомы метастазов зависит от того, в каком органе находятся вторичные очаги и насколько сильно нарушают его работу:
- При поражении легких: одышка, боли в груди, упорный кашель.
- При поражении брюшины: скопление жидкости в животе, которое называется асцитом. У таких пациентов проводят лапароцентез и другие виды лечения.
- При поражении печени: боли под правым ребром, ухудшение аппетита, тошнота, механическая желтуха.
- При поражении плевры между ее листками скапливается жидкость, которая сдавливает легкие и нарушает дыхание. Это состояние называется экссудативным плевритом. Необходим плевроцентез.
- При поражении костей беспокоят боли. Они усиливаются в покое, по ночам, мешают спать. Если опухоль сильно ослабляет костную ткань, возникают патологические переломы.
- При поражении головного мозга чаще всего беспокоят головные боли, головокружения. Могут возникать нарушения сознания, судороги.
Метастазы приводят к нарушениям не только в том месте, где они находятся: во время гибели раковых клеток выделяются токсины, и они влияют на весь организм.
Диагностика метастатического рака
Чтобы обнаружить метастазы рака, применяют разные методы диагностики:
- ультразвуковое исследование;
- компьютерная томография;
- магнитно-резонансная томография;
- позитронно-эмиссионная томография, ПЭТ (чаще всего применяется в сочетании с компьютерной томографией – ПЭТ/КТ);
- сцинтиграфия, однофотонная эмиссионная компьютерная томография (ОФЭКТ);
- рентгенография в последние годы утратила свое значение, так как существуют более информативные вышеперечисленные методы.
С помощью этих диагностических методик можно выявить метастазы, оценить их количество, величину, локализацию, характер роста, обнаружить их нагноение и распад. Как определить метастазы в конкретном случае и какие методы диагностики нужны конкретному пациенту – это определяет врач по результатам расспроса и осмотра пациента, предшествующего обследования.
Эти же методики применяются для регулярных контрольных обследований у пациентов, которые уже завершили лечение. Они помогают своевременно обнаружить рецидив рака.
Можно ли вылечить пациента, если у него рак с метастазами?
Пациенты часто с надеждой спрашивают онколога: «убивает ли химиотерапия метастазы?». К сожалению, при метастатическом раке шансы на ремиссию крайне малы. Чаще всего цели лечения – продлить жизнь больного, обеспечить хорошее самочувствие, устранить мучительные симптомы. Хотя рак IV стадии неизлечим, зачастую его можно лечить как хроническое заболевание (например, как артериальную гипертонию, сахарный диабет) и существенно продлить жизнь больного. В клиниках «Евроонко» для этого применяются все современные методики:
- Противоопухолевая терапия препаратами последних поколений, включая таргетную, гормональную терапию, иммунотерапию.
- Паллиативные хирургические вмешательства любого уровня сложности.
- В некоторых случаях, при единичных метастазах, можно полностью удалить очаги – выполнить радикальную операцию.
- Малоинвазивные вмешательства, такие как радиочастотная аблация при метастазах в печени, эмболизация опухолевых очагов.
- Обезболивание в соответствии с современными рекомендациями ВОЗ и другие виды симптоматического лечения.
- Поддерживающая терапия, которая помогает комфортно и без побочных эффектов перенести курс химиотерапии.
Где лучше лечиться при раке с метастазами?
Существует миф о том, что эффективное лечение при раке IV стадии можно получить только за границей – в Европе, США, Израиле. На самом деле в России уже давно доступны все те же технологии и лекарственные препараты. В клиниках «Евроонко» работают врачи, которые по уровню профессионализма и знаний ничем не уступают своим зарубежным коллегам, руководствуются теми же международными протоколами лечения. Ехать за границу вовсе не обязательно. Онкологическую помощь на том же уровне можно получить в Москве.
А если вы проходите лечение в другой клинике, то всегда можете получить услугу второго врачебного мнения у ведущих онкологов в «Евроонко».
| Подробнее о лечении в «Евроонко»: | |
| Консультация онколога в «Евроонко» | от 5 100 руб |
| Скорая помощь для онкологических больных | от 12 100 руб |
| Приём химиотерапевта | 6 900 руб |
| Паллиативная терапия в Москве | от 35 000 руб в сутки |
Метастазы
Метастазы – вторичные злокачественные опухоли различных органов и тканей, возникшие в результате гематогенного, лимфогенного или имплантационного распространения злокачественных клеток первичного новообразования. Могут обнаруживаться в любом органе. На ранних стадиях протекают бессимптомно. В последующем клинические проявления зависят от локализации метастаза. Диагноз устанавливается с учетом анамнеза, жалоб, данных объективного осмотра, результатов анализов и инструментальных исследований. Лечение – химиотерапия, радиотерапия, хирургические вмешательства.
Общие сведения
Метастазы – отдаленные очаги онкологического процесса, возникшие при перемещении злокачественных клеток по организму. Выявляются у лиц любых возрастов, однако наибольшее количество поражений обнаруживаются у пациентов старше 50 лет. Могут появляться при большинстве злокачественных опухолей и поражать любые органы. Чаще всего злокачественные новообразования метастазируют в лимфатические узлы, легкие и печень. Несколько реже встречаются метастазы в кости, надпочечники, почки и центральную нервную систему. Редко диагностируются метастатические поражения поджелудочной железы, селезенки, кожи, скелетных мышц и сердечной мышцы.
Нарушения функции различных органов, обусловленные ростом метастазов, являются ведущей причиной смертности при онкологических заболеваниях. Появление вторичных очагов ухудшает прогноз и делает невозможным радикальное лечение злокачественной опухоли либо создает существенные ограничения при выборе методов терапии. Диагностику и лечение метастазов осуществляют специалисты в области онкологии и других специальностей (в зависимости от локализации вторичного очага).
Метастазы
Этиология и патологическая анатомия метастазов
Без соответствующего лечения со временем метастазы возникают почти при всех злокачественных опухолях, однако сроки их появления могут существенно варьировать. Иногда метастазы обнаруживаются через несколько лет после развития первичного процесса, иногда – через несколько месяцев, а иногда и вовсе становятся первым проявлением онкологического заболевания, поэтому временной интервал между развитием первичной опухоли и возникновением метастазов не удается установить даже приблизительно.
Специалисты считают, что в некоторых случаях злокачественные клетки могут мигрировать в различные органы, образовывая «спящие очаги», которые в последующем активизируются и начинают быстро расти. Однако причины, по которым метастазы при одном и том же заболевании появляются и развиваются с разной скоростью, пока не установлены. Можно лишь перечислить ряд факторов, способствующих быстрому возникновению и прогрессированию вторичных образований.
В числе таких факторов – большое количество мелких сосудов вокруг первичного новообразования, особенности расположения и гистологического строения первичного очага, иммунные расстройства и возраст пациентов (у молодых метастазы возникают и прогрессируют быстрее, чем у пожилых). Большое значение имеет противоопухолевая терапия – после такой терапии трудно прогнозировать вероятность и возможное время появления метастазов. Иногда вторичные очаги возникают спустя несколько лет после прохождения курса лечения, на фоне изменения каких-то жизненных условий или без всяких видимых причин.
Клетки первичной опухоли могут распространяться по организму тремя путями: лимфогенным (по лимфатическим сосудам), гематогенным (по кровеносным сосудам) и имплантационным. Имплантационное метастазирование становится возможным после разрушения капсулы органа и выхода злокачественных клеток в ту или иную естественную полость. Например, клетки рака яичника через брюшную полость могут мигрировать на поверхность печени, а клетки первичного рака легких через плевральную полость – на поверхность плевры.
Преобладающий путь метастазирования определяется происхождением и степенью злокачественности опухоли. Клетки соединительнотканных и эпителиальных новообразований чаще мигрируют по лимфатическим путям. При опухолях высокой степени злокачественности преобладает гематогенное распространение. В большинстве случаев лимфогенные метастазы появляются раньше гематогенных. В первую очередь страдают регионарные лимфоузлы. Затем злокачественные клетки могут распространяться дальше по лимфатической системе.
Знание особенностей лимфотока в той или иной анатомической зоне позволяет определять возможные пути метастазирования и выявлять вторичные скопления злокачественных клеток (за исключением случаев микрометастазирования). Гематогенные метастазы возникают на значительном удалении от органа, пораженного первичным процессом, поэтому для их обнаружения приходится проводить комплексное обследование с учетом наиболее вероятных областей метастазирования.
Разные виды рака с различной частотой метастазируют в те или иные органы. Так, рак молочной железы, рак почек, рак предстательной железы и рак щитовидной железы чаще всего дают метастазы в легкие, кости и печень. При раке желудка, раке яичников, раке толстой кишки, раке тела матки и раке поджелудочной железы поражаются печень, брюшина и легкие. Рак прямой кишки и рак легкого распространяются в печень, надпочечники и легкие (при раке легкого страдает второе легкое). Меланома дает метастазы в печень, легкие, кожу и мышцы.
Среди вторичных новообразований преобладают солидные узловые формы, реже встречаются язвенные поверхности (например, при поражении кожи), слизеобразующие объемные образования (метастазы Крукенберга) и другие типы опухолей. Размер метастазов может варьировать от нескольких миллиметров до 20 и более сантиметров. Возможно одиночное поражение определенного органа, множественное поражение определенного органа, а также одиночные или множественные вторичные очаги в нескольких органах. Отдельно стоит упомянуть так называемые «пылевые» метастазы – множественные мелкие очаги в брюшной полости, провоцирующие развитие асцита.
По своей гистологической структуре вторичные новообразования обычно соответствуют первичной опухоли. Вместе с тем, в отдельных случаях метастазы могут иметь гистологическое строение, отличающееся от строения первичного рака. Обычно такие отличия выявляются при метастазировании опухоли полого органа в паренхиматозный орган (например, при метастатическом раке печени, возникшем вследствие первичного рака толстой кишки). Иногда из-за различия в структуре первичного и вторичного очагов возникают сложности при дифференцировке метастазов и множественного рака.
Симптомы метастазов
На начальных стадиях метастазы обычно протекают бессимптомно. В последующем клинические проявления зависят от локализации вторичного новообразования. Местная симптоматика сочетается с общими признаками онкологического заболевания: гипертермией, потерей аппетита, уменьшением массы тела вплоть до раковой кахексии, общей слабостью и анемией. При метастазах в лимфатические узлы наблюдается увеличение их размера, определяемое при пальпации или в процессе визуального осмотра.
Узлы обычно безболезненные, мягко-эластической консистенции. Чаще всего метастазы локализуются в шейных, паховых, подмышечных и надключичных лимфоузлах. При достаточно большом размере такие очаги могут быть обнаружены уже на этапе обычного осмотра. Выявление метастазов в некоторых лимфатических узлах (забрюшинных, парааортальных, узлах брюшной полости, узлах средостения) возможно только при проведении инструментальных исследований, поскольку эти анатомические образования недоступны для объективного обследования. Подозрение на наличие таких метастазов может возникнуть при их значительном увеличении, вызывающем сдавление близлежащих анатомических образований.
Проявления гематогенных метастазов определяются их локализацией. При вторичных очагах в головном мозге возникают головокружения, распирающие головные боли, тошнота, рвота и очаговые неврологические расстройства. При метастазировании в спинной мозг появляются боли, быстрая утомляемость при физической нагрузке, нарушения деятельности тазовых органов, прогрессирующие расстройства движений и чувствительности. При метастазах в легких наблюдаются частые рецидивы воспалительных заболеваний (бронхита, пневмонии, гриппа, ОРВИ), в последующем присоединяется одышка и кашель с примесью крови в мокроте.
Метастазы в печень проявляются тяжестью и болями в правом подреберье, нарушением печеночных функций, увеличением и бугристостью печени. На поздних стадиях выявляются желтуха, асцит и прогрессирующая печеночная недостаточность. Вторичные новообразования в костях вызывают мучительные боли, гиперкальциемию и патологические переломы. Возможно сдавление спинного мозга, нервных и сосудистых стволов. При метастазах в брюшину возникает асцит, обусловленный нарушением регуляции процесса выделения и всасывания жидкости тканями брюшины.
Метастазы в кожу представляют собой плотные, быстро растущие одиночные или множественные узлы телесного, синеватого или розоватого цвета. В последующем наблюдается их распад и изъязвление. При некоторых первичных новообразованиях (например, при карциноме молочной железы, раке толстого кишечника, раке яичника и раке мочевого пузыря) симптомы вторичных кожных опухолей могут имитировать клиническую картину рожистого воспаления. Реже (обычно – при опухолях молочной железы) выявляются склеродермоподобные метастазы.
Диагностика метастазов
Диагноз устанавливается на основании клинических данных и результатов дополнительных исследований. Из-за высокой склонности к развитию метастазов любое злокачественное новообразование является показанием для расширенного обследования (даже если признаки поражения других органов отсутствуют). Больным с подозрением на метастазы назначают общий анализ крови, биохимический анализ крови и анализ крови на маркеры рака. Пациентов направляют на рентгенографию грудной клетки, УЗИ органов брюшной полости, УЗИ органов малого таза, КТ и МРТ головного мозга, КТ и МРТ спинного мозга, сцинтиграфию костей скелета, рентгенографию костей скелета и другие исследования.
Наличие метастазов окончательно подтверждают при проведении гистологического либо цитологического исследования измененной ткани. Забор гистологического материала из мягких тканей осуществляют путем инцизионной, сердцевинной или щипковой биопсии. При поверхностном расположении метастазов используют скарификационную биопсию, при поражении костей – трепан-биопсию. Материал для цитологического исследования получают путем взятия обычных отпечатков или мазков-отпечатков. Для забора жидкости проводят аспирационную биопсию.
Дифференциальную диагностику метастазов осуществляют с первичными новообразованиями и с множественным раком (при одновременном или почти одновременном обнаружении нескольких очагов в одном или разных органах). В некоторых случаях требуется дифференцировка с дегенеративно-дистрофическими и воспалительными процессами. Так, симптоматическую пневмонию при метастазах в легких необходимо дифференцировать с обычной пневмонией, мелкие метастазы в позвоночник на фоне предшествующего остеопороза – с возрастными изменениями позвоночника и т. д.
Лечение метастазов
Тактика лечения определяется индивидуально с учетом вида рака, состояния первичной опухоли, общего состояния больного, чувствительности клеток к тому или иному типу лечебного воздействия, количества, локализации и размера метастазов. Возможно использование радиотерапии, химиотерапии, иммунохимиотерапии, гормонотерапии, классических хирургических вмешательств, радиохирургии, криохирургии и эмболизации питающих артерий. Как правило, при метастазах применяется комбинация нескольких методов лечения (например, химиотерапии и лучевой терапии, химиотерапии и иммунотерапии, лучевой терапии и хирургического вмешательства и т. д.). Показания к оперативному лечению и объем вмешательства также зависят от количества и локализации метастазов.
При метастазах в регионарные лимфатические узлы обычно проводят лимфаденэктомию в сочетании с удалением первичного новообразования. При контролируемых первичных опухолях и одиночных метастазах в отдаленные органы в некоторых случаях возможно радикальное иссечение вторичных очагов. При множественных метастазах хирургическое вмешательство, как правило, не показано. Исключением являются ситуации, когда паллиативная операция может отсрочить летальный исход или улучшить качество жизни больного (например, краниотомия для снижения опасного внутричерепного давления, вызванного метастатической опухолью мозга).
Прогноз при метастазах
До недавнего времени наличие метастазов рассматривалось, как свидетельство скорой гибели пациента. Сейчас ситуация постепенно меняется, хотя наличие вторичных опухолей по-прежнему рассматривается, как крайне неблагоприятный прогностический признак. Использование новых методов диагностики и лечения в ряде случаев позволяет увеличить среднюю продолжительность жизни больных. При определенных условиях стало возможным радикальное лечение метастазов некоторых локализаций, например, одиночных очагов метастатического рака печени или метастатического рака головного мозга.
В целом прогноз при метастазах определяется степенью запущенности онкологического процесса, возможностями конкретного лечебного учреждения (некоторые лечебные и диагностические методики доступны только в крупных центрах), видом, локализацией и стадией первичной опухоли, возрастом больного, состоянием его иммунной системы, степенью истощения, уровнем нарушения функций различных органов и пр. Средняя продолжительность жизни при метастатическом раке печени составляет около полугода, поражении головного мозга – несколько недель, при метастазах в кости – несколько лет, при вторичных новообразованиях в почках – 1-3 года.








 Как ставят окончательный диагноз “рак”? Достаточно ли биопсии для постановки диагноза?
Как ставят окончательный диагноз “рак”? Достаточно ли биопсии для постановки диагноза?