Liquid fluorine (F2 at extremely low temperature) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fluorine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotropes | alpha, beta (see Allotropes of fluorine) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | gas: very pale yellow liquid: bright yellow solid: alpha is opaque, beta is transparent |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fluorine in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 17 (halogens) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p5[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | (F2) 53.48 K (−219.67 °C, −363.41 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | (F2) 85.03 K (−188.11 °C, −306.60 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 1.696 g/L[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.505 g/cm3[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 53.48 K, 90 kPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 144.41 K, 5.1724 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 6.51 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | Cp: 31 J/(mol·K)[5] (at 21.1 °C) Cv: 23 J/(mol·K)[5] (at 21.1 °C) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −1, 0[6] (oxidizes oxygen) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 3.98[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 64 pm[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 135 pm[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of fluorine |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubic
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 0.02591 W/(m⋅K)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic (−1.2×10−4)[11][12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7782-41-4[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after the mineral fluorite, itself named after Latin fluo (to flow, in smelting) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | André-Marie Ampère (1810) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Henri Moissan[2] (June 26, 1886) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Named by |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of fluorine
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[13] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Fluorine is a chemical element with the symbol F and atomic number 9. It is the lightest halogen and exists at standard conditions as a highly toxic, pale yellow diatomic gas. As the most electronegative reactive element, it is extremely reactive, as it reacts with all other elements except for the light inert gases.
Among the elements, fluorine ranks 24th in universal abundance and 13th in terrestrial abundance. Fluorite, the primary mineral source of fluorine which gave the element its name, was first described in 1529; as it was added to metal ores to lower their melting points for smelting, the Latin verb fluo meaning ‘flow’ gave the mineral its name. Proposed as an element in 1810, fluorine proved difficult and dangerous to separate from its compounds, and several early experimenters died or sustained injuries from their attempts. Only in 1886 did French chemist Henri Moissan isolate elemental fluorine using low-temperature electrolysis, a process still employed for modern production. Industrial production of fluorine gas for uranium enrichment, its largest application, began during the Manhattan Project in World War II.
Owing to the expense of refining pure fluorine, most commercial applications use fluorine compounds, with about half of mined fluorite used in steelmaking. The rest of the fluorite is converted into corrosive hydrogen fluoride en route to various organic fluorides, or into cryolite, which plays a key role in aluminium refining. Molecules containing a carbon–fluorine bond often have very high chemical and thermal stability; their major uses are as refrigerants, electrical insulation and cookware, and PTFE (Teflon). Pharmaceuticals such as atorvastatin and fluoxetine contain C−F bonds. The fluoride ion from dissolved fluoride salts inhibits dental cavities, and so finds use in toothpaste and water fluoridation. Global fluorochemical sales amount to more than US$69 billion a year.
Fluorocarbon gases are generally greenhouse gases with global-warming potentials 100 to 23,500 times that of carbon dioxide, and SF6 has the highest global warming potential of any known substance. Organofluorine compounds often persist in the environment due to the strength of the carbon–fluorine bond. Fluorine has no known metabolic role in mammals; a few plants and sea sponges synthesize organofluorine poisons (most often monofluoroacetates) that help deter predation.[14]
Characteristics[edit]
Electron configuration[edit]
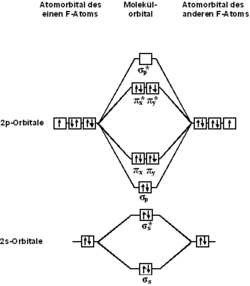
Fluorine atoms have nine electrons, one fewer than neon, and electron configuration 1s22s22p5: two electrons in a filled inner shell and seven in an outer shell requiring one more to be filled. The outer electrons are ineffective at nuclear shielding, and experience a high effective nuclear charge of 9 − 2 = 7; this affects the atom’s physical properties.[2]
Fluorine’s first ionization energy is third-highest among all elements, behind helium and neon,[15] which complicates the removal of electrons from neutral fluorine atoms. It also has a high electron affinity, second only to chlorine,[16] and tends to capture an electron to become isoelectronic with the noble gas neon;[2] it has the highest electronegativity of any reactive element.[17] Fluorine atoms have a small covalent radius of around 60 picometers, similar to those of its period neighbors oxygen and neon.[18][19][note 1]
Reactivity[edit]
| External video |
|---|
The bond energy of difluorine is much lower than that of either Cl
2 or Br
2 and similar to the easily cleaved peroxide bond; this, along with high electronegativity, accounts for fluorine’s easy dissociation, high reactivity, and strong bonds to non-fluorine atoms.[20][21] Conversely, bonds to other atoms are very strong because of fluorine’s high electronegativity. Unreactive substances like powdered steel, glass fragments, and asbestos fibers react quickly with cold fluorine gas; wood and water spontaneously combust under a fluorine jet.[4][22]
Reactions of elemental fluorine with metals require varying conditions. Alkali metals cause explosions and alkaline earth metals display vigorous activity in bulk; to prevent passivation from the formation of metal fluoride layers, most other metals such as aluminium and iron must be powdered,[20] and noble metals require pure fluorine gas at 300–450 °C (575–850 °F).[23] Some solid nonmetals (sulfur, phosphorus) react vigorously in liquid fluorine.[24] Hydrogen sulfide[24] and sulfur dioxide[25] combine readily with fluorine, the latter sometimes explosively; sulfuric acid exhibits much less activity, requiring elevated temperatures.[26]
Hydrogen, like some of the alkali metals, reacts explosively with fluorine.[27] Carbon, as lamp black, reacts at room temperature to yield tetrafluoromethane. Graphite combines with fluorine above 400 °C (750 °F) to produce non-stoichiometric carbon monofluoride; higher temperatures generate gaseous fluorocarbons, sometimes with explosions.[28] Carbon dioxide and carbon monoxide react at or just above room temperature,[29] whereas paraffins and other organic chemicals generate strong reactions:[30] even completely substituted haloalkanes such as carbon tetrachloride, normally incombustible, may explode.[31] Although nitrogen trifluoride is stable, nitrogen requires an electric discharge at elevated temperatures for reaction with fluorine to occur, due to the very strong triple bond in elemental nitrogen;[32] ammonia may react explosively.[33][34] Oxygen does not combine with fluorine under ambient conditions, but can be made to react using electric discharge at low temperatures and pressures; the products tend to disintegrate into their constituent elements when heated.[35][36][37] Heavier halogens[38] react readily with fluorine as does the noble gas radon;[39] of the other noble gases, only xenon and krypton react, and only under special conditions.[40] Argon does not react with fluorine gas; however, it does form a compound with fluorine, argon fluorohydride.
Phases[edit]
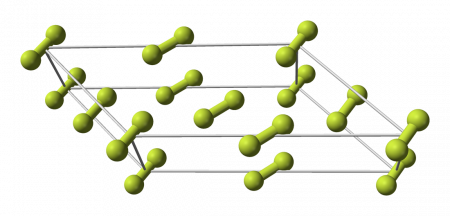
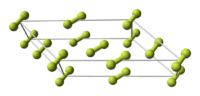
Crystal structure of β-fluorine. Spheres indicate F
2 molecules that may assume any angle. Other molecules are constrained to planes.
Animation showing the crystal structure of beta-fluorine. Molecules on the faces of the unit cell have rotations constrained to a plane.
At room temperature, fluorine is a gas of diatomic molecules,[4] pale yellow when pure (sometimes described as yellow-green).[41] It has a characteristic halogen-like pungent and biting odor detectable at 20 ppb.[42] Fluorine condenses into a bright yellow liquid at −188 °C (−306 °F), a transition temperature similar to those of oxygen and nitrogen.[43]
Fluorine has two solid forms, α- and β-fluorine. The latter crystallizes at −220 °C (−364 °F) and is transparent and soft, with the same disordered cubic structure of freshly crystallized solid oxygen,[43][note 2] unlike the orthorhombic systems of other solid halogens.[47][48] Further cooling to −228 °C (−378 °F) induces a phase transition into opaque and hard α-fluorine, which has a monoclinic structure with dense, angled layers of molecules. The transition from β- to α-fluorine is more exothermic than the condensation of fluorine, and can be violent.[47][48][note 3]
Isotopes[edit]
Only one isotope of fluorine occurs naturally in abundance, the stable isotope 19
F.[49] It has a high magnetogyric ratio[note 4] and exceptional sensitivity to magnetic fields; because it is also the only stable isotope, it is used in magnetic resonance imaging.[51] Eighteen radioisotopes with mass numbers from 13 to 31 have been synthesized, of which 18
F is the most stable with a half-life of 109.77 minutes. 18
F is a natural trace radioisotope produced by cosmic ray spallation of atmospheric argon as well as by reaction of protons with natural oxygen: 18O + p → 18F + n.[52] Other radioisotopes have half-lives less than 70 seconds; most decay in less than half a second.[53] The isotopes 17
F and 18
F undergo β+ decay and electron capture, lighter isotopes decay by proton emission, and those heavier than 19
F undergo β− decay (the heaviest ones with delayed neutron emission).[53][54] Two metastable isomers of fluorine are known, 18m
F, with a half-life of 162(7) nanoseconds, and 26m
F, with a half-life of 2.2(1) milliseconds.[55]
Occurrence[edit]
Universe[edit]
| Atomic number |
Element | Relative amount |
|---|---|---|
| 6 | Carbon | 4,800 |
| 7 | Nitrogen | 1,500 |
| 8 | Oxygen | 8,800 |
| 9 | Fluorine | 1 |
| 10 | Neon | 1,400 |
| 11 | Sodium | 24 |
| 12 | Magnesium | 430 |
Among the lighter elements, fluorine’s abundance value of 400 ppb (parts per billion) – 24th among elements in the universe – is exceptionally low: other elements from carbon to magnesium are twenty or more times as common.[57] This is because stellar nucleosynthesis processes bypass fluorine, and any fluorine atoms otherwise created have high nuclear cross sections, allowing collisions with hydrogen or helium to generate oxygen or neon respectively.[57][58]
Beyond this transient existence, three explanations have been proposed for the presence of fluorine:[57][59]
- during type II supernovae, bombardment of neon atoms by neutrinos could transmute them to fluorine;
- the solar wind of Wolf–Rayet stars could blow fluorine away from any hydrogen or helium atoms; or
- fluorine is borne out on convection currents arising from fusion in asymptotic giant branch stars.
Earth[edit]
Fluorine is the thirteenth most common element in Earth’s crust at 600–700 ppm (parts per million) by mass.[60] Though believed not to occur naturally, elemental fluorine has been shown to be present as an occlusion in antozonite, a variant of fluorite.[61] Most fluorine exists as fluoride-containing minerals. Fluorite, fluorapatite and cryolite are the most industrially significant.[60][62] Fluorite (CaF
2), also known as fluorspar, abundant worldwide, is the main source of fluoride, and hence fluorine. China and Mexico are the major suppliers.[62][63][64][65][66] Fluorapatite (Ca5(PO4)3F), which contains most of the world’s fluoride, is an inadvertent source of fluoride as a byproduct of fertilizer production.[62] Cryolite (Na
3AlF
6), used in the production of aluminium, is the most fluorine-rich mineral. Economically viable natural sources of cryolite have been exhausted, and most is now synthesised commercially.[62]
-
Fluorite: Pink globular mass with crystal facets
-
Fluorapatite: Long prism-like crystal, without luster, at an angle coming out of aggregate-like rock
-
Cryolite: A parallelogram-shaped outline with diatomic molecules arranged in two layers
Other minerals such as topaz contain fluorine. Fluorides, unlike other halides, are insoluble and do not occur in commercially favorable concentrations in saline waters.[62] Trace quantities of organofluorines of uncertain origin have been detected in volcanic eruptions and geothermal springs.[67] The existence of gaseous fluorine in crystals, suggested by the smell of crushed antozonite, is contentious;[68][61] a 2012 study reported the presence of 0.04% F
2 by weight in antozonite, attributing these inclusions to radiation from the presence of tiny amounts of uranium.[61]
History[edit]
Early discoveries[edit]
In 1529, Georgius Agricola described fluorite as an additive used to lower the melting point of metals during smelting.[69][70][note 5] He penned the Latin word fluorēs (fluor, flow) for fluorite rocks. The name later evolved into fluorspar (still commonly used) and then fluorite.[63][74][75] The composition of fluorite was later determined to be calcium difluoride.[76]
Hydrofluoric acid was used in glass etching from 1720 onward.[note 6] Andreas Sigismund Marggraf first characterized it in 1764 when he heated fluorite with sulfuric acid, and the resulting solution corroded its glass container.[78][79] Swedish chemist Carl Wilhelm Scheele repeated the experiment in 1771, and named the acidic product fluss-spats-syran (fluorspar acid).[79][80] In 1810, the French physicist André-Marie Ampère suggested that hydrogen and an element analogous to chlorine constituted hydrofluoric acid.[81] He also proposed in a letter to Sir Humphry Davy dated August 26, 1812 that this then-unknown substance may be named fluorine from fluoric acid and the -ine suffix of other halogens.[82][83] This word, often with modifications, is used in most European languages; however, Greek, Russian, and some others, following Ampère’s later suggestion, use the name ftor or derivatives, from the Greek φθόριος (phthorios, destructive).[84] The New Latin name fluorum gave the element its current symbol F; Fl was used in early papers.[85][note 7]
Isolation[edit]
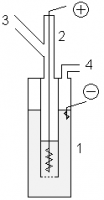
1887 drawing of Moissan’s apparatus
Initial studies on fluorine were so dangerous that several 19th-century experimenters were deemed «fluorine martyrs» after misfortunes with hydrofluoric acid.[note 8] Isolation of elemental fluorine was hindered by the extreme corrosiveness of both elemental fluorine itself and hydrogen fluoride, as well as the lack of a simple and suitable electrolyte.[76][86] Edmond Frémy postulated that electrolysis of pure hydrogen fluoride to generate fluorine was feasible and devised a method to produce anhydrous samples from acidified potassium bifluoride; instead, he discovered that the resulting (dry) hydrogen fluoride did not conduct electricity.[76][86][87] Frémy’s former student Henri Moissan persevered, and after much trial and error found that a mixture of potassium bifluoride and dry hydrogen fluoride was a conductor, enabling electrolysis. To prevent rapid corrosion of the platinum in his electrochemical cells, he cooled the reaction to extremely low temperatures in a special bath and forged cells from a more resistant mixture of platinum and iridium, and used fluorite stoppers.[86][88] In 1886, after 74 years of effort by many chemists, Moissan isolated elemental fluorine.[87][89]
In 1906, two months before his death, Moissan received the Nobel Prize in Chemistry,[90] with the following citation:[86]
[I]n recognition of the great services rendered by him in his investigation and isolation of the element fluorine … The whole world has admired the great experimental skill with which you have studied that savage beast among the elements.[note 9]
Later uses[edit]
The Frigidaire division of General Motors (GM) experimented with chlorofluorocarbon refrigerants in the late 1920s, and Kinetic Chemicals was formed as a joint venture between GM and DuPont in 1930 hoping to market Freon-12 (CCl
2F
2) as one such refrigerant. It replaced earlier and more toxic compounds, increased demand for kitchen refrigerators, and became profitable; by 1949 DuPont had bought out Kinetic and marketed several other Freon compounds.[79][91][92][93] Polytetrafluoroethylene (Teflon) was serendipitously discovered in 1938 by Roy J. Plunkett while working on refrigerants at Kinetic, and its superlative chemical and thermal resistance lent it to accelerated commercialization and mass production by 1941.[79][91][92]
Large-scale production of elemental fluorine began during World War II. Germany used high-temperature electrolysis to make tons of the planned incendiary chlorine trifluoride[94] and the Manhattan Project used huge quantities to produce uranium hexafluoride for uranium enrichment. Since UF
6 is as corrosive as fluorine, gaseous diffusion plants required special materials: nickel for membranes, fluoropolymers for seals, and liquid fluorocarbons as coolants and lubricants. This burgeoning nuclear industry later drove post-war fluorochemical development.[95]
Compounds[edit]
Fluorine has a rich chemistry, encompassing organic and inorganic domains. It combines with metals, nonmetals, metalloids, and most noble gases,[96] and almost exclusively assumes an oxidation state of −1.[note 10] Fluorine’s high electron affinity results in a preference for ionic bonding; when it forms covalent bonds, these are polar, and almost always single.[99][100][note 11]
Metals[edit]
Alkali metals form ionic and highly soluble monofluorides; these have the cubic arrangement of sodium chloride and analogous chlorides.[101][102] Alkaline earth difluorides possess strong ionic bonds but are insoluble in water,[85] with the exception of beryllium difluoride, which also exhibits some covalent character and has a quartz-like structure.[103] Rare earth elements and many other metals form mostly ionic trifluorides.[104][105][106]
Covalent bonding first comes to prominence in the tetrafluorides: those of zirconium, hafnium[107][108] and several actinides[109] are ionic with high melting points,[110][note 12] while those of titanium,[113] vanadium,[114] and niobium are polymeric,[115] melting or decomposing at no more than 350 °C (660 °F).[116] Pentafluorides continue this trend with their linear polymers and oligomeric complexes.[117][118][119] Thirteen metal hexafluorides are known,[note 13] all octahedral, and are mostly volatile solids but for liquid MoF
6 and ReF
6, and gaseous WF
6.[120][121][122] Rhenium heptafluoride, the only characterized metal heptafluoride, is a low-melting molecular solid with pentagonal bipyramidal molecular geometry.[123] Metal fluorides with more fluorine atoms are particularly reactive.[124]
Hydrogen[edit]
Boiling points of hydrogen halides and chalcogenides, showing the unusually high values for hydrogen fluoride and water
Hydrogen and fluorine combine to yield hydrogen fluoride, in which discrete molecules form clusters by hydrogen bonding, resembling water more than hydrogen chloride.[125][126][127] It boils at a much higher temperature than heavier hydrogen halides and unlike them is miscible with water.[128] Hydrogen fluoride readily hydrates on contact with water to form aqueous hydrogen fluoride, also known as hydrofluoric acid. Unlike the other hydrohalic acids, which are strong, hydrofluoric acid is a weak acid at low concentrations.[129][note 14] However, it can attack glass, something the other acids cannot do.[131]
Other reactive nonmetals[edit]
Chlorine trifluoride, whose corrosive potential ignites asbestos, concrete, sand and other fire retardants[132]
Binary fluorides of metalloids and p-block nonmetals are generally covalent and volatile, with varying reactivities. Period 3 and heavier nonmetals can form hypervalent fluorides.[133]
Boron trifluoride is planar and possesses an incomplete octet. It functions as a Lewis acid and combines with Lewis bases like ammonia to form adducts.[134] Carbon tetrafluoride is tetrahedral and inert;[note 15] its group analogues, silicon and germanium tetrafluoride, are also tetrahedral[135] but behave as Lewis acids.[136][137] The pnictogens form trifluorides that increase in reactivity and basicity with higher molecular weight, although nitrogen trifluoride resists hydrolysis and is not basic.[138] The pentafluorides of phosphorus, arsenic, and antimony are more reactive than their respective trifluorides, with antimony pentafluoride the strongest neutral Lewis acid known.[117][139][140]
Chalcogens have diverse fluorides: unstable difluorides have been reported for oxygen (the only known compound with oxygen in an oxidation state of +2), sulfur, and selenium; tetrafluorides and hexafluorides exist for sulfur, selenium, and tellurium. The latter are stabilized by more fluorine atoms and lighter central atoms, so sulfur hexafluoride is especially inert.[141][142] Chlorine, bromine, and iodine can each form mono-, tri-, and pentafluorides, but only iodine heptafluoride has been characterized among possible interhalogen heptafluorides.[143] Many of them are powerful sources of fluorine atoms, and industrial applications using chlorine trifluoride require precautions similar to those using fluorine.[144][145]
Noble gases[edit]
These xenon tetrafluoride crystals were photographed in 1962. The compound’s synthesis, as with xenon hexafluoroplatinate, surprised many chemists.[146]
Noble gases, having complete electron shells, defied reaction with other elements until 1962 when Neil Bartlett reported synthesis of xenon hexafluoroplatinate;[147] xenon difluoride, tetrafluoride, hexafluoride, and multiple oxyfluorides have been isolated since then.[148] Among other noble gases, krypton forms a difluoride,[149] and radon and fluorine generate a solid suspected to be radon difluoride.[150][151] Binary fluorides of lighter noble gases are exceptionally unstable: argon and hydrogen fluoride combine under extreme conditions to give argon fluorohydride.[40] Helium and neon have no long-lived fluorides,[152] and no neon fluoride has ever been observed;[153] helium fluorohydride has been detected for milliseconds at high pressures and low temperatures.[152]
Organic compounds[edit]
Immiscible layers of colored water (top) and much denser perfluoroheptane (bottom) in a beaker; a goldfish and crab cannot penetrate the boundary; quarters rest at the bottom.
Chemical structure of Nafion, a fluoropolymer used in fuel cells and many other applications[154]
The carbon–fluorine bond is organic chemistry’s strongest,[155] and gives stability to organofluorines.[156] It is almost non-existent in nature, but is used in artificial compounds. Research in this area is usually driven by commercial applications;[157] the compounds involved are diverse and reflect the complexity inherent in organic chemistry.[91]
Discrete molecules[edit]
The substitution of hydrogen atoms in an alkane by progressively more fluorine atoms gradually alters several properties: melting and boiling points are lowered, density increases, solubility in hydrocarbons decreases and overall stability increases. Perfluorocarbons,[note 16] in which all hydrogen atoms are substituted, are insoluble in most organic solvents, reacting at ambient conditions only with sodium in liquid ammonia.[158]
The term perfluorinated compound is used for what would otherwise be a perfluorocarbon if not for the presence of a functional group,[159][note 17] often a carboxylic acid. These compounds share many properties with perfluorocarbons such as stability and hydrophobicity,[161] while the functional group augments their reactivity, enabling them to adhere to surfaces or act as surfactants;[162] Fluorosurfactants, in particular, can lower the surface tension of water more than their hydrocarbon-based analogues. Fluorotelomers, which have some unfluorinated carbon atoms near the functional group, are also regarded as perfluorinated.[161]
Polymers[edit]
Polymers exhibit the same stability increases afforded by fluorine substitution (for hydrogen) in discrete molecules; their melting points generally increase too.[163] Polytetrafluoroethylene (PTFE), the simplest fluoropolymer and perfluoro analogue of polyethylene with structural unit –CF
2–, demonstrates this change as expected, but its very high melting point makes it difficult to mold.[164] Various PTFE derivatives are less temperature-tolerant but easier to mold: fluorinated ethylene propylene replaces some fluorine atoms with trifluoromethyl groups, perfluoroalkoxy alkanes do the same with trifluoromethoxy groups,[164] and Nafion contains perfluoroether side chains capped with sulfonic acid groups.[165][166] Other fluoropolymers retain some hydrogen atoms; polyvinylidene fluoride has half the fluorine atoms of PTFE and polyvinyl fluoride has a quarter, but both behave much like perfluorinated polymers.[167]
Production[edit]
Elemental fluorine and virtually all fluorine compounds are produced from hydrogen fluoride or its aqueous solutions, hydrofluoric acid. Hydrogen fluoride is produced in kilns by the endothermic reaction of fluorite (CaF2) with sulfuric acid:[168]
- CaF2 + H2SO4 → 2 HF(g) + CaSO4
The gaseous HF can then be absorbed in water or liquefied.[169]
About 20% of manufactured HF is a byproduct of fertilizer production, which produces hexafluorosilicic acid (H2SiF6), which can be degraded to release HF thermally and by hydrolysis:
- H2SiF6 → 2 HF + SiF4
- SiF4 + 2 H2O → 4 HF + SiO2
Industrial routes to F2[edit]
Industrial fluorine cells at Preston
Moissan’s method is used to produce industrial quantities of fluorine, via the electrolysis of a potassium fluoride/hydrogen fluoride mixture: hydrogen and fluoride ions are reduced and oxidized at a steel container cathode and a carbon block anode, under 8–12 volts, to generate hydrogen and fluorine gas respectively.[64][170] Temperatures are elevated, KF•2HF melting at 70 °C (158 °F) and being electrolyzed at 70–130 °C (158–266 °F). KF, which acts to provide electrical conductivity, is essential since pure HF cannot be electrolyzed because it is virtually non-conductive.[79][171][172] Fluorine can be stored in steel cylinders that have passivated interiors, at temperatures below 200 °C (392 °F); otherwise nickel can be used.[79][173] Regulator valves and pipework are made of nickel, the latter possibly using Monel instead.[174] Frequent passivation, along with the strict exclusion of water and greases, must be undertaken. In the laboratory, glassware may carry fluorine gas under low pressure and anhydrous conditions;[174] some sources instead recommend nickel-Monel-PTFE systems.[175]
Laboratory routes[edit]
While preparing for a 1986 conference to celebrate the centennial of Moissan’s achievement, Karl O. Christe reasoned that chemical fluorine generation should be feasible since some metal fluoride anions have no stable neutral counterparts; their acidification potentially triggers oxidation instead. He devised a method which evolves fluorine at high yield and atmospheric pressure:[176]
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Christe later commented that the reactants «had been known for more than 100 years and even Moissan could have come up with this scheme.»[177] As late as 2008, some references still asserted that fluorine was too reactive for any chemical isolation.[178]
Industrial applications[edit]
Fluorite mining, which supplies most global fluorine, peaked in 1989 when 5.6 million metric tons of ore were extracted. Chlorofluorocarbon restrictions lowered this to 3.6 million tons in 1994; production has since been increasing. Around 4.5 million tons of ore and revenue of US$550 million were generated in 2003; later reports estimated 2011 global fluorochemical sales at $15 billion and predicted 2016–18 production figures of 3.5 to 5.9 million tons, and revenue of at least $20 billion.[79][179][180][181][182] Froth flotation separates mined fluorite into two main metallurgical grades of equal proportion: 60–85% pure metspar is almost all used in iron smelting whereas 97%+ pure acidspar is mainly converted to the key industrial intermediate hydrogen fluoride.[64][79][183]
Clickable diagram of the fluorochemical industry according to mass flows
SF
6 current transformers at a Russian railway.
At least 17,000 metric tons of fluorine are produced each year. It costs only $5–8 per kilogram as uranium or sulfur hexafluoride, but many times more as an element because of handling challenges. Most processes using free fluorine in large amounts employ in situ generation under vertical integration.[184]
The largest application of fluorine gas, consuming up to 7,000 metric tons annually, is in the preparation of UF
6 for the nuclear fuel cycle. Fluorine is used to fluorinate uranium tetrafluoride, itself formed from uranium dioxide and hydrofluoric acid.[184] Fluorine is monoisotopic, so any mass differences between UF
6 molecules are due to the presence of 235
U or 238
U, enabling uranium enrichment via gaseous diffusion or gas centrifuge.[4][64] About 6,000 metric tons per year go into producing the inert dielectric SF
6 for high-voltage transformers and circuit breakers, eliminating the need for hazardous polychlorinated biphenyls associated with oil-filled devices.[185] Several fluorine compounds are used in electronics: rhenium and tungsten hexafluoride in chemical vapor deposition, tetrafluoromethane in plasma etching[186][187][188] and nitrogen trifluoride in cleaning equipment.[64] Fluorine is also used in the synthesis of organic fluorides, but its reactivity often necessitates conversion first to the gentler ClF
3, BrF
3, or IF
5, which together allow calibrated fluorination. Fluorinated pharmaceuticals use sulfur tetrafluoride instead.[64]
Inorganic fluorides[edit]
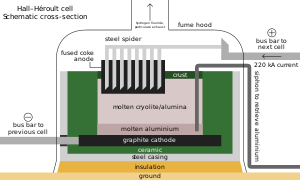
Aluminium extraction depends critically on cryolite
As with other iron alloys, around 3 kg (6.5 lb) metspar is added to each metric ton of steel; the fluoride ions lower its melting point and viscosity.[64][189] Alongside its role as an additive in materials like enamels and welding rod coats, most acidspar is reacted with sulfuric acid to form hydrofluoric acid, which is used in steel pickling, glass etching and alkane cracking.[64] One-third of HF goes into synthesizing cryolite and aluminium trifluoride, both fluxes in the Hall–Héroult process for aluminium extraction; replenishment is necessitated by their occasional reactions with the smelting apparatus. Each metric ton of aluminium requires about 23 kg (51 lb) of flux.[64][190] Fluorosilicates consume the second largest portion, with sodium fluorosilicate used in water fluoridation and laundry effluent treatment, and as an intermediate en route to cryolite and silicon tetrafluoride.[191] Other important inorganic fluorides include those of cobalt, nickel, and ammonium.[64][102][192]
Organic fluorides[edit]
Organofluorides consume over 20% of mined fluorite and over 40% of hydrofluoric acid, with refrigerant gases dominating and fluoropolymers increasing their market share.[64][193] Surfactants are a minor application but generate over $1 billion in annual revenue.[194] Due to the danger from direct hydrocarbon–fluorine reactions above −150 °C (−240 °F), industrial fluorocarbon production is indirect, mostly through halogen exchange reactions such as Swarts fluorination, in which chlorocarbon chlorines are substituted for fluorines by hydrogen fluoride under catalysts. Electrochemical fluorination subjects hydrocarbons to electrolysis in hydrogen fluoride, and the Fowler process treats them with solid fluorine carriers like cobalt trifluoride.[91][195]
Refrigerant gases[edit]
Halogenated refrigerants, termed Freons in informal contexts,[note 18] are identified by R-numbers that denote the amount of fluorine, chlorine, carbon, and hydrogen present.[64][196] Chlorofluorocarbons (CFCs) like R-11, R-12, and R-114 once dominated organofluorines, peaking in production in the 1980s. Used for air conditioning systems, propellants and solvents, their production was below one-tenth of this peak by the early 2000s, after widespread international prohibition.[64] Hydrochlorofluorocarbons (HCFCs) and hydrofluorocarbons (HFCs) were designed as replacements; their synthesis consumes more than 90% of the fluorine in the organic industry. Important HCFCs include R-22, chlorodifluoromethane, and R-141b. The main HFC is R-134a[64] with a new type of molecule HFO-1234yf, a Hydrofluoroolefin (HFO) coming to prominence owing to its global warming potential of less than 1% that of HFC-134a.[197]
Polymers[edit]
About 180,000 metric tons of fluoropolymers were produced in 2006 and 2007, generating over $3.5 billion revenue per year.[198] The global market was estimated at just under $6 billion in 2011 and was predicted to grow by 6.5% per year up to 2016.[199] Fluoropolymers can only be formed by polymerizing free radicals.[163]
Polytetrafluoroethylene (PTFE), sometimes called by its DuPont name Teflon,[200] represents 60–80% by mass of the world’s fluoropolymer production.[198] The largest application is in electrical insulation since PTFE is an excellent dielectric. It is also used in the chemical industry where corrosion resistance is needed, in coating pipes, tubing, and gaskets. Another major use is in PFTE-coated fiberglass cloth for stadium roofs. The major consumer application is for non-stick cookware.[200] Jerked PTFE film becomes expanded PTFE (ePTFE), a fine-pored membrane sometimes referred to by the brand name Gore-Tex and used for rainwear, protective apparel, and filters; ePTFE fibers may be made into seals and dust filters.[200] Other fluoropolymers, including fluorinated ethylene propylene, mimic PTFE’s properties and can substitute for it; they are more moldable, but also more costly and have lower thermal stability. Films from two different fluoropolymers replace glass in solar cells.[200][201]
The chemically resistant (but expensive) fluorinated ionomers are used as electrochemical cell membranes, of which the first and most prominent example is Nafion. Developed in the 1960s, it was initially deployed as fuel cell material in spacecraft and then replaced mercury-based chloralkali process cells. Recently, the fuel cell application has reemerged with efforts to install proton exchange membrane fuel cells into automobiles.[202][203][204] Fluoroelastomers such as Viton are crosslinked fluoropolymer mixtures mainly used in O-rings;[200] perfluorobutane (C4F10) is used as a fire-extinguishing agent.[205]
Surfactants[edit]
Fluorosurfactants are small organofluorine molecules used for repelling water and stains. Although expensive (comparable to pharmaceuticals at $200–2000 per kilogram), they yielded over $1 billion in annual revenues by 2006; Scotchgard alone generated over $300 million in 2000.[194][206][207] Fluorosurfactants are a minority in the overall surfactant market, most of which is taken up by much cheaper hydrocarbon-based products. Applications in paints are burdened by compounding costs; this use was valued at only $100 million in 2006.[194]
Agrichemicals[edit]
About 30% of agrichemicals contain fluorine,[208] most of them herbicides and fungicides with a few crop regulators. Fluorine substitution, usually of a single atom or at most a trifluoromethyl group, is a robust modification with effects analogous to fluorinated pharmaceuticals: increased biological stay time, membrane crossing, and altering of molecular recognition.[209] Trifluralin is a prominent example, with large-scale use in the U.S. as a weedkiller,[209][210] but it is a suspected carcinogen and has been banned in many European countries.[211] Sodium monofluoroacetate (1080) is a mammalian poison in which two acetic acid hydrogens are replaced with fluorine and sodium; it disrupts cell metabolism by replacing acetate in the citric acid cycle. First synthesized in the late 19th century, it was recognized as an insecticide in the early 20th, and was later deployed in its current use. New Zealand, the largest consumer of 1080, uses it to protect kiwis from the invasive Australian common brushtail possum.[212] Europe and the U.S. have banned 1080.[213][214][note 19]
Medicinal applications[edit]
Dental care[edit]
Topical fluoride treatment in Panama
Population studies from the mid-20th century onwards show topical fluoride reduces dental caries. This was first attributed to the conversion of tooth enamel hydroxyapatite into the more durable fluorapatite, but studies on pre-fluoridated teeth refuted this hypothesis, and current theories involve fluoride aiding enamel growth in small caries.[215] After studies of children in areas where fluoride was naturally present in drinking water, controlled public water supply fluoridation to fight tooth decay[216] began in the 1940s and is now applied to water supplying 6 percent of the global population, including two-thirds of Americans.[217][218] Reviews of the scholarly literature in 2000 and 2007 associated water fluoridation with a significant reduction of tooth decay in children.[219] Despite such endorsements and evidence of no adverse effects other than mostly benign dental fluorosis,[220] opposition still exists on ethical and safety grounds.[218][221] The benefits of fluoridation have lessened, possibly due to other fluoride sources, but are still measurable in low-income groups.[222] Sodium monofluorophosphate and sometimes sodium or tin(II) fluoride are often found in fluoride toothpastes, first introduced in the U.S. in 1955 and now ubiquitous in developed countries, alongside fluoridated mouthwashes, gels, foams, and varnishes.[222][223][relevant?]
Pharmaceuticals[edit]
Twenty percent of modern pharmaceuticals contain fluorine.[224] One of these, the cholesterol-reducer atorvastatin (Lipitor), made more revenue than any other drug until it became generic in 2011.[225] The combination asthma prescription Seretide, a top-ten revenue drug in the mid-2000s, contains two active ingredients, one of which – fluticasone – is fluorinated.[226] Many drugs are fluorinated to delay inactivation and lengthen dosage periods because the carbon–fluorine bond is very stable.[227] Fluorination also increases lipophilicity because the bond is more hydrophobic than the carbon–hydrogen bond, and this often helps in cell membrane penetration and hence bioavailability.[226]
Tricyclics and other pre-1980s antidepressants had several side effects due to their non-selective interference with neurotransmitters other than the serotonin target; the fluorinated fluoxetine was selective and one of the first to avoid this problem. Many current antidepressants receive this same treatment, including the selective serotonin reuptake inhibitors: citalopram, its isomer escitalopram, and fluvoxamine and paroxetine.[228][229] Quinolones are artificial broad-spectrum antibiotics that are often fluorinated to enhance their effects. These include ciprofloxacin and levofloxacin.[230][231][232][233] Fluorine also finds use in steroids:[234] fludrocortisone is a blood pressure-raising mineralocorticoid, and triamcinolone and dexamethasone are strong glucocorticoids.[235] The majority of inhaled anesthetics are heavily fluorinated; the prototype halothane is much more inert and potent than its contemporaries. Later compounds such as the fluorinated ethers sevoflurane and desflurane are better than halothane and are almost insoluble in blood, allowing faster waking times.[236][237]
PET scanning[edit]
A full-body 18
F PET scan with glucose tagged with radioactive fluorine-18. The normal brain and kidneys take up enough glucose to be imaged. A malignant tumor is seen in the upper abdomen. Radioactive fluorine is seen in urine in the bladder.
Fluorine-18 is often found in radioactive tracers for positron emission tomography, as its half-life of almost two hours is long enough to allow for its transport from production facilities to imaging centers.[238] The most common tracer is fluorodeoxyglucose[238] which, after intravenous injection, is taken up by glucose-requiring tissues such as the brain and most malignant tumors;[239] computer-assisted tomography can then be used for detailed imaging.[240]
Oxygen carriers[edit]
Liquid fluorocarbons can hold large volumes of oxygen or carbon dioxide, more so than blood, and have attracted attention for their possible uses in artificial blood and in liquid breathing.[241] Because fluorocarbons do not normally mix with water, they must be mixed into emulsions (small droplets of perfluorocarbon suspended in water) to be used as blood.[242][243] One such product, Oxycyte, has been through initial clinical trials.[244] These substances can aid endurance athletes and are banned from sports; one cyclist’s near death in 1998 prompted an investigation into their abuse.[245][246] Applications of pure perfluorocarbon liquid breathing (which uses pure perfluorocarbon liquid, not a water emulsion) include assisting burn victims and premature babies with deficient lungs. Partial and complete lung filling have been considered, though only the former has had any significant tests in humans.[247] An Alliance Pharmaceuticals effort reached clinical trials but was abandoned because the results were not better than normal therapies.[248]
Biological role[edit]
The gifblaar is one of the few organofluorine-synthesizing organisms
Fluorine is not essential for humans and other mammals, but small amounts are known to be beneficial for the strengthening of dental enamel (where the formation of fluorapatite makes the enamel more resistant to attack, from acids produced by bacterial fermentation of sugars). Small amounts of fluorine may be beneficial for bone strength, but the latter has not been definitively established.[249] Both the WHO and the Institute of Medicine of the US National Academies publish recommended daily allowance (RDA) and upper tolerated intake of fluorine, which varies with age and gender.[250][251]
Natural organofluorines have been found in microorganisms and plants[67] but not animals.[252] The most common is fluoroacetate, which is used as a defense against herbivores by at least 40 plants in Africa, Australia and Brazil.[213] Other examples include terminally fluorinated fatty acids, fluoroacetone, and 2-fluorocitrate.[252] An enzyme that binds fluorine to carbon – adenosyl-fluoride synthase – was discovered in bacteria in 2002.[253]
Toxicity[edit]
U.S. hazard signs for commercially transported fluorine[254]
Elemental fluorine is highly toxic to living organisms. Its effects in humans start at concentrations lower than hydrogen cyanide’s 50 ppm[255] and are similar to those of chlorine:[256] significant irritation of the eyes and respiratory system as well as liver and kidney damage occur above 25 ppm, which is the immediately dangerous to life and health value for fluorine.[257] The eyes and nose are seriously damaged at 100 ppm,[257] and inhalation of 1,000 ppm fluorine will cause death in minutes,[258] compared to 270 ppm for hydrogen cyanide.[259]
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
   
|
|
Signal word |
Danger |
|
Hazard statements |
H270, H314, H330[260] |
| NFPA 704 (fire diamond) |
4 0 3
|
Hydrofluoric acid[edit]
Hydrofluoric acid burns may not be evident for a day, after which calcium treatments are less effective.[261]
Hydrofluoric acid is the weakest of the hydrohalic acids, having a pKa of 3.2 at 25 °C.[262] It is a volatile liquid due to the presence of hydrogen bonding (while the other hydrohalic acids are gases). It is able to attack glass, concrete, metals, and organic matter.[263]
Hydrofluoric acid is a contact poison with greater hazards than many strong acids like sulfuric acid even though it is weak: it remains neutral in aqueous solution and thus penetrates tissue faster, whether through inhalation, ingestion or the skin, and at least nine U.S. workers died in such accidents from 1984 to 1994. It reacts with calcium and magnesium in the blood leading to hypocalcemia and possible death through cardiac arrhythmia.[264] Insoluble calcium fluoride formation triggers strong pain[265] and burns larger than 160 cm2 (25 in2) can cause serious systemic toxicity.[266]
Exposure may not be evident for eight hours for 50% HF, rising to 24 hours for lower concentrations, and a burn may initially be painless as hydrogen fluoride affects nerve function. If skin has been exposed to HF, damage can be reduced by rinsing it under a jet of water for 10–15 minutes and removing contaminated clothing.[267] Calcium gluconate is often applied next, providing calcium ions to bind with fluoride; skin burns can be treated with 2.5% calcium gluconate gel or special rinsing solutions.[268][269][270] Hydrofluoric acid absorption requires further medical treatment; calcium gluconate may be injected or administered intravenously. Using calcium chloride – a common laboratory reagent – in lieu of calcium gluconate is contraindicated, and may lead to severe complications. Excision or amputation of affected parts may be required.[266][271]
Fluoride ion[edit]
Soluble fluorides are moderately toxic: 5–10 g sodium fluoride, or 32–64 mg fluoride ions per kilogram of body mass, represents a lethal dose for adults.[272] One-fifth of the lethal dose can cause adverse health effects,[273] and chronic excess consumption may lead to skeletal fluorosis, which affects millions in Asia and Africa.[273][274] Ingested fluoride forms hydrofluoric acid in the stomach which is easily absorbed by the intestines, where it crosses cell membranes, binds with calcium and interferes with various enzymes, before urinary excretion. Exposure limits are determined by urine testing of the body’s ability to clear fluoride ions.[273][275]
Historically, most cases of fluoride poisoning have been caused by accidental ingestion of insecticides containing inorganic fluorides.[276] Most current calls to poison control centers for possible fluoride poisoning come from the ingestion of fluoride-containing toothpaste.[273] Malfunctioning water fluoridation equipment is another cause: one incident in Alaska affected almost 300 people and killed one person.[277] Dangers from toothpaste are aggravated for small children, and the Centers for Disease Control and Prevention recommends supervising children below six brushing their teeth so that they do not swallow toothpaste.[278] One regional study examined a year of pre-teen fluoride poisoning reports totaling 87 cases, including one death from ingesting insecticide. Most had no symptoms, but about 30% had stomach pains.[276] A larger study across the U.S. had similar findings: 80% of cases involved children under six, and there were few serious cases.[279]
Environmental concerns[edit]
Atmosphere[edit]
NASA projection of stratospheric ozone over North America without the Montreal Protocol[280]
The Montreal Protocol, signed in 1987, set strict regulations on chlorofluorocarbons (CFCs) and bromofluorocarbons due to their ozone damaging potential (ODP). The high stability which suited them to their original applications also meant that they were not decomposing until they reached higher altitudes, where liberated chlorine and bromine atoms attacked ozone molecules.[281] Even with the ban, and early indications of its efficacy, predictions warned that several generations would pass before full recovery.[282][283] With one-tenth the ODP of CFCs, hydrochlorofluorocarbons (HCFCs) are the current replacements,[284] and are themselves scheduled for substitution by 2030–2040 by hydrofluorocarbons (HFCs) with no chlorine and zero ODP.[285] In 2007 this date was brought forward to 2020 for developed countries;[286] the Environmental Protection Agency had already prohibited one HCFC’s production and capped those of two others in 2003.[285] Fluorocarbon gases are generally greenhouse gases with global-warming potentials (GWPs) of about 100 to 10,000; sulfur hexafluoride has a value of around 20,000.[287] An outlier is HFO-1234yf which is a new type of refrigerant called a Hydrofluoroolefin (HFO) and has attracted global demand due to its GWP of less than 1 compared to 1,430 for the current refrigerant standard HFC-134a.[197]
Biopersistence[edit]
Organofluorines exhibit biopersistence due to the strength of the carbon–fluorine bond. Perfluoroalkyl acids (PFAAs), which are sparingly water-soluble owing to their acidic functional groups, are noted persistent organic pollutants;[289] perfluorooctanesulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) are most often researched.[290][291][292] PFAAs have been found in trace quantities worldwide from polar bears to humans, with PFOS and PFOA known to reside in breast milk and the blood of newborn babies. A 2013 review showed a slight correlation between groundwater and soil PFAA levels and human activity; there was no clear pattern of one chemical dominating, and higher amounts of PFOS were correlated to higher amounts of PFOA.[290][291][293] In the body, PFAAs bind to proteins such as serum albumin; they tend to concentrate within humans in the liver and blood before excretion through the kidneys. Dwell time in the body varies greatly by species, with half-lives of days in rodents, and years in humans.[290][291][294] High doses of PFOS and PFOA cause cancer and death in newborn rodents but human studies have not established an effect at current exposure levels.[290][291][294]
See also[edit]
- Argon fluoride laser
- Electrophilic fluorination
- Fluoride selective electrode, which measures fluoride concentration
- Fluorine absorption dating
- Fluorous chemistry, a process used to separate reagents from organic solvents
- Krypton fluoride laser
- Radical fluorination
Notes[edit]
- ^ Sources disagree on the radii of oxygen, fluorine, and neon atoms. Precise comparison is thus impossible.
- ^ α-Fluorine has a regular pattern of molecules and is a crystalline solid, but its molecules do not have a specific orientation. β-Fluorine’s molecules have fixed locations and minimal rotational uncertainty. For further detail on α-fluorine, see the 1970 structure by Pauling.[44] For further detail on the concept of disorder in crystals, see the referenced general reviews.[45][46]
- ^ A loud click is heard. Samples may shatter and sample windows blow out.
- ^ The ratio of the angular momentum to magnetic moment is called the gyromagnetic ratio. «Certain nuclei can for many purposes be thought of as spinning round an axis like the Earth or like a top. In general the spin endows them with angular momentum and with a magnetic moment; the first because of their mass, the second because all or part of their electric charge may be rotating with the mass.»[50]
- ^ Basilius Valentinus supposedly described fluorite in the late 15th century, but because his writings were uncovered 200 years later, this work’s veracity is doubtful.[71][72][73]
- ^ Or perhaps from as early as 1670 onwards; Partington[77] and Weeks[76] give differing accounts.
- ^ Fl, since 2012, is used for flerovium.
- ^ Davy, Gay-Lussac, Thénard, and the Irish chemists Thomas and George Knox were injured. Belgian chemist Paulin Louyet and French chemist Jérôme Nicklès died. Moissan also experienced serious hydrogen fluoride poisoning.[76][86]
- ^ Also honored was his invention of the electric arc furnace.
- ^ Fluorine in F
2 is defined to have oxidation state 0. The unstable species F−
2 and F−
3, which decompose at around 40 K, have intermediate oxidation states;[97] F+
4 and a few related species are predicted to be stable.[98] - ^ The metastable boron and nitrogen monofluoride have higher-order fluorine bonds, and some metal complexes use it as a bridging ligand. Hydrogen bonding is another possibility.
- ^ ZrF
4 melts at 932 °C (1710 °F),[111] HfF
4 sublimes at 968 °C (1774 °F),[108] and UF
4 melts at 1036 °C (1897 °F).[112] - ^ These thirteen are those of molybdenum, technetium, ruthenium, rhodium, tungsten, rhenium, osmium, iridium, platinum, polonium, uranium, neptunium, and plutonium.
- ^ See also the explanation by Clark.[130]
- ^ Carbon tetrafluoride is formally organic, but is included here rather than in the organofluorine chemistry section – where more complex carbon-fluorine compounds are discussed – for comparison with SiF
4 and GeF
4. - ^ Perfluorocarbon and fluorocarbon are IUPAC synonyms for molecules containing carbon and fluorine only, but in colloquial and commercial contexts the latter term may refer to any carbon- and fluorine-containing molecule, possibly with other elements.
- ^ This terminology is imprecise, and perfluorinated substance is also used.[160]
- ^ This DuPont trademark is sometimes further misused for CFCs, HFCs, or HCFCs.
- ^ American sheep and cattle collars may use 1080 against predators like coyotes.
Sources[edit]
Citations[edit]
- ^ «Standard Atomic Weights: Fluorine». CIAAW. 2021.
- ^ a b c d e f Jaccaud et al. 2000, p. 381.
- ^ a b c d Haynes 2011, p. 4.121.
- ^ a b c d e Jaccaud et al. 2000, p. 382.
- ^ a b c Compressed Gas Association 1999, p. 365.
- ^ Himmel, D.; Riedel, S. (2007). «After 20 Years, Theoretical Evidence That ‘AuF7‘ Is Actually AuF5·F2«. Inorganic Chemistry. 46 (13). 5338–5342. doi:10.1021/ic700431s.
- ^ Dean 1999, p. 4.6.
- ^ Dean 1999, p. 4.35.
- ^ Matsui 2006, p. 257.
- ^ Yaws & Braker 2001, p. 385.
- ^ Mackay, Mackay & Henderson 2002, p. 72.
- ^ Cheng et al. 1999.
- ^ Chisté & Bé 2011.
- ^ Lee et al. 2014.
- ^ Dean 1999, p. 564.
- ^ Lide 2004, pp. 10.137–10.138.
- ^ Moore, Stanitski & Just urs 2010, p. 156.
- ^ Cordero et al. 2008.
- ^ Pyykkö & Atsumi 2009.
- ^ a b Greenwood & Earnshaw 1998, p. 804.
- ^ Macomber 1996, p. 230
- ^ Nelson 1947.
- ^ Lidin, Molochko & Andreeva 2000, pp. 442–455.
- ^ a b Wiberg, Wiberg & Holleman 2001, p. 404.
- ^ Patnaik 2007, p. 472.
- ^ Aigueperse et al. 2000, p. 400.
- ^ Greenwood & Earnshaw 1998, pp. 76, 804.
- ^ Kuriakose & Margrave 1965.
- ^ Hasegawa et al. 2007.
- ^ Lagow 1970, pp. 64–78.
- ^ Navarrini et al. 2012.
- ^ Lidin, Molochko & Andreeva 2000, p. 252.
- ^ Tanner Industries 2011.
- ^ Morrow, Perry & Cohen 1959.
- ^ Emeléus & Sharpe 1974, p. 111.
- ^ Wiberg, Wiberg & Holleman 2001, p. 457.
- ^ Brantley 1949, p. 26.
- ^ Jaccaud et al. 2000, p. 383.
- ^ Pitzer 1975.
- ^ a b Khriachtchev et al. 2000.
- ^ Burdon, Emson & Edwards 1987.
- ^ Lide 2004, p. 4.12.
- ^ a b Dean 1999, p. 523.
- ^ Pauling, Keaveny & Robinson 1970.
- ^ Bürgi 2000.
- ^ Müller 2009.
- ^ a b Young 1975, p. 10.
- ^ a b Barrett, Meyer & Wasserman 1967.
- ^ National Nuclear Data Center & NuDat 2.1, Fluorine-19.
- ^ Vigoureux 1961.
- ^ Meusinger, Chippendale & Fairhurst 2012, pp. 752, 754.
- ^
SCOPE 50 — Radioecology after Chernobyl Archived 2014-05-13 at the Wayback Machine, the Scientific Committee on Problems of the Environment (SCOPE), 1993. See table 1.9 in Section 1.4.5.2. - ^ a b National Nuclear Data Center & NuDat 2.1.
- ^ NUBASE 2016, pp. 030001-23–030001-27.
- ^ NUBASE 2016, pp. 030001–24.
- ^ Cameron 1973.
- ^ a b c Croswell 2003.
- ^ Clayton 2003, pp. 101–104.
- ^ Renda et al. 2004.
- ^ a b Jaccaud et al. 2000, p. 384.
- ^ a b c Schmedt, Mangstl & Kraus 2012.
- ^ a b c d e Greenwood & Earnshaw 1998, p. 795.
- ^ a b Norwood & Fohs 1907, p. 52.
- ^ a b c d e f g h i j k l m n Villalba, Ayres & Schroder 2008.
- ^ Kelly & Miller 2005.
- ^ Lusty et al. 2008.
- ^ a b Gribble 2002.
- ^ Richter, Hahn & Fuchs 2001, p. 3.
- ^ Greenwood & Earnshaw 1998, p. 790.
- ^ Senning 2007, p. 149.
- ^ Stillman 1912.
- ^ Principe 2012, pp. 140, 145.
- ^ Agricola, Hoover & Hoover 1912, footnotes and commentary, pp. xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Earnshaw 1998, p. 109.
- ^ Agricola, Hoover & Hoover 1912, preface, pp. 380–381.
- ^ a b c d e Weeks 1932.
- ^ Partington 1923.
- ^ Marggraf 1770.
- ^ a b c d e f g h Kirsch 2004, pp. 3–10.
- ^ Scheele 1771.
- ^ Ampère 1816.
- ^ Tressaud, Alain (6 October 2018). Fluorine: A Paradoxical Element. ISBN 9780128129913.
- ^ Davy 1813, p. 278.
- ^ Banks 1986, p. 11.
- ^ a b Storer 1864, pp. 278–280.
- ^ a b c d e Toon 2011.
- ^ a b Asimov 1966, p. 162.
- ^ Greenwood & Earnshaw 1998, pp. 789–791.
- ^ Moissan 1886.
- ^ Viel & Goldwhite 1993, p. 35.
- ^ a b c d Okazoe 2009.
- ^ a b Hounshell & Smith 1988, pp. 156–157.
- ^ DuPont 2013a.
- ^ Meyer 1977, p. 111.
- ^ Kirsch 2004, pp. 60–66.
- ^ Riedel & Kaupp 2009.
- ^ Wiberg, Wiberg & Holleman 2001, p. 422.
- ^ Schlöder & Riedel 2012.
- ^ Harbison 2002.
- ^ Edwards 1994, p. 515.
- ^ Katakuse et al. 1999, p. 267.
- ^ a b Aigueperse et al. 2000, pp. 420–422.
- ^ Walsh 2009, pp. 99–102, 118–119.
- ^ Emeléus & Sharpe 1983, pp. 89–97.
- ^ Babel & Tressaud 1985, pp. 91–96.
- ^ Einstein et al. 1967.
- ^ Brown et al. 2005, p. 144.
- ^ a b Perry 2011, p. 193.
- ^ Kern et al. 1994.
- ^ Lide 2004, pp. 4.60, 4.76, 4.92, 4.96.
- ^ Lide 2004, p. 4.96.
- ^ Lide 2004, p. 4.92.
- ^ Greenwood & Earnshaw 1998, p. 964.
- ^ Becker & Müller 1990.
- ^ Greenwood & Earnshaw 1998, p. 990.
- ^ Lide 2004, pp. 4.72, 4.91, 4.93.
- ^ a b Greenwood & Earnshaw 1998, pp. 561–563.
- ^ Emeléus & Sharpe 1983, pp. 256–277.
- ^ Mackay, Mackay & Henderson 2002, pp. 355–356.
- ^ Greenwood & Earnshaw 1998, (various pages, by metal in respective chapters).
- ^ Lide 2004, pp. 4.71, 4.78, 4.92.
- ^ Drews et al. 2006.
- ^ Greenwood & Earnshaw 1998, p. 819.
- ^ Bartlett 1962.
- ^ Pauling 1960, pp. 454–464.
- ^ Atkins & Jones 2007, pp. 184–185.
- ^ Emsley 1981.
- ^ Greenwood & Earnshaw 1998, pp. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, p. 425.
- ^ Clark 2002.
- ^ Chambers & Holliday 1975, pp. 328–329.
- ^ Air Products and Chemicals 2004, p. 1.
- ^ Noury, Silvi & Gillespie 2002.
- ^ Chang & Goldsby 2013, p. 706.
- ^ Ellis 2001, p. 69.
- ^ Aigueperse et al. 2000, p. 423.
- ^ Wiberg, Wiberg & Holleman 2001, p. 897.
- ^ Raghavan 1998, pp. 164–165.
- ^ Godfrey et al. 1998, p. 98.
- ^ Aigueperse et al. 2000, p. 432.
- ^ Murthy, Mehdi Ali & Ashok 1995, pp. 180–182, 206–208.
- ^ Greenwood & Earnshaw 1998, pp. 638–640, 683–689, 767–778.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 435–436.
- ^ Greenwood & Earnshaw 1998, pp. 828–830.
- ^ Patnaik 2007, pp. 478–479.
- ^ Moeller, Bailar & Kleinberg 1980, p. 236.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 392–393.
- ^ Wiberg, Wiberg & Holleman 2001, p. 395–397, 400.
- ^ Lewars 2008, p. 68.
- ^ Pitzer 1993, p. 111.
- ^ Lewars 2008, p. 67.
- ^ a b Bihary, Chaban & Gerber 2002.
- ^ Lewars 2008, p. 71.
- ^ Hoogers 2002, pp. 4–12.
- ^ O’Hagan 2008.
- ^ Siegemund et al. 2005, p. 444.
- ^ Sandford 2000, p. 455.
- ^ Siegemund et al. 2005, pp. 451–452.
- ^ Barbee, McCormack & Vartanian 2000, p. 116.
- ^ Posner et al. 2013, pp. +hydrocarbons+that+are+fully+fluorinated+except+for+one+functional+group%22 187–190.
- ^ a b Posner 2011, p. 27.
- ^ Salager 2002, p. 45.
- ^ a b Carlson & Schmiegel 2000, p. 3.
- ^ a b Carlson & Schmiegel 2000, pp. 3–4.
- ^ Rhoades 2008, p. 2.
- ^ Okada et al. 1998.
- ^ Carlson & Schmiegel 2000, p. 4.
- ^ Aigueperse et al. 2000.
- ^ Norris Shreve; Joseph Brink, Jr. (1977). Chemical Process Industries (4 ed.). p. 321. ISBN 0070571457.
- ^ Jaccaud et al. 2000, p. 386.
- ^ Jaccaud et al. 2000, pp. 384–285.
- ^ Greenwood & Earnshaw 1998, pp. 796–797.
- ^ Jaccaud et al. 2000, pp. 384–385.
- ^ a b Jaccaud et al. 2000, pp. 390–391.
- ^ Shriver & Atkins 2010, p. 427.
- ^ Christe 1986.
- ^ Christe Research Group n.d.
- ^ Carey 2008, p. 173.
- ^ Miller 2003b.
- ^ PRWeb 2012.
- ^ Bombourg 2012.
- ^ TMR 2013.
- ^ Fulton & Miller 2006, p. 471.
- ^ a b Jaccaud et al. 2000, p. 392.
- ^ Aigueperse et al. 2000, p. 430.
- ^ Jaccaud et al. 2000, pp. 391–392.
- ^ El-Kareh 1994, p. 317.
- ^ Arana et al. 2007.
- ^ Miller 2003a.
- ^ Energetics, Inc. 1997, pp. 41, 50.
- ^ Aigueperse et al. 2000, p. 428.
- ^ Willey 2007, p. 113.
- ^ PRWeb 2010.
- ^ a b c Renner 2006.
- ^ Green et al. 1994, pp. 91–93.
- ^ DuPont 2013b.
- ^ a b Walter 2013.
- ^ a b Buznik 2009.
- ^ PRWeb 2013.
- ^ a b c d e Martin 2007, pp. 187–194.
- ^ DeBergalis 2004.
- ^ Grot 2011, pp. 1–10.
- ^ Ramkumar 2012, p. 567.
- ^ Burney 1999, p. 111.
- ^ Slye 2012, p. 10.
- ^ Kissa 2001, pp. 516–551.
- ^ Ullmann 2008, pp. 538, 543–547.
- ^ ICIS 2006.
- ^ a b Theodoridis 2006.
- ^ EPA 1996.
- ^ DG Environment 2007.
- ^ Beasley 2002.
- ^ a b Proudfoot, Bradberry & Vale 2006.
- ^ Eisler 1995.
- ^ Pizzo et al. 2007.
- ^ CDC 2001.
- ^ Ripa 1993.
- ^ a b Cheng, Chalmers & Sheldon 2007.
- ^ NHMRC 2007; see Yeung 2008 for a summary.
- ^ Marya 2011, p. 343.
- ^ Armfield 2007.
- ^ a b Baelum, Sheiham & Burt 2008, p. 518.
- ^ Cracher 2012, p. 12.
- ^ Emsley 2011, p. 178.
- ^ Johnson 2011.
- ^ a b Swinson 2005.
- ^ Hagmann 2008.
- ^ Mitchell 2004, pp. 37–39.
- ^ Preskorn 1996, chap. 2.
- ^ Werner et al. 2011.
- ^ Brody 2012.
- ^ Nelson et al. 2007.
- ^ King, Malone & Lilley 2000.
- ^ Parente 2001, p. 40.
- ^ Raj & Erdine 2012, p. 58.
- ^ Filler & Saha 2009.
- ^ Bégué & Bonnet-Delpon 2008, pp. 335–336.
- ^ a b Schmitz et al. 2000.
- ^ Bustamante & Pedersen 1977.
- ^ Alavi & Huang 2007, p. 41.
- ^ Gabriel et al. 1996.
- ^ Sarkar 2008.
- ^ Schimmeyer 2002.
- ^ Davis 2006.
- ^ Gains 1998.
- ^ Taber 1999.
- ^ Shaffer, Wolfson & Clark 1992, p. 102.
- ^ Kacmarek et al. 2006.
- ^ Nielsen 2009.
- ^ Olivares & Uauy 2004.
- ^ Food and Nutrition Board.
- ^ a b Murphy, Schaffrath & O’Hagan 2003
- ^ O’Hagan et al. 2002.
- ^ National Oceanic and Atmospheric Administration.
- ^ The National Institute for Occupational Safety and Health 1994a.
- ^ The National Institute for Occupational Safety and Health 1994b.
- ^ a b Keplinger & Suissa 1968.
- ^ Emsley 2011, p. 179.
- ^ Biller 2007, p. 939.
- ^ «Fluorine. Safety data sheet» (PDF). Airgas. Archived from the original (PDF) on 19 April 2015.
- ^ Eaton 1997.
- ^ «Inorganic Chemistry» by Gary L. Miessler and Donald A. Tarr, 4th edition, Pearson
- ^ «Inorganic Chemistry» by Shriver, Weller, Overton, Rourke and Armstrong, 6th edition, Freeman
- ^ Blodgett, Suruda & Crouch 2001.
- ^ Hoffman et al. 2007, p. 1333.
- ^ a b HSM 2006.
- ^ Fischman 2001, pp. 458–459.
- ^ El Saadi et al. 1989.
- ^ Roblin et al. 2006.
- ^ Hultén et al. 2004.
- ^ Zorich 1991, pp. 182–183.
- ^ Liteplo et al. 2002, p. 100.
- ^ a b c d Shin & Silverberg 2013.
- ^ Reddy 2009.
- ^ Baez, Baez & Marthaler 2000.
- ^ a b Augenstein et al. 1991.
- ^ Gessner et al. 1994.
- ^ CDC 2013.
- ^ Shulman & Wells 1997.
- ^ Beck et al. 2011.
- ^ Aucamp & Björn 2010, pp. 4–6, 41, 46–47.
- ^ Mitchell Crow 2011.
- ^ Barry & Phillips 2006.
- ^ EPA 2013a.
- ^ a b EPA 2013b.
- ^ McCoy 2007.
- ^ Forster et al. 2007, pp. 212–213.
- ^ Schwarcz 2004, p. 37.
- ^ Giesy & Kannan 2002.
- ^ a b c d Steenland, Fletcher & Savitz 2010.
- ^ a b c d Betts 2007.
- ^ EPA 2012.
- ^ Zareitalabad et al. 2013.
- ^ a b Lau et al. 2007.
Indexed references[edit]
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry (1912). De Re Metallica. London: The Mining Magazine.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. (2000). «Fluorine Compounds, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 397–441. doi:10.1002/14356007.
- Air Products and Chemicals (2004). «Safetygram #39 Chlorine Trifluoride» (PDF). Air Products and Chemicals. Archived from the original (PDF) on 18 March 2006. Retrieved 16 February 2014.
- Alavi, Abbas; Huang, Steve S. (2007). «Positron Emission Tomography in Medicine: An Overview». In Hayat, M. A. (ed.). Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. pp. 39–44. ISBN 978-0-12-370468-9.
- Ampère, André-Marie (1816). «Suite d’une classification naturelle pour les corps simples». Annales de chimie et de physique (in French). 2: 1–5.
- Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. (2007). «Isotropic Etching of Silicon in Fluorine Gas for MEMS Micromachining». Journal of Micromechanics and Microengineering. 17 (2): 384–392. Bibcode:2007JMiMi..17..384A. doi:10.1088/0960-1317/17/2/026. S2CID 135708022.
- Armfield, J. M. (2007). «When Public Action Undermines Public Health: A Critical Examination of Antifluoridationist Literature». Australia and New Zealand Health Policy. 4: 25. doi:10.1186/1743-8462-4-25. PMC 2222595. PMID 18067684.
- Asimov, Isaac (1966). The Noble Gases. New York: Basic Books. ISBN 978-0-465-05129-8.
- Atkins, Peter; Jones, Loretta (2007). Chemical Principles: The Quest for Insight (4th ed.). New York: W. H. Freeman. ISBN 978-1-4292-0965-6.
- Aucamp, Pieter J.; Björn, Lars Olof (2010). «Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update» (PDF). United Nations Environmental Programme. Archived from the original (PDF) on 3 September 2013. Retrieved 14 October 2013.
- Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001..
- Augenstein, W. L.; et al. (1991). «Fluoride Ingestion in Children: A Review of 87 cases». Pediatrics. 88 (5): 907–912. doi:10.1542/peds.88.5.907. PMID 1945630. S2CID 22106466.
- Babel, Dietrich; Tressaud, Alain (1985). «Crystal Chemistry of Fluorides». In Hagenmuller, Paul (ed.). Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. pp. 78–203. ISBN 978-0-12-412490-5.
- Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian (2008). «Caries Control for Populations». In Fejerskov, Ole; Kidd, Edwina (eds.). Dental Caries: The Disease and Its Clinical Management (2nd ed.). Oxford: Blackwell Munksgaard. pp. 505–526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. (2000). «Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community». Revista Panamericana de Salud Pública. 7 (4): 242–248. doi:10.1590/S1020-49892000000400005. PMID 10846927.
- Banks, R. E. (1986). «Isolation of fluorine by Moissan: Setting the scene». Journal of Fluorine Chemistry. 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- Barbee, K.; McCormack, K.; Vartanian, V. (2000). «EHS Concerns with Ozonated Water Spray Processing». In Mendicino, L. (ed.). Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. pp. 108–121. ISBN 978-1-56677-230-3.
- Barrett, C. S.; Meyer, L.; Wasserman, J. (1967). «Argon—Fluorine Phase Diagram». The Journal of Chemical Physics. 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- Barry, Patrick L.; Phillips, Tony (26 May 2006). «Good News and a Puzzle». National Aeronautics and Space Administration. Retrieved 6 January 2012.
- Bartlett, N. (1962). «Xenon Hexafluoroplatinate (V) Xe+[PtF6]−«. Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- Beasley, Michael (August 2002). Guidelines for the safe use of sodium fluoroacetate (1080) (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). ISBN 0-477-03664-3. Archived from the original (PDF) on 11 November 2013. Retrieved 11 November 2013.
- Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori (2011). «What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?». National Aeronautics and Space Administration. Retrieved 15 October 2013.
- Becker, S.; Müller, B. G. (1990). «Vanadium Tetrafluoride». Angewandte Chemie International Edition in English. 29 (4): 406–407. doi:10.1002/anie.199004061.
- Bégué, Jean-Pierre; Bonnet-Delpon, Danièle (2008). Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. ISBN 978-0-470-27830-7.
- Betts, K. S. (2007). «Perfluoroalkyl Acids: What is the Evidence Telling Us?». Environmental Health Perspectives. 115 (5): A250–A256. doi:10.1289/ehp.115-a250. PMC 1867999. PMID 17520044.
- Bihary, Z.; Chaban, G. M.; Gerber, R. B. (2002). «Stability of a Chemically Bound Helium Compound in High-pressure Solid Helium». The Journal of Chemical Physics. 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- Biller, José (2007). Interface of Neurology and Internal Medicine (illustrated ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-7906-7.
- Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. (2001). «Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S» (PDF). American Journal of Industrial Medicine. 40 (2): 215–220. doi:10.1002/ajim.1090. PMID 11494350. Archived from the original (PDF) on 17 July 2012.
- Bombourg, Nicolas (4 July 2012). «World Fluorochemicals Market, Freedonia». Reporterlinker. Retrieved 20 October 2013.
- Brantley, L. R. (1949). Squires, Roy; Clarke, Arthur C. (eds.). «Fluorine». Pacific Rockets: Journal of the Pacific Rocket Society. South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Brody, Jane E. (10 September 2012). «Popular Antibiotics May Carry Serious Side Effects». The New York Times Well Blog. Retrieved 18 October 2013.
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. ISBN 978-0-444-51803-3.
- Burdon, J.; Emson, B.; Edwards, A. J. (1987). «Is Fluorine Gas Really Yellow?». Journal of Fluorine Chemistry. 34 (3–4): 471–474. doi:10.1016/S0022-1139(00)85188-X.
- Bürgi, H. B. (2000). «Motion and Disorder in Crystal Structure Analysis: Measuring and Distinguishing them». Annual Review of Physical Chemistry. 51: 275–296. Bibcode:2000ARPC…51..275B. doi:10.1146/annurev.physchem.51.1.275. PMID 11031283.
- Burney, H. (1999). «Past, Present and Future of the Chlor-Alkali Industry». In Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. (eds.). Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. pp. 105–126. ISBN 1-56677-244-3.
- Bustamante, E.; Pedersen, P. L. (1977). «High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase». Proceedings of the National Academy of Sciences. 74 (9): 3735–3739. Bibcode:1977PNAS…74.3735B. doi:10.1073/pnas.74.9.3735. PMC 431708. PMID 198801.
- Buznik, V. M. (2009). «Fluoropolymer Chemistry in Russia: Current Situation and Prospects». Russian Journal of General Chemistry. 79 (3): 520–526. doi:10.1134/S1070363209030335. S2CID 97518401.
- Cameron, A. G. W. (1973). «Abundance of the Elements in the Solar System» (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv…15..121C. doi:10.1007/BF00172440. S2CID 120201972. Archived from the original (PDF) on 21 October 2011.
- Carey, Charles W. (2008). African Americans in Science. Santa Barbara: ABC-CLIO. ISBN 978-1-85109-998-6.
- Carlson, D. P.; Schmiegel, W. (2000). «Fluoropolymers, Organic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 495–533. doi:10.1002/14356007.a11_393.
- Centers for Disease Control and Prevention (2001). «Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States». MMWR Recommendations and Reports. 50 (RR–14): 1–42. PMID 11521913. Retrieved 14 October 2013.
- Centers for Disease for Control and Prevention (10 July 2013). «Community Water Fluoridation». Retrieved 25 October 2013.
- Chambers, C.; Holliday, A. K. (1975). Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. ISBN 978-0-408-70663-6. Archived from the original (PDF) on 23 March 2013.
- Chang, Raymond; Goldsby, Kenneth A. (2013). Chemistry (11th ed.). New York: McGraw-Hill. ISBN 978-0-07-131787-0.
- Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascolini, M. R. (1999). «On the Magnetic Susceptibility of Fluorine». The Journal of Physical Chemistry A. 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C. doi:10.1021/jp9844720.
- Chisté, V.; Bé, M. M. (2011). «F-18» (PDF). In Bé, M. M.; Coursol, N.; Duchemin, B.; Lagoutine, F.; et al. (eds.). Table de radionucléides (Report). CEA (Commissariat à l’énergie atomique et aux énergies alternatives), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l’Energie Atomique). Retrieved 15 June 2011.
- Christe, Karl O. (1986). «Chemical Synthesis of Elemental Fluorine». Inorganic Chemistry. 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- Christe Research Group (n.d.). «Chemical Synthesis of Elemental Fluorine». Archived from the original on 4 March 2016. Retrieved 12 January 2013.
- Clark, Jim (2002). «The Acidity of the Hydrogen Halides». chemguide.co.uk. Retrieved 15 October 2013.
- Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. ISBN 978-0-521-82381-4.
- Compressed Gas Association (1999). Handbook of Compressed Gases (4th ed.). Boston: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. (2008). «Covalent Radii Revisited». Dalton Transactions (21): 2832–2838. doi:10.1039/b801115j. PMID 18478144.
- Cracher, Connie M. (2012). «Current Concepts in Preventive Dentistry» (PDF). dentalcare.com. Archived from the original (PDF) on 14 October 2013. Retrieved 14 October 2013.
- Croswell, Ken (September 2003). «Fluorine: An element–ary Mystery». Sky and Telescope. Retrieved 17 October 2013.
- Mitchell Crow, James (2011). «First signs of ozone-hole recovery spotted». Nature. doi:10.1038/news.2011.293.
- Davis, Nicole (November 2006). «Better than blood». Popular Science. Archived from the original on 4 June 2011. Retrieved 20 October 2013.
- Davy, Humphry (1813). «Some experiments and observations on the substances produced in different chemical processes on fluor spar». Philosophical Transactions of the Royal Society. 103: 263–279. doi:10.1098/rstl.1813.0034.
- Dean, John A. (1999). Lange’s Handbook of Chemistry (15th ed.). New York: McGraw-Hill. ISBN 0-07-016190-9.
- DeBergalis, Michael (2004). «Fluoropolymer films in the photovoltaic industry». Journal of Fluorine Chemistry. 125 (8): 1255–1257. doi:10.1016/j.jfluchem.2004.05.013.
- Directorate-General for the Environment (European Commission) (2007). Trifluralin (PDF) (Report). European Commission. Retrieved 14 October 2013.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). «Solid State Molecular Structures of Transition Metal Hexafluorides». Inorganic Chemistry. 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- DuPont (2013a). «Freon». Retrieved 17 October 2013.
- DuPont (2013b). «Understanding the Refrigerant ‘R’ Nomenclature». Retrieved 17 October 2013.
- Eaton, Charles (1997). «Figure hfl». E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). Retrieved 28 September 2013.
- Edwards, Philip Neil (1994). «Use of Fluorine in Chemotherapy». In Banks, R. E.; Smart, B. E.; Tatlow, J. C. (eds.). Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. pp. 501–542. ISBN 978-0-306-44610-8.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. (1967). «The Crystal Structure of Gold Trifluoride». Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 4: 478–482. doi:10.1039/J19670000478.
- Eisler, Ronald (1995). Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (Report). Patuxent Environmental Science Center (U.S. National Biological Service). Retrieved 5 June 2011.
- Ellis, Brian (2001). Scientific Essentialism. Cambridge: Cambridge University Press. ISBN 978-0-521-80094-5.
- El-Kareh, Badih (1994). Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. (1989). «Hydrofluoric Acid Dermal Exposure». Veterinary and Human Toxicology. 31 (3): 243–247. PMID 2741315.
- Emeléus, H. J.; Sharpe, A. G. (1974). Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. New York: Academic Press. ISBN 978-0-08-057865-1.
- Emeléus, H. J.; Sharpe, A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. Vol. 27. Academic Press. ISBN 0-12-023627-3.
- Emsley, John (1981). «The Hidden Strength of Hydrogen». New Scientist. 91 (1264): 291–292.
- Emsley, John (2011). Nature’s Building Blocks: An A–Z Guide to the Elements (2nd ed.). Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Energetics, Inc. (1997). Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (Report). Retrieved 15 October 2013.
- Filler, R.; Saha, R. (2009). «Fluorine in Medicinal Chemistry: A Century of Progress and a 60-year Retrospective of Selected Highlights» (PDF). Future Medicinal Chemistry. 1 (5): 777–791. doi:10.4155/fmc.09.65. PMID 21426080. Archived from the original (PDF) on 22 October 2013.
- Fischman, Michael L. (2001). «Semiconductor Manufacturing Hazards». In Sullivan, John B.; Krieger, Gary R. (eds.). Clinical Environmental Health and Toxic Exposures (2nd ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 431–465. ISBN 978-0-683-08027-8.
- Food and Nutrition Board. «Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes, Elements» (PDF). Institute of Medicine, National Academies. Archived from the original (PDF) on 13 November 2018. Retrieved 2 January 2019.
- Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhr e, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. (2007). «Changes in Atmospheric Constituents and in Radiative Forcing». In Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. (eds.). Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. pp. 129–234. ISBN 978-0-521-70596-7.
- Fulton, Robert B.; Miller, M. Michael (2006). «Fluorspar». In Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (eds.). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). pp. 461–473. ISBN 978-0-87335-233-8.
- Gabriel, J. L.; Miller, T. F. Jr.; Wolfson, M. R.; Shaffer, T. H. (1996). «Quantitative Structure-Activity Relationships of Perfluorinated Hetero-Hydrocarbons as Potential Respiratory Media». ASAIO Journal. 42 (6): 968–973. doi:10.1097/00002480-199642060-00009. PMID 8959271. S2CID 31161098.
- Gains, Paul (18 October 1998). «A New Threat in Blood Doping». The New York Times. Retrieved 18 October 2013.
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. (1994). «Acute Fluoride Poisoning from a Public Water System». New England Journal of Medicine. 330 (2): 95–99. doi:10.1056/NEJM199401133300203. PMID 8259189.
- Giesy, J. P.; Kannan, K. (2002). «Perfluorochemical Surfactants in the Environment». Environmental Science & Technology. 36 (7): 146A–152A. Bibcode:2002EnST…36..146G. doi:10.1021/es022253t. PMID 11999053.
- Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). «Inorganic Derivatives of the Elements». In Norman, Nicholas C. (ed.). Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. pp. 67–158. ISBN 978-0-7514-0389-3.
- Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. (1994). «Perfluorocarbon Fluids». In Banks, R. E.; Smart, B. E.; Tatlow, J. C. (eds.). Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. pp. 89–119. ISBN 978-0-306-44610-8.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Oxford: Butterworth Heinemann. ISBN 0-7506-3365-4.
- Gribble, G. W. (2002). «Naturally Occurring Organofluorines». In Neison, A. H. (ed.). Organofluorines. The Handbook of Environmental Chemistry. Vol. 3N. Berlin: Springer. pp. 121–136. doi:10.1007/10721878_5. ISBN 3-540-42064-9.
- Grot, Walter (2011). Fluorinated Ionomers (2nd ed.). Oxford and Waltham: Elsevier. ISBN 978-1-4377-4457-6.
- Hagmann, W. K. (2008). «The Many Roles for Fluorine in Medicinal Chemistry». Journal of Medicinal Chemistry. 51 (15): 4359–4369. doi:10.1021/jm800219f. PMID 18570365.
- Harbison, G. S. (2002). «The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF». Journal of the American Chemical Society. 124 (3): 366–367. doi:10.1021/ja0159261. PMID 11792193.
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. (2007). «Reaction Between Carbon Dioxide and Elementary Fluorine». Journal of Fluorine Chemistry. 128 (1): 17–28. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665. S2CID 95754841.
- Haxel, G. B.; Hedrick, J. B.; Orris, G. J. (2005). Stauffer, P. H.; Hendley II, J. W. (eds.). Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (Report). U.S. Geological Survey. Retrieved 31 January 2014.
- Haynes, William M., ed. (2011). Handbook of Chemistry and Physics (92nd ed.). Boca Raton: CRC Press. ISBN 978-1-4398-5511-9.
- Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis (2007). Goldfrank’s Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Honeywell (2006). Recommended medical treatment for hydrofluoric acid exposure (PDF). Morristown: Honeywell International. Archived from the original (PDF) on 8 October 2013. Retrieved 9 January 2014.
- Hoogers, G. (2002). «Fuel Cell Components and Their Impact on Performance». In Hoogers, G. (ed.). Fuel Cell Technology Handbook. Boca Raton: CRC Press. pp. 4-1–4-27. ISBN 0-8493-0877-1.
- Hounshell, David A.; Smith, John Kelly (1988). Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. ISBN 0-521-32767-9.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. (2004). «Hexafluorine vs. Standard Decontamination to Reduce Systemic Toxicity After Dermal Exposure to Hydrofluoric Acid». Clinical Toxicology. 42 (4): 355–361. doi:10.1081/CLT-120039541. PMID 15461243. S2CID 27090208.
- ICIS (2 October 2006). «Fluorine’s Treasure Trove». Reed Business Information. Retrieved 24 October 2013.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. (2000). «Fluorine». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 381–395. doi:10.1002/14356007.a11_293.
- Johnson, Linda A. (28 December 2011). «Against Odds, Lipitor Became World’s Top Seller». The Boston Globe. Retrieved 24 October 2013.
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. (2006). «Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome». American Journal of Respiratory and Critical Care Medicine. 173 (8): 882–9. doi:10.1164/rccm.200508-1196OC. PMID 16254269.
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo (1999). «SIMS Experiment». In Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (eds.). Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. pp. 259–273. ISBN 4-06-208635-2.
- Kelly, T. D.; Miller, M. M. (2005). «Historical Fluorspar Statistics». U.S. Geological Service. Retrieved 10 February 2014.
- Keplinger, M. L.; Suissa, L. W. (1968). «Toxicity of Fluorine Short-Term Inhalation». American Industrial Hygiene Association Journal. 29 (1): 10–18. doi:10.1080/00028896809342975. PMID 5667185.
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. (1994). «Temperature Variation of the Structural Parameters in Actinide Tetrafluorides». The Journal of Chemical Physics. 101 (11): 9333–9337. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963.<
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. (2000). «A Stable Argon Compound». Nature. 406 (6798): 874–876. Bibcode:2000Natur.406..874K. doi:10.1038/35022551. PMID 10972285. S2CID 4382128.
- King, D. E.; Malone, R.; Lilley, S. H. (2000). «New Classification and Update on the Quinolone Antibiotics». American Family Physician. 61 (9): 2741–2748. PMID 10821154. Retrieved 8 October 2013.
- Kirsch, Peer (2004). Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. ISBN 978-3-527-30691-6.
- Kissa, Erik (2001). Fluorinated Surfactants and Repellents (2nd ed.). New York: Marcel Dekker. ISBN 978-0-8247-0472-8.
- Kuriakose, A. K.; Margrave, J. L. (1965). «Kinetics of the Reactions of Elemental Fluorine. IV. Fluorination of Graphite». Journal of Physical Chemistry. 69 (8): 2772–2775. doi:10.1021/j100892a049.
- Lagow, R. J. (1970). The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (PDF) (PhD, Rice University, TX). Ann Arbor: UMI.
- Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. (2007). «Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings». Toxicological Sciences. 99 (2): 366–394. doi:10.1093/toxsci/kfm128. PMID 17519394.
- Lee, Stephen; et al. (2014). «Monofluoroacetate-Containing Plants That Are Potentially Toxic to Livestock». Journal of Agricultural and Food Chemistry. ACS Publications. 62 (30): 7345–7354. doi:10.1021/jf500563h. PMID 24724702.
- Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. ISBN 978-1-4020-6972-7.
- Lide, David R. (2004). Handbook of Chemistry and Physics (84th ed.). Boca Raton: CRC Press. ISBN 0-8493-0566-7.
- Lidin, R.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances] (in Russian). Moscow: Khimiya. ISBN 5-7245-1163-0.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. (2002). Environmental Health Criteria 227 (Fluoride). Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. ISBN 92-4-157227-2. Retrieved 14 October 2013.
- Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. (2008). «The Need for Indigenous Fluorspar Production in England». British Geological Survey. Retrieved 13 October 2013.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (6th ed.). Cheltenham: Nelson Thornes. ISBN 0-7487-6420-8.
- Macomber, Roger (1996). Organic chemistry. Vol. 1. Sausalito: University Science Books. ISBN 978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). «Observation concernant une volatilisation remarquable d’une partie de l’espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d’hesperos; laquelle volatilisation a été effectuée au moyen des acides» [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l’Académie royale des sciences et belles-lettres (in French). XXIV: 3–11.
- Martin, John W., ed. (2007). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. ISBN 978-0-08-045127-5.
- Marya, C. M. (2011). A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-216-1.
- Matsui, M. (2006). «Fluorine-containing Dyes». In Kim, Sung-Hoon (ed.). Functional dyes. Orlando: Academic Press. pp. 257–266. ISBN 978-0-12-412490-5.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. (2012). «Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 609–660. doi:10.1002/14356007.b05_471.
- Meyer, Eugene (1977). Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. ISBN 978-0-13-129239-0.
- Miller, M. Michael (2003a). «Fluorspar» (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. pp. 27.1–27.12.
- Miller, M. Michael (2003b). «Mineral Resource of the Month, Fluorspar» (PDF). U.S. Geological Survey. Retrieved 24 October 2013.
- Mitchell, E. Siobhan (2004). Antidepressants. New York: Chelsea House Publishers. ISBN 978-1-4381-0192-7.
- Moeller, T.; Bailar, J. C.; Kleinberg (1980). Chemistry, with Inorganic Qualitative Analysis (3rd ed.). New York: Academic Press. ISBN 0-12-503350-8.
- Moissan, Henri (1886). «Action d’un courant électrique sur l’acide fluorhydrique anhydre». Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French). 102: 1543–1544. Retrieved 9 October 2013.
- McCoy, M. (2007). «SURVEY Market Challenges Dim the Confidence of the World’s Chemical CEOs». Chemical & Engineering News. 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2010). Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. ISBN 978-0-495-39079-4.
- Morrow, S. I.; Perry, D. D.; Cohen, M. S. (1959). «The Formation of Dinitrogen Tetrafluoride in the Reaction of Fluorine and Ammonia». Journal of the American Chemical Society. 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- Müller, Peter (2009). «5.067 Crystal Structure Refinement» (PDF). Cambridge: MIT OpenCourseWare. Retrieved 13 October 2013.
- Murphy, C. D.; Schaffrath, C.; O’Hagan, D. (2003). «Fluorinated Natural Products: The Biosynthesis of Fluoroacetate and 4-Fluorothreonine in Streptomyces cattleya«. Chemosphere. 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. doi:10.1016/S0045-6535(03)00191-7. PMID 12738270.
- Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. (1995). University Chemistry. Vol. I. New Delhi: New Age International. ISBN 978-81-224-0742-6.
- National Health and Medical Research Council (2007). A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results (PDF). Canberra: Australian Government. ISBN 978-1-86496-421-9. Archived from the original (PDF) on 13 January 2012. Retrieved 8 October 2013.
- The National Institute for Occupational Safety and Health (1994). «Fluorine». Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 15 January 2014.
- The National Institute for Occupational Safety and Health (1994). «Chlorine». Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 13 July 2014.
- National Nuclear Data Center. «NuDat 2.1 Database». Brookhaven National Laboratory. Retrieved 25 October 2013.
- National Oceanic and Atmospheric Administration. «UN/NA 1045 (United Nations/North America Fluorine Data Sheet)». Retrieved 15 October 2013.
- Navarrini, Walter; Venturini, Francesco; Tortelli, Vito; Basak, Soubir; Pimparkar, Ketan P.; Adamo, Andrea; Jensen, Klavs F. (2012). «Direct fluorination of carbon monoxide in microreactors». Journal of Fluorine Chemistry. 142: 19–23. doi:10.1016/j.jfluchem.2012.06.006.
- Nelson, Eugene W. (1947). «‘Bad Man’ of The Elements». Popular Mechanics. 88 (2): 106–108, 260.
- Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (2007). «Food Safety: Fluoroquinolone‐ResistantCampylobacterSpecies and the Withdrawal of Fluoroquinolones from Use in Poultry: A Public Health Success Story» (PDF). Clinical Infectious Diseases. 44 (7): 977–980. doi:10.1086/512369. PMID 17342653.
- Nielsen, Forrest H. (2009). «Micronutrients in Parenteral Nutrition: Boron, Silicon, and Fluoride». Gastroenterology. 137 (5): S55–60. doi:10.1053/j.gastro.2009.07.072. PMID 19874950. Retrieved 29 April 2018.
- Norwood, Charles J.; Fohs, F. Julius (1907). Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey.
- Noury, S.; Silvi, B.; Gillespie, R. J. (2002). «Chemical Bonding in Hypervalent Molecules: Is the Octet Rule Relevant?» (PDF). Inorganic Chemistry. 41 (8): 2164–2172. doi:10.1021/ic011003v. PMID 11952370. Retrieved 23 May 2012.
- O’Hagan, D. (2008). «Understanding Organofluorine Chemistry. An Introduction to the C–F Bond». Chemical Society Reviews. 37 (2): 308–319. doi:10.1039/b711844a. PMID 18197347.
- O’Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. (2002). «Biochemistry: Biosynthesis of an Organofluorine Molecule». Nature. 416 (6878): 279. Bibcode:2002Natur.416..279O. doi:10.1038/416279a. PMID 11907567. S2CID 4415511.
- Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. (1998). «Ion and Water Transport Characteristics of Nafion Membranes as Electrolytes». Electrochimica Acta. 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- Okazoe, T. (2009). «Overview on the History of Organofluorine Chemistry from the Viewpoint of Material Industry». Proceedings of the Japan Academy, Series B. 85 (8): 276–289. Bibcode:2009PJAB…85..276O. doi:10.2183/pjab.85.276. PMC 3621566. PMID 19838009.
- Olivares, M.; Uauy, R. (2004). Essential Nutrients in Drinking Water (Draft) (PDF) (Report). World Health Organization (WHO). Archived from the original (PDF) on 19 October 2012. Retrieved 14 October 2013.
- Parente, Luca (2001). «The Development of Synthetic Glucocorticoids». In Goulding, Nicolas J.; Flower, Rod J. (eds.). Glucocorticoids. Basel: Birkhäuser. pp. 35–53. ISBN 978-3-7643-6059-7.
- Partington, J. R. (1923). «The early history of hydrofluoric acid». Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 67 (6): 73–87.
- Patnaik, Pradyot (2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances (3rd ed.). Hoboken: John Wiley & Sons. ISBN 978-0-471-71458-3.
- Pauling, Linus (1960). The Nature of the Chemical Bond (3rd ed.). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0.
- Pauling, L.; Keaveny, I.; Robinson, A. B. (1970). «The Crystal Structure of α-Fluorine». Journal of Solid State Chemistry. 2 (2): 225–227. Bibcode:1970JSSCh…2..225P. doi:10.1016/0022-4596(70)90074-5.
- Perry, Dale L. (2011). Handbook of Inorganic Compounds (2nd ed.). Boca Raton: CRC Press. ISBN 978-1-4398-1461-1.
- Pitzer, K. S. (1975). «Fluorides of Radon and Element 118». Journal of the Chemical Society, Chemical Communications (18): 760b–761. doi:10.1039/C3975000760B.
- Pitzer, Kenneth S., ed. (1993). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. ISBN 978-981-02-1439-5.
- Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (2007). «Community Water Fluoridation and Caries Prevention: A Critical Review» (PDF). Clinical Oral Investigations. 11 (3): 189–193. doi:10.1007/s00784-007-0111-6. PMID 17333303. S2CID 13189520.
- Posner, Stefan (2011). «Perfluorinated Compounds: Occurrence and Uses in Products». In Knepper, Thomas P.; Large, Frank T. (eds.). Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. pp. 25–40. ISBN 978-3-642-21871-2.
- Posner, Stefan; et al. (2013). Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology (PDF). Copenhagen: Nordic Council of Ministers. doi:10.6027/TN2013-542. ISBN 978-92-893-2562-2.
- Preskorn, Sheldon H. (1996). Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. ISBN 978-1-884735-08-0.
- Principe, Lawrence M. (2012). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN 978-0-226-68295-2.
- Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. (2006). «Sodium Fluoroacetate Poisoning». Toxicological Reviews. 25 (4): 213–219. doi:10.2165/00139709-200625040-00002. PMID 17288493. S2CID 29189551.
- PRWeb (28 October 2010). «Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc». prweb.com. Retrieved 24 October 2013.
- PRWeb (23 February 2012). «Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc». prweb.com. Retrieved 24 October 2013.
- PRWeb (7 April 2013). «Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets». prweb.com. Retrieved 24 October 2013.
- Pyykkö, Pekka; Atsumi, Michiko (2009). «Molecular Double-Bond Covalent Radii for Elements Li–E112». Chemistry: A European Journal. 15 (46): 12770–9. doi:10.1002/chem.200901472. PMID 19856342.
- Raghavan, P. S. (1998). Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. ISBN 978-81-7141-418-5.
- Raj, P. Prithvi; Erdine, Serdar (2012). Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. ISBN 978-0-470-67038-5.
- Ramkumar, Jayshree (2012). «Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications». In Banerjee, S.; Tyagi, A. K. (eds.). Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. pp. 549–578. ISBN 978-0-12-385142-0.
- Reddy, D. (2009). «Neurology of Endemic Skeletal Fluorosis». Neurology India. 57 (1): 7–12. doi:10.4103/0028-3886.48793. PMID 19305069.
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. (2004). «On the origin of fluorine in the Milky Way». Monthly Notices of the Royal Astronomical Society. 354 (2): 575–580. arXiv:astro-ph/0410580. Bibcode:2004MNRAS.354..575R. doi:10.1111/j.1365-2966.2004.08215.x. S2CID 12330666.
- Renner, R. (2006). «The Long and the Short of Perfluorinated Replacements». Environmental Science & Technology. 40 (1): 12–13. Bibcode:2006EnST…40…12R. doi:10.1021/es062612a. PMID 16433328.
- Rhoades, David Walter (2008). Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor. ISBN 978-0-549-78540-8.
- Richter, M.; Hahn, O.; Fuchs, R. (2001). «Purple Fluorite: A Little Known Artists’ Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe». Studies in Conservation. 46 (1): 1–13. doi:10.1179/sic.2001.46.1.1. JSTOR 1506878. S2CID 191611885.
- Riedel, Sebastian; Kaupp, Martin (2009). «The highest oxidation states of the transition metal elements». Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- Ripa, L. W. (1993). «A Half-century of Community Water Fluoridation in the United States: Review and Commentary» (PDF). Journal of Public Health Dentistry. 53 (1): 17–44. doi:10.1111/j.1752-7325.1993.tb02666.x. PMID 8474047. Archived from the original (PDF) on 4 March 2009.
- Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. (2006). «Topical Treatment of Experimental Hydrofluoric Acid Skin Burns by 2.5% Calcium Gluconate». Journal of Burn Care & Research. 27 (6): 889–894. doi:10.1097/01.BCR.0000245767.54278.09. PMID 17091088. S2CID 3691306.
- Salager, Jean-Louis (2002). Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. Retrieved 13 October 2013.
- Sandford, Graham (2000). «Organofluorine Chemistry». Philosophical Transactions. 358 (1766): 455–471. Bibcode:2000RSPTA.358..455S. doi:10.1098/rsta.2000.0541. S2CID 202574641.
- Sarkar, S. (2008). «Artificial Blood». Indian Journal of Critical Care Medicine. 12 (3): 140–144. doi:10.4103/0972-5229.43685. PMC 2738310. PMID 19742251.
- Scheele, Carl Wilhelm (1771). «Undersŏkning om fluss-spat och dess syra» [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (in Swedish). 32: 129–138.
- Schimmeyer, S. (2002). «The Search for a Blood Substitute». Illumin. Columbia: University of Southern Carolina. 15 (1). Archived from the original on 2 October 2011. Retrieved 15 October 2013.
- Schlöder, T.; Riedel, S. (2012). «Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2O2]+, [F2Cl2]+, [Cl2O2]+, [F4]+, and [Cl4]+«. RSC Advances. Royal Society of Chemistry. 2 (3): 876–881. Bibcode:2012RSCAd…2..876S. doi:10.1039/C1RA00804H.
- Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian (2012). «Occurrence of Difluorine F2 in Nature-In Situ Proof and Quantification by NMR Spectroscopy». Angewandte Chemie International Edition. 51 (31): 7847–7849. doi:10.1002/anie.201203515. ISSN 1521-3773. PMID 22763992.
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). «Use of Fluorine-18 Fluoro-2-deoxy-D-glucose Positron Emission Tomography in Assessing the Process of Tuberculous Spondylitis» (PDF). Journal of Spinal Disorders. 13 (6): 541–544. doi:10.1097/00002517-200012000-00016. PMID 11132989. Retrieved 8 October 2013.
- Schulze-Makuch, D.; Irwin, L. N. (2008). Life in the Universe: Expectations and Constraints (2nd ed.). Berlin: Springer-Verlag. ISBN 978-3-540-76816-6.
- Schwarcz, Joseph A. (2004). The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life. Toronto: ECW Press. ISBN 1-55022-621-5.
- Senning, A. (2007). Elsevier’s Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. ISBN 978-0-444-52239-9.
- Shaffer, T. H.; Wolfson, M. R.; Clark, L. C. Jr. (1992). «Liquid Ventilation». Pediatric Pulmonology. 14 (2): 102–109. doi:10.1002/ppul.1950140208. PMID 1437347. S2CID 222167378.
- Shin, Richard D.; Silverberg, Mark A. (2013). «Fluoride Toxicity». Medscape. Retrieved 15 October 2013.
- Shriver, Duward; Atkins, Peter (2010). Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. ISBN 978-1-4292-5255-3.
- Shulman, J. D.; Wells, L. M. (1997). «Acute Fluoride Toxicity from Ingesting Home-use Dental Products in Children, Birth to 6 Years of Age». Journal of Public Health Dentistry. 57 (3): 150–158. doi:10.1111/j.1752-7325.1997.tb02966.x. PMID 9383753.
- Siegemund, G. N.; Schwertfeger, W.; Feiring, A.; Smart, B.; Behr, F.; Vogel, H.; McKusick, B. (2000). «Fluorine Compounds, Organic». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 15. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_349.
- Slye, Orville M. (2012). «Fire Extinguishing Agents». In Ullmann, Franz (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 15. Weinheim: Wiley-VCH. pp. 1–11. doi:10.1002/14356007.a11_113.pub2. ISBN 978-3527306732.
- Steenland, K.; Fletcher, T.; Savitz, D. A. (2010). «Epidemiologic Evidence on the Health Effects of Perfluorooctanoic Acid (PFOA)». Environmental Health Perspectives. 118 (8): 1100–1108. doi:10.1289/ehp.0901827. PMC 2920088. PMID 20423814.
- Stillman, John Maxson (December 1912). «Basil Valentine, A Seventeenth Century Hoax». Popular Science Monthly. 81. Retrieved 14 October 2013.
- Storer, Frank H. (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis.
- Swinson, Joel (June 2005). «Fluorine – A Vital Element in the Medicine Chest» (PDF). PharmaChem. Pharmaceutical Chemistry: 26–27. Archived from the original (PDF) on 8 February 2012. Retrieved 9 October 2013.
- Taber, Andrew (22 April 1999). «Dying to ride». Salon. Retrieved 18 October 2013.
- Tanner Industries (January 2011). «Anhydrous Ammonia: (MSDS) Material Safety Data Sheet». tannerind.com. Retrieved 24 October 2013.
- Theodoridis, George (2006). «Fluorine-Containing Agrochemicals: An Overview of Recent Developments». In Tressaud, Alain (ed.). Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. pp. 121–176. ISBN 978-0-444-52672-4.
- Toon, Richard (1 September 2011). «The discovery of fluorine». Education in Chemistry. Vol. 48, no. 5. Royal Society of Chemistry. pp. 148–151. ISSN 0013-1350.
- Transparency Market Research (17 May 2013). «Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research». Transparency Market Research Blog. Archived from the original on 22 February 2014. Retrieved 15 October 2013.
- Ullmann, Fritz (2008). Ullmann’s Fibers (2 volumes). Weinheim: Wiley-VCH. ISBN 978-3-527-31772-1.
- United States Environmental Protection Agency (1996). «R.E.D. Facts: Trifluralin» (PDF). Archived from the original (PDF) on 18 October 2013. Retrieved 17 October 2013.
- United States Environmental Protection Agency (2012). «Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA)» (PDF). Archived from the original (PDF) on 29 October 2013. Retrieved 4 November 2013.
- United States Environmental Protection Agency (2013a). «Class I Ozone-depleting Substances». Archived from the original on 10 December 2010. Retrieved 15 October 2013.
- United States Environmental Protection Agency (2013b). «Phaseout of HCFCs (Class II Ozone-Depleting Substances)». Retrieved 15 October 2013.
- Viel, Claude; Goldwhite, Harold (1993). «1906 Nobel Laureate: Henri Moissan, 1852–1907». In Laylin, K. James (ed.). Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. pp. 35–41. ISBN 978-0-8412-2690-6.
- Vigoureux, P. (1961). «The Gyromagnetic Ratio of the Proton». Contemporary Physics. 2 (5): 360–366. Bibcode:1961ConPh…2..360V. doi:10.1080/00107516108205282. S2CID 5092147.
- Villalba, Gara; Ayres, Robert U.; Schroder, Hans (2008). «Accounting for Fluorine: Production, Use, and Loss». Journal of Industrial Ecology. 11: 85–101. doi:10.1162/jiec.2007.1075. S2CID 153740615.
- Walsh, Kenneth A. (2009). Beryllium Chemistry and Processing. Materials Park: ASM International. ISBN 978-0-87170-721-5.
- Walter, P. (2013). «Honeywell Invests $300m in Green Refrigerant». Chemistry World.
- Weeks, M. E. (1932). «The Discovery of the Elements. XVII. The Halogen Family». Journal of Chemical Education. 9 (11): 1915–1939. Bibcode:1932JChEd…9.1915W. doi:10.1021/ed009p1915.
- Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. (2011). «Unnecessary use of Fluoroquinolone Antibiotics in Hospitalized Patients». BMC Infectious Diseases. 11: 187–193. doi:10.1186/1471-2334-11-187. PMC 3145580. PMID 21729289.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Willey, Ronald R. (2007). Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L.; Braker, William (2001). «Fluorine». Matheson Gas Data Book (7th ed.). Parsippany: Matheson Tri-Gas. ISBN 978-0-07-135854-5.
- Yeung, C. A. (2008). «A Systematic Review of the Efficacy and Safety of Fluoridation». Evidence-Based Dentistry. 9 (2): 39–43. doi:10.1038/sj.ebd.6400578. PMID 18584000.
- Young, David A. (1975). Phase Diagrams of the Elements (Report). Lawrence Livermore Laboratory. Retrieved 10 June 2011.
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. (2013). «Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients». Chemosphere. 91 (6): 725–32. Bibcode:2013Chmsp..91..725Z. doi:10.1016/j.chemosphere.2013.02.024. PMID 23498059.
- Zorich, Robert (1991). Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. ISBN 978-0-323-14055-3.
External links[edit]
Media related to Fluorine at Wikimedia Commons

Liquid fluorine (F2 at extremely low temperature) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fluorine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotropes | alpha, beta (see Allotropes of fluorine) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | gas: very pale yellow liquid: bright yellow solid: alpha is opaque, beta is transparent |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fluorine in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 17 (halogens) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p5[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | (F2) 53.48 K (−219.67 °C, −363.41 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | (F2) 85.03 K (−188.11 °C, −306.60 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 1.696 g/L[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.505 g/cm3[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 53.48 K, 90 kPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 144.41 K, 5.1724 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 6.51 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | Cp: 31 J/(mol·K)[5] (at 21.1 °C) Cv: 23 J/(mol·K)[5] (at 21.1 °C) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −1, 0[6] (oxidizes oxygen) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 3.98[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 64 pm[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 135 pm[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of fluorine |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubic
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 0.02591 W/(m⋅K)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic (−1.2×10−4)[11][12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7782-41-4[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after the mineral fluorite, itself named after Latin fluo (to flow, in smelting) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | André-Marie Ampère (1810) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Henri Moissan[2] (June 26, 1886) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Named by |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of fluorine
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[13] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Fluorine is a chemical element with the symbol F and atomic number 9. It is the lightest halogen and exists at standard conditions as a highly toxic, pale yellow diatomic gas. As the most electronegative reactive element, it is extremely reactive, as it reacts with all other elements except for the light inert gases.
Among the elements, fluorine ranks 24th in universal abundance and 13th in terrestrial abundance. Fluorite, the primary mineral source of fluorine which gave the element its name, was first described in 1529; as it was added to metal ores to lower their melting points for smelting, the Latin verb fluo meaning ‘flow’ gave the mineral its name. Proposed as an element in 1810, fluorine proved difficult and dangerous to separate from its compounds, and several early experimenters died or sustained injuries from their attempts. Only in 1886 did French chemist Henri Moissan isolate elemental fluorine using low-temperature electrolysis, a process still employed for modern production. Industrial production of fluorine gas for uranium enrichment, its largest application, began during the Manhattan Project in World War II.
Owing to the expense of refining pure fluorine, most commercial applications use fluorine compounds, with about half of mined fluorite used in steelmaking. The rest of the fluorite is converted into corrosive hydrogen fluoride en route to various organic fluorides, or into cryolite, which plays a key role in aluminium refining. Molecules containing a carbon–fluorine bond often have very high chemical and thermal stability; their major uses are as refrigerants, electrical insulation and cookware, and PTFE (Teflon). Pharmaceuticals such as atorvastatin and fluoxetine contain C−F bonds. The fluoride ion from dissolved fluoride salts inhibits dental cavities, and so finds use in toothpaste and water fluoridation. Global fluorochemical sales amount to more than US$69 billion a year.
Fluorocarbon gases are generally greenhouse gases with global-warming potentials 100 to 23,500 times that of carbon dioxide, and SF6 has the highest global warming potential of any known substance. Organofluorine compounds often persist in the environment due to the strength of the carbon–fluorine bond. Fluorine has no known metabolic role in mammals; a few plants and sea sponges synthesize organofluorine poisons (most often monofluoroacetates) that help deter predation.[14]
Characteristics[edit]
Electron configuration[edit]
Fluorine atoms have nine electrons, one fewer than neon, and electron configuration 1s22s22p5: two electrons in a filled inner shell and seven in an outer shell requiring one more to be filled. The outer electrons are ineffective at nuclear shielding, and experience a high effective nuclear charge of 9 − 2 = 7; this affects the atom’s physical properties.[2]
Fluorine’s first ionization energy is third-highest among all elements, behind helium and neon,[15] which complicates the removal of electrons from neutral fluorine atoms. It also has a high electron affinity, second only to chlorine,[16] and tends to capture an electron to become isoelectronic with the noble gas neon;[2] it has the highest electronegativity of any reactive element.[17] Fluorine atoms have a small covalent radius of around 60 picometers, similar to those of its period neighbors oxygen and neon.[18][19][note 1]
Reactivity[edit]
| External video |
|---|
The bond energy of difluorine is much lower than that of either Cl
2 or Br
2 and similar to the easily cleaved peroxide bond; this, along with high electronegativity, accounts for fluorine’s easy dissociation, high reactivity, and strong bonds to non-fluorine atoms.[20][21] Conversely, bonds to other atoms are very strong because of fluorine’s high electronegativity. Unreactive substances like powdered steel, glass fragments, and asbestos fibers react quickly with cold fluorine gas; wood and water spontaneously combust under a fluorine jet.[4][22]
Reactions of elemental fluorine with metals require varying conditions. Alkali metals cause explosions and alkaline earth metals display vigorous activity in bulk; to prevent passivation from the formation of metal fluoride layers, most other metals such as aluminium and iron must be powdered,[20] and noble metals require pure fluorine gas at 300–450 °C (575–850 °F).[23] Some solid nonmetals (sulfur, phosphorus) react vigorously in liquid fluorine.[24] Hydrogen sulfide[24] and sulfur dioxide[25] combine readily with fluorine, the latter sometimes explosively; sulfuric acid exhibits much less activity, requiring elevated temperatures.[26]
Hydrogen, like some of the alkali metals, reacts explosively with fluorine.[27] Carbon, as lamp black, reacts at room temperature to yield tetrafluoromethane. Graphite combines with fluorine above 400 °C (750 °F) to produce non-stoichiometric carbon monofluoride; higher temperatures generate gaseous fluorocarbons, sometimes with explosions.[28] Carbon dioxide and carbon monoxide react at or just above room temperature,[29] whereas paraffins and other organic chemicals generate strong reactions:[30] even completely substituted haloalkanes such as carbon tetrachloride, normally incombustible, may explode.[31] Although nitrogen trifluoride is stable, nitrogen requires an electric discharge at elevated temperatures for reaction with fluorine to occur, due to the very strong triple bond in elemental nitrogen;[32] ammonia may react explosively.[33][34] Oxygen does not combine with fluorine under ambient conditions, but can be made to react using electric discharge at low temperatures and pressures; the products tend to disintegrate into their constituent elements when heated.[35][36][37] Heavier halogens[38] react readily with fluorine as does the noble gas radon;[39] of the other noble gases, only xenon and krypton react, and only under special conditions.[40] Argon does not react with fluorine gas; however, it does form a compound with fluorine, argon fluorohydride.
Phases[edit]
Crystal structure of β-fluorine. Spheres indicate F
2 molecules that may assume any angle. Other molecules are constrained to planes.
Animation showing the crystal structure of beta-fluorine. Molecules on the faces of the unit cell have rotations constrained to a plane.
At room temperature, fluorine is a gas of diatomic molecules,[4] pale yellow when pure (sometimes described as yellow-green).[41] It has a characteristic halogen-like pungent and biting odor detectable at 20 ppb.[42] Fluorine condenses into a bright yellow liquid at −188 °C (−306 °F), a transition temperature similar to those of oxygen and nitrogen.[43]
Fluorine has two solid forms, α- and β-fluorine. The latter crystallizes at −220 °C (−364 °F) and is transparent and soft, with the same disordered cubic structure of freshly crystallized solid oxygen,[43][note 2] unlike the orthorhombic systems of other solid halogens.[47][48] Further cooling to −228 °C (−378 °F) induces a phase transition into opaque and hard α-fluorine, which has a monoclinic structure with dense, angled layers of molecules. The transition from β- to α-fluorine is more exothermic than the condensation of fluorine, and can be violent.[47][48][note 3]
Isotopes[edit]
Only one isotope of fluorine occurs naturally in abundance, the stable isotope 19
F.[49] It has a high magnetogyric ratio[note 4] and exceptional sensitivity to magnetic fields; because it is also the only stable isotope, it is used in magnetic resonance imaging.[51] Eighteen radioisotopes with mass numbers from 13 to 31 have been synthesized, of which 18
F is the most stable with a half-life of 109.77 minutes. 18
F is a natural trace radioisotope produced by cosmic ray spallation of atmospheric argon as well as by reaction of protons with natural oxygen: 18O + p → 18F + n.[52] Other radioisotopes have half-lives less than 70 seconds; most decay in less than half a second.[53] The isotopes 17
F and 18
F undergo β+ decay and electron capture, lighter isotopes decay by proton emission, and those heavier than 19
F undergo β− decay (the heaviest ones with delayed neutron emission).[53][54] Two metastable isomers of fluorine are known, 18m
F, with a half-life of 162(7) nanoseconds, and 26m
F, with a half-life of 2.2(1) milliseconds.[55]
Occurrence[edit]
Universe[edit]
| Atomic number |
Element | Relative amount |
|---|---|---|
| 6 | Carbon | 4,800 |
| 7 | Nitrogen | 1,500 |
| 8 | Oxygen | 8,800 |
| 9 | Fluorine | 1 |
| 10 | Neon | 1,400 |
| 11 | Sodium | 24 |
| 12 | Magnesium | 430 |
Among the lighter elements, fluorine’s abundance value of 400 ppb (parts per billion) – 24th among elements in the universe – is exceptionally low: other elements from carbon to magnesium are twenty or more times as common.[57] This is because stellar nucleosynthesis processes bypass fluorine, and any fluorine atoms otherwise created have high nuclear cross sections, allowing collisions with hydrogen or helium to generate oxygen or neon respectively.[57][58]
Beyond this transient existence, three explanations have been proposed for the presence of fluorine:[57][59]
- during type II supernovae, bombardment of neon atoms by neutrinos could transmute them to fluorine;
- the solar wind of Wolf–Rayet stars could blow fluorine away from any hydrogen or helium atoms; or
- fluorine is borne out on convection currents arising from fusion in asymptotic giant branch stars.
Earth[edit]
Fluorine is the thirteenth most common element in Earth’s crust at 600–700 ppm (parts per million) by mass.[60] Though believed not to occur naturally, elemental fluorine has been shown to be present as an occlusion in antozonite, a variant of fluorite.[61] Most fluorine exists as fluoride-containing minerals. Fluorite, fluorapatite and cryolite are the most industrially significant.[60][62] Fluorite (CaF
2), also known as fluorspar, abundant worldwide, is the main source of fluoride, and hence fluorine. China and Mexico are the major suppliers.[62][63][64][65][66] Fluorapatite (Ca5(PO4)3F), which contains most of the world’s fluoride, is an inadvertent source of fluoride as a byproduct of fertilizer production.[62] Cryolite (Na
3AlF
6), used in the production of aluminium, is the most fluorine-rich mineral. Economically viable natural sources of cryolite have been exhausted, and most is now synthesised commercially.[62]
-
Fluorite: Pink globular mass with crystal facets
-
Fluorapatite: Long prism-like crystal, without luster, at an angle coming out of aggregate-like rock
-
Cryolite: A parallelogram-shaped outline with diatomic molecules arranged in two layers
Other minerals such as topaz contain fluorine. Fluorides, unlike other halides, are insoluble and do not occur in commercially favorable concentrations in saline waters.[62] Trace quantities of organofluorines of uncertain origin have been detected in volcanic eruptions and geothermal springs.[67] The existence of gaseous fluorine in crystals, suggested by the smell of crushed antozonite, is contentious;[68][61] a 2012 study reported the presence of 0.04% F
2 by weight in antozonite, attributing these inclusions to radiation from the presence of tiny amounts of uranium.[61]
History[edit]
Early discoveries[edit]
In 1529, Georgius Agricola described fluorite as an additive used to lower the melting point of metals during smelting.[69][70][note 5] He penned the Latin word fluorēs (fluor, flow) for fluorite rocks. The name later evolved into fluorspar (still commonly used) and then fluorite.[63][74][75] The composition of fluorite was later determined to be calcium difluoride.[76]
Hydrofluoric acid was used in glass etching from 1720 onward.[note 6] Andreas Sigismund Marggraf first characterized it in 1764 when he heated fluorite with sulfuric acid, and the resulting solution corroded its glass container.[78][79] Swedish chemist Carl Wilhelm Scheele repeated the experiment in 1771, and named the acidic product fluss-spats-syran (fluorspar acid).[79][80] In 1810, the French physicist André-Marie Ampère suggested that hydrogen and an element analogous to chlorine constituted hydrofluoric acid.[81] He also proposed in a letter to Sir Humphry Davy dated August 26, 1812 that this then-unknown substance may be named fluorine from fluoric acid and the -ine suffix of other halogens.[82][83] This word, often with modifications, is used in most European languages; however, Greek, Russian, and some others, following Ampère’s later suggestion, use the name ftor or derivatives, from the Greek φθόριος (phthorios, destructive).[84] The New Latin name fluorum gave the element its current symbol F; Fl was used in early papers.[85][note 7]
Isolation[edit]
1887 drawing of Moissan’s apparatus
Initial studies on fluorine were so dangerous that several 19th-century experimenters were deemed «fluorine martyrs» after misfortunes with hydrofluoric acid.[note 8] Isolation of elemental fluorine was hindered by the extreme corrosiveness of both elemental fluorine itself and hydrogen fluoride, as well as the lack of a simple and suitable electrolyte.[76][86] Edmond Frémy postulated that electrolysis of pure hydrogen fluoride to generate fluorine was feasible and devised a method to produce anhydrous samples from acidified potassium bifluoride; instead, he discovered that the resulting (dry) hydrogen fluoride did not conduct electricity.[76][86][87] Frémy’s former student Henri Moissan persevered, and after much trial and error found that a mixture of potassium bifluoride and dry hydrogen fluoride was a conductor, enabling electrolysis. To prevent rapid corrosion of the platinum in his electrochemical cells, he cooled the reaction to extremely low temperatures in a special bath and forged cells from a more resistant mixture of platinum and iridium, and used fluorite stoppers.[86][88] In 1886, after 74 years of effort by many chemists, Moissan isolated elemental fluorine.[87][89]
In 1906, two months before his death, Moissan received the Nobel Prize in Chemistry,[90] with the following citation:[86]
[I]n recognition of the great services rendered by him in his investigation and isolation of the element fluorine … The whole world has admired the great experimental skill with which you have studied that savage beast among the elements.[note 9]
Later uses[edit]
The Frigidaire division of General Motors (GM) experimented with chlorofluorocarbon refrigerants in the late 1920s, and Kinetic Chemicals was formed as a joint venture between GM and DuPont in 1930 hoping to market Freon-12 (CCl
2F
2) as one such refrigerant. It replaced earlier and more toxic compounds, increased demand for kitchen refrigerators, and became profitable; by 1949 DuPont had bought out Kinetic and marketed several other Freon compounds.[79][91][92][93] Polytetrafluoroethylene (Teflon) was serendipitously discovered in 1938 by Roy J. Plunkett while working on refrigerants at Kinetic, and its superlative chemical and thermal resistance lent it to accelerated commercialization and mass production by 1941.[79][91][92]
Large-scale production of elemental fluorine began during World War II. Germany used high-temperature electrolysis to make tons of the planned incendiary chlorine trifluoride[94] and the Manhattan Project used huge quantities to produce uranium hexafluoride for uranium enrichment. Since UF
6 is as corrosive as fluorine, gaseous diffusion plants required special materials: nickel for membranes, fluoropolymers for seals, and liquid fluorocarbons as coolants and lubricants. This burgeoning nuclear industry later drove post-war fluorochemical development.[95]
Compounds[edit]
Fluorine has a rich chemistry, encompassing organic and inorganic domains. It combines with metals, nonmetals, metalloids, and most noble gases,[96] and almost exclusively assumes an oxidation state of −1.[note 10] Fluorine’s high electron affinity results in a preference for ionic bonding; when it forms covalent bonds, these are polar, and almost always single.[99][100][note 11]
Metals[edit]
Alkali metals form ionic and highly soluble monofluorides; these have the cubic arrangement of sodium chloride and analogous chlorides.[101][102] Alkaline earth difluorides possess strong ionic bonds but are insoluble in water,[85] with the exception of beryllium difluoride, which also exhibits some covalent character and has a quartz-like structure.[103] Rare earth elements and many other metals form mostly ionic trifluorides.[104][105][106]
Covalent bonding first comes to prominence in the tetrafluorides: those of zirconium, hafnium[107][108] and several actinides[109] are ionic with high melting points,[110][note 12] while those of titanium,[113] vanadium,[114] and niobium are polymeric,[115] melting or decomposing at no more than 350 °C (660 °F).[116] Pentafluorides continue this trend with their linear polymers and oligomeric complexes.[117][118][119] Thirteen metal hexafluorides are known,[note 13] all octahedral, and are mostly volatile solids but for liquid MoF
6 and ReF
6, and gaseous WF
6.[120][121][122] Rhenium heptafluoride, the only characterized metal heptafluoride, is a low-melting molecular solid with pentagonal bipyramidal molecular geometry.[123] Metal fluorides with more fluorine atoms are particularly reactive.[124]
Hydrogen[edit]
Boiling points of hydrogen halides and chalcogenides, showing the unusually high values for hydrogen fluoride and water
Hydrogen and fluorine combine to yield hydrogen fluoride, in which discrete molecules form clusters by hydrogen bonding, resembling water more than hydrogen chloride.[125][126][127] It boils at a much higher temperature than heavier hydrogen halides and unlike them is miscible with water.[128] Hydrogen fluoride readily hydrates on contact with water to form aqueous hydrogen fluoride, also known as hydrofluoric acid. Unlike the other hydrohalic acids, which are strong, hydrofluoric acid is a weak acid at low concentrations.[129][note 14] However, it can attack glass, something the other acids cannot do.[131]
Other reactive nonmetals[edit]
Chlorine trifluoride, whose corrosive potential ignites asbestos, concrete, sand and other fire retardants[132]
Binary fluorides of metalloids and p-block nonmetals are generally covalent and volatile, with varying reactivities. Period 3 and heavier nonmetals can form hypervalent fluorides.[133]
Boron trifluoride is planar and possesses an incomplete octet. It functions as a Lewis acid and combines with Lewis bases like ammonia to form adducts.[134] Carbon tetrafluoride is tetrahedral and inert;[note 15] its group analogues, silicon and germanium tetrafluoride, are also tetrahedral[135] but behave as Lewis acids.[136][137] The pnictogens form trifluorides that increase in reactivity and basicity with higher molecular weight, although nitrogen trifluoride resists hydrolysis and is not basic.[138] The pentafluorides of phosphorus, arsenic, and antimony are more reactive than their respective trifluorides, with antimony pentafluoride the strongest neutral Lewis acid known.[117][139][140]
Chalcogens have diverse fluorides: unstable difluorides have been reported for oxygen (the only known compound with oxygen in an oxidation state of +2), sulfur, and selenium; tetrafluorides and hexafluorides exist for sulfur, selenium, and tellurium. The latter are stabilized by more fluorine atoms and lighter central atoms, so sulfur hexafluoride is especially inert.[141][142] Chlorine, bromine, and iodine can each form mono-, tri-, and pentafluorides, but only iodine heptafluoride has been characterized among possible interhalogen heptafluorides.[143] Many of them are powerful sources of fluorine atoms, and industrial applications using chlorine trifluoride require precautions similar to those using fluorine.[144][145]
Noble gases[edit]
These xenon tetrafluoride crystals were photographed in 1962. The compound’s synthesis, as with xenon hexafluoroplatinate, surprised many chemists.[146]
Noble gases, having complete electron shells, defied reaction with other elements until 1962 when Neil Bartlett reported synthesis of xenon hexafluoroplatinate;[147] xenon difluoride, tetrafluoride, hexafluoride, and multiple oxyfluorides have been isolated since then.[148] Among other noble gases, krypton forms a difluoride,[149] and radon and fluorine generate a solid suspected to be radon difluoride.[150][151] Binary fluorides of lighter noble gases are exceptionally unstable: argon and hydrogen fluoride combine under extreme conditions to give argon fluorohydride.[40] Helium and neon have no long-lived fluorides,[152] and no neon fluoride has ever been observed;[153] helium fluorohydride has been detected for milliseconds at high pressures and low temperatures.[152]
Organic compounds[edit]
Immiscible layers of colored water (top) and much denser perfluoroheptane (bottom) in a beaker; a goldfish and crab cannot penetrate the boundary; quarters rest at the bottom.
Chemical structure of Nafion, a fluoropolymer used in fuel cells and many other applications[154]
The carbon–fluorine bond is organic chemistry’s strongest,[155] and gives stability to organofluorines.[156] It is almost non-existent in nature, but is used in artificial compounds. Research in this area is usually driven by commercial applications;[157] the compounds involved are diverse and reflect the complexity inherent in organic chemistry.[91]
Discrete molecules[edit]
The substitution of hydrogen atoms in an alkane by progressively more fluorine atoms gradually alters several properties: melting and boiling points are lowered, density increases, solubility in hydrocarbons decreases and overall stability increases. Perfluorocarbons,[note 16] in which all hydrogen atoms are substituted, are insoluble in most organic solvents, reacting at ambient conditions only with sodium in liquid ammonia.[158]
The term perfluorinated compound is used for what would otherwise be a perfluorocarbon if not for the presence of a functional group,[159][note 17] often a carboxylic acid. These compounds share many properties with perfluorocarbons such as stability and hydrophobicity,[161] while the functional group augments their reactivity, enabling them to adhere to surfaces or act as surfactants;[162] Fluorosurfactants, in particular, can lower the surface tension of water more than their hydrocarbon-based analogues. Fluorotelomers, which have some unfluorinated carbon atoms near the functional group, are also regarded as perfluorinated.[161]
Polymers[edit]
Polymers exhibit the same stability increases afforded by fluorine substitution (for hydrogen) in discrete molecules; their melting points generally increase too.[163] Polytetrafluoroethylene (PTFE), the simplest fluoropolymer and perfluoro analogue of polyethylene with structural unit –CF
2–, demonstrates this change as expected, but its very high melting point makes it difficult to mold.[164] Various PTFE derivatives are less temperature-tolerant but easier to mold: fluorinated ethylene propylene replaces some fluorine atoms with trifluoromethyl groups, perfluoroalkoxy alkanes do the same with trifluoromethoxy groups,[164] and Nafion contains perfluoroether side chains capped with sulfonic acid groups.[165][166] Other fluoropolymers retain some hydrogen atoms; polyvinylidene fluoride has half the fluorine atoms of PTFE and polyvinyl fluoride has a quarter, but both behave much like perfluorinated polymers.[167]
Production[edit]
Elemental fluorine and virtually all fluorine compounds are produced from hydrogen fluoride or its aqueous solutions, hydrofluoric acid. Hydrogen fluoride is produced in kilns by the endothermic reaction of fluorite (CaF2) with sulfuric acid:[168]
- CaF2 + H2SO4 → 2 HF(g) + CaSO4
The gaseous HF can then be absorbed in water or liquefied.[169]
About 20% of manufactured HF is a byproduct of fertilizer production, which produces hexafluorosilicic acid (H2SiF6), which can be degraded to release HF thermally and by hydrolysis:
- H2SiF6 → 2 HF + SiF4
- SiF4 + 2 H2O → 4 HF + SiO2
Industrial routes to F2[edit]
Industrial fluorine cells at Preston
Moissan’s method is used to produce industrial quantities of fluorine, via the electrolysis of a potassium fluoride/hydrogen fluoride mixture: hydrogen and fluoride ions are reduced and oxidized at a steel container cathode and a carbon block anode, under 8–12 volts, to generate hydrogen and fluorine gas respectively.[64][170] Temperatures are elevated, KF•2HF melting at 70 °C (158 °F) and being electrolyzed at 70–130 °C (158–266 °F). KF, which acts to provide electrical conductivity, is essential since pure HF cannot be electrolyzed because it is virtually non-conductive.[79][171][172] Fluorine can be stored in steel cylinders that have passivated interiors, at temperatures below 200 °C (392 °F); otherwise nickel can be used.[79][173] Regulator valves and pipework are made of nickel, the latter possibly using Monel instead.[174] Frequent passivation, along with the strict exclusion of water and greases, must be undertaken. In the laboratory, glassware may carry fluorine gas under low pressure and anhydrous conditions;[174] some sources instead recommend nickel-Monel-PTFE systems.[175]
Laboratory routes[edit]
While preparing for a 1986 conference to celebrate the centennial of Moissan’s achievement, Karl O. Christe reasoned that chemical fluorine generation should be feasible since some metal fluoride anions have no stable neutral counterparts; their acidification potentially triggers oxidation instead. He devised a method which evolves fluorine at high yield and atmospheric pressure:[176]
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Christe later commented that the reactants «had been known for more than 100 years and even Moissan could have come up with this scheme.»[177] As late as 2008, some references still asserted that fluorine was too reactive for any chemical isolation.[178]
Industrial applications[edit]
Fluorite mining, which supplies most global fluorine, peaked in 1989 when 5.6 million metric tons of ore were extracted. Chlorofluorocarbon restrictions lowered this to 3.6 million tons in 1994; production has since been increasing. Around 4.5 million tons of ore and revenue of US$550 million were generated in 2003; later reports estimated 2011 global fluorochemical sales at $15 billion and predicted 2016–18 production figures of 3.5 to 5.9 million tons, and revenue of at least $20 billion.[79][179][180][181][182] Froth flotation separates mined fluorite into two main metallurgical grades of equal proportion: 60–85% pure metspar is almost all used in iron smelting whereas 97%+ pure acidspar is mainly converted to the key industrial intermediate hydrogen fluoride.[64][79][183]
Clickable diagram of the fluorochemical industry according to mass flows
SF
6 current transformers at a Russian railway.
At least 17,000 metric tons of fluorine are produced each year. It costs only $5–8 per kilogram as uranium or sulfur hexafluoride, but many times more as an element because of handling challenges. Most processes using free fluorine in large amounts employ in situ generation under vertical integration.[184]
The largest application of fluorine gas, consuming up to 7,000 metric tons annually, is in the preparation of UF
6 for the nuclear fuel cycle. Fluorine is used to fluorinate uranium tetrafluoride, itself formed from uranium dioxide and hydrofluoric acid.[184] Fluorine is monoisotopic, so any mass differences between UF
6 molecules are due to the presence of 235
U or 238
U, enabling uranium enrichment via gaseous diffusion or gas centrifuge.[4][64] About 6,000 metric tons per year go into producing the inert dielectric SF
6 for high-voltage transformers and circuit breakers, eliminating the need for hazardous polychlorinated biphenyls associated with oil-filled devices.[185] Several fluorine compounds are used in electronics: rhenium and tungsten hexafluoride in chemical vapor deposition, tetrafluoromethane in plasma etching[186][187][188] and nitrogen trifluoride in cleaning equipment.[64] Fluorine is also used in the synthesis of organic fluorides, but its reactivity often necessitates conversion first to the gentler ClF
3, BrF
3, or IF
5, which together allow calibrated fluorination. Fluorinated pharmaceuticals use sulfur tetrafluoride instead.[64]
Inorganic fluorides[edit]
Aluminium extraction depends critically on cryolite
As with other iron alloys, around 3 kg (6.5 lb) metspar is added to each metric ton of steel; the fluoride ions lower its melting point and viscosity.[64][189] Alongside its role as an additive in materials like enamels and welding rod coats, most acidspar is reacted with sulfuric acid to form hydrofluoric acid, which is used in steel pickling, glass etching and alkane cracking.[64] One-third of HF goes into synthesizing cryolite and aluminium trifluoride, both fluxes in the Hall–Héroult process for aluminium extraction; replenishment is necessitated by their occasional reactions with the smelting apparatus. Each metric ton of aluminium requires about 23 kg (51 lb) of flux.[64][190] Fluorosilicates consume the second largest portion, with sodium fluorosilicate used in water fluoridation and laundry effluent treatment, and as an intermediate en route to cryolite and silicon tetrafluoride.[191] Other important inorganic fluorides include those of cobalt, nickel, and ammonium.[64][102][192]
Organic fluorides[edit]
Organofluorides consume over 20% of mined fluorite and over 40% of hydrofluoric acid, with refrigerant gases dominating and fluoropolymers increasing their market share.[64][193] Surfactants are a minor application but generate over $1 billion in annual revenue.[194] Due to the danger from direct hydrocarbon–fluorine reactions above −150 °C (−240 °F), industrial fluorocarbon production is indirect, mostly through halogen exchange reactions such as Swarts fluorination, in which chlorocarbon chlorines are substituted for fluorines by hydrogen fluoride under catalysts. Electrochemical fluorination subjects hydrocarbons to electrolysis in hydrogen fluoride, and the Fowler process treats them with solid fluorine carriers like cobalt trifluoride.[91][195]
Refrigerant gases[edit]
Halogenated refrigerants, termed Freons in informal contexts,[note 18] are identified by R-numbers that denote the amount of fluorine, chlorine, carbon, and hydrogen present.[64][196] Chlorofluorocarbons (CFCs) like R-11, R-12, and R-114 once dominated organofluorines, peaking in production in the 1980s. Used for air conditioning systems, propellants and solvents, their production was below one-tenth of this peak by the early 2000s, after widespread international prohibition.[64] Hydrochlorofluorocarbons (HCFCs) and hydrofluorocarbons (HFCs) were designed as replacements; their synthesis consumes more than 90% of the fluorine in the organic industry. Important HCFCs include R-22, chlorodifluoromethane, and R-141b. The main HFC is R-134a[64] with a new type of molecule HFO-1234yf, a Hydrofluoroolefin (HFO) coming to prominence owing to its global warming potential of less than 1% that of HFC-134a.[197]
Polymers[edit]
About 180,000 metric tons of fluoropolymers were produced in 2006 and 2007, generating over $3.5 billion revenue per year.[198] The global market was estimated at just under $6 billion in 2011 and was predicted to grow by 6.5% per year up to 2016.[199] Fluoropolymers can only be formed by polymerizing free radicals.[163]
Polytetrafluoroethylene (PTFE), sometimes called by its DuPont name Teflon,[200] represents 60–80% by mass of the world’s fluoropolymer production.[198] The largest application is in electrical insulation since PTFE is an excellent dielectric. It is also used in the chemical industry where corrosion resistance is needed, in coating pipes, tubing, and gaskets. Another major use is in PFTE-coated fiberglass cloth for stadium roofs. The major consumer application is for non-stick cookware.[200] Jerked PTFE film becomes expanded PTFE (ePTFE), a fine-pored membrane sometimes referred to by the brand name Gore-Tex and used for rainwear, protective apparel, and filters; ePTFE fibers may be made into seals and dust filters.[200] Other fluoropolymers, including fluorinated ethylene propylene, mimic PTFE’s properties and can substitute for it; they are more moldable, but also more costly and have lower thermal stability. Films from two different fluoropolymers replace glass in solar cells.[200][201]
The chemically resistant (but expensive) fluorinated ionomers are used as electrochemical cell membranes, of which the first and most prominent example is Nafion. Developed in the 1960s, it was initially deployed as fuel cell material in spacecraft and then replaced mercury-based chloralkali process cells. Recently, the fuel cell application has reemerged with efforts to install proton exchange membrane fuel cells into automobiles.[202][203][204] Fluoroelastomers such as Viton are crosslinked fluoropolymer mixtures mainly used in O-rings;[200] perfluorobutane (C4F10) is used as a fire-extinguishing agent.[205]
Surfactants[edit]
Fluorosurfactants are small organofluorine molecules used for repelling water and stains. Although expensive (comparable to pharmaceuticals at $200–2000 per kilogram), they yielded over $1 billion in annual revenues by 2006; Scotchgard alone generated over $300 million in 2000.[194][206][207] Fluorosurfactants are a minority in the overall surfactant market, most of which is taken up by much cheaper hydrocarbon-based products. Applications in paints are burdened by compounding costs; this use was valued at only $100 million in 2006.[194]
Agrichemicals[edit]
About 30% of agrichemicals contain fluorine,[208] most of them herbicides and fungicides with a few crop regulators. Fluorine substitution, usually of a single atom or at most a trifluoromethyl group, is a robust modification with effects analogous to fluorinated pharmaceuticals: increased biological stay time, membrane crossing, and altering of molecular recognition.[209] Trifluralin is a prominent example, with large-scale use in the U.S. as a weedkiller,[209][210] but it is a suspected carcinogen and has been banned in many European countries.[211] Sodium monofluoroacetate (1080) is a mammalian poison in which two acetic acid hydrogens are replaced with fluorine and sodium; it disrupts cell metabolism by replacing acetate in the citric acid cycle. First synthesized in the late 19th century, it was recognized as an insecticide in the early 20th, and was later deployed in its current use. New Zealand, the largest consumer of 1080, uses it to protect kiwis from the invasive Australian common brushtail possum.[212] Europe and the U.S. have banned 1080.[213][214][note 19]
Medicinal applications[edit]
Dental care[edit]
Topical fluoride treatment in Panama
Population studies from the mid-20th century onwards show topical fluoride reduces dental caries. This was first attributed to the conversion of tooth enamel hydroxyapatite into the more durable fluorapatite, but studies on pre-fluoridated teeth refuted this hypothesis, and current theories involve fluoride aiding enamel growth in small caries.[215] After studies of children in areas where fluoride was naturally present in drinking water, controlled public water supply fluoridation to fight tooth decay[216] began in the 1940s and is now applied to water supplying 6 percent of the global population, including two-thirds of Americans.[217][218] Reviews of the scholarly literature in 2000 and 2007 associated water fluoridation with a significant reduction of tooth decay in children.[219] Despite such endorsements and evidence of no adverse effects other than mostly benign dental fluorosis,[220] opposition still exists on ethical and safety grounds.[218][221] The benefits of fluoridation have lessened, possibly due to other fluoride sources, but are still measurable in low-income groups.[222] Sodium monofluorophosphate and sometimes sodium or tin(II) fluoride are often found in fluoride toothpastes, first introduced in the U.S. in 1955 and now ubiquitous in developed countries, alongside fluoridated mouthwashes, gels, foams, and varnishes.[222][223][relevant?]
Pharmaceuticals[edit]
Twenty percent of modern pharmaceuticals contain fluorine.[224] One of these, the cholesterol-reducer atorvastatin (Lipitor), made more revenue than any other drug until it became generic in 2011.[225] The combination asthma prescription Seretide, a top-ten revenue drug in the mid-2000s, contains two active ingredients, one of which – fluticasone – is fluorinated.[226] Many drugs are fluorinated to delay inactivation and lengthen dosage periods because the carbon–fluorine bond is very stable.[227] Fluorination also increases lipophilicity because the bond is more hydrophobic than the carbon–hydrogen bond, and this often helps in cell membrane penetration and hence bioavailability.[226]
Tricyclics and other pre-1980s antidepressants had several side effects due to their non-selective interference with neurotransmitters other than the serotonin target; the fluorinated fluoxetine was selective and one of the first to avoid this problem. Many current antidepressants receive this same treatment, including the selective serotonin reuptake inhibitors: citalopram, its isomer escitalopram, and fluvoxamine and paroxetine.[228][229] Quinolones are artificial broad-spectrum antibiotics that are often fluorinated to enhance their effects. These include ciprofloxacin and levofloxacin.[230][231][232][233] Fluorine also finds use in steroids:[234] fludrocortisone is a blood pressure-raising mineralocorticoid, and triamcinolone and dexamethasone are strong glucocorticoids.[235] The majority of inhaled anesthetics are heavily fluorinated; the prototype halothane is much more inert and potent than its contemporaries. Later compounds such as the fluorinated ethers sevoflurane and desflurane are better than halothane and are almost insoluble in blood, allowing faster waking times.[236][237]
PET scanning[edit]
A full-body 18
F PET scan with glucose tagged with radioactive fluorine-18. The normal brain and kidneys take up enough glucose to be imaged. A malignant tumor is seen in the upper abdomen. Radioactive fluorine is seen in urine in the bladder.
Fluorine-18 is often found in radioactive tracers for positron emission tomography, as its half-life of almost two hours is long enough to allow for its transport from production facilities to imaging centers.[238] The most common tracer is fluorodeoxyglucose[238] which, after intravenous injection, is taken up by glucose-requiring tissues such as the brain and most malignant tumors;[239] computer-assisted tomography can then be used for detailed imaging.[240]
Oxygen carriers[edit]
Liquid fluorocarbons can hold large volumes of oxygen or carbon dioxide, more so than blood, and have attracted attention for their possible uses in artificial blood and in liquid breathing.[241] Because fluorocarbons do not normally mix with water, they must be mixed into emulsions (small droplets of perfluorocarbon suspended in water) to be used as blood.[242][243] One such product, Oxycyte, has been through initial clinical trials.[244] These substances can aid endurance athletes and are banned from sports; one cyclist’s near death in 1998 prompted an investigation into their abuse.[245][246] Applications of pure perfluorocarbon liquid breathing (which uses pure perfluorocarbon liquid, not a water emulsion) include assisting burn victims and premature babies with deficient lungs. Partial and complete lung filling have been considered, though only the former has had any significant tests in humans.[247] An Alliance Pharmaceuticals effort reached clinical trials but was abandoned because the results were not better than normal therapies.[248]
Biological role[edit]
The gifblaar is one of the few organofluorine-synthesizing organisms
Fluorine is not essential for humans and other mammals, but small amounts are known to be beneficial for the strengthening of dental enamel (where the formation of fluorapatite makes the enamel more resistant to attack, from acids produced by bacterial fermentation of sugars). Small amounts of fluorine may be beneficial for bone strength, but the latter has not been definitively established.[249] Both the WHO and the Institute of Medicine of the US National Academies publish recommended daily allowance (RDA) and upper tolerated intake of fluorine, which varies with age and gender.[250][251]
Natural organofluorines have been found in microorganisms and plants[67] but not animals.[252] The most common is fluoroacetate, which is used as a defense against herbivores by at least 40 plants in Africa, Australia and Brazil.[213] Other examples include terminally fluorinated fatty acids, fluoroacetone, and 2-fluorocitrate.[252] An enzyme that binds fluorine to carbon – adenosyl-fluoride synthase – was discovered in bacteria in 2002.[253]
Toxicity[edit]
U.S. hazard signs for commercially transported fluorine[254]
Elemental fluorine is highly toxic to living organisms. Its effects in humans start at concentrations lower than hydrogen cyanide’s 50 ppm[255] and are similar to those of chlorine:[256] significant irritation of the eyes and respiratory system as well as liver and kidney damage occur above 25 ppm, which is the immediately dangerous to life and health value for fluorine.[257] The eyes and nose are seriously damaged at 100 ppm,[257] and inhalation of 1,000 ppm fluorine will cause death in minutes,[258] compared to 270 ppm for hydrogen cyanide.[259]
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
   
|
|
Signal word |
Danger |
|
Hazard statements |
H270, H314, H330[260] |
| NFPA 704 (fire diamond) |
4 0 3
|
Hydrofluoric acid[edit]
Hydrofluoric acid burns may not be evident for a day, after which calcium treatments are less effective.[261]
Hydrofluoric acid is the weakest of the hydrohalic acids, having a pKa of 3.2 at 25 °C.[262] It is a volatile liquid due to the presence of hydrogen bonding (while the other hydrohalic acids are gases). It is able to attack glass, concrete, metals, and organic matter.[263]
Hydrofluoric acid is a contact poison with greater hazards than many strong acids like sulfuric acid even though it is weak: it remains neutral in aqueous solution and thus penetrates tissue faster, whether through inhalation, ingestion or the skin, and at least nine U.S. workers died in such accidents from 1984 to 1994. It reacts with calcium and magnesium in the blood leading to hypocalcemia and possible death through cardiac arrhythmia.[264] Insoluble calcium fluoride formation triggers strong pain[265] and burns larger than 160 cm2 (25 in2) can cause serious systemic toxicity.[266]
Exposure may not be evident for eight hours for 50% HF, rising to 24 hours for lower concentrations, and a burn may initially be painless as hydrogen fluoride affects nerve function. If skin has been exposed to HF, damage can be reduced by rinsing it under a jet of water for 10–15 minutes and removing contaminated clothing.[267] Calcium gluconate is often applied next, providing calcium ions to bind with fluoride; skin burns can be treated with 2.5% calcium gluconate gel or special rinsing solutions.[268][269][270] Hydrofluoric acid absorption requires further medical treatment; calcium gluconate may be injected or administered intravenously. Using calcium chloride – a common laboratory reagent – in lieu of calcium gluconate is contraindicated, and may lead to severe complications. Excision or amputation of affected parts may be required.[266][271]
Fluoride ion[edit]
Soluble fluorides are moderately toxic: 5–10 g sodium fluoride, or 32–64 mg fluoride ions per kilogram of body mass, represents a lethal dose for adults.[272] One-fifth of the lethal dose can cause adverse health effects,[273] and chronic excess consumption may lead to skeletal fluorosis, which affects millions in Asia and Africa.[273][274] Ingested fluoride forms hydrofluoric acid in the stomach which is easily absorbed by the intestines, where it crosses cell membranes, binds with calcium and interferes with various enzymes, before urinary excretion. Exposure limits are determined by urine testing of the body’s ability to clear fluoride ions.[273][275]
Historically, most cases of fluoride poisoning have been caused by accidental ingestion of insecticides containing inorganic fluorides.[276] Most current calls to poison control centers for possible fluoride poisoning come from the ingestion of fluoride-containing toothpaste.[273] Malfunctioning water fluoridation equipment is another cause: one incident in Alaska affected almost 300 people and killed one person.[277] Dangers from toothpaste are aggravated for small children, and the Centers for Disease Control and Prevention recommends supervising children below six brushing their teeth so that they do not swallow toothpaste.[278] One regional study examined a year of pre-teen fluoride poisoning reports totaling 87 cases, including one death from ingesting insecticide. Most had no symptoms, but about 30% had stomach pains.[276] A larger study across the U.S. had similar findings: 80% of cases involved children under six, and there were few serious cases.[279]
Environmental concerns[edit]
Atmosphere[edit]
NASA projection of stratospheric ozone over North America without the Montreal Protocol[280]
The Montreal Protocol, signed in 1987, set strict regulations on chlorofluorocarbons (CFCs) and bromofluorocarbons due to their ozone damaging potential (ODP). The high stability which suited them to their original applications also meant that they were not decomposing until they reached higher altitudes, where liberated chlorine and bromine atoms attacked ozone molecules.[281] Even with the ban, and early indications of its efficacy, predictions warned that several generations would pass before full recovery.[282][283] With one-tenth the ODP of CFCs, hydrochlorofluorocarbons (HCFCs) are the current replacements,[284] and are themselves scheduled for substitution by 2030–2040 by hydrofluorocarbons (HFCs) with no chlorine and zero ODP.[285] In 2007 this date was brought forward to 2020 for developed countries;[286] the Environmental Protection Agency had already prohibited one HCFC’s production and capped those of two others in 2003.[285] Fluorocarbon gases are generally greenhouse gases with global-warming potentials (GWPs) of about 100 to 10,000; sulfur hexafluoride has a value of around 20,000.[287] An outlier is HFO-1234yf which is a new type of refrigerant called a Hydrofluoroolefin (HFO) and has attracted global demand due to its GWP of less than 1 compared to 1,430 for the current refrigerant standard HFC-134a.[197]
Biopersistence[edit]
Organofluorines exhibit biopersistence due to the strength of the carbon–fluorine bond. Perfluoroalkyl acids (PFAAs), which are sparingly water-soluble owing to their acidic functional groups, are noted persistent organic pollutants;[289] perfluorooctanesulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) are most often researched.[290][291][292] PFAAs have been found in trace quantities worldwide from polar bears to humans, with PFOS and PFOA known to reside in breast milk and the blood of newborn babies. A 2013 review showed a slight correlation between groundwater and soil PFAA levels and human activity; there was no clear pattern of one chemical dominating, and higher amounts of PFOS were correlated to higher amounts of PFOA.[290][291][293] In the body, PFAAs bind to proteins such as serum albumin; they tend to concentrate within humans in the liver and blood before excretion through the kidneys. Dwell time in the body varies greatly by species, with half-lives of days in rodents, and years in humans.[290][291][294] High doses of PFOS and PFOA cause cancer and death in newborn rodents but human studies have not established an effect at current exposure levels.[290][291][294]
See also[edit]
- Argon fluoride laser
- Electrophilic fluorination
- Fluoride selective electrode, which measures fluoride concentration
- Fluorine absorption dating
- Fluorous chemistry, a process used to separate reagents from organic solvents
- Krypton fluoride laser
- Radical fluorination
Notes[edit]
- ^ Sources disagree on the radii of oxygen, fluorine, and neon atoms. Precise comparison is thus impossible.
- ^ α-Fluorine has a regular pattern of molecules and is a crystalline solid, but its molecules do not have a specific orientation. β-Fluorine’s molecules have fixed locations and minimal rotational uncertainty. For further detail on α-fluorine, see the 1970 structure by Pauling.[44] For further detail on the concept of disorder in crystals, see the referenced general reviews.[45][46]
- ^ A loud click is heard. Samples may shatter and sample windows blow out.
- ^ The ratio of the angular momentum to magnetic moment is called the gyromagnetic ratio. «Certain nuclei can for many purposes be thought of as spinning round an axis like the Earth or like a top. In general the spin endows them with angular momentum and with a magnetic moment; the first because of their mass, the second because all or part of their electric charge may be rotating with the mass.»[50]
- ^ Basilius Valentinus supposedly described fluorite in the late 15th century, but because his writings were uncovered 200 years later, this work’s veracity is doubtful.[71][72][73]
- ^ Or perhaps from as early as 1670 onwards; Partington[77] and Weeks[76] give differing accounts.
- ^ Fl, since 2012, is used for flerovium.
- ^ Davy, Gay-Lussac, Thénard, and the Irish chemists Thomas and George Knox were injured. Belgian chemist Paulin Louyet and French chemist Jérôme Nicklès died. Moissan also experienced serious hydrogen fluoride poisoning.[76][86]
- ^ Also honored was his invention of the electric arc furnace.
- ^ Fluorine in F
2 is defined to have oxidation state 0. The unstable species F−
2 and F−
3, which decompose at around 40 K, have intermediate oxidation states;[97] F+
4 and a few related species are predicted to be stable.[98] - ^ The metastable boron and nitrogen monofluoride have higher-order fluorine bonds, and some metal complexes use it as a bridging ligand. Hydrogen bonding is another possibility.
- ^ ZrF
4 melts at 932 °C (1710 °F),[111] HfF
4 sublimes at 968 °C (1774 °F),[108] and UF
4 melts at 1036 °C (1897 °F).[112] - ^ These thirteen are those of molybdenum, technetium, ruthenium, rhodium, tungsten, rhenium, osmium, iridium, platinum, polonium, uranium, neptunium, and plutonium.
- ^ See also the explanation by Clark.[130]
- ^ Carbon tetrafluoride is formally organic, but is included here rather than in the organofluorine chemistry section – where more complex carbon-fluorine compounds are discussed – for comparison with SiF
4 and GeF
4. - ^ Perfluorocarbon and fluorocarbon are IUPAC synonyms for molecules containing carbon and fluorine only, but in colloquial and commercial contexts the latter term may refer to any carbon- and fluorine-containing molecule, possibly with other elements.
- ^ This terminology is imprecise, and perfluorinated substance is also used.[160]
- ^ This DuPont trademark is sometimes further misused for CFCs, HFCs, or HCFCs.
- ^ American sheep and cattle collars may use 1080 against predators like coyotes.
Sources[edit]
Citations[edit]
- ^ «Standard Atomic Weights: Fluorine». CIAAW. 2021.
- ^ a b c d e f Jaccaud et al. 2000, p. 381.
- ^ a b c d Haynes 2011, p. 4.121.
- ^ a b c d e Jaccaud et al. 2000, p. 382.
- ^ a b c Compressed Gas Association 1999, p. 365.
- ^ Himmel, D.; Riedel, S. (2007). «After 20 Years, Theoretical Evidence That ‘AuF7‘ Is Actually AuF5·F2«. Inorganic Chemistry. 46 (13). 5338–5342. doi:10.1021/ic700431s.
- ^ Dean 1999, p. 4.6.
- ^ Dean 1999, p. 4.35.
- ^ Matsui 2006, p. 257.
- ^ Yaws & Braker 2001, p. 385.
- ^ Mackay, Mackay & Henderson 2002, p. 72.
- ^ Cheng et al. 1999.
- ^ Chisté & Bé 2011.
- ^ Lee et al. 2014.
- ^ Dean 1999, p. 564.
- ^ Lide 2004, pp. 10.137–10.138.
- ^ Moore, Stanitski & Just urs 2010, p. 156.
- ^ Cordero et al. 2008.
- ^ Pyykkö & Atsumi 2009.
- ^ a b Greenwood & Earnshaw 1998, p. 804.
- ^ Macomber 1996, p. 230
- ^ Nelson 1947.
- ^ Lidin, Molochko & Andreeva 2000, pp. 442–455.
- ^ a b Wiberg, Wiberg & Holleman 2001, p. 404.
- ^ Patnaik 2007, p. 472.
- ^ Aigueperse et al. 2000, p. 400.
- ^ Greenwood & Earnshaw 1998, pp. 76, 804.
- ^ Kuriakose & Margrave 1965.
- ^ Hasegawa et al. 2007.
- ^ Lagow 1970, pp. 64–78.
- ^ Navarrini et al. 2012.
- ^ Lidin, Molochko & Andreeva 2000, p. 252.
- ^ Tanner Industries 2011.
- ^ Morrow, Perry & Cohen 1959.
- ^ Emeléus & Sharpe 1974, p. 111.
- ^ Wiberg, Wiberg & Holleman 2001, p. 457.
- ^ Brantley 1949, p. 26.
- ^ Jaccaud et al. 2000, p. 383.
- ^ Pitzer 1975.
- ^ a b Khriachtchev et al. 2000.
- ^ Burdon, Emson & Edwards 1987.
- ^ Lide 2004, p. 4.12.
- ^ a b Dean 1999, p. 523.
- ^ Pauling, Keaveny & Robinson 1970.
- ^ Bürgi 2000.
- ^ Müller 2009.
- ^ a b Young 1975, p. 10.
- ^ a b Barrett, Meyer & Wasserman 1967.
- ^ National Nuclear Data Center & NuDat 2.1, Fluorine-19.
- ^ Vigoureux 1961.
- ^ Meusinger, Chippendale & Fairhurst 2012, pp. 752, 754.
- ^
SCOPE 50 — Radioecology after Chernobyl Archived 2014-05-13 at the Wayback Machine, the Scientific Committee on Problems of the Environment (SCOPE), 1993. See table 1.9 in Section 1.4.5.2. - ^ a b National Nuclear Data Center & NuDat 2.1.
- ^ NUBASE 2016, pp. 030001-23–030001-27.
- ^ NUBASE 2016, pp. 030001–24.
- ^ Cameron 1973.
- ^ a b c Croswell 2003.
- ^ Clayton 2003, pp. 101–104.
- ^ Renda et al. 2004.
- ^ a b Jaccaud et al. 2000, p. 384.
- ^ a b c Schmedt, Mangstl & Kraus 2012.
- ^ a b c d e Greenwood & Earnshaw 1998, p. 795.
- ^ a b Norwood & Fohs 1907, p. 52.
- ^ a b c d e f g h i j k l m n Villalba, Ayres & Schroder 2008.
- ^ Kelly & Miller 2005.
- ^ Lusty et al. 2008.
- ^ a b Gribble 2002.
- ^ Richter, Hahn & Fuchs 2001, p. 3.
- ^ Greenwood & Earnshaw 1998, p. 790.
- ^ Senning 2007, p. 149.
- ^ Stillman 1912.
- ^ Principe 2012, pp. 140, 145.
- ^ Agricola, Hoover & Hoover 1912, footnotes and commentary, pp. xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Earnshaw 1998, p. 109.
- ^ Agricola, Hoover & Hoover 1912, preface, pp. 380–381.
- ^ a b c d e Weeks 1932.
- ^ Partington 1923.
- ^ Marggraf 1770.
- ^ a b c d e f g h Kirsch 2004, pp. 3–10.
- ^ Scheele 1771.
- ^ Ampère 1816.
- ^ Tressaud, Alain (6 October 2018). Fluorine: A Paradoxical Element. ISBN 9780128129913.
- ^ Davy 1813, p. 278.
- ^ Banks 1986, p. 11.
- ^ a b Storer 1864, pp. 278–280.
- ^ a b c d e Toon 2011.
- ^ a b Asimov 1966, p. 162.
- ^ Greenwood & Earnshaw 1998, pp. 789–791.
- ^ Moissan 1886.
- ^ Viel & Goldwhite 1993, p. 35.
- ^ a b c d Okazoe 2009.
- ^ a b Hounshell & Smith 1988, pp. 156–157.
- ^ DuPont 2013a.
- ^ Meyer 1977, p. 111.
- ^ Kirsch 2004, pp. 60–66.
- ^ Riedel & Kaupp 2009.
- ^ Wiberg, Wiberg & Holleman 2001, p. 422.
- ^ Schlöder & Riedel 2012.
- ^ Harbison 2002.
- ^ Edwards 1994, p. 515.
- ^ Katakuse et al. 1999, p. 267.
- ^ a b Aigueperse et al. 2000, pp. 420–422.
- ^ Walsh 2009, pp. 99–102, 118–119.
- ^ Emeléus & Sharpe 1983, pp. 89–97.
- ^ Babel & Tressaud 1985, pp. 91–96.
- ^ Einstein et al. 1967.
- ^ Brown et al. 2005, p. 144.
- ^ a b Perry 2011, p. 193.
- ^ Kern et al. 1994.
- ^ Lide 2004, pp. 4.60, 4.76, 4.92, 4.96.
- ^ Lide 2004, p. 4.96.
- ^ Lide 2004, p. 4.92.
- ^ Greenwood & Earnshaw 1998, p. 964.
- ^ Becker & Müller 1990.
- ^ Greenwood & Earnshaw 1998, p. 990.
- ^ Lide 2004, pp. 4.72, 4.91, 4.93.
- ^ a b Greenwood & Earnshaw 1998, pp. 561–563.
- ^ Emeléus & Sharpe 1983, pp. 256–277.
- ^ Mackay, Mackay & Henderson 2002, pp. 355–356.
- ^ Greenwood & Earnshaw 1998, (various pages, by metal in respective chapters).
- ^ Lide 2004, pp. 4.71, 4.78, 4.92.
- ^ Drews et al. 2006.
- ^ Greenwood & Earnshaw 1998, p. 819.
- ^ Bartlett 1962.
- ^ Pauling 1960, pp. 454–464.
- ^ Atkins & Jones 2007, pp. 184–185.
- ^ Emsley 1981.
- ^ Greenwood & Earnshaw 1998, pp. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, p. 425.
- ^ Clark 2002.
- ^ Chambers & Holliday 1975, pp. 328–329.
- ^ Air Products and Chemicals 2004, p. 1.
- ^ Noury, Silvi & Gillespie 2002.
- ^ Chang & Goldsby 2013, p. 706.
- ^ Ellis 2001, p. 69.
- ^ Aigueperse et al. 2000, p. 423.
- ^ Wiberg, Wiberg & Holleman 2001, p. 897.
- ^ Raghavan 1998, pp. 164–165.
- ^ Godfrey et al. 1998, p. 98.
- ^ Aigueperse et al. 2000, p. 432.
- ^ Murthy, Mehdi Ali & Ashok 1995, pp. 180–182, 206–208.
- ^ Greenwood & Earnshaw 1998, pp. 638–640, 683–689, 767–778.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 435–436.
- ^ Greenwood & Earnshaw 1998, pp. 828–830.
- ^ Patnaik 2007, pp. 478–479.
- ^ Moeller, Bailar & Kleinberg 1980, p. 236.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 392–393.
- ^ Wiberg, Wiberg & Holleman 2001, p. 395–397, 400.
- ^ Lewars 2008, p. 68.
- ^ Pitzer 1993, p. 111.
- ^ Lewars 2008, p. 67.
- ^ a b Bihary, Chaban & Gerber 2002.
- ^ Lewars 2008, p. 71.
- ^ Hoogers 2002, pp. 4–12.
- ^ O’Hagan 2008.
- ^ Siegemund et al. 2005, p. 444.
- ^ Sandford 2000, p. 455.
- ^ Siegemund et al. 2005, pp. 451–452.
- ^ Barbee, McCormack & Vartanian 2000, p. 116.
- ^ Posner et al. 2013, pp. +hydrocarbons+that+are+fully+fluorinated+except+for+one+functional+group%22 187–190.
- ^ a b Posner 2011, p. 27.
- ^ Salager 2002, p. 45.
- ^ a b Carlson & Schmiegel 2000, p. 3.
- ^ a b Carlson & Schmiegel 2000, pp. 3–4.
- ^ Rhoades 2008, p. 2.
- ^ Okada et al. 1998.
- ^ Carlson & Schmiegel 2000, p. 4.
- ^ Aigueperse et al. 2000.
- ^ Norris Shreve; Joseph Brink, Jr. (1977). Chemical Process Industries (4 ed.). p. 321. ISBN 0070571457.
- ^ Jaccaud et al. 2000, p. 386.
- ^ Jaccaud et al. 2000, pp. 384–285.
- ^ Greenwood & Earnshaw 1998, pp. 796–797.
- ^ Jaccaud et al. 2000, pp. 384–385.
- ^ a b Jaccaud et al. 2000, pp. 390–391.
- ^ Shriver & Atkins 2010, p. 427.
- ^ Christe 1986.
- ^ Christe Research Group n.d.
- ^ Carey 2008, p. 173.
- ^ Miller 2003b.
- ^ PRWeb 2012.
- ^ Bombourg 2012.
- ^ TMR 2013.
- ^ Fulton & Miller 2006, p. 471.
- ^ a b Jaccaud et al. 2000, p. 392.
- ^ Aigueperse et al. 2000, p. 430.
- ^ Jaccaud et al. 2000, pp. 391–392.
- ^ El-Kareh 1994, p. 317.
- ^ Arana et al. 2007.
- ^ Miller 2003a.
- ^ Energetics, Inc. 1997, pp. 41, 50.
- ^ Aigueperse et al. 2000, p. 428.
- ^ Willey 2007, p. 113.
- ^ PRWeb 2010.
- ^ a b c Renner 2006.
- ^ Green et al. 1994, pp. 91–93.
- ^ DuPont 2013b.
- ^ a b Walter 2013.
- ^ a b Buznik 2009.
- ^ PRWeb 2013.
- ^ a b c d e Martin 2007, pp. 187–194.
- ^ DeBergalis 2004.
- ^ Grot 2011, pp. 1–10.
- ^ Ramkumar 2012, p. 567.
- ^ Burney 1999, p. 111.
- ^ Slye 2012, p. 10.
- ^ Kissa 2001, pp. 516–551.
- ^ Ullmann 2008, pp. 538, 543–547.
- ^ ICIS 2006.
- ^ a b Theodoridis 2006.
- ^ EPA 1996.
- ^ DG Environment 2007.
- ^ Beasley 2002.
- ^ a b Proudfoot, Bradberry & Vale 2006.
- ^ Eisler 1995.
- ^ Pizzo et al. 2007.
- ^ CDC 2001.
- ^ Ripa 1993.
- ^ a b Cheng, Chalmers & Sheldon 2007.
- ^ NHMRC 2007; see Yeung 2008 for a summary.
- ^ Marya 2011, p. 343.
- ^ Armfield 2007.
- ^ a b Baelum, Sheiham & Burt 2008, p. 518.
- ^ Cracher 2012, p. 12.
- ^ Emsley 2011, p. 178.
- ^ Johnson 2011.
- ^ a b Swinson 2005.
- ^ Hagmann 2008.
- ^ Mitchell 2004, pp. 37–39.
- ^ Preskorn 1996, chap. 2.
- ^ Werner et al. 2011.
- ^ Brody 2012.
- ^ Nelson et al. 2007.
- ^ King, Malone & Lilley 2000.
- ^ Parente 2001, p. 40.
- ^ Raj & Erdine 2012, p. 58.
- ^ Filler & Saha 2009.
- ^ Bégué & Bonnet-Delpon 2008, pp. 335–336.
- ^ a b Schmitz et al. 2000.
- ^ Bustamante & Pedersen 1977.
- ^ Alavi & Huang 2007, p. 41.
- ^ Gabriel et al. 1996.
- ^ Sarkar 2008.
- ^ Schimmeyer 2002.
- ^ Davis 2006.
- ^ Gains 1998.
- ^ Taber 1999.
- ^ Shaffer, Wolfson & Clark 1992, p. 102.
- ^ Kacmarek et al. 2006.
- ^ Nielsen 2009.
- ^ Olivares & Uauy 2004.
- ^ Food and Nutrition Board.
- ^ a b Murphy, Schaffrath & O’Hagan 2003
- ^ O’Hagan et al. 2002.
- ^ National Oceanic and Atmospheric Administration.
- ^ The National Institute for Occupational Safety and Health 1994a.
- ^ The National Institute for Occupational Safety and Health 1994b.
- ^ a b Keplinger & Suissa 1968.
- ^ Emsley 2011, p. 179.
- ^ Biller 2007, p. 939.
- ^ «Fluorine. Safety data sheet» (PDF). Airgas. Archived from the original (PDF) on 19 April 2015.
- ^ Eaton 1997.
- ^ «Inorganic Chemistry» by Gary L. Miessler and Donald A. Tarr, 4th edition, Pearson
- ^ «Inorganic Chemistry» by Shriver, Weller, Overton, Rourke and Armstrong, 6th edition, Freeman
- ^ Blodgett, Suruda & Crouch 2001.
- ^ Hoffman et al. 2007, p. 1333.
- ^ a b HSM 2006.
- ^ Fischman 2001, pp. 458–459.
- ^ El Saadi et al. 1989.
- ^ Roblin et al. 2006.
- ^ Hultén et al. 2004.
- ^ Zorich 1991, pp. 182–183.
- ^ Liteplo et al. 2002, p. 100.
- ^ a b c d Shin & Silverberg 2013.
- ^ Reddy 2009.
- ^ Baez, Baez & Marthaler 2000.
- ^ a b Augenstein et al. 1991.
- ^ Gessner et al. 1994.
- ^ CDC 2013.
- ^ Shulman & Wells 1997.
- ^ Beck et al. 2011.
- ^ Aucamp & Björn 2010, pp. 4–6, 41, 46–47.
- ^ Mitchell Crow 2011.
- ^ Barry & Phillips 2006.
- ^ EPA 2013a.
- ^ a b EPA 2013b.
- ^ McCoy 2007.
- ^ Forster et al. 2007, pp. 212–213.
- ^ Schwarcz 2004, p. 37.
- ^ Giesy & Kannan 2002.
- ^ a b c d Steenland, Fletcher & Savitz 2010.
- ^ a b c d Betts 2007.
- ^ EPA 2012.
- ^ Zareitalabad et al. 2013.
- ^ a b Lau et al. 2007.
Indexed references[edit]
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry (1912). De Re Metallica. London: The Mining Magazine.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. (2000). «Fluorine Compounds, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 397–441. doi:10.1002/14356007.
- Air Products and Chemicals (2004). «Safetygram #39 Chlorine Trifluoride» (PDF). Air Products and Chemicals. Archived from the original (PDF) on 18 March 2006. Retrieved 16 February 2014.
- Alavi, Abbas; Huang, Steve S. (2007). «Positron Emission Tomography in Medicine: An Overview». In Hayat, M. A. (ed.). Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. pp. 39–44. ISBN 978-0-12-370468-9.
- Ampère, André-Marie (1816). «Suite d’une classification naturelle pour les corps simples». Annales de chimie et de physique (in French). 2: 1–5.
- Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. (2007). «Isotropic Etching of Silicon in Fluorine Gas for MEMS Micromachining». Journal of Micromechanics and Microengineering. 17 (2): 384–392. Bibcode:2007JMiMi..17..384A. doi:10.1088/0960-1317/17/2/026. S2CID 135708022.
- Armfield, J. M. (2007). «When Public Action Undermines Public Health: A Critical Examination of Antifluoridationist Literature». Australia and New Zealand Health Policy. 4: 25. doi:10.1186/1743-8462-4-25. PMC 2222595. PMID 18067684.
- Asimov, Isaac (1966). The Noble Gases. New York: Basic Books. ISBN 978-0-465-05129-8.
- Atkins, Peter; Jones, Loretta (2007). Chemical Principles: The Quest for Insight (4th ed.). New York: W. H. Freeman. ISBN 978-1-4292-0965-6.
- Aucamp, Pieter J.; Björn, Lars Olof (2010). «Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update» (PDF). United Nations Environmental Programme. Archived from the original (PDF) on 3 September 2013. Retrieved 14 October 2013.
- Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001..
- Augenstein, W. L.; et al. (1991). «Fluoride Ingestion in Children: A Review of 87 cases». Pediatrics. 88 (5): 907–912. doi:10.1542/peds.88.5.907. PMID 1945630. S2CID 22106466.
- Babel, Dietrich; Tressaud, Alain (1985). «Crystal Chemistry of Fluorides». In Hagenmuller, Paul (ed.). Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. pp. 78–203. ISBN 978-0-12-412490-5.
- Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian (2008). «Caries Control for Populations». In Fejerskov, Ole; Kidd, Edwina (eds.). Dental Caries: The Disease and Its Clinical Management (2nd ed.). Oxford: Blackwell Munksgaard. pp. 505–526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. (2000). «Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community». Revista Panamericana de Salud Pública. 7 (4): 242–248. doi:10.1590/S1020-49892000000400005. PMID 10846927.
- Banks, R. E. (1986). «Isolation of fluorine by Moissan: Setting the scene». Journal of Fluorine Chemistry. 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- Barbee, K.; McCormack, K.; Vartanian, V. (2000). «EHS Concerns with Ozonated Water Spray Processing». In Mendicino, L. (ed.). Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. pp. 108–121. ISBN 978-1-56677-230-3.
- Barrett, C. S.; Meyer, L.; Wasserman, J. (1967). «Argon—Fluorine Phase Diagram». The Journal of Chemical Physics. 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- Barry, Patrick L.; Phillips, Tony (26 May 2006). «Good News and a Puzzle». National Aeronautics and Space Administration. Retrieved 6 January 2012.
- Bartlett, N. (1962). «Xenon Hexafluoroplatinate (V) Xe+[PtF6]−«. Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- Beasley, Michael (August 2002). Guidelines for the safe use of sodium fluoroacetate (1080) (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). ISBN 0-477-03664-3. Archived from the original (PDF) on 11 November 2013. Retrieved 11 November 2013.
- Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori (2011). «What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?». National Aeronautics and Space Administration. Retrieved 15 October 2013.
- Becker, S.; Müller, B. G. (1990). «Vanadium Tetrafluoride». Angewandte Chemie International Edition in English. 29 (4): 406–407. doi:10.1002/anie.199004061.
- Bégué, Jean-Pierre; Bonnet-Delpon, Danièle (2008). Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. ISBN 978-0-470-27830-7.
- Betts, K. S. (2007). «Perfluoroalkyl Acids: What is the Evidence Telling Us?». Environmental Health Perspectives. 115 (5): A250–A256. doi:10.1289/ehp.115-a250. PMC 1867999. PMID 17520044.
- Bihary, Z.; Chaban, G. M.; Gerber, R. B. (2002). «Stability of a Chemically Bound Helium Compound in High-pressure Solid Helium». The Journal of Chemical Physics. 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- Biller, José (2007). Interface of Neurology and Internal Medicine (illustrated ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-7906-7.
- Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. (2001). «Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S» (PDF). American Journal of Industrial Medicine. 40 (2): 215–220. doi:10.1002/ajim.1090. PMID 11494350. Archived from the original (PDF) on 17 July 2012.
- Bombourg, Nicolas (4 July 2012). «World Fluorochemicals Market, Freedonia». Reporterlinker. Retrieved 20 October 2013.
- Brantley, L. R. (1949). Squires, Roy; Clarke, Arthur C. (eds.). «Fluorine». Pacific Rockets: Journal of the Pacific Rocket Society. South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Brody, Jane E. (10 September 2012). «Popular Antibiotics May Carry Serious Side Effects». The New York Times Well Blog. Retrieved 18 October 2013.
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. ISBN 978-0-444-51803-3.
- Burdon, J.; Emson, B.; Edwards, A. J. (1987). «Is Fluorine Gas Really Yellow?». Journal of Fluorine Chemistry. 34 (3–4): 471–474. doi:10.1016/S0022-1139(00)85188-X.
- Bürgi, H. B. (2000). «Motion and Disorder in Crystal Structure Analysis: Measuring and Distinguishing them». Annual Review of Physical Chemistry. 51: 275–296. Bibcode:2000ARPC…51..275B. doi:10.1146/annurev.physchem.51.1.275. PMID 11031283.
- Burney, H. (1999). «Past, Present and Future of the Chlor-Alkali Industry». In Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. (eds.). Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. pp. 105–126. ISBN 1-56677-244-3.
- Bustamante, E.; Pedersen, P. L. (1977). «High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase». Proceedings of the National Academy of Sciences. 74 (9): 3735–3739. Bibcode:1977PNAS…74.3735B. doi:10.1073/pnas.74.9.3735. PMC 431708. PMID 198801.
- Buznik, V. M. (2009). «Fluoropolymer Chemistry in Russia: Current Situation and Prospects». Russian Journal of General Chemistry. 79 (3): 520–526. doi:10.1134/S1070363209030335. S2CID 97518401.
- Cameron, A. G. W. (1973). «Abundance of the Elements in the Solar System» (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv…15..121C. doi:10.1007/BF00172440. S2CID 120201972. Archived from the original (PDF) on 21 October 2011.
- Carey, Charles W. (2008). African Americans in Science. Santa Barbara: ABC-CLIO. ISBN 978-1-85109-998-6.
- Carlson, D. P.; Schmiegel, W. (2000). «Fluoropolymers, Organic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 495–533. doi:10.1002/14356007.a11_393.
- Centers for Disease Control and Prevention (2001). «Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States». MMWR Recommendations and Reports. 50 (RR–14): 1–42. PMID 11521913. Retrieved 14 October 2013.
- Centers for Disease for Control and Prevention (10 July 2013). «Community Water Fluoridation». Retrieved 25 October 2013.
- Chambers, C.; Holliday, A. K. (1975). Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. ISBN 978-0-408-70663-6. Archived from the original (PDF) on 23 March 2013.
- Chang, Raymond; Goldsby, Kenneth A. (2013). Chemistry (11th ed.). New York: McGraw-Hill. ISBN 978-0-07-131787-0.
- Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascolini, M. R. (1999). «On the Magnetic Susceptibility of Fluorine». The Journal of Physical Chemistry A. 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C. doi:10.1021/jp9844720.
- Chisté, V.; Bé, M. M. (2011). «F-18» (PDF). In Bé, M. M.; Coursol, N.; Duchemin, B.; Lagoutine, F.; et al. (eds.). Table de radionucléides (Report). CEA (Commissariat à l’énergie atomique et aux énergies alternatives), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l’Energie Atomique). Retrieved 15 June 2011.
- Christe, Karl O. (1986). «Chemical Synthesis of Elemental Fluorine». Inorganic Chemistry. 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- Christe Research Group (n.d.). «Chemical Synthesis of Elemental Fluorine». Archived from the original on 4 March 2016. Retrieved 12 January 2013.
- Clark, Jim (2002). «The Acidity of the Hydrogen Halides». chemguide.co.uk. Retrieved 15 October 2013.
- Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. ISBN 978-0-521-82381-4.
- Compressed Gas Association (1999). Handbook of Compressed Gases (4th ed.). Boston: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. (2008). «Covalent Radii Revisited». Dalton Transactions (21): 2832–2838. doi:10.1039/b801115j. PMID 18478144.
- Cracher, Connie M. (2012). «Current Concepts in Preventive Dentistry» (PDF). dentalcare.com. Archived from the original (PDF) on 14 October 2013. Retrieved 14 October 2013.
- Croswell, Ken (September 2003). «Fluorine: An element–ary Mystery». Sky and Telescope. Retrieved 17 October 2013.
- Mitchell Crow, James (2011). «First signs of ozone-hole recovery spotted». Nature. doi:10.1038/news.2011.293.
- Davis, Nicole (November 2006). «Better than blood». Popular Science. Archived from the original on 4 June 2011. Retrieved 20 October 2013.
- Davy, Humphry (1813). «Some experiments and observations on the substances produced in different chemical processes on fluor spar». Philosophical Transactions of the Royal Society. 103: 263–279. doi:10.1098/rstl.1813.0034.
- Dean, John A. (1999). Lange’s Handbook of Chemistry (15th ed.). New York: McGraw-Hill. ISBN 0-07-016190-9.
- DeBergalis, Michael (2004). «Fluoropolymer films in the photovoltaic industry». Journal of Fluorine Chemistry. 125 (8): 1255–1257. doi:10.1016/j.jfluchem.2004.05.013.
- Directorate-General for the Environment (European Commission) (2007). Trifluralin (PDF) (Report). European Commission. Retrieved 14 October 2013.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). «Solid State Molecular Structures of Transition Metal Hexafluorides». Inorganic Chemistry. 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- DuPont (2013a). «Freon». Retrieved 17 October 2013.
- DuPont (2013b). «Understanding the Refrigerant ‘R’ Nomenclature». Retrieved 17 October 2013.
- Eaton, Charles (1997). «Figure hfl». E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). Retrieved 28 September 2013.
- Edwards, Philip Neil (1994). «Use of Fluorine in Chemotherapy». In Banks, R. E.; Smart, B. E.; Tatlow, J. C. (eds.). Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. pp. 501–542. ISBN 978-0-306-44610-8.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. (1967). «The Crystal Structure of Gold Trifluoride». Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 4: 478–482. doi:10.1039/J19670000478.
- Eisler, Ronald (1995). Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (Report). Patuxent Environmental Science Center (U.S. National Biological Service). Retrieved 5 June 2011.
- Ellis, Brian (2001). Scientific Essentialism. Cambridge: Cambridge University Press. ISBN 978-0-521-80094-5.
- El-Kareh, Badih (1994). Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. (1989). «Hydrofluoric Acid Dermal Exposure». Veterinary and Human Toxicology. 31 (3): 243–247. PMID 2741315.
- Emeléus, H. J.; Sharpe, A. G. (1974). Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. New York: Academic Press. ISBN 978-0-08-057865-1.
- Emeléus, H. J.; Sharpe, A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. Vol. 27. Academic Press. ISBN 0-12-023627-3.
- Emsley, John (1981). «The Hidden Strength of Hydrogen». New Scientist. 91 (1264): 291–292.
- Emsley, John (2011). Nature’s Building Blocks: An A–Z Guide to the Elements (2nd ed.). Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Energetics, Inc. (1997). Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (Report). Retrieved 15 October 2013.
- Filler, R.; Saha, R. (2009). «Fluorine in Medicinal Chemistry: A Century of Progress and a 60-year Retrospective of Selected Highlights» (PDF). Future Medicinal Chemistry. 1 (5): 777–791. doi:10.4155/fmc.09.65. PMID 21426080. Archived from the original (PDF) on 22 October 2013.
- Fischman, Michael L. (2001). «Semiconductor Manufacturing Hazards». In Sullivan, John B.; Krieger, Gary R. (eds.). Clinical Environmental Health and Toxic Exposures (2nd ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 431–465. ISBN 978-0-683-08027-8.
- Food and Nutrition Board. «Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes, Elements» (PDF). Institute of Medicine, National Academies. Archived from the original (PDF) on 13 November 2018. Retrieved 2 January 2019.
- Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhr e, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. (2007). «Changes in Atmospheric Constituents and in Radiative Forcing». In Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. (eds.). Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. pp. 129–234. ISBN 978-0-521-70596-7.
- Fulton, Robert B.; Miller, M. Michael (2006). «Fluorspar». In Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (eds.). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). pp. 461–473. ISBN 978-0-87335-233-8.
- Gabriel, J. L.; Miller, T. F. Jr.; Wolfson, M. R.; Shaffer, T. H. (1996). «Quantitative Structure-Activity Relationships of Perfluorinated Hetero-Hydrocarbons as Potential Respiratory Media». ASAIO Journal. 42 (6): 968–973. doi:10.1097/00002480-199642060-00009. PMID 8959271. S2CID 31161098.
- Gains, Paul (18 October 1998). «A New Threat in Blood Doping». The New York Times. Retrieved 18 October 2013.
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. (1994). «Acute Fluoride Poisoning from a Public Water System». New England Journal of Medicine. 330 (2): 95–99. doi:10.1056/NEJM199401133300203. PMID 8259189.
- Giesy, J. P.; Kannan, K. (2002). «Perfluorochemical Surfactants in the Environment». Environmental Science & Technology. 36 (7): 146A–152A. Bibcode:2002EnST…36..146G. doi:10.1021/es022253t. PMID 11999053.
- Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). «Inorganic Derivatives of the Elements». In Norman, Nicholas C. (ed.). Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. pp. 67–158. ISBN 978-0-7514-0389-3.
- Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. (1994). «Perfluorocarbon Fluids». In Banks, R. E.; Smart, B. E.; Tatlow, J. C. (eds.). Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. pp. 89–119. ISBN 978-0-306-44610-8.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Oxford: Butterworth Heinemann. ISBN 0-7506-3365-4.
- Gribble, G. W. (2002). «Naturally Occurring Organofluorines». In Neison, A. H. (ed.). Organofluorines. The Handbook of Environmental Chemistry. Vol. 3N. Berlin: Springer. pp. 121–136. doi:10.1007/10721878_5. ISBN 3-540-42064-9.
- Grot, Walter (2011). Fluorinated Ionomers (2nd ed.). Oxford and Waltham: Elsevier. ISBN 978-1-4377-4457-6.
- Hagmann, W. K. (2008). «The Many Roles for Fluorine in Medicinal Chemistry». Journal of Medicinal Chemistry. 51 (15): 4359–4369. doi:10.1021/jm800219f. PMID 18570365.
- Harbison, G. S. (2002). «The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF». Journal of the American Chemical Society. 124 (3): 366–367. doi:10.1021/ja0159261. PMID 11792193.
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. (2007). «Reaction Between Carbon Dioxide and Elementary Fluorine». Journal of Fluorine Chemistry. 128 (1): 17–28. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665. S2CID 95754841.
- Haxel, G. B.; Hedrick, J. B.; Orris, G. J. (2005). Stauffer, P. H.; Hendley II, J. W. (eds.). Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (Report). U.S. Geological Survey. Retrieved 31 January 2014.
- Haynes, William M., ed. (2011). Handbook of Chemistry and Physics (92nd ed.). Boca Raton: CRC Press. ISBN 978-1-4398-5511-9.
- Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis (2007). Goldfrank’s Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Honeywell (2006). Recommended medical treatment for hydrofluoric acid exposure (PDF). Morristown: Honeywell International. Archived from the original (PDF) on 8 October 2013. Retrieved 9 January 2014.
- Hoogers, G. (2002). «Fuel Cell Components and Their Impact on Performance». In Hoogers, G. (ed.). Fuel Cell Technology Handbook. Boca Raton: CRC Press. pp. 4-1–4-27. ISBN 0-8493-0877-1.
- Hounshell, David A.; Smith, John Kelly (1988). Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. ISBN 0-521-32767-9.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. (2004). «Hexafluorine vs. Standard Decontamination to Reduce Systemic Toxicity After Dermal Exposure to Hydrofluoric Acid». Clinical Toxicology. 42 (4): 355–361. doi:10.1081/CLT-120039541. PMID 15461243. S2CID 27090208.
- ICIS (2 October 2006). «Fluorine’s Treasure Trove». Reed Business Information. Retrieved 24 October 2013.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. (2000). «Fluorine». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 381–395. doi:10.1002/14356007.a11_293.
- Johnson, Linda A. (28 December 2011). «Against Odds, Lipitor Became World’s Top Seller». The Boston Globe. Retrieved 24 October 2013.
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. (2006). «Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome». American Journal of Respiratory and Critical Care Medicine. 173 (8): 882–9. doi:10.1164/rccm.200508-1196OC. PMID 16254269.
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo (1999). «SIMS Experiment». In Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (eds.). Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. pp. 259–273. ISBN 4-06-208635-2.
- Kelly, T. D.; Miller, M. M. (2005). «Historical Fluorspar Statistics». U.S. Geological Service. Retrieved 10 February 2014.
- Keplinger, M. L.; Suissa, L. W. (1968). «Toxicity of Fluorine Short-Term Inhalation». American Industrial Hygiene Association Journal. 29 (1): 10–18. doi:10.1080/00028896809342975. PMID 5667185.
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. (1994). «Temperature Variation of the Structural Parameters in Actinide Tetrafluorides». The Journal of Chemical Physics. 101 (11): 9333–9337. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963.<
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. (2000). «A Stable Argon Compound». Nature. 406 (6798): 874–876. Bibcode:2000Natur.406..874K. doi:10.1038/35022551. PMID 10972285. S2CID 4382128.
- King, D. E.; Malone, R.; Lilley, S. H. (2000). «New Classification and Update on the Quinolone Antibiotics». American Family Physician. 61 (9): 2741–2748. PMID 10821154. Retrieved 8 October 2013.
- Kirsch, Peer (2004). Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. ISBN 978-3-527-30691-6.
- Kissa, Erik (2001). Fluorinated Surfactants and Repellents (2nd ed.). New York: Marcel Dekker. ISBN 978-0-8247-0472-8.
- Kuriakose, A. K.; Margrave, J. L. (1965). «Kinetics of the Reactions of Elemental Fluorine. IV. Fluorination of Graphite». Journal of Physical Chemistry. 69 (8): 2772–2775. doi:10.1021/j100892a049.
- Lagow, R. J. (1970). The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (PDF) (PhD, Rice University, TX). Ann Arbor: UMI.
- Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. (2007). «Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings». Toxicological Sciences. 99 (2): 366–394. doi:10.1093/toxsci/kfm128. PMID 17519394.
- Lee, Stephen; et al. (2014). «Monofluoroacetate-Containing Plants That Are Potentially Toxic to Livestock». Journal of Agricultural and Food Chemistry. ACS Publications. 62 (30): 7345–7354. doi:10.1021/jf500563h. PMID 24724702.
- Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. ISBN 978-1-4020-6972-7.
- Lide, David R. (2004). Handbook of Chemistry and Physics (84th ed.). Boca Raton: CRC Press. ISBN 0-8493-0566-7.
- Lidin, R.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances] (in Russian). Moscow: Khimiya. ISBN 5-7245-1163-0.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. (2002). Environmental Health Criteria 227 (Fluoride). Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. ISBN 92-4-157227-2. Retrieved 14 October 2013.
- Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. (2008). «The Need for Indigenous Fluorspar Production in England». British Geological Survey. Retrieved 13 October 2013.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (6th ed.). Cheltenham: Nelson Thornes. ISBN 0-7487-6420-8.
- Macomber, Roger (1996). Organic chemistry. Vol. 1. Sausalito: University Science Books. ISBN 978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). «Observation concernant une volatilisation remarquable d’une partie de l’espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d’hesperos; laquelle volatilisation a été effectuée au moyen des acides» [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l’Académie royale des sciences et belles-lettres (in French). XXIV: 3–11.
- Martin, John W., ed. (2007). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. ISBN 978-0-08-045127-5.
- Marya, C. M. (2011). A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-216-1.
- Matsui, M. (2006). «Fluorine-containing Dyes». In Kim, Sung-Hoon (ed.). Functional dyes. Orlando: Academic Press. pp. 257–266. ISBN 978-0-12-412490-5.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. (2012). «Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 609–660. doi:10.1002/14356007.b05_471.
- Meyer, Eugene (1977). Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. ISBN 978-0-13-129239-0.
- Miller, M. Michael (2003a). «Fluorspar» (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. pp. 27.1–27.12.
- Miller, M. Michael (2003b). «Mineral Resource of the Month, Fluorspar» (PDF). U.S. Geological Survey. Retrieved 24 October 2013.
- Mitchell, E. Siobhan (2004). Antidepressants. New York: Chelsea House Publishers. ISBN 978-1-4381-0192-7.
- Moeller, T.; Bailar, J. C.; Kleinberg (1980). Chemistry, with Inorganic Qualitative Analysis (3rd ed.). New York: Academic Press. ISBN 0-12-503350-8.
- Moissan, Henri (1886). «Action d’un courant électrique sur l’acide fluorhydrique anhydre». Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French). 102: 1543–1544. Retrieved 9 October 2013.
- McCoy, M. (2007). «SURVEY Market Challenges Dim the Confidence of the World’s Chemical CEOs». Chemical & Engineering News. 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2010). Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. ISBN 978-0-495-39079-4.
- Morrow, S. I.; Perry, D. D.; Cohen, M. S. (1959). «The Formation of Dinitrogen Tetrafluoride in the Reaction of Fluorine and Ammonia». Journal of the American Chemical Society. 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- Müller, Peter (2009). «5.067 Crystal Structure Refinement» (PDF). Cambridge: MIT OpenCourseWare. Retrieved 13 October 2013.
- Murphy, C. D.; Schaffrath, C.; O’Hagan, D. (2003). «Fluorinated Natural Products: The Biosynthesis of Fluoroacetate and 4-Fluorothreonine in Streptomyces cattleya«. Chemosphere. 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. doi:10.1016/S0045-6535(03)00191-7. PMID 12738270.
- Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. (1995). University Chemistry. Vol. I. New Delhi: New Age International. ISBN 978-81-224-0742-6.
- National Health and Medical Research Council (2007). A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results (PDF). Canberra: Australian Government. ISBN 978-1-86496-421-9. Archived from the original (PDF) on 13 January 2012. Retrieved 8 October 2013.
- The National Institute for Occupational Safety and Health (1994). «Fluorine». Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 15 January 2014.
- The National Institute for Occupational Safety and Health (1994). «Chlorine». Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 13 July 2014.
- National Nuclear Data Center. «NuDat 2.1 Database». Brookhaven National Laboratory. Retrieved 25 October 2013.
- National Oceanic and Atmospheric Administration. «UN/NA 1045 (United Nations/North America Fluorine Data Sheet)». Retrieved 15 October 2013.
- Navarrini, Walter; Venturini, Francesco; Tortelli, Vito; Basak, Soubir; Pimparkar, Ketan P.; Adamo, Andrea; Jensen, Klavs F. (2012). «Direct fluorination of carbon monoxide in microreactors». Journal of Fluorine Chemistry. 142: 19–23. doi:10.1016/j.jfluchem.2012.06.006.
- Nelson, Eugene W. (1947). «‘Bad Man’ of The Elements». Popular Mechanics. 88 (2): 106–108, 260.
- Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (2007). «Food Safety: Fluoroquinolone‐ResistantCampylobacterSpecies and the Withdrawal of Fluoroquinolones from Use in Poultry: A Public Health Success Story» (PDF). Clinical Infectious Diseases. 44 (7): 977–980. doi:10.1086/512369. PMID 17342653.
- Nielsen, Forrest H. (2009). «Micronutrients in Parenteral Nutrition: Boron, Silicon, and Fluoride». Gastroenterology. 137 (5): S55–60. doi:10.1053/j.gastro.2009.07.072. PMID 19874950. Retrieved 29 April 2018.
- Norwood, Charles J.; Fohs, F. Julius (1907). Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey.
- Noury, S.; Silvi, B.; Gillespie, R. J. (2002). «Chemical Bonding in Hypervalent Molecules: Is the Octet Rule Relevant?» (PDF). Inorganic Chemistry. 41 (8): 2164–2172. doi:10.1021/ic011003v. PMID 11952370. Retrieved 23 May 2012.
- O’Hagan, D. (2008). «Understanding Organofluorine Chemistry. An Introduction to the C–F Bond». Chemical Society Reviews. 37 (2): 308–319. doi:10.1039/b711844a. PMID 18197347.
- O’Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. (2002). «Biochemistry: Biosynthesis of an Organofluorine Molecule». Nature. 416 (6878): 279. Bibcode:2002Natur.416..279O. doi:10.1038/416279a. PMID 11907567. S2CID 4415511.
- Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. (1998). «Ion and Water Transport Characteristics of Nafion Membranes as Electrolytes». Electrochimica Acta. 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- Okazoe, T. (2009). «Overview on the History of Organofluorine Chemistry from the Viewpoint of Material Industry». Proceedings of the Japan Academy, Series B. 85 (8): 276–289. Bibcode:2009PJAB…85..276O. doi:10.2183/pjab.85.276. PMC 3621566. PMID 19838009.
- Olivares, M.; Uauy, R. (2004). Essential Nutrients in Drinking Water (Draft) (PDF) (Report). World Health Organization (WHO). Archived from the original (PDF) on 19 October 2012. Retrieved 14 October 2013.
- Parente, Luca (2001). «The Development of Synthetic Glucocorticoids». In Goulding, Nicolas J.; Flower, Rod J. (eds.). Glucocorticoids. Basel: Birkhäuser. pp. 35–53. ISBN 978-3-7643-6059-7.
- Partington, J. R. (1923). «The early history of hydrofluoric acid». Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 67 (6): 73–87.
- Patnaik, Pradyot (2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances (3rd ed.). Hoboken: John Wiley & Sons. ISBN 978-0-471-71458-3.
- Pauling, Linus (1960). The Nature of the Chemical Bond (3rd ed.). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0.
- Pauling, L.; Keaveny, I.; Robinson, A. B. (1970). «The Crystal Structure of α-Fluorine». Journal of Solid State Chemistry. 2 (2): 225–227. Bibcode:1970JSSCh…2..225P. doi:10.1016/0022-4596(70)90074-5.
- Perry, Dale L. (2011). Handbook of Inorganic Compounds (2nd ed.). Boca Raton: CRC Press. ISBN 978-1-4398-1461-1.
- Pitzer, K. S. (1975). «Fluorides of Radon and Element 118». Journal of the Chemical Society, Chemical Communications (18): 760b–761. doi:10.1039/C3975000760B.
- Pitzer, Kenneth S., ed. (1993). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. ISBN 978-981-02-1439-5.
- Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (2007). «Community Water Fluoridation and Caries Prevention: A Critical Review» (PDF). Clinical Oral Investigations. 11 (3): 189–193. doi:10.1007/s00784-007-0111-6. PMID 17333303. S2CID 13189520.
- Posner, Stefan (2011). «Perfluorinated Compounds: Occurrence and Uses in Products». In Knepper, Thomas P.; Large, Frank T. (eds.). Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. pp. 25–40. ISBN 978-3-642-21871-2.
- Posner, Stefan; et al. (2013). Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology (PDF). Copenhagen: Nordic Council of Ministers. doi:10.6027/TN2013-542. ISBN 978-92-893-2562-2.
- Preskorn, Sheldon H. (1996). Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. ISBN 978-1-884735-08-0.
- Principe, Lawrence M. (2012). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN 978-0-226-68295-2.
- Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. (2006). «Sodium Fluoroacetate Poisoning». Toxicological Reviews. 25 (4): 213–219. doi:10.2165/00139709-200625040-00002. PMID 17288493. S2CID 29189551.
- PRWeb (28 October 2010). «Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc». prweb.com. Retrieved 24 October 2013.
- PRWeb (23 February 2012). «Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc». prweb.com. Retrieved 24 October 2013.
- PRWeb (7 April 2013). «Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets». prweb.com. Retrieved 24 October 2013.
- Pyykkö, Pekka; Atsumi, Michiko (2009). «Molecular Double-Bond Covalent Radii for Elements Li–E112». Chemistry: A European Journal. 15 (46): 12770–9. doi:10.1002/chem.200901472. PMID 19856342.
- Raghavan, P. S. (1998). Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. ISBN 978-81-7141-418-5.
- Raj, P. Prithvi; Erdine, Serdar (2012). Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. ISBN 978-0-470-67038-5.
- Ramkumar, Jayshree (2012). «Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications». In Banerjee, S.; Tyagi, A. K. (eds.). Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. pp. 549–578. ISBN 978-0-12-385142-0.
- Reddy, D. (2009). «Neurology of Endemic Skeletal Fluorosis». Neurology India. 57 (1): 7–12. doi:10.4103/0028-3886.48793. PMID 19305069.
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. (2004). «On the origin of fluorine in the Milky Way». Monthly Notices of the Royal Astronomical Society. 354 (2): 575–580. arXiv:astro-ph/0410580. Bibcode:2004MNRAS.354..575R. doi:10.1111/j.1365-2966.2004.08215.x. S2CID 12330666.
- Renner, R. (2006). «The Long and the Short of Perfluorinated Replacements». Environmental Science & Technology. 40 (1): 12–13. Bibcode:2006EnST…40…12R. doi:10.1021/es062612a. PMID 16433328.
- Rhoades, David Walter (2008). Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor. ISBN 978-0-549-78540-8.
- Richter, M.; Hahn, O.; Fuchs, R. (2001). «Purple Fluorite: A Little Known Artists’ Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe». Studies in Conservation. 46 (1): 1–13. doi:10.1179/sic.2001.46.1.1. JSTOR 1506878. S2CID 191611885.
- Riedel, Sebastian; Kaupp, Martin (2009). «The highest oxidation states of the transition metal elements». Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- Ripa, L. W. (1993). «A Half-century of Community Water Fluoridation in the United States: Review and Commentary» (PDF). Journal of Public Health Dentistry. 53 (1): 17–44. doi:10.1111/j.1752-7325.1993.tb02666.x. PMID 8474047. Archived from the original (PDF) on 4 March 2009.
- Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. (2006). «Topical Treatment of Experimental Hydrofluoric Acid Skin Burns by 2.5% Calcium Gluconate». Journal of Burn Care & Research. 27 (6): 889–894. doi:10.1097/01.BCR.0000245767.54278.09. PMID 17091088. S2CID 3691306.
- Salager, Jean-Louis (2002). Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. Retrieved 13 October 2013.
- Sandford, Graham (2000). «Organofluorine Chemistry». Philosophical Transactions. 358 (1766): 455–471. Bibcode:2000RSPTA.358..455S. doi:10.1098/rsta.2000.0541. S2CID 202574641.
- Sarkar, S. (2008). «Artificial Blood». Indian Journal of Critical Care Medicine. 12 (3): 140–144. doi:10.4103/0972-5229.43685. PMC 2738310. PMID 19742251.
- Scheele, Carl Wilhelm (1771). «Undersŏkning om fluss-spat och dess syra» [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (in Swedish). 32: 129–138.
- Schimmeyer, S. (2002). «The Search for a Blood Substitute». Illumin. Columbia: University of Southern Carolina. 15 (1). Archived from the original on 2 October 2011. Retrieved 15 October 2013.
- Schlöder, T.; Riedel, S. (2012). «Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2O2]+, [F2Cl2]+, [Cl2O2]+, [F4]+, and [Cl4]+«. RSC Advances. Royal Society of Chemistry. 2 (3): 876–881. Bibcode:2012RSCAd…2..876S. doi:10.1039/C1RA00804H.
- Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian (2012). «Occurrence of Difluorine F2 in Nature-In Situ Proof and Quantification by NMR Spectroscopy». Angewandte Chemie International Edition. 51 (31): 7847–7849. doi:10.1002/anie.201203515. ISSN 1521-3773. PMID 22763992.
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). «Use of Fluorine-18 Fluoro-2-deoxy-D-glucose Positron Emission Tomography in Assessing the Process of Tuberculous Spondylitis» (PDF). Journal of Spinal Disorders. 13 (6): 541–544. doi:10.1097/00002517-200012000-00016. PMID 11132989. Retrieved 8 October 2013.
- Schulze-Makuch, D.; Irwin, L. N. (2008). Life in the Universe: Expectations and Constraints (2nd ed.). Berlin: Springer-Verlag. ISBN 978-3-540-76816-6.
- Schwarcz, Joseph A. (2004). The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life. Toronto: ECW Press. ISBN 1-55022-621-5.
- Senning, A. (2007). Elsevier’s Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. ISBN 978-0-444-52239-9.
- Shaffer, T. H.; Wolfson, M. R.; Clark, L. C. Jr. (1992). «Liquid Ventilation». Pediatric Pulmonology. 14 (2): 102–109. doi:10.1002/ppul.1950140208. PMID 1437347. S2CID 222167378.
- Shin, Richard D.; Silverberg, Mark A. (2013). «Fluoride Toxicity». Medscape. Retrieved 15 October 2013.
- Shriver, Duward; Atkins, Peter (2010). Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. ISBN 978-1-4292-5255-3.
- Shulman, J. D.; Wells, L. M. (1997). «Acute Fluoride Toxicity from Ingesting Home-use Dental Products in Children, Birth to 6 Years of Age». Journal of Public Health Dentistry. 57 (3): 150–158. doi:10.1111/j.1752-7325.1997.tb02966.x. PMID 9383753.
- Siegemund, G. N.; Schwertfeger, W.; Feiring, A.; Smart, B.; Behr, F.; Vogel, H.; McKusick, B. (2000). «Fluorine Compounds, Organic». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 15. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_349.
- Slye, Orville M. (2012). «Fire Extinguishing Agents». In Ullmann, Franz (ed.). Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 15. Weinheim: Wiley-VCH. pp. 1–11. doi:10.1002/14356007.a11_113.pub2. ISBN 978-3527306732.
- Steenland, K.; Fletcher, T.; Savitz, D. A. (2010). «Epidemiologic Evidence on the Health Effects of Perfluorooctanoic Acid (PFOA)». Environmental Health Perspectives. 118 (8): 1100–1108. doi:10.1289/ehp.0901827. PMC 2920088. PMID 20423814.
- Stillman, John Maxson (December 1912). «Basil Valentine, A Seventeenth Century Hoax». Popular Science Monthly. 81. Retrieved 14 October 2013.
- Storer, Frank H. (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis.
- Swinson, Joel (June 2005). «Fluorine – A Vital Element in the Medicine Chest» (PDF). PharmaChem. Pharmaceutical Chemistry: 26–27. Archived from the original (PDF) on 8 February 2012. Retrieved 9 October 2013.
- Taber, Andrew (22 April 1999). «Dying to ride». Salon. Retrieved 18 October 2013.
- Tanner Industries (January 2011). «Anhydrous Ammonia: (MSDS) Material Safety Data Sheet». tannerind.com. Retrieved 24 October 2013.
- Theodoridis, George (2006). «Fluorine-Containing Agrochemicals: An Overview of Recent Developments». In Tressaud, Alain (ed.). Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. pp. 121–176. ISBN 978-0-444-52672-4.
- Toon, Richard (1 September 2011). «The discovery of fluorine». Education in Chemistry. Vol. 48, no. 5. Royal Society of Chemistry. pp. 148–151. ISSN 0013-1350.
- Transparency Market Research (17 May 2013). «Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research». Transparency Market Research Blog. Archived from the original on 22 February 2014. Retrieved 15 October 2013.
- Ullmann, Fritz (2008). Ullmann’s Fibers (2 volumes). Weinheim: Wiley-VCH. ISBN 978-3-527-31772-1.
- United States Environmental Protection Agency (1996). «R.E.D. Facts: Trifluralin» (PDF). Archived from the original (PDF) on 18 October 2013. Retrieved 17 October 2013.
- United States Environmental Protection Agency (2012). «Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA)» (PDF). Archived from the original (PDF) on 29 October 2013. Retrieved 4 November 2013.
- United States Environmental Protection Agency (2013a). «Class I Ozone-depleting Substances». Archived from the original on 10 December 2010. Retrieved 15 October 2013.
- United States Environmental Protection Agency (2013b). «Phaseout of HCFCs (Class II Ozone-Depleting Substances)». Retrieved 15 October 2013.
- Viel, Claude; Goldwhite, Harold (1993). «1906 Nobel Laureate: Henri Moissan, 1852–1907». In Laylin, K. James (ed.). Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. pp. 35–41. ISBN 978-0-8412-2690-6.
- Vigoureux, P. (1961). «The Gyromagnetic Ratio of the Proton». Contemporary Physics. 2 (5): 360–366. Bibcode:1961ConPh…2..360V. doi:10.1080/00107516108205282. S2CID 5092147.
- Villalba, Gara; Ayres, Robert U.; Schroder, Hans (2008). «Accounting for Fluorine: Production, Use, and Loss». Journal of Industrial Ecology. 11: 85–101. doi:10.1162/jiec.2007.1075. S2CID 153740615.
- Walsh, Kenneth A. (2009). Beryllium Chemistry and Processing. Materials Park: ASM International. ISBN 978-0-87170-721-5.
- Walter, P. (2013). «Honeywell Invests $300m in Green Refrigerant». Chemistry World.
- Weeks, M. E. (1932). «The Discovery of the Elements. XVII. The Halogen Family». Journal of Chemical Education. 9 (11): 1915–1939. Bibcode:1932JChEd…9.1915W. doi:10.1021/ed009p1915.
- Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. (2011). «Unnecessary use of Fluoroquinolone Antibiotics in Hospitalized Patients». BMC Infectious Diseases. 11: 187–193. doi:10.1186/1471-2334-11-187. PMC 3145580. PMID 21729289.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Willey, Ronald R. (2007). Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L.; Braker, William (2001). «Fluorine». Matheson Gas Data Book (7th ed.). Parsippany: Matheson Tri-Gas. ISBN 978-0-07-135854-5.
- Yeung, C. A. (2008). «A Systematic Review of the Efficacy and Safety of Fluoridation». Evidence-Based Dentistry. 9 (2): 39–43. doi:10.1038/sj.ebd.6400578. PMID 18584000.
- Young, David A. (1975). Phase Diagrams of the Elements (Report). Lawrence Livermore Laboratory. Retrieved 10 June 2011.
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. (2013). «Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients». Chemosphere. 91 (6): 725–32. Bibcode:2013Chmsp..91..725Z. doi:10.1016/j.chemosphere.2013.02.024. PMID 23498059.
- Zorich, Robert (1991). Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. ISBN 978-0-323-14055-3.
External links[edit]
Media related to Fluorine at Wikimedia Commons
-
Скачать презентацию (0.27 Мб)
-
336 загрузок -
3.0 оценка
Ваша оценка презентации
Оцените презентацию по шкале от 1 до 5 баллов
Комментарии
Добавить свой комментарий
Аннотация к презентации
Смотреть презентацию онлайн с анимацией на тему «Фтор» по химии. Презентация состоит из 14 слайдов. Материал добавлен в 2016 году. Средняя оценка: 3.0 балла из 5.. Возможность скчачать презентацию powerpoint бесплатно и без регистрации. Размер файла 0.27 Мб.
-
Формат
pptx (powerpoint)
-
Количество слайдов
14
-
Слова
-
Конспект
Отсутствует
Содержание
-
Слайд 1
Применение фтора и его соединений
Работа
Ячменёва Дмитрия,
ученика 9 класса «Б» МОУ СОШ № 23 хутора Братского МО Усть-Лабинский район Краснодарского края
Руководитель
Воронцова Татьяна Николаевна,
учитель химии5klass.net
-
Слайд 2
Цели и задачи реферата
Фтор довольно распространен в природе. Процентное содержание его в земной коре приближается к содержанию таких элементов, как азот, сера, хром, марганец и фосфор. И в тоже время соединения этих элементов широко описаны в любой химической литературе, тогда как о фторе и его соединениях даны лишь небольшие справочные данные.
Задачи моего реферата следующие:
Исследовать историю открытия фтора и его распространение в природе.
Описать физические и химические свойства фтора.
Собрать данные о соединениях фтора.
Изучить применение фтора и его соединений. -
Слайд 3
Историческая справка
О существовании элемента, который впоследствии был назван фтором (от греческого «фторос» — разрушение, гибель), догадывались многие химики конца XVIII – начала XIX в., но получить его в чистом виде из-за его необычайной активности долго не удавалось.
Одно из самых интересных соединений фтора – плавиковая кислота HF, была получена в 1771 г. знаменитым шведским химиком К.Шееле, который предположил, что в этой кислоте содержится новый химический элемент.
Но прошло больше ста лет, прежде чем химики выделили наконец этот элемент. Произошло это в 1886 г., первооткрывателем свободного фтора стал французский химик А. Муассан.
-
Слайд 4
Происхождение фтора
Название «фтор», предложенное А.Ампером в 1810г, употребляется только в русском языке, во многих странах применяют название «флюор».
-
Слайд 5
Нахождение в природе
Фтор распространяется в природе довольно широко. Его содержание в земной коре 6,25 .10-2% от общей массы.
Свободный фтор в природе фактически не встречается.
Основная масса фтора распределена по различным горным породам.
Из минералов, содержащих фтор наибольшее значение имеют
плавиковый шпат(флюорит) CaF2,
апатит Ca10 (F,CI)2 (PO4 )6 ,
криолит Na3 AlF6. -
Слайд 6
Физические свойства фтора
Фтор – ядовитый газ. В обычных условиях фтор – газ бледно-желтого цвета, с резким характерным запахом, напоминающим запах хлора и озона, обнаруживаемым даже при следах фтора.
В жидком виде фтор имеет канареечно-жёлтый цвет.
Молекула фтор двухатомна (F2); теплота её диссоциации точно неустановленна и зависимости от метода измерения колеблется от 51 до 73 ккал/моль. -
Слайд 7
Химические свойства фтора
Фтор в своих соединениях бывает только отрицательно одновалентным.
Уже на холоде фтор энергичен: соединяется с бромом, йодом, серой, фосфором, кремнием, большинством металлов, причем эти реакции часто сопровождаются взрывом.
Самое простое средство тушения пожаров – вода – горит во фторе светло-коричневым пламенем.
С органическими веществами фтор образует фторорганические соединения.
-
Слайд 8
Отравление фтором и его соединениями
Острые отравления фтором в производственных условиях наблюдаются крайне редко, лишь при авариях.
При высоких концентрациях фтористого водорода в воздухе, проявляются раздражение глаз и слизистой оболочки гортани и бронхов, слёзотечение, слюнотечение, носовые кровотечения.
На кожу плавиковая кислота действует прижигающее, вызывая образование трудно заживающих язв. Фтористые соединения действуют угнетающе на ферменты энолазу, холинэстеразу и другие, а также вызывают нарушение кальциевого и фосфорного обмена.
Лечение при отравлении соединениями фтора – питьё 0,5 – 1% раствора хлористого кальция с смесью жжёной магнезии, промывание желудка такой же смесью; внутривенное введение 10% раствора хлористого кальция (10мл). -
Слайд 9
Техника безопасности
Для индивидуальной защиты от фтористых соединений применяются резиновые перчатки и обувь, спецодежда, противогазы, противопылевые респираторы и др.
Рабочие, занятые на производстве фтора, плавиковой кислоты, фторорганических соединений, на производстве и применении фтористого бериллия и фторокиси бериллия, подлежат периодическому медицинскому осмотру раз в 6 месяцев, а в некоторых производствах – 1 раз в год.
Дополнительное специальное питание назначается при производстве суперфосфата, криолита, фторпроизводных и фторсодержащих солей. Рекомендуются витамины группы В, аскорбинат кальция, пища, богатая кальцием. -
Слайд 10
Применение
Наибольшее применение получили соединения фториды:
фторид кислорода используют в реактивной технике как наиболее мощные окислители после озона,
плавиковая кислота – в качестве растворителя и для травления стекла,
фтористый борприменяют в жидком виде как окислитель жидкого реактивного топлива, для фторирования соединений урана в атомной промышленности и т. д.,
уран шестифтористый – для выделения радиоактивного изотопа урана в атомной технике -
Слайд 11
Применение
сера шестифтористая –в качестве газа для изоляции высоковольтных установок,
фтористый натрий – для борьбы с вредителями сельскохозяйственных растений,
криолит – при производстве алюминия,
плавиковый шпат широко используется в металлургии и при изготовлении эмалей,
элементарный фтор применяют в жидком виде как окислитель реактивного топлива и для обеззараживания питьевой воды,
фреоныприменяются как хладагенты в холодильных установках. -
Слайд 12
Фтор в организме
Фтор – постоянная составная часть растительных и животных организмов.
При увеличении или уменьшении уровня фтора в воде у пресноводных и наземных животных наблюдается заболевания; например, при содержании фтора в воде, больше 0,00005%, может развиться флюороз — заболевание, сопровождающееся пятнистостью эмали и хрупкостью зубов.
При содержании фтора, не достигающем этого уровня, наступает кариес зубов (разрушение эмали и дентина зубов).
Фтор поступает в живой организм, помимо питьевой воды, с пищевыми продуктами, в которых содержится в среднем около
0,02-0,05 мг % фтора. -
Слайд 13
Получение
Получают фтор электролизом расплава кислого трифторида калия KF· 2HF, так как фтор обладает чрезвычайно большой реакционной способностью.
При переработке природных фосфатов на искусственные удобрения в качестве побочных продуктов получают фтористые соединения, применяемые в жидком виде как окислитель жидкого реактивного топлива, для фторирования соединений урана в атомной промышленности. -
Слайд 14
Заключение
В результате своей работы над темой реферата я познакомился со свойствами фтора и его соединений в процессе изучения различной литературы.
Многообразие неорганических и органических соединений фтора и широкий спектр их применения в повседневной жизни были для меня открытием.
Конечно, очень жаль, что моя работа ограничивается чисто теоретическим содержанием, но я надеюсь, что эти материалы будут интересны и другим ребятам, которые будут изучать химию.
Посмотреть все слайды
Сообщить об ошибке
Спасибо, что оценили презентацию.
Мы будем благодарны если вы поможете сделать сайт лучше и оставите отзыв или предложение по улучшению.
Добавить отзыв о сайте
|
Разработчик сайта, Мухитова Влада, приветствует жюри конкурса «Лучший образовательный сайт — 2012»
Периодическая система элементов Менделеева — Фтор
Самый активный, самый электроотрицательный, На полюсе периодической системы Фтор — элемент из семейства галогенов, в Число присоединенных электронов показывает, Стремление к заполнению внешнего электронного Удержать фтор от реакции очень Влияние размера атома галогена на устойчивость Таблица 1
Очевидно, что чем больше Атомы фтора обладают очень высокой Не только вода, но и другие обычно негорючие Поэтому не удивительно само название фтора. В Фтор или флюор? Фтор — разрушающий — удивительно подходящее Это название больше подходит не к фтору, а к Это название настолько укоренилось в умах Жертвы?—Нет, герои Первое упоминание о флюоре относится к XV веку. В начале XVIII века была открыта плавиковая Сегодня мы знаем, что фтор очень токсичен, что Более удачливыми оказались А. Лавуазье, М. В 1834 году Фарадею показалось, что ему, наконец, Неудачи преследовали ученых, однако, Были на этом пути и удачи. Фреми, пытаясь с 26 июня 1886 года французский О своем открытии Муассан сообщил Парижской Муассан тщательно подготовился к проведению Но Муассану удалось найти причину. Оказалось, Применение в первом опыте фтористого водорода И все-таки удача определенно сопутствовала Первые граммы фтора Муассан получил в Платиновый сосуд Муассан заменил медным. Электролиз до сих пор остается практически Фтор и многие его соединения представляют не Гидрид фтора и… вода Что общего может быть у всеразрушающего фтора и Известны гидриды всех галогенов. Их свойства Одно из природных соединений фтора — минерал В одном из рассказов известного На Земле фтористый водород служит другим целям. Нюрнбергский художник Швангард еще в 1670 году Достаточно сказать, что менее чем через Стекольная, пищевая, нефтяная, атомная, Искусственное добавление фтора к воде в тех Во многих местах построены установки для Особенно эффективен этот способ лечения Существует предположение о том, что фтор Фтор находит широкое применение при синтезе Некоторые фторорганические препараты — Фтор и жизнь—именно этот раздел химии фтора И лед и пламень Как приятно бывает в жаркий летний день достать В большинстве холодильников — и промышленных, Фреоны получаются при замене атомов водорода в Простейший углеводород метан — СН4. Если все В домашних Холодильниках обычно работает Фреоны исключительно устойчивы, химически Сейчас известны тысячи фторорганических На примере фреонов мы могли наблюдать, как фтор Сравните эти цифры: температура Не случайно авторов научно-фантастических Но у фтора, как составной части ракетного Некоторые из этих соединений по своим Среди фторгалоидных соединений наиболее Из других фтористых соединений, обладающих Огромный интерес к фторидам Несомненно, что столь широкое развитие Дальнейшее развитие химии коррозионных Фтор и будущее Контуры будущего. Ученым-химикам они рисуются в боящихся ни воды, ни огня, ни резких ударов, ни И везде нужен фтор! Не случайно в составленном |
Ответ:
Правильное написание слова — фтор
Ударение и произношение — фтор
Значение слова -химический элемент, ядовитый бесцветный газ с едким запахом
Выберите, на какой слог падает ударение в слове — КАТАЛОГ?
Слово состоит из букв:
Ф,
Т,
О,
Р,
Похожие слова:
фитофтора
фторидный
фтористый
фторопласт
фторопластовый
фторохлористый
Рифма к слову фтор
оратор, ритор, оператор, простор, император, аудитор, ефрейтор, берейтор, доктор, губернатор, сенатор, архитектор, администратор, форейтор, импэратор, договор, собор, подбор, говор, напор, купор, коридор, колидор, упор, перебор, заговор, сговор, азор, майор, раздор, укор, тенор, вздор, гор, позор, топор, вор, сбор, свор, набор, узор, профессор, пор, рессор, выговор, двор, спор, разговор, бугор, выбор, приговор, шпор, дюпор, федор, уговор, обзор, кор, отпор, капор, прибор, забор, хведор
Толкование слова. Правильное произношение слова. Значение слова.
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
Применение метода МО для молекулы F2
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К);
- β-фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3, и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3.
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм.
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Основная статья: Изотопы фтора
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
-
- 2F2 + 2H2O → 4HF↑ + O2↑
- 12F2 + 11H2O → 19HF↑ + H2O2 + HOF ↑ + O2↑ + O3↑ + OF2 ↑ + O2F2↑
-
- Pt + 2F2 →350−400oC PtF4
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
-
- 2CoF3 → 2CoF2 + F2↑
-
- 2MnF4 → 2MnF3 + F2↑
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
-
- 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Ракетная техника
Основная статья: Соединения фтора в ракетной технике
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Основная статья: Соединения фтора в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|

Жидкий фтор (при экстремально низких температурах ) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фтор | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аллотропы | альфа, бета | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Появление | газ: очень бледно-желтая жидкость: ярко-желтое твердое вещество: альфа непрозрачно, бета прозрачно |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (F) | 18.998 403 163 (6) [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фтор в периодической таблице | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 17 (галогены) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ He ] 2s 2 2p 5 [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза на СТП | газ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | (F 2 ) 53,48 К (-219,67 ° С, -363,41 ° F) [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | (F 2 ) 85,03 К (-188,11 ° C, -306,60 ° F) [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при СТП) | 1,696 г / л [4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при bp ) | 1,505 г / см 3 [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тройная точка | 53,48 К, 90 кПа [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 144,41 К, 5,1724 МПа [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 6,51 кДж / моль [4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | C p : 31 Дж / (моль · K) [5] (при 21,1 ° C) C v : 23 Дж / (моль · K) [5] (при 21,1 ° C) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление газа
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | −1 , 0 [6] (окисляет кислород) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 3,98 [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 64 вечера [8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 135 часов [9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Спектральные линии фтора |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прочие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | изначальный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | кубический
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 0,02591 Вт / (м⋅К) [10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный (−1,2 × 10 −4 ) [11] [12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Количество CAS | 7782-41-4 [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Именование | в честь минерала флюорита , названного в честь латинского fluo (течь, при плавке) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Андре-Мари Ампер (1810) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Первая изоляция | Анри Муассан [2] (26 июня 1886 г.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Названный |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы фтора [13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| использованная литература |
Фтор — это химический элемент с символом F и атомным номером 9. Это самый легкий галоген, существующий в стандартных условиях как высокотоксичный двухатомный газ бледно-желтого цвета . Как наиболее электроотрицательный элемент, он чрезвычайно реактивен, поскольку реагирует со всеми другими элементами, кроме аргона , неона и гелия .
Среди элементов фтор занимает 24- е место по общему содержанию и 13-е по распространенности на суше . Флюорит , первичный минеральный источник фтора, давший этому элементу название, был впервые описан в 1529 году; поскольку он добавлялся в металлические руды для снижения их температуры плавления при плавлении , латинский глагол fluo, означающий «поток», дал минералу свое название. Предложенный в качестве элемента в 1810 году фтор оказалось трудным и опасным для отделения от его соединений, и несколько первых экспериментаторов погибли или получили травмы в результате своих попыток. Только в 1886 году французский химик Анри Муассан выделил элементарный фтор с помощью низкотемпературного электролиза., процесс, который до сих пор используется в современном производстве. Промышленное производство газообразного фтора для обогащения урана , его крупнейшее применение, началось во время Манхэттенского проекта во время Второй мировой войны .
Из-за дороговизны очистки чистого фтора в большинстве коммерческих применений используются соединения фтора, при этом примерно половина добываемого флюорита используется в сталеплавильном производстве . Остальной флюорит превращается в коррозионный фтористый водород на пути к различным органическим фторидам или в криолит , который играет ключевую роль в рафинировании алюминия . Молекулы, содержащие связь углерод-фтор, часто обладают очень высокой химической и термической стабильностью; в основном они используются в качестве хладагентов , электрической изоляции и кухонной посуды, последнее — в качестве ПТФЭ (тефлона). Фармацевтические препараты, такие как аторвастатин и флуоксетин, содержат связи C-F. ВИон фтора из растворенных фторидных солей препятствует развитию кариеса и поэтому находит применение в зубной пасте и фторировании воды . Мировые продажи фторсодержащих химикатов составляют более 15 миллиардов долларов США в год.
Фторуглеродные газы, как правило, представляют собой парниковые газы с потенциалом глобального потепления в 100–23 500 раз больше, чем у углекислого газа , причем SF 6 имеет самый высокий потенциал глобального потепления среди всех известных веществ. Фторорганические соединения часто сохраняются в окружающей среде из-за прочности связи углерод-фтор . Фтор не имеет известной метаболической роли у млекопитающих; Некоторые растения и морские губки синтезируют фторорганические яды (чаще всего монофторацетаты ), которые помогают сдерживать хищников. [14]
Характеристики
Электронная конфигурация
Атомы фтора имеют девять электронов, на один меньше, чем у неона , и электронную конфигурацию 1s 2 2s 2 2p 5 : два электрона в заполненной внутренней оболочке и семь во внешней оболочке, требующей заполнения еще одного. Внешние электроны неэффективны при ядерной защите и испытывают высокий эффективный ядерный заряд 9 — 2 = 7; это влияет на физические свойства атома. [2]
Первая энергия ионизации фтора занимает третье место среди всех элементов после гелия и неона [15], что затрудняет удаление электронов из нейтральных атомов фтора. Она также имеет высокое сродство к электрону , второй только хлору , [16] и , как правило , чтобы захватить электрон , чтобы стать изоэлектронными с благородным газом неоном; [2] он имеет самую высокую электроотрицательность из всех элементов. [17] атомы фтора имеют малый радиус ковалентной около 60 пм , аналогичных тем , которые его периода соседей кислорода и неона. [18][19] [примечание 1]
Реакционная способность
| Внешнее видео |
|---|
Энергия связи в difluorine значительно ниже , чем у любого Cl
2или Br
2и аналогично легко расщепляемой пероксидной связи; это, наряду с высокой электроотрицательностью, объясняет легкую диссоциацию фтора, высокую реакционную способность и прочные связи с атомами, не содержащими фтора. [20] [21] И наоборот, связи с другими атомами очень сильны из-за высокой электроотрицательности фтора. Инертные вещества, такие как порошковая сталь, осколки стекла и волокна асбеста, быстро вступают в реакцию с холодным газообразным фтором; дерево и вода самопроизвольно воспламеняются под струей фтора. [4] [22]
Реакции элементарного фтора с металлами требуют различных условий. Щелочные металлы вызывают взрывы, а щелочноземельные металлы проявляют большую активность в массе; Чтобы предотвратить пассивацию из-за образования слоев фторида металлов, большинство других металлов, таких как алюминий и железо, должны быть измельчены [20], а для благородных металлов требуется чистый газообразный фтор при температуре 300–450 ° C (575–850 ° F). [23] Некоторые твердые неметаллы (сера, фосфор) активно вступают в реакцию с жидким фтором. [24] Сероводород [24] и диоксид серы [25] легко соединяются с фтором, последний иногда взрывоопасен; серная кислотапроявляет гораздо меньшую активность, требует повышенных температур. [26]
Водород , как и некоторые щелочные металлы, взрывоопасно реагирует с фтором. [27] Углерод , как ламповая сажа , реагирует при комнатной температуре с образованием фторметана . Графит соединяется с фтором при температуре выше 400 ° C (750 ° F) с образованием нестехиометрического монофторида углерода ; при более высоких температурах образуются газообразные фторуглероды , иногда со взрывами. [28] Диоксид углерода и монооксид углерода реагируют при комнатной температуре или чуть выше, [29] тогда как парафины и другие органические химические вещества вызывают сильные реакции: [30] даже полностью замещенные галогеналканы, такие какчетыреххлористый углерод , обычно негорючий, может взорваться. [31] Хотя трифторид азота стабилен, азот требует электрического разряда при повышенных температурах для реакции с фтором из-за очень сильной тройной связи в элементарном азоте; [32] аммиак может взрываться. [33] [34] Кислород не соединяется с фтором в условиях окружающей среды, но его можно заставить реагировать с помощью электрического разряда при низких температурах и давлениях; продукты имеют тенденцию распадаться на составляющие при нагревании. [35] [36] [37] Более тяжелые галогены [38]легко реагирует с фтором, как и благородный газ радон ; [39] из других благородных газов реагируют только ксенон и криптон , и только при определенных условиях. [40]
Фазы
Кристаллическая структура β-фтора. Сферы указывают F
2молекулы, которые могут принимать любой угол. Остальные молекулы прижаты к плоскостям.
Анимация, показывающая кристаллическую структуру бета-фтора. Молекулы на гранях элементарной ячейки имеют вращение, ограниченное плоскостью.
При комнатной температуре, фтор представляет собой газ из двухатомных молекул , [4] бледно — желтого цвета в чистом виде (иногда называют желто-зеленым цветом). [41] Он имеет характерный галогеноподобный резкий и едкий запах, обнаруживаемый при концентрации 20 частей на миллиард . [42] Фтор конденсируется в ярко-желтую жидкость при температуре –188 ° C (–306 ° F), температуре перехода, аналогичной температуре кислорода и азота. [43]
Фтор имеет две твердые формы: α- и β-фтор. Последний кристаллизуется при -220 ° C (-364 ° F) и является прозрачным и мягким, с такой же неупорядоченной кубической структурой свежеокристаллизованного твердого кислорода [43] [примечание 2], в отличие от орторомбических систем других твердых галогенов. [47] [48] Дальнейшее охлаждение до -228 ° C (-378 ° F) вызывает фазовый переход в непрозрачный и твердый α-фтор, который имеет моноклинную структуру с плотными, расположенными под углом слоями молекул. Переход от β- к α-фтору более экзотермичен, чем конденсация фтора, и может быть резким. [47] [48] [примечание 3]
Изотопы
В естественных условиях в изобилии встречается только один изотоп фтора — стабильный изотоп.19
F . [49] Обладает высоким магнитным коэффициентом [примечание 4] и исключительной чувствительностью к магнитным полям; поскольку это также единственный стабильный изотоп , он используется в магнитно-резонансной томографии . [51] Синтезировано семнадцать радиоизотопов с массовыми числами от 14 до 31, из которых18
F является наиболее стабильным с периодом полураспада 109,77 минут. Другие радиоизотопы имеют период полураспада менее 70 секунд; большая часть распадается менее чем за полсекунды. [52] Изотопы17
F и18
F подвергаются β + -распаду и захвату электронов , более легкие изотопы распадаются с испусканием протонов , а те, которые тяжелее19
F проходят бета — распад (самых тяжелых с задержкой эмиссии нейтронов ). [52] [53] Известны два метастабильных изомера фтора,18м
F , с периодом полураспада 162 (7) наносекунды, и26м
F с периодом полураспада 2,2 (1) миллисекунды. [54]
Происшествие
Вселенная
| Атомный номер |
Элемент |
Относительная сумма |
|---|---|---|
| 6 |
Углерод |
4800 |
| 7 |
Азот |
1,500 |
| 8 |
Кислород |
8 800 |
| 9 |
Фтор |
1 |
| 10 |
Неон |
1,400 |
| 11 |
Натрий |
24 |
| 12 |
Магний |
430 |
Среди легких элементов, обилие значение фтора в 400 млрд — (частей на миллиард) — среди 24 — элементов во Вселенной — это исключительно низкий: другие элементы от углерода до магния двадцать или более раз , как общие. [56] Это связано с тем, что процессы звездного нуклеосинтеза обходят фтор, и любые атомы фтора, созданные иным образом, имеют высокое ядерное сечение , что позволяет в дальнейшем синтезировать водород или гелий с образованием кислорода или неона соответственно. [56] [57]
Помимо этого временного существования, присутствию фтора было предложено три объяснения: [56] [58]
- во время сверхновых типа II бомбардировка атомов неона нейтрино может трансмутировать их во фтор;
- солнечный ветер звезд Вольфа – Райе мог уносить фтор от любых атомов водорода или гелия; или
- фтор подтверждается конвекционными токами, возникающими в результате слияния в асимптотических звездах ветви гигантов .
Земля
Фтор является тринадцатым по распространенности элементом в земной коре с концентрацией 600–700 частей на миллион (частей на миллион) по массе. [59] Хотя считается, что элементарный фтор не встречается в природе, было показано, что он присутствует в виде окклюзии в антозоните, разновидности флюорита. [60] Большая часть фтора существует в виде фторидсодержащих минералов. Флюорит , фторапатит и криолит являются наиболее промышленно значимыми. [59] [61] Флюорит, также известный как плавиковый шпат ( CaF
2), широко распространенный во всем мире, является основным источником фтора и, следовательно, фтора. Китай и Мексика — основные поставщики. [61] [62] [63] [64] [65] Фторапатит (Ca 5 (PO 4 ) 3 F), который содержит большую часть фторидов в мире, является непреднамеренным источником фторида в качестве побочного продукта при производстве удобрений. [61] Криолит ( Na
3AlF
6), используемый в производстве алюминия, является наиболее богатым фтором минералом. Экономически жизнеспособные природные источники криолита исчерпаны, и в настоящее время большая их часть синтезируется в промышленных масштабах. [61]
-
Флюорит: розовая шаровидная масса с кристаллическими гранями.
-
Фторапатит: длинный призматический кристалл без блеска, выходящий под углом из агрегатоподобной породы.
-
Криолит: контур в форме параллелограмма с двухатомными молекулами, расположенными в два слоя.
Другие минералы, такие как топаз, содержат фтор. Фториды, в отличие от других галогенидов, нерастворимы и не встречаются в коммерчески выгодных концентрациях в соленых водах. [61] Следовые количества фторорганических соединений неопределенного происхождения были обнаружены при извержениях вулканов и геотермальных источниках. [66] Существование газообразного фтора в кристаллах, о чем свидетельствует запах измельченного антозонита , является спорным; [67] [60] исследование 2012 г. сообщило о присутствии 0,04% F
2по весу в антозоните, приписывая эти включения радиации из-за присутствия крошечных количеств урана . [60]
История
Ранние открытия
В 1529 году Георгиус Агрикола описал флюорит как добавку, используемую для понижения температуры плавления металлов во время плавки . [68] [69] [примечание 5] Он написал латинское слово fluorēs ( флюор , поток) для обозначения флюоритовых пород. Позже название превратилось в плавиковый шпат (до сих пор широко используемый), а затем в флюорит . [62] [73] [74] Позже было установлено, что флюорит представляет собой дифторид кальция . [75]
Плавиковая кислота использовалась при травлении стекла с 1720 года. [примечание 6] Андреас Сигизмунд Маргграф впервые охарактеризовал его в 1764 году, когда он нагрел флюорит с серной кислотой, и полученный раствор разъел его стеклянный сосуд. [77] [78] Шведский химик Карл Вильгельм Шееле повторил эксперимент в 1771 году и назвал кислый продукт fluss-spats-syran (плавиковая кислота). [78] [79] В 1810 году французский физик Андре-Мари Ампер предположил, что водород и элемент, аналогичный хлору, составляют плавиковую кислоту. [80] Он также предложил в письме сэру Хэмфри Дэвиот 26 августа 1812 года, что это неизвестное тогда вещество может быть названо фтором от плавиковой кислоты и суффикса -ine для других галогенов. [81] [82] Это слово, часто с модификациями, используется в большинстве европейских языков; однако греческий, русский и некоторые другие, следуя более позднему предложению Ампера, используют имя ftor или производные от греческого φθόριος ( phthorios , деструктивный). [83] Новое латинское название fluorum дало элементу его нынешний символ F ; Fl использовался в ранних работах. [84] [примечание 7]
Изоляция
Чертеж аппарата Муассана 1887 г.
Первоначальные исследования фтора были настолько опасны, что несколько экспериментаторов 19-го века были сочтены «мучениками фтора» после несчастий с плавиковой кислотой. [примечание 8] Выделение элементарного фтора затруднялось из-за чрезвычайной коррозионной активности как самого элементарного фтора, так и фтороводорода, а также из-за отсутствия простого и подходящего электролита . [75] [85] Эдмон Фреми предположил, что электролиз чистого фтористого водорода для получения фтора возможен, и разработал метод получения безводных образцов из подкисленного бифторида калия ; вместо этого он обнаружил, что образующийся (сухой) фтористый водород не проводит электричество. [75][85] [86] Бывший ученик Фреми, Анри Муассан , проявил упорство и после долгих проб и ошибок обнаружил, что смесь бифторида калия и сухого фтористого водорода является проводником, обеспечивающим электролиз. Чтобы предотвратить быструю коррозию платины в своих электрохимических ячейках , он охладил реакцию до чрезвычайно низких температур в специальной ванне и выковал ячейки из более прочной смеси платины и иридия , а также использовал флюоритовые пробки. [85] [87] В 1886 году, после 74 лет усилий многих химиков, Муассан выделил элементарный фтор. [86] [88]
В 1906 году, за два месяца до его смерти, Муассан получил Нобелевскую премию по химии , [89] со следующей цитатой: [85]
[В] признание великих заслуг, оказанных им в его исследовании и выделении элемента фтора … Весь мир восхищался великим экспериментальным мастерством, с которым вы изучили этого дикого зверя среди элементов. [примечание 9]
Более позднее использование
Frigidaire подразделение General Motors (GM) экспериментировал с хлорфторуглеродов хладагенты в конце 1920 — х годов, и Kinetic Chemicals была создана как совместное предприятие между GM и DuPont в 1930 году в надежде на рынок фреона-12 ( CCl
2F
2) как один из таких хладагентов . Он заменил более ранние и более токсичные соединения, повысил спрос на кухонные холодильники и стал прибыльным; к 1949 году DuPont выкупила Kinetic и начала продавать несколько других фреоновых соединений. [78] [90] [91] [92] Политетрафторэтилен (тефлон) был случайно обнаружен в 1938 году Роем Дж. Планкеттом во время работы над хладагентами в Kinetic, а его превосходная химическая и термическая стойкость позволила ускорить его коммерциализацию и массовое производство к 1941 году. . [78] [90] [91]
Крупномасштабное производство элементарного фтора началось во время Второй мировой войны. Германия использовала высокотемпературный электролиз для производства тонн запланированного зажигательного трифторида хлора [93], а Манхэттенский проект использовал огромные количества для производства гексафторида урана для обогащения урана. Поскольку УФ
6столь же агрессивен, как фтор, газодиффузионным установкам требуются специальные материалы: никель для мембран, фторполимеры для уплотнений и жидкие фторуглероды в качестве охлаждающих и смазочных материалов. Эта быстроразвивающаяся ядерная промышленность позже стала стимулом послевоенного развития фторхимии. [94]
Соединения
У фтора богатый химический состав, охватывающий органические и неорганические домены. Он соединяется с металлами, неметаллами, металлоидами и большинством благородных газов [95] и почти всегда имеет степень окисления -1. [примечание 10] Высокое сродство фтора к электрону приводит к предпочтению ионной связи ; когда он образует ковалентные связи , они полярные и почти всегда одиночные . [98] [99] [примечание 11]
Металлы
Щелочные металлы образуют ионные и хорошо растворимые монофториды ; они имеют кубическое расположение хлорида натрия и аналогичных хлоридов. [100] [101] Дифториды щелочноземельных металлов обладают прочными ионными связями, но нерастворимы в воде [84], за исключением дифторида бериллия , который также обладает некоторыми ковалентными свойствами и имеет структуру, подобную кварцу . [102] Редкоземельные элементы и многие другие металлы образуют в основном ионные трифториды . [103] [104] [105]
Ковалентная связь в первую очередь проявляется в тетрафторидах : циркония , гафния [106] [107] и некоторых актинидов [108] ионные с высокими температурами плавления [109] [примечание 12], а у титана , [112] ванадия , [113] и ниобий являются полимерными [114], плавящимися или разлагающимися при температуре не более 350 ° C (660 ° F). [115] Пентафториды продолжают эту тенденцию со своими линейными полимерами и олигомерными комплексами. [116] [117][118] Известнотринадцать гексафторидов металлов, [примечание 13] все октаэдрические, и в основном это летучие твердые вещества, но для жидкого MoF
6и ReF
6, и газообразный WF
6. [119] [120] [121] Гептафторид рения , единственный охарактеризованный гептафторид металла , представляет собой легкоплавкое молекулярное твердое вещество с пентагональной бипирамидальной молекулярной геометрией . [122] Фториды металлов с большим количеством атомов фтора особенно реактивны. [123]
Водород
Температуры кипения галогенидов и халькогенидов, демонстрирующие необычно высокие значения для фтороводорода и воды.
Водород и фтор объединяются, образуя фтористый водород, в котором отдельные молекулы образуют кластеры за счет водородных связей, больше напоминающих воду, чем хлористый водород . [124] [125] [126] Он кипит при гораздо более высокой температуре, чем более тяжелые галогениды водорода, и, в отличие от них, смешивается с водой. [127] Фтористый водород легко гидратируется при контакте с водой с образованием водного фтороводорода, также известного как фтористоводородная кислота. В отличие от других галогеноводородных кислот, которые являются сильными , фтористоводородная кислота является слабой кислотой при низких концентрациях. [128] [примечание 14] Однако он может разрушать стекло, чего не могут сделать другие кислоты.[130]
Другие реактивные неметаллы
Трифторид хлора , коррозионный потенциал которого вызывает воспламенение асбеста, бетона, песка и других антипиренов [131]
Бинарные фториды металлоидов и неметаллов с p-блоком обычно ковалентны и летучие с различной реакционной способностью. Неметаллы периода 3 и более тяжелые могут образовывать гипервалентные фториды. [132]
Трифторид бора плоский и имеет неполный октет. Он действует как кислота Льюиса и соединяется с основаниями Льюиса, такими как аммиак, с образованием аддуктов . [133] Тетрафторид углерода является тетраэдрическим и инертным; [примечание 15] его аналоги группы , кремний и тетрафторид германия, также являются тетраэдрическими [134], но ведут себя как кислоты Льюиса. [135] [136] В подгруппа азота образуют трифторидов , что увеличение реакционной способности и основности с более высокой молекулярной массой, хотя трифторида азота , резистов гидролиза и не является основным. [137]Пентафториды фосфора, мышьяка и сурьмы более реакционноспособны, чем их соответствующие трифториды, при этом пентафторид сурьмы является самой сильной из известных нейтральных кислот Льюиса. [116] [138] [139]
У халькогенов есть различные фториды: о нестабильных дифторидах сообщалось для кислорода (единственное известное соединение с кислородом в степени окисления +2), серы и селена; тетрафториды и гексафториды существуют для серы, селена и теллура. Последние стабилизируются большим количеством атомов фтора и более легкими центральными атомами, поэтому гексафторид серы особенно инертен. [140] [141] Хлор, бром и йод могут образовывать моно-, три- и пентафториды, но только гептафторид йода охарактеризован среди возможных межгалогенных гептафторидов. [142]Многие из них являются мощными источниками атомов фтора, и промышленное применение трифторида хлора требует мер предосторожности, аналогичных тем, которые используются при использовании фтора. [143] [144]
Благородные газы
Эти кристаллы тетрафторида ксенона были сфотографированы в 1962 году. Синтез этого соединения, как и гексафтороплатината ксенона, удивил многих химиков. [145]
Благородные газы , имеющие полные электронные оболочки, не вступали в реакцию с другими элементами до 1962 года, когда Нил Бартлетт сообщил о синтезе гексафтороплатината ксенона ; С тех пор были выделены [146] дифторид , тетрафторид , гексафторид и множественные оксифториды ксенона . [147] Среди других благородных газов криптон образует дифторид , [148] а радон и фтор образуют твердое вещество, предположительно дифторид радона . [149] [150]Бинарные фториды легких благородных газов исключительно нестабильны: аргон и фтористый водород объединяются в экстремальных условиях с образованием фторгидрида аргона . [40] Гелий и неон не содержат долгоживущих фторидов [151], а фторид неона никогда не наблюдался; [152] Фторгидрид гелия был обнаружен за миллисекунды при высоких давлениях и низких температурах. [151]
Органические соединения
Химическая структура нафиона , фторполимера, используемого в топливных элементах и многих других областях [153]
Углерод-фтор связь является органической химии «с сильным, [154] и дает устойчивость к organofluorines. [155] В природе его практически не существует, но он используется в искусственных соединениях. Исследования в этой области обычно проводятся с помощью коммерческих приложений; [156] вовлеченные соединения разнообразны и отражают сложность, присущую органической химии. [90]
Дискретные молекулы
Замена атомов водорода в алкане на все большее количество атомов фтора постепенно изменяет несколько свойств: точки плавления и кипения снижаются, плотность увеличивается, растворимость в углеводородах уменьшается, а общая стабильность увеличивается. Перфторуглероды [примечание 16], в которых все атомы водорода замещены, нерастворимы в большинстве органических растворителей, реагируя в условиях окружающей среды только с натрием в жидком аммиаке. [157]
Термин перфторированное соединение используется для обозначения того, что в противном случае было бы перфторуглеродом, если бы не присутствие функциональной группы , [158] [примечание 17] часто карбоновой кислоты . Эти соединения имеют много общих свойств с перфторуглеродами , такие как стабильность и гидрофобность , [160] в то время как функциональная группа увеличивает их реакционная способность , что позволяет им придерживаться поверхностей или действовать в качестве поверхностно -активных веществ ; [161] Фторсодержащие ПАВ , в частности, могут снизить поверхностное натяжение воды в большей степени, чем их аналоги на углеводородной основе. Фтортеломеры, которые имеют некоторые нефторированные атомы углерода рядом с функциональной группой, также считаются перфторированными. [160]
Полимеры
Полимеры демонстрируют такое же повышение стабильности, которое дает замещение фтором (водорода) в дискретных молекулах; их температуры плавления обычно также увеличиваются. [162] Политетрафторэтилен (ПТФЭ), простейший фторполимер и перфторированный аналог полиэтилена со структурной единицей — CF
2-, демонстрирует это изменение, как и ожидалось, но его очень высокая температура плавления затрудняет формование. [163] Различные производные ПТФЭ менее устойчивы к температуре, но их легче формовать: фторированный этиленпропилен заменяет некоторые атомы фтора трифторметильными группами, перфторалкоксиалканы делают то же самое с трифторметоксигруппами , [163] и Нафион содержит боковые цепи перфторэфира, закрытые группами сульфоновой кислоты. . [164] [165] Другие фторполимеры сохраняют некоторые атомы водорода; поливинилиденфторид имеет половину атомов фтора, чем ПТФЭ, иполивинилфторид имеет четверть, но оба ведут себя так же, как перфторированные полимеры. [166]
Производство
Элементарный фтор и практически все соединения фтора производятся из фтороводорода или его водных растворов, плавиковой кислоты . Фтористый водород образуется в печах с помощью эндотермической реакции из флюорита (CaF 2 ) с серной кислотой: [167]
- CaF 2 + H 2 SO 4 → 2 HF (г) + CaSO 4
Затем газообразный HF можно абсорбировать водой или сжижать. [168]
Около 20% произведенного HF является побочным продуктом производства удобрений, в результате которого образуется гексафторкремниевая кислота (H 2 SiF 6 ), которая может разлагаться с выделением HF термически и путем гидролиза:
- H 2 SiF 6 → 2 HF + SiF 4
- SiF 4 + 2 H 2 O → 4 HF + SiO 2
Промышленные маршруты к F 2
Метод Муассан в используется для производства промышленных количеств фтора, посредством электролиза фторида калия / фтористого водорода смеси: водород и фторид — ионов уменьшаются и окисляется на стальной контейнер катода и углеродного блока анода , при 8-12 вольт, чтобы генерировать водород и фтор соответственно. [63] [169] Повышенные температуры, KF • 2HF плавится при 70 ° C (158 ° F) и подвергается электролизу при 70–130 ° C (158–266 ° F). KF, который действует как катализатор, очень важен, поскольку чистый HF не может быть подвергнут электролизу. [78] [170] [171]Фтор можно хранить в стальных баллонах с пассивированными внутренними поверхностями при температуре ниже 200 ° C (392 ° F); в противном случае можно использовать никель. [78] [172] Регулятор клапаны и трубопроводы выполнены из никеля, причем последний , возможно , с помощью монель вместо этого. [173] Необходимо проводить частую пассивацию, строго исключая попадание воды и жиров. В лаборатории стеклянная посуда может содержать газообразный фтор при низком давлении и в безводных условиях; [173] некоторые источники вместо этого рекомендуют системы никель-монель-ПТФЭ. [174]
Лабораторные маршруты
Готовясь к конференции 1986 года, посвященной столетию достижений Муассана, Карл О. Кристе рассуждал, что химическое образование фтора должно быть возможным, поскольку у некоторых анионов фторида металлов нет стабильных нейтральных аналогов; их подкисление потенциально может вызвать окисление. Он разработал метод, который выделяет фтор с высоким выходом и атмосферным давлением: [175]
- 2 KMnO 4 + 2 KF + 10 HF + 3 H 2 O 2 → 2 K 2 MnF 6 + 8 H 2 O + 3 O 2 ↑
- 2 К 2 MnF 6 + 4 SbF 5 → 4 KSbF 6 + 2 MnF 3 + F 2 ↑
Позднее Кристе прокомментировал, что реагенты «были известны более 100 лет, и даже Муассан мог придумать эту схему». [176] Еще в 2008 году в некоторых источниках утверждалось, что фтор слишком реактивен для какой-либо химической изоляции. [177]
Промышленное применение
Добыча флюорита, обеспечивающая наибольшее количество фтора в мире, достигла своего пика в 1989 году, когда было добыто 5,6 миллиона метрических тонн руды. Ограничения по хлорфторуглеродам снизили этот показатель до 3,6 млн. Тонн в 1994 году; производство с тех пор увеличивается. В 2003 году было получено около 4,5 миллионов тонн руды и выручка в размере 550 миллионов долларов США; более поздние отчеты оценили глобальные продажи фторсодержащих химикатов в 2011 году в 15 миллиардов долларов и прогнозировали производственные показатели в 2016–2018 годах от 3,5 до 5,9 миллионов тонн, а выручку — не менее 20 миллиардов долларов. [78] [178] [179] [180] [181] Пенная флотацияразделяет добытый флюорит на два основных металлургических сорта в равных пропорциях: метшпат с чистотой 60–85% почти весь используется при выплавке чугуна, тогда как кислотный шпат с чистотой 97% в основном превращается в ключевой промышленный промежуточный фтористый водород. [63] [78] [182]
Интерактивная диаграмма фторхимической промышленности по массовым расходам
SF
6 трансформаторы на железной дороге
Ежегодно производится не менее 17 000 метрических тонн фтора. Он стоит всего 5–8 долларов за килограмм в виде гексафторида урана или серы, но во много раз дороже как элемент из-за проблем с обращением. В большинстве процессов, в которых используется свободный фтор в больших количествах, используется генерация на месте при вертикальной интеграции . [183]
Наибольшее применение газообразного фтора, потребляющего до 7000 метрических тонн в год, связано с приготовлением UF
6для ядерного топливного цикла . Фтор используется для фторирования тетрафторида урана , который образуется из диоксида урана и плавиковой кислоты. [183] Фтор является моноизотопом, поэтому любые различия в массе между UF
6 молекулы обусловлены наличием 235
U или238
U , позволяющий обогащать уран с помощью газовой диффузии или газовой центрифуги . [4] [63] Около 6000 метрических тонн в год идет на производство инертного диэлектрика SF.
6для высоковольтных трансформаторов и автоматических выключателей, устраняя необходимость в опасных полихлорированных дифенилах, связанных с маслонаполненными устройствами. [184] Некоторые соединения фтора используются в электронике: гексафторид рения и вольфрама при химическом осаждении из паровой фазы , тетрафторметан при плазменном травлении [185] [186] [187] и трифторид азота в очистном оборудовании. [63] Фтор также используется в синтезе органических фторидов, но его реакционная способность часто требует преобразования сначала в более мягкий ClF.
3, BrF
3, или ЕСЛИ
5, которые вместе позволяют откалиброванное фторирование. Вместо этого в фторированных фармацевтических препаратах используется тетрафторид серы . [63]
Неорганические фториды
Извлечение алюминия критически зависит от криолита
Как и в случае с другими сплавами железа, на каждую метрическую тонну стали добавляется около 3 кг (6,5 фунта) метшпата; ионы фтора понижают его температуру плавления и вязкость . [63] [188] Помимо своей роли добавки в таких материалах, как эмали и покрытия сварочных стержней, большая часть кислотного шпата вступает в реакцию с серной кислотой с образованием плавиковой кислоты, которая используется при травлении стали, травлении стекла и растрескивании алканов . [63] Одна треть HF идет на синтез криолита и трифторида алюминия , оба флюса в процессе Холла-Эру.для извлечения алюминия; пополнение необходимо из-за их случайных реакций с плавильным аппаратом. На каждую метрическую тонну алюминия требуется около 23 кг (51 фунт) флюса. [63] [189] Фторсиликаты потребляют вторую по величине часть, при этом фторсиликат натрия используется при фторировании воды и очистке сточных вод, а также в качестве промежуточного продукта на пути к криолиту и тетрафториду кремния. [190] Другие важные неорганические фториды включают фториды кобальта , никеля и аммония . [63] [101] [191]
Органические фториды
Фторуглероды потребляют более 20% добываемого флюорита и более 40% плавиковой кислоты, при этом преобладают хладагенты, а доля фторполимеров на рынке увеличивается. [63] [192] Поверхностно-активные вещества — незначительное применение, но приносят более 1 миллиарда долларов годового дохода. [193] Из-за опасности прямых реакций углеводород-фтор при температуре выше -150 ° C (-240 ° F) промышленное производство фторуглеродов является косвенным, в основном через реакции галогенобмена, такие как фторирование Свартса , в котором хлорфторуглероды заменяют фтор на фтороводород под катализаторами. Электрохимическое фторированиеподвергает углеводороды электролизу во фтористом водороде, а процесс Фаулера обрабатывает их твердыми носителями фтора, такими как трифторид кобальта . [90] [194]
Хладагенты
Галогенированные хладагенты, в неформальном контексте называемые фреонами [примечание 18] , обозначаются R-числами, которые обозначают количество присутствующих фтора, хлора, углерода и водорода. [63] [195] Хлорфторуглероды (ХФУ), такие как R-11 , R-12 и R-114, когда — то преобладали в фторуглеродах, пик их производства пришелся на 1980-е годы. Используемые для систем кондиционирования воздуха, пропеллентов и растворителей, их производство было ниже одной десятой этого пика к началу 2000-х годов после широкого международного запрета. [63]Гидрохлорфторуглероды (ГХФУ) и гидрофторуглероды (ГФУ) были разработаны в качестве замены; на их синтез уходит более 90% фтора в органической промышленности. Важные ГХФУ включают R-22, хлордифторметан и R-141b . Основным ГФУ является R-134a [63] с новым типом молекулы HFO-1234yf , гидрофторолефин (HFO), получивший известность благодаря своему потенциалу глобального потепления менее 1%, чем у ГФУ-134a. [196]
Полимеры
Ткани, обработанные фторсодержащими ПАВ, часто бывают гидрофобными.
В 2006 и 2007 годах было произведено около 180 000 метрических тонн фторполимеров, что принесло доход более 3,5 миллиардов долларов в год. [197] Мировой рынок оценивался в чуть менее 6 миллиардов долларов в 2011 году и, по прогнозам, будет расти на 6,5% в год до 2016 года. [198] Фторполимеры могут быть образованы только путем полимеризации свободных радикалов. [162]
Политетрафторэтилен (ПТФЭ), иногда называемый DuPont тефлоном [199], составляет 60–80% по массе мирового производства фторполимеров. [197] Самым большим применением является электроизоляция, поскольку ПТФЭ является отличным диэлектриком . Он также используется в химической промышленности, где требуется устойчивость к коррозии, для покрытия труб, труб и прокладок. Еще одним важным использование в PFTE покрытием стеклоткани для стадионных крыш. Основное потребительское применение — посуда с антипригарным покрытием . [199] Рваная пленка из ПТФЭ становится расширенным ПТФЭ (ePTFE), мелкопористой мембраной, которую иногда называют торговой маркой Gore-Tex.и используется для изготовления дождевиков, защитной одежды и фильтров ; Волокна ePTFE могут использоваться в уплотнениях и пылевых фильтрах . [199] Другие фторполимеры, включая фторированный этиленпропилен , имитируют свойства ПТФЭ и могут его заменить; они более пластичны, но также более дороги и имеют более низкую термостойкость. Пленки из двух разных фторполимеров заменяют стекло в солнечных элементах. [199] [200]
Химически стойкие (но дорогие) фторированные иономеры используются в качестве мембран электрохимических ячеек, первым и наиболее ярким примером которых является Nafion . Разработанный в 1960-х годах, он первоначально использовался в качестве материала топливных элементов в космических кораблях, а затем заменил хлорно — щелочные технологические элементы на основе ртути . В последнее время применение топливных элементов возобновилось с попытками установить топливные элементы с протонообменной мембраной в автомобили. [201] [202] [203] Фторэластомеры, такие как витон, представляют собой сшитые смеси фторполимеров, в основном используемые в уплотнительных кольцах ; [199] перфторбутан(C 4 F 10 ) используется как средство пожаротушения. [204]
Поверхностно-активные вещества
Фторсодержащие ПАВ — это небольшие молекулы фторорганического соединения, используемые для отталкивания воды и пятен. Хотя они дороги (сравнимы с фармацевтическими препаратами по цене 200–2000 долларов за килограмм), к 2006 году они принесли более 1 миллиарда долларов годовой выручки; Одна только компания Scotchgard принесла более 300 миллионов долларов в 2000 году. [193] [205] [206] Фторсодержащие ПАВ составляют меньшинство на общем рынке поверхностно-активных веществ, большая часть которых занята гораздо более дешевыми продуктами на углеводородной основе. Применение в красках обременены компаундирования затрат; в 2006 году это использование было оценено всего в 100 миллионов долларов [193].
Сельскохозяйственная химия
Около 30% агрохимикатов содержат фтор [207], большинство из которых — гербициды и фунгициды с некоторыми регуляторами урожая . Замена фтором, обычно одного атома или максимум трифторметильной группы, представляет собой надежную модификацию с эффектами, аналогичными фторированным фармацевтическим препаратам: увеличение времени биологического пребывания, пересечение мембраны и изменение молекулярного распознавания. [208] Трифлуралин является ярким примером, с крупномасштабным использованием в США в качестве weedkiller, [208] [209] , но это канцероген и было запрещено во многих европейских странах. [210] Монофторацетат натрия(1080) — яд млекопитающих, в котором два атома водорода уксусной кислоты заменены фтором и натрием; он нарушает клеточный метаболизм, заменяя ацетат в цикле лимонной кислоты . Впервые синтезированный в конце 19-го века, он был признан инсектицидом в начале 20-го, а затем был использован в настоящее время. Новая Зеландия, крупнейший потребитель 1080, использует его для защиты киви от агрессивного австралийского опоссума . [211] Европа и США запретили 1080. [212] [213] [примечание 19]
Лекарственные препараты
Стоматологическая помощь
Местное лечение фтором в Панаме
Популяционные исследования, начиная с середины 20 века, показывают, что фторид местного действия снижает кариес зубов . Сначала это было связано с превращением гидроксиапатита зубной эмали в более прочный фторапатит, но исследования предварительно фторированных зубов опровергли эту гипотезу, и современные теории предполагают, что фторид способствует росту эмали при небольшом кариесе. [214] После исследований детей в районах, где фторид естественным образом присутствовал в питьевой воде, в 1940-х годах началось контролируемое фторирование систем водоснабжения для борьбы с кариесом [215], и теперь оно применяется для водоснабжения 6 процентов населения мира, в том числе двух треть американцев. [216] [217]Обзоры научной литературы 2000 и 2007 годов связывают фторирование воды со значительным сокращением кариеса у детей. [218] Несмотря на такие одобрения и доказательства отсутствия побочных эффектов, кроме в основном доброкачественного флюороза зубов , [219] все еще существует возражение по этическим соображениям и соображениям безопасности. [217] [220] Преимущества фторирования уменьшились, возможно, из-за других источников фтора, но их все еще можно измерить в группах с низким доходом. [221] Монофторфосфат натрия и иногда фторид натрия или олова (II) часто встречаются в зубных пастах с фтором., впервые представленный в США в 1955 году и теперь повсеместно распространенный в развитых странах, наряду с фторированными жидкостями для полоскания рта, гелями, пенами и лаками. [221] [222] [ актуально? ]
Фармацевтика
Двадцать процентов современных фармацевтических препаратов содержат фтор. [223] Один из них, понижающий холестерин аторвастатин (липитор), приносил больше доходов, чем любой другой препарат, пока в 2011 году он не стал генериком. [224] Комбинированный рецептурный препарат от астмы Серетид , входивший в десятку самых прибыльных лекарств в середине 2000-х годов. , содержит два активных ингредиента, один из которых — флутиказон — фторирован. [225] Многие лекарства фторированы, чтобы замедлить инактивацию и продлить периоды дозировки, потому что связь углерод-фтор очень стабильна. [226] Фторирование также увеличивает липофильность, поскольку связь более гидрофобна, чем связь углерод-водород., и это часто помогает в проникновении через клеточную мембрану и, следовательно, в биодоступности . [225]
Трициклические и другие антидепрессанты до 1980-х годов имели несколько побочных эффектов из-за их неизбирательного взаимодействия с нейротрансмиттерами, отличными от серотониновой мишени; фторированный флуоксетин был селективным и одним из первых, кто избежал этой проблемы. Многие современные антидепрессанты получают такое же лечение, включая селективные ингибиторы обратного захвата серотонина : циталопрам , его изомер эсциталопрам , флувоксамин и пароксетин . [227] [228] Хинолоны — это искусственные антибиотики широкого спектра действия.которые часто фторированы для усиления их действия. К ним относятся ципрофлоксацин и левофлоксацин . [229] [230] [231] [232] Фтор также находит применение в стероидах: [233] флудрокортизон — это минералокортикоид , повышающий кровяное давление , а триамцинолон и дексаметазон — сильные глюкокортикоиды . [234] Большинство ингаляционных анестетиков сильно фторированы; Галотан- прототип гораздо более инертен и эффективен, чем его современники. Более поздние соединения, такие как фторированные эфиры севофлуран и десфлуран лучше галотана и почти нерастворимы в крови, что ускоряет время бодрствования. [235] [236]
ПЭТ сканирование
Полное тело 18
F- ПЭТ сканирование с глюкозой, меченной радиоактивным фтором-18. Нормальный мозг и почки потребляют достаточно глюкозы для визуализации. В верхней части живота видна злокачественная опухоль. Радиоактивный фтор обнаруживается в моче мочевого пузыря.
Фтор-18 часто встречается в радиоактивных индикаторах для позитронно-эмиссионной томографии, так как его период полураспада, составляющий почти два часа, достаточно велик, чтобы его можно было транспортировать от производственных объектов к центрам визуализации. [237] Наиболее распространенным индикатором является фтордезоксиглюкоза [237], которая после внутривенной инъекции поглощается тканями, требующими глюкозы, такими как мозг и большинство злокачественных опухолей; [238] Компьютерная томография может затем использоваться для получения подробных изображений. [239]
Кислородные носители
Жидкие фторуглероды могут удерживать большие объемы кислорода или углекислого газа, больше, чем кровь, и привлекли внимание из-за их возможного использования в искусственной крови и жидкостном дыхании. [240] Поскольку фторуглероды обычно не смешиваются с водой, их необходимо смешивать с эмульсиями (маленькие капли перфторуглерода, взвешенные в воде), чтобы использовать их в качестве крови. [241] [242] Один из таких продуктов, Oxycyte , прошел начальные клинические испытания. [243] Эти вещества могут помочь спортсменам, работающим на выносливость, и запрещены к занятиям спортом; предсмерть одного велосипедиста в 1998 году побудила к расследованию жестокого обращения с ним. [244] [245]Применение дыхания чистой перфторуглеродной жидкостью (в которой используется чистая перфторуглеродная жидкость, а не водная эмульсия) включает помощь пострадавшим от ожогов и недоношенным детям с недостаточностью легких. Рассматривалось частичное и полное наполнение легких, хотя только первое было проведено сколько-нибудь значительных испытаний на людях. [246] Компания Alliance Pharmaceuticals достигла клинических испытаний, но от нее отказались, поскольку результаты были не лучше, чем у обычных методов лечения. [247]
Биологическая роль
Gifblaar является одним из немногих фторорганических синтезирующих организмов
Фтор не важен для людей и млекопитающих, но известно, что небольшие количества полезны для укрепления зубной эмали (где образование фторапатита делает эмаль более устойчивой к воздействию кислот, образующихся в результате бактериальной ферментации сахаров). Небольшие количества фтора могут быть полезны для прочности костей, но последнее не установлено окончательно. [248] И ВОЗ, и Институт медицины национальных академий США публикуют рекомендованную суточную норму (RDA) и максимально допустимое потребление фтора, которое зависит от возраста и пола. [249] [250]
Природные фторорганические соединения были обнаружены в микроорганизмах и растениях [66], но не в животных. [251] Наиболее распространенным является фторацетат , который используется в качестве защиты от травоядных по меньшей мере 40 растений в Африке, Австралии и Бразилии. [212] Другие примеры включают концевые фторированные жирные кислоты , фторацетон и 2-фторцитрат. [251] Фермент, связывающий фтор с углеродом — аденозилфторидсинтаза — был обнаружен у бактерий в 2002 году. [252]
Токсичность
Знаки опасности США для коммерчески перевозимого фтора [253]
Элементарный фтор очень токсичен для живых организмов. Его эффекты у людей начинаются при концентрациях ниже 50 ppm [254] цианида водорода и аналогичны эффектам хлора: [255] значительное раздражение глаз и дыхательной системы, а также поражение печени и почек возникают при концентрациях выше 25 ppm, что представляет собой непосредственную опасность для жизни и здоровья фтора. [256] Глаза и нос серьезно повреждаются при концентрации 100 ppm [256], а вдыхание 1000 ppm фтора вызывает смерть в считанные минуты [257] по сравнению с 270 ppm для цианистого водорода. [258]
| Опасности |
|
|---|---|
| Пиктограммы GHS |    
|
| Сигнальное слово GHS | Опасность |
|
Положения об опасности GHS |
H270 , H330 , H314 , H318 [259] |
| NFPA 704 (огненный алмаз) |
4 0 4
|
Плавиковая кислота
Ожоги плавиковой кислотой могут не проявляться в течение дня, после чего лечение кальцием становится менее эффективным. [260]
Плавиковая кислота является самой слабой из галогеноводородных кислот, ее pKa составляет 3,2 при 25 ° C. [261] Это летучая жидкость из-за наличия водородных связей (в то время как другие галогеноводородные кислоты являются газами). Он способен разрушать стекло, бетон, металлы, органические вещества. [262]
Плавиковая кислота представляет собой контактный яд с большей опасностью, чем многие сильные кислоты, такие как серная кислота, даже несмотря на то, что она слабая: она остается нейтральной в водном растворе и, таким образом, быстрее проникает в ткани, будь то при вдыхании, проглатывании или через кожу, и по крайней мере девять американских рабочих погибли. в таких авариях с 1984 по 1994 год. Он вступает в реакцию с кальцием и магнием в крови, что приводит к гипокальциемии и возможной смерти от сердечной аритмии . [263] Образование нерастворимого фторида кальция вызывает сильную боль [264], а ожоги размером более 160 см 2 (25 из 2 ) могут вызвать серьезную системную токсичность. [265]
Воздействие может быть незаметным в течение восьми часов для 50% HF, возрастает до 24 часов для более низких концентраций, а ожог изначально может быть безболезненным, поскольку фтористый водород влияет на нервную функцию. Если кожа подверглась воздействию HF, повреждение можно уменьшить, промыв ее под струей воды в течение 10–15 минут и сняв загрязненную одежду. [266] Затем часто применяется глюконат кальция , обеспечивающий связывание ионов кальция с фторидом; ожоги кожи можно лечить 2,5% гелем глюконата кальция или специальными растворами для полоскания. [267] [268] [269]Абсорбция фтористоводородной кислоты требует дальнейшего лечения; Глюконат кальция можно вводить инъекционно или внутривенно. Использование хлорида кальция — обычного лабораторного реагента — вместо глюконата кальция противопоказано и может привести к серьезным осложнениям. Может потребоваться иссечение или ампутация пораженных частей. [265] [270]
Фторид-ион
Растворимые фториды умеренно токсичны: 5–10 г фторида натрия или 32–64 мг фторид-ионов на килограмм массы тела представляют собой смертельную дозу для взрослых. [271] Одна пятая смертельной дозы может вызвать неблагоприятные последствия для здоровья [272], а хроническое избыточное потребление может привести к флюорозу скелета , от которого страдают миллионы людей в Азии и Африке. [272] [273] Проглоченный фторид образует в желудке фтористоводородную кислоту, которая легко всасывается в кишечнике, проникает через клеточные мембраны, связывается с кальцием и препятствует выделению с мочой различных ферментов . Пределы воздействия определяются путем анализа мочи на способность организма выводить фторид-ионы. [272] [274]
Исторически сложилось так, что большинство случаев отравления фтором было вызвано случайным проглатыванием инсектицидов, содержащих неорганические фториды. [275] Большинство обращений в токсикологические центры по поводу возможного отравления фтором поступают из-за проглатывания фторсодержащей зубной пасты. [272] Другой причиной является неисправное оборудование для фторирования воды: в результате одного инцидента на Аляске пострадало почти 300 человек и погиб один человек. [276] Опасности, связанные с зубной пастой для маленьких детей, усугубляются, и Центры по контролю и профилактике заболеваний рекомендуют присматривать за чисткой зубов детьми младше шести лет, чтобы они не проглотили зубную пасту. [277]В одном региональном исследовании за год были изучены отчеты об отравлении фторидом у детей в подростковом возрасте, в которых было зарегистрировано 87 случаев, в том числе один случай смерти от приема инсектицида. У большинства из них не было никаких симптомов, но около 30% имели боли в животе. [275] Более крупное исследование, проведенное в США, дало аналогичные результаты: 80% случаев касались детей до шести лет, и было несколько серьезных случаев. [278]
Проблемы окружающей среды
Атмосфера
Проекция НАСА стратосферного озона над Северной Америкой без Монреальского протокола [279]
Монреальский протокол , подписанный в 1987 году, установлены строгие правила по хлорфторуглеродов (ХФУ) и бромфторуглероды из — за их озоноразрущающей (ОРС). Высокая стабильность, которая подходила для их первоначального применения, также означала, что они не разлагались, пока не достигли больших высот, где высвободившиеся атомы хлора и брома атаковали молекулы озона. [280] Даже с учетом запрета и первых признаков его эффективности предсказания предупреждали, что пройдет несколько поколений до полного выздоровления. [281] [282] Гидрохлорфторуглероды (ГХФУ), составляющие одну десятую ОРС ХФУ, являются нынешней заменой, [283]и сами по себе намечены к замене к 2030–2040 годам на гидрофторуглероды (ГФУ) без хлора и с нулевым ОРП. [284] В 2007 году эта дата была перенесена на 2020 год для развитых стран; [285] Агентство по охране окружающей среды уже запрещено одно производства HCFC и закрывают те из двух других в 2003 году [284] фторуглеродных газов , как правило , парниковые газов с потенциалом глобального потепления (ПГП) от 100 до 10000; гексафторид серы имеет значение около 20 000. [286] Исключением является HFO-1234yf, который представляет собой новый тип хладагента, называемый гидрофторолефином.(HFO) и привлек мировой спрос из-за его GWP менее 1 по сравнению с 1430 для текущего стандарта хладагента HFC-134a . [196]
Биоперсистентность
Фторорганические соединения проявляют биостойкость благодаря прочности связи углерод-фтор. Перфторалкиловые кислоты (PFAA), которые плохо растворимы в воде из-за их кислотных функциональных групп, являются стойкими органическими загрязнителями ; [288] Наиболее часто исследуются перфтороктансульфоновая кислота (ПФОС) и перфтороктановая кислота (ПФОК). [289] [290] [291]PFAA были обнаружены в следовых количествах во всем мире от белых медведей до людей, при этом известно, что PFOS и PFOA содержатся в грудном молоке и крови новорожденных. Обзор 2013 года показал небольшую корреляцию между уровнями PFAA в грунтовых водах и почвах и деятельностью человека; не было четкой картины преобладания одного химического вещества, и более высокие количества ПФОС коррелировали с более высокими количествами ПФОК. [289] [290] [292] В организме PFAA связываются с белками, такими как сывороточный альбумин ; они имеют тенденцию концентрироваться в организме человека в печени и крови, прежде чем вывести их через почки. Время пребывания в организме сильно варьируется в зависимости от вида: у грызунов период полураспада составляет дни, а у человека — годы. [289] [290] [293]Высокие дозы ПФОС и ПФОК вызывают рак и смерть новорожденных грызунов, но исследования на людях не выявили эффекта при нынешних уровнях воздействия. [289] [290] [293]
См. Также
- Лазер на фториде аргона
- Электрофильное фторирование
- Фторид-селективный электрод , измеряющий концентрацию фторида
- Датирование абсорбции фтора
- Фтористая химия , процесс, используемый для отделения реагентов от органических растворителей.
- Криптон-фторидный лазер
- Радикальное фторирование
Примечания
- ^ Источники расходятся во мнениях относительно радиусов атомов кислорода, фтора и неона, поэтому точное сравнение невозможно.
- ^ α-Фтор имеет регулярную структуру молекул и является кристаллическим твердым телом, но его молекулы не имеют определенной ориентации. Молекулы β-фтора имеют фиксированное положение и минимальную неопределенность вращения. Для получения дополнительной информации об α-фторе см. Структуру Полинга 1970 года. [44] Для получения более подробной информации о концепции беспорядка в кристаллах см. Упомянутые общие обзоры. [45] [46]
- ^ Слышен громкий щелчок. Образцы могут разбиться, а окна для образцов взорвутся.
- ^ Отношение углового момента к магнитному моменту называется гиромагнитным отношением. «Некоторые ядра можно во многих целях рассматривать как вращающиеся вокруг оси, подобной Земле, или как волчок. В общем, вращение наделяет их угловым моментом и магнитным моментом; первое из-за их массы, второе из-за того, что все или часть их электрического заряда может вращаться вместе с массой «. [50]
- ^ Basilius Valentinus якобы описан флюоритом в конце 15го века, а потомучто его труды были обнаружены 200 лет спустя, правдивость этой работы является сомнительной. [70] [71] [72]
- ↑ Или, возможно, уже с 1670 года; Партингтон [76] и Уикс [75] дают разные оценки.
- ^ Fl, с 2012 г., используется для флеровиума .
- ^ Дэви , Гей-Люссак , Тенар , и ирландские химики Томас и Джордж Нокс получили ранения. Бельгийский химик Полин Луайе и французский химик Жером Никлес умерли. Муассан также испытал серьезное отравление фтористым водородом. [75] [85]
- ↑ Также удостоился награды за изобретение электродуговой печи .
- ^ Фтор в F
2имеет степень окисления 0. Нестабильные частицы F—
2и F—
3, которые разлагаются при температуре около 40 К, имеют промежуточную степень окисления; [96] F+
4и несколько родственных видов, по прогнозам, будут стабильными. [97] - ^ Метастабильный монофторид бора и азота имеет фторные связи более высокого порядка, а некоторые комплексы металлов используют его в качестве мостикового лиганда . Еще одна возможность — водородная связь .
- ^ ZrF
4плавится при 932 ° C (1710 ° F), [110] HfF
4возгоняется при 968 ° C (1774 ° F), [107] и UF
4плавится при 1036 ° C (1897 ° F). [111] - ^ Эти тринадцать состоят из молибдена, технеция, рутения, родия, вольфрама, рения, осмия, иридия, платины, полония, урана, нептуния и плутония.
- ↑ См. Также объяснение Кларка. [129]
- ^ Тетрафторид углерода формально является органическим, но включен здесь, а не в раздел химии фторорганических соединений, где обсуждаются более сложные соединения углерода и фтора, для сравнения с SiF
4и GeF
4. - ^ Перфторуглерод и фторуглерод являютсясинонимами IUPAC для молекул, содержащих только углерод и фтор, но в разговорном и коммерческом контексте последний термин может относиться к любой углерод- и фторсодержащей молекуле, возможно, с другими элементами.
- ^ Эта терминология неточна,также используется перфторированное вещество . [159]
- ^ Этот товарный знак DuPont иногда используется не по назначению для CFC, HFC или HCFC.
- ^ Ошейники для американских овец и крупного рогатого скота могут использовать 1080 против хищников, таких как койоты.
Источники
Цитаты
- ^ «Стандартный атомный вес: фтор» . CIAAW . 2013.
- ^ Б с д е е Jaccaud и др. 2000 , стр. 381.
- ^ а б в г Хейнс 2011 , стр. 4.121.
- ^ a b c d e Jaccaud et al. 2000 , стр. 382.
- ^ a b c Ассоциация сжатого газа 1999 , стр. 365.
- ^ Химмель, D .; Ридель, С. (2007). «Спустя 20 лет теоретические доказательства того, что« AuF 7 »на самом деле является AuF 5 · F 2 ». Неорганическая химия . 46 (13). 5338–5342. DOI : 10.1021 / ic700431s .
- Перейти ↑ Dean 1999 , p. 4.6.
- Перейти ↑ Dean 1999 , p. 4.35.
- Перейти ↑ Matsui 2006 , p. 257.
- ^ Yaws & Braker 2001 , стр. 385.
- ↑ Mackay, Mackay & Henderson 2002 , стр. 72.
- ^ Cheng et al. 1999 .
- ^ Chisté & Bé 2011 .
- ^ Ли и др. 2014 .
- Перейти ↑ Dean 1999 , p. 564.
- ^ Лида 2004 , стр. 10.137-10.138.
- ^ Мур, Stanitski & Jurs 2010 , стр. 156 .
- ^ Кордеро и др. 2008 .
- ^ Pyykkö & Ацуе 2009 .
- ^ a b Greenwood & Earnshaw 1998 , стр. 804.
- ^ Macomber 1996 , стр. 230
- ^ Нельсон 1947 .
- ^ Лидин, Молочко & Андреевой 2000 , стр. 442-455.
- ^ a b Wiberg, Wiberg & Holleman 2001 , стр. 404.
- ^ Patnaik 2007 , стр. 472.
- ^ Aigueperse et al. 2000 , стр. 400.
- ^ Greenwood & Эрншо 1998 , стр. 76, 804.
- ^ Kuriakose и маркграф 1965 .
- ^ Hasegawa et al. 2007 .
- ^ Лагув 1970 , стр. 64-78.
- ^ Наваррини и др. 2012 .
- ↑ Лидин, Молочко и Андреева 2000 , стр. 252.
- Перейти ↑ Tanner Industries 2011 .
- ^ Морроу, Перри и Коэн 1959 .
- ^ Emeléus & Sharpe 1974 , стр. 111 .
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 457.
- ^ Брэнтли 1949 , стр. 26 .
- ^ Жакко и др. 2000 , стр. 383.
- ^ Pitzer 1975 .
- ^ а б Хряччев и др. 2000 .
- ^ Бурдон, Emson & Edwards 1987 .
- ^ Лида 2004 , стр. 4.12.
- ^ а б Дин 1999 , стр. 523.
- ^ Полинг, Кивени и Робинсон 1970 .
- ^ Bürgi 2000 .
- Перейти ↑ Müller 2009 .
- ^ а б Янг 1975 , стр. 10.
- ^ a b Барретт, Мейер и Вассерман 1967 .
- ^ Национальный центр ядерных данных и NuDat 2.1 , Фтор-19 .
- ^ Vigoureux 1961 .
- ^ Meusinger, Чиппендейл и Fairhurst 2012 , стр. 752, 754.
- ^ a b Национальный центр ядерных данных и NuDat 2.1 .
- ^ NUBASE 2016 , стр. 030001-23-030001-27.
- ^ NUBASE 2016 , стр. 030001-24.
- ^ Кэмерон 1973 .
- ^ а б в Кросвелл 2003 .
- Перейти ↑ Clayton 2003 , pp. 101–104 .
- ^ Ренда и др. 2004 .
- ^ a b Jaccaud et al. 2000 , стр. 384.
- ^ а б в Шмедт, Mangstl & Kraus 2012 .
- ^ a b c d e Greenwood & Earnshaw 1998 , стр. 795.
- ^ a b Norwood & Fohs 1907 , стр. 52 .
- ^ Б с д е е г ч я J к л м н Виллалба, Ayres & Schroder 2008 .
- ^ Келли и Миллер 2005 .
- ^ Lusty et al. 2008 .
- ^ а Б. Гриббл 2002 .
- Перейти ↑ Richter, Hahn & Fuchs 2001 , p. 3.
- ^ Greenwood & Эрншо 1998 , стр. 790.
- ^ Сеннинг 2007 , стр. 149 .
- ↑ Стилман, 1912 .
- Перейти ↑ Principe 2012 , pp. 140, 145.
- ↑ Agricola, Hoover & Hoover 1912 , сноски и комментарии, стр. Xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Эрншо 1998 , стр. 109.
- ↑ Agricola, Hoover & Hoover 1912 , предисловие, стр. 380–381 .
- ^ a b c d e Недели 1932 года .
- ^ Партингтон 1923 .
- ^ Маргграф 1770 .
- ^ Б с д е е г ч Kirsch 2004 , стр. 3-10.
- ^ Шееле 1771 .
- ^ Ампер 1816 .
- ^ Tressaud, Ален (6 октября 2018). Фтор: парадоксальный элемент . ISBN 9780128129913.
- ↑ Дэви 1813 , стр. 278 .
- Перейти ↑ Banks 1986 , p. 11.
- ^ a b Storer 1864 , стр. 278–280 .
- ^ а б в г д Мультяшный 2011 .
- ^ а б Азимов 1966 , с. 162.
- ^ Greenwood & Эрншо 1998 , стр. 789-791.
- ^ Муассан 1886 .
- ^ Viel & Goldwhite 1993 , стр. 35 .
- ^ а б в г Оказое 2009 .
- ^ a b Hounshell & Smith 1988 , стр. 156–157.
- ^ DuPont 2013a .
- Перейти ↑ Meyer 1977 , p. 111.
- Перейти ↑ Kirsch 2004 , pp. 60–66 .
- ^ Riedel & Kaupp 2009 .
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 422.
- ^ Schlöder & Riedel 2012 .
- ^ Harbison 2002 .
- ^ Эдвардс 1994 , стр. 515 .
- ^ Katakuse et al. 1999 , стр. 267 .
- ^ a b Aigueperse et al. 2000. С. 420–422.
- Перейти ↑ Walsh 2009 , pp. 99–102 , 118–119 .
- ^ Emeléus & Sharpe 1983 , стр. 89-97.
- ^ Babel & Tressaud 1985 , стр. 91-96 .
- ^ Эйнштейн и др. 1967 .
- ^ Браун и др. 2005 , стр. 144 .
- ^ а б Перри 2011 , стр. 193 .
- ^ Kern et al. 1994 .
- ^ Лида 2004 , стр. 4,60, 4,76, 4,92, 4,96.
- ^ Лида 2004 , стр. 4.96.
- ^ Лида 2004 , стр. 4.92.
- ^ Greenwood & Эрншо 1998 , стр. 964.
- Перейти ↑ Becker & Müller 1990 .
- ^ Greenwood & Эрншо 1998 , стр. 990.
- ^ Лида 2004 , стр. 4,72, 4,91, 4,93.
- ^ a b Гринвуд и Эрншоу 1998 , стр. 561–563.
- ^ Emeléus & Sharpe 1983 , стр. 256-277.
- ↑ Mackay, Mackay & Henderson 2002 , стр. 355–356.
- ^ Greenwood & Earnshaw 1998 , (разные страницы по металлу в соответствующих главах).
- ^ Лида 2004 , стр. 4,71, 4,78, 4,92.
- ^ Дрюс и др. 2006 .
- ^ Greenwood & Эрншо 1998 , стр. 819.
- ^ Бартлетт 1962 .
- ^ Полинг 1960 , стр. 454-464 .
- ↑ Аткинс и Джонс, 2007 , стр. 184–185.
- ^ Emsley 1981 .
- ^ Greenwood & Эрншо 1998 , стр. 812-816.
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 425.
- ^ Кларк 2002 .
- Перейти ↑ Chambers & Holliday 1975 , pp. 328–329.
- ^ Air Products and Chemicals 2004 , стр. 1.
- ^ Noury, Сильви & Gillespie 2002 .
- ^ Чанг и Голдсби 2013 , стр. 706.
- Перейти ↑ Ellis 2001 , p. 69.
- ^ Aigueperse et al. 2000 , стр. 423.
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 897.
- ^ Raghavan 1998 , стр. 164-165 .
- ^ Годфри и др. 1998 , стр. 98 .
- ^ Aigueperse et al. 2000 , стр. 432.
- ^ Мурти, Mehdi Ali & Ashok 1995 , стр. 180-182 , 206-208 .
- ^ Greenwood & Эрншо 1998 , стр. 638-640, 683-689, 767-778.
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 435-436.
- ^ Greenwood & Эрншо 1998 , стр. 828-830.
- ^ Patnaik 2007 , стр. 478-479 .
- ^ Moeller, Bailar & Клейнберг 1980 , стр. 236.
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 392-393.
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 395–397, 400.
- ^ Lewars 2008 , с. 68.
- ^ Pitzer 1993 , стр. 111 .
- ^ Lewars 2008 , с. 67.
- ^ а б Бихари, Чабан и Гербер 2002 .
- ^ Lewars 2008 , с. 71.
- ^ Hoogers 2002 , стр. 4-12.
- ^ О’Хаган 2008 .
- ^ Зигемунд и др. 2005 , стр. 444.
- Перейти ↑ Sandford, 2000 , p. 455.
- ^ Зигемунд и др. 2005 , с. 451–452.
- ^ Barbee, Маккормак & Вартанян 2000 , стр. 116 .
- ^ Познер и др. 2013 , стр. + Углеводороды + которые + полностью + фторированы + кроме + одной + функциональной + группы% 22 187–190 .
- ^ а б Познер 2011 , стр. 27.
- ^ Salager 2002 , стр. 45.
- ^ a b Carlson & Schmiegel 2000 , стр. 3.
- ^ a b Carlson & Schmiegel 2000 , стр. 3–4.
- ^ Rhoades 2008 , стр. 2 .
- ^ Окада и др. 1998 .
- ^ Carlson & Шмигель 2000 , стр. 4.
- ^ Aigueperse et al. 2000 .
- ^ Норрис Шрив; Джозеф Бринк младший (1977). Химическая промышленность (4-е изд.). п. 321. ISBN. 0070571457.
- ^ Жакко и др. 2000 , стр. 386.
- ^ Жакко и др. 2000. С. 384–285.
- ^ Greenwood & Эрншо 1998 , стр. 796-797.
- ^ Жакко и др. 2000 , с. 384–385.
- ^ a b Jaccaud et al. 2000 , с. 390–391.
- ^ Шрайвер и Аткинс 2010 , стр. 427.
- ^ Christe 1986 .
- ^ Christe Research Group nd
- ^ Кэри 2008 , стр. 173.
- ^ Миллер 2003b .
- ^ PRWeb 2012 .
- ^ Bombourg 2012 .
- ^ TMR 2013 .
- Перейти ↑ Fulton & Miller 2006 , p. 471 .
- ^ a b Jaccaud et al. 2000 , стр. 392.
- ^ Aigueperse et al. 2000 , стр. 430.
- ^ Жакко и др. 2000 , с. 391–392.
- ^ Эль-Карэ 1994 , стр. 317 .
- ^ Арана и др. 2007 .
- ^ Миллер 2003a .
- ↑ Энергетика, Инк. 1997 , стр. 41, 50.
- ^ Aigueperse et al. 2000 , стр. 428.
- ^ Уилли 2007 , стр. 113 .
- ^ PRWeb 2010 .
- ^ a b c Реннер 2006 .
- ^ Грин и др. 1994 , с. 91–93 .
- ^ DuPont 2013b .
- ^ а б Уолтер 2013 .
- ^ а б Бузник 2009 .
- ^ PRWeb 2013 .
- ^ а б в г д Мартин 2007 , стр. 187–194 .
- ^ DeBergalis 2004 .
- Перейти ↑ Grot 2011 , pp. 1–10 .
- ^ Рамкумар 2012 , стр. 567 .
- Перейти ↑ Burney 1999 , p. 111 .
- ^ Slye 2012 , стр. 10.
- ^ Kissa 2001 , стр. 516-551 .
- ^ Ульман 2008 , стр. 538, 543-547.
- ^ МКИС 2006 .
- ^ a b Теодоридис 2006 .
- ↑ EPA 1996 .
- Перейти ↑ DG Environment 2007 .
- Перейти ↑ Beasley 2002 .
- ^ a b Proudfoot, Bradberry & Vale 2006 .
- Перейти ↑ Eisler 1995 .
- ^ Пиццо и др. 2007 .
- ^ CDC 2001 .
- Перейти ↑ Ripa 1993 .
- ^ а б Ченг, Чалмерс и Шелдон 2007 .
- ^ NHMRC 2007 ; см.сводку в Yeung 2008 .
- ↑ Марья 2011 , с. 343 .
- ^ Armfield 2007 .
- ^ a b Baelum, Sheiham & Burt 2008 , стр. 518 .
- ^ Cracher 2012 , стр. 12.
- ^ Emsley 2011 , стр. 178.
- ^ Джонсон 2011 .
- ^ а б Суинсон 2005 .
- ^ Хагманн 2008 .
- Перейти ↑ Mitchell 2004 , pp. 37–39 .
- ^ Прескорн 1996 , гл. 2 .
- ^ Вернер и др. 2011 .
- Перейти ↑ Brody 2012 .
- ^ Нельсон и др. 2007 .
- ^ Король, Malone & Лилли 2000 .
- ^ Parente 2001 , стр. 40 .
- ^ Raj & Erdine 2012 , стр. 58 .
- Перейти ↑ Filler & Saha 2009 .
- ^ Беге & Bonnet-Delpon 2008 , стр. 335-336 .
- ^ а б Шмитц и др. 2000 .
- Перейти ↑ Bustamante & Pedersen 1977 .
- ^ Алави и Хуанг 2007 , стр. 41.
- ^ Габриэль и др. 1996 .
- Перейти ↑ Sarkar 2008 .
- ^ Schimmeyer 2002 .
- ^ Дэвис 2006 .
- ^ Прибыль 1998 .
- ^ Табер 1999 .
- ↑ Shaffer, Wolfson & Clark Jr 1992 , стр. 102.
- ^ Kacmarek et al. 2006 .
- Перейти ↑ Nielsen 2009 .
- ^ Оливарес & Uauy 2004 .
- ^ Совет по продовольствию и питанию .
- ^ a b Мерфи, Шаффрат и О’Хаган 2003
- ^ О’Хаган и др. 2002 .
- ^ Национальное управление океанических и атмосферных исследований .
- ^ Национальный институт безопасности и гигиены труда 1994a .
- ^ Национальный институт безопасности и гигиены труда 1994b .
- ^ а б Кеплингер и Суисса 1968 .
- ^ Emsley 2011 , стр. 179.
- ^ Биллер 2007 , стр. 939.
- ^ «Фтор. Паспорт безопасности» (PDF) . Аэрогаз. Архивировано из оригинального (PDF) 19 апреля 2015 года.
- Перейти ↑ Eaton 1997 .
- ^ «Неорганическая химия» Гэри Л. Мисслер и Дональд А. Тарр, 4-е издание, Пирсон
- ^ «Неорганическая химия» Шрайвер, Веллер, Овертон, Рурк и Армстронг, 6-е издание, Фриман
- ^ Блоджетт, Suruda & Крауч 2001 .
- ^ Хоффман и др. 2007 , стр. 1333.
- ^ а б HSM 2006 .
- ^ Фишман 2001 , стр. 458-459 .
- ^ Эль Саади и др. 1989 .
- ^ Роблин и др. 2006 .
- ^ Hultén et al. 2004 .
- ↑ Зорич, 1991 , стр. 182–183 .
- ^ Liteplo et al. 2002 , стр. 100.
- ^ а б в г Шин и Сильверберг 2013 .
- ^ Редди 2009 .
- ^ Баэз, Баэз и Marthaler 2000 .
- ^ а б Augenstein et al. 1991 .
- ^ Гесснер и др. 1994 .
- ^ CDC 2013 .
- Перейти ↑ Shulman & Wells 1997 .
- ^ Бек и др. 2011 .
- ^ Aucamp и Бьорн 2010 , стр. 4-6, 41, 46-47.
- ^ Митчелл Кроу 2011 .
- Перейти ↑ Barry & Phillips, 2006 .
- ^ EPA 2013a .
- ^ a b EPA 2013b .
- ^ Маккой 2007 .
- ^ Forster et al. 2007 , стр. 212–213.
- ^ Schwarcz 2004 , стр. 37.
- ^ Giesy & Kannan 2002 .
- ^ а б в г Стинланд, Флетчер и Савиц 2010 .
- ^ а б в г Беттс 2007 .
- ^ EPA 2012 .
- ^ Zareitalabad et al. 2013 .
- ^ а б Лау и др. 2007 .
Проиндексированные ссылки
- Агрикола, Георгий ; Гувер, Герберт Кларк; Гувер, Лу Генри (1912). De Re Metallica . Лондон: Горный журнал.
- Aigueperse, J .; Mollard, P .; Devilliers, D .; Chemla, M .; Faron, R .; Романо, RE; Кью, JP (2000). «Соединения фтора неорганические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. С. 397–441. DOI : 10.1002 / 14356007 .
- Air Products and Chemicals (2004 г.). «График безопасности № 39 Трифторид хлора» (PDF) . Воздушные продукты и химикаты. Архивировано из оригинального (PDF) 18 марта 2006 года . Проверено 16 февраля 2014 года .
- Алави, Аббас; Хуанг, Стив С. (2007). «Позитронно-эмиссионная томография в медицине: обзор». В Хайят, Массачусетс (ред.). Визуализация рака, Том 1: Карциномы легких и груди . Берлингтон: Academic Press. С. 39–44. ISBN 978-0-12-370468-9.
- Ампер, Андре-Мари (1816). «Натуральная сюита для классификаций для простых корпусов» . Annales de chimie et de Physique (на французском языке). 2 : 1–5.
- Arana, LR; Mas, N .; Schmidt, R .; Franz, AJ; Шмидт, Массачусетс; Дженсен, К.Ф. (2007). «Изотропное травление кремния в газообразном фторе для микрообработки MEMS». Журнал микромеханики и микротехники . 17 (2): 384–392. Bibcode : 2007JMiMi..17..384A . DOI : 10.1088 / 0960-1317 / 17/2/026 .
- Армфилд, JM (2007). «Когда общественные действия подрывают общественное здоровье: критическое рассмотрение антифторированной литературы» . Политика Австралии и Новой Зеландии в области здравоохранения . 4 : 25. DOI : 10,1186 / 1743-8462-4-25 . PMC 2222595 . PMID 18067684 .
- Азимов, Исаак (1966). Благородные газы . Нью-Йорк: Основные книги. ISBN 978-0-465-05129-8.
- Аткинс, Питер ; Джонс, Лоретта (2007). Химические принципы: поиски понимания (4-е изд.). Нью-Йорк: WH Freeman. ISBN 978-1-4292-0965-6.
- Aucamp, Pieter J .; Бьорн, Ларс Олоф (2010). «Вопросы и ответы об экологических последствиях истощения озонового слоя и изменения климата: обновление 2010 г.» (PDF) . Программа ООН по окружающей среде. Архивировано из оригинального (PDF) 3 сентября 2013 года . Проверено 14 октября 2013 года .
- Audi, G .; Кондев Ф.Г .; Wang, M .; Хуанг, WJ; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF) . Китайская физика C . 41 (3): 030001. Bibcode : 2017ChPhC..41c0001A . DOI : 10.1088 / 1674-1137 / 41/3/030001 ..
- Augenstein, WL; и другие. (1991). «Проглатывание фтора у детей: обзор 87 случаев» . Педиатрия . 88 (5): 907–912. PMID 1945630 .
- Бабель, Дитрих; Трессо, Ален (1985). «Кристаллохимия фторидов». В Hagenmuller, Paul (ред.). Неорганические твердые фториды: химия и физика . Орландо: Academic Press. С. 78–203. ISBN 978-0-12-412490-5.
- Баэлум, Вибеке; Шейхэм, Обри; Берт, Брайан (2008). «Контроль кариеса среди населения». В Фейерсков, Оле; Кидд, Эдвина (ред.). Кариес зубов: заболевание и его клиническое лечение (2-е изд.). Оксфорд: Блэквелл Манксгаард. С. 505–526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J .; Baez, Martha X .; Марталер, Томас М. (2000). «Экскреция фторидов с мочой детьми 4–6 лет в общине Южного Техаса» . Revista Panamericana de Salud Pública . 7 (4): 242–248. DOI : 10.1590 / S1020-49892000000400005 . PMID 10846927 .
- Банки, RE (1986). «Выделение фтора Муассаном: декорации». Журнал химии фтора . 33 (1–4): 3–26. DOI : 10.1016 / S0022-1139 (00) 85269-0 .
- Барби, К .; McCormack, K .; Вартанян, В. (2000). «Проблемы EHS, связанные с обработкой распыления озонированной воды». В Мендичино, Л. (ред.). Экологические проблемы в электронной и полупроводниковой промышленности . Пеннингтон, Нью-Джерси: Электрохимическое общество. С. 108–121. ISBN 978-1-56677-230-3.
- Барретт, CS; Meyer, L .; Вассерман, Дж. (1967). «Фазовая диаграмма аргон — фтор». Журнал химической физики . 47 (2): 740–743. Bibcode : 1967JChPh..47..740B . DOI : 10.1063 / 1.1711946 .
- Барри, Патрик Л .; Филлипс, Тони (26 мая 2006 г.). «Хорошие новости и загадка» . Национальное управление по аэронавтике и исследованию космического пространства . Проверено 6 января 2012 года .
- Бартлетт, Н. (1962). «Гексафтороплатинат (V) ксенона Xe + [PtF 6 ] — ». Труды химического общества (6): 218. DOI : 10.1039 / PS9620000197 .
- Бисли, Майкл (август 2002). Руководство по безопасному использованию фторацетата натрия (1080) (PDF) . Веллингтон: Служба охраны труда и здоровья Министерства труда (Новая Зеландия). ISBN 0-477-03664-3. Архивировано из оригинального (PDF) 11 ноября 2013 года . Проверено 11 ноября 2013 года .
- Бек, Джефферсон; Ньюман, Пол; Шиндлер, Трент Л .; Перкинс, Лори (2011). «Что случилось бы с озоновым слоем, если бы хлорфторуглероды (ХФУ) не регулировались?» . Национальное управление по аэронавтике и исследованию космического пространства . Проверено 15 октября 2013 года .
- Becker, S .; Мюллер, Б.Г. (1990). «Тетрафторид ванадия». Angewandte Chemie International Edition на английском языке . 29 (4): 406–407. DOI : 10.1002 / anie.199004061 .
- Беге, Жан-Пьер; Бонне-Дельпон, Даниэль (2008). Биоорганическая и лекарственная химия фтора . Хобокен: Джон Уайли и сыновья. ISBN 978-0-470-27830-7.
- Беттс, KS (2007). «Перфторалкиловые кислоты: о чем нам говорят свидетельства?» . Перспективы гигиены окружающей среды . 115 (5): A250 – A256. DOI : 10.1289 / ehp.115-A250 . PMC 1867999 . PMID 17520044 .
- Bihary, Z .; Чабан, GM; Гербер, РБ (2002). «Устойчивость химически связанного гелиевого соединения в твердом гелии высокого давления». Журнал химической физики . 117 (11): 5105–5108. Bibcode : 2002JChPh.117.5105B . DOI : 10.1063 / 1.1506150 .
- Биллер, Хосе (2007). Интерфейс неврологии и внутренней медицины (иллюстрированный ред.). Филадельфия: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7906-7.
- Блоджетт, DW; Suruda, AJ; Крауч, Б.И. (2001). «Непреднамеренные профессиональные отравления со смертельным исходом плавиковой кислотой в США» (PDF) . Американский журнал промышленной медицины . 40 (2): 215–220. DOI : 10.1002 / ajim.1090 . PMID 11494350 . Архивировано из оригинального (PDF) 17 июля 2012 года.
- Бомбург, Николя (4 июля 2012 г.). «Мировой рынок фторированных химикатов, Фридония» . Репортерлинкер . Проверено 20 октября 2013 года .
- Брантли, Л. Р. (1949). Сквайрз, Рой; Кларк, Артур С. (ред.). «Фтор». Pacific Rockets: журнал Тихоокеанского ракетного общества . Южная Пасадена: Издательство Сойера / Историческая библиотека Тихоокеанского ракетного общества. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Броуди, Джейн Э. (10 сентября 2012 г.). «Популярные антибиотики могут иметь серьезные побочные эффекты» . Блог New York Times Well . Проверено 18 октября 2013 года .
- Brown, Paul L .; Mompean, Federico J .; Перроне, Джейн; Иллемассен, Мириам (2005). Химическая термодинамика циркония . Амстердам: ISBN Elsevier BV 978-0-444-51803-3.
- Burdon, J .; Emson, B .; Эдвардс, AJ (1987). «Действительно ли газообразный фтор желтый?». Журнал химии фтора . 34 (3–4): 471–474. DOI : 10.1016 / S0022-1139 (00) 85188-X .
- Bürgi, HB (2000). «Движение и беспорядок в анализе кристаллической структуры: измерение и различение». Ежегодный обзор физической химии . 51 : 275–296. Bibcode : 2000ARPC … 51..275B . DOI : 10.1146 / annurev.physchem.51.1.275 . PMID 11031283 .
- Берни, Х. (1999). «Прошлое, настоящее и будущее хлорно-щелочной промышленности». В Берни, HS; Furuya, N .; Hine, F .; Ота, К.-И. (ред.). Хлор-щелочная и хлоратная технология: симпозиум Р.Б. МакМуллина . Пеннингтон: Электрохимическое общество. С. 105–126. ISBN 1-56677-244-3.
- Bustamante, E .; Педерсен, П.Л. (1977). «Высокий аэробный гликолиз клеток гепатомы крысы в культуре: роль митохондриальной гексокиназы» . Труды Национальной академии наук . 74 (9): 3735–3739. Bibcode : 1977PNAS … 74.3735B . DOI : 10.1073 / pnas.74.9.3735 . PMC 431708 . PMID 198801 .
- Бузник, ВМ (2009). «Химия фторполимеров в России: состояние и перспективы». Российский журнал общей химии . 79 (3): 520–526. DOI : 10.1134 / S1070363209030335 . S2CID 97518401 .
- Кэмерон, AGW (1973). «Изобилие элементов в Солнечной системе» (PDF) . Обзоры космической науки . 15 (1): 121–146. Bibcode : 1973SSRv … 15..121C . DOI : 10.1007 / BF00172440 . S2CID 120201972 . Архивировано из оригинального (PDF) 21 октября 2011 года.
- Кэри, Чарльз В. (2008). Афроамериканцы в науке . Санта-Барбара: ABC-CLIO. ISBN 978-1-85109-998-6.
- Карлсон, Д.П .; Шмигель, В. (2000). «Фторполимеры органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. С. 495–533. DOI : 10.1002 / 14356007.a11_393 .
- Центры по контролю и профилактике заболеваний (2001 г.). «Рекомендации по использованию фторида для профилактики и контроля кариеса зубов в США» . Рекомендации и отчеты MMWR . 50 (RR – 14): 1–42. PMID 11521913 . Проверено 14 октября 2013 года .
- Центры по контролю и профилактике заболеваний (10 июля 2013 г.). «Фторирование воды в общинах» . Проверено 25 октября 2013 года .
- Chambers, C .; Холлидей, АК (1975). Современная неорганическая химия: промежуточный текст (PDF) . Лондон: ISBN Butterworth & Co. 978-0-408-70663-6. Архивировано из оригинального (PDF) 23 марта 2013 года.
- Чанг, Раймонд ; Голдсби, Кеннет А. (2013). Химия (11-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 978-0-07-131787-0.
- Cheng, H .; Fowler, DE; Хендерсон, ПБ; Hobbs, JP; Пасколини, MR (1999). «О магнитной восприимчивости фтора». Журнал физической химии . 103 (15): 2861–2866. Bibcode : 1999JPCA..103.2861C . DOI : 10.1021 / jp9844720 .
- Chisté, V .; Бе, ММ (2011). «Ф-18» (PDF) . In Bé, MM; Coursol, N .; Duchemin, B .; Lagoutine, F .; и другие. (ред.). Таблица радионуклеидов (Отчет). CEA (Альтернативы Commissariat à l’énergie atomique et aux énergies), LIST, LNE-LNHB (Национальная лаборатория Анри Беккереля / Commissariat à l’Energie Atomique) . Проверено 15 июня 2011 года .
- Кристе, Карл О. (1986). «Химический синтез элементарного фтора». Неорганическая химия . 25 (21): 3721–3722. DOI : 10.1021 / ic00241a001 .
- Christe Research Group (nd). «Химический синтез элементарного фтора» . Архивировано из оригинала 4 марта 2016 года . Проверено 12 января 2013 года .
- Кларк, Джим (2002). «Кислотность галогенидов водорода» . Chemguide.co.uk . Проверено 15 октября 2013 года .
- Клейтон, Дональд (2003). Справочник изотопов в космосе: от водорода до галлия . Нью-Йорк: Издательство Кембриджского университета. ISBN 978-0-521-82381-4.
- Ассоциация сжатого газа (1999 г.). Справочник по сжатым газам (4-е изд.). Бостон: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cordero, B .; Gómez, V .; Платеро-Пратс, А.Е .; Revés, M .; Echeverría, J .; Cremades, E .; Barragán, F .; Альварес, С. (2008). «Новый взгляд на ковалентные радиусы». Dalton Transactions (21): 2832–2838. DOI : 10.1039 / b801115j . PMID 18478144 .
- Кракер, Конни М. (2012). «Современные концепции профилактической стоматологии» (PDF) . dentalcare.com. Архивировано из оригинального (PDF) 14 октября 2013 года . Проверено 14 октября 2013 года .
- Кросвелл, Кен (сентябрь 2003 г.). «Фтор: элементарная тайна» . Небо и телескоп . Проверено 17 октября 2013 года .
- Митчелл Кроу, Джеймс (2011). «Обнаружены первые признаки восстановления озоновой дыры». Природа . DOI : 10.1038 / news.2011.293 .
- Дэвис, Николь (ноябрь 2006 г.). «Лучше крови» . Популярная наука . Архивировано из оригинала на 4 июня 2011 года . Проверено 20 октября 2013 года .
- Дэви, Хамфри (1813). «Некоторые эксперименты и наблюдения за веществами, образующимися в различных химических процессах на плавиковом шпате» . Философские труды Королевского общества . 103 : 263–279. DOI : 10,1098 / rstl.1813.0034 .
- Дин, Джон А. (1999). Справочник Ланге по химии (15-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-07-016190-9.
- ДеБергалис, Майкл (2004). «Фторполимерные пленки в фотоэлектрической промышленности». Журнал химии фтора . 125 (8): 1255–1257. DOI : 10.1016 / j.jfluchem.2004.05.013 .
- Генеральный директорат по окружающей среде (Европейская комиссия) (2007). Трифлуралин (PDF) (Отчет). Европейская комиссия . Проверено 14 октября 2013 года .
- Drews, T .; Supeł, J .; Hagenbach, A .; Сеппельт, К. (2006). «Твердотельные молекулярные структуры гексафторидов переходных металлов». Неорганическая химия . 45 (9): 3782–3788. DOI : 10.1021 / ic052029f . PMID 16634614 .
- DuPont (2013a). «Фреон» . Проверено 17 октября 2013 года .
- DuPont (2013b). «Понимание номенклатуры хладагента R» . Проверено 17 октября 2013 года .
- Итон, Чарльз (1997). «Рисунок hfl» . E-Hand.com: Электронный учебник по хирургии кисти . Центр рук (бывшая практика доктора Итона) . Проверено 28 сентября 2013 года .
- Эдвардс, Филип Нил (1994). «Использование фтора в химиотерапии». В банках, RE; Умный, БЫТЬ; Tatlow, JC (ред.). Фторорганическая химия: принципы и коммерческое применение . Нью-Йорк: Пленум Пресс. С. 501–542. ISBN 978-0-306-44610-8.
- Эйнштейн, FWB; Рао, PR; Trotter, J .; Бартлетт, Н. (1967). «Кристаллическая структура трифторида золота». Журнал химического общества A: неорганический, физический, теоретический . 4 : 478–482. DOI : 10.1039 / J19670000478 .
- Эйслер, Рональд (1995). Монофторацетат натрия (1080) Опасности для рыб, диких животных и беспозвоночных: синоптический обзор (PDF) (отчет). Центр экологических наук Патаксента (Национальная биологическая служба США) . Проверено 5 июня 2011 года .
- Эллис, Брайан (2001). Научный эссенциализм . Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-80094-5.
- Эль-Каре, Бадих (1994). Основы технологии обработки полупроводников . Norwell и Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- Эль Саади, MS; Холл, AH; Холл, ПК; Риггс, BS; Augenstein, WL; Rumack, BH (1989). «Воздействие на кожу плавиковой кислоты». Ветеринария и токсикология человека . 31 (3): 243–247. PMID 2741315 .
- Emeléus, HJ; Шарп, AG (1974). Успехи неорганической химии и радиохимии . 16 . Нью-Йорк: Academic Press. ISBN 978-0-08-057865-1.
- Emeléus, HJ; Шарп, AG (1983). Успехи неорганической химии и радиохимии . 27 . Академическая пресса. ISBN 0-12-023627-3.
- Эмсли, Джон (1981). «Скрытая сила водорода» . Новый ученый . 91 (1264): 291–292.
- Эмсли, Джон (2011). Строительные блоки природы: Руководство по элементам от А до Я (2-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-960563-7.
- Энергетика, Инк. (1997). Энергетический и экологический профиль алюминиевой промышленности США (PDF) (Отчет) . Проверено 15 октября 2013 года .
- Наполнитель, Р .; Саха, Р. (2009). «Фтор в медицинской химии: век прогресса и 60-летняя ретроспектива избранных основных моментов» (PDF) . Медицинская химия будущего . 1 (5): 777–791. DOI : 10.4155 / fmc.09.65 . PMID 21426080 . Архивировано из оригинального (PDF) 22 октября 2013 года.
- Фишман, Майкл Л. (2001). «Опасности при производстве полупроводников». В Салливане, Джон Б.; Кригер, Гэри Р. (ред.). Клиническое состояние окружающей среды и токсическое воздействие (2-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. С. 431–465. ISBN 978-0-683-08027-8.
- Совет по продовольствию и питанию. «Референсные диетические дозы (DRI): рекомендуемые диетические нормы и адекватное потребление, элементы» (PDF) . Институт медицины национальных академий. Архивировано из оригинального (PDF) 13 ноября 2018 года . Проверено 2 января 2019 .
- Forster, P .; Ramaswamy, V .; Artaxo, P .; Berntsen, T .; Betts, R .; Fahey, DW; Haywood, J .; Lean, J .; Лоу, округ Колумбия; Myhre, G .; Nganga, J .; Prinn, R .; Raga, G .; Schulz, M .; Ван Дорланд, Р. (2007). «Изменения в атмосферных составляющих и в радиационном воздействии». У Соломона, S .; Manning, M .; Chen, Z .; Marquis, M .; Аверит, КБ; Тиньор, М .; Миллер, HL (ред.). Изменение климата 2007: основы физических наук. Вклад Рабочей группы I в Четвертый оценочный доклад Межправительственной группы экспертов по изменению климата . Кембридж: Кембриджский университет. С. 129–234. ISBN 978-0-521-70596-7.
- Фултон, Роберт Б .; Миллер, М. Майкл (2006). «Плавиковый шпат». В Когеле — Джессика Эльзея; Триведи, Нихил С .; Баркер, Джеймс М .; Круковски, Стэнли Т. (ред.). Промышленные полезные ископаемые и горные породы: сырьевые товары, рынки и использование . Литтлтон: Общество горного, металлургического и геологоразведочного общества (США). С. 461–473. ISBN 978-0-87335-233-8.
- Габриэль, JL; Миллер-младший, TF; Вольфсон, MR; Шаффер, TH (1996). «Количественные отношения структура-активность перфторированных гетероуглеводородов как потенциальных респираторных сред». Журнал ASAIO . 42 (6): 968–973. DOI : 10.1097 / 00002480-199642060-00009 . PMID 8959271 . S2CID 31161098 .
- Гейнс, Пол (18 октября 1998 г.). «Новая угроза кровяного допинга» . Нью-Йорк Таймс . Проверено 18 октября 2013 года .
- Gessner, BD; Beller, M .; Middaugh, JP; Уитфорд, GM (1994). «Острое отравление фтором из системы водоснабжения общего пользования». Медицинский журнал Новой Англии . 330 (2): 95–99. DOI : 10.1056 / NEJM199401133300203 . PMID 8259189 .
- Giesy, JP; Каннан, К. (2002). «Перфторхимические ПАВ в окружающей среде» . Наука об окружающей среде и технологии . 36 (7): 146A – 152A. Bibcode : 2002EnST … 36..146G . DOI : 10.1021 / es022253t . PMID 11999053 .
- Годфри, С. М.; Макаулифф, Калифорния; Mackie, AG; Притчард, Р.Г. (1998). «Неорганические производные элементов». В Нормане, Николас С. (ред.). Химия мышьяка, сурьмы и висмута . Лондон: Blackie Academic & Professional. С. 67–158. ISBN 978-0-7514-0389-3.
- Зеленый, ЮЗ; Слинн, DSL; Симпсон, РНФ; Войтек, AJ (1994). «Перфторуглеродные жидкости». В банках, RE; Умный, БЫТЬ; Tatlow, JC (ред.). Фторорганическая химия: принципы и применение . Нью-Йорк: Пленум Пресс. С. 89–119. ISBN 978-0-306-44610-8.
- Гринвуд, штат Нью-Йорк; Эрншоу, А. (1998). Химия элементов (2-е изд.). Оксфорд: Баттерворт Хайнеманн. ISBN 0-7506-3365-4.
- Гриббл, GW (2002). «Естественно встречающиеся фторорганические соединения». В Neison, AH (ред.). Фторорганические соединения . Справочник по химии окружающей среды. 3N . Берлин: Springer. С. 121–136. DOI : 10.1007 / 10721878_5 . ISBN 3-540-42064-9.
- Грот, Уолтер (2011). Фторированные иономеры (2-е изд.). Оксфорд и Уолтем: Эльзевир. ISBN 978-1-4377-4457-6.
- Хагманн, WK (2008). «Многие роли фтора в медицинской химии». Журнал медицинской химии . 51 (15): 4359–4369. DOI : 10.1021 / jm800219f . PMID 18570365 .
- Харбисон, GS (2002). «Электродипольная полярность наземных и низколежащих метастабильных возбужденных состояний НФ». Журнал Американского химического общества . 124 (3): 366–367. DOI : 10.1021 / ja0159261 . PMID 11792193 .
- Hasegawa, Y .; Otani, R .; Yonezawa, S .; Такашима, М. (2007). «Реакция между диоксидом углерода и элементарным фтором». Журнал химии фтора . 128 (1): 17–28. DOI : 10.1016 / j.jfluchem.2006.09.002 . ЛВП : 10098/1665 .
- Haxel, GB; Хедрик, JB; Оррис, GJ (2005). Штауфер, PH; Хендли II, JW (ред.). Редкоземельные элементы — критические ресурсы для высоких технологий, информационный бюллетень 087-02 (отчет). Геологическая служба США . Проверено 31 января 2014 года .
- Хейнс, Уильям М., изд. (2011). Справочник по химии и физике (92-е изд.). Бока-Ратон: CRC Press. ISBN 978-1-4398-5511-9.
- Хоффман, Роберт; Нельсон, Льюис; Хауленд, Мэри; Левин, Нил; Фломенбаум, Нил; Голдфрэнк, Льюис (2007). Руководство Голдфрэнка по чрезвычайным токсикологическим ситуациям . Нью-Йорк: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Honeywell (2006). Рекомендуемое лечение при воздействии плавиковой кислоты (PDF) . Морристаун: Honeywell International. Архивировано из оригинального (PDF) 8 октября 2013 года . Проверено 9 января 2014 года .
- Хугерс, Г. (2002). «Компоненты топливных элементов и их влияние на производительность». В Hoogers, G. (ред.). Справочник по технологии топливных элементов . Бока-Ратон: CRC Press. С. 4-1–4-27. ISBN 0-8493-0877-1.
- Hounshell, David A .; Смит, Джон Келли (1988). Наука и корпоративная стратегия: DuPont R&D, 1902–1980 . Кембридж: Издательство Кембриджского университета. ISBN 0-521-32767-9.
- Hultén, P .; Höjer, J .; Ludwigs, U .; Янсон, А. (2004). «Гексафтор против стандартной дезактивации для снижения системной токсичности после воздействия на кожу плавиковой кислоты». Клиническая токсикология . 42 (4): 355–361. DOI : 10,1081 / CLT-120039541 . PMID 15461243 . S2CID 27090208 .
- ICIS (2 октября 2006 г.). «Сокровищница фтора» . Деловая информация компании Reed . Проверено 24 октября 2013 года .
- Jaccaud, M .; Faron, R .; Devilliers, D .; Романо, Р. (2000). «Фтор». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. С. 381–395. DOI : 10.1002 / 14356007.a11_293 .
- Джонсон, Линда А. (28 декабря 2011 г.). «Несмотря ни на что, Lipitor стал лидером продаж в мире» . The Boston Globe . Проверено 24 октября 2013 года .
- Kacmarek, Роберт М .; Wiedemann, Herbert P .; Лавин, Филип Т .; Ведель, Марк К .; Tütüncü, Ahmet S .; Слуцкий, Артур С. (2006). «Частичная жидкостная вентиляция у взрослых пациентов с острым респираторным дистресс-синдромом». Американский журнал респираторной медицины и реанимации . 173 (8): 882–9. DOI : 10,1164 / rccm.200508-1196OC . PMID 16254269 .
- Катакусе, Ицуо; Ичихара, Тошио; Ито, Хироюки; Сакураи, Тору; Мацуо, Такэкиё (1999). «Эксперимент SIMS». In Arai, T .; Mihama, K .; Ямамото, К .; Сугано, С. (ред.). Мезоскопические материалы и кластеры: их физико-химические свойства . Токио: Коданша. С. 259–273. ISBN 4-06-208635-2.
- Келли, Т.Д .; Миллер, ММ (2005). «Историческая статистика плавикового шпата» . Геологическая служба США . Проверено 10 февраля 2014 .
- Кеплингер, М.Л .; Суисса, LW (1968). «Токсичность фтора при кратковременном вдыхании». Журнал Американской ассоциации промышленной гигиены . 29 (1): 10–18. DOI : 10.1080 / 00028896809342975 . PMID 5667185 .
- Kern, S .; Hayward, J .; Робертс, С .; Ричардсон, JW; Rotella, FJ; Содерхольм, Л .; Cort, B .; Tinkle, M .; West, M .; Hoisington, D .; Лендер, Джорджия (1994). «Температурное изменение структурных параметров в тетрафторидах актинидов» . Журнал химической физики . 101 (11): 9333–9337. Bibcode : 1994JChPh.101.9333K . DOI : 10.1063 / 1.467963 .<
- Хряччев, Л .; Петтерссон, М .; Runeberg, N .; Lundell, J .; Рясянен, М. (2000). «Стабильное соединение аргона» . Природа . 406 (6798): 874–876. Bibcode : 2000Natur.406..874K . DOI : 10.1038 / 35022551 . PMID 10972285 . S2CID 4382128 .
- King, DE; Malone, R .; Лилли, SH (2000). «Новая классификация и обновление хинолоновых антибиотиков» . Американский семейный врач . 61 (9): 2741–2748. PMID 10821154 . Проверено 8 октября 2013 года .
- Кирш, Пер (2004). Современная фторорганическая химия: синтез, реакционная способность, применения . Вайнхайм: Wiley-VCH. ISBN 978-3-527-30691-6.
- Кисса, Эрик (2001). Фторированные поверхностно-активные вещества и репелленты (2-е изд.). Нью-Йорк: Марсель Деккер. ISBN 978-0-8247-0472-8.
- Куриакосе, AK; Маркгрейв, JL (1965). «Кинетика реакций элементарного фтора. IV. Фторирование графита». Журнал физической химии . 69 (8): 2772–2775. DOI : 10.1021 / j100892a049 .
- Лагоу, Р.Дж. (1970). Реакции элементарного фтора; Новый подход к химии фтора (PDF) (доктор философии, Университет Райса, Техас). Анн-Арбор: UMI.
- Lau, C .; Anitole, K .; Hodes, C .; Проложенный.; Pfahles-Hutchens, A .; Сид, Дж. (2007). «Перфторалкиловые кислоты: обзор результатов мониторинга и токсикологических исследований» . Токсикологические науки . 99 (2): 366–394. DOI : 10.1093 / toxsci / kfm128 . PMID 17519394 .
- Ли, Стивен; и другие. (2014). «Монофторацетатсодержащие растения, потенциально токсичные для домашнего скота». Журнал сельскохозяйственной и пищевой химии . Публикации ACS. 62 (30): 7345–7354. DOI : 10.1021 / jf500563h . PMID 24724702 .
- Льюарс, Эррол Г. (2008). Моделирование чудес: вычислительное ожидание новых молекул . Дордрехт: Спрингер. ISBN 978-1-4020-6972-7.
- Лиде, Дэвид Р. (2004). Справочник по химии и физике (84-е изд.). Бока-Ратон: CRC Press. ISBN 0-8493-0566-7.
- Лидин, Р .; Молочко, В.А.; Андреева, Л.Л. (2000). Химические свойства неорганических веществ [ Химические свойства неорганических веществ ] (на русском языке ). Москва: Химия. ISBN 5-7245-1163-0.
- Liteplo, R .; Gomes, R .; Howe, P .; Малькольм, Х. (2002). Критерии гигиены окружающей среды 227 (фтор) . Женева: Программа Организации Объединенных Наций по окружающей среде; Международная организация труда; Всемирная организация здравоохранения. ISBN 92-4-157227-2. Проверено 14 октября 2013 года .
- Lusty, PAJ; Браун, TJ; Ward, J .; Блумфилд, С. (2008). «Необходимость местного производства плавикового шпата в Англии» . Британская геологическая служба . Проверено 13 октября 2013 года .
- Маккей, Кеннет Малкольм; Маккей, Розмари Энн; Хендерсон, В. (2002). Введение в современную неорганическую химию (6-е изд.). Челтнем: Нельсон Торнс. ISBN 0-7487-6420-8.
- Макомбер, Роджер (1996). Органическая химия . 1 . Саусалито: Университетские научные книги. ISBN 978-0-935702-90-3.
- Маргграф, Андреас Сигизмун (1770). «Наблюдение касается неравномерного улетучивания, вызываемого партией de l’espece de Pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d’hesperos; laquelle volatilisation a été effectuée au moyen des acides» [ Наблюдение за заметным улетучиванием части камня, которому дали название flosse, flüsse, flus-spaht, а также hesperos; улетучивание которых осуществлялось с помощью кислот]. Mémoires de l’Académie royale des Sciences et belles-lettres (на французском языке). XXIV : 3–11.
- Мартин, Джон В., изд. (2007). Краткая энциклопедия структуры материалов . Оксфорд и Амстердам: Эльзевир. ISBN 978-0-08-045127-5.
- Марья, CM (2011). Учебник стоматологии общественного здравоохранения . Нью-Дели: издательство Jaypee Brothers Medical. ISBN 978-93-5025-216-1.
- Мацуи, М. (2006). «Фторсодержащие красители». Ин Ким, Сон Хун (ред.). Функциональные красители . Орландо: Academic Press. С. 257–266. ISBN 978-0-12-412490-5.
- Meusinger, Рейнхард; Чиппендейл, А. Маргарет; Фэрхерст, Ширли А. (2012). «Ядерный магнитный резонанс и спектроскопия электронного спинового резонанса». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. С. 609–660. DOI : 10.1002 / 14356007.b05_471 .
- Мейер, Юджин (1977). Химия опасных материалов . Энглвудские скалы: Прентис-холл. ISBN 978-0-13-129239-0.
- Миллер, М. Майкл (2003a). «Плавиковый шпат» (PDF) . Ежегодник полезных ископаемых Геологической службы США . Геологическая служба США. С. 27.1–27.12.
- Миллер, М. Майкл (2003b). «Минеральные ресурсы месяца, плавиковый шпат» (PDF) . Геологическая служба США . Проверено 24 октября 2013 года .
- Митчелл, Э. Сиобан (2004). Антидепрессанты . Нью-Йорк: Издательство Chelsea House. ISBN 978-1-4381-0192-7.
- Moeller, T .; Байлар, JC; Клейнберг (1980). Химия с неорганическим качественным анализом (3-е изд.). Нью-Йорк: Academic Press. ISBN 0-12-503350-8.
- Муассан, Анри (1886). «Action d’un courant électrique sur l’acide fluorhydrique anhydre» . Comptes rendus hebdomadaires des séances de l’Académie des Sciences (на французском языке). 102 : 1543–1544 . Проверено 9 октября 2013 года .
- Маккой, М. (2007). «ИССЛЕДОВАНИЕ: вызовы рынка ослабляют уверенность руководителей мировой химической отрасли». Новости химии и машиностроения . 85 (23): 11. DOI : 10.1021 / Сеп-v085n023.p011a .
- Мур, Джон В .; Станицкий, Конрад Л .; Юрс, Питер К. (2010). Принципы химии: молекулярная наука . Бельмонт: Брукс / Коул. ISBN 978-0-495-39079-4.
- Морроу, С.И.; Перри, Д. Д.; Коэн, MS (1959). «Образование тетрафторида диазота в реакции фтора и аммиака». Журнал Американского химического общества . 81 (23): 6338–6339. DOI : 10.1021 / ja01532a066 .
- Мюллер, Питер (2009). «5.067 Уточнение кристаллической структуры» (PDF) . Кембридж: MIT OpenCourseWare . Проверено 13 октября 2013 года .
- Мерфи, компакт-диск; Schaffrath, C .; О’Хаган, Д. (2003). «Фторированные натуральные продукты: биосинтез фторацетата и 4-фторотреонина в Streptomyces cattleya ». Chemosphere . 52 (2): 455–461. Bibcode : 2003Chmsp..52..455M . DOI : 10.1016 / S0045-6535 (03) 00191-7 . PMID 12738270 .
- Мурти, К. Парамешвара; Мехди Али, СФ; Ашок, Д. (1995). Университетская химия . Я . Нью-Дели: New Age International. ISBN 978-81-224-0742-6.
- Национальный совет здравоохранения и медицинских исследований (2007 г.). Систематический обзор эффективности и безопасности фторирования, Часть A: Обзор методологии и результатов (PDF) . Канберра: Правительство Австралии. ISBN 978-1-86496-421-9. Архивировано из оригинального (PDF) 13 января 2012 года . Проверено 8 октября 2013 года .
- Национальный институт безопасности и гигиены труда (1994). «Фтор» . Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH) . Проверено 15 января 2014 года .
- Национальный институт безопасности и гигиены труда (1994). «Хлор» . Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH) . Проверено 13 июля 2014 года .
- Национальный центр ядерных данных . «База данных NuDat 2.1» . Брукхейвенская национальная лаборатория . Проверено 25 октября 2013 года .
- Национальное управление океанических и атмосферных исследований. «UN / NA 1045 (Таблица данных по флюору в Организации Объединенных Наций / Северной Америке)» . Проверено 15 октября 2013 года .
- Наваррини, Уолтер; Вентурини, Франческо; Тортелли, Вито; Башак, Субир; Pimparkar, Ketan P .; Адамо, Андреа; Йенсен, Клавс Ф. (2012). «Прямое фторирование оксида углерода в микрореакторах». Журнал химии фтора . 142 : 19–23. DOI : 10.1016 / j.jfluchem.2012.06.006 .
- Нельсон, Юджин В. (1947). « „ Bad Man“из элементов» . Популярная механика . 88 (2): 106–108, 260.
- Нельсон, JM; Чиллер, ТМ; Пауэрс, JH; Ангуло, FJ (2007). «Безопасность пищевых продуктов: устойчивые к фторхинолонам виды Campylobacter и прекращение использования фторхинолонов в птицеводстве: история успеха в области общественного здравоохранения» (PDF) . Клинические инфекционные болезни . 44 (7): 977–980. DOI : 10.1086 / 512369 . PMID 17342653 .
- Нильсен, Форрест Х. (2009). «Микроэлементы в парентеральном питании: бор, кремний и фтор» . Гастроэнтерология . 137 (5): S55–60. DOI : 10,1053 / j.gastro.2009.07.072 . PMID 19874950 . Проверено 29 апреля 2018 года .
- Норвуд, Чарльз Дж .; Фос, Ф. Юлиус (1907). Геологическая служба Кентукки, Бюллетень № 9: Месторождения плавикового шпата Кентукки . Геологическая служба Кентукки.
- Нури, S .; Silvi, B .; Гиллеспи, Р.Дж. (2002). «Химическая связь в гипервалентных молекулах: актуально ли правило октета?» (PDF) . Неорганическая химия . 41 (8): 2164–2172. DOI : 10.1021 / ic011003v . PMID 11952370 . Проверено 23 мая 2012 года .
- О’Хаган, Д. (2008). «Понимание фторорганической химии. Введение в связь C – F». Обзоры химического общества . 37 (2): 308–319. DOI : 10.1039 / b711844a . PMID 18197347 .
- O’Hagan, D .; Schaffrath, C .; Cobb, SL; Гамильтон, JTG; Мерфи, компакт-диск (2002). «Биохимия: биосинтез фторорганической молекулы» . Природа . 416 (6878): 279. Bibcode : 2002Natur.416..279O . DOI : 10.1038 / 416279a . PMID 11907567 . S2CID 4415511 .
- Окада, Т .; Xie, G .; Gorseth, O .; Kjelstrup, S .; Nakamura, N .; Аримура, Т. (1998). «Ионно-водные характеристики мембран нафиона как электролитов». Electrochimica Acta . 43 (24): 3741–3747. DOI : 10.1016 / S0013-4686 (98) 00132-7 .
- Оказое Т. (2009). «Обзор истории фторорганической химии с точки зрения материальной промышленности» . Труды Японской академии, серии B . 85 (8): 276–289. Bibcode : 2009PJAB … 85..276O . DOI : 10,2183 / pjab.85.276 . PMC 3621566 . PMID 19838009 .
- Olivares, M .; Уауи, Р. (2004). Основные питательные вещества в питьевой воде (проект) (PDF) (отчет). Всемирная организация здравоохранения (ВОЗ). Архивировано из оригинального (PDF) 19 октября 2012 года . Проверено 14 октября 2013 года .
- Паренте, Лука (2001). «Разработка синтетических глюкокортикоидов». В Goulding, Nicolas J .; Цветок, Род Дж. (Ред.). Глюкокортикоиды . Базель: Биркхойзер. С. 35–53. ISBN 978-3-7643-6059-7.
- Партингтон, младший (1923). «Ранняя история плавиковой кислоты». Мемуары и материалы Манчестерского литературно-философского общества . 67 (6): 73–87.
- Патнаик, Прадёт (2007). Всеобъемлющее руководство по опасным свойствам химических веществ (3-е изд.). Хобокен: Джон Уайли и сыновья. ISBN 978-0-471-71458-3.
- Полинг, Линус (1960). Природа химической связи (3-е изд.). Итака: Издательство Корнельского университета. ISBN 978-0-8014-0333-0.
- Pauling, L .; Keaveny, I .; Робинсон, А.Б. (1970). «Кристаллическая структура α-фтора». Журнал химии твердого тела . 2 (2): 225–227. Bibcode : 1970JSSCh … 2..225P . DOI : 10.1016 / 0022-4596 (70) 90074-5 .
- Перри, Дейл Л. (2011). Справочник неорганических соединений (2-е изд.). Бока-Ратон: CRC Press. ISBN 978-1-4398-1461-1.
- Питцер, К.С. (1975). «Фториды радона и элемент 118» . Журнал химического общества, химические коммуникации (18): 760b – 761. DOI : 10.1039 / C3975000760B .
- Питцер, Кеннет С. , изд. (1993). Молекулярная структура и статистическая термодинамика: избранные статьи Кеннета С. Питцера . Сингапур: World Scientific Publishing. ISBN 978-981-02-1439-5.
- Пиццо, G .; Пископо, MR; Пиццо, I .; Джулиана, Г. (2007). «Фторирование воды в общинах и профилактика кариеса: критический обзор» (PDF) . Клинические исследования полости рта . 11 (3): 189–193. DOI : 10.1007 / s00784-007-0111-6 . PMID 17333303 . S2CID 13189520 .
- Познер, Стефан (2011). «Перфторированные соединения: наличие и использование в продуктах». В Knepper, Thomas P .; Большой, Фрэнк Т. (ред.). Полифторированные химикаты и продукты трансформации . Гейдельберг: Springer Science + Business Media. С. 25–40. ISBN 978-3-642-21871-2.
- Познер, Стефан; и другие. (2013). Пер- и полифторированные вещества в странах Северной Европы: использование и токсикология (PDF) . Копенгаген: Совет министров северных стран. DOI : 10.6027 / TN2013-542 . ISBN 978-92-893-2562-2.
- Прескорн, Шелдон Х. (1996). Клиническая фармакология селективных ингибиторов обратного захвата серотонина . Caddo: профессиональные коммуникации. ISBN 978-1-884735-08-0.
- Принсипи, Лоуренс М. (2012). Секреты алхимии . Чикаго: Издательство Чикагского университета. ISBN 978-0-226-68295-2.
- Proudfoot, AT; Брэдберри, С.М. Вейл, Дж. А. (2006). «Отравление фторацетатом натрия». Токсикологические обзоры . 25 (4): 213–219. DOI : 10.2165 / 00139709-200625040-00002 . PMID 17288493 . S2CID 29189551 .
- PRWeb (28 октября 2010 г.). «Согласно новому отчету Global Industry Analysts, Inc., к 2015 году мировой рынок фторсодержащих химикатов превысит 2,6 миллиона тонн» . prweb.com . Проверено 24 октября 2013 года .
- PRWeb (23 февраля 2012 г.). «Согласно новому отчету Global Industry Analysts, Inc., к 2017 году мировой рынок плавикового шпата достигнет 5,94 миллиона метрических тонн» . prweb.com . Проверено 24 октября 2013 года .
- PRWeb (7 апреля 2013 г.). «Рынок фторполимеров будет расти со среднегодовым темпом роста 6,5% и достигнет 9 446,0 миллионов долларов к 2016 году — новый отчет MarketsandMarkets» . prweb.com . Проверено 24 октября 2013 года .
- Пюккё, Пекка; Ацуми, Митико (2009). «Ковалентные радиусы молекул с двойной связью для элементов Li – E112». Химия: Европейский журнал . 15 (46): 12770–9. DOI : 10.1002 / chem.200901472 . PMID 19856342 .
- Рагхаван, PS (1998). Концепции и проблемы неорганической химии . Дели: Издательство Discovery. ISBN 978-81-7141-418-5.
- Радж, П. Притхви; Эрдин, Сердар (2012). Обезболивающие процедуры: иллюстрированное руководство . Чичестер: Джон Уайли и сыновья. ISBN 978-0-470-67038-5.
- Рамкумар, Джейшри (2012). «Перфторсульфонатная мембрана Nafion: уникальные свойства и различные применения». In Banerjee, S .; Тяги, АК (ред.). Функциональные материалы: подготовка, обработка и применение . Лондон и Уолтем: Эльзевир. С. 549–578. ISBN 978-0-12-385142-0.
- Редди, Д. (2009). «Неврология эндемического флюороза скелета» . Неврология Индии . 57 (1): 7–12. DOI : 10.4103 / 0028-3886.48793 . PMID 19305069 .
- Ренда, Агостино; Феннер, Еше; Гибсон, Брэд К .; Каракас, Аманда I .; Латтанцио, Джон К.; Кэмпбелл, Саймон; Чиффи, Алессандро; Кунья, Катя; Смит, Верн В. (2004). «О происхождении фтора в Млечном Пути». Ежемесячные уведомления Королевского астрономического общества . 354 (2): 575–580. arXiv : astro-ph / 0410580 . Bibcode : 2004MNRAS.354..575R . DOI : 10.1111 / j.1365-2966.2004.08215.x . S2CID 12330666 .
- Реннер, Р. (2006). «Долгое и короткое время перфторированных заменителей» . Наука об окружающей среде и технологии . 40 (1): 12–13. Bibcode : 2006EnST … 40 … 12R . DOI : 10.1021 / es062612a . PMID 16433328 .
- Роудс, Дэвид Уолтер (2008). Исследования Нафиона с помощью широкополосной диэлектрической спектроскопии (докторская диссертация, Университет Южного Миссисипи, штат Массачусетс). Анн-Арбор. ISBN 978-0-549-78540-8.
- Richter, M .; Hahn, O .; Фукс, Р. (2001). «Пурпурный флюорит: пигмент малоизвестных художников и его использование в поздней готике и ранней ренессансной живописи в Северной Европе». Исследования в области сохранения . 46 (1): 1–13. DOI : 10,1179 / sic.2001.46.1.1 . JSTOR 1506878 . S2CID 191611885 .
- Ридель, Себастьян; Каупп, Мартин (2009). «Наивысшие степени окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–624. DOI : 10.1016 / j.ccr.2008.07.014 .
- Рипа, LW (1993). «Полвека общественного фторирования воды в Соединенных Штатах: обзор и комментарии» (PDF) . Журнал стоматологии общественного здравоохранения . 53 (1): 17–44. DOI : 10.1111 / j.1752-7325.1993.tb02666.x . PMID 8474047 . Архивировано из оригинального (PDF) 4 марта 2009 года.
- Роблин, I .; Городской, М .; Flicoteau, D .; Martin, C .; Прадо, Д. (2006). «Местное лечение экспериментальных ожогов кожи плавиковой кислотой 2,5% глюконатом кальция». Журнал ожогового ухода и исследований . 27 (6): 889–894. DOI : 10,1097 / 01.BCR.0000245767.54278.09 . PMID 17091088 . S2CID 3691306 .
- Salager, Жан-Луи (2002). Поверхностно-активные вещества: типы и использование (PDF) . Буклет FIRP № 300-А. Лаборатория формул, интерфейсов, реологии и процессов, Андский университет . Проверено 13 октября 2013 года .
- Сэндфорд, Грэм (2000). «Фторорганическая химия». Философские труды . 358 (1766): 455–471. Bibcode : 2000RSPTA.358..455S . DOI : 10,1098 / rsta.2000.0541 . S2CID 202574641 .
- Саркар, С. (2008). «Искусственная кровь» . Индийский журнал реанимации . 12 (3): 140–144. DOI : 10.4103 / 0972-5229.43685 . PMC 2738310 . PMID 19742251 .
- Шееле, Карл Вильгельм (1771). «Undersŏkning om fluss-spat och dess syra» [Исследование флюорита и его кислоты]. Kungliga Svenska Vetenskapsademiens Handlingar [Труды Шведской королевской академии наук] (на шведском языке). 32 : 129–138.
- Шиммейер, С. (2002). «В поисках кровезаменителя» . Иллюминат . Колумбия: Университет Южной Каролины. 15 (1). Архивировано из оригинального 2 -го октября 2011 года . Проверено 15 октября 2013 года .
- Schlöder, T .; Ридель, С. (2012). «Исследование гетеродимерных и гомодимерных радикальных катионов ряда: [F 2 O 2 ] + , [F 2 Cl 2 ] + , [Cl 2 O 2 ] + , [F 4 ] + и [Cl 4 ] + ». RSC Advances . Королевское химическое общество . 2 (3): 876–881. Bibcode : 2012RSCAd … 2..876S . DOI : 10.1039 / C1RA00804H .
- Schmedt Auf Der Günne, Jörn; Мангстль, Мартин; Краус, Флориан (2012). «Присутствие дифтора F2 в естественных условиях и количественной оценке с помощью ЯМР-спектроскопии». Angewandte Chemie International Edition . 51 (31): 7847–7849. DOI : 10.1002 / anie.201203515 . ISSN 1521-3773 . PMID 22763992 .
- Schmitz, A .; Kälicke, T .; Willkomm, P .; Grünwald, F .; Kandyba, J .; Шмитт, О. (2000). «Использование позитронно-эмиссионной томографии фтор-18 фтор-2-дезокси-D-глюкозы в оценке процесса туберкулезного спондилита» (PDF) . Журнал заболеваний позвоночника . 13 (6): 541–544. DOI : 10.1097 / 00002517-200012000-00016 . PMID 11132989 . Проверено 8 октября 2013 года .
- Schulze-Makuch, D .; Ирвин, Л.Н. (2008). Жизнь во Вселенной: ожидания и ограничения (2-е изд.). Берлин: Springer-Verlag. ISBN 978-3-540-76816-6.
- Шварц, Джозеф А. (2004). Ложка дегтя: 70 увлекательных комментариев о науке повседневной жизни . Торонто: ECW Press. ISBN 1-55022-621-5.
- Сеннинг, А. (2007). Словарь хемоэтимологии Эльзевьера: причины и причины химической номенклатуры и терминологии . Амстердам и Оксфорд: Эльзевир. ISBN 978-0-444-52239-9.
- Шаффер, TH; Вольфсон, MR; Кларк-младший, LC (1992). «Жидкостная вентиляция». Детская пульмонология . 14 (2): 102–109. DOI : 10.1002 / ppul.1950140208 . PMID 1437347 . S2CID 222167378 .
- Шин, Ричард Д .; Сильверберг, Марк А. (2013). «Токсичность фтора» . Medscape . Проверено 15 октября 2013 года .
- Шрайвер, Дувард; Аткинс, Питер (2010). Руководство по решениям для неорганической химии . Нью-Йорк: WH Freeman. ISBN 978-1-4292-5255-3.
- Шульман, JD; Уэллс, Л. М. (1997). «Острая токсичность фтора в результате проглатывания домашних стоматологических продуктов у детей от рождения до 6 лет». Журнал стоматологии общественного здравоохранения . 57 (3): 150–158. DOI : 10.1111 / j.1752-7325.1997.tb02966.x . PMID 9383753 .
- Зигемунд, штат Джорджия; Schwertfeger, W .; Feiring, A .; Смарт, Б .; Behr, F .; Vogel, H .; МакКьюсик, Б. (2000). «Соединения фтора, органические». Энциклопедия промышленной химии Ульмана . 15 . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a11_349 .
- Слай, Орвилл М. (2012). «Средства пожаротушения». У Ульманна, Франца (ред.). Энциклопедия промышленной химии Ульмана . 15 . Вайнхайм: Wiley-VCH. С. 1–11. DOI : 10.1002 / 14356007.a11_113.pub2 . ISBN 978-3527306732.
- Steenland, K .; Флетчер, Т .; Савиц, Д.А. (2010). «Эпидемиологические данные о влиянии перфтороктановой кислоты на здоровье» . Перспективы гигиены окружающей среды . 118 (8): 1100–1108. DOI : 10.1289 / ehp.0901827 . PMC 2920088 . PMID 20423814 .
- Стиллман, Джон Максон (декабрь 1912 г.). «Василий Валентин, мистификация семнадцатого века» . Ежемесячный научно-популярный журнал . 81 . Проверено 14 октября 2013 года .
- Сторер, Фрэнк Х. (1864). Первые наброски словаря растворимости химических веществ . Кембридж: Север и Фрэнсис.
- Суинсон, Джоэл (июнь 2005 г.). «Фтор — жизненно важный элемент в аптечке» (PDF) . ФармаХим . Фармацевтическая химия: 26–27. Архивировано из оригинального (PDF) 8 февраля 2012 года . Проверено 9 октября 2013 года .
- Табер, Эндрю (22 апреля 1999 г.). «Умирая ехать» . Салон . Проверено 18 октября 2013 года .
- Tanner Industries (январь 2011 г.). «Безводный аммиак: (MSDS) Паспорт безопасности материала» . tannerind.com . Проверено 24 октября 2013 года .
- Теодоридис, Джордж (2006). «Фторсодержащие агрохимикаты: обзор последних разработок». В Трессо, Ален (ред.). Фтор и окружающая среда: агрохимия, археология, экологическая химия и вода . Амстердам и Оксфорд: Эльзевир. С. 121–176. ISBN 978-0-444-52672-4.
- Мульт, Ричард (1 сентября 2011 г.). «Открытие фтора» . Образование в области химии . Vol. 48 нет. 5. Королевское химическое общество . С. 148–151. ISSN 0013-1350 .
- Исследование рынка прозрачности (17 мая 2013 г.). «Ожидается, что к 2018 году мировой рынок фторсодержащих химикатов достигнет 21,5 млрд долларов США: исследование прозрачности рынка» . Блог исследования рынка прозрачности. Архивировано из оригинального 22 февраля 2014 года . Проверено 15 октября 2013 года .
- Ульманн, Фриц (2008). Волокна Ульмана (2 тома). Вайнхайм: Wiley-VCH. ISBN 978-3-527-31772-1.
- Агентство по охране окружающей среды США (1996). «RED Facts: Трифлуралин» (PDF) . Архивировано из оригинального (PDF) 18 октября 2013 года . Проверено 17 октября 2013 года .
- Агентство по охране окружающей среды США (2012). «Новые загрязнители — перфтороктановый сульфонат (ПФОС) и перфтороктановая кислота (ПФОК)» (PDF) . Архивировано из оригинального (PDF) 29 октября 2013 года . Проверено 4 ноября 2013 года .
- Агентство по охране окружающей среды США (2013a). «Озоноразрушающие вещества I класса» . Архивировано из оригинального 10 декабря 2010 года . Проверено 15 октября 2013 года .
- Агентство по охране окружающей среды США (2013b). «Поэтапный отказ от ГХФУ (озоноразрушающих веществ класса II)» . Проверено 15 октября 2013 года .
- Виль, Клод; Голдвайт, Гарольд (1993). «Нобелевский лауреат 1906 года: Анри Муассан, 1852–1907». В Laylin, К. Джеймс (ред.). Нобелевские лауреаты по химии, 1901–1992 . Вашингтон: Американское химическое общество; Фонд химического наследия. С. 35–41 . ISBN 978-0-8412-2690-6.
- Вигуро, П. (1961). «Гиромагнитное отношение протона». Современная физика . 2 (5): 360–366. Bibcode : 1961ConPh … 2..360V . DOI : 10.1080 / 00107516108205282 .
- Виллальба, Гара; Эйрес, Роберт У .; Шредер, Ганс (2008). «Учет фтора: производство, использование и потери». Журнал промышленной экологии . 11 : 85–101. DOI : 10.1162 / jiec.2007.1075 .
- Уолш, Кеннет А. (2009). Химия и переработка бериллия . Парк материалов: ASM International. ISBN 978-0-87170-721-5.
- Уолтер, П. (2013). «Honeywell инвестирует 300 млн долларов в экологически чистый хладагент» . Мир химии .
- Weeks, ME (1932). «Открытие элементов. XVII. Семейство галогенов». Журнал химического образования . 9 (11): 1915–1939. Bibcode : 1932JChEd … 9.1915W . DOI : 10.1021 / ed009p1915 .
- Вернер, Нидерланды; Hecker, MT; Сетхи, АК; Донски, CJ (2011). «Ненужное использование фторхинолоновых антибиотиков у госпитализированных пациентов» . BMC Инфекционные болезни . 11 : 187–193. DOI : 10.1186 / 1471-2334-11-187 . PMC 3145580 . PMID 21729289 .
- Виберг, Эгон; Виберг, Нильс; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Сан-Диего: Academic Press. ISBN 978-0-12-352651-9.
- Уилли, Рональд Р. (2007). Практическое оборудование, материалы и процессы для оптических тонких пленок . Шарлевуа: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L .; Брейкер, Уильям (2001). «Фтор». Книга данных Matheson Gas (7-е изд.). Парсиппани: Мэтисон Три-Газ. ISBN 978-0-07-135854-5.
- Йунг, Калифорния (2008). «Систематический обзор эффективности и безопасности фторирования» . Доказательная стоматология . 9 (2): 39–43. DOI : 10.1038 / sj.ebd.6400578 . PMID 18584000 .
- Янг, Дэвид А. (1975). Фазовые диаграммы элементов (отчет). Ливерморская лаборатория Лоуренса . Проверено 10 июня 2011 года .
- Зарейталабад, П .; Siemens, J .; Hamer, M .; Амелунг, В. (2013). «Перфтороктановая кислота (ПФОК) и перфтороктансульфоновая кислота (ПФОС) в поверхностных водах, отложениях, почвах и сточных водах — обзор концентраций и коэффициентов распределения». Chemosphere . 91 (6): 725–32. Bibcode : 2013Chmsp..91..725Z . DOI : 10.1016 / j.chemosphere.2013.02.024 . PMID 23498059 .
- Зорич, Роберт (1991). Справочник по качеству изготовления интегральных схем . Сан-Диего: Academic Press. ISBN 978-0-323-14055-3.
Внешние ссылки
СМИ, связанные с фтором на Викискладе?
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре меньше 45,6 K, кристаллическая решетка моноклинная, пространственная группа C 2/c, параметры a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4[5][6].
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубическая, параметры a = 0,667 нм, Z = 8.
Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[7]:
- Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен, кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[8].
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[9].
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов[10]).
Применение
Применение в химии
Газообразный фтор используется для получения:
- гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
- трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
- шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
- фреонов — хороших хладагентов
- тефлонов — химически инертных полимеров
- гексафтороалюмината натрия — для последующего получения алюминия электролизом
- различных соединений фтора
Ракетная техника
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
Применение в медицине
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др.).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно[11].
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50% [12].
Предельно допустимая концентрация связанного фтора[13] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
См. также
| Фтор на Викискладе? |
- Фториды
- Соединения фтора в ракетной технике
- Соединения фтора в медицине
- Категория:Соединения фтора
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. англ. — Подробней о кристаллической структуре фтора
Примечания
- ↑ http://www.xumuk.ru/nekrasov/vii-01.html
- ↑ Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 198.
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Главным образом в эмали зубов
- ↑ Journal of Solid State Chemistry, Vol. 2, Issue 2, 1970, P. 225—227.
- ↑ J. Chem. Phys. 49, 1902 (1968)
- ↑ Гринвуд Н., Эрншо А. «Химия элементов» т.2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- ↑ Ахметов Н. С. «Общая и неорганическая химия».
- ↑ Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- ↑ Фтор в Популярной библиотеке химических элементов
- ↑ По данным National Toxicology Program
- ↑ Справочник потребителя. Журнал без рекламы
- ↑ в виде фторидов и фторорганических соединений
Ссылки
- Фтор на Webelements
- Фтор в Популярной библиотеке химических элементов
- Информация о Перфторане
- Кровезаменитель Перфторан // Вестник РАН, 1997, том 67, N 11, с. 998—1013
- Фтор
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
|
Соединения фтора |
|---|
|
Гексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF) |
| |
|
|---|---|
| Алканы и циклоалканы |
Фреоны · Перфторуглеводороды · Тетрафторид углерода |
| Алкены и алкины |
Фторолефины · Тетрафторэтилен · Трифторхлорэтилен · Винилиденфторид · Винилфторид · Перфторизобутилен · Гексафторпропилен |
| Спирты и кетоны |
Трифторэтанол · Фторэтанол · Гексафторацетон |
| Кислоты и ангидриды |
Трифторуксусная кислота · Фторуксусная кислота · Олигомеры гексафторпропиленоксида · Карбонилфторид |
| Элементоорганические соединения (N,S,P) |
Трифторметилфенотиазин · Трифтазин · Фторацизин · Фторафур · Фторфеназин · Фторурацил · Зарин · Зоман |
| Ароматические соединения |
Гексафторбензол · Октафтортолуол · Бензотрифтоид |
| Высокомолекулярные соединения |
Фторопласты · Политетрафторэтилен · Поливинилиденфторид · Фторкаучуки |
Категории:
- Химические элементы
- Фториды
- Галогены
- Неметаллы
- Высокоопасные вещества
- Фтор
Wikimedia Foundation.
2010.
Синонимы:
Полезное
Смотреть что такое «Фтор» в других словарях:
-
фтор — фтор, а … Русский орфографический словарь
-
фтор — фтор/ … Морфемно-орфографический словарь
-
фтор — а; м. [от греч. phthoros гибель, разрушение] Химический элемент (F), светло жёлтый газ с едким запахом. Добавлять в питьевую воду ф. * * * фтор (лат. Fluorum), химический элемент VII группы периодической системы, относится к галогенам. Свободный… … Энциклопедический словарь
-
ФТОР — (лат. Fluorum) F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам. Бледно желтый газ с резким запахом, tпл ?219,699 .С, tкип ?188,200 .С, плотность 1,70 г/см³.… … Большой Энциклопедический словарь
-
Фтор — F (от греч. phthoros гибель, разрушение, лат. Fluorum * a. fluorine; н. Fluor; ф. fluor; и. fluor), хим. элемент VII группы периодич. системы Mенделеева, относится к галогенам, ат. н. 9, ат. м. 18,998403. B природе 1 стабильный изотоп 19F … Геологическая энциклопедия
-
ФТОР — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2шC. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Современная энциклопедия
-
Фтор — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2°C. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Иллюстрированный энциклопедический словарь
-
ФТОР — (символ F), газообразный токсичный элемент группы ГАЛОГЕНОВ (элементы VII группы периодической таблицы), впервые выделенный в 1886 г. Его основными источниками являются флюорит и криолит. Это бледно желтое вещество, получаем в результате… … Научно-технический энциклопедический словарь
-
ФТОР — ФТОР, фтора, муж. (греч. phthoros гибель) (хим.). Химический элемент, бесцветный газ с едким запахом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
-
ФТОР — ФТОР, а, муж. Химический элемент, ядовитый бесцветный газ с едким запахом. | прил. фтористый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
-
ФТОР — ФТОР, см. флюор. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Фтор, свойства атома, химические и физические свойства.
F 9 Фтор
18,998403163(6) 1s2 2s2 2p5
Фтор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 9. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), втором периоде периодической системы.
Атом и молекула фтора. Формула фтора. Строение атома фтора
Изотопы и модификации фтора
Свойства фтора (таблица): температура, плотность, давление и пр.
Физические свойства фтора
Химические свойства фтора. Взаимодействие фтора. Химические реакции с фтором
Получение фтора
Применение фтора
Таблица химических элементов Д.И. Менделеева
Атом и молекула фтора. Формула фтора. Строение атома фтора:
Фтор (лат. Fluorum, от др.-греч. φθόρος — «разрушение, порча, вред») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением F и атомным номером 9. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), втором периоде периодической системы.
Фтор самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы галогенов.
Фтор самый химически активный неметалл и сильнейший окислитель.
Фтор обозначается символом F.
Как простое вещество фтор при нормальных условиях представляет собой двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор.
Молекула фтора двухатомна.
Химическая формула фтора F2.
Электронная конфигурация атома фтора 1s2 2s2 2p5. Потенциал ионизации (первый электрон) атома фтора равен 1681,05 кДж/моль (17,42282 (5) эВ).
Строение атома фтора. Атом фтора состоит из положительно заряженного ядра (+9), вокруг которого по двум оболочкам движется 9 электронов. При этом 2 электрона находятся на внутреннем уровне, а 7 электронов – на внешнем. Поскольку фтор расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлены s- и р-орбиталями. На внешнем энергетическом уровне атома фтора на 2s-орбитали находятся два спаренных электрона, на 2p-орбитали находятся четыре спаренных электрона и один неспаренный электрон. В свою очередь ядро атома фтора состоит из 9 протонов и 10 нейтронов. Фтор относится к элементам p-семейства.
Радиус атома фтора (вычисленный) составляет 42 пм.
Атомная масса атома фтора составляет 18,998403163(6) а. е. м.
Содержание фтора в земной коре составляет 0,054 %, в морской воде и океане – 0,00013 %.
Фтор очень ядовит.
Изотопы и модификации фтора:
Свойства фтора (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Фтор |
| 102 | Прежнее название | |
| 103 | Латинское название | Fluorum |
| 104 | Английское название | Fluorine |
| 105 | Символ | F |
| 106 | Атомный номер (номер в таблице) | 9 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Андре-Мари Ампер, Франция, 1810 г. |
| 110 | Год открытия | 1810 г. |
| 111 | Внешний вид и пр. | Газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации фтора:
– α-фтор с простой моноклинной кристаллической решёткой, – β-фтор с простой кубической кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,054 % |
| 120 | Содержание в морях и океанах (по массе) | 0,00013 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,00004 % |
| 122 | Содержание в Солнце (по массе) | 0,00005 % |
| 123 | Содержание в метеоритах (по массе) | 0,0087 % |
| 124 | Содержание в организме человека (по массе) | 0,0037 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 18,998403163(6) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p5 |
| 203 | Электронная оболочка | K2 L7 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 42 пм |
| 205 | Эмпирический радиус атома* | 50 пм |
| 206 | Ковалентный радиус* | 71 пм |
| 207 | Радиус иона (кристаллический) | F–
117 (4) пм, 119 (6) пм, F7+ 22 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса* | 147 пм |
| 209 | Электроны, Протоны, Нейтроны | 9 электронов, 9 протонов, 10 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 3,98 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1681,05 кДж/моль (17,42282 (5) эВ) |
| 305 | Электродный потенциал | F2 + 2e– → 2F–, Eo = +2,87 В |
| 306 | Энергия сродства атома к электрону | 328,1649(3) кДж/моль (3,4011898(24) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001696 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ),
1,505 г/см3 (при температуре кипения -188,11 °C и иных стандартных условиях, состояние вещества – жидкость), 1,587 г/см³ (при -218 °C и иных стандартных условиях, состояние вещества – жидкость), 1,81 г/см3 (при -225 °C и иных стандартных условиях, состояние вещества – твердое тело), 1,7 г/см3 (при -228 °C и иных стандартных условиях, состояние вещества – твердое тело), 1,5 г/см3 (при -273 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -219,67 °C (53,48 K, -363,41 °F) |
| 403 | Температура кипения* | -188,11 °C (85,03 K, -306,60 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 0,5104 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,51 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 31,34 Дж/(K·моль) |
| 411 | Молярный объём | 11,202 см³/моль |
| 412 | Теплопроводность | 0,02591 Вт/(м·К) (при стандартных условиях),
0,028 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-фтор |
| 512 | Структура решётки | Простая моноклинная
|
| 513 | Параметры решётки | a = 5,478 Å, b = 3,27 Å, c = 7,265 Å, β = 102,088° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | С12/с1 |
| 517 | Номер пространственной группы симметрии | 15 |
| 521 | Кристаллическая решётка #2 | β-фтор |
| 522 | Структура решётки | Простая кубическая
|
| 523 | Параметры решётки | a = 5,531 |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7782-41-4 |
Примечание:
205* Эмпирический радиус атома фтора согласно [3] составляет 73 пм.
206* Ковалентный радиус фтора согласно [1] и [3] составляет 64 пм и 72 пм соответственно.
208* Радиус Радиус Ван-дер-Ваальса согласно [1] составляет 135 пм.
401* Плотность фтора согласно [4] составляет 0,001693 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления фтора согласно [3] и [4] составляет -219,62 °C (53,53 K, -363,32 °F) и -219,6 °C (53,55 K, -363,28 °F) соответственно.
403* Температура кипения фтора согласно [3] и [4] составляет -188,12 °C (85,03 K, -306,62 °F) и -188,13 °C (85,02 K, -306,63 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) фтора согласно [3] и [4] составляет 6,544 кДж/моль и 6,54 кДж/моль соответственно.
Физические свойства фтора:
Химические свойства фтора. Взаимодействие фтора. Химические реакции с фтором:
Получение фтора:
Применение фтора:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Fluorine
- https://de.wikipedia.org/wiki/Fluor
- https://ru.wikipedia.org/wiki/Фтор
- http://chemister.ru/Database/properties.php?dbid=1&id=219
- https://chemicalstudy.ru/ftor-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
фтор атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле фтора
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
1 355