молекула газа
- молекула газа
- n
Универсальный русско-немецкий словарь.
.
2011.
Смотреть что такое «молекула газа» в других словарях:
-
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
-
МОЛЕКУЛА — (уменьшительная форма от лат. moles – масса) наименьшая частица химического соединения; состоит из системы атомов, с помощью химических средств может распадаться на отдельные атомы. Молекулы благородных газов, гелия и т. д. одноатомны; сложнейшие … Философская энциклопедия
-
ГРАММ-МОЛЕКУЛА — ГРАММ МОЛЕКУЛА, грамм моль, число граммов данного вещества, равное его молекулярному весу. Так,молекулярный вес кислорода равен 32; следовательно, если взять 32 г кислорода, то это и будет Г. м. кислорода. Молекулярный вес углекислого газа 44;… … Большая медицинская энциклопедия
-
Грамм-молекула — моль, число граммов простого или сложного химического вещества, равное его молекулярной массе (См. Молекулярная масса). Так, если молярные массы азота N2 и серной кислоты H2SO4 соответственно 28,0134 и 98,078, то их Г. м. равны 28,0134 г… … Большая советская энциклопедия
-
Уравнение состояния идеального газа — Уравнение состояния Стат … Википедия
-
Природный газ — (Natural gas) Природный газ это один из самых распространенных энергоносителей Определение и применение газа, физические и химические свойства природного газа Содержание >>>>>>>>>>>>>>> … Энциклопедия инвестора
-
ТЕПЛОЁМКОСТЬ — количество теплоты, поглощаемой телом при нагревании на 1 градус (1°С или 1К); точнее отношение кол ва теплоты, поглощаемой телом при бесконечно малом изменении его темп ры, к этому изменению. Т. ед. массы в ва (г, кг) наз. удельной Т., 1 моля в… … Физическая энциклопедия
-
ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ — изучает химические силы, действующие на поверхности. В общем случае химия поверхности рассматривает свойства трех состояний вещества твердого (Т), жидкого (Ж) и газообразного (Г) и дает описание вещества как фазовой системы. Однако если два… … Энциклопедия Кольера
-
Теплоёмкость — количество теплоты, поглощаемой телом при нагревании на 1 градус; точнее отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению Т. единицы массы вещества (г, кг) называется… … Большая советская энциклопедия
-
АТМОСФЕРА — газовая оболочка, окружающая небесное тело. Ее характеристики зависят от размера, массы, температуры, скорости вращения и химического состава данного небесного тела, а также определяются историей его формирования начиная с момента зарождения.… … Энциклопедия Кольера
-
Авогадро, Амедео — В Википедии есть статьи о других людях с такой фамилией, см. Авогадро. Амедео Авогадро, граф Куаренья и Черрето Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e Cerreto … Википедия
Как правильно пишется словосочетание «молекулы газа»
- Как правильно пишется слово «молекула»
- Как правильно пишется слово «газ»
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: гидратация — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «молекула»
Ассоциации к слову «газ»
Синонимы к словосочетанию «молекулы газа»
Предложения со словосочетанием «молекулы газа»
- Хорошее следствие состоит в том, что после некоторой первоначальной неразберихи молекулы газа начинают вращаться преимущественно в одной плоскости.
- Физика утверждает, что молекулы газа находятся в непрерывном движении. Как же объяснить то, что вес несущихся в пустоте молекул передаётся дну сосуда?
- Так система оказывается высокоэнтропийной, а движение отдельной молекулы газа непредсказуемым.
- (все предложения)
Сочетаемость слова «газ»
- углекислый газ
выхлопные газы
угарный газ - выхлопные газы автомобилей
выхлопные газы машин
выхлопные газы двигателей - педаль газа
запах газа
облако газа - газ выходит
газ взорвался
газ горит - дать газу
прибавить газу
надавить на газ - (полная таблица сочетаемости)
Значение слова «молекула»
-
МОЛЕ́КУЛА, -ы, ж. Наименьшая частица вещества, обладающая всеми его химическими свойствами. (Малый академический словарь, МАС)
Все значения слова МОЛЕКУЛА
Значение слова «газ»
-
ГАЗ1, -а (-у), предл. на га́зе и (прост.) на газу́, м. 1. Состояние вещества, в котором его частицы не связаны молекулярными силами притяжения и, двигаясь свободно, стремятся занять все пространство, в котором они заключены. Гремучий газ. Угарный газ. Рудничный газ. Слезоточивые газы.
ГАЗ2, -а (-у), м. Шелковая прозрачная ткань. (Малый академический словарь, МАС)
Все значения слова ГАЗ
Отправить комментарий
Дополнительно
Смотрите также
МОЛЕ́КУЛА, -ы, ж. Наименьшая частица вещества, обладающая всеми его химическими свойствами.
Все значения слова «молекула»
ГАЗ1, -а (-у), предл. на га́зе и (прост.) на газу́, м. 1. Состояние вещества, в котором его частицы не связаны молекулярными силами притяжения и, двигаясь свободно, стремятся занять все пространство, в котором они заключены. Гремучий газ. Угарный газ. Рудничный газ. Слезоточивые газы.
ГАЗ2, -а (-у), м. Шелковая прозрачная ткань.
Все значения слова «газ»
-
Хорошее следствие состоит в том, что после некоторой первоначальной неразберихи молекулы газа начинают вращаться преимущественно в одной плоскости.
-
Физика утверждает, что молекулы газа находятся в непрерывном движении. Как же объяснить то, что вес несущихся в пустоте молекул передаётся дну сосуда?
-
Так система оказывается высокоэнтропийной, а движение отдельной молекулы газа непредсказуемым.
- (все предложения)
- молекулы воды
- молекулы вещества
- молекулы водорода
- отдельные молекулы
- движение молекул
- (ещё синонимы…)
- атом
- фермент
- химия
- физика
- частица
- (ещё ассоциации…)
- плита
- баллон
- газпром
- противогаз
- озон
- (ещё ассоциации…)
- белковые молекулы
- молекулы воды
- движение молекул
- состоять из молекул
- (полная таблица сочетаемости…)
- углекислый газ
- выхлопные газы автомобилей
- педаль газа
- газ выходит
- дать газу
- (полная таблица сочетаемости…)
- Разбор по составу слова «молекула»
- Как правильно пишется слово «молекула»
- Как правильно пишется слово «газ»
Химическая формула вещества — условная запись вещества, отражающая его качественный и количественный состав.
Символы химических элементов показывают из каких атомов состоит вещество (его качественный состав), а индексы — число атомов химических элементов в веществе (его количественный состав).
Индекс — цифра, находящаяся справа внизу символа химического элемента, обозначающая число атомов этого элемента в химической формуле вещества.
Обрати внимание!
Индекс «(1)» в химической формуле опускается (не пишется).
Если в формуле записан знак химического элемента без индекса, значит, в частице вещества содержится один атом данного элемента.
Химические формулы веществ молекулярного строения показывают состав молекул. Это молекулярные формулы.
Пример:
(«о-два») — молекулярная формула кислорода. В молекуле кислорода содержатся два атома химического элемента кислорода.
(«гелий») — молекулярная формула инертного (благородного) газа гелия. Молекулы благородных газов одноатомные.
(«аш-два-эс-о-четыре») — молекулярная формула серной кислоты. Молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.
Химические формулы веществ немолекулярного строения показывают простейшее соотношение числа атомов химических элементов в веществе. Такие формулы называют простейшими формулами.
Группа атомов, состав которой соответствует простейшей формуле вещества, называется формульной единицей.
Для простых веществ немолекулярного строения формульной единицей является атом, поэтому их формулы записывают просто знаками химических элементов без индексов.
Пример:
(«купрум»)— формула меди, которая показывает, что её формульной единицей является атом.
(«феррум-два-о-три») — простейшая формула оксида железа(
III
). В этом веществе на два атома железа приходится три атома кислорода.
Обрати внимание!
Повторяющиеся группы атомов в формуле заключают в скобки.
Пример:
(«магний-о-аш-дважды»)— в гидроксиде магния на один атом магния приходится два атома кислорода и два атома водорода.
(«кальций-три-пэ-о-четыре-дважды»)— в фосфате кальция на три атома кальция приходится два атома фосфора и восемь атомов кислорода.
В химических записях используются коэффициенты.
Коэффициент — цифра в химической записи, которая ставится перед формулой и показывает число отдельных атомов, молекул или формульных единиц.
Обрати внимание!
Коэффициент «(1)» не записывается.
Пример:
— три молекулы водорода, каждая из которых состоит из двух атомов химического элемента водорода.
— десять молекул серной кислоты, содержащих по два атома водорода, одному атому серы и по четыре атома кислорода.
— две формульные единицы гидроксида магния, состоящие из одного атома магния, двух атомов кислорода и двух атомов водорода.
Содержание:
Фазовые состояния вещества:
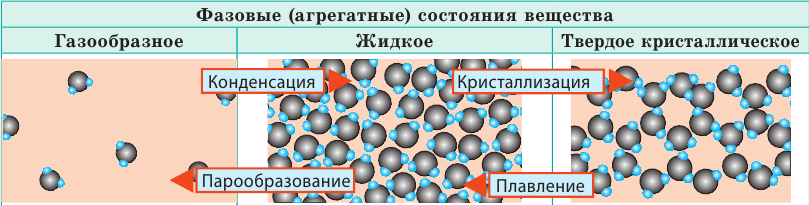
В МКТ различают три фазовых (агрегатных) состояния вещества: жидкое, кристаллическое, газообразное (существует и четвертое состояние — плазма, и оно самое распространенное во Вселенной, ведь именно в состоянии плазмы находится вещество в звездах). Изменение фазового состояния называют фазовым переходом. Рассмотрим разные фазовые состояния вещества и выясним особенности движения и взаимодействия молекул вещества в разных состояниях.
 |
||
| Слово «газ» происходит от греческого слова chaos («хаос»). Молекулы газов расположены беспорядочно и на расстояниях, которые в десятки раз больше размеров самих молекул. На таких расстояниях молекулы практически не взаимодействуют друг с другом. Непрерывно сталкиваясь, молекулы газов разлетаются во все стороны, пока не встретят какое-либо препятствие, например стенки сосуда. Именно поэтому газы не имеют формы и занимают весь предоставленный объем. Большими расстояниями между молекулами объясняется и тот факт, что газы легко сжимаются. | Молекулы жидкости в целом расположены хаотично, однако в расположении ближайших молекул сохраняется определенный (ближний) порядок. Среднее расстояние между молекулами примерно равно размерам молекул, и межмолекулярные силы удерживают их около положения равновесия. Каждая молекула жидкости некоторое время (порядка 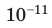 |
В веществе, находящемся в твердом кристаллическом состоянии, молекулы расположены в определенном порядке (образуют кристаллическую решетку) на расстояниях, примерно равных размерам самих молекул, поэтому силы межмолекулярного взаимодействия удерживают их около положения равновесия. В отличие от жидкостей, перескакивания молекул в твердых телах происходят очень редко — каждая молекула сохраняет положение равновесия достаточно долго, а ее движение сводится к колебаниям около этого положения. Поэтому твердые тела сохраняют и объем, и форму; как и жидкость, их очень трудно сжать. |
Молекулы некоторых твердых тел в целом расположены беспорядочно. Такое состояние вещества называют аморфным. Вещества в аморфном состоянии напоминают очень вязкие жидкости. Так, если положить в сосуд кусочки смолы (аморфное вещество), со временем смола сольется и примет форму сосуда.
В отличие от кристаллических, аморфные вещества не имеют определенной температуры плавления, а переходят в жидкое состояние постепенно размягчаясь. Аморфное состояние веществ неустойчиво — постепенно происходит кристаллизация. Так, стекло имеет аморфную структуру, но со временем в нем образуются помутнения — кристаллики кварца. Сахар — это молекулярный кристалл. Если его расплавить и охладить, получим леденец — аморфное состояние сахара. Но через некоторое время в леденце начнут расти кристаллики сахара. Именно по этой причине засахаривается варенье.
Выводы:
- Молекулы, атомы, ионы находятся в непрерывном хаотическом движении. Именно движением частиц вещества можно объяснить такие явления, как броуновское движение (видимое в микроскоп хаотическое перемещение малых макрочастиц, взвешенных в жидкости или газе) и диффузия (взаимное проникновение соприкасающихся веществ друг в друга).
- Частицы вещества взаимодействуют друг с другом. Основная причина межмолекулярного взаимодействия — электрическое притяжение и отталкивание заряженных частиц, образующих атом. На расстояниях, которые больше размеров молекул, молекулы притягиваются друг к другу; на расстояниях, которые незначительно меньше размера молекул, — отталкиваются.
- Вещество может находиться в твердом, жидком и газообразном фазовых (агрегатных) состояниях в зависимости от того, как расположены, как двигаются и как взаимодействуют его частицы.
Основное уравнение МКТ идеального газа
Каждое макроскопическое тело состоит из огромного количества молекул. МКТ рассматривает строение и свойства макроскопических тел, а также процессы, происходящие в этих телах, с точки зрения их молекулярной структуры. Поведение макроскопических тел описывается рядом физических величин — микроскопическими и макроскопическими параметрами. Выясним, что это за параметры и как они связаны.
Микроскопические и макроскопические параметры
Рассмотрим систему, состоящую из очень большого количества атомов или молекул. Такой системой, например, может быть какой-либо газ. В любой момент времени каждая микрочастица газа обладает энергией, движется с некоторой скоростью, имеет массу.
Физические величины, характеризующие свойства и поведение отдельных микрочастиц вещества, называют микроскопическими параметрами.
Некоторые микроскопические параметры могут изменяться без внешнего воздействия на систему. Например, скорости движения молекул газа непрерывно изменяются в результате их столкновений друг с другом.
В то же время газ данной массы занимает некоторый объем, создает давление, имеет температуру. Значения этих физических величин определяются совокупностью множества молекул — например, мы не можем говорить о давлении, температуре или плотности одной молекулы.
Физические величины, характеризующие свойства и поведение макроскопических тел без учета их молекулярного строения, называют макроскопическими параметрами.
Макроскопические параметры могут изменяться только за счет внешних воздействий на систему или за счет теплообмена. Так, чтобы увеличить давление газа, газ нужно нагреть (передать определенное количество теплоты) или сжать (то есть совершить работу).
Какой газ называют идеальным
Количественные закономерности, связывающие макроскопические и микроскопические параметры тел, достаточно сложны. Рассмотрим самый простой случай — достаточно разреженные газы (такими, например, являются обычные газы при нормальных условиях). В разреженных газах расстояние между молекулами во много раз превышает размеры самих молекул, поэтому эти молекулы можно считать материальными точками, а их взаимодействием, за исключением моментов соударения, можно пренебречь. Кроме того, свойства разреженных газов практически не зависят от их молекулярного состава, а столкновения молекул такого газа приближаются к упругим. Таким образом, вместо реальных газов можно рассматривать их физическую модель — идеальный газ.
Идеальный газ — это физическая модель газа, молекулы которого принимают за материальные точки, не взаимодействующие друг с другом на расстоянии и упруго взаимодействующие в моменты столкновений.
Основное уравнение МКТ идеального газа
Начнем с такого микроскопического параметра, как скорость движения молекул. Обратим внимание на то, что бессмысленно рассматривать движение каждой отдельной молекулы и устанавливать скорость ее движения в данный момент времени, да это и невозможно: число молекул огромно, и за секунду каждая молекула изменяет скорость своего движения миллиарды раз. Поэтому физики используют средние значения скоростей молекул. Важнейшим в МКТ является понятие средний квадрат скорости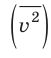
где N — число молекул; 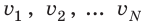
Квадратный корень из среднего квадрата скорости называют средней квадратичной скоростью движения молекул (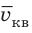
Понятно, что средний квадрат скорости (а следовательно, и среднюю квадратичную скорость) невозможно определить с помощью прямых измерений. Однако эта величина связана с определенными макроскопическими (измеряемыми) параметрами газа, например с давлением.
Напомним, что давление газа обусловлено ударами его молекул (рис. 28.1). Находясь в непрерывном хаотическом движении, молекулы газа сталкиваются со стенками сосуда и поверхностью любого тела в газе, действуя на них с некоторой силой. Суммарная сила воздействия частиц на единицу площади поверхности и есть давление газа: 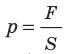
Уравнение зависимости давления p идеального газа от массы 
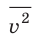
Здесь n — концентрация молекул газа — физическая величина, равная числу молекул в единице объема газа:
Средняя кинетическая энергия поступательного движения молекул идеального газа (кинетическая энергия поступательного движения, в среднем приходящаяся на одну молекулу) равна: 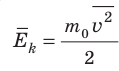
Пример решения задачи
Определите плотность идеального газа, находящегося под давлением 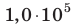
Решение:
В задаче нужно найти макроскопический параметр — плотность газа. Для решения задачи воспользуемся основным уравнением МКТ идеального газа:
Поскольку ρ = 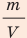
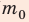
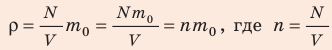
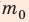
Отсюда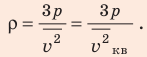
Проверим единицу, найдем значение искомой величины:
Анализ результата. Плотности газов при нормальных условиях колеблются от 0,09 до 1,5 кг/м3, то есть получен реальный результат.
Ответ: ρ = 1, 2 кг/м3.
Выводы:
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Движение тел под воздействием нескольких сил
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 


Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (

Для каждого состояния запишем уравнение Менделеева — Клапейрона: 



Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (



Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (


Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (


Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется:
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 




Ответ: примерно в 2,7 раза.
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
— универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
Важна только та масса, что осталась в сосуде. Поэтому:
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза |  |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул |  |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы |  |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Уравнение состояния идеального газа
Содержание:
Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона». Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Уравнение состояния идеального газа
Уравнение состояния идеального газа — это p = nkT называется уравнением Менделеева Клапейрона и оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа давления, объёма и температуры. Поэтому уравнение Менделеева Клапейрона называется ещё уравнением состояния идеального газа.
Термодинамические параметры газа
В предыдущих главах было показано, что при описании свойств газа можно пользоваться величинами, характеризующими молекулярный мир (микромир), например энергией молекулы, скоростью ее движения, массой и т. п. Числовые значения таких величин мы можем определять только с помощью расчета. Все такие величины принято называть микроскопическими (от греческого «микрос» — малый).
Однако для описания свойств газов можно пользоваться и такими величинами, числовые значения которых находят простым измерением с помощью приборов, например давлением, температурой и объемом газа. Значения таких величин определяются совместным действием огромного числа молекул, поэтому они называются макроскопическими (от греческого «макрос» — большой).
Соотношение (4.1): 
Если взять определенную массу газа т, то при постоянных р, V и Т газ будет находиться в равновесном состоянии. Когда происходят изменения этих параметров, то в газе протекает тот или иной процесс. Если этот процесс состоит из ряда непрерывно следующих друг за другом равновесных состояний газа, то он называется равновесным процессом. Равновесный процесс должен протекать достаточно медленно, так как при быстром изменении параметров давление и температура не могут иметь соответственно одинаковые значения во всем объеме газа. В этой главе рассматриваются только равновесные процессы в газах, при которых масса газа остается постоянной.
Когда процесс в газе заканчивается, то газ переходит в новое состояние, а его параметры приобретают новые постоянные числовые значения, вообще говоря, отличные от их значений в начале процесса. Если же при постоянной массе газа значения всех его параметров в начале и в конце процесса окажутся одинаковыми, то процесс называется круговым или замкнутым.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом. Газовый закон, выражающий связь между всеми тремя параметрами газа, называется объединенным газовым законом.
Отметим еще, что такого процесса в газе, при котором изменялся бы только один параметр газа, не существует, так как значения этих параметров взаимосвязаны. Примером сказанного является закон Шарля, выражающий связь между р и Т.
Объединенный газовый закон. Приведение объема газа к нормальным условиям
Связь между давлением, объемом и температурой определенной массы газа устанавливается с помощью соотношения (4.9):
Поскольку 

Так как при постоянной массе газа N остается неизменным, 
Поскольку значения р, V и Т в (5.2) относятся к одному и тому же состоянию газа, можно следующим образом сформулировать объединенный газовый закон: при постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Следовательно, если числовые значения параметров в начале процесса, происходящего с какой-либо определенной массой газа, обозначить через р1 , V1 и Т1, а их значения в конце процесса соответственно через р2 , V2 и Т2, то
Формулы (5.2) и (5.3) представляют собой математическое выражение объединенного газового закона.
На практике иногда нужно установить, какой объем V0 займет имеющаяся масса газа при нормальных условиях, т. е. при Т0=273 К и при р0=1,013 . 10 5 Па. Если значения параметров для этой массы газа в каком-либо произвольном состоянии, отличном от нормального, обозначить через р, V и Т, то на основании (5.3) получаем 
Формула (5.4) позволяет приводить объем заданной массы газа к нормальным условиям.
Молярная газовая постоянная. Определение числового значения постоянной Больцмана
Формула (5.1) справедлива для любой массы газа, в которой содержится N молекул. Если применить эту формулу к одному молю какого-либо газа, то N нужно заменить постоянной Авогадро NA, а V — объемом одного моля Vмоль
Так как в одном моле любого газа содержится одно и то же число молекул NA, то произведение 

Числовое значение R можно найти, если применить (5.5) к состоянию одного моля газа при нормальных условиях, так как при этом 
Это числовое значение R в СИ необходимо запомнить, так как им часто пользуются при расчетах и при решении задач.
Теперь легко найти числовое значение постоянной Больнмана 



Уравнение Клапейрона — Менделеева. Плотность газа
Выясним, как будет выглядеть соотношение (5.1), если в него ввести молярную газовую постоянную R. Так как N — полное число молекул в массе газа т, а 
где 
Поскольку 


Соотношение (5.7) называется уравнением Клапейрона — Менделеева или уравнением состояния для произвольной массы идеального газа. Для одного моля идеального газа уравнение Клапейрона — Менделеева принимает вид
С помощью формулы (5.7) легко выяснить, какими величинами определяется плотность газа. Так как 
Зависимость средней квадратичной скорости молекул газа от температуры
Выясним теперь, как можно с помощью вычислений находить среднюю квадратичную скорость движения молекул газа 



Отметим, что под т в формуле (5.10) подразумевается масса одной молекулы в кг. Так как 



Наконец, из (5.9) следует, что 
Среднюю квадратичную скорость можно находить по любой из формул (5.10)—(5.12). Из функции Максвелла можно получить формулы для средней арифметической скорости и наивероятнейшей скорости. Средняя арифметическая скорость
Наконец, наивероятнейшую скорость вычисляют так:
(Используя график функции Максвелла (рис. 3.3), поясните, почему 


Изохорический процесс
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого «изос» — равный, одинаковый). Поскольку имеется три параметра газа, существует три различных изопроцесса. Первый из них (изохорический) рассмотрен выше (§ 4.3). Процесс в газе, который происходит при постоянной массе и неизменном объеме, называется изохорическим (от греческого «хора» — пространство). Графики для этого процесса называются изохорами (рис. 4.3).
Отметим, что к любому изопроцессу применим объединенный газовый закон и формулы (5.3), (5.7) и (5.8) с учетом того, что один из параметров остается постоянным. При изохорическом процессе постоянным остается объем V, поэтому формула (5.3) после сокращения на V принимает вид
Итак, изохорический процесс подчиняется закону Шарля: при постоянной-массе газа и неизменном объеме давление газа прямо пропорционально его абсолютной температуре. Это видно и из уравнения Клапейрона — Менделеева (5.7):
Так как V, т, 
Изобарический- процесс
Процесс в газе, который происходит при постоянной массе и неизменном давлении, называется изобарическим (от греческого «барос» — тяжесть). Этот процесс был изучен французским физиком Л. Гей-Люссаком в 1802 г.
Поскольку при изобарическом процессе р постоянно, то после сокращения на р формула (5.3) принимает вид
Формула (5.16) является математическим выражением закона Гей-Люссака: при постоянной массе газа и неизменном давлении объем газа прямо пропорционален его абсолютной температуре. (Это видно и из уравнения Клапейрона — Менделеева (5.7): так как р, т, 
На рис. 5.1 схематически изображен опыт Гей-Люссака. Колба с газом помещается в сосуд с водой и льдом.
В пробку вставлена трубка, изогнутая таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа определяют по термометру, а объем — по положению столбика ртути. Для этого на трубке нанесены деления, соответствующие определенному внутреннему объему трубки (при градуировке трубки можно учесть и расширение сосуда при нагревании, но оно сравнительно мало’).
Сначала по положению столбика ртути 1 определяют 
Оказывается, что изобара представляет собой прямую линию (рис. 5.2, а), которая пересекается с осью абсцисс в точке А.
Из подобия треугольников на рис. 5.2, а следует
Обозначив 

Здесь 
Если повторять этот опыт для разных газов или для разных масс газа, то все графики будут пересекаться в точке А, соответствующей t=—273°С (рис. 5.2, б), т. е. коэффициент 
Отметим, что для газов коэффициенты 


Изотермический процесс
Процесс в газе, который происходит при постоянной температуре, называется изотермическим.
Изотермический процесс в газе был изучен английским ученым Р. Бойлем и французским ученым Э. Мариоттом. Установленная ими опытным путем связь получается непосредственно из формулы (5.3) после сокращения на Т:
Формула (5.18) является математическим выражением закона Бойля — Мариотта: при постоянной массе газа и неизменной температуре давление газа обратно пропорционально его объему. Иначе говоря, в этих условиях произведение объема газа на соответствующее давление есть величина постоянная: 
Соотношение (5.19) можно получить и из (5.7) или (5.8), так как при постоянном Г справа в формулах (5.7) и (5.8) стоит постоянная величина. График зависимости р от V при изотермическом процессе в газе представляет собой гиперболу и называется изотермой. На рис. 5.3 изображены три изотермы для одной и той же массы газа, но при разных температурах Т.
Отметим еще, что из формулы (5.9) непосредственно вытекает, что при изотермическом процессе плотность газа изменяется прямо пропорционально давлению:
(Подумайте, как проверить закон Бойля — Мариотта на опыте.)
Внутренняя энергия идеального газа
Как отмечалось, силы взаимодействия молекул в идеальном газе отсутствуют. Это означает, что молекулярно-потенциальной энергии у идеального газа нет. Кроме того, атомы идеального газа представляют собой материальные точки, т. е. не имеют внутренней структуры, а значит, не имеют и энергии, связанной с движением и взаимодействием частиц внутри атома. Таким образом, внутренняя энергия идеального газа представляет собой только сумму знамений кинетической энергии хаотического движения всех его молекул:
Поскольку у материальной точки вращательного движения быть не может, то у одноатомных газов (молекула состоит из одного атома) молекулы обладают только поступательным движением. Так как среднее значение энергии поступательного движения молекул определяется соотношением(4.8): 



Для произвольной массы одноатомного идеального газа имеем
Если молекула газа состоит из двух жестко связанных атомов (двухатомный газ), то молекулы при хаотическом движении приобретают еще и вращательное движение, которое происходит вокруг двух взаимно перпендикулярных осей. Поэтому при одинаковой температуре внутренняя энергия двухатомного газа больше, чем одноатомного, и выражается формулой
Наконец, внутренняя энергия многоатомного газа (молекула содержит три или больше атомов) в два раза больше, чем у одно-атомного при той же температуре:
поскольку вращение молекулы вокруг трех взаимно перпендикулярных осей вносит в энергию теплового движения такой же вклад, как поступательное движение молекулы по трем взаимно перпендикулярным направлениям.
Отметим, что формулы (5.23) и (5.24) теряют силу для реальных газов при высоких температурах, так как при этом в молекулах возникают еще колебания атомов, что ведет к увеличению внутренней энергии газа. (Почему это не относится к формуле (5.22)?)
Работа газа при изменении его объема
Физический смысл молярной газовой постоянной. Опыт показывает, что сжатый газ в процессе своего расширения может выполнять работу. Приборы и агрегаты, действия которых основаны на этом свойстве газа, называют пневматическими. На этом принципе действуют пневматические молотки, механизмы для закрывания и открывания дверей на транспорте и т. д.
Представим себе цилиндр с подвижным поршнем, заполненный газом (рис. 5.4).
Пока давление газа внутри цилиндра и окружающего наружного воздуха одинаковы, поршень неподвижен. Пусть при этом температура газа и окружающей среды равна 
Будем теперь медленно нагревать газ в цилиндре до температуры 






Нетрудно сообразить, что при изохорическом процессе работа газа равна нулю, так как никакого изменения объема, занятого газом, в этом случае не происходит. Вообще следует помнить, что газ выполняет работу только в процессе изменения своего объема, т. е. при 


Выясним, как можно определить работу газа по графику зависимости р от V в том или ином газовом процессе. При изобарическом процессе график зависимости р от V представляет собой прямую линию, параллельную оси абсцисс, так как р постоянно. Из рис. 5.5 видно, что работа газа в этом случае численно равна заштрихованной площади.
Выясним, как найти работу газа при изотермическом процессе. На рис. 5.6 изображена изотерма идеального газа. При таком процессе газ выполняет работу, так как 




Разбивая интервал 





Можно строго доказать, что работа газа при любом процессе выражается площадью, ограниченной двумя ординатами, отрезком оси абсцисс и графиком того процесса в координатах V и р.
Выясним теперь физический смысл молярной газовой постоянной R. Применяя формулу (5.25) к одному молю идеального газа, получим
Но из уравнения Клапейрона — Менделеева (5.8) для одного моля можно записать для двух состояний газа:
Подставляя это выражение в (5.26), будем иметь 
Из (5.27) следует, что молярная газовая постоянная численно равна работе, совершаемой одним молем идеального газа при его изобарическом нагревании на один кельвин.
Из соотношения 
Услуги по физике:
Лекции по физике:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
источники:
http://spadilo.ru/uravnenie-sostoyaniya-idealnogo-gaza/
http://natalibrilenova.ru/uravnenie-sostoyaniya-idealnogo-gaza/
Gas Sensors for Underground Mines and Hazardous Areas
S.K. Chaulya, G.M. Prasad, in Sensing and Monitoring Technologies for Mines and Hazardous Areas, 2016
3.4.2.1 Theory
Gas molecules are made up of a number of atoms bonded to one another. These interatomic bonds are similar to springs connecting atoms of various masses together. This bonding vibrates with a fixed frequency called the natural frequency. When infrared (IR) radiation interacts with gas molecules, a part of energy is absorbed while the rest of the radiation is transmitted. As the gas molecules absorb this radiation, the molecules gain energy and vibrate more vigorously (Fig. 3.4).
Fig. 3.4. Effect of infrared radiation on bonding of molecule.
This vibration results in rise in temperature of the gas molecules. Temperature increases in proportion to gas concentration and this increase in temperature is shown by the detector in terms of gas concentration. On the other hand, the radiation absorbed by the gas molecules at a particular wavelength causes a decrease in the original wavelength. This decrease of radiation energy can also be detected as a signal.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128031940000039
Effect of Gas Wettability on the Surface Properties of Rocks
Jiang Guancheng, in Gas Wettability of Reservoir Rock Surfaces with Porous Media, 2018
4.1.1.1 Adsorption Phenomena and Classification
When gas molecules collide with a rock surface, some molecules remain on the surface for a period of time due to the effect of residual force field, causing the density of gas molecules on the rock surface to increase and density of gas phase to decrease. This phenomenon is called gas adsorption on the rock surface. Normally, the solid substance is called adsorbent and the adsorbed gas is called adsorbate.
Adsorption is the result of interaction between solid surface molecules or atoms and gas molecules. Adsorption can be classified into two types: physical adsorption and chemical adsorption, depending on the forces of attraction between the adsorbate and adsorbent. The former is due to van der Waals forces of attraction, while the latter is due to a chemical bond. This results in different properties of the two kinds of adsorption (Table 4.1).
Table 4.1. Physical Adsorption and Chemical Adsorption
| Property | Physical Adsorption | Chemical Adsorption |
|---|---|---|
| Adsorption | Vanderwaal Van der Waal force | Chemical bond |
| Selectivity | No | Yes |
| Adsorption heat | Approximate heat of liquefaction (0–20 kJ/mol) | Approximate heat of reaction (80–400 kJ/mol) |
| Adsorption rate | Quick, easy to balance, doesn’t require activation energy | Slow, difficult to balance, and requires activation energy |
| Adsorption layer | Monomolecular layer or polymolecular layer | Monomolecular layer |
| Reversibility | Reversible | Irreversible |
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128151501000043
Component Technology
Morgan Jones, in Valve Amplifiers (Fourth Edition), 2012
The Getter
Gas molecules are trapped in the interstices of the metal parts – not dissolved, so heating to red heat can force them out, just before the getter is flashed.
The getter is a metal structure often fitted near the top of the valve, coated with a highly volatile powder (usually a barium compound similar to the cathode emissive surface). Once the valve has been sealed and as much gas as possible has been pumped out, the getter is heated and the powder explodes, consuming the remaining gas. The force of the explosion throws molten barium onto the inside surface of the envelope to give the familiar mirrored coating at the top of the valve. The explosion is initiated electrically, either by directly passing a heating current through the getter’s metallic supporting structure (metal envelope valves), or by shaping the getter as a short-circuited turn and using transformer action to induce the heating current from an external RF source at ≈450 kHz (glass envelope valves).
Although some of the getter material is deactivated by the explosion, the getter must continue to consume gas molecules throughout the life of the valve because gas continuously permeates the vacuum, either via leaks at the seals where the leads leave the envelope, or by outgassing from hot structures. The rate of a chemical reaction doubles with each 10 °C rise in temperature, so most valves thermally bond the getter to the hot anode with a thick wire. Because the anode is not at a constant temperature over its entire surface, and the wire has thermal resistance, some valves mount getters via short stubs onto the hottest parts of the anode. If bonded with only one stub, the mass of the getter combined with the spring of the stub can form a mechanically resonant system with a very high Q, so some special quality valves support their getters with two stubs to reduce the Q, and hence microphony.
To be consumed by the getter, the gas molecules must touch it, but this is ensured by entropy, and provided the heater reaches operating temperature before HT is applied to the anode, it should be effective.
Soft valves can often be spotted by the gentle blue glow near the glass envelope, which is due to the collision of ionised gas molecules with the glass. This should not be confused with the blue fluorescence that can be seen on the inner surface of the anode in valves such as the EL84, and which is perfectly normal.
Valves stored for decades in a cold warehouse may have an imperfect vacuum because the getter was too cold to be fully effective. Fortunately, 24 h in a domestic oven at 100 °C warms the getter and will often clear residual gas [22], but beware that the phenolic bases of Octal valves can easily be damaged by a higher temperature. When first used, even new valves should have their heaters powered for a least half an hour before applying HT. Although a few hours of electrical use also clears the gas, the previous methods avoid the damaging ion bombardment suffered by the cathode until the getter has cleaned the vacuum.
Occasionally, rather than air gently seeping in through the Kovar alloy glass to metal seals at the valve’s pins, a severely overheated anode may release sufficient gas (known as outgassing) to poison the cathode and turn the getter sputtering from silver/brown to an almost transparent brown. Long-term overheating results in stains on the anode, so the combination of stains and nearly transparent getter sputtering may reveal the damage even before the ‘gas’ test on a valve tester (see Figure 4.50).
Figure 4.50. The right-hand valve of this pair has almost lost its gettering due to outgassing caused by catastrophic anode overheating.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080966403000046
Gauges for Low-Pressure Measurement
A. BERMAN, in Total Pressure Measurements in Vacuum Technology, 1985
4.3.4 The Rotating Gauge
Gas molecules which come in touch with the surface of a body rotating at high speed in a rarefied environment acquire momentum in the direction of the movement. This momentum can be transmitted, if conditions are conducive, to the adjacent surface of another body suspended a small distance away. The suspended body starts rotating until the force accounting for its movement is balanced by the torque of its suspension. If the rotating body is suspended in the rarefied environment by magnetic levitation (the body’s weight is balanced by a magnetic force so that it remains suspended in space) and allowed to coast freely, the momentum imparted by gas molecules decelerates its movement. Either the torque in the suspension or the deceleration of the rotating body can be used as a means of measuring pressure since the rate of the transfer of momentum producing them is related to the number density of molecules.
Dushman (1915) designed a rotating gauge according to the suggestion of Langmuir (1913). This gauge uses the rate of momentum of molecules transmitted by a very fast rotating disk to a coaxially suspended disk a few millimeters away. The gauge called a rotating disk (Dushman, 1949, p. 291), shown in Fig. 4.8, consists of two coplanar disks D1 and D2 of aluminum and mica, respectively. The disk D1 is rotated at constant speed by means of an external rotary magnetic field (Rf). The rotation of the disk D2, produced by the momentum transferred by gas molecules, generates a torque in the quartz suspension fiber (F). A mirror (M), an illumination system, and an external scale permit reading the displacement of D2 from its rest position. The angle of torque is
Fig. 4.8. Rotating gauge head. A, aluminum frame work; B, bearings; D1, aluminum disk; D2, mica disk; F, quartz fiber; G, glass enclosure; M, mirror; R, rotor; Rf, rotating magnetic field.
Reprinted with permission from “Scientific Foundation of Vacuum Technique” S. Dushman. p. 291. Copyright 1949 John Wiley and Sons, Inc.Copyright © 1949
(4.13)α t =( Ct ×τ o 2r4/I i )(Pω)(M/T)1/2
where the constant Ct depends on the nature of the gas and the accommodation coefficients, τo is the oscillation period, r the radius of D2, Ii the moment of inertia of D2, P the total pressure, ω the angular velocity of rotation, and M and T the molecular mass and the thermodynamic temperature of the gas. The proportionality between the torque in the suspension of D2 and the quantity P(M/T)1/2 is valid only in the range where the mean free paths of gas molecules is larger than the dimensions of the vessel. Pressure measurements in the range 4 × 10−5 Pa (3 × 10−7 Torr) are inaccurate because of both the eddy currents induced in the aluminum frame-work supporting the mirror and the pronounced tendency of D2 to oscillate.
Briggs (1955) described an improved rotating gauge, but Beams et al. (1962) developed an instrument by which they overcame the difficulties arising in pressure measurement, mainly because of the suspension of the rotating body. The principle of the gauge relies on the drag effect produced by rarefied gas on a magnetically suspended rotor (steel ball) brought to high speed and subsequently allowed to spin with driving power off (Beams et al., 1946). The approximate formula given by Beams et al. (1946) relates the deceleration of the rotor (N/N0) to pressure P as
(4.14)log (N r /N0 r )=(5P/r B ρ B )(m/2πkT)1/2(t−t0)
Here Nr and N0r are the number of revolutions of the rotor at times t and t0, respectively, P is the total pressure, and rB and ρB the radius and the mass density of the rotor, respectively.
Theoretically, the rotating gauge of Beams et al. (1946) can be considered a primary standard since its calibration depends only on the diameter and the mass of the rotor. Actually, determination of pressure is a function of the thermal coefficient of accommodation of the gas.
Different techniques have been used for the stabilization of the rotor in the magnetic field, e.g., by means of a photoelectric servomechanism (Harbour and Lord, 1965), and for the determination of times t and t0.
The research work of Fremerey (1972, 1973), Fremerey et al. (1974), Fremerey and Boden (1978), and Comsa et al. (1977, 1980) made possible the industrial realization of a rotating gauge for measuring pressures in the range 10−2–10−5 Pa (10−4–10−7 Torr). The main limitation to the measurement of very low pressures is the time involved in determining the deceleration of the rotor.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780120924400500107
ENVIRONMENTAL MEASUREMENTS | Optical Transmission and Scatter of the Atmosphere
S.M. Adler-Golden, A. Berk, in Encyclopedia of Modern Optics, 2005
Gases
Gas molecules both scatter and absorb light. Rayleigh scattering by gases scales inversely with the fourth power of the wavelength, and is responsible for the sky’s blue color. For typical atmospheric conditions, the optical depth for Rayleigh extinction is approximately 0.009/λ4 per air mass (λ is in μm and air mass is defined by the vertical column from ground to space). The Rayleigh phase function has a 1+cos2θ dependence.
Absorption by gases may consist of a smooth spectral continuum (such as the ultraviolet and visible electronic transitions of ozone) or of discrete spectral lines, which are primarily rotation lines of molecular vibrational bands. In the lower atmosphere (below around 25 km altitude), the spectral shape of these lines is determined by collisional broadening and described by the normalized Lorentz line shape formula:
[4]fLorentzν=αc/παc2+ν−ν02
Here ν is the wavenumber (in cm−1) [ν = (10 000 μm/cm)/λ], ν0 is the molecular line transition frequency and αc is the collision-broadened half-width (in cm−1), which is proportional to pressure. The constant of proportionality, known as the pressure-broadening parameter, has a typical value on the order of 0.06 cm−1 atm−1 at ambient temperature. The extinction coefficient k(ν) is the product of fLorentzν and the integrated line strength S, which is commonly in units of atm−1 cm−2.
At higher altitudes in the atmosphere the pressure is reduced sufficiently that Doppler broadening becomes competitive with collisional broadening, and the Lorentz formula becomes inaccurate. The general lineshape for combined collisional and Doppler broadening is the Voigt lineshape, which is proportional to the real part of the complex error (probability) function, w:
[5]fVoigtν=1αdπRewν−ν0αd+αcαdi
Here, αd is the Doppler 1/e half-width.
Comprehensive spectral databases have been compiled of the transition frequencies, strengths, and pressure-broadened half-widths for atmospherically important molecules throughout the electromagnetic spectrum. Perhaps the most notable of these databases is HITRAN, which was developed by the US Air Force Research Laboratory and is currently maintained at the Harvard-Smithsonian Center for Astrophysics in Cambridge, MA.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0123693950007399
Facilitated Transport Membranes for CO2 Removal From Natural Gas
Xuezhong He, … Yunhan Chu, in Current Trends and Future Developments on (Bio-) Membranes, 2018
3 Transport Mechanism
Gas molecules transport through a membrane usually takes place by a driving force of chemical potential difference (e.g., transmembrane partial pressure/concentration difference). Different transport mechanisms are applied for various membrane materials. The S-D mechanism is well used to describe gas transport through conventional polymeric membranes where the Fick’s first law is employed as shown in Fig. 9.4. The gas permeate flux, Ji (m3(STP)/(m2 h)), of the component i through a membrane is described in Eq. (9.1):
Figure 9.4. Schematic diagram of a membrane gas separation process.
(9.1)Ji=−Didcidxi
where Di is the diffusion coefficient of component i, and dcidxi is the driving force. For an ideal system, the gas solubility is independent on concentration and can be described by Henry’s law (c = S × p). Thus, the Ji can be modified to
(9.2)Ji=PeiΔpi=Pei(pHxi,F−pLyi,P)
where Pei is the gas permeance (m3(STP)/(m2 h bar)) of component i, Δp is the driving force for gas transport, and p is total pressure (subscripts H and L represent high pressure and low pressure sides, respectively) (bar). xi,F and yi,P are the mole fraction of component i on feed and permeate side, respectively.
For the FT membranes, both solution-diffusion and carrier-mediated diffusion (i.e., FT) mechanism contribute the flux of reactive component A (such as CO2) and is described as follows (Kim et al., 2004):
(9.3)JA=DAl(cA,0−cA,l)+DACl(cAC,0−cAC,l)
where DA and DAC are diffusion coefficient of Fickian diffusion and carrier mediated (complex, AC) diffusion, respectively. L is the membrane thickness of a selective layer. For the PVAm-based FSC membranes developed by the Memfo group at NTNU (Kim et al., 2013), the carrier is chemically bonded to the polymer matrix. A schematic diagram for the gas separation through a FT membrane is shown in Fig. 9.5, where CO2 passes through a membrane based on the FT and solution-diffusion mechanism, while the nonreactive gas molecules (e.g., CH4) can only transport via a solution-diffusion mechanism. Thus, this type of membranes shows both high CO2 permeance and selectivity of CO2/CH4 applied to NG sweetening.
Figure 9.5. Gas transport through a facilitated transport membrane.
As illustrated in Fig. 9.5, CO2 (the component A) will dissolve on the membrane surface and diffuse into the membrane matrix where CO2 reaction has taken place to form a complex. The complex concentration inside the membrane depends on the CO2 concentration when the carrier is not saturated. After the carrier saturation, further increasing feed CO2 concentration will not increase the complex concentration (the maximum complex concentration is the total carrier concentration, CC). When the complex reaches the permeate side, CO2 will be released as illustrated in Fig. 9.5. The detailed description of CO2 flux calculation was reported by He et al. (2017). It is worth noting that feed pressure is crucial to increase flux by enhancing the contribution from both S-D and FT. However, after carrier saturation, further increasing feed CO2 partial pressure will not enhance the FT, but the total CO2 flux still increases because of the continuous S-D contribution. It is also expected that mass transfer coefficient will be enhanced by the increase of temperature, and thus an elevated temperature could present a higher gas permeance, but the selectivity is hard to predict because of the contrary dependency of solubility coefficient and diffusivity on temperature and should be optimized in a real application.
Fig. 9.6 shows CO2/CH4 selectivity and CO2 permeability in different polymer materials. For the pure polymeric membranes, their performance was always below the Robeson upper bound. However, by incorporating CO2 carrier into polymer matrix, the CO2 selectivity can be improved and the performance of FT membranes can surpass the 2008 upper bound (see Fig. 9.6).
Figure 9.6. CO2/CH4 separation property of polymer-based membrane materials (Wang et al., 2016). PEO, poly(ethylene oxide); PFTMs, polymer facilitate transport membranes; PIM, polymers of intrinsic microporosity; TR, thermally rearranged.
Similarly, gas transport on SILMs is governed by the S-D mechanism and FT mechanism. Compared with conventional polymer membranes, the SILMs often have higher CO2 solubility because of their physical and chemical properties tailored by cations and anions or additional functional groups. On one side, the gas solubility theories in ILs are controversial. Some studies showed that the cations–anions interaction dictated the solubility (Babarao et al., 2011; Hollóczki et al., 2013), whereas others suggested that the gas–anions interaction played a key role on solubility (Anthony et al., 2005; Prasad and Senapati, 2009). However, both experimental and theoretical studies showed the ILs are nanosegregated, where the anions and cations tend to form a three-dimensional ionic polar network and alkyl chains segregate into nonpolar domains. As a result, when a gas dissolves, it will locate in polar or nonpolar domain (Hu et al., 2011; Pison et al., 2008). On the other hand, free volume in ILs is also important in determining gas solubility. High free volume, contributed by the flexibility of the ionic structures, could increase gas solubility (Hu et al., 2011). Moreover, by incorporating amine group in cations or anions can increase CO2 selectivity because of facilitate transport (Hanioka et al., 2008; Myers et al., 2008). The gas transport in SILM is depicted in Fig. 9.7.
Figure 9.7. Illustration of gas transport mechanism through a supported ionic liquid membrane.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012813645400009X
Lacustrine Shale Gas Occurrence Characteristics
Xiangzeng Wang, in Lacustrine Shale Gas, 2017
3 Dissolved gas
Shale gas partly exists in shale reservoir fluid in the dissolved state, when natural gas molecules undergo absorption and enter into liquid material where they can be dissolved. The dissolved gas content in the shale layer mainly depends on the solubility in the fluid system.
Currently, the theoretical basis concerning the hydrocarbon gas dissolution mechanism originates from water-soluble gas reservoir research. Water-soluble gas reservoir exploitation and development in the USA began in the 1950s. With the findings on water-soluble gas reservoirs worldwide, research on dissolution mechanisms concerning hydrocarbon gas is also being carried out. Researchers are primarily concerned about the insolubility of hydrocarbon gas in water, which is applied to quantitative research in the oil–gas primary migration field (Barker, 1987; McAuliffe, 1979Barker, 1987McAuliffe, 1979). Water-soluble gas reservoir research began very late in China. Sun (1992) discussed the effect of underground water on gas reservoirs, while Hao and Zhang (1993) studied the change insolubility characteristics of natural gas in formation water, and Fu and Wang (1996) proposed two main dissolution mechanisms of gas in formation water. It is currently believed that the dissolution of natural gas in water obeys Henry’s Law (Fu and Wang, 1996), and that there is a close relationship among gas solubility, natural gas, water content, and pressure. Many hydrocarbon gas water-soluble experiments have also been carried out (Li, 2005; Lu, 1991; Liu, 2004). A series of advances were achieved in the area of geochemical characteristics, including gas source correlation. For example, the use of C2+, iC4/nC4 as geochemical indicators to assess water-soluble gas was studied by Chen and Li (1994). A rock acidolysis hydrocarbon abnormality identification method was established using the adsorption equilibrium principle between natural gas solubility and rock adsorbed hydrocarbon (Fu and Wang, 1996).
Incorporating previous research, there still remain different views and hypotheses on the mechanism of hydrocarbon gas dissolution. For example, based on experimental research, Fu and Wang (1996) believe that the mechanism of hydrocarbon gas dissolution mainly includes two gases: (1) the natural gas molecules infill the interstices between water molecules; and (2) the natural gas molecules and water molecules interact to form hydrated molecules. Whatever the actual mechanism, the solubility of hydrocarbon gas is affected by such factors as temperature, pressure, solution systems, and molecular polarity.
3.1 Interstitial Filling
When shale gas molecules come in contact with liquid hydrocarbons, they can fill the interstices between liquid hydrocarbon molecules due to molecular diffusion, known as interstitial filling. Both temperature and pressure have substantial effects on interstitial filling.
According to Fu and Wang (1996) research, the following assumptions on interstitial filling of dissolved gas molecules in shale can be proposed: (1) there exists a certain gap between molecules of the dissolution system, and gas molecules can infill these interstices; (2) when the properties of gas molecules and the molecules of the dissolution system differ greatly (such as methane and water molecules), and the gas does not exhibit significant hydrolysis, the contribution of interstitial filling to gas solubility cannot be ignored; and (3) gas infilled into the interstices of the liquid can be described by the equation of gas state.
Based on the earlier assumptions, as long as the interstitial percentage of the dissolution system is known, the amount of gas in the interstices of the dissolution system can be calculated according to the equation of gas state. As it is difficult to determine the absolute interstitial percentage of the dissolution system, a concept-driven interstitial percentage is proposed for this purpose. In other words, that part of interstitial space that a specific gas molecule is allowed to enter in a dissolution system of a certain volume, under a certain temperature, is the effective interstitial volume of the gas. The ratio between the effective interstitial volume and the corresponding total volume is known as the effective interstitial percentage.
3.2 Hydration
The combination and decomposition process of gas and water molecules in shale is known as hydration. This is a reversible process, in which dynamic equilibrium is achieved when the combination rate and the decomposition rate are equal.
Based on the phenomenon that gas solubility decreases with increasing temperature, it is believed that there is interaction between gas molecules and water molecules when the temperature is low. Although the strength of the interaction and modes of occurrence of different gas molecules are different, they are collectively called “hydration,” which is another reason why the gas dissolves in water.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128133002000040
Functionalized Graphene Nanocomposite in Gas Sensing
Bhargav Raval, Indrani Banerjee, in Functionalized Graphene Nanocomposites and their Derivatives, 2019
5.2.1 Gas Adsorption on Pristine Graphene
The gas molecule adsorption on graphene sheets has attracted many experimental researchers to study. The basic work that has been carried out on this path was done by Wehling et al. [82] and showed that graphene is a promising material for chemical sensing by density of state, and it also explained the experimental results by Schedin et al. [11] on the single-molecule detection of NO2. Based on density functional theory (DFT) calculations, Leenaerts et al. [83] have considered interaction between PG and varieties of gas molecules such as H2O, CO, NO, NH3, and NO2 by simulation. The adsorbed ion energy for physically absorbed hydrogen on coronene (a graphene display) surface computed utilizing nonlocal van der Waals corrected DFT technique demonstrated great correspondence with the experimental data.
Similarly, the CO2 adsorption energies on graphene for chemisorption and physisorption utilizing DFT and second-order Møller–Plesset methods [84] show great agreement with previous experimental results and theoretical reports. The selective detection can also be possible in the case of NH3. DFT and quantum transport–based calculations show that when graphene with armchair edges has been used for simulation, it affected the transport properties strongly. Out of various gas species, it can be possible to sense NH3 [85]. PG always interacts with weak van der Waal forces, as it does not have any dandling bond on its surface. With strong covalent bonding with neighboring carbon atoms, it has high stability that makes low adsorption energy for gases on PG [86].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128145487000155
Properties of gases
Bai Shaoxian, Wen Shizhu, in Gas Thermohydrodynamic Lubrication and Seals, 2019
1.1.4 Degree of gas molecular freedom
A gas molecule at room temperature can be considered as a rigid body without considering the freedom of vibration. For a nonrigid molecule, there is also a spring-like vibration, so we add 1 to the degree of freedom.
Monatomic molecules, such as helium, neon, and argon, have only one atom, which can be seen as a free particle, so there are three translational degrees of freedom.
In rigid diatomic molecules, such as hydrogen, oxygen, and carbon monoxide, the distance between the two atoms remains the same, and to determine the location of the center of mass, three independent coordinates are required. To determine the location of the point line, two independent coordinates are needed. It makes no sense to rotate the two points around the wire. Therefore the rigid diatomic molecule has five degrees of freedom: three translational degrees of freedom and two rotational degrees of freedom.
For rigid triatoms or polyatomic molecules, such as water, carbon dioxide, and ammonia, as long as the atoms are not aligned in a straight line, they can be seen as free rigid bodies with six degrees of freedom.
The degree of gas molecular freedom is shown in Table 1.2.
Table 1.2. Degree of gas molecular freedom.
| Molecular type | Degree of freedom | ||||
|---|---|---|---|---|---|
| Translation it | Rotation ir | Vibration is | id=it+ir+is | ||
| Monatomic molecule | 3 | 0 | 0 | 3 | |
| Diatomic molecule | Rigid | 3 | 2 | 0 | 5 |
| Nonrigid | 3 | 2 | 1 | 6 | |
| Polyatomic molecule | Rigid | 3 | 3 | 0 | 6 |
| Nonrigid | 3 | 3 | 3n−6 | 3n |
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128167168000012
Voltage losses in a solid oxide fuel cell (SOFC)
Kevin Huang, John B. Goodenough, in Solid Oxide Fuel Cell Technology, 2009
Knudsen diffusion
Consider the diffusion of gas molecules through very small capillary pores. If the pore diameter is smaller than the mean free path length of the diffusing gas molecules, and the density of the gas is low, the gas molecules will collide with the pore walls more frequently than with each other. This process is known as Knudsen diffusion. The gas flux is reduced by the wall collisions. The diffusivity of species A for Knudsen diffusion, DK, A (in cm2/s), is obtained from the self-diffusivity derived from the classical kinetic theory of gases70
[7.34]DK,A=13dpore8RTπMA=4850dporeTMA
where dpore is the mean pore diameter (in cm). It is obvious that DK,A ∝ T1/2 and is a function of the pore size.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781845696283500070
Gas Sensors for Underground Mines and Hazardous Areas
S.K. Chaulya, G.M. Prasad, in Sensing and Monitoring Technologies for Mines and Hazardous Areas, 2016
3.4.2.1 Theory
Gas molecules are made up of a number of atoms bonded to one another. These interatomic bonds are similar to springs connecting atoms of various masses together. This bonding vibrates with a fixed frequency called the natural frequency. When infrared (IR) radiation interacts with gas molecules, a part of energy is absorbed while the rest of the radiation is transmitted. As the gas molecules absorb this radiation, the molecules gain energy and vibrate more vigorously (Fig. 3.4).
Fig. 3.4. Effect of infrared radiation on bonding of molecule.
This vibration results in rise in temperature of the gas molecules. Temperature increases in proportion to gas concentration and this increase in temperature is shown by the detector in terms of gas concentration. On the other hand, the radiation absorbed by the gas molecules at a particular wavelength causes a decrease in the original wavelength. This decrease of radiation energy can also be detected as a signal.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128031940000039
Effect of Gas Wettability on the Surface Properties of Rocks
Jiang Guancheng, in Gas Wettability of Reservoir Rock Surfaces with Porous Media, 2018
4.1.1.1 Adsorption Phenomena and Classification
When gas molecules collide with a rock surface, some molecules remain on the surface for a period of time due to the effect of residual force field, causing the density of gas molecules on the rock surface to increase and density of gas phase to decrease. This phenomenon is called gas adsorption on the rock surface. Normally, the solid substance is called adsorbent and the adsorbed gas is called adsorbate.
Adsorption is the result of interaction between solid surface molecules or atoms and gas molecules. Adsorption can be classified into two types: physical adsorption and chemical adsorption, depending on the forces of attraction between the adsorbate and adsorbent. The former is due to van der Waals forces of attraction, while the latter is due to a chemical bond. This results in different properties of the two kinds of adsorption (Table 4.1).
Table 4.1. Physical Adsorption and Chemical Adsorption
| Property | Physical Adsorption | Chemical Adsorption |
|---|---|---|
| Adsorption | Vanderwaal Van der Waal force | Chemical bond |
| Selectivity | No | Yes |
| Adsorption heat | Approximate heat of liquefaction (0–20 kJ/mol) | Approximate heat of reaction (80–400 kJ/mol) |
| Adsorption rate | Quick, easy to balance, doesn’t require activation energy | Slow, difficult to balance, and requires activation energy |
| Adsorption layer | Monomolecular layer or polymolecular layer | Monomolecular layer |
| Reversibility | Reversible | Irreversible |
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128151501000043
Component Technology
Morgan Jones, in Valve Amplifiers (Fourth Edition), 2012
The Getter
Gas molecules are trapped in the interstices of the metal parts – not dissolved, so heating to red heat can force them out, just before the getter is flashed.
The getter is a metal structure often fitted near the top of the valve, coated with a highly volatile powder (usually a barium compound similar to the cathode emissive surface). Once the valve has been sealed and as much gas as possible has been pumped out, the getter is heated and the powder explodes, consuming the remaining gas. The force of the explosion throws molten barium onto the inside surface of the envelope to give the familiar mirrored coating at the top of the valve. The explosion is initiated electrically, either by directly passing a heating current through the getter’s metallic supporting structure (metal envelope valves), or by shaping the getter as a short-circuited turn and using transformer action to induce the heating current from an external RF source at ≈450 kHz (glass envelope valves).
Although some of the getter material is deactivated by the explosion, the getter must continue to consume gas molecules throughout the life of the valve because gas continuously permeates the vacuum, either via leaks at the seals where the leads leave the envelope, or by outgassing from hot structures. The rate of a chemical reaction doubles with each 10 °C rise in temperature, so most valves thermally bond the getter to the hot anode with a thick wire. Because the anode is not at a constant temperature over its entire surface, and the wire has thermal resistance, some valves mount getters via short stubs onto the hottest parts of the anode. If bonded with only one stub, the mass of the getter combined with the spring of the stub can form a mechanically resonant system with a very high Q, so some special quality valves support their getters with two stubs to reduce the Q, and hence microphony.
To be consumed by the getter, the gas molecules must touch it, but this is ensured by entropy, and provided the heater reaches operating temperature before HT is applied to the anode, it should be effective.
Soft valves can often be spotted by the gentle blue glow near the glass envelope, which is due to the collision of ionised gas molecules with the glass. This should not be confused with the blue fluorescence that can be seen on the inner surface of the anode in valves such as the EL84, and which is perfectly normal.
Valves stored for decades in a cold warehouse may have an imperfect vacuum because the getter was too cold to be fully effective. Fortunately, 24 h in a domestic oven at 100 °C warms the getter and will often clear residual gas [22], but beware that the phenolic bases of Octal valves can easily be damaged by a higher temperature. When first used, even new valves should have their heaters powered for a least half an hour before applying HT. Although a few hours of electrical use also clears the gas, the previous methods avoid the damaging ion bombardment suffered by the cathode until the getter has cleaned the vacuum.
Occasionally, rather than air gently seeping in through the Kovar alloy glass to metal seals at the valve’s pins, a severely overheated anode may release sufficient gas (known as outgassing) to poison the cathode and turn the getter sputtering from silver/brown to an almost transparent brown. Long-term overheating results in stains on the anode, so the combination of stains and nearly transparent getter sputtering may reveal the damage even before the ‘gas’ test on a valve tester (see Figure 4.50).
Figure 4.50. The right-hand valve of this pair has almost lost its gettering due to outgassing caused by catastrophic anode overheating.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080966403000046
Gauges for Low-Pressure Measurement
A. BERMAN, in Total Pressure Measurements in Vacuum Technology, 1985
4.3.4 The Rotating Gauge
Gas molecules which come in touch with the surface of a body rotating at high speed in a rarefied environment acquire momentum in the direction of the movement. This momentum can be transmitted, if conditions are conducive, to the adjacent surface of another body suspended a small distance away. The suspended body starts rotating until the force accounting for its movement is balanced by the torque of its suspension. If the rotating body is suspended in the rarefied environment by magnetic levitation (the body’s weight is balanced by a magnetic force so that it remains suspended in space) and allowed to coast freely, the momentum imparted by gas molecules decelerates its movement. Either the torque in the suspension or the deceleration of the rotating body can be used as a means of measuring pressure since the rate of the transfer of momentum producing them is related to the number density of molecules.
Dushman (1915) designed a rotating gauge according to the suggestion of Langmuir (1913). This gauge uses the rate of momentum of molecules transmitted by a very fast rotating disk to a coaxially suspended disk a few millimeters away. The gauge called a rotating disk (Dushman, 1949, p. 291), shown in Fig. 4.8, consists of two coplanar disks D1 and D2 of aluminum and mica, respectively. The disk D1 is rotated at constant speed by means of an external rotary magnetic field (Rf). The rotation of the disk D2, produced by the momentum transferred by gas molecules, generates a torque in the quartz suspension fiber (F). A mirror (M), an illumination system, and an external scale permit reading the displacement of D2 from its rest position. The angle of torque is
Fig. 4.8. Rotating gauge head. A, aluminum frame work; B, bearings; D1, aluminum disk; D2, mica disk; F, quartz fiber; G, glass enclosure; M, mirror; R, rotor; Rf, rotating magnetic field.
Reprinted with permission from “Scientific Foundation of Vacuum Technique” S. Dushman. p. 291. Copyright 1949 John Wiley and Sons, Inc.Copyright © 1949
(4.13)α t =( Ct ×τ o 2r4/I i )(Pω)(M/T)1/2
where the constant Ct depends on the nature of the gas and the accommodation coefficients, τo is the oscillation period, r the radius of D2, Ii the moment of inertia of D2, P the total pressure, ω the angular velocity of rotation, and M and T the molecular mass and the thermodynamic temperature of the gas. The proportionality between the torque in the suspension of D2 and the quantity P(M/T)1/2 is valid only in the range where the mean free paths of gas molecules is larger than the dimensions of the vessel. Pressure measurements in the range 4 × 10−5 Pa (3 × 10−7 Torr) are inaccurate because of both the eddy currents induced in the aluminum frame-work supporting the mirror and the pronounced tendency of D2 to oscillate.
Briggs (1955) described an improved rotating gauge, but Beams et al. (1962) developed an instrument by which they overcame the difficulties arising in pressure measurement, mainly because of the suspension of the rotating body. The principle of the gauge relies on the drag effect produced by rarefied gas on a magnetically suspended rotor (steel ball) brought to high speed and subsequently allowed to spin with driving power off (Beams et al., 1946). The approximate formula given by Beams et al. (1946) relates the deceleration of the rotor (N/N0) to pressure P as
(4.14)log (N r /N0 r )=(5P/r B ρ B )(m/2πkT)1/2(t−t0)
Here Nr and N0r are the number of revolutions of the rotor at times t and t0, respectively, P is the total pressure, and rB and ρB the radius and the mass density of the rotor, respectively.
Theoretically, the rotating gauge of Beams et al. (1946) can be considered a primary standard since its calibration depends only on the diameter and the mass of the rotor. Actually, determination of pressure is a function of the thermal coefficient of accommodation of the gas.
Different techniques have been used for the stabilization of the rotor in the magnetic field, e.g., by means of a photoelectric servomechanism (Harbour and Lord, 1965), and for the determination of times t and t0.
The research work of Fremerey (1972, 1973), Fremerey et al. (1974), Fremerey and Boden (1978), and Comsa et al. (1977, 1980) made possible the industrial realization of a rotating gauge for measuring pressures in the range 10−2–10−5 Pa (10−4–10−7 Torr). The main limitation to the measurement of very low pressures is the time involved in determining the deceleration of the rotor.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780120924400500107
ENVIRONMENTAL MEASUREMENTS | Optical Transmission and Scatter of the Atmosphere
S.M. Adler-Golden, A. Berk, in Encyclopedia of Modern Optics, 2005
Gases
Gas molecules both scatter and absorb light. Rayleigh scattering by gases scales inversely with the fourth power of the wavelength, and is responsible for the sky’s blue color. For typical atmospheric conditions, the optical depth for Rayleigh extinction is approximately 0.009/λ4 per air mass (λ is in μm and air mass is defined by the vertical column from ground to space). The Rayleigh phase function has a 1+cos2θ dependence.
Absorption by gases may consist of a smooth spectral continuum (such as the ultraviolet and visible electronic transitions of ozone) or of discrete spectral lines, which are primarily rotation lines of molecular vibrational bands. In the lower atmosphere (below around 25 km altitude), the spectral shape of these lines is determined by collisional broadening and described by the normalized Lorentz line shape formula:
[4]fLorentzν=αc/παc2+ν−ν02
Here ν is the wavenumber (in cm−1) [ν = (10 000 μm/cm)/λ], ν0 is the molecular line transition frequency and αc is the collision-broadened half-width (in cm−1), which is proportional to pressure. The constant of proportionality, known as the pressure-broadening parameter, has a typical value on the order of 0.06 cm−1 atm−1 at ambient temperature. The extinction coefficient k(ν) is the product of fLorentzν and the integrated line strength S, which is commonly in units of atm−1 cm−2.
At higher altitudes in the atmosphere the pressure is reduced sufficiently that Doppler broadening becomes competitive with collisional broadening, and the Lorentz formula becomes inaccurate. The general lineshape for combined collisional and Doppler broadening is the Voigt lineshape, which is proportional to the real part of the complex error (probability) function, w:
[5]fVoigtν=1αdπRewν−ν0αd+αcαdi
Here, αd is the Doppler 1/e half-width.
Comprehensive spectral databases have been compiled of the transition frequencies, strengths, and pressure-broadened half-widths for atmospherically important molecules throughout the electromagnetic spectrum. Perhaps the most notable of these databases is HITRAN, which was developed by the US Air Force Research Laboratory and is currently maintained at the Harvard-Smithsonian Center for Astrophysics in Cambridge, MA.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0123693950007399
Facilitated Transport Membranes for CO2 Removal From Natural Gas
Xuezhong He, … Yunhan Chu, in Current Trends and Future Developments on (Bio-) Membranes, 2018
3 Transport Mechanism
Gas molecules transport through a membrane usually takes place by a driving force of chemical potential difference (e.g., transmembrane partial pressure/concentration difference). Different transport mechanisms are applied for various membrane materials. The S-D mechanism is well used to describe gas transport through conventional polymeric membranes where the Fick’s first law is employed as shown in Fig. 9.4. The gas permeate flux, Ji (m3(STP)/(m2 h)), of the component i through a membrane is described in Eq. (9.1):
Figure 9.4. Schematic diagram of a membrane gas separation process.
(9.1)Ji=−Didcidxi
where Di is the diffusion coefficient of component i, and dcidxi is the driving force. For an ideal system, the gas solubility is independent on concentration and can be described by Henry’s law (c = S × p). Thus, the Ji can be modified to
(9.2)Ji=PeiΔpi=Pei(pHxi,F−pLyi,P)
where Pei is the gas permeance (m3(STP)/(m2 h bar)) of component i, Δp is the driving force for gas transport, and p is total pressure (subscripts H and L represent high pressure and low pressure sides, respectively) (bar). xi,F and yi,P are the mole fraction of component i on feed and permeate side, respectively.
For the FT membranes, both solution-diffusion and carrier-mediated diffusion (i.e., FT) mechanism contribute the flux of reactive component A (such as CO2) and is described as follows (Kim et al., 2004):
(9.3)JA=DAl(cA,0−cA,l)+DACl(cAC,0−cAC,l)
where DA and DAC are diffusion coefficient of Fickian diffusion and carrier mediated (complex, AC) diffusion, respectively. L is the membrane thickness of a selective layer. For the PVAm-based FSC membranes developed by the Memfo group at NTNU (Kim et al., 2013), the carrier is chemically bonded to the polymer matrix. A schematic diagram for the gas separation through a FT membrane is shown in Fig. 9.5, where CO2 passes through a membrane based on the FT and solution-diffusion mechanism, while the nonreactive gas molecules (e.g., CH4) can only transport via a solution-diffusion mechanism. Thus, this type of membranes shows both high CO2 permeance and selectivity of CO2/CH4 applied to NG sweetening.
Figure 9.5. Gas transport through a facilitated transport membrane.
As illustrated in Fig. 9.5, CO2 (the component A) will dissolve on the membrane surface and diffuse into the membrane matrix where CO2 reaction has taken place to form a complex. The complex concentration inside the membrane depends on the CO2 concentration when the carrier is not saturated. After the carrier saturation, further increasing feed CO2 concentration will not increase the complex concentration (the maximum complex concentration is the total carrier concentration, CC). When the complex reaches the permeate side, CO2 will be released as illustrated in Fig. 9.5. The detailed description of CO2 flux calculation was reported by He et al. (2017). It is worth noting that feed pressure is crucial to increase flux by enhancing the contribution from both S-D and FT. However, after carrier saturation, further increasing feed CO2 partial pressure will not enhance the FT, but the total CO2 flux still increases because of the continuous S-D contribution. It is also expected that mass transfer coefficient will be enhanced by the increase of temperature, and thus an elevated temperature could present a higher gas permeance, but the selectivity is hard to predict because of the contrary dependency of solubility coefficient and diffusivity on temperature and should be optimized in a real application.
Fig. 9.6 shows CO2/CH4 selectivity and CO2 permeability in different polymer materials. For the pure polymeric membranes, their performance was always below the Robeson upper bound. However, by incorporating CO2 carrier into polymer matrix, the CO2 selectivity can be improved and the performance of FT membranes can surpass the 2008 upper bound (see Fig. 9.6).
Figure 9.6. CO2/CH4 separation property of polymer-based membrane materials (Wang et al., 2016). PEO, poly(ethylene oxide); PFTMs, polymer facilitate transport membranes; PIM, polymers of intrinsic microporosity; TR, thermally rearranged.
Similarly, gas transport on SILMs is governed by the S-D mechanism and FT mechanism. Compared with conventional polymer membranes, the SILMs often have higher CO2 solubility because of their physical and chemical properties tailored by cations and anions or additional functional groups. On one side, the gas solubility theories in ILs are controversial. Some studies showed that the cations–anions interaction dictated the solubility (Babarao et al., 2011; Hollóczki et al., 2013), whereas others suggested that the gas–anions interaction played a key role on solubility (Anthony et al., 2005; Prasad and Senapati, 2009). However, both experimental and theoretical studies showed the ILs are nanosegregated, where the anions and cations tend to form a three-dimensional ionic polar network and alkyl chains segregate into nonpolar domains. As a result, when a gas dissolves, it will locate in polar or nonpolar domain (Hu et al., 2011; Pison et al., 2008). On the other hand, free volume in ILs is also important in determining gas solubility. High free volume, contributed by the flexibility of the ionic structures, could increase gas solubility (Hu et al., 2011). Moreover, by incorporating amine group in cations or anions can increase CO2 selectivity because of facilitate transport (Hanioka et al., 2008; Myers et al., 2008). The gas transport in SILM is depicted in Fig. 9.7.
Figure 9.7. Illustration of gas transport mechanism through a supported ionic liquid membrane.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012813645400009X
Lacustrine Shale Gas Occurrence Characteristics
Xiangzeng Wang, in Lacustrine Shale Gas, 2017
3 Dissolved gas
Shale gas partly exists in shale reservoir fluid in the dissolved state, when natural gas molecules undergo absorption and enter into liquid material where they can be dissolved. The dissolved gas content in the shale layer mainly depends on the solubility in the fluid system.
Currently, the theoretical basis concerning the hydrocarbon gas dissolution mechanism originates from water-soluble gas reservoir research. Water-soluble gas reservoir exploitation and development in the USA began in the 1950s. With the findings on water-soluble gas reservoirs worldwide, research on dissolution mechanisms concerning hydrocarbon gas is also being carried out. Researchers are primarily concerned about the insolubility of hydrocarbon gas in water, which is applied to quantitative research in the oil–gas primary migration field (Barker, 1987; McAuliffe, 1979Barker, 1987McAuliffe, 1979). Water-soluble gas reservoir research began very late in China. Sun (1992) discussed the effect of underground water on gas reservoirs, while Hao and Zhang (1993) studied the change insolubility characteristics of natural gas in formation water, and Fu and Wang (1996) proposed two main dissolution mechanisms of gas in formation water. It is currently believed that the dissolution of natural gas in water obeys Henry’s Law (Fu and Wang, 1996), and that there is a close relationship among gas solubility, natural gas, water content, and pressure. Many hydrocarbon gas water-soluble experiments have also been carried out (Li, 2005; Lu, 1991; Liu, 2004). A series of advances were achieved in the area of geochemical characteristics, including gas source correlation. For example, the use of C2+, iC4/nC4 as geochemical indicators to assess water-soluble gas was studied by Chen and Li (1994). A rock acidolysis hydrocarbon abnormality identification method was established using the adsorption equilibrium principle between natural gas solubility and rock adsorbed hydrocarbon (Fu and Wang, 1996).
Incorporating previous research, there still remain different views and hypotheses on the mechanism of hydrocarbon gas dissolution. For example, based on experimental research, Fu and Wang (1996) believe that the mechanism of hydrocarbon gas dissolution mainly includes two gases: (1) the natural gas molecules infill the interstices between water molecules; and (2) the natural gas molecules and water molecules interact to form hydrated molecules. Whatever the actual mechanism, the solubility of hydrocarbon gas is affected by such factors as temperature, pressure, solution systems, and molecular polarity.
3.1 Interstitial Filling
When shale gas molecules come in contact with liquid hydrocarbons, they can fill the interstices between liquid hydrocarbon molecules due to molecular diffusion, known as interstitial filling. Both temperature and pressure have substantial effects on interstitial filling.
According to Fu and Wang (1996) research, the following assumptions on interstitial filling of dissolved gas molecules in shale can be proposed: (1) there exists a certain gap between molecules of the dissolution system, and gas molecules can infill these interstices; (2) when the properties of gas molecules and the molecules of the dissolution system differ greatly (such as methane and water molecules), and the gas does not exhibit significant hydrolysis, the contribution of interstitial filling to gas solubility cannot be ignored; and (3) gas infilled into the interstices of the liquid can be described by the equation of gas state.
Based on the earlier assumptions, as long as the interstitial percentage of the dissolution system is known, the amount of gas in the interstices of the dissolution system can be calculated according to the equation of gas state. As it is difficult to determine the absolute interstitial percentage of the dissolution system, a concept-driven interstitial percentage is proposed for this purpose. In other words, that part of interstitial space that a specific gas molecule is allowed to enter in a dissolution system of a certain volume, under a certain temperature, is the effective interstitial volume of the gas. The ratio between the effective interstitial volume and the corresponding total volume is known as the effective interstitial percentage.
3.2 Hydration
The combination and decomposition process of gas and water molecules in shale is known as hydration. This is a reversible process, in which dynamic equilibrium is achieved when the combination rate and the decomposition rate are equal.
Based on the phenomenon that gas solubility decreases with increasing temperature, it is believed that there is interaction between gas molecules and water molecules when the temperature is low. Although the strength of the interaction and modes of occurrence of different gas molecules are different, they are collectively called “hydration,” which is another reason why the gas dissolves in water.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128133002000040
Functionalized Graphene Nanocomposite in Gas Sensing
Bhargav Raval, Indrani Banerjee, in Functionalized Graphene Nanocomposites and their Derivatives, 2019
5.2.1 Gas Adsorption on Pristine Graphene
The gas molecule adsorption on graphene sheets has attracted many experimental researchers to study. The basic work that has been carried out on this path was done by Wehling et al. [82] and showed that graphene is a promising material for chemical sensing by density of state, and it also explained the experimental results by Schedin et al. [11] on the single-molecule detection of NO2. Based on density functional theory (DFT) calculations, Leenaerts et al. [83] have considered interaction between PG and varieties of gas molecules such as H2O, CO, NO, NH3, and NO2 by simulation. The adsorbed ion energy for physically absorbed hydrogen on coronene (a graphene display) surface computed utilizing nonlocal van der Waals corrected DFT technique demonstrated great correspondence with the experimental data.
Similarly, the CO2 adsorption energies on graphene for chemisorption and physisorption utilizing DFT and second-order Møller–Plesset methods [84] show great agreement with previous experimental results and theoretical reports. The selective detection can also be possible in the case of NH3. DFT and quantum transport–based calculations show that when graphene with armchair edges has been used for simulation, it affected the transport properties strongly. Out of various gas species, it can be possible to sense NH3 [85]. PG always interacts with weak van der Waal forces, as it does not have any dandling bond on its surface. With strong covalent bonding with neighboring carbon atoms, it has high stability that makes low adsorption energy for gases on PG [86].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128145487000155
Properties of gases
Bai Shaoxian, Wen Shizhu, in Gas Thermohydrodynamic Lubrication and Seals, 2019
1.1.4 Degree of gas molecular freedom
A gas molecule at room temperature can be considered as a rigid body without considering the freedom of vibration. For a nonrigid molecule, there is also a spring-like vibration, so we add 1 to the degree of freedom.
Monatomic molecules, such as helium, neon, and argon, have only one atom, which can be seen as a free particle, so there are three translational degrees of freedom.
In rigid diatomic molecules, such as hydrogen, oxygen, and carbon monoxide, the distance between the two atoms remains the same, and to determine the location of the center of mass, three independent coordinates are required. To determine the location of the point line, two independent coordinates are needed. It makes no sense to rotate the two points around the wire. Therefore the rigid diatomic molecule has five degrees of freedom: three translational degrees of freedom and two rotational degrees of freedom.
For rigid triatoms or polyatomic molecules, such as water, carbon dioxide, and ammonia, as long as the atoms are not aligned in a straight line, they can be seen as free rigid bodies with six degrees of freedom.
The degree of gas molecular freedom is shown in Table 1.2.
Table 1.2. Degree of gas molecular freedom.
| Molecular type | Degree of freedom | ||||
|---|---|---|---|---|---|
| Translation it | Rotation ir | Vibration is | id=it+ir+is | ||
| Monatomic molecule | 3 | 0 | 0 | 3 | |
| Diatomic molecule | Rigid | 3 | 2 | 0 | 5 |
| Nonrigid | 3 | 2 | 1 | 6 | |
| Polyatomic molecule | Rigid | 3 | 3 | 0 | 6 |
| Nonrigid | 3 | 3 | 3n−6 | 3n |
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128167168000012
Voltage losses in a solid oxide fuel cell (SOFC)
Kevin Huang, John B. Goodenough, in Solid Oxide Fuel Cell Technology, 2009
Knudsen diffusion
Consider the diffusion of gas molecules through very small capillary pores. If the pore diameter is smaller than the mean free path length of the diffusing gas molecules, and the density of the gas is low, the gas molecules will collide with the pore walls more frequently than with each other. This process is known as Knudsen diffusion. The gas flux is reduced by the wall collisions. The diffusivity of species A for Knudsen diffusion, DK, A (in cm2/s), is obtained from the self-diffusivity derived from the classical kinetic theory of gases70
[7.34]DK,A=13dpore8RTπMA=4850dporeTMA
where dpore is the mean pore diameter (in cm). It is obvious that DK,A ∝ T1/2 and is a function of the pore size.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781845696283500070


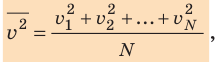
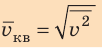
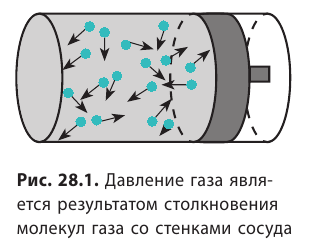
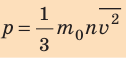
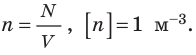
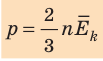
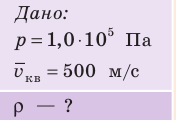


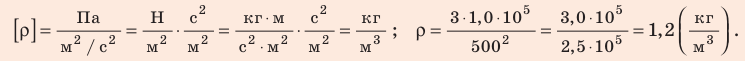




























 — универсальная газовая постоянная.
— универсальная газовая постоянная.
























































