Фраза «озоновый слой», ставшая известной в 70-е гг. прошлого века, давно уже набила оскомину. При этом мало кто действительно понимает, что означает это понятие и чем опасно разрушение озонового слоя. Еще большей загадкой для многих является строение молекулы озона, а ведь она напрямую связана с проблемами озонового слоя. Давайте узнаем больше об озоне, его строении и применении этого вещества в промышленности.
Что такое озон
Озон, или, как его еще называют, активный кислород, – это газ лазурного цвета с резким металлическим запахом.
Данное вещество может существовать во всех трех агрегатных состояниях: газообразном, твердом и жидком.
При этом в природе озон встречается только в виде газа, образуя так называемый озоновый слой. Именно из-за его лазурного цвета небо кажется голубым.
Как выглядит молекула озона
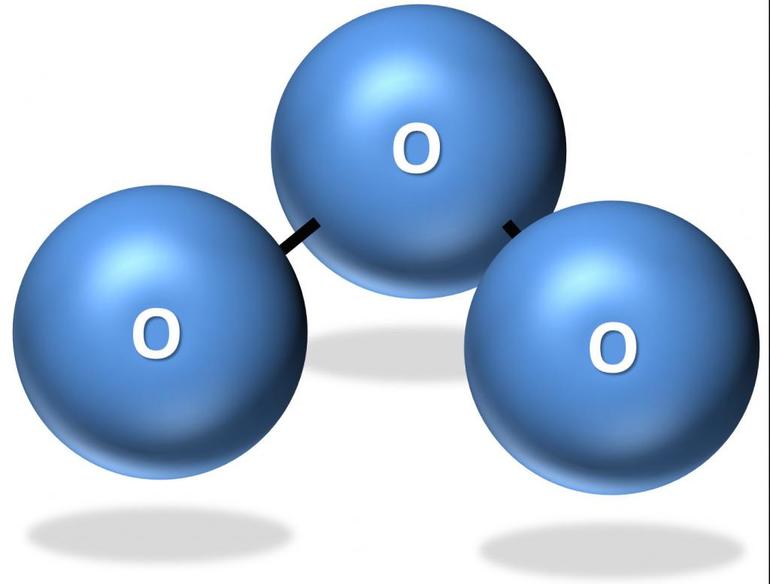
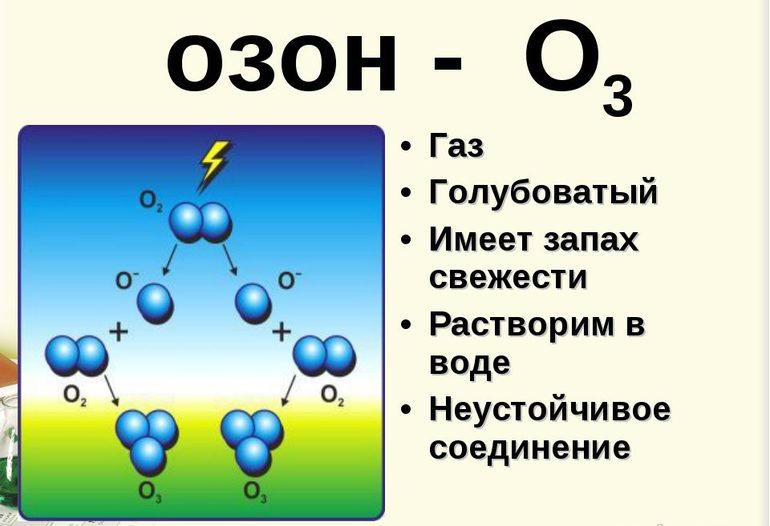
Свое прозвище «активный кислород» озон получил из-за своего сходства с кислородом. Так главным действующим химическим элементом в этих веществах является оксиген (О). Однако если в молекуле кислорода содержится 2 его атома, то молекула озона (формула — О3) состоит из 3 атомов этого элемента.
Благодаря такому строению, свойства озона подобны кислородным, однако более выражены. В частности, как и О2, О3 является сильнейшим окислителем.
Самое главное отличие между этими «родственными» веществами, которое помнить жизненно важно для каждого, следующее: озоном нельзя дышать, он токсичен и при вдыхании способен повредить легкие или даже убить человека. При этом О3 прекрасно подходит для очистки воздуха от токсичных примесей. Кстати, именно из-за этого после дождя так легко дышится: озон окисляет вредные вещества, содержащиеся в воздухе, и он очищается.
Модель молекулы озона (состоящая из 3 атомов оксигена) немного напоминает изображение угла, причем его размер — 117°. Эта молекула не имеет неспаренных электронов, поэтому является диамагнитной. Помимо этого, она обладает полярностью, хотя и состоит из атомов одного элемента.
Два атома данной молекулы прочно скреплены между собой. А вот связь с третьим менее надежна. По этой причине молекула озона (фото модели можно увидеть ниже) весьма непрочна и вскоре после образования распадается. Как правило, при любой реакции распада О3 выделяется кислород.
Из-за нестабильности озона его не получается заготавливать и хранить, а также перевозить, как другие вещества. По этой причине его производство более затратно, чем других веществ.
При этом высокая активность молекул О3 позволяет этому веществу быть сильнейшим окислителем, более мощным, чем кислород, и более безопасным, чем хлор.
Если молекула озона разрушается и выделяется О2, данная реакция всегда сопровождается выделением энергии. В то же время, чтобы произошел обратный процесс (образование О3 из О2), необходимо затратить ее не меньше.
В газообразном состоянии молекула озона распадается при температуре 70° С . Если ее повысить до 100 градусов и более, реакция значительно ускорится. Также ускоряет период распада молекул озона наличие примесей.
Свойства О3
В каком бы из трех состояний ни пребывал озон, он сохраняет синий цвет. Чем тверже вещество, тем насыщеннее и темнее этот оттенок.
Каждая молекула озона весит 48 г/моль. Она является более тяжелой, чем воздух, что помогает разделять эти вещества между собою.
О3 способен окислять практически все металлы и неметаллы (кроме золота, иридия и платины).
Также это вещество может участвовать в реакции горения, однако для этого нужна более высокая температура, чем для О2.
Озон способен растворяться в Н2О и фреонах. В жидком состоянии он может смешиваться с жидким кислородом, азотом, метаном, аргоном, тетрахлоруглеродом и углекислотой.
Как образуется молекула озона
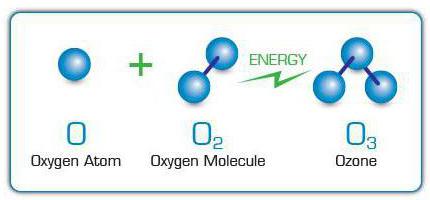
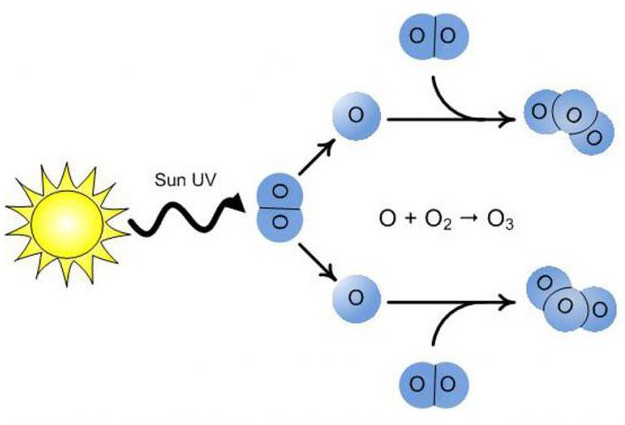
Молекулы О3 образуются с помощью прикрепления к молекулам кислорода свободных атомов оксигена. Они, в свою очередь, появляются благодаря расщеплению других молекул О2 из-за воздействия на них электрических разрядов, ультрафиолетовых лучей, быстрых электронов и других частиц высокой энергии. По этой причине специфический запах озона можно почувствовать возле искрящих электрических приборов или ламп, излучающих ультрафиолет.
В промышленных масштабах О3 выделяют с помощью электрических генераторов озона или озонаторов. В этих приборах электрический ток высокого напряжения пропускается через газовый поток, в котором находится О2, атомы которого и служат «строительным материалом» для озона.
Иногда в эти аппараты запускают чистый кислород или обычный воздух. От чистоты исходного продукта зависит качество получаемого озона. Так, медицинский О3, предназначенный для обработки ран, добывают только из химически чистого О2.
История открытия озона
Разобравшись с тем, как выглядит молекула озона и как она образуется, стоит познакомиться с историей этого вещества.
Впервые оно было синтезировано нидерландским исследователем Мартином Ван Марумом во второй половине XVIII в. Ученый заметил, что после пропускания электрических искр через емкость с воздухом газ в ней менял свои свойства. При этом Ван Марум так и не понял, что выделил молекулы нового вещества.
А вот его немецкий коллега по фамилии Шейнбейн, пытаясь с помощью электричества разложить Н2О на Н и О2, обратил внимание на выделение нового газа с едким запахом. Проведя массу исследований, ученый описал открытое им вещество и дал ему имя «озон» в честь греческого слова «пахнуть».
Способность убивать грибки и бактерии, а также понижать токсичность вредных соединений, которой обладало открытое вещество, заинтересовала многих ученых. Через 17 лет после официального открытия О3 Вернером фон Сименсом был сконструирован первый аппарат, позволяющий синтезировать озон в любом количестве. А еще через 39 лет гениальный Никола Тесла изобрел и запатентовал первый в мире генератор озона.
Именно этот аппарат уже через 2 года впервые был использован во Франции на очистительных сооружениях для питьевой воды. С началом XX в. Европа начинает переходить на озонирование питьевой воды для ее очистки.
Российская империя впервые использовала эту методику в 1911 г., а через 5 лет в стране было оборудовано почти 4 десятка установок для очистки питьевой воды с помощью озона.
Сегодня озонирование воды постепенно вытесняет хлорирование. Так, 95% всей питьевой воды в Европе очищается с помощью О3. Также весьма популярна данная методика и в США. В СНГ она пока еще на стадии изучения, поскольку, хотя данная процедура и более безопасна и удобна, обходится она дороже, чем хлорирование.
Сферы применения озона
Помимо очистки воды, О3 имеет ряд других сфер применения.
- Озон используется в качестве отбеливателя при производстве бумаги и ткани.
- Активный кислород применяется для дезинфекции вин, а также для ускорения процесса «старения» коньяков.
- С помощью О3 рафинируются различные растительные масла.
- Очень часто это вещество применяют для обработки скоропортящихся продуктов, вроде мяса, яиц, фруктов и овощей. При этой процедуре не остается химических следов, как при использовании хлора или формальдегидов, а продукты могут храниться значительно дольше.
- Озоном стерилизуют медицинское оборудование и одежду.
- Также очищенный О3 применяют для различных медицинских и косметических процедур. В частности, с его помощью в стоматологии дезинфицируют ротовую полость и десны, а также лечат различные заболевания (стоматит, герпес, оральный кандидоз). В европейских странах О3 весьма популярен для дезинфекции ран.
- В последние годы огромную популярность приобретают портативные домашние приборы для фильтрации воздуха и воды с помощью озона.
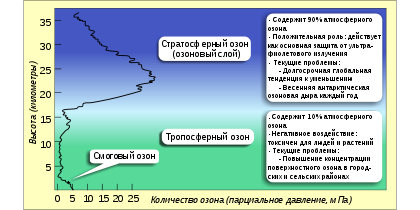
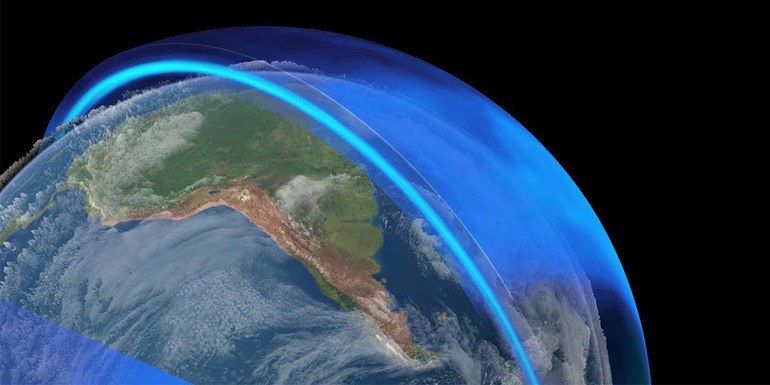
Озоновый слой — что это?
На расстоянии 15-35 км над поверхностью Земли находится озоновый слой, или, как его еще называют, озоносфера. В этом месте концентрированный О3 служит своеобразным фильтром для вредного солнечного излучения.
Откуда берется такое количество вещества, если его молекулы нестабильны? Ответить на этот вопрос не сложно, если вспомнить модель молекулы озона и способ ее образования. Итак, кислород, состоящий из 2 молекул оксигена, попадая в стратосферу, нагревается там солнечными лучами. Этой энергии оказывается достаточно, чтобы расщепить О2 на атомы, из которых образуется О3. При этом озоновый слой не только использует часть солнечной энергии, но и фильтрует ее, поглощает опасный ультрафиолет.
Выше было сказано, что озон растворяется фреонами. Эти газообразные вещества (применяются при изготовлении дезодорантов, огнетушителей и холодильников), попав в атмосферу, влияют на озон и способствуют его разложению. Вследствие этого в озоносфере возникают дыры, сквозь которые на планету попадают нефильтрированые солнечные лучи, которые разрушительно действуют на живые организмы.
Рассмотрев особенности и строение молекул озона, можно прийти к выводу, что это вещество, хотя и опасно, но весьма полезно для человечества, если его правильно использовать.
Содержание
- Строение озона
- История открытия
- Физические свойства
- Химические свойства
- Получение озона
- Токсичность
- Применение озона
- Применение жидкого озона
- Озон в атмосфере
Озон — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
| Озон | |
|---|---|
| Общие | |
| Систематическое наименование |
Трикислород |
| Хим. формула | O3 |
| Физические свойства | |
| Состояние | голубой газ |
| Молярная масса | 47,998 г/моль |
| Плотность | 0,0021445 г/см3 (г., 0°C); 1,59(7) г/см3 (ж., 85,2 К); 1,73(2) г/см3 (тв., 77,4 К) |
| Поверхностное натяжение | 43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К) Н/м |
| Динамическая вязкость | 4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К) |
| Энергия ионизации | 12,52 ± 0,01 эВ |
| Термические свойства | |
| Температура | |
| • плавления | −197,2 °C |
| • кипения | −111,9 °C |
| Критическая точка | |
| • температура | −12,0 °С (261,1 К) °C |
| • давление | 54,6 атм. |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К) Дж/(моль·К) |
| Энтальпия | |
| • образования | 144,457 (при 0 К, отн. О2) кДж/моль |
| Коэфф. тепл. расширения | 2,0·10−3 К−1 (ж., 90,1 К) 2,5·10−3 К−1 (ж., 161 К) |
| Давление пара | 1 ± 1 атм |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,06 г/л (при 0 °С) |
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж) |
| Оптические свойства | |
| Показатель преломления | 1,0533 (г., 480 нм) 1,0520 (г., 546 нм) 1,0502 (г., 671 нм) 1,2236 (ж., 535 нм) 1,2226 (ж., 589 нм) 1,2213 (ж., 670,5 нм) |
| Структура | |
| Дипольный момент | 0,5337 Д |
| Классификация | |
| Рег. номер CAS | 10028-15-6 |
| PubChem | 24823 |
| Рег. номер EINECS | 233-069-2 |
| SMILES |
[O-][O+]=O |
| InChI |
1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N |
| RTECS | RS8225000 |
| ChEBI | 25812 |
| ChemSpider | 23208 |
| Безопасность | |
| ЛД50 | 4,8 ppm |
| Токсичность | сильнодействующий яд, обладающий раздражающим и канцерогенным действием |
| Пиктограммы СГС |     |
| NFPA 704 |
Строение озона
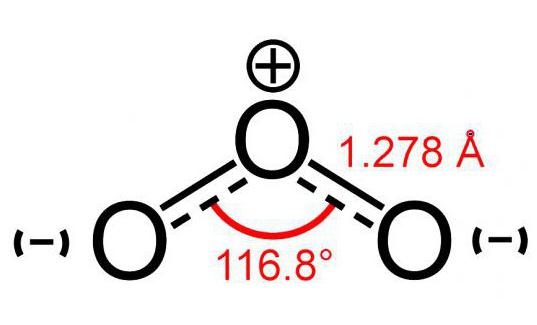
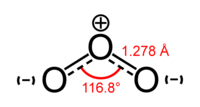
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д.
История открытия
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом.
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда.
Физические свойства
- Молекулярная масса — 48 а. е. м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³.
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3.
- Температура кипения −111,8(3) °C (161,3 К). Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению. По другим сведениям Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К).
- Критическое давление 51,6 атм.
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с.
- Теплота плавления 2,1 кДж/моль.
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль; при 90 К от 15,27 до 16,6 кДж/моль.
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы.
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ.
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Химические свойства
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония русск. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Получение озона
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария:
Токсичность
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм является общетоксическим, раздражающим, канцерогенным, а также может приводить к преждевременной смерти.
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³;
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³;
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) — 4,8 ppm
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³.
Озон эффективно убивает плесень, бактерии и вирусы. Промышленные озонаторы используются для дезинфекции помещений от коронавируса COVID-19.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента.
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники.
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Озон в атмосфере
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
У этого термина существуют и другие значения, см. Озон (значения).
| Озон | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Озон |
| Химическая формула | O3 |
| Физические свойства | |
| Состояние (ст. усл.) | голубой газ |
| Отн. молек. масса | 47.998 а. е. м. |
| Молярная масса | 47.998 г/моль |
| Плотность | 0,0021445 г/см³ |
| Термические свойства | |
| Температура плавления | −197,2 °C |
| Температура кипения | −119,9 °C |
| Химические свойства | |
| Растворимость в воде | 39,4 г/100 мл |
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Содержание
- 1 Строение озона
- 2 История открытия
- 3 Физические свойства
- 4 Химические свойства
- 5 Получение озона
- 6 Биологические свойства
- 7 Применение озона
- 7.1 Применение жидкого озона
- 8 Озон в атмосфере
- 9 Примечания
- 10 См. также
- 11 Ссылки
Строение озона
Обе связи O-O в молекуле озона имеют одинаковую длину 1,272 Å. Угол между связями составляет 116,78°[1]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной с другим и наоборот. Молекула полярна, дипольный момент 0,5337 D[2].
История открытия
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[3]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[3]:
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали[когда?] Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проволками для получения электрического разряда[3].
Физические свойства
- Молекулярная масса — 48 а.е.м.
- Плотность газа при нормальных условиях — 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху — 1,62 (1,658[4]).
- Плотность жидкости при −183 °C — 1,71 г/см³
- Температура кипения — −111,9 °C. Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления — −197,2 ± 0,2 °С (приводимая обычно т.пл. −251,4 °C ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению)[5]. В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом.
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1 : 100000.
Химические свойства
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[6] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств HNO3 озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (—78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить Серную кислоту как из элементарной серы, так и из диоксида серы:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
В газовой фазе озон взаимодействует с сероводородом с образованием двуокиси серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый нитрилперхлорат может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (-196 °C), атомарный водород взаимодействует с озоном с образованием супероксидного радикала с димеризацией последнего[7]:
Озон может образовывать озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3, и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[8]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[9]:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[7]:
Озон может быть использован для удаления марганца из воды с образованием осадка, который может быть отделён фильтрованием:
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину[10] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Получение озона
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлажденной концентрированной серной кислоты с пероксидом бария:
Биологические свойства
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм может приводить к преждевременной смерти.[11]
Наиболее опасное воздействие:
- на органы дыхания прямым раздражением и повреждением тканей
- на холестерин в крови человека с образованием нерастворимых форм, приводящим к атеросклерозу
- на органы размножения у самцов всех видов животных, в том числе и человека (вдыхание этого газа убивает мужские половые клетки и препятствует их образованию). При долгом нахождении в среде с повышенной концентрацией этот газ может стать причиной мужского бесплодия.
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[12]
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[12]
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³.[13]
Озон эффективно убивает плесень и бактерии.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения
- при получении многих веществ в лабораторной и промышленной практике
- для отбеливания бумаги
- для очистки масел
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование)
- для дезинфекции помещений и одежды
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие[13] токсинов после обработки, тогда как при хлорировании возможно образование существенного количества токсинов и ядов, например, диоксина.
- лучшая, по сравнению с кислородом, растворимость в воде:
- По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск его мутагенного, канцерогенного и токсического воздействия[14] перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента.
В 21 веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности столь необходимых при применении данной техники[источник не указан 219 дней].
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[15]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона больший удельный вес, чем у жидкого кислорода (1,35 и 1,14 соответственно), а его температура кипения выше (минус 112° и минус 183°С соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона. При взрыве возникает движущаяся с огромной скоростью — по некоторым данным более 200 км/сек — детонационная волна и развивается разрушающее детонационное давление более 4000 атм, что делает применение жидкого озона невозможным при нынешнем уровне техники[16].
Озон в атмосфере
Распределение озона по высоте
Атмосферный озон играет важную роль для всего живого на планете. Образуя озоновый слой в стратосфере, он защищает растения и животных от жёсткого ультрафиолетового излучения. Поэтому проблема образования озоновых дыр имеет особое значение. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждать растения.
Примечания
- ↑ Takehiko Tanaka; Yonezo Morino. Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states // Journal of Molecular Spectroscopy. — 1970. — Vol. 33. — P. 538—551.
- ↑ Kenneth M. Mack; J. S. Muenter. Stark and Zeeman properties of ozone from molecular beam spectroscopy // Journal of Chemical Physics. — 1977. — Vol. 66. — P. 5278-5283.
- ↑ 1 2 3 С. С. Колотов, Д. И. Менделеев Озон // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Справочник химика, т. II. Л., «Химия», 1971.
- ↑ Карякин Ю. В. Ангелов И. И. Чистые химические вещества. М., «Химия», 1974.
- ↑ Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion?
- ↑ 1 2 Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
- ↑ Housecroft & Sharpe, 2005. «Inorganic Chemistry.» pg 439
- ↑ Housecroft & Sharpe, 2005. «Inorganic Chemistry.» pg 265
- ↑ Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
- ↑ National Academy of Sciences: Link Between Ozone Air Pollution and Premature Death Confirmed
- ↑ 1 2 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Гигиенические нормативы 2.1.6.1338-03
- ↑ 1 2 Озон — мирное оружие XXI века — Костромской научно-исследовательский институт сельского хозяйства
- ↑ Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies, American Cancer Society
- ↑ Перспективные окислители.
- ↑ Жидкий озон
См. также
- Ионизирующее излучение
Ссылки
- Озон — Химическая энциклопедия.
- Озон — не всегда хорошо // Наука и Жизнь : журнал. — 1992. — № 8. — С. 155.
|
Чрезвычайно опасные вещества |
||
|---|---|---|
|
У этого термина существуют и другие значения, см. Озон (значения).
| Озон | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Трикислород | |
| Традиционные названия | Озон | |
| Хим. формула | O3 | |
| Физические свойства | ||
| Состояние | голубой газ | |
| Молярная масса | 47,998 г/моль | |
| Плотность |
0,0021445 г/см³ (газ при 0 °C); 1,59(7) г/см³ (жидкость при 85,2 К); 1,73(2) г/см³ (твердый вид при 77,4 К)[1] |
|
| Поверхностное натяжение |
43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м |
|
| Динамическая вязкость |
4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] |
|
| Энергия ионизации | 12,52 ± 0,01 эВ | |
| Термические свойства | ||
| Температура | ||
| • плавления | −197,2 °C | |
| • кипения | −111,9 °C | |
| Критическая точка | ||
| • температура | −12,0 °С (261,1 К)[1] °C | |
| • давление | 54,6 атм.[1] | |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) | |
| Энтальпия | ||
| • образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль | |
| Коэфф. тепл. расширения |
2,0·10−3 К−1 (жидкость, 90,1 К) 2,5·10−3 К−1 (жидкость, 161 К)[1] |
|
| Давление пара | 1 ± 1 атм | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 1,06 г/л (при 0 °С)[2] | |
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж)[1] | |
| Оптические свойства | ||
| Показатель преломления |
1,0533 (газ, 480 нм) 1,0520 (газ, 546 нм) 1,0502 (газ, 671 нм) 1,2236 (жидкость, 535 нм) 1,2226 (жидкость, 589 нм) 1,2213 (жидкость, 670,5 нм)[1] |
|
| Структура | ||
| Дипольный момент | 0,5337 Д | |
| Классификация | ||
| Рег. номер CAS | 10028-15-6 | |
| PubChem | 24823 | |
| Рег. номер EINECS | 233-069-2 | |
| SMILES |
[O-][O+]=O |
|
| InChI |
InChI=1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N |
|
| RTECS | RS8225000 | |
| ChEBI | 25812 | |
| ChemSpider | 23208 | |
| Безопасность | ||
| ЛД50 | 4,8 ppm | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 2 4 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3, аллотропная модификация кислорода. При нормальных условиях — голубой газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Строение озона
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°[3]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д[4].
История открытия
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[5]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[5]:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом[6].
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда[5].
Физические свойства
- Молекулярная масса — 48 а. е. м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658[7]).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³[1].
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см³[1].
- Температура кипения −111,8(3) °C (161,3 К)[1]. Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К). Приводимая иногда температура плавления −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению[8]. По другим сведениям[1] Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К)[1].
- Критическое давление 51,6 атм[1].
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см²/с[1].
- Теплота плавления 2,1 кДж/моль[1].
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль[1]; при 90 К от 15,27 до 16,6 кДж/моль[1].
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы[1].
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ[1].
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100 000.
Химические свойства
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[9] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины[10] и иридия) до их высших степеней окисления (после некоторого поверхностного окисления довольно хорошо противостоят действию озона Ni, Cu, Sn)[11]. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония (англ.) (рус. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего[12]:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO<sub>3</sub> могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[14]:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[12]:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину[15] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Получение озона
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[6]:
Токсичность
В умеренных концентрациях озон не токсичен. Однако высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его токсичность (в больших концентрациях). Чрезмерное воздействие озона на организм может приводить к преждевременной смерти.
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[16];
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[16];
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³;
- минимальная смертельная концентрация (LC50) — 4,8 ppm.
Порог человеческого обоняния приближённо равен 0,01 мг/м³[17].
Озон эффективно уничтожает плесень, бактерии и вирусы.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие[17] токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента[18].
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники[источник не указан 3937 дней].
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[19]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см³ соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см² (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс (УИ) для водородных двигателей, по сравнению с озон-водородными[20]. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Жидкий озон при низких температурах (в жидком азоте) также иногда применяется в органическом синтезе для мягкого разрыва двойной углерод-углеродной связи.
Озон в атмосфере
Распределение озона по высоте
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
При взаимодействии солнечных лучей с диоксидом азота и углеводородами, попадающими в атмосферу из выхлопных газов автомобилей, образуется фотохимический смог. Диоксид азота под действием ультрафиолетового излучения солнца распадается, образуя оксид азота и свободные атомы кислорода (озон). Фотохимические смоги впервые были обнаружены в 1940-х годах в Лос-Анджелесе. Они приводят к раздражению слизистых оболочек глаз и носоглотки у людей, а также гибели растительности и порче резиновых изделий[21][22].
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Лунин, 1998.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. ss. 91—100. Auflage. de Gruyter, 1985, S. 460.
- ↑ Takehiko Tanaka; Yonezo Morino. Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states // Journal of Molecular Spectroscopy. — 1970. — Vol. 33. — P. 538—551.
- ↑ Kenneth M. Mack; J. S. Muenter. Stark and Zeeman properties of ozone from molecular beam spectroscopy // Journal of Chemical Physics. — 1977. — Vol. 66. — P. 5278—5283.
- ↑ 1 2 3 С. С. Колотов, Д. И. Менделеев. Озон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ 1 2 Получение озона и его определение. Дата обращения: 29 сентября 2014. Архивировано 6 октября 2014 года.
- ↑
Справочник химика, т. II. — Л.: «Химия», 1971. - ↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974.
- ↑ Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion? Архивировано 1 июня 2006 года.
- ↑ Платина не окисляется озоном, но катализирует его разложение.
- ↑ Некрасов Б. В. Н48 Основы общей химии. В 2 томах. Том 1.4-е изд., стер.-СПб.: Издательство «Лань», 2003. — 656 с. — (Учебники для вузов, специальная литература).
- ↑ 1 2 Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 439.
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 265
- ↑ Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
- ↑ 1 2 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест. Гигиенические нормативы 2.1.6.1338-03. Дата обращения: 21 ноября 2012. Архивировано из оригинала 3 декабря 2013 года.
- ↑ 1 2 Тышкевич Е. В. Озон — мирное оружие XXI века Архивная копия от 1 апреля 2009 на Wayback Machine [неавторитетный источник?]
- ↑ Questionable methods of cancer management: hydrogen peroxide and other ’hyperoxygenation’ therapies Архивная копия от 7 июля 2010 на Wayback Machine, American Cancer Society
- ↑ Перспективные окислители. Дата обращения: 24 декабря 2009. Архивировано из оригинала 3 ноября 2009 года.
- ↑ The Dynamics of Unsteady Detonation in Ozone. Дата обращения: 23 января 2015. Архивировано 16 января 2017 года.
- ↑ Фотохимический смог. Дата обращения: 5 мая 2022. Архивировано 3 января 2019 года.
- ↑ Погода, климат и воздух, которым мы дышим. Дата обращения: 5 мая 2022. Архивировано 22 октября 2021 года.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Разумовский С. Д., Заиков Г. Е. Озон и его реакции с органическими соединениями (кинетика и механизм). — М.: Наука, 1974. — 322 с.
- Лунин В. В., Попович М. П., Ткаченко С. Н. Физическая химия озона. — М.: МГУ, 1998. — 480 с. — ISBN 5-211-03719-7.
Ссылки
- Озон — не всегда хорошо // Наука и жизнь : журнал. — 1992. — № 8. — С. 155.
Эта страница в последний раз была отредактирована 10 февраля 2023 в 12:25.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Ozone is an irritating light blue gas that, even at low concentrations, is explosive and poisonous. It naturally occurs in small levels in the Earth’s stratosphere, where it absorbs solar UV light, which would otherwise cause severe harm to living things on the Earth’s surface. Under some conditions, photochemical reactions in the lower atmosphere between nitrogen oxides and hydrocarbons can produce ozone in concentrations high enough to irritate the eyes and mucous membranes.
Ozone is a triatomic oxygen allotrope that gives the air a distinctive odour after a thunderstorm or near electrical equipment. The odour of ozone surrounding electrical machinery was first reported in 1785, and the chemical composition of ozone was identified in 1872.
Ozone
The odour of ozone is similar to that of chlorine and may be detected by many people in quantities as low as 0.1 ppm in the air. In 1865, the structure of ozone was discovered. Later, it was discovered that the molecule has a bent shape and is mildly paramagnetic. Under normal conditions, ozone is a pale blue gas that condenses to a dark blue liquid and then to a violet-black solid at cryogenic temperatures. Ozone’s incompatibility with more prevalent dioxygen causes both concentrated gas and liquid ozone to break down explosively under high temperatures, physical trauma, or rapid warming to the boiling point. As a result, it is only utilised commercially in low amounts.
Ozone is a potent oxidant (much more potent than dioxygen) with numerous industrial and consumer applications involving oxidation. Above concentrations of roughly 0.1 ppm, ozone’s high oxidizing potential leads it to harm mucous and respiratory tissues in animals, as well as tissues in plants. While this makes ozone a substantial respiratory hazard and pollutant near the ground, a higher ozone layer concentration (from two to eight ppm) is beneficial because it keeps harmful UV rays from reaching the Earth’s surface.
Physical Properties of Ozone
- Ozone is a colourless or pale blue gas that is mildly soluble in water but much more soluble in inert nonpolar solvents like carbon tetrachloride or fluorocarbons, where it forms a blue solution.
- It condenses to create a dark blue liquid around 161K.
- Allowing this liquid to reach its boiling point is dangerous since both concentrated gaseous and liquid ozone has the potential to explode.
- At temperatures below 80 degrees Celsius, it solidifies as a violet-black liquid.
- Most people can detect ozone in the air because it has a distinct sharp odour that is similar to chlorine bleach.
- Ozone exposure causes headaches, burning eyes, and irritation of the respiratory passages.
- Modest levels of ozone in the air are extremely damaging to organic materials such as latex, polymers, and animal lung tissue.
- Ozone has a weak paramagnetic property.
Chemical Properties of Ozone
- Ozone acts as a powerful oxidizing agent. Reaction is
O3 ⇢ O2 + O
- Ozone reduces peroxides to oxides and gets reduced to oxygen
H2O2 + O3 ⇢ H2O + 2O2
Structure of Ozone
Ozone is a bent molecule with symmetry similar to water, according to microwave spectroscopy experiments. The angle formed by O-O-O is 116.78°. One lone pair is sp2 hybridised with the centre atom. The molecule ozone is polar. The molecule can be described as a resonance hybrid with two contributing structures, one with a single bond on one side and the other with a double bond. It has the same isoelectronic properties as the nitrite anion.
Structure of Ozone
Preparation of Ozone
In a laboratory, ozone is created by passing a quiet electric discharge across dry oxygen. Some oxygen molecules dissociate when an electric current is sent through them, and subsequently, atomic oxygen mixes with oxygen molecules to generate ozone.
O2 ⇢ O + O
O2 + O ⇢ O3
Reactions of Ozone
Ozone is one of the most potent oxidizing agents known, significantly more potent than O2. At large concentrations, it is likewise unstable and degrades into regular oxygen. Its half-life is affected by atmospheric factors like temperature, humidity, and air movement. As the temperature rises, the rate of this reaction accelerates. A spark can cause ozone deflagration, which can occur at ozone concentrations of 10% or more. At the anode of an electrochemical cell, oxygen can also be used to make ozone. Smaller amounts of ozone can be produced by this process for scientific purposes.
With metals: Ozone will oxidize most metals (excluding gold, platinum, and iridium) to oxides of the metals in their highest oxidation state. Consider the following scenario:
Cu + O3 → CuO + O2
Even at ambient temperature, ozone interacts with carbon to produce carbon dioxide:
C + 2O3 → CO2 + 2O2
Ozone Decomposition
Ozone is a harmful gas that is widely found or produced in human surroundings (aircraft cabins, offices with photocopiers, laser printers, and sterilizers, for example), and its catalytic decomposition is critical for pollution reduction. This is the most common kind of breakdown, especially with solid catalysts, and it has a number of advantages, including better conversion at lower temperatures. Furthermore, the product and catalyst can be separated instantly, allowing the catalyst to be recovered without the need for a separation process. Furthermore, noble metals such as Pt, Rh, or Pd, as well as transition metals such as Mn, Co, Cu, Fe, Ni, or Ag, are the most commonly employed materials in the catalytic breakdown of ozone in the gas phase.
In the gas phase, there are two alternative options for ozone decomposition: The first is a thermal decomposition, which decomposes ozone only by the action of heat. The issue is that at temperatures below 250°C, this sort of breakdown is extremely sluggish. However, by working at greater temperatures, the breakdown rate can be increased, albeit at a considerable energy expense. The second is a photochemical breakdown, which occurs when ozone is exposed to ultraviolet radiation (UV), resulting in the formation of oxygen and radical peroxide.
Uses of Ozone
- Water treatment plants without filtering systems employ ozone.
- Commonly used equipment, such as photocopiers, laser printers, and other electrical devices, can produce ozone.
- Ozone therapy is used to disinfect and treat diseases by minimising the impacts of bacteria, viruses, fungi, yeast, and protozoa.
- Several ozone-depleting chemicals have features that allow them to efficiently transfer heat from one site to another, making them good refrigerants.
What is an Ozone Layer?
The ozone layer, also known as the ozone shield, is a region of the Earth’s stratosphere that absorbs the majority of ultraviolet radiation from the Sun. It has a high concentration of ozone in comparison to the rest of the atmosphere, although it is relatively low in comparison to other gases in the stratosphere. The ozone layer contains fewer than 10ppm of ozone, whereas the average ozone concentration in the Earth’s atmosphere is around 0.3ppm. The ozone layer is primarily located in the lower stratosphere, between 15 and 35 kilometres above Earth, however, its thickness varies seasonally and geographically.
Sample Questions
Question 1: What is ozone?
Answer:
Ozone is a gas that exists naturally in our environment. Each ozone molecule has three oxygen atoms and is designated chemically as O3.
Question 2: Where is ozone found in the atmosphere?
Answer:
Ozone is typically present in two regions of the atmosphere. The troposphere, which stretches from the surface to roughly 10–15 kilometres height, contains around 10% of the Earth’s ozone. The stratosphere, the region of the atmosphere between the top of the troposphere and about 50 kilometres altitude, contains approximately 90 percent of the Earth’s ozone. The “ozone layer” refers to the region of the stratosphere with the highest concentration of ozone.
Question 3: How is ozone formed?
Answer:
Ozone is generated in the atmosphere through multistep chemical processes begun by sunlight. The process begins in the stratosphere with an oxygen molecule being torn apart by UV light from the Sun. Ozone is generated in the troposphere through a separate set of chemical reactions that involve both naturally occurring chemicals and those emitted by sources of air pollution.
Question 4: How is ozone measured in the atmosphere?
Answer:
Instruments on the ground and transported aloft on balloons, aircraft, and satellites measure the amount of ozone in the atmosphere. Some instruments use a continuous air sampler to monitor ozone in a tiny detection chamber. Other technologies use ozone’s distinctive optical absorption or emission qualities to assess ozone across vast distances.
Question 5: What emissions from human activities lead to ozone depletion?
Answer:
Ozone-depleting substances (ODSs) are released into the atmosphere by some industrial operations and consumer items. The Montreal Protocol regulates the use of produced halogen source gases around the world. These gases transport chlorine and bromine atoms to the stratosphere, where chemical processes destroy ozone. Chlorofluorocarbons (CFCs), which were originally utilised in practically all refrigeration and air conditioning systems, and halons, which were used as fire suppressing agents, are two notable examples.
Ozone is an irritating light blue gas that, even at low concentrations, is explosive and poisonous. It naturally occurs in small levels in the Earth’s stratosphere, where it absorbs solar UV light, which would otherwise cause severe harm to living things on the Earth’s surface. Under some conditions, photochemical reactions in the lower atmosphere between nitrogen oxides and hydrocarbons can produce ozone in concentrations high enough to irritate the eyes and mucous membranes.
Ozone is a triatomic oxygen allotrope that gives the air a distinctive odour after a thunderstorm or near electrical equipment. The odour of ozone surrounding electrical machinery was first reported in 1785, and the chemical composition of ozone was identified in 1872.
Ozone
The odour of ozone is similar to that of chlorine and may be detected by many people in quantities as low as 0.1 ppm in the air. In 1865, the structure of ozone was discovered. Later, it was discovered that the molecule has a bent shape and is mildly paramagnetic. Under normal conditions, ozone is a pale blue gas that condenses to a dark blue liquid and then to a violet-black solid at cryogenic temperatures. Ozone’s incompatibility with more prevalent dioxygen causes both concentrated gas and liquid ozone to break down explosively under high temperatures, physical trauma, or rapid warming to the boiling point. As a result, it is only utilised commercially in low amounts.
Ozone is a potent oxidant (much more potent than dioxygen) with numerous industrial and consumer applications involving oxidation. Above concentrations of roughly 0.1 ppm, ozone’s high oxidizing potential leads it to harm mucous and respiratory tissues in animals, as well as tissues in plants. While this makes ozone a substantial respiratory hazard and pollutant near the ground, a higher ozone layer concentration (from two to eight ppm) is beneficial because it keeps harmful UV rays from reaching the Earth’s surface.
Physical Properties of Ozone
- Ozone is a colourless or pale blue gas that is mildly soluble in water but much more soluble in inert nonpolar solvents like carbon tetrachloride or fluorocarbons, where it forms a blue solution.
- It condenses to create a dark blue liquid around 161K.
- Allowing this liquid to reach its boiling point is dangerous since both concentrated gaseous and liquid ozone has the potential to explode.
- At temperatures below 80 degrees Celsius, it solidifies as a violet-black liquid.
- Most people can detect ozone in the air because it has a distinct sharp odour that is similar to chlorine bleach.
- Ozone exposure causes headaches, burning eyes, and irritation of the respiratory passages.
- Modest levels of ozone in the air are extremely damaging to organic materials such as latex, polymers, and animal lung tissue.
- Ozone has a weak paramagnetic property.
Chemical Properties of Ozone
- Ozone acts as a powerful oxidizing agent. Reaction is
O3 ⇢ O2 + O
- Ozone reduces peroxides to oxides and gets reduced to oxygen
H2O2 + O3 ⇢ H2O + 2O2
Structure of Ozone
Ozone is a bent molecule with symmetry similar to water, according to microwave spectroscopy experiments. The angle formed by O-O-O is 116.78°. One lone pair is sp2 hybridised with the centre atom. The molecule ozone is polar. The molecule can be described as a resonance hybrid with two contributing structures, one with a single bond on one side and the other with a double bond. It has the same isoelectronic properties as the nitrite anion.
Structure of Ozone
Preparation of Ozone
In a laboratory, ozone is created by passing a quiet electric discharge across dry oxygen. Some oxygen molecules dissociate when an electric current is sent through them, and subsequently, atomic oxygen mixes with oxygen molecules to generate ozone.
O2 ⇢ O + O
O2 + O ⇢ O3
Reactions of Ozone
Ozone is one of the most potent oxidizing agents known, significantly more potent than O2. At large concentrations, it is likewise unstable and degrades into regular oxygen. Its half-life is affected by atmospheric factors like temperature, humidity, and air movement. As the temperature rises, the rate of this reaction accelerates. A spark can cause ozone deflagration, which can occur at ozone concentrations of 10% or more. At the anode of an electrochemical cell, oxygen can also be used to make ozone. Smaller amounts of ozone can be produced by this process for scientific purposes.
With metals: Ozone will oxidize most metals (excluding gold, platinum, and iridium) to oxides of the metals in their highest oxidation state. Consider the following scenario:
Cu + O3 → CuO + O2
Even at ambient temperature, ozone interacts with carbon to produce carbon dioxide:
C + 2O3 → CO2 + 2O2
Ozone Decomposition
Ozone is a harmful gas that is widely found or produced in human surroundings (aircraft cabins, offices with photocopiers, laser printers, and sterilizers, for example), and its catalytic decomposition is critical for pollution reduction. This is the most common kind of breakdown, especially with solid catalysts, and it has a number of advantages, including better conversion at lower temperatures. Furthermore, the product and catalyst can be separated instantly, allowing the catalyst to be recovered without the need for a separation process. Furthermore, noble metals such as Pt, Rh, or Pd, as well as transition metals such as Mn, Co, Cu, Fe, Ni, or Ag, are the most commonly employed materials in the catalytic breakdown of ozone in the gas phase.
In the gas phase, there are two alternative options for ozone decomposition: The first is a thermal decomposition, which decomposes ozone only by the action of heat. The issue is that at temperatures below 250°C, this sort of breakdown is extremely sluggish. However, by working at greater temperatures, the breakdown rate can be increased, albeit at a considerable energy expense. The second is a photochemical breakdown, which occurs when ozone is exposed to ultraviolet radiation (UV), resulting in the formation of oxygen and radical peroxide.
Uses of Ozone
- Water treatment plants without filtering systems employ ozone.
- Commonly used equipment, such as photocopiers, laser printers, and other electrical devices, can produce ozone.
- Ozone therapy is used to disinfect and treat diseases by minimising the impacts of bacteria, viruses, fungi, yeast, and protozoa.
- Several ozone-depleting chemicals have features that allow them to efficiently transfer heat from one site to another, making them good refrigerants.
What is an Ozone Layer?
The ozone layer, also known as the ozone shield, is a region of the Earth’s stratosphere that absorbs the majority of ultraviolet radiation from the Sun. It has a high concentration of ozone in comparison to the rest of the atmosphere, although it is relatively low in comparison to other gases in the stratosphere. The ozone layer contains fewer than 10ppm of ozone, whereas the average ozone concentration in the Earth’s atmosphere is around 0.3ppm. The ozone layer is primarily located in the lower stratosphere, between 15 and 35 kilometres above Earth, however, its thickness varies seasonally and geographically.
Sample Questions
Question 1: What is ozone?
Answer:
Ozone is a gas that exists naturally in our environment. Each ozone molecule has three oxygen atoms and is designated chemically as O3.
Question 2: Where is ozone found in the atmosphere?
Answer:
Ozone is typically present in two regions of the atmosphere. The troposphere, which stretches from the surface to roughly 10–15 kilometres height, contains around 10% of the Earth’s ozone. The stratosphere, the region of the atmosphere between the top of the troposphere and about 50 kilometres altitude, contains approximately 90 percent of the Earth’s ozone. The “ozone layer” refers to the region of the stratosphere with the highest concentration of ozone.
Question 3: How is ozone formed?
Answer:
Ozone is generated in the atmosphere through multistep chemical processes begun by sunlight. The process begins in the stratosphere with an oxygen molecule being torn apart by UV light from the Sun. Ozone is generated in the troposphere through a separate set of chemical reactions that involve both naturally occurring chemicals and those emitted by sources of air pollution.
Question 4: How is ozone measured in the atmosphere?
Answer:
Instruments on the ground and transported aloft on balloons, aircraft, and satellites measure the amount of ozone in the atmosphere. Some instruments use a continuous air sampler to monitor ozone in a tiny detection chamber. Other technologies use ozone’s distinctive optical absorption or emission qualities to assess ozone across vast distances.
Question 5: What emissions from human activities lead to ozone depletion?
Answer:
Ozone-depleting substances (ODSs) are released into the atmosphere by some industrial operations and consumer items. The Montreal Protocol regulates the use of produced halogen source gases around the world. These gases transport chlorine and bromine atoms to the stratosphere, where chemical processes destroy ozone. Chlorofluorocarbons (CFCs), which were originally utilised in practically all refrigeration and air conditioning systems, and halons, which were used as fire suppressing agents, are two notable examples.
История открытия
Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
Немец Кристиан Фридрих Шенбейн тщательно изучил нераскрытую материю и её свойства. В 1840 году он дал веществу название «озон», что на греческом означает «пахнуть». Такое наименование было связано со специфическим запахом газа. По ошибке многие считают, что именно Шенбейн был первооткрывателем этой материи. Учёный провёл эксперимент, в ходе которого озон вытеснял иод из иодида калия. Эта качественная реакция позволяет определить наличие вещества при помощи иодкрахмальной бумаги, которая приобретает синий оттенок.
В 1860 году было доказано, что при превращении кислорода в озон объём газа уменьшался. Для опытов химики Тэт и Эндрюс использовали стеклянную трубку с манометром, наполненную O2, с впаянными в неё проводниками из платины, которые способствовали получению электрического заряда.
В 1880 году французские учёные Готфейль и Шаппюи смогли получить вещество из кислорода при температуре -23oC. Когда газ медленно сжимался, он постепенно приобретал тёмно-синий оттенок. Затем давление резко сбросили, а температура ещё понизилась, что привело к образованию фиолетовых капель жидкого озона. Если вещество не охлаждали или быстро сжимали, тогда оно переходило в кислород с мгновенной жёлтой вспышкой.
Способы получения
Газ образуется во многих процессах, которые сопровождаются выделением атомарного кислорода. Озон формируется при разложении пероксидов, окислении фосфора и т. д.
В промышленной сфере вещество получают в специальном оборудовании, которое называют озонатор. Через воздух проводят электрическую искру, которая даёт реакцию 3O2→cur2O3. Получившийся газ отделяют фракционной перегонкой.
В лабораторных условиях используют пероксид бария, который обрабатывают концентрированной серной кислотой. В результате реакции получаются сульфат бария и озон.
В медицинских учреждениях, где вещество применяют для оздоровления пациентов, средство получают путём облучения кислорода ультрафиолетом. Именно этим способом газ образуется и в атмосфере нашей планеты под воздействием солнца.
Вещество в атмосфере
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
В последние годы специалисты уделяют много внимания появлению «озоновых дыр». В этих областях наблюдается значительно уменьшенный объём стратосферного вещества. Через такой тонкий газовый слой до Земли доходит жёсткое ультрафиолетовое излучение. Озон могут разрушать пыль, газы и различные естественные факторы.
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Также следует учитывать тот факт, что сегодня люди вдыхают больше озона, чем в далёком прошлом. Это связано с загрязнением воздуха большими объёмами метана и оксидов азота.
Физические особенности
Вещество представляет аллотропную модификацию кислорода, состоящую из трёхатомных молекул. Химическая формула озона и обозначение — O3. При нормальных условиях вещество выглядит как голубой ядовитый газ с резким запахом, напоминающим металлический аромат. При сжижении преобразуется в жидкость оттенка индиго. В твёрдом состоянии выглядит как тёмно-синие или чёрные кристаллы. Полярная молекула отличается уголковым строением. Между атомами имеется две связи О-О.
Основные физические свойства озона:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8oC;
- температура плавления — 197,2oC;
- растворимость в воде при 0о — 0,394 кг/м3.
Плотность озона в газообразном состоянии равна 2,1445 г/дм3, в жидком — 1,59 г/см3, в твёрдом — 1,73 г/см3. Ещё одна важная характеристика вещества — его молекулярная кристаллическая решётка.
O3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Химическая природа
Молекулы озона отличаются неустойчивостью. После образования они существуют около 10−30 минут, а затем начинают разлагаться, образуя кислород и большой объём тепла. Если температура окружающей среды будет высокой, тогда процесс реакции ускорится. Тот же эффект наблюдается и при понижении атмосферного давления.
Среди химических свойств озона следует выделить его высокую реакционную способность. Он окисляет металлы (за исключением платины, золота и иридия), органические вещества, а также повышает степень окисления у оксидов. Действующим началом газа в качестве окислителя выступает атомарный кислород, который образуется при распаде молекулы озона. Однако в некоторых случаях в окислении участвуют все три атома элемента. Озон считается сильным окислителем, хотя уступает в этом плане фтору и фториду кислорода.
Если смешать озон с концентрированным раствором аммиака, получится нитрит аммония с выделением белого дыма. Вещество также способно «чернить» изделия из серебра, образуя AgO и Ag2O3.
Молекула газа становится стабильнее, если она превращается в отрицательный ион О3-. Такие анионы содержатся в озонидах (озонокислых солях). Соединения разлагаются во время хранения или при избытке H2O. Озонокислые соли хорошо растворяются в жидком аммиаке.
Озон разрушает все органические вещества, с которыми он контактирует. При реакции выделяется большое количество энергии. К примеру, такие вещества, как эфир, спирт или метан, самовоспламеняются, когда они соприкасаются с озонированным воздухом. При смешении этилена и озона произойдёт сильный взрыв.
Газ способен уменьшать токсичность некоторых веществ. Например, он может окислить цианиды до цианатов, которые безопаснее для живых организмов.
Области использования
В Российской Федерации озон относится к группе вредных веществ первого класса опасности. Сильные окислительные свойства делают его опасным для здоровья человека. Однако вещество широко используется в разных сферах.
Основные области применения озона:
- стерилизация медицинских инструментов;
- отбеливание бумаги;
- очистка нефтепродуктов и масел;
- лабораторный и промышленный синтез.
Озон применяется для дезинфекции одежды и помещений, озонирования растворов медицинского назначения. Также вещество используется в качестве дезинфицирующего средства при очистке воздуха и воды от вредных микроорганизмов.
Озонирование воды имеет много преимуществ перед хлорированием, поскольку в обработанной жидкости отсутствуют токсины. Кроме того, озон лучше растворяется в воде.
Если верить заявлениям озонотерапевтов, здоровье пациентов значительно улучшается, когда лечение включает пероральное или внутривенное применение вещества. Однако пока нет объективных клинических подтверждений терапевтического эффекта. Сегодня озонотерапию используют только в некоторых частных клиниках развитых стран, где она не считается лечебным методом. Поскольку доказано мутагенное и токсическое действие этого вещества, пациентов лечат озоном только с их согласия и лишь в тяжёлых случаях.
С начала XXI века многие компании начали выпускать бытовые озонаторы. Такие устройства предназначены для дезинфекции помещений. Перед их использованием необходимо прочитать инструкцию по применению техники. Поскольку некоторые фирмы не пишут в аннотациях о мерах безопасности при работе с озонаторами, не рекомендуется приобретать их продукцию.
Влияние на здоровье человека
Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Опасный газ может образовывать с кислородом другое опасное вещество — пероксиацетилнитрат. Органическое соединение затрудняет дыхание и вызывает слезоточивость. Высокие концентрации этого вещества могут привести к параличу сердца.
Занимательные факты
Озон вызывает большой интерес не только у учёных, но и у обычных людей. Хотя это вещество ещё не полностью изучено, о нём уже имеется немало занимательной информации:
- Озон эффективно уничтожает бактерии и плесень.
- В малых концентрациях запах вещества может напоминать хлор, сернистый газ или даже чеснок.
- Озон образуется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- Он применяется в стоматологии вместо антибиотиков.
- Для очистки воды вещество начали использовать в 1898 году во Франции.
- Во время Первой мировой войны его применяли в качестве антисептического средства.
- Самая большая озоновая дыра была обнаружена над Антарктидой в 1985 году. Это явление отличается диаметром свыше 1000 км.
- Молнии Кататумбо считаются крупнейшим одиночным генератором озона в тропосфере нашей планеты.
Вещество продолжают изучать не только из-за озоновых дыр, которые могут повлиять на будущее людей и всех других живых организмов. Хотя озон опасен, учёные считают, что он способен заменить многие лечебные средства при борьбе с тяжёлыми заболеваниями.