Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Натрия хлорид
- Брутто формула
- Фармакологическая группа вещества Натрия хлорид
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Натрия хлорид
- Противопоказания
- Ограничения к применению
- Побочные действия вещества Натрия хлорид
- Передозировка
- Способ применения и дозы
- Торговые названия с действующим веществом Натрия хлорид
Структурная формула
Русское название
Натрия хлорид
Английское название
Sodium chloride
Латинское название вещества Натрия хлорид
Natrii chloridum (род. Natrii chloridi)
Фармакологическая группа вещества Натрия хлорид
Нозологическая классификация
Список кодов МКБ-10
- K92.2 Желудочно-кишечное кровотечение неуточненное
- K52.1 Токсический гастроэнтерит и колит
- T79.3 Посттравматическая раневая инфекция, не классифицированная в других рубриках
- K30 Диспепсия
- E87.1 Гипоосмолярность и гипонатриемия
- E86 Уменьшение объема жидкости [гиповолемия]
- T30 Термические и химические ожоги неуточненной локализации
- R58 Кровотечение, не классифицированное в других рубриках
- T57.8 Других уточненных неорганических веществ
- A00.9 Холера неуточненная
- K56.6 Другая и неуточненная кишечная непроходимость
- R11 Тошнота и рвота
- Z100* КЛАСС XXII Хирургическая практика
Фармакологическое действие
—
гидратирующее, дезинтоксикационное, нормализующее КЩС, плазмозамещающее.
Характеристика
Белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Легко растворим в воде (1:3), мало растворим в этаноле.
Фармакология
Натрия хлорид поддерживает соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. При снижении концентрации натрия хлорида в плазме крови вода переходит из сосудистого русла в межтканевую жидкость, при значительном дефиците возникают спазмы гладких мышц и судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем.
Раствор натрия хлорида 0,9% изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости. Гипертонические растворы (3–5–10%) применяются в/в и наружно. При наружной аппликации они способствуют выделению гноя, проявляют противомикробную активность, при в/в введении — усиливают диурез и восполняют дефицит ионов натрия и хлора.
Применение вещества Натрия хлорид
Раствор 0,9% — большие потери внеклеточной жидкости (в т.ч. токсическая диспепсия, холера, диарея, неукротимая рвота, обширные ожоги с сильной экссудацией), гипохлоремия и гипонатриемия с обезвоживанием, кишечная непроходимость, в качестве дезинтоксикационного средства; промывание ран, глаз, полости носа, для растворения и разведения различных лекарственных веществ и увлажнения перевязочного материала.
Гипертонический раствор — легочное, желудочное и кишечное кровотечение, в качестве вспомогательного осмотического диуретика при проведении форсированного диуреза, обезвоживание, отравление нитратом серебра, для обработки гнойных ран (местно), запор (ректально).
Противопоказания
Гипернатриемия, ацидоз, гиперхлоремия, гипокалиемия, внеклеточная гипергидратация; циркуляторные нарушения, угрожающие отеком мозга и легких; отек мозга, отек легких, острая левожелудочковая недостаточность, сопутствующая терапия ГК в больших дозах.
Ограничения к применению
Нарушение функции почек, сердечная недостаточность, артериальная гипертензия, периферические отеки, токсикоз беременных (для больших объемов изотонического раствора).
Побочные действия вещества Натрия хлорид
Ацидоз, гипергидратация, гипокалиемия.
Передозировка
Случаи передозировки не описаны.
Способ применения и дозы
Изотонический раствор — в/в, п/к, в клизмах, местно. Перед введением раствор нагревают до 36–38 °C. Доза определяется в зависимости от потери организмом жидкости, в среднем составляет 1 л/сут; при дегидратации и интоксикациях — до 3 л/сут. Скорость введения — 540 мл/ч; при необходимости — больше. 0,9% раствор натрия хлорида применяют для промывания ран, глаз, слизистой оболочки полости носа, увлажнения перевязочного материала.
Гипертонические растворы: 10% раствор — в/в (до 20 мл); 2–5% раствор — для промывания желудка; 5% раствор — в клизмах (100 мл) для стимуляции дефекации при запорах (либо до 3 л/сут 0,9% раствора); местно — для обработки гнойных ран.
Торговые названия с действующим веществом Натрия хлорид
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Аква-Риносоль |
от 63.00 до 63.00 |
| АкваМастер® |
от 186.00 до 327.00 |
| ЛинАква беби Средство для промывания и орошения полости носа для детей и взрослых |
от 209.00 до 418.00 |
| ЛинАква норм Средство для промывания и орошения полости носа для детей и взрослых |
от 418.00 до 418.00 |
| ЛинАква софт Средство для промывания и орошения полости носа для детей и взрослых |
от 451.00 до 451.00 |
| ЛинАква форте Средство для промывания и орошения полости носа для детей и взрослых |
от 398.00 до 418.00 |
| ЛинАква форте Средство для промывания и орошения полости рта и горла для детей и взрослых |
от 434.00 до 456.00 |
| Натрия хлорид |
от 43.10 до 706.00 |
| Натрия хлорид Браун |
от 495.40 до 605.00 |
| Натрия хлорид буфус |
от 71.80 до 144.00 |
| Натрия хлорид-СОЛОфарм |
от 57.00 до 1445.00 |
Морфемный разбор слова:
Однокоренные слова к слову:
Хлористый натрий
Хлористый натрий
| Хлорид натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | хлорид натрия / Sodium chloride |
| Химическая формула | NaCl |
| Молярная масса | 58.44277 г/моль |
| Физические свойства | |
| Плотность вещества | 2.165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Химические свойства | |
| Растворимость в воде | 35.9 г/100 мл |
| Классификация | |
| номер CAS | [7647-14-5] |
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов.
Кристаллическая структура
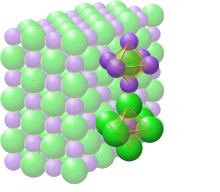
Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль K) |
| S 0 l, 1 bar | 95,06 Дж/(моль K) |
| S 0 s | 72,11 Дж/(моль•K) |
Диэлектрическая проницаемость NaCl — 6,3
См. также
Полезное
Смотреть что такое «Хлористый натрий» в других словарях:
ХЛОРИСТЫЙ НАТРИЙ — Поваренная соль. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ХЛОРИСТЫЙ НАТРИЙ То же, что поваренная соль. Словарь иностранных слов, вошедших в состав русского языка.… … Словарь иностранных слов русского языка
ХЛОРИСТЫЙ НАТРИЙ — (ХН) – кристаллический порошок белого цвета, растворимый в воде; должен храниться в условиях исключающих увлажнение. [Изотов В.С. Химические добавки для модификации бетона: монография / В.С. Изотов, Ю.А. Соколова. М.: Казанский Государственный… … Энциклопедия терминов, определений и пояснений строительных материалов
Хлористый натрий — см. Соль поваренная, Каменная соль и Натрий … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлористый натрий — хлорид натрия … Cловарь химических синонимов I
НАТРИЙ — НАТРИЙ. Natrium, химич. элемент, симв. Na, серебристобелый, блестящий, при обыкновенной t° восковой плотности одноатомный металл, делающийся хрупким на холоду и при ярко краснокалильном жаре перегоняющийся; открыт Де.ви (1807) электролизом… … Большая медицинская энциклопедия
хлористый — прилагательное от слова хлор; хлористый этил – жидкость, получаемая из винного спирта и соляной кислоты; ввиду её быстрой испаряемости ею пользуются в медицине для местной анестезии; хлористый кальций – вещество, получаемое при растворении… … Словарь иностранных слов русского языка
ХЛОРИСТЫЙ — ХЛОРИСТЫЙ, хлористая, хлористое (хим.). Находящийся в соединении с хлором, содержащий в себе хлор. Хлористый кальций. Хлористый натрий. Хлористый водород. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
НАТРИЙ — (греч. nitron, лат. natrum). Металл белого цвета, составляющий часть поваренной соли, соды, селитры и др. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. НАТРИЙ белый блестящий мягкий металл, быстро окисляющийся в… … Словарь иностранных слов русского языка
НАТРИЙ — щелочный металл белого цвета, блестящий, быстро тускнеющий на воздухе; при соединении с водой образует едкий натр, энергично выделяя водород. Физические свойства Н.: уд. вес 0,97, темп pa плавления 97,7°. Чистый Н. хранится только в керосине. В… … Технический железнодорожный словарь
Натрий* — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Источник
Хлорид натрия: способы получения и химические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Источник
Хлорид натрия
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Содержание
Нахождение в природе и производство
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п. [4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д. [4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды [4] :
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
Залежи
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы [6] :
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Добыча соли в южной части Мертвого моря, Израиль
Кристаллы каменной соли
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
CaR2 + 2NаСl = 2NаR + CaСl2. МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах [13] [14] :
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO [14] :
2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия [14] [16] :
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль·K) |
| S 0 l, 1 bar | 95,06 Дж/(моль·K) |
| S 0 s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
Структура
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
Источник
Хлорид натрия
Характеристики и физические свойства хлорида натрия
Плавится и кипит без разложения. Умеренно растворяется в воде (не гидролизуется), растворимость не зависит от температуры, но сильно снижается в присутствии HCl, NaOH, хлоридов металла.
Рис. 1. Хлорид натрия. Внешний вид.
Основные характеристики хлорида натрия приведены в таблице ниже:
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Растворимость в воде (25 o С), г/100 мл
Получение хлорида натрия
Хлорид натрия в виде минерала галита образует залежи каменной соли среди пластов горных и осадочных пород, поэтому необходимости его получения в промышленных или лабораторных масштабах нет. Однако, иногда он образуется в качестве побочного продукта, например, в таких реакциях, как:
— взаимодействие натрия с хлором
— реакция нейтрализации между соляной кислотой и гидроксидом натрия
HCl + NaOH = NaCl + H2O.
Химические свойства хлорида натрия
В водном растворе хлорид натрия диссоциирует на ионы:
Хлорид натрия способен вступать в реакции обмена с кислотами (1) и другими солями (2, 3):
В окислительно-восстановительных реакциях хлорид натрия проявляет свойства слабого восстановителя:
При пропускании через насыщенный раствор хлорида натрия смесь газов, состоящую из аммиака и диоксида углерода можно получить гидрокарбонат натрия (выпадает в осадок):
Расплав и раствор хлорида натрия подвергаются электролизу:
Применение хлорида натрия
Хлорид натрия (поваренная соль) служит сырьем для получения хлора, соляной кислоты, едкого натра и карбоната натрия (соды), применяется в красильном деле, в мыловарении и во многих других производствах. Он служит также приправой к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 г натрия? |
| Решение | Запишем уравнение реакции взаимодействия хлора с натрием: |
Рассчитаем количество вещества натрия, вступившего в реакцию:
n (Na)= 10 / 23 = 0,43 моль.
Согласно уравнению, n (Na) :n(Cl2) = 2 : 1, значит,
n (Cl2) = ½ n (Na) = ½ ×0,43 = 0,215моль.
Тогда, объем хлора, вступившего в реакцию взаимодействия с натрием равен:
V (Cl2) = 0,215 × 22,4 = 4,816л.
Ответ Объем хлора равен 4,816 л
| Задание | К 200-м граммам 5%-го раствора хлорида натрия добавили 15 г этой же соли и столько же граммов воды. Чему стала равна массовая доля хлорида натрия в получившемся растворе? |
| Решение | Решение задачи следует начать с записи формулы для вычисления массовой доли растворенного вещества: |
Найдем массу растворенного вещества хлорида натрия в изначальном растворе:
msolute (NaCl) = ω (NaCl) / 100% ×msolution;
msolute (NaCl) = 5 / 100% × 200 = 10 г.
Рассчитаем массу нового раствора:
msolution(new) = 200 + 15 + 15 = 230 г.
Найдем общую массу растворенного хлорида натрия и его массовую долю в новом растворе:
m(NaCl)sum = 10 + 15 = 25г.
ω (NaCl)new= 25 / 230 × 100% = 11%.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется натрий хлор в химии, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется натрий хлор в химии», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
НАТРИЯ ХЛОРИД
- НАТРИЯ ХЛОРИД
-
поваренная соль, NaCl — бесцветные кристаллы, плотн. 2161 кг/м3, tпл 801 °С, растворимость в воде 26,43% (при 25 °С). В природе Н. х. широко распространён в виде минерала галита(каменная соль); содержится в мор. воде, рапе соляных озёр. Н. х. — важнейший пищ. продукт; служит также для консервирования мяса, рыбы и др. продуктов. Используется для получения гидроксида натрия, хлора, соды, сульфата натрия.
Большой энциклопедический политехнический словарь.
2004.
Смотреть что такое «НАТРИЯ ХЛОРИД» в других словарях:
-
Натрия хлорид — Хлорид натрия Общие Систематическое наименование хлорид натрия / Sodium chloride Химическая формула NaCl Молярная масса 58.44277 г/м … Википедия
-
НАТРИЯ ХЛОРИД — Natrii chloridum. Синонимы: хлористый натрий, поваренная соль. Свойства. Белые кубические кристаллы или белый кристаллический порошок, без запаха, соленого вкуса, растворим в трех частях воды (растворимость при 20°С 36,0; при 100°С 39,1), слабо … Отечественные ветеринарные препараты
-
Натрия хлорид — Действующее вещество ›› Натрия хлорид (Sodium chloride) Латинское название Sodium chloride АТХ: ›› B05CB01 Натрия хлорид Фармакологические группы: Регуляторы водно электролитного баланса и КЩС ›› Вспомогательные вещества, реактивы и полупродукты… … Словарь медицинских препаратов
-
НАТРИЯ ХЛОРИД — (поваренная соль) NaCl, бесцветные кристаллы. Растворяется в воде. В природе натрия хлорид широко распространен в виде каменной соли (галита), содержится в морской воде. Важная пищевая приправа; идет на получение едкого натра, хлора, соды … Большой Энциклопедический словарь
-
НАТРИЯ ХЛОРИД — (хлористый натрий, поваренная соль) NaCl минерал галит, природное осадочное образование, широко распространённое на всём земном шаре и представляющее собой бесцветные кристаллы; плотность 2161 кг/м3, t = 801 °С, вкус солёный. H. X. важный пищевой … Большая политехническая энциклопедия
-
натрия хлорид — (поваренная соль), NaCl, бесцветные кристаллы. Растворяется в воде. В природе натрия хлорид широко распространён в виде каменной соли (галита), содержится в морской воде. Важная пищевая приправа; идёт на получение едкого натра, хлора, соды. * * * … Энциклопедический словарь
-
Натрия хлорид — Кристаллы хлорида натрия. НАТРИЯ ХЛОРИД (поваренная соль), NaCl, кристаллы, tпл 801°C. В природе распространен в виде минерала (каменная соль, галит), содержится в морской воде, рапе соляных озер и подземных рассолах. Хлорид натрия – пищевой… … Иллюстрированный энциклопедический словарь
-
натрия хлорид — natrio chloridas statusas T sritis chemija formulė NaCl atitikmenys: angl. common salt; sodium chloride; table salt rus. натрий хлористый; натрия хлорид; пищевая соль; поваренная соль ryšiai: sinonimas – valgomoji druska … Chemijos terminų aiškinamasis žodynas
-
Натрия хлорид Биеффе — Действующее вещество ›› Натрия хлорид (Sodium chloride) Латинское название Sodium chloride Bieffe АТХ: ›› B05CB01 Натрия хлорид Фармакологическая группа: Регуляторы водно электролитного баланса и КЩС Состав и форма выпуска 1000 мл раствора для… … Словарь медицинских препаратов
-
НАТРИЯ ХЛОРИД — (sodium chloride) обычная поваренная соль: натриевая соль, которая присутствует во всех тканях и необходима для поддержания в организме нормального электролитного баланса. Внутривенное введение хлорида натрия является основой инфузионной… … Толковый словарь по медицине
This article is about the chemical. For its familiar form, common table salt, see Salt. For the medical solutions, see Saline (medicine). For the mineral, see Halite.

Sodium chloride crystals in a form of halite |
|

Crystal structure with sodium in purple and chloride in green[1] |
|
| Names | |
|---|---|
| IUPAC name
Sodium chloride |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3534976 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.726 |
| EC Number |
|
|
Gmelin Reference |
13673 |
| KEGG |
|
| MeSH | Sodium+chloride |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaCl |
| Molar mass | 58.443 g/mol[2] |
| Appearance | Colorless cubic crystals[2] |
| Odor | Odorless |
| Density | 2.17 g/cm3[2] |
| Melting point | 800.7 °C (1,473.3 °F; 1,073.8 K)[2] |
| Boiling point | 1,465 °C (2,669 °F; 1,738 K)[2] |
|
Solubility in water |
360 g/1000 g pure water at T = 25 °C[2] |
| Solubility in ammonia | 21.5 g/L at T = ?[clarification needed] |
| Solubility in methanol | 14.9 g/L at T = ?[clarification needed] |
|
Magnetic susceptibility (χ) |
−30.2·10−6 cm3/mol[3] |
|
Refractive index (nD) |
1.5441 (at 589 nm)[4] |
| Structure[5] | |
|
Crystal structure |
Face-centered cubic (see text), cF8 |
|
Space group |
Fm3m (No. 225) |
|
Lattice constant |
a = 564.02 pm |
|
Formula units (Z) |
4 |
|
Coordination geometry |
octahedral at Na+ octahedral at Cl− |
| Thermochemistry[6] | |
|
Heat capacity (C) |
50.5 J/(K·mol) |
|
Std molar |
72.10 J/(K·mol) |
|
Std enthalpy of |
−411.120 kJ/mol |
| Pharmacology | |
|
ATC code |
A12CA01 (WHO) B05CB01 (WHO), B05XA03 (WHO), S01XA03 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
0 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3 g/kg (oral, rats)[7] |
| Related compounds | |
|
Other anions |
Sodium fluoride Sodium bromide Sodium iodide Sodium astatide |
|
Other cations |
Lithium chloride Potassium chloride Rubidium chloride Caesium chloride Francium chloride |
| Supplementary data page | |
| Sodium chloride (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium chloride ,[8] commonly known as salt (although sea salt also contains other chemical salts), is an ionic compound with the chemical formula NaCl, representing a 1:1 ratio of sodium and chloride ions. With molar masses of 22.99 and 35.45 g/mol respectively, 100 g of NaCl contains 39.34 g Na and 60.66 g Cl. Sodium chloride is the salt most responsible for the salinity of seawater and of the extracellular fluid of many multicellular organisms. In its edible form, salt (also known as table salt) is commonly used as a condiment and food preservative. Large quantities of sodium chloride are used in many industrial processes, and it is a major source of sodium and chlorine compounds used as feedstocks for further chemical syntheses. Another major application of sodium chloride is de-icing of roadways in sub-freezing weather.
Uses[edit]
In addition to the familiar domestic uses of salt, more dominant applications of the approximately 250 million tonnes per year production (2008 data) include chemicals and de-icing.[9]
Chemical functions[edit]
Salt is used, directly or indirectly, in the production of many chemicals, which consume most of the world’s production.[10]
Chlor-alkali industry[edit]
It is the starting point for the chloralkali process, the industrial process to produce chlorine and sodium hydroxide, according to the chemical equation
This electrolysis is conducted in either a mercury cell, a diaphragm cell, or a membrane cell. Each of those uses a different method to separate the chlorine from the sodium hydroxide. Other technologies are under development due to the high energy consumption of the electrolysis, whereby small improvements in the efficiency can have large economic paybacks. Some applications of chlorine include PVC thermoplastics production, disinfectants, and solvents.
Sodium hydroxide is extensively used in many different industries enabling production of paper, soap, and aluminium etc.
Soda-ash industry[edit]
Sodium chloride is used in the Solvay process to produce sodium carbonate and calcium chloride. Sodium carbonate, in turn, is used to produce glass, sodium bicarbonate, and dyes, as well as a myriad of other chemicals. In the Mannheim process, sodium chloride is used for the production of sodium sulfate and hydrochloric acid.
Standard[edit]
Sodium chloride has an international standard that is created by ASTM International. The standard is named ASTM E534-13 and is the standard test methods for chemical analysis of sodium chloride. These methods listed provide procedures for analyzing sodium chloride to determine whether it is suitable for its intended use and application.
Miscellaneous industrial uses[edit]
Sodium chloride is heavily used, so even relatively minor applications can consume massive quantities. In oil and gas exploration, salt is an important component of drilling fluids in well drilling. It is used to flocculate and increase the density of the drilling fluid to overcome high downwell gas pressures. Whenever a drill hits a salt formation, salt is added to the drilling fluid to saturate the solution in order to minimize the dissolution within the salt stratum.[9] Salt is also used to increase the curing of concrete in cemented casings.[10]
In textiles and dyeing, salt is used as a brine rinse to separate organic contaminants, to promote «salting out» of dyestuff precipitates, and to blend with concentrated dyes to standardize[clarification needed] them. One of its main roles is to provide the positive ion charge to promote the absorption of negatively charged ions of dyes.[10]
It is also used in processing aluminium, beryllium, copper, steel and vanadium. In the pulp and paper industry, salt is used to bleach wood pulp. It also is used to make sodium chlorate, which is added along with sulfuric acid and water to manufacture chlorine dioxide, an excellent oxygen-based bleaching chemical. The chlorine dioxide process, which originated in Germany after World War I, is becoming more popular because of environmental pressures to reduce or eliminate chlorinated bleaching compounds. In tanning and leather treatment, salt is added to animal hides to inhibit microbial activity on the underside of the hides and to attract moisture back into the hides.[10]
In rubber manufacture, salt is used to make buna, neoprene and white rubber types. Salt brine and sulfuric acid are used to coagulate an emulsified latex made from chlorinated butadiene.[10][9]
Salt also is added to secure the soil and to provide firmness to the foundation on which highways are built. The salt acts to minimize the effects of shifting caused in the subsurface by changes in humidity and traffic load.[10]
Sodium chloride is sometimes used as a cheap and safe desiccant because of its hygroscopic properties, making salting an effective method of food preservation historically; the salt draws water out of bacteria through osmotic pressure, keeping it from reproducing, a major source of food spoilage. Even though more effective desiccants are available, few are safe for humans to ingest.
Water softening[edit]
Hard water contains calcium and magnesium ions that interfere with action of soap and contribute to the buildup of a scale or film of alkaline mineral deposits in household and industrial equipment and pipes. Commercial and residential water-softening units use ion-exchange resins to remove ions that cause the hardness. These resins are generated and regenerated using sodium chloride.[10][9]
Road salt[edit]
Phase diagram of water–NaCl mixture
The second major application of salt is for de-icing and anti-icing of roads, both in grit bins and spread by winter service vehicles. In anticipation of snowfall, roads are optimally «anti-iced» with brine (concentrated solution of salt in water), which prevents bonding between the snow-ice and the road surface. This procedure obviates the heavy use of salt after the snowfall. For de-icing, mixtures of brine and salt are used, sometimes with additional agents such as calcium chloride and/or magnesium chloride. The use of salt or brine becomes ineffective below −10 °C (14 °F).
Mounds of road salt for use in winter
Salt for de-icing in the United Kingdom predominantly comes from a single mine in Winsford in Cheshire. Prior to distribution it is mixed with <100 ppm of sodium ferrocyanide as an anti-caking agent, which enables rock salt to flow freely out of the gritting vehicles despite being stockpiled prior to use. In recent years this additive has also been used in table salt. Other additives had been used in road salt to reduce the total costs. For example, in the US, a byproduct carbohydrate solution from sugar-beet processing was mixed with rock salt and adhered to road surfaces about 40% better than loose rock salt alone. Because it stayed on the road longer, the treatment did not have to be repeated several times, saving time and money.[10]
In the technical terms of physical chemistry, the minimum freezing point of a water-salt mixture is −21.12 °C (−6.02 °F) for 23.31 wt% of salt. Freezing near this concentration is however so slow that the eutectic point of −22.4 °C (−8.3 °F) can be reached with about 25 wt% of salt.[11]
Environmental effects[edit]
Road salt ends up in fresh-water bodies and could harm aquatic plants and animals by disrupting their osmoregulation ability.[12] The omnipresence of salt poses a problem in any coastal coating application, as trapped salts cause great problems in adhesion. Naval authorities and ship builders monitor the salt concentrations on surfaces during construction. Maximal salt concentrations on surfaces are dependent on the authority and application. The IMO regulation is mostly used and sets salt levels to a maximum of 50 mg/m2 soluble salts measured as sodium chloride. These measurements are done by means of a Bresle test. Salinization (increasing salinity, aka freshwater salinization syndrome) and subsequent increased metal leaching is an ongoing problem throughout North America and European fresh waterways.[13]
In highway de-icing, salt has been associated with corrosion of bridge decks, motor vehicles, reinforcement bar and wire, and unprotected steel structures used in road construction. Surface runoff, vehicle spraying, and windblown actions also affect soil, roadside vegetation, and local surface water and groundwater supplies. Although evidence of environmental loading of salt has been found during peak usage, the spring rains and thaws usually dilute the concentrations of sodium in the area where salt was applied.[10] A 2009 study found that approximately 70% of the road salt being applied in the Minneapolis-St Paul metro area is retained in the local watershed.[14]
Substitution[edit]
Some agencies are substituting beer, molasses, and beet juice instead of road salt.[15] Airlines utilize more glycol and sugar rather than salt based solutions for de-icing.[16]
Food industry and agriculture[edit]
Main article: Salt
Many microorganisms cannot live in a salty environment: water is drawn out of their cells by osmosis. For this reason salt is used to preserve some foods, such as bacon, fish, or cabbage.
Salt is added to food, either by the food producer or by the consumer, as a flavor enhancer, preservative, binder, fermentation-control additive, texture-control agent and color developer. The salt consumption in the food industry is subdivided, in descending order of consumption, into other food processing, meat packers, canning, baking, dairy and grain mill products. Salt is added to promote color development in bacon, ham and other processed meat products. As a preservative, salt inhibits the growth of bacteria. Salt acts as a binder in sausages to form a binding gel made up of meat, fat, and moisture. Salt also acts as a flavor enhancer and as a tenderizer.[10]
In many dairy industries, salt is added to cheese as a color-, fermentation-, and texture-control agent. The dairy subsector includes companies that manufacture creamery butter, condensed and evaporated milk, frozen desserts, ice cream, natural and processed cheese, and specialty dairy products. In canning, salt is primarily added as a flavor enhancer and preservative. It also is used as a carrier for other ingredients, dehydrating agent, enzyme inhibitor and tenderizer. In baking, salt is added to control the rate of fermentation in bread dough. It also is used to strengthen the gluten (the elastic protein-water complex in certain doughs) and as a flavor enhancer, such as a topping on baked goods. The food-processing category also contains grain mill products. These products consist of milling flour and rice and manufacturing cereal breakfast food and blended or prepared flour. Salt is also used a seasoning agent, e.g. in potato chips, pretzels, cat and dog food.[10]
Sodium chloride is used in veterinary medicine as emesis-causing agent. It is given as warm saturated solution. Emesis can also be caused by pharyngeal placement of small amount of plain salt or salt crystals.
Medicine[edit]
Sodium chloride is used together with water as one of the primary solutions for intravenous therapy. Nasal spray often contains a saline solution.
Firefighting[edit]
A class-D fire extinguisher for various metals
Sodium chloride is the principal extinguishing agent in fire extinguishers (Met-L-X, Super D) used on combustible metal fires such as magnesium, potassium, sodium, and NaK alloys (Class D). Thermoplastic powder is added to the mixture, along with waterproofing (metal stearates) and anti-caking materials (tricalcium phosphate) to form the extinguishing agent. When it is applied to the fire, the salt acts like a heat sink, dissipating heat from the fire, and also forms an oxygen-excluding crust to smother the fire. The plastic additive melts and helps the crust maintain its integrity until the burning metal cools below its ignition temperature. This type of extinguisher was invented in the late 1940s as a cartridge-operated unit, although stored pressure versions are now popular. Common sizes are 30 pounds (14 kg) portable and 350 pounds (160 kg) wheeled.[citation needed]
Cleanser[edit]
Since at least medieval times, people have used salt as a cleansing agent rubbed on household surfaces. It is also used in many brands of shampoo, toothpaste and popularly to de-ice driveways and patches of ice.
Optical usage[edit]
Defect-free NaCl crystals have an optical transmittance of about 90% for infrared light, specifically between 200 nm and 20 µm. They were therefore used in optical components (windows and prisms) operating in that spectral range, where few non-absorbing alternatives exist and where requirements for absence of microscopic inhomogeneities are less strict than in the visible range. While inexpensive, NaCl crystals are soft and hygroscopic – when exposed to the ambient air, they gradually cover with «frost». This limits application of NaCl to dry environments, vacuum sealed assembly areas or for short-term uses such as prototyping. Nowadays materials like zinc selenide (ZnSe), which are stronger mechanically and are less sensitive to moisture, are used instead of NaCl for the infrared spectral range.
Chemistry[edit]
Solid sodium chloride[edit]
Sodium chloride crystal under microscope.
NaCl octahedra. The yellow stipples represent the electrostatic force between the ions of opposite charge
In solid sodium chloride, each ion is surrounded by six ions of the opposite charge as expected on electrostatic grounds. The surrounding ions are located at the vertices of a regular octahedron. In the language of close-packing, the larger chloride ions (167 pm in size[17]) are arranged in a cubic array whereas the smaller sodium ions (116 pm[17]) fill all the cubic gaps (octahedral voids) between them. This same basic structure is found in many other compounds and is commonly known as the halite or rock-salt crystal structure. It can be represented as a face-centered cubic (fcc) lattice with a two-atom basis or as two interpenetrating face centered cubic lattices. The first atom is located at each lattice point, and the second atom is located halfway between lattice points along the fcc unit cell edge.
Solid sodium chloride has a melting point of 801 °C. Thermal conductivity of sodium chloride as a function of temperature has a maximum of 2.03 W/(cm K) at 8 K (−265.15 °C; −445.27 °F) and decreases to 0.069 at 314 K (41 °C; 106 °F). It also decreases with doping.[18]
Atomic-resolution real-time video imaging allows visualization of the initial stage of crystal nucleation of sodium chloride.[19]
Aqueous solutions[edit]
| Solubility of NaCl (g NaCl / 1 kg of solvent at 25 °C (77 °F))[20] |
|
|---|---|
| Water | 360 |
| Formamide | 94 |
| Glycerin | 83 |
| Propylene glycol | 71 |
| Formic acid | 52 |
| Liquid ammonia | 30.2 |
| Methanol | 14 |
| Ethanol | 0.65 |
| Dimethylformamide | 0.4 |
| Propan-1-ol | 0.124 |
| Sulfolane | 0.05 |
| Butan-1-ol | 0.05 |
| Propan-2-ol | 0.03 |
| Pentan-1-ol | 0.018 |
| Acetonitrile | 0.003 |
| Acetone | 0.00042 |
The attraction between the Na+ and Cl− ions in the solid is so strong that only highly polar solvents like water dissolve NaCl well.
View of one slab of NaCl(H2O)2 (red = O, white = H, green = Cl, purple = Na).[21]
When dissolved in water, the sodium chloride framework disintegrates as the Na+ and Cl− ions become surrounded by polar water molecules. These solutions consist of metal aquo complex with the formula [Na(H2O)8]+, with the Na–O distance of 250 pm. The chloride ions are also strongly solvated, each being surrounded by an average of six molecules of water.[22] Solutions of sodium chloride have very different properties from pure water. The eutectic point is −21.12 °C (−6.02 °F) for 23.31% mass fraction of salt, and the boiling point of saturated salt solution is near 108.7 °C (227.7 °F).[11] From cold solutions, salt crystallises as the dihydrate NaCl·2H2O.[23] In 2023, it was discovered that under pressure, sodium chloride can form the hydrates NaCl·8.5H2O and NaCl·13H2O.[24]
pH of sodium chloride solutions[edit]
The pH of a sodium chloride solution remains ≈7 due to the extremely weak basicity of the Cl− ion, which is the conjugate base of the strong acid HCl. In other words, NaCl has no effect on system pH[25] in diluted solutions where the effects of ionic strength and activity coefficients are negligible.
Stoichiometric and structure variants[edit]
Common salt has a 1:1 molar ratio of sodium and chlorine. In 2013, compounds of sodium and chloride of different stoichiometries have been discovered; five new compounds were predicted (e.g., Na3Cl, Na2Cl, Na3Cl2, NaCl3, and NaCl7). The existence of some of them has been experimentally confirmed at high pressures and other conditions: cubic and orthorhombic NaCl3, two-dimensional metallic tetragonal Na3Cl and exotic hexagonal NaCl.[26] This indicates that compounds violating chemical intuition are possible, in simple systems under nonambient conditions.[27]
Occurrence[edit]
Most of the world’s salt is dissolved in the ocean[citation needed]. A lesser amount is found in the Earth’s crust as the water-soluble mineral halite (rock salt), and a tiny amount exists as suspended sea salt particles in the atmosphere[citation needed]. These particles are the dominant cloud condensation nuclei far out at sea, which allow the formation of clouds in otherwise non-polluted air.[28]
Production[edit]
Salt is currently mass-produced by evaporation of seawater or brine from brine wells and salt lakes. Mining of rock salt is also a major source. China is the world’s main supplier of salt.[10] In 2017, world production was estimated at 280 million tonnes, the top five producers (in million tonnes) being China (68.0), United States (43.0), India (26.0), Germany (13.0), and Canada (13.0).[29] Salt is also a byproduct of potassium mining.
See also[edit]
- Biosalinity
- Edible salt (table salt)
- Halite, the mineral form of sodium chloride
- Health effects of salt
- Salinity
- Salting the earth
- Salt poisoning
References[edit]
- ^ «Sodium Chloride (NaCl) Crystal». PhysicsOpenLab. Retrieved 23 August 2021.
- ^ a b c d e f Haynes, 4.89
- ^ Haynes, 4.135
- ^ Haynes, 10.241
- ^ Haynes, 4.148
- ^ Haynes, 5.8
- ^ Sodium chloride. nlm.nih.gov.
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, pp. 143 and 755, ISBN 9781405881180
- ^ a b c d Westphal, Gisbert et al. (2002) «Sodium Chloride» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
- ^ a b c d e f g h i j k l Kostick, Dennis S. (October 2010) «Salt» in U.S. Geological Survey, 2008 Minerals Yearbook
- ^ a b Elvers, B. et al. (ed.) (1991) Ullmann’s Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, ISBN 978-3-527-20124-2.
- ^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? slate.com.
- ^ «Saltier waterways are creating dangerous ‘chemical cocktails’«. phys.org.
- ^ «Most Road Salt Is Making It into Lakes And Rivers». www.sciencedaily.com. University of Minnesota. 20 February 2009. Retrieved 27 September 2015.
- ^ Casey, Michael. «Turning to beet juice and beer to address road salt danger». phys.org.
- ^ «EASA Cautions on Organic Salt Deicing Fluid». MRO Network. 9 December 2016.
- ^ a b R. D. Shannon (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. (2001). Alkali halides: a handbook of physical properties. Springer. pp. 65, 68. ISBN 978-3-540-42180-1.
- ^ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021). «Capturing the Moment of Emergence of Crystal Nucleus from Disorder». Journal of the American Chemical Society. 143 (4): 1763–1767. doi:10.1021/jacs.0c12100. PMID 33475359.
- ^ Burgess, J (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 978-0-85312-027-8.
- ^ Klewe, B; Pedersen (1974). «The crystal structure of sodium chloride dihydrate». Acta Crystallogr. B30 (10): 2363–2371. doi:10.1107/S0567740874007138.
- ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) «Metal Aqua Ions» Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0.
- ^ Water-NaCl phase diagram. Lide, CRC Handbook of Chemistry and Physics, 86 ed (2005-2006), CRC pages 8-71, 8-116
- ^ University of Washington. «Newly discovered form of salty ice could exist on surface of extraterrestrial moons». Phys.org.
- ^ «Acidic, Basic, and Neutral Salts». Flinn Scientific Chem Fax. 2016. Retrieved 18 September 2018.
Neutralization of a strong acid and a strong base gives a neutral salt.
- ^ Tikhomirova, K. A.; Tantardini, C.; Sukhanova, E. V.; Popov, Z. I.; Evlashin, S. A.; Tarkhov, M. A.; Zhdanov, V. L. (2020). «Exotic Two-Dimensional Structure: The first case of Hexagonal NaCl». The Journal of Physical Chemistry Letters. 11 (10): 3821–3827. doi:10.1021/acs.jpclett.0c00874. PMID 32330050. S2CID 216130640.
- ^ Zhang, W.; Oganov, A. R.; Goncharov, A. F.; Zhu, Q.; Boulfelfel, S. E.; Lyakhov, A. O.; Stavrou, E.; Somayazulu, M.; Prakapenka, V. B.; Konôpková, Z. (2013). «Unexpected Stable Stoichiometries of Sodium Chlorides». Science. 342 (6165): 1502–1505. arXiv:1310.7674. Bibcode:2013Sci…342.1502Z. doi:10.1126/science.1244989. PMID 24357316. S2CID 15298372.
- ^ Mason, B. J. (2006). «The role of sea-salt particles as cloud condensation nuclei over the remote oceans». Quarterly Journal of the Royal Meteorological Society. 127 (576): 2023–32. Bibcode:2001QJRMS.127.2023M. doi:10.1002/qj.49712757609. S2CID 121846285.
- ^ Salt, U.S. Geological Survey
This article incorporates public domain material from Salt (PDF). United States Geological Survey.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
Wikimedia Commons has media related to NaCl.
- Salt United States Geological Survey Statistics and Information
- «Using Salt and Sand for Winter Road Maintenance». Road Management Journal. December 1997. Archived from the original on 21 September 2016. Retrieved 13 February 2007.
- Calculators: surface tensions, and densities, molarities and molalities of aqueous NaCl (and other salts)
- JtBaker MSDS
This article is about the chemical. For its familiar form, common table salt, see Salt. For the medical solutions, see Saline (medicine). For the mineral, see Halite.

Sodium chloride crystals in a form of halite |
|

Crystal structure with sodium in purple and chloride in green[1] |
|
| Names | |
|---|---|
| IUPAC name
Sodium chloride |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3534976 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.726 |
| EC Number |
|
|
Gmelin Reference |
13673 |
| KEGG |
|
| MeSH | Sodium+chloride |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
NaCl |
| Molar mass | 58.443 g/mol[2] |
| Appearance | Colorless cubic crystals[2] |
| Odor | Odorless |
| Density | 2.17 g/cm3[2] |
| Melting point | 800.7 °C (1,473.3 °F; 1,073.8 K)[2] |
| Boiling point | 1,465 °C (2,669 °F; 1,738 K)[2] |
|
Solubility in water |
360 g/1000 g pure water at T = 25 °C[2] |
| Solubility in ammonia | 21.5 g/L at T = ?[clarification needed] |
| Solubility in methanol | 14.9 g/L at T = ?[clarification needed] |
|
Magnetic susceptibility (χ) |
−30.2·10−6 cm3/mol[3] |
|
Refractive index (nD) |
1.5441 (at 589 nm)[4] |
| Structure[5] | |
|
Crystal structure |
Face-centered cubic (see text), cF8 |
|
Space group |
Fm3m (No. 225) |
|
Lattice constant |
a = 564.02 pm |
|
Formula units (Z) |
4 |
|
Coordination geometry |
octahedral at Na+ octahedral at Cl− |
| Thermochemistry[6] | |
|
Heat capacity (C) |
50.5 J/(K·mol) |
|
Std molar |
72.10 J/(K·mol) |
|
Std enthalpy of |
−411.120 kJ/mol |
| Pharmacology | |
|
ATC code |
A12CA01 (WHO) B05CB01 (WHO), B05XA03 (WHO), S01XA03 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
0 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
3 g/kg (oral, rats)[7] |
| Related compounds | |
|
Other anions |
Sodium fluoride Sodium bromide Sodium iodide Sodium astatide |
|
Other cations |
Lithium chloride Potassium chloride Rubidium chloride Caesium chloride Francium chloride |
| Supplementary data page | |
| Sodium chloride (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium chloride ,[8] commonly known as salt (although sea salt also contains other chemical salts), is an ionic compound with the chemical formula NaCl, representing a 1:1 ratio of sodium and chloride ions. With molar masses of 22.99 and 35.45 g/mol respectively, 100 g of NaCl contains 39.34 g Na and 60.66 g Cl. Sodium chloride is the salt most responsible for the salinity of seawater and of the extracellular fluid of many multicellular organisms. In its edible form, salt (also known as table salt) is commonly used as a condiment and food preservative. Large quantities of sodium chloride are used in many industrial processes, and it is a major source of sodium and chlorine compounds used as feedstocks for further chemical syntheses. Another major application of sodium chloride is de-icing of roadways in sub-freezing weather.
Uses[edit]
In addition to the familiar domestic uses of salt, more dominant applications of the approximately 250 million tonnes per year production (2008 data) include chemicals and de-icing.[9]
Chemical functions[edit]
Salt is used, directly or indirectly, in the production of many chemicals, which consume most of the world’s production.[10]
Chlor-alkali industry[edit]
It is the starting point for the chloralkali process, the industrial process to produce chlorine and sodium hydroxide, according to the chemical equation
This electrolysis is conducted in either a mercury cell, a diaphragm cell, or a membrane cell. Each of those uses a different method to separate the chlorine from the sodium hydroxide. Other technologies are under development due to the high energy consumption of the electrolysis, whereby small improvements in the efficiency can have large economic paybacks. Some applications of chlorine include PVC thermoplastics production, disinfectants, and solvents.
Sodium hydroxide is extensively used in many different industries enabling production of paper, soap, and aluminium etc.
Soda-ash industry[edit]
Sodium chloride is used in the Solvay process to produce sodium carbonate and calcium chloride. Sodium carbonate, in turn, is used to produce glass, sodium bicarbonate, and dyes, as well as a myriad of other chemicals. In the Mannheim process, sodium chloride is used for the production of sodium sulfate and hydrochloric acid.
Standard[edit]
Sodium chloride has an international standard that is created by ASTM International. The standard is named ASTM E534-13 and is the standard test methods for chemical analysis of sodium chloride. These methods listed provide procedures for analyzing sodium chloride to determine whether it is suitable for its intended use and application.
Miscellaneous industrial uses[edit]
Sodium chloride is heavily used, so even relatively minor applications can consume massive quantities. In oil and gas exploration, salt is an important component of drilling fluids in well drilling. It is used to flocculate and increase the density of the drilling fluid to overcome high downwell gas pressures. Whenever a drill hits a salt formation, salt is added to the drilling fluid to saturate the solution in order to minimize the dissolution within the salt stratum.[9] Salt is also used to increase the curing of concrete in cemented casings.[10]
In textiles and dyeing, salt is used as a brine rinse to separate organic contaminants, to promote «salting out» of dyestuff precipitates, and to blend with concentrated dyes to standardize[clarification needed] them. One of its main roles is to provide the positive ion charge to promote the absorption of negatively charged ions of dyes.[10]
It is also used in processing aluminium, beryllium, copper, steel and vanadium. In the pulp and paper industry, salt is used to bleach wood pulp. It also is used to make sodium chlorate, which is added along with sulfuric acid and water to manufacture chlorine dioxide, an excellent oxygen-based bleaching chemical. The chlorine dioxide process, which originated in Germany after World War I, is becoming more popular because of environmental pressures to reduce or eliminate chlorinated bleaching compounds. In tanning and leather treatment, salt is added to animal hides to inhibit microbial activity on the underside of the hides and to attract moisture back into the hides.[10]
In rubber manufacture, salt is used to make buna, neoprene and white rubber types. Salt brine and sulfuric acid are used to coagulate an emulsified latex made from chlorinated butadiene.[10][9]
Salt also is added to secure the soil and to provide firmness to the foundation on which highways are built. The salt acts to minimize the effects of shifting caused in the subsurface by changes in humidity and traffic load.[10]
Sodium chloride is sometimes used as a cheap and safe desiccant because of its hygroscopic properties, making salting an effective method of food preservation historically; the salt draws water out of bacteria through osmotic pressure, keeping it from reproducing, a major source of food spoilage. Even though more effective desiccants are available, few are safe for humans to ingest.
Water softening[edit]
Hard water contains calcium and magnesium ions that interfere with action of soap and contribute to the buildup of a scale or film of alkaline mineral deposits in household and industrial equipment and pipes. Commercial and residential water-softening units use ion-exchange resins to remove ions that cause the hardness. These resins are generated and regenerated using sodium chloride.[10][9]
Road salt[edit]
Phase diagram of water–NaCl mixture
The second major application of salt is for de-icing and anti-icing of roads, both in grit bins and spread by winter service vehicles. In anticipation of snowfall, roads are optimally «anti-iced» with brine (concentrated solution of salt in water), which prevents bonding between the snow-ice and the road surface. This procedure obviates the heavy use of salt after the snowfall. For de-icing, mixtures of brine and salt are used, sometimes with additional agents such as calcium chloride and/or magnesium chloride. The use of salt or brine becomes ineffective below −10 °C (14 °F).
Mounds of road salt for use in winter
Salt for de-icing in the United Kingdom predominantly comes from a single mine in Winsford in Cheshire. Prior to distribution it is mixed with <100 ppm of sodium ferrocyanide as an anti-caking agent, which enables rock salt to flow freely out of the gritting vehicles despite being stockpiled prior to use. In recent years this additive has also been used in table salt. Other additives had been used in road salt to reduce the total costs. For example, in the US, a byproduct carbohydrate solution from sugar-beet processing was mixed with rock salt and adhered to road surfaces about 40% better than loose rock salt alone. Because it stayed on the road longer, the treatment did not have to be repeated several times, saving time and money.[10]
In the technical terms of physical chemistry, the minimum freezing point of a water-salt mixture is −21.12 °C (−6.02 °F) for 23.31 wt% of salt. Freezing near this concentration is however so slow that the eutectic point of −22.4 °C (−8.3 °F) can be reached with about 25 wt% of salt.[11]
Environmental effects[edit]
Road salt ends up in fresh-water bodies and could harm aquatic plants and animals by disrupting their osmoregulation ability.[12] The omnipresence of salt poses a problem in any coastal coating application, as trapped salts cause great problems in adhesion. Naval authorities and ship builders monitor the salt concentrations on surfaces during construction. Maximal salt concentrations on surfaces are dependent on the authority and application. The IMO regulation is mostly used and sets salt levels to a maximum of 50 mg/m2 soluble salts measured as sodium chloride. These measurements are done by means of a Bresle test. Salinization (increasing salinity, aka freshwater salinization syndrome) and subsequent increased metal leaching is an ongoing problem throughout North America and European fresh waterways.[13]
In highway de-icing, salt has been associated with corrosion of bridge decks, motor vehicles, reinforcement bar and wire, and unprotected steel structures used in road construction. Surface runoff, vehicle spraying, and windblown actions also affect soil, roadside vegetation, and local surface water and groundwater supplies. Although evidence of environmental loading of salt has been found during peak usage, the spring rains and thaws usually dilute the concentrations of sodium in the area where salt was applied.[10] A 2009 study found that approximately 70% of the road salt being applied in the Minneapolis-St Paul metro area is retained in the local watershed.[14]
Substitution[edit]
Some agencies are substituting beer, molasses, and beet juice instead of road salt.[15] Airlines utilize more glycol and sugar rather than salt based solutions for de-icing.[16]
Food industry and agriculture[edit]
Main article: Salt
Many microorganisms cannot live in a salty environment: water is drawn out of their cells by osmosis. For this reason salt is used to preserve some foods, such as bacon, fish, or cabbage.
Salt is added to food, either by the food producer or by the consumer, as a flavor enhancer, preservative, binder, fermentation-control additive, texture-control agent and color developer. The salt consumption in the food industry is subdivided, in descending order of consumption, into other food processing, meat packers, canning, baking, dairy and grain mill products. Salt is added to promote color development in bacon, ham and other processed meat products. As a preservative, salt inhibits the growth of bacteria. Salt acts as a binder in sausages to form a binding gel made up of meat, fat, and moisture. Salt also acts as a flavor enhancer and as a tenderizer.[10]
In many dairy industries, salt is added to cheese as a color-, fermentation-, and texture-control agent. The dairy subsector includes companies that manufacture creamery butter, condensed and evaporated milk, frozen desserts, ice cream, natural and processed cheese, and specialty dairy products. In canning, salt is primarily added as a flavor enhancer and preservative. It also is used as a carrier for other ingredients, dehydrating agent, enzyme inhibitor and tenderizer. In baking, salt is added to control the rate of fermentation in bread dough. It also is used to strengthen the gluten (the elastic protein-water complex in certain doughs) and as a flavor enhancer, such as a topping on baked goods. The food-processing category also contains grain mill products. These products consist of milling flour and rice and manufacturing cereal breakfast food and blended or prepared flour. Salt is also used a seasoning agent, e.g. in potato chips, pretzels, cat and dog food.[10]
Sodium chloride is used in veterinary medicine as emesis-causing agent. It is given as warm saturated solution. Emesis can also be caused by pharyngeal placement of small amount of plain salt or salt crystals.
Medicine[edit]
Sodium chloride is used together with water as one of the primary solutions for intravenous therapy. Nasal spray often contains a saline solution.
Firefighting[edit]
A class-D fire extinguisher for various metals
Sodium chloride is the principal extinguishing agent in fire extinguishers (Met-L-X, Super D) used on combustible metal fires such as magnesium, potassium, sodium, and NaK alloys (Class D). Thermoplastic powder is added to the mixture, along with waterproofing (metal stearates) and anti-caking materials (tricalcium phosphate) to form the extinguishing agent. When it is applied to the fire, the salt acts like a heat sink, dissipating heat from the fire, and also forms an oxygen-excluding crust to smother the fire. The plastic additive melts and helps the crust maintain its integrity until the burning metal cools below its ignition temperature. This type of extinguisher was invented in the late 1940s as a cartridge-operated unit, although stored pressure versions are now popular. Common sizes are 30 pounds (14 kg) portable and 350 pounds (160 kg) wheeled.[citation needed]
Cleanser[edit]
Since at least medieval times, people have used salt as a cleansing agent rubbed on household surfaces. It is also used in many brands of shampoo, toothpaste and popularly to de-ice driveways and patches of ice.
Optical usage[edit]
Defect-free NaCl crystals have an optical transmittance of about 90% for infrared light, specifically between 200 nm and 20 µm. They were therefore used in optical components (windows and prisms) operating in that spectral range, where few non-absorbing alternatives exist and where requirements for absence of microscopic inhomogeneities are less strict than in the visible range. While inexpensive, NaCl crystals are soft and hygroscopic – when exposed to the ambient air, they gradually cover with «frost». This limits application of NaCl to dry environments, vacuum sealed assembly areas or for short-term uses such as prototyping. Nowadays materials like zinc selenide (ZnSe), which are stronger mechanically and are less sensitive to moisture, are used instead of NaCl for the infrared spectral range.
Chemistry[edit]
Solid sodium chloride[edit]
Sodium chloride crystal under microscope.
NaCl octahedra. The yellow stipples represent the electrostatic force between the ions of opposite charge
In solid sodium chloride, each ion is surrounded by six ions of the opposite charge as expected on electrostatic grounds. The surrounding ions are located at the vertices of a regular octahedron. In the language of close-packing, the larger chloride ions (167 pm in size[17]) are arranged in a cubic array whereas the smaller sodium ions (116 pm[17]) fill all the cubic gaps (octahedral voids) between them. This same basic structure is found in many other compounds and is commonly known as the halite or rock-salt crystal structure. It can be represented as a face-centered cubic (fcc) lattice with a two-atom basis or as two interpenetrating face centered cubic lattices. The first atom is located at each lattice point, and the second atom is located halfway between lattice points along the fcc unit cell edge.
Solid sodium chloride has a melting point of 801 °C. Thermal conductivity of sodium chloride as a function of temperature has a maximum of 2.03 W/(cm K) at 8 K (−265.15 °C; −445.27 °F) and decreases to 0.069 at 314 K (41 °C; 106 °F). It also decreases with doping.[18]
Atomic-resolution real-time video imaging allows visualization of the initial stage of crystal nucleation of sodium chloride.[19]
Aqueous solutions[edit]
| Solubility of NaCl (g NaCl / 1 kg of solvent at 25 °C (77 °F))[20] |
|
|---|---|
| Water | 360 |
| Formamide | 94 |
| Glycerin | 83 |
| Propylene glycol | 71 |
| Formic acid | 52 |
| Liquid ammonia | 30.2 |
| Methanol | 14 |
| Ethanol | 0.65 |
| Dimethylformamide | 0.4 |
| Propan-1-ol | 0.124 |
| Sulfolane | 0.05 |
| Butan-1-ol | 0.05 |
| Propan-2-ol | 0.03 |
| Pentan-1-ol | 0.018 |
| Acetonitrile | 0.003 |
| Acetone | 0.00042 |
The attraction between the Na+ and Cl− ions in the solid is so strong that only highly polar solvents like water dissolve NaCl well.
View of one slab of NaCl(H2O)2 (red = O, white = H, green = Cl, purple = Na).[21]
When dissolved in water, the sodium chloride framework disintegrates as the Na+ and Cl− ions become surrounded by polar water molecules. These solutions consist of metal aquo complex with the formula [Na(H2O)8]+, with the Na–O distance of 250 pm. The chloride ions are also strongly solvated, each being surrounded by an average of six molecules of water.[22] Solutions of sodium chloride have very different properties from pure water. The eutectic point is −21.12 °C (−6.02 °F) for 23.31% mass fraction of salt, and the boiling point of saturated salt solution is near 108.7 °C (227.7 °F).[11] From cold solutions, salt crystallises as the dihydrate NaCl·2H2O.[23] In 2023, it was discovered that under pressure, sodium chloride can form the hydrates NaCl·8.5H2O and NaCl·13H2O.[24]
pH of sodium chloride solutions[edit]
The pH of a sodium chloride solution remains ≈7 due to the extremely weak basicity of the Cl− ion, which is the conjugate base of the strong acid HCl. In other words, NaCl has no effect on system pH[25] in diluted solutions where the effects of ionic strength and activity coefficients are negligible.
Stoichiometric and structure variants[edit]
Common salt has a 1:1 molar ratio of sodium and chlorine. In 2013, compounds of sodium and chloride of different stoichiometries have been discovered; five new compounds were predicted (e.g., Na3Cl, Na2Cl, Na3Cl2, NaCl3, and NaCl7). The existence of some of them has been experimentally confirmed at high pressures and other conditions: cubic and orthorhombic NaCl3, two-dimensional metallic tetragonal Na3Cl and exotic hexagonal NaCl.[26] This indicates that compounds violating chemical intuition are possible, in simple systems under nonambient conditions.[27]
Occurrence[edit]
Most of the world’s salt is dissolved in the ocean[citation needed]. A lesser amount is found in the Earth’s crust as the water-soluble mineral halite (rock salt), and a tiny amount exists as suspended sea salt particles in the atmosphere[citation needed]. These particles are the dominant cloud condensation nuclei far out at sea, which allow the formation of clouds in otherwise non-polluted air.[28]
Production[edit]
Salt is currently mass-produced by evaporation of seawater or brine from brine wells and salt lakes. Mining of rock salt is also a major source. China is the world’s main supplier of salt.[10] In 2017, world production was estimated at 280 million tonnes, the top five producers (in million tonnes) being China (68.0), United States (43.0), India (26.0), Germany (13.0), and Canada (13.0).[29] Salt is also a byproduct of potassium mining.
See also[edit]
- Biosalinity
- Edible salt (table salt)
- Halite, the mineral form of sodium chloride
- Health effects of salt
- Salinity
- Salting the earth
- Salt poisoning
References[edit]
- ^ «Sodium Chloride (NaCl) Crystal». PhysicsOpenLab. Retrieved 23 August 2021.
- ^ a b c d e f Haynes, 4.89
- ^ Haynes, 4.135
- ^ Haynes, 10.241
- ^ Haynes, 4.148
- ^ Haynes, 5.8
- ^ Sodium chloride. nlm.nih.gov.
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, pp. 143 and 755, ISBN 9781405881180
- ^ a b c d Westphal, Gisbert et al. (2002) «Sodium Chloride» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
- ^ a b c d e f g h i j k l Kostick, Dennis S. (October 2010) «Salt» in U.S. Geological Survey, 2008 Minerals Yearbook
- ^ a b Elvers, B. et al. (ed.) (1991) Ullmann’s Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, ISBN 978-3-527-20124-2.
- ^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? slate.com.
- ^ «Saltier waterways are creating dangerous ‘chemical cocktails’«. phys.org.
- ^ «Most Road Salt Is Making It into Lakes And Rivers». www.sciencedaily.com. University of Minnesota. 20 February 2009. Retrieved 27 September 2015.
- ^ Casey, Michael. «Turning to beet juice and beer to address road salt danger». phys.org.
- ^ «EASA Cautions on Organic Salt Deicing Fluid». MRO Network. 9 December 2016.
- ^ a b R. D. Shannon (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. (2001). Alkali halides: a handbook of physical properties. Springer. pp. 65, 68. ISBN 978-3-540-42180-1.
- ^ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021). «Capturing the Moment of Emergence of Crystal Nucleus from Disorder». Journal of the American Chemical Society. 143 (4): 1763–1767. doi:10.1021/jacs.0c12100. PMID 33475359.
- ^ Burgess, J (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 978-0-85312-027-8.
- ^ Klewe, B; Pedersen (1974). «The crystal structure of sodium chloride dihydrate». Acta Crystallogr. B30 (10): 2363–2371. doi:10.1107/S0567740874007138.
- ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) «Metal Aqua Ions» Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0.
- ^ Water-NaCl phase diagram. Lide, CRC Handbook of Chemistry and Physics, 86 ed (2005-2006), CRC pages 8-71, 8-116
- ^ University of Washington. «Newly discovered form of salty ice could exist on surface of extraterrestrial moons». Phys.org.
- ^ «Acidic, Basic, and Neutral Salts». Flinn Scientific Chem Fax. 2016. Retrieved 18 September 2018.
Neutralization of a strong acid and a strong base gives a neutral salt.
- ^ Tikhomirova, K. A.; Tantardini, C.; Sukhanova, E. V.; Popov, Z. I.; Evlashin, S. A.; Tarkhov, M. A.; Zhdanov, V. L. (2020). «Exotic Two-Dimensional Structure: The first case of Hexagonal NaCl». The Journal of Physical Chemistry Letters. 11 (10): 3821–3827. doi:10.1021/acs.jpclett.0c00874. PMID 32330050. S2CID 216130640.
- ^ Zhang, W.; Oganov, A. R.; Goncharov, A. F.; Zhu, Q.; Boulfelfel, S. E.; Lyakhov, A. O.; Stavrou, E.; Somayazulu, M.; Prakapenka, V. B.; Konôpková, Z. (2013). «Unexpected Stable Stoichiometries of Sodium Chlorides». Science. 342 (6165): 1502–1505. arXiv:1310.7674. Bibcode:2013Sci…342.1502Z. doi:10.1126/science.1244989. PMID 24357316. S2CID 15298372.
- ^ Mason, B. J. (2006). «The role of sea-salt particles as cloud condensation nuclei over the remote oceans». Quarterly Journal of the Royal Meteorological Society. 127 (576): 2023–32. Bibcode:2001QJRMS.127.2023M. doi:10.1002/qj.49712757609. S2CID 121846285.
- ^ Salt, U.S. Geological Survey
This article incorporates public domain material from Salt (PDF). United States Geological Survey.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
Wikimedia Commons has media related to NaCl.
- Salt United States Geological Survey Statistics and Information
- «Using Salt and Sand for Winter Road Maintenance». Road Management Journal. December 1997. Archived from the original on 21 September 2016. Retrieved 13 February 2007.
- Calculators: surface tensions, and densities, molarities and molalities of aqueous NaCl (and other salts)
- JtBaker MSDS
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Хлорид натрия
Брутто-формула:
ClNa
Названия
Русский:
- Хлорид натрия(IUPAC)
- галит
- каменная соль
- натрия хлорид
- обычная соль
- пищевая соль
- поваренная соль
- столовая соль
Варианты формулы:
Реакции, в которых участвует Хлорид натрия
-
2{M} + {Hal}2 = 2{M}{Hal}
, где M =
Li Na K Rb Cs; Hal =
F Cl Br I -
2NaCl + 2H2O «e-«-> 2NaOH + Cl2″|^» + H2″|^»
-
ZnCl2 + 4NaOH «90^oC»—> Na2[Zn(OH)4] + 2NaCl
-
Na2[Zn(OH)4] + 2HCl -> 2NaCl + Zn(OH)2″|v» + 2H2O
-
Na2[Zn(OH)4] + 4HCl -> 2NaCl + ZnCl2 + 4H2O
Хлорид натрия является одним из химических веществ, которые используются для приготовления пищи. Давайте подробно обсудим хлорид натрия и его различные факты в этой статье.
Щелочной металл натрия и галоген хлор объединяются, образуя ионное соединение, известное как хлорид натрия. Хлорид натрия имеет показатель преломления 1.5441. Установлено, что хлорид натрия имеет рН 7. Химическое вещество, называемое хлоридом натрия, растворимо в метаноле, аммиаке и воде.
В некоторых случаях в качестве электролита используется хлорид натрия. В этой статье мы имеем дело с различными фактами, такими как степень окисления, температура плавления, температура кипения хлорида натрия.
Хлорид натрия название ИЮПАК
Название IUPAC хлорида натрия — хлорид натрия.
Химическая формула хлорида натрия
Химическая формула или символ хлорида натрия — NaCl.
Номер CAS хлорида натрия
Номер CAS хлорида натрия: 7647-14-5.
ID химического паука натрия хлорида
Идентификатор химического паука хлорида натрия равен 5044.
Химическая классификация хлорида натрия
- Хлорид натрия представляет собой ионное соединение, образованное реакцией натрия и хлора друг с другом.
- Гидроксид натрия сильного основания и хлороводород реагируют с образованием соли, известной как хлорид натрия.
- Натрий и хлор присутствуют в соотношении 1:1.
- Теплоемкость хлорида натрия 50.5 Дж/кмоль.
Молярная масса хлорида натрия
Молярная масса хлорида натрия 58.443 г/моль.
Цвет хлорида натрия
Хлорид натрия представляет собой бесцветный кубический кристалл или кристалл белого цвета.
Вязкость хлорида натрия
Вязкость самого хлорида натрия можно найти, потому что вязкость — это свойство, полностью связанное с жидкостями. Установлено, что вязкость солевого раствора уменьшается при увеличении концентрации соли в воде.
Молярная плотность хлорида натрия
Молярная плотность хлорида натрия 2.17 г/см.3.
Температура плавления хлорида натрия
Хлорид натрия имеет температуру плавления 1073.8 К или 800.7 К.0 C. По шкале Фаренгейта это 1473.3.0 F.
Температура кипения хлорида натрия
Хлорид натрия имеет температуру кипения 14650 С (1738 К). По шкале Фаренгейта это 2669.0 F.
Состояние хлорида натрия при комнатной температуре
Хлорид натрия представляет собой бесцветное твердое вещество при комнатной температуре.
Ионная связь хлорида натрия
В хлориде натрия между элементами натрия и хлора образуется ионная связь. Хлор получает электрон, превращаясь в Cl–, а натрий теряет единицу, превращаясь в Na+. Затем эти два противоположных заряда притягиваются друг к другу, образуя хлорид натрия.
Хлорид натрия Ионный радиус
Ионный радиус хлорида натрия равен 2.36А.0.
Электронная конфигурация хлорида натрия
Количество электронов, которые может удерживать p-орбиталь, равно 6, в то время как ad и f орбитальный может вместить 10 и 14 соответственно. Изучим электронную конфигурацию хлорида натрия.
Натрий имеет электронную конфигурацию 1s.2 2s2 2p6 3s1 а хлор имеет конфигурацию 1s2 2s2 2p63s2 3p5.
Степень окисления хлорида натрия
Степень окисления хлорида натрия +1 у натрия и -1 у хлора. Количество электронов атом теряет или приобретает, когда он образует соединение, дает его степень окисления. Здесь натрий теряет, так что это +1, а хлор принимает один электрон, так что -1.
Кислотность хлорида натрия или щелочь
Хлорид натрия не является ни кислотой, ни основанием, это нейтральное вещество, так как его ионы равны в растворе.
Хлористый натрий не имеет запаха?
Соленый на вкус материал без запаха представляет собой хлорид натрия.
Является ли хлорид натрия парамагнитным?
Магнитный момент атома рассчитывается на основе его неспаренных электронов. Посмотрим, является ли хлорид натрия парамагнитным или нет.
Хлорид натрия является диамагнитным веществом. Поскольку все электроны как в натрии, так и в хлор является парным. Поскольку неспаренных электронов нет, он не может иметь парамагнитный характер.
Гидраты хлорида натрия
Хлорид натрия не образует никаких гидратов. Поскольку хлорид натрия легко растворяется в воде, и если мы кристаллизуем хлорид натрия из воды, он не будет образовывать никаких частиц. гидраты.
Кристаллическая структура хлорида натрия
Хлорид натрия имеет лицевой центр кубическая решетка как его кристаллическая структура. Значение его постоянной решетки составляет 564.02 пм. Геометрия хлорида натрия октаэдрическая, то есть каждый атом натрия окружен 6 ионами хлорида и наоборот.
Полярность и проводимость хлорида натрия
- Обнаружено, что хлорид натрия является полярным соединением, поскольку он имеет ионную природу. Между натрием и хлоридом можно увидеть дипольный момент, и его значение составляет 8.5 Д.
- Молярная проводимость хлорида натрия составляет 126.45 Ом.-1 cm2 моль-1 .
Реакция хлорида натрия с кислотой
Серная кислота и хлорид натрия объединяются с образованием сульфата натрия и хлороводорода. Также хлорид натрия реагирует с азотной кислотой с образованием нитрата натрия и хлороводорода. Реакции хлорида натрия с хлористым водородом не наблюдается.
2NaCl + Н2 SO4 → На2SO4 + 2НСl
NaCl + HNO3 → NaNO3 + HCl
NaCl + HCl → Нет видимой реакции
Реакция хлорида натрия с основанием
Реакция взаимодействия хлорида натрия с основанием, например гидроксидом калия, с образованием гидроксида натрия и хлорида калия. Но при взаимодействии с другим щелочным гидроксидом натрия видимой реакции не происходит.
NaCl + КОН → Na2О + MgCl2
Реакция хлорида натрия с оксидами
Хлорид натрия реагирует с одним из оксидов металлов, таких как оксид магния, с образованием оксида натрия и хлорида магния.
2NaCl + MgO → Na2О + MgCl2
Реакция хлорида натрия с металлами
Когда хлорид натрия реагирует с металлами, наиболее активный металл замещает натрий с образованием соответствующего хлорида металла. Это можно назвать реакцией замещения.
Заключение
Хлорид натрия отвечает за соленый вкус морской воды. Он используется в качестве пищевого консерванта, источника соединений натрия и хлорида, для борьбы с обледенением дорог в зимнее время года, в качестве огнетушителя, для смягчения воды и во многих промышленных целях.

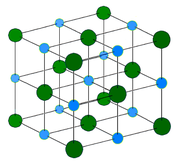









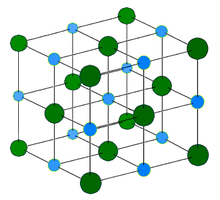


![{displaystyle {ce {2 NaCl + 2 H2O ->[electrolysis] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6175336b0ecf3b2032d6a60ac2a534b10e6f61f3)