- ЛИТИЯ НИТРАТ
-
LiNO3, бесцв. кристаллы с гексагон. решеткой ( а =1,392 нм, с =1,522 нм, пространств. группа P3с); т. пл. 253 °С; плотн. 2,37 г/см 3; С 0 р89 Дж/(моль. К); DH0 обр -482,7 кДж/моль, DH0 пл 25 кДж/молъ, DH0 возг 170 кДж/моль; S0298 104,0 Дж/(моль. К). Разлагается выше 600 °С. Раств. в воде (72,8 при 20 °С и 194 г в 100 г при 75 °С), этаноле, жидком NH3, ацетоне. Тригидрат Л. н. — бесцв. гигроскопичные кристаллы с ромбич. решеткой (а= 0,8803 нм, b= 1,272 нм, с= 0,600 нм, z = 4, пространств. группа Сmcm); т. пл. 30 °С; плотн. 1,57 г/см 3; С° р202,1 Дж/(моль. К); DH0 пл 36,4 кДж/моль, DH0 обр -1372,06 кДж/моль; S0298 209 Дж/(моль. К); ур-ние температурной зависимости давления пара Н 2 О над твердым тригидратом Л. н.: lgp(мм рт. ст.) = 10,2922 Ч 2856/Т (289-300 К). Гигроскопичен. Получают Л. н. взаимод. оксида, гидроксида или карбоната Li с разб. HNO3. Применяют как компонент пиротехн. и теплоаккумулирующих составов. П. М. Чукуров.
Химическая энциклопедия. — М.: Советская энциклопедия.
Под ред. И. Л. Кнунянца.
1988.
Смотреть что такое «ЛИТИЯ НИТРАТ» в других словарях:
-
лития нитрат — ličio nitratas statusas T sritis chemija formulė LiNO₃ atitikmenys: angl. lithium nitrate rus. литий азотнокислый; лития нитрат ryšiai: sinonimas – ličio trioksonitratas … Chemijos terminų aiškinamasis žodynas
-
Нитрат лития — Нитрат лития … Википедия
-
Нитрат алюминия — Нитрат алюминия … Википедия
-
Нитрат рубидия — Общие Систематическое наименование Нитрат рубидия Традиционные названия Азотнокислый рубидий Химическая формула RbNO3 Физические свойства Состояние … Википедия
-
Нитрат цезия — Общие Систематическое наименование Нитрат цезия Традиционные названия Азотнокислый цезий Химическая формула CsNO3 Физические свойства Состояние ( … Википедия
-
Нитрат аммония — Нитрат аммония … Википедия
-
Нитрат кальция — Нитрат кальция … Википедия
-
Нитрат меди(II) — Нитрат меди(II) … Википедия
-
Нитрат калия — Нитрат калия … Википедия
-
Нитрат натрия — Нитрат натрия … Википедия
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
LiNO3, бесцв. Кристаллы с гексагон. Решеткой ( а =1,392 нм, с =1,522 нм, пространств. Группа P3с). Т. Пл. 253 °С. Плотн. 2,37 г/см 3. С 0 р89 Дж/(моль. К). DH0 обр -482,7 кДж/моль, DH0 пл 25 кДж/молъ, DH0 возг 170 кДж/моль. S0298 104,0 Дж/(моль. К). Разлагается выше 600 °С. Раств. В воде (72,8 при 20 °С и 194 г в 100 г при 75 °С), этаноле, жидком NH3, ацетоне. Тригидрат Л. Н. — бесцв. Гигроскопичные кристаллы с ромбич. Решеткой (а= 0,8803 нм, b= 1,272 нм, с= 0,600 нм, z = 4, пространств. Группа Сmcm). Т. Пл. 30 °С. Плотн. 1,57 г/см 3. С°. Р202,1 Дж/(моль. К). DH0 пл 36,4 кДж/моль, DH0 обр -1372,06 кДж/моль. S0298 209 Дж/(моль. К). Ур-ние температурной зависимости давления пара Н 2 О над твердым тригидратом Л. Н. Lgp(мм рт. Ст.) = 10,2922 Ч 2856/Т (289-300 К).
Гигроскопичен. Получают Л. Н. Взаимод. Оксида, гидроксида или карбоната Li с разб. HNO3. Применяют как компонент пиротехн. И теплоаккумулирующих составов. П. М. Чукуров..
На нашем сайте Вы найдете значение «Лития Нитрат» в словаре Химическая энциклопедия, подробное описание, примеры использования, словосочетания с выражением Лития Нитрат, различные варианты толкований, скрытый смысл.
Первая буква «Л». Общая длина 12 символа

Русско-английский перевод НИТРАТ ЛИТИЯ
lithium nitrate
Большой Русско-Английский словарь.
New big Russian-English dictionary.
2012
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 июля 2016 года; проверки требуют 9 правок.
Нитрат лития — соль щелочного металла лития и азотной кислоты с формулой LiNO3. Эта гигроскопичная соль используется в пиротехнике для придания пламени красного цвета.
Образует кристаллогидрат LiNO3·3H2O.
Получение[править | править код]
- Нитрат лития можно получить по реакции карбоната лития[2] или гидроксида лития[3] с азотной кислотой:
Li2CO3 + 2 HNO3 → 2 LiNO3 + CO2 + H2O
LiOH + HNO3 → LiNO3 + H2O
- Также взаимодействием металлического лития или его оксида с азотной кислотой:
21Li + 26HNO3 → 21LiNO3 + NO↑ + N2↑ + N2O↑ + 13H2O
Li2O + 2HNO3 → 2LiNO3 + H2O
- Взаимодействие лития с азотной кислотой:
2Li + 2HNO3 → 2LiNO3 + H2 ↑
Свойства[править | править код]
При термическом разложении LiNO3 образует оксид лития (Li2O), диоксид азота и кислород:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Нитраты других щелочных металлов разлагаются иначе, с образованием нитритов и кислорода. Это объясняется относительно малым размером катиона лития, который является сильно поляризующим, что способствует образованию оксида при разложении.
Примечания[править | править код]
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1154.
- ↑ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 228
Ссылки[править | править код]
- Hazardous Chemical Database (недоступная ссылка)
| Нитрат лития | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | нитрат лития |
| Химическая формула | LiNO3 |
| Физические свойства | |
| Состояние (ст. усл.) | белое твердое |
| Молярная масса | 68,946 г/моль |
| Плотность | 2,38 г/см³ |
| Термические свойства | |
| Температура плавления | 255 °C |
| Температура кипения | 873 °C |
| Энтальпия образования (ст. усл.) | -483,104 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 90 г/100 мл (28 °C) 234 г/100 мл (100 °C) |
| Оптические свойства | |
| Показатель преломления | 1,735 [1] |
| Классификация | |
| Рег. номер CAS | 7790-69-4 |
| RTECS | QU9200000 |
Нитрат лития — соль щелочного металла лития и азотной кислоты с формулой LiNO3. Эта гигроскопичная соль используется в пиротехнике для придания пламени красного цвета. Образует кристаллогидрат LiNO3·3H2O.
Получение
Нитрат лития можно получить по реакции карбоната лития[2] или гидроксида лития[3] с азотной кислотой:
Li2CO3 + 2 HNO3 → 2 LiNO3 + CO2 + H2O
LiOH + HNO3 → LiNO3 + H2O
Также взаимодействием металлического лития или его оксида на азотную кислоту:
21Li + 26HNO3 → 21LiNO3 + NO↑ + N2↑ + N2O↑ + 13H2O
Li2O + 2HNO3 → 2LiNO3 + H2O
Свойства
При термическом разложении LiNO3 образует оксид лития (Li2O), диоксид азота и кислород:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Нитраты других металлов разлагаются иначе, с образованием нитритов и кислорода. Это объясняется относительно малым размером катиона лития, который является сильно поляризующим, что способствует образованию оксида при разложении.
Примечания
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1154.
- ↑ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 228
Ссылки
- Hazardous Chemical Database
|
Соединения лития |
|---|
|
Азид лития (LiN3) • Алюминат лития (LiAlO2) • Алюмогидрид лития (LiAlH4) • Амид лития (LiNH2) • Ацетат лития (CH3COOLi) • Ацетиленид лития (Li2C2) • Бензиллитий (LiСH2С6H5) • Бензоат лития (C6H5COOLi) • Бромат лития (LiBrO3) • Бромид лития (LiBr) • Гексафторфосфат лития (LiPF6) • Гидрид лития (LiH) • Гидрокарбонат лития (LiHCO3) • Гидроксид лития (LiOH) • Гидроортофосфат лития (Li2HPO4) • Гидросульфат лития (LiHSO4) • Гидросульфид лития (LiHS) • Гидрофторид лития (LiHF2) • Дигидроортофосфат лития (LiH2PO4) • Дисульфит лития (Li2S2O5) • Дихромат лития (Li2Cr2O7) • Имид лития (Li2NH) • Иодат лития (LiIO3) • Иодид лития (LiI) • Карбид лития (Li2С2) • Карбонат лития (Li2CO3) • Метагерманат лития (Li2GeO3) • Метасиликат лития (Li2SiO3) • Метафосфат лития (LiPO3) • Метиллитий (LiСH3) • Нитрат лития (LiNO3) • Нитрид лития (Li3N) • Нитрит лития (LiNO2) • Оксалат лития (Li2C2O4) • Оксид лития (Li2O) • Ортофосфат лития (Li3PO4) • Пербромат лития (LiBrO4) • Пероксид лития (Li2O2) • Пероксомоносульфат лития (Li2SO5) • Персульфат лития (Li2S2O8) • Перхлорат лития (LiClO4) • Силицид лития (Li6Si2) • Сорбат лития (C6H7LiO2) • Сульфат лития (Li2SO4) • Сульфид лития (Li2S) • Сульфит лития (Li2SO3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоборат лития (Li[BH4]) • Тиоцианат лития (LiSCN) • Фениллитий (LiС6H5) • Формиат лития (HCOOLi) • Фталимид лития • Фторид лития (LiF) • Хлорат лития (LiClO3) • Хлорид лития (LiCl) • Хромат лития (Li2CrO4) • Цианат лития (LiOCN) • Цианид лития (LiCN) • Цианоаурат лития (Li[Au(CN)2] • Этиллитий (LiС2H5) • |
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
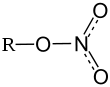 |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Нитрат лития | |
|---|---|
 |
|
| Систематическое наименование |
нитрат лития |
| Хим. формула | LiNO3 |
| Состояние | белое твердое |
| Молярная масса | 68,946 г/моль |
| Плотность | 2,38 г/см³ |
| Температура | |
| • плавления | 255 °C |
| • кипения | > 600 °C (разлагается) °C |
| Энтальпия | |
| • образования | -483,104 кДж/моль |
| Растворимость | |
| • в воде | 90 г/100 мл (28 °C) 234 г/100 мл (100 °C) |
| Показатель преломления | 1,735 |
| Рег. номер CAS | 7790-69-4 |
| PubChem | 10129889 |
| Рег. номер EINECS | 232-218-9 |
| SMILES |
[Li+].[N+](=O)([O-])[O-] |
| InChI |
1S/Li.NO3/c;2-1(3)4/q+1;-1 IIPYXGDZVMZOAP-UHFFFAOYSA-N |
| RTECS | QU9200000 |
| ChEBI | 63315 |
| ChemSpider | 8305408 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат лития — соль щелочного металла лития и азотной кислоты с формулой LiNO3. Эта гигроскопичная соль используется в пиротехнике для придания пламени красного цвета.
Образует кристаллогидрат LiNO3·3H2O.
Содержание
- 1 Получение
- 2 Свойства
Получение
Нитрат лития можно получить по реакции карбоната лития или гидроксида лития с азотной кислотой:
Li2CO3 + 2 HNO3 → 2 LiNO3 + CO2 + H2O
LiOH + HNO3 → LiNO3 + H2O
Также взаимодействием металлического лития или его оксида с азотной кислотой:
21 Li + 26 HNO3 → 21 LiNO3 + NO↑ + N2↑ + N2O↑ + 13 H2O
Li2O + 2 HNO3 → 2 LiNO3 + H2O
Свойства
При термическом разложении LiNO3 образует оксид лития (Li2O), диоксид азота и кислород:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Нитраты других щелочных металлов разлагаются иначе, с образованием нитритов и кислорода. Это объясняется относительно малым размером катиона лития, который является сильно поляризующим, что способствует образованию оксида при разложении.
Физические свойства
Нитрат лития LiNO3 — соль щелочного металла лития и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 68,95; относительная плотность по тв. и ж. состоянию d = 2,38; tпл = 253º C.
Способ получения
1. Нитрат лития можно получить путем взаимодействия лития и азотной кислоты, образуется нитрат лития, оксид азота (II) и вода :
3Li + 4HNO3 = 3LiNO3 + NO↑ + 2H2O.
2. В результате взаимодействия фторида лития и азотной кислоты образуется нитрат лития и фтороводород:
LiF + HNO3 = LiNO3 + HF↑
3. В результате реакции между сульфидом лития и азотной кислотой, происходит образование нитрата лития, оксида азота, серы и воды:
Li2S + 4HNO3 = 2LiNO3 + 2NO2↑ + S↓ + 2H2O.
Качественная реакция
Качественная реакция на нитрат лития — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат лития образует сульфат лития, нитрат меди, оксид азота и воду:
LiNO3 + H2SO4 + Cu = Li2SO4 + Cu(NO3)2 + NO2↑ + H2O
Химические свойства
1. Hитрат лития разлагается при температуре от 475ºС до 650ºС с образованием оксида лития, оксида азота и воды:
4LiNO3 = 2Li2O + 4NO2 + O2
2. Нитрат лития может реагировать с простыми веществами:
2.1. Нитрат лития реагирует со свинцом при температуре 400ºС. При этом образуется нитрат лития и оксид свинца:
LiNO3 + Pb = LiNO2 + PbO
2.2. С водородом нитрат лития реагирует в присутствии цинка и разбавленной хлороводородной кислоты с образованием нитрита лития и воды:
LiNO3 + 2[H] = LiNO2 + H2O
| Нитрат лития | |
|---|---|
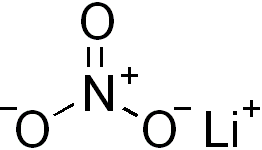 |
|
 |
|
| Общие | |
| Систематическое наименование |
нитрат лития |
| Хим. формула | LiNO3 |
| Физические свойства | |
| Состояние | белое твердое |
| Молярная масса | 68,946 г/моль |
| Плотность | 2,38 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 255 °C |
| • кипения | > 600 °C (разлагается) °C |
| Энтальпия | |
| • образования | -483,104 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
90 г/100 мл (28 °C) 234 г/100 мл (100 °C) |
| Оптические свойства | |
| Показатель преломления | 1,735 [1] |
| Классификация | |
| Рег. номер CAS | 7790-69-4 |
| RTECS | QU9200000 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат лития — соль щелочного металла лития и азотной кислоты с формулой LiNO3. Эта гигроскопичная соль используется в пиротехнике для придания пламени красного цвета.
Образует кристаллогидрат LiNO3·3H2O.
Получение
- Нитрат лития можно получить по реакции карбоната лития[2] или гидроксида лития[3] с азотной кислотой:
Li2CO3 + 2 HNO3 → 2 LiNO3 + CO2 + H2O
LiOH + HNO3 → LiNO3 + H2O
- Также взаимодействием металлического лития или его оксида с азотной кислотой:
21Li + 26HNO3 → 21LiNO3 + NO↑ + N2↑ + N2O↑ + 13H2O
Li2O + 2HNO3 → 2LiNO3 + H2O
- Взаимодействие лития с азотной кислотой:
8Li + 10HNO3 → 8LiNO3 + N2O+5H2O
Свойства
При термическом разложении LiNO3 образует оксид лития (Li2O), диоксид азота и кислород:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Нитраты других щелочных металлов разлагаются иначе, с образованием нитритов и кислорода. Это объясняется относительно малым размером катиона лития, который является сильно поляризующим, что способствует образованию оксида при разложении.
Примечания
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1154.
- ↑ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 228
Ссылки
- Hazardous Chemical Database (недоступная ссылка)

Нитрат лития — соль щелочного металла лития и азотной кислоты с формулой LiNO3. Эта гигроскопичная соль используется в пиротехнике для придания пламени красного цвета.Образует кристаллогидрат LiNO3·3H2O.
| Нитрат лития | |
|---|---|
| Общие | |
| Систематическое наименование |
нитрат лития |
| Хим. формула | LiNO3 |
| Физические свойства | |
| Состояние | белое твердое |
| Молярная масса | 68,946 г/моль |
| Плотность | 2,38 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 255 °C |
| • кипения | > 600 °C (разлагается) °C |
| Энтальпия | |
| • образования | -483,104 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 90 г/100 мл (28 °C) 234 г/100 мл (100 °C) |
| Оптические свойства | |
| Показатель преломления | 1,735 |
| Классификация | |
| Рег. номер CAS | 7790-69-4 |
| PubChem | 10129889 |
| Рег. номер EINECS | 232-218-9 |
| SMILES |
[Li+].[N+](=O)([O-])[O-] |
| InChI |
1S/Li.NO3/c;2-1(3)4/q+1;-1 IIPYXGDZVMZOAP-UHFFFAOYSA-N |
| RTECS | QU9200000 |
| ChEBI | 63315 |
| ChemSpider | 8305408 |
| Безопасность | |
| NFPA 704 |
Получение
- Нитрат лития можно получить по реакции карбоната лития или гидроксида лития с азотной кислотой:
Li2CO3 + 2 HNO3 → 2 LiNO3 + CO2 + H2O
LiOH + HNO3 → LiNO3 + H2O
- Также взаимодействием металлического лития или его оксида с азотной кислотой:
21Li + 26HNO3 → 21LiNO3 + NO↑ + N2↑ + N2O↑ + 13H2O
Li2O + 2HNO3 → 2LiNO3 + H2O
- Взаимодействие лития с нитратной кислотой
2Li + 2HNO3 → 2LiNO3 + H2 ↑
Свойства
При термическом разложении LiNO3 образует оксид лития (Li2O), диоксид азота и кислород:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Нитраты других щелочных металлов разлагаются иначе, с образованием нитритов и кислорода. Это объясняется относительно малым размером катиона лития, который является сильно поляризующим, что способствует образованию оксида при разложении.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Нитрат лития
Брутто-формула:
LiNO3
CAS# 7790-69-4
Названия
Варианты формулы:
Реакции, в которых участвует Нитрат лития
-
{M}OH + H{X} -> {M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 BrO4 ClO4 N3 [AuCl4] ClO2 ReO4 -
Li2CO3 + 2HNO3 -> 2LiNO3 + CO2 + H2O
-
{M}2O + 2H{X} = 2{M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 ClO4 BrO4 -
Ag{X} + {M}Br -> AgBr»|v» + {M}{X}
, где X =
NO3; M =
H Na K Li Rb -
2{M}NO3 + H2SO4 -> {M}2SO4 + 2HNO3
, где M =
Li Na K Rb Ag
