Введение
Вряд ли кто-нибудь из вас ничего не слышал о нитрате натрия. Его название нередко упоминается еще в школе, не то что в промышленности. Но только название! А что еще известно про натриевую селитру? Вот о чем мы поговорим в сегодняшней статье.
Определение
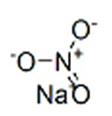
Нитрат натрия (формула NaNO3) является натриевой солью азотной кислоты. Его могут называть «натрием азотнокислым» или «натриевой/натронной/чилийской селитрой».
Свойства
Натрий азотнокислый представлен бесцветными длинными кристаллами, имеющими ромбоэдрическую или тригональную кристаллическую решетку. На вкус они являются очень солеными. В разных веществах растворяются по-разному, но лучше всего нитрат натрия «тает» в воде. При температуре 380оС данное соединение разлагается на азотистокислый натрий и кислород. Реакция выглядит так: 2NaNO3 => 2NaNO2 + O2. Также нитрат натрия может вступать в реакции обмена, вторым реагентом которых являются соли щелочных металлов. Одним из продуктов при этом всегда будет нитрат с растворимостью, значение которой будет гораздо ниже, чем у обсуждаемого сейчас вещества. Например, при взаимодействии натриевой селитры с хлоридом калия образуется нитрат калия и поваренная соль (хлорид натрия). В расплаве обсуждаемый нитрат проявляет сильные окислительные, а в растворе — восстановительные свойства. При его разложении выделяется кислород, и благодаря этому данное соединение может вступать в реакцию с неметаллами.
Получение
Данный нитрат можно получить несколькими способами:
Реакция азотной кислоты с металлом или оксидом натрия
При добавлении в азотную кислоту чистого натрия происходит реакция нейтрализации. Продуктами ее станут искомое вещество, вода, а также газообразные азот и его оксиды (I, II). Если к этой же кислоте добавить оксид натрия, то в результате получатся обсуждаемое сейчас соединение и вода.
Реакция азотной кислоты с кислыми солями или гидроксидом натрия
Если к HNO3 добавить кислую соль натрия (например, его гидрокарбонат), то образуются искомое вещество, вода и углекислый газ, который быстро улетучивается. Если же вторым реагентом станет гидроксид натрия, то, как в случае с его оксидом и азотной кислотой, получаются только нитрат натрия и H2O.
Реакция аммиачной селитры с кислыми солями или гидроксидом натрия
Азотную кислоту может с успехом заменить нитрат аммония. Во время его взаимодействия с гидроксидом натрия образуются искомое вещество, вода и газообразный аммиак, а при реакции с гидрокарбонатом натрия продуктами станут эти соединения и углекислый газ.
Реакция поваренной соли с нитратом серебра
В этом случае происходит реакция обмена, продуктами которой являются нитрат натрия и хлорид серебра.
Применение
Данное вещество используется в качестве ценного азотного удобрения. Без нитрата натрия не обходятся пиротехническая, пищевая, стекольная и металлообрабатывающая отрасли промышленности. Натриевая селитра добывается из природных залежей несколькими способами:
— выщелачивание данного вещества с помощью горячей воды и кристаллизации;
— абсорбция окислов азота с использованием раствора пищевой соды;
— реакция обмена, в которой участвуют сульфат/хлорид/карбонат натрия и кальциевая/аммиачная селитра.
Заключение
Вот какую важную роль играет азотнокислый натрий. Есть еще и другие вещества, без которых не обходится человек, но о них поговорим в другой раз.
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Свойства
Физические свойства
Бесцветные кристаллы, плотность 2,257 г/см3, tпл 308 °C (выше tпл разлагается на NaNO2 и O2). Растворимость (г в 100 г): в воде-72,7 (0°С), 87,6 (20°С), 124,7 (60°С), 176 (100°С); при 25 °С в этаноле-0,036, метаноле-0,41, пиридине-0,35;. Сильный окислитель. Природные месторождения находятся в Чили, Перу и ряде других стран.Температура плавления = 308 °C, плотность равна 2,26 г/см3. Окислитель. Молекулярная масса (по международным атомным массам 1985 г.) — 84,99. Канцероген
Химические свойства
- При 380°С разлагается с выделением кислорода и нитрита натрия:
- Может вступать в реакции с солями щелочных металлов стоящих в ряду активности металлов до натрия:
- Проявляет сильные окислительные свойства в твердом агрегатном состоянии. В растворах проявляет более восстановительные, нежели окислительные свойства. В процессе разложения выделяет кислород вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на хлорид ион):
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
См. также
- Получение нитрата натрия
- Нитрит натрия
- Натрий
- Нитрат калия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 октября 2020 года; проверки требуют 12 правок.
| Нитрат натрия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Нитрат натрия |
| Традиционные названия | Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
| Хим. формула | NaNO3 |
| Состояние | твёрдое |
| Молярная масса | 84,993 г/моль |
| Плотность | 2,257 г/см³ |
| Твёрдость | 2 |
| Поверхностное натяжение | 119 (320°C) 117 (350°C) 114 (400°C) Н/м |
| Динамическая вязкость | 2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
| Температура | |
| • плавления | 308 °C |
| • кипения | с разложением °C |
| • разложения | 380 °C |
| Мол. теплоёмк. | 67 Дж/(моль·К) |
| Энтальпия | |
| • образования | -257 кДж/моль |
| • плавления | 16 кДж/моль |
| Растворимость | |
| • в жидком аммиаке | 127 г/100 мл |
| • в воде | 91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
| • в гидразине | 100 (20°C) |
| Рег. номер CAS | 7631-99-4 |
| PubChem | 24268 |
| Рег. номер EINECS | 231-554-3 |
| SMILES |
[N+](=O)([O-])[O-].[Na+] |
| InChI |
InChI=1S/NO3.Na/c2-1(3)4;/q-1;+1 VWDWKYIASSYTQR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E251 |
| RTECS | WC5600000 |
| ChEBI | 63005 |
| Номер ООН | 1498 |
| ChemSpider | 22688 |
| ЛД50 | 3500 мг/кг (мыши, перорально) |
| Пиктограммы ECB | |
| NFPA 704 |
1 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Свойства[править | править код]
Физические свойства[править | править код]
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства[править | править код]
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.[источник не указан 3425 дней].
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение[править | править код]
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl—):
Применение[править | править код]
Применяется как удобрение; в пищевой[1], стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Примечания[править | править код]
Ссылки[править | править код]
- Производство нитрата натрия в Корее Архивная копия от 2 декабря 2021 на Wayback Machine
~ Urania ~
Просветленный
(24426)
12 лет назад
Зависит от формулы. И то, и другое существует.
Нитрит — соль азотистой кислоты HNO2 (нитрит натрия NaNO2)
Нитрид — соединения азота с менее электроотрицательными элементами, например с металлами (с тем же натрием) и с рядом неметаллов (нитрид натрия Na3N)
Нитрат натрия не продается в магазине: говорят, что с помощью его поджигают школы. Нитрат натрия очень полезный реактив, поэтому его нужно получить, к тому же с помощью него можно получить KNO3 который очень дорогой, дешевым способом.
1) Можно получить NaNO3 по реакции: Na2CO3 + 2NH4NO3 —> 2NaNO3 + (NH4)2CO3. Потом если кипятить раствор, карбонат аммония разложится и улетучится, а нитрат натрия остается только выпарить и использовать?
2) При какой t нужно прокаливать NaNO3, чтобы получить NaNO2 и кислород выделившийся не взорвался?3) Как и написано выше NaNO3 не продают ссылаясь на то, что поджигают здания. Я думаю, что речь идет о «дымовухах»(бумага пропитанная аммиачкой) и так и сказал, что типа это аммиачная селитра виновата, а не натриевая, но потом задумался: «Может действительно с NaNO3 что-то мутят?» Что делают с чилийской селитрой, чтобы там чето зажигалось?
(основные вопросы подчеркнуты)
Морфемный разбор слова:
Однокоренные слова к слову:
Нитрат натрия
| Нитрат натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра |
| Химическая формула | NaNO3 |
| Физические свойства | |
| Отн. молек. масса | 84,99 а. е. м. |
| Плотность | 2,257 г/см³ |
| Термические свойства | |
| Температура плавления | 308 °C |
| Температура разложения | 380 °C |
| Безопасность | |
| Токсичность | соединение не токсично |
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Содержание
Свойства
Физические свойства
Химические свойства
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
Также вместо азотной кислоты можно использовать нитрат аммония:
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Источник
Нитрат натрия ГОСТ 828-77
Кодекс Алиментариус E251 RTECS WC5600000 ChEBI 63005 Номер ООН 1498 ChemSpider 22688 ЛД50 3500 мг/кг (мыши, перорально) Токсичность
Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного.
Содержание
Свойства
Физические свойства
Растворимость (г в 100 г) в:
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
NaNO3 + KCl ⟶ KNO3 + NaCl NaNO3 + RbI ⟶ RbNO3 + NaI
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
Также вместо азотной кислоты можно использовать нитрат аммония:
Применение
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Источник
Формула нитрата натрия
Определение и формула нитрата натрия
Плавится без разложения, но разлагается при дальнейшем нагревании. Хорошо растворяется в воде (не гидролизуется). Кристаллогидратов не образует. Практически не растворяется в концентрированной азотной кислоте. Сильный окислитель при спекании.
Рис. 1. Нитрат натрия. Внешний вид.
Химическая формула нитрата натрия
Химическая формула нитрата натрия NaNO3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества (Ar(Na) =23а.е.м., Ar(N) = 14 а.е.м., Ar(O) = 16 а.е.м.):
Mr(NaNO3) = 23 + 14 + 3×16 = 23 + 14 + 48 = 85.
Структурная (графическая) формула нитрата натрия
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Ниже представлена графическая формула нитрата натрия:
Ионная формула
Нитрат натрия электролит, поэтому он способен диссоциировать в водном растворе на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде: |
Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа:
n(CO2) = 5,6 / 22,4 = 0,25 моль.
Рассчитаем молярную массу предельной одноосновной кислоты:
Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода):
M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46;
14n + 46 = 102 г/моль;
Значит молекулярная формула предельной одноосновной кислоты C4H9COOH.
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде: |
Рассчитаем количество вещества хлороводорода:
n(HCl) = 1,2 / 22,4 = 0,05 моль.
Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль.
Рассчитаем молярную массу алкена:
Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода):
Значит молекулярная формула алкена C4H8.
Источник
Нитрат натрия, характеристика, свойства и применение
Нитрат натрия, характеристика, свойства и применение.
Нитрат натрия – неорганическое вещество, имеет химическую формулу NaNO3.
Краткая характеристика нитрата натрия:
Нитрат натрия – неорганическое вещество белого цвета.
Химическая формула нитрата натрия NaNO3.
Нитрат натрия – неорганическое химическое соединение, соль азотной кислоты и натрия.
Хорошо растворяется в воде, жидком аммиаке, перекиси водорода. Плохо растворим в этаноле, метаноле. Не растворим в ацетоне.
Гигроскопичен. Кристаллогидратов не образует.
Нитрат натрия токсичен, по степени воздействия на организм человека относится к умеренно опасным веществам (3-й класс опасности по ГОСТ 12.1.007).
Наиболее крупные месторождения природного нитрата натрия находятся в Чили и Перу.
В пищевой промышленности нитрат натрия зарегистрирован как пищевая добавка Е251 и используется как консервант и фиксатор окраски. В некоторых странах нитрат натрия запрещен как пищевая добавка.
Физические свойства нитрата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaNO3 |
| Синонимы и названия иностранном языке | sodium nitrate (англ.) |
натрий азотнокислый (рус.)
Химические свойства нитрата натрия. Химические реакции нитрата натрия:
Источник
Описание нитрата натрия и химическая формула селитры, правила применения
Нитратом натрия называют подкормку, которая отличается выраженными щелочными характеристиками и сильной окислительной активностью. Ее также называют азотнокислым натрием или натриевой селитрой. Состав часто применяется в сельском хозяйстве для улучшения структуры грунта. Благодаря этому он становится пригоден для культивации различных растений. При этом важно применять состав правильно.
Описание вещества
Какие физические свойства проявляет
Нитрат натрия – это далеко не единственное название вещества. Для обозначения этого средства часто применяют такие понятия, как «натриевая селитра» или «азотнокислый натрий». Также его нередко называют чилийской селитрой.
Сегодня соль обычно получают в качестве побочного продукта, который формируется вследствие получения азотной кислоты из аммиака. Удобрение легко смешивается с обычной водой. По мере повышения температуры растворимость увеличивается. При +20 градусах в 100 миллилитрах воды растворяется 87,6 грамма порошка, а при +100 градусах – 176 граммов.
Основные химические свойства
Формула натриевой селитры – NaNO3. Вещество поглощает из воздуха влагу, потому оно сильно слеживается. При этом наблюдаются структурные изменения, а мелкие кристаллы – превращаются в большие. В сухом помещении соль не слеживается и сохраняет свою рассыпчатость. Именно в таком виде ее проще всего вносить в грунт.
В земле азотнокислый натрий распадается на катион Na+ и анион NO3-. Нитрат ион усваивается исключительно биологическим способом. Это происходит осенью и зимой. Однако в силу отсутствия биологического поглощения вещество не остается в почве. Это приводит к потерям азота, особенно на легких по структуре типах почвы. Эта особенность не позволяет применять состав для внесения осенью. При необходимости предзимнего внесения дозировку повышают.
Главная польза и возможный вред
Вещество приносит растениям и грунту большую пользу. К его главным преимуществам относят следующее:
Недостатком вещества считается невозможность его применения в осеннее время года. В этом случае оно легко вымывается и не приносит пользы.
Где применяется
Лишь определенный класс натриевой селитры может применяться в сельском хозяйстве, а именно – СХ. В качестве добавки к составу для удобрений запрещено применять марку А. Ее главным назначением считаются химическая, стекольная, металлообрабатывающая отрасли промышленности. Класс Б обладает свойствами нитрата натрия. Они будут полезны для грунта и растений, однако основным назначением этого вида селитры считается осветление стекол и травление металлов.
Чтобы применение вещества приносило настоящую пользу, требуется четко соблюдать инструкцию и выполнить тест на наличие нитратов.
При использовании состава важно учитывать, что он представляет собой сильный окислитель. Потому сочетать его вещество с некоторыми препаратами нельзя.
Можно ли приготовить натриевую селитру самостоятельно
Чтобы сделать препарат своими руками, рекомендуется взять такие компоненты:
Для приготовления подкормки стоит сделать следующее:
Не стоит заниматься приготовлением средства в закрытом помещении. Испарения аммиачной селитры плохо выветриваются и могут оседать на предметах интерьерах. В результате человек будет получать систематическое отравление. Готовить состав рекомендуется на свежем воздухе. При этом важно периодически отходить от емкости с кипящим составом.
Правила использования
Нитрат натрия можно вносить под любые растения. Исключением считаются лишь те культуры, которые не требуют большого количества натрия в качестве питательного вещества. На дозировку влияет количество азота в почве, погода, климат, разновидность растения.
Норму натриевой селитры на 1 квадратный метр требуется в каждом конкретном случае рассчитывать индивидуально:
При использовании натриевой селитры в личных подсобных хозяйствах ее стоит вносить под перекопку осенью – по 1-2 килограмму на сотку. Весной рекомендуется использовать по 500 граммов вещества на 1 сотку.
Для кустарников требуется 60 граммов средства на 1 лунку. Также разрешается распределять порошок в приствольных кругах. В этом случае на 1 квадратный метр рекомендуется использовать по 15-30 граммов средства. На 1 взрослое дерево максимальная дозировка составляет максимум 250 граммов.
Существуют ли противопоказания и срок годности
Нитрат натрия не стоит использовать на солончаках или в засоленном грунте. В этом случае рекомендуется выбрать другой препарат с аналогичными свойствами. При комбинированном применении вещество нельзя сочетать с перегноем и средствами на основе фосфора и калия. Также препарат запрещено применять в телицах.
Срок хранения натриевой селитры не ограничен. Ее разрешается держать исключительно в заводской упаковке, которая не пропускает влагу. Нельзя хранить рядом органические подкормки, пищевые продукты и бытовые средства. Помимо этого, вещество должно находиться вне зоны доступа детей и домашних животных.
При нагревании подкормки есть вероятность взрыва или возгорания. Потому препарат требуется изолировать от горючих средств и герметично закрыть. Мешки с порошком должны находиться на поддонах.
Техника безопасности и первая помощь при интоксикации
При попадании нитрата натрия на кожу есть риск ее раздражения. Чтобы избежать подобных проблем, при работе с веществом требуется использовать резиновые перчатки. После завершения процедур руки рекомендуется тщательно вымыть.
Немаловажное значение имеет использование очков и респиратора. Нитрат натрия вреден для людей. Он может представлять серьезную опасность при вдыхании и попадании на слизистые оболочки. Пыль оказывает раздражающий эффект и может стать причиной ожога.
При отравлении натриевой селитрой появляются такие признаки:
При появлении таких симптомов следует сразу обратиться к врачу. В качестве первой помощи пострадавшего требуется вывести на свежий воздух и переодеть. Кожу и глаза рекомендуется тщательно промыть холодной водой. При попадании вещества в желудок требуется сделать промывание. Для этого нужно принять 6-7 таблеток активированного угля и запить водой. Через 20 минут рекомендуется спровоцировать рвоту.
Нитрат натрия представляет собой эффективное азотное удобрение, которое применяется для подкормки всех растений. Также его можно использовать для подщелачивания грунта. Чтобы средство дало нужный эффект, важно придерживаться инструкции по его применению.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется нитрат натрия в химии формула, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется нитрат натрия в химии формула», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
From Wikipedia, the free encyclopedia

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Sodium nitrate |
||
| Other names
Peru saltpeter |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.686 |
|
| EC Number |
|
|
| E number | E251 (preservatives) | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1498 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaNO3 | |
| Molar mass | 84.9947 g/mol | |
| Appearance | White powder or colorless crystals | |
| Odor | sweet | |
| Density | 2.257 g/cm3, solid | |
| Melting point | 308 °C (586 °F; 581 K) | |
| Boiling point | 380 °C (716 °F; 653 K) decomposes | |
|
Solubility in water |
73 g/100 g water (0 °C) 91.2 g/100 g water (25 °C)[1][2] 180 g/100 g water (100 °C) |
|
| Solubility | very soluble in ammonia, hydrazine soluble in alcohol slightly soluble in pyridine insoluble in acetone |
|
|
Magnetic susceptibility (χ) |
−25.6·10−6 cm3/mol | |
|
Refractive index (nD) |
1.587 (trigonal) 1.336 (rhombohedral) |
|
| Viscosity | 2.85 cP (317 °C) | |
| Structure | ||
|
Crystal structure |
trigonal and rhombohedral | |
| Thermochemistry | ||
|
Heat capacity (C) |
93.05 J/(mol K) | |
|
Std molar |
116 J/(mol K)[3] | |
|
Std enthalpy of |
−467 kJ/mol[3] | |
|
Gibbs free energy (ΔfG⦵) |
−365.9 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Harmful (Xn) Oxidant (O) |
|
| GHS labelling: | ||
|
Pictograms |
 
|
|
| NFPA 704 (fire diamond) |
1 0 0 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
3236 mg/kg | |
| Safety data sheet (SDS) | ICSC 0185 | |
| Related compounds | ||
|
Other anions |
Sodium nitrite | |
|
Other cations |
Lithium nitrate Potassium nitrate Rubidium nitrate Caesium nitrate |
|
|
Related compounds |
Sodium sulfate Sodium chloride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium nitrate is the chemical compound with the formula NaNO
3. This alkali metal nitrate salt is also known as Chile saltpeter (large deposits of which were historically mined in Chile)[4][5] to distinguish it from ordinary saltpeter, potassium nitrate. The mineral form is also known as nitratine, nitratite or soda niter.
Sodium nitrate is a white deliquescent solid very soluble in water. It is a readily available source of the nitrate anion (NO3−), which is useful in several reactions carried out on industrial scales for the production of fertilizers, pyrotechnics, smoke bombs and other explosives, glass and pottery enamels, food preservatives (esp. meats), and solid rocket propellant. It has been mined extensively for these purposes.
History[edit]
The first shipment of saltpeter to Europe arrived in England from Peru in 1820 or 1825, right after that country’s independence from Spain, but did not find any buyers and was dumped at sea in order to avoid customs toll.[6][7] With time, however, the mining of South American saltpeter became a profitable business (in 1859, England alone consumed 47,000 metric tons).[7] Chile fought the War of the Pacific (1879–1884) against the allies Peru and Bolivia and took over their richest deposits of saltpeter. In 1919, Ralph Walter Graystone Wyckoff determined its crystal structure using X-ray crystallography.
Occurrence[edit]
Advertisement for sodium nitrate fertilizer from Chile on a wall of a village in the Algarve area of Portugal
Mines of Chile, green is sodium nitrate area
The largest accumulations of naturally occurring sodium nitrate are found in Chile and Peru, where nitrate salts are bound within mineral deposits called caliche ore.[8] Nitrates accumulate on land through marine-fog precipitation and sea-spray oxidation/desiccation followed by gravitational settling of airborne NaNO3, KNO3, NaCl, Na2SO4, and I, in the hot-dry desert atmosphere.[9] El Niño/La Niña extreme aridity/torrential rain cycles favor nitrates accumulation through both aridity and water solution/remobilization/transportation onto slopes and into basins; capillary solution movement forms layers of nitrates; pure nitrate forms rare veins. For more than a century, the world supply of the compound was mined almost exclusively from the Atacama desert in northern Chile until, at the turn of the 20th century, German chemists Fritz Haber and Carl Bosch developed a process for producing ammonia from the atmosphere on an industrial scale (see Haber process). With the onset of World War I, Germany began converting ammonia from this process into a synthetic Chilean saltpeter, which was as practical as the natural compound in production of gunpowder and other munitions. By the 1940s, this conversion process resulted in a dramatic decline in demand for sodium nitrate procured from natural sources.
Chile still has the largest reserves of caliche, with active mines in such locations as Valdivia, María Elena and Pampa Blanca, and there it used to be called white gold.[4][5] Sodium nitrate, potassium nitrate, sodium sulfate and iodine are all obtained by the processing of caliche. The former Chilean saltpeter mining communities of Humberstone and Santa Laura were declared UNESCO World Heritage sites in 2005.
Synthesis[edit]
Sodium nitrate is also synthesized industrially by neutralizing nitric acid with sodium carbonate or sodium bicarbonate:
- 2 HNO3 + Na2CO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
or also by neutralizing it with sodium hydroxide (however, this reaction is very exothermic):
- HNO3 + NaOH → NaNO3 + H2O
or by mixing stoichiometric amounts of ammonium nitrate and sodium hydroxide, sodium bicarbonate or sodium carbonate:
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
Uses[edit]
Most sodium nitrate is used in fertilizers, where it supplies a water-soluble form of nitrogen. Its use, which is mainly outside of high-income countries, is attractive since it does not alter the pH of the soil. Another major use is as a complement to ammonium nitrate in explosives. Molten sodium nitrate and its solutions with potassium nitrate have good thermal stability (up to 600 °C) and high heat capacities. These properties are suitable for thermally annealing metals and for storing thermal energy in solar applications.[10]
Food[edit]
Sodium nitrate is also a food additive used as a preservative and color fixative in cured meats and poultry; it is listed under its INS number 251 or E number E251. It is approved for use in the EU,[11] US[12] and Australia and New Zealand.[13] Sodium nitrate should not be confused with sodium nitrite, which is also a common food additive and preservative used, for example, in deli meats.
Thermal storage[edit]
Sodium nitrate has also been investigated as a phase-change material for thermal energy recovery, owing to its relatively high melting enthalpy of 178 J/g.[14][15] Examples of the applications of sodium nitrate used for thermal energy storage include solar thermal power technologies and direct steam generating parabolic troughs.[14]
Steel coating[edit]
Sodium nitrate is used in a steel coating process in which it forms a surface magnetite layer.[16]
Health concerns[edit]
Studies have shown a link between increased levels of nitrates and increased deaths from certain diseases including Alzheimer’s disease, diabetes mellitus, stomach cancer, and Parkinson’s disease: possibly through the damaging effect of nitrosamines on DNA; however, little has been done to control for other possible causes in the epidemiological results.[17] Nitrosamines, formed in cured meats containing sodium nitrate and nitrite, have been linked to gastric cancer and esophageal cancer.[18] Sodium nitrate and nitrite are associated with a higher risk of colorectal cancer.[19]
Substantial evidence in recent decades, facilitated by an increased understanding of pathological processes and science, exists in support of the theory that processed meat increases the risk of colon cancer and that this is due to the nitrate content. A small amount of the nitrate added to meat as a preservative breaks down into nitrite, in addition to any nitrite that may also be added. The nitrite then reacts with protein-rich foods (such as meat) to produce carcinogenic NOCs (nitroso compounds). NOCs can be formed either when meat is cured or in the body as meat is digested.[20]
However, several things complicate the otherwise straightforward understanding that «nitrates in food raise your risk of cancer»: Commonly consumed plants are well known to be rich sources of nitrates.[citation needed] In fact, exposure of nitrates from plants may even be higher than meat for most people.[citation needed] Processed meats have no fiber, vitamins, or phytochemical antioxidants, are high in sodium, may contain high fat, and are often fried or cooked at a temperature sufficient to degrade protein into nitrosamines. Nitrates are key intermediates and effectors in the primary vasculature signaling which is necessary for all mammals to survive.[21]
See also[edit]
- Sodium nitrite
References[edit]
- ^ Haynes, William M. (2016-06-22). CRC Handbook of Chemistry and Physics. CRC Press. ISBN 978-1-4987-5429-3.
- ^ «Sodium nitrate». PubChem. Retrieved 11 June 2021.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b «The Nitrate Towns of Chile». Atlas Obscura. Retrieved 27 May 2019.
- ^ a b Mutic, Anja (26 October 2012). «The ghost towns of northern Chile». Washington Post. Retrieved 27 May 2019.
- ^ S. H. Baekeland «Några sidor af den kemiska industrien» (1914) Svensk Kemisk Tidskrift, p. 140.
- ^ a b Friedrich Georg Wieck, Uppfinningarnas bok (1873, Swedish translation of Buch der Erfindungen), vol. 4, p. 473.
- ^ Stephen R. Bown, A Most Damnable Invention: Dynamite, Nitrates, and the Making of the Modern World, Macmillan, 2005, ISBN 0-312-32913-X, p. 157.
- ^ Arias, Jaime (24 Jul 2003). On the Origin of Saltpeter, Northern Chile Coast. International Union for Quaternary Research. Archived from the original on 4 March 2016. Retrieved 19 Aug 2018.
- ^ Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl (2000). «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ UK Food Standards Agency: «Current EU approved additives and their E Numbers». Retrieved 2011-10-27.
- ^ US Food and Drug Administration: «Listing of Food Additives Status Part II». Food and Drug Administration. Retrieved 2011-10-27.
- ^ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». Retrieved 2011-10-27.
- ^ a b Bauer, Thomas; Laing, Doerte; Tamme, Rainer (2011-11-15). «Characterization of Sodium Nitrate as Phase Change Material». International Journal of Thermophysics. 33 (1): 91–104. doi:10.1007/s10765-011-1113-9. ISSN 0195-928X. S2CID 54513228.
- ^ ICTAC Working Group; Sabbah, R. (France, Chairman); et al. (1999-06-14). «Reference materials for calorimetry and differential thermal analysis». Thermochimica Acta. 331 (2): 93–204. doi:10.1016/S0040-6031(99)00009-X. ISSN 0040-6031.
- ^ Fauzi, Ahmad Asyraf Bin Ahmad (2014). Production of Magnetite Thin Film Over Steel Substrate Using Hot Alkaline Nitrate Blackening Method. Universitat Politècnica de Catalunya. Escola Politècnica Superior d’Enginyeria de Vilanova i la Geltrú. Departament de Ciència dels Materials i Enginyeria Metal·lúrgica, 2014 (Grau en Enginyeria Mecànica).
- ^ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). «Epidemilogical trends strongly suggest exposures as etiologic agents in the pathogenesis of sporadic Alzheimer’s disease, diabetes mellitus, and non-alcoholic steatohepatitis». Journal of Alzheimer’s Disease. 17 (3): 519–29. doi:10.3233/JAD-2009-1070. PMC 4551511. PMID 19363256.
- ^ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21 Jul 2006). «Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence». World Journal of Gastroenterology. 12 (27): 4296–4303. doi:10.3748/wjg.v12.i27.4296. PMC 4087738. PMID 16865769. Archived from the original on 14 October 2018. Retrieved 4 November 2010.
- ^ Cross, AJ; Ferrucci, LM; Risch, A; et al. (2010). «A large prospective study of meat consumption and colorectal cancer risk: An investigation of potential mechanisms underlying this association». Cancer Research. 70 (6): 2406–14. doi:10.1158/0008-5472.CAN-09-3929. PMC 2840051. PMID 20215514.
- ^ «The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer», Archived 2019-07-26 at the Wayback Machine World Cancer Research Fund (2010)
- ^ Machha, Ajay; Schechter, Alan N. (August 2011). «Dietary nitrite and nitrate: a review of potential mechanisms of cardiovascular benefits». European Journal of Nutrition. 50 (5): 293–303. doi:10.1007/s00394-011-0192-5. ISSN 1436-6207. PMC 3489477. PMID 21626413.
Further reading[edit]
- Archer, Donald G. (2000). «Thermodynamic properties of the NaNO3 + H2O system». Journal of Physical and Chemical Reference Data. 29 (5): 1141–1156. Bibcode:2000JPCRD..29.1141A. doi:10.1063/1.1329317. ISSN 0047-2689.
- Barnum, Dennis (2003). «Some history of nitrates». Journal of Chemical Education. 80 (12): 1393–. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- Mullin, J. W. (1997). Crystallization. Butterworth-Heinemann. ISBN 978-0-7506-3759-6.
External links[edit]
- CHORI CO., LTD. :https://chori-mukifine.com/en/sodium-nitrate/
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sodium nitrate
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
From Wikipedia, the free encyclopedia

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Sodium nitrate |
||
| Other names
Peru saltpeter |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.686 |
|
| EC Number |
|
|
| E number | E251 (preservatives) | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1498 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaNO3 | |
| Molar mass | 84.9947 g/mol | |
| Appearance | White powder or colorless crystals | |
| Odor | sweet | |
| Density | 2.257 g/cm3, solid | |
| Melting point | 308 °C (586 °F; 581 K) | |
| Boiling point | 380 °C (716 °F; 653 K) decomposes | |
|
Solubility in water |
73 g/100 g water (0 °C) 91.2 g/100 g water (25 °C)[1][2] 180 g/100 g water (100 °C) |
|
| Solubility | very soluble in ammonia, hydrazine soluble in alcohol slightly soluble in pyridine insoluble in acetone |
|
|
Magnetic susceptibility (χ) |
−25.6·10−6 cm3/mol | |
|
Refractive index (nD) |
1.587 (trigonal) 1.336 (rhombohedral) |
|
| Viscosity | 2.85 cP (317 °C) | |
| Structure | ||
|
Crystal structure |
trigonal and rhombohedral | |
| Thermochemistry | ||
|
Heat capacity (C) |
93.05 J/(mol K) | |
|
Std molar |
116 J/(mol K)[3] | |
|
Std enthalpy of |
−467 kJ/mol[3] | |
|
Gibbs free energy (ΔfG⦵) |
−365.9 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Harmful (Xn) Oxidant (O) |
|
| GHS labelling: | ||
|
Pictograms |
 
|
|
| NFPA 704 (fire diamond) |
1 0 0 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
3236 mg/kg | |
| Safety data sheet (SDS) | ICSC 0185 | |
| Related compounds | ||
|
Other anions |
Sodium nitrite | |
|
Other cations |
Lithium nitrate Potassium nitrate Rubidium nitrate Caesium nitrate |
|
|
Related compounds |
Sodium sulfate Sodium chloride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium nitrate is the chemical compound with the formula NaNO
3. This alkali metal nitrate salt is also known as Chile saltpeter (large deposits of which were historically mined in Chile)[4][5] to distinguish it from ordinary saltpeter, potassium nitrate. The mineral form is also known as nitratine, nitratite or soda niter.
Sodium nitrate is a white deliquescent solid very soluble in water. It is a readily available source of the nitrate anion (NO3−), which is useful in several reactions carried out on industrial scales for the production of fertilizers, pyrotechnics, smoke bombs and other explosives, glass and pottery enamels, food preservatives (esp. meats), and solid rocket propellant. It has been mined extensively for these purposes.
History[edit]
The first shipment of saltpeter to Europe arrived in England from Peru in 1820 or 1825, right after that country’s independence from Spain, but did not find any buyers and was dumped at sea in order to avoid customs toll.[6][7] With time, however, the mining of South American saltpeter became a profitable business (in 1859, England alone consumed 47,000 metric tons).[7] Chile fought the War of the Pacific (1879–1884) against the allies Peru and Bolivia and took over their richest deposits of saltpeter. In 1919, Ralph Walter Graystone Wyckoff determined its crystal structure using X-ray crystallography.
Occurrence[edit]
Advertisement for sodium nitrate fertilizer from Chile on a wall of a village in the Algarve area of Portugal
Mines of Chile, green is sodium nitrate area
The largest accumulations of naturally occurring sodium nitrate are found in Chile and Peru, where nitrate salts are bound within mineral deposits called caliche ore.[8] Nitrates accumulate on land through marine-fog precipitation and sea-spray oxidation/desiccation followed by gravitational settling of airborne NaNO3, KNO3, NaCl, Na2SO4, and I, in the hot-dry desert atmosphere.[9] El Niño/La Niña extreme aridity/torrential rain cycles favor nitrates accumulation through both aridity and water solution/remobilization/transportation onto slopes and into basins; capillary solution movement forms layers of nitrates; pure nitrate forms rare veins. For more than a century, the world supply of the compound was mined almost exclusively from the Atacama desert in northern Chile until, at the turn of the 20th century, German chemists Fritz Haber and Carl Bosch developed a process for producing ammonia from the atmosphere on an industrial scale (see Haber process). With the onset of World War I, Germany began converting ammonia from this process into a synthetic Chilean saltpeter, which was as practical as the natural compound in production of gunpowder and other munitions. By the 1940s, this conversion process resulted in a dramatic decline in demand for sodium nitrate procured from natural sources.
Chile still has the largest reserves of caliche, with active mines in such locations as Valdivia, María Elena and Pampa Blanca, and there it used to be called white gold.[4][5] Sodium nitrate, potassium nitrate, sodium sulfate and iodine are all obtained by the processing of caliche. The former Chilean saltpeter mining communities of Humberstone and Santa Laura were declared UNESCO World Heritage sites in 2005.
Synthesis[edit]
Sodium nitrate is also synthesized industrially by neutralizing nitric acid with sodium carbonate or sodium bicarbonate:
- 2 HNO3 + Na2CO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
or also by neutralizing it with sodium hydroxide (however, this reaction is very exothermic):
- HNO3 + NaOH → NaNO3 + H2O
or by mixing stoichiometric amounts of ammonium nitrate and sodium hydroxide, sodium bicarbonate or sodium carbonate:
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
Uses[edit]
Most sodium nitrate is used in fertilizers, where it supplies a water-soluble form of nitrogen. Its use, which is mainly outside of high-income countries, is attractive since it does not alter the pH of the soil. Another major use is as a complement to ammonium nitrate in explosives. Molten sodium nitrate and its solutions with potassium nitrate have good thermal stability (up to 600 °C) and high heat capacities. These properties are suitable for thermally annealing metals and for storing thermal energy in solar applications.[10]
Food[edit]
Sodium nitrate is also a food additive used as a preservative and color fixative in cured meats and poultry; it is listed under its INS number 251 or E number E251. It is approved for use in the EU,[11] US[12] and Australia and New Zealand.[13] Sodium nitrate should not be confused with sodium nitrite, which is also a common food additive and preservative used, for example, in deli meats.
Thermal storage[edit]
Sodium nitrate has also been investigated as a phase-change material for thermal energy recovery, owing to its relatively high melting enthalpy of 178 J/g.[14][15] Examples of the applications of sodium nitrate used for thermal energy storage include solar thermal power technologies and direct steam generating parabolic troughs.[14]
Steel coating[edit]
Sodium nitrate is used in a steel coating process in which it forms a surface magnetite layer.[16]
Health concerns[edit]
Studies have shown a link between increased levels of nitrates and increased deaths from certain diseases including Alzheimer’s disease, diabetes mellitus, stomach cancer, and Parkinson’s disease: possibly through the damaging effect of nitrosamines on DNA; however, little has been done to control for other possible causes in the epidemiological results.[17] Nitrosamines, formed in cured meats containing sodium nitrate and nitrite, have been linked to gastric cancer and esophageal cancer.[18] Sodium nitrate and nitrite are associated with a higher risk of colorectal cancer.[19]
Substantial evidence in recent decades, facilitated by an increased understanding of pathological processes and science, exists in support of the theory that processed meat increases the risk of colon cancer and that this is due to the nitrate content. A small amount of the nitrate added to meat as a preservative breaks down into nitrite, in addition to any nitrite that may also be added. The nitrite then reacts with protein-rich foods (such as meat) to produce carcinogenic NOCs (nitroso compounds). NOCs can be formed either when meat is cured or in the body as meat is digested.[20]
However, several things complicate the otherwise straightforward understanding that «nitrates in food raise your risk of cancer»: Commonly consumed plants are well known to be rich sources of nitrates.[citation needed] In fact, exposure of nitrates from plants may even be higher than meat for most people.[citation needed] Processed meats have no fiber, vitamins, or phytochemical antioxidants, are high in sodium, may contain high fat, and are often fried or cooked at a temperature sufficient to degrade protein into nitrosamines. Nitrates are key intermediates and effectors in the primary vasculature signaling which is necessary for all mammals to survive.[21]
See also[edit]
- Sodium nitrite
References[edit]
- ^ Haynes, William M. (2016-06-22). CRC Handbook of Chemistry and Physics. CRC Press. ISBN 978-1-4987-5429-3.
- ^ «Sodium nitrate». PubChem. Retrieved 11 June 2021.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b «The Nitrate Towns of Chile». Atlas Obscura. Retrieved 27 May 2019.
- ^ a b Mutic, Anja (26 October 2012). «The ghost towns of northern Chile». Washington Post. Retrieved 27 May 2019.
- ^ S. H. Baekeland «Några sidor af den kemiska industrien» (1914) Svensk Kemisk Tidskrift, p. 140.
- ^ a b Friedrich Georg Wieck, Uppfinningarnas bok (1873, Swedish translation of Buch der Erfindungen), vol. 4, p. 473.
- ^ Stephen R. Bown, A Most Damnable Invention: Dynamite, Nitrates, and the Making of the Modern World, Macmillan, 2005, ISBN 0-312-32913-X, p. 157.
- ^ Arias, Jaime (24 Jul 2003). On the Origin of Saltpeter, Northern Chile Coast. International Union for Quaternary Research. Archived from the original on 4 March 2016. Retrieved 19 Aug 2018.
- ^ Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl (2000). «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ UK Food Standards Agency: «Current EU approved additives and their E Numbers». Retrieved 2011-10-27.
- ^ US Food and Drug Administration: «Listing of Food Additives Status Part II». Food and Drug Administration. Retrieved 2011-10-27.
- ^ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». Retrieved 2011-10-27.
- ^ a b Bauer, Thomas; Laing, Doerte; Tamme, Rainer (2011-11-15). «Characterization of Sodium Nitrate as Phase Change Material». International Journal of Thermophysics. 33 (1): 91–104. doi:10.1007/s10765-011-1113-9. ISSN 0195-928X. S2CID 54513228.
- ^ ICTAC Working Group; Sabbah, R. (France, Chairman); et al. (1999-06-14). «Reference materials for calorimetry and differential thermal analysis». Thermochimica Acta. 331 (2): 93–204. doi:10.1016/S0040-6031(99)00009-X. ISSN 0040-6031.
- ^ Fauzi, Ahmad Asyraf Bin Ahmad (2014). Production of Magnetite Thin Film Over Steel Substrate Using Hot Alkaline Nitrate Blackening Method. Universitat Politècnica de Catalunya. Escola Politècnica Superior d’Enginyeria de Vilanova i la Geltrú. Departament de Ciència dels Materials i Enginyeria Metal·lúrgica, 2014 (Grau en Enginyeria Mecànica).
- ^ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). «Epidemilogical trends strongly suggest exposures as etiologic agents in the pathogenesis of sporadic Alzheimer’s disease, diabetes mellitus, and non-alcoholic steatohepatitis». Journal of Alzheimer’s Disease. 17 (3): 519–29. doi:10.3233/JAD-2009-1070. PMC 4551511. PMID 19363256.
- ^ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21 Jul 2006). «Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence». World Journal of Gastroenterology. 12 (27): 4296–4303. doi:10.3748/wjg.v12.i27.4296. PMC 4087738. PMID 16865769. Archived from the original on 14 October 2018. Retrieved 4 November 2010.
- ^ Cross, AJ; Ferrucci, LM; Risch, A; et al. (2010). «A large prospective study of meat consumption and colorectal cancer risk: An investigation of potential mechanisms underlying this association». Cancer Research. 70 (6): 2406–14. doi:10.1158/0008-5472.CAN-09-3929. PMC 2840051. PMID 20215514.
- ^ «The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer», Archived 2019-07-26 at the Wayback Machine World Cancer Research Fund (2010)
- ^ Machha, Ajay; Schechter, Alan N. (August 2011). «Dietary nitrite and nitrate: a review of potential mechanisms of cardiovascular benefits». European Journal of Nutrition. 50 (5): 293–303. doi:10.1007/s00394-011-0192-5. ISSN 1436-6207. PMC 3489477. PMID 21626413.
Further reading[edit]
- Archer, Donald G. (2000). «Thermodynamic properties of the NaNO3 + H2O system». Journal of Physical and Chemical Reference Data. 29 (5): 1141–1156. Bibcode:2000JPCRD..29.1141A. doi:10.1063/1.1329317. ISSN 0047-2689.
- Barnum, Dennis (2003). «Some history of nitrates». Journal of Chemical Education. 80 (12): 1393–. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- Mullin, J. W. (1997). Crystallization. Butterworth-Heinemann. ISBN 978-0-7506-3759-6.
External links[edit]
- CHORI CO., LTD. :https://chori-mukifine.com/en/sodium-nitrate/
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sodium nitrate
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Sodium nitrate

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Sodium nitrate |
||
| Other names
Peru saltpeter |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.686 |
|
| EC Number |
|
|
| E number | E251 (preservatives) | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1498 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaNO3 | |
| Molar mass | 84.9947 g/mol | |
| Appearance | White powder or colorless crystals | |
| Odor | sweet | |
| Density | 2.257 g/cm3, solid | |
| Melting point | 308 °C (586 °F; 581 K) | |
| Boiling point | 380 °C (716 °F; 653 K) decomposes | |
|
Solubility in water |
73 g/100 g water (0 °C) 91.2 g/100 g water (25 °C)[1][2] 180 g/100 g water (100 °C) |
|
| Solubility | very soluble in ammonia, hydrazine soluble in alcohol slightly soluble in pyridine insoluble in acetone |
|
|
Magnetic susceptibility (χ) |
−25.6·10−6 cm3/mol | |
|
Refractive index (nD) |
1.587 (trigonal) 1.336 (rhombohedral) |
|
| Viscosity | 2.85 cP (317 °C) | |
| Structure | ||
|
Crystal structure |
trigonal and rhombohedral | |
| Thermochemistry | ||
|
Heat capacity (C) |
93.05 J/(mol K) | |
|
Std molar |
116 J/(mol K)[3] | |
|
Std enthalpy of |
−467 kJ/mol[3] | |
|
Gibbs free energy (ΔfG⦵) |
−365.9 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Harmful (Xn) Oxidant (O) |
|
| GHS labelling: | ||
|
Pictograms |
 
|
|
| NFPA 704 (fire diamond) |
1 0 0 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
3236 mg/kg | |
| Safety data sheet (SDS) | ICSC 0185 | |
| Related compounds | ||
|
Other anions |
Sodium nitrite | |
|
Other cations |
Lithium nitrate Potassium nitrate Rubidium nitrate Caesium nitrate |
|
|
Related compounds |
Sodium sulfate Sodium chloride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium nitrate is the chemical compound with the formula NaNO
3. This alkali metal nitrate salt is also known as Chile saltpeter (large deposits of which were historically mined in Chile)[4][5] to distinguish it from ordinary saltpeter, potassium nitrate. The mineral form is also known as nitratine, nitratite or soda niter.
Sodium nitrate is a white deliquescent solid very soluble in water. It is a readily available source of the nitrate anion (NO3−), which is useful in several reactions carried out on industrial scales for the production of fertilizers, pyrotechnics, smoke bombs and other explosives, glass and pottery enamels, food preservatives (esp. meats), and solid rocket propellant. It has been mined extensively for these purposes.
History[edit]
The first shipment of saltpeter to Europe arrived in England from Peru in 1820 or 1825, right after that country’s independence from Spain, but did not find any buyers and was dumped at sea in order to avoid customs toll.[6][7] With time, however, the mining of South American saltpeter became a profitable business (in 1859, England alone consumed 47,000 metric tons).[7] Chile fought the War of the Pacific (1879–1884) against the allies Peru and Bolivia and took over their richest deposits of saltpeter. In 1919, Ralph Walter Graystone Wyckoff determined its crystal structure using X-ray crystallography.
Occurrence[edit]
Advertisement for sodium nitrate fertilizer from Chile on a wall of a village in the Algarve area of Portugal
Mines of Chile, green is sodium nitrate area
The largest accumulations of naturally occurring sodium nitrate are found in Chile and Peru, where nitrate salts are bound within mineral deposits called caliche ore.[8] Nitrates accumulate on land through marine-fog precipitation and sea-spray oxidation/desiccation followed by gravitational settling of airborne NaNO3, KNO3, NaCl, Na2SO4, and I, in the hot-dry desert atmosphere.[9] El Niño/La Niña extreme aridity/torrential rain cycles favor nitrates accumulation through both aridity and water solution/remobilization/transportation onto slopes and into basins; capillary solution movement forms layers of nitrates; pure nitrate forms rare veins. For more than a century, the world supply of the compound was mined almost exclusively from the Atacama desert in northern Chile until, at the turn of the 20th century, German chemists Fritz Haber and Carl Bosch developed a process for producing ammonia from the atmosphere on an industrial scale (see Haber process). With the onset of World War I, Germany began converting ammonia from this process into a synthetic Chilean saltpeter, which was as practical as the natural compound in production of gunpowder and other munitions. By the 1940s, this conversion process resulted in a dramatic decline in demand for sodium nitrate procured from natural sources.
Chile still has the largest reserves of caliche, with active mines in such locations as Valdivia, María Elena and Pampa Blanca, and there it used to be called white gold.[4][5] Sodium nitrate, potassium nitrate, sodium sulfate and iodine are all obtained by the processing of caliche. The former Chilean saltpeter mining communities of Humberstone and Santa Laura were declared UNESCO World Heritage sites in 2005.
Synthesis[edit]
Sodium nitrate is also synthesized industrially by neutralizing nitric acid with sodium carbonate or sodium bicarbonate:
- 2 HNO3 + Na2CO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
or also by neutralizing it with sodium hydroxide (however, this reaction is very exothermic):
- HNO3 + NaOH → NaNO3 + H2O
or by mixing stoichiometric amounts of ammonium nitrate and sodium hydroxide, sodium bicarbonate or sodium carbonate:
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
Uses[edit]
Most sodium nitrate is used in fertilizers, where it supplies a water soluble form of nitrogen. Its use, which is mainly outside of high-income countries, is attractive since it does not alter the pH of the soil. Another major use is as a complement to ammonium nitrate in explosives. Molten sodium nitrate and its solutions with potassium nitrate have good thermal stability (up to 600 °C) and high heat capacities. These properties are suitable for thermally annealing metals and for storing thermal energy in solar applications.[10]
Food[edit]
Sodium nitrate is also a food additive used as a preservative and color fixative in cured meats and poultry; it is listed under its INS number 251 or E number E251. It is approved for use in the EU,[11] US[12] and Australia and New Zealand.[13] Sodium nitrate should not be confused with sodium nitrite, which is also a common food additive and preservative used, for example, in deli meats.
Thermal storage[edit]
Sodium nitrate has also been investigated as a phase-change material for thermal energy recovery, owing to its relatively high melting enthalpy of 178 J/g.[14][15] Examples of the applications of sodium nitrate used for thermal energy storage include solar thermal power technologies and direct steam generating parabolic troughs.[14]
Steel coating[edit]
Sodium nitrate is used in a steel coating process in which it forms a surface magnetite layer.[16]
Health concerns[edit]
Studies have shown a link between increased levels of nitrates and increased deaths from certain diseases including Alzheimer’s disease, diabetes mellitus, stomach cancer, and Parkinson’s disease: possibly through the damaging effect of nitrosamines on DNA; however, little has been done to control for other possible causes in the epidemiological results.[17] Nitrosamines, formed in cured meats containing sodium nitrate and nitrite, have been linked to gastric cancer and esophageal cancer.[18] Sodium nitrate and nitrite are associated with a higher risk of colorectal cancer.[19]
Substantial evidence in recent decades, facilitated by an increased understanding of pathological processes and science, exists in support of the theory that processed meat increases the risk of colon cancer and that this is due to the nitrate content. A small amount of the nitrate added to meat as a preservative breaks down into nitrite, in addition to any nitrite that may also be added. The nitrite then reacts with protein-rich foods (such as meat) to produce carcinogenic NOCs (nitroso compounds). NOCs can be formed either when meat is cured or in the body as meat is digested.[20]
However, several things complicate the otherwise straightforward understanding that «nitrates in food raise your risk of cancer»: Commonly consumed plants are well known to be rich sources of nitrates.[citation needed] In fact, exposure of nitrates from plants may even be higher than meat for most people.[citation needed] Processed meats have no fiber, vitamins, or phytochemical antioxidants, are high in sodium, may contain high fat, and are often fried or cooked at a temperature sufficient to degrade protein into nitrosamines. Nitrates are key intermediates and effectors in the primary vasculature signaling which is necessary for all mammals to survive.[21]
See also[edit]
- Sodium nitrite
References[edit]
- ^ Haynes, William M. (2016-06-22). CRC Handbook of Chemistry and Physics. CRC Press. ISBN 978-1-4987-5429-3.
- ^ «Sodium nitrate». PubChem. Retrieved 11 June 2021.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b «The Nitrate Towns of Chile». Atlas Obscura. Retrieved 27 May 2019.
- ^ a b Mutic, Anja (26 October 2012). «The ghost towns of northern Chile». Washington Post. Retrieved 27 May 2019.
- ^ S. H. Baekeland «Några sidor af den kemiska industrien» (1914) Svensk Kemisk Tidskrift, p. 140.
- ^ a b Friedrich Georg Wieck, Uppfinningarnas bok (1873, Swedish translation of Buch der Erfindungen), vol. 4, p. 473.
- ^ Stephen R. Bown, A Most Damnable Invention: Dynamite, Nitrates, and the Making of the Modern World, Macmillan, 2005, ISBN 0-312-32913-X, p. 157.
- ^ Arias, Jaime (24 Jul 2003). On the Origin of Saltpeter, Northern Chile Coast. International Union for Quaternary Research. Archived from the original on 4 March 2016. Retrieved 19 Aug 2018.
- ^ Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl (2000). «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ UK Food Standards Agency: «Current EU approved additives and their E Numbers». Retrieved 2011-10-27.
- ^ US Food and Drug Administration: «Listing of Food Additives Status Part II». Food and Drug Administration. Retrieved 2011-10-27.
- ^ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». Retrieved 2011-10-27.
- ^ a b Bauer, Thomas; Laing, Doerte; Tamme, Rainer (2011-11-15). «Characterization of Sodium Nitrate as Phase Change Material». International Journal of Thermophysics. 33 (1): 91–104. doi:10.1007/s10765-011-1113-9. ISSN 0195-928X. S2CID 54513228.
- ^ ICTAC Working Group; Sabbah, R. (France, Chairman); et al. (1999-06-14). «Reference materials for calorimetry and differential thermal analysis». Thermochimica Acta. 331 (2): 93–204. doi:10.1016/S0040-6031(99)00009-X. ISSN 0040-6031.
- ^ Fauzi, Ahmad Asyraf Bin Ahmad (2014). Production of Magnetite Thin Film Over Steel Substrate Using Hot Alkaline Nitrate Blackening Method. Universitat Politècnica de Catalunya. Escola Politècnica Superior d’Enginyeria de Vilanova i la Geltrú. Departament de Ciència dels Materials i Enginyeria Metal·lúrgica, 2014 (Grau en Enginyeria Mecànica).
- ^ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). «Epidemilogical trends strongly suggest exposures as etiologic agents in the pathogenesis of sporadic Alzheimer’s disease, diabetes mellitus, and non-alcoholic steatohepatitis». Journal of Alzheimer’s Disease. 17 (3): 519–29. doi:10.3233/JAD-2009-1070. PMC 4551511. PMID 19363256.
- ^ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21 Jul 2006). «Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence». World Journal of Gastroenterology. 12 (27): 4296–4303. doi:10.3748/wjg.v12.i27.4296. PMC 4087738. PMID 16865769. Archived from the original on 14 October 2018. Retrieved 4 November 2010.
- ^ Cross, AJ; Ferrucci, LM; Risch, A; et al. (2010). «A large prospective study of meat consumption and colorectal cancer risk: An investigation of potential mechanisms underlying this association». Cancer Research. 70 (6): 2406–14. doi:10.1158/0008-5472.CAN-09-3929. PMC 2840051. PMID 20215514.
- ^ «The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer», Archived 2019-07-26 at the Wayback Machine World Cancer Research Fund (2010)
- ^ Machha, Ajay; Schechter, Alan N. (August 2011). «Dietary nitrite and nitrate: a review of potential mechanisms of cardiovascular benefits». European Journal of Nutrition. 50 (5): 293–303. doi:10.1007/s00394-011-0192-5. ISSN 1436-6207. PMC 3489477. PMID 21626413.
Further reading[edit]
- Archer, Donald G. (2000). «Thermodynamic properties of the NaNO3 + H2O system». Journal of Physical and Chemical Reference Data. 29 (5): 1141–1156. Bibcode:2000JPCRD..29.1141A. doi:10.1063/1.1329317. ISSN 0047-2689.
- Barnum, Dennis (2003). «Some history of nitrates». Journal of Chemical Education. 80 (12): 1393–. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- Mullin, J. W. (1997). Crystallization. Butterworth-Heinemann. ISBN 978-0-7506-3759-6.
External links[edit]
- CHORI CO., LTD. :https://chori-mukifine.com/en/sodium-nitrate/
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sodium nitrate
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Sodium nitrate

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Sodium nitrate |
||
| Other names
Peru saltpeter |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.686 |
|
| EC Number |
|
|
| E number | E251 (preservatives) | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1498 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaNO3 | |
| Molar mass | 84.9947 g/mol | |
| Appearance | White powder or colorless crystals | |
| Odor | sweet | |
| Density | 2.257 g/cm3, solid | |
| Melting point | 308 °C (586 °F; 581 K) | |
| Boiling point | 380 °C (716 °F; 653 K) decomposes | |
|
Solubility in water |
73 g/100 g water (0 °C) 91.2 g/100 g water (25 °C)[1][2] 180 g/100 g water (100 °C) |
|
| Solubility | very soluble in ammonia, hydrazine soluble in alcohol slightly soluble in pyridine insoluble in acetone |
|
|
Magnetic susceptibility (χ) |
−25.6·10−6 cm3/mol | |
|
Refractive index (nD) |
1.587 (trigonal) 1.336 (rhombohedral) |
|
| Viscosity | 2.85 cP (317 °C) | |
| Structure | ||
|
Crystal structure |
trigonal and rhombohedral | |
| Thermochemistry | ||
|
Heat capacity (C) |
93.05 J/(mol K) | |
|
Std molar |
116 J/(mol K)[3] | |
|
Std enthalpy of |
−467 kJ/mol[3] | |
|
Gibbs free energy (ΔfG⦵) |
−365.9 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Harmful (Xn) Oxidant (O) |
|
| GHS labelling: | ||
|
Pictograms |
 
|
|
| NFPA 704 (fire diamond) |
1 0 0 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
3236 mg/kg | |
| Safety data sheet (SDS) | ICSC 0185 | |
| Related compounds | ||
|
Other anions |
Sodium nitrite | |
|
Other cations |
Lithium nitrate Potassium nitrate Rubidium nitrate Caesium nitrate |
|
|
Related compounds |
Sodium sulfate Sodium chloride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium nitrate is the chemical compound with the formula NaNO
3. This alkali metal nitrate salt is also known as Chile saltpeter (large deposits of which were historically mined in Chile)[4][5] to distinguish it from ordinary saltpeter, potassium nitrate. The mineral form is also known as nitratine, nitratite or soda niter.
Sodium nitrate is a white deliquescent solid very soluble in water. It is a readily available source of the nitrate anion (NO3−), which is useful in several reactions carried out on industrial scales for the production of fertilizers, pyrotechnics, smoke bombs and other explosives, glass and pottery enamels, food preservatives (esp. meats), and solid rocket propellant. It has been mined extensively for these purposes.
History[edit]
The first shipment of saltpeter to Europe arrived in England from Peru in 1820 or 1825, right after that country’s independence from Spain, but did not find any buyers and was dumped at sea in order to avoid customs toll.[6][7] With time, however, the mining of South American saltpeter became a profitable business (in 1859, England alone consumed 47,000 metric tons).[7] Chile fought the War of the Pacific (1879–1884) against the allies Peru and Bolivia and took over their richest deposits of saltpeter. In 1919, Ralph Walter Graystone Wyckoff determined its crystal structure using X-ray crystallography.
Occurrence[edit]
Advertisement for sodium nitrate fertilizer from Chile on a wall of a village in the Algarve area of Portugal
Mines of Chile, green is sodium nitrate area
The largest accumulations of naturally occurring sodium nitrate are found in Chile and Peru, where nitrate salts are bound within mineral deposits called caliche ore.[8] Nitrates accumulate on land through marine-fog precipitation and sea-spray oxidation/desiccation followed by gravitational settling of airborne NaNO3, KNO3, NaCl, Na2SO4, and I, in the hot-dry desert atmosphere.[9] El Niño/La Niña extreme aridity/torrential rain cycles favor nitrates accumulation through both aridity and water solution/remobilization/transportation onto slopes and into basins; capillary solution movement forms layers of nitrates; pure nitrate forms rare veins. For more than a century, the world supply of the compound was mined almost exclusively from the Atacama desert in northern Chile until, at the turn of the 20th century, German chemists Fritz Haber and Carl Bosch developed a process for producing ammonia from the atmosphere on an industrial scale (see Haber process). With the onset of World War I, Germany began converting ammonia from this process into a synthetic Chilean saltpeter, which was as practical as the natural compound in production of gunpowder and other munitions. By the 1940s, this conversion process resulted in a dramatic decline in demand for sodium nitrate procured from natural sources.
Chile still has the largest reserves of caliche, with active mines in such locations as Valdivia, María Elena and Pampa Blanca, and there it used to be called white gold.[4][5] Sodium nitrate, potassium nitrate, sodium sulfate and iodine are all obtained by the processing of caliche. The former Chilean saltpeter mining communities of Humberstone and Santa Laura were declared UNESCO World Heritage sites in 2005.
Synthesis[edit]
Sodium nitrate is also synthesized industrially by neutralizing nitric acid with sodium carbonate or sodium bicarbonate:
- 2 HNO3 + Na2CO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
or also by neutralizing it with sodium hydroxide (however, this reaction is very exothermic):
- HNO3 + NaOH → NaNO3 + H2O
or by mixing stoichiometric amounts of ammonium nitrate and sodium hydroxide, sodium bicarbonate or sodium carbonate:
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
Uses[edit]
Most sodium nitrate is used in fertilizers, where it supplies a water soluble form of nitrogen. Its use, which is mainly outside of high-income countries, is attractive since it does not alter the pH of the soil. Another major use is as a complement to ammonium nitrate in explosives. Molten sodium nitrate and its solutions with potassium nitrate have good thermal stability (up to 600 °C) and high heat capacities. These properties are suitable for thermally annealing metals and for storing thermal energy in solar applications.[10]
Food[edit]
Sodium nitrate is also a food additive used as a preservative and color fixative in cured meats and poultry; it is listed under its INS number 251 or E number E251. It is approved for use in the EU,[11] US[12] and Australia and New Zealand.[13] Sodium nitrate should not be confused with sodium nitrite, which is also a common food additive and preservative used, for example, in deli meats.
Thermal storage[edit]
Sodium nitrate has also been investigated as a phase-change material for thermal energy recovery, owing to its relatively high melting enthalpy of 178 J/g.[14][15] Examples of the applications of sodium nitrate used for thermal energy storage include solar thermal power technologies and direct steam generating parabolic troughs.[14]
Steel coating[edit]
Sodium nitrate is used in a steel coating process in which it forms a surface magnetite layer.[16]
Health concerns[edit]
Studies have shown a link between increased levels of nitrates and increased deaths from certain diseases including Alzheimer’s disease, diabetes mellitus, stomach cancer, and Parkinson’s disease: possibly through the damaging effect of nitrosamines on DNA; however, little has been done to control for other possible causes in the epidemiological results.[17] Nitrosamines, formed in cured meats containing sodium nitrate and nitrite, have been linked to gastric cancer and esophageal cancer.[18] Sodium nitrate and nitrite are associated with a higher risk of colorectal cancer.[19]
Substantial evidence in recent decades, facilitated by an increased understanding of pathological processes and science, exists in support of the theory that processed meat increases the risk of colon cancer and that this is due to the nitrate content. A small amount of the nitrate added to meat as a preservative breaks down into nitrite, in addition to any nitrite that may also be added. The nitrite then reacts with protein-rich foods (such as meat) to produce carcinogenic NOCs (nitroso compounds). NOCs can be formed either when meat is cured or in the body as meat is digested.[20]
However, several things complicate the otherwise straightforward understanding that «nitrates in food raise your risk of cancer»: Commonly consumed plants are well known to be rich sources of nitrates.[citation needed] In fact, exposure of nitrates from plants may even be higher than meat for most people.[citation needed] Processed meats have no fiber, vitamins, or phytochemical antioxidants, are high in sodium, may contain high fat, and are often fried or cooked at a temperature sufficient to degrade protein into nitrosamines. Nitrates are key intermediates and effectors in the primary vasculature signaling which is necessary for all mammals to survive.[21]
See also[edit]
- Sodium nitrite
References[edit]
- ^ Haynes, William M. (2016-06-22). CRC Handbook of Chemistry and Physics. CRC Press. ISBN 978-1-4987-5429-3.
- ^ «Sodium nitrate». PubChem. Retrieved 11 June 2021.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b «The Nitrate Towns of Chile». Atlas Obscura. Retrieved 27 May 2019.
- ^ a b Mutic, Anja (26 October 2012). «The ghost towns of northern Chile». Washington Post. Retrieved 27 May 2019.
- ^ S. H. Baekeland «Några sidor af den kemiska industrien» (1914) Svensk Kemisk Tidskrift, p. 140.
- ^ a b Friedrich Georg Wieck, Uppfinningarnas bok (1873, Swedish translation of Buch der Erfindungen), vol. 4, p. 473.
- ^ Stephen R. Bown, A Most Damnable Invention: Dynamite, Nitrates, and the Making of the Modern World, Macmillan, 2005, ISBN 0-312-32913-X, p. 157.
- ^ Arias, Jaime (24 Jul 2003). On the Origin of Saltpeter, Northern Chile Coast. International Union for Quaternary Research. Archived from the original on 4 March 2016. Retrieved 19 Aug 2018.
- ^ Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl (2000). «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ UK Food Standards Agency: «Current EU approved additives and their E Numbers». Retrieved 2011-10-27.
- ^ US Food and Drug Administration: «Listing of Food Additives Status Part II». Food and Drug Administration. Retrieved 2011-10-27.
- ^ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». Retrieved 2011-10-27.
- ^ a b Bauer, Thomas; Laing, Doerte; Tamme, Rainer (2011-11-15). «Characterization of Sodium Nitrate as Phase Change Material». International Journal of Thermophysics. 33 (1): 91–104. doi:10.1007/s10765-011-1113-9. ISSN 0195-928X. S2CID 54513228.
- ^ ICTAC Working Group; Sabbah, R. (France, Chairman); et al. (1999-06-14). «Reference materials for calorimetry and differential thermal analysis». Thermochimica Acta. 331 (2): 93–204. doi:10.1016/S0040-6031(99)00009-X. ISSN 0040-6031.
- ^ Fauzi, Ahmad Asyraf Bin Ahmad (2014). Production of Magnetite Thin Film Over Steel Substrate Using Hot Alkaline Nitrate Blackening Method. Universitat Politècnica de Catalunya. Escola Politècnica Superior d’Enginyeria de Vilanova i la Geltrú. Departament de Ciència dels Materials i Enginyeria Metal·lúrgica, 2014 (Grau en Enginyeria Mecànica).
- ^ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). «Epidemilogical trends strongly suggest exposures as etiologic agents in the pathogenesis of sporadic Alzheimer’s disease, diabetes mellitus, and non-alcoholic steatohepatitis». Journal of Alzheimer’s Disease. 17 (3): 519–29. doi:10.3233/JAD-2009-1070. PMC 4551511. PMID 19363256.
- ^ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21 Jul 2006). «Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence». World Journal of Gastroenterology. 12 (27): 4296–4303. doi:10.3748/wjg.v12.i27.4296. PMC 4087738. PMID 16865769. Archived from the original on 14 October 2018. Retrieved 4 November 2010.
- ^ Cross, AJ; Ferrucci, LM; Risch, A; et al. (2010). «A large prospective study of meat consumption and colorectal cancer risk: An investigation of potential mechanisms underlying this association». Cancer Research. 70 (6): 2406–14. doi:10.1158/0008-5472.CAN-09-3929. PMC 2840051. PMID 20215514.
- ^ «The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer», Archived 2019-07-26 at the Wayback Machine World Cancer Research Fund (2010)
- ^ Machha, Ajay; Schechter, Alan N. (August 2011). «Dietary nitrite and nitrate: a review of potential mechanisms of cardiovascular benefits». European Journal of Nutrition. 50 (5): 293–303. doi:10.1007/s00394-011-0192-5. ISSN 1436-6207. PMC 3489477. PMID 21626413.
Further reading[edit]
- Archer, Donald G. (2000). «Thermodynamic properties of the NaNO3 + H2O system». Journal of Physical and Chemical Reference Data. 29 (5): 1141–1156. Bibcode:2000JPCRD..29.1141A. doi:10.1063/1.1329317. ISSN 0047-2689.
- Barnum, Dennis (2003). «Some history of nitrates». Journal of Chemical Education. 80 (12): 1393–. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- Mullin, J. W. (1997). Crystallization. Butterworth-Heinemann. ISBN 978-0-7506-3759-6.
External links[edit]
- CHORI CO., LTD. :https://chori-mukifine.com/en/sodium-nitrate/
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sodium nitrate
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра |
| Химическая формула | NaNO3 |
| Физические свойства | |
| Отн. молек. масса | 84,99 а. е. м. |
| Плотность | 2,257 г/см³ |
| Термические свойства | |
| Температура плавления | 308 °C |
| Температура разложения | 380 °C |
| Безопасность | |
| Токсичность | соединение не токсично |
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 3 Применение
- 4 См. также
Свойства
Физические свойства
Бесцветные кристаллы, плотность 2,257 г/см3, tпл 308 °C (выше tпл разлагается на NaNO2 и O2). Растворимость (г в 100 г): в воде-72,7 (0°С), 87,6 (20°С), 124,7 (60°С), 176 (100°С); при 25 °С в этаноле-0,036, метаноле-0,41, пиридине-0,35;. Сильный окислитель. Природные месторождения находятся в Чили, Перу и ряде других стран.Температура плавления = 308 °C, плотность равна 2,26 г/см3. Окислитель. Молекулярная масса (по международным атомным массам 1985 г.) — 84,99. Канцероген
Химические свойства
- При 380°С разлагается с выделением кислорода и нитрита натрия:
- Может вступать в реакции с солями щелочных металлов стоящих в ряду активности металлов до натрия:
- Проявляет сильные окислительные свойства в твердом агрегатном состоянии. В растворах проявляет более восстановительные, нежели окислительные свойства. В процессе разложения выделяет кислород вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на хлорид ион):
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
См. также
- Получение нитрата натрия
- Нитрит натрия
- Натрий
- Нитрат калия
Введение
Вряд ли кто-нибудь из вас ничего не слышал о нитрате натрия. Его название нередко упоминается еще в школе, не то что в промышленности. Но только название! А что еще известно про натриевую селитру? Вот о чем мы поговорим в сегодняшней статье.
Определение
Нитрат натрия (формула NaNO3) является натриевой солью азотной кислоты. Его могут называть «натрием азотнокислым» или «натриевой/натронной/чилийской селитрой».
Свойства
Натрий азотнокислый представлен бесцветными длинными кристаллами, имеющими ромбоэдрическую или тригональную кристаллическую решетку. На вкус они являются очень солеными. В разных веществах растворяются по-разному, но лучше всего нитрат натрия «тает» в воде. При температуре 380оС данное соединение разлагается на азотистокислый натрий и кислород. Реакция выглядит так: 2NaNO3 => 2NaNO2 + O2. Также нитрат натрия может вступать в реакции обмена, вторым реагентом которых являются соли щелочных металлов. Одним из продуктов при этом всегда будет нитрат с растворимостью, значение которой будет гораздо ниже, чем у обсуждаемого сейчас вещества. Например, при взаимодействии натриевой селитры с хлоридом калия образуется нитрат калия и поваренная соль (хлорид натрия). В расплаве обсуждаемый нитрат проявляет сильные окислительные, а в растворе — восстановительные свойства. При его разложении выделяется кислород, и благодаря этому данное соединение может вступать в реакцию с неметаллами.
Получение
Данный нитрат можно получить несколькими способами:
Реакция азотной кислоты с металлом или оксидом натрия
При добавлении в азотную кислоту чистого натрия происходит реакция нейтрализации. Продуктами ее станут искомое вещество, вода, а также газообразные азот и его оксиды (I, II). Если к этой же кислоте добавить оксид натрия, то в результате получатся обсуждаемое сейчас соединение и вода.
Реакция азотной кислоты с кислыми солями или гидроксидом натрия
Если к HNO3 добавить кислую соль натрия (например, его гидрокарбонат), то образуются искомое вещество, вода и углекислый газ, который быстро улетучивается. Если же вторым реагентом станет гидроксид натрия, то, как в случае с его оксидом и азотной кислотой, получаются только нитрат натрия и H2O.
Реакция аммиачной селитры с кислыми солями или гидроксидом натрия
Азотную кислоту может с успехом заменить нитрат аммония. Во время его взаимодействия с гидроксидом натрия образуются искомое вещество, вода и газообразный аммиак, а при реакции с гидрокарбонатом натрия продуктами станут эти соединения и углекислый газ.
Реакция поваренной соли с нитратом серебра
В этом случае происходит реакция обмена, продуктами которой являются нитрат натрия и хлорид серебра.
Применение
Данное вещество используется в качестве ценного азотного удобрения. Без нитрата натрия не обходятся пиротехническая, пищевая, стекольная и металлообрабатывающая отрасли промышленности. Натриевая селитра добывается из природных залежей несколькими способами:
— выщелачивание данного вещества с помощью горячей воды и кристаллизации;
— абсорбция окислов азота с использованием раствора пищевой соды;
— реакция обмена, в которой участвуют сульфат/хлорид/карбонат натрия и кальциевая/аммиачная селитра.
Заключение
Вот какую важную роль играет азотнокислый натрий. Есть еще и другие вещества, без которых не обходится человек, но о них поговорим в другой раз.
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Свойства
Физические свойства
Бесцветные кристаллы, плотность 2,257 г/см3, tпл 308 °C (выше tпл разлагается на NaNO2 и O2). Растворимость (г в 100 г): в воде-72,7 (0°С), 87,6 (20°С), 124,7 (60°С), 176 (100°С); при 25 °С в этаноле-0,036, метаноле-0,41, пиридине-0,35;. Сильный окислитель. Природные месторождения находятся в Чили, Перу и ряде других стран.Температура плавления = 308 °C, плотность равна 2,26 г/см3. Окислитель. Молекулярная масса (по международным атомным массам 1985 г.) — 84,99. Канцероген
Химические свойства
- При 380°С разлагается с выделением кислорода и нитрита натрия:
- Может вступать в реакции с солями щелочных металлов стоящих в ряду активности металлов до натрия:
- Проявляет сильные окислительные свойства в твердом агрегатном состоянии. В растворах проявляет более восстановительные, нежели окислительные свойства. В процессе разложения выделяет кислород вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на хлорид ион):
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
См. также
- Получение нитрата натрия
- Нитрит натрия
- Натрий
- Нитрат калия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 октября 2020 года; проверки требуют 12 правок.
| Нитрат натрия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Нитрат натрия |
| Традиционные названия | Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
| Хим. формула | NaNO3 |
| Состояние | твёрдое |
| Молярная масса | 84,993 г/моль |
| Плотность | 2,257 г/см³ |
| Твёрдость | 2 |
| Поверхностное натяжение | 119 (320°C) 117 (350°C) 114 (400°C) Н/м |
| Динамическая вязкость | 2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
| Температура | |
| • плавления | 308 °C |
| • кипения | с разложением °C |
| • разложения | 380 °C |
| Мол. теплоёмк. | 67 Дж/(моль·К) |
| Энтальпия | |
| • образования | -257 кДж/моль |
| • плавления | 16 кДж/моль |
| Растворимость | |
| • в жидком аммиаке | 127 г/100 мл |
| • в воде | 91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
| • в гидразине | 100 (20°C) |
| Рег. номер CAS | 7631-99-4 |
| PubChem | 24268 |
| Рег. номер EINECS | 231-554-3 |
| SMILES |
[N+](=O)([O-])[O-].[Na+] |
| InChI |
InChI=1S/NO3.Na/c2-1(3)4;/q-1;+1 VWDWKYIASSYTQR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E251 |
| RTECS | WC5600000 |
| ChEBI | 63005 |
| Номер ООН | 1498 |
| ChemSpider | 22688 |
| ЛД50 | 3500 мг/кг (мыши, перорально) |
| Пиктограммы ECB | |
| NFPA 704 |
1 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Свойства[править | править код]
Физические свойства[править | править код]
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства[править | править код]
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.[источник не указан 3425 дней].
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение[править | править код]
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl—):
Применение[править | править код]
Применяется как удобрение; в пищевой[1], стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Примечания[править | править код]
Ссылки[править | править код]
- Производство нитрата натрия в Корее Архивная копия от 2 декабря 2021 на Wayback Machine
~ Urania ~
Просветленный
(24426)
12 лет назад
Зависит от формулы. И то, и другое существует.
Нитрит — соль азотистой кислоты HNO2 (нитрит натрия NaNO2)
Нитрид — соединения азота с менее электроотрицательными элементами, например с металлами (с тем же натрием) и с рядом неметаллов (нитрид натрия Na3N)
Нитрат натрия не продается в магазине: говорят, что с помощью его поджигают школы. Нитрат натрия очень полезный реактив, поэтому его нужно получить, к тому же с помощью него можно получить KNO3 который очень дорогой, дешевым способом.
1) Можно получить NaNO3 по реакции: Na2CO3 + 2NH4NO3 —> 2NaNO3 + (NH4)2CO3. Потом если кипятить раствор, карбонат аммония разложится и улетучится, а нитрат натрия остается только выпарить и использовать?
2) При какой t нужно прокаливать NaNO3, чтобы получить NaNO2 и кислород выделившийся не взорвался?3) Как и написано выше NaNO3 не продают ссылаясь на то, что поджигают здания. Я думаю, что речь идет о «дымовухах»(бумага пропитанная аммиачкой) и так и сказал, что типа это аммиачная селитра виновата, а не натриевая, но потом задумался: «Может действительно с NaNO3 что-то мутят?» Что делают с чилийской селитрой, чтобы там чето зажигалось?
(основные вопросы подчеркнуты)
Морфемный разбор слова:
Однокоренные слова к слову:
Нитрат натрия
| Нитрат натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра |
| Химическая формула | NaNO3 |
| Физические свойства | |
| Отн. молек. масса | 84,99 а. е. м. |
| Плотность | 2,257 г/см³ |
| Термические свойства | |
| Температура плавления | 308 °C |
| Температура разложения | 380 °C |
| Безопасность | |
| Токсичность | соединение не токсично |
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Содержание
Свойства
Физические свойства
Химические свойства
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
Также вместо азотной кислоты можно использовать нитрат аммония:
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Источник
Нитрат натрия ГОСТ 828-77
Кодекс Алиментариус E251 RTECS WC5600000 ChEBI 63005 Номер ООН 1498 ChemSpider 22688 ЛД50 3500 мг/кг (мыши, перорально) Токсичность
Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного.
Содержание
Свойства
Физические свойства
Растворимость (г в 100 г) в:
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
NaNO3 + KCl ⟶ KNO3 + NaCl NaNO3 + RbI ⟶ RbNO3 + NaI
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
Также вместо азотной кислоты можно использовать нитрат аммония:
Применение
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Источник
Формула нитрата натрия
Определение и формула нитрата натрия
Плавится без разложения, но разлагается при дальнейшем нагревании. Хорошо растворяется в воде (не гидролизуется). Кристаллогидратов не образует. Практически не растворяется в концентрированной азотной кислоте. Сильный окислитель при спекании.
Рис. 1. Нитрат натрия. Внешний вид.
Химическая формула нитрата натрия
Химическая формула нитрата натрия NaNO3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества (Ar(Na) =23а.е.м., Ar(N) = 14 а.е.м., Ar(O) = 16 а.е.м.):
Mr(NaNO3) = 23 + 14 + 3×16 = 23 + 14 + 48 = 85.
Структурная (графическая) формула нитрата натрия
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Ниже представлена графическая формула нитрата натрия:
Ионная формула
Нитрат натрия электролит, поэтому он способен диссоциировать в водном растворе на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде: |
Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа:
n(CO2) = 5,6 / 22,4 = 0,25 моль.
Рассчитаем молярную массу предельной одноосновной кислоты:
Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода):
M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46;
14n + 46 = 102 г/моль;
Значит молекулярная формула предельной одноосновной кислоты C4H9COOH.
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде: |
Рассчитаем количество вещества хлороводорода:
n(HCl) = 1,2 / 22,4 = 0,05 моль.
Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль.
Рассчитаем молярную массу алкена:
Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода):
Значит молекулярная формула алкена C4H8.
Источник
Нитрат натрия, характеристика, свойства и применение
Нитрат натрия, характеристика, свойства и применение.
Нитрат натрия – неорганическое вещество, имеет химическую формулу NaNO3.
Краткая характеристика нитрата натрия:
Нитрат натрия – неорганическое вещество белого цвета.
Химическая формула нитрата натрия NaNO3.
Нитрат натрия – неорганическое химическое соединение, соль азотной кислоты и натрия.
Хорошо растворяется в воде, жидком аммиаке, перекиси водорода. Плохо растворим в этаноле, метаноле. Не растворим в ацетоне.
Гигроскопичен. Кристаллогидратов не образует.
Нитрат натрия токсичен, по степени воздействия на организм человека относится к умеренно опасным веществам (3-й класс опасности по ГОСТ 12.1.007).
Наиболее крупные месторождения природного нитрата натрия находятся в Чили и Перу.
В пищевой промышленности нитрат натрия зарегистрирован как пищевая добавка Е251 и используется как консервант и фиксатор окраски. В некоторых странах нитрат натрия запрещен как пищевая добавка.
Физические свойства нитрата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaNO3 |
| Синонимы и названия иностранном языке | sodium nitrate (англ.) |
натрий азотнокислый (рус.)
Химические свойства нитрата натрия. Химические реакции нитрата натрия:
Источник
Описание нитрата натрия и химическая формула селитры, правила применения
Нитратом натрия называют подкормку, которая отличается выраженными щелочными характеристиками и сильной окислительной активностью. Ее также называют азотнокислым натрием или натриевой селитрой. Состав часто применяется в сельском хозяйстве для улучшения структуры грунта. Благодаря этому он становится пригоден для культивации различных растений. При этом важно применять состав правильно.
Описание вещества
Какие физические свойства проявляет
Нитрат натрия – это далеко не единственное название вещества. Для обозначения этого средства часто применяют такие понятия, как «натриевая селитра» или «азотнокислый натрий». Также его нередко называют чилийской селитрой.
Сегодня соль обычно получают в качестве побочного продукта, который формируется вследствие получения азотной кислоты из аммиака. Удобрение легко смешивается с обычной водой. По мере повышения температуры растворимость увеличивается. При +20 градусах в 100 миллилитрах воды растворяется 87,6 грамма порошка, а при +100 градусах – 176 граммов.
Основные химические свойства
Формула натриевой селитры – NaNO3. Вещество поглощает из воздуха влагу, потому оно сильно слеживается. При этом наблюдаются структурные изменения, а мелкие кристаллы – превращаются в большие. В сухом помещении соль не слеживается и сохраняет свою рассыпчатость. Именно в таком виде ее проще всего вносить в грунт.
В земле азотнокислый натрий распадается на катион Na+ и анион NO3-. Нитрат ион усваивается исключительно биологическим способом. Это происходит осенью и зимой. Однако в силу отсутствия биологического поглощения вещество не остается в почве. Это приводит к потерям азота, особенно на легких по структуре типах почвы. Эта особенность не позволяет применять состав для внесения осенью. При необходимости предзимнего внесения дозировку повышают.
Главная польза и возможный вред
Вещество приносит растениям и грунту большую пользу. К его главным преимуществам относят следующее:
Недостатком вещества считается невозможность его применения в осеннее время года. В этом случае оно легко вымывается и не приносит пользы.
Где применяется
Лишь определенный класс натриевой селитры может применяться в сельском хозяйстве, а именно – СХ. В качестве добавки к составу для удобрений запрещено применять марку А. Ее главным назначением считаются химическая, стекольная, металлообрабатывающая отрасли промышленности. Класс Б обладает свойствами нитрата натрия. Они будут полезны для грунта и растений, однако основным назначением этого вида селитры считается осветление стекол и травление металлов.
Чтобы применение вещества приносило настоящую пользу, требуется четко соблюдать инструкцию и выполнить тест на наличие нитратов.
При использовании состава важно учитывать, что он представляет собой сильный окислитель. Потому сочетать его вещество с некоторыми препаратами нельзя.
Можно ли приготовить натриевую селитру самостоятельно
Чтобы сделать препарат своими руками, рекомендуется взять такие компоненты:
Для приготовления подкормки стоит сделать следующее:
Не стоит заниматься приготовлением средства в закрытом помещении. Испарения аммиачной селитры плохо выветриваются и могут оседать на предметах интерьерах. В результате человек будет получать систематическое отравление. Готовить состав рекомендуется на свежем воздухе. При этом важно периодически отходить от емкости с кипящим составом.
Правила использования
Нитрат натрия можно вносить под любые растения. Исключением считаются лишь те культуры, которые не требуют большого количества натрия в качестве питательного вещества. На дозировку влияет количество азота в почве, погода, климат, разновидность растения.
Норму натриевой селитры на 1 квадратный метр требуется в каждом конкретном случае рассчитывать индивидуально:
При использовании натриевой селитры в личных подсобных хозяйствах ее стоит вносить под перекопку осенью – по 1-2 килограмму на сотку. Весной рекомендуется использовать по 500 граммов вещества на 1 сотку.
Для кустарников требуется 60 граммов средства на 1 лунку. Также разрешается распределять порошок в приствольных кругах. В этом случае на 1 квадратный метр рекомендуется использовать по 15-30 граммов средства. На 1 взрослое дерево максимальная дозировка составляет максимум 250 граммов.
Существуют ли противопоказания и срок годности
Нитрат натрия не стоит использовать на солончаках или в засоленном грунте. В этом случае рекомендуется выбрать другой препарат с аналогичными свойствами. При комбинированном применении вещество нельзя сочетать с перегноем и средствами на основе фосфора и калия. Также препарат запрещено применять в телицах.
Срок хранения натриевой селитры не ограничен. Ее разрешается держать исключительно в заводской упаковке, которая не пропускает влагу. Нельзя хранить рядом органические подкормки, пищевые продукты и бытовые средства. Помимо этого, вещество должно находиться вне зоны доступа детей и домашних животных.
При нагревании подкормки есть вероятность взрыва или возгорания. Потому препарат требуется изолировать от горючих средств и герметично закрыть. Мешки с порошком должны находиться на поддонах.
Техника безопасности и первая помощь при интоксикации
При попадании нитрата натрия на кожу есть риск ее раздражения. Чтобы избежать подобных проблем, при работе с веществом требуется использовать резиновые перчатки. После завершения процедур руки рекомендуется тщательно вымыть.
Немаловажное значение имеет использование очков и респиратора. Нитрат натрия вреден для людей. Он может представлять серьезную опасность при вдыхании и попадании на слизистые оболочки. Пыль оказывает раздражающий эффект и может стать причиной ожога.
При отравлении натриевой селитрой появляются такие признаки:
При появлении таких симптомов следует сразу обратиться к врачу. В качестве первой помощи пострадавшего требуется вывести на свежий воздух и переодеть. Кожу и глаза рекомендуется тщательно промыть холодной водой. При попадании вещества в желудок требуется сделать промывание. Для этого нужно принять 6-7 таблеток активированного угля и запить водой. Через 20 минут рекомендуется спровоцировать рвоту.
Нитрат натрия представляет собой эффективное азотное удобрение, которое применяется для подкормки всех растений. Также его можно использовать для подщелачивания грунта. Чтобы средство дало нужный эффект, важно придерживаться инструкции по его применению.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется нитрат натрия в химии формула, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется нитрат натрия в химии формула», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
|
Нитрат натрия |
|
|---|---|
|
|
|
| Систематическое наименование |
Нитрат натрия |
| Традиционные названия | Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
| Хим. формула | NaNO3 |
| Состояние | твёрдое |
| Молярная масса | 84,993 г/моль |
| Плотность | 2,257 г/см³ |
| Твёрдость | 2 |
| Поверхностное натяжение | 119 (320°C) 117 (350°C) 114 (400°C) Н/м |
| Динамическая вязкость | 2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
| Т. плав. | 308 °C |
| Т. кип. | с разложением °C |
| Т. разл. | 380 °C |
| Мол. теплоёмк. | 67 Дж/(моль·К) |
| Энтальпия образования | -257 кДж/моль |
| Энтальпия плавления | 16 кДж/моль |
| Растворимость в жидком аммиаке | 127 г/100 мл |
| Растворимость в воде | 91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
| Растворимость в гидразине | 100 (20°C) |
| ГОСТ | ГОСТ 828-77 ГОСТ 4168-79 ГОСТ 4197-74 |
| Рег. номер CAS | 7631-99-4 |
| PubChem | 24268 |
| Рег. номер EINECS | 231-554-3 |
| SMILES |
[N+](=O)([O-])[O-].[Na+] |
| InChI |
1S/NO3.Na/c2-1(3)4;/q-1;+1 VWDWKYIASSYTQR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E251 |
| RTECS | WC5600000 |
| ChEBI | 63005 |
| Номер ООН | 1498 |
| ChemSpider | 22688 |
| ЛД50 | 3500 мг/кг (мыши, перорально) |
| Токсичность |
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат натрия (азотнокислый натрий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 3 Применение
Свойства
Физические свойства
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,7 (60°С), 176,0 (100°С)
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
- 2NaNO3 ⟶ 2NaNO2 + O2↑
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
- NaNO3 + KCl ⟶ KNO3 + NaCl
- NaNO3 + RbI ⟶ RbNO3 + NaI
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
- 2NaNO3 + S ⟶ 2NaNO2 + SO2↑
- 2NaNO3 + C ⟶ 2NaNO2 + CO2↑
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- 21Na + 26 HNO3 ⟶ 21NaNO3 + NO↑ + N2O↑ + N2↑ + 13H2O
- Na2O + 2HNO3 ⟶ 2NaNO3 + H2O
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
- NaOH + HNO3 ⟶ NaNO3 + H2O
- NaHCO3 + HNO3 ⟶ NaNO3 + CO2↑ + H2O
Также вместо азотной кислоты можно использовать нитрат аммония:
- NaOH + NH4NO3 ⟶ NaNO3 + NH3↑ + H2O
- NaHCO3 + NH4NO3 ⟶ NaNO3 + NH3↑ + CO2↑ + H2O
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl—):
- AgNO3 + NaCl ⟶ NaNO3 + AgCl↓
Применение
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
|
Соединения натрия |
|---|
|
|
Нитраты |
|
|---|---|
|
| Нитрат натрия | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат натрия |
| Традиционные названия |
Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
| Хим. формула | NaNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 84,993 г/моль |
| Плотность | 2,257 г/см³ |
| Твёрдость | 2 |
| Поверхностное натяжение |
119 (320°C) 117 (350°C) 114 (400°C) Н/м |
| Динамическая вязкость |
2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
| Термические свойства | |
| Температура | |
| • плавления | 308 °C |
| • кипения | с разложением °C |
| • разложения | 380 °C |
| Мол. теплоёмк. | 67 Дж/(моль·К) |
| Энтальпия | |
| • образования | -257 кДж/моль |
| • плавления | 16 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в жидком аммиаке | 127 г/100 мл |
| • в воде |
91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
| • в гидразине | 100 (20°C) |
| Классификация | |
| Рег. номер CAS | 7631-99-4 |
| RTECS | WC5600000 |
| Номер ООН | 1498 |
| Безопасность | |
| ЛД50 | 3500 мг/кг (мыши, перорально) |
| Пиктограммы ECB |
|
| NFPA 704 |
0 1 0 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Свойства
Физические свойства
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
- [math]displaystyle{ mathsf{ 2NaNO_3 longrightarrow 2NaNO_2 + O_2uparrow} }[/math]
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
- [math]displaystyle{ mathsf{ NaNO_3 + KCl longrightarrow KNO_3 + NaCl} }[/math]
- [math]displaystyle{ mathsf{ NaNO_3 + RbI longrightarrow RbNO_3 + NaI} }[/math]
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.[источник не указан 3680 дней].
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
- [math]displaystyle{ mathsf{ 2NaNO_3 + S longrightarrow 2NaNO_2 + SO_2uparrow} }[/math]
- [math]displaystyle{ mathsf{ 2NaNO_3 + C longrightarrow 2NaNO_2 + CO_2uparrow} }[/math]
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Окисляет концентрированные HI, HBr и HCl до свободных галогенов:
[math]displaystyle{ mathsf{2NaNO_3 + 8HI longrightarrow 2NaI + 3I_2downarrow + 2NOuparrow + 4H_2O} }[/math]
[math]displaystyle{ mathsf{2NaNO_3 + 8HBr rightarrow 2NaBr + 3Br_2 + 2NOuparrow + 4H_2O} }[/math]
[math]displaystyle{ mathsf{2NaNO_3 + 8HCl rightleftarrows 2NaCl + 2Cl_2uparrow + 2NOCluparrow + 4H_2O} }[/math]
[math]displaystyle{ mathsf{2NaNO_3 + 8HCl xrightarrow{^ot} 2NaCl + 3Cl_2uparrow + 2NOuparrow + 4H_2O} }[/math]
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- [math]displaystyle{ mathsf{ 21Na + 26 HNO_3 longrightarrow 21NaNO_3 + NOuparrow + N_2Ouparrow + N_2uparrow + 13H_2O} }[/math]
- [math]displaystyle{ mathsf{ Na_2O + 2HNO_3 longrightarrow 2NaNO_3 + H_2O} }[/math]
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
- [math]displaystyle{ mathsf{ NaOH + HNO_3 longrightarrow NaNO_3 + H_2O} }[/math]
- [math]displaystyle{ mathsf{ NaHCO_3 + HNO_3 longrightarrow NaNO_3 + CO_2uparrow + H_2O} }[/math]
Также вместо азотной кислоты можно использовать нитрат аммония:
- [math]displaystyle{ mathsf{ NaOH + NH_4NO_3 longrightarrow NaNO_3 + NH_3uparrow + H_2O} }[/math]
- [math]displaystyle{ mathsf{ NaHCO_3 + NH_4NO_3 longrightarrow NaNO_3 + NH_3uparrow + CO_2uparrow + H_2O} }[/math]
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl—):
- [math]displaystyle{ mathsf{ AgNO_3 + NaCl longrightarrow NaNO_3 + AgCldownarrow} }[/math]
Применение
Применяется как удобрение; в пищевой[1], стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Примечания
- ↑ OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite Архивная копия от 6 марта 2015 на Wayback Machine / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
Ссылки
- Производство нитрата натрия в Корее Архивная копия от 2 декабря 2021 на Wayback Machine
Поиск химических веществ по названиям или формулам.
Физические свойства
Нитрат натрия NaNO3 — соль щелочного металла натрия и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 84,99; относительная плотность для тв. и ж. состояния d = 2,266; tпл = 306,5º C;
Способ получения
1. Нитрат натрия можно получить путем взаимодействия гидроксида натрия и разбавленной азотной кислоты, образуется нитрат натрия и вода:
NaOH + HNO3 = NaNO3 + H2O
2. В результате взаимодействия горячего гидроксида натрия, оксида азота (IV) и кислорода образуется нитрат натрия и вода:
4NaOH + 4NO2 + O2 = 4NaNO3 + 2H2O
3. В результате реакции между горячим гидроксидом натрия, оксидом натрия (IV) и кислородом, происходит образование нитрата натрия и воды:
4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
4. При комнатной температуре, в результате взаимодействия оксида азота (IV) и натрия образуется нитрат натрия и газ оксид азота (II):
2NO2 + Na = NO↑ + NaNO3
5. При смешивании горячего пероксида водорода и нитрита азота происходит образование нитрата натрия и воды:
NaNO2 + H2O2 = NaNO3 + H2O
Качественная реакция
Качественная реакция на нитрат натрия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат натрия образует сульфат натрия, нитрат меди, газ оксид азота и воду:
NaNO3 + H2SO4 + Cu = Na2SO4 + Cu(NO3)2 + NO2↑ + H2O
Химические свойства
1. Hитрат натрия разлагается при температуре 380–500º С с образованием нитрита натрия и кислорода:
2NaNO3 = 2NaNO2 + O2
2. Нитрат натрия может реагировать с простыми веществами:
2.1. Нитрат натрия реагирует со свинцом при температуре выше 350 ºС. При этом образуется нитрит натрия и оксид свинца:
NaNO3 + Pb = NaNO2 + PbO
2.2. Нитрат натрия реагирует при комнатной температуре с цинком и разбавленной хлороводородной кислотой с образованием нитрита натрия и воды:
NaNO3 + Zn + 2HCl = NaNO2 + ZnCl2 + H2O,
| Нитрат натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра |
| Химическая формула | NaNO3 |
| Физические свойства | |
| Отн. молек. масса | 84,99 а. е. м. |
| Плотность | 2,257 г/см³ |
| Термические свойства | |
| Температура плавления | 308 °C |
| Температура разложения | 380 °C |
| Безопасность | |
| Токсичность | соединение не токсично |
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 3 Применение
- 4 См. также
Свойства
Физические свойства
Бесцветные кристаллы, плотность 2,257 г/см3, tпл 308 °C (выше tпл разлагается на NaNO2 и O2). Растворимость (г в 100 г): в воде-72,7 (0°С), 87,6 (20°С), 124,7 (60°С), 176 (100°С); при 25 °С в этаноле-0,036, метаноле-0,41, пиридине-0,35;. Сильный окислитель. Природные месторождения находятся в Чили, Перу и ряде других стран.Температура плавления = 308 °C, плотность равна 2,26 г/см3. Окислитель. Молекулярная масса (по международным атомным массам 1985 г.) — 84,99. Канцероген
Химические свойства
- При 380°С разлагается с выделением кислорода и нитрита натрия:
- Может вступать в реакции с солями щелочных металлов стоящих в ряду активности металлов до натрия:
- Проявляет сильные окислительные свойства в твердом агрегатном состоянии. В растворах проявляет более восстановительные, нежели окислительные свойства. В процессе разложения выделяет кислород вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на хлорид ион):
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
См. также
- Получение нитрата натрия
- Нитрит натрия
- Натрий
- Нитрат калия
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Нитрат натрия
Из Википедии — свободной энциклопедии
| Нитрат натрия | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Нитрат натрия | |
| Традиционные названия |
Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
|
| Хим. формула | NaNO3 | |
| Физические свойства | ||
| Состояние | твёрдое | |
| Молярная масса | 84,993 г/моль | |
| Плотность | 2,257 г/см³ | |
| Твёрдость | 2 | |
| Поверхностное натяжение |
119 (320°C) 117 (350°C) 114 (400°C) Н/м |
|
| Динамическая вязкость |
2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
|
| Термические свойства | ||
| Температура | ||
| • плавления | 308 °C | |
| • кипения | с разложением °C | |
| • разложения | 380 °C | |
| Мол. теплоёмк. | 67 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | -257 кДж/моль | |
| • плавления | 16 кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в жидком аммиаке | 127 г/100 мл | |
| • в воде |
91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
|
| • в гидразине | 100 (20°C) | |
| Классификация | ||
| Рег. номер CAS | 7631-99-4 | |
| PubChem | 24268 | |
| Рег. номер EINECS | 231-554-3 | |
| SMILES |
[N+](=O)([O-])[O-].[Na+] |
|
| InChI |
InChI=1S/NO3.Na/c2-1(3)4;/q-1;+1 VWDWKYIASSYTQR-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E251 | |
| RTECS | WC5600000 | |
| ChEBI | 63005 | |
| Номер ООН | 1498 | |
| ChemSpider | 22688 | |
| Безопасность | ||
| ЛД50 | 3500 мг/кг (мыши, перорально) | |
| Пиктограммы ECB |
|
|
| NFPA 704 |
0 1 0 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Свойства
Физические свойства
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.[источник не указан 3719 дней].
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Окисляет концентрированные HI, HBr и HCl до свободных галогенов:




Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl—):
Применение
Применяется как удобрение; в пищевой[1], стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Примечания
- ↑ OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite Архивная копия от 6 марта 2015 на Wayback Machine / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
Ссылки
- Производство нитрата натрия в Корее Архивная копия от 2 декабря 2021 на Wayback Machine
Эта страница в последний раз была отредактирована 19 сентября 2022 в 02:15.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.