НИКЕЛЯ НИТРАТ
- НИКЕЛЯ НИТРАТ
-
Ni(NO3)2, зеленые кристаллы кубич. сингонии (а = 0,73 нм); С 0p 86 ДжДмольХК); DH0oбр Ч401,5 кДж/моль. При нагр. разлагается вначале до Ni(NO2)2 при 200-250 °С, а затем при 300-350 °С-до NiOx> (х= 1-1,5). Р-римость в воде (г в 100 г): 79,2 (0°С), 100 (25 °С), 139,2 (50 oC), 180,1 (75 °С). Раств. в ацетонитриле, ДМФА, ДМСО и др. полярных р-рителях. Из водного р-ра кристаллизуются гидраты Н. н., содержащие 9, 6, 4 и 2 молекулы Н 2 О при концентрациях р-ра соотв. 36-39, 40-58, 60-66 и 68-71% по массе.
Г е к с а г и д р а т Ni(NO3)2.6H2O-зеленые кристаллы триклинной сингонии ( а =0,7694 нм, b= 1,1916 нм, с = =0,5817 н м, a = 102,3°, b = 102,5°, g = 105,9°, пространств. группа Р1). Т. пл. 54 °С (инконгруэнтно); плотн. 2,04 г/см 3; C0p 462,3 ДжДмоль . К); DH0 пл 41,4 кДж/моль, DH0oбр -2215,0 кДж/моль; S0298 511,3 Дж/(моль . К).
При нагр. гидраты Н. н. вначале частично дегидратируют-ся, выше 150 °С разлагаются с образованием гидроксосолей переменного состава, конечный продукт разложения-NiOx.
Безводный Н. н. получают растворением NiCl2 в смеси N2O4 или N2O5 с орг. р-рителем с послед. отгонкой из реакц. смеси оксидов азота и р-рителя; кристаллогидраты-обработкой Ni, его оксида, гидроксида или карбоната разб. HNO3 с послед. кристаллизацией. Применяют Н. н. для получения др. соед. Ni и никельсодержащих катализаторов, как компонент электролитов для нанесения покрытий Ni на металлы, шихты в произ-ве цветной керамики.
П. М. Чукуров.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Полезное
Смотреть что такое «НИКЕЛЯ НИТРАТ» в других словарях:
-
Нитрат никеля(II) — Нитрат никеля(II) … Википедия
-
Нитрат аммония — Нитрат аммония … Википедия
-
Нитрат калия — Нитрат калия … Википедия
-
Нитрат натрия — Нитрат натрия … Википедия
-
Нитрат бария — Нитрат бария … Википедия
-
Нитрат лития — Нитрат лития … Википедия
-
Нитрат стронция — Общие … Википедия
-
Нитрат алюминия — Нитрат алюминия … Википедия
-
Нитрат кальция — Нитрат кальция … Википедия
-
Нитрат актиния(III) — Общие Систематическое наименование Нитрат актиния (III) Традиционные названия Нитрат актиния Химическая формула Ac(NO3)3 Эмпирическая формула Ac(NO3)3 … Википедия
From Wikipedia, the free encyclopedia
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Nickel(II) nitrate |
|
| Other names
Nickel nitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.032.774 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 2725 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ni(NO3)2 |
| Molar mass | 182.703 g/mol (anhydrous) 290.79 g/mol (hexahydrate) |
| Appearance | emerald green hygroscopic solid |
| Odor | odorless |
| Density | 2.05 g/cm3 (hexahydrate) |
| Melting point | 56.7 °C (134.1 °F; 329.8 K) (hexahydrate) |
| Boiling point | 136.7 °C (278.1 °F; 409.8 K) (hexahydrate) |
|
Solubility in water |
243 (hexahydrate) g/100ml (0 °C)[1] |
| Solubility | soluble in ethanol |
|
Magnetic susceptibility (χ) |
+4300.0·10−6 cm3/mol (+6 H2O) |
|
Refractive index (nD) |
1.422 (hexahydrate) |
| Structure | |
|
Crystal structure |
monoclinic (hexahydrate) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
    
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H302, H315, H317, H318, H332, H334, H341, H350, H360, H372, H410 |
|
Precautionary statements |
P201, P202, P210, P220, P221, P260, P261, P264, P270, P271, P272, P273, P280, P281, P285, P301+P312, P302+P352, P304+P312, P304+P340, P304+P341, P305+P351+P338, P308+P313, P310, P312, P314, P321, P330, P332+P313, P333+P313, P342+P311, P362, P363, P370+P378, P391, P405, P501 |
| NFPA 704 (fire diamond) |
2 0 0 OX |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1620 mg/kg (oral, rat) |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Nickel(II) sulfate Nickel(II) chloride |
|
Other cations |
Palladium(II) nitrate |
|
Related compounds |
Cobalt(II) nitrate Copper(II) nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Nickel nitrate is the inorganic compound Ni(NO3)2 or any hydrate thereof. The anhydrous form is not commonly encountered, thus «nickel nitrate» usually refers to nickel(II) nitrate hexahydrate. The formula for this species is written in two ways: Ni(NO3)2.6H2O and, more descriptively [Ni(H2O)6](NO3)2. The latter formula indicates that the nickel(II) center is surrounded by six water molecules in this hydrated salt. In the hexahydrate, the nitrate anions are not bonded to nickel. Also known are three other hydrates: Ni(NO3)2.9H2O, Ni(NO3)2.4H2O, and Ni(NO3)2.2H2O. Anhydrous Ni(NO3)2 is also known.[2]
It is prepared by the reaction of nickel oxide with nitric acid:
- NiO + 2 HNO3 + 5 H2O → Ni(NO3)2.6H2O
The anhydrous nickel nitrate is typically not prepared by the heating the hydrates. Rather is generated by reaction of hydrates with dinitrogen pentoxide or of nickel carbonyl with dinitrogen tetroxide:[2]
- Ni(CO)4 + 2 N2O4 → Ni(NO3)2 + 2 NO + 4 CO
The hydrated nitrate is often used as a precursor to supported nickel catalysts.[2]
Structure[edit]
Nickel(II) compounds with oxygenated ligands often feature octahedral coordination geometry. Two polymorphs of the tetrahydrate Ni(NO3)2.4H2O have been crystallized. In one the monodentate nitrate ligands are trans[3] while in the other they are cis.[4]
Safety[edit]
Like other nitrates, nickel nitrate is oxidizing. It is also irritating to the eyes, skin and, upon inhalation of the dust, respiratory tract. It may cause skin allergy. Nickel nitrate is a carcinogen, along with most other nickel compounds. The nickel ion is also toxic to aquatic organisms.
Uses[edit]
Nickel(II) nitrate is primarily used in electrotyping and electroplating of metallic nickel.
References[edit]
- ^ Perry’s Chem Eng Handbook, 7th Ed
- ^ a b c Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David; Beyersmann, Detmar (2005). «Nickel Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_235.pub2.
- ^ Morosin, B.; Haseda, T. (1979). «Crystal Structure of the β Form of Ni(NO3)2.4H2O». Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 35 (12): 2856–2858. doi:10.1107/S0567740879010827.
- ^ Gallezot, P.; Weigel, D.; Prettre, M. (1967). «Structure du Nitrate de Nickel Tétrahydraté». Acta Crystallographica. 22 (5): 699–705. doi:10.1107/S0365110X67001392.
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Nickel(II) nitrate |
|
| Other names
Nickel nitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.032.774 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 2725 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ni(NO3)2 |
| Molar mass | 182.703 g/mol (anhydrous) 290.79 g/mol (hexahydrate) |
| Appearance | emerald green hygroscopic solid |
| Odor | odorless |
| Density | 2.05 g/cm3 (hexahydrate) |
| Melting point | 56.7 °C (134.1 °F; 329.8 K) (hexahydrate) |
| Boiling point | 136.7 °C (278.1 °F; 409.8 K) (hexahydrate) |
|
Solubility in water |
243 (hexahydrate) g/100ml (0 °C)[1] |
| Solubility | soluble in ethanol |
|
Magnetic susceptibility (χ) |
+4300.0·10−6 cm3/mol (+6 H2O) |
|
Refractive index (nD) |
1.422 (hexahydrate) |
| Structure | |
|
Crystal structure |
monoclinic (hexahydrate) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
    
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H302, H315, H317, H318, H332, H334, H341, H350, H360, H372, H410 |
|
Precautionary statements |
P201, P202, P210, P220, P221, P260, P261, P264, P270, P271, P272, P273, P280, P281, P285, P301+P312, P302+P352, P304+P312, P304+P340, P304+P341, P305+P351+P338, P308+P313, P310, P312, P314, P321, P330, P332+P313, P333+P313, P342+P311, P362, P363, P370+P378, P391, P405, P501 |
| NFPA 704 (fire diamond) |
2 0 0 OX |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1620 mg/kg (oral, rat) |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Nickel(II) sulfate Nickel(II) chloride |
|
Other cations |
Palladium(II) nitrate |
|
Related compounds |
Cobalt(II) nitrate Copper(II) nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Nickel nitrate is the inorganic compound Ni(NO3)2 or any hydrate thereof. The anhydrous form is not commonly encountered, thus «nickel nitrate» usually refers to nickel(II) nitrate hexahydrate. The formula for this species is written in two ways: Ni(NO3)2.6H2O and, more descriptively [Ni(H2O)6](NO3)2. The latter formula indicates that the nickel(II) center is surrounded by six water molecules in this hydrated salt. In the hexahydrate, the nitrate anions are not bonded to nickel. Also known are three other hydrates: Ni(NO3)2.9H2O, Ni(NO3)2.4H2O, and Ni(NO3)2.2H2O. Anhydrous Ni(NO3)2 is also known.[2]
It is prepared by the reaction of nickel oxide with nitric acid:
- NiO + 2 HNO3 + 5 H2O → Ni(NO3)2.6H2O
The anhydrous nickel nitrate is typically not prepared by the heating the hydrates. Rather is generated by reaction of hydrates with dinitrogen pentoxide or of nickel carbonyl with dinitrogen tetroxide:[2]
- Ni(CO)4 + 2 N2O4 → Ni(NO3)2 + 2 NO + 4 CO
The hydrated nitrate is often used as a precursor to supported nickel catalysts.[2]
Structure[edit]
Nickel(II) compounds with oxygenated ligands often feature octahedral coordination geometry. Two polymorphs of the tetrahydrate Ni(NO3)2.4H2O have been crystallized. In one the monodentate nitrate ligands are trans[3] while in the other they are cis.[4]
Safety[edit]
Like other nitrates, nickel nitrate is oxidizing. It is also irritating to the eyes, skin and, upon inhalation of the dust, respiratory tract. It may cause skin allergy. Nickel nitrate is a carcinogen, along with most other nickel compounds. The nickel ion is also toxic to aquatic organisms.
Uses[edit]
Nickel(II) nitrate is primarily used in electrotyping and electroplating of metallic nickel.
References[edit]
- ^ Perry’s Chem Eng Handbook, 7th Ed
- ^ a b c Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David; Beyersmann, Detmar (2005). «Nickel Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_235.pub2.
- ^ Morosin, B.; Haseda, T. (1979). «Crystal Structure of the β Form of Ni(NO3)2.4H2O». Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 35 (12): 2856–2858. doi:10.1107/S0567740879010827.
- ^ Gallezot, P.; Weigel, D.; Prettre, M. (1967). «Structure du Nitrate de Nickel Tétrahydraté». Acta Crystallographica. 22 (5): 699–705. doi:10.1107/S0365110X67001392.
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат никеля | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат никеля(II) |
| Традиционные названия | азотнокислый никель |
| Хим. формула | Ni(NO3)2 |
| Физические свойства | |
| Состояние | светло-зелёные кристаллы |
| Молярная масса | 182,70 г/моль |
| Плотность | гидр. 2,05 г/см³ |
| Термические свойства | |
| Т. плав. | гидр. 56,7 °C |
| Мол. теплоёмк. | 86 Дж/(моль·К) |
| Энтальпия образования | -401,5 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 79,20; 10025; 139,250; 180,175 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13138-45-9 |
| PubChem | 25736 |
| Рег. номер EINECS | 236-068-5 |
| SMILES |
[Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/2NO3.Ni/c2*2-1(3)4;/q2*-1;+2 KBJMLQFLOWQJNF-UHFFFAOYSA-N |
| Рег. номер EC | 238-076-4 |
| ChemSpider | 23976 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат никеля(II) — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёные кристаллы, хорошо растворяется в воде, образует кристаллогидраты.
Получение
- Растворение никеля, оксида никеля(II) в разбавленной азотной кислоте:
- Растворение хлорида никеля(II) в горячей азотной кислоте:
Физические свойства
Нитрат никеля(II) образует светло-зелёные кристаллы, хорошо растворимые в воде, ацетонитриле, диметилсульфоксиде.
Образует кристаллогидраты состава Ni(NO3)2•n H2O, где n = 2, 4, 6 и 9.
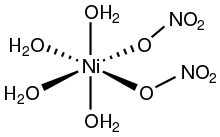
Наиболее стабильный кристаллогидрат Ni(NO3)2•6 H2O имеет строение [Ni(H2O)6](NO3)2.
Химические свойства
- Безводная соль при нагревании разлагается:
- Кристаллогидрат при нагревании разлагается иначе:
- Реагирует с щелочами:
- Иначе реакция идёт в растворами аммиака: с разбавленными:
- и с концентрированными:
- Является слабым восстановителем:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
| Нитрат никеля II | |
|---|---|
| Систематическое наименование |
Нитрат никеля II |
| Традиционные названия | азотнокислый никель |
| Хим. формула | Ni(NO3)2 |
| Рац. формула | Ni(NO3)2 |
| Состояние | светло-зелёные кристаллы |
| Молярная масса | 182,70 г/моль |
| Плотность | гидр. 2,05 г/см³ |
| Температура | |
| • плавления | гидр. 56,7 °C |
| Мол. теплоёмк. | 86 Дж/(моль·К) |
| Энтальпия | |
| • образования | -401,5 кДж/моль |
| Растворимость | |
| • в воде | 79,20; 10025; 139,250; 180,175 г/100 мл |
| Рег. номер CAS | 13138-45-9 |
| PubChem | 25736 |
| Рег. номер EINECS | 236-068-5 |
| SMILES |
[Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/2NO3.Ni/c2*2-1(3)4;/q2*-1;+2 KBJMLQFLOWQJNF-UHFFFAOYSA-N |
| ChemSpider | 23976 |
| ЛД50 | 1620 мг/кг |
| Токсичность | умеренно-токсичен, ирритант, опасен для окружающей среды |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат никеля II — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёные кристаллы, хорошо растворяется в воде. Образует кристаллогидраты.
Применяется для получения гальванических покрытий из никеля, осаждения никеля на носители никелевых катализаторов, окрашивания стекла и керамики в коричневый цвет.
Канцерогенен и ядовит в больших концентрациях, как и многие другие соединения никеля.
Получение
Растворение никеля или оксида никеля II в разбавленной азотной кислоте:
- 3 Ni + 8 HNO3 ⟶ 3 Ni(NO3)2 + 2 NO ↑ + 4 H2O
- NiO + 2 HNO3 ⟶ Ni(NO3)2 + H2O
Растворение хлорида никеля(II) в горячей азотной кислоте:
- 3 NiCl2 + 8 HNO3 →100oC 3 Ni(NO3)2 + 3 Cl2 ↑ + 2 NO ↑ + 4 H2O
Физические свойства
Нитрат никеля II образует светло-зелёные кристаллы, хорошо растворимые в воде, ацетонитриле, диметилсульфоксиде.
Образует кристаллогидраты состава Ni(NO3)2•nH2O, где n = 2, 4, 6 и 9.
Наиболее стабильный кристаллогидрат Ni(NO3)2•6 H2O имеет строение [Ni(H2O)6](NO3)2 — ион никеля в этом кристаллогидрате окружён шестью молекулами воды и не имеет непосредственной химической связи с нитрат-ионами.
Химические свойства
Безводная соль при нагревании разлагается:
- 2 Ni(NO3)2 →500oC 2 NiO + 4 NO2 + O2
- 2 Ni(NO3)2 →150oC, vacuum 2 Ni(NO2)2 + O2
Гексагидрат при нагревании разлагается иначе:
- 4 (Ni(NO3)2 ⋅ 6 H2O ) →100−140oC 4 NiO(OH) + 8 NO2 + O2 + 2 H2O
- 2 (Ni(NO3)2 ⋅ 6 H2O ) →300oC 2 NiO + 4 NO2 + O2 + 12 H2O
Из-за разложения гидратов безводный нитрат никеля не может быть получен нагреванием, способы получения безводной соли — нагреванием гидратов с пентаоксидом азота или взаимодействием тетракарбонила никеля с тетраоксидом азота[1]:
Ni(CO)4 + 2 N2O4 ⟶ Ni(NO3)2 + 2 NO + 4 CO
Реагирует с гидроксидами щелочных металлов с выпадением в осадок изумрудно-зелёного гидроксида никеля(II):
- Ni(NO3)2 + 2 NaOH ⟶ Ni(OH)2 ↓ + 2 NaNO3
Иначе реакция идёт с водными растворами аммиака, с разбавленным раствором образуется основной нитрат никеля:
- Ni(NO3)2 + NH3 ⋅ H2O ⟶ Ni(NO3)(OH) ↓ + 2 NH4NO3
и с концентрированным раствором аммиака:
- Ni(NO3)2 + 6 (NH3 ⋅ H2O) ⟶ [Ni(NH3)6](NO3)2 + 6 H2O
При взаимодействии с сильными окислителями является слабым восстановителем:
- 2 Ni(NO3)2 + Cl2 + 6 NaOH ⟶ 2 NiO(OH) ↓ + 2 NaCl + 4 NaNO3 + 2 H2O
Применение
Применяется для в гальванотехнике для никелирования, осаждения никеля на твердую фазу при создании никелевых катализаторов, в стекольной и керамической промышленности при окрашивания стекла, неорганических глазурей и керамики в коричневый цвет.
Безопасность
Как и все нитраты является окислителем, образует огнеопасные смеси с органическими веществами.
Пыль вещества раздражает глаза и слизистые оболочки, может вызывать аллергические реакции.
Умеренно ядовит для теплокровных животных, ЛД50 для крыс перорально 1620 г/кг. Является канцерогеном.
Ядовит для водных организмов.
| Нитрат никеля(II) | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат никеля(II) |
| Традиционные названия | азотнокислый никель |
| Хим. формула | Ni(NO3)2 |
| Рац. формула | Ni(NO3)2 |
| Физические свойства | |
| Состояние | светло-зелёные кристаллы |
| Молярная масса | 182,70 г/моль |
| Плотность | гидр. 2,05 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | гидр. 56,7 °C |
| Мол. теплоёмк. | 86 Дж/(моль·К) |
| Энтальпия | |
| • образования | -401,5 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 79,20; 10025; 139,250; 180,175 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13138-45-9 |
| PubChem | 25736 |
| SMILES |
[Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| Безопасность | |
| ЛД50 | 1620 мг/кг |
| Токсичность | умеренно-токсичен, ирритант, опасен для окружающей среды |
| NFPA 704 |
0 2 0 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитра́т ни́келя(II) — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёные кристаллы, хорошо растворяется в воде.
Образует кристаллогидраты.
Применяется для получения гальванических покрытий из никеля, осаждения никеля на носители никелевых катализаторов, окрашивания стекла и керамики в коричневый цвет.
Канцерогенен и ядовит в больших концентрациях, как и многие другие соединения никеля.
Получение
Растворение никеля или оксида никеля(II) в разбавленной азотной кислоте:
- [math]ce{ 3Ni + 8HNO3 -> 3Ni(NO3)2 + 2NO ^ + 4H2O, }[/math]
- [math]ce{ NiO + 2HNO3 -> Ni(NO3)2 + H2O }[/math]
Растворение хлорида никеля(II) в горячей азотной кислоте:
- [math]ce{ 3NiCl2 + 8HNO3 ->[100^oC] 3Ni(NO3)2 + 3Cl2 ^ + 2NO ^ + 4H2O. }[/math]
Физические свойства
Нитрат никеля(II) образует светло-зелёные кристаллы, хорошо растворимые в воде, ацетонитриле, диметилсульфоксиде.
Образует кристаллогидраты состава Ni(NO3)2•nH2O, где n = 2, 4, 6 и 9.
Наиболее стабильный кристаллогидрат Ni(NO3)2•6 H2O имеет строение [Ni(H2O)6](NO3)2 — ион никеля в этом кристаллогидрате окружён шестью молекулами воды и не имеет непосредственной химической связи с нитрат-ионами.
Химические свойства
Безводная соль при нагревании разлагается:
- [math]ce{ 2Ni(NO3)2 ->[500^oC] 2NiO + 4NO2 + O2, }[/math]
- [math]ce{ 2Ni(NO3)2 ->[150^oC, vacuum] 2Ni(NO2)2 + O2. }[/math]
Гексагидрат при нагревании разлагается иначе:
- [math]ce{ 4(Ni(NO3)2.6H2O) ->[100-140^oC] 4NiO(OH) + 8NO2 + O2 + 2H2O, }[/math]
- [math]ce{ 2(Ni(NO3)2.6H2O) ->[300^oC] 2NiO + 4NO2 + O2 + 12H2O. }[/math]
Из-за разложения гидратов безводный нитрат никеля не может быть получен нагреванием, способы получения безводной соли — нагреванием гидратов с пентаоксидом азота или взаимодействием тетракарбонила никеля с тетраоксидом азота[1]:
[math]ce{ Ni(CO)4 + 2N2O4 -> Ni(NO3)2 + 2NO + 4CO. }[/math]
Реагирует с гидроксидами щелочных металлов с выпадением в осадок изумрудно-зелёного гидроксида никеля(II):
- [math]ce{ Ni(NO3)2 + 2NaOH -> Ni(OH)2 v + 2NaNO3. }[/math]
Иначе реакция идёт с водными растворами аммиака, с разбавленным раствором образуется основной нитрат никеля:
- [math]ce{ Ni(NO3)2 + NH3.H2O -> Ni(NO3)(OH) v + 2NH4NO3, }[/math]
и с концентрированным раствором аммиака:
- [math]ce{ Ni(NO3)2 + 6(NH3.H2O)-> [Ni(NH3)6](NO3)2 + 6H2O. }[/math]
При взаимодействии с сильными окислителями является слабым восстановителем:
- [math]ce{ 2Ni(NO3)2 + Cl2 + 6NaOH -> 2NiO(OH) v + 2NaCl + 4NaNO3 + 2H2O. }[/math]
Применение
Применяется для в гальванотехнике для никелирования, осаждения никеля на твердую фазу при создании никелевых катализаторов, в стекольной и керамической промышленности при окрашивания стекла, неорганических глазурей и керамики в коричневый цвет.
Безопасность
Как и все нитраты является окислителем, образует огнеопасные смеси с органическими веществами.
Пыль вещества раздражает глаза и слизистые оболочки, может вызывать аллергические реакции.
Умеренно ядовит для теплокровных животных, ЛД50 для крыс перорально 1620 мг/кг. Является канцерогеном.
Ядовит для водных организмов.
Примечания
- ↑ Keith Lascelles, Lindsay G. Morgan, David Nicholls, Detmar Beyersmann Nickel Compounds in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a17_235.pub2
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учебное пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.

Нитрат никеля представляет собой изумрудно-зеленые кристаллы моноклинной системы, слегка выветривающиеся в сухом и быстро расплывающиеся во влажном воздухе. Плотн.2,05 г/см3, при 56,70С реактив плавится в кристаллизованной воде ; при дальнейшем нагревании теряет три молекулы воды и HNO3. При прокаливании нитрат никеля разлагается.
Сведения о термических превращениях азотнокислых солей никеля (II), имеющиеся в литературных источниках довольно противоречивы. Считается, что на первых стадиях разложения ( температурный интервал 90-1900С)гексагидрата никеля Ni(NO3)2∙6H2O происходит ступенчатое удаление молекул кристаллизационной воды вплоть до образования безводной соли Ni(NO3)2, а затем при дальнейшем ее нагреве до 270-5000С наблюдается ее распад до оксида никеля (II) NiO.
Нитрат никеля растворим в воде и этиловом спирте.
В лаборатории нитрат никеля получают растворением карбоната никеля в азотной кислоте:
NiCO3+2HNO3→ Ni(NO3)2+CO2+H2O
Нитрат никеля квалификацией ч.д.а. можно получить по методике, основанной на следующих реакциях:
3NiCl2+8HNO3→3Ni(NO3)2+3Cl2+2NO+4H2O
2Ni(NO3)2→2NiO+4NO2+O2
NiO+2HNO3→Ni(NO3)2+H2O
Нитраты переходных металлов широко используются в различных областях науки и производства, в частности, при приготовлении катализаторов, а также в качестве микродобавок к удобрениям.
ГОСТ4055-78 Никель(II) азотнокислый 6- водный. Технические условия.
материал сайта chemanalytica.ru











_{2}+6H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2193153f66175b45720984723b9f853d4d1331ab)


