| Нитрат серебра | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
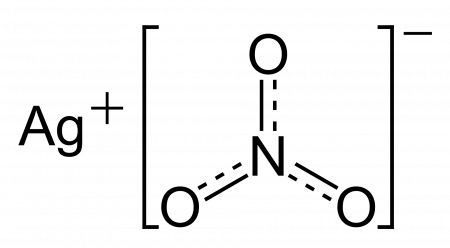
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES |
[N+](=O)([O-])[O-].[Ag+] |
| InChI |
1S/Ag.NO3/c;2-1(3)4/q+1;-1 SQGYOTSLMSWVJD-UHFFFAOYSA-N |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 |
20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС | 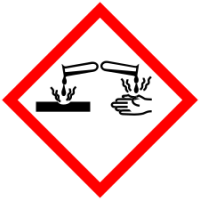    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
- Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г; растворимость в метиловом спирте — 3,6 г/100 г; в этиловом спирте — 2,12 г/100 г; в ацетоне — 0,44 г/100 г; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
- HCl + AgNO3 ⟶ AgCl ↓ + HNO3
- NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
- 2 AgNO3 →350∘C 2 Ag + 2 NO2 + O2
- Реагирует с щелочью с образованием оксида:
- 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O
- в этаноле, при -50 градусах, образуется гидроксид серебра
- AgNO3 + NaOH →C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
Пятна от нитрата серебра на коже
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея
- Изображения нитрата серебра
-
Определение и формула нитрата серебра

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это твёрдое вещество, представляющее из себя бесцветные ромбические кристаллы, с плотностью 4,352 г/см, хорошо растворяется в воде 222,5 г/100 г (
).
Растворимость в метаноле и этаноле равно соответственно 3,6 г/100 г и 2,12 г/100, температура плавления , выше
разлагается.
Химические свойства нитрата серебра
взаимодействует c металлами, стоящими в ряду напряжения левее серебра:
- Взаимодействует с основаниями:
взаимодействует кислотами и солями по обменному механизму с выпадением осадка или комплексообразованием, с органическими веществами, которые имеют в своём составе альдегидную группу:
- При нагревании
разлагается:
Получение
Нитрат серебра получают растворением металлического серебра в концентрированной азотной кислоте:
Качественная реакция
Качественной реакцией на нитрат-ион является образование тёмно-бурого раствора сульфата нитрозожелеза (II) при взаимодействии с
в сильно кислой среде:
Качественной реакцией на ионы серебра является образование белого творожистого осадка хлорида серебра при добавлении к раствору или
:
Применение
Нитрат серебра применяется в медицине для прижигания небольших ран и бородавок.
В малых концентрациях он используется в качестве противовоспалительного и вяжущего средства.
Также используется в изготовлении зеркал.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
СЕРЕБРА НИТРАТ AgNO3,
бесцв. кристаллы; до 159,5°С устойчива ромбич. модификация (а = 0,6995
нм, b — 0,7328 нм, с = 1,0118 нм, z= 8, пространств. группа
Рbса, плотн. 4,35 г/см3); выше 159,5°С-ромбоэдрич. (а
= 0,6287 нм, a = 48,5°, z = 2); DH полиморфного
перехода 2,47 кДж/моль; т.пл. 209,7 °С;
93,0 Дж/(моль·К);
12,1 кДж/моль,
—124,5 кДж/моль;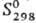
Дж/(моль· К). Р-римость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С),
651,9 (80°С); в присут. HNО3 р-римость в воде
резко понижается. Легко восстанавливается до Ag° под действием орг., неорг.
восстановителей, света, нагревания.
В пром-сти серебра нитрат получают
взаимод. Ag (рудного или вторичного) с HNO3 с послед. кристаллизацией
из р-ра. Применяют для получения др. соед. Ag, как реагент в арген-тометрии,
для серебрения зеркал, как вяжущее бактерицидное ср-во (ляпис), в произ-ве фотографич.
эмульсий и др.
П. М. Чукуров.
Еще по теме:
- Серебра нитрат — справочник по веществам
- Серебра нитрат — фармацевтический справочник
- Как правильно пишется слово «серебро»
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова накрапать (глагол), накрапал:
Ассоциации к слову «серебро»
Синонимы к словосочетанию «нитрат серебра»
Предложения со словосочетанием «нитрат серебра»
- Мокроколлодионым процесс называется потому, что перед экспонированием стеклянные пластинки сенсибилизируют водным раствором нитрата серебра.
- Специфическими красителями являются орсеин, окрашивающий эластические волокна в коричневый цвет, судан III окрашивает жир в жёлтый цвет, а четырёхокись осмия – в чёрный цвет, нитрат серебра импрегнирует нервные клетки и волокна в цвета от коричневого до чёрного, метиленовый синий окрашивает нервные элементы в синий цвет.
- Он начинает с простейшего: покрывает листы бумаги нитратом серебра, укладывая на них листья растений и кружева, и получает их белые силуэтные изображения.
- (все предложения)
Цитаты из русской классики со словосочетанием «нитрат серебра»
- Венецианское зеркало в массивной раме из серебра; небольшие диваны, обитые дорогим серо-зеленым шелком; палисандровая отделка стен; карнизы, штофные портьеры, индийский ковер и три электрические лампы с матовыми колпаками в фигурной бронзовой сетке — были предметами подлинной роскоши — в том виде, как это технически уместно на корабле.
- Мы поглядели за лощину и увидали, что с той стороны, куда лежит наш путь и куда позорно бежала наша свита, неслась по небу огромная дождевая туча с весенним дождем и с первым весенним громом, при котором молодые девушки умываются с серебряной ложечки, чтобы самим стать белей серебра.
- — Прощай! — говорил он, положив руку на плечо Евсея. — Живи осторожно. Людям не верь, женщинам — того больше. Деньгам цену знай. Серебром — купи, золото — копи, меди — не гнушайся, железом — обороняйся, есть такая казацкая поговорка. Я ведь казак, н-на…
- (все
цитаты из русской классики)
Определение и формула нитрата серебра
Молярная масса равна г/моль.
Физические свойства – это твёрдое вещество, представляющее из себя бесцветные ромбические кристаллы, с плотностью 4,352 г/см , хорошо растворяется в воде 222,5 г/100 г ( ).
Растворимость в метаноле и этаноле равно соответственно 3,6 г/100 г и 2,12 г/100, температура плавления , выше разлагается.
Химические свойства нитрата серебра
- взаимодействует c металлами, стоящими в ряду напряжения левее серебра:
Взаимодействует с основаниями:
взаимодействует кислотами и солями по обменному механизму с выпадением осадка или комплексообразованием, с органическими веществами, которые имеют в своём составе альдегидную группу:
При нагревании разлагается:
Получение
Нитрат серебра получают растворением металлического серебра в концентрированной азотной кислоте:
Качественная реакция
Качественной реакцией на ионы серебра является образование белого творожистого осадка хлорида серебра при добавлении к раствору или :
Применение
Нитрат серебра применяется в медицине для прижигания небольших ран и бородавок.
В малых концентрациях он используется в качестве противовоспалительного и вяжущего средства.
Также используется в изготовлении зеркал.
Примеры решения задач
| Задание | Рассчитайте эффективную степень диссоциации в воде при моляльности раствора моль/кг, если понижение температуры замерзания этого раствора равно град. |
| Решение | На первом шаге вычислим изотонический коэффициент, который показывает формальное число частиц, на которое продиссоциировало соединение: |
— криоскопическая постоянная воды
Рассчитаем степень диссоциации :
— число ионов, на которые диссоциирует .
| Задание | Рассчитайте концентрацию ионов серебра в насыщенном растворе метанола при для . |
| Решение | в является слабым электролитом, поэтому запишем диссоциацию через константу равновесия: |
Равновесные концентрации частиц:
Здесь — исходная концентрация нитрата серебра, — убыль концентрации .
Нитрат серебра
- Нитрат серебра
-
Кристаллы азотнокислого серебра
Нитра́т серебра́(I) (азотноки́слое серебро́, ля́пис от лат. lapis — камень, «адский камень») — бесцветные ромбические кристаллы. Плотность 4,352 г/см³. Температура плавления 209,7 °C. При температуре выше 300 °C разлагается. Растворимость в воде (г/100 г): 122,2 при 0 °C; 222,5 при 20 °C; 770 при 100 °C. Растворимость в метиловом спирте 3,6 г/100 г; в этиловом спирте 2,12 г/100 г; в ацетоне 0,44 г/100 г; в пиридине 33,6 г/100 г (все растворимости — при 20 °C).
Нитрат серебра может быть синтезирован растворением серебра в азотной кислоте по реакции:
- Ag + 2HNO3 = AgNO3 + NO2 + H2O.
Оставляет на коже тёмные пятна, используется в медицине для прижигания и стерилизации ранок. Применяется также в аналоговой фотографии.
Использование в медицине
Нитрат серебра используется в медицине (ляписный карандаш) для прижигания ранок. Используется как действующие вещество в гомеопатии.
Впервые ляпис применили врачи Ян-Баптист ван Гельмонт (1579—1644) и Франциск де ла Бое Сильвий (1614—1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой.
Пятна от нитрата серебра на коже
Они обнаружили, что прикосновение к кристаллам полученной серебряной соли приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов. Адский камень, строго говоря, не чистый нитрат серебра, а его сплав с нитратом калия, иногда отлитый в виде палочек — ляписного карандаша. Ляпис оказывает прижигающее действие и применяется с давних пор. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани. [1]
Ляпис в литературе
В романе И. С. Тургенева ««Отцы и дети» Евгений Базаров просит у своего отца адский камень:
Дня три спустя Базаров вошел к отцу в комнату и спросил, нет ли у него адского камня?
— Есть; на что тебе?
— Нужно… ранку прижечь.Источники
Аптечные старожилы
Также ляписный карандаш используется при лечении вроcшего ногтя.
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Нитрат серебра» в других словарях:
-
Нитрат серебра(II) — Общие Систематическое наименование Нитрат серебра(II) Традиционные названия Азотнокислое серебро Химическая формула Ag(NO3)2 Физические свойства … Википедия
-
НИТРАТ СЕРЕБРА — (азотнокислое серебро, АgNO3), бесцветное твердое соединение. Является самой важной солью СЕРЕБРА, т. к. хорошо растворим в воде. Используется в ФОТОГРАФИИ, химическом анализе, серебрении, в изготовлении зеркал, чернил и красителей. Очень едкое… … Научно-технический энциклопедический словарь
-
Нитрат серебра(I) — Под вечный гул вертящихся колес!..Нитрат серебра … Википедия
-
нитрат серебра — азотнокислое серебро … Cловарь химических синонимов I
-
Нитрат натрия — Нитрат натрия … Википедия
-
Нитрат железа(III) — Нитрат железа(III) … Википедия
-
СЕРЕБРА НИТРАТ — Argenti nitras. Синоним: ляпис. Свойства. Бесцветные прозрачные кристаллы в виде пластинок или белых кристаллических палочек без запаха. Очень хорошо растворяется в воде (1:0,6), в спирте (1:30). Под действием света темнеет. Несовместим с органи … Отечественные ветеринарные препараты
-
Нитрат аммония — Нитрат аммония … Википедия
-
Нитрат калия — Нитрат калия … Википедия
-
Нитрат бария — Нитрат бария … Википедия
From Wikipedia, the free encyclopedia

Structural formula |
|

|
|

Crystal structure |
|
| Names | |
|---|---|
| IUPAC name
Silver nitrate |
|
| Systematic IUPAC name
Silver(I) nitrate |
|
| Other names
Nitric acid silver(1+) salt |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.958 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1493 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AgNO3 |
| Molar mass | 169.872 g·mol−1 |
| Appearance | colorless solid |
| Odor | Odorless |
| Density | 4.35 g/cm3 (24 °C) 3.97 g/cm3 (210 °C)[1] |
| Melting point | 209.7 °C (409.5 °F; 482.8 K)[1][3] |
| Boiling point | 440 °C (824 °F; 713 K) decomposes[1] |
|
Solubility in water |
122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C)[2] |
| Solubility | Soluble in acetone,[1] ammonia, ether, glycerol |
| Solubility in acetic acid | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C)[3] |
| Solubility in acetone | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C)[2] |
| Solubility in benzene | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C)[2] |
| Solubility in ethanol | 3.1 g/100 g (19 °C)[2] |
| Solubility in ethyl acetate | 2.7 g/100 g (20 °C)[3] |
| log P | 0.19 |
|
Magnetic susceptibility (χ) |
−45.7·10−6 cm3/mol |
|
Refractive index (nD) |
1.744 |
| Viscosity | 3.77 cP (244 °C) 3.04 cP (275 °C)[3] |
| Structure | |
|
Crystal structure |
Orthorhombic, oP56[4] |
|
Space group |
P212121, No. 19[4] |
|
Point group |
222[4] |
|
Lattice constant |
a = 6.992(2) Å, b = 7.335(2) Å, c = 10.125(2) Å[4] α = 90°, β = 90°, γ = 90° |
| Thermochemistry | |
|
Heat capacity (C) |
93.1 J/mol·K[1] |
|
Std molar |
140.9 J/mol·K[1] |
|
Std enthalpy of |
−124.4 kJ/mol[1] |
|
Gibbs free energy (ΔfG⦵) |
−33.4 kJ/mol[1] |
| Pharmacology | |
|
ATC code |
D08AL01 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Reacts explosively with ethanol. Toxic. Corrosive. |
| GHS labelling: | |
|
Pictograms |
    [5] [5]
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H314, H410[5] |
|
Precautionary statements |
P220, P273, P280, P305+P351+P338, P310, P501[5] |
| NFPA 704 (fire diamond) |
3 0 2 OX |
| Lethal dose or concentration (LD, LC): | |
|
LDLo (lowest published) |
800 mg/kg (rabbit, oral) 20 mg/kg (dog, oral)[6] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Crystals of silver nitrate under a microscope.
Silver nitrate is an inorganic compound with chemical formula AgNO
3. It is a versatile precursor to many other silver compounds, such as those used in photography. It is far less sensitive to light than the halides. It was once called lunar caustic because silver was called luna by ancient alchemists who associated silver with the moon.[7] In solid silver nitrate, the silver ions are three-coordinated in a trigonal planar arrangement.[4]
Synthesis and structure[edit]
Albertus Magnus, in the 13th century, documented the ability of nitric acid to separate gold and silver by dissolving the silver.[8] Indeed silver nitrate can be prepared by dissolving silver in nitric acid followed by evaporation of the solution. The stoichiometry of the reaction depends upon the concentration of nitric acid used.
- 3 Ag + 4 HNO3 (cold and diluted) → 3 AgNO3 + 2 H2O + NO
- Ag + 2 HNO3 (hot and concentrated) → AgNO3 + H2O + NO2
The structure of silver nitrate has been examined by X-ray crystallography several times. In the common orthorhombic form stable at ordinary temperature and pressure, the silver atoms form pairs with Ag—Ag contacts of 3.227 Å. Each Ag+ center is bonded to six oxygen centers of both uni- and bidentate nitrate ligands. The Ag-O distances range from 2.384 to 2.702 Å.[4]

Reactions[edit]
A typical reaction with silver nitrate is to suspend a rod of copper in a solution of silver nitrate and leave it for a few hours. The silver nitrate reacts with copper to form hairlike crystals of silver metal and a blue solution of copper nitrate:
- 2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
Silver nitrate decomposes when heated:
- 2 AgNO3(l) → 2 Ag(s) + O2(g) + 2 NO2(g)
Qualitatively, decomposition is negligible below the melting point, but becomes appreciable around 250 °C and fully decomposes at 440 °C.[9]
Most metal nitrates thermally decompose to the respective oxides, but silver oxide decomposes at a lower temperature than silver nitrate, so the decomposition of silver nitrate yields elemental silver instead.
Uses[edit]
Precursor to other silver compounds[edit]
Silver nitrate is the least expensive salt of silver; it offers several other advantages as well. It is non-hygroscopic, in contrast to silver fluoroborate and silver perchlorate. In addition, it is relatively stable to light, and it dissolves in numerous solvents, including water. The nitrate can be easily replaced by other ligands, rendering AgNO3 versatile. Treatment with solutions of halide ions gives a precipitate of AgX (X = Cl, Br, I). When making photographic film, silver nitrate is treated with halide salts of sodium or potassium to form insoluble silver halide in situ in photographic gelatin, which is then applied to strips of tri-acetate or polyester. Similarly, silver nitrate is used to prepare some silver-based explosives, such as the fulminate, azide, or acetylide, through a precipitation reaction.
Treatment of silver nitrate with base gives dark grey silver oxide:[10]
- 2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O
Halide abstraction[edit]
The silver cation, Ag+
, reacts quickly with halide sources to produce the insoluble silver halide, which is a cream precipitate if Br−
is used, a white precipitate if Cl−
is used and a yellow precipitate if I−
is used. This reaction is commonly used in inorganic chemistry to abstract halides:
- Ag+
(aq) + X−
(aq) → AgX(s)
where X−
= Cl−
, Br−
, or I−
.
Other silver salts with non-coordinating anions, namely silver tetrafluoroborate and silver hexafluorophosphate are used for more demanding applications.
Similarly, this reaction is used in analytical chemistry to confirm the presence of chloride, bromide, or iodide ions. Samples are typically acidified with dilute nitric acid to remove interfering ions, e.g. carbonate ions and sulfide ions. This step avoids confusion of silver sulfide or silver carbonate precipitates with that of silver halides. The color of precipitate varies with the halide: white (silver chloride), pale yellow/cream (silver bromide), yellow (silver iodide). AgBr and especially AgI photo-decompose to the metal, as evidence by a grayish color on exposed samples.
The same reaction was used on steamships in order to determine whether or not boiler feedwater had been contaminated with seawater. It is still used to determine if moisture on formerly dry cargo is a result of condensation from humid air, or from seawater leaking through the hull.[11]
Organic synthesis[edit]
Silver nitrate is used in many ways in organic synthesis, e.g. for deprotection and oxidations. Ag+
binds alkenes reversibly, and silver nitrate has been used to separate mixtures of alkenes by selective absorption. The resulting adduct can be decomposed with ammonia to release the free alkene.[12] Silver nitrate is highly soluble in water but is poorly soluble in most organic solvents, except acetonitrile (111.8 g/100 g, 25 °C).[13]
Biology[edit]
In histology, silver nitrate is used for silver staining, for demonstrating reticular fibers, proteins and nucleic acids. For this reason it is also used to demonstrate proteins in PAGE gels. It can be used as a stain in scanning electron microscopy.[14]
Indelible ink[edit]
Silver nitrate produces long-lasting stain when applied to skin. An electoral stain makes use of this to mark a finger of people who have voted in an election, allowing easy identification to prevent double-voting.
Medicine[edit]
Silver salts have antiseptic properties. In 1881 Credé introduced the use of dilute solutions of AgNO3 in newborn babies’ eyes at birth to prevent contraction of gonorrhea from the mother, which could cause blindness. (Modern antibiotics are now used instead).[15][16][17]
Fused silver nitrate, shaped into sticks, was traditionally called «lunar caustic». It is used as a cauterizing agent, for example to remove granulation tissue around a stoma. General Sir James Abbott noted in his journals that in India in 1827 it was infused by a British surgeon into wounds in his arm resulting from the bite of a mad dog to cauterize the wounds and prevent the onset of rabies.[18]
Silver nitrate is used to cauterize superficial blood vessels in the nose to help prevent nose bleeds.
Dentists sometimes use silver nitrate-infused swabs to heal oral ulcers. Silver nitrate is used by some podiatrists to kill cells located in the nail bed.
The Canadian physician C. A. Douglas Ringrose researched the use of silver nitrate for sterilization procedures, believing that silver nitrate could be used to block and corrode the fallopian tubes.[19] The technique was ineffective.[20]
Disinfection[edit]
Much research has been done in evaluating the ability of the silver ion at inactivating Escherichia coli, a microorganism commonly used as an indicator for fecal contamination and as a surrogate for pathogens in drinking water treatment. Concentrations of silver nitrate evaluated in inactivation experiments range from 10–200 micrograms per liter as Ag+.
Silver’s antimicrobial activity saw many applications prior to the discovery of modern antibiotics, when it fell into near disuse. Its association with argyria made consumers wary and led them to turn away from it when given an alternative.
Against warts[edit]
Skin stained by silver nitrate
Repeated daily application of silver nitrate can induce adequate destruction of cutaneous warts, but occasionally pigmented scars may develop. In a placebo-controlled study of 70 patients, silver nitrate given over nine days resulted in clearance of all warts in 43% and improvement in warts in 26% one month after treatment compared to 11% and 14%, respectively, in the placebo group.[21]
Safety[edit]
As an oxidant, silver nitrate should be properly stored away from organic compounds. Despite its common usage in extremely low concentrations to prevent gonorrhea and control nose bleeds, silver nitrate is still very toxic and corrosive.[22] Brief exposure will not produce any immediate side effects other than the purple, brown or black stains on the skin, but upon constant exposure to high concentrations, side effects will be noticeable, which include burns. Long-term exposure may cause eye damage. Silver nitrate is known to be a skin and eye irritant. Silver nitrate has not been thoroughly investigated for potential carcinogenic effect.[23]
Silver nitrate is currently unregulated in water sources by the United States Environmental Protection Agency. However, if more than 1 gram of silver is accumulated in the body, a condition called argyria may develop. Argyria is a permanent cosmetic condition in which the skin and internal organs turn a blue-gray color. The United States Environmental Protection Agency used to have a maximum contaminant limit for silver in water until 1990, when it was determined that argyria did not impact the function of any affected organs despite the discolouration.[24] Argyria is more often associated with the consumption of colloidal silver solutions rather than with silver nitrate, since it is only used at extremely low concentrations to disinfect the water. However, it is still important to be wary before ingesting any sort of silver-ion solution.
References[edit]
- ^ a b c d e f g h Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York City: D. Van Nostrand Company. pp. 617–619.
- ^ a b c d Kiper, Ruslan Anatolievich. «silver nitrate». Chemister.ru. Retrieved 2014-07-20.
- ^ a b c d e f Meyer, P.; Rimsky, A.; Chevalier, R. (1978). «Structure du nitrate d’argent à pression et température ordinaires. Exemple de cristal parfait». Acta Crystallogr. B. 34 (5): 1457–1462. doi:10.1107/S0567740878005907.
- ^ a b c Sigma-Aldrich Co., Silver nitrate. Retrieved on 2014-07-20.
- ^ «Silver (metal dust and soluble compounds, as Ag)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Definition of Lunar Caustic». dictionary.die.net. Archived from the original on 2012-01-31.
- ^ Szabadváry, Ferenc (1992). History of analytical chemistry. Taylor & Francis. p. 17. ISBN 978-2-88124-569-5.
- ^ Stern, K. H. (1972). «High Temperature Properties and Decomposition of Inorganic Salts Part 3, Nitrates and Nitrites». Journal of Physical and Chemical Reference Data. 1 (3): 747–772. Bibcode:1972JPCRD…1..747S. doi:10.1063/1.3253104. S2CID 95532988.
- ^ Campaigne, E.; LeSuer, W. M. (1963). «3-Thiophenecarboxylic (Thenoic) Acid». Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 4, p. 919 (preparation of Ag2O, used in oxidation of an aldehyde) - ^ «Silver nitrate method». Transport Information Service. Gesamtverband der Deutschen Versicherungswirtschaf. Retrieved 22 June 2015.
- ^ Cope, A. C.; Bach, R. D. (1973). «trans-Cyclooctene». Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 5, p. 315 - ^ «silver nitrate». chemister.ru. Retrieved 2019-04-04.
- ^ Geissinger HD (2011). «The use of silver nitrate as a stain for scanning electron microscopy of arterial intima and paraffin sections of kidney». Journal of Microscopy. 95 (3): 471–481. doi:10.1111/j.1365-2818.1972.tb01051.x. PMID 4114959. S2CID 38335416.
- ^ Peter.H (2000). «Dr Carl Credé (1819–1892) and the prevention of ophthalmia neonatorum». Arch Dis Child Fetal Neonatal Ed. 83 (2): F158–F159. doi:10.1136/fn.83.2.F158. PMC 1721147. PMID 10952715.
- ^ Credé C. S. E. (1881). «Die Verhürtung der Augenentzündung der Neugeborenen». Archiv für Gynäkologie. 17 (1): 50–53. doi:10.1007/BF01977793. S2CID 10053605.
- ^ Schaller, Ulrich C. & Klauss, Volker (2001). «Is Credés prophylaxis for ophthalmia neonatorum still valid?». Bulletin of the World Health Organization. 79 (3): 262–266. PMC 2566367. PMID 11285676.
- ^ British Library, India Office Records, European Manuscripts, MSS EUR F171/33/3, page 109.
- ^ Ringrose CA. (1973). «Office tubal sterilization». Obstetrics and Gynecology. 42 (1): 151–5. PMID 4720201.
- ^ Cryderman v. Ringrose (1978), 89 D.L.R. (3d) 32 (Alta S.C.) and Zimmer et al. v. Ringrose (1981) 4 W.W.R. 75 (Alta C.A.).
- ^ Sterling, J. C.; Handfield-Jones, S.; Hudson, P. M.; British Association of Dermatologists (2001). «Guidelines for the management of cutaneous warts» (PDF). British Journal of Dermatology. 144 (1): 4–11. doi:10.1046/j.1365-2133.2001.04066.x. PMID 11167676. S2CID 20179474. Archived from the original (PDF) on 2012-03-03.
- ^ «Safety data for silver nitrate (MSDS)». Oxford University Chemistry department.
- ^ «New Jersey Right-To-Know-Act Hazardous Substance Fact Sheet — Silver Nitrate» (PDF).
- ^ «Silver Compounds.» Encyclopedia of Chemical Technology. Vol. 22. Fourth Ed. Excec. Ed. Jaqueline I. Kroschwitz. New York: John Wiley and Sons, 1997.
External links[edit]
- International Chemical Safety Card 1116
- NIOSH Pocket Guide to Chemical Hazards
- History of Kodak: About Film and Imaging
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
From Wikipedia, the free encyclopedia

Structural formula |
|

|
|

Crystal structure |
|
| Names | |
|---|---|
| IUPAC name
Silver nitrate |
|
| Systematic IUPAC name
Silver(I) nitrate |
|
| Other names
Nitric acid silver(1+) salt |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.958 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1493 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AgNO3 |
| Molar mass | 169.872 g·mol−1 |
| Appearance | colorless solid |
| Odor | Odorless |
| Density | 4.35 g/cm3 (24 °C) 3.97 g/cm3 (210 °C)[1] |
| Melting point | 209.7 °C (409.5 °F; 482.8 K)[1][3] |
| Boiling point | 440 °C (824 °F; 713 K) decomposes[1] |
|
Solubility in water |
122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C)[2] |
| Solubility | Soluble in acetone,[1] ammonia, ether, glycerol |
| Solubility in acetic acid | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C)[3] |
| Solubility in acetone | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C)[2] |
| Solubility in benzene | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C)[2] |
| Solubility in ethanol | 3.1 g/100 g (19 °C)[2] |
| Solubility in ethyl acetate | 2.7 g/100 g (20 °C)[3] |
| log P | 0.19 |
|
Magnetic susceptibility (χ) |
−45.7·10−6 cm3/mol |
|
Refractive index (nD) |
1.744 |
| Viscosity | 3.77 cP (244 °C) 3.04 cP (275 °C)[3] |
| Structure | |
|
Crystal structure |
Orthorhombic, oP56[4] |
|
Space group |
P212121, No. 19[4] |
|
Point group |
222[4] |
|
Lattice constant |
a = 6.992(2) Å, b = 7.335(2) Å, c = 10.125(2) Å[4] α = 90°, β = 90°, γ = 90° |
| Thermochemistry | |
|
Heat capacity (C) |
93.1 J/mol·K[1] |
|
Std molar |
140.9 J/mol·K[1] |
|
Std enthalpy of |
−124.4 kJ/mol[1] |
|
Gibbs free energy (ΔfG⦵) |
−33.4 kJ/mol[1] |
| Pharmacology | |
|
ATC code |
D08AL01 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Reacts explosively with ethanol. Toxic. Corrosive. |
| GHS labelling: | |
|
Pictograms |
    [5] [5]
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H314, H410[5] |
|
Precautionary statements |
P220, P273, P280, P305+P351+P338, P310, P501[5] |
| NFPA 704 (fire diamond) |
3 0 2 OX |
| Lethal dose or concentration (LD, LC): | |
|
LDLo (lowest published) |
800 mg/kg (rabbit, oral) 20 mg/kg (dog, oral)[6] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Crystals of silver nitrate under a microscope.
Silver nitrate is an inorganic compound with chemical formula AgNO
3. It is a versatile precursor to many other silver compounds, such as those used in photography. It is far less sensitive to light than the halides. It was once called lunar caustic because silver was called luna by ancient alchemists who associated silver with the moon.[7] In solid silver nitrate, the silver ions are three-coordinated in a trigonal planar arrangement.[4]
Synthesis and structure[edit]
Albertus Magnus, in the 13th century, documented the ability of nitric acid to separate gold and silver by dissolving the silver.[8] Indeed silver nitrate can be prepared by dissolving silver in nitric acid followed by evaporation of the solution. The stoichiometry of the reaction depends upon the concentration of nitric acid used.
- 3 Ag + 4 HNO3 (cold and diluted) → 3 AgNO3 + 2 H2O + NO
- Ag + 2 HNO3 (hot and concentrated) → AgNO3 + H2O + NO2
The structure of silver nitrate has been examined by X-ray crystallography several times. In the common orthorhombic form stable at ordinary temperature and pressure, the silver atoms form pairs with Ag—Ag contacts of 3.227 Å. Each Ag+ center is bonded to six oxygen centers of both uni- and bidentate nitrate ligands. The Ag-O distances range from 2.384 to 2.702 Å.[4]

Reactions[edit]
A typical reaction with silver nitrate is to suspend a rod of copper in a solution of silver nitrate and leave it for a few hours. The silver nitrate reacts with copper to form hairlike crystals of silver metal and a blue solution of copper nitrate:
- 2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
Silver nitrate decomposes when heated:
- 2 AgNO3(l) → 2 Ag(s) + O2(g) + 2 NO2(g)
Qualitatively, decomposition is negligible below the melting point, but becomes appreciable around 250 °C and fully decomposes at 440 °C.[9]
Most metal nitrates thermally decompose to the respective oxides, but silver oxide decomposes at a lower temperature than silver nitrate, so the decomposition of silver nitrate yields elemental silver instead.
Uses[edit]
Precursor to other silver compounds[edit]
Silver nitrate is the least expensive salt of silver; it offers several other advantages as well. It is non-hygroscopic, in contrast to silver fluoroborate and silver perchlorate. In addition, it is relatively stable to light, and it dissolves in numerous solvents, including water. The nitrate can be easily replaced by other ligands, rendering AgNO3 versatile. Treatment with solutions of halide ions gives a precipitate of AgX (X = Cl, Br, I). When making photographic film, silver nitrate is treated with halide salts of sodium or potassium to form insoluble silver halide in situ in photographic gelatin, which is then applied to strips of tri-acetate or polyester. Similarly, silver nitrate is used to prepare some silver-based explosives, such as the fulminate, azide, or acetylide, through a precipitation reaction.
Treatment of silver nitrate with base gives dark grey silver oxide:[10]
- 2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O
Halide abstraction[edit]
The silver cation, Ag+
, reacts quickly with halide sources to produce the insoluble silver halide, which is a cream precipitate if Br−
is used, a white precipitate if Cl−
is used and a yellow precipitate if I−
is used. This reaction is commonly used in inorganic chemistry to abstract halides:
- Ag+
(aq) + X−
(aq) → AgX(s)
where X−
= Cl−
, Br−
, or I−
.
Other silver salts with non-coordinating anions, namely silver tetrafluoroborate and silver hexafluorophosphate are used for more demanding applications.
Similarly, this reaction is used in analytical chemistry to confirm the presence of chloride, bromide, or iodide ions. Samples are typically acidified with dilute nitric acid to remove interfering ions, e.g. carbonate ions and sulfide ions. This step avoids confusion of silver sulfide or silver carbonate precipitates with that of silver halides. The color of precipitate varies with the halide: white (silver chloride), pale yellow/cream (silver bromide), yellow (silver iodide). AgBr and especially AgI photo-decompose to the metal, as evidence by a grayish color on exposed samples.
The same reaction was used on steamships in order to determine whether or not boiler feedwater had been contaminated with seawater. It is still used to determine if moisture on formerly dry cargo is a result of condensation from humid air, or from seawater leaking through the hull.[11]
Organic synthesis[edit]
Silver nitrate is used in many ways in organic synthesis, e.g. for deprotection and oxidations. Ag+
binds alkenes reversibly, and silver nitrate has been used to separate mixtures of alkenes by selective absorption. The resulting adduct can be decomposed with ammonia to release the free alkene.[12] Silver nitrate is highly soluble in water but is poorly soluble in most organic solvents, except acetonitrile (111.8 g/100 g, 25 °C).[13]
Biology[edit]
In histology, silver nitrate is used for silver staining, for demonstrating reticular fibers, proteins and nucleic acids. For this reason it is also used to demonstrate proteins in PAGE gels. It can be used as a stain in scanning electron microscopy.[14]
Indelible ink[edit]
Silver nitrate produces long-lasting stain when applied to skin. An electoral stain makes use of this to mark a finger of people who have voted in an election, allowing easy identification to prevent double-voting.
Medicine[edit]
Silver salts have antiseptic properties. In 1881 Credé introduced the use of dilute solutions of AgNO3 in newborn babies’ eyes at birth to prevent contraction of gonorrhea from the mother, which could cause blindness. (Modern antibiotics are now used instead).[15][16][17]
Fused silver nitrate, shaped into sticks, was traditionally called «lunar caustic». It is used as a cauterizing agent, for example to remove granulation tissue around a stoma. General Sir James Abbott noted in his journals that in India in 1827 it was infused by a British surgeon into wounds in his arm resulting from the bite of a mad dog to cauterize the wounds and prevent the onset of rabies.[18]
Silver nitrate is used to cauterize superficial blood vessels in the nose to help prevent nose bleeds.
Dentists sometimes use silver nitrate-infused swabs to heal oral ulcers. Silver nitrate is used by some podiatrists to kill cells located in the nail bed.
The Canadian physician C. A. Douglas Ringrose researched the use of silver nitrate for sterilization procedures, believing that silver nitrate could be used to block and corrode the fallopian tubes.[19] The technique was ineffective.[20]
Disinfection[edit]
Much research has been done in evaluating the ability of the silver ion at inactivating Escherichia coli, a microorganism commonly used as an indicator for fecal contamination and as a surrogate for pathogens in drinking water treatment. Concentrations of silver nitrate evaluated in inactivation experiments range from 10–200 micrograms per liter as Ag+.
Silver’s antimicrobial activity saw many applications prior to the discovery of modern antibiotics, when it fell into near disuse. Its association with argyria made consumers wary and led them to turn away from it when given an alternative.
Against warts[edit]
Skin stained by silver nitrate
Repeated daily application of silver nitrate can induce adequate destruction of cutaneous warts, but occasionally pigmented scars may develop. In a placebo-controlled study of 70 patients, silver nitrate given over nine days resulted in clearance of all warts in 43% and improvement in warts in 26% one month after treatment compared to 11% and 14%, respectively, in the placebo group.[21]
Safety[edit]
As an oxidant, silver nitrate should be properly stored away from organic compounds. Despite its common usage in extremely low concentrations to prevent gonorrhea and control nose bleeds, silver nitrate is still very toxic and corrosive.[22] Brief exposure will not produce any immediate side effects other than the purple, brown or black stains on the skin, but upon constant exposure to high concentrations, side effects will be noticeable, which include burns. Long-term exposure may cause eye damage. Silver nitrate is known to be a skin and eye irritant. Silver nitrate has not been thoroughly investigated for potential carcinogenic effect.[23]
Silver nitrate is currently unregulated in water sources by the United States Environmental Protection Agency. However, if more than 1 gram of silver is accumulated in the body, a condition called argyria may develop. Argyria is a permanent cosmetic condition in which the skin and internal organs turn a blue-gray color. The United States Environmental Protection Agency used to have a maximum contaminant limit for silver in water until 1990, when it was determined that argyria did not impact the function of any affected organs despite the discolouration.[24] Argyria is more often associated with the consumption of colloidal silver solutions rather than with silver nitrate, since it is only used at extremely low concentrations to disinfect the water. However, it is still important to be wary before ingesting any sort of silver-ion solution.
References[edit]
- ^ a b c d e f g h Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York City: D. Van Nostrand Company. pp. 617–619.
- ^ a b c d Kiper, Ruslan Anatolievich. «silver nitrate». Chemister.ru. Retrieved 2014-07-20.
- ^ a b c d e f Meyer, P.; Rimsky, A.; Chevalier, R. (1978). «Structure du nitrate d’argent à pression et température ordinaires. Exemple de cristal parfait». Acta Crystallogr. B. 34 (5): 1457–1462. doi:10.1107/S0567740878005907.
- ^ a b c Sigma-Aldrich Co., Silver nitrate. Retrieved on 2014-07-20.
- ^ «Silver (metal dust and soluble compounds, as Ag)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Definition of Lunar Caustic». dictionary.die.net. Archived from the original on 2012-01-31.
- ^ Szabadváry, Ferenc (1992). History of analytical chemistry. Taylor & Francis. p. 17. ISBN 978-2-88124-569-5.
- ^ Stern, K. H. (1972). «High Temperature Properties and Decomposition of Inorganic Salts Part 3, Nitrates and Nitrites». Journal of Physical and Chemical Reference Data. 1 (3): 747–772. Bibcode:1972JPCRD…1..747S. doi:10.1063/1.3253104. S2CID 95532988.
- ^ Campaigne, E.; LeSuer, W. M. (1963). «3-Thiophenecarboxylic (Thenoic) Acid». Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 4, p. 919 (preparation of Ag2O, used in oxidation of an aldehyde) - ^ «Silver nitrate method». Transport Information Service. Gesamtverband der Deutschen Versicherungswirtschaf. Retrieved 22 June 2015.
- ^ Cope, A. C.; Bach, R. D. (1973). «trans-Cyclooctene». Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 5, p. 315 - ^ «silver nitrate». chemister.ru. Retrieved 2019-04-04.
- ^ Geissinger HD (2011). «The use of silver nitrate as a stain for scanning electron microscopy of arterial intima and paraffin sections of kidney». Journal of Microscopy. 95 (3): 471–481. doi:10.1111/j.1365-2818.1972.tb01051.x. PMID 4114959. S2CID 38335416.
- ^ Peter.H (2000). «Dr Carl Credé (1819–1892) and the prevention of ophthalmia neonatorum». Arch Dis Child Fetal Neonatal Ed. 83 (2): F158–F159. doi:10.1136/fn.83.2.F158. PMC 1721147. PMID 10952715.
- ^ Credé C. S. E. (1881). «Die Verhürtung der Augenentzündung der Neugeborenen». Archiv für Gynäkologie. 17 (1): 50–53. doi:10.1007/BF01977793. S2CID 10053605.
- ^ Schaller, Ulrich C. & Klauss, Volker (2001). «Is Credés prophylaxis for ophthalmia neonatorum still valid?». Bulletin of the World Health Organization. 79 (3): 262–266. PMC 2566367. PMID 11285676.
- ^ British Library, India Office Records, European Manuscripts, MSS EUR F171/33/3, page 109.
- ^ Ringrose CA. (1973). «Office tubal sterilization». Obstetrics and Gynecology. 42 (1): 151–5. PMID 4720201.
- ^ Cryderman v. Ringrose (1978), 89 D.L.R. (3d) 32 (Alta S.C.) and Zimmer et al. v. Ringrose (1981) 4 W.W.R. 75 (Alta C.A.).
- ^ Sterling, J. C.; Handfield-Jones, S.; Hudson, P. M.; British Association of Dermatologists (2001). «Guidelines for the management of cutaneous warts» (PDF). British Journal of Dermatology. 144 (1): 4–11. doi:10.1046/j.1365-2133.2001.04066.x. PMID 11167676. S2CID 20179474. Archived from the original (PDF) on 2012-03-03.
- ^ «Safety data for silver nitrate (MSDS)». Oxford University Chemistry department.
- ^ «New Jersey Right-To-Know-Act Hazardous Substance Fact Sheet — Silver Nitrate» (PDF).
- ^ «Silver Compounds.» Encyclopedia of Chemical Technology. Vol. 22. Fourth Ed. Excec. Ed. Jaqueline I. Kroschwitz. New York: John Wiley and Sons, 1997.
External links[edit]
- International Chemical Safety Card 1116
- NIOSH Pocket Guide to Chemical Hazards
- History of Kodak: About Film and Imaging
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат серебра | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат серебра(I) |
| Традиционные названия | Серебро азотнокислое; нитрат серебра; адский камень, ляпис |
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352[1] |
| Термические свойства | |
| Температура | |
| • плавления | 209,7[1] |
| • разложения | 440[1] |
| Мол. теплоёмк. | 93,1[1] Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4[1] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C)[1] |
| Оптические свойства | |
| Показатель преломления | 1,744 |
| Классификация | |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES |
[N+](=O)([O-])[O-].[Ag+] |
| InChI |
InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 SQGYOTSLMSWVJD-UHFFFAOYSA-N |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ (в воздухе) |
| ЛД50 |
20 мг/кг (собака, орально) 130 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |
|
| NFPA 704 |
0 3 3 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т серебра́(I), также азотноки́слое серебро́, «а́дский ка́мень», ля́пис (от итал. lapis «карандаш» ← лат. lapis «камень») — неорганическое соединение, соль переходного металла серебра и неорганической азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, легко растворимые в воде. Весьма токсичен, как и все растворимые соли серебра. Не образует кристаллогидратов.
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
.
Этот способ применяют и в промышленности, используют рудное или вторичное серебро с последующей кристаллизацией нитрата серебра из раствора[2].
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C, энтальпия плавления 12,1 кДж/моль[2]. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью[1]. Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К[2].
Хорошо растворим в воде, растворимость 215,5 г/100 г при 20 °C; с ростом температуры растворимость растёт (471,4 г/100 г при 60 °C, 651,9 г/100 г при 80 °C), в присутствии азотной кислоты резко снижается[2].
Другие растворимости (при 20 °C): в метиловом спирте — 3,6 г/100 г; в этиловом спирте — 2,12 г/100 г; в ацетоне — 0,44 г/100 г; в пиридине — 33,6 г/100 г. Растворим в ацетонитриле.
Нитрат серебра(I) обладает жгуче-кислым вкусом.
При комнатной температуре образует кристаллы ромбической сингонии, пространственная группа Pbca, параметры ячейки a = 0,6995 нм, b = 0,7328 нм, c = 1,0118 нм, Z = 8, d = 4,35 г/см3. При температуре выше 159,5 °C переходит в кристаллы тригональной сингонии, параметры ячейки a = 0,6287 нм, α = 48,5°, Z = 2. Энтальпия полиморфного перехода 2,47 кДж/моль[2].
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте[3]:
,
.
Образует осадки с водными растворами бромидов, иодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
.
- Реагирует с щёлочью с образованием оксида:
- в этаноле, при -50 °C, образуется гидроксид серебра
Применение
Нитрат серебра применяется:
- в гальванотехнике, производстве зеркал и неорганическом синтезе как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов[4], в производстве фотоэмульсий[2];
- в медицине, как средство для прижигания кожи и бактерицидное средство.
Использование в медицине

Пятна от нитрата серебра на коже
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия, иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок[5][6].
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Особенности обращения, биологическое действие
- Нитрат серебра(I) в высоких концентрациях ядовит. Минимальная смертельная доза (ЛД50) для собак — 20 мг/кг, для кроликов — 130 мг/кг.
- ПДК нитрата серебра(I) в воздухе рабочей зоны — 0,5 мг/м³, ПДК в воде — 0,05 мг/дм³ (с обязательным контролем по ионам серебра).
- Класс опасности — 2 (вещества высокоопасные) согласно ГОСТ 12.1.007-76.
- Как и все нитраты, является сильным окислителем.
- Вещество коррозионно-активно, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея
- Изображения нитрата серебра
-
-
Примечания
- ↑ 1 2 3 4 5 6 7 CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — 2828 p. — ISBN 1420090844.
- ↑ 1 2 3 4 5 6 Чукуров П. М. Серебра нитрат // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 322. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 82. Соляная кислота // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 195—196. — 240 с. — 1 630 000 экз.
- ↑ Гурлев, 1988, с. 149—150, 300—301.
- ↑ Бельских С. А. Эффективен ли ляписный карандаш при лечении бородавок, отзывы Архивная копия от 2 марта 2017 на Wayback Machine. — dermatolog.guru.
- ↑ Аптечные старожилы Архивная копия от 31 января 2009 на Wayback Machine // alhimik.ru
Литература
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — Киев: Тэхника, 1988.
Ссылки
- Аптечные старожилы Архивная копия от 31 января 2009 на Wayback Machine.
Эта страница в последний раз была отредактирована 16 февраля 2023 в 16:05.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Химическое название
Нитрат Серебра 1
Химические свойства
Вещество также называют ляпис, азотнокислое серебро, «адский камень». Химическое соединение из неорганической химии, соль, образованная металлом и азотной кислотой. Молярная масса соединения = 169,9 грамм на моль. По своим физическим свойствам – это прозрачные бесцветные кристаллы, в форме мелких палочек и пластинок. Хорошо растворяется в воде и этиловом спирте. Вещество темнеет на свету, имеет жгуче-кислый вкус. Формула Нитрата Серебра: AgNO3, совпадает с рацемической формулой. Начинает разлагаться при температуре выше 300 градусов Цельсия.
Химические свойства
Раствор Нитрата Серебра реагирует с соляной кислотой и солями соляной кислоты. Во время реакции образуется белый творожистый осадок хлорида Ag, который не растворим в азотной кислоте. При действии высоких температур начинается разложение Нитрата Серебра (примерно 350 градусов), при этом выделяется металл, кислород и NO2. При электролизе раствора азотнокислого серебра на катоде выделяется Ag, а на аноде — кислород. Таким образом вещество диссоциирует на ионы Ag+ и NO3–.
Соль активно применяется в медицине; при проявке пленочных фотографий; входит в состав ляписного карандаша в комбинации с нитратом калия; при получении диоксана, растворителей для смягчения химикатов. Вещество используют при производстве аккумуляторов, в криминалистике, текстильной промышленности.
Фармакологическое действие
Прижигающее, противовоспалительное, антисептическое, бактерицидное, противомикробное.
Фармакодинамика и фармакокинетика
Нитрат Серебра вызывает денатурацию белковых молекул, связывая карбоксильные и сульфгидрильные группы, изменяя конформацию молекулы. Бактерицидное действие вещества возникает во время диссоциации соединения на ионы. При взаимодействии средства с белками образуется альбуминат серебра имеющий черную окраску. Вещество нарушает работу некоторых ферментных систем в микробных клетках. Лекарство обладает кратковременными бактерицидным и длительным бактериостатическим действием. Даже сильно разведенный раствор способен оказывает сильное бактерицидное действие.
При определенной концентрации ионов Ag вещество проявляется вяжущие и противовоспалительные свойства, так как преципитация происходит только в интерстициальных белках. При применении высоких концентраций лекарства, образуются рыхлые альбуминаты и значительно повреждаются клеточные мембраны и внутриклеточные структуры.
Показания к применению
Применение азотнокислого серебра:
- при эрозиях, язвах, трещинах;
- для ликвидации мелких бородавок;
- в гомеопатии;
- для профилактики гонококковой инфекции у грудных детей (2% раствор);
- внутрь, при язве желудка и 12-перстной кишки (сейчас не назначается).
Противопоказания
Средство нельзя использовать при аллергии.
Побочные действия
Азотнокислое серебро может спровоцировать развитие аллергических реакций.
Нитрат Серебра, инструкция по применению (Способ и дозировка)
Применять наружно. Перед использованием следует проконсультироваться с врачом и четко соблюдать его рекомендации.
Передозировка
При длительном контакте вещества с кожей могут возникнуть глубокие ожоги.
Взаимодействие
Вещество разлагается при контакте с бромидами, хлоридами, йодидами и органикой.
Условия продажи
Может понадобиться рецепт.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Азотнокислое серебро в сочетании с нитратом калия находится в Ляписном медицинском карандаше; входит в состав некоторых гомеопатических средств.
Отзывы
Отзывы о лекарственном средстве оставляют в основном при попытках избавиться от бородавок с помощью Ляписного карандаша:
- “… Использовала это средство в течение 2 месяцев на бородавке на руке. Сейчас она вроде сошла, только осталось маленькое красное пятнышко”;
- “… Мне карандаш не помог вообще. Что только не пробовала, пока не попала к врачу, и не удалила новообразование ультразвуком — все было напрасно”;
- “… Бородавки постепенно начали чернеть, эффект начал проявляться спустя несколько недель. После использования карандаша пока не появлялись более”.
Цена, где купить
Купить азотнокислое серебро удастся в интернет-магазине или аптечной сети. Купить Нитрат Серебра в аптеке в виде Медицинского Ляписного карандаша можно примерно за 120 рублей.






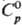
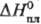
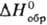










![{displaystyle {ce {2AgNO3->[350~^{circ }{text{C}}]2Ag + 2NO2 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8970bc87aa0e2d0f31de127b3cc825046d651dd4)

![{displaystyle {ce {AgNO3 +KOH->[{-50~^{circ }{text{C}}}][{C_{2}H_{5}OH}]AgOH +KNO3v}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cbc14be6b6b7072f3a821180a0f555f848f69d9)

