| Нитрат свинца | ||
|---|---|---|
|
||
| Систематическое наименование |
нитрат свинца II | |
| Хим. формула | Pb(NO3)2 | |
| Состояние | бесцветное вещество | |
| Молярная масса | 331.2 г/моль | |
| Плотность | (20 °C) 4,53 г/см³ | |
| Температура | ||
| • плавления | (разл.) 270 °C | |
| • вспышки | негорюч °C | |
| Растворимость | ||
| • в воде | (20 °C) 52 г/100мл
(100 °C) 127 г/100 мл |
|
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим | |
| Показатель преломления | 1.782 | |
| Координационная геометрия | кубооктаэдрическая | |
| Кристаллическая структура | гранецентрированная кубическая | |
| Рег. номер CAS | 10099-74-8 | |
| PubChem | 16683880 | |
| Рег. номер EINECS | 233-245-9 | |
| SMILES |
[N+](=O)([O-])O[Pb]O[N+](=O)[O-] |
|
| InChI |
1S/2NO3.Pb/c2*2-1(3)4;/q2*-1;+2 RLJMLMKIBZAXJO-UHFFFAOYSA-N |
|
| RTECS | OG2100000 | |
| ChEBI | 37187 | |
| Номер ООН | 1469 | |
| ChemSpider | 23300 и 21781774 | |
| Пиктограммы ECB |  |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат свинца II (Свинец азотнокислый) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
Содержание
- 1 История
- 2 Физические свойства
- 2.1 Кристаллическая структура
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Меры предосторожности
История
Исторически первое промышленное применение нитрата свинца II — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца II), «хром оранжевый» (гидроксид-хромат свинца II) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий.
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса.
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны.
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
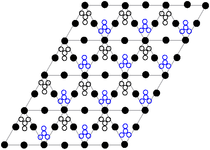
Кристаллическая структура динитрата свинца, плоскость
Кристаллическая структура
Кристаллическая структура твердого динитрата свинца была определена с помощью нейтронной дифракции. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
- 3 Pb + 8 HNO3 ⟶ 3 Pb(NO3)2 + 2 NO ↑ + 4 H2O
- PbO + 2 HNO3 ⟶ Pb(NO3)2 + H2O
- Pb(OH)2 + 2 HNO3 ⟶ Pb(NO3)2 + 2 H2O
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота.
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
- Pb(NO3)2 ⇄ Pb2+ + 2 NO3−
Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель pH от 3,0 до 4,0 для 20 % водного раствора. При избытке ионов NO3− в растворе образуются нитратокомплексы [Pb(NO3)3]−, [Pb(NO3)4]2− и [Pb(NO3)6]4−. При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца II являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
- Pb(NO3)2 + 2 HCl ⟶ PbCl2 ↓ + 2 HNO3
- Pb(NO3)2 + H2SO4 ⟶ PbSO4 ↓ + 2 HNO3
- Pb(NO3)2 + 2 NaOH ⟶ Pb(OH)2 ↓ + 2 NaNO3
- Pb(NO3)2 + 2 NaN3 ⟶ Pb(N3)2 ↓ + 2 NaNO3
Любое соединение, содержащее катион свинца II, будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-жёлтого цвета (йодид свинца II). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь:
- Pb2+ + 2 I− ⟶ PbI2 ↓
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступке, происходит реакция:
- Pb(NO3)2 + 2 KI ⟶ PbI2 + 2 KNO3
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb2+-ион, который имеет стандартный редокс-потенциал (E0) −0.125 V, или нитрат-ион, который в кислой среде имеет (E0) +0.956 V .
При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца II, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
- 2 Pb(NO3)2 ⟶ 2 PbO + 4 NO2 + O2
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике.
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца II начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота).
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции.
Меры предосторожности
Динитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца.
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери.
From Wikipedia, the free encyclopedia
|
||
| Identifiers | ||
|---|---|---|
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.030.210 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1469 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Pb(NO3)2 | |
| Molar mass | 331.2 g/mol | |
| Appearance | colorless or white | |
| Density | 4.53 g/cm3 | |
| Melting point | 470 °C (878 °F; 743 K)[2] decomposes | |
|
Solubility in water |
376.5 g/L (0 °C) 597 g/L (25°C) 1270 g/L (100°C) |
|
|
Magnetic susceptibility (χ) |
−74·10−6 cm3/mol[1] | |
|
Refractive index (nD) |
1.782[2] | |
| Thermochemistry | ||
|
Std enthalpy of |
−451.9 kJ·mol−1[1] | |
| Hazards | ||
| GHS labelling:[4] | ||
|
Pictograms |
   
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H302, H317, H318, H332, H360, H373, H410 | |
|
Precautionary statements |
P201, P202, P210, P220, P221, P260, P261, P264, P270, P271, P272, P273, P280, P281, P301+P312, P302+P352, P304+P312, P304+P340, P305+P351+P338, P308+P313, P310, P312, P314, P321, P330, P333+P313, P363, P370+P378, P391, P405, P501 | |
| NFPA 704 (fire diamond) |
3 0 1 OX |
|
| Lethal dose or concentration (LD, LC): | ||
|
LDLo (lowest published) |
500 mg/kg (guinea pig, oral)[3] | |
| Safety data sheet (SDS) | ICSC 1000 | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Lead(II) nitrate is an inorganic compound with the chemical formula Pb(NO3)2. It commonly occurs as a colourless crystal or white powder and, unlike most other lead(II) salts, is soluble in water.
Known since the Middle Ages by the name plumbum dulce, the production of lead(II) nitrate from either metallic lead or lead oxide in nitric acid was small-scale, for direct use in making other lead compounds. In the nineteenth century lead(II) nitrate began to be produced commercially in Europe and the United States. Historically, the main use was as a raw material in the production of pigments for lead paints, but such paints have been superseded by less toxic paints based on titanium dioxide. Other industrial uses included heat stabilization in nylon and polyesters, and in coatings of photothermographic paper. Since around the year 2000, lead(II) nitrate has begun to be used in gold cyanidation.
Lead(II) nitrate is toxic and must be handled with care to prevent inhalation, ingestion and skin contact. Due to its hazardous nature, the limited applications of lead(II) nitrate are under constant scrutiny.
History[edit]
Lead nitrate was first identified in 1597 by the alchemist Andreas Libavius, who called the substance plumbum dulce, meaning «sweet lead», because of its taste.[5] It is produced commercially by reaction of metallic lead with concentrated nitric acid in which it is sparingly soluble.[6][7] It has been produced as a raw material for making pigments such as chrome yellow (lead(II) chromate, PbCrO4) and chrome orange (basic lead(II) chromate, Pb2CrO5) and Naples yellow. These pigments were used for dyeing and printing calico and other textiles.[8] It has been used as an oxidizer in black powder and together with lead azide in special explosives.[9]
Production[edit]
Lead nitrate is produced by reaction of lead(II) oxide with concentrated nitric acid:[10]
- PbO + 2 HNO3(concentrated) → Pb(NO3)2↓ + H2O
It may also be obtained evaporation of the solution obtained by reacting metallic lead with dilute nitric acid.[11]
- Pb + 4 HNO3 → Pb(NO3)2 + 2 NO2 + 2 H2O
Solutions and crystals of lead(II) nitrate are formed in the processing of lead–bismuth wastes from lead refineries.[12]
Structure[edit]
Crystal structure of Pb(NO3)2 [111] plane
The crystal structure of solid lead(II) nitrate has been determined by neutron diffraction.[13][14] The compound crystallizes in the cubic system with the lead atoms in a face-centred cubic system. Its space group is Pa3Z=4 (Bravais lattice notation), with each side of the cube with length 784 picometres.
The black dots represent the lead atoms, the white dots the nitrate groups 27 picometres above the plane of the lead atoms, and the blue dots the nitrate groups the same distance below this plane. In this configuration, every lead atom is bonded to twelve oxygen atoms (bond length: 281 pm). All N–O bond lengths are identical, at 127 picometres.[15]
Research interest in the crystal structure of lead(II) nitrate was partly based on the possibility of free internal rotation of the nitrate groups within the crystal lattice at elevated temperatures, but this did not materialise.[14]
Chemical properties and reactions[edit]
Solubility of lead nitrate in nitric acid at 26 °C.[16]
Lead nitrate decomposes on heating, a property that has been used in pyrotechnics .[9] It is soluble in water and dilute nitric acid.
Basic nitrates are formed in when alkali is added to a solution. Pb2(OH)2(NO3)2 is the predominant species formed at low pH. At higher pH Pb6(OH)5(NO3) is formed.[17] The cation [Pb6O(OH)6]4+ is unusual in having an oxide ion inside a cluster of 3 face-sharing PbO4 tetrahedra.[18]
There is no evidence for the formation of the hydroxide, Pb(OH)2, in aqueous solution below pH 12.
Solutions of lead nitrate can be used to form co-ordination complexes. Lead(II) is a hard acceptor; it forms stronger complexes with nitrogen and oxygen electron-donating ligands. For example, combining lead nitrate and pentaethylene glycol (EO5) in a solution of acetonitrile and methanol followed by slow evaporation produced the compound [Pb(NO3)2(EO5)].[19] In the crystal structure for this compound, the EO5 chain is wrapped around the lead ion in an equatorial plane similar to that of a crown ether. The two bidentate nitrate ligands are in trans configuration. The total coordination number is 10, with the lead ion in a bicapped square antiprism molecular geometry.
The complex formed by lead nitrate with a bithiazole bidentate N-donor ligand is binuclear. The crystal structure shows that the nitrate group forms a bridge between two lead atoms.[20] One interesting aspect of this type of complexes is the presence of a physical gap in the coordination sphere; i.e., the ligands are not placed symmetrically around the metal ion. This is potentially due to a lead lone pair of electrons, also found in lead complexes with an imidazole ligand.[21]
Applications[edit]
Lead nitrate has been used as a heat stabiliser in nylon and polyesters, as a coating for photothermographic paper, and in rodenticides.[10]
Heating lead nitrate is convenient means of making nitrogen dioxide
In the gold cyanidation process, addition of lead(II) nitrate solution improves the leaching process. Only limited amounts (10 to 100 milligrams lead nitrate per kilogram gold) are required.[22][23]
In organic chemistry, it may be used in the preparation of isothiocyanates from dithiocarbamates.[24] Its use as a bromide scavenger during SN1 substitution has been reported.[25]
Safety[edit]
Lead(II) nitrate is toxic, and ingestion may lead to acute lead poisoning, as is applicable for all soluble lead compounds.[26] All inorganic lead compounds are classified by the International Agency for Research on Cancer (IARC) as probably carcinogenic to humans (Category 2A).[27] They have been linked to renal cancer and glioma in experimental animals and to renal cancer, brain cancer and lung cancer in humans, although studies of workers exposed to lead are often complicated by concurrent exposure to arsenic.[28] Lead is known to substitute for zinc in a number of enzymes, including δ-aminolevulinic acid dehydratase (porphobilinogen synthase) in the haem biosynthetic pathway and pyrimidine-5′-nucleotidase, important for the correct metabolism of DNA and can therefore cause fetal damage.[29]
References[edit]
- ^ a b CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ a b Patnaik, Pradyot (2003). Handbook of inorganic chemicals. New York: McGraw-Hill. p. 475. ISBN 0-07-049439-8. OCLC 50252041.
- ^ «Lead compounds (as Pb)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Lead nitrate». pubchem.ncbi.nlm.nih.gov. Retrieved 19 December 2021.
- ^ Libavius, Andreas (1595). Alchemia Andreæ Libavii. Francofurti: Iohannes Saurius.
- ^ Chisholm, Hugh, ed. (1911). «Lead» . Encyclopædia Britannica. Vol. 16 (11th ed.). Cambridge University Press. pp. 314–320.
- ^ Macgregor, John (1847). Progress of America to year 1846. London: Whittaker & Co. ISBN 0-665-51791-2.
- ^ Partington, James Riddick (1950). A Text-book of Inorganic Chemistry. MacMillan. p. 838.
- ^ a b Barkley, J. B. (October 1978). «Lead nitrate as an oxidizer in blackpowder». Pyrotechnica. Post Falls, Idaho: Pyrotechnica Publications. 4: 16–18.
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. pp. 388, 456. ISBN 0-7506-3365-4.
- ^ Othmer, D. F. (1967). Kirk-Othmer Encyclopedia of Chemical Technology. Vol. 12 (Iron to Manganese) (second completely revised ed.). New York: John Wiley & Sons. p. 272. ISBN 0-471-02040-0.
- ^ «Product catalog; other products». Tilly, Belgium: Sidech. Archived from the original on 2007-07-01. Retrieved 2008-01-05.
- ^ Hamilton, W. C. (1957). «A neutron crystallographic study of lead nitrate». Acta Crystallogr. 10 (2): 103–107. doi:10.1107/S0365110X57000304.
- ^ a b Nowotny, H.; G. Heger (1986). «Structure refinement of lead nitrate». Acta Crystallogr. C. 42 (2): 133–35. doi:10.1107/S0108270186097032.
- ^ «Cấu trúc của chì nitrat». Retrieved 15 July 2019.
- ^ Ferris, L. M. (1959). «Lead nitrate—Nitric acid—Water system». Journal of Chemical & Engineering Data. 5 (3): 242. doi:10.1021/je60007a002.
- ^ Pauley, J. L.; M. K. Testerman (1954). «Basic Salts of Lead Nitrate Formed in Aqueous Media». Journal of the American Chemical Society. 76 (16): 4220–4222. doi:10.1021/ja01645a062.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. p. 395
- ^ Rogers, Robin D.; Andrew H. Bond; Debra M. Roden (1996). «Structural Chemistry of Poly (ethylene glycol). Complexes of Lead(II) Nitrate and Lead(II) Bromide». Inorg. Chem. 35 (24): 6964–6973. doi:10.1021/ic960587b. PMID 11666874.
- ^ Mahjoub, Ali Reza; Ali Morsali (2001). «A Dimeric Mixed-Anions Lead(II) Complex: Synthesis and Structural Characterization of [Pb2(BTZ)4(NO3)(H2O)](ClO4)3 {BTZ = 4,4′-Bithiazole}». Chemistry Letters. 30 (12): 1234. doi:10.1246/cl.2001.1234.
- ^ Shuang-Yi Wan; Jian Fan; Taka-aki Okamura; Hui-Fang Zhu; Xing-Mei Ouyang; Wei-Yin Sun & Norikazu Ueyama (2002). «2D 4.82 Network with threefold parallel interpenetration from nanometre-sized tripodal ligand and lead(II) nitrate». Chem. Commun. (21): 2520–2521. doi:10.1039/b207568g.
- ^ Habashi, Fathi (1998). «Recent advances in gold metallurgy». Revisa de la Facultad de Ingeniera, Universidad Central de Venezuela. 13 (2): 43–54.
- ^ «Auxiliary agents in gold cyanidation». Gold Prospecting and Gold Mining. Retrieved 2008-01-05.
- ^ Dains, F. B.; Brewster, R. Q.; Olander, C. P. «Phenyl isothiocyanate». Organic Syntheses.; Collective Volume, vol. 1, p. 447
- ^
Rapoport, H.; Jamison, T. (1998). «(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate». Organic Syntheses.; Collective Volume, vol. 9, p. 344 - ^ «Lead nitrate, Chemical Safety Card 1000». International Labour Organization, International Occupational Safety and Health Information Centre. March 1999. Retrieved 2008-01-19.
- ^ «Inorganic and Organic Lead Compounds» (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer. Suppl. 7: 239. 1987. Archived from the original (PDF) on 2008-03-06. Retrieved 2008-01-19.
- ^ World Health Organization, International Agency for Research on Cancer (2006). «Inorganic and Organic Lead Compounds» (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer. 87. ISBN 92-832-1287-8. Archived from the original (PDF) on 2007-10-21. Retrieved 2008-01-01.
- ^ Mohammed-Brahim, B.; Buchet, J.P.; Lauwerys, R. (1985). «Erythrocyte pyrimidine 5′-nucleotidase activity in workers exposed to lead, mercury or cadmium». Int Arch Occup Environ Health. 55 (3): 247–52. doi:10.1007/BF00383757. PMID 2987134. S2CID 40092031.
External links[edit]
- Woodbury, William D. (1982). «Lead». Mineral Yearbook Metals and Minerals. Bureau of Mines: 515–42. Retrieved 2008-01-18.
- «Lead». NIOSH Pocket Guide to Chemical Hazards. National Institute for Occupational Safety and Health. September 2005. NIOSH 2005-149. Retrieved 2008-01-19.
- «Lead and Lead Compounds Fact Sheet». National Pollutant Inventory. Australian Government, Department of the Environment and Water Resources. July 2007. Archived from the original on January 11, 2008. Retrieved 2008-01-19.
- «Lead». A Healthy Home Environment, Health Hazards. US Alliance for healthy homes. Archived from the original on 2008-02-20. Retrieved 2008-01-19.
- Material Safety Data Sheets
- MSDS for lead nitrate, PTCL, Oxford University
- MSDS for lead nitrate, Science Stuff Inc
- MSDS for lead nitrate, Iowa State University
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
From Wikipedia, the free encyclopedia
|
||
| Identifiers | ||
|---|---|---|
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.030.210 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1469 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Pb(NO3)2 | |
| Molar mass | 331.2 g/mol | |
| Appearance | colorless or white | |
| Density | 4.53 g/cm3 | |
| Melting point | 470 °C (878 °F; 743 K)[2] decomposes | |
|
Solubility in water |
376.5 g/L (0 °C) 597 g/L (25°C) 1270 g/L (100°C) |
|
|
Magnetic susceptibility (χ) |
−74·10−6 cm3/mol[1] | |
|
Refractive index (nD) |
1.782[2] | |
| Thermochemistry | ||
|
Std enthalpy of |
−451.9 kJ·mol−1[1] | |
| Hazards | ||
| GHS labelling:[4] | ||
|
Pictograms |
   
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H302, H317, H318, H332, H360, H373, H410 | |
|
Precautionary statements |
P201, P202, P210, P220, P221, P260, P261, P264, P270, P271, P272, P273, P280, P281, P301+P312, P302+P352, P304+P312, P304+P340, P305+P351+P338, P308+P313, P310, P312, P314, P321, P330, P333+P313, P363, P370+P378, P391, P405, P501 | |
| NFPA 704 (fire diamond) |
3 0 1 OX |
|
| Lethal dose or concentration (LD, LC): | ||
|
LDLo (lowest published) |
500 mg/kg (guinea pig, oral)[3] | |
| Safety data sheet (SDS) | ICSC 1000 | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Lead(II) nitrate is an inorganic compound with the chemical formula Pb(NO3)2. It commonly occurs as a colourless crystal or white powder and, unlike most other lead(II) salts, is soluble in water.
Known since the Middle Ages by the name plumbum dulce, the production of lead(II) nitrate from either metallic lead or lead oxide in nitric acid was small-scale, for direct use in making other lead compounds. In the nineteenth century lead(II) nitrate began to be produced commercially in Europe and the United States. Historically, the main use was as a raw material in the production of pigments for lead paints, but such paints have been superseded by less toxic paints based on titanium dioxide. Other industrial uses included heat stabilization in nylon and polyesters, and in coatings of photothermographic paper. Since around the year 2000, lead(II) nitrate has begun to be used in gold cyanidation.
Lead(II) nitrate is toxic and must be handled with care to prevent inhalation, ingestion and skin contact. Due to its hazardous nature, the limited applications of lead(II) nitrate are under constant scrutiny.
History[edit]
Lead nitrate was first identified in 1597 by the alchemist Andreas Libavius, who called the substance plumbum dulce, meaning «sweet lead», because of its taste.[5] It is produced commercially by reaction of metallic lead with concentrated nitric acid in which it is sparingly soluble.[6][7] It has been produced as a raw material for making pigments such as chrome yellow (lead(II) chromate, PbCrO4) and chrome orange (basic lead(II) chromate, Pb2CrO5) and Naples yellow. These pigments were used for dyeing and printing calico and other textiles.[8] It has been used as an oxidizer in black powder and together with lead azide in special explosives.[9]
Production[edit]
Lead nitrate is produced by reaction of lead(II) oxide with concentrated nitric acid:[10]
- PbO + 2 HNO3(concentrated) → Pb(NO3)2↓ + H2O
It may also be obtained evaporation of the solution obtained by reacting metallic lead with dilute nitric acid.[11]
- Pb + 4 HNO3 → Pb(NO3)2 + 2 NO2 + 2 H2O
Solutions and crystals of lead(II) nitrate are formed in the processing of lead–bismuth wastes from lead refineries.[12]
Structure[edit]
Crystal structure of Pb(NO3)2 [111] plane
The crystal structure of solid lead(II) nitrate has been determined by neutron diffraction.[13][14] The compound crystallizes in the cubic system with the lead atoms in a face-centred cubic system. Its space group is Pa3Z=4 (Bravais lattice notation), with each side of the cube with length 784 picometres.
The black dots represent the lead atoms, the white dots the nitrate groups 27 picometres above the plane of the lead atoms, and the blue dots the nitrate groups the same distance below this plane. In this configuration, every lead atom is bonded to twelve oxygen atoms (bond length: 281 pm). All N–O bond lengths are identical, at 127 picometres.[15]
Research interest in the crystal structure of lead(II) nitrate was partly based on the possibility of free internal rotation of the nitrate groups within the crystal lattice at elevated temperatures, but this did not materialise.[14]
Chemical properties and reactions[edit]
Solubility of lead nitrate in nitric acid at 26 °C.[16]
Lead nitrate decomposes on heating, a property that has been used in pyrotechnics .[9] It is soluble in water and dilute nitric acid.
Basic nitrates are formed in when alkali is added to a solution. Pb2(OH)2(NO3)2 is the predominant species formed at low pH. At higher pH Pb6(OH)5(NO3) is formed.[17] The cation [Pb6O(OH)6]4+ is unusual in having an oxide ion inside a cluster of 3 face-sharing PbO4 tetrahedra.[18]
There is no evidence for the formation of the hydroxide, Pb(OH)2, in aqueous solution below pH 12.
Solutions of lead nitrate can be used to form co-ordination complexes. Lead(II) is a hard acceptor; it forms stronger complexes with nitrogen and oxygen electron-donating ligands. For example, combining lead nitrate and pentaethylene glycol (EO5) in a solution of acetonitrile and methanol followed by slow evaporation produced the compound [Pb(NO3)2(EO5)].[19] In the crystal structure for this compound, the EO5 chain is wrapped around the lead ion in an equatorial plane similar to that of a crown ether. The two bidentate nitrate ligands are in trans configuration. The total coordination number is 10, with the lead ion in a bicapped square antiprism molecular geometry.
The complex formed by lead nitrate with a bithiazole bidentate N-donor ligand is binuclear. The crystal structure shows that the nitrate group forms a bridge between two lead atoms.[20] One interesting aspect of this type of complexes is the presence of a physical gap in the coordination sphere; i.e., the ligands are not placed symmetrically around the metal ion. This is potentially due to a lead lone pair of electrons, also found in lead complexes with an imidazole ligand.[21]
Applications[edit]
Lead nitrate has been used as a heat stabiliser in nylon and polyesters, as a coating for photothermographic paper, and in rodenticides.[10]
Heating lead nitrate is convenient means of making nitrogen dioxide
In the gold cyanidation process, addition of lead(II) nitrate solution improves the leaching process. Only limited amounts (10 to 100 milligrams lead nitrate per kilogram gold) are required.[22][23]
In organic chemistry, it may be used in the preparation of isothiocyanates from dithiocarbamates.[24] Its use as a bromide scavenger during SN1 substitution has been reported.[25]
Safety[edit]
Lead(II) nitrate is toxic, and ingestion may lead to acute lead poisoning, as is applicable for all soluble lead compounds.[26] All inorganic lead compounds are classified by the International Agency for Research on Cancer (IARC) as probably carcinogenic to humans (Category 2A).[27] They have been linked to renal cancer and glioma in experimental animals and to renal cancer, brain cancer and lung cancer in humans, although studies of workers exposed to lead are often complicated by concurrent exposure to arsenic.[28] Lead is known to substitute for zinc in a number of enzymes, including δ-aminolevulinic acid dehydratase (porphobilinogen synthase) in the haem biosynthetic pathway and pyrimidine-5′-nucleotidase, important for the correct metabolism of DNA and can therefore cause fetal damage.[29]
References[edit]
- ^ a b CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ a b Patnaik, Pradyot (2003). Handbook of inorganic chemicals. New York: McGraw-Hill. p. 475. ISBN 0-07-049439-8. OCLC 50252041.
- ^ «Lead compounds (as Pb)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Lead nitrate». pubchem.ncbi.nlm.nih.gov. Retrieved 19 December 2021.
- ^ Libavius, Andreas (1595). Alchemia Andreæ Libavii. Francofurti: Iohannes Saurius.
- ^ Chisholm, Hugh, ed. (1911). «Lead» . Encyclopædia Britannica. Vol. 16 (11th ed.). Cambridge University Press. pp. 314–320.
- ^ Macgregor, John (1847). Progress of America to year 1846. London: Whittaker & Co. ISBN 0-665-51791-2.
- ^ Partington, James Riddick (1950). A Text-book of Inorganic Chemistry. MacMillan. p. 838.
- ^ a b Barkley, J. B. (October 1978). «Lead nitrate as an oxidizer in blackpowder». Pyrotechnica. Post Falls, Idaho: Pyrotechnica Publications. 4: 16–18.
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. pp. 388, 456. ISBN 0-7506-3365-4.
- ^ Othmer, D. F. (1967). Kirk-Othmer Encyclopedia of Chemical Technology. Vol. 12 (Iron to Manganese) (second completely revised ed.). New York: John Wiley & Sons. p. 272. ISBN 0-471-02040-0.
- ^ «Product catalog; other products». Tilly, Belgium: Sidech. Archived from the original on 2007-07-01. Retrieved 2008-01-05.
- ^ Hamilton, W. C. (1957). «A neutron crystallographic study of lead nitrate». Acta Crystallogr. 10 (2): 103–107. doi:10.1107/S0365110X57000304.
- ^ a b Nowotny, H.; G. Heger (1986). «Structure refinement of lead nitrate». Acta Crystallogr. C. 42 (2): 133–35. doi:10.1107/S0108270186097032.
- ^ «Cấu trúc của chì nitrat». Retrieved 15 July 2019.
- ^ Ferris, L. M. (1959). «Lead nitrate—Nitric acid—Water system». Journal of Chemical & Engineering Data. 5 (3): 242. doi:10.1021/je60007a002.
- ^ Pauley, J. L.; M. K. Testerman (1954). «Basic Salts of Lead Nitrate Formed in Aqueous Media». Journal of the American Chemical Society. 76 (16): 4220–4222. doi:10.1021/ja01645a062.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. p. 395
- ^ Rogers, Robin D.; Andrew H. Bond; Debra M. Roden (1996). «Structural Chemistry of Poly (ethylene glycol). Complexes of Lead(II) Nitrate and Lead(II) Bromide». Inorg. Chem. 35 (24): 6964–6973. doi:10.1021/ic960587b. PMID 11666874.
- ^ Mahjoub, Ali Reza; Ali Morsali (2001). «A Dimeric Mixed-Anions Lead(II) Complex: Synthesis and Structural Characterization of [Pb2(BTZ)4(NO3)(H2O)](ClO4)3 {BTZ = 4,4′-Bithiazole}». Chemistry Letters. 30 (12): 1234. doi:10.1246/cl.2001.1234.
- ^ Shuang-Yi Wan; Jian Fan; Taka-aki Okamura; Hui-Fang Zhu; Xing-Mei Ouyang; Wei-Yin Sun & Norikazu Ueyama (2002). «2D 4.82 Network with threefold parallel interpenetration from nanometre-sized tripodal ligand and lead(II) nitrate». Chem. Commun. (21): 2520–2521. doi:10.1039/b207568g.
- ^ Habashi, Fathi (1998). «Recent advances in gold metallurgy». Revisa de la Facultad de Ingeniera, Universidad Central de Venezuela. 13 (2): 43–54.
- ^ «Auxiliary agents in gold cyanidation». Gold Prospecting and Gold Mining. Retrieved 2008-01-05.
- ^ Dains, F. B.; Brewster, R. Q.; Olander, C. P. «Phenyl isothiocyanate». Organic Syntheses.; Collective Volume, vol. 1, p. 447
- ^
Rapoport, H.; Jamison, T. (1998). «(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate». Organic Syntheses.; Collective Volume, vol. 9, p. 344 - ^ «Lead nitrate, Chemical Safety Card 1000». International Labour Organization, International Occupational Safety and Health Information Centre. March 1999. Retrieved 2008-01-19.
- ^ «Inorganic and Organic Lead Compounds» (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer. Suppl. 7: 239. 1987. Archived from the original (PDF) on 2008-03-06. Retrieved 2008-01-19.
- ^ World Health Organization, International Agency for Research on Cancer (2006). «Inorganic and Organic Lead Compounds» (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer. 87. ISBN 92-832-1287-8. Archived from the original (PDF) on 2007-10-21. Retrieved 2008-01-01.
- ^ Mohammed-Brahim, B.; Buchet, J.P.; Lauwerys, R. (1985). «Erythrocyte pyrimidine 5′-nucleotidase activity in workers exposed to lead, mercury or cadmium». Int Arch Occup Environ Health. 55 (3): 247–52. doi:10.1007/BF00383757. PMID 2987134. S2CID 40092031.
External links[edit]
- Woodbury, William D. (1982). «Lead». Mineral Yearbook Metals and Minerals. Bureau of Mines: 515–42. Retrieved 2008-01-18.
- «Lead». NIOSH Pocket Guide to Chemical Hazards. National Institute for Occupational Safety and Health. September 2005. NIOSH 2005-149. Retrieved 2008-01-19.
- «Lead and Lead Compounds Fact Sheet». National Pollutant Inventory. Australian Government, Department of the Environment and Water Resources. July 2007. Archived from the original on January 11, 2008. Retrieved 2008-01-19.
- «Lead». A Healthy Home Environment, Health Hazards. US Alliance for healthy homes. Archived from the original on 2008-02-20. Retrieved 2008-01-19.
- Material Safety Data Sheets
- MSDS for lead nitrate, PTCL, Oxford University
- MSDS for lead nitrate, Science Stuff Inc
- MSDS for lead nitrate, Iowa State University
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Морфемный разбор слова:
Однокоренные слова к слову:
Нитрат свинца(II)
| Динитрат свинца | |
 |
|
 |
|
  |
|
| Общие | |
|---|---|
| Систематическое наименование | нитрат свинца(II) |
| Химическая формула | Pb(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветное вещество |
| Молярная масса | 331.2 г/моль |
| Плотность | (20 °C) 4,53 г/см³ |
| Термические свойства | |
| Температура плавления | (разл.) 270 °C |
| Температура вспышки | негорюч °C |
| Химические свойства | |
| Растворимость в воде | (20 °C) 52 г/100мл |
Растворимость в остальных веществах в азотной кислоте, этаноле: нерастворим Оптические свойства Показатель преломления 1.782 [1] Структура Координационная геометрия кубооктаэдрическая Кристаллическая структура гранецентрированная кубическая Классификация Рег. номер CAS 10099-74-8 Номер ООН 1469 RTECS OG2100000 Безопасность Токсичность
Нитрат свинца(II) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Хорошо растворим в воде.
Содержание
История
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
Кристаллическая структура
Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:


кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
Химические свойства
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Так как только динитрат и ацетат свинца(II) являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:



Любое соединение, содержащее катион свинца(II), будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-желтого цвета (иодид свинца(II)). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь [11] :
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступе, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
При нагревании кристаллов динитрата свинца они начинают разлагаться на диоксид свинца, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Меры предосторожности
Источник
Нитрат свинца II
| Нитрат свинца | ||
|---|---|---|
|
||
| Систематическое наименование |
нитрат свинца II | |
| Хим. формула | Pb(NO3)2 | |
| Состояние | бесцветное вещество | |
| Молярная масса | 331.2 г/моль | |
| Плотность | (20 °C) 4,53 г/см³ | |
| Температура | ||
| • плавления | (разл.) 270 °C | |
| • вспышки | негорюч °C | |
| Растворимость | ||
| • в воде | (20 °C) 52 г/100мл (100 °C) 127 г/100 мл | |
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим | |
| Показатель преломления | 1.782 | |
| Координационная геометрия | кубооктаэдрическая | |
| Кристаллическая структура | гранецентрированная кубическая | |
| Рег. номер CAS | 10099-74-8 | |
| PubChem | 16683880 | |
| Рег. номер EINECS | 233-245-9 | |
| SMILES | ||
| RTECS | OG2100000 | |
| ChEBI | 37187 | |
| Номер ООН | 1469 | |
| ChemSpider | 23300 и 21781774 | |
| Пиктограммы ECB |    |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат свинца II (Свинец азотнокислый) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
Содержание
История
Исторически первое промышленное применение нитрата свинца II — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца II), «хром оранжевый» (гидроксид-хромат свинца II) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий.
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса.
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны.
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
Кристаллическая структура
Кристаллическая структура твердого динитрата свинца была определена с помощью нейтронной дифракции. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота.
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Так как только динитрат и ацетат свинца II являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
Любое соединение, содержащее катион свинца II, будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-жёлтого цвета (йодид свинца II). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь:
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступке, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца II, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике.
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца II начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота).
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции.
Меры предосторожности
Динитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца.
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase ) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери.
Источник
Нитрат свинца: состав, свойства, получение, применение.
Содержание:
Он обладает сильными окислительными свойствами, поэтому его используют там, где это требуется, например, при получении различных органических соединений и в качестве лабораторного реагента.
В прошлом он широко использовался для приготовления красок на основе свинца, где он также действовал как закрепитель цвета в тканях. От этого приложения отказались из-за токсичности свинца.
Он использовался в металлургической промышленности по-разному, и недавно было обнаружено, что он полезен для образования вместе с другими соединениями материалов с высокой способностью поглощать свет и превращать его в электричество.
Однако это опасное вещество, поскольку оно может способствовать возникновению пожаров. Он также токсичен для людей, животных и растений, поэтому его нельзя выбрасывать в окружающую среду.
Состав
Свинец в этом соединении имеет следующую электронную конфигурацию:
Номенклатура
Свойства
Физическое состояние
Белое или бесцветное кристаллическое твердое вещество. Кубические кристаллы.
Молекулярный вес
Температура плавления
470 ° С. По некоторым данным, при этой температуре он разлагается.
Плотность
Растворимость
Хорошо растворим в воде: 59,7 г / 100 мл воды при 25 ° C. Слабо растворим в этаноле. Нерастворим в азотной кислоте (HNO3) концентрированный.
pH
Водный раствор с 20% Pb (NO3)2 он имеет pH 3,0-4,0.
Химические свойства
Это окислитель. Реагирует бурно с горючими материалами и восстановителями.
Он не горюч, но может ускорить горение материалов. При нагревании до разложения выделяет токсичные газы оксида азота:
При растворении в воде ионизирует:
Получение
Его можно получить путем реакции металлического свинца, монооксида свинца (PbO) или карбоната свинца PbCO.3 с азотной кислотой. Желательно использовать избыток кислоты, чтобы избежать образования основных нитратов.
Приложения
В органическом синтезе
Его окислительная способность находит применение при получении различных соединений.
Он был использован для синтеза каликсаренов, которые представляют собой органические соединения, молекула которых имеет форму корзины, которая позволяет вмещать другие вещества в зависимости от того, как они будут использоваться.
Он используется для получения изотиоцианатов (R-NCS), исходя из аминов (R-NH2).
Он используется в промышленных масштабах для получения бензальдегида путем окисления бензилхлорида. Он также служит катализатором этерификации органических соединений, например, при производстве сложных полиэфиров.
В химическом анализе
Он используется как реагент при определении алюминия и свинца в минералах и горных породах.
При окраске текстильных волокон
Некоторые хромовые красители требуют использования Pb (NO3)2 чтобы получить это. Например, чтобы окрасить хлопок в желтый цвет, хлопок покрывают нитратом свинца и обрабатывают сульфатом натрия для получения сульфата свинца.
Затем наносят разбавленный раствор дихромата натрия для образования хромата свинца (PbCrO4), который представляет собой желтый пигмент.
Однако в настоящее время производство свинцовых пигментов прекращено из-за их токсичности.
Он также действует как протрава для фиксации красителей во время окрашивания или печати других типов волокон.
В ветеринарной медине
Ранее он использовался как едкое средство при лечении язвы или гангрены у лошадей.
В металлургической промышленности
Нитрат свинца используется при электролитическом рафинировании свинца в качестве агента, способствующего флотации при удалении титана из определенных глин, он позволяет извлекать драгоценные металлы из цианидных растворов и используется при электроосаждении PbO.2 на никелевых анодах.
В солнечных батареях
Он использовался в виде водного раствора для изготовления солнечных элементов на основе перовскита, минерала оксида титана.
Синтезированный материал представляет собой металлоорганический перовскит или перовскит из иодида свинца, который привлек внимание исследователей, так как обладает высокой способностью поглощать свет и большой длиной диффузии носителей заряда.
Эти характеристики делают его отличным кандидатом для фотоэлектрических устройств, которые преобразуют свет в электрический ток.
Другие приложения
Риски
Пожар и взрыв
Хотя это не горючий состав, при воздействии огня или тепла он может взорваться, образуя токсичные оксиды азота.
Поскольку это сильно окислитель, существует опасность возгорания при контакте с органическими материалами.
На здоровье
Вызывает раздражение глаз, дыхательных путей и пищеварительного тракта. Он токсичен при вдыхании и проглатывании. Наиболее частыми симптомами интоксикации этим соединением являются желудочно-кишечные расстройства, колики, запоры и слабость, которые, в частности, могут перерасти в паралич некоторых мышц.
Для окружающей среды
Он токсичен для водных и наземных организмов, кроме того, его повреждения являются стойкими, и он биоаккумулируется в живых существах, поэтому считается опасным загрязнителем и не должен выбрасываться в окружающую среду.
При случайном попадании в воду его необходимо нейтрализовать оксидом кальция (CaO), карбонатом кальция (CaCO3) или бикарбонат натрия (NaHCO3).
Было подтверждено, что он канцерогенный для животных и, возможно, для человека.
Ссылки
Что такое делитель напряжения? (с примерами)
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется нитрат свинца, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется нитрат свинца», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Нитрат свинца(II)
Брутто-формула:
N2O6Pb
CAS# 10099-74-8
Категории:
Неорганические соли
PubChem CID: 24924
| ChemSpider ID: 23300
Названия
Русский:
- Нитрат свинца(II) [Wiki]
- динитрат свинца
English:
- Lead dinitrate
- Lead nitrate
- Lead(II) nitrate [Wiki]
- Plumb dulcis
- Plumbous nitrate
- lead(2+);dinitrate(IUPAC)
Варианты формулы:
Pb(NO3)2
Pb(+2)(N(+5)O(-2)3)2
O`^-/N^+`|O|O^-/0Pb^++O`^-/N^+`|O|O^-
Вещества, имеющие отношение…
Анион:
Нитраты
Химический состав
Реакции, в которых участвует Нитрат свинца(II)
-
{M}O + 2H{X} -> {M}({X})2 + H2O
, где M =
Ca Cu Mg Ba Sr Pb; X =
NO3 -
3Pb + 8HNO3 -> 3Pb(NO3)2 + 2NO»|^» + 4H2O
-
2Pb(NO3)2 «470^oC»—> 2PbO + 4NO2″|^» + O2″|^»
-
Pb(NO3)2 + 2NaOH -> Pb(OH)2″|v» + 2NaNO3
-
Pb(OH)2 + 2HNO3 -> Pb(NO3)2 + 2H2O
И ещё 17 реакций…
| Динитрат свинца | |
 |
|
 |
|
  |
|
| Общие | |
|---|---|
| Систематическое наименование | нитрат свинца(II) |
| Химическая формула | Pb(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветное вещество |
| Молярная масса | 331.2 г/моль |
| Плотность | (20 °C) 4,53 г/см³ |
| Термические свойства | |
| Температура плавления | (разл.) 270 °C |
| Температура вспышки | негорюч °C |
| Химические свойства | |
| Растворимость в воде | (20 °C) 52 г/100мл
(100 °C) 127 г/100 мл |
| Растворимость в остальных веществах | в азотной кислоте, этаноле: нерастворим |
| Оптические свойства | |
| Показатель преломления | 1.782[1] |
| Структура | |
| Координационная геометрия | кубооктаэдрическая |
| Кристаллическая структура | гранецентрированная кубическая |
| Классификация | |
| Рег. номер CAS | 10099-74-8 |
| Номер ООН | 1469 |
| RTECS | OG2100000 |
| Безопасность | |
| Токсичность |
0 3 1 OX |
Нитрат свинца(II) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Хорошо растворим в воде.
Содержание
- 1 История
- 2 Физические свойства
- 2.1 Кристаллическая структура
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Меры предосторожности
- 7 См. также
- 8 Примечания
История
Исторически первое промышленное применение нитрата свинца (II) — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца(II)), «хром оранжевый» (гидроксид-хромат свинца(II)) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий[2].
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса[3].
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835[4][5]. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, было 642 тонн[6].
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
Кристаллическая структура динитрата свинца, плоскость [111]
Кристаллическая структура
Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось[7].
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота[8].
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор[9]. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель рН от 3,0 до 4,0 для 20 % водного раствора[10]. При избытке ионов NO3− в растворе образуются нитратокомплексы [Pb(NO3)3]−, [Pb(NO3)4]2− и [Pb(NO3)6]3−. При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца(II) являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
Любое соединение, содержащее катион свинца(II), будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-желтого цвета (иодид свинца(II)). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь[11]:
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступе, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb2+-ион, который имеет стандартный редокс-потенциал (E0) −0.125 V, или нитрат-ион, который в кислой среде имеет (E0) +0.956 V[12] .
При нагревании кристаллов динитрата свинца они начинают разлагаться на диоксид свинца, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике[13].
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках[14]. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида[6].
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота)[15][16].
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов[17]. Он также нашел применение для получения изотиоцианатов из дитиокарбаматов[18]. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в [19].
Меры предосторожности
Динитрат свинца токсичен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака[20]. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца[21].
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка[20]. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери[22].
См. также
- Координационная сфера
- Реакция Соммелета
Примечания
- ↑ Patnaik Pradyot Handbook of Inorganic Chemical Compounds. — McGraw-Hill, 2003. — P. 475. — ISBN 0070494398
- ↑ Partington James Riddick A Text-book of Inorganic Chemistry. — MacMillan, 1950. — P. 838.
- ↑ Libavius Andreas Alchemia Andreæ Libavii. — Francofurti: Iohannes Saurius, 1595.
- ↑ Lead. Encyclopædia Britannica Eleventh Edition. Архивировано из первоисточника 23 апреля 2012.
- ↑ Macgregor John Progress of America to year 1846. — London: Whittaker & Co, 1847. — ISBN 0665517912
- ↑ 1 2 Greenwood Norman N. Chemistry of the Elements. — 2nd. — Oxford: Butterworth-Heinemann, 1997. — P. 388, 456. — ISBN 0-7506-3365-4
- ↑ Nowotny, H.; G. Heger (1986). «Structure refinement of lead nitrate». Acta Cryst. C42: 133–35. DOI:10.1107/S0108270186097032.
- ↑ Product catalog; other products. Tilly, Belgium: Sidech. Архивировано из первоисточника 23 апреля 2012.
- ↑ Ferris, L.M. (1959). «Lead nitrate—Nitric acid—Water system». Journal of Chemicals and Engineering Date 5: 242. DOI:10.1021/je60007a002.
- ↑ MSDS — описание нитрата свинца (англ.)
- ↑ Adlam George Henry Joseph A Higher School Certificate Inorganic Chemistry. — London: John Murray, 1938.
- ↑ Hill John W. General Chemistry. — 2nd. — Upper Saddle River, New Jersey: Prentice Hall, 1999. — P. 781. — ISBN 0-13-010318-7
- ↑ Barkley, J.B. (October 1978). «Lead nitrate as an oxidizer in blackpowder» (Pyrotechnica Publications) IV.
- ↑ Historical development of titanium dioxide. Millennium Inorganic Chemicals.(недоступная ссылка — история)
- ↑ Habashi Fathi Recent advances in gold metallurgy. — Quebec City, Canada: Laval University, 1998 (est).
- ↑ Auxiliary agents in gold cyanidation. Gold Prospecting and Gold Mining. Архивировано из первоисточника 23 апреля 2012.
- ↑ Schulze, K. E. (1884). «Über α- und β-Methylnaphtalin». Berichte der deutschen chemischen Gesellschaft 17. DOI:10.1002/cber.188401701384.
- ↑ Dains, F. B.; Brewster, R. Q.; Olander, C. P. Phenyl isothiocyanate 1, 447 страниц
- ↑ Rapoport, H.; Jamison, T. (1998), «(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate», Орг.синтез; 344 страницы
- ↑ 1 2 World Health Organization, International Agency for Research on Cancer. Inorganic and Organic Lead Compounds (PDF). International Agency for Research on Cancer (2006). Архивировано из первоисточника 23 апреля 2012.
- ↑ Lead nitrate, International Chemical Safety Card 1000. International Labour Organization, International Occupational Safety and Health Information Centre (March 1999). Архивировано из первоисточника 23 апреля 2012.
- ↑ Mohammed-Brahim, B.; J.P. Buchet, R. Lauwerys (1985). «Erythrocyte pyrimidine 5′-nucleotidase activity in workers exposed to lead, mercury or cadmium». Int Arch Occup Environ Health 55 (3): 247–52. DOI:10.1007/BF00383757. PMID 2987134.
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения свинца |
|---|
|
Азид свинца (Pb(N3)2) • Ацетат свинца(II) (Pb(CH3COO)2) • Ацетат свинца(IV) (Pb(CH3COO)4) • Бромид свинца(II) (PbBr2) • Гексагидроксоплюмбат(IV) натрия (Na2[Pb(OH)6]) • Гексафтороплюмбаты • Гексахлороплюмбаты • Гексахлоросвинцовая кислота (H2[PbCl6]) • Гидроксид свинца(II) (Pb(OH)2) • Иодид свинца(II) (PbI2) • Карбид свинца (PbC2) • Карбонат свинца(II) (PbCO3) • Метаплюмбаты • Метасиликат свинца(II) (PbSiO3) • Нитрат свинца(II) (Pb(NO3)2) • Оксид свинца(II) (PbO) • Оксид свинца(IV) (PbO2) • Оксихлориды свинца(II) • Ортоплюмбат свинца(II) (Pb3O4) • Ортоплюмбаты • Ортофосфат свинца(II) (Pb3(PO4)2) • Основной карбонат свинца (2PbCO3•Pb(OH)2) • Плюмбан (PbH4) • Селенид свинца(II) (PbSe) • Сульфат свинца(II) (PbSO4) • Сульфат свинца(IV) (Pb(SO4)2) • Сульфид свинца(II) (PbS) • Сульфид свинца(IV) (PbS2) • Сульфит свинца(II) (PbSO3) • Тетраоксид свинца (Pb3O4) • Теллурид свинца (PbTe) • Тетраметилсвинец (Pb(CH3)4) • Тетрафенилсвинец (Pb(C6H5)4) • Тетраэтилсвинец (Pb(C2H5)4) • Тиоцианат свинца(II) (Pb(SCN)2) • Титанат свинца (PbTiO3) • Трииодоплюмбат(II) калия (K[PbI3]) • Тринитрорезорцинат свинца • Фторид свинца(II) (PbF2) • Фторид свинца(IV) (PbF4) • Хлорид свинца(II) (PbCl2) • Хлорид свинца(IV) (PbCl4) • Хромат свинца(II) (РbСrO4) • Цианид свинца(II) (Pb(CN)2) • |
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
Содержание
- История
- Физические свойства
- Кристаллическая структура
- Получение
- Применение
- Меры предосторожности
Нитрат свинца(II) — неорганическое химическое соединение с химической формулой Pb2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
| Динитрат свинца | |
|---|---|
| Общие | |
| Систематическое наименование |
нитрат свинца(II) |
| Хим. формула | Pb(NO3)2 |
| Физические свойства | |
| Состояние | бесцветное вещество |
| Молярная масса | 331.2 г/моль |
| Плотность | (20 °C) 4,53 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | (разл.) 270 °C |
| • вспышки | негорюч °C |
| Химические свойства | |
| Растворимость | |
| • в воде | (20 °C) 52 г/100мл
(100 °C) 127 г/100 мл |
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим |
| Оптические свойства | |
| Показатель преломления | 1.782 |
| Структура | |
| Координационная геометрия | кубооктаэдрическая |
| Кристаллическая структура | гранецентрированная кубическая |
| Классификация | |
| Рег. номер CAS | 10099-74-8 |
| PubChem | 16683880 |
| Рег. номер EINECS | 233-245-9 |
| SMILES |
[N+](=O)([O-])O[Pb]O[N+](=O)[O-] |
| InChI |
1S/2NO3.Pb/c2*2-1(3)4;/q2*-1;+2 RLJMLMKIBZAXJO-UHFFFAOYSA-N |
| RTECS | OG2100000 |
| ChEBI | 37187 |
| Номер ООН | 1469 |
| ChemSpider | 23300 и 21781774 |
| Безопасность | |
| Пиктограммы ECB |    |
| NFPA 704 |
История
Исторически первое промышленное применение нитрата свинца (II) — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца(II)), «хром оранжевый» (гидроксид-хромат свинца(II)) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий.
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса.
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны.
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
Кристаллическая структура динитрата свинца, плоскость
Кристаллическая структура
Кристаллическая структура твердого динитрата свинца была определена с помощью нейтронной дифракции. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель рН от 3,0 до 4,0 для 20 % водного раствора. При избытке ионов NO3− в растворе образуются нитратокомплексы [Pb(NO3)3]−, [Pb(NO3)4]2− и [Pb(NO3)6]4−. При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца(II) являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
Любое соединение, содержащее катион свинца(II), будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-жёлтого цвета (иодид свинца(II)). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb2+-ион, который имеет стандартный редокс-потенциал (E0) −0.125 V, или нитрат-ион, который в кислой среде имеет (E0) +0.956 V .
При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца(II), кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике.
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как
полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество.
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции.
Меры предосторожности
Динитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца.
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери.


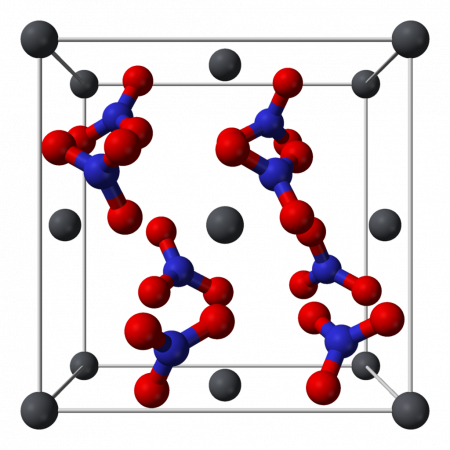


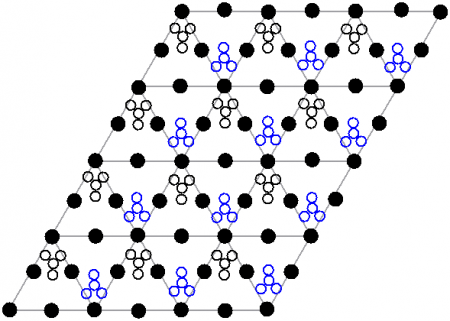



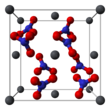


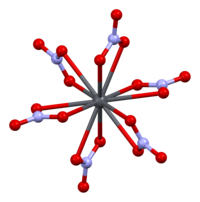

![{displaystyle {ce {2 Pb(NO_3)_2->[Delta]2PbO + 4NO_2 +O_2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06f64696eaa883432008d7e6af4c5af9b60a6b85)