From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Other names
AlN |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.041.931 |
| EC Number |
|
|
Gmelin Reference |
13611 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AlN |
| Molar mass | 40.989 g/mol[1] |
| Appearance | white to pale-yellow solid |
| Density | 3.255 g/cm3[1] |
| Melting point | 2,500 °C (4,530 °F; 2,770 K)[6] |
|
Solubility in water |
hydrolyses (powder), insoluble (monocrystalline) |
| Solubility | insoluble, subject of hydrolysis in water solutions of bases and acids [2] |
| Band gap | 6.015 eV[3][4] (direct) |
| Electron mobility | ~300 cm2/(V·s) |
| Thermal conductivity | 321 W/(m·K)[5] |
| Structure[7] | |
|
Crystal structure |
Wurtzite |
|
Space group |
C6v4—P63mc, No. 186, hP4 |
|
Lattice constant |
a = 0.31117 nm, c = 0.49788 nm |
|
Formula units (Z) |
2 |
|
Coordination geometry |
Tetrahedral |
| Thermochemistry[8] | |
|
Heat capacity (C) |
30.1 J/(mol·K) |
|
Std molar |
20.2 J/(mol·K) |
|
Std enthalpy of |
−318.0 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
−287.0 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Warning |
|
Hazard statements |
H315, H319, H335, H373, H411 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P332+P313, P337+P313, P362, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium nitride (AlN) is a solid nitride of aluminium. It has a high thermal conductivity of up to 321 W/(m·K)[5] and is an electrical insulator. Its wurtzite phase (w-AlN) has a band gap of ~6 eV at room temperature and has a potential application in optoelectronics operating at deep ultraviolet frequencies.
History and physical properties[edit]
AlN was first synthesized in 1862 by F. Briegleb and A. Geuther.[9][10]
AlN, in the pure (undoped) state has an electrical conductivity of 10−11–10−13 Ω−1⋅cm−1, rising to 10−5–10−6 Ω−1⋅cm−1 when doped.[11] Electrical breakdown occurs at a field of 1.2–1.8×105 V/mm (dielectric strength).[11]
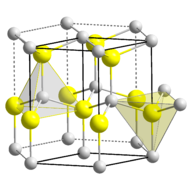
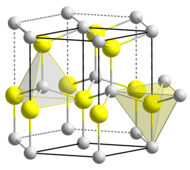
The material exists primarily in the hexagonal wurtzite crystal structure, but also has a metastable cubic zincblende phase, which is synthesized primarily in the form of thin films. It is predicted that the cubic phase of AlN (zb-AlN) can exhibit superconductivity at high pressures.[12] In AlN wurtzite crystal structure, Al and N alternate along the c-axis, and each bond is tetrahedrally coordinated with four atoms per unit cell.
One of the unique intrinsic properties of wurtzite AlN is its spontaneous polarization. The origin of spontaneous polarization is the strong ionic character of chemical bonds in wurtzite AlN due to the large difference in electronegativity between aluminum and nitrogen atoms. Furthermore, the non-centrosymmetric wurtzite crystal structure gives rise to a net polarization along the c-axis. Compared with other III-nitride materials, AlN has a larger spontaneous polarization due to the higher nonideality of its crystal structure (Psp: AlN 0.081 C/m2 > InN 0.032 C/m2 > GaN 0.029 C/m2).[13] Moreover, the piezoelectric nature of AlN gives rise to internal piezoelectric polarization charges under strain. These polarization effects can be utilized to induce a high density of free carriers at III-nitride semiconductor heterostructure interfaces completely dispensing with the need of intentional doping. Owing to the broken inversion symmetry along the polar direction, AlN thin film can be grown on either metal-polar or nitrogen-polar faces. Their bulk and surface properties depend significantly on this choice. The polarization effect is currently under investigation for both polarities.
Critical spontaneous and piezoelectric polarization constants for AlN are listed in the table below:[13][14]
| e31
(C/m2) |
e33
(C/m2) |
c13
(GPa) |
c33
(GPa) |
a0
(Å) |
c0
(Å) |
|
| AlN | -0.60 | 1.46 | 108 | 373 | 3.112 | 4.982 |
AlN has high thermal conductivity, high-quality MOCVD-grown AlN single crystal has an intrinsic thermal conductivity of 321 W/(m·K), consistent with a first-principle calculation.[5] For an electrically insulating ceramic, it is 70–210 W/(m·K) for polycrystalline material, and as high as 285 W/(m·K) for single crystals).[11]
AlN is one of the few materials that have both a wide and direct bandgap (almost twice that of SiC and GaN) and large thermal conductivity.[15] This is due to its small atomic mass, strong interatomic bonds, and simple crystal structure.[16] This property makes AlN attractive for application in high speed and high power communication networks. Many devices handle and manipulate large amounts of energy in small volumes and at high speeds, so due to the electrically insulating nature and high thermal conductivity of AlN, it becomes a potential material for high-power power electronics. Among group III-nitride materials, AlN has higher thermal conductivity compared to gallium nitride (GaN). Therefore, AlN is more advantageous than GaN in terms of heat dissipation in many power and radio frequency electronic devices.
Thermal expansivity is another critical property for high temperature applications. The calculated thermal expansion coefficients of AlN at 300 K are 4.2×10-6 K-1along a-axis and 5.3×10-6 K-1 along c-axis.[17]
Stability and chemical properties[edit]
Aluminium nitride is stable at high temperatures in inert atmospheres and melts at about 2200 °C. In a vacuum, AlN decomposes at ~1800 °C. In the air, surface oxidation occurs above 700 °C, and even at room temperature, surface oxide layers of 5–10 nm thickness have been detected. This oxide layer protects the material up to 1370 °C. Above this temperature bulk oxidation occurs. Aluminium nitride is stable in hydrogen and carbon-dioxide atmospheres up to 980 °C.[18]
The material dissolves slowly in mineral acids through grain-boundary attack and in strong alkalies through attack on the aluminium-nitride grains. The material hydrolyzes slowly in water. Aluminium nitride is resistant to attack from most molten salts, including chlorides and cryolite.[citation needed]
Aluminium nitride can be patterned with a Cl2-based reactive ion etch.[19][20]
Manufacture[edit]
AlN is synthesized by the carbothermal reduction of aluminium oxide in the presence of gaseous nitrogen or ammonia or by direct nitridation of aluminium. The use of sintering aids, such as Y2O3 or CaO, and hot pressing is required to produce a dense technical-grade material.
Applications[edit]
Epitaxially grown thin film crystalline aluminium nitride is used for surface acoustic wave sensors (SAWs) deposited on silicon wafers because of AlN’s piezoelectric properties. One application is an RF filter, widely used in mobile phones,[21] which is called a thin-film bulk acoustic resonator (FBAR). This is a MEMS device that uses aluminium nitride sandwiched between two metal layers.[22]
AlN is also used to build piezoelectric micromachined ultrasound transducers, which emit and receive ultrasound and which can be used for in-air rangefinding over distances of up to a meter.[23][24]
Metallization methods are available to allow AlN to be used in electronics applications similar to those of alumina and beryllium oxide. AlN nanotubes as inorganic quasi-one-dimensional nanotubes, which are isoelectronic with carbon nanotubes, have been suggested as chemical sensors for toxic gases.[25][26]
Currently there is much research into developing light-emitting diodes to operate in the ultraviolet using gallium nitride based semiconductors and, using the alloy aluminium gallium nitride, wavelengths as short as 250 nm have been achieved. In 2006, an inefficient AlN LED emission at 210 nm was reported.[27]
AlN-based high electron mobility transistors (HEMTs) have attracted a high level of attention due to AlN’s superior properties, such as better thermal management, reduced buffer leakage, and excellent integration for all nitride electronics. AlN buffer layer is a critical building block for AlN-based HEMTs, and it has been grown by using MOCVD or MBE on different substrates. Building on top of AlN buffer, n-channel devices with 2D electron gas (2DEG) and p-channel devices with 2D hole gas (2DHG) have been demonstrated. The combination of high-density 2DEG and 2DHG on the same semiconductor platform makes it a potential candidate for CMOS devices.
Among the applications of AlN are
- opto-electronics,
- dielectric layers in optical storage media,
- electronic substrates, chip carriers where high thermal conductivity is essential,
- military applications,
- as a crucible to grow crystals of gallium arsenide,
- steel and semiconductor manufacturing.
See also[edit]
- Boron nitride
- Aluminium phosphide
- Indium nitride
- Aluminium oxynitride
- Titanium aluminium nitride, TiAlN or AlTiN
References[edit]
- ^ a b Haynes, p. 4.45.
- ^ Fukumoto, S.; Hookabe, T.; Tsubakino, H. (2010). «Hydrolysis behavior of aluminum nitride in various solutions». J. Mat. Science. 35 (11): 2743–2748. doi:10.1023/A:1004718329003. S2CID 91552821.
- ^ Haynes, p. 12.85.
- ^ Feneberg, M.; Leute, R. A. R.; Neuschl, B.; Thonke, K.; Bickermann, M. (2010). Phys. Rev. B. 82 (7): 075208. Bibcode:2010PhRvB..82g5208F. doi:10.1103/physrevb.82.075208.
{{cite journal}}: CS1 maint: untitled periodical (link) - ^ a b c Cheng, Zhe; Koh, Yee Rui; Mamun, Abdullah; Shi, Jingjing; Bai, Tingyu; Huynh, Kenny; Yates, Luke; Liu, Zeyu; Li, Ruiyang; Lee, Eungkyu; Liao, Michael E.; Wang, Yekan; Yu, Hsuan Ming; Kushimoto, Maki; Luo, Tengfei; Goorsky, Mark S.; Hopkins, Patrick E.; Amano, Hiroshi; Khan, Asif; Graham, Samuel (2020). «Experimental observation of high intrinsic thermal conductivity of AlN». Physical Review Materials. 4 (4): 044602. arXiv:1911.01595. Bibcode:2020PhRvM…4d4602C. doi:10.1103/PhysRevMaterials.4.044602. S2CID 207780348. Retrieved 2020-04-03.
- ^ Haynes, p. 12.80.
- ^ Vandamme, Nobuko S.; Richard, Sarah M.; Winzer, Stephen R. (1989). «Liquid-Phase Sintering of Aluminum Nitride by Europium Oxide Additives». Journal of the American Ceramic Society. 72 (8): 1409–1414. doi:10.1111/j.1151-2916.1989.tb07662.x.
- ^ Haynes, p. 5.4.
- ^ Fesenko I. P.; Prokopiv M. M.; Chasnyk V. I.; et al. (2015). Aluminium nitride based functional materials, prepared from nano/micron-sized powders via hot pressing/pressureless sintering. EPC ALCON. p. 11. ISBN 978-966-8449-53-6.
- ^ Briegleb, F.; Geuther, A. (1862). «Ueber das Stickstoffmagnesium und die Affinitäten des Stickgases zu Metallen». Justus Liebigs Annalen der Chemie. 123 (2): 228–241. doi:10.1002/jlac.18621230212.
- ^ a b c «AlN – Aluminium Nitride». Ioffe Database. Sankt-Peterburg: FTI im. A. F. Ioffe, RAN. Retrieved 2014-01-01.
- ^ Dancy, G. Selva; Sheeba, V. Benaline; Louis, C. Nirmala; Amalraj, A. (2015-09-30). «Superconductivity in Group III-V Semiconductor AlN Under High Pressure». Orbital — the Electronic Journal of Chemistry. Instituto de Quimica — Univ. Federal do Mato Grosso do Sul. 7 (3). doi:10.17807/orbital.v7i3.628. ISSN 1984-6428.
- ^ a b Ambacher, O (1998-10-21). «Growth and applications of Group III-nitrides». Journal of Physics D: Applied Physics. 31 (20): 2653–2710. doi:10.1088/0022-3727/31/20/001. ISSN 0022-3727. S2CID 250782290.
- ^ Ambacher, O.; Foutz, B.; Smart, J.; Shealy, J. R.; Weimann, N. G.; Chu, K.; Murphy, M.; Sierakowski, A. J.; Schaff, W. J.; Eastman, L. F.; Dimitrov, R.; Mitchell, A.; Stutzmann, M. (2000-01-01). «Two dimensional electron gases induced by spontaneous and piezoelectric polarization in undoped and doped AlGaN/GaN heterostructures». Journal of Applied Physics. 87 (1): 334–344. doi:10.1063/1.371866. ISSN 0021-8979.
- ^ Hickman, Austin Lee; Chaudhuri, Reet; Bader, Samuel James; Nomoto, Kazuki; Li, Lei; Hwang, James C M; Grace Xing, Huili; Jena, Debdeep (2021-04-01). «Next generation electronics on the ultrawide-bandgap aluminum nitride platform». Semiconductor Science and Technology. 36 (4): 044001. doi:10.1088/1361-6641/abe5fd. ISSN 0268-1242. S2CID 233936255.
- ^ Xu, Runjie Lily; Muñoz Rojo, Miguel; Islam, S. M.; Sood, Aditya; Vareskic, Bozo; Katre, Ankita; Mingo, Natalio; Goodson, Kenneth E.; Xing, Huili Grace; Jena, Debdeep; Pop, Eric (2019-11-14). «Thermal conductivity of crystalline AlN and the influence of atomic-scale defects». Journal of Applied Physics. 126 (18): 185105. arXiv:1904.00345. doi:10.1063/1.5097172. ISSN 0021-8979. S2CID 90262793.
- ^ Slack, Glen A.; Bartram, S. F. (1975-01-01). «Thermal expansion of some diamondlike crystals». Journal of Applied Physics. 46 (1): 89–98. doi:10.1063/1.321373. ISSN 0021-8979.
- ^ Berger, L. I. (1997). Semiconductor Materials. CRC Press. pp. 123–124. ISBN 978-0-8493-8912-2.
- ^ Chih-ming Lin; Ting-ta Yen; Yun-ju Lai; Felmetsger, V. V.; Hopcroft, M. A.; Kuypers, J. H.; Pisano, A. P. (March 2010). «Temperature-compensated aluminum nitride lamb wave resonators». IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 57 (3): 524–532. doi:10.1109/TUFFC.2010.1443. PMID 20211766. S2CID 20028149.
- ^ Xiong, Chi; Pernice, Wolfram H. P.; Sun, Xiankai; Schuck, Carsten; Fong, King Y.; Tang, Hong X. (2012). «Aluminum nitride as a new material for chip-scale optomechanics and nonlinear optics». New Journal of Physics. 14 (9): 095014. arXiv:1210.0975. Bibcode:2012NJPh…14i5014X. doi:10.1088/1367-2630/14/9/095014. ISSN 1367-2630. S2CID 118571039.
- ^ Tsuruoka, Doug (2014-03-17). «Apple, Samsung Cellphone Filter Orders Lift Avago». Investor’s Business Daily.
- ^ «ACPF-7001: Agilent Technologies Announces FBAR Filter for U.S. PCS Band Mobile Phones and Data Cards». wirelessZONE. EN-Genius Network Ltd. 2002-05-27. Retrieved 2008-10-18.
- ^ «A Gestural Interface for Smart Watches».
- ^
Przybyla, R.; al, et (2014). «3D Ultrasonic Gesture Recognition». International Solid State Circuits Conference. San Francisco. pp. 210–211. - ^ Ahmadi, A.; Hadipour, N. L.; Kamfiroozi, M.; Bagheri, Z. (2012). «Theoretical study of aluminium nitride nanotubes for chemical sensing of formaldehyde». Sensors and Actuators B: Chemical. 161 (1): 1025–1029. doi:10.1016/j.snb.2011.12.001.
- ^ Ahmadi Peyghan, A.; Omidvar, A.; Hadipour, N. L.; Bagheri, Z.; Kamfiroozi, M. (2012). «Can aluminum nitride nanotubes detect the toxic NH3 molecules?». Physica E. 44 (7–8): 1357–1360. Bibcode:2012PhyE…44.1357A. doi:10.1016/j.physe.2012.02.018.
- ^ Taniyasu, Y.; et al. (2006). «An Aluminium Nitride Light-Emitting Diode with a Wavelength of 210 Nanometres». Nature. 441 (7091): 325–328. Bibcode:2006Natur.441..325T. doi:10.1038/nature04760. PMID 16710416. S2CID 4373542.
Cited sources[edit]
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. p. 4.45. ISBN 9781498754293.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Other names
AlN |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.041.931 |
| EC Number |
|
|
Gmelin Reference |
13611 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AlN |
| Molar mass | 40.989 g/mol[1] |
| Appearance | white to pale-yellow solid |
| Density | 3.255 g/cm3[1] |
| Melting point | 2,500 °C (4,530 °F; 2,770 K)[6] |
|
Solubility in water |
hydrolyses (powder), insoluble (monocrystalline) |
| Solubility | insoluble, subject of hydrolysis in water solutions of bases and acids [2] |
| Band gap | 6.015 eV[3][4] (direct) |
| Electron mobility | ~300 cm2/(V·s) |
| Thermal conductivity | 321 W/(m·K)[5] |
| Structure[7] | |
|
Crystal structure |
Wurtzite |
|
Space group |
C6v4—P63mc, No. 186, hP4 |
|
Lattice constant |
a = 0.31117 nm, c = 0.49788 nm |
|
Formula units (Z) |
2 |
|
Coordination geometry |
Tetrahedral |
| Thermochemistry[8] | |
|
Heat capacity (C) |
30.1 J/(mol·K) |
|
Std molar |
20.2 J/(mol·K) |
|
Std enthalpy of |
−318.0 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
−287.0 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Warning |
|
Hazard statements |
H315, H319, H335, H373, H411 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P332+P313, P337+P313, P362, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium nitride (AlN) is a solid nitride of aluminium. It has a high thermal conductivity of up to 321 W/(m·K)[5] and is an electrical insulator. Its wurtzite phase (w-AlN) has a band gap of ~6 eV at room temperature and has a potential application in optoelectronics operating at deep ultraviolet frequencies.
History and physical properties[edit]
AlN was first synthesized in 1862 by F. Briegleb and A. Geuther.[9][10]
AlN, in the pure (undoped) state has an electrical conductivity of 10−11–10−13 Ω−1⋅cm−1, rising to 10−5–10−6 Ω−1⋅cm−1 when doped.[11] Electrical breakdown occurs at a field of 1.2–1.8×105 V/mm (dielectric strength).[11]
The material exists primarily in the hexagonal wurtzite crystal structure, but also has a metastable cubic zincblende phase, which is synthesized primarily in the form of thin films. It is predicted that the cubic phase of AlN (zb-AlN) can exhibit superconductivity at high pressures.[12] In AlN wurtzite crystal structure, Al and N alternate along the c-axis, and each bond is tetrahedrally coordinated with four atoms per unit cell.
One of the unique intrinsic properties of wurtzite AlN is its spontaneous polarization. The origin of spontaneous polarization is the strong ionic character of chemical bonds in wurtzite AlN due to the large difference in electronegativity between aluminum and nitrogen atoms. Furthermore, the non-centrosymmetric wurtzite crystal structure gives rise to a net polarization along the c-axis. Compared with other III-nitride materials, AlN has a larger spontaneous polarization due to the higher nonideality of its crystal structure (Psp: AlN 0.081 C/m2 > InN 0.032 C/m2 > GaN 0.029 C/m2).[13] Moreover, the piezoelectric nature of AlN gives rise to internal piezoelectric polarization charges under strain. These polarization effects can be utilized to induce a high density of free carriers at III-nitride semiconductor heterostructure interfaces completely dispensing with the need of intentional doping. Owing to the broken inversion symmetry along the polar direction, AlN thin film can be grown on either metal-polar or nitrogen-polar faces. Their bulk and surface properties depend significantly on this choice. The polarization effect is currently under investigation for both polarities.
Critical spontaneous and piezoelectric polarization constants for AlN are listed in the table below:[13][14]
| e31
(C/m2) |
e33
(C/m2) |
c13
(GPa) |
c33
(GPa) |
a0
(Å) |
c0
(Å) |
|
| AlN | -0.60 | 1.46 | 108 | 373 | 3.112 | 4.982 |
AlN has high thermal conductivity, high-quality MOCVD-grown AlN single crystal has an intrinsic thermal conductivity of 321 W/(m·K), consistent with a first-principle calculation.[5] For an electrically insulating ceramic, it is 70–210 W/(m·K) for polycrystalline material, and as high as 285 W/(m·K) for single crystals).[11]
AlN is one of the few materials that have both a wide and direct bandgap (almost twice that of SiC and GaN) and large thermal conductivity.[15] This is due to its small atomic mass, strong interatomic bonds, and simple crystal structure.[16] This property makes AlN attractive for application in high speed and high power communication networks. Many devices handle and manipulate large amounts of energy in small volumes and at high speeds, so due to the electrically insulating nature and high thermal conductivity of AlN, it becomes a potential material for high-power power electronics. Among group III-nitride materials, AlN has higher thermal conductivity compared to gallium nitride (GaN). Therefore, AlN is more advantageous than GaN in terms of heat dissipation in many power and radio frequency electronic devices.
Thermal expansivity is another critical property for high temperature applications. The calculated thermal expansion coefficients of AlN at 300 K are 4.2×10-6 K-1along a-axis and 5.3×10-6 K-1 along c-axis.[17]
Stability and chemical properties[edit]
Aluminium nitride is stable at high temperatures in inert atmospheres and melts at about 2200 °C. In a vacuum, AlN decomposes at ~1800 °C. In the air, surface oxidation occurs above 700 °C, and even at room temperature, surface oxide layers of 5–10 nm thickness have been detected. This oxide layer protects the material up to 1370 °C. Above this temperature bulk oxidation occurs. Aluminium nitride is stable in hydrogen and carbon-dioxide atmospheres up to 980 °C.[18]
The material dissolves slowly in mineral acids through grain-boundary attack and in strong alkalies through attack on the aluminium-nitride grains. The material hydrolyzes slowly in water. Aluminium nitride is resistant to attack from most molten salts, including chlorides and cryolite.[citation needed]
Aluminium nitride can be patterned with a Cl2-based reactive ion etch.[19][20]
Manufacture[edit]
AlN is synthesized by the carbothermal reduction of aluminium oxide in the presence of gaseous nitrogen or ammonia or by direct nitridation of aluminium. The use of sintering aids, such as Y2O3 or CaO, and hot pressing is required to produce a dense technical-grade material.
Applications[edit]
Epitaxially grown thin film crystalline aluminium nitride is used for surface acoustic wave sensors (SAWs) deposited on silicon wafers because of AlN’s piezoelectric properties. One application is an RF filter, widely used in mobile phones,[21] which is called a thin-film bulk acoustic resonator (FBAR). This is a MEMS device that uses aluminium nitride sandwiched between two metal layers.[22]
AlN is also used to build piezoelectric micromachined ultrasound transducers, which emit and receive ultrasound and which can be used for in-air rangefinding over distances of up to a meter.[23][24]
Metallization methods are available to allow AlN to be used in electronics applications similar to those of alumina and beryllium oxide. AlN nanotubes as inorganic quasi-one-dimensional nanotubes, which are isoelectronic with carbon nanotubes, have been suggested as chemical sensors for toxic gases.[25][26]
Currently there is much research into developing light-emitting diodes to operate in the ultraviolet using gallium nitride based semiconductors and, using the alloy aluminium gallium nitride, wavelengths as short as 250 nm have been achieved. In 2006, an inefficient AlN LED emission at 210 nm was reported.[27]
AlN-based high electron mobility transistors (HEMTs) have attracted a high level of attention due to AlN’s superior properties, such as better thermal management, reduced buffer leakage, and excellent integration for all nitride electronics. AlN buffer layer is a critical building block for AlN-based HEMTs, and it has been grown by using MOCVD or MBE on different substrates. Building on top of AlN buffer, n-channel devices with 2D electron gas (2DEG) and p-channel devices with 2D hole gas (2DHG) have been demonstrated. The combination of high-density 2DEG and 2DHG on the same semiconductor platform makes it a potential candidate for CMOS devices.
Among the applications of AlN are
- opto-electronics,
- dielectric layers in optical storage media,
- electronic substrates, chip carriers where high thermal conductivity is essential,
- military applications,
- as a crucible to grow crystals of gallium arsenide,
- steel and semiconductor manufacturing.
See also[edit]
- Boron nitride
- Aluminium phosphide
- Indium nitride
- Aluminium oxynitride
- Titanium aluminium nitride, TiAlN or AlTiN
References[edit]
- ^ a b Haynes, p. 4.45.
- ^ Fukumoto, S.; Hookabe, T.; Tsubakino, H. (2010). «Hydrolysis behavior of aluminum nitride in various solutions». J. Mat. Science. 35 (11): 2743–2748. doi:10.1023/A:1004718329003. S2CID 91552821.
- ^ Haynes, p. 12.85.
- ^ Feneberg, M.; Leute, R. A. R.; Neuschl, B.; Thonke, K.; Bickermann, M. (2010). Phys. Rev. B. 82 (7): 075208. Bibcode:2010PhRvB..82g5208F. doi:10.1103/physrevb.82.075208.
{{cite journal}}: CS1 maint: untitled periodical (link) - ^ a b c Cheng, Zhe; Koh, Yee Rui; Mamun, Abdullah; Shi, Jingjing; Bai, Tingyu; Huynh, Kenny; Yates, Luke; Liu, Zeyu; Li, Ruiyang; Lee, Eungkyu; Liao, Michael E.; Wang, Yekan; Yu, Hsuan Ming; Kushimoto, Maki; Luo, Tengfei; Goorsky, Mark S.; Hopkins, Patrick E.; Amano, Hiroshi; Khan, Asif; Graham, Samuel (2020). «Experimental observation of high intrinsic thermal conductivity of AlN». Physical Review Materials. 4 (4): 044602. arXiv:1911.01595. Bibcode:2020PhRvM…4d4602C. doi:10.1103/PhysRevMaterials.4.044602. S2CID 207780348. Retrieved 2020-04-03.
- ^ Haynes, p. 12.80.
- ^ Vandamme, Nobuko S.; Richard, Sarah M.; Winzer, Stephen R. (1989). «Liquid-Phase Sintering of Aluminum Nitride by Europium Oxide Additives». Journal of the American Ceramic Society. 72 (8): 1409–1414. doi:10.1111/j.1151-2916.1989.tb07662.x.
- ^ Haynes, p. 5.4.
- ^ Fesenko I. P.; Prokopiv M. M.; Chasnyk V. I.; et al. (2015). Aluminium nitride based functional materials, prepared from nano/micron-sized powders via hot pressing/pressureless sintering. EPC ALCON. p. 11. ISBN 978-966-8449-53-6.
- ^ Briegleb, F.; Geuther, A. (1862). «Ueber das Stickstoffmagnesium und die Affinitäten des Stickgases zu Metallen». Justus Liebigs Annalen der Chemie. 123 (2): 228–241. doi:10.1002/jlac.18621230212.
- ^ a b c «AlN – Aluminium Nitride». Ioffe Database. Sankt-Peterburg: FTI im. A. F. Ioffe, RAN. Retrieved 2014-01-01.
- ^ Dancy, G. Selva; Sheeba, V. Benaline; Louis, C. Nirmala; Amalraj, A. (2015-09-30). «Superconductivity in Group III-V Semiconductor AlN Under High Pressure». Orbital — the Electronic Journal of Chemistry. Instituto de Quimica — Univ. Federal do Mato Grosso do Sul. 7 (3). doi:10.17807/orbital.v7i3.628. ISSN 1984-6428.
- ^ a b Ambacher, O (1998-10-21). «Growth and applications of Group III-nitrides». Journal of Physics D: Applied Physics. 31 (20): 2653–2710. doi:10.1088/0022-3727/31/20/001. ISSN 0022-3727. S2CID 250782290.
- ^ Ambacher, O.; Foutz, B.; Smart, J.; Shealy, J. R.; Weimann, N. G.; Chu, K.; Murphy, M.; Sierakowski, A. J.; Schaff, W. J.; Eastman, L. F.; Dimitrov, R.; Mitchell, A.; Stutzmann, M. (2000-01-01). «Two dimensional electron gases induced by spontaneous and piezoelectric polarization in undoped and doped AlGaN/GaN heterostructures». Journal of Applied Physics. 87 (1): 334–344. doi:10.1063/1.371866. ISSN 0021-8979.
- ^ Hickman, Austin Lee; Chaudhuri, Reet; Bader, Samuel James; Nomoto, Kazuki; Li, Lei; Hwang, James C M; Grace Xing, Huili; Jena, Debdeep (2021-04-01). «Next generation electronics on the ultrawide-bandgap aluminum nitride platform». Semiconductor Science and Technology. 36 (4): 044001. doi:10.1088/1361-6641/abe5fd. ISSN 0268-1242. S2CID 233936255.
- ^ Xu, Runjie Lily; Muñoz Rojo, Miguel; Islam, S. M.; Sood, Aditya; Vareskic, Bozo; Katre, Ankita; Mingo, Natalio; Goodson, Kenneth E.; Xing, Huili Grace; Jena, Debdeep; Pop, Eric (2019-11-14). «Thermal conductivity of crystalline AlN and the influence of atomic-scale defects». Journal of Applied Physics. 126 (18): 185105. arXiv:1904.00345. doi:10.1063/1.5097172. ISSN 0021-8979. S2CID 90262793.
- ^ Slack, Glen A.; Bartram, S. F. (1975-01-01). «Thermal expansion of some diamondlike crystals». Journal of Applied Physics. 46 (1): 89–98. doi:10.1063/1.321373. ISSN 0021-8979.
- ^ Berger, L. I. (1997). Semiconductor Materials. CRC Press. pp. 123–124. ISBN 978-0-8493-8912-2.
- ^ Chih-ming Lin; Ting-ta Yen; Yun-ju Lai; Felmetsger, V. V.; Hopcroft, M. A.; Kuypers, J. H.; Pisano, A. P. (March 2010). «Temperature-compensated aluminum nitride lamb wave resonators». IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 57 (3): 524–532. doi:10.1109/TUFFC.2010.1443. PMID 20211766. S2CID 20028149.
- ^ Xiong, Chi; Pernice, Wolfram H. P.; Sun, Xiankai; Schuck, Carsten; Fong, King Y.; Tang, Hong X. (2012). «Aluminum nitride as a new material for chip-scale optomechanics and nonlinear optics». New Journal of Physics. 14 (9): 095014. arXiv:1210.0975. Bibcode:2012NJPh…14i5014X. doi:10.1088/1367-2630/14/9/095014. ISSN 1367-2630. S2CID 118571039.
- ^ Tsuruoka, Doug (2014-03-17). «Apple, Samsung Cellphone Filter Orders Lift Avago». Investor’s Business Daily.
- ^ «ACPF-7001: Agilent Technologies Announces FBAR Filter for U.S. PCS Band Mobile Phones and Data Cards». wirelessZONE. EN-Genius Network Ltd. 2002-05-27. Retrieved 2008-10-18.
- ^ «A Gestural Interface for Smart Watches».
- ^
Przybyla, R.; al, et (2014). «3D Ultrasonic Gesture Recognition». International Solid State Circuits Conference. San Francisco. pp. 210–211. - ^ Ahmadi, A.; Hadipour, N. L.; Kamfiroozi, M.; Bagheri, Z. (2012). «Theoretical study of aluminium nitride nanotubes for chemical sensing of formaldehyde». Sensors and Actuators B: Chemical. 161 (1): 1025–1029. doi:10.1016/j.snb.2011.12.001.
- ^ Ahmadi Peyghan, A.; Omidvar, A.; Hadipour, N. L.; Bagheri, Z.; Kamfiroozi, M. (2012). «Can aluminum nitride nanotubes detect the toxic NH3 molecules?». Physica E. 44 (7–8): 1357–1360. Bibcode:2012PhyE…44.1357A. doi:10.1016/j.physe.2012.02.018.
- ^ Taniyasu, Y.; et al. (2006). «An Aluminium Nitride Light-Emitting Diode with a Wavelength of 210 Nanometres». Nature. 441 (7091): 325–328. Bibcode:2006Natur.441..325T. doi:10.1038/nature04760. PMID 16710416. S2CID 4373542.
Cited sources[edit]
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. p. 4.45. ISBN 9781498754293.
Запрос «» перенаправляется сюда; см. также другие значения.
Нитри́д алюми́ния (алюмонитри́д) — бинарное неорганическое химическое соединение алюминия с азотом. Химическая формула — AlN.
История
Нитрид алюминия был впервые синтезирован в 1877 году, но только в середине 1980-х его важность для практического применения в микроэлектронике был оценён из-за его относительно высокой для керамических материалов теплопроводности (70—210 Вт·м−1·K−1 — для поликристаллического материала, и до 275 Вт·м−1·K−1 — для монокристаллов). Этот материал представляет интерес как нетоксичная альтернатива оксиду бериллия. Методы металлизации позволяют применять соединение в электронике вместо глинозёма и оксида бериллия.
Физические свойства
Нитрид алюминия — материал с ковалентными связями, имеющий гексагональную кристаллическую структуру типа вюрцита. Кристаллографическая группа для этой структуры — 
Химические свойства
Белый порошок или бесцветные прозрачные кристаллы. Медленно растворяется в горячих минеральных кислотах. Холодные НCl, H2SО4, HNO3 и царская водка действуют слабо, холодная HF не действует.
Концентрированные горячие растворы щелочей разлагают с выделением NH3. Вещество устойчиво к высоким температурам в инертных атмосферах.
На воздухе поверхностное окисление происходит выше 700 °C, и при комнатной температуре были обнаружены поверхностные окисленные слои толщиной 5—10 нм. Этот окисный слой оксида алюминия защищает от окисления до 1370 °C. Выше этой температуры происходит объёмное окисление материала.
Нитрид алюминия устойчив в атмосферах водорода и углекислого газа до 980 °C. Вещество медленно реагирует с неорганическими кислотами на границах кристаллических зёрен, также с сильными щелочами. Медленно гидролизуется в воде.
Применение
Относится к классу неоксидной керамики.
- Производство светодиодов (полупроводник с шириной запрещённой зоны 6 эВ).
- Материалы из нановолокна[источник не указан 726 дней].
- Материал для керамики с высокой теплопроводностью (вместо токсичного оксида бериллия) — для подложек полупроводниковых компонентов.
Получение
Восстановлением Аl2О3 углём в атмосфере азота:
Также нитрид алюминия можно получить с помощью азотирования (без доступа кислорода) с порошком алюминия:
Пропусканием через расплавленный алюминий аммиак:
Ссылки
- Библиография 1995—1996 годов. Исследования применений нитрида алюминия Архивная копия от 29 мая 2007 на Wayback Machine
Эта страница в последний раз была отредактирована 30 июня 2022 в 19:59.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Нитрид алюминия
Брутто-формула:
AlN
CAS# 24304-00-5
Категории:
Нитриды
PubChem CID: 90455
| ChemSpider ID: 81668
| CHEBI:50884
Названия
Русский:
- Нитрид алюминия [Wiki]
English:
- 21RAlN
- A 100S
- A 100WR
- A 200 (nitride)
- A 500FXWR
- AGN 1 (nitride)
- AN 215
- AS 10 (nitride)
- AlN 2
- Alnel A 100
- Aluminium nitride [Wiki]
- Aluminum mononitride
- Aluminum nitride
- Aluminum nitride (AlN)
- Aluminumnitride (8CI)
- Denka AN Plate
- EINECS:246-140-8
- FAN-F 05
- FAN-F 30
- FAN-f 30A-TY
- FAN-f 50J-A
- FAN-f 80
- FLA
- GP 1000
- HR 10
- JC
- MAN 20
- R 15
- R 15 (nitride)
- R15S
- SCAN 70
- SH 02SW10 Type I
- SH 15
- SH 30
- Shapal E
- Shapal SH 04
- Shapal SH 15
- Shapal SH 30
- Toyalnite FLA
- Toyalnite FLD
- Toyalnite FLG
- Toyalnite FLX
- Toyalnite FS
- Toyalnite Super FL
- Toyalnite UC
- Toyalnite US
- UM 53E9
- UMS
- WR 100
- XUR-YM 2002-97923
- XUS 35560
- XUS 35569
- XUS35548
- aluminum, nitrido-(CAS)
- azanylidynealumane(IUPAC)
Варианты формулы:
AlN
Al%N
Al|||N
Химический состав
Реакции, в которых участвует Нитрид алюминия
-
2Al + N2 -> 2AlN
Запрос «AlN» перенаправляется сюда; см. также другие значения.
| Нитрид алюминия | |
 |
|
 __ Al3+ __ N3− |
|
| Общие | |
|---|---|
| Систематическое наименование | нитрид алюминия |
| Химическая формула | AlN |
| Физические свойства | |
| Состояние (ст. усл.) | порошок от белого до светло-жёлтого цвета |
| Молярная масса | 40,9882 г/моль |
| Плотность | 3,260 г/см³ |
| Термические свойства | |
| Температура плавления | 2200 °C |
| Температура кипения | 2517 °C |
| Удельная теплоёмкость (ст. усл.) | 740 Дж/(кг·К) |
| Теплопроводность (ст. усл.) | 285 Вт/(м·K) |
| Химические свойства | |
| Растворимость в воде | разлагается |
| Оптические свойства | |
| Показатель преломления | 1,9–2,2 |
| Структура | |
| Координационная геометрия | тетраэдральная |
| Кристаллическая структура | типа вюрцита |
| Классификация | |
| Рег. номер CAS | 24304-00-5 |
Нитри́д алюми́ния (алюмонитри́д) — бинарное неорганическое химическое соединение алюминия с азотом. Химическая формула — AlN.
История
Нитрид алюминия был впервые синтезирован в 1877 году, но только в середине 1980-х его потенциал для практического применения в микроэлектронике был осознан из-за его относительно высокой теплопроводности для изоляции керамики (70—210 Вт·м−1·K−1 для поликристаллического материала, и до 275 Вт·м−1·K−1 для монокристаллов). Этот материал представляет интерес как нетоксичная альтернатива оксиду бериллия. Методы металлизации позволяют находить применение в электронике данному веществу вместо глинозёма и оксида бериллия.
Химические свойства
Нитрид алюминия — (главным образом) материал с ковалентными связями, имеющий гексагональную кристаллическую структуру, которая является аналогом структуры сульфида цинка, известной как вюрцит. Кристаллографическая группа для этой структуры — 
Физические свойства
Белый порошок или водянисто-белые прозрачные кристаллы. Медленно растворяется в горячих минеральных кислотах. Холодные НCl, H2SО4, HNO3 и царская водка действуют слабо, холодная HF не действует. Концентрированные горячие растворы щелочей разлагают с выделением NH3.
Применение
- Производство светодиодов (полупроводник с шириной запрещённой зоны 6 эВ);
- Материалы из нановолокна;
- Материал для высокотеплопроводной керамики (вместо оксида бериллия) — подложки, корпуса электронных схем.
Получение
Получается восстановлением Аl2О3 углем в атмосфере азота:
Также нитрид алюминия можно получить с помощью азотирования алюминиевой пудры:
Пропустив через алюминий аммиак, получим водород и, в виде осадка, нитрид алюминия:
Ссылки
- Библиография 1995—1996 годов. Исследования применений нитрида алюминия
|
Соединения алюминия |
|---|
|
Алюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3) |
| Нитрид алюминия | |

|
|
 |
|
| __ Al __ N | |
| Идентификация | |
|---|---|
| Название ИЮПАК | Нитрид алюминия |
| Н о CAS | 24304-00-5 |
| N о ИК | 100 041 931 |
| N о ЕС | 246-140-8 |
| Появление | голубовато-белые гексагональные кристаллы |
| Химические свойства | |
| Грубая формула | Al N [изомеры] |
| Молярная масса | 40,9882 ± 0,0002 г / моль Al 65,83%, N 34,17%, |
| Физические свойства | |
| Т ° плавления | разлагается при 2200 ° C |
| T ° кипения | сублимация при 2517 ° C |
| Растворимость | Нерастворимый |
| Объемная масса | 3,255 г · см -3 |
| Электронные свойства | |
| Запретная группа | 6,2 эВ |
| Кристаллография | |
| Типовая структура | вюрцит |
| Меры предосторожности | |
| WHMIS | |
|
Неконтролируемый продукт |
|
|
|
|
| Единицы СИ и СТП, если не указано иное. | |
Нитрида алюминия (химический символ: AlN ) представляет собой полупроводниковый III-V шириной запрещенной зоны ( 6,2 эВ ). Это огнеупорный и керамический материал , который предлагает редкую характеристику связывая электрическую изоляцию с очень высокой теплопроводностью при комнатной температуре ( в диапазоне от 25 до 319 W.m -1 · .К -1 в зависимости от его микроструктуры и ее формы. (Монокристалла ), тонкая пленка, нанопроволока …). Он также обладает высокой устойчивостью к окислению и истиранию. Наконец, этот материал имеет интересные пьезоэлектрические свойства : пьезоэлектрический коэффициент d 33 между 3,4 и 5 пм · В -1 и коэффициент электромеханической связи, близкий к 7%.
История
Этот материал не встречается в природе. Впервые он был синтезирован в 1877 году, но не нашел применения до 1980-х годов.
Кристаллические структуры
Нитрид алюминия встречается в двух кристаллографических структурах:
- один, гексагональный, термодинамически устойчив; относится к типу вюрцита ;
- второй, кубический, метастабильный; это типа цинковой обманки .
Приложения
Нитрид алюминия находит потенциальное применение в оптоэлектронике в области ультрафиолетовых лучей , в качестве подложки для эпитаксиального роста и в силовой электронике для производства силовых микроволновых транзисторов.
В настоящее время проводится большое количество исследований по производству УФ -излучающих светодиодов (СИД) на основе нитрида алюминия-галлия . В 2006 году исследователи из лаборатории Nippon Telegraph and Telephone ( NTT ) в Японии сообщили о производстве диодов на основе нитрида алюминия с длинами волн порядка 210 нм . Исследования этого материала все еще продолжаются, чтобы уменьшить длину волны излучения светодиодов, в частности, за счет введения AlN в виде нанопроволок.
Нитрид алюминия также используется для получения этих пьезоэлектрических свойств. Фактически, из-за своего особенно высокого модуля Юнга он демонстрирует высокие скорости акустических волн порядка 10 400 м / с . Эта характеристика делает его материалом выбора для фильтров на поверхностных акустических волнах типа SAW ( поверхностная акустическая волна ) и устройств объемного звука типа FBAR ( пленочный резонатор акустических волн) .
Производство
Синтез может быть осуществлен путем прямого азотирования из алюминия, или путем уменьшения из оксида алюминия в присутствии газообразного азота или аммиака.
Современное использование AlN в устройствах для оптоэлектроники и микроэлектроники требует синтеза эпитаксиальных тонких пленок; физико-химические методы производства этих тонких пленок:
- молекулярно — лучевой эпитаксии (МЛЭ)
- химического осаждения из паровой ( ХОП )
- осаждение методом импульсной лазерной абляции (PLD)
- напыление (который может быть РЧ или постоянного тока)
- осаждения атомных слоев (ALD)
Рекомендации
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ (in) Боди Э. Дуглас, Ши-Мин Хо, Структура и химия кристаллических твердых тел , Питтсбург, Пенсильвания, США, Springer Science + Business Media, Inc.,2006 г., 346 с. ( ISBN 978-0-387-26147-8 , LCCN 2005927929 )
- ↑ « Нитрид алюминия » в базе данных химических продуктов Reptox в CSST (организации Квебека , ответственного за охрану труда и здоровья), доступ к 25 апреля 2009
- ↑ (о) С. Иноуэ, « Эпитаксиальный рост AlN на Cu (111) с использованием импульсного лазерного осаждения » , журнал рост кристаллов , п о 289,1 — го апреля 2006, стр. 574-577 ( читать онлайн )
- ↑ (в) А. AlShaikhi, « Теплопроводность монокристалла и керамики AlN » , Журнал прикладной физики , п о 103,29 апреля 2008 г., стр. 083554-1 083554-6 ( читать онлайн )
- ↑ (в) PK Kuo, » Микроструктура и теплопроводность AlN эпитаксиальной тонкой пленки « , Thin Solid Films , п о 253,15 декабря 1994 г., стр. 223–227 ( читать онлайн )
- ↑ (в) У Ли и Наталио минго, « Теплопроводность объеме InAs нанопроволоки и, AlN и ВеО polymorpha из первых принципов » , Журнал прикладной физики , п о 114,28 августа 2013 г., стр. 183505 ( читать онлайн )
- ↑ (в) Марк-Александра Дюбуа и Пола Muralt, « Свойства нитрида алюминия тонкой пленки для пьезоэлектрических преобразователей и приложений СВЧ — фильтров » , Applied Physics Letters , п о 74,1999 г., стр. 3032 ( читать онлайн )
- ↑ (в) Г. Д. Бу Ciplys, г — н Суром и LJ Schowalter, « электромеханический коэффициент связи для поверхности акустических волн в монокристаллического нитрида алюминия навалом » , Applied Physics Letters , п о 84,7 июня 2004 г., стр. 4611 ( читать онлайн )
- ↑ Жан-Кристоф Морено, Исследование роста и свойств тонких пленок AlN, эпитаксированных молекулярными струями на кремниевой подложке: применение к акустическим резонаторам и перспективы интегрированных гетероструктур на кремнии ,2011 г., 148 с. ( читать онлайн )
- ↑ (в) Еситака Taniyasu Макото Касу и Тосики Makimoto, « нитрид Алюминиевый светоизлучающий диод с длиной волны 210 нм » , Природа , п о 441,18 мая 2006 г., стр. 325-328 ( читать онлайн )
- ↑ (ен) С. Чжао, Конни АТ и МНТ Дастджерди, « Нитрид алюминия нанопроволоки светоизлучающие диоды: Breaking Фундаментальной узкое место глубокого ультрафиолетового света » , Научные доклады , п о 5,16 февраля 2015 г.( читать онлайн )
- ↑ Даниэль Ройе и Эжен Дьёльзен, Упругие волны в твердых телах Том 2, Поколение, акустооптическое взаимодействие, приложения , Париж / Милан / Барселона, Данод ,1999 г., 410 с. ( ISBN 2-225-83441-5 ) , стр. 34
- ↑ Дж.К. Лю, « Измерение морфологии роста и поверхность-акустической волна из AlN пленок были сапфиром », Журнал прикладной физики , п о 46,1975 г., стр. 3703 ( читать онлайн )
- ↑ Куаны-Сюнь Его, « Осаждение и характеристика реактивных магнетронного распыленных нитрид алюминия тонкой пленка объемная акустическая волна для пленочного резонатора » Thin Solid Films , п о 515,9 апреля 2007 г., стр. 4819–4825 ( читать онлайн )
- ↑ (о) Сатору Танака, « Первичное размещение нитрида алюминия роста пленки является карбидом кремния 6H-с помощью плазмы, газа-источник молекулярно — лучевой эпитаксии » , Applied Physics Letters , п о 66,1995 г., стр. 37 ( читать онлайн )
- ↑ (в) Mizuho Morita, « эпитаксиального роста нитрида алюминия является сапфир , используя металлоорганическое химическое осаждение из паровой фазы » , японский Журнал прикладной физики , п о 20,девятнадцать восемьдесят один, стр. 17 ( читать онлайн )
- ↑ (ru) RD Vispute, « Высококачественные эпитаксиальные слои нитрида алюминия, нанесенные методом импульсного лазерного осаждения сапфира » , Applied Physics Letters ,1995 г., стр. 1549 ( читать онлайн )
- ↑ (в) AJ Shuskus, » ВЧ-распыленных нитрида алюминия пленка сапфир « , Applied Physics Letters , п о 24,1974 г., стр. 155 ( читать онлайн )
- ↑ Юн Ли и Ю. Sang-Won Kang, « Рост нитрида алюминия тонкой пленки Подготовили плазмостимулированного осаждения атомных слоев ,» Thin Solid Films , п о 446,15 января 2004 г., стр. 227–231 ( читать онлайн )
Нитрид алюминия
| Нитрид алюминия | |
 |
|
 __ Al3+ __ N3− |
|
| Общие | |
|---|---|
| Систематическое наименование |
нитрид алюминия |
| Хим. формула | AlN |
| Физические свойства | |
| Состояние | порошок от белого до светло-жёлтого цвета |
| Молярная масса | 40,9882 г/моль |
| Плотность | 3,260 г/см³ |
| Термические свойства | |
| Т. плав. | 2200 °C |
| Т. кип. | 2517 °C |
| Уд. теплоёмк. | 740 Дж/(кг·К) |
| Теплопроводность | 285 Вт/(м·K) |
| Химические свойства | |
| Растворимость в воде | разлагается |
| Оптические свойства | |
| Показатель преломления | 1,9–2,2 |
| Структура | |
| Координационная геометрия | тетраэдральная |
| Кристаллическая структура | типа вюрцита |
| Классификация | |
| Рег. номер CAS | 24304-00-5 |
| PubChem | 90455 |
| Рег. номер EINECS | 246-140-8 |
| SMILES |
N#[Al] |
| InChI |
1S/Al.N PIGFYZPCRLYGLF-UHFFFAOYSA-N |
| ChEBI | 50884 |
| ChemSpider | 81668 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитри́д алюми́ния (алюмонитри́д) — бинарное неорганическое химическое соединение алюминия с азотом. Химическая формула — AlN.
История
Нитрид алюминия был впервые синтезирован в 1877 году, но только в середине 1980-х его потенциал для практического применения в микроэлектронике был осознан из-за его относительно высокой, для керамики, теплопроводности (70—210 Вт·м−1·K−1 для поликристаллического материала, и до 275 Вт·м−1·K−1 для монокристаллов). Этот материал представляет интерес как нетоксичная альтернатива оксиду бериллия. Методы металлизации позволяют применять данное вещество в электронике вместо глинозёма и оксида бериллия.
Физические свойства
Нитрид алюминия — (главным образом) материал с ковалентными связями, имеющий гексагональную кристаллическую структуру, известную как вюрцит. Кристаллографическая группа для этой структуры — 
Химические свойства
Белый порошок или водянисто-белые прозрачные кристаллы. Медленно растворяется в горячих минеральных кислотах. Холодные НCl, H2SО4, HNO3 и царская водка действуют слабо, холодная HF не действует. Концентрированные горячие растворы щелочей разлагают с выделением NH3. Материал устойчив к очень высоким температурам в инертных атмосферах. На воздухе поверхностное окисление происходит выше 700 °C, и при комнатной температуре были обнаружены поверхностные окисленные слои толщиной 5—10 нм. Этот окисный слой защищает материал до 1370 °C. Выше этой температуры происходит объёмное окисление материала. Нитрид алюминия устойчив в атмосферах водорода и углекислого газа до 980 °C. Материал медленно распадается в неорганических кислотах при контакте жидкости с границами зёрен, как и в случае с сильными щелочами. Материал медленно гидролизуется в воде.
Применение
- Производство светодиодов (полупроводник с шириной запрещённой зоны 6 эВ);
- Материалы из нановолокна;
- Материал для высокотеплопроводной керамики (вместо оксида бериллия) — подложки для производства высокочастотных резисторов, корпуса электронных схем.
Получение
Получается восстановлением Аl2О3 углем в атмосфере азота:
Также нитрид алюминия можно получить с помощью азотирования (без доступа кислорода) алюминиевой пудры:
При пропускании через алюминий аммиака получается водород и, в виде осадка, нитрид алюминия:
Ссылки
- Библиография 1995—1996 годов. Исследования применений нитрида алюминия









