Оксид кремния

4.5
Средняя оценка: 4.5
Всего получено оценок: 101.
4.5
Средняя оценка: 4.5
Всего получено оценок: 101.
Кремний проявляет переменную валентность (II, IV), поэтому может образовывать два оксида кремния – монооксид и диоксид. Они отличаются физическими и химическими свойствами. Подробнее об оксидах кремния говорим в этой статье.
Монооксид
Формула оксид кремния (II) – SiO. Это вязкое, похожее на смолу вещество. Сохраняет аморфное состояние и не окисляется при обычных условиях. Не образует соли, не проводит электричество.
Монооксид получают двумя способами:
- нагреванием (температура выше 400°C) кремния при недостатке кислорода:
2Si + O2 → 2SiO;
- методом Чохральского при восстановлении диоксида при высоких температурах:
SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой тёмно-коричневый порошок. Проявляет прочность и инертность в реакциях с кислотами. Растворим в плавиковой кислоте.
Химические свойства монооксида кремния:
- разлагается при нагревании:
2SiO → 2Si + O2;
- реагирует с парами воды при нагревании до 500°C:
SiO + H2O → SiO2 + H2;
- взаимодействует с углекислым газом при нагревании:
SiO + СО2 → SiO2 + CO;
- реагирует с хлором при температуре 800°C, образуя жидкий хлорид кремния:
2SiO + 4Cl2 → 2SiCl4 + O2.
Монооксид не встречается на Земле в естественной среде. Однако газообразный монооксид входит в состав межзвёздных пылевых облаков.
Диоксид
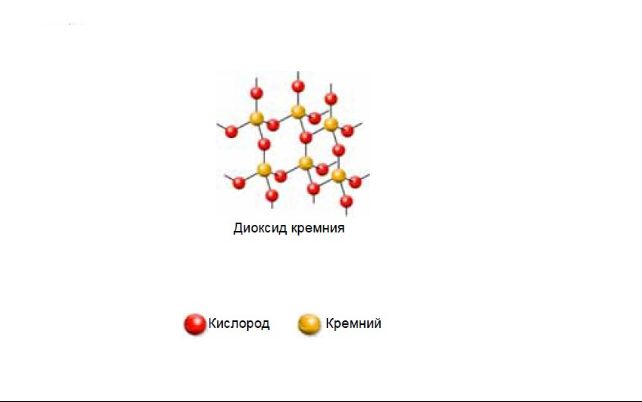
Оксид кремния (IV) – SiO2. Это твёрдое кристаллическое тугоплавкое вещество, нерастворимое в воде. Не проводит электрический ток.
Формулу диоксида имеют песок, кварц, горный хрусталь, яшма, агат, аметист и другие горные породы. Диоксид входит в состав 87 % литосферы.
Диоксид кремния имеет немолекулярное строение. Кристаллическая решётка состоит из атомов кремния и кислорода, связанных ковалентными связями. К каждому атому кремния присоединено четыре атома кислорода, а каждый атом кислорода связан с двумя атомами кремния.
Диоксид можно получить в лаборатории, нагрев кремний до 400-500°C в присутствии кислорода:
Si + O2 → SiO2.
Диоксид образуется при действии кислот на растворимые силикаты. В результате образующаяся кремниевая кислота распадается на воду и диоксид:
- Na2SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓;
- H2SiO3 → H2O + SiO2.
При нормальных условиях реагирует только с плавиковой кислотой. Со щелочами и основными оксидами реагирует при нагревании. Не реагирует с водой. Основные свойства с химическими уравнениями представлены в таблице.
|
Взаимодействие |
Описание |
Уравнение |
|
С неметаллами |
Реагирует с водородом и углеродом с образованием кремния и карборунда соответственно |
– SiO2 + 2Н2 → Si + 2H2O; – SiO2 + 3С → SiC + 2CO |
|
С активными металлами |
Реагирует при температуре выше 1000°С с образованием кремния. При избытке металла образуются силициды |
– SiO2 + 2Mg → Si + 2MgO; – SiO2 + 4Mg → Mg2Si + 2MgO |
|
С фтороводородом |
Реагирует с газом и плавиковой кислотой при нормальных условиях |
– SiO2 + 4HF → SiF4 + 2H2O; – SiO2 + 6HF → H2[SiF6] + 2H2O |
|
Со щелочами |
Сплавляется с образованием силикатов |
SiO2 + 4NaOH → Na4SiO4 + 2H2O |
|
С оксидами |
Реагирует при высоких температурах |
SiO2 + MgO → MgSiO3 |
|
С карбонатами щелочных металлов |
Взаимодействует при нагревании |
SiO2 + K2CO3 → K2SiO3 + CO2 |
Диоксид кремния используется для производства стекла, силикагеля, бетона.
Что мы узнали?
Кремний образует два оксида – монооксид и диоксид. Монооксид – аморфное вещество, не образующее соли. Взаимодействует при нагревании с водяным паром, углекислым газом, хлором. Разлагается на простые вещества при нагревании. Диоксид – песок и его производные. Это кристаллическое вещество с немолекулярным строением. Не реагирует с водой, кислотами (исключение – плавиковая кислота). Взаимодействует с неметаллами, металлами, фтороводородом, щелочами, оксидами, карбонатами. Оксиды кремния – диэлектрики.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 101.
А какая ваша оценка?
Оксид кремния((IV)), или кремнезём
SiO2
— твёрдое тугоплавкое вещество, нерастворимое в воде. В отличие от оксидов других неметаллов он имеет немолекулярное строение. Каждый атом кремния в его решётке соединён ковалентными связями с четырьмя атомами кислорода, а каждый атом кислорода — с двумя атомами кремния. Образуется кристаллическая решётка атомного типа. Молекул
SiO2
не существует, а формула показывает простейшее соотношение числа атомов кремния и кислорода в этом веществе.
В природе оксид кремния((IV)) встречается в виде песка, кремнезёма, кварца, горного хрусталя, аметиста и др.
Рис. (1). Кристаллы кварца
Рис. (2). Аметист
В результате химических реакций получают пористый оксид кремния((IV)) — силикагель.
Рис. (3). Силикагель
По химическим свойствам оксид кремния((IV)) — кислотный оксид. Он вступает в реакции с основными и амфотерными оксидами, со щелочами. При этом образуются соли кремниевой кислоты силикаты:
В отличие от других кислотных оксидов он не реагирует с водой.
При нагревании взаимодействует с карбонатами и вытесняет из них углекислый газ:
Ещё одна особенность оксида кремния((IV)) — взаимодействие с плавиковой кислотой:
С помощью плавиковой кислоты можно наносить рисунки или надписи на стекло, так как его основу составляет оксид кремния((IV)).
Оксид кремния((IV)) используется:
- для производства оконного стекла и стеклянной посуды;
Рис. (4). Оконное стекло
- для изготовления кварцевых ламп и термостойкой лабораторной посуды;
Рис. (5). Лабораторная посуда
- для приготовления бетона — смеси песка и цемента;
Рис. (6). Бетонные плиты
- силикагель применяется в качестве адсорбента и для поглощения влаги.
Источники:
Рис. 1. Кристаллы кварца https://cdn.pixabay.com/photo/2016/02/18/08/16/quartz-1206671_960_720.jpg
Рис. 2. Аметист https://cdn.pixabay.com/photo/2014/02/13/14/37/amethyst-265347_960_720.jpg
Рис. 3. Силикагель https://cdn.pixabay.com/photo/2016/04/05/10/33/silica-1309134_960_720.jpg
Рис. 4. Оконное стекло https://cdn.pixabay.com/photo/2013/03/11/14/55/the-window-92549_960_720.jpg
Рис. 5. Лабораторная посуда https://cdn.pixabay.com/photo/2015/10/27/15/24/laboratory-1009178_960_720.jpg
Рис. 6. Бетонные плиты https://cdn.pixabay.com/photo/2019/07/16/13/01/bottom-plate-4341841_960_720.jpg
Кислородные соединения
Известно 2 соединения силициума с кислородом: монооксид (SiO) и диоксид (SiO2). Первый, двухвалентный, является неустойчивым: на воздухе он медленно окисляется до четырехвалентного: SiO + O2 → 2SiO2. При повышении температуры (от 400° C до 1000°C) реакция будет протекать так: 4SiO + O2 → 2Si2O3.
Si2O3 относится к низшим кислородным соединениям кремния. Данные о нем довольно ограничены — еще не так давно в среде химиков существование этого вещества оспаривалось. Объяснялось это не только трудностью его получения, но и необычностью основных свойств.
По внешнему виду SiO — порошок, тёмно-коричневого цвета, механически прочный, обладающий хорошими диэлектрическими характеристиками. Его химические свойства:
- Инертен по отношению к кислотам (кроме плавиковой): SiO + HF → SiF2 + H2O.
- Хорошо растворяется в щелочах: SiO + 4NaOH → Na4SiO4 + H2 + H2O.
- Проявляет свойства восстановителя.
Двухвалентный оксид в естественном виде в природе не встречается. Однако в газообразном состоянии он присутствует в космических пылевых облаках.
Получают монооксид путем нагревания кремния при недостатке кислорода, температура протекания реакции составляет 400 °C и выше: 2Si + O2 → 2SiO.
Еще один способ — восстановление диоксида кремнием при высоких температурах: SiO2 + Si → 2SiO.
Монооксид кремния используется при изготовлении волоконной оптики, изоляционных материалов, полупроводников (оптические слои).
Второе соединение с кислородом — диоксид кремния (наиболее характерное и устойчивое). Он широко распространен в природе — присутствует в составе практически всех горных пород.
Физические признаки и получение SiO2
Другое название соединения — кремнезем. Это твердое вещество с атомной кристаллической решеткой (в узлах расположены отдельные атомы, соединенные ковалентными связями). Температура плавления — 1713 °C, кипения — 2590 °C. Получение:
- Окисление кремния: Si + O2 → SiO2.
- Разложение водой сульфида: SiS2 + 2H2O → SiO2 + 2H2S.
- Воздействие кислот на растворимые силикаты: Na2SiO3 + 2CH3COOH (уксусная кислота) → 2CH3COONa + H2SiO3; H2SiO3 → SiO2 + H2O.
В природе соединение встречается в виде обычного и кварцевого песка (из-за содержащихся в нем примесей может приобретать разную окраску), крупных прозрачных кристаллов горного хрусталя или фиолетового аметиста, агата, яшмы, в минералах тридимит и кристобалит (редкие камни).
Химические свойства
Диоксид кремния — соединение довольно инертное. По химическим свойствам — ангидрид кремневой кислоты. При нормальных условиях (комнатная температура) он слабо реагирует только с концентрированными щелочами и фторводородной кислотой.
При нагревании двуокись кремния взаимодействует с плавиковой кислотой: SiO2 + 4HF → SiF4 + 2H2O. Какие еще особенности присущи двуокиси силициума:
- Взаимодействие со щелочами происходит только при повышенном давлении. В результате реакций образуются силикаты — соединения с кремнекислым радикалом: SiO2 + 2NaOH → Na2SiO3 + H2O; KOH + SiO2 → K2SiO3 + H2O.
- Аналогично протекают и реакции взаимодействия с карбонатами щелочных металлов: SiO2 + Na2CO3 → Na2SiO3 + CO2.
- Реагирование с оксидами щёлочноземельных металлов: SiO2 + CaO → CaSiO3.
- С водой кремнезем не вступает во взаимодействие.
- При нагревании до 1000 °C силициум будет реагировать с металлами, образуя при этом чистый кремний: SiO2 + 2Mg → Si + 2MgO.
- Протекание реакций с неметаллами: SiO2 + 2H2 → Si + 2H2O; SiO2 + 3C → SiC (карборунд) + 2CO.
При реакции сплавления двуокиси кремния с фосфатом кальция и углеродом происходит образование силиката, угарного газа (CO) и выделение чистого фосфора (P): 3SiO2 + Ca3 (PO4)2 + 5C → 3CaSiO3 + 5CO + 2P.
Фосфат кальция — минеральное удобрение, используемое в сельском хозяйстве как источник фосфора.
Производственное применение стабильного оксида
До того времени, как его свойства не были исследованы досконально, кремнезем использовался лишь для изготовления стройматериалов (цемент, бетон). Но по мере его дальнейшего изучения сферы применения значительно расширились:
- Крупные кристаллы кварца популярны в ювелирном деле — в качестве полудрагоценных камней (например, горный хрусталь, опал).
- В промышленности — авиационная индустрия, оптика, электроника.
- При производстве зубной пасты — как «мягкий» абразив.
- В качестве огнеупорного вещества в сталелитейном производстве.
- В фармацевтической отрасли (как загуститель) — при производстве мазей, суспензий, гелей.
- При производстве ядохимикатов (средство для борьбы с клопами «Гектор») — порошок не отравляет насекомых, но он выводит воду из их организма, что приводит к последующему обезвоживанию и гибели вредителей.
- В пищевой промышленности — как стабилизатор суспензий, загуститель, порошок для фильтрации (в производстве пива, масел, натуральных соков), для предотвращения слеживания и комкования сыпучих продуктов (сахара, муки, соли). Кроме того, этот материал используется как энтеросорбент и даже самостоятельная пищевая добавка (E551 — в сырах, специях, сухих завтраках).
Добавка E551 считается полностью безопасной для организма человека — он разрешена к использованию не только в России и странах бывшего СНГ, но также в государствах ЕС и США.
Однако вдыхание пыли двуокиси кремния может привести к появлению проблем со стороны дыхательной системы — бронхиту, реже — силикозу легких (заболеванию, снижающему способность легких перерабатывать кислород) и даже спровоцировать развитие онкозаболеваний.
КРЕМНИЯ ОКСИД
- КРЕМНИЯ ОКСИД
-
SiO, устойчив в газообразном состоянии (SiOr) выше 1000°С; для газа: C0p 29,901 Дж/(моль К), DH0 обр — 100,000 кДж/моль, S0296211,489 Дж/(моль . К). При быстром охлаждении SiO конденсируется в аморфный продукт SiOx-1, (плота. 2,15 г/см 3) светло-коричневого цвета, реиспаряющийся в вакууме с послед. конденсацией аморфного SiOx (0<х[1), св-ва к-рого определяются условиями реиспарения. При старении и отжигах SiOx распадается на кластеры из Si и SiO2, содержащие До 1020 см -3 парамагнитных центров. К. о. не имеет определенных т-р плавления и кипения, DH0 исп 240-380 кДж/моль. Оптич. св-ва SiOx зависят от скорости конденсации, остаточного давления О 2 и др. факторов; коэф. поглощения 0,02 (l=700 нм)-0,20 (l=400 нм); показатель преломления в видимой области 1,5-3,8. Структура SiOx удовлетворительно описывается моделью случайного распределения тетраэдров Si-SiyO4-y (у=1,2,3), статистич. веса к-рых зависят от величины х. При нагр. на воздухе К. о. частично окисляется; при 500 °С взаимод. с парами воды и СО 2, выделяя соотв. Н 2 и СО; при 800 °С реагирует с Сl2, давая SiCl4. К. о. образуется при восстановлении SiO2 кремнием. С, Н 2, углеводородами, окислении Si при недостатке О 2, диссоциации SiO2 выше 1800°С. Газообразный К. о. обнаружен в газопылевых облаках межзвездных сред, на солнечных пятнах, в разреженных пламенах моносилана с О 2, в продуктах взаимод. паров Si с N2O. К. о.-материал для изолирующих, защитных, пассивирующих, оптич. слоев в полупроводниковых устройствах, волоконной оптике. Слои наносятся напылением в вакууме, реактивным распылением Si в плазме О 2. Образующийся при термич. окислении Si слой (между Si и пленкой SiO2) состава SiOx (0[х[2) толщиной до 1 нм определяет электрофиз. параметры структур SiO2-Si. Лит.: Гельд П. В., Есин О. А., Процессы высокотемпературного восстановления. Свердловск. 1957; Sosman R. В., The phases of silica. New Brunswick, 1965, p. 7-10; Rockow E.G., The chemistry of silicon, Oxf.-[a.o.], 1975 (Pergamon texts hi inorganic chemistry, v. 9); Finster J, Schulze D, Meisel A, «Surface Science», 1985, v. 162, p. 671-79. В. И. Белый.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Полезное
Смотреть что такое «КРЕМНИЯ ОКСИД» в других словарях:
-
Оксид кремния(II) — (монооксид кремния) SiO смолоподобное аморфное вещество, при обычных условиях устойчиво к действию кислорода. Относится к несолеобразующим оксидам. В природе (на Земле) SiO не встречается. Газообразный моноксид кремния обнаружен в… … Википедия
-
Оксид цинка — Оксид цинка … Википедия
-
Оксид кобальта(II) — Общие Систематическое наименование оксид кобальта(II) Традиционные названия окись кобальта Химическая формула CoO Физические свойства Состояние ( … Википедия
-
Оксид полония(IV) — Общие Систематическое наименование Оксид полония Традиционные названия Двуокись полония Химическая формула PoO2 Физические свойства … Википедия
-
Оксид тория(IV) — Общие Систематическое наименование Оксид тория Традиционные названия Окись тория Химическая формула ThO2 Физические свойства Состояние ( … Википедия
-
оксид — В полупроводниковой технологии так обычно обозначается двуокись кремния (SiO2). [http://www.cscleansystems.com/glossary.html] Тематики полупроводниковые приборы EN oxide … Справочник технического переводчика
-
Оксид кремния(IV) — Кварц … Википедия
-
Оксид кремния (IV) — Кварц Кварцевое стекло Диоксид кремния (оксид кремния (IV), кремнезём, SiO2) бесцветные кристаллы, tпл 1713 1728 °C, обладают высокой твёрдостью и прочностью … Википедия
-
Моноксид кремния — Оксид кремния (II) (моноксид кремния) SiO смолоподобное аморфное вещество, при обычных условиях устойчиво к действию кислорода. Относится к несолеобразующим оксидам. В природе (на земле) SiO не встречается. Газообразный моноксид кремния обнаружен … Википедия
-
Кремния двуокись — Кварц Кварцевое стекло Диоксид кремния (оксид кремния (IV), кремнезём, SiO2) бесцветные кристаллы, tпл 1713 1728 °C, обладают высокой твёрдостью и прочностью … Википедия
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т.к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.