Химия — Оксид лития
01 марта 2011
Оглавление:
1. Оксид лития
2. Получение
Оксид лития бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Описание
Оксид лития при стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой. При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе.
Просмотров: 3966
Оксид лития — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
| Оксид лития | |
|---|---|
| Систематическое наименование |
Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Температура | |
| • плавления | 1570 |
| • кипения | 2600 °C |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Рег. номер CAS | 12057-24-8 |
| PubChem | 166630 |
| Рег. номер EINECS | 235-019-5 |
| SMILES |
[Li+].[Li+].[O-2] |
| InChI |
1S/2Li.O/q2*+1;-2 FUJCRWPEOMXPAD-UHFFFAOYSA-N |
| RTECS | OJ6360000 |
| ChemSpider | 145811 |
Описание
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).
Получение
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
- с кислотообразующими оксидами образует соли:
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 мая 2020 года; проверки требуют 5 правок.
Окси́д ли́тия (окись лития) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Описание[править | править код]
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).[2]
Получение[править | править код]
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
Химические свойства[править | править код]
- Взаимодействует с водой, образуя щёлочь:
- с кислотами:
- литий из оксида вытесняется некоторыми металлами и неметаллами:
- с кислотообразующими оксидами образует соли:
Применение[править | править код]
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Основное применение оксид лития нашел в производстве литий-ионных аккумуляторов, в качестве источника ионов катода.
См. также[править | править код]
- Литий
- Пероксид лития
Примечания[править | править код]
- ↑ 1 2 [www.xumuk.ru/spravochnik/611.html Оксид лития на XuMuK.Ru]
- ↑ [www.xumuk.ru/encyklopedia/2352.html Описание оксида лития на XuMuK.Ru]
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Оксид лития, характеристика, свойства и получение, химические реакции.
Оксид лития – неорганическое вещество, имеет химическую формулу Li2O.
Краткая характеристика оксида лития
Физические свойства оксида лития
Получение оксида лития
Химические свойства оксида лития
Химические реакции оксида лития
Применение и использование оксида лития
Краткая характеристика оксида лития:
Оксид лития – неорганическое вещество, без цвета.
Так как валентность лития равна одному, то оксид лития содержит один атом кислорода и два атома лития.
Химическая формула оксида лития Li2O.
В воде не растворяется, а вступает в реакцию с ней.
Обладает гигроскопичностью.
Оксид лития – единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).
Физические свойства оксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | Li2O |
| Синонимы и названия иностранном языке | lithium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2013 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,013 |
| Температура кипения, °C | 2600 |
| Температура плавления, °C | 1570 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 29,8774 |
* Примечание:
— нет данных.
Получение оксида лития:
Оксид лития получается в результате следующих химических реакций:
- 1. путем разложения пероксида лития:
2Li2О2 → 2Li2О + О2 (t = 195 oC).
- 2.путем взаимодействия лития с кислородом:
4Li + О2 → 2Li2О.
Химические свойства оксида лития. Химические реакции оксида лития:
Химические свойства оксида лития аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида лития с магнием:
Li2O + Mg → 2Li + MgO (t > 800 oC).
В результате реакции образуется оксид магния и литий.
2. реакция оксида лития с магнием и водородом:
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 oC).
В результате реакции образуется оксид магния и гидрид лития.
3. реакция оксида лития с алюминием:
3Li2O + 2Al → 6Li + Al2O3 (t > 1000 oC).
В результате реакции образуется оксид алюминия и литий.
4. реакция оксида лития с алюминием и водородом:
3Li2O + 2Al + 3H2 → 6LiH + Al2O3 (t = 600-700 oC).
В результате реакции образуется оксид алюминия и гидрида лития.
5. реакция оксида лития с кремнием:
2Li2O + Si → 4Li + SiO2 (t = 1000 oC).
В результате реакции образуется оксид кремния и литий.
6. реакция оксида лития с водой:
Li2О + Н2О → 2LiОН.
Оксид лития медленно реагирует с водой, образуя гидроксид лития.
7. реакция оксида лития с оксидом углерода (углекислым газом):
Li2О + СО2 → Li2СО3.
Оксид лития на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат лития.
8. реакция оксида лития с оксидом кремния:
Li2О + SiО2 → Li2SiО3 (t = 1200-1300 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – метасиликат лития.
9. реакция оксида лития с оксидом серы:
Li2О + SО2 → Li2SО3.
Оксид серы также является кислотным оксидом. В результате реакции образуется соль – сульфит лития.
10. реакция оксида лития с оксидом азота (IV) и оксидом азота (II):
Li2O + NO2 + NO → 2LiNO2 (t = 300 oC).
В результате реакции образуются соль – нитрит лития.
11. реакция оксида лития с оксидом ванадия:
V2O3 + Li2O → 2LiVO2 (t = 1200 oC).
В результате реакции образуется диоксованадат лития.
12. реакция оксида лития с оксидом теллура:
TeO2 + Li2O → Li2TeO3 (to).
В результате реакции образуется теллурит лития.
13. реакция оксида лития с оксидом марганца:
Mn2O3 + Li2O → 2LiMnO2 (t = 800-900 oC).
В результате реакции образуется оксид марганца-лития.
14. реакция оксида лития с йодоводородом:
Li2O + 2HI → 2LiI + H2O.
В результате химической реакции получается соль – йодид лития и вода.
15. реакция оксида лития с сероводородом:
Li2O + H2S → Li2S + H2O (t = 900-1000 oC).
В результате химической реакции получается соль – сульфид лития и вода.
16. реакция оксида лития с плавиковой кислотой:
Li2O + 2HF → 2LiF + H2O.
В результате химической реакции получается соль – фторид лития и вода.
17. реакция оксида лития с азотной кислотой:
Li2O + 2HNO3 → 2LiNO3 + H2O.
В результате химической реакции получается соль – нитрат лития и вода.
Аналогично проходят реакции оксида лития и с другими кислотами.
18. реакция оксида лития с бромистым водородом (бромоводородом):
Li2O + 2HBr → 2LiBr + H2O.
В результате химической реакции получается соль – бромид лития и вода.
Применение и использование оксида лития:
Оксид лития используется как компонент в производстве стекол, а также в химической промышленности.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид лития реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида лития
реакции с оксидом лития
Коэффициент востребованности
4 289
From Wikipedia, the free encyclopedia

|
|

|
|

__ Li+ __ O2− |
|

|
|
| Names | |
|---|---|
| IUPAC name
Lithium oxide |
|
| Other names
Lithia, Kickerite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.031.823 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Li 2O |
| Molar mass | 29.88 g/mol |
| Appearance | white solid |
| Density | 2.013 g/cm3 |
| Melting point | 1,438 °C (2,620 °F; 1,711 K) |
| Boiling point | 2,600 °C (4,710 °F; 2,870 K) |
|
Solubility in water |
Reacts to form LiOH |
| log P | 9.23 |
|
Refractive index (nD) |
1.644 [1] |
| Structure | |
|
Crystal structure |
Antifluorite (cubic), cF12 |
|
Space group |
Fm3m, No. 225 |
|
Coordination geometry |
Tetrahedral (Li+); cubic (O2−) |
| Thermochemistry | |
|
Heat capacity (C) |
1.8105 J/g K or 54.1 J/mol K |
|
Std molar |
37.89 J/mol K |
|
Std enthalpy of |
-20.01 kJ/g or -595.8 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-562.1 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Corrosive, reacts violently with water |
| NFPA 704 (fire diamond) |
3 0 1
|
| Flash point | Non-flammable |
| Related compounds | |
|
Other anions |
Lithium sulfide Lithium selenide Lithium telluride Lithium polonide |
|
Other cations |
Sodium oxide Potassium oxide Rubidium oxide Caesium oxide |
|
Related lithium oxides |
Lithium peroxide Lithium superoxide |
|
Related compounds |
Lithium hydroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lithium oxide (Li
2O) or lithia is an inorganic chemical compound. It is a white solid. Although not specifically important, many materials are assessed on the basis of their Li2O content. For example, the Li2O content of the principal lithium mineral spodumene (LiAlSi2O6) is 8.03%.[2]
Production[edit]
Burning lithium metal produces lithium oxide.
Lithium oxide is produced by thermal decomposition of lithium peroxide at 300–400 °C.[2]
Lithium oxide forms along with small amounts of lithium peroxide when lithium metal is burned in the air at and combines with oxygen at temperatures above 100 °C:[3]
- 4Li + O
2 → 2Li
2O.
Pure Li
2O can be produced by the thermal decomposition of lithium peroxide, Li
2O
2, at 450 °C[3]
- 2Li
2O
2 → 2Li
2O + O
2
Structure[edit]
Solid lithium oxide adopts an antifluorite structure with four-coordinated Li+ centers and eight-coordinated oxides.[4]
The ground state gas phase Li
2O molecule is linear with a bond length consistent with strong ionic bonding.[5][6] VSEPR theory would predict a bent shape similar to H
2O.
Uses[edit]
Lithium oxide is used as a flux in ceramic glazes; and creates blues with copper and pinks with cobalt. Lithium oxide reacts with water and steam, forming lithium hydroxide and should be isolated from them.
Its usage is also being investigated for non-destructive emission spectroscopy evaluation and degradation monitoring within thermal barrier coating systems. It can be added as a co-dopant with yttria in the zirconia ceramic top coat, without a large decrease in expected service life of the coating. At high heat, lithium oxide emits a very detectable spectral pattern, which increases in intensity along with degradation of the coating. Implementation would allow in situ monitoring of such systems, enabling an efficient means to predict lifetime until failure or necessary maintenance.
Lithium metal might be obtained from lithium oxide by electrolysis, releasing oxygen as by-product.
Reactions[edit]
Lithium oxide absorbs carbon dioxide forming lithium carbonate:
- Li
2O + CO
2 → Li
2CO
3
The oxide reacts slowly with water, forming lithium hydroxide:
- Li
2O + H
2O → 2LiOH
See also[edit]
- Lithium monoxide anion
- Lithium peroxide
- Lithium cobalt oxide
- Lithium-oxide memristor
References[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b Wietelmann, Ulrich and Bauer, Richard J. (2005) «Lithium and Lithium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim. doi:10.1002/14356007.a15_393.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 97–99. ISBN 978-0-08-022057-4.
- ^ Zintl, Eduard; Harder, A.; Dauth, B. (1934). «Gitterstruktur der Oxyde, Sulfide, Selenide und Telluride des Lithiums, Natriums und Kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie (in German). 40 (8): 588–593. doi:10.1002/bbpc.19340400811. S2CID 94213844.
- ^ Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ A spectroscopic determination of the bond length of the LiOLi molecule: Strong ionic bonding, D. Bellert, W. H. Breckenridge, J. Chem. Phys. 114, 2871 (2001); doi:10.1063/1.1349424
External links[edit]
- CeramicMaterials.Info entry
From Wikipedia, the free encyclopedia

|
|

|
|

__ Li+ __ O2− |
|

|
|
| Names | |
|---|---|
| IUPAC name
Lithium oxide |
|
| Other names
Lithia, Kickerite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.031.823 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Li 2O |
| Molar mass | 29.88 g/mol |
| Appearance | white solid |
| Density | 2.013 g/cm3 |
| Melting point | 1,438 °C (2,620 °F; 1,711 K) |
| Boiling point | 2,600 °C (4,710 °F; 2,870 K) |
|
Solubility in water |
Reacts to form LiOH |
| log P | 9.23 |
|
Refractive index (nD) |
1.644 [1] |
| Structure | |
|
Crystal structure |
Antifluorite (cubic), cF12 |
|
Space group |
Fm3m, No. 225 |
|
Coordination geometry |
Tetrahedral (Li+); cubic (O2−) |
| Thermochemistry | |
|
Heat capacity (C) |
1.8105 J/g K or 54.1 J/mol K |
|
Std molar |
37.89 J/mol K |
|
Std enthalpy of |
-20.01 kJ/g or -595.8 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-562.1 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Corrosive, reacts violently with water |
| NFPA 704 (fire diamond) |
3 0 1
|
| Flash point | Non-flammable |
| Related compounds | |
|
Other anions |
Lithium sulfide Lithium selenide Lithium telluride Lithium polonide |
|
Other cations |
Sodium oxide Potassium oxide Rubidium oxide Caesium oxide |
|
Related lithium oxides |
Lithium peroxide Lithium superoxide |
|
Related compounds |
Lithium hydroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lithium oxide (Li
2O) or lithia is an inorganic chemical compound. It is a white solid. Although not specifically important, many materials are assessed on the basis of their Li2O content. For example, the Li2O content of the principal lithium mineral spodumene (LiAlSi2O6) is 8.03%.[2]
Production[edit]
Burning lithium metal produces lithium oxide.
Lithium oxide is produced by thermal decomposition of lithium peroxide at 300–400 °C.[2]
Lithium oxide forms along with small amounts of lithium peroxide when lithium metal is burned in the air at and combines with oxygen at temperatures above 100 °C:[3]
- 4Li + O
2 → 2Li
2O.
Pure Li
2O can be produced by the thermal decomposition of lithium peroxide, Li
2O
2, at 450 °C[3]
- 2Li
2O
2 → 2Li
2O + O
2
Structure[edit]
Solid lithium oxide adopts an antifluorite structure with four-coordinated Li+ centers and eight-coordinated oxides.[4]
The ground state gas phase Li
2O molecule is linear with a bond length consistent with strong ionic bonding.[5][6] VSEPR theory would predict a bent shape similar to H
2O.
Uses[edit]
Lithium oxide is used as a flux in ceramic glazes; and creates blues with copper and pinks with cobalt. Lithium oxide reacts with water and steam, forming lithium hydroxide and should be isolated from them.
Its usage is also being investigated for non-destructive emission spectroscopy evaluation and degradation monitoring within thermal barrier coating systems. It can be added as a co-dopant with yttria in the zirconia ceramic top coat, without a large decrease in expected service life of the coating. At high heat, lithium oxide emits a very detectable spectral pattern, which increases in intensity along with degradation of the coating. Implementation would allow in situ monitoring of such systems, enabling an efficient means to predict lifetime until failure or necessary maintenance.
Lithium metal might be obtained from lithium oxide by electrolysis, releasing oxygen as by-product.
Reactions[edit]
Lithium oxide absorbs carbon dioxide forming lithium carbonate:
- Li
2O + CO
2 → Li
2CO
3
The oxide reacts slowly with water, forming lithium hydroxide:
- Li
2O + H
2O → 2LiOH
See also[edit]
- Lithium monoxide anion
- Lithium peroxide
- Lithium cobalt oxide
- Lithium-oxide memristor
References[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b Wietelmann, Ulrich and Bauer, Richard J. (2005) «Lithium and Lithium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim. doi:10.1002/14356007.a15_393.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 97–99. ISBN 978-0-08-022057-4.
- ^ Zintl, Eduard; Harder, A.; Dauth, B. (1934). «Gitterstruktur der Oxyde, Sulfide, Selenide und Telluride des Lithiums, Natriums und Kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie (in German). 40 (8): 588–593. doi:10.1002/bbpc.19340400811. S2CID 94213844.
- ^ Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ A spectroscopic determination of the bond length of the LiOLi molecule: Strong ionic bonding, D. Bellert, W. H. Breckenridge, J. Chem. Phys. 114, 2871 (2001); doi:10.1063/1.1349424
External links[edit]
- CeramicMaterials.Info entry
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1.
Показано записей: 1.
Оксид лития
Брутто-формула:
Li2O
CAS# 12057-24-8
Названия
Русский:
- Оксид лития [Wiki]
- окись лития
English:
- EINECS:235-019-5
- Kickerite
- Lithium monooxide
- Lithium monoxide
- Lithium oxide [Wiki]
- Lithium oxide (LiO)
- Monolithium monoxide
- dilithium oxygen(2-)
- dilithium;oxygen(2-)(IUPAC)
- lithia
Варианты формулы:
Реакции, в которых участвует Оксид лития
-
{M}2O + {X}O2 -> {M}2{X}O3
, где M =
Na K Li Rb Cs; X =
C S Si -
{M}2O + H2O -> 2{M}OH
, где M =
Li Na K Rb Cs -
{M}2O + 2H{X} = 2{M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 ClO4 BrO4 -
Li2O + Mg «800^oC»—> 2Li + MgO
-
2Li2O + Si «1000^oC»—> 4Li + SiO2
Физические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода:
4Li + O2 = 2Li2O
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
Li2CO3 = Li2O + CO2
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
4LiNO3 = 2Li2O + 4NO2 + O2
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами:
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой. Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид лития взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид лития с соляной кислотой образует хлорид лития и воду:
Li2O + 2HCl = 2LiCl + H2O.
Li2O + H2S = Li2S + H2O
2.3. При взаимодействии лития с оксидами образуются соли:
Li2O + CO2 = Li2CO3
Li2O + SiO2 = Li2SiO3
Admin2
 |
|
 |
|
 . __ Li __ O . __ Li __ O |
|
 |
|
| Имена | |
|---|---|
| Название IUPAC Оксид лития | |
| Другие названия Kickerite | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.031.823 |
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| Панель управления CompTox (EPA ) |
|
InChI
|
|
| SMILES Li +]. [Li +]. [O-2] | |
| Свойства | |
| Химическая формула | Li. 2O |
| Молярная масса | 29,88 г / моль |
| Внешний вид | белое твердое вещество |
| Плотность | 2,013 г / см |
| Температура плавления | 1,438 ° C (2620 ° F; 1711 K) |
| Температура кипения | 2600 ° C (4710 ° F; 2870 K) |
| Растворимость в воде | бурно реагирует с образованием LiOH |
| log P | 9,23 |
| Показатель преломления (nD) | 1,644 |
| Структура | |
| Кристаллическая структура | Антифлюорит (кубический), cF12 |
| Пространственная группа | Fm3м, №225 |
| Координационная геометрия | Тетраэдр (Ли); кубическая (O) |
| Термохимия | |
| Теплоемкость (C) | 1,8 · 105 Дж / г K или 54,1 Дж / моль K |
| Стандартная молярная. энтропия (S 298) | 37,89 Дж / моль K |
| Стандартная энтальпия образования. (ΔfH298) | -20,01 кДж / г или -595,8 кДж / моль |
| свободная энергия Гиббса (ΔfG˚) | -562,1 кДж / моль |
| Опасности | |
| Основные опасности | Коррозийный, бурно реагирует с водой |
| NFPA 704 (огненный алмаз) |  0 3 1 0 3 1 |
| Температура вспышки | Негорючие |
| Связанные соединения | |
| Другие анионы | Сульфид лития |
| Прочие катионы | Оксид натрия. Оксид калия. Оксид рубидия. Оксид цезия |
| Родственные оксиды лития | Пероксид лития. Супероксид лития |
| Родственные соединения | Гидроксид лития |
| Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Оксид лития (Li. 2 O ) или лития — это неорганическое химическое соединение. Это белое твердое вещество. Хотя это не особенно важно, многие материалы оцениваются на основе содержания в них Li 2 O. Например, содержание Li 2 O в основном литиевом минерале сподумене (LiAlSi 2O6) составляет 8,03%.
Содержание
- 1 Производство
- 2 Структура
- 3 Использование
- 4 См. Также
- 5 Ссылки
- 6 Внешние ссылки
Производство


Оксид лития получают путем термического разложения пероксида лития при 300-400 ° C.
Оксид лития образуется вместе с небольшими количествами пероксида лития, когда металлический литий сжигается на воздухе и соединяется с кислородом:
- 4Li + O. 2→ 2Li. 2O.
Чистый Li. 2O может быть получен посредством термического разложения пероксида лития, Li. 2O. 2, при 450 ° C
- 2Li. 2O. 2→ 2Li. 2O + O. 2
Структура

В твердом состоянии оксид лития имеет антифтористую структуру, которая связана с CaF. 2, флюоритовой структурой с катионами Li, замещенными фторид-анионы и оксидные анионы, замещающие катионы кальция.
Молекула Li. 2O в газовой фазе основного состояния линейна с длиной связи, соответствующей сильной ионной связи. Теория VSEPR предсказывает изогнутая форма аналогична H. 2O.
Использует
Оксид лития используется в качестве флюса в керамической глазури; и создает синий цвет с помощью меди и розовый с помощью кобальта. Оксид лития реагирует с водой и водяным паром с образованием гидроксида лития и должен быть изолирован от них.
Его использование также исследуется для оценки методом неразрушающей эмиссионной спектроскопии и мониторинга деградации в системах термобарьерных покрытий. Его можно добавлять в качестве дополнительной легирующей добавки с иттрием в верхнее покрытие из циркониевой керамики без значительного уменьшения ожидаемого срока службы покрытия. При высоких температурах оксид лития излучает очень заметную спектральную картину, интенсивность которой увеличивается вместе с разрушением покрытия. Реализация позволит осуществлять мониторинг таких систем на месте, давая возможность эффективно прогнозировать срок службы до отказа или необходимого обслуживания.
Металлический литий может быть получен из оксида лития электролизом с выделением кислорода в качестве побочного продукта.
См. Также
- Литий
- Пероксид лития
- Оксид лития-кобальта
Ссылки
Внешние ссылки
- CeramicMaterials.Info entry
| Оксид лития | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид лития |
| Традиционные названия | Окись лития |
| Химическая формула | Li2O |
| Эмпирическая формула | Li2O |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Термические свойства | |
| Температура плавления | 1570 [1] °C |
| Температура кипения | 2600 [1] °C |
| Химические свойства | |
| Растворимость в воде | 6,67 (0 °C) |
| Классификация | |
| Рег. номер CAS | 12057-24-8 |
| RTECS | OJ6360000 |
Окси́д ли́тия (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Описание
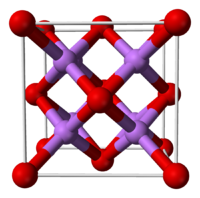
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).[2]
Получение
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
- с кислотами:
- литий из окисла вытесняется некоторыми металлами и неметаллами:
- с кислотообразующими оксидами образует соли:
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и рентгенопрозрачных), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с иттрием и цирконием как показатель уменьшения покрытия.
См. также
- Литий
- Пероксид лития
Примечания
- ↑ 1 2 Оксид лития на XuMuK.Ru
- ↑ Описание оксида лития на XuMuK.Ru
|
Соединения лития |
|---|
|
Азид лития (LiN3) • Алюминат лития (LiAlO2) • Алюмогидрид лития (LiAlH4) • Амид лития (LiNH2) • Ацетат лития (CH3COOLi) • Ацетиленид лития (Li2C2) • Бензиллитий (LiСH2С6H5) • Бензоат лития (C6H5COOLi) • Бромат лития (LiBrO3) • Бромид лития (LiBr) • Гексафторфосфат лития (LiPF6) • Гидрид лития (LiH) • Гидрокарбонат лития (LiHCO3) • Гидроксид лития (LiOH) • Гидроортофосфат лития (Li2HPO4) • Гидросульфат лития (LiHSO4) • Гидросульфид лития (LiHS) • Гидрофторид лития (LiHF2) • Дигидроортофосфат лития (LiH2PO4) • Дисульфит лития (Li2S2O5) • Дихромат лития (Li2Cr2O7) • Имид лития (Li2NH) • Иодат лития (LiIO3) • Иодид лития (LiI) • Карбид лития (Li2С2) • Карбонат лития (Li2CO3) • Метагерманат лития (Li2GeO3) • Метасиликат лития (Li2SiO3) • Метафосфат лития (LiPO3) • Метиллитий (LiСH3) • Нитрат лития (LiNO3) • Нитрид лития (Li3N) • Нитрит лития (LiNO2) • Оксалат лития (Li2C2O4) • Оксид лития (Li2O) • Ортофосфат лития (Li3PO4) • Пербромат лития (LiBrO4) • Пероксид лития (Li2O2) • Пероксомоносульфат лития (Li2SO5) • Персульфат лития (Li2S2O8) • Перхлорат лития (LiClO4) • Силицид лития (Li6Si2) • Сорбат лития (C6H7LiO2) • Сульфат лития (Li2SO4) • Сульфид лития (Li2S) • Сульфит лития (Li2SO3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоборат лития (Li[BH4]) • Тиоцианат лития (LiSCN) • Фениллитий (LiС6H5) • Формиат лития (HCOOLi) • Фталимид лития • Фторид лития (LiF) • Хлорат лития (LiClO3) • Хлорид лития (LiCl) • Хромат лития (Li2CrO4) • Цианат лития (LiOCN) • Цианид лития (LiCN) • Цианоаурат лития (Li[Au(CN)2] • Этиллитий (LiС2H5) • |







