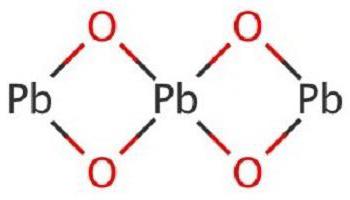
Монооксид свинца (PbO). β-PbO — «массикот», обладает характерным жёлтым цветом.
Оксиды свинца — группа соединений свинца с кислородом.
- Pb2O — Оксид свинца (1+) (сведения о данном соединении требуют проверки)
- Pb3O4 — Сурик (свинцовый), Ортоплюмбат свинца (2+) иначе записывают Pb2(PbO4) — важный пигмент, поэтому описан отдельно,
- PbO — Оксид свинца (2+), тетрагональная и ромбическая модификации,
- Pb2O3 — Метаплюмбат свинца (2+), иначе записывают Pb(PbO3)
- PbO2 — Двуокись свинца, или оксид свинца (4+) PbO2
- Известны также многочисленные нестехиометрические оксиды, лежащие по составу между Pb3O4 и PbO2
- Растворимость кислорода в жидком свинце незначительна (0,10 % при 1000 °C и 0,135 % при 1200 °C)
Содержание
- 1 Оксид свинца (2+)
- 1.1 Внешние ссылки: Оксид свинца (2+)
- 2 Диоксид свинца (4+)
- 2.1 Внешние ссылки: Диоксид свинца (4+)
Оксид свинца (2+)
- α-PbO — глёт, свинцовый глёт. Тетрагональная модификация, красного цвета. Термодинамически устойчив при комнатной и более низкой температуре.
- β-PbO — массикот. Ромбическая модификация, жёлтого цвета. Термодинамически устойчив при высоких температурах, метастабилен при комнатной температуре.
Температура полиморфного перехода 489 °C, обратное превращение происходит замедленно, поэтому жёлтый оксид может длительно существовать при комнатной температуре.
Внешние ссылки: Оксид свинца (2+)
- Case Studies in Environmental Medicine — Lead Toxicity
- ToxFAQs™: Lead
- National Pollutant Inventory — Lead and Lead Compounds Fact Sheet
Диоксид свинца (4+)
Амфотерное соединение. Растворим в сильных кислотах с образованием плюмбат-ионов, Pb(OH)62−.
В кислой среде наиболее часто восстанавливается до валентности (II) Pb2+; ион Pb(IV), Pb4+, не образует водных растворов.
Внешние ссылки: Диоксид свинца (4+)
- National Pollutant Inventory — Lead and Lead Compounds Fact Sheet
|
Чрезвычайно опасные вещества |
||
|---|---|---|
|
From Wikipedia, the free encyclopedia
(Redirected from Lead monoxide)

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Lead(II) oxide |
|
| Other names
Lead monoxide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.880 |
| EC Number |
|
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3288 2291 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
PbO |
| Molar mass | 223.20 g/mol |
| Appearance | red or yellow powder |
| Density | 9.53 g/cm3 |
| Melting point | 888 °C (1,630 °F; 1,161 K) |
| Boiling point | 1,477 °C (2,691 °F; 1,750 K) |
|
Solubility in water |
0.017 g/L[1] |
| Solubility | insoluble in dilute alkalis, alcohol soluble in concentrated alkalis soluble in HCl, ammonium chloride |
|
Magnetic susceptibility (χ) |
4.20×10−5 cm3/mol |
| Structure | |
|
Crystal structure |
Tetragonal, tP4 |
|
Space group |
P4/nmm, No. 129 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H332, H351, H360Df, H362, H373, H410 |
|
Precautionary statements |
P201, P202, P260, P261, P263, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P314, P330, P391, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LDLo (lowest published) |
1400 mg/kg (dog, oral)[2] |
| Safety data sheet (SDS) | ICSC 0288 |
| Related compounds | |
|
Other anions |
Lead sulfide Lead selenide Lead telluride |
|
Other cations |
Carbon monoxide Silicon monoxide Germanium monoxide Tin(II) oxide |
|
Related lead oxides |
Lead(II,II,IV) oxide Lead dioxide |
|
Related compounds |
Thallium(III) oxide Bismuth(III) oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lead(II) oxide, also called lead monoxide, is the inorganic compound with the molecular formula PbO. PbO occurs in two polymorphs: litharge having a tetragonal crystal structure, and massicot having an orthorhombic crystal structure. Modern applications for PbO are mostly in lead-based industrial glass and industrial ceramics, including computer components. It is an amphoteric oxide.[3]
Types[edit]
Lead oxide exists in two types:
- Red tetragonal (α-PbO), obtained at lower temperatures than the β-PbO
- Yellow orthorhombic (β-PbO), which is obtained temperatures higher than 486 °C (907 °F)
Synthesis[edit]
PbO may be prepared by heating lead metal in air at approximately 600 °C (1,100 °F). At this temperature it is also the end product of decomposition of other oxides of lead in air:[4]
Thermal decomposition of lead(II) nitrate or lead(II) carbonate also results in the formation of PbO:
- 2 Pb(NO
3)
2 → 2 PbO + 4 NO
2 + O
2 - PbCO
3 → PbO + CO2
PbO is produced on a large scale as an intermediate product in refining raw lead ores into metallic lead. The usual lead ore is galena (lead(II) sulfide). At a temperature of around 1,000 °C (1,800 °F) the sulfide is converted to the oxide:[5]
- 2 PbS + 3 O
2 → 2 PbO + 2 SO2
From lead[edit]
There are two principal methods to make lead monoxide both of which resemble combustion of the lead at high temperature:[6]
- Barton pot method.
- The refined molten lead droplets are oxidized in a vessel under a forced air flow which carries them out to the separation system (e.g. cyclonic separators) for further processing.[6][7]: 245 Oxides produced by this method are mostly a mixture of α-PbO and β-PbO. The overall reaction is:
2Pb + O2450 °C (842 °F)→2PbO
- Ball mill method
- The lead balls are oxidized in a cooled rotating drum. The oxidation is achieved by collisions of the balls. Just like in Barton pot method, the supply of air and separators may also be used.[6][7]: 245
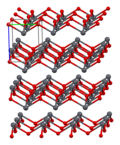
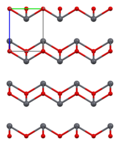
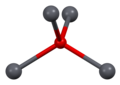
Structure[edit]
As determined by X-ray crystallography, both polymorphs, tetragonal and orthorhombic feature a pyramidal four-coordinate lead center. In the tetragonal form the four lead–oxygen bonds have the same length, but in the orthorhombic two are shorter and two longer. The pyramidal nature indicates the presence of a stereochemically active lone pair of electrons.[8] When PbO occurs in tetragonal lattice structure it is called litharge; and when the PbO has orthorhombic lattice structure it is called massicot. The PbO can be changed from massicot to litharge or vice versa by controlled heating and cooling.[9] The tetragonal form is usually red or orange color, while the orthorhombic is usually yellow or orange, but the color is not a very reliable indicator of the structure.[10] The tetragonal and orthorhombic forms of PbO occur naturally as rare minerals.
| Unit cell | Packing | Packing | Packing | Lead coordination | Oxygen coordination |
|---|---|---|---|---|---|

|
|
|

|

|
|
| 3×3×3 unit cells | viewed along the a axis | viewed along the c axis | square pyramidal | distorted tetrahedral |
Reactions[edit]
Metallic lead is obtained by reducing PbO with carbon monoxide at around 1,200 °C (2,200 °F):[13]
- PbO + CO → Pb + CO2
The red and yellow forms of this material are related by a small change in enthalpy:
- PbO(red) → PbO(yellow) ΔH = 1.6 kJ/mol
PbO is amphoteric, which means that it reacts with both acids and with bases. With acids, it forms salts of Pb2+
via the intermediacy of oxo clusters such as [Pb
6O(OH)
6]4+
. With strong bases, PbO dissolves to form plumbite (also called plumbate(II)) salts:[14]
- PbO + H2O + OH−
→ [Pb(OH)
3]−
Applications[edit]
The kind of lead in lead glass is normally PbO, and PbO is used extensively in making glass. Depending on the glass, the benefit of using PbO in glass can be one or more of increasing the refractive index of the glass, decreasing the viscosity of the glass, increasing the electrical resistivity of the glass, and increasing the ability of the glass to absorb X-rays. Adding PbO to industrial ceramics (as well as glass) makes the materials more magnetically and electrically inert (by raising their Curie temperature) and it is often used for this purpose.[15] Historically PbO was also used extensively in ceramic glazes for household ceramics, and it is still used, but not extensively any more. Other less dominant applications include the vulcanization of rubber and the production of certain pigments and paints.[3] PbO is used in cathode ray tube glass to block X-ray emission, but mainly in the neck and funnel because it can cause discoloration when used in the faceplate. Strontium oxide and Barium oxide are preferred for the faceplate.[16]
The consumption of lead, and hence the processing of PbO, correlates with the number of automobiles, because it remains the key component of automotive lead–acid batteries.[17]
Niche or declining uses[edit]
A mixture of PbO with glycerine sets to a hard, waterproof cement that has been used to join the flat glass sides and bottoms of aquariums, and was also once used to seal glass panels in window frames. It is a component of lead paints.
PbO was one of the raw materials for century eggs, a type of Chinese preserved egg. but it has been gradually replaced due to health problems. It was an unscrupulous practice in some small factories but it became rampant in China and forced many honest manufacturers to label their boxes «lead-free» after the scandal went mainstream in 2013.
In powdered tetragonal litharge form, it can be mixed with linseed oil and then boiled to create a weather-resistant sizing used in gilding. The litharge would give the sizing a dark red color that made the gold leaf appear warm and lustrous, while the linseed oil would impart adhesion and a flat durable binding surface.
PbO is used in certain condensation reactions in organic synthesis.[18]
PbO is the input photoconductor in a video camera tube called the Plumbicon.
Health issues[edit]
Lead oxide may be fatal if swallowed or inhaled. It causes irritation to skin, eyes, and respiratory tract. It affects gum tissue, the central nervous system, the kidneys, the blood, and the reproductive system. It can bioaccumulate in plants and in mammals.[19]
References[edit]
- ^ Blei(II)-oxid. Merck
- ^ «Lead compounds (as Pb)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Carr, Dodd S. (2005). «Lead Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_249.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 382–387. ISBN 978-0-08-037941-8.
- ^ Abdel-Rehim, A. M. (2006). «Thermal and XRD analysis of Egyptian galena». Journal of Thermal Analysis and Calorimetry. 86 (2): 393–401. doi:10.1007/s10973-005-6785-6. S2CID 96393940.
- ^ a b c Dix, J. E. (1987-02-01). «A comparison of barton-pot and ball-mill processes for making leady oxide». Journal of Power Sources. 19 (2): 157–161. doi:10.1016/0378-7753(87)80024-1. ISSN 0378-7753.
- ^ a b Pavlov, D. (2017). Lead-acid batteries : science and technology : a handbook of lead-acid battery technology and its influence on the product (2 ed.). Saint Louis. ISBN 978-0-444-59560-7. OCLC 978538577.
- ^ Wells, A. F. (1984), Structural Inorganic Chemistry (5th ed.), Oxford: Clarendon Press, ISBN 0-19-855370-6[page needed]
- ^ A simple example is given in Anil Kumar De (2007). «§9.2.6 Lead (Pb): Lead Monoxide PbO». A Textbook Of Inorganic Chemistry. New Age International. p. 383. ISBN 978-81-224-1384-7. A more complex example is in Turova, N.Y. (2002). «§9.4 Germanium, tin, lead alkoxides». The Chemistry of Metal Alkoxides. Springer. p. 115. ISBN 978-0-7923-7521-0.
- ^ Rowe, David John (1983). Lead Manufacturing in Britain: A History. Croom Helm. p. 16. ISBN 978-0-7099-2250-6.
- ^ Pirovano, Caroline; Islam, M. Saiful; Vannier, Rose-Noëlle; Nowogrocki, Guy; Mairesse, Gaëtan (2001). «Modelling the crystal structures of Aurivillius phases». Solid State Ion. 140 (1–2): 115–123. doi:10.1016/S0167-2738(01)00699-3.
- ^ «ICSD Entry: 94333». Cambridge Structural Database: Access Structures. Cambridge Crystallographic Data Centre. Retrieved 2021-06-01.
- ^ Lead Processing @ Universalium.academic.ru. Alt address: Lead processing @ Enwiki.net.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5[page needed]
- ^ Chapter 9, «Lead Compounds», in the book Ceramic and Glass Materials: Structure, Properties and Processing, published by Springer, year 2008.
- ^ Compton, Kenneth (5 December 2003). Image Performance in CRT Displays. SPIE Press. ISBN 9780819441447 – via Google Books.
- ^ Sutherland, Charles A.; Milner, Edward F.; Kerby, Robert C.; Teindl, Herbert; Melin, Albert; Bolt, Hermann M. «Lead». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_193.pub2.
- ^ Corson, B. B. (1936). «1,4-Diphenylbutadiene». Organic Syntheses. 16: 28.; Collective Volume, vol. 2, p. 229
- ^ «Lead(II) oxide». International Occupational Safety and Health Information Centre. Archived from the original on 2011-12-15. Retrieved 2009-06-06.
External links[edit]
- Case Studies in Environmental Medicine — Lead Toxicity
- ToxFAQs: Lead
- National Pollutant Inventory — Lead and Lead Compounds Fact Sheet
- Webelements PbO
From Wikipedia, the free encyclopedia
(Redirected from Lead monoxide)

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Lead(II) oxide |
|
| Other names
Lead monoxide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.880 |
| EC Number |
|
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3288 2291 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
PbO |
| Molar mass | 223.20 g/mol |
| Appearance | red or yellow powder |
| Density | 9.53 g/cm3 |
| Melting point | 888 °C (1,630 °F; 1,161 K) |
| Boiling point | 1,477 °C (2,691 °F; 1,750 K) |
|
Solubility in water |
0.017 g/L[1] |
| Solubility | insoluble in dilute alkalis, alcohol soluble in concentrated alkalis soluble in HCl, ammonium chloride |
|
Magnetic susceptibility (χ) |
4.20×10−5 cm3/mol |
| Structure | |
|
Crystal structure |
Tetragonal, tP4 |
|
Space group |
P4/nmm, No. 129 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H332, H351, H360Df, H362, H373, H410 |
|
Precautionary statements |
P201, P202, P260, P261, P263, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P314, P330, P391, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LDLo (lowest published) |
1400 mg/kg (dog, oral)[2] |
| Safety data sheet (SDS) | ICSC 0288 |
| Related compounds | |
|
Other anions |
Lead sulfide Lead selenide Lead telluride |
|
Other cations |
Carbon monoxide Silicon monoxide Germanium monoxide Tin(II) oxide |
|
Related lead oxides |
Lead(II,II,IV) oxide Lead dioxide |
|
Related compounds |
Thallium(III) oxide Bismuth(III) oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lead(II) oxide, also called lead monoxide, is the inorganic compound with the molecular formula PbO. PbO occurs in two polymorphs: litharge having a tetragonal crystal structure, and massicot having an orthorhombic crystal structure. Modern applications for PbO are mostly in lead-based industrial glass and industrial ceramics, including computer components. It is an amphoteric oxide.[3]
Types[edit]
Lead oxide exists in two types:
- Red tetragonal (α-PbO), obtained at lower temperatures than the β-PbO
- Yellow orthorhombic (β-PbO), which is obtained temperatures higher than 486 °C (907 °F)
Synthesis[edit]
PbO may be prepared by heating lead metal in air at approximately 600 °C (1,100 °F). At this temperature it is also the end product of decomposition of other oxides of lead in air:[4]
Thermal decomposition of lead(II) nitrate or lead(II) carbonate also results in the formation of PbO:
- 2 Pb(NO
3)
2 → 2 PbO + 4 NO
2 + O
2 - PbCO
3 → PbO + CO2
PbO is produced on a large scale as an intermediate product in refining raw lead ores into metallic lead. The usual lead ore is galena (lead(II) sulfide). At a temperature of around 1,000 °C (1,800 °F) the sulfide is converted to the oxide:[5]
- 2 PbS + 3 O
2 → 2 PbO + 2 SO2
From lead[edit]
There are two principal methods to make lead monoxide both of which resemble combustion of the lead at high temperature:[6]
- Barton pot method.
- The refined molten lead droplets are oxidized in a vessel under a forced air flow which carries them out to the separation system (e.g. cyclonic separators) for further processing.[6][7]: 245 Oxides produced by this method are mostly a mixture of α-PbO and β-PbO. The overall reaction is:
2Pb + O2450 °C (842 °F)→2PbO
- Ball mill method
- The lead balls are oxidized in a cooled rotating drum. The oxidation is achieved by collisions of the balls. Just like in Barton pot method, the supply of air and separators may also be used.[6][7]: 245
Structure[edit]
As determined by X-ray crystallography, both polymorphs, tetragonal and orthorhombic feature a pyramidal four-coordinate lead center. In the tetragonal form the four lead–oxygen bonds have the same length, but in the orthorhombic two are shorter and two longer. The pyramidal nature indicates the presence of a stereochemically active lone pair of electrons.[8] When PbO occurs in tetragonal lattice structure it is called litharge; and when the PbO has orthorhombic lattice structure it is called massicot. The PbO can be changed from massicot to litharge or vice versa by controlled heating and cooling.[9] The tetragonal form is usually red or orange color, while the orthorhombic is usually yellow or orange, but the color is not a very reliable indicator of the structure.[10] The tetragonal and orthorhombic forms of PbO occur naturally as rare minerals.
| Unit cell | Packing | Packing | Packing | Lead coordination | Oxygen coordination |
|---|---|---|---|---|---|

|

|

|

|

|

|
| 3×3×3 unit cells | viewed along the a axis | viewed along the c axis | square pyramidal | distorted tetrahedral |
Reactions[edit]
Metallic lead is obtained by reducing PbO with carbon monoxide at around 1,200 °C (2,200 °F):[13]
- PbO + CO → Pb + CO2
The red and yellow forms of this material are related by a small change in enthalpy:
- PbO(red) → PbO(yellow) ΔH = 1.6 kJ/mol
PbO is amphoteric, which means that it reacts with both acids and with bases. With acids, it forms salts of Pb2+
via the intermediacy of oxo clusters such as [Pb
6O(OH)
6]4+
. With strong bases, PbO dissolves to form plumbite (also called plumbate(II)) salts:[14]
- PbO + H2O + OH−
→ [Pb(OH)
3]−
Applications[edit]
The kind of lead in lead glass is normally PbO, and PbO is used extensively in making glass. Depending on the glass, the benefit of using PbO in glass can be one or more of increasing the refractive index of the glass, decreasing the viscosity of the glass, increasing the electrical resistivity of the glass, and increasing the ability of the glass to absorb X-rays. Adding PbO to industrial ceramics (as well as glass) makes the materials more magnetically and electrically inert (by raising their Curie temperature) and it is often used for this purpose.[15] Historically PbO was also used extensively in ceramic glazes for household ceramics, and it is still used, but not extensively any more. Other less dominant applications include the vulcanization of rubber and the production of certain pigments and paints.[3] PbO is used in cathode ray tube glass to block X-ray emission, but mainly in the neck and funnel because it can cause discoloration when used in the faceplate. Strontium oxide and Barium oxide are preferred for the faceplate.[16]
The consumption of lead, and hence the processing of PbO, correlates with the number of automobiles, because it remains the key component of automotive lead–acid batteries.[17]
Niche or declining uses[edit]
A mixture of PbO with glycerine sets to a hard, waterproof cement that has been used to join the flat glass sides and bottoms of aquariums, and was also once used to seal glass panels in window frames. It is a component of lead paints.
PbO was one of the raw materials for century eggs, a type of Chinese preserved egg. but it has been gradually replaced due to health problems. It was an unscrupulous practice in some small factories but it became rampant in China and forced many honest manufacturers to label their boxes «lead-free» after the scandal went mainstream in 2013.
In powdered tetragonal litharge form, it can be mixed with linseed oil and then boiled to create a weather-resistant sizing used in gilding. The litharge would give the sizing a dark red color that made the gold leaf appear warm and lustrous, while the linseed oil would impart adhesion and a flat durable binding surface.
PbO is used in certain condensation reactions in organic synthesis.[18]
PbO is the input photoconductor in a video camera tube called the Plumbicon.
Health issues[edit]
Lead oxide may be fatal if swallowed or inhaled. It causes irritation to skin, eyes, and respiratory tract. It affects gum tissue, the central nervous system, the kidneys, the blood, and the reproductive system. It can bioaccumulate in plants and in mammals.[19]
References[edit]
- ^ Blei(II)-oxid. Merck
- ^ «Lead compounds (as Pb)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Carr, Dodd S. (2005). «Lead Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_249.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 382–387. ISBN 978-0-08-037941-8.
- ^ Abdel-Rehim, A. M. (2006). «Thermal and XRD analysis of Egyptian galena». Journal of Thermal Analysis and Calorimetry. 86 (2): 393–401. doi:10.1007/s10973-005-6785-6. S2CID 96393940.
- ^ a b c Dix, J. E. (1987-02-01). «A comparison of barton-pot and ball-mill processes for making leady oxide». Journal of Power Sources. 19 (2): 157–161. doi:10.1016/0378-7753(87)80024-1. ISSN 0378-7753.
- ^ a b Pavlov, D. (2017). Lead-acid batteries : science and technology : a handbook of lead-acid battery technology and its influence on the product (2 ed.). Saint Louis. ISBN 978-0-444-59560-7. OCLC 978538577.
- ^ Wells, A. F. (1984), Structural Inorganic Chemistry (5th ed.), Oxford: Clarendon Press, ISBN 0-19-855370-6[page needed]
- ^ A simple example is given in Anil Kumar De (2007). «§9.2.6 Lead (Pb): Lead Monoxide PbO». A Textbook Of Inorganic Chemistry. New Age International. p. 383. ISBN 978-81-224-1384-7. A more complex example is in Turova, N.Y. (2002). «§9.4 Germanium, tin, lead alkoxides». The Chemistry of Metal Alkoxides. Springer. p. 115. ISBN 978-0-7923-7521-0.
- ^ Rowe, David John (1983). Lead Manufacturing in Britain: A History. Croom Helm. p. 16. ISBN 978-0-7099-2250-6.
- ^ Pirovano, Caroline; Islam, M. Saiful; Vannier, Rose-Noëlle; Nowogrocki, Guy; Mairesse, Gaëtan (2001). «Modelling the crystal structures of Aurivillius phases». Solid State Ion. 140 (1–2): 115–123. doi:10.1016/S0167-2738(01)00699-3.
- ^ «ICSD Entry: 94333». Cambridge Structural Database: Access Structures. Cambridge Crystallographic Data Centre. Retrieved 2021-06-01.
- ^ Lead Processing @ Universalium.academic.ru. Alt address: Lead processing @ Enwiki.net.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5[page needed]
- ^ Chapter 9, «Lead Compounds», in the book Ceramic and Glass Materials: Structure, Properties and Processing, published by Springer, year 2008.
- ^ Compton, Kenneth (5 December 2003). Image Performance in CRT Displays. SPIE Press. ISBN 9780819441447 – via Google Books.
- ^ Sutherland, Charles A.; Milner, Edward F.; Kerby, Robert C.; Teindl, Herbert; Melin, Albert; Bolt, Hermann M. «Lead». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_193.pub2.
- ^ Corson, B. B. (1936). «1,4-Diphenylbutadiene». Organic Syntheses. 16: 28.; Collective Volume, vol. 2, p. 229
- ^ «Lead(II) oxide». International Occupational Safety and Health Information Centre. Archived from the original on 2011-12-15. Retrieved 2009-06-06.
External links[edit]
- Case Studies in Environmental Medicine — Lead Toxicity
- ToxFAQs: Lead
- National Pollutant Inventory — Lead and Lead Compounds Fact Sheet
- Webelements PbO
Оксид свинца: формула, свойства, метод получения
В этой статье мы разберемся с тем, что собой представляет оксид свинца, покажем его формулу, рассмотрим химические и физические характеристики, а также не забудем рассказать о способах его получения. В общем, эта статья понравится тем, кто хочет или уже разбирается в химии. Ведь свинец встречается повсеместно. Если вы до сих пор не знаете область его применения, то прочитайте статью, чтобы понять весь потенциал этого химического элемента таблицы Менделеева.
Способы его получения
Изначально разберемся, как называется оксид свинца. Он традиционно именуется окисью свинца и представляют собой группу бинарных веществ, образованных элементами металла свинца и неметалла кислорода. Существует шесть основных форм PbO: PbO2, PbO, Pb12O19, Pb12O17, Pb3O4. Каждая из них имеет свои особенности строения молекулы, способы получения и область применения. Самые распространенные формы — это оксид свинца (II) и (IV).
Физические характеристики
Оксид свинца, формула которого PbO, может находиться в двухвидовых модификациях: высоко- и низкотемпературных. Переходы от высокотемпературной формы к низкотемпературной происходят медленнее, чем в обратном порядке. Вследствие этого элемент может пребывать в метастабильности при комнатной температуре, а в процессе растирания изменять модификационную форму.
Испарение протекает конгруэнтно, чаще всего в формах Pb2O2 и Pb4O4. Также данная группа оксидов является полупроводником. По типу проводимости, в зависимости от состава, но не превышая пределы гомогенности, оксиды бывают дырочными и электронными. По цвету они обычно бывают желтыми, красными и черными.
Химические особенности и свойства
Растворение хорошо протекает в азотной и кислородной кислотах, ухудшается растворимость в серной и соляной кислоте, так как образуются PbC12 и PbSO4, которые слаборастворимы. При растворении в щелочной среде образуются гексагидроксоплюмбаты (Na2[Pb(OH)4]). Они являются сильными окислителями, некоторые из них могут проявлять свойства амфотеров — окисляться и поглощать другие вещества. Все они способны окисляться до различных состояний, например, на открытом воздухе PbO при температуре 370 градусов перейдет в состояние молекулы Pb12O17, при 540 градусах образуется Pb3O4, а в водородной (H2) и монооксид углеродной (СО) среде вновь образуется металл путем восстановления.
Оксид свинца II
PbO является неорганическим соединением, которое в воде растворяется плохо. Это бинарное вещество в виде кристаллов красного или желтого цвета. В данном соединении свинец проявляет вторую валентность, соответствуя постоянной валентности кислорода. Встречается в природе с примесями, например, в массикоте или свинцовом глёте.
Как получить оксид свинца в промышленности? Его получают путем пропускания кислорода через свинец, нагретый до температуры 600 градусов (2Pb+O2—2PbO), путем нагревания гидроксида свинца при температурах около 100-145 градусов (Pb(OH)2—PbO+CO2), разложением нитратов (2Pb(NO3)2—2Pb+4NO2+O2), прогреванием карбоната свинца (PbCO3—PbO+CO2), разложением диоксидов свинца (2PbO2—PbO+O2) и окислением сульфидов свинца (2PbS+3O2—2PbO+2SO2).
По своим свойствам PbO (II) способен образовать кристаллы в двух модификационных вариантах, которые устойчивы при 489 градусах и выше.
Альфа модификация (свинцовый углет) представляет собой кристаллы красного цвета тетрагональной сингонии, имеют пространственную группу P 4/nmm. Показатель растворимости в воде — α 0,279 22 . Бета модификация (массикот) проявляет метастабильность при комнатных температурах, имеет желтый цвет, кристаллическую форму, ромбическую сингонию, пространственную группу P bcm. Показатель растворимости в воде — β 0,513 22 г/100 мл.
Оксид свинца может проявлять свойства амфотеров при взаимодействии с кислотами (PbO+2HCl—PbCl2+H2O), щелочами (PbO+2NaOH—(400градусов)Na2PbO2+H2O). Способен окисляться, взаимодействуя с кислородом до Pb3O4, а в водной суспензии бромом окисляется до диоксида свинца PbO2. Восстановление до металла происходит при участии оксида углерода, водорода и алюминия. В состоянии влажности поглощает диоксид углерода, образуя при этом основные соли.
Оксид свинца IV
Оксид свинца 4, он же диоксид свинца, имеет формулу PbO2. Является оксидом высших степеней. Как и другие соединения свинца с кислородом является бинарным веществом. Это порошок тёмно-коричневого цвета, довольно тяжелый, которому присущ запах озона. Раньше его можно было встретить под названием пероксид, или перекись свинца.
Добывают PbO2 в промышленности при помощи обработки азотной кислотой сурика свинца, после чего проводится промывка, помещение в вакуум и сушка: Pb3O4+4HNO3—PbO2+2Pb(NO3)2+2H2O.
Температура плавления данного соединения равна 290 градусов, плотность составляет 9.38г/ см³, молярная масса — 239,1988г/моль. Диоксид свинца 4 является очень сильным окислителем, способен вытеснять из концентрированной соляной кислоты хлор в результате нагревания (PbO2+4HCl—PbCl2+Cl2+2H2O). Соли марганца (II) также поддаются окислению до перманганата (5PbO2+2MnSO4+3H2SO4—5PbSO4+2HMnO4+2H2O). Является весьма токсичным веществом.
Применение
Области применения диоксидов свинца самые разнообразные. Оксид свинца 4 находит свое применение, выполняя функцию сиккативов (маслянистых веществ, необходимых для ускорения процесса засыхания красок), катализатора (вещества, необходимого для ускорения протекания химических реакций между соединениями, которые при этом не входят в конечный состав продуктов любых протекающих реакций) и окислителя (вещества, в состав которого входят атомы, способные присоединять к себе свободные электроны в процессе химической реакции, окислитель также можно назвать акцептором).
PbO2 широко используется в свинцово-сернокислотных аккумуляторах, в роли положительных электронных масс в гальванических элементах. Часто, но в малых количествах может применяться как покрытие для электродов, чтобы улучшить электролизный процесс. Диоксид свинца 2 используют при изготовлении суриков, PbO2 можно встретить в аккумуляторах. Оксид свинца широко используется в области изготовления свинцовых стёкол и глазурей. Pb3O4 можно встретить в свинцовых аккумуляторах в качестве замазки и как пигмент для красок против коррозии. Большинство оксидов свинца используют при изготовлении радиотехники, резинотехнической продукции. Также незаменимы они в процессе добычи свинцовых солей при химическом синтезе.
Оксид свинца II
| Оксид свинца II | |
|---|---|
 |
|
| Систематическое наименование |
Оксид свинца |
| Традиционные названия | Окись свинца |
| Хим. формула | PbO |
| Рац. формула | PbO |
| Состояние | α-красные, β-жёлтые кристаллы |
| Молярная масса | 223,20 г/моль |
| Плотность | α 9,13; 9,40 β 9,45; 9,63 г/см³ |
| Т. плав. | 886 °C |
| Т. кип. | 1535 °C |
| Мол. теплоёмк. | 46,41 Дж/(моль·К) |
| Энтальпия образования | -218,6 кДж/моль |
| Растворимость в воде | α 0,279 22 β 0,513 22 г/100 мл |
| ГОСТ | ГОСТ 9199-77 ГОСТ 5539-73 |
| Рег. номер CAS | 1317-36-8 |
| PubChem | 14827 |
| Рег. номер EINECS | 215-267-0 |
| SMILES | |
| RTECS | OG1750000 |
| ChEBI | 81045 |
| Номер ООН | 3288 |
| ChemSpider | 14141 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Оксид свинца II — бинарное неорганическое соединение металла свинца и кислорода с формулой PbO, красные или жёлтые кристаллы, плохо растворимые в воде.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Физиологическое действие
Получение
- В природе встречаются минералы свинцовый глёт и массикот — оксид свинца PbO с различными примесями.
- Пропуская воздух через расплавленный свинец:
2Pb + O2 → 600oC 2PbO
- Нагревание гидроксида свинца:
Pb(OH)2 → 100−145oC PbO + H2O
- Нагревание карбоната свинца:
PbCO3 → 315oC PbO + CO2
- Разложение нитрата свинца:
2Pb(NO3)2 → 200−470oC 2PbO + 4NO2 + O2
- Разложение диоксида свинца:
2PbO2 → 600oC 2PbO + O2
- Окисление сульфида свинца:
2PbS + 3O2 → 1200oC 2PbO + 2SO2
Физические свойства
Оксид свинца II образует кристаллы двух модификаций:
- α-модификация, свинцовый глёт, устойчивый до температуры 489°С, красные кристаллы тетрагональной сингонии, пространственная группа P 4/nmm, параметры ячейки a = 0,396 нм, c = 0,500 нм, Z = 4.
- β-модификация, массикот, устойчивый при температуре выше 489°С, при комнатной температуре метастабилен, жёлтые кристаллы ромбической сингонии, пространственная группа P bcm, параметры ячейки a = 0,5492 нм, b = 0,4497 нм, c = 0,5891 нм, Z = 4.
Диамагнитен, обладает полупроводниковыми свойствами, тип проводимости зависит от состава.
Химические свойства
- Проявляет амфотерные свойства, реагирует с кислотами:
PbO + 2HCl → PbCl2 + H2O
- и щелочами:
PbO + 2NaOH → 400oC Na2PbO2 + H2O
- Во влажном состоянии поглощает углекислоту с образованием основной соли:
2PbO + CO2 + H2O → Pb2(OH)2CO3
- Окисляется кислородом:
6PbO + O2 → 445−480oC 2Pb3O4
- Бромом в водной суспензии окисляется до диоксида свинца:
PbO + Br2 + H2O → PbO2 + 2HBr
- Восстанавливается до металлического свинца водородом, оксидом углерода, алюминием (со взрывом):
PbO + H2 → 200−350oC Pb + H2O PbO + CO → 3 00−400oC Pb + CO2 3PbO + 2Al → T 3Pb + Al2O3
Применение
- В производстве сурика и других соединений свинца.
- Как компонент свинцово-кислотных аккумуляторов.
- В производстве свинцовых стёкол (хрусталь, флинтглас) и глазурей.
- При производстве олиф (сиккатив).
Как и все соединения свинца, оксид свинца(II) токсичен.
Физиологическое действие
Оксид свинца ядовит, как и все его соединения. Относится ко 2-му классу опасности.
источники:
http://chem.ru/oksid-svinca-ii.html
| Оксид свинца | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Оксид свинца |
| Традиционные названия | Окись свинца |
| Хим. формула | PbO |
| Физические свойства | |
| Состояние | α-красные, β-жёлтые кристаллы |
| Молярная масса | 223,20 г/моль |
| Плотность |
α 9,13; 9,40 β 9,45; 9,63 г/см³ |
| Термические свойства | |
| Т. плав. | 886 °C |
| Т. кип. | 1535 °C |
| Мол. теплоёмк. | 46,41 Дж/(моль·К) |
| Энтальпия образования | -218,6 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
α 0,27922 β 0,51322 г/100 мл |
| Классификация | |
| Рег. номер CAS | 1317-36-8 |
| PubChem | 14827 |
| Рег. номер EINECS | 215-267-0 |
| SMILES |
O=[Pb] |
| InChI |
1S/O.Pb YEXPOXQUZXUXJW-UHFFFAOYSA-N |
| RTECS | OG1750000 |
| Номер ООН | 3288 |
| ChemSpider | 14141 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Оксид свинца(II) — бинарное неорганическое соединение металла свинца и кислорода с формулой PbO, красные или жёлтые кристаллы, плохо растворимые в воде.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Физиологическое действие
- 6 Литература
Получение
- В природе встречаются минералы свинцовый глёт и массикот — оксид свинца PbO с различными примесями.
- Пропуская воздух через расплавленный свинец:
- Нагревание гидроксида свинца:
- Нагревание карбоната свинца:
- Разложение нитрата свинца:
- Разложение диоксида свинца:
- Окисление сульфида свинца:
Физические свойства
Оксид свинца(II) образует кристаллы двух модификаций:
- α-модификация, свинцовый глёт, устойчивый до температуры 489°С, красные кристаллы тетрагональной сингонии, пространственная группа P 4/nmm, параметры ячейки a = 0,396 нм, c = 0,500 нм, Z = 4.
- β-модификация, массикот, устойчивый при температуре выше 489°С, при комнатной температуре метастабилен, жёлтые кристаллы ромбической сингонии, пространственная группа P bcm, параметры ячейки a = 0,5492 нм, b = 0,4497 нм, c = 0,5891 нм, Z = 4.
Диамагнитен, обладает полупроводниковыми свойствами, тип проводимости зависит от состава.
Химические свойства
- Проявляет амфотерные свойства, реагирует с кислотами:
- и щелочами:
- Во влажном состоянии поглощает углекислоту с образованием основной соли:
- Окисляется кислородом:
- Бромом в водной суспензии окисляется до диоксида свинца:
- Восстанавливается до металлического свинца водородом, оксидом углерода, алюминием (со взрывом):
Применение
- В производстве сурика и других соединений свинца.
- Как компонент свинцово-кислотных аккумуляторов.
- В производстве свинцовых стёкол (хрусталь, флинтглас) и глазурей.
- При производстве олиф (сиккатив).
Как и все соединения свинца, оксид свинца(II) токсичен.
Физиологическое действие
Оксид свинца ядовит, как и все его соединения. Относится ко 2-му классу опасности.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Содержание
- Химические свойства
- Получение
- Применение
- Физиологическое действие и токсичность
- Нахождение в природе
Оксид свинца(IV) (диоксид свинца, двуокись свинца) — бинарное неорганическое соединение свинца с кислородом, химическая формула — PbO2. Является высшим оксидом свинца. Представляет собой тёмно-коричневый тяжёлый порошок, имеющий тонкий характерный запах озона. В высоких концентрациях ядовит.
| Оксид свинца(IV) | |
|---|---|
| Общие | |
| Систематическое наименование |
Оксид свинца(IV) |
| Традиционные названия | Диоксид свинца, двуокись свинца, платтнерит |
| Хим. формула | PbO2 |
| Рац. формула | PbO2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 239,1988 г/моль |
| Плотность | 9,38 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 290 °C |
| Классификация | |
| Рег. номер CAS | 1309-60-0 |
| PubChem | 14793 |
| Рег. номер EINECS | 215-174-5 |
| SMILES |
O=[Pb]=O |
| InChI |
1S/2O.Pb YADSGOSSYOOKMP-UHFFFAOYSA-N |
| RTECS | OGO700000 |
| ChemSpider | 14109 |
| Безопасность | |
| Предельная концентрация | 0,01 мг/м³ (в пересчёте на Pb) |
| Токсичность | Высокотоксичен, канцерогенен, мутагенен, сильный окислитель |
| NFPA 704 |
Встречающееся в старой литературе название «перекись свинца», «пероксид свинца» фундаментально неверно, поскольку в структуре соединения отсутствуют пероксидные группы [-O-O-].
Химические свойства
Диоксид свинца существует в двух формах — α-PbO2 (коричневый порошок, тетрагональная сингония) и β-PbO2 (чёрный порошок, ромбическая сингония).
Диоксид свинца обладает сильными окислительными свойствами. Окисляет хлорид-анион до хлора из концентрированной соляной кислоты при нагревании:
Также окисляет соли марганца (II) в кислой среде до перманганата:
Сера и фосфор при растирании с диоксидом свинца воспламеняются.
Как и многие другие соединения свинца, его диоксид в больших количествах очень токсичен.
Получение
Промышленный способ производства диоксида свинца заключается в обработке свинцового сурикa азотной кислотой и последующей промывке и сушке в вакууме.
Применение
Диоксид свинца находит применение в качестве важного сиккатива, катализатора и окислителя в некоторых химических процессах. Также широко применяется в свинцово-сернокислотных аккумуляторах и гальванических элементах в качестве положительной электродной массы. Небольшое количество диоксида свинца используется в качестве покрытия электродов для электролизных процессов.
Физиологическое действие и токсичность
- Будучи сильным окислителем, диоксид свинца PbO2 токсичен при попадании в организм в больших концентрациях. По токсикологии NFPA 704 оксиду свинца (IV) присвоена высшая токсичность. Симптомы отравления: боль в животе, спазмы, тошнота, рвота, головная боль. Острые отравления могут привести к мышечной слабости, металлическому привкусу во рту, потере аппетита, бессоннице, головокружению, шоку, коме и смерти в крайних случаях. Отравление также приводит к повышению уровня свинца в крови и моче. Контакт с кожей или глазами вызывает местное раздражение и боль.
- Предельно допустимая концентрация диоксида свинца в воздухе рабочей зоны составляет 0,01 мг/м³ (в пересчёте на свинец). Класс опасности — I (чрезвычайно опасное химическое вещество).
- Оксид свинца (IV) PbO2 опасен для окружающей среды.
Нахождение в природе
Диоксид свинца встречается в природе в виде минерала платтнерита.



![{displaystyle {ce {PbO2->[{293 °C}] Pb12O19 ->[{351 °C}] Pb12O17 ->[{375 °C}] Pb3O4 ->[{605 °C}] PbO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65b5cadcc73921d39d6f69f4b6d59a4227e2b780)