|
|

|
|
| Names | |
|---|---|
| IUPAC names
Titanium dioxide |
|
| Other names
Titania |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.033.327 |
| E number | E171 (colours) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
TiO 2 |
| Molar mass | 79.866 g/mol |
| Appearance | White solid |
| Odor | Odorless |
| Density |
|
| Melting point | 1,843 °C (3,349 °F; 2,116 K) |
| Boiling point | 2,972 °C (5,382 °F; 3,245 K) |
|
Solubility in water |
Insoluble |
| Band gap | 3.05 eV (rutile)[1] |
|
Magnetic susceptibility (χ) |
+5.9·10−6 cm3/mol |
|
Refractive index (nD) |
|
| Thermochemistry | |
|
Std molar |
50 J·mol−1·K−1[2] |
|
Std enthalpy of |
−945 kJ·mol−1[2] |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | not flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3[3] |
|
REL (Recommended) |
Ca[3] |
|
IDLH (Immediate danger) |
Ca [5000 mg/m3][3] |
| Safety data sheet (SDS) | ICSC 0338 |
| Related compounds | |
|
Other cations |
Zirconium dioxide Hafnium dioxide |
|
Related Titanium oxides |
Titanium(II) oxide Titanium(III) oxide Titanium(III,IV) oxide |
|
Related compounds |
Titanic acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Titanium dioxide, also known as titanium(IV) oxide or titania , is the inorganic compound with the chemical formula TiO
2. When used as a pigment, it is called titanium white, Pigment White 6 (PW6), or CI 77891.[4] It is a white solid that is insoluble to water, although mineral forms can appear black. As a pigment, it has a wide range of applications, including paint, sunscreen, and food coloring. When used as a food coloring, it has E number E171. World production in 2014 exceeded 9 million tonnes.[5][6][7] It has been estimated that titanium dioxide is used in two-thirds of all pigments, and pigments based on the oxide have been valued at a price of $13.2 billion.[8]
Structure[edit]
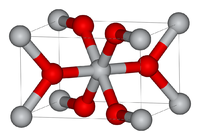
In all three of its main dioxides, titanium exhibits octahedral geometry, being bonded to six oxide anions. The oxides in turn are bonded to three Ti centers. The overall crystal structure of rutile is tetragonal in symmetry whereas anatase and brookite are orthorhombic. The oxygen substructures are all slight distortions of close packing: in rutile, the oxide anions are arranged in distorted hexagonal close-packing, whereas they are close to cubic close-packing in anatase and to «double hexagonal close-packing» for brookite. The rutile structure is widespread for other metal dioxides and difluorides, e.g. RuO2 and ZnF2.
Molten titanium dioxide has a local structure in which each Ti is coordinated to, on average, about 5 oxygen atoms.[9] This is distinct from the crystalline forms in which Ti coordinates to 6 oxygen atoms.
Structure of anatase. Together with rutile and brookite, one of the three major polymorphs of TiO2.
Production and occurrence[edit]
Synthetic TiO2 is mainly produced from the mineral ilmenite. Rutile, and anatase, naturally occurring TiO2, occur widely also, e.g. rutile as a ‘heavy mineral’ in beach sand. Leucoxene, fine-grained anatase formed by natural alteration of ilmenite, is yet another ore. Star sapphires and rubies get their asterism from oriented inclusions of rutile needles.[10]
Mineralogy and uncommon polymorphs[edit]
Titanium dioxide occurs in nature as the minerals rutile and anatase. Additionally two high-pressure forms are known minerals: a monoclinic baddeleyite-like form known as akaogiite, and the other has a slight monoclinic distortion of the orthorhombic α-PbO2 structure and is known as riesite. Both of which can be found at the Ries crater in Bavaria.[11][12][13] It is mainly sourced from ilmenite, which is the most widespread titanium dioxide-bearing ore around the world. Rutile is the next most abundant and contains around 98% titanium dioxide in the ore. The metastable anatase and brookite phases convert irreversibly to the equilibrium rutile phase upon heating above temperatures in the range 600–800 °C (1,110–1,470 °F).[14]
Titanium dioxide has twelve known polymorphs – in addition to rutile, anatase, brookite, akaogiite and riesite, three metastable phases can be produced synthetically (monoclinic, tetragonal, and orthorhombic ramsdellite-like), and four high-pressure forms (α-PbO2-like, cotunnite-like, orthorhombic OI, and cubic phases) also exist:
| Form | Crystal system | Synthesis |
|---|---|---|
| Rutile | Tetragonal | |
| Anatase | Tetragonal | |
| Brookite | Orthorhombic | |
| TiO2(B)[15] | Monoclinic | Hydrolysis of K2Ti4O9 followed by heating |
| TiO2(H), hollandite-like form[16] | Tetragonal | Oxidation of the related potassium titanate bronze, K0.25TiO2 |
| TiO2(R), ramsdellite-like form[17] | Orthorhombic | Oxidation of the related lithium titanate bronze Li0.5TiO2 |
| TiO2(II)-(α-PbO2-like form)[18] | Orthorhombic | |
| Akaogiite (baddeleyite-like form, 7 coordinated Ti)[19] | Monoclinic | |
| TiO2 -OI[20] | Orthorhombic | |
| Cubic form[21] | Cubic | P > 40 GPa, T > 1600 °C |
| TiO2 -OII, cotunnite(PbCl2)-like[22] | Orthorhombic | P > 40 GPa, T > 700 °C |
The cotunnite-type phase was claimed to be the hardest known oxide with the Vickers hardness of 38 GPa and the bulk modulus of 431 GPa (i.e. close to diamond’s value of 446 GPa) at atmospheric pressure.[22] However, later studies came to different conclusions with much lower values for both the hardness (7–20 GPa, which makes it softer than common oxides like corundum Al2O3 and rutile TiO2)[23] and bulk modulus (~300 GPa).[24][25]
Titanium dioxide (B) is found as a mineral in magmatic rocks and hydrothermal veins, as well as weathering rims on perovskite. TiO2 also forms lamellae in other minerals.[26]
Production[edit]
Evolution of the global production of titanium dioxide according to process
The five largest TiO
2 pigment processors are in 2019 Chemours, Cristal Global, Venator, Kronos [de], and Tronox.[27][28] Major paint and coating company end users for pigment grade titanium dioxide include Akzo Nobel, PPG Industries, Sherwin Williams, BASF, Kansai Paints and Valspar.[29] Global TiO
2 pigment demand for 2010 was 5.3 Mt with annual growth expected to be about 3–4%.[30]
The production method depends on the feedstock. In addition to ores, other feedstocks include upgraded slag. Both sulfate and chloride processes produce the titanium dioxide pigment in the rutile crystal form, but the Sulfate Process can be adjusted to produce the anatase form. Anatase, being softer, is used in fiber and paper applications. The Sulfate Process is run as a batch process; the Chloride Process is run as a continuous process.[31]
Chloride process[edit]
In chloride process, the ore is treated with chlorine and carbon to give titanium tetrachloride, a volatile liquid that is further purified by distillation. The TiCl4 is treated with oxygen to regenerate chlorine and produce the titanium dioxide.
Sulfate process[edit]
Chemical manufacturing plants using the sulfate process, require ilmenite concentrate (45–60% TiO2) or pretreated feedstocks as a suitable source of titanium.[32] In the sulfate process, ilmenite is treated with sulfuric acid to extract iron(II) sulfate pentahydrate. The resulting synthetic rutile is further processed according to the specifications of the end user, i.e. pigment grade or otherwise.[33] In another method for the production of synthetic rutile from ilmenite the Becher process first oxidizes the ilmenite as a means to separate the iron component.
Specialized methods[edit]
For specialty applications, TiO2 films are prepared by various specialized chemistries.[34] Sol-gel routes involve the hydrolysis of titanium alkoxides, such as titanium ethoxide:
- Ti(OEt)4 + 2 H2O → TiO2 + 4 EtOH
This technology is suited for the preparation of films. A related approach that also relies on molecular precursors involves chemical vapor deposition. In this application, the alkoxide is volatilized and then decomposed on contact with a hot surface:
- Ti(OEt)4 → TiO2 + 2 Et2O
Applications[edit]
The most important application areas are paints and varnishes as well as paper and plastics, which account for about 80% of the world’s titanium dioxide consumption. Other pigment applications such as printing inks, fibers, rubber, cosmetic products, and food account for another 8%. The rest is used in other applications, for instance the production of technical pure titanium, glass and glass ceramics, electrical ceramics, metal patinas, catalysts, electric conductors, chemical intermediates, or as a substrate for phosphonic acid adsorption.[35][36]
Pigment[edit]
First mass-produced in 1916,[37] titanium dioxide is the most widely used white pigment because of its brightness and very high refractive index, in which it is surpassed only by a few other materials (see list of indices of refraction). Titanium dioxide crystal size is ideally around 220 nm (measured by electron microscope) to optimize the maximum reflection of visible light. However, abnormal grain growth is often observed in titanium dioxide, particularly in its rutile phase. The occurrence of abnormal grain growth brings about a deviation of a small number of crystallites from the mean crystal size and modifies the physical behaviour of TiO2. The optical properties of the finished pigment are highly sensitive to purity. As little as a few parts per million (ppm) of certain metals (Cr, V, Cu, Fe, Nb) can disturb the crystal lattice so much that the effect can be detected in quality control.[38] Approximately 4.6 million tons of pigmentary TiO2 are used annually worldwide, and this number is expected to increase as use continues to rise.[39]
TiO2 is also an effective opacifier in powder form, where it is employed as a pigment to provide whiteness and opacity to products such as paints, coatings, plastics, papers, inks, foods, supplements, medicines (i.e. pills and tablets), and most toothpastes; in 2019 it was present in two-thirds of toothpastes on the French market.[40] In food, it is commonly found in products like ice creams, chocolates, all types of candy, creamers, desserts, marshmallows, chewing gum, pastries, spreads, dressings, cakes, and many other foods.[41] In paint, it is often referred to offhandedly as «brilliant white», «the perfect white», «the whitest white», or other similar terms. Opacity is improved by optimal sizing of the titanium dioxide particles.
Thin films[edit]
When deposited as a thin film, its refractive index and colour make it an excellent reflective optical coating for dielectric mirrors; it is also used in generating decorative thin films such as found in «mystic fire topaz».
Some grades of modified titanium based pigments as used in sparkly paints, plastics, finishes and cosmetics – these are man-made pigments whose particles have two or more layers of various oxides – often titanium dioxide, iron oxide or alumina – in order to have glittering, iridescent and or pearlescent effects similar to crushed mica or guanine-based products. In addition to these effects a limited colour change is possible in certain formulations depending on how and at which angle the finished product is illuminated and the thickness of the oxide layer in the pigment particle; one or more colours appear by reflection while the other tones appear due to interference of the transparent titanium dioxide layers.[42] In some products, the layer of titanium dioxide is grown in conjunction with iron oxide by calcination of titanium salts (sulfates, chlorates) around 800 °C[43] One example of a pearlescent pigment is Iriodin, based on mica coated with titanium dioxide or iron (III) oxide.[44]
The iridescent effect in these titanium oxide particles is unlike the opaque effect obtained with usual ground titanium oxide pigment obtained by mining, in which case only a certain diameter of the particle is considered and the effect is due only to scattering.
Sunscreen and UV blocking pigments[edit]
In cosmetic and skin care products, titanium dioxide is used as a pigment, sunscreen and a thickener. As a sunscreen, ultrafine TiO2 is used, which is notable in that combined with ultrafine zinc oxide, it is considered to be an effective sunscreen that lowers the incidence of sun burns and minimizes the premature photoaging, photocarcinogenesis and immunosuppression associated with long term excess sun exposure.[45] Sometimes these UV blockers are combined with iron oxide pigments in sunscreen to increase visible light protection.[46]
Titanium dioxide and zinc oxide are generally considered to be less harmful to coral reefs than sunscreens that include chemicals such as oxybenzone, octocrylene and octinoxate.[47]
Nanosized titanium dioxide is found in the majority of physical sunscreens because of its strong UV light absorbing capabilities and its resistance to discolouration under ultraviolet light. This advantage enhances its stability and ability to protect the skin from ultraviolet light. Nano-scaled (particle size of 20–40 nm)[48] titanium dioxide particles are primarily used in sunscreen lotion because they scatter visible light much less than titanium dioxide pigments, and can give UV protection.[39] Sunscreens designed for infants or people with sensitive skin are often based on titanium dioxide and/or zinc oxide, as these mineral UV blockers are believed to cause less skin irritation than other UV absorbing chemicals. Nano-TiO2 blocks both UV-A and UV-B radiation, which is used in sunscreens and other cosmetic products. It is safe to use and it is better to environment than organic UV-absorbers.[49]
The risk assessment of different titanium dioxide nanomaterials in sunscreen is currently evolving as nano-sized TiO2 is different from the well-known micronized form.[50] The rutile form is generally used in cosmetic and sunscreen products due to it not possessing any observed ability to damage the skin under normal conditions[51] and having a higher UV absorption.[52] In 2016 Scientific Committee on Consumer Safety (SCCS) tests concluded that the use of nano titanium dioxide (95–100% rutile, ≦5% anatase) as a UV filter can be considered to not pose any risk of adverse effects in humans post-application on healthy skin,[53] except in the case the application method would lead to substantial risk of inhalation (ie; powder or spray formulations). This safety opinion applied to nano TiO2 in concentrations of up to 25%.[54]
Initial studies indicated that nano-TiO2 particles could penetrate the skin causing concern over the use of nano-TiO2. These studies were later refuted, when it was discovered that the testing methodology couldn’t differentiate between penetrated particles and particles simply trapped in hair follicles and that having a diseased or physically damaged dermis could be the true cause of insufficient barrier protection.[50]
SCCS research found that when nanoparticles had certain photostable coatings (eg. alumina, silica, cetyl phosphate, triethoxycaprylylsilane, manganese dioxide) the photocatalytic activity was attenuated and no notable skin penetration was observed; the sunscreen in this research was applied at amounts of 10 mg/cm2 for exposure periods of 24 hours.[54] Coating TiO2 with alumina, silica, zircon or various polymers can minimize avobenzone degradation[55] and enhance UV absorption by adding an additional light diffraction mechanism.[52]
TiO
2 is used extensively in plastics and other applications as a white pigment or an opacifier and for its UV resistant properties where the powder disperses light – unlike organic UV absorbers – and reduces UV damage, due mostly to the particle’s high refractive index.[56]
Other uses of titanium dioxide[edit]
In ceramic glazes, titanium dioxide acts as an opacifier and seeds crystal formation.
It is used as a tattoo pigment and in styptic pencils. Titanium dioxide is produced in varying particle sizes which are both oil and water dispersible, and in certain grades for the cosmetic industry. It is also a common ingredient in toothpaste.
The exterior of the Saturn V rocket was painted with titanium dioxide; this later allowed astronomers to determine that J002E3 was likely the S-IVB stage from Apollo 12 and not an asteroid.[57]
Research[edit]
Photocatalyst[edit]
Nanosized titanium dioxide, particularly in the anatase form, exhibits photocatalytic activity under ultraviolet (UV) irradiation. This photoactivity is reportedly most pronounced at the {001} planes of anatase,[58][59] although the {101} planes are thermodynamically more stable and thus more prominent in most synthesised and natural anatase,[60] as evident by the often observed tetragonal dipyramidal growth habit. Interfaces between rutile and anatase are further considered to improve photocatalytic activity by facilitating charge carrier separation and as a result, biphasic titanium dioxide is often considered to possess enhanced functionality as a photocatalyst.[61] It has been reported that titanium dioxide, when doped with nitrogen ions or doped with metal oxide like tungsten trioxide, exhibits excitation also under visible light.[62] The strong oxidative potential of the positive holes oxidizes water to create hydroxyl radicals. It can also oxidize oxygen or organic materials directly. Hence, in addition to its use as a pigment, titanium dioxide can be added to paints, cements, windows, tiles, or other products for its sterilizing, deodorizing, and anti-fouling properties, and is used as a hydrolysis catalyst. It is also used in dye-sensitized solar cells, which are a type of chemical solar cell (also known as a Graetzel cell).
The photocatalytic properties of nanosized titanium dioxide were discovered by Akira Fujishima in 1967[63] and published in 1972.[64] The process on the surface of the titanium dioxide was called the Honda-Fujishima effect (ja:本多-藤嶋効果).[63] Titanium dioxide, in thin film and nanoparticle form has potential for use in energy production: as a photocatalyst, it can break water into hydrogen and oxygen. With the hydrogen collected, it could be used as a fuel. The efficiency of this process can be greatly improved by doping the oxide with carbon.[65] Further efficiency and durability has been obtained by introducing disorder to the lattice structure of the surface layer of titanium dioxide nanocrystals, permitting infrared absorption.[66] Visible-light-active nanosized anatase and rutile has been developed for photocatalytic applications.[67][68]
In 1995 Fujishima and his group discovered the superhydrophilicity phenomenon for titanium dioxide coated glass exposed to sun light.[63] This resulted in the development of self-cleaning glass and anti-fogging coatings.
Nanosized TiO2 incorporated into outdoor building materials, such as paving stones in noxer blocks[69] or paints, can substantially reduce concentrations of airborne pollutants such as volatile organic compounds and nitrogen oxides.[70] A cement that uses titanium dioxide as a photocatalytic component, produced by Italcementi Group, was included in Time Magazine’s Top 50 Inventions of 2008.[71]
Attempts have been made to photocatalytically mineralize pollutants (to convert into CO2 and H2O) in waste water.[72] TiO2 offers great potential as an industrial technology for detoxification or remediation of wastewater due to several factors:[73]
- The process uses natural oxygen and sunlight and thus occurs under ambient conditions; it is wavelength selective and is accelerated by UV light.
- The photocatalyst is inexpensive, readily available, non-toxic, chemically and mechanically stable, and has a high turnover.
- The formation of photocyclized intermediate products, unlike direct photolysis techniques, is avoided.
- Oxidation of the substrates to CO2 is complete.
- TiO2 can be supported as thin films on suitable reactor substrates, which can be readily separated from treated water.[74]
The photocatalytic destruction of organic matter is also exploited in photocatalytic antimicrobial coatings,[75] which are typically thin films applied to furniture in hospitals and other surfaces susceptible to be contaminated with bacteria, fungi, and viruses.
Hydroxyl radical formation[edit]
Although nanosized anatase TiO2 does not absorb visible light, it does strongly absorb ultraviolet (UV) radiation (hv), leading to the formation of hydroxyl radicals.[76] This occurs when photo-induced valence bond holes (h+vb) are trapped at the surface of TiO2 leading to the formation of trapped holes (h+tr) that cannot oxidize water.[77]
- TiO2 + hv → e− + h+vb
- h+vb → h+tr
- O2 + e− → O2•−
- O2•− + O2•−+ 2 H+ → H2O2 + O2
- O2•− + h+vb → O2
- O2•− + h+tr → O2
- OH− + h+vb → HO•
- e− + h+tr → recombination
- Note: Wavelength (λ)= 387 nm[77] This reaction has been found to mineralize and decompose undesirable compounds in the environment, specifically the air and in wastewater.[77]
Synthetic single crystals of TiO2, ca. 2–3 mm in size, cut from a larger plate
Nanotubes[edit]
Titanium oxide nanotubes, SEM image
Nanotubes of titanium dioxide (TiO2-Nt) obtained by electrochemical synthesis. The SEM image shows an array of vertical self-ordered TiO2-Nt with closed bottom ends of tubes.
Anatase can be converted into non-carbon nanotubes and nanowires.[78] Hollow TiO2 nanofibers can be also prepared by coating carbon nanofibers by first applying titanium butoxide.[79]
Health and safety[edit]
As of 2006, titanium dioxide has been regarded as «completely nontoxic.»[4] Widely occurring minerals and even gemstones are composed of TiO2. All natural titanium, comprising more than 0.5% of the earth’s crust, exists as oxides. Although no evidence points to acute toxicity, recurring concerns have been expressed about nanophase forms of these materials. Studies of workers with high exposure to TiO2 particles indicate that even at high exposure there is no adverse effect to human health.[80]
The European Union removed the authorisation to use titanium dioxide (E 171) in foods, effective 7 February 2022, with a six months grace period.[81]
Titanium dioxide dust, when inhaled, has been classified by the International Agency for Research on Cancer (IARC) as an IARC Group 2B carcinogen, meaning it is possibly carcinogenic to humans.[82][83]
The US National Institute for Occupational Safety and Health recommends two separate exposure limits. NIOSH recommends that fine TiO
2 particles be set at an exposure limit of 2.4 mg/m3, while ultrafine TiO
2 be set at an exposure limit of 0.3 mg/m3, as time-weighted average concentrations up to 10 hours a day for a 40-hour work week.[84]
Environmental waste introduction[edit]
Titanium dioxide (TiO₂) is mostly introduced into the environment as nanoparticles via wastewater treatment plants.[85] Cosmetic pigments including titanium dioxide enter the wastewater when the product is washed off into sinks after cosmetic use. Once in the sewage treatment plants, pigments separate into sewage sludge which can then be released into the soil when injected into the soil or distributed on its surface. 99% of these nanoparticles wind up on land rather than in aquatic environments due to their retention in sewage sludge.[85] In the environment, titanium dioxide nanoparticles have low to negligible solubility and have been shown to be stable once particle aggregates are formed in soil and water surroundings.[85] In the process of dissolution, water-soluble ions typically dissociate from the nanoparticle into solution when thermodynamically unstable. TiO2 dissolution increases when there are higher levels of dissolved organic matter and clay in the soil. However, aggregation is promoted by pH at the isoelectric point of TiO2 (pH= 5.8) which renders it neutral and solution ion concentrations above 4.5 mM.[86][87]
National policies on food additive use[edit]
TiO2 whitener in food was banned in France from 2020, due to uncertainty about what quantities were safe for human consumption.[88]
In 2021, the European Food Safety Authority (EFSA) ruled that as a consequence of new understandings of nanoparticles, titanium dioxide could «no longer be considered safe as a food additive», and the EU health commissioner announced plans to ban its use across the EU, with discussions beginning in June 2021. EFSA concluded that genotoxicity—which could lead to carcinogenic effects—could not be ruled out, and that a «safe level for daily intake of the food additive could not be established».[89] In 2022, the UK Food Standards Agency and Food Standards Scotland announced they disagreed with the EFSA ruling, and would therefore not follow the EU in banning titanium dioxide as a food additive.[90] Health Canada has similarly reviewed the available evidence and decided not to change their position on titanium dioxide as a food additive at this time.[91]
Culture and society[edit]
Companies such as Dunkin’ Donuts dropped titanium dioxide from their merchandise in 2015 after public pressure.[92] Andrew Maynard, director of Risk Science Center at the University of Michigan, rejected the supposed danger from use of titanium dioxide in food. He says that the titanium dioxide used by Dunkin’ Brands and many other food producers is not a new material, and it is not a nanomaterial either. Nanoparticles are typically smaller than 100 nanometres in diameter, yet most of the particles in food grade titanium dioxide are much larger.[93]
Still, size distribution analyses showed that batches of food-grade TiO₂ always include a nano-sized fraction as inevitable byproduct of the manufacturing processes.[94]
See also[edit]
- Delustrant
- Dye-sensitized solar cell
- List of inorganic pigments
- Noxer blocks, TiO2-coated pavers that remove NOx pollutants from the air
- Suboxide
- Surface properties of transition metal oxides
- Titanium dioxide nanoparticle
References[edit]
- ^ Nowotny, Janusz (2011). Oxide Semiconductors for Solar Energy Conversion: Titanium Dioxide. CRC Press. p. 156. ISBN 9781439848395.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0617». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Völz, Hans G.; et al. (2006). «Pigments, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a20_243.pub2.
- ^ «Titanium» in 2014 Minerals Yearbook. USGS
- ^ «Mineral Commodity Summaries, 2015» (PDF). U.S. Geological Survey. U.S. Geological Survey 2015.
- ^ «Mineral Commodity Summaries, January 2016» (PDF). U.S. Geological Survey. U.S. Geological Survey 2016.
- ^ Schonbrun, Zach. «The Quest for the Next Billion-Dollar Color». Bloomberg.com. Retrieved 24 April 2018.
- ^ Alderman, O. L. G., Skinner, L. B., Benmore, C. J., Tamalonis, A., Weber, J. K. R. (2014). «Structure of Molten Titanium Dioxide». Physical Review B. 90 (9): 094204. Bibcode:2014PhRvB..90i4204A. doi:10.1103/PhysRevB.90.094204.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Emsley, John (2001). Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford: Oxford University Press. pp. 451–53. ISBN 978-0-19-850341-5.
- ^ El, Goresy; Chen, M; Dubrovinsky, L; Gillet, P; Graup, G (2001). «An ultradense polymorph of rutile with seven-coordinated titanium from the Ries crater». Science. 293 (5534): 1467–70. Bibcode:2001Sci…293.1467E. doi:10.1126/science.1062342. PMID 11520981. S2CID 24349901.
- ^ El Goresy, Ahmed; Chen, Ming; Gillet, Philippe; Dubrovinsky, Leonid; Graup, GüNther; Ahuja, Rajeev (2001). «A natural shock-induced dense polymorph of rutile with α-PbO2 structure in the suevite from the Ries crater in Germany». Earth and Planetary Science Letters. 192 (4): 485. Bibcode:2001E&PSL.192..485E. doi:10.1016/S0012-821X(01)00480-0.
- ^ Akaogiite. mindat.org
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 1117–19. ISBN 978-0-08-022057-4.
- ^ Marchand R.; Brohan L.; Tournoux M. (1980). «A new form of titanium dioxide and the potassium octatitanate K2Ti8O17«. Materials Research Bulletin. 15 (8): 1129–1133. doi:10.1016/0025-5408(80)90076-8.
- ^ Latroche, M; Brohan, L; Marchand, R; Tournoux (1989). «New hollandite oxides: TiO2(H) and K0.06TiO2«. Journal of Solid State Chemistry. 81 (1): 78–82. Bibcode:1989JSSCh..81…78L. doi:10.1016/0022-4596(89)90204-1.
- ^ Akimoto, J.; Gotoh, Y.; Oosawa, Y.; Nonose, N.; Kumagai, T.; Aoki, K.; Takei, H. (1994). «Topotactic Oxidation of Ramsdellite-Type Li0.5TiO2, a New Polymorph of Titanium Dioxide: TiO2(R)». Journal of Solid State Chemistry. 113 (1): 27–36. Bibcode:1994JSSCh.113…27A. doi:10.1006/jssc.1994.1337.
- ^ Simons, P. Y.; Dachille, F. (1967). «The structure of TiO2II, a high-pressure phase of TiO2«. Acta Crystallographica. 23 (2): 334–336. doi:10.1107/S0365110X67002713.
- ^ Sato H; Endo S; Sugiyama M; Kikegawa T; Shimomura O; Kusaba K (1991). «Baddeleyite-Type High-Pressure Phase of TiO2«. Science. 251 (4995): 786–788. Bibcode:1991Sci…251..786S. doi:10.1126/science.251.4995.786. PMID 17775458. S2CID 28241170.
- ^ Dubrovinskaia N. A.; Dubrovinsky L. S.; Ahuja R.; Prokopenko V. B.; Dmitriev V.; Weber H.-P.; Osorio-Guillen J. M.; Johansson B. (2001). «Experimental and Theoretical Identification of a New High-Pressure TiO2 Polymorph». Phys. Rev. Lett. 87 (27 Pt 1): 275501. Bibcode:2001PhRvL..87A5501D. doi:10.1103/PhysRevLett.87.275501. PMID 11800890.
- ^ Mattesini M.; de Almeida J. S.; Dubrovinsky L.; Dubrovinskaia L.; Johansson B.; Ahuja R. (2004). «High-pressure and high-temperature synthesis of the cubic TiO2 polymorph». Phys. Rev. B. 70 (21): 212101. Bibcode:2004PhRvB..70u2101M. doi:10.1103/PhysRevB.70.212101.
- ^ a b Dubrovinsky, LS; Dubrovinskaia, NA; Swamy, V; Muscat, J; Harrison, NM; Ahuja, R; Holm, B; Johansson, B (2001). «Materials science: The hardest known oxide». Nature. 410 (6829): 653–654. Bibcode:2001Natur.410..653D. doi:10.1038/35070650. hdl:10044/1/11018. PMID 11287944. S2CID 4365291.
- ^ Oganov A.R.; Lyakhov A.O. (2010). «Towards the theory of hardness of materials». Journal of Superhard Materials. 32 (3): 143–147. arXiv:1009.5477. Bibcode:2010arXiv1009.5477O. doi:10.3103/S1063457610030019. S2CID 119280867.
- ^ Al-Khatatbeh, Y.; Lee, K. K. M. & Kiefer, B. (2009). «High-pressure behavior of TiO2 as determined by experiment and theory». Phys. Rev. B. 79 (13): 134114. Bibcode:2009PhRvB..79m4114A. doi:10.1103/PhysRevB.79.134114.
- ^ Nishio-Hamane D.; Shimizu A.; Nakahira R.; Niwa K.; Sano-Furukawa A.; Okada T.; Yagi T.; Kikegawa T. (2010). «The stability and equation of state for the cotunnite phase of TiO2 up to 70 GPa». Phys. Chem. Minerals. 37 (3): 129–136. Bibcode:2010PCM….37..129N. doi:10.1007/s00269-009-0316-0. S2CID 95463163.
- ^ Banfield, J. F., Veblen, D. R., and Smith, D. J. (1991). «The identification of naturally occurring TiO2 (B) by structure determination using high-resolution electron microscopy, image simulation, and distance–least–squares refinement» (PDF). American Mineralogist. 76: 343.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «Top 5 Vendors in the Global Titanium Dioxide Market From 2017-2021: Technavio». 20 April 2017.
- ^ Hayes, Tony (2011). «Titanium Dioxide: A Shining Future Ahead» (PDF). Euro Pacific Canada. p. 5. Retrieved 16 August 2012.[permanent dead link]
- ^ Hayes (2011), p. 3
- ^ Hayes (2011), p. 4
- ^ «Titanium dioxide».
- ^ Vartiainen, Jaana (7 October 1998). «Process for preparing titanium dioxide» (PDF).
- ^ Winkler, Jochen (2003). Titanium Dioxide. Hannover: Vincentz Network. pp. 30–31. ISBN 978-3-87870-148-4.
- ^ By Chen, Xiaobo; Mao, Samuel S. (2007). «Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications». Chemical Reviews. 107 (7): 2891–2959. doi:10.1021/cr0500535. PMID 17590053.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ «Market Study: Titanium Dioxide». Ceresana. Retrieved 21 May 2013.
- ^
- ^ St. Clair, Kassia (2016). The Secret Lives of Colour. London: John Murray. p. 40. ISBN 9781473630819. OCLC 936144129.
- ^ Anderson, Bruce (1999). Kemira pigments quality titanium dioxide. Savannah, Georgia. p. 39.
- ^ a b Winkler, Jochen (2003). Titanium Dioxide. Hannover, Germany: Vincentz Network. p. 5. ISBN 978-3-87870-148-4.
- ^ Margaux de Frouville (28 March 2019). «Deux dentifrices sur trois contiennent du dioxyde de titane, un colorant au possible effet cancérogène» [Two out of three toothpastes contain titanium dioxide, a possibly carcinogenic colouring material] (in French). BFMTV.com.
- ^ «Titanium Dioxide (E171) – Overview, Uses, Side Effects & More». HealthKnight. 10 April 2022. Retrieved 9 June 2022.
- ^ Koleske, J. V. (1995). Paint and Coating Testing Manual. ASTM International. p. 232. ISBN 978-0-8031-2060-0.
- ^ Koleske, J. V. (1995). Paint and Coating Testing Manual. ASTM International. p. 229. ISBN 978-0-8031-2060-0.
- ^ «Pearlescence with Iriodin», pearl-effect.com, archived from the original on 17 January 2012
- ^ Gabros, Sarah; Nessel, Trevor A.; Zito, Patrick M. (2021), «Sunscreens And Photoprotection», StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 30725849, retrieved 6 March 2021
- ^ Dumbuya, Hawasatu; Grimes, Pearl E.; Lynch, Stephen; Ji, Kaili; Brahmachary, Manisha; Zheng, Qian; Bouez, Charbel; Wangari-Talbot, Janet (1 July 2020). «Impact of Iron-Oxide Containing Formulations Against Visible Light-Induced Skin Pigmentation in Skin of Color Individuals». Journal of Drugs in Dermatology. 19 (7): 712–717. doi:10.36849/JDD.2020.5032. ISSN 1545-9616. PMID 32726103.
- ^ «US Virgin Islands bans sunscreens harming coral reefs». www.downtoearth.org.in. Retrieved 6 March 2021.
- ^ Dan, Yongbo et al. Measurement of Titanium Dioxide Nanoparticles in Sunscreen using Single Particle ICP-MS. perkinelmer.com
- ^ «Health_scientific_committees» (PDF).
- ^ a b Jacobs, J. F.; Van De Poel, I.; Osseweijer, P. (2010). «Sunscreens with Titanium Dioxide (TiO2) Nano-Particles: A Societal Experiment». Nanoethics. 4 (2): 103–113. doi:10.1007/s11569-010-0090-y. PMC 2933802. PMID 20835397.
- ^ cosmeticsdesign-europe.com. «Scientists encourage ‘safer’ rutile form of TiO2 in cosmetics». cosmeticsdesign-europe.com. Retrieved 6 March 2021.
- ^ a b Jaroenworaluck, A.; Sunsaneeyametha, W.; Kosachan, N.; Stevens, R. (29 March 2006). «Characteristics of silica‐coated TiO2 and its UV absorption for sunscreen cosmetic applications». Wiley Analytical Science. 38 (4): 473–477. doi:10.1002/sia.2313. S2CID 97137064 – via Wiley Online Library.
- ^ Dréno, Alexis, Chuberre, & Marinovich (2019). «Safety of Titanium Dioxide Nanoparticles in Cosmetics». Journal of the European Academy of Dermatology and Venereology. 33 Suppl 7: 34–46. doi:10.1111/jdv.15943. PMID 31588611. S2CID 203849903.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ a b «OPINION ON additional coatings for Titanium Dioxide (nano form) as UV-filter in dermally applied cosmetic products» (PDF). Scientific Committee on Consumer Safety (SCCS). European Commission. 7 November 2016 – via ec.europa.eu.
- ^ Wang, Can; Zuo, Shixiang; Liu, Wenjie; Yao, Chao; Li, Xiazhang; Li, Zhongyu (2016). «Preparation of rutile TiO2@avobenzone composites for the further enhancement of sunscreen performance». RSC Advances. 6 (113): 111865. Bibcode:2016RSCAd…6k1865W. doi:10.1039/C6RA23282E – via Royal society of chemistry.
- ^ Polymers, Light and the Science of TiO2, DuPont, pp. 1–2
- ^ Jorgensen, K.; Rivkin, A.; Binzel, R.; Whitely, R.; Hergenrother, C.; Chodas, P.; Chesley, S.; Vilas, F. (May 2003). «Observations of J002E3: Possible Discovery of an Apollo Rocket Body». Bulletin of the American Astronomical Society. 35: 981. Bibcode:2003DPS….35.3602J.
- ^ Liang Chu (2015). «Anatase TiO2 Nanoparticles with Exposed {001} Facets for Efficient Dye-Sensitized Solar Cells». Scientific Reports. 5: 12143. Bibcode:2015NatSR…512143C. doi:10.1038/srep12143. PMC 4507182. PMID 26190140.
- ^ Li Jianming and Dongsheng Xu (2010). «tetragonal faceted-nanorods of anatase TiO2 single crystals with a large percentage of active {100} facets». Chemical Communications. 46 (13): 2301–3. doi:10.1039/b923755k. PMID 20234939.
- ^ M Hussein N Assadi (2016). «The effects of copper doping on photocatalytic activity at (101) planes of anatase TiO 2: A theoretical study». Applied Surface Science. 387: 682–689. arXiv:1811.09157. Bibcode:2016ApSS..387..682A. doi:10.1016/j.apsusc.2016.06.178. S2CID 99834042.
- ^ Hanaor, Dorian A. H.; Sorrell, Charles C. (2014). «Sand Supported Mixed-Phase TiO2 Photocatalysts for Water Decontamination Applications». Advanced Engineering Materials. 16 (2): 248–254. arXiv:1404.2652. Bibcode:2014arXiv1404.2652H. doi:10.1002/adem.201300259. S2CID 118571942.
- ^ Kurtoglu M. E.; Longenbach T.; Gogotsi Y. (2011). «Preventing Sodium Poisoning of Photocatalytic TiO2 Films on Glass by Metal Doping». International Journal of Applied Glass Science. 2 (2): 108–116. doi:10.1111/j.2041-1294.2011.00040.x.
- ^ a b c «Discovery and applications of photocatalysis – Creating a comfortable future by making use of light energy». Japan Nanonet Bulletin Issue 44, 12 May 2005.
- ^ Fujishima, Akira; Honda, Kenichi (1972). «Electrochemical Photolysis of Water at a Semiconductor Electrode». Nature. 238 (5358): 37–8. Bibcode:1972Natur.238…37F. doi:10.1038/238037a0. PMID 12635268. S2CID 4251015.
- ^ «Carbon-doped titanium dioxide is an effective photocatalyst». Advanced Ceramics Report. 1 December 2003. Archived from the original on 4 February 2007.
This carbon-doped titanium dioxide is highly efficient; under artificial visible light, it breaks down chlorophenol five times more efficiently than the nitrogen-doped version.
- ^ Cheap, Clean Ways to Produce Hydrogen for Use in Fuel Cells? A Dash of Disorder Yields a Very Efficient Photocatalyst. Sciencedaily (28 January 2011)
- ^ Karvinen, Saila (2003). «Preparation and Characterization of Mesoporous Visible-Light-Active Anatase». Solid State Sciences. 5 2003 (8): 1159–1166. Bibcode:2003SSSci…5.1159K. doi:10.1016/S1293-2558(03)00147-X.
- ^ Bian, Liang. «Band gap calculation and photo catalytic activity of rare earths doped rutile TiO2«. Journal of Rare Earths. 27 2009: 461–468.
- ^ Advanced Concrete Pavement materials Archived 20 June 2013 at the Wayback Machine, National Concrete Pavement Technology Center, Iowa State University, p. 435.
- ^ Hogan, Jenny (4 February 2004) «Smog-busting paint soaks up noxious gases». New Scientist.
- ^ TIME’s Best Inventions of 2008. (31 October 2008).
- ^ Winkler, Jochen (2003). Titanium Dioxide. Hannover: Vincentz Network. pp. 115–116. ISBN 978-3-87870-148-4.
- ^ Konstantinou, Ioannis K; Albanis, Triantafyllos A (2004). «TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution: Kinetic and mechanistic investigations». Applied Catalysis B: Environmental. 49: 1–14. doi:10.1016/j.apcatb.2003.11.010.
- ^ Hanaor, Dorian A. H.; Sorrell, Charles C. (2014). «Sand Supported Mixed-Phase TiO2 Photocatalysts for Water Decontamination Applications». Advanced Engineering Materials. 16 (2): 248–254. arXiv:1404.2652. doi:10.1002/adem.201300259. S2CID 118571942.
- ^ Ramsden, Jeremy J. (2015). «Photocatalytic antimicrobial coatings». Nanotechnology Perceptions. 11 (3): 146–168. doi:10.4024/N12RA15A.ntp.15.03.
- ^ Jones, Tony; Egerton, Terry A. (2000). «Titanium Compounds, Inorganic». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0914151805070518.a01.pub3. ISBN 9780471238966.
- ^ a b c Hirakawa, Tsutomu; Nosaka, Yoshio (23 January 2002). «Properties of O2•-and OH• formed in TiO2 aqueous suspensions by photocatalytic reaction and the influence of H2O2 and some ions». Langmuir. 18 (8): 3247–3254. doi:10.1021/la015685a.
- ^ Mogilevsky, Gregory; Chen, Qiang; Kleinhammes, Alfred; Wu, Yue (2008). «The structure of multilayered titania nanotubes based on delaminated anatase». Chemical Physics Letters. 460 (4–6): 517–520. Bibcode:2008CPL…460..517M. doi:10.1016/j.cplett.2008.06.063.
- ^ a b Wang, Cui (2015). «Hard-templating of chiral TiO2 nanofibres with electron transition-based optical activity». Science and Technology of Advanced Materials. 16 (5): 054206. Bibcode:2015STAdM..16e4206W. doi:10.1088/1468-6996/16/5/054206. PMC 5070021. PMID 27877835.
- ^ Warheit DB, Donner EM (November 2015). «Risk assessment strategies for nanoscale and fine-sized titanium dioxide particles: Recognizing hazard and exposure issues». Food Chem Toxicol (Review). 85: 138–47. doi:10.1016/j.fct.2015.07.001. PMID 26362081.
- ^ ‘amending Annexes II and III to Regulation (EC) No 1333/2008 of the European Parliament and of the Council as regards the food additive titanium dioxide (E 171)’. COMMISSION REGULATION (EU) 2022/63, 14 January 2022
- ^ «Titanium dioxide» (PDF). 93. International Agency for Research on Cancer. 2006.
- ^ «Titanium Dioxide Classified as Possibly Carcinogenic to Humans». Canadian Centre for Occupational Health & Safety. August 2006.
- ^ National Institute for Occupational Safety and Health. «Current Intelligence Bulletin 63: Occupational Exposure to Titanium Dioxide (NIOSH Publication No. 2011-160)» (PDF). National Institute for Occupational Safety and Health.
- ^ a b c Tourinho, Paula S.; van Gestel, Cornelis A. M.; Lofts, Stephen; Svendsen, Claus; Soares, Amadeu M. V. M.; Loureiro, Susana (1 August 2012). «Metal-based nanoparticles in soil: Fate, behavior, and effects on soil invertebrates». Environmental Toxicology and Chemistry. 31 (8): 1679–1692. doi:10.1002/etc.1880. ISSN 1552-8618. PMID 22573562. S2CID 45296995.
- ^ Swiler, Daniel R. (2005). «Pigments, Inorganic». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0914151814152215.a01.pub2. ISBN 9780471238966.
- ^ Preočanin, Tajana; Kallay, Nikola (2006). «Point of Zero Charge and Surface Charge Density of TiO2 in Aqueous Electrolyte Solution as Obtained by Potentiometric Mass Titration». Croatica Chemica Acta. 79 (1): 95–106. ISSN 0011-1643.
- ^ France to ban titanium dioxide whitener in food from 2020. Reuters, 2019-04-17
- ^ Boffey, Daniel (6 May 2021). «E171: EU watchdog says food colouring widely used in UK is unsafe». the Guardian.
- ^ ‘UK disagrees with EU position on titanium dioxide’. Food Safety News, 2022-03-09
- ^ ‘Titanium dioxide (TiO2) as a food additive: Current science report’. Health Canada, 2022-06-20
- ^ «Dunkin’ Donuts to remove titanium dioxide from donuts». CNN Money. March 2015.
- ^
Dunkin’ Donuts ditches titanium dioxide – but is it actually harmful? The Conversation. 12 March 2015 - ^
[1] Critical review of the safety assessment of titanium dioxide additives in food. 1 June 2018
External links[edit]
- International Chemical Safety Card 0338
- «Nano-Oxides, Inc. – Nano Powders, LEGIT information on Titanium Dioxide TiO2» (PDF). nano-oxides.com. Archived from the original (PDF) on 13 October 2017.
- NIOSH Pocket Guide to Chemical Hazards
- The Largest TiO2 Distributor in China Interview with Chairman Yang Tao by ICOAT.CC.
- «Fresh doubt over America map», bbc.co.uk, 30 July 2002
- «Titanium Dioxide Classified as Possibly Carcinogenic to Humans», Canadian Centre for Occupational Health and Safety, August, 2006 (if inhaled as a powder)
- A description of TiO2 photocatalysis
- Crystal structures of the three forms of TiO2
- «Architecture in Italy goes green», Elisabetta Povoledo, International Herald Tribune, 22 November 2006
- «A Concrete Step Toward Cleaner Air», Bruno Giussani, BusinessWeek.com, 8 November 2006
- Sunscreen in the Sky? Reflective Particles May Combat Warming
- Titanium and titanium dioxide production data (US and World)

|
|

|
|
| Names | |
|---|---|
| IUPAC names
Titanium dioxide |
|
| Other names
Titania |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.033.327 |
| E number | E171 (colours) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
TiO 2 |
| Molar mass | 79.866 g/mol |
| Appearance | White solid |
| Odor | Odorless |
| Density |
|
| Melting point | 1,843 °C (3,349 °F; 2,116 K) |
| Boiling point | 2,972 °C (5,382 °F; 3,245 K) |
|
Solubility in water |
Insoluble |
| Band gap | 3.05 eV (rutile)[1] |
|
Magnetic susceptibility (χ) |
+5.9·10−6 cm3/mol |
|
Refractive index (nD) |
|
| Thermochemistry | |
|
Std molar |
50 J·mol−1·K−1[2] |
|
Std enthalpy of |
−945 kJ·mol−1[2] |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | not flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3[3] |
|
REL (Recommended) |
Ca[3] |
|
IDLH (Immediate danger) |
Ca [5000 mg/m3][3] |
| Safety data sheet (SDS) | ICSC 0338 |
| Related compounds | |
|
Other cations |
Zirconium dioxide Hafnium dioxide |
|
Related Titanium oxides |
Titanium(II) oxide Titanium(III) oxide Titanium(III,IV) oxide |
|
Related compounds |
Titanic acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Titanium dioxide, also known as titanium(IV) oxide or titania , is the inorganic compound with the chemical formula TiO
2. When used as a pigment, it is called titanium white, Pigment White 6 (PW6), or CI 77891.[4] It is a white solid that is insoluble to water, although mineral forms can appear black. As a pigment, it has a wide range of applications, including paint, sunscreen, and food coloring. When used as a food coloring, it has E number E171. World production in 2014 exceeded 9 million tonnes.[5][6][7] It has been estimated that titanium dioxide is used in two-thirds of all pigments, and pigments based on the oxide have been valued at a price of $13.2 billion.[8]
Structure[edit]
In all three of its main dioxides, titanium exhibits octahedral geometry, being bonded to six oxide anions. The oxides in turn are bonded to three Ti centers. The overall crystal structure of rutile is tetragonal in symmetry whereas anatase and brookite are orthorhombic. The oxygen substructures are all slight distortions of close packing: in rutile, the oxide anions are arranged in distorted hexagonal close-packing, whereas they are close to cubic close-packing in anatase and to «double hexagonal close-packing» for brookite. The rutile structure is widespread for other metal dioxides and difluorides, e.g. RuO2 and ZnF2.
Molten titanium dioxide has a local structure in which each Ti is coordinated to, on average, about 5 oxygen atoms.[9] This is distinct from the crystalline forms in which Ti coordinates to 6 oxygen atoms.
Structure of anatase. Together with rutile and brookite, one of the three major polymorphs of TiO2.
Production and occurrence[edit]
Synthetic TiO2 is mainly produced from the mineral ilmenite. Rutile, and anatase, naturally occurring TiO2, occur widely also, e.g. rutile as a ‘heavy mineral’ in beach sand. Leucoxene, fine-grained anatase formed by natural alteration of ilmenite, is yet another ore. Star sapphires and rubies get their asterism from oriented inclusions of rutile needles.[10]
Mineralogy and uncommon polymorphs[edit]
Titanium dioxide occurs in nature as the minerals rutile and anatase. Additionally two high-pressure forms are known minerals: a monoclinic baddeleyite-like form known as akaogiite, and the other has a slight monoclinic distortion of the orthorhombic α-PbO2 structure and is known as riesite. Both of which can be found at the Ries crater in Bavaria.[11][12][13] It is mainly sourced from ilmenite, which is the most widespread titanium dioxide-bearing ore around the world. Rutile is the next most abundant and contains around 98% titanium dioxide in the ore. The metastable anatase and brookite phases convert irreversibly to the equilibrium rutile phase upon heating above temperatures in the range 600–800 °C (1,110–1,470 °F).[14]
Titanium dioxide has twelve known polymorphs – in addition to rutile, anatase, brookite, akaogiite and riesite, three metastable phases can be produced synthetically (monoclinic, tetragonal, and orthorhombic ramsdellite-like), and four high-pressure forms (α-PbO2-like, cotunnite-like, orthorhombic OI, and cubic phases) also exist:
| Form | Crystal system | Synthesis |
|---|---|---|
| Rutile | Tetragonal | |
| Anatase | Tetragonal | |
| Brookite | Orthorhombic | |
| TiO2(B)[15] | Monoclinic | Hydrolysis of K2Ti4O9 followed by heating |
| TiO2(H), hollandite-like form[16] | Tetragonal | Oxidation of the related potassium titanate bronze, K0.25TiO2 |
| TiO2(R), ramsdellite-like form[17] | Orthorhombic | Oxidation of the related lithium titanate bronze Li0.5TiO2 |
| TiO2(II)-(α-PbO2-like form)[18] | Orthorhombic | |
| Akaogiite (baddeleyite-like form, 7 coordinated Ti)[19] | Monoclinic | |
| TiO2 -OI[20] | Orthorhombic | |
| Cubic form[21] | Cubic | P > 40 GPa, T > 1600 °C |
| TiO2 -OII, cotunnite(PbCl2)-like[22] | Orthorhombic | P > 40 GPa, T > 700 °C |
The cotunnite-type phase was claimed to be the hardest known oxide with the Vickers hardness of 38 GPa and the bulk modulus of 431 GPa (i.e. close to diamond’s value of 446 GPa) at atmospheric pressure.[22] However, later studies came to different conclusions with much lower values for both the hardness (7–20 GPa, which makes it softer than common oxides like corundum Al2O3 and rutile TiO2)[23] and bulk modulus (~300 GPa).[24][25]
Titanium dioxide (B) is found as a mineral in magmatic rocks and hydrothermal veins, as well as weathering rims on perovskite. TiO2 also forms lamellae in other minerals.[26]
Production[edit]
Evolution of the global production of titanium dioxide according to process
The five largest TiO
2 pigment processors are in 2019 Chemours, Cristal Global, Venator, Kronos [de], and Tronox.[27][28] Major paint and coating company end users for pigment grade titanium dioxide include Akzo Nobel, PPG Industries, Sherwin Williams, BASF, Kansai Paints and Valspar.[29] Global TiO
2 pigment demand for 2010 was 5.3 Mt with annual growth expected to be about 3–4%.[30]
The production method depends on the feedstock. In addition to ores, other feedstocks include upgraded slag. Both sulfate and chloride processes produce the titanium dioxide pigment in the rutile crystal form, but the Sulfate Process can be adjusted to produce the anatase form. Anatase, being softer, is used in fiber and paper applications. The Sulfate Process is run as a batch process; the Chloride Process is run as a continuous process.[31]
Chloride process[edit]
In chloride process, the ore is treated with chlorine and carbon to give titanium tetrachloride, a volatile liquid that is further purified by distillation. The TiCl4 is treated with oxygen to regenerate chlorine and produce the titanium dioxide.
Sulfate process[edit]
Chemical manufacturing plants using the sulfate process, require ilmenite concentrate (45–60% TiO2) or pretreated feedstocks as a suitable source of titanium.[32] In the sulfate process, ilmenite is treated with sulfuric acid to extract iron(II) sulfate pentahydrate. The resulting synthetic rutile is further processed according to the specifications of the end user, i.e. pigment grade or otherwise.[33] In another method for the production of synthetic rutile from ilmenite the Becher process first oxidizes the ilmenite as a means to separate the iron component.
Specialized methods[edit]
For specialty applications, TiO2 films are prepared by various specialized chemistries.[34] Sol-gel routes involve the hydrolysis of titanium alkoxides, such as titanium ethoxide:
- Ti(OEt)4 + 2 H2O → TiO2 + 4 EtOH
This technology is suited for the preparation of films. A related approach that also relies on molecular precursors involves chemical vapor deposition. In this application, the alkoxide is volatilized and then decomposed on contact with a hot surface:
- Ti(OEt)4 → TiO2 + 2 Et2O
Applications[edit]
The most important application areas are paints and varnishes as well as paper and plastics, which account for about 80% of the world’s titanium dioxide consumption. Other pigment applications such as printing inks, fibers, rubber, cosmetic products, and food account for another 8%. The rest is used in other applications, for instance the production of technical pure titanium, glass and glass ceramics, electrical ceramics, metal patinas, catalysts, electric conductors, chemical intermediates, or as a substrate for phosphonic acid adsorption.[35][36]
Pigment[edit]
First mass-produced in 1916,[37] titanium dioxide is the most widely used white pigment because of its brightness and very high refractive index, in which it is surpassed only by a few other materials (see list of indices of refraction). Titanium dioxide crystal size is ideally around 220 nm (measured by electron microscope) to optimize the maximum reflection of visible light. However, abnormal grain growth is often observed in titanium dioxide, particularly in its rutile phase. The occurrence of abnormal grain growth brings about a deviation of a small number of crystallites from the mean crystal size and modifies the physical behaviour of TiO2. The optical properties of the finished pigment are highly sensitive to purity. As little as a few parts per million (ppm) of certain metals (Cr, V, Cu, Fe, Nb) can disturb the crystal lattice so much that the effect can be detected in quality control.[38] Approximately 4.6 million tons of pigmentary TiO2 are used annually worldwide, and this number is expected to increase as use continues to rise.[39]
TiO2 is also an effective opacifier in powder form, where it is employed as a pigment to provide whiteness and opacity to products such as paints, coatings, plastics, papers, inks, foods, supplements, medicines (i.e. pills and tablets), and most toothpastes; in 2019 it was present in two-thirds of toothpastes on the French market.[40] In food, it is commonly found in products like ice creams, chocolates, all types of candy, creamers, desserts, marshmallows, chewing gum, pastries, spreads, dressings, cakes, and many other foods.[41] In paint, it is often referred to offhandedly as «brilliant white», «the perfect white», «the whitest white», or other similar terms. Opacity is improved by optimal sizing of the titanium dioxide particles.
Thin films[edit]
When deposited as a thin film, its refractive index and colour make it an excellent reflective optical coating for dielectric mirrors; it is also used in generating decorative thin films such as found in «mystic fire topaz».
Some grades of modified titanium based pigments as used in sparkly paints, plastics, finishes and cosmetics – these are man-made pigments whose particles have two or more layers of various oxides – often titanium dioxide, iron oxide or alumina – in order to have glittering, iridescent and or pearlescent effects similar to crushed mica or guanine-based products. In addition to these effects a limited colour change is possible in certain formulations depending on how and at which angle the finished product is illuminated and the thickness of the oxide layer in the pigment particle; one or more colours appear by reflection while the other tones appear due to interference of the transparent titanium dioxide layers.[42] In some products, the layer of titanium dioxide is grown in conjunction with iron oxide by calcination of titanium salts (sulfates, chlorates) around 800 °C[43] One example of a pearlescent pigment is Iriodin, based on mica coated with titanium dioxide or iron (III) oxide.[44]
The iridescent effect in these titanium oxide particles is unlike the opaque effect obtained with usual ground titanium oxide pigment obtained by mining, in which case only a certain diameter of the particle is considered and the effect is due only to scattering.
Sunscreen and UV blocking pigments[edit]
In cosmetic and skin care products, titanium dioxide is used as a pigment, sunscreen and a thickener. As a sunscreen, ultrafine TiO2 is used, which is notable in that combined with ultrafine zinc oxide, it is considered to be an effective sunscreen that lowers the incidence of sun burns and minimizes the premature photoaging, photocarcinogenesis and immunosuppression associated with long term excess sun exposure.[45] Sometimes these UV blockers are combined with iron oxide pigments in sunscreen to increase visible light protection.[46]
Titanium dioxide and zinc oxide are generally considered to be less harmful to coral reefs than sunscreens that include chemicals such as oxybenzone, octocrylene and octinoxate.[47]
Nanosized titanium dioxide is found in the majority of physical sunscreens because of its strong UV light absorbing capabilities and its resistance to discolouration under ultraviolet light. This advantage enhances its stability and ability to protect the skin from ultraviolet light. Nano-scaled (particle size of 20–40 nm)[48] titanium dioxide particles are primarily used in sunscreen lotion because they scatter visible light much less than titanium dioxide pigments, and can give UV protection.[39] Sunscreens designed for infants or people with sensitive skin are often based on titanium dioxide and/or zinc oxide, as these mineral UV blockers are believed to cause less skin irritation than other UV absorbing chemicals. Nano-TiO2 blocks both UV-A and UV-B radiation, which is used in sunscreens and other cosmetic products. It is safe to use and it is better to environment than organic UV-absorbers.[49]
The risk assessment of different titanium dioxide nanomaterials in sunscreen is currently evolving as nano-sized TiO2 is different from the well-known micronized form.[50] The rutile form is generally used in cosmetic and sunscreen products due to it not possessing any observed ability to damage the skin under normal conditions[51] and having a higher UV absorption.[52] In 2016 Scientific Committee on Consumer Safety (SCCS) tests concluded that the use of nano titanium dioxide (95–100% rutile, ≦5% anatase) as a UV filter can be considered to not pose any risk of adverse effects in humans post-application on healthy skin,[53] except in the case the application method would lead to substantial risk of inhalation (ie; powder or spray formulations). This safety opinion applied to nano TiO2 in concentrations of up to 25%.[54]
Initial studies indicated that nano-TiO2 particles could penetrate the skin causing concern over the use of nano-TiO2. These studies were later refuted, when it was discovered that the testing methodology couldn’t differentiate between penetrated particles and particles simply trapped in hair follicles and that having a diseased or physically damaged dermis could be the true cause of insufficient barrier protection.[50]
SCCS research found that when nanoparticles had certain photostable coatings (eg. alumina, silica, cetyl phosphate, triethoxycaprylylsilane, manganese dioxide) the photocatalytic activity was attenuated and no notable skin penetration was observed; the sunscreen in this research was applied at amounts of 10 mg/cm2 for exposure periods of 24 hours.[54] Coating TiO2 with alumina, silica, zircon or various polymers can minimize avobenzone degradation[55] and enhance UV absorption by adding an additional light diffraction mechanism.[52]
TiO
2 is used extensively in plastics and other applications as a white pigment or an opacifier and for its UV resistant properties where the powder disperses light – unlike organic UV absorbers – and reduces UV damage, due mostly to the particle’s high refractive index.[56]
Other uses of titanium dioxide[edit]
In ceramic glazes, titanium dioxide acts as an opacifier and seeds crystal formation.
It is used as a tattoo pigment and in styptic pencils. Titanium dioxide is produced in varying particle sizes which are both oil and water dispersible, and in certain grades for the cosmetic industry. It is also a common ingredient in toothpaste.
The exterior of the Saturn V rocket was painted with titanium dioxide; this later allowed astronomers to determine that J002E3 was likely the S-IVB stage from Apollo 12 and not an asteroid.[57]
Research[edit]
Photocatalyst[edit]
Nanosized titanium dioxide, particularly in the anatase form, exhibits photocatalytic activity under ultraviolet (UV) irradiation. This photoactivity is reportedly most pronounced at the {001} planes of anatase,[58][59] although the {101} planes are thermodynamically more stable and thus more prominent in most synthesised and natural anatase,[60] as evident by the often observed tetragonal dipyramidal growth habit. Interfaces between rutile and anatase are further considered to improve photocatalytic activity by facilitating charge carrier separation and as a result, biphasic titanium dioxide is often considered to possess enhanced functionality as a photocatalyst.[61] It has been reported that titanium dioxide, when doped with nitrogen ions or doped with metal oxide like tungsten trioxide, exhibits excitation also under visible light.[62] The strong oxidative potential of the positive holes oxidizes water to create hydroxyl radicals. It can also oxidize oxygen or organic materials directly. Hence, in addition to its use as a pigment, titanium dioxide can be added to paints, cements, windows, tiles, or other products for its sterilizing, deodorizing, and anti-fouling properties, and is used as a hydrolysis catalyst. It is also used in dye-sensitized solar cells, which are a type of chemical solar cell (also known as a Graetzel cell).
The photocatalytic properties of nanosized titanium dioxide were discovered by Akira Fujishima in 1967[63] and published in 1972.[64] The process on the surface of the titanium dioxide was called the Honda-Fujishima effect (ja:本多-藤嶋効果).[63] Titanium dioxide, in thin film and nanoparticle form has potential for use in energy production: as a photocatalyst, it can break water into hydrogen and oxygen. With the hydrogen collected, it could be used as a fuel. The efficiency of this process can be greatly improved by doping the oxide with carbon.[65] Further efficiency and durability has been obtained by introducing disorder to the lattice structure of the surface layer of titanium dioxide nanocrystals, permitting infrared absorption.[66] Visible-light-active nanosized anatase and rutile has been developed for photocatalytic applications.[67][68]
In 1995 Fujishima and his group discovered the superhydrophilicity phenomenon for titanium dioxide coated glass exposed to sun light.[63] This resulted in the development of self-cleaning glass and anti-fogging coatings.
Nanosized TiO2 incorporated into outdoor building materials, such as paving stones in noxer blocks[69] or paints, can substantially reduce concentrations of airborne pollutants such as volatile organic compounds and nitrogen oxides.[70] A cement that uses titanium dioxide as a photocatalytic component, produced by Italcementi Group, was included in Time Magazine’s Top 50 Inventions of 2008.[71]
Attempts have been made to photocatalytically mineralize pollutants (to convert into CO2 and H2O) in waste water.[72] TiO2 offers great potential as an industrial technology for detoxification or remediation of wastewater due to several factors:[73]
- The process uses natural oxygen and sunlight and thus occurs under ambient conditions; it is wavelength selective and is accelerated by UV light.
- The photocatalyst is inexpensive, readily available, non-toxic, chemically and mechanically stable, and has a high turnover.
- The formation of photocyclized intermediate products, unlike direct photolysis techniques, is avoided.
- Oxidation of the substrates to CO2 is complete.
- TiO2 can be supported as thin films on suitable reactor substrates, which can be readily separated from treated water.[74]
The photocatalytic destruction of organic matter is also exploited in photocatalytic antimicrobial coatings,[75] which are typically thin films applied to furniture in hospitals and other surfaces susceptible to be contaminated with bacteria, fungi, and viruses.
Hydroxyl radical formation[edit]
Although nanosized anatase TiO2 does not absorb visible light, it does strongly absorb ultraviolet (UV) radiation (hv), leading to the formation of hydroxyl radicals.[76] This occurs when photo-induced valence bond holes (h+vb) are trapped at the surface of TiO2 leading to the formation of trapped holes (h+tr) that cannot oxidize water.[77]
- TiO2 + hv → e− + h+vb
- h+vb → h+tr
- O2 + e− → O2•−
- O2•− + O2•−+ 2 H+ → H2O2 + O2
- O2•− + h+vb → O2
- O2•− + h+tr → O2
- OH− + h+vb → HO•
- e− + h+tr → recombination
- Note: Wavelength (λ)= 387 nm[77] This reaction has been found to mineralize and decompose undesirable compounds in the environment, specifically the air and in wastewater.[77]
Synthetic single crystals of TiO2, ca. 2–3 mm in size, cut from a larger plate
Nanotubes[edit]
Titanium oxide nanotubes, SEM image
Nanotubes of titanium dioxide (TiO2-Nt) obtained by electrochemical synthesis. The SEM image shows an array of vertical self-ordered TiO2-Nt with closed bottom ends of tubes.
Anatase can be converted into non-carbon nanotubes and nanowires.[78] Hollow TiO2 nanofibers can be also prepared by coating carbon nanofibers by first applying titanium butoxide.[79]
Health and safety[edit]
As of 2006, titanium dioxide has been regarded as «completely nontoxic.»[4] Widely occurring minerals and even gemstones are composed of TiO2. All natural titanium, comprising more than 0.5% of the earth’s crust, exists as oxides. Although no evidence points to acute toxicity, recurring concerns have been expressed about nanophase forms of these materials. Studies of workers with high exposure to TiO2 particles indicate that even at high exposure there is no adverse effect to human health.[80]
The European Union removed the authorisation to use titanium dioxide (E 171) in foods, effective 7 February 2022, with a six months grace period.[81]
Titanium dioxide dust, when inhaled, has been classified by the International Agency for Research on Cancer (IARC) as an IARC Group 2B carcinogen, meaning it is possibly carcinogenic to humans.[82][83]
The US National Institute for Occupational Safety and Health recommends two separate exposure limits. NIOSH recommends that fine TiO
2 particles be set at an exposure limit of 2.4 mg/m3, while ultrafine TiO
2 be set at an exposure limit of 0.3 mg/m3, as time-weighted average concentrations up to 10 hours a day for a 40-hour work week.[84]
Environmental waste introduction[edit]
Titanium dioxide (TiO₂) is mostly introduced into the environment as nanoparticles via wastewater treatment plants.[85] Cosmetic pigments including titanium dioxide enter the wastewater when the product is washed off into sinks after cosmetic use. Once in the sewage treatment plants, pigments separate into sewage sludge which can then be released into the soil when injected into the soil or distributed on its surface. 99% of these nanoparticles wind up on land rather than in aquatic environments due to their retention in sewage sludge.[85] In the environment, titanium dioxide nanoparticles have low to negligible solubility and have been shown to be stable once particle aggregates are formed in soil and water surroundings.[85] In the process of dissolution, water-soluble ions typically dissociate from the nanoparticle into solution when thermodynamically unstable. TiO2 dissolution increases when there are higher levels of dissolved organic matter and clay in the soil. However, aggregation is promoted by pH at the isoelectric point of TiO2 (pH= 5.8) which renders it neutral and solution ion concentrations above 4.5 mM.[86][87]
National policies on food additive use[edit]
TiO2 whitener in food was banned in France from 2020, due to uncertainty about what quantities were safe for human consumption.[88]
In 2021, the European Food Safety Authority (EFSA) ruled that as a consequence of new understandings of nanoparticles, titanium dioxide could «no longer be considered safe as a food additive», and the EU health commissioner announced plans to ban its use across the EU, with discussions beginning in June 2021. EFSA concluded that genotoxicity—which could lead to carcinogenic effects—could not be ruled out, and that a «safe level for daily intake of the food additive could not be established».[89] In 2022, the UK Food Standards Agency and Food Standards Scotland announced they disagreed with the EFSA ruling, and would therefore not follow the EU in banning titanium dioxide as a food additive.[90] Health Canada has similarly reviewed the available evidence and decided not to change their position on titanium dioxide as a food additive at this time.[91]
Culture and society[edit]
Companies such as Dunkin’ Donuts dropped titanium dioxide from their merchandise in 2015 after public pressure.[92] Andrew Maynard, director of Risk Science Center at the University of Michigan, rejected the supposed danger from use of titanium dioxide in food. He says that the titanium dioxide used by Dunkin’ Brands and many other food producers is not a new material, and it is not a nanomaterial either. Nanoparticles are typically smaller than 100 nanometres in diameter, yet most of the particles in food grade titanium dioxide are much larger.[93]
Still, size distribution analyses showed that batches of food-grade TiO₂ always include a nano-sized fraction as inevitable byproduct of the manufacturing processes.[94]
See also[edit]
- Delustrant
- Dye-sensitized solar cell
- List of inorganic pigments
- Noxer blocks, TiO2-coated pavers that remove NOx pollutants from the air
- Suboxide
- Surface properties of transition metal oxides
- Titanium dioxide nanoparticle
References[edit]
- ^ Nowotny, Janusz (2011). Oxide Semiconductors for Solar Energy Conversion: Titanium Dioxide. CRC Press. p. 156. ISBN 9781439848395.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0617». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Völz, Hans G.; et al. (2006). «Pigments, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a20_243.pub2.
- ^ «Titanium» in 2014 Minerals Yearbook. USGS
- ^ «Mineral Commodity Summaries, 2015» (PDF). U.S. Geological Survey. U.S. Geological Survey 2015.
- ^ «Mineral Commodity Summaries, January 2016» (PDF). U.S. Geological Survey. U.S. Geological Survey 2016.
- ^ Schonbrun, Zach. «The Quest for the Next Billion-Dollar Color». Bloomberg.com. Retrieved 24 April 2018.
- ^ Alderman, O. L. G., Skinner, L. B., Benmore, C. J., Tamalonis, A., Weber, J. K. R. (2014). «Structure of Molten Titanium Dioxide». Physical Review B. 90 (9): 094204. Bibcode:2014PhRvB..90i4204A. doi:10.1103/PhysRevB.90.094204.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Emsley, John (2001). Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford: Oxford University Press. pp. 451–53. ISBN 978-0-19-850341-5.
- ^ El, Goresy; Chen, M; Dubrovinsky, L; Gillet, P; Graup, G (2001). «An ultradense polymorph of rutile with seven-coordinated titanium from the Ries crater». Science. 293 (5534): 1467–70. Bibcode:2001Sci…293.1467E. doi:10.1126/science.1062342. PMID 11520981. S2CID 24349901.
- ^ El Goresy, Ahmed; Chen, Ming; Gillet, Philippe; Dubrovinsky, Leonid; Graup, GüNther; Ahuja, Rajeev (2001). «A natural shock-induced dense polymorph of rutile with α-PbO2 structure in the suevite from the Ries crater in Germany». Earth and Planetary Science Letters. 192 (4): 485. Bibcode:2001E&PSL.192..485E. doi:10.1016/S0012-821X(01)00480-0.
- ^ Akaogiite. mindat.org
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 1117–19. ISBN 978-0-08-022057-4.
- ^ Marchand R.; Brohan L.; Tournoux M. (1980). «A new form of titanium dioxide and the potassium octatitanate K2Ti8O17«. Materials Research Bulletin. 15 (8): 1129–1133. doi:10.1016/0025-5408(80)90076-8.
- ^ Latroche, M; Brohan, L; Marchand, R; Tournoux (1989). «New hollandite oxides: TiO2(H) and K0.06TiO2«. Journal of Solid State Chemistry. 81 (1): 78–82. Bibcode:1989JSSCh..81…78L. doi:10.1016/0022-4596(89)90204-1.
- ^ Akimoto, J.; Gotoh, Y.; Oosawa, Y.; Nonose, N.; Kumagai, T.; Aoki, K.; Takei, H. (1994). «Topotactic Oxidation of Ramsdellite-Type Li0.5TiO2, a New Polymorph of Titanium Dioxide: TiO2(R)». Journal of Solid State Chemistry. 113 (1): 27–36. Bibcode:1994JSSCh.113…27A. doi:10.1006/jssc.1994.1337.
- ^ Simons, P. Y.; Dachille, F. (1967). «The structure of TiO2II, a high-pressure phase of TiO2«. Acta Crystallographica. 23 (2): 334–336. doi:10.1107/S0365110X67002713.
- ^ Sato H; Endo S; Sugiyama M; Kikegawa T; Shimomura O; Kusaba K (1991). «Baddeleyite-Type High-Pressure Phase of TiO2«. Science. 251 (4995): 786–788. Bibcode:1991Sci…251..786S. doi:10.1126/science.251.4995.786. PMID 17775458. S2CID 28241170.
- ^ Dubrovinskaia N. A.; Dubrovinsky L. S.; Ahuja R.; Prokopenko V. B.; Dmitriev V.; Weber H.-P.; Osorio-Guillen J. M.; Johansson B. (2001). «Experimental and Theoretical Identification of a New High-Pressure TiO2 Polymorph». Phys. Rev. Lett. 87 (27 Pt 1): 275501. Bibcode:2001PhRvL..87A5501D. doi:10.1103/PhysRevLett.87.275501. PMID 11800890.
- ^ Mattesini M.; de Almeida J. S.; Dubrovinsky L.; Dubrovinskaia L.; Johansson B.; Ahuja R. (2004). «High-pressure and high-temperature synthesis of the cubic TiO2 polymorph». Phys. Rev. B. 70 (21): 212101. Bibcode:2004PhRvB..70u2101M. doi:10.1103/PhysRevB.70.212101.
- ^ a b Dubrovinsky, LS; Dubrovinskaia, NA; Swamy, V; Muscat, J; Harrison, NM; Ahuja, R; Holm, B; Johansson, B (2001). «Materials science: The hardest known oxide». Nature. 410 (6829): 653–654. Bibcode:2001Natur.410..653D. doi:10.1038/35070650. hdl:10044/1/11018. PMID 11287944. S2CID 4365291.
- ^ Oganov A.R.; Lyakhov A.O. (2010). «Towards the theory of hardness of materials». Journal of Superhard Materials. 32 (3): 143–147. arXiv:1009.5477. Bibcode:2010arXiv1009.5477O. doi:10.3103/S1063457610030019. S2CID 119280867.
- ^ Al-Khatatbeh, Y.; Lee, K. K. M. & Kiefer, B. (2009). «High-pressure behavior of TiO2 as determined by experiment and theory». Phys. Rev. B. 79 (13): 134114. Bibcode:2009PhRvB..79m4114A. doi:10.1103/PhysRevB.79.134114.
- ^ Nishio-Hamane D.; Shimizu A.; Nakahira R.; Niwa K.; Sano-Furukawa A.; Okada T.; Yagi T.; Kikegawa T. (2010). «The stability and equation of state for the cotunnite phase of TiO2 up to 70 GPa». Phys. Chem. Minerals. 37 (3): 129–136. Bibcode:2010PCM….37..129N. doi:10.1007/s00269-009-0316-0. S2CID 95463163.
- ^ Banfield, J. F., Veblen, D. R., and Smith, D. J. (1991). «The identification of naturally occurring TiO2 (B) by structure determination using high-resolution electron microscopy, image simulation, and distance–least–squares refinement» (PDF). American Mineralogist. 76: 343.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «Top 5 Vendors in the Global Titanium Dioxide Market From 2017-2021: Technavio». 20 April 2017.
- ^ Hayes, Tony (2011). «Titanium Dioxide: A Shining Future Ahead» (PDF). Euro Pacific Canada. p. 5. Retrieved 16 August 2012.[permanent dead link]
- ^ Hayes (2011), p. 3
- ^ Hayes (2011), p. 4
- ^ «Titanium dioxide».
- ^ Vartiainen, Jaana (7 October 1998). «Process for preparing titanium dioxide» (PDF).
- ^ Winkler, Jochen (2003). Titanium Dioxide. Hannover: Vincentz Network. pp. 30–31. ISBN 978-3-87870-148-4.
- ^ By Chen, Xiaobo; Mao, Samuel S. (2007). «Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications». Chemical Reviews. 107 (7): 2891–2959. doi:10.1021/cr0500535. PMID 17590053.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ «Market Study: Titanium Dioxide». Ceresana. Retrieved 21 May 2013.
- ^
- ^ St. Clair, Kassia (2016). The Secret Lives of Colour. London: John Murray. p. 40. ISBN 9781473630819. OCLC 936144129.
- ^ Anderson, Bruce (1999). Kemira pigments quality titanium dioxide. Savannah, Georgia. p. 39.
- ^ a b Winkler, Jochen (2003). Titanium Dioxide. Hannover, Germany: Vincentz Network. p. 5. ISBN 978-3-87870-148-4.
- ^ Margaux de Frouville (28 March 2019). «Deux dentifrices sur trois contiennent du dioxyde de titane, un colorant au possible effet cancérogène» [Two out of three toothpastes contain titanium dioxide, a possibly carcinogenic colouring material] (in French). BFMTV.com.
- ^ «Titanium Dioxide (E171) – Overview, Uses, Side Effects & More». HealthKnight. 10 April 2022. Retrieved 9 June 2022.
- ^ Koleske, J. V. (1995). Paint and Coating Testing Manual. ASTM International. p. 232. ISBN 978-0-8031-2060-0.
- ^ Koleske, J. V. (1995). Paint and Coating Testing Manual. ASTM International. p. 229. ISBN 978-0-8031-2060-0.
- ^ «Pearlescence with Iriodin», pearl-effect.com, archived from the original on 17 January 2012
- ^ Gabros, Sarah; Nessel, Trevor A.; Zito, Patrick M. (2021), «Sunscreens And Photoprotection», StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 30725849, retrieved 6 March 2021
- ^ Dumbuya, Hawasatu; Grimes, Pearl E.; Lynch, Stephen; Ji, Kaili; Brahmachary, Manisha; Zheng, Qian; Bouez, Charbel; Wangari-Talbot, Janet (1 July 2020). «Impact of Iron-Oxide Containing Formulations Against Visible Light-Induced Skin Pigmentation in Skin of Color Individuals». Journal of Drugs in Dermatology. 19 (7): 712–717. doi:10.36849/JDD.2020.5032. ISSN 1545-9616. PMID 32726103.
- ^ «US Virgin Islands bans sunscreens harming coral reefs». www.downtoearth.org.in. Retrieved 6 March 2021.
- ^ Dan, Yongbo et al. Measurement of Titanium Dioxide Nanoparticles in Sunscreen using Single Particle ICP-MS. perkinelmer.com
- ^ «Health_scientific_committees» (PDF).
- ^ a b Jacobs, J. F.; Van De Poel, I.; Osseweijer, P. (2010). «Sunscreens with Titanium Dioxide (TiO2) Nano-Particles: A Societal Experiment». Nanoethics. 4 (2): 103–113. doi:10.1007/s11569-010-0090-y. PMC 2933802. PMID 20835397.
- ^ cosmeticsdesign-europe.com. «Scientists encourage ‘safer’ rutile form of TiO2 in cosmetics». cosmeticsdesign-europe.com. Retrieved 6 March 2021.
- ^ a b Jaroenworaluck, A.; Sunsaneeyametha, W.; Kosachan, N.; Stevens, R. (29 March 2006). «Characteristics of silica‐coated TiO2 and its UV absorption for sunscreen cosmetic applications». Wiley Analytical Science. 38 (4): 473–477. doi:10.1002/sia.2313. S2CID 97137064 – via Wiley Online Library.
- ^ Dréno, Alexis, Chuberre, & Marinovich (2019). «Safety of Titanium Dioxide Nanoparticles in Cosmetics». Journal of the European Academy of Dermatology and Venereology. 33 Suppl 7: 34–46. doi:10.1111/jdv.15943. PMID 31588611. S2CID 203849903.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ a b «OPINION ON additional coatings for Titanium Dioxide (nano form) as UV-filter in dermally applied cosmetic products» (PDF). Scientific Committee on Consumer Safety (SCCS). European Commission. 7 November 2016 – via ec.europa.eu.
- ^ Wang, Can; Zuo, Shixiang; Liu, Wenjie; Yao, Chao; Li, Xiazhang; Li, Zhongyu (2016). «Preparation of rutile TiO2@avobenzone composites for the further enhancement of sunscreen performance». RSC Advances. 6 (113): 111865. Bibcode:2016RSCAd…6k1865W. doi:10.1039/C6RA23282E – via Royal society of chemistry.
- ^ Polymers, Light and the Science of TiO2, DuPont, pp. 1–2
- ^ Jorgensen, K.; Rivkin, A.; Binzel, R.; Whitely, R.; Hergenrother, C.; Chodas, P.; Chesley, S.; Vilas, F. (May 2003). «Observations of J002E3: Possible Discovery of an Apollo Rocket Body». Bulletin of the American Astronomical Society. 35: 981. Bibcode:2003DPS….35.3602J.
- ^ Liang Chu (2015). «Anatase TiO2 Nanoparticles with Exposed {001} Facets for Efficient Dye-Sensitized Solar Cells». Scientific Reports. 5: 12143. Bibcode:2015NatSR…512143C. doi:10.1038/srep12143. PMC 4507182. PMID 26190140.
- ^ Li Jianming and Dongsheng Xu (2010). «tetragonal faceted-nanorods of anatase TiO2 single crystals with a large percentage of active {100} facets». Chemical Communications. 46 (13): 2301–3. doi:10.1039/b923755k. PMID 20234939.
- ^ M Hussein N Assadi (2016). «The effects of copper doping on photocatalytic activity at (101) planes of anatase TiO 2: A theoretical study». Applied Surface Science. 387: 682–689. arXiv:1811.09157. Bibcode:2016ApSS..387..682A. doi:10.1016/j.apsusc.2016.06.178. S2CID 99834042.
- ^ Hanaor, Dorian A. H.; Sorrell, Charles C. (2014). «Sand Supported Mixed-Phase TiO2 Photocatalysts for Water Decontamination Applications». Advanced Engineering Materials. 16 (2): 248–254. arXiv:1404.2652. Bibcode:2014arXiv1404.2652H. doi:10.1002/adem.201300259. S2CID 118571942.
- ^ Kurtoglu M. E.; Longenbach T.; Gogotsi Y. (2011). «Preventing Sodium Poisoning of Photocatalytic TiO2 Films on Glass by Metal Doping». International Journal of Applied Glass Science. 2 (2): 108–116. doi:10.1111/j.2041-1294.2011.00040.x.
- ^ a b c «Discovery and applications of photocatalysis – Creating a comfortable future by making use of light energy». Japan Nanonet Bulletin Issue 44, 12 May 2005.
- ^ Fujishima, Akira; Honda, Kenichi (1972). «Electrochemical Photolysis of Water at a Semiconductor Electrode». Nature. 238 (5358): 37–8. Bibcode:1972Natur.238…37F. doi:10.1038/238037a0. PMID 12635268. S2CID 4251015.
- ^ «Carbon-doped titanium dioxide is an effective photocatalyst». Advanced Ceramics Report. 1 December 2003. Archived from the original on 4 February 2007.
This carbon-doped titanium dioxide is highly efficient; under artificial visible light, it breaks down chlorophenol five times more efficiently than the nitrogen-doped version.
- ^ Cheap, Clean Ways to Produce Hydrogen for Use in Fuel Cells? A Dash of Disorder Yields a Very Efficient Photocatalyst. Sciencedaily (28 January 2011)
- ^ Karvinen, Saila (2003). «Preparation and Characterization of Mesoporous Visible-Light-Active Anatase». Solid State Sciences. 5 2003 (8): 1159–1166. Bibcode:2003SSSci…5.1159K. doi:10.1016/S1293-2558(03)00147-X.
- ^ Bian, Liang. «Band gap calculation and photo catalytic activity of rare earths doped rutile TiO2«. Journal of Rare Earths. 27 2009: 461–468.
- ^ Advanced Concrete Pavement materials Archived 20 June 2013 at the Wayback Machine, National Concrete Pavement Technology Center, Iowa State University, p. 435.
- ^ Hogan, Jenny (4 February 2004) «Smog-busting paint soaks up noxious gases». New Scientist.
- ^ TIME’s Best Inventions of 2008. (31 October 2008).
- ^ Winkler, Jochen (2003). Titanium Dioxide. Hannover: Vincentz Network. pp. 115–116. ISBN 978-3-87870-148-4.
- ^ Konstantinou, Ioannis K; Albanis, Triantafyllos A (2004). «TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution: Kinetic and mechanistic investigations». Applied Catalysis B: Environmental. 49: 1–14. doi:10.1016/j.apcatb.2003.11.010.
- ^ Hanaor, Dorian A. H.; Sorrell, Charles C. (2014). «Sand Supported Mixed-Phase TiO2 Photocatalysts for Water Decontamination Applications». Advanced Engineering Materials. 16 (2): 248–254. arXiv:1404.2652. doi:10.1002/adem.201300259. S2CID 118571942.
- ^ Ramsden, Jeremy J. (2015). «Photocatalytic antimicrobial coatings». Nanotechnology Perceptions. 11 (3): 146–168. doi:10.4024/N12RA15A.ntp.15.03.
- ^ Jones, Tony; Egerton, Terry A. (2000). «Titanium Compounds, Inorganic». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0914151805070518.a01.pub3. ISBN 9780471238966.
- ^ a b c Hirakawa, Tsutomu; Nosaka, Yoshio (23 January 2002). «Properties of O2•-and OH• formed in TiO2 aqueous suspensions by photocatalytic reaction and the influence of H2O2 and some ions». Langmuir. 18 (8): 3247–3254. doi:10.1021/la015685a.
- ^ Mogilevsky, Gregory; Chen, Qiang; Kleinhammes, Alfred; Wu, Yue (2008). «The structure of multilayered titania nanotubes based on delaminated anatase». Chemical Physics Letters. 460 (4–6): 517–520. Bibcode:2008CPL…460..517M. doi:10.1016/j.cplett.2008.06.063.
- ^ a b Wang, Cui (2015). «Hard-templating of chiral TiO2 nanofibres with electron transition-based optical activity». Science and Technology of Advanced Materials. 16 (5): 054206. Bibcode:2015STAdM..16e4206W. doi:10.1088/1468-6996/16/5/054206. PMC 5070021. PMID 27877835.
- ^ Warheit DB, Donner EM (November 2015). «Risk assessment strategies for nanoscale and fine-sized titanium dioxide particles: Recognizing hazard and exposure issues». Food Chem Toxicol (Review). 85: 138–47. doi:10.1016/j.fct.2015.07.001. PMID 26362081.
- ^ ‘amending Annexes II and III to Regulation (EC) No 1333/2008 of the European Parliament and of the Council as regards the food additive titanium dioxide (E 171)’. COMMISSION REGULATION (EU) 2022/63, 14 January 2022
- ^ «Titanium dioxide» (PDF). 93. International Agency for Research on Cancer. 2006.
- ^ «Titanium Dioxide Classified as Possibly Carcinogenic to Humans». Canadian Centre for Occupational Health & Safety. August 2006.
- ^ National Institute for Occupational Safety and Health. «Current Intelligence Bulletin 63: Occupational Exposure to Titanium Dioxide (NIOSH Publication No. 2011-160)» (PDF). National Institute for Occupational Safety and Health.
- ^ a b c Tourinho, Paula S.; van Gestel, Cornelis A. M.; Lofts, Stephen; Svendsen, Claus; Soares, Amadeu M. V. M.; Loureiro, Susana (1 August 2012). «Metal-based nanoparticles in soil: Fate, behavior, and effects on soil invertebrates». Environmental Toxicology and Chemistry. 31 (8): 1679–1692. doi:10.1002/etc.1880. ISSN 1552-8618. PMID 22573562. S2CID 45296995.
- ^ Swiler, Daniel R. (2005). «Pigments, Inorganic». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0914151814152215.a01.pub2. ISBN 9780471238966.
- ^ Preočanin, Tajana; Kallay, Nikola (2006). «Point of Zero Charge and Surface Charge Density of TiO2 in Aqueous Electrolyte Solution as Obtained by Potentiometric Mass Titration». Croatica Chemica Acta. 79 (1): 95–106. ISSN 0011-1643.
- ^ France to ban titanium dioxide whitener in food from 2020. Reuters, 2019-04-17
- ^ Boffey, Daniel (6 May 2021). «E171: EU watchdog says food colouring widely used in UK is unsafe». the Guardian.
- ^ ‘UK disagrees with EU position on titanium dioxide’. Food Safety News, 2022-03-09
- ^ ‘Titanium dioxide (TiO2) as a food additive: Current science report’. Health Canada, 2022-06-20
- ^ «Dunkin’ Donuts to remove titanium dioxide from donuts». CNN Money. March 2015.
- ^
Dunkin’ Donuts ditches titanium dioxide – but is it actually harmful? The Conversation. 12 March 2015 - ^
[1] Critical review of the safety assessment of titanium dioxide additives in food. 1 June 2018
External links[edit]
- International Chemical Safety Card 0338
- «Nano-Oxides, Inc. – Nano Powders, LEGIT information on Titanium Dioxide TiO2» (PDF). nano-oxides.com. Archived from the original (PDF) on 13 October 2017.
- NIOSH Pocket Guide to Chemical Hazards
- The Largest TiO2 Distributor in China Interview with Chairman Yang Tao by ICOAT.CC.
- «Fresh doubt over America map», bbc.co.uk, 30 July 2002
- «Titanium Dioxide Classified as Possibly Carcinogenic to Humans», Canadian Centre for Occupational Health and Safety, August, 2006 (if inhaled as a powder)
- A description of TiO2 photocatalysis
- Crystal structures of the three forms of TiO2
- «Architecture in Italy goes green», Elisabetta Povoledo, International Herald Tribune, 22 November 2006
- «A Concrete Step Toward Cleaner Air», Bruno Giussani, BusinessWeek.com, 8 November 2006
- Sunscreen in the Sky? Reflective Particles May Combat Warming
- Titanium and titanium dioxide production data (US and World)
Оксид титана (двуокись титана)
Понятие и общие сведения
Титан является металлом четвертой группы, который при соединении с кислородом может образовывать до 15 различных оксидов. Однако, наиболее характерен для него диоксид или оксид титана (IV), или двуокись титана.
В зависимости от вида кристаллической решетки титановый диоксид образует следующие минералы:
— Рутил, обладающий тетрагональной кристаллической решеткой.
— Анатаз, имеющий тетрагональную решетку.
— Брукит, характеризующийся ромбической решеткой.
Кроме того, известны две другие модификации титаноксида высокого давления: ромбическая и гексагональная. В лаборатории под давлением 60 000 бар синтезировали еще одну модификацию двуокиси титана с наиболее высокой твердостью из известных.
Свойства
Оксиды титана различных степеней окисления сильно отличаются друг от друга по своим физико-химическим характеристикам. Рассмотрим свойства наиболее распространенных оксидов.
-
Монооксид (оксид титана II) формулой TiO представляет собой кристаллы, обладающие цветом в гамме от золотисто-желтого до коричнево-фиолетового цвета. Это вещество не растворимо в воде, но растворимо в разбавленных соляной и серной кислотах. В случае нагревания в воздушной среде монооксид окисляется до двуокиси титана TiO2. Это свойство используется в катализаторах, где находит применение окись титана (II).
-
Сесквиоксид (оксид титана III), химически описываемый как Ti2O3, выглядит как кристаллы темно-фиолетового или черного цвета. Не является устойчивым соединением, при сильном нагреве до испарения диссоциирует на два других оксида TiO и TiO2. В среде воздуха подвергается окислению лишь при очень высокой температуре. Не реагирует с водой и неорганическими кислотами. Растворяется при нагреве в концентрированной серной кислоте с выходом сульфата титана (III) фиолетового цвета.
-
Двуокись титана (оксид титана IV) формулой TiO2 – это, как ни странно, в кристаллической форме представляют собой неокрашенные кристаллы, желтеющие при нагревании, однако вновь теряющие цвет при последующем охлаждении. Диоксид титана не растворим в воде, набухает в неорганических кислотах и разбавленных растворах щелочей. С трудом растворим в концентрированных серной кислоте и щелочных растворах. При нагревании в азотной кислоте образуется карбид титана (III) TiN. Титаноксид (IV) восстанавливают до оксидов титана (III и II) нагревая первый в среде водорода, углерода, щелочных или щелочноземельных металлов – натрия, магния, кальция и т.д. При нагревании в среде газообразного хлора и восстановителей, например углерода получается хлорид титана (IV).
Получение
Титаноксид (IV) производят различными способами, например путем прокаливания кислородсодержащих солей и оснований, гидролизом или сжиганием титансодержащих соединений и другими способами.
Чаще всего двуокись титана получают прокаливанием гидроокиси, полученной после гидролиза сульфатных растворов или сжиганием хлорида титана (IV) при температурах от 1200 градусов С. Высокочистый диоксид титана получается при помощи гидролиза титанорганических веществ с последующим прокаливанием.
Из полученной таким образом двуокиси титана можно произвести оксиды с более низкими степенями окисления при помощи частичного восстановления водородом или элементарным титаном при температурах порядка 1500 градусов С по схеме:
3TiO2+Ti = 2Ti2O3
Оксиды с большим количеством атомов титана и наличествующими связями типа Ti-Ti, например Ti6O, Ti3O, Ti2O образуются в ходе растворения кислорода в непосредственно в титане. В случае повышения температуры более 300 градусов С такие соединения окисляются далее вплоть до двуокиси титана.
Применение титаноксида
Титан образует множество оксидов, однако подавляющее большинство применений имеет только оксид титана (IV) или двуокись. Среди других подобных соединений она является важным керамическим материалом и важнейшим пигментом.

Рис.1. Гранулированный суперконцентрат пигмента TiO2.
Суть применения двуокиси титана в современной индустрии базируется на способности мелкодисперсного порошка оксида с размером частиц от 20 до 50 нанометров демонстрировать очень высокую отражательную способность. Это свойство позволяет применять диоксид титана в качестве белого пигмента при изготовлении красок, известных как «титановые белила». Кроме того, пигмент повсеместно применяется при производстве эмалей, окраске бумаги, пластмасс и эластомеров, синтетических волокон, керамической продукции, стекла и многого другого. Титановые краски имеют ряд преимуществ перед аналогами и прежде всего ранее широко применяющимися свинцовыми белилами:
— химическая инертность,
— отсутствие токсичности (кроме порошкообразной формы – см. ниже),
— имеют более высокие эксплуатационные характеристики, надежность и долговечность.
В промышленности производства и переработки пластмасс и эластомеров диоксид титана является одним из самых важных пигментов. Он применяется в основном в двух формах:
-
Порошкообразной форме для приготовления смесей, применяемых при экструзии изделий из ПВХ (оконные и дверные профили, подоконники, водостоки, сайдинг, отделочные панели и т.д.). Также применяется для приготовления пластизолей и при других нераспространенных применениях.
-
В виде гранулированных суперконцентратов пигментов на основе различных полимеров, чаще всего полиэтилена, сэвилена, полипропилена, полистирола. Такая форма, с наполнением оксидом титана до 80% суперконцентрата, широко используется при литье под давлением, выдувном формовании, экструзии гранулированных пластмасс.
Также двуокись титана используется при приготовлении жидких красителей для пластмасс, опудривании гранул непосредственно пигментами и т.д.

Рис.2. Типичное изделие из ПВХ окрашенное в массе
Возможный вред здоровью
В действующих стандартах указано, что пыль диоксида титана обладает раздражающим действием. Она в определенных концентрациях может стать причиной бронхитов, пневмосклероза и прочих болезней легких человека. Предельно-допустимая концентрация титаноксида в воздухе рабочей зоны составляет 10 мг/куб.м, в атмосферном воздухе 0,5 мг/куб.м, в воде 0,1 мг/литр.
Вредность и теоретическая опасность диоксида титана привела к пристальному вниманию к этому соединению со стороны законодателей ряда стран, прежде всего государств Евросоюза. В 2019 году в новостных лентах стали появляться сообщения об ограничении использования титаноксида и его возможном запрете в будущем. В частности, Европейское Химическое Агентство в 2017 году подтвердило опасность порошкообразного титаноксида. В сентябре 2019 года эксперты Competent Authorities for REACH and CLP предложили Европейской Комиссии внести двуокись титана в перечень потенциально опасных веществ. Пока речь идет только о пигменте в порошкообразной форме, однако и это наносит большой ущерб полимерной отрасли, т.к. порошок TiO2 практически незаменим при экструзии в частности ПВХ-профилей.
Порошок оксида титана
Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды).[1]
- ICSC 0338
- CAS [13463-67-7]
- RTECS XR2775000
- EC —
Содержание
- 1 Строение
- 2 Нахождение в природе
- 3 Свойства
- 3.1 Физические, термодинамическе свойства
- 3.2 Химические свойства
- 3.3 Токсические свойства, физиологическое действие, опасные свойства
- 4 Добыча и производство
- 4.1 Производство диоксида титана из ильменитового концентрата
- 4.2 Производство диоксида титана из тетрахлорида титана
- 5 Применение
- 6 Цены и рынок
- 7 Нормативы
- 8 Использованная литература
- 9 Ссылки
- 10 Примечания
Строение
Диоксид титана в рутильной форме
Серым цветом обозначены атомы титана, красным — кислорода
Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
| Модификация/Параметр | Рутил | Анатаз | Брукит | Ромбическая IV | Гексагональная V | |
|---|---|---|---|---|---|---|
| Параметры элементарной решётки, нм | a | 0,45929 | 0,3785 | 0,51447 | 0,4531 | 0,922 |
| b | — | — | 0,9184 | 0,5498 | — | |
| c | 0,29591 | 0,9486 | 0,5145 | 0,4900 | 0,5685 | |
| Число формульных единиц в ячейке | 2 | 4 | 8 | |||
| Пространственная группа | P4/mnm | I4/amd | Pbca | Pbcn |
При нагревании и анатаз, и брукит необратимо превращаются в рутил (температуры перехода соответственно 400—1000°C и около 750 °C). Основой структур этих модификаций являются октаэдры TiO6, то есть каждый ион Ti4+ окружён шестью ионами O2-, а каждый ион O2- окружён тремя ионами Ti4+. Октаэдры расположены таким образом, что каждый ион кислорода принадлежит трём октаэдрам. В анатазе на один октаэдр приходятся 4 общих ребра, в рутиле — 2.
Нахождение в природе
В чистом виде в природе встречается в виде минералов рутила, анатаза и брукита (по строению первые два имеют тетрагональную, а последний — ромбическую сингонию), причём основную часть составляет рутил.
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области. Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек, Сьерра-Леоне.
Свойства
Физические, термодинамическе свойства
Чистый диоксид титана — бесцветные кристаллы (желтеет при нагревании). Для технических целей применяется в раздробленном состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой).
- Температура плавления для рутила — 1870 °C (по другим данным — 1850 °C, 1855 °C)
- Температура кипения для рутила — 2500 °C.
- Плотность при 20 °C:
- для рутила 4,235 г/см3[2]
- для анатаза 4,05 г/см3[2] (3,95 г/см3[3])
- для брукита 4,1 г/см3[2]
- Температура разложения для рутила 2900 °C[3]
Температура плавления, кипения и разложения для других модификаций не указана, т.к. они переходят в рутильную форму при нагревании (см. выше).
| Модификация | Интервал температуры, K | |||||
|---|---|---|---|---|---|---|
| 298—500 | 298—600 | 298—700 | 298—800 | 298—900 | 298—1000 | |
| рутил | 60,71 | 62,39 | 63,76 | 64,92 | 65,95 | 66,89 |
| анатаз | 63,21 | 65,18 | 66,59 | 67,64 | 68,47 | 69,12 |
| Модификация | ΔH°f, 298, кДж/моль[6] | S°298, Дж/моль/K[7] | ΔG°f, 298, кДж/моль[8] | C°p, 298, Дж/моль/K[9] | ΔHпл., кДж/моль[10] |
|---|---|---|---|---|---|
| рутил | -944,75 (-943,9[3]) | 50,33 | -889,49 (-888,6[3]) | 55,04 (55,02[3]) | 67 |
| анатаз | -933,03 (938,6[3]) | 49,92 | -877,65 (-888,3 [3]) | 55,21 (55,48 [3]) | 58 |
Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная.
Химические свойства
Диоксид титана амфотерен, то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
TiO2 + 2H2SO4 → Ti(SO4)2 + 2H2O
В концентрированных растворах щелочей или при сплавлении с ними образуются титанаты — соли титановой кислоты (амфотерного гидроксида титана TiO(OH)2)
TiO2 + 2NaOH → Na2TiO3 + H2O
То же происходит и в концентрированных растворах карбонатов или гидрокарбонатов:
TiO2 + K2CO3 → K2TiO3 + CO2↑ TiO2 + 2KHCO3 → K2TiO3 + 2CO2↑ + H2O
C перекисью водорода даёт ортотитановую кислоту:
TiO2 + 2H2O2 → H4TiO4 + О2↑
При нагревании с аммиаком даёт нитрид титана:
2TiO2 + 4NH3 →(t) 4TiN + 6H2O + O2↑
При сплавлении с оксидами, гидроксидами и карбонатами образуются титанаты и двойные оксиды:
TiO2 + BaO → BaO·TiO2
TiO2 + BaCO3 → BaO·TiO2 + CO2↑
TiO2 + Ba(OH)2 → BaO·TiO2 + H2O
При нагревании восстанавливается углеродом и активными металлами (Mg, Ca, Na) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана.
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti3O5 (то есть TiO2·Ti2O3), а затем и тёмно-фиолетового Ti2O3.
Гидратированный диоксид TiO2·nH2O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосажденный TiO2·nH2O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов. При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO2·2H2O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO2·H2O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO3 и т. п. Их плотность ~ 3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO2·nH2O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН < 2 получаются образцы со структурой рутила, при рН 2—5 — со структурой анатаза, из щелочной среды — рентгеноаморфные. Из сульфатных растворов продукты со структурой рутила не образуются.
Токсические свойства, физиологическое действие, опасные свойства
TLV(предельная пороговая концентрация, США): как TWA (среднесменная концентрация, США) 10 мг/м³ A4 (ACGIH 2001).
ПДК в воздухе рабочей зоны — 10 мг/м³ (1998)
ООН — 2546
Добыча и производство
Полная статья получение оксида титана(IV)
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн. [11]
Основными производители и экспортёры диоксида титана:
- KEMIRA PIGMENTS OY (Финляндия)
- ЗАО «Крымский Титан» (АР Крым)
- KRONOS TITAN GmbH & Co. OHG (Германия)
- Sachtleben (Германия)
- Kerr-McGee (США)
В последние годы чрезвычайно быстро растет производство диоксида титана в Китае.
В России пигментный диоксид титана не производят, но производят технические марки, используемые в металлургии. На территории СНГ диоксид титана производится на Украине предприятиями «Сумыхимпром», город Сумы, «Крымский титан», г. Армянск) и КП «Титано-магниевый комбинат» (г. Запорожье). Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технология получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Как указано выше, диоксид титана встречается в виде минералов, однако этого источника недостаточно, поэтому значительная его часть производится. Существуют два основных промышленных метода получения TiO2: из ильменитового (FeTiO3) концентрата и из тетрахлорида титана.
Производство диоксида титана из ильменитового концентрата
Технология производства состоит из трёх этапов:
- получение растворов сульфата титана (путём обработки ильменитовых концентратов серной кислотой). В результате получают смесь сульфата титана и сульфатов железа (II) и (III), последний восстанавливают металлическим железом до степени окисления железа +2. После восстановления на барабанных вакуум-фильтрах отделяют растворов сульфтов от шлама. Сульфат железа(II) отделяют в вакуум-кристаллизаторе.
- гидролиз раствора сульфатных солей титана. Гидролиз проводят методом введения зародышей (их готовят осаждая Ti(OH)4 из растворов сульфата титана гидроксидом натрия). На этапе гидролиза образующиеся частицы гидролизата (гидратов диоксида титана) обладают высокой адсорбционной способностью, особенно по отношению к солям Fe3+, именно по этой причине на предыдущей стадии трёхвалентное железо восстанавливается до двухвалентного. Варьируя условия проведения гидролиза (концентрацию, длительность стадий, количество зародышей, кислотность и т. п.) можно добиться выхода частиц гидролизата с заданными свойствами, в зависимости от предполагаемого применения.
- термообработка гидратов диоксида титана. На этом этапе, варьируя температуру сушки и используя добавки (такие, как оксид цинка, хлорид титана и используя другие методы можно провести рутилизацию (то есть перестройку оксида титана в рутильную модификацию). Для термообработки используют вращающиеся барабанные печи длиной 40—60 м. При термообработке испаряется вода (гидроксид титана и гидраты оксида титана переходят в форму диоксида титана), а также диоксид серы.
Производство диоксида титана из тетрахлорида титана
Существуют три основных метода получения диоксида титана из его тетрахлорида:
- гидролиз водных растворов тетрахлорида титана (с последующей термообработкой осадка)
- парофазный гидролиз тетрахлорида титана (основан на взаимодействии паров тетрахлорида титана с парами воды). Процесс обычно ведётся при температуре 900—1000°C
- термообработка тетрахлорида (сжигание в токе кислорода)
Применение
Основные применения диоксида титана:
- производителей лакокрасочных материалов, в частности, титановых белил — 57 % от всего потребления[11] (диоксид титана рутильной модификации обладает более высокими пигментными свойствами — светостойкостью, разбеливающей способностью и др.)
- производство пластмасс — 21 %[11]
- производство ламинированной бумаги — 14 %[11]
| 2001 г. | 2002 г. | 2003 г. | 2004 г. | |
|---|---|---|---|---|
| Америка | 1730 | 1730 | 1730 | 1680 |
| Запад. Европа | 1440 | 1470 | 1480 | 1480 |
| Япония | 340 | 340 | 320 | 320 |
| Австралия | 180 | 200 | 200 | 200 |
| Прочие страны | 690 | 740 | 1200 | 1400 |
| Всего | 4380 | 4480 | 4930 | 5080 |
Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т.д.), в пищевой промышленности (пищевая добавка E171).
Цены и рынок
Цены на диоксид титана отличаются в зависимости от степени чистоты и марки. Так, особо чистый (99,999 %) диоксид титана в рутильной и анатазной форме стоил в сентябре 2006 года 0,5—1 доллара за грамм (в зависимости от размера покупки), а технический диоксид титана — 2,2—4,8 доллара за килограмм в зависимости от марки и объёма покупки[13].
Нормативы
- Двуокись титана пигментная. Технические условия ГОСТ 9808-84
В настоящее время диоксид титана по ГОСТ 9808-84 не выпускается.
- Диоксид титана пигментный. ТУ У 24.1-05762329-001-2003
По данным техническим условиям работает ГАК «Титан» (г. Армянск).
- Титана диоксид пигментный. ТУ У 24.1-05766356-054:2005
По данным техническим условиям работает ОАО «Сумыхимпром» (г. Сумы).
Использованная литература
- Б. В. Некрасов. Основы общей химии. Т. I изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. С. 644, 648
- Т. Г. Ахметов, Р. Т. Порфирьева, Л. Г. Гайсин и др. Химическая технология неорганических веществ: в 2 кн. Кн. 1 Под ред. Т. Г. Ахметова.—М.:Высшая школа, 2002 ISBN 5-06-004244-8 С. 369—402
- Химия: Справ. изд./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. 2-е изд., стереотип. — М.:Химия, 2000. С. 411
- Химическая энциклопедия (электронная версия) С. 593, 594
Ссылки
- Мировой рынок пигментного диоксида титана Состояние, тенденции, прогнозы
- TiO2 — Titanium Dioxide | Двуокись титана (диоксид титана) | Свойства, область применения, производители диоксида титана
- Международная карта химической безопасности для диоксида титана
- Titanium dioxide Информация из Химической базы данных Акронского университета
- Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) (г.Сумы, Украина)
Примечания
- ↑ http://www.snab.ru/lkm2/01/03.pdf
- ↑ 1 2 3 4 Химическая энциклопедия
- ↑ 1 2 3 4 5 6 7 8 Рабинович. В. А., Хавин З. Я. Краткий химический справочник Л.:Химия, 1977 с. 105
- ↑ Краткий справочник физико-химических величин. Изд. 8-е, перераб./Под ред. А. А. Равделя и А. М. Пономаревой. — Л.:Химия, 1983. С.60
- ↑ Кроме изменения стандартной энтальпии плавления там же с. 82
- ↑ изменение стандартной энтальпии (теплоты образования) при образовании из простых веществ, термодинамически устойчивых при 101,325 кПа (1 атм) и температуре 298 K
- ↑ стандартная энтропия при температуре 298 K
- ↑ изменение стандартной энергии Гиббса (теплоты образования) при образовании из простых веществ, термодинамически устойчивых при 101,325 кПа (1 атм) и температуре 298 K
- ↑ стандартная изобарная теплоёмкость при температуре 298 K
- ↑ Изменение энтальпии плавления. Данные по Химической энциклопедии с. 593
- ↑ 1 2 3 4 http://www.titanium-chemical.com
- ↑ http://www.titanmet.ru/Pages/News.aspx?action=view&nid=4eeff716-272d-433f-a74d-a6e046c66a86&lang=ru
- ↑ http://www.pure-tio2.com/buy.htm
Wikimedia Foundation.
2010.
 |
|
 |
|
| Имена | |
|---|---|
| Имена ИЮПАК Диоксид титана. Оксид титана (IV) | |
| Другие названия Титания. Рутил. Анатаз. Брукайт | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.033.327 |
| E number | E171 (colours) |
| KEGG |
|
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| Панель управления CompTox (EPA ) |
|
InChI
|
|
SMILES
|
|
| Свойства | |
| Химическая формула | TiO. 2 |
| Молярная масса | 79,866 г / моль |
| Внешний вид | Белое твердое вещество |
| Запах | Без запаха |
| Плотность |
|
| Температура плавления | 1843 ° C (3349 ° F; 2116 K) |
| Точка кипения | 2972 ° C (5382 ° F; 3245 K) |
| Растворимость в воде | Нерастворимый |
| Ширина запрещенной зоны | 3,05 эВ (рутил) |
| Магнитная восприимчивость (χ) | + 5,9 · 10 см / моль |
| Показатель преломления (nD) |
|
| Термохимия | |
| Стандартная молярная. энтропия (S 298) | 50 Дж · моль · K |
| Стандартная энтальпия образования. (ΔfH298) | -945 кДж · mol |
| Опасности | |
| Паспорт безопасности | ICSC 0338 |
| Классификация ЕС (DSD) (устаревшая) | Не указана |
| NFPA 704 (огненный алмаз) |  0 1 0 0 1 0 |
| Температура вспышки | Невоспламеняющийся |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (Допустимо) | TWA 15 мг / м |
| REL (рекомендуется) | Ca |
| IDLH (непосредственная опасность) | Ca [5000 мг / м] |
| Родственные соединения | |
| Другие катионы | Цирконий диоксид. диоксид гафния |
| Родственные оксиды титана оксиды | оксид титана (II). оксид титана (III). |
| родственные соединения | титановая кислота |
| За исключением тех случаев, когда Следует отметить, что данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Диоксид титана, также известный как оксид титана (IV) или титан, встречается в природе оксид из титана, химическая формула TiO. 2. При использовании в качестве пигмента он называется титановый белый, пигментный белый 6 (PW6 ) или . CI 77891. Обычно его получают из ильменита, рутила и анатаза. Он имеет широкий спектр применения, включая краску, солнцезащитный крем и пищевой краситель. При использовании в качестве пищевого красителя имеет номер E E171. Мировое производство в 2014 году превысило 9 миллионов тонн. Было подсчитано, что диоксид титана используется в двух третях всех пигментов, а пигменты на его основе оцениваются в 13,2 миллиарда долларов.
Содержание
- 1 Происшествие
- 2 Производство
- 2.1 Специализированные методы
- 3 Области применения
- 3.1 Пигмент
- 3.2 Тонкие пленки
- 3.3 Солнцезащитный крем и пигменты, блокирующие УФ-излучение
- 3.4 Другие области применения диоксида титана
- 4 Исследования
- 4.1 Фотокатализатор
- 4.1.1 Образование гидроксильных радикалов
- 4.2 Нанотрубки
- 4.1 Фотокатализатор
- 5 Здоровье и безопасность
- 5.1 Экологические отходы
- 5.2 Национальные запреты на диоксид титана в качестве пищевой добавки
- 6 Общая информация
- 7 См. Также
- 8 Ссылки
- 9 Внешние ссылки
Встречаемость
Диоксид титана встречается в природе в виде минералов рутил и анатаз. Кроме того, известны две формы высокого давления: моноклинная бадделеитоподобная форма, известная как акаогиит, а другая — орторомбическая α-PbO 2 -подобная форма, известная как брукит, оба из которых можно найти в кратере Рис в Баварии. В основном добывается из ильменитовой руды. Это самая распространенная форма руды, содержащая диоксид титана, во всем мире. Следующим по распространенности является рутил, содержащий около 98% диоксида титана в руде. Метастабильные фазы анатаза и брукита необратимо превращаются в равновесную фазу рутила при нагревании выше температур в диапазоне 600–800 ° C (1,110–1,470 ° F).
Диоксид титана имеет восемь модификаций — помимо рутила, анатаза, акогиита и брукита, три метастабильные фазы могут быть получены синтетически (моноклинная, тетрагональная и орторомбическая) и пять форм высокого давления (α-PbO 2 -подобные, бадделеитоподобные, котуннитные -подобные, орторомбические OI и кубические фазы) также существуют:
| Форма | Кристаллическая система | Синтез |
|---|---|---|
| Рутил | Тетрагональный | |
| Анатаз | Тетрагональный | |
| Брукит | Орторомбический | |
| TiO 2 (B) | Моноклинный | Гидролиз K 2Ti4O9следует при нагревании |
| TiO 2 (H), голландит -подобная форма | Тетрагональная | Окисление родственной титанатной бронзы калия, K 0,25 TiO 2 |
| TiO 2 (R), рамсделлит -подобная форма | Орторомбическая | Окисление родственного лития м титанат бронза Li 0,5 TiO 2 |
| TiO 2 (II) — (α-PbO 2 -подобная форма) | Орторомбический | |
| Акаогиит (бадделеит -подобная форма, 7 координированных Ti) | Моноклинная | |
| TiO 2 -OI | Орторомбическая | |
| Кубическая форма | Кубический | P>40 ГПа, T>1600 ° C |
| TiO 2 -OII, котуннит (PbCl 2 ) -подобный | Орторомбический | P>40 ГПа, T>700 ° C |
Фаза типа котуннит была заявлена Л. Дубровинским и соавторами как самый твердый из известных оксидов с твердостью по Виккерсу. 38 ГПа и модуль объемной упругости 431 ГПа (т. Е. близка к значению алмаза 446 ГПа) при атмосферном давлении. Однако более поздние исследования пришли к другим выводам с гораздо более низкими значениями как твердости (7–20 ГПа, что делает его более мягким, чем обычные оксиды, такие как корунд Al 2O3и рутил TiO 2), так и объемного модуля ( ~ 300 ГПа).
Оксиды представляют собой коммерчески важные руды титана. Металл также добывают из других руд, таких как ильменит или лейкоксен, или из одной из самых чистых форм — рутилового пляжного песка. Звездчатые сапфиры и рубины получают свой астеризм из-за присутствующих примесей рутила.
Диоксид титана (B) обнаружен как минерал в магматических породах и гидротермальных жилах, а также в каймах выветривания на перовските. TiO 2 также образует пластинки в других минералах.
Расплавленный диоксид титана имеет локальную структуру, в которой каждый Ti координирован в среднем примерно с 5 атомами кислорода. Это отличается от кристаллических форм, в которых Ti координируется с 6 атомами кислорода.

Производство
Развитие мирового производства диоксида титана в соответствии с процессом
Метод производства зависит от исходного сырья. Самый распространенный минеральный источник — ильменит. Обильный минеральный песок рутил можно также очистить с помощью хлоридного процесса или других процессов. Ильменит превращается в диоксид титана пигментной чистоты либо сульфатным, либо хлоридным способом. Как сульфатный, так и хлоридный процессы производят пигмент диоксида титана в кристаллической форме рутила, но сульфатный процесс можно отрегулировать для получения формы анатаза. Анатаз, будучи более мягким, используется в волокнах и бумаге. Сульфатный процесс выполняется как периодический процесс ; Хлоридный процесс осуществляется как непрерывный процесс.
. Заводы, использующие сульфатный процесс, требуют ильменитовый концентрат (45-60% TiO 2) или предварительно обработанное сырье в качестве подходящего источника титана. В сульфатном процессе ильменит обрабатывают серной кислотой для извлечения пентагидрата сульфата железа (II). Полученный синтетический рутил дополнительно обрабатывается в соответствии со спецификациями конечного пользователя, то есть сорт пигмента или иным образом. В другом способе производства синтетического рутила из ильменита процесс Бехера сначала окисляется ильменит как средство отделения железного компонента.
Альтернативный процесс, известный как хлоридный процесс, превращает ильменит или другие источники титана в тетрахлорид титана посредством реакции с элементарным хлором, который является затем очищают перегонкой и реагируют с кислородом для регенерации хлора и получения диоксида титана. Пигмент на основе диоксида титана может быть также получен из исходного сырья с более высоким содержанием титана, такого как обогащенный шлак, рутил и лейкоксен, посредством хлоридно-кислотного процесса.
Пять крупнейших переработчиков пигмента TiO. 2представлены Chemours, Cristal Global, Venator, Kronos и Tronox, который является крупнейшим в 2019 году. Основными конечными пользователями диоксида титана пигментных марок являются компании Akzo Nobel, PPG Industries, Sherwin Williams, BASF, Kansai Paints и Valspar. Мировой спрос на пигмент TiO. 2в 2010 г. составил 5,3 млн т, при этом ежегодный рост ожидается примерно на 3-4%.
Специализированные методы
Для специальных применений TiO 2 пленки готовятся различными специализированными химическими предприятиями. Золь-гель способы включают гидролиз алкоксидов титана, таких как этоксид титана :
- Ti (OEt) 4 + 2 H 2 O → TiO 2 + 4 EtOH
Эта технология подходит для изготовления пленок. Родственный подход, который также основан на молекулярных прекурсорах, включает химическое осаждение из паровой фазы. В этом случае алкоксид улетучивается, а затем разлагается при контакте с горячей поверхностью:
- Ti (OEt) 4 → TiO 2 + 2 Et 2O
Применения
Наиболее важными областями применения являются краски и лаки, а также бумага и пластмассы, на которые приходится около 80% мирового потребления диоксида титана. Другие применения пигментов, такие как печатные краски, волокна, резина, косметические продукты и продукты питания, составляют еще 8%. Остальное используется для других целей, например, для производства технического чистого титана, стекла и стеклокерамики, электрокерамики, металлических патинов, катализаторов, электрических проводников и химических промежуточных продуктов.
Пигмент
Диоксид титана, впервые произведенный серийно в 1916 году, является наиболее широко используемым белым пигментом из-за его яркости и очень высокого показателя преломления, по которому он уступает лишь некоторым другим материалам (см. список показатели преломления ). Размер кристалла диоксида титана в идеале составляет около 220 нм (измерено с помощью электронного микроскопа), чтобы оптимизировать максимальное отражение видимого света. Оптические свойства готового пигмента очень чувствительны к чистоте. Всего несколько частей на миллион (ppm) некоторых металлов (Cr, V, Cu, Fe, Nb) могут настолько нарушить кристаллическую решетку, что эффект можно будет обнаружить при контроле качества. Примерно 4,6 миллиона тонн пигментного TiO 2 ежегодно используется во всем мире, и ожидается, что это число будет увеличиваться по мере дальнейшего роста использования.
TiO 2 также является эффективным глушитель в форме порошка, где он используется в качестве пигмента для придания белизны и непрозрачности таким продуктам, как краски, покрытия, пластмассы, бумага, чернила, продукты, лекарства (т.е. пилюли и таблетки) и многое другое зубные пасты. В красках его часто небрежно называют «ярко-белый», «идеальный белый», «самый белый белый» или другими подобными терминами. Непрозрачность улучшается за счет оптимального размера частиц диоксида титана.
TiO 2 отмечен как возможно канцерогенный. В 2019 году он присутствовал в двух третях зубных паст на французском рынке. Бруно Ле Мэр, министр в правительстве Эдуарда Филиппа, пообещал в марте 2019 года удалить его из этого и других пищевых потребителей.
Тонкие пленки
При осаждении в виде тонкой пленки ее показатель преломления и цвет делают ее превосходным отражающим оптическим покрытием для диэлектрических зеркал ; он также используется для создания декоративных тонких пленок, таких как «мистический огненный топаз».
Некоторые марки модифицированных пигментов на основе титана, которые используются в блестящих красках, пластмассах, отделках и косметике — это искусственные пигменты, частицы которых содержат два или более слоев различных оксидов — часто диоксида титана, железа оксид или оксид алюминия — для получения блестящих, переливающихся и / / перламутровых эффектов, подобных измельченной слюде или продукты на основе гуанина. В дополнение к этим эффектам в некоторых составах возможно ограниченное изменение цвета в зависимости от того, как и под каким углом освещается готовый продукт, а также от толщины оксидного слоя в частице пигмента; один или несколько цветов появляются из-за отражения, в то время как другие тона появляются из-за интерференции прозрачных слоев диоксида титана. В некоторых продуктах слой диоксида титана выращивают вместе с оксидом железа путем прокаливания солей титана (сульфатов, хлоратов) при температуре около 800 ° C. Одним из примеров перламутрового пигмента является ириодин на основе слюды, покрытой диоксидом титана или железом (III) оксида.
Радужный эффект в этих частицах оксида титана отличается от эффекта непрозрачности, полученного с помощью обычного измельченного пигмента оксида титана, полученного при добыче полезных ископаемых, в этом случае учитывается только определенный диаметр частицы, и эффект обусловлен только к рассыпанию.
Солнцезащитный крем и пигменты, блокирующие УФ-лучи
В косметических и средствах по уходу за кожей диоксид титана используется в качестве пигмента, солнцезащитного крема и загуститель. В качестве солнцезащитного крема используется ультратонкий TiO 2, который отличается тем, что в сочетании с ультратонким оксидом цинка считается эффективным солнцезащитным кремом, который менее вреден для кораллов. рифы, чем солнцезащитные кремы, содержащие химические вещества, такие как оксибензон и октиноксат.
Наноразмерный диоксид титана содержится в большинстве физических солнцезащитных кремов из-за его сильного поглощения УФ-света способность и его устойчивость к изменению цвета под ультрафиолетовым светом. Это преимущество повышает его стабильность и способность защищать кожу от ультрафиолета. Наноразмерные (размер частиц 20–40 нм) частицы диоксида титана в основном используются в солнцезащитных лосьонах, поскольку они рассеивают видимый свет гораздо меньше, чем пигменты диоксида титана, и могут обеспечить защиту от ультрафиолета. Солнцезащитные кремы, предназначенные для младенцев или людей с чувствительной кожей, часто основаны на диоксиде титана и / или оксиде цинка, поскольку считается, что эти минеральные блокаторы УФ-излучения вызывают меньшее раздражение кожи, чем другие химические вещества, поглощающие УФ-излучение.. Nano-TiO 2 блокирует как УФ-А, так и УФ-В излучение, которое используется в солнцезащитных кремах и других косметических продуктах. Он безопасен в использовании и лучше для окружающей среды, чем органические поглотители ультрафиолета.
TiO. 2широко используется в пластмассах и других областях в качестве белого пигмента или глушителя, а также благодаря своим свойствам устойчивости к ультрафиолету там, где порошок рассеивает свет — в отличие от органических поглотителей ультрафиолета — и уменьшает повреждение ультрафиолетом, в основном из-за высокого показателя преломления частиц.
Другие применения диоксида титана
В керамических глазури, диоксид титана действует как помутнение и образование зародышей кристаллов.
Используется как пигмент татуировки и в кровоостанавливающих карандашах. Диоксид титана производится с различными размерами частиц, диспергируется в масле и воде, а также в некоторых сортах для косметической промышленности.
Research
Фотокатализатор
Наноразмерный диоксид титана, особенно в форме анатаза, проявляет фотокаталитическую активность при ультрафиолетовом (УФ) облучении. Сообщается, что эта фотоактивность наиболее выражена в плоскостях {001} анатаза, хотя плоскости {101} термодинамически более стабильны и, следовательно, более заметны в большинстве синтезируемых и природных анатазов, о чем свидетельствует часто наблюдаемая тетрагональная дипирамидная привычка роста. Также считается, что границы раздела между рутилом и анатазом улучшают фотокаталитическую активность за счет облегчения разделения носителей заряда, и в результате двухфазный диоксид титана часто считается обладающим улучшенными функциональными возможностями в качестве фотокатализатора. Сообщалось, что диоксид титана, когда он легирован ионами азота или легированным оксидом металла, таким как триоксид вольфрама, проявляет возбуждение также в видимом свете. Сильный окислительный потенциал положительных дырок окисляет воду с образованием гидроксильных радикалов. Он также может напрямую окислять кислород или органические материалы. Следовательно, помимо использования в качестве пигмента, диоксид титана может быть добавлен к краскам, цементу, окнам, плитке или другим продуктам из-за его стерилизующих, дезодорирующих и противообрастающих свойств и используется в качестве гидролиза катализатор. Он также используется в сенсибилизированных красителем солнечных элементах, которые представляют собой химический солнечный элемент (также известный как элемент Гретцеля).
Фотокаталитические свойства наноразмерного диоксида титана были обнаружены Акирой Фудзисимой в 1967 году и опубликованы в 1972 году. Процесс на поверхности диоксида титана был назван эффектом Хонда-Фудзисимы. (ja: 本 多 — 藤 嶋 効果 ). Диоксид титана в форме тонкой пленки и наночастиц имеет потенциал для использования в производстве энергии: в качестве фотокатализатора он может расщеплять воду на водород и кислород. Собранный водород можно использовать в качестве топлива. Эффективность этого процесса можно значительно повысить, допируя оксид углеродом. Дальнейшая эффективность и долговечность были получены за счет внесения беспорядка в решеточную структуру поверхностного слоя нанокристаллов диоксида титана, позволяющего поглощать инфракрасное излучение. Активный в видимом свете наноразмерный анатаз и рутил были разработаны для фотокаталитических применений.
В 1995 году Фудзисима и его группа обнаружили явление супергидрофильности стекла, покрытого диоксидом титана, подвергающегося воздействию солнечного света. Это привело к разработке самоочищающегося стекла и антизапотевающих покрытий.
Наноразмерный TiO 2, включенный в наружные строительные материалы, такие как брусчатка в блоках noxer или краски, может существенно снизить концентрацию переносимых по воздуху загрязнителей, таких как летучие вещества. органические соединения и оксиды азота. Цемент, в котором в качестве фотокаталитического компонента используется диоксид титана, произведенный Italcementi Group, был включен в список 50 лучших изобретений 2008 года журнала Time Magazine.
Были предприняты попытки фотокаталитической минерализации загрязняющих веществ ( для преобразования в CO 2 и H 2 O) в сточных водах. TiO 2 предлагает большой потенциал в качестве промышленной технологии для детоксикации или восстановления сточных вод из-за нескольких факторов:
- В процессе используются естественный кислород и солнечный свет и, следовательно, происходит в условиях окружающей среды; он является селективным по длине волны и ускоряется УФ-светом.
- Фотокатализатор недорогой, легко доступный, нетоксичный, химически и механически стабильный и имеет высокую текучесть.
- Образование фотоциклизированных частиц. промежуточные продукты, в отличие от методов прямого фотолиза, исключаются.
- Окисление субстратов до CO 2 завершено.
- TiO 2 могут быть нанесены в виде тонких пленок на подходящие подложки реактора, которые можно легко отделить от очищенной воды.
Фотокаталитическое разрушение органического вещества также используется в фотокаталитических антимикробных покрытиях, которые обычно тонкие пленки, наносимые на мебель в больницах и другие поверхности, подверженные загрязнению бактериями, грибками и вирусами.
Образование гидроксильных радикалов
Хотя наноразмерный анатаз TiO 2 не поглощает видимый свет, он сильно поглощает ультрафиолетовое (УФ) излучение (hv), что приводит к образованию гидроксильных радикалов. Это происходит, когда фотоиндуцированные дырки валентных связей (h vb) захватываются на поверхности TiO 2, что приводит к образованию захваченных дырок (h tr) которые не могут окислять воду.
- TiO 2 + hv → e + h vb
- hvb→ h tr
- O2+ e → O 2
- O2+ O 2 + 2 H → H 2O2+ O 2
- O2+ h vb → O 2
- O2+ h tr → O 2
- OH + h vb → HO •
- e + h tr → рекомбинация
- Примечание: длина волны (λ) = 387 нм Было обнаружено, что эта реакция минерализует и разлагает нежелательные соединения в окружающей среды, в частности воздуха и сточных вод.
Синтетические монокристаллы TiO 2, ок. Размер 2–3 мм, вырезанный из большей пластины.
Нанотрубки


Анатаз можно преобразовать в неорганические нанотрубки и нанопроволоки. Полые нановолокна TiO 2 могут быть также получены путем покрытия углеродных нановолокон путем предварительного нанесения бутоксида титана.

Здоровье и безопасность
Диоксид титана несовместим с сильными восстановителями и сильными кислотами. Бурные или раскаленные реакции происходят с расплавленными металлами, которые электроположительны, например алюминий, кальций, магний, калий, натрий, цинк и литий.
Во многих солнцезащитных кремах используются наночастицы диоксида титана (вместе с наночастицами оксида цинка), который, несмотря на сообщения о потенциальном риске для здоровья, на самом деле не всасывается через кожу. Другие эффекты наночастиц диоксида титана на здоровье человека недостаточно изучены.
Пыль диоксида титана при вдыхании классифицирована Международным агентством по изучению рака (IARC) как Канцероген IARC группы 2B, что означает, что он, возможно, канцерогенен для человека. Выводы IARC основаны на открытии того, что высокие концентрации пигментной (порошкообразной) и ультратонкой пыли диоксида титана вызывают рак дыхательных путей у крыс, подвергшихся воздействию ингаляции и интратрахеальной инстилляции. Ряд биологических событий или шагов, которые вызывают рак легких у крыс (например, отложение частиц, нарушение очистки легких, клеточное повреждение, фиброз, мутации и, в конечном итоге, рак), также наблюдались у людей, работающих в пыльной среде. Таким образом, IARC посчитал, что наблюдения рака у животных актуальны для людей, работающих с пылью диоксида титана. Например, рабочие, занимающиеся производством диоксида титана, могут подвергаться воздействию высоких концентраций пыли во время упаковки, измельчения, очистки участка и технического обслуживания, если не будут приняты достаточные меры по борьбе с пылью. Однако проведенные до сих пор исследования на людях не предполагают связи между воздействием диоксида титана на рабочем месте и повышенным риском рака. Была подвергнута критике безопасность использования диоксида титана размером с наночастицы, который может проникать в организм и достигать внутренних органов. Исследования также показали, что наночастицы диоксида титана вызывают воспалительную реакцию и генетические повреждения у мышей. Механизм, посредством которого TiO. 2может вызывать рак, неясен. Молекулярные исследования показывают, что клеточная цитотоксичность из-за TiO. 2возникает в результате взаимодействия между наночастицами TiO. 2и лизосомным отсеком, независимо от известного апоптоз сигнальные пути.
В результате проведенных исследований канцерогенности диоксида титана с разным размером частиц Американский Национальный институт охраны труда рекомендовал два отдельных пределы воздействия. NIOSH рекомендует устанавливать для мелких частиц TiO. 2предел воздействия 2,4 мг / м, а для сверхтонких TiO. 2- предел воздействия 0,3 мг / м, как средневзвешенное по времени концентрации до 10 часов в сутки при 40-часовой рабочей неделе. Эти рекомендации отражают результаты исследовательской литературы, которые показывают, что более мелкие частицы диоксида титана с большей вероятностью представляют канцерогенный риск, чем более крупные частицы диоксида титана.
Есть некоторые свидетельства того, что редкое заболевание синдром желтого ногтя может быть вызвано титаном, имплантированным по медицинским показаниям или употреблением различных продуктов, содержащих диоксид титана.
Такие компании as Mars и Dunkin ‘Donuts отказались от диоксида титана из своих товаров в 2015 году под давлением общественности. Однако Эндрю Мейнард, директор Центра изучения рисков при Мичиганском университете, преуменьшил предполагаемую опасность от использования диоксида титана в пищевых продуктах. Он говорит, что диоксид титана, используемый Dunkin ‘Brands и многими другими производителями продуктов питания, не является новым материалом и не является наноматериалом. Наночастицы обычно меньше 100 нанометров в диаметре, но большинство частиц в диоксиде титана пищевого качества намного больше. Тем не менее, анализ распределения по размерам показал, что партии пищевого TiO₂ всегда содержат наноразмерную фракцию как неизбежный побочный продукт производственных процессов.
Введение экологических отходов
Диоксид титана (TiO₂) в основном попадает в окружающую среду в виде наночастиц через очистные сооружения. Косметические пигменты, включая диоксид титана, попадают в сточные воды, когда продукт смывается в раковину после косметического использования. Попадая на очистные сооружения, пигменты разделяются на осадок сточных вод, который затем может попасть в почву при внесении в почву или распределении по ее поверхности. 99% этих наночастиц оседают на суше, а не в водной среде из-за их удерживания в осадке сточных вод. В окружающей среде наночастицы диоксида титана имеют растворимость от низкой до пренебрежимо малой и, как было показано, стабильны после образования агрегатов частиц в почве и водной среде. В процессе растворения водорастворимые ионы обычно диссоциируют из наночастиц в раствор, когда они термодинамически нестабильны. Растворение TiO 2 увеличивается, когда в почве более высокие уровни растворенного органического вещества и глины. Однако агрегации способствует pH в изоэлектрической точке TiO 2 (pH = 5,8), что делает его нейтральным, а концентрации ионов раствора выше 4,5 мМ.
Национальные запреты на диоксид титана в качестве пищевая добавка
В 2019 году Франция запретила использование диоксида титана в продуктах питания с 2020 года.
Общая информация
Внешний вид ракеты Saturn V окрашен диоксидом титана; это позже позволило астрономам определить, что J002E3 был этапом S-IVB с Аполлона 12, а не астероидом.
См. также
- Delustrant
- Сенсибилизированный красителем солнечный элемент
- Список неорганических пигментов
- Брусчатка с покрытием Noxer, TiO 2, удаляющая из воздуха загрязнители NOx
- Suboxide
- Поверхностные свойства оксидов переходных металлов
- Наночастица диоксида титана
Ссылки
Внешние ссылки
- Международная карта химической безопасности 0338
- «Nano-Oxides, Inc. — нанопорошки, информация LEGIT о диоксиде титана TiO 2» (PDF). Www.nano-oxides.com.
- Карманное руководство NIOSH по Химическая опасность
- Крупнейший дистрибьютор TiO 2 Дистрибьютор в Китае Интервью с председателем Ян Тао на ICOAT.CC.
- «Новые сомнения по поводу карты Америки», bbc.co.uk, 30 июля 2002 г.
- «Диоксид титана классифицируется как потенциально канцерогенный для человека», Канадский центр профессионального здоровья. lth and Safety, август 2006 г. (при вдыхании в виде порошка)
- Описание TiO 2 фотокатализа
- Кристаллические структуры трех форм TiO 2
- «Архитектура Италии. становится зеленым », Элизабетта Поволедо, International Herald Tribune, 22 ноября 2006 г.
- « Конкретный шаг к более чистому воздуху », Бруно Джуссани, BusinessWeek.com, 8 ноября 2006 г.
- Солнцезащитный крем в небе? Отражающие частицы могут бороться с потеплением
- Данные по производству титана и диоксида титана (США и мир)
Диоксид титана, TiO2 — химическое соединение, получаемое из титановой 
Характеристики вещества
Диоксид титана встречается в природе, это минералы: рутил, анатаз, брукит. В основном используют рутил (реже анатаз), из-за более плотной кристаллической решетки, которая обуславливает его более высокие параметры твердости, плотности, стабильности. Рутил выигрывает по показателю преломления и фотохимической активности (она у него более низкая, чем у анатаза).
Из химических свойств TiO2 следует отметить химическую инертность, он вступает в реакцию только с концентрированными кислотами и щелочами. Не растворяется в слабых кислотах и щелочах, за исключением плавиковой кислоты, в органических растворителях, воде. Из физических свойств — способность отсекать УФ-излучение, очень белый цвет мелкодисперсионного порошка. Не имеет вкуса и запаха; не гигроскопичен, не горит, не взрывоопасен, не токсичен.
Применение
Диоксид титана самого высокого качества применяют в виде популярной пищевой добавки E171 для отбеливания пищевых продуктов. Например, двуокисью титана отбеливают филе трески для крабовых палочек. Добавлением в муку среднего качества можно придать ей белизну, характерную для продукта более высокого сорта. E171 добавляют в жевательные резинки, в витамины и таблетки, в белый шоколад, сухое молоко, крем, майонез, мороженое, мясные продукты, такие как, например, шпик и паштеты.

Больше половины всего выпускаемого промышленностью оксида титана идет на производство лакокрасочных материалов, порошковых и водоэмульсионных красок, обладающих высокой светостойкостью, белизной, долговечностью.
TiO2 широко применяется при производстве пластмасс, бумаги, синтетических волокон, линолеума, резин, стекол, керамики, твердых сплавов. Белые рамы пластиковых окон, не желтеющие год за годом, жалюзи и обои, скорее всего, изготовлены с применением титановых белил.
Вреден ли оксид титана?
Время от времени публикуются статьи, пытающиеся поставить под сомнение безопасность диоксида титана в пищевых и косметических продуктах. Сейчас принято считать, что ежедневно вдыхать мелкодисперсионный порошок TiO2, а также употреблять его внутрь в дозах, превышающих 1% веса, вредно. Он может оказывать канцерогенное действие, вызывать заболевания печени и почек.
Тем не менее, пищевая добавка E171 разрешена к применению в РФ и ЕС.
В магазине химических реактивов и лабораторного оборудования «ПраймКемикалсГрупп» можно купить высококачественный диоксид титана, различные химические вещества, посуду, лабораторные приборы по доступным ценам.
ФИЗИКО-ХИМИЧЕСКИЕ И ПОТРЕБИТЕЛЬСКИЕ СВОЙСТВА
диоксида титана, нанодиоксида титана, цветных титановых пигментов
Диоксид титана.
Синонимы:
Титана двуокись, Титана (IV) оксид, Титановый ангидрид, Титана (IV) окись, Titanium dioxide, CI 77891, Pigment white 6, Titanic acid anhydride, Titanium oxide
Высший оксид титана – диоксид – в природе встречается в трех модификациях – минералы рутил, анатаз и брукит, отличающиеся различным кристаллическим строением.
Методы получения разработаны только для диоксида титана со структурой рутила и анатаза.
Диоксид титана – вещество белого цвета, с температурой плавления 1870 °С, не растворим в воде и кислотах. При нагревании окрашивается в желтый цвет, исчезающий после охлаждения.
Основные свойства диоксида титана:
- высокая разбеливающая способность;
- хорошая совместимость с любым пленкообразователем;
- хорошая укрывистость;
- высокая атмосферо- и влагостойкость;
- нетоксичность;
- химическая стойкость.
Эти свойства обусловили сферы его основного применения.
Основные области применения диоксида титана:
- производство лакокрасочных материалов;
- производство пластмасс;
- производство резино-технических изделий (РТИ);
- производство бумаги;
- производство химических волокон и другое.
Большая часть производимого в мире диоксида титана (59%) используется при получении лакокрасочной продукции. Это основной белый пигмент, позволяющий не только получать покрытия разнообразной цветовой гаммы, но и значительно улучшать их свойства.
По своим свойствам в качестве пигмента и наполнителя диоксид титана значительно превосходит цинковые белила, сульфид цинка, литопон. Поэтому среди общего ассортимента применяемых пигментов на его долю приходится 90%.
Диоксид титана довольно дорог и его доля в общей стоимости лакокрасочных материалов (ЛКМ) достигает 10-25%. Поэтому все изготовители лакокрасочной продукции стремятся по возможности сократить использование диоксида титана в рецептурах ЛКМ путем его частичной замены более дешевыми аналогами.
Однако диоксид титана не имеет альтернативы в потреблении этого важнейшего компонента лакокрасочных рецептур.
Диоксид титана является наиболее распространенным белым пигментом в лакокрасочной промышленности. Он находит широкое применение в производстве полиграфических красок, пластических масс, линолеума, резины и других материалов; используется для матирования синтетических и искусственных волокон, в радиотехнической и электронной промышленности, а также во многих других областях народного хозяйства. Непигментные сорта диоксида титана, содержащие незначительное количество примесей и для которых не существенны пигментные свойства, применяются в производстве различных титансодержащих сплавов (марки «специальная» и «легированная»), электродов (марки Т-Э), силикатных эмалей (марки ТСЭ), специальных сортов стекол (марки А-Н).
Нанодиоксид титана
Последние годы отмечены быстро растущим спросом на новый вид продукции — высокочистый нанодиоксид титана, который обладает уникальными фотокаталитическими свойствами и имеет широкие возможности применения в солнечных батареях. Использование нанопорошков диоксида титана снижает стоимость 1 кВт•ч в 5 раз по сравнению с аналогами на основе кремниевых полупроводниковых материалов. Кроме того, нанодиоксид применяют в космической отрасли и производстве специальных пластмасс для защиты от ультрафиолетового излучения, при изготовлении самоочищающихся стекол, фотокатализаторов, электрохромных дисплеев. Способ получения нанодисперсного диоксида титана основан на низкотемпературном (200–500 °С) сжигании очищенного тетрахлорида титана в присутствии катализатора в паровой фазе. В зависимости от условий процесса получают рентгеноаморфный, анатазный или рутильный TiO2. Экспериментальные образцы такого продукта имеют частицы размером от 10 до 20 нм.
Цветные титановые пигменты
Цветные титановые пигменты являются новым продуктом на рынке титановой продукции, однако благодаря своим высокотехнологичным свойствам для данного вида пигментов имеется достаточно устойчивый и широкий рынок. Пигмент отличается высокими показателями укрывистости, атмосферостойкости, цветостойкости, имеет устойчивую окраску светло-кирпичных, коричневато-желтых и бежевых тонов, не содержит токсичных компонентов, может полностью или частично заменить диоксид титана в масляных красках и эмалях соответствующих цветов или использоваться в качестве самостоятельного пигмента-наполнителя.
Двуокись титана пигментная
Пигментная двуокись титана (ГОСТ 9808-84) – синтетический неорганический пигмент белого цвета, анатазной и рутильной форм, получаемый гидролизом растворов сернокислого титана с последующим прокаливанием гидратированной двуокиси титана.
Формула: TiO2.
В зависимости от кристаллической структуры выпускают две формы двуокиси титана: Р – рутильная и А – анатазная. При наличии поверхностной обработки в условной обозначение марки добавляется индекс «0». В зависимости от области применения двуокись титана изготовляют следующих марок: Р-1, Р-02, Р-03, Р-04, Р-05; А-1, А-2, А-01, А-02. Пигментная двуокись титана марки Р-02 предназначается для производства лакокрасочных материалов, в том числе вододисперсионных, с хорошей атмосферостойкостью; пластмасс; искусственных кож; пленочных метериалов.
Пигментная двуокись титана пожаро- и взрывобезопасна, по степени воздействия на организм относится к веществам 4-го класса опасности.
Пигментную двуокись титана хранят в закрытых складских помещениях при температуре окружающей среды от минус 40 до плюс 40 °С. Не допускается хранение в упакованном виде на площадках или под навесом. Допускается хранение продукта, упакованного в мягкие специализированные контейнеры, на открытых площадках. При хранении тару укладывают в штабели высотой не более 3 м на подкладки или деревянные поддоны.
Высокочистый диоксид титана используется в электронной промышленности для производства титанитов ультравысокого качества для поглощения ультрафиолетовых лучей, светочувствительный диоксид титана — для цветного копирования.
ОБЛАСТИ ПРИМЕНЕНИЯ ДИОКСИДА ТИТАНА (включая нанодиоксид титана и цветные титановые пигменты)
Наиболее важное значение из всех неорганических пигментов имеют белые. За рубежом основным белым пигментом является диоксид титана. По оценкам зарубежных экспертов, в настоящее время его доля в суммарном потреблении неорганических пигментов составляет 65-70%, а в потреблении белых пигментов – более 90%.
Ведущая роль диоксида титана в группе белых пигментов обусловлена высоким уровнем свойств, характеризующих этот продукт, – способность диспергироваться, тепло- и химическая стойкость, разбеливающая способность, атмосферостойкость, коэффициент преломления и др.
В качестве пигмента диоксид титана используется в лакокрасочной и целлюлозно-бумажной отраслях промышленности, в производствах пластмасс и резинотехнических изделий.
Диоксид титана — универсальный отбеливатель для применения в пищевой, косметической и фармацевтической промышленности.
Применение в пищевой промышленности: для отбеливания всех сортов рыбного фарша, филе, полуфабрикатов, сурими, паштетов и других продуктов. Диоксид титана так же широко применяется в кондитерской промышленности для придания белизны сахарной глазури, конфетам.
Перечень других областей применения приведен ниже:
- непрозрачный агент;
- косметическое производство;
- радиоактивное обезвреживание кожи;
- производство стекла и керамики;
- эмалевые фритты;
- матирование синтетических волокон;
- печатные краски;
- сварочные стержни;
- высокотемпературные датчики (единичные кристаллы TiO2).
В косметическом производстве используется высокоочищенный и тонкодисперсный диоксид титана, обладающий способностью отражать УФ-лучи.
Относится к неорганическим УФ-фильтрам. Такие УФ-фильтры не вызывают аллергию и не раздражают кожу, однако в составе солнцезащитных средств они могут окрашивать её в белый цвет. Для того чтобы физические УФ-фильтры не были видны на коже, частицы диоксида титана стараются сделать более мелкими. Однако здесь есть свой предел — очень мелкие частицы диоксида титана могут играть роль фотокатализатора, то есть вещества, усиливающего повреждающее действие УФ-излучения. Также, слишком мелкие частички диоксида титана способны накапливаться в кожном покрове. В зависимости от конкретных условий его применяют как наполнитель, как белый пигмент, как фотозащитную добавку в различных изделиях — пудре, тенях для век, губной помаде, антиперспирантах, защитных кремах, На основе диоксида титана получают более совершенные виды косметического сырья, например, перламутровый пигмент (титанированную слюду).
Пигментный диоксид титана является одним из важнейших промышленных неорганических материалов, по уровню потребления которого можно судить об экономическом, научно-техническом потенциале государства и качестве жизни населения.
Спрос на него обусловлен ростом объемов строительства, производства товаров народного потребления, развитием машиностроения и других отраслей экономики, в т. ч. и тех, продукция которых требует нанесения стойких покрытий. В экономически развитых странах на эти цели расходуется до 90-95% TiO2. Потребление пигментного диоксида титана составляет 2-4 кг на душу населения, в России же — только 0,3 кг, причем преимущественно за счет импорта.
В ближайшие годы наиболее высокими темпами будет расти потребление TiO2 в производстве ламинированной бумаги (на 4–6% в год) и пластмасс (4% в год), в лакокрасочной же промышленности — не более 2% в год. Тем не менее, по оценкам европейских экспертов, при изготовлении ЛКМ используется 58–62% мирового выпуска диоксида титана. Как следствие, из производства постепенно вытесняются краски на основе цинка, бария и свинца, среднее содержание в красках которого составляет 25%.
Следует отметить новую и быстро растущую область потребления двуокиси титана — применение его в виде микрочастиц в нанотехнологии, хотя современный мировой объем потребления этих частиц еще не превышает 2 тыс. т.
Принимая во внимание значительные резервы увеличения емкости рынка пигментного TiO2 в Азиатско-Тихоокеанском регионе, а также возможности развития новых областей использования продукта, можно заключить, что этот сегмент мирового рынка имеет хорошие перспективы.
Мировое потребление нанодиоксида титана в 2013 году оценивалось в 2400 тонн в год, 50% из которых шло на производство косметики.