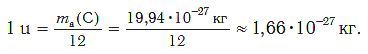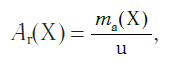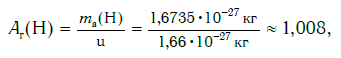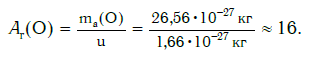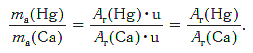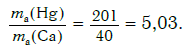В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
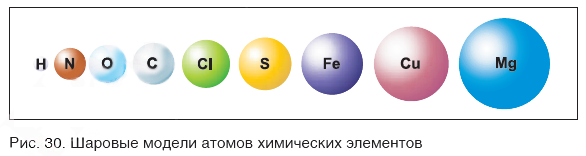
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
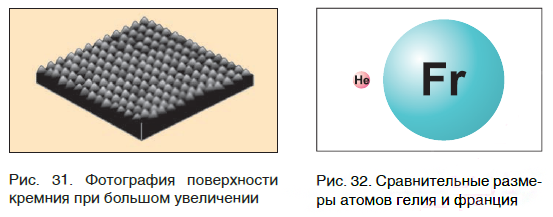
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
а кислорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
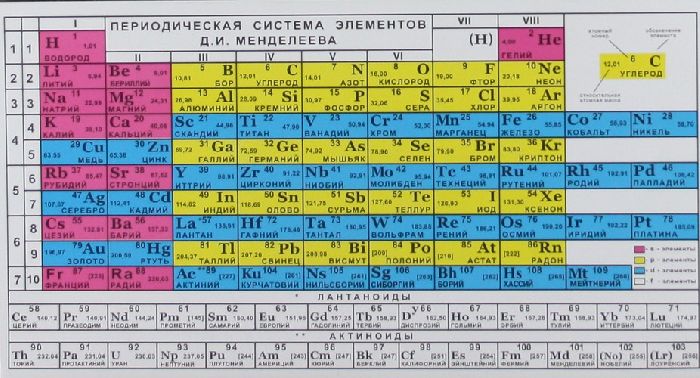
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Атомы химических элементов различаются своими массами. Масса атома обозначается символом
ma
и выражается в единицах массы кг или г.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24
г, а масса атома углерода —
ma(C)=19,94⋅10−24
г.
Использовать такие числа неудобно. Поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
За атомную единицу массы выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u).
Ar(X)=ma(X)1u=ma(X)1,66⋅10−24г
Относительные атомные массы химических элементов приведены в периодической таблице. В расчётах обычно используют их значения, округлённые до целых. Исключение —
Ar(Cl)=
(35,5).
|
Название элемента |
(Ar) |
Название элемента |
(Ar) |
Название элемента |
(Ar) |
| Азот |
(14) |
Железо |
(56) |
Медь |
(64) |
| Алюминий |
(27) |
Иод |
(127) |
Натрий |
(23) |
| Барий |
(137) |
Калий |
(39) |
Сера |
(32) |
| Бром |
(80) |
Кальций |
(40) |
Углерод |
(12) |
| Водород |
(1) |
Кислород |
(16) |
Фосфор |
(31) |
| Гелий |
(4) |
Магний |
(24) |
Хлор |
(35,5) |
From Wikipedia, the free encyclopedia
Relative atomic mass (symbol: Ar; sometimes abbreviated RAM or r.a.m.), also known by the deprecated synonym atomic weight, is a dimensionless physical quantity defined as the ratio of the average mass of atoms of a chemical element in a given sample to the atomic mass constant. The atomic mass constant (symbol: mu) is defined as being 1/12 of the mass of a carbon-12 atom.[1][2] Since both quantities in the ratio are masses, the resulting value is dimensionless; hence the value is said to be relative.
For a single given sample, the relative atomic mass of a given element is the weighted arithmetic mean of the masses of the individual atoms (including their isotopes) that are present in the sample. This quantity can vary substantially between samples because the sample’s origin (and therefore its radioactive history or diffusion history) may have produced unique combinations of isotopic abundances. For example, due to a different mixture of stable carbon-12 and carbon-13 isotopes, a sample of elemental carbon from volcanic methane will have a different relative atomic mass than one collected from plant or animal tissues.
The more common, and more specific quantity known as standard atomic weight (Ar, standard) is an application of the relative atomic mass values obtained from multiple different samples. It is sometimes interpreted as the expected range of the relative atomic mass values for the atoms of a given element from all terrestrial sources, with the various sources being taken from Earth.[3] «Atomic weight» is often loosely and incorrectly used as a synonym for standard atomic weight (incorrectly because standard atomic weights are not from a single sample). Standard atomic weight is nevertheless the most widely published variant of relative atomic mass.
Additionally, the continued use of the term «atomic weight» (for any element) as opposed to «relative atomic mass» has attracted considerable controversy since at least the 1960s, mainly due to the technical difference between weight and mass in physics.[4] Still, both terms are officially sanctioned by the IUPAC. The term «relative atomic mass» now seems to be replacing «atomic weight» as the preferred term, although the term «standard atomic weight» (as opposed to the more correct «standard relative atomic mass») continues to be used.
Definition[edit]
Relative atomic mass is determined by the average atomic mass, or the weighted mean of the atomic masses of all the atoms of a particular chemical element found in a particular sample, which is then compared to the atomic mass of carbon-12.[5] This comparison is the quotient of the two weights, which makes the value dimensionless (having no unit). This quotient also explains the word relative: the sample mass value is considered relative to that of carbon-12.
It is a synonym for atomic weight, though it is not to be confused with relative isotopic mass. Relative atomic mass is also frequently used as a synonym for standard atomic weight and these quantities may have overlapping values if the relative atomic mass used is that for an element from Earth under defined conditions. However, relative atomic mass (atomic weight) is still technically distinct from standard atomic weight because of its application only to the atoms obtained from a single sample; it is also not restricted to terrestrial samples, whereas standard atomic weight averages multiple samples but only from terrestrial sources. Relative atomic mass is therefore a more general term that can more broadly refer to samples taken from non-terrestrial environments or highly specific terrestrial environments which may differ substantially from Earth-average or reflect different degrees of certainty (e.g., in number of significant figures) than those reflected in standard atomic weights.
Current definition[edit]
The prevailing IUPAC definitions (as taken from the «Gold Book») are:
- atomic weight — See: relative atomic mass[6]
and
- relative atomic mass (atomic weight) — The ratio of the average mass of the atom to the unified atomic mass unit.[7]
Here the «unified atomic mass unit» refers to 1⁄12 of the mass of an atom of 12C in its ground state.[8]
The IUPAC definition[1] of relative atomic mass is:
- An atomic weight (relative atomic mass) of an element from a specified source is the ratio of the average mass per atom of the element to 1/12 of the mass of an atom of 12C.
The definition deliberately specifies «An atomic weight…», as an element will have different relative atomic masses depending on the source. For example, boron from Turkey has a lower relative atomic mass than boron from California, because of its different isotopic composition.[9][10] Nevertheless, given the cost and difficulty of isotope analysis, it is common practice to instead substitute the tabulated values of standard atomic weights, which are ubiquitous in chemical laboratories and which are revised biennially by the IUPAC’s Commission on Isotopic Abundances and Atomic Weights (CIAAW).[11]
Historical usage[edit]
Older (pre-1961) historical relative scales based on the atomic mass unit (symbol: a.m.u. or amu) used either the oxygen-16 relative isotopic mass or else the oxygen relative atomic mass (i.e., atomic weight) for reference. See the article on the history of the modern unified atomic mass unit for the resolution of these problems.
Standard atomic weight[edit]
The IUPAC commission CIAAW maintains an expectation-interval value for relative atomic mass (or atomic weight) on Earth named standard atomic weight. Standard atomic weight requires the sources be terrestrial, natural, and stable with regard to radioactivity. Also, there are requirements for the research process. For 84 stable elements, CIAAW has determined this standard atomic weight. These values are widely published and referred to loosely as ‘the’ atomic weight of elements for real-life substances like pharmaceuticals and commercial trade.
Also, CIAAW has published abridged (rounded) values and simplified values (for when the Earthly sources vary systematically).
Other measures of the mass of atoms[edit]
Atomic mass (ma) is the mass of a single atom, with unit Da or u (the dalton). It defines the mass of a specific isotope, which is an input value for the determination of the relative atomic mass. An example for three silicon isotopes is given below.
The relative isotopic mass is specifically the ratio of the mass of a single atom to the mass of a unified atomic mass unit. This value, too, is relative, and therefore dimensionless.
Determination of relative atomic mass[edit]
Modern relative atomic masses (a term specific to a given element sample) are calculated from measured values of atomic mass (for each nuclide) and isotopic composition of a sample. Highly accurate atomic masses are available[12][13] for virtually all non-radioactive nuclides, but isotopic compositions are both harder to measure to high precision and more subject to variation between samples.[14][15] For this reason, the relative atomic masses of the 22 mononuclidic elements (which are the same as the isotopic masses for each of the single naturally occurring nuclides of these elements) are known to especially high accuracy. For example, there is an uncertainty of only one part in 38 million for the relative atomic mass of fluorine, a precision which is greater than the current best value for the Avogadro constant (one part in 20 million).
| Isotope | Atomic mass[13] | Abundance[14] | |
|---|---|---|---|
| Standard | Range | ||
| 28Si | 27.97692653246(194) | 92.2297(7)% | 92.21–92.25% |
| 29Si | 28.976494700(22) | 4.6832(5)% | 4.67–4.69% |
| 30Si | 29.973770171(32) | 3.0872(5)% | 3.08–3.10% |
The calculation is exemplified for silicon, whose relative atomic mass is especially important in metrology. Silicon exists in nature as a mixture of three isotopes: 28Si, 29Si and 30Si. The atomic masses of these nuclides are known to a precision of one part in 14 billion for 28Si and about one part in one billion for the others. However, the range of natural abundance for the isotopes is such that the standard abundance can only be given to about ±0.001% (see table).
The calculation is as follows:
- Ar(Si) = (27.97693 × 0.922297) + (28.97649 × 0.046832) + (29.97377 × 0.030872) = 28.0854
The estimation of the uncertainty is complicated,[16] especially as the sample distribution is not necessarily symmetrical: the IUPAC standard relative atomic masses are quoted with estimated symmetrical uncertainties,[17] and the value for silicon is 28.0855(3). The relative standard uncertainty in this value is 1×10–5 or 10 ppm.
Apart from this uncertainty by measurement, some elements have variation over sources. That is, different sources (ocean water, rocks) have a different radioactive history and so different isotopic composition. To reflect this natural variability, the IUPAC made the decision in 2010 to list the standard relative atomic masses of 10 elements as an interval rather than a fixed number.[18]
See also[edit]
- Possolo, Antonio; van der Veen, Adriaan M.H.; Meija, Juris; Brynn Hibbert, D. (2018-01-04). «Interpreting and propagating the uncertainty of the standard atomic weights (IUPAC Technical Report)». Pure and Applied Chemistry. 90 (2): 395–424. doi:10.1515/pac-2016-0402. S2CID 145931362. Retrieved 2019-02-08.
- International Union of Pure and Applied Chemistry (IUPAC)
- Commission on Isotopic Abundances and Atomic Weights (CIAAW)
References[edit]
- ^ a b International Union of Pure and Applied Chemistry (1980). «Atomic Weights of the Elements 1979» (PDF). Pure Appl. Chem. 52 (10): 2349–84. doi:10.1351/pac198052102349.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 41. Electronic version.
- ^ Definition of element sample
- ^ de Bièvre, Paul; Peiser, H. Steffen (1992). «‘Atomic Weight’ — The Name, Its History, Definition, and Units» (PDF). Pure and Applied Chemistry. 64 (10): 1535–43. doi:10.1351/pac199264101535.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «relative atomic mass». doi:10.1351/goldbook.R05258
- ^ IUPAC Gold Book — atomic weight
- ^ IUPAC Gold Book — relative atomic mass (atomic weight), A r
- ^ IUPAC Gold Book — unified atomic mass unit
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 21, 160. ISBN 978-0-08-022057-4.
- ^ International Union of Pure and Applied Chemistry (2003). «Atomic Weights of the Elements: Review 2000» (PDF). Pure Appl. Chem. 75 (6): 683–800. doi:10.1351/pac200375060683. S2CID 96800435.
- ^ IUPAC Gold Book — standard atomic weights
- ^ National Institute of Standards and Technology. Atomic Weights and Isotopic Compositions for All Elements.
- ^ a b Wapstra, A.H.; Audi, G.; Thibault, C. (2003), The AME2003 Atomic Mass Evaluation (Online ed.), National Nuclear Data Center. Based on:
- Wapstra, A.H.; Audi, G.; Thibault, C. (2003), «The AME2003 atomic mass evaluation (I)», Nuclear Physics A, 729: 129–336, Bibcode:2003NuPhA.729..129W, doi:10.1016/j.nuclphysa.2003.11.002
- Audi, G.; Wapstra, A.H.; Thibault, C. (2003), «The AME2003 atomic mass evaluation (II)», Nuclear Physics A, 729: 337–676, Bibcode:2003NuPhA.729..337A, doi:10.1016/j.nuclphysa.2003.11.003
- ^ a b Rosman, K. J. R.; Taylor, P. D. P. (1998), «Isotopic Compositions of the Elements 1997» (PDF), Pure and Applied Chemistry, 70 (1): 217–35, doi:10.1351/pac199870010217
- ^ Coplen, T. B.; et al. (2002), «Isotopic Abundance Variations of Selected Elements» (PDF), Pure and Applied Chemistry, 74 (10): 1987–2017, doi:10.1351/pac200274101987
- ^ Meija, Juris; Mester, Zoltán (2008). «Uncertainty propagation of atomic weight measurement results». Metrologia. 45 (1): 53–62. Bibcode:2008Metro..45…53M. doi:10.1088/0026-1394/45/1/008. S2CID 122229901.
- ^ Holden, Norman E. (2004). «Atomic Weights and the International Committee—A Historical Review». Chemistry International. 26 (1): 4–7.
- ^ «Changes to the Periodic Table». Archived from the original on 2019-07-15.
External links[edit]
- IUPAC Commission on Isotopic Abundances and Atomic Weights
- NIST relative atomic masses of all isotopes and the standard atomic weights of the elements
- Standard Atomic Weights
From Wikipedia, the free encyclopedia
Relative atomic mass (symbol: Ar; sometimes abbreviated RAM or r.a.m.), also known by the deprecated synonym atomic weight, is a dimensionless physical quantity defined as the ratio of the average mass of atoms of a chemical element in a given sample to the atomic mass constant. The atomic mass constant (symbol: mu) is defined as being 1/12 of the mass of a carbon-12 atom.[1][2] Since both quantities in the ratio are masses, the resulting value is dimensionless; hence the value is said to be relative.
For a single given sample, the relative atomic mass of a given element is the weighted arithmetic mean of the masses of the individual atoms (including their isotopes) that are present in the sample. This quantity can vary substantially between samples because the sample’s origin (and therefore its radioactive history or diffusion history) may have produced unique combinations of isotopic abundances. For example, due to a different mixture of stable carbon-12 and carbon-13 isotopes, a sample of elemental carbon from volcanic methane will have a different relative atomic mass than one collected from plant or animal tissues.
The more common, and more specific quantity known as standard atomic weight (Ar, standard) is an application of the relative atomic mass values obtained from multiple different samples. It is sometimes interpreted as the expected range of the relative atomic mass values for the atoms of a given element from all terrestrial sources, with the various sources being taken from Earth.[3] «Atomic weight» is often loosely and incorrectly used as a synonym for standard atomic weight (incorrectly because standard atomic weights are not from a single sample). Standard atomic weight is nevertheless the most widely published variant of relative atomic mass.
Additionally, the continued use of the term «atomic weight» (for any element) as opposed to «relative atomic mass» has attracted considerable controversy since at least the 1960s, mainly due to the technical difference between weight and mass in physics.[4] Still, both terms are officially sanctioned by the IUPAC. The term «relative atomic mass» now seems to be replacing «atomic weight» as the preferred term, although the term «standard atomic weight» (as opposed to the more correct «standard relative atomic mass») continues to be used.
Definition[edit]
Relative atomic mass is determined by the average atomic mass, or the weighted mean of the atomic masses of all the atoms of a particular chemical element found in a particular sample, which is then compared to the atomic mass of carbon-12.[5] This comparison is the quotient of the two weights, which makes the value dimensionless (having no unit). This quotient also explains the word relative: the sample mass value is considered relative to that of carbon-12.
It is a synonym for atomic weight, though it is not to be confused with relative isotopic mass. Relative atomic mass is also frequently used as a synonym for standard atomic weight and these quantities may have overlapping values if the relative atomic mass used is that for an element from Earth under defined conditions. However, relative atomic mass (atomic weight) is still technically distinct from standard atomic weight because of its application only to the atoms obtained from a single sample; it is also not restricted to terrestrial samples, whereas standard atomic weight averages multiple samples but only from terrestrial sources. Relative atomic mass is therefore a more general term that can more broadly refer to samples taken from non-terrestrial environments or highly specific terrestrial environments which may differ substantially from Earth-average or reflect different degrees of certainty (e.g., in number of significant figures) than those reflected in standard atomic weights.
Current definition[edit]
The prevailing IUPAC definitions (as taken from the «Gold Book») are:
- atomic weight — See: relative atomic mass[6]
and
- relative atomic mass (atomic weight) — The ratio of the average mass of the atom to the unified atomic mass unit.[7]
Here the «unified atomic mass unit» refers to 1⁄12 of the mass of an atom of 12C in its ground state.[8]
The IUPAC definition[1] of relative atomic mass is:
- An atomic weight (relative atomic mass) of an element from a specified source is the ratio of the average mass per atom of the element to 1/12 of the mass of an atom of 12C.
The definition deliberately specifies «An atomic weight…», as an element will have different relative atomic masses depending on the source. For example, boron from Turkey has a lower relative atomic mass than boron from California, because of its different isotopic composition.[9][10] Nevertheless, given the cost and difficulty of isotope analysis, it is common practice to instead substitute the tabulated values of standard atomic weights, which are ubiquitous in chemical laboratories and which are revised biennially by the IUPAC’s Commission on Isotopic Abundances and Atomic Weights (CIAAW).[11]
Historical usage[edit]
Older (pre-1961) historical relative scales based on the atomic mass unit (symbol: a.m.u. or amu) used either the oxygen-16 relative isotopic mass or else the oxygen relative atomic mass (i.e., atomic weight) for reference. See the article on the history of the modern unified atomic mass unit for the resolution of these problems.
Standard atomic weight[edit]
The IUPAC commission CIAAW maintains an expectation-interval value for relative atomic mass (or atomic weight) on Earth named standard atomic weight. Standard atomic weight requires the sources be terrestrial, natural, and stable with regard to radioactivity. Also, there are requirements for the research process. For 84 stable elements, CIAAW has determined this standard atomic weight. These values are widely published and referred to loosely as ‘the’ atomic weight of elements for real-life substances like pharmaceuticals and commercial trade.
Also, CIAAW has published abridged (rounded) values and simplified values (for when the Earthly sources vary systematically).
Other measures of the mass of atoms[edit]
Atomic mass (ma) is the mass of a single atom, with unit Da or u (the dalton). It defines the mass of a specific isotope, which is an input value for the determination of the relative atomic mass. An example for three silicon isotopes is given below.
The relative isotopic mass is specifically the ratio of the mass of a single atom to the mass of a unified atomic mass unit. This value, too, is relative, and therefore dimensionless.
Determination of relative atomic mass[edit]
Modern relative atomic masses (a term specific to a given element sample) are calculated from measured values of atomic mass (for each nuclide) and isotopic composition of a sample. Highly accurate atomic masses are available[12][13] for virtually all non-radioactive nuclides, but isotopic compositions are both harder to measure to high precision and more subject to variation between samples.[14][15] For this reason, the relative atomic masses of the 22 mononuclidic elements (which are the same as the isotopic masses for each of the single naturally occurring nuclides of these elements) are known to especially high accuracy. For example, there is an uncertainty of only one part in 38 million for the relative atomic mass of fluorine, a precision which is greater than the current best value for the Avogadro constant (one part in 20 million).
| Isotope | Atomic mass[13] | Abundance[14] | |
|---|---|---|---|
| Standard | Range | ||
| 28Si | 27.97692653246(194) | 92.2297(7)% | 92.21–92.25% |
| 29Si | 28.976494700(22) | 4.6832(5)% | 4.67–4.69% |
| 30Si | 29.973770171(32) | 3.0872(5)% | 3.08–3.10% |
The calculation is exemplified for silicon, whose relative atomic mass is especially important in metrology. Silicon exists in nature as a mixture of three isotopes: 28Si, 29Si and 30Si. The atomic masses of these nuclides are known to a precision of one part in 14 billion for 28Si and about one part in one billion for the others. However, the range of natural abundance for the isotopes is such that the standard abundance can only be given to about ±0.001% (see table).
The calculation is as follows:
- Ar(Si) = (27.97693 × 0.922297) + (28.97649 × 0.046832) + (29.97377 × 0.030872) = 28.0854
The estimation of the uncertainty is complicated,[16] especially as the sample distribution is not necessarily symmetrical: the IUPAC standard relative atomic masses are quoted with estimated symmetrical uncertainties,[17] and the value for silicon is 28.0855(3). The relative standard uncertainty in this value is 1×10–5 or 10 ppm.
Apart from this uncertainty by measurement, some elements have variation over sources. That is, different sources (ocean water, rocks) have a different radioactive history and so different isotopic composition. To reflect this natural variability, the IUPAC made the decision in 2010 to list the standard relative atomic masses of 10 elements as an interval rather than a fixed number.[18]
See also[edit]
- Possolo, Antonio; van der Veen, Adriaan M.H.; Meija, Juris; Brynn Hibbert, D. (2018-01-04). «Interpreting and propagating the uncertainty of the standard atomic weights (IUPAC Technical Report)». Pure and Applied Chemistry. 90 (2): 395–424. doi:10.1515/pac-2016-0402. S2CID 145931362. Retrieved 2019-02-08.
- International Union of Pure and Applied Chemistry (IUPAC)
- Commission on Isotopic Abundances and Atomic Weights (CIAAW)
References[edit]
- ^ a b International Union of Pure and Applied Chemistry (1980). «Atomic Weights of the Elements 1979» (PDF). Pure Appl. Chem. 52 (10): 2349–84. doi:10.1351/pac198052102349.
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 41. Electronic version.
- ^ Definition of element sample
- ^ de Bièvre, Paul; Peiser, H. Steffen (1992). «‘Atomic Weight’ — The Name, Its History, Definition, and Units» (PDF). Pure and Applied Chemistry. 64 (10): 1535–43. doi:10.1351/pac199264101535.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «relative atomic mass». doi:10.1351/goldbook.R05258
- ^ IUPAC Gold Book — atomic weight
- ^ IUPAC Gold Book — relative atomic mass (atomic weight), A r
- ^ IUPAC Gold Book — unified atomic mass unit
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 21, 160. ISBN 978-0-08-022057-4.
- ^ International Union of Pure and Applied Chemistry (2003). «Atomic Weights of the Elements: Review 2000» (PDF). Pure Appl. Chem. 75 (6): 683–800. doi:10.1351/pac200375060683. S2CID 96800435.
- ^ IUPAC Gold Book — standard atomic weights
- ^ National Institute of Standards and Technology. Atomic Weights and Isotopic Compositions for All Elements.
- ^ a b Wapstra, A.H.; Audi, G.; Thibault, C. (2003), The AME2003 Atomic Mass Evaluation (Online ed.), National Nuclear Data Center. Based on:
- Wapstra, A.H.; Audi, G.; Thibault, C. (2003), «The AME2003 atomic mass evaluation (I)», Nuclear Physics A, 729: 129–336, Bibcode:2003NuPhA.729..129W, doi:10.1016/j.nuclphysa.2003.11.002
- Audi, G.; Wapstra, A.H.; Thibault, C. (2003), «The AME2003 atomic mass evaluation (II)», Nuclear Physics A, 729: 337–676, Bibcode:2003NuPhA.729..337A, doi:10.1016/j.nuclphysa.2003.11.003
- ^ a b Rosman, K. J. R.; Taylor, P. D. P. (1998), «Isotopic Compositions of the Elements 1997» (PDF), Pure and Applied Chemistry, 70 (1): 217–35, doi:10.1351/pac199870010217
- ^ Coplen, T. B.; et al. (2002), «Isotopic Abundance Variations of Selected Elements» (PDF), Pure and Applied Chemistry, 74 (10): 1987–2017, doi:10.1351/pac200274101987
- ^ Meija, Juris; Mester, Zoltán (2008). «Uncertainty propagation of atomic weight measurement results». Metrologia. 45 (1): 53–62. Bibcode:2008Metro..45…53M. doi:10.1088/0026-1394/45/1/008. S2CID 122229901.
- ^ Holden, Norman E. (2004). «Atomic Weights and the International Committee—A Historical Review». Chemistry International. 26 (1): 4–7.
- ^ «Changes to the Periodic Table». Archived from the original on 2019-07-15.
External links[edit]
- IUPAC Commission on Isotopic Abundances and Atomic Weights
- NIST relative atomic masses of all isotopes and the standard atomic weights of the elements
- Standard Atomic Weights
Относительная атомная и молекулярная массы

4.6
Средняя оценка: 4.6
Всего получено оценок: 1182.
4.6
Средняя оценка: 4.6
Всего получено оценок: 1182.
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а. е. м.). Относительная молекулярная масса складывается из относительных атомных масс веществ.
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).
Как видно, эти два понятия имеют несколько общих характеристик:
- относительная атомная и молекулярная массы вещества – безразмерные величины;
- относительная атомная масса имеет обозначение Ar, молекулярная – Mr;
- единица измерения одинакова в обоих случаях – а. е. м.
Молярная и молекулярная массы совпадают численно, но отличаются по размерности. Молярная масса – это отношение массы вещества к количеству молей. Она отражает массу одного моля, который равен числу Авогадро, т.е. 6,02 ⋅ 1023. Например, 1 моль воды весит 18 г/моль, а Mr(Н2О) = 18 а. е. м. (тяжелее в 18 раз одной атомной единицы массы).
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10−24 г. Следовательно, формула относительной атомной массы имеет следующий вид:
Ar(X) = ma(X) / 1,66⋅10−24,
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
Ar = ΣAr,ini,
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа – 16О,17О, 18О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Ar = 15,995 ∙ 0,99759 + 16,999 ∙ 0,00037 + 17,999 ∙ 0,00204 = 15,999 а.е.м.
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Относительная молекулярная масса – сумма масс атомов вещества:
Mr = ΣAr.
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Mr = 1 ∙ 2 + 12 + 16 ∙ 3 = 62 а. е. м.
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Что мы узнали?
Из урока 8 класса узнали об относительной атомной и молекулярной массе. За единицу относительной атомной массы принята 1/12 часть массы углерода, равная 1,66⋅10−24 г. Для вычисления массы необходимо абсолютную атомную массу вещества разделить на атомную единицу массы (а. е. м.). Значение относительной атомной массы указано в периодической системе Менделеева в каждой клетке элемента. Молекулярная масса вещества складывается из суммы относительных атомных масс элементов.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Захар Харитонов
10/10
-
Александр Котков
10/10
-
Евгения Медникова
10/10
-
Александр Котков
10/10
-
Сергей Ефремов
9/10
-
Сергей Макаров
10/10
-
Вася Загайнов
9/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 1182.
А какая ваша оценка?