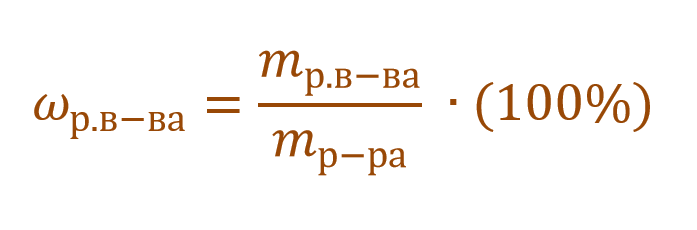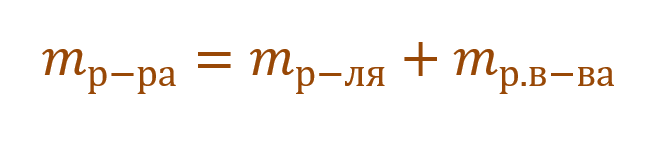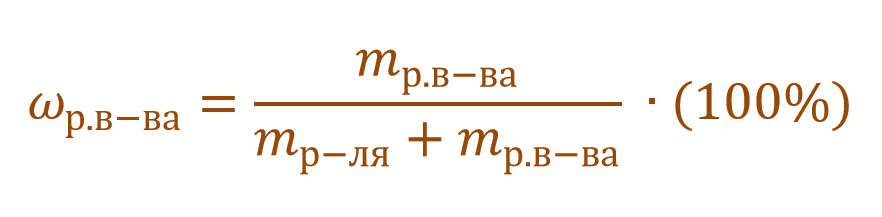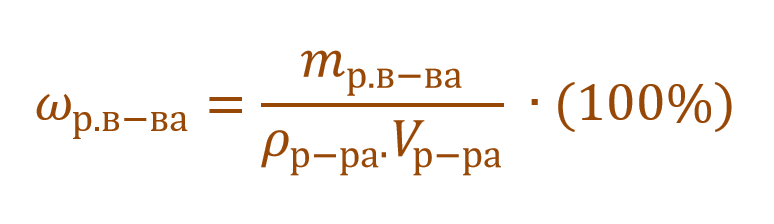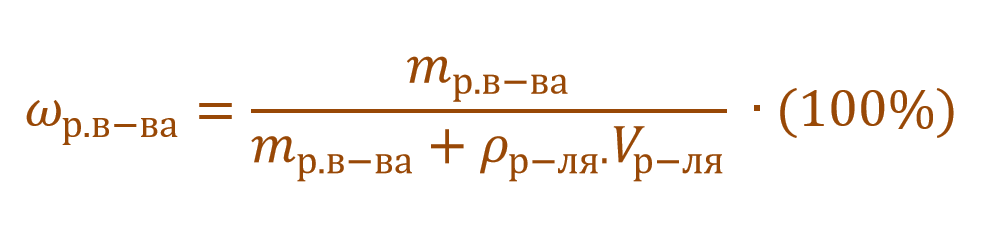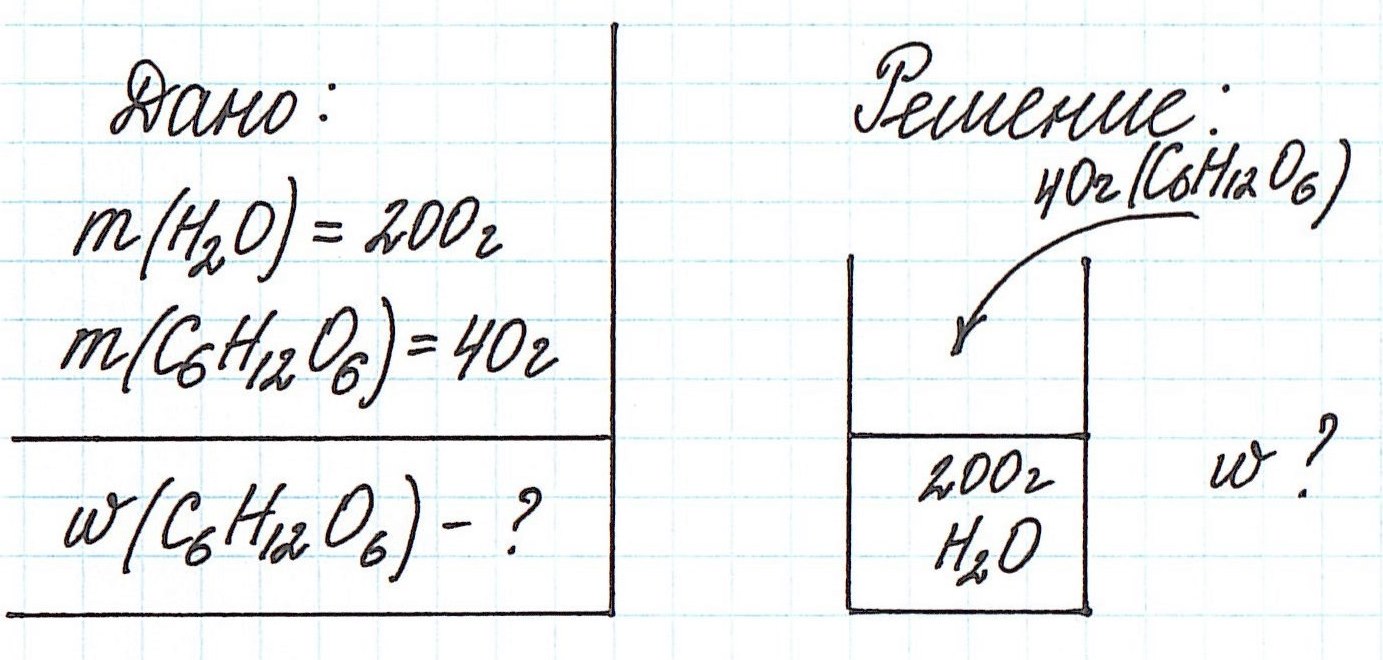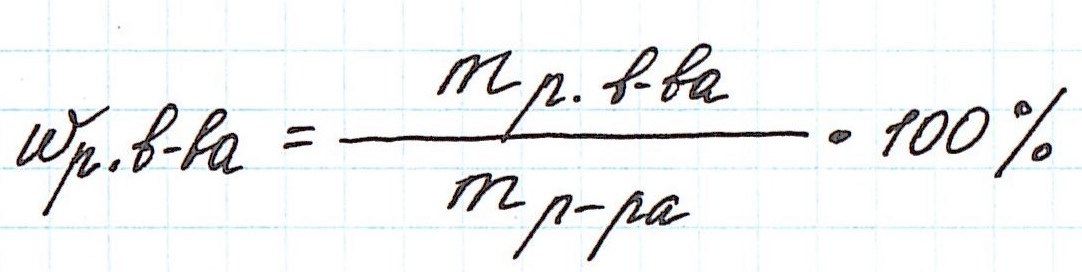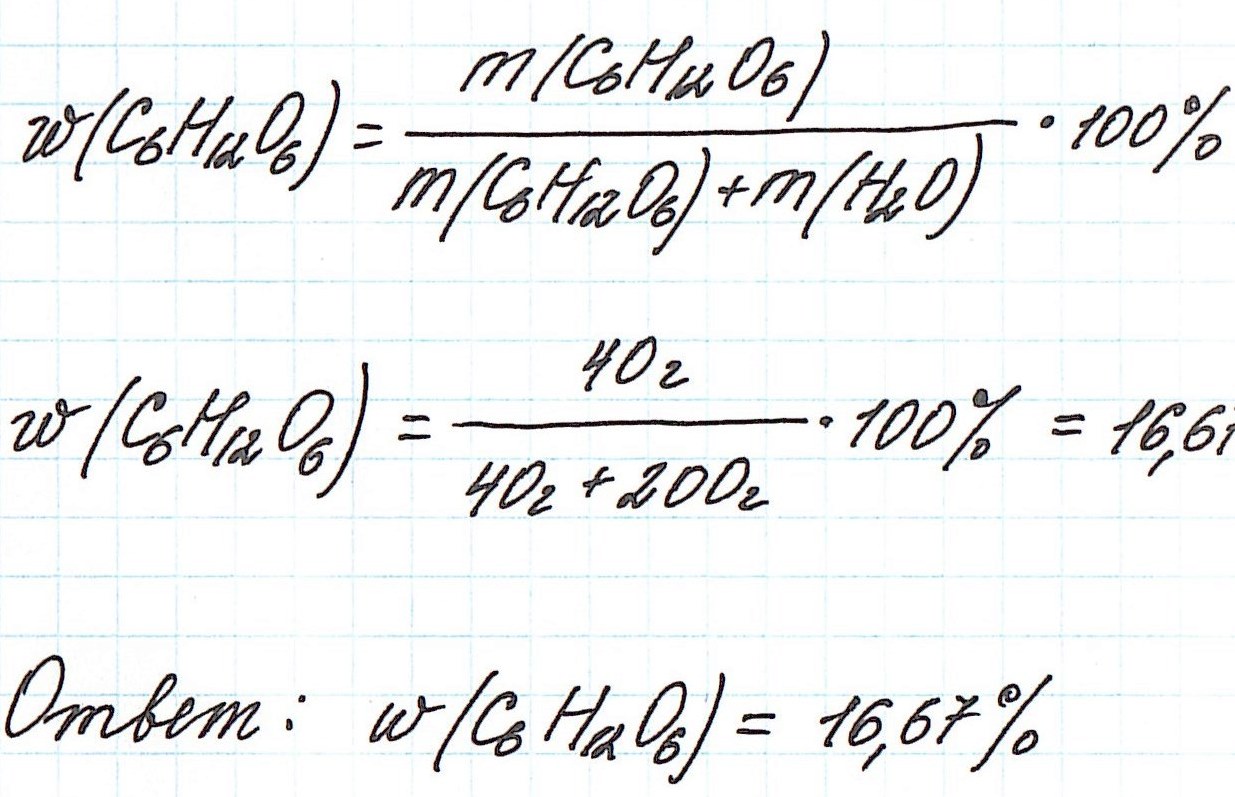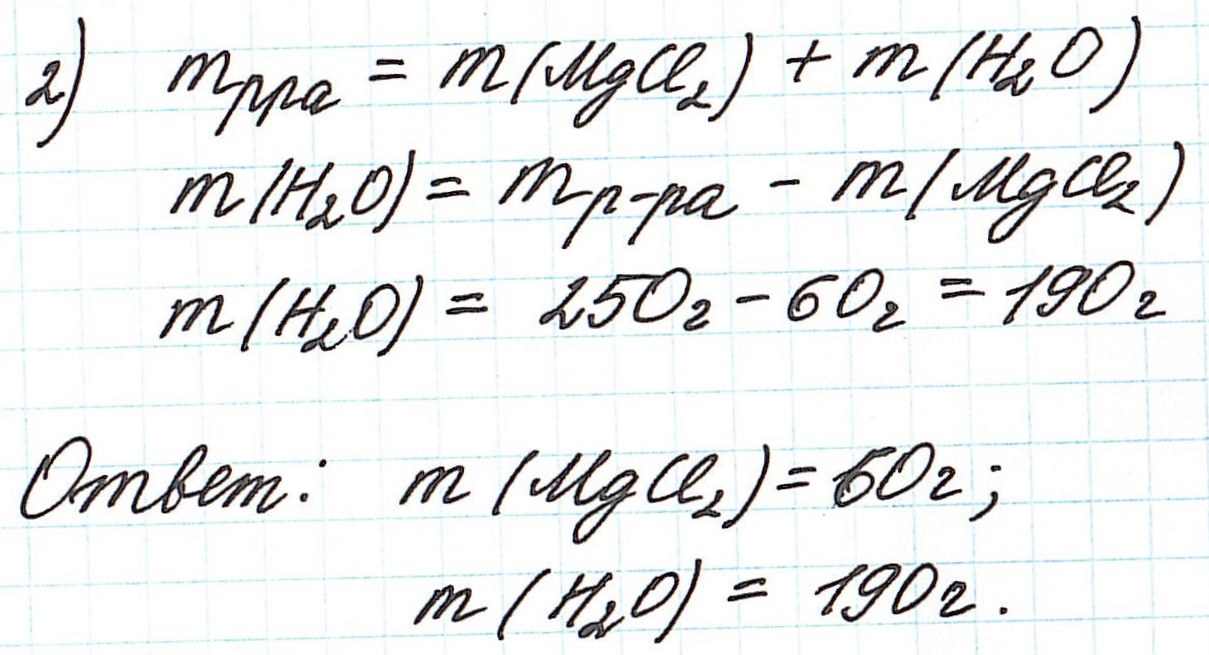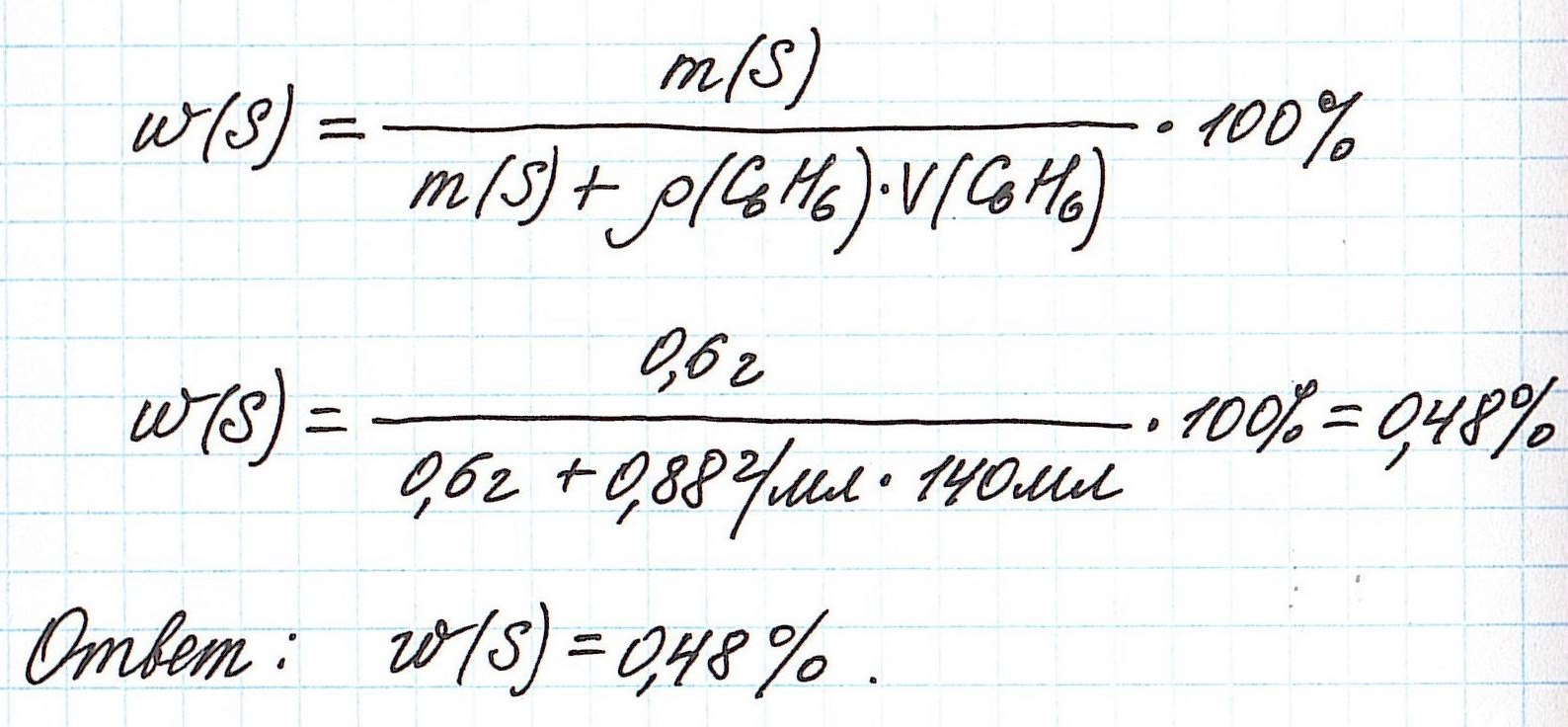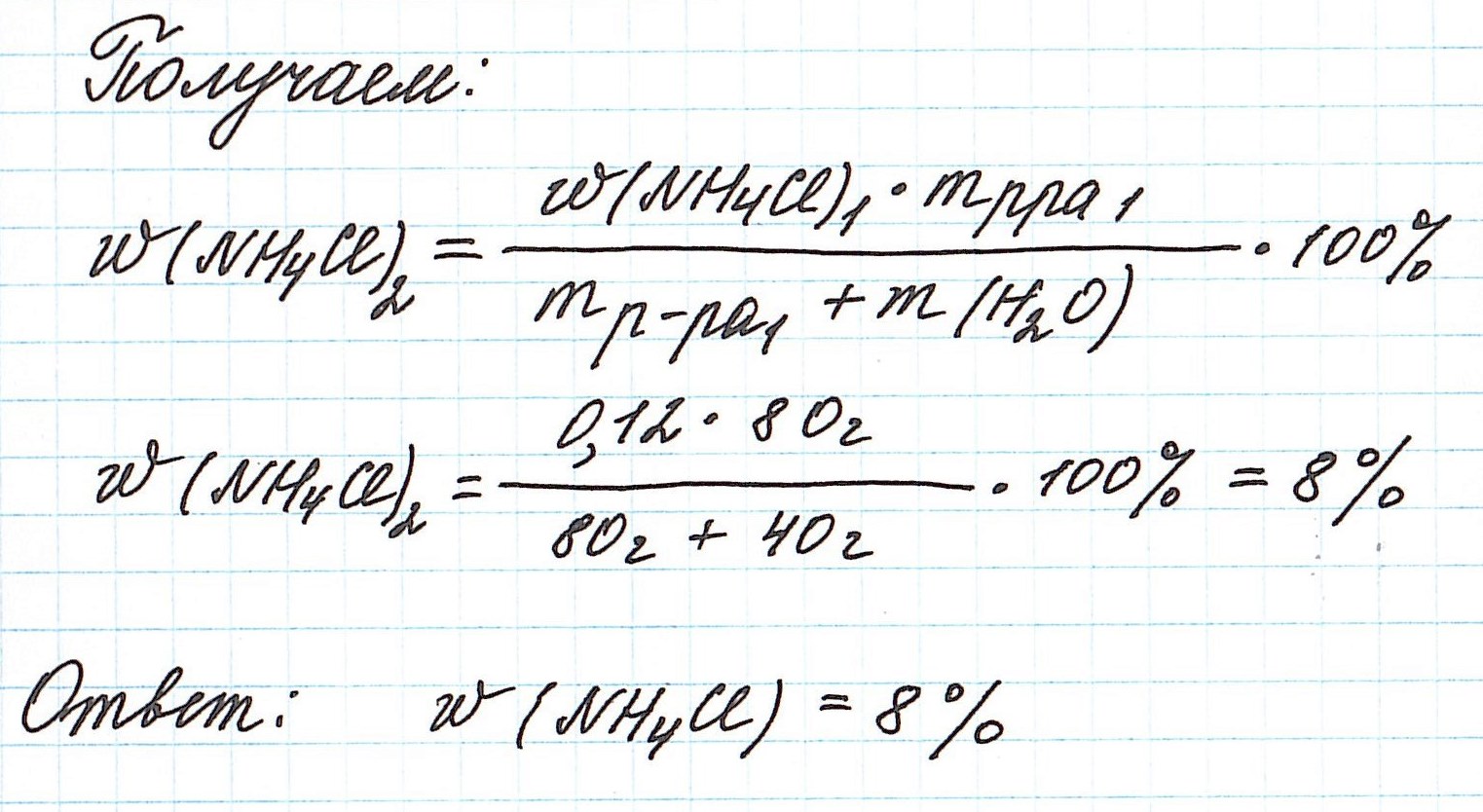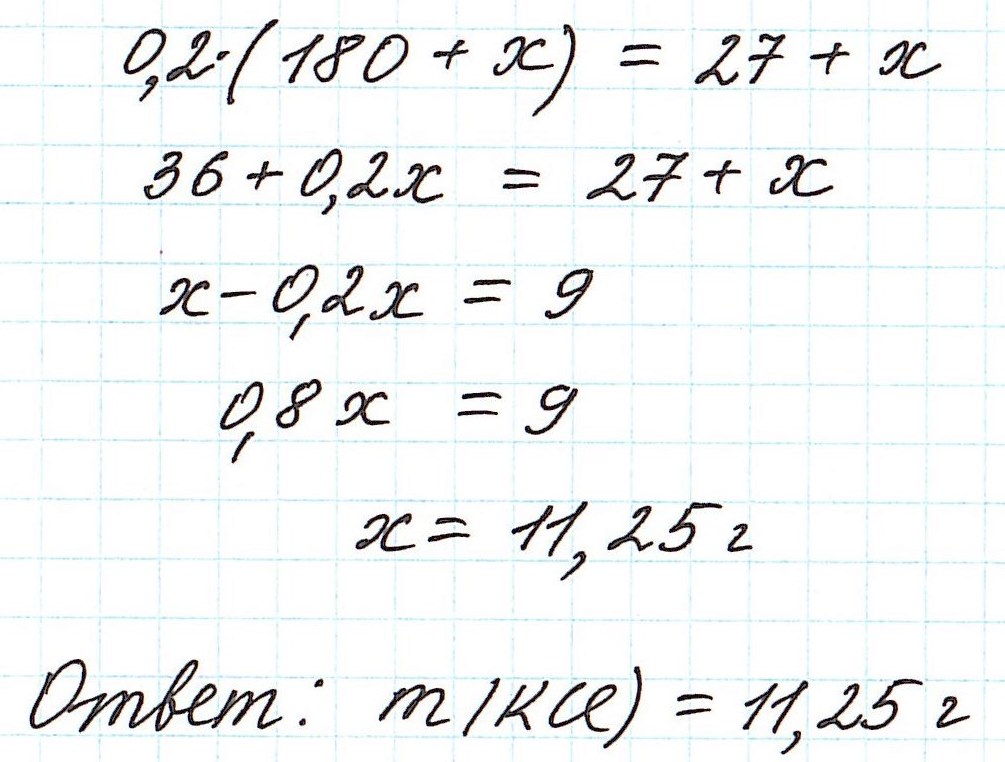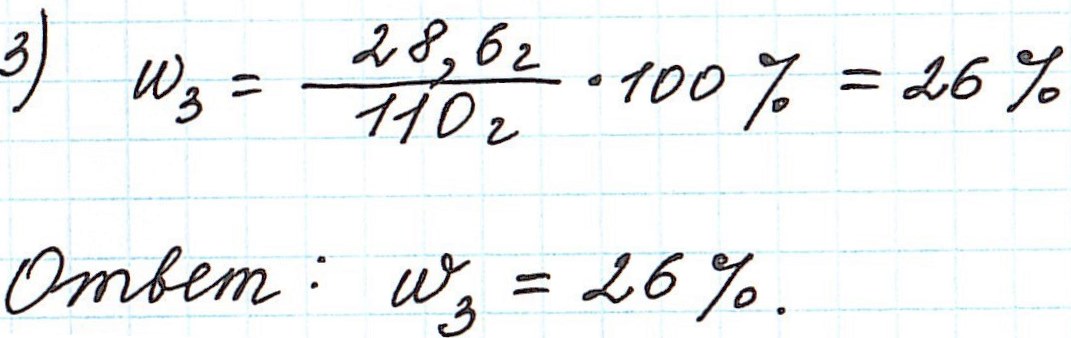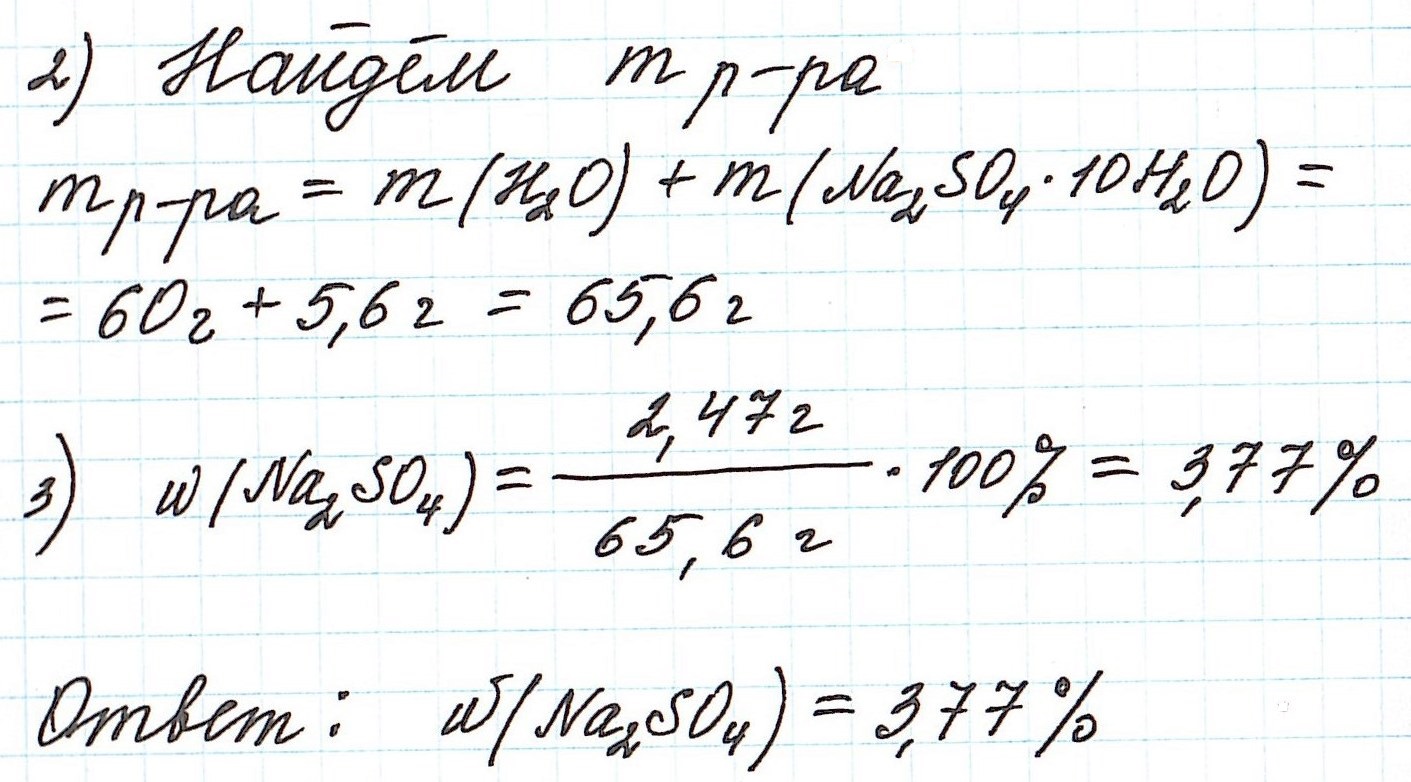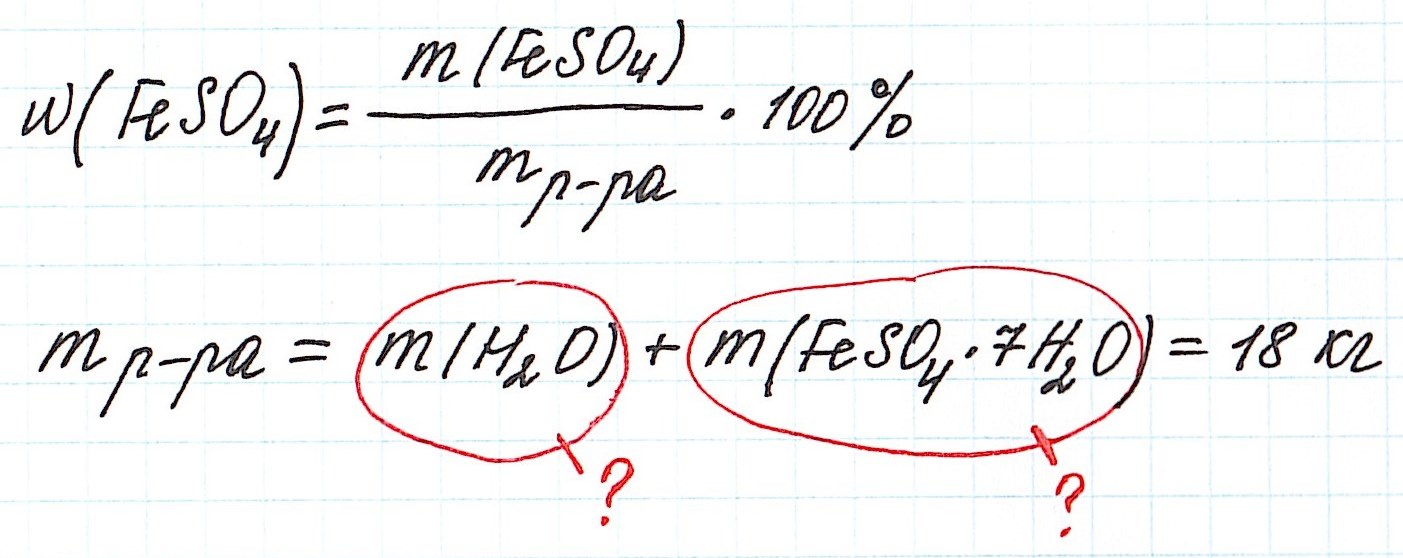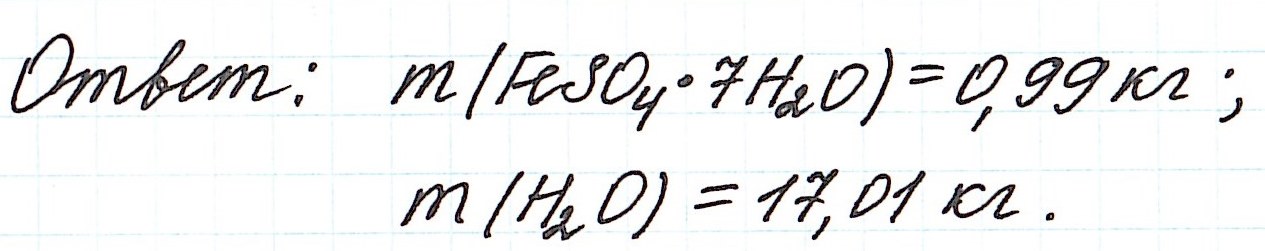…
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
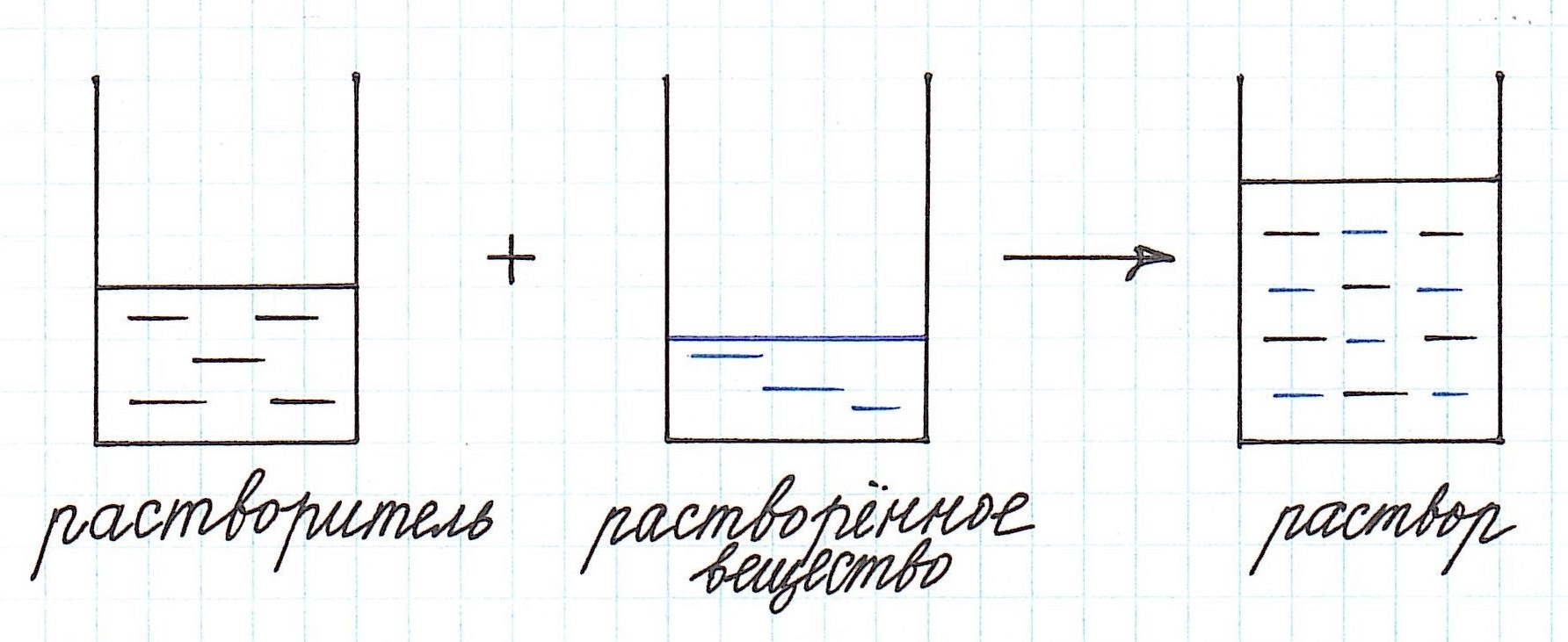
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
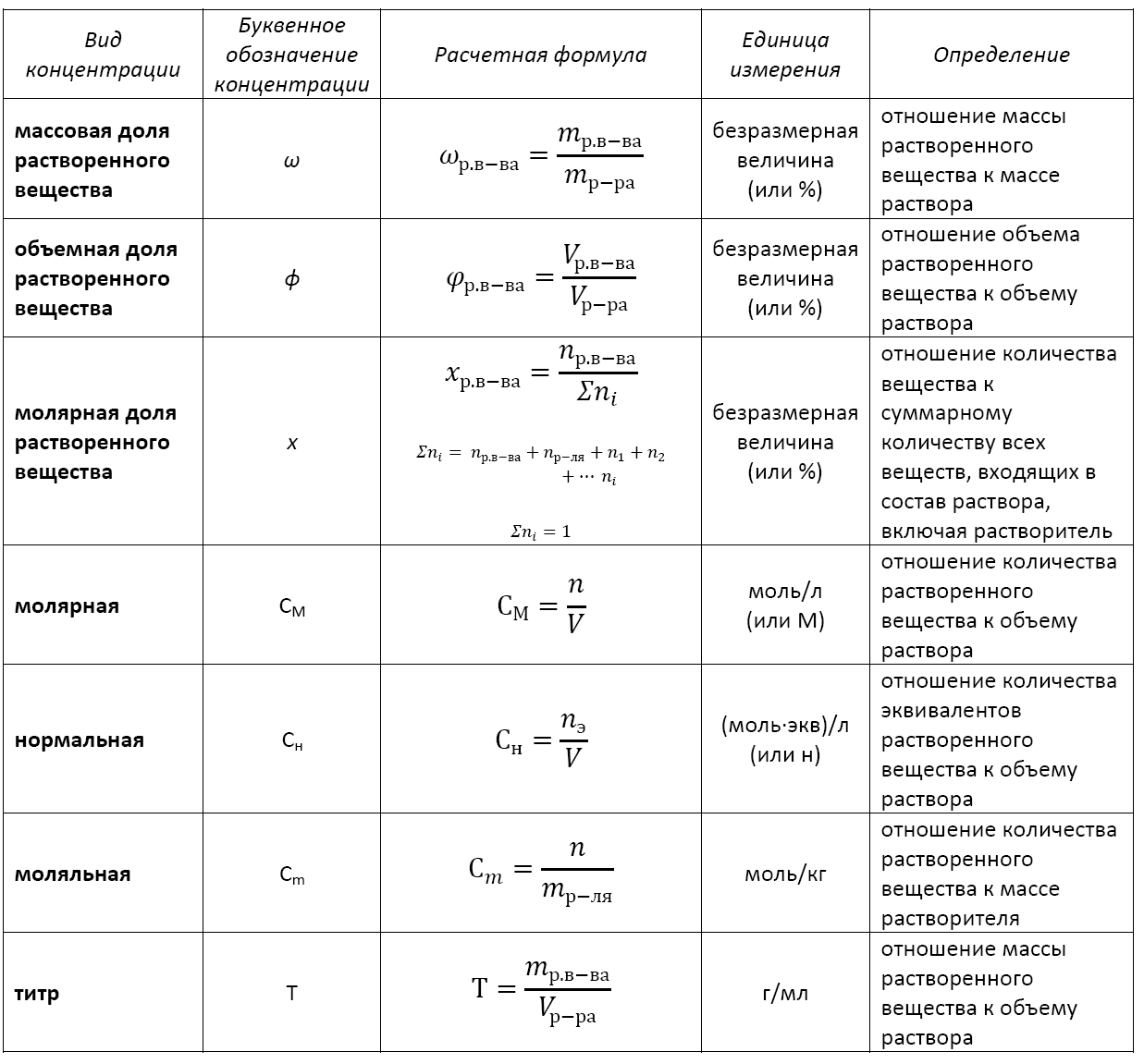
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) =
56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв·
М(FeSO4) = 1/2·152
= 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029
= 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) =
0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е.
воды в растворе равна:
mH2O = 2,06-0,0412
= 2,02 кг
b
(FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
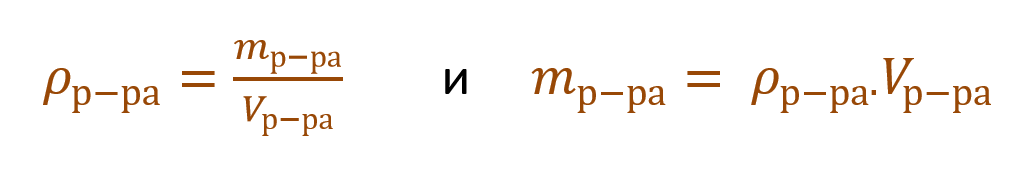
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
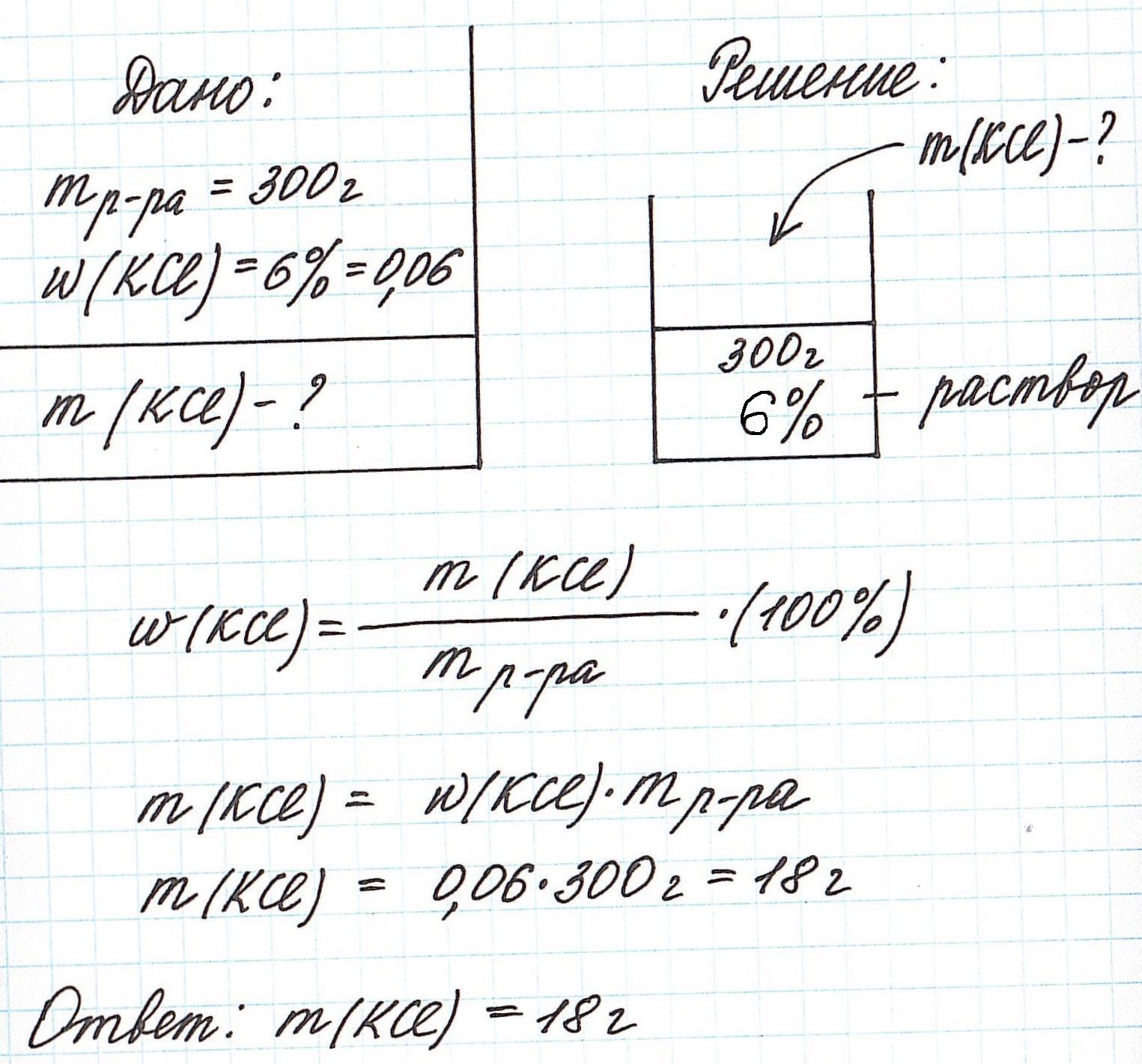
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
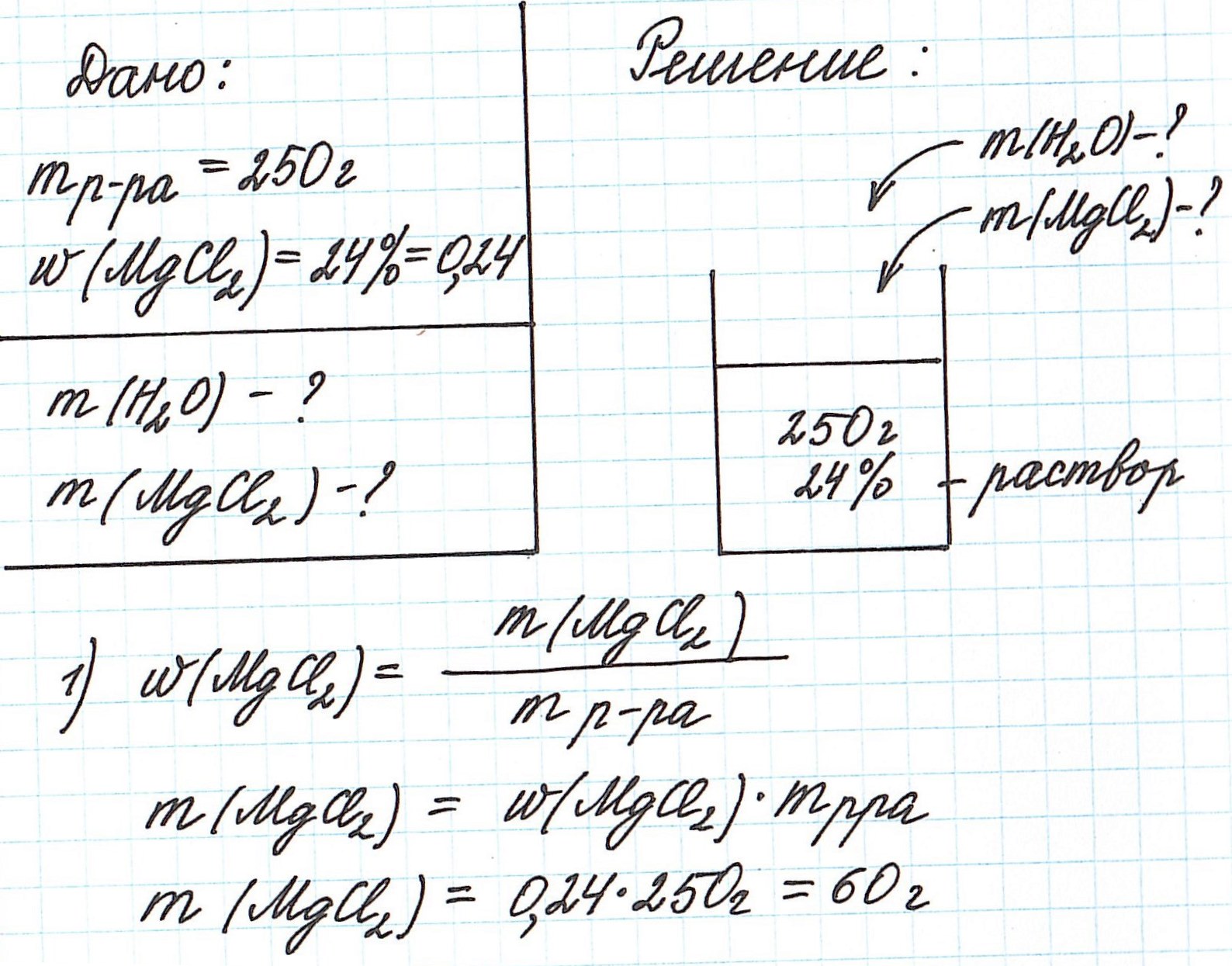
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
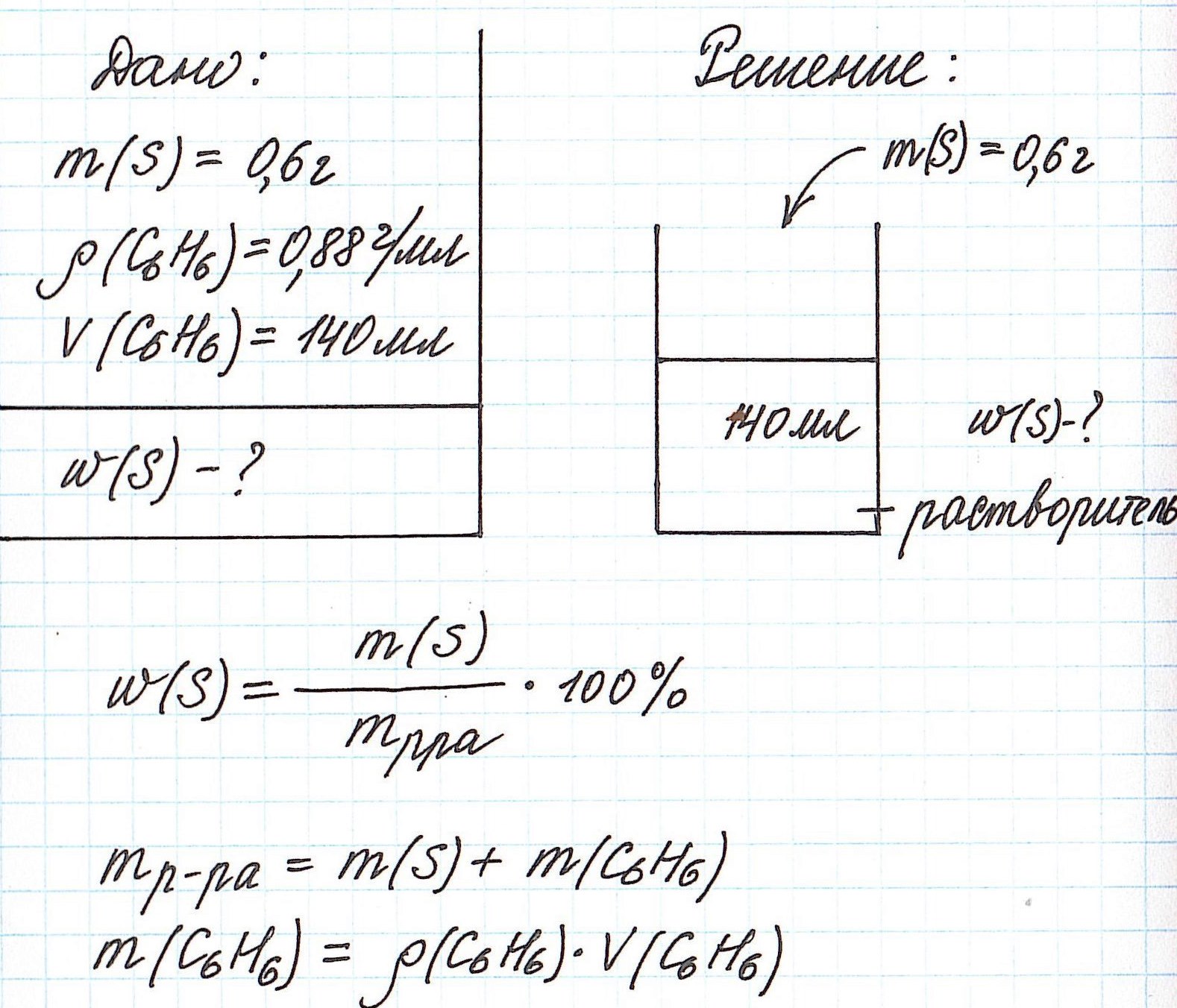
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
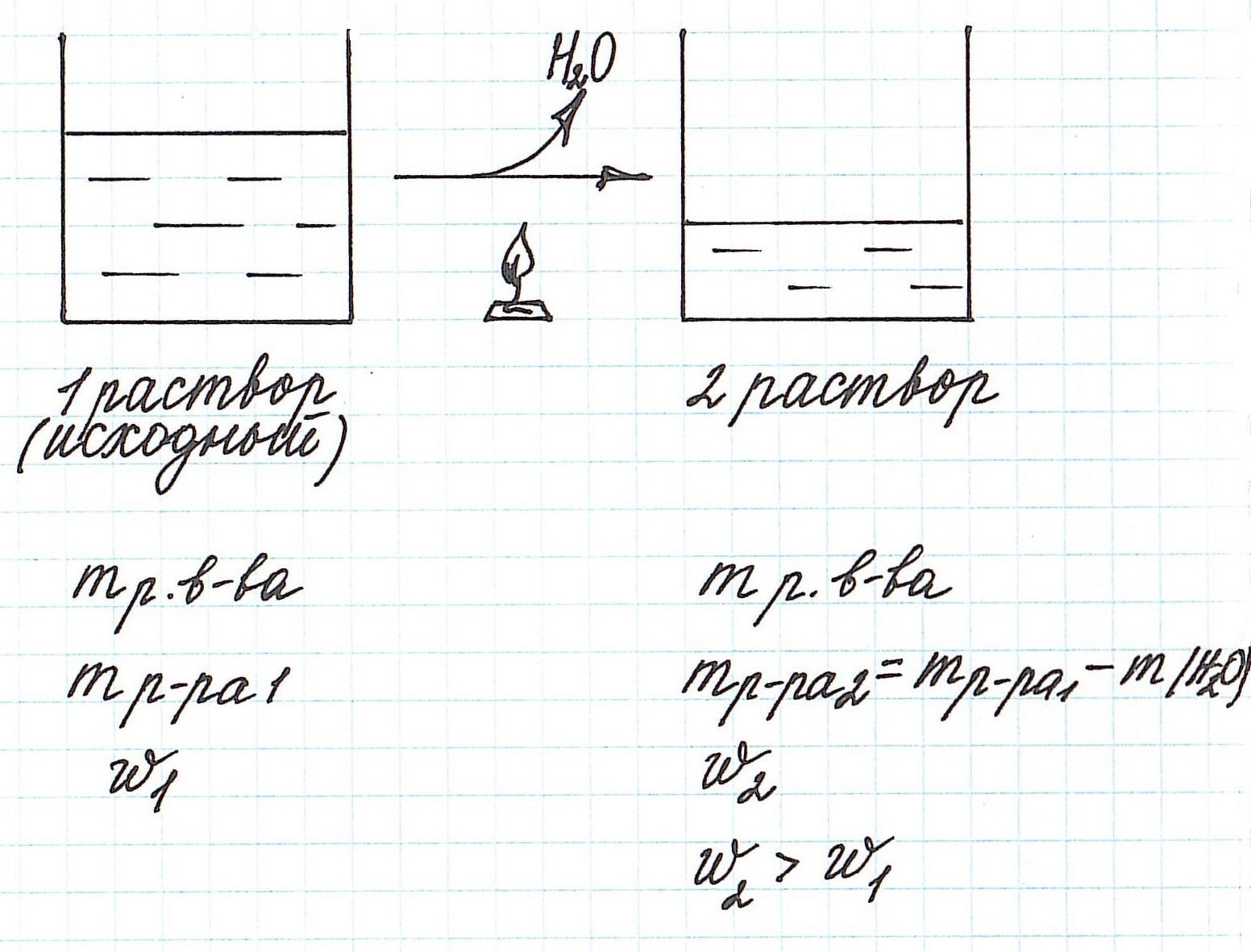
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
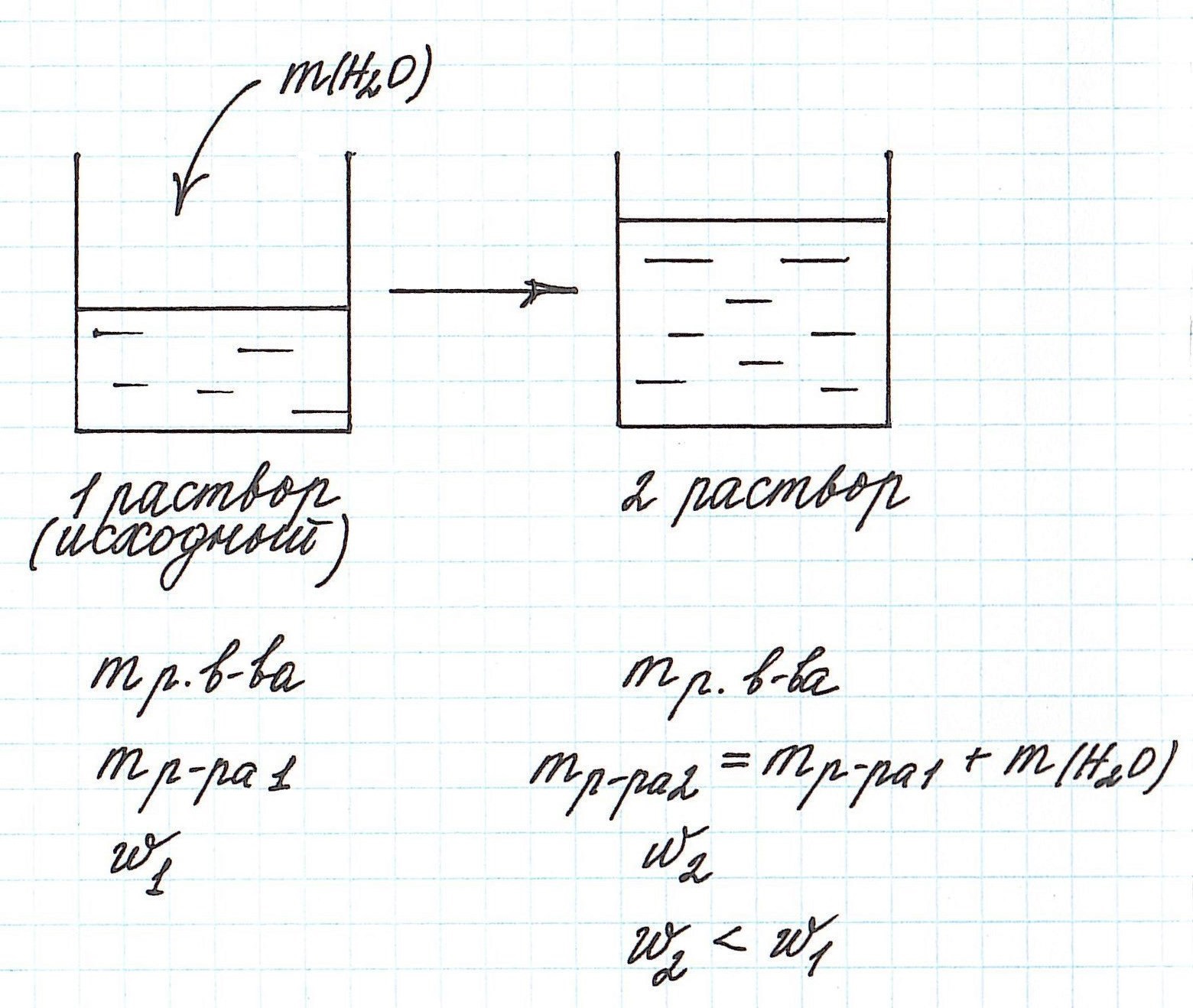
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
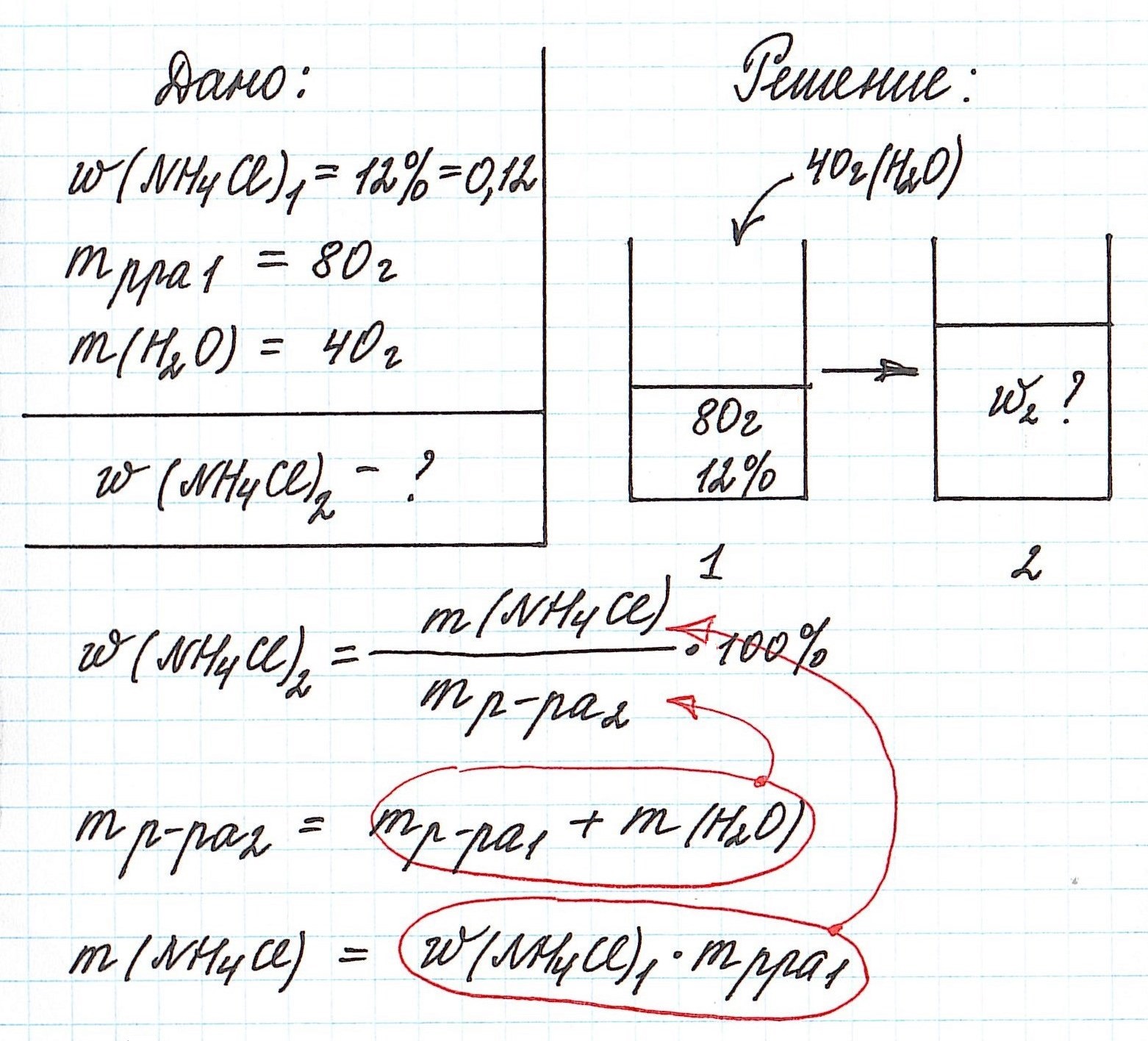
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
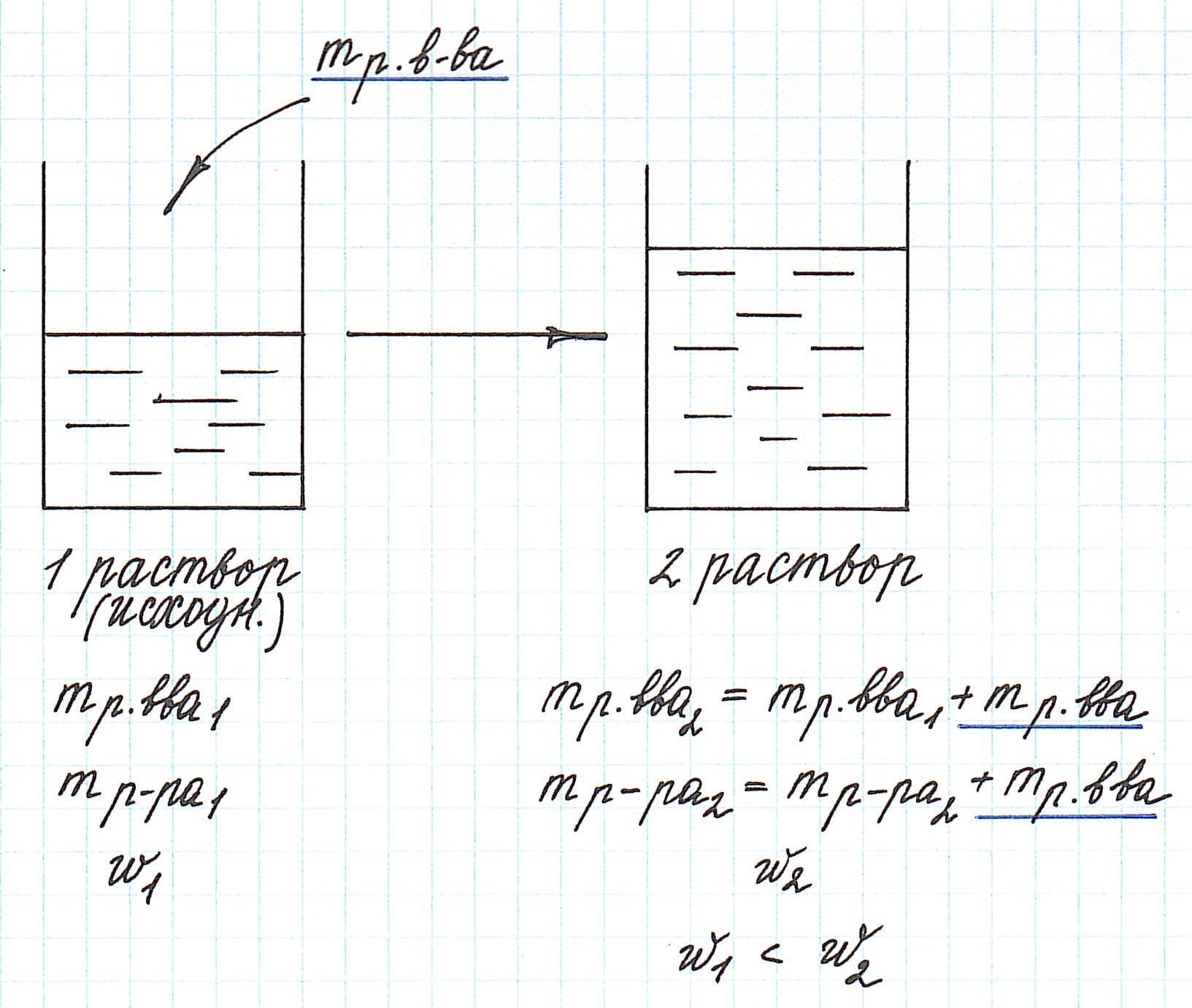
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
Вычисление массовой доли растворенного вещества при смешивании двух растворов
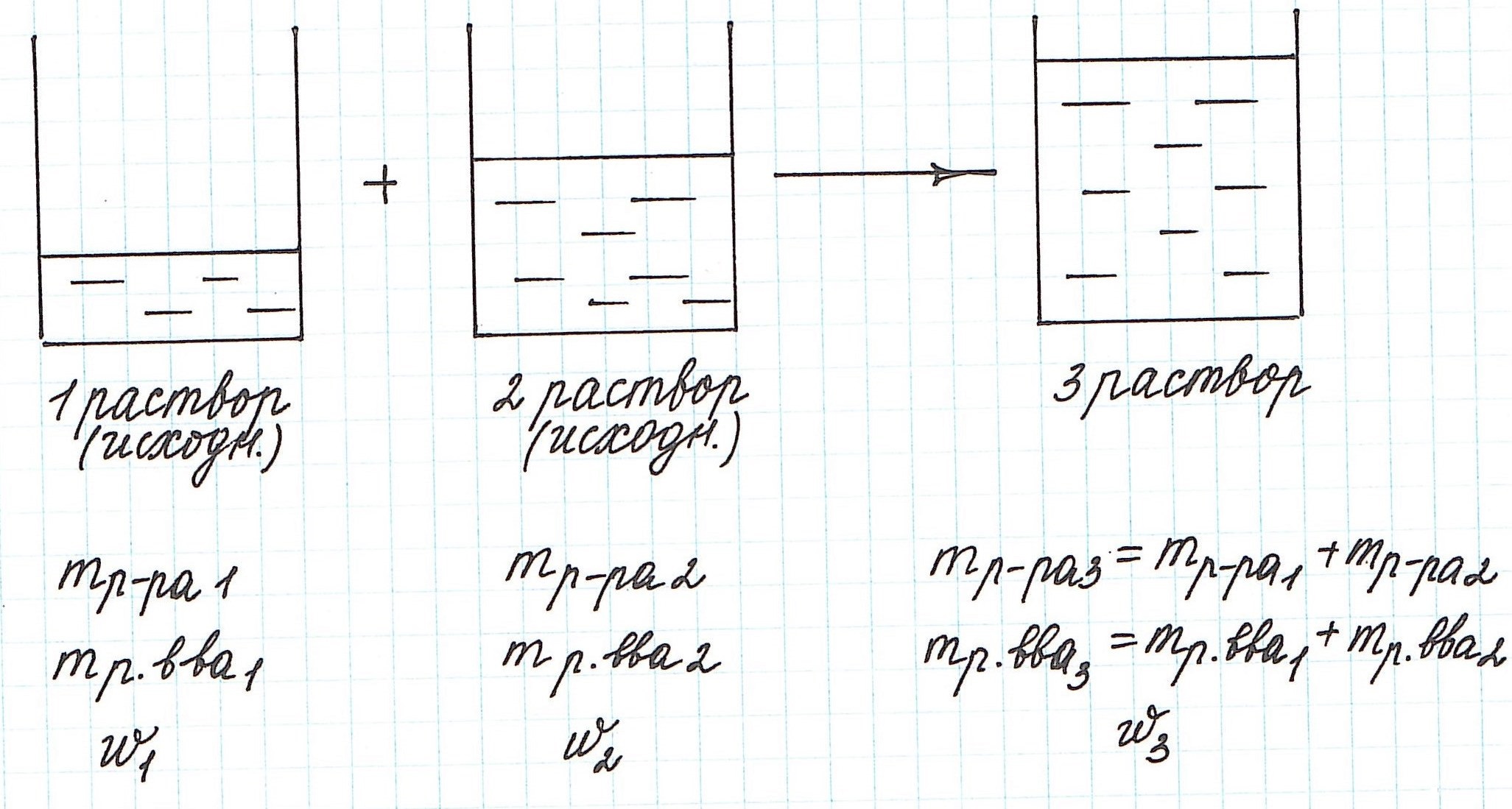
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
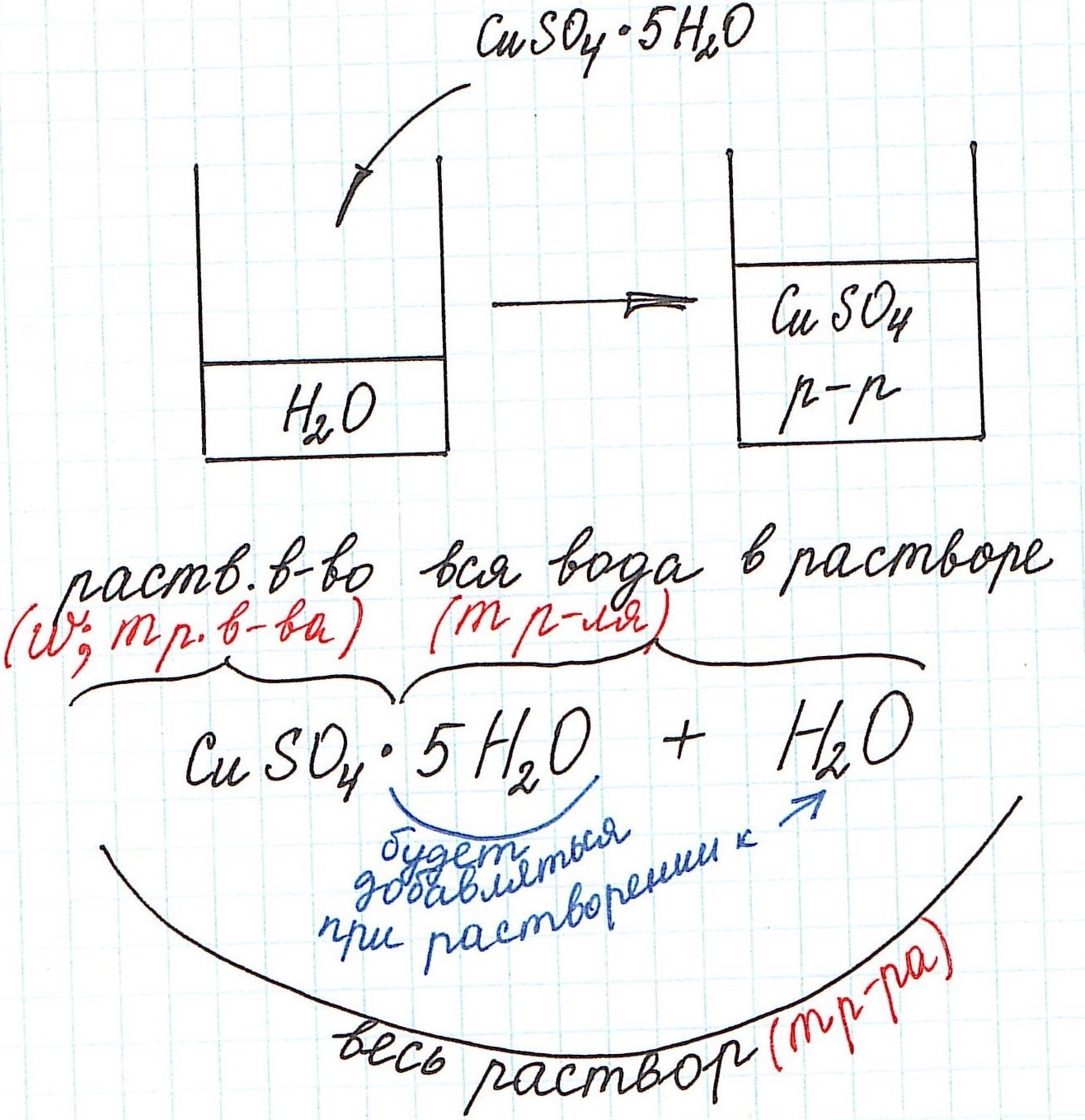
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
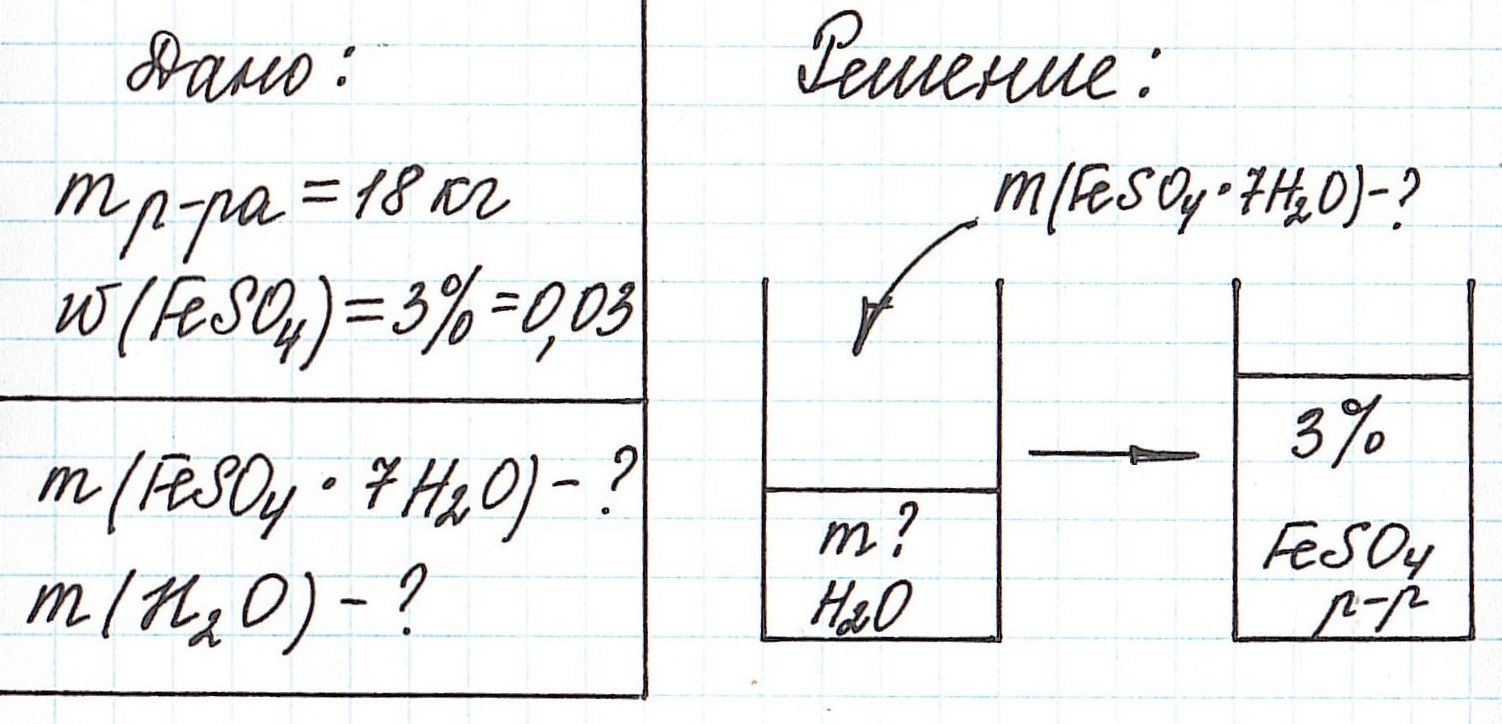
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
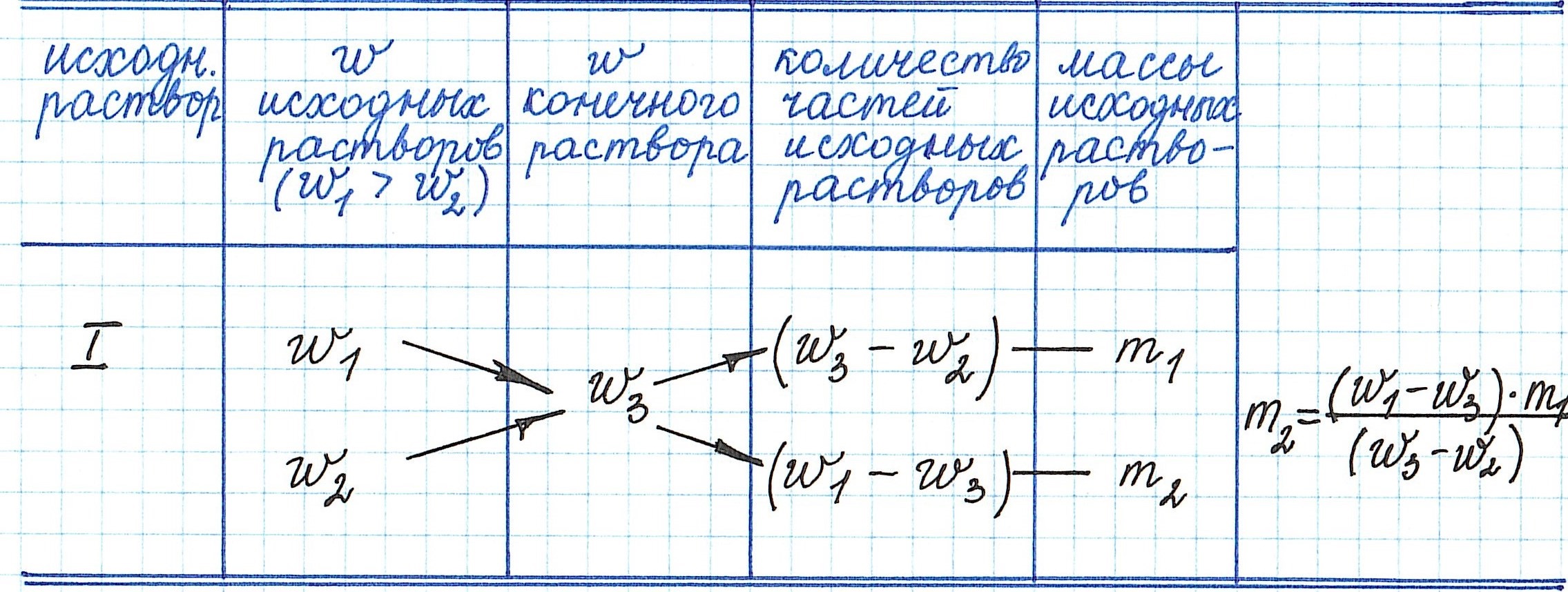
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
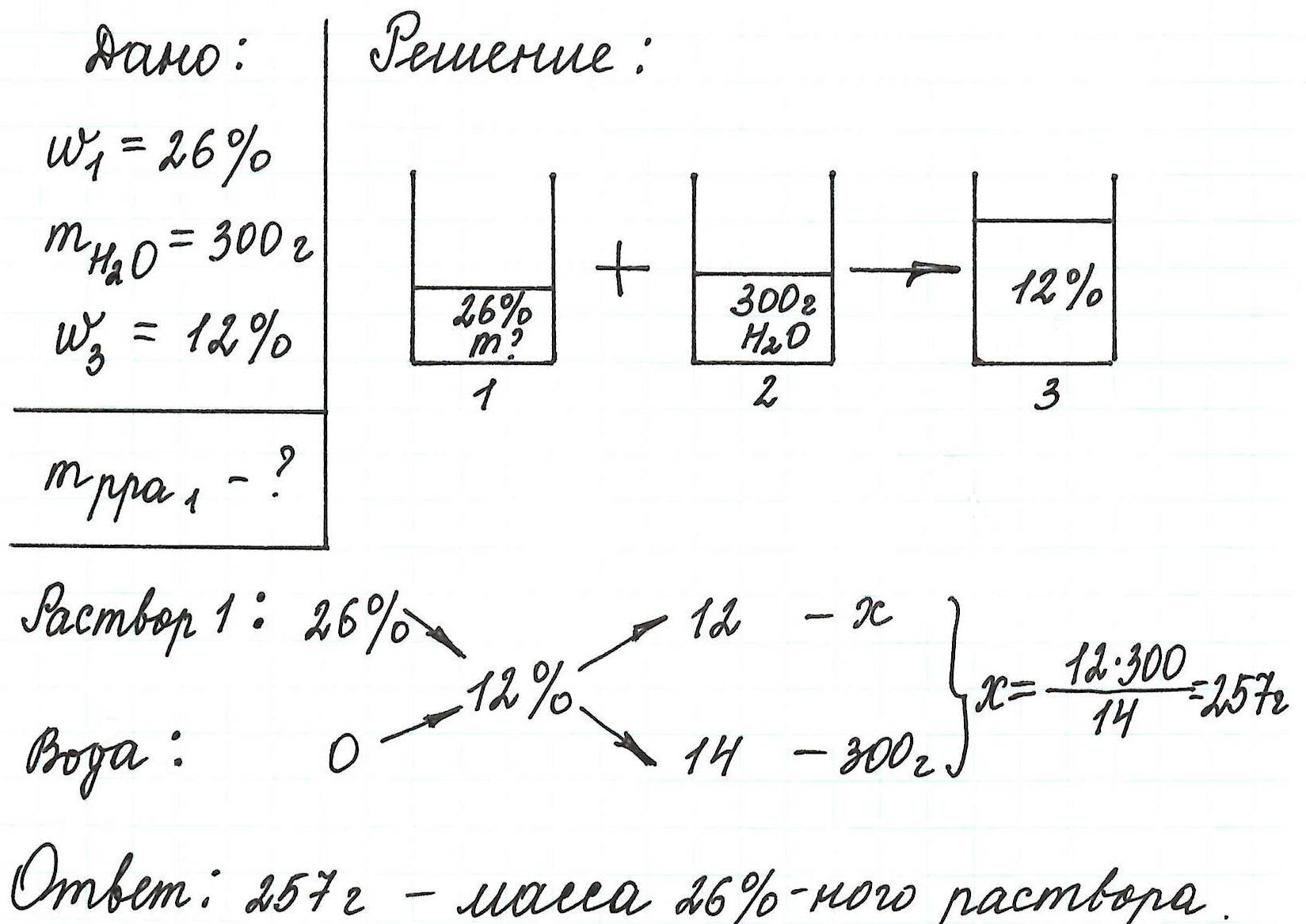
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
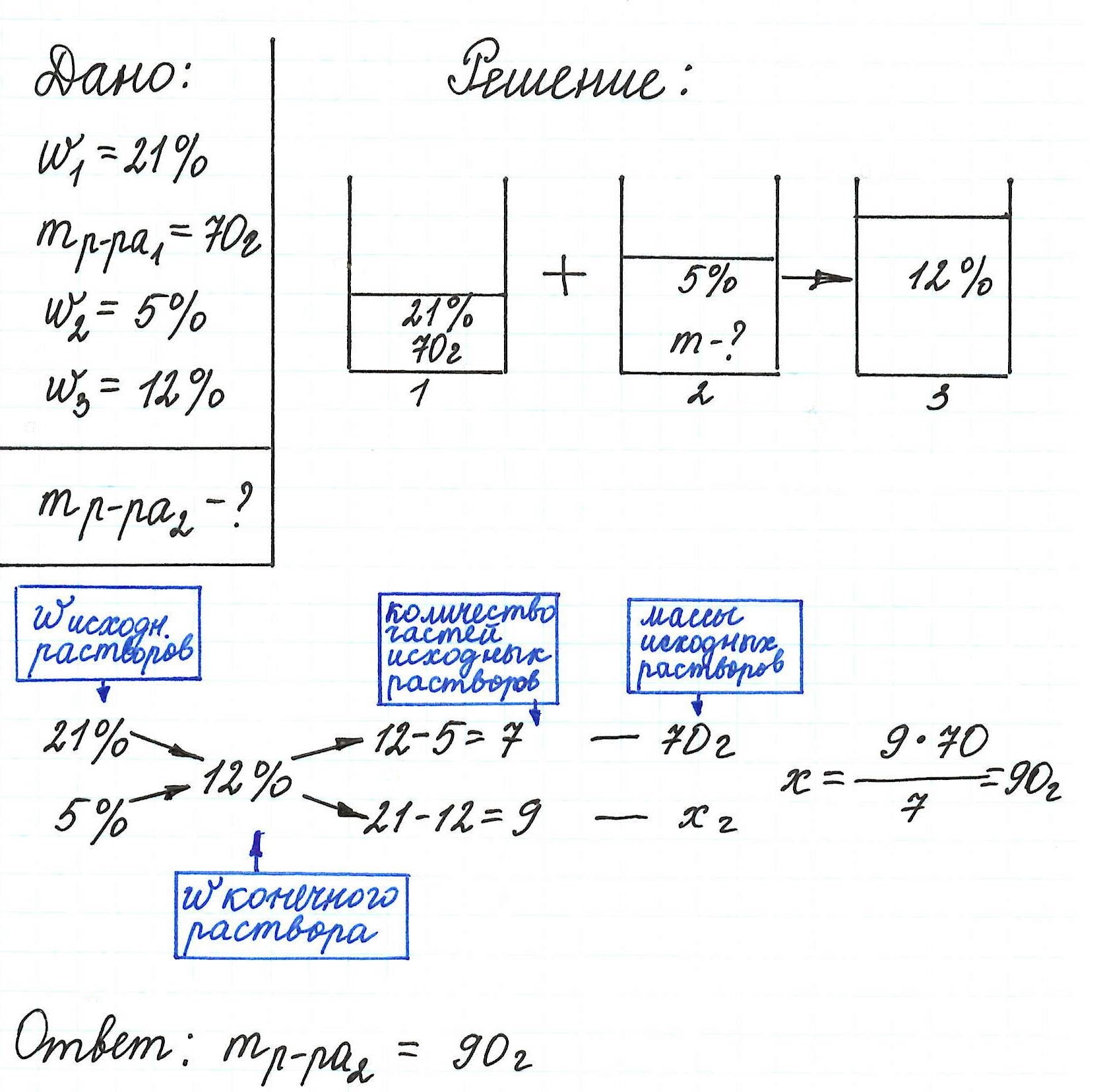
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Источник
Растворы. Способы выражения концентрации растворов
Растворы. Способы выражения концентрации растворов
Важной характеристикой раствора является концентрация.
Концентрация – это величина, измеряемая количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
Наиболее часто применяемые способы выражения концентрации: массовая доля , молярная концентрация , молярная концентрация эквивалента , моляльность , молярная доля , объемная доля , титр .

где m ( X ) – масса растворенного вещества Х, кг (г);
m р-ра – масса раствора, кг (г).
Молярную концентрацию с(Х) выражают в моль/л. Молярную концентрацию находят по формуле:

где n( X ) – количество растворенного вещества, моль;
M ( X ) – молярная масса растворенного вещества, кг/моль, или г/моль;
m ( X ) – масса растворенного вещества, соответственно, кг или г;
V р-ра – объем раствора, л.

где m (р-ль) – масса растворителя, кг.
Моляльность показывает, сколько моль растворенного вещества Х приходится на 1 кг растворителя.
В химии широко используют понятие эквивалента и фактора эквивалентности.
Эквивалентом называют реальную или условную частицу вещества Х, которая в данной обменной реакции обменивает один однозарядный ион или в данной окислительно–восстановительной реакции переносит один электрон.
Фактор эквивалентности f экв (Х) – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно–основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Фактор эквивалентности рассчитывают на основе стехиометрии данной реакции из равенства:
где z – основность кислоты или кислотность основания данной кислотно-основной реакции, или число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции.
Фактор эквивалентности зависит от реакции, в которой участвует данное вещество; так для фосфорной кислоты в реакциях:
Для перманганата калия в реакциях:
Для иодид-иона и иода в реакции:
Молярной массой эквивалента вещества Х (масса одного моль эквивалента вещества) называют величину, измеряемую произведением фактора эквивалентности на молярную массу вещества Х.
где М( f экв (Х)) – молярная масса эквивалента.
Единица измерения молярной массы эквивалента – г/моль.
Соответственно для растворов используют понятие молярной концентрации эквивалента (нормальная концентрация).
Молярную концентрацию эквивалента (нормальность) с( f экв (Х)) рассчитывают по формуле:

где n ( f экв (Х)) – количество вещества эквивалента, моль;
V р-ра – объем раствора, л;
Молярная концентрация эквивалента (нормальность) связана с молярной концентрацией (молярностью) следующим выражением:

Молярную долю x ( X i ) выражают в долях единицы или в процентах. Молярную долю рассчитывают по формуле:

где n ( X i )– количество вещества данного компонента, моль;

Объемную долю φ(Х) выражают в долях единицы или в процентах, ее рассчитывают по формуле

где V (Х)– объем данного компонента Х, л;
V р-ра – общий объем раствора, л.

где m (Х) – масса вещества, обычно г;
V р-ра – объем раствора, мл.
Титр показывает, какая масса вещества содержится в 1 мл его раствора.
В клинической практике нередко выражают концентрацию ионов в миллиграмм–процентах (мг %). Это масса вещества, выраженная в миллиграммах на 100 мл раствора.
Формулы перехода от одних способов выражения концентрации к другим см. прил., табл. №2.
В 180 г воды растворили H 3 PO 4 массой 9.8 г. Определите молярную долю (Х) и моляльную концентрацию (С m ) ортофосфорной кислоты.

n ( H 3 PO 4 )= 
n ( H 2 O ) = 
Х ( H 3 PO 4 ) = 
С m ( H 3 PO 4 ) = 
Ответ: Х ( H 3 PO 4 ) = 0.0099; С m ( H 3 PO 4 ) = 0.0566 моль/кг.
Массовая доля хлорида натрия в физиологическом растворе 0.9% (ρ = 1 г/мл). Вычислите: а) молярную концентрацию и титр NaCl в этом растворе; б) массу соли, веденной в организм при вливании 500 мл данного раствора.
с ( X ) = 


с ( NaCl ) = 
Т ( NaCl ) = 
m ( NaCl ) = 0.00900 г/мл · 500 мл = 4.5 г.
Ответ: с ( NaCl ) = 0.154 моль/л; Т ( NaCl ) = 0.00900 г/мл.
Сколько мл 80% раствора CH 3 COOH (ρ = 1.070 г/см 3 ) необходимо для приготовления 500 мл 0.1 М раствора?
Найдем, сколько граммов уксусной кислоты содержится в 500 мл раствора:


Определим, в какой массе 80% раствора уксусной кислоты содержится 3.0 г CH 3 COOH :

Найдем объем 80% раствора CH 3 COOH :

Источник
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Источник
Способы выражения концентрации
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = 41,2/76 = 0,54 моль
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mH2O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Источник
Количество и концентрация вещества. Выражение и пересчеты из одних единиц в другие. Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества.
Масса и количество вещества. Массу вещества (m) измеряют в граммах, а количество вещества (n) в молях. Если обозначить вещество буквой Х, то тогда его масса может быть обозначена как m (X), а количество – n (X).
- Моль–количество вещества, которое содержит столько определенных структурных единиц (молекул, атомов, ионов и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода-12.
- При использовании термина моль следует указывать частицы, к которым относится этот термин. Соответственно, можно говорить «моль молекул», «моль атомов», «моль ионов» и т.д. (например, моль молекул водорода, моль атомов водорода, моль ионов водорода). Так как 0,012 кг углерода-12 содержит ~ 6,022х1023атомов углерода (постоянная Авогадро = число Авогадро), то моль– такое количество вещества, которое содержит 6,022х1023структурных элементов (молекул, атомов, ионов и др.).
- Отношение массы вещества к количеству вещества называют молярной массой.
- M (X) = m (X) / n(X)
- То есть, молярная масса (М) – это масса одного моля вещества. Основной системной (в международной системе единиц СИ) единицей молярной массы является кг/моль, а на практике – г/моль. Например, молярная масса самого легкого металла лития М (Li) = 6,939 г/моль, молярная масса газа метана М (СН4) = 16,043 г/моль. Молярная масса серной кислоты рассчитывается следующим образом M (Н2SО4) = 196 г / 2 моль = 96 г/моль.
- Молярная масса М (Х) — масса одного моля молекул вещества (г/моль). M(X)=mx/n (X), где mx – масса вещества, г; n (X) – количество вещества, моль. Молярная масса вещества Х численно равна относительной молекулярной массе Mr (в случае молекул) или относительной атомной массе (в случае атомов).
- Любое соединение (вещество), кроме молярной массы, характеризуется относительной молекулярной или атомной массой. Существует и эквивалентная масса Е, равная молекулярной, умноженной на фактор эквивалентности (см. далее).
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
- Например,Мr(СН4) = 16,043. Относительная молекулярная масса – величина безразмерная.
- Относительная атомная масса (Ar) –это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12.
- Например, Ar(Li) = 6,039.
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
Концентрация. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. В России чаще всего концентрацию обозначают заглавной буквой С, имея в виду прежде всего массовую концентрацию, которая по праву считается наиболее часто применяемой в экологическом мониторинге форма выражения концентрации (именно в ней измеряют величины ПДК).
- Массовая концентрация (С или β) –отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (V). Это самая распространенная у российских аналитиков форма выражения концентрации.
- β(Х) =m (X) / V(смеси)
- Единица измерения массовой концентрации – кг/м3 или г/м3, кг/дм3или г/дм3(г/л), кг/см3, или г/см3 (г/мл), мкг/л или мкг/мл и т.д. Арифметические пересчеты из одних размерностей в другие не представляет большой сложности, но требуют внимательности. Например, массовая концентрация хлористоводородной (соляной) кислотыС(HCl) = 40 г / 1 л = 40 г/л = 0,04 г/мл = 4·10–5мкг/л и т.д. Обозначение массовой концентрации С нельзя путать с обозначением мольной концентрации (с), которая рассматривается далее.
- Типичными являются соотношения β(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
- Массовая концентрация — это отношение массы к объему системы !!!! а отношение массы к массе это — массовая доля
Титр (Т) В объемном анализе (титриметрии) употребляется одна из форм массовой концентрации – титр. Титр раствора (Т) –это масса вещества, содержащегося в одном кубическом сантиметре = в одном миллилитре раствора.
- Единицы измерения титра — кг/см3, г/см3, г/мл и др.
Моляльность (b) —отношение количества растворенного вещества (в молях) к массе растворителя (в кг).
- b(Х) = n(X) / m (растворителя) = n(X) / m (R)
- Единица измерения моляльности —моль/кг. Например,b (HCl/H2O) = 2 моль/кг. Моляльная концентрация применяется в основном для концентрированных растворов.
Мольная (! )доля (х) –отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях).
- х(Х) =n(X) / n(X) + n(Y)
- Мольнаядоля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных (млн–1,ppm), миллиардных (млрд–1,ppb), триллионных (трлн–1,ppt) и др. долях, но единицей измерения все равно является отношение –моль/моль. Например,х(С2Н6) = 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая доля (ω) –отношение массы данного компонента, содержащегося в системе, к общей массе этой системы.
- ω (Х) = m(X) / m(смеси)
- Массовая доля измеряется в отношениях кг/кг (г/г). При этом она может быть выражена в долях единицы, процентах (%), промилле, миллионных, миллиардных и т.д. долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
- Например, условно ω (KCl) = 12 г / 12 г + 28 г = 0,3 (30%).
Объемная доля (φ) –отношение объема компонента, содержащегося в системе, к общему объему системы.
- φ (Х)=v(X) /v(X)+v(Y)
- Объемная доля измеряется в отношениях л/л или мл/мл и тоже может быть выражена в долях единицы, процентах, промилле, миллионных и т.д. долях. Например, объемная доля кислорода газовой смеси составляет φ (О2)=0,15 л / 0,15 л + 0,56 л.
Молярная (мольная) концентрация (с) –отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы.
- с(Х) = n(X)/ V(смеси)
- Единица измерения молярной концентрации моль/м3(дольная производная, СИ – моль/л).
- Например,c (H2S04) = 1 моль/л,с(КОН) = 0,5 моль/л.
- Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают как 1 М раствор (не надо путать эту букву М, стоящую после цифры, с ранее указанным обозначением молярной массы, т.е. количества вещества М). Соответственно раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М (полумолярный р-р); 0,1 моль/л – 0,1 М (децимолярный р.р); 0,01 моль/л – 0,01 М (сантимолярный р-р) и т.д.
- Эта форма выражения концентрации также очень часто применяется в аналитике.
Нормальная (эквивалентная) концентрация (N), молярная концентрация эквивалента(Сэкв.)– это отношение количества вещества эквивалента в растворе (моль) к объему этого раствора (л).
- N = Сэкв (Х) = n (1/Z X) / V (смеси)
- Количество вещества (в молях), в котором реагирующими частицами являются эквиваленты, называется количеством вещества эквивалента nэ (1/Z X) = nэ (Х).
- Единица измерения нормальной концентрации («нормальности») тоже моль/л (дольная производная, СИ).
- Например, Сэкв.(1/3 АlCl3) = 1 моль/л.
- Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,5 н («пятидецинормальный»); 0,01 н (сантинормальный») и т.п. растворы.
- Следует отметить, что понятие эквивалентностиреагирующих веществ в химических реакциях является одним из базовых для аналитической химии. Именно на эквивалентности как правило основаны вычисления результатов химического анализа (особенно в титриметрии). Рассмотрим несколько связанных с этим базовых с т.з. теории аналитики понятий.
Фактор эквивалентности (fэкв )– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв (Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе:
- fэкв (Х) = 1/Zx
- где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций);
- Х — химическая формула вещества.
- Фактор эквивалентности всегда равен или меньше единицы. Будучи умноженным на относительную молекулярную массу, он дает значение эквивалентной массы (Е).
- Для реакции:
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- fэкв (H2SО4) = 1/2,fэкв (NaOH) = 1
- fэкв (H2SО4) = 1/2, т.е. это означает, что ½ молекулы серной кислоты дает для данной реакции 1 ион водорода (Н+), а соответственноfэкв (NaOH) = 1 означает, что одна молекулаNaOHсоединяется в данной реакции с одним ионом водорода.
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- Для реакции:
- 10 FeSО4 + 2 KMnО4 + 8 H2SО4 = 5 Fe2(SО4)3 + 2 MnSО4 + K2SО4 + 8 H2О
- 2МпО4— + 8Н++5е—→ Мп2+– 2e—+ 4 Н2О
- 5 Fe2+ – 2e— → Fe3+
- fэкв (KMnО4) = 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4 в данной реакции эквивалентна 1 электрону. При этом fэкв (Fe2+) = 1, т.е. один ион железа (II) также эквивалентен 1 электрону.
- Для реакции:
Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону.
- Форма записи эквивалента: fэкв(Х) Х (см. табл.), или упрощенно Эх, где Х –химическая формула вещества, т.е. [Эх =fэкв(Х) Х]. Эквивалент безразмерен.
- Эквивалент кислоты(или основания) – такая условная частица данного вещества, которая в данной реакции титрования высвобождает один ион водорода или соединяется с ним, или каким-либо другим образом эквивалентна ему.
- Например, для первой из вышеуказанных реакций эквивалент серной кислоты — это условная частица вида ½ H2SО4 т.е. fэкв (H2SО4) = 1/Z= ½; ЭH2SО4 = ½ H2SО4.
- Эквивалент окисляющегося(или восстанавливающегося)вещества— это такая условная частица данного вещества, которая в данной химической реакции может присоединять один электрон или высвобождать его, или быть каким-либо другим образом эквивалентна этому одному электрону.
- Например, при окислении перманганатом в кислой среде эквивалент марганцевокислого калия – это условная частица вида 1/5 КМпО4, т.е. ЭКМпО4 =1/5КМпО4.
- Так как эквивалент вещества может меняться в зависимости от реакции, в которой это вещество участвует, необходимо указывать соответствующую реакцию.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- эквивалент фосфорной кислоты Э Н3РО4 == 1 Н3РО4.
- Для реакции Н3РО4+ 2NaOH=Na2HPО4+ 2H2O
- ее эквивалент Э Н3РО4 == ½ Н3РО4,.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- Принимая во внимание, что понятие моля позволяет пользоваться любыми видами условных частиц, можно дать понятиемолярной массы эквивалента вещества X. Напомним, что моль– это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 г изотопа углерода12 С (6,02 1023). Под реальными частицами следует понимать атомы, ионы, молекулы, электроны и т.п., а под условными – такие как, например, 1/5 молекулы КМпО4в случае О/В реакции в кислой среде или ½ молекулы H2SО4 в реакции с гидроксидом натрия.
Молярная масса эквивалента вещества – масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности fэкв (Х) на молярную массу вещества М (Х)1.
- Молярную массу эквивалента обозначают как М [fэкв (Х) Х] или с учетом равенства Эх = fэкв (Х) Х ее обозначают М [Эх]:
- М (Эх)= fэкв (Х) М (Х); М [Эх] = М (Х) /Z
- Например, молярная масса эквивалента КМпО4
- М (ЭКМпО4) =1/5КМпО4 = М 1/5 КМпО4 = 31,6 г/моль.
- Это означает, что масса одного моля условных частиц вида 1/5КМпО4 составляет 31,6 г/моль. По аналогии молярная масса эквивалента серной кислоты М ½ H2SО4 = 49 г/моль; фосфорной кислоты М ½ H3 РО4 = 49 г/моль и т.д.
- В соответствии с требованиями Международной системы (СИ) именно молярная концентрацияя вляется основным способом выражения концентрации растворов, но как уже отмечалось, на практике чаще применяетсямассовая концентрация.
- Рассмотрим основные формулы и соотношения между способами выражения концентрации растворов (см. табл. 1 и 2).
Таблица 1 Основные способы выражения концентрации растворов
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 1. Массовая концентрация (С или β) | кг/м3 | Производная (СИ) |
|
| кг/дм3 | Дольная производная (СИ) | ||
| кг/л | Производная (внесистемная) | ||
| 2. Титр раствора (Т) | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 3. Титр раствора А по определяемому компоненту Х | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 4. Молярная концентрация, молярность(с) | моль/м3 | Производная (СИ) |
|
| моль/дм3 | Дольная производная (СИ) | ||
| моль/л | Производная (внесистемная) | ||
| 5. Молярная концентрация эквивалента (N), нормальность | моль/дм3 | Производная (СИ) |
|
| моль/л | Производная (внесистемная) | ||
| 6. Моляльная концентрация, моляльность (b) | моль/кг | Производная (СИ) |
|
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 7. Мольная доля(х) | Относительная = моль/моль. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,pptили в др. ед. | Безразмерная = 1 моль/моль = 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 8. Массовая доля (ω) | Относительная = кг / кг. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,ppt или в др. ед. |
Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 9. Объемная доля (φ) | Относительная = м3/м3(илил/л, илимл/мл, или в %, или в млн–1,ppm, в млрд–1 ,ppb, или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
* В расчетных уравнениях химическую формулу обычно ставят в индексе.
Пересчеты из одной формы выражения концентрации в другую являются достаточно простыми арифметическими задачами, с решениями которых аналитику приходится сталкиваться очень часто – при приготовлении аналитических растворов, при пробоотборе и пробоподготовке, при смешении пробы с аналитическими растворами, а также при статистической обработке и представлении получившихся результатов в цифровой и графической форме. Рассмотрим формулы для пересчета шести наиболее часто применяемых форм выражения концентраций (см. табл. 2).
Таблица 2 Формулы перехода от одних выражений концентраций растворов к другим (процентная, в граммах на грамм растворителя, в граммах на грамм раствора, нормальная, молярная, моляльная) 6
- Обозначения:
- d-плотность раствора,
- W- молекулярный вес (масса) растворенного вещества,
- E- грамм-эквивалентный вес растворенного вещества
- Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные работы по химии.Учеб. пособие для техн. направ. и спец. вузов. /Под ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1998. – с. 21–39.
- Жарский И.М., Кузьменко А.Л., Орехова С.Е.Лабораторный практикум по общей и неорганической химии./Под ред. Г.И. Новикова. – Мн.: Дизайн ПРО, 1998. – с. 3-27 и 46-56.
- Попадич И.А., Траубенберг С.Е, Осташенкова Н.В. и др.. Аналитическая химия.Учебное пособие для техникумов. М.: Химия, 1989. – с. 91-98.
- Зайцев О.С.Исследовательский практикум по общей химии.Учебное пособие. М.: Изд-во МГУ, 1994. – с. 91-98.
- Лурье Ю.Ю.Справочник по аналитической химии.Справ. Изд. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – с. 172-173.
Важнейшей
характеристикой любого раствора является
его состав, который выражается
концентрацией. Концентрацией
раствора
называется количество растворенного
вещества в определенном массовом или
объемном количестве раствора или
растворителя.
Для приблизительного
выражения концентрации растворов
используют термины концентрированный
и разбавленный
растворы.
Концентрированный
раствор содержит
такие количества растворенного вещества,
которые сравнимы с количеством
растворителя. Например, в 100г воды
растворено 20г поваренной соли. Это
концентрированный раствор (20 и 100
сравнимые величины).
Разбавленный
раствор содержит
очень малое количество растворенного
вещества по сравнению с количеством
растворителя. Например, в 100г воды
растворено 0,2г поваренной соли. Это
разбавленный раствор (0,2г соли очень
мало по сравнению со 100г растворителя).
Границы между
концентрированными и разбавленными
растворами условны.
Существуют различные
способы численного выражения концентрации
растворов: массовая доля (%), объемная
доля (%), молекулярные и атомные проценты,
молярность, нормальность или молярная
концентрация эквивалента, моляльность,
мольная, атомная и массовые доли, титр
и т.д.
4.1 Процентная
концентрация (массовая доля ) раствора
показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Процентная
концентрация — это безразмерная величина
и выражается соотношением
где С%
— концентрация раствора, %;
m1
— масса растворенного вещества, г;
m — масса раствора,
г.
Пример 1.
Найти процентную концентрацию
раствора
хлорида калия, содержащего
53г КС1 в 500 мл раствора.
Плотность
раствора ρ=1,063 г/см3.
Решение: Масса
раствора равна произведению объема
раствора V
на его плотность ρ
:
m = ρV,
тогда
С%=
=
.
Процентная
концентрация раствора КС1 10 %.
4.2 Молярная
концентрация раствора
(молярность) показывает число молей
растворенного вещества, содержащихся
в 1 л раствора.
Молярная концентрация
имеет размерность моль/л и выражается
формулой
См=,
моль/л,
где m1
— масса
растворенного вещества, г;
М — молярная
масса растворенного вещества, г/моль;
V
— объем раствора, л.
Пример 2. Найти
массу NаОН,
содержащегося в 0,2 л раствора, если
молярная концентрация раствора равна
0,2 моль/л.
Решение: Молярная
масса NаОН
= 40г/моль.
mNaОН
= СмМV
= 0,2∙40∙0,2 =1,6 г.
4.3 Молярная
концентрация эквивалента (нормальная
концентрация)
вещества (нормальность) показывает
число моль-эквивалентов растворенного
вещества, содержащихся в 1 л раствора
(моль∙экв/л; н):
моль∙экв/л,
где m1—
масса растворенного вещества, г;
Мэ—
молярная масса эквивалента растворенного
вещества, г/моль;
V
— объем раствора, л.
Закон эквивалентов:
Все вещества
взаимодействуют между собой в соотношениях
масс, пропорциональных их эквивалентам.
Один эквивалент одного вещества всегда
реагирует с одним эквивалентом другого
вещества:
или
или
~
,
где mA
и mB
– массы
взаимодействующих веществ А и В, г;
МЭА
МЭВ –
молярные массы эквивалентов этих
веществ, г/моль;
и
—
эквивалентные количества Аи В.
Эквивалент
вещества –
это целая часть формульной единицы
вещества, которая в данной реакции
химически равноценна 1 атому водорода.
Молярная масса
эквивалента
вещества
рассчитывается в общем случае по формуле
[г/моль], где
М(ЭА)-
молярная
масса эквивалента вещества,
z—
фактор эквивалентности, определяется
типом вещества и реакции, в которой оно
участвует.
Для кислот в
реакции нейтрализации z
равно числу протонов, замещающихся на
катионы металла.
Для оснований в
реакции нейтрализации z
равно числу гидроксогрупп, замещающихся
на кислотные остатки.
Для солей в
реакциях обмена z
равно произведению числа катионов на
заряд катиона.
Для окислителей
(восстановителей) z
равно числу электронов, которые принимает
(отдает) в данной реакции одна формульная
единица окислителя (восстановителя).
Молярная масса
эквивалента
вещества
зависит от
типа реакции и для одного вещества может
иметь разные значения. Следовательно,
нормальная концентрация одного и того
же раствора будет иметь разные значения
для различных превращений этого вещества.
В общем случае
молярная масса эквивалента вещества
Мэ
определяется реакцией, в которой он
участвует. Например:
а) взаимодействие
фосфорной кислоты со щелочью в реакции
нейтрализации:
H3PO4
+ 2NaOH
= Na2HPO4
+ 2H2O
г/моль,
z=2,
т.к. молекула кислоты реагирует с двумя
молекулами NaOH,
что соответствует замещению двух ионов
водорода;
б) взаимодействие
бихромата калия с иодидом калия в кислой
среде:
K2Cr2O7
+ 6KI + 7H2SO4
= 3I2
+ Cr2(SO4)3
+ 4K2SO4
+ 7H2O
г/моль,
z=6,
т.к. бихромат калия принимает в данной
реакции шесть электронов:
г/моль.
Пример 3.
Определить молярную концентрацию
эквивалента хлорида железа (III),
если в 0,3л раствора содержится 32,44г
FеС13.
Решение: Молярная
масса эквивалента FеС13
равна
МэFeС13=
Молярная концентрация
эквивалента раствора FeCl3
равна
4.4 Моляльная
концентрация раствора
(моляльность) показывает число молей
растворенного вещества, растворенного
в 1000 г (1 кг) растворителя. Размерность
моляльной концентрации моль/кг:
Сm
=

моль/кг,
где Сm
— моляльная концентрация, моль/кг;
m1
— масса растворенного вещества, г;
m2
— масса растворителя, кг;
М — молярная
масса растворенного вещества, г/моль .
Пример 4. В
каком количестве эфира надо растворить
3,0 г анилина С6H5NH2,
чтобы получить раствор, моляльность
которого равна 0,3 моль/кг?
Решение: Моль
С6H5NH2
= 93 г/моль.
Масса растворителя
(эфира) равна
m2
=
4.5 Мольная доля
растворенного
вещества и растворителя в растворе
Мольная доля Ni
вещества в растворе равна отношению
числа молей данного вещества к сумме
чисел молей всех компонентов, содержащихся
в растворе. Например, если раствор
состоит из двух компонентов (растворитель
+ одно растворенное вещество), мольные
доли компонентов будут равны
N1=иN2=
где N1
и N2—
мольные доли растворителя и растворенного
вещества соответственно;
n1
— число молей растворителя;
n2
— число молей растворенного вещества.
где
m1—
масса растворенного вещества, г;
М1—
молярная масса растворенного вещества,
г;
где m2—
масса растворителя, г;
М2—
молярная масса растворителя, г;
Пример 5.
Рассчитать мольные доли глюкозы С6H12O6
и воды в
36%-ном водном растворе глюкозы.
Решение: В
100 г 36%-ного раствора глюкозы содержится
36 г глюкозы и 64 г воды. Определяем число
молей глюкозы и воды
(М (С6H12O6)
=180; М Н2O=18):
n
(С6H12O6)
n
(Н2O)
N
(С6H12O6)
=
N
(С6H12O6
)
=
Сумма мольных
долей компонентов раствора всегда равна
1.
N
(С6H12O6
) + N
(H2O)
= 0,053 + 0,947 = 1,0.
4.6 Титр раствора
Титр раствора
Т показывает количество граммов
растворенного вещества, содержащегося
в 1 мл раствора. Размерность титра — г/мл.
г/мл,
где mA—
масса растворенного вещества, г;
VА
– объем раствора, мл.
Пример 6. Определить
титр 0,01н КОН.
Решение: В
1л 0,01н раствора КОН содержится
(МЭ
KOH=56)
Титр этого раствора
равен
ТКОН
=