| Liver cancer | |
|---|---|
| Other names | Hepatic cancer, primary hepatic malignancy, primary liver cancer |
 |
|
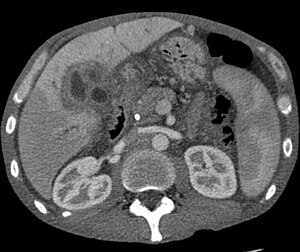
| CT scan of a liver with cholangiocarcinoma | |
| Specialty | Gastroenterology Hepatology Oncology |
| Symptoms | Lump or pain in the right side below the rib cage, swelling of the abdomen, yellowish skin, easy bruising, weight loss, weakness[1] |
| Usual onset | 55 to 65 years old[2] |
| Causes | hepatitis B, hepatitis C, alcohol, aflatoxin, non-alcoholic fatty liver disease, liver flukes[3][4] |
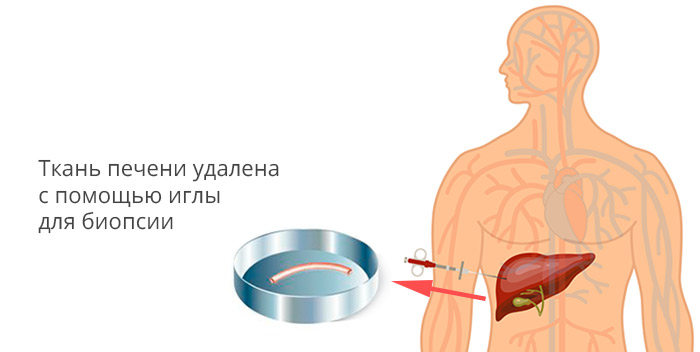
| Diagnostic method | Blood tests, medical imaging, tissue biopsy[1] |
| Prevention | Immunization against hepatitis B, treating those infected with hepatitis B or C,[3] decreasing exposure to aflatoxin, decreasing high levels of alcohol consumption |
| Treatment | Surgery, targeted therapy, radiation therapy[1] |
| Prognosis | Five-year survival rates ~18% (US);[2] 40% (Japan)[5] |
| Frequency | 618,700 (point in time in 2015)[6] |
| Deaths | 782,000 (2018)[7] |
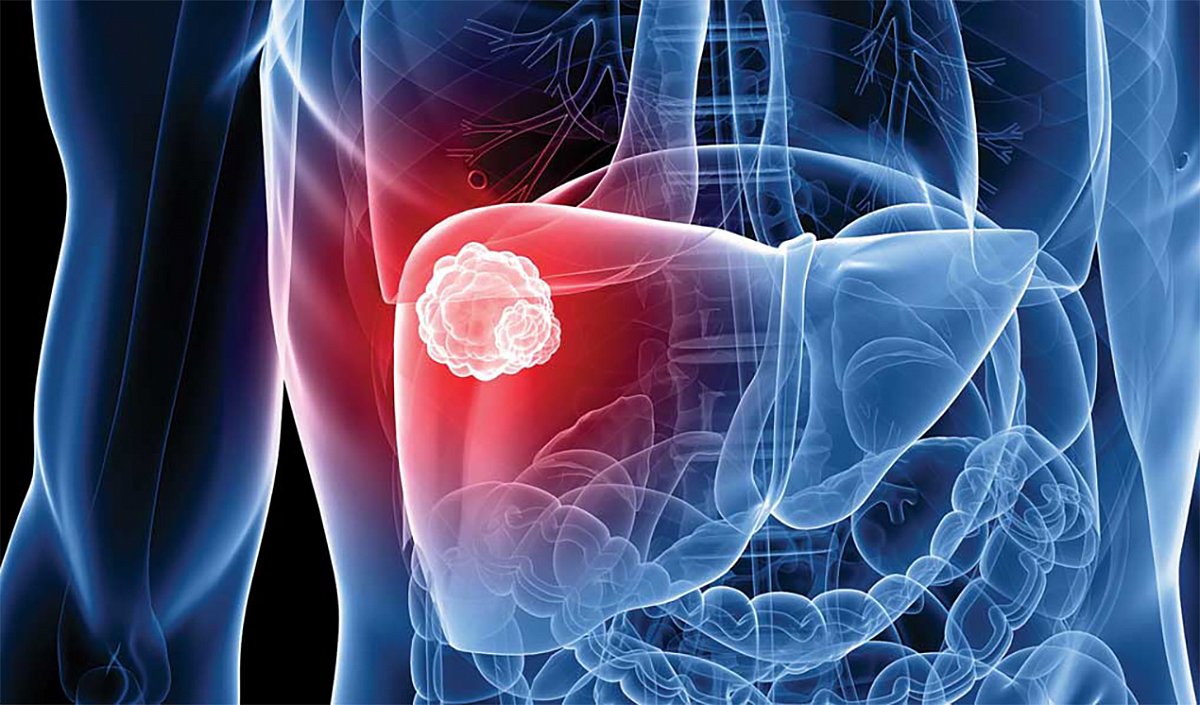
Liver cancer (also known as hepatic cancer, primary hepatic cancer, or primary hepatic malignancy) is cancer that starts in the liver.[1] Liver cancer can be primary (starts in liver) or secondary (meaning cancer which has spread from elsewhere to the liver, known as liver metastasis). Liver metastasis is more common than that which starts in the liver.[3] Liver cancer is increasing globally.[8][9]
Primary liver cancer is globally the sixth-most frequent cancer and the fourth-leading cause of death from cancer.[7][10] In 2018, it occurred in 841,000 people and resulted in 782,000 deaths globally.[7] Higher rates of liver cancer occur where hepatitis B and C are common, including Asia and sub-Saharan Africa.[3] Males are more often affected with hepatocellular carcinoma (HCC) than females.[3] Diagnosis is most frequent among those 55 to 65 years old.[2]
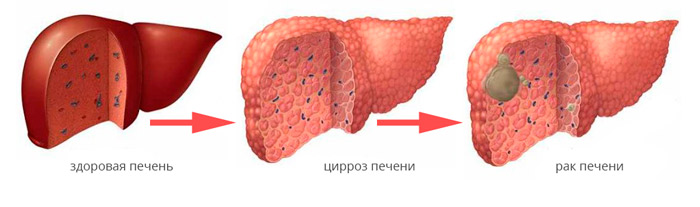
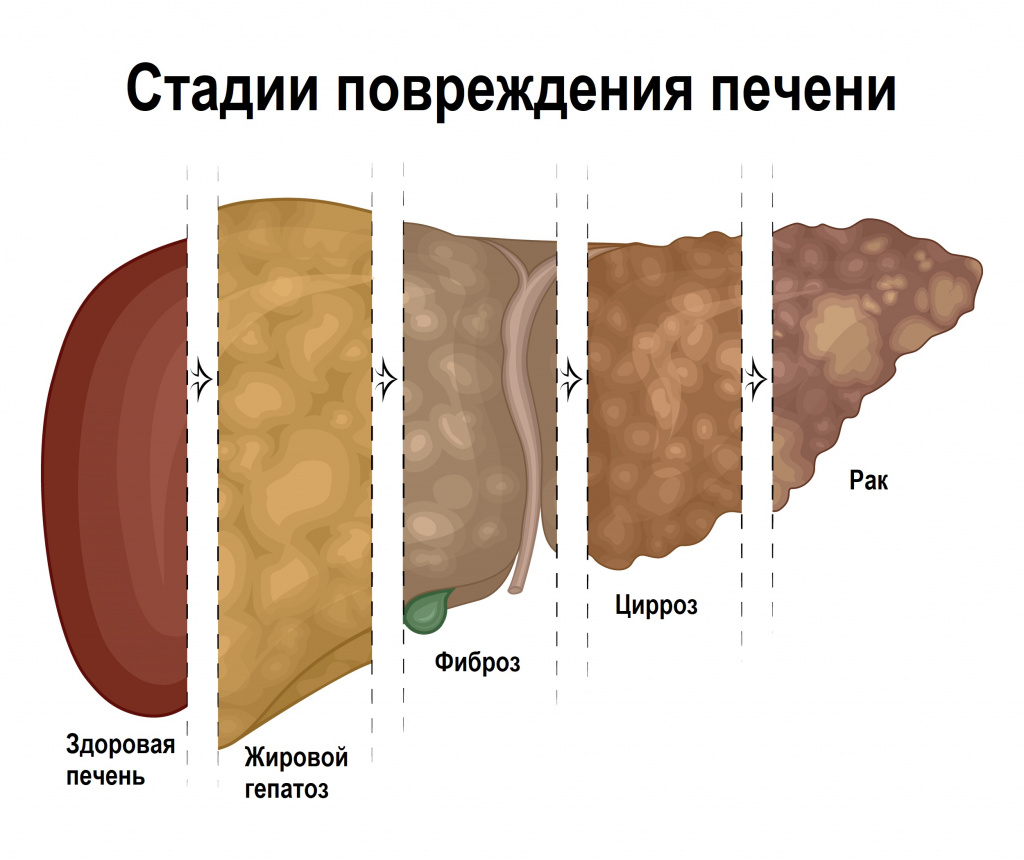
The leading cause of liver cancer is cirrhosis due to hepatitis B, hepatitis C or alcohol.[4] Other causes include aflatoxin, non-alcoholic fatty liver disease and liver flukes.[3] The most common types are HCC, which makes up 80% of cases and intrahepatic cholangiocarcinoma.[3] The diagnosis may be supported by blood tests and medical imaging, with confirmation by tissue biopsy.[1]
Given that there are many different causes of liver cancer, there are many approaches to liver cancer prevention. These efforts include immunization against hepatitis B,[3] hepatitis B treatment, hepatitis C treatment, decreasing alcohol use,[8] decreasing exposure to aflatoxin in agriculture, and management of obesity and diabetes.[9] Screening is recommended in those with chronic liver disease.[3] For example, it is recommended that people with chronic liver disease who are at risk for hepatocellular carcinoma be screened every 6 months using ultrasound imaging.[8]
Because liver cancer is an umbrella term for many types of cancer, the signs and symptoms depend on what type of cancer is present. Symptoms can be vague and broad. Cholangiocarcinoma is associated with sweating, jaundice, abdominal pain, weight loss and liver enlargement.[11] Hepatocellular carcinoma is associated with abdominal mass, abdominal pain, emesis, anemia, back pain, jaundice, itching, weight loss and fever.[12]
Treatment options may include surgery, targeted therapy and radiation therapy.[1] In certain cases, ablation therapy, embolization therapy or liver transplantation may be used.[1]
Classification[edit]
Liver cancer can come from the liver parenchyma as well as other structures within the liver such as the bile duct, blood vessels and immune cells[13] There are many sub-types of liver cancer, the most common of which are described below.
Hepatocellular carcinoma[edit]
Liver tumor types by relative incidence in adults in the United States (liver cancers in dark red color).[14]
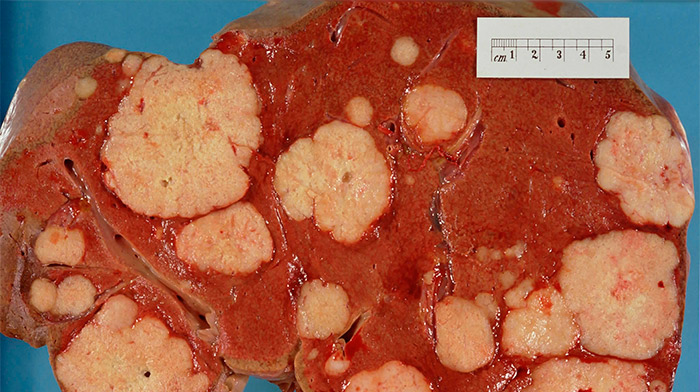
The most frequent liver cancer, accounting for approximately 75% of all primary liver cancers, is hepatocellular carcinoma (HCC).[15] HCC is a cancer formed by liver cells, known as hepatocytes, that become malignant. In terms of cancer deaths, worldwide HCC is considered the 3rd most common cause of cancer mortalities.[16]
In terms of HCC diagnosis, it is recommended that people with risk factors (including known chronic liver disease, cirrhosis, etc.) should receive screening ultrasounds. If the ultrasound shows a focal area that is larger than 1 centimeter in size, patients should then get a triple-phase contrast-enhanced CT or MRI imaging.[17] HCC can then be diagnosed radiologically using the Liver Imaging Reporting and Data System (LI-RADS).[18] There is also a variant type of HCC that consists of both HCC and cholangiocarcinoma.[19]
Intrahepatic cholangiocarcinoma[edit]
Cancer of the bile duct (cholangiocarcinoma and cholangiocellular cystadenocarcinoma) account for approximately 6% of primary liver cancers.[20] Intrahepatic cholangiocarcinoma (CCA) is an epithelial cancer of the intra-hepatic biliary tree branches.[21] Intrahepatic CCA is the second leading cause of primary liver cancer.[21] It is more common in men and usually is diagnosed in 60-70 year olds.[21] Risk factors for development of intrahepatic CCA include opisthorchus viverrini infection, Clonorchis sinensis infection, sclerosing cholangitis, choledochal cysts, past procedures of the biliary tree, exposure to thorotrast and dioxins, and cirrhosis.[21] This cancer is usually asymptomatic until the disease has progressed. Symptoms include abdominal pain, night sweats, weight loss, and fatigue.[21] Liver markers that can be increased with intrahepatic CCA are carcinoembryonic antigen (CEA), CA19-9, and CA-125.[21]
Angiosarcoma and hemangiosarcoma[edit]
These are rare and aggressive liver cancers, yet are the third most common primary liver cancer making up 0.1-2.0% of primary liver cancer.[22] Angiosarcoma and hemangiosarcoma of the liver come from the blood vessel’s endothelial layer. These tumors have poor outcomes because they grow rapidly and metastasise easily. They are also hard to diagnose but are typically suspected on CT or MRI imaging that shows focal lesions with differing amounts of echogenicity (these tumors have a lot of bleeding or hemorrhage and subsequent dying of tissue (necrosis)).[23] Biopsy with histopathological evaluation yields the definitive diagnosis.[22] While the cause is often never identified (75% are idiopathic), they are associated with exposures to substances such as vinyl chloride, arsenic, thorotrast (e.g. occupational exposure). Radiation is also a risk factor.[22] In adults, these tumors are more common in males; however, in children they are more common in females.[22]
Even with surgery prognosis is poor with most individuals not living longer than six months after diagnosis. Only 3% of individuals live longer than two years.[22]
Hepatoblastoma[edit]
Another type of cancer formed by liver cells is hepatoblastoma, which is specifically formed by immature liver cells.[20] It is a rare malignant tumor that primarily develops in children, and accounts for approximately 1% of all cancers in children and 79% of all primary liver cancers under the age of 15.[24][25] Most hepatoblastomas form in the right lobe.[26]
Metastasis to liver[edit]
Many cancers found in the liver are not true liver cancers but are cancers from other sites in the body that have spread to the liver (known as metastases). Frequently, the site of origin is the gastrointestinal tract, since the liver is close to many of these metabolically active, blood-rich organs near to blood vessels and lymph nodes (such as pancreatic cancer, stomach cancer, colon cancer and carcinoid tumors mainly of the appendix), but also from breast cancer, ovarian cancer, lung cancer, renal cancer, prostate cancer.
Children[edit]
The Children’s Oncology Group (COG) has developed a protocol to help diagnose and manage childhood liver tumors.[27]
Causes[edit]
Viral infection[edit]
Viral infection with hepatitis C virus (HCV) or Hepatitis B virus (HBV) is the chief cause of liver cancer in the world today, accounting for 80% of HCC.[28][29][30] Men with chronic HCV or HBV are more likely to develop HCC than women with chronic HCV or HBV; however, the reasons for this gender difference is unknown. HBV infection is also linked to cholangiocarcinoma.[31] The role of viruses other than HCV or HBV in liver cancer is much less clear, even though there is some evidence that co-infection of HBV and hepatitis D virus may increase the risk for HCC.[32]
HBV and HCV can lead to HCC, because these viral infections cause massive inflammation, fibrosis, and eventual cirrhosis occurs within the liver.[33] In addition, many genetic and epigenetic changes are formed in liver cells during HCV and HBV infection, which is a major factor in the production of the liver tumors. The viruses induce malignant changes in cells by altering gene methylation, affecting gene expression, and promoting or repressing cellular signal transduction pathways. By doing this, the viruses can prevent cells from undergoing a programmed form of cell death (apoptosis) and promote viral replication and persistence.[28][34]
HBV and HCV also induce malignant changes by causing DNA damage and genomic instability. This is by creating reactive oxygen species, express proteins that interfere with DNA repair enzymes, and HCV causes activation of a mutator enzyme.[35][36]
Cirrhosis[edit]
In addition to virus-related cirrhosis described above, other causes of cirrhosis can lead to HCC. Alcohol intake correlates with risk of HCC, and the risk is far greater in individuals with an alcohol-induced cirrhotic liver.[37] There are a few disorders that are known to cause cirrhosis and lead to cancer, including hereditary hemochromatosis and primary biliary cirrhosis.[38]
Aflatoxin[edit]
Aflatoxin exposure can lead to the development of HCC.[39] The aflatoxins are a group of chemicals produced by the fungi Aspergillus flavus (the name comes from A. flavus toxin) and A. parasiticus. Food contamination by the fungi leads to ingestion of the chemicals, which are very toxic to the liver. Common foodstuffs contaminated with the toxins are cereals, peanuts, and other vegetables. The amount (dose) and how long (duration) that a person is in contact with aflatoxin is associated with HCC.[39] Contamination of food is common in Africa, South-East Asia, and China. The mechanism by which aflatoxins cause cancer is through mutations and epigenetic alterations. Aflatoxins induce a spectrum of mutations,[40][41] including in the p53 tumor suppressor gene, which is a mutation seen in many types of cancers.[40] Mutation in p53, presumably in conjunction with other aflatoxin-induced mutations and epigenetic alterations,[42] is likely a common cause of aflatoxin-induced carcinogenesis.
Nonalcoholic steatohepatitis (NASH) and Nonalcoholic fatty liver (NAFL)[edit]
NASH and NAFL is beginning to be called a risk factor for liver cancer, particularly HCC.[43] In recent years, there has been a noted increase in liver transplantations for HCC that was attributable to NASH.[39] More research is needed in this area and NASH/NAFL.[43]
Other risk factors in adults[edit]
- High grade dysplastic nodules are precancerous lesions of the liver. Within two years, there is a risk for cancer arising from these nodules of 30–40%.[44]
- Obesity and metabolic syndrome have emerged as an important risk factor, as they can lead to steatohepatitis.[30][45]
- Diabetes increases the risk for HCC.[45][39]
- Smoking increases the risk for HCC compared to non-smokers and previous smokers.[45]
- There is around 5-10% lifetime risk of cholangiocarcinoma in people with primary sclerosing cholangitis.[46]
- Liver fluke infection increases the risk for cholangiocarcinoma, and this is the reason why Thailand has particularly high rates of this cancer.[47]
- Choledochal cysts, Caroli’s disease, and congenital hepatic fibrosis are associated with cholangiocarcinoma development.[48]
- Genetic conditions: untreated hereditary hemochromatosis, alpha-1-antitrypsin deficiency, glycogen storage diseases, porphyria cutanea tarda, Wilson’s disease, tyrosinemia have all been associated with development of HCC.[39][43]
- Oral contraceptive pill: There is insufficient evidence to label oral contraceptives as a risk factor. However, recent studies have found that taking oral contraceptives for longer than 5 years is associated with HCC.[39]
Children[edit]
Childhood liver cancer is uncommon.[27] The liver cancer sub-types most commonly seen in children are hepatoblastoma, hepatocellular carcinoma, embryomal sarcoma of liver, infantile choriocarcinoma of liver, and biliary rhabdomyosarcoma.[27] Increased risk for liver cancer in children can be caused by Beckwith–Wiedemann syndrome (associated with hepatoblastoma),[49][50] familial adenomatous polyposis (associated with hepatoblastoma),[50] low birth weight (associated with hepatoblastoma),[26] Progressive familial intrahepatic cholestasis (associated with HCC)[51] and Trisomy 18 (associated with hepatoblastoma).[50]
Diagnosis[edit]
Many imaging modalities are used to aid in the diagnosis of liver cancer. For HCC these include medical ultrasound, computed tomography (CT) and magnetic resonance imaging (MRI). When imaging the liver with ultrasound, large lesions are likely to be HCC (e.g., a mass greater than 2 cm has more than 95% chance of being HCC).Given the blood flow to the liver, HCC would be most visible when the contrast flows through the arteries of the liver (also called the arterial phase) rather than when the contrast flows through the veins (also called the venous phase).[17] Sometimes doctors will get a liver biopsy, if they are worried about HCC and the imaging studies (CT or MRI) do not have clear results.[17] The majority of cholangiocarcimas occur in the hilar region of the liver, and often present as bile duct obstruction. If the cause of obstruction is suspected to be malignant, endoscopic retrograde cholangiopancreatography (ERCP), ultrasound, CT, MRI and magnetic resonance cholangiopancreatography (MRCP) are used.[52]
Tumor markers, chemicals sometimes found in the blood of people with cancer, can be helpful in diagnosing and monitoring the course of liver cancers. High levels of alpha-fetoprotein (AFP) in the blood can be found in many cases of HCC and intrahepatic cholangiocarcinoma.[17] Of note, AFP is most useful for monitoring if liver cancers come back after treatment rather than for initial diagnosis.[17] Cholangiocarcinoma can be detected with these commonly used tumor markers: carbohydrate antigen 19-9 (CA 19–9), carcinoembryonic antigen (CEA) and cancer antigen 125 (CA125). These tumor markers are found in primary liver cancers, as well as in other cancers and certain other disorders.[53][54]
Prevention[edit]
Prevention of cancers can be separated into primary, secondary, and tertiary prevention. Primary prevention preemptively reduces exposure to a risk factor for liver cancer. One of the most successful primary liver cancer preventions is vaccination against hepatitis B.[43] Vaccination against the hepatitis C virus is currently unavailable.[55] Other forms of primary prevention are aimed at limiting transmission of these viruses by promoting safe injection practices, screening blood donation products, and screening high-risk asymptomatic individuals.[55] Aflatoxin exposure can be avoided by post-harvest intervention to discourage mold, which has been effective in west Africa. Reducing alcohol use disorder, obesity, and diabetes mellitus would also reduce rates of liver cancer. Diet control in hemochromatosis could decrease the risk of iron overload, decreasing the risk of cancer.[56]
Secondary prevention includes both cure of the agent involved in the formation of cancer (carcinogenesis) and the prevention of carcinogenesis if this is not possible. Cure of virus-infected individuals is not possible, but treatment with antiviral drugs can decrease the risk of liver cancer. Chlorophyllin may have potential in reducing the effects of aflatoxin.[56]
Tertiary prevention includes treatments to prevent the recurrence of liver cancer. These include the use of surgical interventions, chemotherapy drugs, and antiviral drugs.[56]
Treatment[edit]
General considerations[edit]
Like many cancers, treatment depends on the specific type of liver cancer as well as stage of the cancer. The main way cancer is staged is based on the TMN staging systems. There are also liver cancer specific staging systems, each of which has treatment options that may result in a non recurrence of cancer, or cure[57][58] [59] (see Radio Frequency Ablation) For example, for HCC it is common to use the Barcelona Clinic Liver Cancer Staging System.[39]
Treatments include surgery, medications, and ablation methods, which are described in the sections below. There are many chemotherapeutic drugs approved for liver cancer including: atezolizumab, nivolumab, keytruda, stivarga, etc.[60] Increasingly, immunotherapy agents (also called targeted cancer therapies or precision medicine) is being used to treat hepatobiliary cancers.[61]
Hepatocellular carcinoma[edit]
|
|
This section’s factual accuracy may be compromised due to out-of-date information. Please help update this article to reflect recent events or newly available information. (June 2017) |
Partial surgical resection is the recommended treatment for hepatocellular carcinoma (HCC) when patients have sufficient hepatic function reserve.[39] 5-year survival rates after resection have massively improved over the last few decades and can now ranges from 41 to 74%.[39] However, recurrence rates after resection can exceed 70%, whether due to spread of the initial tumor or formation of new tumors .[62] Liver transplantation can also be considered in cases of HCC where this form of treatment can be tolerated and the tumor fits specific criteria (such as the Milan criteria). In general, patients who are being considered for liver transplantation have multiple hepatic lesions, severe underlying liver dysfunction, or both.
Percutaneous ablation is the only non-surgical treatment that can offer cure. There are many forms of percutaneous ablation, which consist of either injecting chemicals into the liver (ethanol or acetic acid) or producing extremes of temperature using radio frequency ablation, microwaves, lasers or cryotherapy. Of these, radio frequency ablation has one of the best reputations in HCC, but the limitations include inability to treat tumors close to other organs and blood vessels due to heat generation and the heat sink effect, respectively.[63][64] In addition, long-term of outcomes of percutaneous ablation procedures for HCC have not been well studied. In general, surgery is the preferred treatment modality when possible.
Systemic chemotherapeutics are not routinely used in HCC, although local chemotherapy may be used in a procedure known as transarterial chemoembolization (TACE). In this procedure, drugs that kill cancer cells and interrupt the blood supply are applied to the tumor. Because most systemic drugs have no efficacy in the treatment of HCC, research into the molecular pathways involved in the production of liver cancer produced sorafenib, a targeted therapy drug that prevents cell proliferation and blood cell growth. Sorafenib obtained FDA approval for the treatment of advanced hepatocellular carcinoma in November 2007.[65] This drug provides a survival benefit for advanced HCC.[64]
Transarterial radioembolization (TRACE) is another option for HCC.[39] In this procedure, radiation treatment is targeted at the tumor. TRACE is still considered an add on treatment rather than the first choice for treatment of HCC,[39] as dual treatments of radiotherapy plus chemoembolization, local chemotherapy, systemic chemotherapy or targeted therapy drugs may show benefit over radiotherapy alone.[66]
Ablation methods (e.g. radiofrequency ablation or microwave ablation) are also an option for HCC treatment.[39][67] This method is recommended for small, localized liver tumors as it is recommended that the area treated with radiofrequency ablation should be 2 centimeters or less.[67]
Intrahepatic cholangiocarcinoma[edit]
Resection is an option in cholangiocarcinoma, but fewer than 30% of cases of cholangiocarcinoma are resectable at diagnosis. The reason the majority of intrahepatic cholangiocarcinomas are not able to be surgically removed is because there are often multiple focal tumors within the liver.[68] After surgery, recurrence rates are up to 60%.[69][70] Liver transplant may be used where partial resection is not an option, and adjuvant chemoradiation may benefit some cases.[46]
60% of cholangiocarcinomas form in the perihilar region and photodynamic therapy can be used to improve quality of life and survival time in these un-resectable cases.[48] Photodynamic therapy is a novel treatment that uses light activated molecules to treat the tumor. The compounds are activated in the tumor region by laser light, which causes the release of toxic reactive oxygen species, killing tumor cells.[69][71]
Systemic chemotherapies such as gemcitabine and cisplatin are sometimes used in inoperable cases of cholangiocarcinoma.[46]
Radio frequency ablation, transarterial chemoembolization and internal radiotherapy (brachytherapy) all show promise in the treatment of cholangiocarcinoma[70] and can sometimes improve bile flow, which can decrease the symptoms a patient experiences.[68]
Radiotherapy may be used in the adjuvant setting or for palliative treatment of cholangiocarcinoma.[72]
Hepatoblastoma[edit]
Removing the tumor by either surgical resection or liver transplant can be used in the treatment of hepatoblastoma. In some cases surgery can offer a cure. Chemotherapy may be used before and after surgery and transplant.[73]
Chemotherapy, including cisplatin, vincristine, cyclophosphamide, and doxorubicin are used for the systemic treatment of hepatoblastoma. Out of these drugs, cisplatin seems to be the most effective.[74]
Angiosarcoma and hemangiosarcoma[edit]
Many of these tumors end up not being amenable to surgical treatment.[23] Treatment options include surgically removing parts of the liver that are affected.[22] Liver transplantation and chemotherapy are not effective for angiosarcomas and hemangiosarcomas of the liver.[22]
Epidemiology[edit]
Deaths from liver cancer per million persons in 2012
6–18
19–24
25–32
33–40
41–50
51–65
66–72
73–90
91–122
123–479
Globally, liver cancer is common and increasing.[10] Most recent epidemiological data suggests that liver cancer is in the top 10 for both prevalence and mortality (noted to be the 6th leading cause of cancer and 4th most common cause of death).[43] The Global Burden of Disease Liver Cancer Collaboration found that from 1990 to 2015 the new cases of liver cancer per year increased by 75%.[10] Estimates based on most recent data suggest that each year there are 841,000 new liver cancer diagnoses and 782,000 deaths across the globe.[55] Liver cancer is the most common cancer in Egypt, the Gambia, Guinea, Mongolia, Cambodia, and Vietnam.[55] In terms of gender breakdown, globally liver cancer is more common in men than in women.[43][55]
Given that HCC is the most common type of liver cancer, the areas around the world with the most new cases of HCC each year are Northern and Western Africa as well as Eastern and South-Eastern Asia.[43] China has 50% of HCC cases globally, and more than 80% of total cases occur in sub-Saharan Africa or in East-Asia due to hepatitis B virus.[47][75] In these high disease burden areas, evidence indicates the majority of the HBC and HCV infections occur via perinatal transmission (also called mother-to-child transmission).[43] However, it is important to note that the risk factors for HCC varies by geographic region. For example, in China chronic HBV infection and aflatoxin are the largest risk factors; whereas, in Mongolia it is a combination of HBV and HCV co-infection and high levels of alcohol use that are driving the high levels of HCC.[55]
In terms of intrahepatic cholangiocarcinoma, we currently do not have sufficient epidemiological data because it is a rare cancer. According to the United States National Cancer Institute, the incidence of cholangiocarcinoma is not known. Cholangiocarcinoma also has a significant geographical distribution, with Thailand showing the highest rates worldwide due to the presence of liver fluke.[47][76]
In the United States there were 42,810 new cases of liver and intrahepatic bile duct cancer in 2020, which represents 2.4% of all new cancer cases in the United States.[77] There are about 89.950 people who have liver and intrahepatic liver cancer in the United States.[77] In terms of mortality, the 5-year survival rate for liver and intrahepatic bile duct cancers in the United States is 19.6%.[77] In the United States there is an estimated 1% chance of getting liver cancer across the lifespan, which makes this cancer relatively rare.[77] Despite the low number of cases, it is one of the top causes of cancer deaths.[43]
References[edit]
- ^ a b c d e f g «Adult Primary Liver Cancer Treatment (PDQ®)–Patient Version». NCI. 6 July 2016. Archived from the original on 2 October 2016. Retrieved 29 September 2016.
- ^ a b c «SEER Stat Fact Sheets: Liver and Intrahepatic Bile Duct Cancer». NCI. Archived from the original on 2017-07-28.
- ^ a b c d e f g h i World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 5.6. ISBN 978-9283204299.
- ^ a b GBD 2013 Mortality Causes of Death Collaborators (January 2015). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–171. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ «がん診療連携拠点病院等院内がん登録生存率集計:[国立がん研究センター がん登録・統計]». ganjoho.jp. Retrieved 2 February 2020.
- ^ Vos, Theo; et al. (October 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ a b c Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A (November 2018). «Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries». CA. 68 (6): 394–424. doi:10.3322/caac.21492. PMID 30207593. S2CID 52188256.
- ^ a b c Bruix J, Han KH, Gores G, Llovet JM, Mazzaferro V (April 2015). «Liver cancer: Approaching a personalized care». Journal of Hepatology. 62 (1 Suppl): S144–S156. doi:10.1016/j.jhep.2015.02.007. PMC 4520430. PMID 25920083.
- ^ a b Mantovani A, Targher G (July 2017). «Type 2 diabetes mellitus and risk of hepatocellular carcinoma: spotlight on nonalcoholic fatty liver disease». Annals of Translational Medicine. 5 (13): 270. doi:10.21037/atm.2017.04.41. PMC 5515814. PMID 28758096.
- ^ a b c Akinyemiju T, Abera S, Ahmed M, Alam N, Alemayohu MA, Allen C, et al. (December 2017). «The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level: Results From the Global Burden of Disease Study 2015». JAMA Oncology. 3 (12): 1683–1691. doi:10.1001/jamaoncol.2017.3055. hdl:10037/11672. PMC 5824275. PMID 28983565.
- ^ Cholangiocarcinoma at eMedicine
- ^ «Liver tumors in Children». Boston Children’s Hospital. Archived from the original on 2011-06-04.
- ^ «Liver cancer — Symptoms and causes». Mayo Clinic. Retrieved 2023-02-06.
- ^ Table 37.2 in: Sternberg S (2012). Sternberg’s diagnostic surgical pathology. Place of publication not identified: LWW. ISBN 978-1-4511-5289-0. OCLC 953861627.
- ^ Yang JD, Hainaut P, Gores GJ, Amadou A, Plymoth A, Roberts LR (October 2019). «A global view of hepatocellular carcinoma: trends, risk, prevention and management». Nature Reviews. Gastroenterology & Hepatology. 16 (10): 589–604. doi:10.1038/s41575-019-0186-y. PMC 6813818. PMID 31439937.
- ^ Mokdad AA, Singal AG, Yopp AC (2015-12-22). «JAMA PATIENT PAGE. Liver Cancer». JAMA. 314 (24): 2701. doi:10.1001/jama.2015.15425. PMID 26720038.
- ^ a b c d e «Adult Primary Liver Cancer Treatment (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2021-01-15. Retrieved 2021-02-25.
- ^ Mitchell DG, Bruix J, Sherman M, Sirlin CB (March 2015). «LI-RADS (Liver Imaging Reporting and Data System): summary, discussion, and consensus of the LI-RADS Management Working Group and future directions». Hepatology. 61 (3): 1056–1065. doi:10.1002/hep.27304. PMID 25041904. S2CID 205894014.
- ^ Khan SA, Davidson BR, Goldin RD, Heaton N, Karani J, Pereira SP, et al. (December 2012). «Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update». Gut. 61 (12): 1657–1669. doi:10.1136/gutjnl-2011-301748. PMID 22895392.
- ^ a b Ahmed I, Lobo DN (January 2009). «Malignant tumours of the liver». Surgery. Oxford. 27 (1): 30–37. doi:10.1016/j.mpsur.2008.12.005.
- ^ a b c d e f Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (8 June 2018). Sherlock’s Diseases of the Liver and Biliary System. pp. 705–729. ISBN 978-1-119-23764-8. OCLC 1187411089.
- ^ a b c d e f g Kumar A, Sharma B, Samant H (2021). «Liver Angiosarcoma». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30855812. Retrieved 2021-02-25.
- ^ a b Chen, Nelson; Yu, Aidan (Jia Sheng); Jung, Jihye (2018-05-31). «Editor’s Pick: Primary Hepatic Angiosarcoma: A Brief Review of the Literature». Emj Hepatol Hepatology 6.1 2018. 6 (1): 64–71. doi:10.33590/emjhepatol/10314175. S2CID 53063864. Retrieved 2021-02-25.
- ^ PDQ Pediatric Treatment Editorial Board (2002), «Childhood Liver Cancer Treatment (PDQ®): Health Professional Version», PDQ Cancer Information Summaries, Bethesda (MD): National Cancer Institute (US), PMID 26389232, retrieved 2021-02-25
- ^ Khanna R, Verma SK (September 2018). «Pediatric hepatocellular carcinoma». World Journal of Gastroenterology. 24 (35): 3980–3999. doi:10.3748/wjg.v24.i35.3980. PMC 6148423. PMID 30254403.
- ^ a b Emre S, McKenna GJ (December 2004). «Liver tumors in children». Pediatric Transplantation. 8 (6): 632–638. doi:10.1111/j.1399-3046.2004.00268.x. PMID 15598339. S2CID 35883310.
- ^ a b c «Childhood Liver Cancer Treatment (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2020-11-27. Retrieved 2021-02-25.
- ^ a b Arzumanyan A, Reis HM, Feitelson MA (February 2013). «Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma». Nature Reviews. Cancer. 13 (2): 123–135. doi:10.1038/nrc3449. PMID 23344543. S2CID 29447705.
- ^ Rosen HR (June 2011). «Clinical practice. Chronic hepatitis C infection». The New England Journal of Medicine. 364 (25): 2429–2438. doi:10.1056/NEJMcp1006613. PMID 21696309. S2CID 19755395.
- ^ a b «General Information About Adult Primary Liver Cancer». National Cancer Instituteb. 1980-01-01. Archived from the original on 2 January 2013. Retrieved 13 January 2013.
- ^ Ralphs S, Khan SA (May 2013). «The role of the hepatitis viruses in cholangiocarcinoma». Journal of Viral Hepatitis. 20 (5): 297–305. doi:10.1111/jvh.12093. PMID 23565610. S2CID 44318080.
- ^ Kew MC (March 2013). «Hepatitis viruses (other than hepatitis B and C viruses) as causes of hepatocellular carcinoma: an update». Journal of Viral Hepatitis. 20 (3): 149–157. doi:10.1111/jvh.12043. PMID 23383653. S2CID 206164005.
- ^ Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (8 June 2018). Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (eds.). Sherlock’s diseases of the liver and biliary system. ISBN 978-1-119-23756-3. OCLC 1019837000.
- ^ Jeong SW, Jang JY, Chung RT (December 2012). «Hepatitis C virus and hepatocarcinogenesis». Clinical and Molecular Hepatology. 18 (4): 347–356. doi:10.3350/cmh.2012.18.4.347. PMC 3540370. PMID 23323249.
- ^ Takeda H, Takai A, Inuzuka T, Marusawa H (January 2017). «Genetic basis of hepatitis virus-associated hepatocellular carcinoma: linkage between infection, inflammation, and tumorigenesis». Journal of Gastroenterology. 52 (1): 26–38. doi:10.1007/s00535-016-1273-2. PMID 27714455.
- ^ Yang SF, Chang CW, Wei RJ, Shiue YL, Wang SN, Yeh YT (2014). «Involvement of DNA damage response pathways in hepatocellular carcinoma». BioMed Research International. 2014: 153867. doi:10.1155/2014/153867. PMC 4022277. PMID 24877058.
- ^ Du X, Hidayat K, Shi BM (June 2017). «Abdominal obesity and gastroesophageal cancer risk: systematic review and meta-analysis of prospective studies». Bioscience Reports. 37 (3): BSR20160474. doi:10.1042/BSR20160474. PMC 5426287. PMID 28336766.
- ^ Fattovich G, Stroffolini T, Zagni I, Donato F (November 2004). «Hepatocellular carcinoma in cirrhosis: incidence and risk factors». Gastroenterology. 127 (5 Suppl 1): S35–S50. doi:10.1053/j.gastro.2004.09.014. PMID 15508101.
- ^ a b c d e f g h i j k l Balogh J, Victor D, Asham EH, Burroughs SG, Boktour M, Saharia A, et al. (October 2016). «Hepatocellular carcinoma: a review». Journal of Hepatocellular Carcinoma. 3: 41–53. doi:10.2147/JHC.S61146. PMC 5063561. PMID 27785449.
- ^ a b Smela ME, Currier SS, Bailey EA, Essigmann JM (April 2001). «The chemistry and biology of aflatoxin B(1): from mutational spectrometry to carcinogenesis». Carcinogenesis. 22 (4): 535–545. doi:10.1093/carcin/22.4.535. PMID 11285186.
- ^ Perduca V, Omichessan H, Baglietto L, Severi G (January 2018). «Mutational and epigenetic signatures in cancer tissue linked to environmental exposures and lifestyle». Current Opinion in Oncology. 30 (1): 61–67. doi:10.1097/CCO.0000000000000418. PMID 29076965. S2CID 20842446.
- ^ Dai Y, Huang K, Zhang B, Zhu L, Xu W (November 2017). «Aflatoxin B1-induced epigenetic alterations: An overview». Food and Chemical Toxicology. 109 (Pt 1): 683–689. doi:10.1016/j.fct.2017.06.034. PMID 28645871.
- ^ a b c d e f g h i «Liver (Hepatocellular) Cancer Prevention (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2005-05-23. Retrieved 2021-02-23.
- ^ Di Tommaso L, Sangiovanni A, Borzio M, Park YN, Farinati F, Roncalli M (April 2013). «Advanced precancerous lesions in the liver». Best Practice & Research. Clinical Gastroenterology. 27 (2): 269–284. doi:10.1016/j.bpg.2013.03.015. PMID 23809245.
- ^ a b c Chuang SC, La Vecchia C, Boffetta P (December 2009). «Liver cancer: descriptive epidemiology and risk factors other than HBV and HCV infection». Cancer Letters. 286 (1): 9–14. doi:10.1016/j.canlet.2008.10.040. hdl:11585/682618. PMID 19091458.
- ^ a b c Razumilava N, Gores GJ (January 2013). «Classification, diagnosis, and management of cholangiocarcinoma». Clinical Gastroenterology and Hepatology. 11 (1): 13–21.e1, quiz e3–4. doi:10.1016/j.cgh.2012.09.009. PMC 3596004. PMID 22982100.
- ^ a b c Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D (Mar–Apr 2011). «Global cancer statistics». CA. 61 (2): 69–90. doi:10.3322/caac.20107. PMID 21296855. S2CID 30500384.
- ^ a b Patel T (April 2011). «Cholangiocarcinoma—controversies and challenges». Nature Reviews. Gastroenterology & Hepatology. 8 (4): 189–200. doi:10.1038/nrgastro.2011.20. PMC 3888819. PMID 21460876.
- ^ DeBaun MR, Tucker MA (March 1998). «Risk of cancer during the first four years of life in children from The Beckwith-Wiedemann Syndrome Registry». The Journal of Pediatrics. 132 (3 Pt 1): 398–400. doi:10.1016/S0022-3476(98)70008-3. PMID 9544889.
- ^ a b c Spector LG, Birch J (November 2012). «The epidemiology of hepatoblastoma». Pediatric Blood & Cancer. 59 (5): 776–779. doi:10.1002/pbc.24215. PMID 22692949. S2CID 65545.
- ^ Davit-Spraul A, Gonzales E, Baussan C, Jacquemin E (January 2009). «Progressive familial intrahepatic cholestasis». Orphanet Journal of Rare Diseases. 4: 1. doi:10.1186/1750-1172-4-1. PMC 2647530. PMID 19133130.
- ^ Ariff B, Lloyd CR, Khan S, Shariff M, Thillainayagam AV, Bansi DS, et al. (March 2009). «Imaging of liver cancer». World Journal of Gastroenterology. 15 (11): 1289–1300. doi:10.3748/wjg.15.1289. PMC 2658841. PMID 19294758.
- ^ Malaguarnera G, Paladina I, Giordano M, Malaguarnera M, Bertino G, Berretta M (2013). «Serum markers of intrahepatic cholangiocarcinoma». Disease Markers. 34 (4): 219–228. doi:10.1155/2013/196412. PMC 3809974. PMID 23396291.
- ^ Zhao YJ, Ju Q, Li GC (July 2013). «Tumor markers for hepatocellular carcinoma». Molecular and Clinical Oncology. 1 (4): 593–598. doi:10.3892/mco.2013.119. PMC 3915636. PMID 24649215.
- ^ a b c d e f Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A (November 2018). «Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries». CA. 68 (6): 394–424. doi:10.3322/caac.21492. PMID 30207593.
- ^ a b c Hoshida Y, Fuchs BC, Tanabe KK (November 2012). «Prevention of hepatocellular carcinoma: potential targets, experimental models, and clinical challenges». Current Cancer Drug Targets. 12 (9): 1129–1159. doi:10.2174/156800912803987977. PMC 3776581. PMID 22873223.
- ^ Yen YH, Cheng YF, Wang JH, Lin CC, Chen YY, Yong CC, et al. (2020-03-12). «Real world clinical practice in treating advanced hepatocellular carcinoma: When East meets West». PLOS ONE. 15 (3): e0230005. Bibcode:2020PLoSO..1530005Y. doi:10.1371/journal.pone.0230005. PMC 7067409. PMID 32163475.
- ^ Bruix J, Sherman M (March 2011). «Management of hepatocellular carcinoma: an update». Hepatology. 53 (3): 1020–1022. doi:10.1002/hep.24199. PMC 3084991. PMID 21374666.
- ^ Chen CH (2016-12-01). «Percutaneous radiofrequency ablation for hepatocellular carcinoma: Shortened duration does not comprise its efficacy». Advances in Digestive Medicine. 3 (4): 149–150. doi:10.1016/j.aidm.2016.10.001. S2CID 44047011.
- ^ «Drugs Approved for Liver Cancer — National Cancer Institute». www.cancer.gov. 2011-10-04. Retrieved 2021-02-25.
- ^ «Targeted Cancer Therapies Fact Sheet — National Cancer Institute». www.cancer.gov. 2021-01-25. Retrieved 2021-02-25.
- ^ Bruix J, Sherman M (March 2011). «Management of hepatocellular carcinoma: an update». Hepatology. 53 (3): 1020–1022. doi:10.1002/hep.24199. PMC 3084991. PMID 21374666.
- ^ Wang Z, Zhang G, Wu J, Jia M (August 2013). «Adjuvant therapy for hepatocellular carcinoma: current situation and prospect». Drug Discoveries & Therapeutics. 7 (4): 137–143. doi:10.5582/ddt.2013.v7.4.137. PMID 24071575.
- ^ a b de Lope CR, Tremosini S, Forner A, Reig M, Bruix J (2012). «Management of HCC». Journal of Hepatology. 56 (Suppl 1): S75–S87. doi:10.1016/S0168-8278(12)60009-9. PMID 22300468.
- ^ Keating GM, Santoro A (2009). «Sorafenib: a review of its use in advanced hepatocellular carcinoma». Drugs. 69 (2): 223–240. doi:10.2165/00003495-200969020-00006. PMID 19228077.
- ^ Feng M, Ben-Josef E (October 2011). «Radiation therapy for hepatocellular carcinoma». Seminars in Radiation Oncology. 21 (4): 271–277. doi:10.1016/j.semradonc.2011.05.002. PMID 21939856.
- ^ a b Tarasik A, Jaroszewicz J, Januszkiewicz M (March 2017). «Surgical treatment of liver tumors — own experience and literature review». Clinical and Experimental Hepatology. 3 (1): 1–8. doi:10.5114/ceh.2017.65498. PMC 5497454. PMID 28856283.
- ^ a b «Bile Duct Cancer (Cholangiocarcinoma) Treatment (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2021-02-19. Retrieved 2021-02-25.
- ^ a b Ulstrup T, Pedersen FM (February 2013). «[Photodynamic therapy of cholangiocarcinomas]». Ugeskrift for Laeger. 175 (9): 579–582. PMID 23608009.
- ^ a b Kuhlmann JB, Blum HE (May 2013). «Locoregional therapy for cholangiocarcinoma». Current Opinion in Gastroenterology. 29 (3): 324–328. doi:10.1097/MOG.0b013e32835d9dea. PMID 23337933. S2CID 37403999.
- ^ Ortner MA (September 2011). «Photodynamic therapy for cholangiocarcinoma». Lasers in Surgery and Medicine. 43 (7): 776–780. doi:10.1002/lsm.21106. PMID 22057505. S2CID 36852386.
- ^ Valero V, Cosgrove D, Herman JM, Pawlik TM (August 2012). «Management of perihilar cholangiocarcinoma in the era of multimodal therapy». Expert Review of Gastroenterology & Hepatology. 6 (4): 481–495. doi:10.1586/egh.12.20. PMC 3538366. PMID 22928900.
- ^ Meyers RL, Czauderna P, Otte JB (November 2012). «Surgical treatment of hepatoblastoma». Pediatric Blood & Cancer. 59 (5): 800–808. doi:10.1002/pbc.24220. PMID 22887704. S2CID 27329163.
- ^ Perilongo G, Malogolowkin M, Feusner J (November 2012). «Hepatoblastoma clinical research: lessons learned and future challenges». Pediatric Blood & Cancer. 59 (5): 818–821. doi:10.1002/pbc.24217. PMID 22678761. S2CID 19059413.
- ^ El-Serag HB, Rudolph KL (June 2007). «Hepatocellular carcinoma: epidemiology and molecular carcinogenesis». Gastroenterology. 132 (7): 2557–2576. doi:10.1053/j.gastro.2007.04.061. PMID 17570226.
- ^ Khan SA, Toledano MB, Taylor-Robinson SD (2008). «Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma». HPB. 10 (2): 77–82. doi:10.1080/13651820801992641. PMC 2504381. PMID 18773060.
- ^ a b c d «Cancer of the Liver and Intrahepatic Bile Duct — Cancer Stat Facts». SEER. Retrieved 2021-02-23.
External links[edit]
- EASL Guideline
- Liver cancer information from Cancer Research UK
| Liver cancer | |
|---|---|
| Other names | Hepatic cancer, primary hepatic malignancy, primary liver cancer |
 |
|
| CT scan of a liver with cholangiocarcinoma | |
| Specialty | Gastroenterology Hepatology Oncology |
| Symptoms | Lump or pain in the right side below the rib cage, swelling of the abdomen, yellowish skin, easy bruising, weight loss, weakness[1] |
| Usual onset | 55 to 65 years old[2] |
| Causes | hepatitis B, hepatitis C, alcohol, aflatoxin, non-alcoholic fatty liver disease, liver flukes[3][4] |
| Diagnostic method | Blood tests, medical imaging, tissue biopsy[1] |
| Prevention | Immunization against hepatitis B, treating those infected with hepatitis B or C,[3] decreasing exposure to aflatoxin, decreasing high levels of alcohol consumption |
| Treatment | Surgery, targeted therapy, radiation therapy[1] |
| Prognosis | Five-year survival rates ~18% (US);[2] 40% (Japan)[5] |
| Frequency | 618,700 (point in time in 2015)[6] |
| Deaths | 782,000 (2018)[7] |
Liver cancer (also known as hepatic cancer, primary hepatic cancer, or primary hepatic malignancy) is cancer that starts in the liver.[1] Liver cancer can be primary (starts in liver) or secondary (meaning cancer which has spread from elsewhere to the liver, known as liver metastasis). Liver metastasis is more common than that which starts in the liver.[3] Liver cancer is increasing globally.[8][9]
Primary liver cancer is globally the sixth-most frequent cancer and the fourth-leading cause of death from cancer.[7][10] In 2018, it occurred in 841,000 people and resulted in 782,000 deaths globally.[7] Higher rates of liver cancer occur where hepatitis B and C are common, including Asia and sub-Saharan Africa.[3] Males are more often affected with hepatocellular carcinoma (HCC) than females.[3] Diagnosis is most frequent among those 55 to 65 years old.[2]
The leading cause of liver cancer is cirrhosis due to hepatitis B, hepatitis C or alcohol.[4] Other causes include aflatoxin, non-alcoholic fatty liver disease and liver flukes.[3] The most common types are HCC, which makes up 80% of cases and intrahepatic cholangiocarcinoma.[3] The diagnosis may be supported by blood tests and medical imaging, with confirmation by tissue biopsy.[1]
Given that there are many different causes of liver cancer, there are many approaches to liver cancer prevention. These efforts include immunization against hepatitis B,[3] hepatitis B treatment, hepatitis C treatment, decreasing alcohol use,[8] decreasing exposure to aflatoxin in agriculture, and management of obesity and diabetes.[9] Screening is recommended in those with chronic liver disease.[3] For example, it is recommended that people with chronic liver disease who are at risk for hepatocellular carcinoma be screened every 6 months using ultrasound imaging.[8]
Because liver cancer is an umbrella term for many types of cancer, the signs and symptoms depend on what type of cancer is present. Symptoms can be vague and broad. Cholangiocarcinoma is associated with sweating, jaundice, abdominal pain, weight loss and liver enlargement.[11] Hepatocellular carcinoma is associated with abdominal mass, abdominal pain, emesis, anemia, back pain, jaundice, itching, weight loss and fever.[12]
Treatment options may include surgery, targeted therapy and radiation therapy.[1] In certain cases, ablation therapy, embolization therapy or liver transplantation may be used.[1]
Classification[edit]
Liver cancer can come from the liver parenchyma as well as other structures within the liver such as the bile duct, blood vessels and immune cells[13] There are many sub-types of liver cancer, the most common of which are described below.
Hepatocellular carcinoma[edit]
Liver tumor types by relative incidence in adults in the United States (liver cancers in dark red color).[14]
The most frequent liver cancer, accounting for approximately 75% of all primary liver cancers, is hepatocellular carcinoma (HCC).[15] HCC is a cancer formed by liver cells, known as hepatocytes, that become malignant. In terms of cancer deaths, worldwide HCC is considered the 3rd most common cause of cancer mortalities.[16]
In terms of HCC diagnosis, it is recommended that people with risk factors (including known chronic liver disease, cirrhosis, etc.) should receive screening ultrasounds. If the ultrasound shows a focal area that is larger than 1 centimeter in size, patients should then get a triple-phase contrast-enhanced CT or MRI imaging.[17] HCC can then be diagnosed radiologically using the Liver Imaging Reporting and Data System (LI-RADS).[18] There is also a variant type of HCC that consists of both HCC and cholangiocarcinoma.[19]
Intrahepatic cholangiocarcinoma[edit]
Cancer of the bile duct (cholangiocarcinoma and cholangiocellular cystadenocarcinoma) account for approximately 6% of primary liver cancers.[20] Intrahepatic cholangiocarcinoma (CCA) is an epithelial cancer of the intra-hepatic biliary tree branches.[21] Intrahepatic CCA is the second leading cause of primary liver cancer.[21] It is more common in men and usually is diagnosed in 60-70 year olds.[21] Risk factors for development of intrahepatic CCA include opisthorchus viverrini infection, Clonorchis sinensis infection, sclerosing cholangitis, choledochal cysts, past procedures of the biliary tree, exposure to thorotrast and dioxins, and cirrhosis.[21] This cancer is usually asymptomatic until the disease has progressed. Symptoms include abdominal pain, night sweats, weight loss, and fatigue.[21] Liver markers that can be increased with intrahepatic CCA are carcinoembryonic antigen (CEA), CA19-9, and CA-125.[21]
Angiosarcoma and hemangiosarcoma[edit]
These are rare and aggressive liver cancers, yet are the third most common primary liver cancer making up 0.1-2.0% of primary liver cancer.[22] Angiosarcoma and hemangiosarcoma of the liver come from the blood vessel’s endothelial layer. These tumors have poor outcomes because they grow rapidly and metastasise easily. They are also hard to diagnose but are typically suspected on CT or MRI imaging that shows focal lesions with differing amounts of echogenicity (these tumors have a lot of bleeding or hemorrhage and subsequent dying of tissue (necrosis)).[23] Biopsy with histopathological evaluation yields the definitive diagnosis.[22] While the cause is often never identified (75% are idiopathic), they are associated with exposures to substances such as vinyl chloride, arsenic, thorotrast (e.g. occupational exposure). Radiation is also a risk factor.[22] In adults, these tumors are more common in males; however, in children they are more common in females.[22]
Even with surgery prognosis is poor with most individuals not living longer than six months after diagnosis. Only 3% of individuals live longer than two years.[22]
Hepatoblastoma[edit]
Another type of cancer formed by liver cells is hepatoblastoma, which is specifically formed by immature liver cells.[20] It is a rare malignant tumor that primarily develops in children, and accounts for approximately 1% of all cancers in children and 79% of all primary liver cancers under the age of 15.[24][25] Most hepatoblastomas form in the right lobe.[26]
Metastasis to liver[edit]
Many cancers found in the liver are not true liver cancers but are cancers from other sites in the body that have spread to the liver (known as metastases). Frequently, the site of origin is the gastrointestinal tract, since the liver is close to many of these metabolically active, blood-rich organs near to blood vessels and lymph nodes (such as pancreatic cancer, stomach cancer, colon cancer and carcinoid tumors mainly of the appendix), but also from breast cancer, ovarian cancer, lung cancer, renal cancer, prostate cancer.
Children[edit]
The Children’s Oncology Group (COG) has developed a protocol to help diagnose and manage childhood liver tumors.[27]
Causes[edit]
Viral infection[edit]
Viral infection with hepatitis C virus (HCV) or Hepatitis B virus (HBV) is the chief cause of liver cancer in the world today, accounting for 80% of HCC.[28][29][30] Men with chronic HCV or HBV are more likely to develop HCC than women with chronic HCV or HBV; however, the reasons for this gender difference is unknown. HBV infection is also linked to cholangiocarcinoma.[31] The role of viruses other than HCV or HBV in liver cancer is much less clear, even though there is some evidence that co-infection of HBV and hepatitis D virus may increase the risk for HCC.[32]
HBV and HCV can lead to HCC, because these viral infections cause massive inflammation, fibrosis, and eventual cirrhosis occurs within the liver.[33] In addition, many genetic and epigenetic changes are formed in liver cells during HCV and HBV infection, which is a major factor in the production of the liver tumors. The viruses induce malignant changes in cells by altering gene methylation, affecting gene expression, and promoting or repressing cellular signal transduction pathways. By doing this, the viruses can prevent cells from undergoing a programmed form of cell death (apoptosis) and promote viral replication and persistence.[28][34]
HBV and HCV also induce malignant changes by causing DNA damage and genomic instability. This is by creating reactive oxygen species, express proteins that interfere with DNA repair enzymes, and HCV causes activation of a mutator enzyme.[35][36]
Cirrhosis[edit]
In addition to virus-related cirrhosis described above, other causes of cirrhosis can lead to HCC. Alcohol intake correlates with risk of HCC, and the risk is far greater in individuals with an alcohol-induced cirrhotic liver.[37] There are a few disorders that are known to cause cirrhosis and lead to cancer, including hereditary hemochromatosis and primary biliary cirrhosis.[38]
Aflatoxin[edit]
Aflatoxin exposure can lead to the development of HCC.[39] The aflatoxins are a group of chemicals produced by the fungi Aspergillus flavus (the name comes from A. flavus toxin) and A. parasiticus. Food contamination by the fungi leads to ingestion of the chemicals, which are very toxic to the liver. Common foodstuffs contaminated with the toxins are cereals, peanuts, and other vegetables. The amount (dose) and how long (duration) that a person is in contact with aflatoxin is associated with HCC.[39] Contamination of food is common in Africa, South-East Asia, and China. The mechanism by which aflatoxins cause cancer is through mutations and epigenetic alterations. Aflatoxins induce a spectrum of mutations,[40][41] including in the p53 tumor suppressor gene, which is a mutation seen in many types of cancers.[40] Mutation in p53, presumably in conjunction with other aflatoxin-induced mutations and epigenetic alterations,[42] is likely a common cause of aflatoxin-induced carcinogenesis.
Nonalcoholic steatohepatitis (NASH) and Nonalcoholic fatty liver (NAFL)[edit]
NASH and NAFL is beginning to be called a risk factor for liver cancer, particularly HCC.[43] In recent years, there has been a noted increase in liver transplantations for HCC that was attributable to NASH.[39] More research is needed in this area and NASH/NAFL.[43]
Other risk factors in adults[edit]
- High grade dysplastic nodules are precancerous lesions of the liver. Within two years, there is a risk for cancer arising from these nodules of 30–40%.[44]
- Obesity and metabolic syndrome have emerged as an important risk factor, as they can lead to steatohepatitis.[30][45]
- Diabetes increases the risk for HCC.[45][39]
- Smoking increases the risk for HCC compared to non-smokers and previous smokers.[45]
- There is around 5-10% lifetime risk of cholangiocarcinoma in people with primary sclerosing cholangitis.[46]
- Liver fluke infection increases the risk for cholangiocarcinoma, and this is the reason why Thailand has particularly high rates of this cancer.[47]
- Choledochal cysts, Caroli’s disease, and congenital hepatic fibrosis are associated with cholangiocarcinoma development.[48]
- Genetic conditions: untreated hereditary hemochromatosis, alpha-1-antitrypsin deficiency, glycogen storage diseases, porphyria cutanea tarda, Wilson’s disease, tyrosinemia have all been associated with development of HCC.[39][43]
- Oral contraceptive pill: There is insufficient evidence to label oral contraceptives as a risk factor. However, recent studies have found that taking oral contraceptives for longer than 5 years is associated with HCC.[39]
Children[edit]
Childhood liver cancer is uncommon.[27] The liver cancer sub-types most commonly seen in children are hepatoblastoma, hepatocellular carcinoma, embryomal sarcoma of liver, infantile choriocarcinoma of liver, and biliary rhabdomyosarcoma.[27] Increased risk for liver cancer in children can be caused by Beckwith–Wiedemann syndrome (associated with hepatoblastoma),[49][50] familial adenomatous polyposis (associated with hepatoblastoma),[50] low birth weight (associated with hepatoblastoma),[26] Progressive familial intrahepatic cholestasis (associated with HCC)[51] and Trisomy 18 (associated with hepatoblastoma).[50]
Diagnosis[edit]
Many imaging modalities are used to aid in the diagnosis of liver cancer. For HCC these include medical ultrasound, computed tomography (CT) and magnetic resonance imaging (MRI). When imaging the liver with ultrasound, large lesions are likely to be HCC (e.g., a mass greater than 2 cm has more than 95% chance of being HCC).Given the blood flow to the liver, HCC would be most visible when the contrast flows through the arteries of the liver (also called the arterial phase) rather than when the contrast flows through the veins (also called the venous phase).[17] Sometimes doctors will get a liver biopsy, if they are worried about HCC and the imaging studies (CT or MRI) do not have clear results.[17] The majority of cholangiocarcimas occur in the hilar region of the liver, and often present as bile duct obstruction. If the cause of obstruction is suspected to be malignant, endoscopic retrograde cholangiopancreatography (ERCP), ultrasound, CT, MRI and magnetic resonance cholangiopancreatography (MRCP) are used.[52]
Tumor markers, chemicals sometimes found in the blood of people with cancer, can be helpful in diagnosing and monitoring the course of liver cancers. High levels of alpha-fetoprotein (AFP) in the blood can be found in many cases of HCC and intrahepatic cholangiocarcinoma.[17] Of note, AFP is most useful for monitoring if liver cancers come back after treatment rather than for initial diagnosis.[17] Cholangiocarcinoma can be detected with these commonly used tumor markers: carbohydrate antigen 19-9 (CA 19–9), carcinoembryonic antigen (CEA) and cancer antigen 125 (CA125). These tumor markers are found in primary liver cancers, as well as in other cancers and certain other disorders.[53][54]
Prevention[edit]
Prevention of cancers can be separated into primary, secondary, and tertiary prevention. Primary prevention preemptively reduces exposure to a risk factor for liver cancer. One of the most successful primary liver cancer preventions is vaccination against hepatitis B.[43] Vaccination against the hepatitis C virus is currently unavailable.[55] Other forms of primary prevention are aimed at limiting transmission of these viruses by promoting safe injection practices, screening blood donation products, and screening high-risk asymptomatic individuals.[55] Aflatoxin exposure can be avoided by post-harvest intervention to discourage mold, which has been effective in west Africa. Reducing alcohol use disorder, obesity, and diabetes mellitus would also reduce rates of liver cancer. Diet control in hemochromatosis could decrease the risk of iron overload, decreasing the risk of cancer.[56]
Secondary prevention includes both cure of the agent involved in the formation of cancer (carcinogenesis) and the prevention of carcinogenesis if this is not possible. Cure of virus-infected individuals is not possible, but treatment with antiviral drugs can decrease the risk of liver cancer. Chlorophyllin may have potential in reducing the effects of aflatoxin.[56]
Tertiary prevention includes treatments to prevent the recurrence of liver cancer. These include the use of surgical interventions, chemotherapy drugs, and antiviral drugs.[56]
Treatment[edit]
General considerations[edit]
Like many cancers, treatment depends on the specific type of liver cancer as well as stage of the cancer. The main way cancer is staged is based on the TMN staging systems. There are also liver cancer specific staging systems, each of which has treatment options that may result in a non recurrence of cancer, or cure[57][58] [59] (see Radio Frequency Ablation) For example, for HCC it is common to use the Barcelona Clinic Liver Cancer Staging System.[39]
Treatments include surgery, medications, and ablation methods, which are described in the sections below. There are many chemotherapeutic drugs approved for liver cancer including: atezolizumab, nivolumab, keytruda, stivarga, etc.[60] Increasingly, immunotherapy agents (also called targeted cancer therapies or precision medicine) is being used to treat hepatobiliary cancers.[61]
Hepatocellular carcinoma[edit]
|
|
This section’s factual accuracy may be compromised due to out-of-date information. Please help update this article to reflect recent events or newly available information. (June 2017) |
Partial surgical resection is the recommended treatment for hepatocellular carcinoma (HCC) when patients have sufficient hepatic function reserve.[39] 5-year survival rates after resection have massively improved over the last few decades and can now ranges from 41 to 74%.[39] However, recurrence rates after resection can exceed 70%, whether due to spread of the initial tumor or formation of new tumors .[62] Liver transplantation can also be considered in cases of HCC where this form of treatment can be tolerated and the tumor fits specific criteria (such as the Milan criteria). In general, patients who are being considered for liver transplantation have multiple hepatic lesions, severe underlying liver dysfunction, or both.
Percutaneous ablation is the only non-surgical treatment that can offer cure. There are many forms of percutaneous ablation, which consist of either injecting chemicals into the liver (ethanol or acetic acid) or producing extremes of temperature using radio frequency ablation, microwaves, lasers or cryotherapy. Of these, radio frequency ablation has one of the best reputations in HCC, but the limitations include inability to treat tumors close to other organs and blood vessels due to heat generation and the heat sink effect, respectively.[63][64] In addition, long-term of outcomes of percutaneous ablation procedures for HCC have not been well studied. In general, surgery is the preferred treatment modality when possible.
Systemic chemotherapeutics are not routinely used in HCC, although local chemotherapy may be used in a procedure known as transarterial chemoembolization (TACE). In this procedure, drugs that kill cancer cells and interrupt the blood supply are applied to the tumor. Because most systemic drugs have no efficacy in the treatment of HCC, research into the molecular pathways involved in the production of liver cancer produced sorafenib, a targeted therapy drug that prevents cell proliferation and blood cell growth. Sorafenib obtained FDA approval for the treatment of advanced hepatocellular carcinoma in November 2007.[65] This drug provides a survival benefit for advanced HCC.[64]
Transarterial radioembolization (TRACE) is another option for HCC.[39] In this procedure, radiation treatment is targeted at the tumor. TRACE is still considered an add on treatment rather than the first choice for treatment of HCC,[39] as dual treatments of radiotherapy plus chemoembolization, local chemotherapy, systemic chemotherapy or targeted therapy drugs may show benefit over radiotherapy alone.[66]
Ablation methods (e.g. radiofrequency ablation or microwave ablation) are also an option for HCC treatment.[39][67] This method is recommended for small, localized liver tumors as it is recommended that the area treated with radiofrequency ablation should be 2 centimeters or less.[67]
Intrahepatic cholangiocarcinoma[edit]
Resection is an option in cholangiocarcinoma, but fewer than 30% of cases of cholangiocarcinoma are resectable at diagnosis. The reason the majority of intrahepatic cholangiocarcinomas are not able to be surgically removed is because there are often multiple focal tumors within the liver.[68] After surgery, recurrence rates are up to 60%.[69][70] Liver transplant may be used where partial resection is not an option, and adjuvant chemoradiation may benefit some cases.[46]
60% of cholangiocarcinomas form in the perihilar region and photodynamic therapy can be used to improve quality of life and survival time in these un-resectable cases.[48] Photodynamic therapy is a novel treatment that uses light activated molecules to treat the tumor. The compounds are activated in the tumor region by laser light, which causes the release of toxic reactive oxygen species, killing tumor cells.[69][71]
Systemic chemotherapies such as gemcitabine and cisplatin are sometimes used in inoperable cases of cholangiocarcinoma.[46]
Radio frequency ablation, transarterial chemoembolization and internal radiotherapy (brachytherapy) all show promise in the treatment of cholangiocarcinoma[70] and can sometimes improve bile flow, which can decrease the symptoms a patient experiences.[68]
Radiotherapy may be used in the adjuvant setting or for palliative treatment of cholangiocarcinoma.[72]
Hepatoblastoma[edit]
Removing the tumor by either surgical resection or liver transplant can be used in the treatment of hepatoblastoma. In some cases surgery can offer a cure. Chemotherapy may be used before and after surgery and transplant.[73]
Chemotherapy, including cisplatin, vincristine, cyclophosphamide, and doxorubicin are used for the systemic treatment of hepatoblastoma. Out of these drugs, cisplatin seems to be the most effective.[74]
Angiosarcoma and hemangiosarcoma[edit]
Many of these tumors end up not being amenable to surgical treatment.[23] Treatment options include surgically removing parts of the liver that are affected.[22] Liver transplantation and chemotherapy are not effective for angiosarcomas and hemangiosarcomas of the liver.[22]
Epidemiology[edit]
Deaths from liver cancer per million persons in 2012
6–18
19–24
25–32
33–40
41–50
51–65
66–72
73–90
91–122
123–479
Globally, liver cancer is common and increasing.[10] Most recent epidemiological data suggests that liver cancer is in the top 10 for both prevalence and mortality (noted to be the 6th leading cause of cancer and 4th most common cause of death).[43] The Global Burden of Disease Liver Cancer Collaboration found that from 1990 to 2015 the new cases of liver cancer per year increased by 75%.[10] Estimates based on most recent data suggest that each year there are 841,000 new liver cancer diagnoses and 782,000 deaths across the globe.[55] Liver cancer is the most common cancer in Egypt, the Gambia, Guinea, Mongolia, Cambodia, and Vietnam.[55] In terms of gender breakdown, globally liver cancer is more common in men than in women.[43][55]
Given that HCC is the most common type of liver cancer, the areas around the world with the most new cases of HCC each year are Northern and Western Africa as well as Eastern and South-Eastern Asia.[43] China has 50% of HCC cases globally, and more than 80% of total cases occur in sub-Saharan Africa or in East-Asia due to hepatitis B virus.[47][75] In these high disease burden areas, evidence indicates the majority of the HBC and HCV infections occur via perinatal transmission (also called mother-to-child transmission).[43] However, it is important to note that the risk factors for HCC varies by geographic region. For example, in China chronic HBV infection and aflatoxin are the largest risk factors; whereas, in Mongolia it is a combination of HBV and HCV co-infection and high levels of alcohol use that are driving the high levels of HCC.[55]
In terms of intrahepatic cholangiocarcinoma, we currently do not have sufficient epidemiological data because it is a rare cancer. According to the United States National Cancer Institute, the incidence of cholangiocarcinoma is not known. Cholangiocarcinoma also has a significant geographical distribution, with Thailand showing the highest rates worldwide due to the presence of liver fluke.[47][76]
In the United States there were 42,810 new cases of liver and intrahepatic bile duct cancer in 2020, which represents 2.4% of all new cancer cases in the United States.[77] There are about 89.950 people who have liver and intrahepatic liver cancer in the United States.[77] In terms of mortality, the 5-year survival rate for liver and intrahepatic bile duct cancers in the United States is 19.6%.[77] In the United States there is an estimated 1% chance of getting liver cancer across the lifespan, which makes this cancer relatively rare.[77] Despite the low number of cases, it is one of the top causes of cancer deaths.[43]
References[edit]
- ^ a b c d e f g «Adult Primary Liver Cancer Treatment (PDQ®)–Patient Version». NCI. 6 July 2016. Archived from the original on 2 October 2016. Retrieved 29 September 2016.
- ^ a b c «SEER Stat Fact Sheets: Liver and Intrahepatic Bile Duct Cancer». NCI. Archived from the original on 2017-07-28.
- ^ a b c d e f g h i World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 5.6. ISBN 978-9283204299.
- ^ a b GBD 2013 Mortality Causes of Death Collaborators (January 2015). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–171. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ «がん診療連携拠点病院等院内がん登録生存率集計:[国立がん研究センター がん登録・統計]». ganjoho.jp. Retrieved 2 February 2020.
- ^ Vos, Theo; et al. (October 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ a b c Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A (November 2018). «Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries». CA. 68 (6): 394–424. doi:10.3322/caac.21492. PMID 30207593. S2CID 52188256.
- ^ a b c Bruix J, Han KH, Gores G, Llovet JM, Mazzaferro V (April 2015). «Liver cancer: Approaching a personalized care». Journal of Hepatology. 62 (1 Suppl): S144–S156. doi:10.1016/j.jhep.2015.02.007. PMC 4520430. PMID 25920083.
- ^ a b Mantovani A, Targher G (July 2017). «Type 2 diabetes mellitus and risk of hepatocellular carcinoma: spotlight on nonalcoholic fatty liver disease». Annals of Translational Medicine. 5 (13): 270. doi:10.21037/atm.2017.04.41. PMC 5515814. PMID 28758096.
- ^ a b c Akinyemiju T, Abera S, Ahmed M, Alam N, Alemayohu MA, Allen C, et al. (December 2017). «The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level: Results From the Global Burden of Disease Study 2015». JAMA Oncology. 3 (12): 1683–1691. doi:10.1001/jamaoncol.2017.3055. hdl:10037/11672. PMC 5824275. PMID 28983565.
- ^ Cholangiocarcinoma at eMedicine
- ^ «Liver tumors in Children». Boston Children’s Hospital. Archived from the original on 2011-06-04.
- ^ «Liver cancer — Symptoms and causes». Mayo Clinic. Retrieved 2023-02-06.
- ^ Table 37.2 in: Sternberg S (2012). Sternberg’s diagnostic surgical pathology. Place of publication not identified: LWW. ISBN 978-1-4511-5289-0. OCLC 953861627.
- ^ Yang JD, Hainaut P, Gores GJ, Amadou A, Plymoth A, Roberts LR (October 2019). «A global view of hepatocellular carcinoma: trends, risk, prevention and management». Nature Reviews. Gastroenterology & Hepatology. 16 (10): 589–604. doi:10.1038/s41575-019-0186-y. PMC 6813818. PMID 31439937.
- ^ Mokdad AA, Singal AG, Yopp AC (2015-12-22). «JAMA PATIENT PAGE. Liver Cancer». JAMA. 314 (24): 2701. doi:10.1001/jama.2015.15425. PMID 26720038.
- ^ a b c d e «Adult Primary Liver Cancer Treatment (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2021-01-15. Retrieved 2021-02-25.
- ^ Mitchell DG, Bruix J, Sherman M, Sirlin CB (March 2015). «LI-RADS (Liver Imaging Reporting and Data System): summary, discussion, and consensus of the LI-RADS Management Working Group and future directions». Hepatology. 61 (3): 1056–1065. doi:10.1002/hep.27304. PMID 25041904. S2CID 205894014.
- ^ Khan SA, Davidson BR, Goldin RD, Heaton N, Karani J, Pereira SP, et al. (December 2012). «Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update». Gut. 61 (12): 1657–1669. doi:10.1136/gutjnl-2011-301748. PMID 22895392.
- ^ a b Ahmed I, Lobo DN (January 2009). «Malignant tumours of the liver». Surgery. Oxford. 27 (1): 30–37. doi:10.1016/j.mpsur.2008.12.005.
- ^ a b c d e f Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (8 June 2018). Sherlock’s Diseases of the Liver and Biliary System. pp. 705–729. ISBN 978-1-119-23764-8. OCLC 1187411089.
- ^ a b c d e f g Kumar A, Sharma B, Samant H (2021). «Liver Angiosarcoma». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30855812. Retrieved 2021-02-25.
- ^ a b Chen, Nelson; Yu, Aidan (Jia Sheng); Jung, Jihye (2018-05-31). «Editor’s Pick: Primary Hepatic Angiosarcoma: A Brief Review of the Literature». Emj Hepatol Hepatology 6.1 2018. 6 (1): 64–71. doi:10.33590/emjhepatol/10314175. S2CID 53063864. Retrieved 2021-02-25.
- ^ PDQ Pediatric Treatment Editorial Board (2002), «Childhood Liver Cancer Treatment (PDQ®): Health Professional Version», PDQ Cancer Information Summaries, Bethesda (MD): National Cancer Institute (US), PMID 26389232, retrieved 2021-02-25
- ^ Khanna R, Verma SK (September 2018). «Pediatric hepatocellular carcinoma». World Journal of Gastroenterology. 24 (35): 3980–3999. doi:10.3748/wjg.v24.i35.3980. PMC 6148423. PMID 30254403.
- ^ a b Emre S, McKenna GJ (December 2004). «Liver tumors in children». Pediatric Transplantation. 8 (6): 632–638. doi:10.1111/j.1399-3046.2004.00268.x. PMID 15598339. S2CID 35883310.
- ^ a b c «Childhood Liver Cancer Treatment (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2020-11-27. Retrieved 2021-02-25.
- ^ a b Arzumanyan A, Reis HM, Feitelson MA (February 2013). «Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma». Nature Reviews. Cancer. 13 (2): 123–135. doi:10.1038/nrc3449. PMID 23344543. S2CID 29447705.
- ^ Rosen HR (June 2011). «Clinical practice. Chronic hepatitis C infection». The New England Journal of Medicine. 364 (25): 2429–2438. doi:10.1056/NEJMcp1006613. PMID 21696309. S2CID 19755395.
- ^ a b «General Information About Adult Primary Liver Cancer». National Cancer Instituteb. 1980-01-01. Archived from the original on 2 January 2013. Retrieved 13 January 2013.
- ^ Ralphs S, Khan SA (May 2013). «The role of the hepatitis viruses in cholangiocarcinoma». Journal of Viral Hepatitis. 20 (5): 297–305. doi:10.1111/jvh.12093. PMID 23565610. S2CID 44318080.
- ^ Kew MC (March 2013). «Hepatitis viruses (other than hepatitis B and C viruses) as causes of hepatocellular carcinoma: an update». Journal of Viral Hepatitis. 20 (3): 149–157. doi:10.1111/jvh.12043. PMID 23383653. S2CID 206164005.
- ^ Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (8 June 2018). Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (eds.). Sherlock’s diseases of the liver and biliary system. ISBN 978-1-119-23756-3. OCLC 1019837000.
- ^ Jeong SW, Jang JY, Chung RT (December 2012). «Hepatitis C virus and hepatocarcinogenesis». Clinical and Molecular Hepatology. 18 (4): 347–356. doi:10.3350/cmh.2012.18.4.347. PMC 3540370. PMID 23323249.
- ^ Takeda H, Takai A, Inuzuka T, Marusawa H (January 2017). «Genetic basis of hepatitis virus-associated hepatocellular carcinoma: linkage between infection, inflammation, and tumorigenesis». Journal of Gastroenterology. 52 (1): 26–38. doi:10.1007/s00535-016-1273-2. PMID 27714455.
- ^ Yang SF, Chang CW, Wei RJ, Shiue YL, Wang SN, Yeh YT (2014). «Involvement of DNA damage response pathways in hepatocellular carcinoma». BioMed Research International. 2014: 153867. doi:10.1155/2014/153867. PMC 4022277. PMID 24877058.
- ^ Du X, Hidayat K, Shi BM (June 2017). «Abdominal obesity and gastroesophageal cancer risk: systematic review and meta-analysis of prospective studies». Bioscience Reports. 37 (3): BSR20160474. doi:10.1042/BSR20160474. PMC 5426287. PMID 28336766.
- ^ Fattovich G, Stroffolini T, Zagni I, Donato F (November 2004). «Hepatocellular carcinoma in cirrhosis: incidence and risk factors». Gastroenterology. 127 (5 Suppl 1): S35–S50. doi:10.1053/j.gastro.2004.09.014. PMID 15508101.
- ^ a b c d e f g h i j k l Balogh J, Victor D, Asham EH, Burroughs SG, Boktour M, Saharia A, et al. (October 2016). «Hepatocellular carcinoma: a review». Journal of Hepatocellular Carcinoma. 3: 41–53. doi:10.2147/JHC.S61146. PMC 5063561. PMID 27785449.
- ^ a b Smela ME, Currier SS, Bailey EA, Essigmann JM (April 2001). «The chemistry and biology of aflatoxin B(1): from mutational spectrometry to carcinogenesis». Carcinogenesis. 22 (4): 535–545. doi:10.1093/carcin/22.4.535. PMID 11285186.
- ^ Perduca V, Omichessan H, Baglietto L, Severi G (January 2018). «Mutational and epigenetic signatures in cancer tissue linked to environmental exposures and lifestyle». Current Opinion in Oncology. 30 (1): 61–67. doi:10.1097/CCO.0000000000000418. PMID 29076965. S2CID 20842446.
- ^ Dai Y, Huang K, Zhang B, Zhu L, Xu W (November 2017). «Aflatoxin B1-induced epigenetic alterations: An overview». Food and Chemical Toxicology. 109 (Pt 1): 683–689. doi:10.1016/j.fct.2017.06.034. PMID 28645871.
- ^ a b c d e f g h i «Liver (Hepatocellular) Cancer Prevention (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2005-05-23. Retrieved 2021-02-23.
- ^ Di Tommaso L, Sangiovanni A, Borzio M, Park YN, Farinati F, Roncalli M (April 2013). «Advanced precancerous lesions in the liver». Best Practice & Research. Clinical Gastroenterology. 27 (2): 269–284. doi:10.1016/j.bpg.2013.03.015. PMID 23809245.
- ^ a b c Chuang SC, La Vecchia C, Boffetta P (December 2009). «Liver cancer: descriptive epidemiology and risk factors other than HBV and HCV infection». Cancer Letters. 286 (1): 9–14. doi:10.1016/j.canlet.2008.10.040. hdl:11585/682618. PMID 19091458.
- ^ a b c Razumilava N, Gores GJ (January 2013). «Classification, diagnosis, and management of cholangiocarcinoma». Clinical Gastroenterology and Hepatology. 11 (1): 13–21.e1, quiz e3–4. doi:10.1016/j.cgh.2012.09.009. PMC 3596004. PMID 22982100.
- ^ a b c Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D (Mar–Apr 2011). «Global cancer statistics». CA. 61 (2): 69–90. doi:10.3322/caac.20107. PMID 21296855. S2CID 30500384.
- ^ a b Patel T (April 2011). «Cholangiocarcinoma—controversies and challenges». Nature Reviews. Gastroenterology & Hepatology. 8 (4): 189–200. doi:10.1038/nrgastro.2011.20. PMC 3888819. PMID 21460876.
- ^ DeBaun MR, Tucker MA (March 1998). «Risk of cancer during the first four years of life in children from The Beckwith-Wiedemann Syndrome Registry». The Journal of Pediatrics. 132 (3 Pt 1): 398–400. doi:10.1016/S0022-3476(98)70008-3. PMID 9544889.
- ^ a b c Spector LG, Birch J (November 2012). «The epidemiology of hepatoblastoma». Pediatric Blood & Cancer. 59 (5): 776–779. doi:10.1002/pbc.24215. PMID 22692949. S2CID 65545.
- ^ Davit-Spraul A, Gonzales E, Baussan C, Jacquemin E (January 2009). «Progressive familial intrahepatic cholestasis». Orphanet Journal of Rare Diseases. 4: 1. doi:10.1186/1750-1172-4-1. PMC 2647530. PMID 19133130.
- ^ Ariff B, Lloyd CR, Khan S, Shariff M, Thillainayagam AV, Bansi DS, et al. (March 2009). «Imaging of liver cancer». World Journal of Gastroenterology. 15 (11): 1289–1300. doi:10.3748/wjg.15.1289. PMC 2658841. PMID 19294758.
- ^ Malaguarnera G, Paladina I, Giordano M, Malaguarnera M, Bertino G, Berretta M (2013). «Serum markers of intrahepatic cholangiocarcinoma». Disease Markers. 34 (4): 219–228. doi:10.1155/2013/196412. PMC 3809974. PMID 23396291.
- ^ Zhao YJ, Ju Q, Li GC (July 2013). «Tumor markers for hepatocellular carcinoma». Molecular and Clinical Oncology. 1 (4): 593–598. doi:10.3892/mco.2013.119. PMC 3915636. PMID 24649215.
- ^ a b c d e f Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A (November 2018). «Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries». CA. 68 (6): 394–424. doi:10.3322/caac.21492. PMID 30207593.
- ^ a b c Hoshida Y, Fuchs BC, Tanabe KK (November 2012). «Prevention of hepatocellular carcinoma: potential targets, experimental models, and clinical challenges». Current Cancer Drug Targets. 12 (9): 1129–1159. doi:10.2174/156800912803987977. PMC 3776581. PMID 22873223.
- ^ Yen YH, Cheng YF, Wang JH, Lin CC, Chen YY, Yong CC, et al. (2020-03-12). «Real world clinical practice in treating advanced hepatocellular carcinoma: When East meets West». PLOS ONE. 15 (3): e0230005. Bibcode:2020PLoSO..1530005Y. doi:10.1371/journal.pone.0230005. PMC 7067409. PMID 32163475.
- ^ Bruix J, Sherman M (March 2011). «Management of hepatocellular carcinoma: an update». Hepatology. 53 (3): 1020–1022. doi:10.1002/hep.24199. PMC 3084991. PMID 21374666.
- ^ Chen CH (2016-12-01). «Percutaneous radiofrequency ablation for hepatocellular carcinoma: Shortened duration does not comprise its efficacy». Advances in Digestive Medicine. 3 (4): 149–150. doi:10.1016/j.aidm.2016.10.001. S2CID 44047011.
- ^ «Drugs Approved for Liver Cancer — National Cancer Institute». www.cancer.gov. 2011-10-04. Retrieved 2021-02-25.
- ^ «Targeted Cancer Therapies Fact Sheet — National Cancer Institute». www.cancer.gov. 2021-01-25. Retrieved 2021-02-25.
- ^ Bruix J, Sherman M (March 2011). «Management of hepatocellular carcinoma: an update». Hepatology. 53 (3): 1020–1022. doi:10.1002/hep.24199. PMC 3084991. PMID 21374666.
- ^ Wang Z, Zhang G, Wu J, Jia M (August 2013). «Adjuvant therapy for hepatocellular carcinoma: current situation and prospect». Drug Discoveries & Therapeutics. 7 (4): 137–143. doi:10.5582/ddt.2013.v7.4.137. PMID 24071575.
- ^ a b de Lope CR, Tremosini S, Forner A, Reig M, Bruix J (2012). «Management of HCC». Journal of Hepatology. 56 (Suppl 1): S75–S87. doi:10.1016/S0168-8278(12)60009-9. PMID 22300468.
- ^ Keating GM, Santoro A (2009). «Sorafenib: a review of its use in advanced hepatocellular carcinoma». Drugs. 69 (2): 223–240. doi:10.2165/00003495-200969020-00006. PMID 19228077.
- ^ Feng M, Ben-Josef E (October 2011). «Radiation therapy for hepatocellular carcinoma». Seminars in Radiation Oncology. 21 (4): 271–277. doi:10.1016/j.semradonc.2011.05.002. PMID 21939856.
- ^ a b Tarasik A, Jaroszewicz J, Januszkiewicz M (March 2017). «Surgical treatment of liver tumors — own experience and literature review». Clinical and Experimental Hepatology. 3 (1): 1–8. doi:10.5114/ceh.2017.65498. PMC 5497454. PMID 28856283.
- ^ a b «Bile Duct Cancer (Cholangiocarcinoma) Treatment (PDQ®)–Health Professional Version — National Cancer Institute». www.cancer.gov. 2021-02-19. Retrieved 2021-02-25.
- ^ a b Ulstrup T, Pedersen FM (February 2013). «[Photodynamic therapy of cholangiocarcinomas]». Ugeskrift for Laeger. 175 (9): 579–582. PMID 23608009.
- ^ a b Kuhlmann JB, Blum HE (May 2013). «Locoregional therapy for cholangiocarcinoma». Current Opinion in Gastroenterology. 29 (3): 324–328. doi:10.1097/MOG.0b013e32835d9dea. PMID 23337933. S2CID 37403999.
- ^ Ortner MA (September 2011). «Photodynamic therapy for cholangiocarcinoma». Lasers in Surgery and Medicine. 43 (7): 776–780. doi:10.1002/lsm.21106. PMID 22057505. S2CID 36852386.
- ^ Valero V, Cosgrove D, Herman JM, Pawlik TM (August 2012). «Management of perihilar cholangiocarcinoma in the era of multimodal therapy». Expert Review of Gastroenterology & Hepatology. 6 (4): 481–495. doi:10.1586/egh.12.20. PMC 3538366. PMID 22928900.
- ^ Meyers RL, Czauderna P, Otte JB (November 2012). «Surgical treatment of hepatoblastoma». Pediatric Blood & Cancer. 59 (5): 800–808. doi:10.1002/pbc.24220. PMID 22887704. S2CID 27329163.
- ^ Perilongo G, Malogolowkin M, Feusner J (November 2012). «Hepatoblastoma clinical research: lessons learned and future challenges». Pediatric Blood & Cancer. 59 (5): 818–821. doi:10.1002/pbc.24217. PMID 22678761. S2CID 19059413.
- ^ El-Serag HB, Rudolph KL (June 2007). «Hepatocellular carcinoma: epidemiology and molecular carcinogenesis». Gastroenterology. 132 (7): 2557–2576. doi:10.1053/j.gastro.2007.04.061. PMID 17570226.
- ^ Khan SA, Toledano MB, Taylor-Robinson SD (2008). «Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma». HPB. 10 (2): 77–82. doi:10.1080/13651820801992641. PMC 2504381. PMID 18773060.
- ^ a b c d «Cancer of the Liver and Intrahepatic Bile Duct — Cancer Stat Facts». SEER. Retrieved 2021-02-23.
External links[edit]
- EASL Guideline
- Liver cancer information from Cancer Research UK
Злокачественные новообразования печени могут быть первичными и вторичными. Вторичные опухоли – это метастазы, которые возникают при распространении злокачественного процесса на IV стадии. Чаще всего в печень метастазирует колоректальный рак. Первичный рак печени развивается непосредственно из ткани органа, и здесь выделяют две разновидности новообразований:
- Гепатоцеллюлярная карцинома. Она происходит непосредственно из печеночных клеток.
- Холангиокарцинома — ее субстратом являются клетки, выстилающие печеночные протоки, выводящие желчь.
По сути, это две совершенно разные опухоли, и объединяет их только то, что они обе изначально локализуются в печени. Далее в этой статье мы будем говорить о гепатоцеллюлярном раке, поскольку это новообразование встречается намного чаще, чем холангиокарцинома.
- Симптомы рака печени
- Диагностика рака печени
- Лечение рака печени
- Факторы риска рака печени
- Профилактика рака печени
- Популярные вопросы
- Отзывы пациентов
Симптомы рака печени
Рак печени может долгое время протекать бессимптомно. У многих пациентов его обнаруживают при проведении контрольных обследований или случайно, при обследовании по поводу другой патологии. Описаны случаи, когда у пациента была опухоль размером 15 см, а никаких клинических признаков при этом не было.
Уже на распространенных стадиях присоединяются следующие симптомы:
- Тяжесть и тупая боль в правом боку.
- Нарастающая слабость, быстрая утомляемость.
- Нарушение аппетита, тошнота, рвота.
- Увеличение объема живота из-за скапливающейся в брюшной полости жидкости (асцита).
- Расширение вен в области стенки живота.
- Пожелтение кожи и склер.
- Боль. Боль тем сильнее, чем больше растянута капсула печени. В ряде случаев она может отсутствовать.
Из клинических признаков присутствуют следующие:
- Увеличение размеров печени.
- Увеличение уровня билирубина. Он может быть повышен и на фоне цирроза.
- Увеличение размеров селезенки.
- Лихорадка, устойчивая к действию антибиотиков и противовоспалительной терапии.
- Желудочно-пищеводные кровотечения из варикозно-расширенных вен пищевода.
Стадии рака печени
Около 10-15% пациентов имеют признаки паранеопластического синдрома:
- Гипогликемия.
- Кожный зуд без желтухи.
- Остеопороз.
- Нарушение работы щитовидной и паращитовидной желез.
В ряде случаев первичные признаки со стороны печени отсутствуют, а симптомы появляются при развитии отдаленных метастазов, например, в легких, костях или головном мозге.
Диагностика рака печени
В рамках диагностики рака печени проводятся исследования, направленные на обнаружение новообразования, определение стадии распространенности опухолевого процесса, а также оценку функциональных резервов печени.
В рамках обнаружения рака проводят следующие исследования.
УЗИ печени. Метод прост, безопасен, доступен и обладает достаточной чувствительность и специфичностью. Также УЗИ позволяет определить инвазию рака в прилежащие к печени ткани, вовлеченность в процесс ворот печени, регионарные метастазы и наличие свободной жидкости в брюшной полости. Также аппараты экспертного класса позволяют оценивать степень фиброза печеночной ткани.
МРТ с контрастным усилением преобладает большей чувствительностью и специфичностью, по сравнению с УЗИ и позволяет обнаружить новообразования меньше 1 см на фоне цирроза.
Для верификации диагноза проводится биопсия опухолевого новообразования под контролем УЗИ.
Пункционная биопсия печени
Для поиска метастазов рака печени проводится УЗИ брюшной полости, обзорная рентгенограмма органов грудной клетки или КТ ОГК. Также назначается КТ или МРТ головного мозга и сцинтиграфия костей.
Для определения функционального резерва печени при наличии цирроза проводится ряд тестов, которые учитывают наличие асцита, энцефалопатии, уровень альбумина и билирубина в сыворотке крови, а также МНО и протромбиновый индекс.
Лечение рака печени
При определении тактики лечения рака печени учитываются следующие факторы:
- Распространенность опухолевого процесса
- Функциональные резервы печени.
Возможные варианты лечения следующие:
- Хирургия — удаление пораженной части печени.
- Рентгенэндоваскулярные методы.
- Абляционные методы.
- Лучевая терапия.
- Медикаментозная терапия.
Хирургия
Если опухоль резектабельна, то предпочтение отдается резекции печени. Можно удалить до 75-80% печеночной ткани, и при этом сохранится ее функция, и пациент сможет жить. Но у больных с циррозом ввиду фибротических изменений, возможности хирургического лечения ограничены.
Развитие гепатоцеллюлярной карциномы на фоне цирроза печени
Трансплантация печени показана пациентам с циррозом, у которых соблюдаются следующие условия:
- Имеется одиночная опухоль размером менее 5 см.
- Наличие 2-3 очагов опухоли размером менее 3 см.
- Нет признаков прорастания рака в кровеносные сосуды.
Удаленная печень со множественными злокачественными очагами
Абляция рака печени
В основе абляционных методов лечения лежит повреждение опухоли с помощью физических или химических агентов. Лечение проводится при единичных узлах. Применяются следующие методы:
- Лазер.
- Ультразвук.
- Радиочастотное воздействие.
- Микроволновое воздействие.
- Криоабляция — применение низких температур.
- Фотодинамическое воздействие.
- Введение в опухоль 96% этанола.
На практике чаще всего применяется радиочастотная или микроволновая абляция. Показанием к применению такого метода лечения являются единичные опухолевые узлы размером менее 5 см.
Рентгенэндоваскулярные методы
Применяются в рамках терапии первой линии при распространенной неоперабельной форме рака печени в комбинации с другими противоопухолевыми методами лечения при соблюдении следующих условий:
- Нет признаков прорастания рака в магистральные сосуды печени.
- Нет отдаленных метастазов.
- Нет признаков тромбоза магистральных сосудов печени.
Метод противопоказан в следующих случаях:
- Декомпенсированный цирроз.
- Коагулопатии с кровотечениями.
- Тромбоз или прорастание рака в магистральные сосуды печени.
- Внепеченочные очаги.
- Некупируемый асцит.
Суть лечения заключается во введении в опухоль химиопрепарата. Это возможно благодаря тому, что печень имеет двойное кровоснабжение. В нее входит воротная вена, которая приносит венозную кровь для фильтрации, и печеночная артерия, которая кровоснабжает саму печень и, соответственно, опухоль. Если блокировать артериальный кровоток в опухолевом узле, то это вызовет ее ишемию и, как следствие, уменьшение ее размеров. А если дополнительно в опухоль ввести химио-или радиопрепарат, то получается двойной эффект – от действия химиопрепарата и от ограничения кровотока.
Вначале вводится рентгеноконтрастный препарат, чтобы понять, какие ветви кровоснабжают опухоль. Затем в просвет сосуда доставляется масляный раствор с химиопрепаратом или специальные микросферы, насыщенные лекарственным средством. Таким образом, создается максимально высокая концентрацию препарата в опухоли плюс блокируется его кровоток.
Лучевая терапия рака печени
Лучевая терапия при лечении рака печени носит паллиативный характер и применяется у пациентов, имеющих противопоказания к вышеперечисленным методам лечения. У пациентов с единичными опухолевыми узлами возможно проведение стереотаксического облучения, которое позволяет подвести максимальную лучевую дозу непосредственно к опухолевому очагу, минимально затрагивая окружающие ткани.
Медикаментозная терапия гепатоцеллюлярного рака
Химиотерапия рака печени является малоэффективным методом лечения и помогает только 20% больных. Поэтому сейчас в рамках медикаментозной терапии применяется таргетная- и иммуно терапия, которая достоверно повышает продолжительность жизни таких пациентов. Терапией первой линии является сорафениб, либо комбинация таргетных и иммунопрепаратов: бевацизумаба и атезолизумаба. Также хорошие результаты показывает терапия регорафенибом.
Факторы риска рака печени
Основным фактором риска развития рака печени является цирроз самой разной этиологии. По сути цирроз является исходом хронического заболевания печени, которое в ряде случаев может длиться годами. Основными причинами развития цирроза являются:
- Хронические гепатиты В и С.
- Алкоголизм. При длительном и обильном употреблении алкоголя может развиться острый гепатит с трансформацией в хронический.
- Некоторые паразитарные инвазии.
- Гемохроматоз.
- Аутоиммунные гепатиты.
- Токсическое отравление афлотоксинами или винилхлоридом.
- Инсулинрезистентный сахарный диабет.
Только у 10% пациентов с раком печени опухоль развивается на фоне здоровой печеночной ткани.
Профилактика рака печени
Учитывая то, что рак печени в основном развивается на фоне цирроза, всем таким пациентам показано регулярное обследование. Проводится анализ на определение уровня онкомаркера альфа-фетопротеина и выполнение УЗИ печени.
Пациентам не из группы риска, т. е. у которых нет цирроза и сопутствующих заболеваний, можно предложить следующие мероприятия:
- Вакцинация против гепатита В.
- Регулярное обследование на определение маркеров вирусных гепатитов, и при постановке диагноза проведение своевременной антивирусной терапии.
- Отказ от употребления алкоголя.
- Соблюдение принципов рационального питания.
- Контроль веса и диабета.
- Контроль метаболического синдрома.
Популярные вопросы
Как можно предотвратить рак печени
В первую очередь, необходимо позаботиться о том, чтобы избежать хронических заболеваний печени, которые могут привести к циррозу. Если он уже есть, то необходимо раз в полгода сдавать анализы на альфа-фетопротеин и выполнять УЗИ брюшной полости.
Какие первые симптомы рака печени?
Первые симптомы могут развиться уже на распространенных стадиях, к тому же они могут маскироваться под признаки цирроза. Поэтому для ранней диагностики необходимо инструментальное обследование. Из симптомов чаще присутствует желтуха, нарушение аппетита, боль и тяжесть в правом подреберье.
Влияет ли цирроз на лечение рака печени?
Да, причем цирроз сам по себе может быть проблемой более серьезной, чем рак, поскольку при выраженной печеночной недостаточности происходит нарушение метаболизма различных соединений и синтеза многих белков, что само по себе приводит к развитию тяжелых состояний. Кроме того, цирроз может оказывать влияние на выбор тактики лечения онкологических пациентов.
Отзывы пациентов
|
|
|
| Подробнее о лечении рака печени в «Евроонко»: |
|
| Лечение рака печени в «Евроонко» | |
| Онколог-гастроэнтеролог | 5 100 руб |
| Скорая помощь для онкологических больных | от 12 100 руб |
Список литературы:
- The prognostic value of tumor cells blood circulation after liver surgery for cancer lesions — Patiutko IuI, Tupitsyn NN, Sagaĭdak IV, Podluzhnyĭ DV, Pylev AL, Zabezhinskiĭ DA. — Khirurgiia (Mosk). 2011. [1]
- Surgical and combined treatment of multiple and bilobar metastatic affection of the liver. — Patiutko IuI, Sagaĭdak IV, Pylev AL, Podluzhnyĭ DV. — Khirurgiia (Mosk). 2005. [2]
- Современные подходы к лечению метастазов колоректального рака в печени — А. Л. Пылёв, И. В. Сагайдак, А. Г. Котельников, Д. В. Подлужный, А. Н. Поляков, Патютко Ю.И.,.. — Вестник хирургической гастроэнтерологии — Номер: 4 за 2008 Страницы: 14–28.
- Десятилетняя выживаемость больных злокачественными опухолями печени после хирургического лечения — Ю. И. Патютко, А. Л. Пылёв, И. В. Сагайдак, А. Г. Котельников, Д. В. Подлужный, М. Г. Агафонова, — Анналы хирургической гепатологии 2010.
- Surgical and combined treatment of patients with metastatic liver and lymph nodes invasion by colorectal cancer — Patiutko IuI, Pylev AL, Sagaĭdak IV, Poliakov AN, Chuchuev ES, Abgarian MG, Shishkina NA. — Khirurgiia (Mosk). 2010. [3]
Рак печени: причины появления, симптомы, диагностика и способы лечения.
Определение
Рак печени (гепатоцеллюлярный рак) – это злокачественное новообразование из эпителиальных клеток.
Злокачественный процесс может быть первичным или представлять собой метастазы из других органов. Согласно наблюдениям врачей, первичный рак печени возникает в среднем в 30 раз реже, чем вторичный. Как правило, опухоль в печени формируется на фоне другого онкологического процесса в организме и его метастазирования, что во многом объясняется интенсивным кровоснабжением этого органа.
Рак печени не имеет возрастных критериев и может наблюдаться у пациентов любого возраста.
Причины появления рака печени
Выделяют ряд факторов, повышающих риск формирования злокачественного новообразования в печени:
- хронические воспалительные процессы в печени: цирроз, гепатит С и В существенно повышают риск развития онкологического процесса;
- злоупотребление алкоголем разрушает клетки печени, обеспечивая благоприятные условия для формирования злокачественного новообразования;
- неправильное питание и, как следствие, избыточный вес и замедленный метаболизм повышают риск развития рака;
- гемохроматоз – нарушение обмена железа в организме с его накоплением в органах ЖКТ;
- сердечная недостаточность;
- заражение паразитами;
- сахарный диабет;
- сифилис;
- желчнокаменная болезнь;
- воздействие радиации и онкогенных вирусов;
- нарушения в работе эндокринной, лимфатической и кровеносной систем;
- нарушения в работе желчевыводящих путей;
- прием гепатотоксичных препаратов;
- пожилой возраст;
- отягощенная наследственность.
Обычно злокачественные новообразования печени развиваются под воздействием нескольких провоцирующих факторов.
Классификация заболевания
Первичный рак печени, как правило, развивается из гепатоцитов (клеток печени) либо из клеток желчного протока. Специалисты различают несколько видов опухолей печени: карциносаркома, саркома, лимфома печени (возникает из-за разрастания атипичных лимфоцитов, отличается быстрым ростом и метастазированием в отдаленные органы), гепатоцеллюлярная карцинома, цистаденокарцинома, гепатобластома (обычно развивается у детей), холангиоцеллюлярный рак печени (рак ворот печени) – достаточно редкая форма онкологического заболевания, связанная с мутацией клеток желчных протоков и выявляемая, как правило, на поздних стадиях, когда лечение уже не приносит результатов; ангиосаркома – самый сложный и практически не поддающийся лечению злокачественный процесс (метастазы распространяются очень быстро, не давая возможности врачам купировать или замедлить их рост), меланома печени, фиброламеллярная карцинома, недифференцированная саркома.
Согласно международной ТNМ-классификации (tumor, nodus и metastasis), выделяют следующие стадии первичного рака печени:
- T0 – первичный рак печени не определяется,
- T1 – образование до 2 см в диаметре; прорастание сосудов отсутствует,
- T2 – образование до 2 см в диаметре с прорастающими сосудами печени или опухоль более 2 см без вовлечения сосудов,
- T3 –опухоль размером более 2 см или множественные мелкие опухоли, прорастающие сосуды и ограниченные одной долей,
- T4 – множественные очаги в обеих долях печени или одиночная опухоль с прорастанием печеночной или портальной вены либо висцеральной брюшины.
- N0 – отсутствует поражение лимфоузлов гепатодуоденальной связки и ворот печени,
- N1 – присутствуют метастазы в лимфоузлы гепатодуоденальной связки либо ворот печени.
- M0 – отдаленные метастазы рака печени не определяются,
- M1 – выявляются метастазы рака печени в отдаленных органах.
Симптомы рака печени
На первых стадиях заболевание нередко протекает бессимптомно. Больного может беспокоить слабость и быстрая утомляемость, однако подозрений на рак печени это, как правило, не вызывает.
Опухоль дает о себе знать после распространения за пределы органа или метастазирования в другие органы. Главными клиническими проявлениями рака печени являются:
- боль в правом подреберье,
- повышение температуры тела,
- чувство тяжести, обостряющееся после приема пищи,
- беспричинное снижение веса и аппетита,
- желтушность кожных покровов и склер,
- тошнота, рвота, отрыжка воздухом,
- склонность к диарее или запорам,
- пальпируемый твердый узел в области печени,
- увеличение объема живота за счет скопления патологической жидкости,
- окрашивание кала в светлый цвет,
- темный цвет мочи,
- анемия,
- носовые или желудочно-кишечные кровотечения.
Диагностика рака печени
При подозрении на злокачественное новообразование печени пациенту назначают ряд лабораторных и инструментальных исследований:
- УЗИ органов брюшной полости;
Альфа-фетопротеин (АФП, alfa-Fetoprotein)
Синонимы: Анализ крови на альфа-фетопротеин.
Alfa fetoprotein AFP.
Краткая характеристика определяемого вещества Альфа-фетопротеин
Альфа-фетопротеин (АФП) относится к гл�…
При подозрении на метастатический рак печени важнейшей задачей является выявление первичного очага. Это может потребовать проведения:
- ирригоскопии;
- колоноскопии;
Колоноскопия
Эндоскопическое исследование толстого кишечника для поиска участков патологии, проведения биопсии и удаления небольших полипов и опухолей.
Гастроскопия
Исследование слизистой оболочки верхнего отдела желудочно-кишечного тракта с возможностью выполнения биопсии или эндоскопического удаления небольших патологич…
УЗИ предстательной железы
Ультразвуковое сканирование простаты, дающее представление о состоянии предстательной железы и наличии патологии.
Внутривенная урография
Внутривенная урография — это рентгенологическое исследование с применением внутривенного контрастного препарата, позволяющее оценить функцию почек и мочевыводя…
К какому врачу обращаться
Лечением новообразований занимаются врачи-онкологи, однако с первыми симптомами пациенты чаще всего обращаются к гастроэнтерологу https://www.invitro.ru/vrachi/gastroehnterolog/ или врачу-терапевту https://www.invitro.ru/vrachi/terapevt/.
Лечение рака печени
При первичном операбельном раке показано комбинированное лечение, включающее резекцию печени и курс химиотерапии.
Операбельной считается опухоль диаметром не более 3 см без прорастания в кровеносные сосуды, отсутствие цирроза печени.
Послеоперационная летальность составляет до 10%, ее главной причиной становится развившаяся печеночная недостаточность. Для профилактики данного осложнения выполняют предоперационную портоэмболизацию (деваскуляризацию новообразования).
Хирургическое лечение метастатического рака печени возможно только при наличии возможности удалить основную опухоль, обнаружении метастазов в одной из долей печени и отсутствии других внепеченочных очагов.
Химиотерапию цитостатическими препаратами применяют при неоперабельном раке печени. В этом случае наилучший эффект достигается при введении цитостатиков непосредственно в печеночную артерию. Лучевую терапию при злокачественном новообразовании в печени используют нечасто ввиду ее малой эффективности.
Последние годы стали активно внедряться в практику альтернативные методы лечения рака печени:
- Протонная терапия, во время которой используют протоны для облучения патологической ткани.
- Абляция – введение в опухоль этанола и воздействие на патологический очаг микроволновым излучением. Абляция может быть эффективна, если опухоль менее 3 см в диаметре.
Осложнения
Рак печени опасен возникновением следующих осложнений:
- кровотечений из опухоли;
- нагноением опухолевого очага;
- нарушением оттока желчи в связи со сдавлением желчных путей;
- нарушением кровообращения в связи со сдавлением органов брюшной полости опухолью большого размера;
- асцитом.
Профилактика рака печени
Снизить риск развития рака печени можно, соблюдая следующие врачебные рекомендации:
- не злоупотреблять алкоголем;
- контролировать вес;
- соблюдать технику безопасности при работе с токсичными веществами;
- не принимать наркотические средства;
- наносить татуировки только в лицензированных салонах;
- вовремя проводить вакцинацию против гепатита В;
- проходить ежегодный профилактический осмотр у врача.
Источники:
- Клинические рекомендации «Рак печени (гепатоцеллюлярный)». Разраб.: Ассоциация онкологов России. – 2021. – 57 с.
- Затевахин И.И. Абдоминальная хирургия / под ред. И.И. Затевахина, А.И. Кириенко, В.А. Кубышкина // – М.: ГЭОТАР-Медиа, 2017. – 912 с.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
13062
01 Марта
-
13060
23 Февраля
-
4422
21 Февраля
Похожие статьи
Аднексит
Аднексит: причины появления, симптомы, диагностика и способы лечения.
Ожоги
Ожоги: причины появления, симптомы, диагностика и способы лечения.
Розацеа
Розацеа: причины появления, симптомы, диагностика и способы лечения.
Рак желудка
Злокачественные новообразования желудка занимают одно из ведущих мест по распространенности среди онкологических заболеваний. Значимую роль в их возникновении отводят бактерии Helicobacter pylori.
Рак печени – это злокачественная опухоль, которая быстро увеличивается в размерах и даёт метастазы. Она может быть первичной или представлять собой метастазы из других органов. Заболевание в течение длительного времени протекает бессимптомно или проявляется неспецифическими признаками.
Диагностику рака печени онкологи Юсуповской проводят с помощью новейших методов исследования. Для лечения заболевания используют эффективнейшие противоопухолевые препараты, обладающие минимальным спектром побочных эффектов. Хирурги применяют инновационные методики оперативных вмешательств. Медицинский персонал обеспечивает профессиональный уход за пациентами.
Причины
Первичный рак печени возникает в среднем в 30 раз реже, чем вторичный. Как правило, злокачественная опухоль печени возникает на фоне наличия другого онкологического процесса в организме и его метастазирования (например, рак матки или желудка с метастазами в печень). Рак печени в 30 лет возникает также часто, как и в 50 и 60 – данное заболевание не имеет возрастных категорий. Активному метастазированию печень подвержена ввиду интенсивного кровообращения в этом органе. Существует ряд факторов риска, оказывающих влияние на формирование злокачественного новообразования в печени:
- хроническое воспаление печени. Цирроз, гепатит С и В существенно повышают риск развития онкологического процесса в печени;
- алкоголизм. Бесконтрольное употребление алкоголя разрушает клетки печени, обеспечивая благоприятные условия для формирования злокачественного новообразования;
- неправильное питание и, как следствие, избыточный вес. Чрезмерное скопление жира и замедление метаболизма повышают риск развития рака. Печень перестает справляться с объемами потребляемых гидрогенизированных жиров и постепенно теряет свои функции;
- гемохроматоз. Данный диагноз предполагает нарушение обмена железа в организме, вследствие чего в органах ЖКТ происходит его скопление;
- сердечная недостаточность;
- заражение паразитами;
- сахарный диабет;
- сифилис;
- желчнокаменная болезнь;
- воздействие радиации и онкогенных вирусов;
- нарушения работы эндокринной, лимфатической и кровеносной систем;
- нарушения в работе желчевыводящих путей;
- накопление в организме контрастного вещества торотраста. Он способен сохраняться в организме долгие года и со временем вызывать опухоль печени;
- прием препаратов, которые токсически воздействуют на печень;
- курение. Курение негативно влияет на здоровье человека, а в особенности на работу печени;
- пожилой возраст. С возрастом органы перестают работать также хорошо, как в молодости — снижается скорость обмена веществ и вероятность развития рака становится выше;
- отягощенная наследственность.
Обычно злокачественные новообразования печени развиваются под воздействием нескольких причин и провоцирующих факторов.
Симптомы
На первых стадиях рак печени протекает практически бессимптомно. Больного может беспокоить слабость и быстрая утомляемость, однако подозрений на рак печени это, как правило, не вызывает. В основном опухоль начинает проявляться после распространения за пределы печени или метастазирования в другие органы. Главными клиническими проявлениями рака печени являются:
- боли в районе правого подреберья;
- повышение температуры тела;
- чувство тяжести, обостряющееся после приема пищи;
- беспричинное снижение веса;
- снижение аппетита;
- желтушность кожных покровов и склер;
- тошнота, рвота, отрыжка воздухом;
- склонность к поносам или запорам;
- пальпируемый твердый узел в области печени;
- увеличение объема живота за счет скопления патологической жидкости;
- окрашивание кала в светлый цвет;
- темный цвет мочи;
- анемия;
- кожный зуд;
- носовые или желудочно-кишечные кровотечения.
Для того чтобы установить как можно раньше диагноз, следует обратиться к гастроэнтерологу при появлении первых признаков нарушения функции печени. После проведенного обследования пациента проконсультирует онколог. Ранняя диагностика злокачественных новообразований печени позволяет провести адекватную терапию, увеличивающую длительность жизни.
Симптомы у мужчин
Для мужчин характерны типичные проявления рака печени. Среди них выделяют:
- кожный зуд;
- увеличение размеров живота;
- гепатомегалия;
- эмоциональная лабильность.
В некоторых случаях возможно развитие гинекомастии, а также снижение либидо.
Симптомы у женщин
Симптомы рака печени у женщин ничем не отличаются от общих признаков. Врачи утверждают, что опасность для представительниц женского пола заключается в более поздних проявлениях заболевания. Характерными изменениями для женщин считаются:
- появление оволосения по мужскому типу;
- огрубение голоса;
- снижение либидо;
- уплотнения в области груди и подмышек.
Классификация
Первичный рак печени в основном развивается из гепатоцитов – клеток печени, либо из клеток желчного протока. Специалисты различают несколько видов опухолей печени:
- карциносаркома;
- саркома;
- лимфома печени. Возникает из-за разрастания атипичных лимфоцитов. Отличается данное новообразование быстрым ростом и распространением метастазов в отдаленные органы;
- гепатоцеллюлярная карцинома — крайне редкая форма опухоли в печени. Главной причиной возникновения данного вида рака является цирроз или гепатит В и С;
- цистаденокарцинома. Строение данного новообразования схоже со строением кисты. Основными проявлениями заболевания являются сильные резкие боли в животе и головокружения. Цистаденокарцинома склонна быстро расти, вследствие чего часто становится причиной сдавливания соседних внутренних органов;
- гепатобластома – опухоль, характерная для детского возраста. Характеризуется снижением веса при непропорциональном увеличении живота;
- холангиоцеллюлярный рак печени (рак ворот печени). Достаточно редкая форма онкологического заболевания, связанная с мутацией клеток желчных протоков. Выявляется, как правило, на поздних стадиях, когда лечение уже не приносит результатов;
- ангиосаркома. Самый сложный и практически не поддающийся лечению рак печени. Метастазы при ангиосаркоме распространяются очень быстро, не давая возможности врачам купировать или замедлить их рост. Причинами появления данной опухоли становится длительный контакт с ядовитыми и токсичными веществами на производствах;
- меланома печени. Одна из самых тяжелых опухолей печени. В основном возникает на почве метастазирования другой опухоли или вследствие развития меланобластомы;
- фиброламеллярная карцинома. Проявляется данное новообразование печени сильными болями в эпигастрии и верхнем отделении живота, если опухоль выросла до размеров 20 и более сантиметров. Поддаётся лечению на ранних стадиях;
- недифференцированная саркома. Опухоль печени в этом случае быстро растет и развивается, распространяя метастазы в соседние органы. Часто обнаруживается в детском возрасте и практически не лечится.
Своевременная диагностика обеспечивает быстрое определение диагноза, что при онкологических заболеваниях чрезвычайно важно. Не следует откладывать поход к врачу, ведь именно это может спасти вам жизнь.
Ангиосаркома печени
Крайне агрессивное злокачественное новообразование, которое возникает при контакте с токсичными химическими веществами (мышьяком, медью, винилхлоридом) и при воздействии радиоактивного излучения – ангиосаркома печени. Нередко рост опухоли начинается на фоне накопления в организме торотраста, который ранее принимали в качестве контрастного вещества при выполнении рентгенологических исследований.
Симптоматика ангиосаркомы является малоспецифичной – у пациента может наблюдаться боль в животе, вздутие, лихорадка, снижение веса и аппетита. При пальпации может ощущаться уплотнение, во время аускультации доктор может услышать характерные шумы. Установить диагноз на ранней стадии развития патологического процесса затруднительно, поскольку дебют заболевания не сопровождается клиническими признаками злокачественной опухоли.
Ангиосаркому выявляют с помощью тех же методов, что и другие виды злокачественных новообразований печени. На рентгенограммах можно увидеть торотраст в печени и селезёнке. Во время диагностической лапароскопии хирурги проводят биопсию и отправляют участки патологически изменённых тканей на гистологическое исследование. Поскольку ангиосаркому выявляют на поздней стадии, пациентам проводят паллиативную терапию в условиях хосписа.
Гемангиоэндотелиома печени
Клиническая картина гемангиоэндотелиомы печени не отличается от других видов опухолей. Поначалу болезнь протекает бессимптомно, впоследствии возникают характерные признаки рака печени – желтушность кожных покровов, лихорадка, слабость, быстрая утомляемость, внезапное и стремительное снижение веса. Нередко данное заболевание влечет за особой обширное внутреннее кровотечение. Ученые связывают это с поражением новообразованием соседних кровеносных сосудов и ухудшением свертываемости крови.
Результативными методами лечения гемангиоэндотелиомы являются:
- лучевая терапия. Применяется данная методика к первичной патологии, повторный курс лучевой терапии при рецидиве является неэффективным;
- оперативное вмешательство. Является наиболее эффективным методом лечения опухоли печени, так как позволяет ликвидировать очаг заболевания. Однако операция не является гарантией к полному выздоровлению, так как метастазы хирургическим путем удалить невозможно;
- химиотерапия. Данный метод подразумевает использование препаратов, разрушающих злокачественные клетки. Химиотерапия чревата ухудшением общего самочувствия пациента и в основном применяется в случаях неоперабельной повторной опухоли.
Врачи клиники онкологии Юсуповской больницы в своей практике используют лишь самые современные методы лечения, которые позволяют улучшить качество жизни пациента.
Метастазы
Метастазы являются главной опасностью любого онкологического заболевания, поскольку их практически невозможно остановить или предупредить их распространение.
Метастазы первичного рака печени способны распространяться в желудок, головной мозг, легкие, пищевод, вены и артерии, сердечную мышцу, сосуды, кости и позвоночник. Метастазы из печени попадают в организм следующими путями:
- через лимфоток;
- через кровеносную систему;
- через разрастание за пределы печени и повреждение соседних тканей и органов.
К сожалению, метастазы встречаются в 40% случаев рака печени и часто поражают жизненно важные органы, которые в последствии крайне тяжело лечить.
Осложнения
Неконтролируемое течение рака печени опасно возникновением осложнений. Их появление зависит от многих факторов. Среди возможных осложнений выделяют:
- кровотечение из опухоли;
- нагноение опухолевого очага;
- нарушение оттока желчи в связи со сдавлением желчных путей;
- нарушение кровообращения в связи со сдавлением органов брюшной полости большими размерами опухоли;
- асцит.
Перечисленные симптомы требуют немедленной диагностики и проведения оперативного вмешательства. Без этого возможен летальный исход.
Диагностика
Онкологи Юсуповской больницы проводят комплексное обследование, позволяющее быстро установить диагноз рака печени и верифицировать вид опухоли. Оно включает следующие исследования:
-
Общий анализ крови – увеличивается количество лейкоцитов и скорости оседания эритроцитов;
-
Биохимический анализ крови – повышается уровень билирубина, АЛТ, АСТ;
-
Определение уровня специфического опухолевого антигена (онкомаркера) АПФ.
С помощью ультразвукового исследования, которое выполняется с применением аппаратуры экспертного класса, обладающей высокой разрешающей способностью, определяют локализацию и размеры опухоли. УЗИ используют как для первичной диагностики, так и с целью динамического контроля состояния новообразования.
Магнитно-резонансная, компьютерная томография выполняется с целью уточнения размера образования, степени прорастания в окружающие ткани и органы, отдалённых метастазов.
Лапароскопия проводится с целью уточнения распространения опухолевого процесса. Во время исследования хирург выполняет биопсию – проводит забор участков тканей для гистологического исследования.
Стадии
Определение стадии заболевания с помощью клинического, инструментального и лабораторного исследования позволяет врачам клиники онкологии выработать оптимальную тактику ведения пациента.
-
При первой стадии рака печени размеры опухоли не превышают двух сантиметров. Клинические симптомы отсутствуют. В отдельных случаях пациенты ощущают повышенную утомляемость и дискомфорт в области правого подреберья.
-
На второй стадии заболевания размеры опухоли достигают пяти сантиметров. Наблюдается инвазия атипичных клеток в сосуды. Пациентов беспокоит тяжесть и тупая ноющая боль в правом подреберье. По мере прогрессирования патологического процесса боль усиливается.
-
Третья стадия рака печени сопровождается распространением опухоли на другие органы и ткани. Выраженный болевой синдром вынуждает больного обратиться к врачу.
- Рак печени четвёртой стадии характеризуется множественными метастазами в другие органы. В связи с повышением давления в портальной вене на передней стенке живота и грудной клетки расширяются вены. Пациентов беспокоит сильная боль, запоры. У них увеличивается объём живота за счёт скопления жидкости в брюшной полости, снижается масса тела, возникает эмоциональная лабильность.
Лечение
Врачи клиники онкологии Юсуповской больницы индивидуально подходят к выбору методов лечения каждого пациента, у которого выявлен рак печени. Комплекс лечебных мероприятий зависит от следующих факторов:
- расположение патологического очага;
- стадия развития опухоли;
- наличие или отсутствие метастазов;
- состояние пациента;
- сопутствующие заболевания.
Решение о необходимости и целесообразности того или иного метода терапии принимается после тщательно проведенной диагностики. Лечение рака печени включает в себя:
- Лекарственные препараты. Действующие вещества медикаментов оказывают токсическое воздействие на раковые клетки. При этом здоровые ткани не повреждаются. Химиотерапия при раке печени не имеет лечебного действия.
- Лучевая терапия. Локальное воздействие на опухоль приводит к уменьшению ее размеров. В результате уменьшается болевой синдром. Лучевая терапия используется на всех стадиях лечения рака печени.
- Абляция. Суть метода заключается во введении в опухолевое образование этанола. Затем на патологический очаг воздействуют микроволновым излучением. Абляция эффективна при наличии рака печени размером менее 3 см в диаметре.
- Сосудистая эмболизация. Кровообращение в области опухоли нарушается благодаря введению в сосуды специальных препаратов. В результате образование уменьшается в размерах. Сосудистая эмболизация эффективна при опухолях до 5 см в диаметре. Данный метод часто используется вместе с другими видами лечения рака печени.
- Оперативное вмешательство. При наличии операбельного рака показано удаление опухоли или трансплантация печени.
Питание
Состояние пациента улучшается при соблюдении специальной диеты. Повара Юсуповской больницы готовят блюда из качественных продуктов, которые не содержат нитратов, ГМО и канцерогенных пищевых добавок. В случае неконтролируемого снижения веса увеличивают суточную калорийность за счёт белковых продуктов. При приготовлении блюд отдают предпочтение щадящим кулинарным технологиям: варке, тушению, на пару и гриле, запеканию в духовке.
Из рациона пациента исключают следующие продукты:
- магазинные соусы;
- копчености и соленья;
- наваристые бульоны;
- маргарин и другие тяжелые жиры;
- свежую выпечку;
- алкогольные напитки;
- крепкий чай и кофе.
Прогноз
Поскольку рак печени часто диагностируют в конечной стадии опухолевого процесса, поэтому прогноз для выздоровления в большинстве случаев пессимистичный. Проводимая паллиативная терапия направлена на уменьшение выраженности симптомов заболевания, облегчение общего состояния. При наличии сопутствующих патологий летальный исход наступает спустя 6 месяцев или 1 год после постановки диагноза.Средняя продолжительность жизни после возникновения данного заболевания около 2 лет при правильно подобранном эффективном лечении.
Профилактика
Снизить риск развития рака печени можно, если соблюдать следующие врачебные рекомендации:
- исключить алкогольные напитки;
- контролировать вес;
- соблюдать технику безопасности при работе с токсичными веществами;
- избегать незащищенного полового акта;
- не принимать наркотические средства;
- наносить тату или татуаж только в проверенных салонах;
- вовремя проводить вакцинацию против гепатита В;
- проходить ежегодный профилактический осмотр у врача.
Лечение рака печени в Юсуповской больнице назначают квалифицированные онкологи сообразно характеру опухоли, ее виду и стадии. Все терапевтические процедуры проводятся под четким контролем медицинского персонала, готового оказать помощь в любую минуту. В нашей клинике можно пройти любые виды обследований с использованием профессионального современного оборудования.
Рак печени
Также:
гепатоцеллюлярный рак, гепатоцеллюлярная карцинома, печеночно-клеточный рак
Версия: Клинические рекомендации РФ 2022 (Россия)
Категории МКБ:
Печеночноклеточный рак (C22.0)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Междисциплинарное общество специалистов по опухолям печени
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Рак печени (гепатоцеллюлярный)
Год утверждения (частота пересмотра): 2022
Возрастная категория: Взрослые
Пересмотр не позднее: 2024
Дата размещения: 22.07.2022
ID: 1
Определение заболевания или состояния(группы заболеваний или состояний)
Гепатоцеллюлярный рак (ГЦР) (гепатоцеллюлярная карцинома, печеночно-клеточный рак) –наиболее частая (около 85 % случаев) злокачественная опухоль печени, исходящая из гепатоцитов. Реже встречается холангиоцеллюлярный рак (холангиокарцинома) –злокачественная опухоль, исходящая из эпителия внутрипеченочных желчных протоков, а также смешанные гепатохолангиокарциномы, фиброламеллярная карцинома, которая формально классифицируется как вариант печеночно-клеточного рака.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Первичный рак печени (С 22)
С22 Злокачественное новообразование печени и внутрипеченочных желчных протоков
С22.0 Печеночно-клеточный рак. Гепатоцеллюлярный рак.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)1.5.1 Международная гистологическая классификация (2010)
Эпителиальные гепатоцеллюлярные доброкачественные опухоли:
Гепатоцеллюлярная аденома 8170/0
Фокальная нодулярная гиперплазия 8170/0
Предраковые или ассоциированные со злокачественными новообразования:
Крупноклеточные изменения
Мелкоклеточные изменения
Диспластические узлы
низкой степени злокачественности
высокой степени злокачественности
Злокачественные гепатоцеллюлярные опухоли:
Гепатоцеллюлярный рак 8170/3
Гепатоцеллюлярный рак (фиброламеллярный вариант) 8171/3
Гепатобластома, эпителиальные варианты 8171/3
Недифференцированный рак 8020/3
Мезенхимальные опухоли:
Доброкачественные
Ангиомиолипома (PECома) 8860/0
Гемангиома
Кавернозная гемангиома 9131/0
Инфантильная гемангиома 9131/0
Воспалительная псевдоопухоль
Лимфангиома 9170/0
Мезенхимальнаягамартома
Солитарная фиброзная опухоль 8815/0
Злокачественные опухоли
Ангиосаркома9120/3
Эмбриональная саркома 8991/3
Эпителиоидная гемангиоэндотелиома 9133/3
Саркома Капоши 9140/3
Лейомиосаркома 8890/3
Рабдомиосаркома 8900/3
Синовиальная саркома 9040/3
Смешанные злокачественные опухоли неясного происхождения:
Смешанный гепатохолангиоцеллюлярный рак 8180/3
Карциносаркома 8980/3
Герминогенные опухоли
Лимфомы
Метастатические опухоли
1.5.2. Стадирование
Стадирование по системе TNM (8-й редакции, 2017 г.) [5].
T – первичная опухоль.
TX – оценить первичную опухоль невозможно.
T0 – признаков первичной опухоли нет
Т1 – одиночная опухоль.
T1a – одиночная опухоль ≤2 см в наибольшем измерении с сосудистой инвазией или без нее.
T1b – одиночная опухоль >2 см в наибольшем измерении без сосудистой инвазии.
T2 – одиночная опухоль размером >2 см с сосудистой инвазией или множественные опухоли ≤5 см в наибольшем измерении.
T3 – множественные опухоли, в том числе хотя бы одна опухоль >5 см в наибольшем измерении.
T4 – одиночная опухоль или множественные опухоли любого размера с прорастанием в крупную ветвь воротной вены либо в печеночную вену, или с прорастанием в соседние органы, включая диафрагму(кроме желчного пузыря), или с прорастанием в висцеральную брюшину.
N – вовлечение регионарных лимфатических узлов. Регионарными лимфатическими узлами являются лимфатические узлы ворот печени (расположенные в печеночно-двенадцатиперстной связке).
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – имеется поражение регионарных лимфатических узлов метастазами.
M – отдаленные метастазы.
МХ – недостаточно данных для определения отдаленных метастазов.
M0 – отдаленных метастазов нет.
M1 – имеются отдаленные метастазы.
pTNM – патогистологическая классификация.
Требования к определению категорий рТ, pN, рМ соответствуют требованиям к определению категорий Т, N, М (таблица 1).
G – гистопатологическая дифференцировка.
Gx – степень дифференцировки не может быть установлена.
G1 – высокая степень дифференцировки.
G2 – средняя степень дифференцировки.
G3 – низкая степень дифференцировки.
G4 – недифференцированные опухоли.
Таблица 1. Группировка гепатоцеллюлярных карцином по стадиям (UICC)
Стадирование по Барселонской системе
Барселонская система стадирования рака печени (BarcelonaClinicLiverCancer (BCLC) classification) – наиболее часто используемая классификация ГЦР, которая учитывает распространенность опухолевого процесса, функциональное состояние печени, объективное состояние пациента и предполагаемую эффективность лечения (см. рисунок А1в приложении А3) [6].
Выделяют 5 стадий: от 0 – очень ранней и А – ранней до D – терминальной. Стадии по BCLC, равно как прогноз заболевания и тактика лечения, могут меняться при прогрессировании заболевания либо эффективном лечении. Следует отметить прогностическую значимость классификации для пациентов с ГЦР безотносительно наличия цирроза печени. Важная особенность этой классификации в том, что в ней предложен алгоритм лечения в зависимости от стадии заболевания. В последней редакции этой классификации (2018 г.) вместо классов цирроза A–Bпо Child – Pugh используется формулировка «сохранная функция печени», что соответствует оценке <8 баллов по классификации Child – Pugh[7].
Очень ранняя стадия (BCLC 0) – солитарная опухоль печени <2 см в диаметре.
Ранняя стадия (BCLCA) – солитарная опухоль печени любого размера или не более 3 узлов размером до 3 см, не распространяющиеся на магистральные сосуды печени, соседние анатомические структуры, у пациента без опухолеспецифических жалоб в удовлетворительном объективном состоянии (ECOG0) при сохранной функции печени.
Промежуточная стадия (BCLC В) –случаи изолированного бессимптомного множественного опухолевого поражения печени без макро сосудистой инвазии у пациентов в удовлетворительном состоянии (ECOG0) при сохранной функции печени.
Распространенная стадия (BCLC С) –симптомная опухоль, ухудшающая объективное состояние пациента (ECOG0–2), любого размера с инвазией или без инвазии в магистральные печеночные сосуды и/или с внепеченочным распространением при сохранной функции печени.
Терминальная стадия (BCLCD) – случаи заболевания со значимым ухудшением объективного состояния (опухоль/цирроз), декомпенсацией цирроза (класс C по Child – Pugh). Но при выявлении малой опухоли (солитарной размером <5 см или не более 3 узлов размером <3 см) при соответствии так называемым «миланским» критериям возможна ортотопическая трансплантация печени.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Гепатоцеллюлярный рак развивается чаще всего на фоне цирроза печени (около 80 % случаев) или хронического воспаления любой этиологии: вирусных гепатитов В и С, алкогольного и неалкогольного стеатогепатита, первичного склерозирующего и аутоиммунного гепатита, вследствие экзогенных токсических повреждений печени (под действием афлотоксинов, винилхлорида, на фоне применения стероидных гормонов), а также при наследственных заболеваниях (дефиците альфа-1-антитрипсина, тирозинемии и гемохроматозе) и нарушениях состояния иммунной системы, при которых происходит повреждение печени с исходом в хронический гепатит и цирроз. Вирусные гепатиты В и С – самый частый фактор риска, являющийся причиной ГЦР в 50% и 15% случаев соответственно. С внедрением вакцинации против гепатита В и эффективной противовирусной терапии гепатита С роль вирусных гепатитов постепенно снижается. В развитых странах повышается роль неалкогольной жировой болезни печени[1–3]. Менее 10%случаев ГЦР развивается в здоровой ткани печени.
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В Российской Федерации ГЦР встречается достаточно редко. В2019г. в России зарегистрировано 9 324 новых случая ГЦР и рака внутрипеченочных желчных протоков, умерло по этой причине 10 430 пациентов[4]. В РФ по данным статистических отчетов за период с 2009 по 2019гг. отмечается самый высокий из онкологических заболеваний – более чем 48% – прирост «грубого» показателя заболеваемости (для мужчин +57%) при более 29% прироста стандартизованного показателя заболеваемости ГЦР. Показатели динамики смертности от ГЦР указывают на 21,6% прирост абсолютного числа случаев смерти от рака печени и 5,65% прироста стандартизованного показателя смертности (на 100 тыс. населения). Обращает внимание различие в смертности: она превышает заболеваемость первичным раком печени на ~ 1100 случаев в 2019 году.
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина, как правило, имеет скрытый характер, не имеет специфических симптомов. Чаще всего ГЦР обнаруживается на более поздних стадиях. Спектр проявлений может определяться фоновым заболеванием печени, циррозом и осложнениями опухолевого процесса.
В начале развития заболевания симптомы мало выражены. Поэтому пациенты не придают им особого значения, не обращаясь за медицинской помощью. Со временем симптомы нарастают и становятся более ощутимыми: появление болей чаще всего связано с прорастанием анатомических структур, включая магистральные сосуды, с образованием опухолевых тромбов, а также с метастатическим поражением органов. Основными жалобами далеко зашедшего процесса являются выраженная общая слабость, вялость, быстрая утомляемость, увеличение размеров живота, дискомфорт и боли в правом подреберье, а также повышение температуры тела, появление отёков нижних конечностей. Паранеопластические синдромы встречаются у небольшой части пациентов и проявляются гипогликемией, эритроцитозом, гиперкальциемией.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния – на основании патогномоничных клинико-рентгенологических данных, результатов патологоанатомического исследования биопсийного или операционного материала, лабораторных исследований, направленных на оценку функции печени и инструментального обследования распространенности опухолевого процесса и выраженности сопутствующих заболеваний.
Чаще всего ГЦР развивается на фоне хронического заболевания печени – цирроза печени, вирусного гепатита, стеатогепатита – которое, как и опухолевый процесс, может проявляться специфическими симптомами, нуждаться в специфической терапии, конкурентно влиять на качество жизни и ухудшать выживаемость. В рамках мультидисциплинарной оценки состояния пациента необходимо оценить функциональные резервы печени, выраженность фоновой патологии печени и распространенность опухолевого процесса.
- Рекомендуется при сборе жалоб и анамнеза активное выявление факторов риска развития хронических заболеваний печени (злоупотребление алкоголем, прием наркотиков, анаболических стероидов, перенесенный вирусный гепатит(ы) и признаки метаболического синдрома, включающего ожирение, сахарный диабет, артериальную гипертензию) с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3,6,8].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
2.2 Физикальное обследование
- Рекомендуется пациентам при подозрении на ГЦР или с установленным диагнозом ГЦР выполнить стандартный врачебный осмотр, включая оценку нутритивного статуса, наличие симптомов хронического заболевания печени (асцита, желтухи, энцефалопатии, кровотечений, спленомегалии)[8,9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Следует стремиться разграничить вызванные опухолью симптомы и длительно существующие симптомы цирроза печени и его осложнений.
2.3 Лабораторные диагностические исследования
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР с целью определения этиологии и выраженности сопутствующего заболевания печени, а также выявления показаний к назначению сопутствующей противовирусной терапии определить антитела к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) и антитела классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови; при положительном результате теста на HBsAg необходимо определение антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови, и определение ДНК HBV(количественный тест) и РНК-ВГД (качественный тест); при положительном результате теста наanti-HCV–исследование на РНК-ВГС (количественный тест и генотип вируса).[8–11].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения для объективной оценки степени выраженности изменений в гемограмме и выявления возможного нарушения функции печени и почек выполнить общий (клинический) анализ крови развернутый(с подсчетом количества тромбоцитов) и анализ крови биохимический общетерапевтический – с измерением уровня сывороточного альбумина, общего и прямого билирубина, мочевины и креатинина, АЛТ, АСТ, ГГТ, ЩФ – анализ крови, определение протромбинового времени и международного нормализованного отношения, общий (клинический) анализ мочи [3,9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить определение концентрации в плазме опухолеспецифического маркера альфа-фетопротеина (АФП)для оценки агрессивности заболевания и прогноза его течения, контроля эффективности лечения.[8]
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: Результат анализа на АФП считается положительным, если уровень АФП >100 нг/мл [12] или если он увеличивался на 7 нг/мл в месяц по результатам 3 последовательных измерений [13]. Следует учитывать, что уровень АФП также может повышаться при хронических заболеваниях печени, например, при острых и хронических вирусных гепатитах, при других онкологических заболеваниях (гепатоидном раке желудка, герминогенных опухолях и т.д.), при беременности.
Оценка функционального статуса печени
- Рекомендуется пациентам с установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, оценить функциональный статус печени по критериям Child – Pugh (Приложение Г1) с целью оценки степени нарушения функций печени для определения переносимости планируемого лечения или токсичности проводимого противоопухолевого лечения и прогноза течения цирроза печени[8,9,14,15].
Уровень убедительности рекомендаций –А (уровень достоверности доказательств –1).
Комментарий: цирроз печени, частое сопутствующее заболевание печени, определяет переносимость основных методов лечения, вплоть до невозможности проведения лечения, негативно и конкурентно с ГЦР влияет на общую выживаемость. Совместно с гастроэнтерологом или терапевтом необходимо своевременно профилактировать, выявлять и лечить осложнения цирроза печени.
2.4 Инструментальные диагностические исследования
- При подозрении или выявлении малого объемного образования в печени пациента, относящегося к группе высокого риска печеночно-клеточного рака (цирроз печени любой этиологии Child–Pughкласс А и В, цирроз печени Child–Pugh класс С, находящиеся в листе ожидания трансплантации печени, больные хроническим вирусным гепатитом В с промежуточным или высоким риском развития ГЦР (в соответствиями с классом PAGE-B, соответственно 10-17 и ≥18 баллов), пациенты с фиброзом печени F3 степени в зависимости от наличия других индивидуальных факторов риска) независимо от уровня АФП, при положительном результате анализа на АФП пациентам с подозрением на ГЦР рекомендуется мультифазная компьютерная томография (КТ) печени и брюшной полости с контрастированием и / или магнитно-резонансная томография (МРТ) печени и брюшной полости с контрастированием независимо от результатов ультразвукового исследования (УЗИ) печени для уточнения диагноза и степени распространенности опухолевого процесса[8,9,14,16–18] .
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
- Рекомендуется использование МРТ с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для выявления раннего ГЦР (до 2,0 см) у пациентов с сопутствующим циррозом печени любой этиологии [19–21].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарий: диагностика раннего ГЦР и своевременное начатое лечение имеют решающее значение для улучшения прогноза и качества жизни пациентов, повышая тем самым долгосрочную выживаемость. Особенности накопления и вымывания контрастного препарата из опухолевых тканей в артериальную, венозную и отсроченные фазы при использовании экстрацеллюлярных магнитно-резонансных контрастных препаратов в ряде случаев не позволяют выявлять и корректно дифференцировать новообразования, в том числе малых размеров. Гиперинтенсивность печеночной паренхимы в гепатоспецифическую фазу позволяет отчетливо визуализировать гипоинтенсивные очаги малых размеров и с учетом особенностей их контрастирования в предыдущие фазы исследования, дифференцировать ранний ГЦР от прочих новообразований печени, в т.ч. и от регенераторных и диспластических узлов, что в ряде случаев может повлиять на изменение стадии опухолевого процесса.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом выполнять МРТ печени с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для корректного стадирования опухолевого процесса перед началом лечения[18–23].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – I).
Комментарий: в ряде систематических обзоров рандомизированных клинических исследований с применением мета-анализа доказана высокая информативность МРТ с применением гепатоспецифического контрастного препарата гадоксетовой кислоты по сравнению с КТ и МРТ с использованием экстрацеллюлярных контрастных препаратов в выявлении и дифференциальной диагностике ГЦР.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, в том числе, печени, включая бассейн воротной вены, для оценки степени распространенности ГЦР, выявления осложнений ГЦР и/или цирроза и их контроля[14].
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 5).
Комментарий: УЗИ применяется на этапе скрининга в группе риска развития ГЦР, при осуществлении чрескожной биопсии, интервенционных вмешательств и иногда мониторинга эффективности лечения. Обязательна оценка проходимости бассейна воротной вены. Чувствительность УЗИ невысока для обнаружения узлов малого размера. УЗИ с контрастным усилением обладает преимуществом в выявлении гиперваскуляризованных узлов, что может использоваться при дифференциальной диагностике очаговых образований печени.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить эзофагогастродуодено-скопию для выявления одного из осложнения портальной гипертензии – варикозного расширения вен пищевода и желудка, оценки степени его выраженности и показаний к лечебно-профилактическим мероприятиям[9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с установленным диагнозом ГЦР, планируемым к проведению или получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить четырех фазную компьютерную томографию (КТ) (нативная, артериальная, венозная и отсроченная венозная фазы) и/или динамическую магнитно-резонансную томографию (МРТ) печени с внутривенным контрастированием для оценки распространенности опухолевого процесса и выявления ее изменений: определяют количество и размеры опухолевых узлов внутри печени, наличие сосудистой инвазии и тромбоза, в не печеночного распространения, контроля эффективности лечения[8,9,14,16–18].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – I).
Комментарий: диагноз печеночно-клеточного рака может считаться обоснованным без морфологической верификации, если в цирротическии змененной печени по данным одного из методов (мультифазной КТ или МРТ) выявляют типичные для ГЦР признаки, а именно: диффузное (не кольцевидное) контрастное усиление опухоли размером >1 см в поздней артериальной фазе и «вымывание» контрастного вещества в венозной фазе; в опухолевых узлах размером>2 см выявление псевдокапсулы в отсроченной (равновесной) фазе; рост опухоли менее чем за 6 мес. на 50 % или увеличение размеров опухоли не менее чем на 5 мм за 6 мес. (Американская ассоциация по изучению заболеваний печени (AmericanAssociationfortheStudyofLiverDisease, AASLD)/LiverImagingReportingandDataSystem (LI-RADS), Европейская ассоциация по изучению печени (TheEuropeanAssociationfortheStudyoftheLiver, EASL) 2018). В дифференциальной диагностике новообразований печени может использоваться рентгенологическая классификация LI-RADS[9,24]. В рандомизированных исследованиях доказано, что категория LI-RADS 4–5 имеет высокую специфичность (95–100 %) для пациентов группы высокого риска ГЦР с узлом размером >10 мм [25,26].
- Рекомендуется пациентам с ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после или в процессе лечения, выполнить МРТ брюшной полости с применением гепатоспецифического контрастного препарата (гадоксетовой кислоты**) для контроля эффективности лечения[18–23,27].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1 ).
Комментарий: применение МРТ с гадоксетовой кислотой демонстрирует наиболее высокие значения чувствительности, специфичности и точности в выявлении и дифференциальной диагностике ГЦР по сравнению с КТ с внутривенным контрастированием и МРТ с внутривенным контрастированием с использованием экстрацеллюлярных контрастных препаратов, позволяя тем самым выбрать оптимальную тактику лечения пациентов, а также повлиять на снижение частоты рецидивов и количество смертельных исходов.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить КТ органов грудной клетки, брюшной полости и малого таза для исключения в не печеночных проявлений опухоли, контроля эффективности лечения[14,28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить остеосцинтиграфию при наличии болевого синдрома для выявления метастатического поражения костей скелета, контроля эффективности лечения[14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Для морфологического подтверждения диагноза рекомендуется пациентам с подозрением на ГЦР выполнить биопсию под контролем УЗИ/КТ для уточнения диагноза[8,9] в следующих случаях:
1. если по данным КТ или МРТ заподозрено патологическое образование в не цирротической печени;
2. если необходимо исключить злокачественную опухоль печени при отсутствии рентгенографических специфических признаков ГЦР в цирротической печени
Уровень убедительности рекомендаций – C(уровень достоверности доказательств – 5).
Комментарии: пункционная биопсия опухоли печени с получением столбика ткани (cor-биопсия) предпочтительнее аспирационной тонкоигольной биопсии. Биопсия рекомендуется при малом размере опухоли (<2 см) и типичном для ГЦР кровотоке, нетипичной васкуляризации узла размером >2 см, расхождениях в описании и трактовке контрастных динамических исследований в сочетании с нормальным или незначительно повышенным уровнем АФП, выявлении любого опухолевого образования внецирротической печени [29]. Отрицательный результат биопсии не исключает диагноза злокачественной опухоли печени и предполагает дальнейшее наблюдение с возможностью повторных биопсий. Биопсия локального образования в цирротической печени не нужна, если: 1) не планируется какого-либо лечения в связи с декомпенсированным циррозом и/или другой тяжелой патологией; 2) планируется резекция печени; 3) при циррозе мультифазная КТи МРТ c контрастированием описывают признаки, специфичные для ГЦР (неравномерное контрастирование узла в артериальной фазе, затем «вымывание» в венозной) [30,31].
Для уточняющей диагностики раннего и высоко дифференцированного ГЦР Международная консенсусная группа по опухолям печени рекомендует панель из 3 иммуногистохимических маркеров – HSP70 (HSPA7), глипикана 3 (GPC3) и глутаминсинтетазы (GS), а для выявления прогностически неблагоприятных случаев – цитокератин 19 (СК 19). В сложных для диагностики случаях целесообразно отправить гистопрепараты для исследования в специализированные центры. При выявлении смешанного гепатохолангиоцеллюлярного рака целесообразно определение микросателлитного статуса опухоли.
- Рекомендуется выполнить позитронно-эмиссионную томографию с фтордезоксиглюкозой[18F], совмещенную с КТ, у пациентов с установленным диагнозом ГЦР, являющихся кандидатами на оперативное лечение, если имеется подозрение на отдаленные метастазы по данным КТ или МРТ,и их подтверждение приведет к отказу от операции[14,32].
Уровень убедительности рекомендаций–C(уровень достоверности доказательств – 4).
- Рекомендуется пациентам с установленным диагнозом ГЦР при подозрении на метастазирование в головной мозг выполнить МРТ или КТ головного мозга с внутривенным контрастированием[18].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется установить стадию ГЦР по классификацииTNM (8-й редакции), AJCCиBCLCдля повышения точности диагностики [8,9,33–35].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
2.5 Иные диагностические исследования
Диагностические ангиографические методики являются неотъемлемой частью эндоваскулярного лечебного вмешательства у пациентов с ГЦР, позволяющие оценить состояние чревного ствола и его ветвей, уточнить анатомический вариант кровоснабжения печени, определить уровень васкуляризации опухолевых узлов, уточнить наличие артерио-портальных или артериовенозных шунтов. Полученные диагностические данные имеют важное значение в определении, как возможности выполнения, так и планирования последующей трансартериальнойхимиоэмболизации (ТАХЭ) печени.
При выявлении у пациентов с ГЦР выраженного артериовенозного фистулирования или наличии артериопортального шунта с контрастированием ствола воротной вены или её долевых ветвей ТАХЭ не показана. Пациентам с наличием артериовенозного фистулирования на Iэтапе эндоваскулярного лечения (перед ТАХЭ) показана эмболизация печеночных артерий с целью окклюзии артериовенозных фистул[36,37].
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Разработка плана лечения по результатам диагностики должна быть отнесена к компетенции специализированной мультидисциплинарной группы по ГЦР, функционирующей на базе специализированных центров. При выборе стратегии лечения пациентов с ГЦР приоритет должен отдаваться противоопухолевому специализированному лечению с использованием методов, позволяющих увеличить выживаемость.
Радикальное лечение раннего локализованного ГЦР включает резекцию печени, ортотопическую трансплантацию печени и применение местно-деструктивных аблативных методов (радиочастотную, микроволновую аблацию и др.) [8,9,14].
Паллиативное лечение ГЦР направлено на достижение контроля над проявлениями болезни, призвано увеличивать продолжительность и улучшать качество жизни пациентов. Паллиативное специализированное лечение включает интервенционно-радиологическое лечение (различные виды эмболизации) и системную химиотерапию [8,9,14].
План лечения вырабатывается на основании результатов объективного обследования мультидисциплинарной командой специалистов (включающей врача-радиолога, врача-хирурга (гепатолога), врача по рентгеноэндоваскулярным диагностике и лечению, врача-онколога, врача-гастроэнтеролога, имеющих опыт работы с пациентами с ГЦР на базе специализированных центров.
Поскольку ГЦР в большинстве случаев выявляется в цирротически измененной печени, прогноз жизни для этих пациентов определяется не только степенью распространения опухоли, но и степенью дисфункции печени и объективным состоянием пациентов.
3.1 Хирургическое лечение
- Рекомендуется резекция печени как метод выбора при лечении больных локализованным ГЦР без лабораторных и инструментальных признаков цирроза. Выполнение оперативного вмешательства должно рассматриваться в первоочередном порядке при наличии у больных ГЦР соответствующего стадии BCLC 0/A, а также при BCLCB в случаях ограниченного поражения печени и у отобранной группы BCLC C (при наличии опухолевого тромбоза сегментарных ветвей воротной вены; солитарного метастатического поражения лимфатического узла гепатодуоденальной связки)[6,8,42,9,14,34,35,38–41].
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 3).
Комментарии: основным условием, которое должно выполняться при планировании резекции печени является сохранение в предполагаемой остающейся части паренхимы печени адекватного кровоснабжения, крово- и желчеоттока. Объем предполагаемой остающейся паренхимы печени должен составлять при отсутствии лабораторных и инструментальных признаков цирроза не менее 25% (отнепораженной паренхимы), при их наличии не менее 40%. В случае недостаточного объема паренхимы возможна рентген-интервенционная эмболизация ветви воротной вены в предполагаемой для удаления до лепечени.
Приналичииубольноголабораторныхиинструментальныхпризнаковцирроза, следует учитывать степень нарушения печено-клеточной функции (резекция печени целесообразна у больных соответствующих классу А по шкале Child – Pugh) и выраженность портальной гипертензии (клинически значимые проявления: наличие варикозно-расширенных вен пищевода, тромбоцитопения менее 100×109/л).
В условиях специализированных центров (при наличии подготовленного персонала и оборудования) возможно выполнение резекций печени мини-инвазивным доступом под видеоэдоскопическим контролем. Предпочтительным для планирования применения данного доступа являются подкапсульно расположенные образования, а также узлы, располагающиеся в латеральных секторах печени.
Следует учитывать, что большой размер опухоли и/или множественное внутриорганное поражение, наличие инвазии магистральных сосудов, метастатическое поражение регионарных лимфатических узлов не являются абсолютным противопоказанием к резекции печени, однако результаты хирургического лечения в этих случаях предсказуемо хуже.
- Рекомендуется ортотопическая трансплантация печени при раннем ГЦР(BCLC 0 – А) в случаях, не подходящих для резекции, при соответствии принятым критериям (показаниям) к трансплантации при ГЦР[8,9,14,43–45].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – 2).
Комментарии: чаще используются так называемые «миланские» критерии: размер единственной опухоли ≤5 см или наличие в печени не более 3 очагов с диаметром наибольшего узла ≤3 см и отсутствием инвазии в сосуды [6,8,9]. Показания и противопоказания к выполнению трансплантации печени определяются врачом-трансплантологом. Трансплантация печени у пациентов с нерезектабельной формой ГЦР (например, фиброламеллярная ГЦК) в отсутствие фонового заболевания печени (цирроз, гепатит) является наиболее радикальным методом. К таким пациентам не должны применяться «миланские» критерии. Важно: отсутствие внепеченочного распространения (строго), отсутствие макрососудистой инвазии (желательно) [46–49].
В целях объективного стадирования и селекции пациентов на трансплантацию печени необходимо исключить внепеченочное распространение. КТ органов грудной клетки является обязательным методом исследования для пациентов с ГЦР, планирующимся на трансплантацию печени [46].
- Bridge-терапия (терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации) рекомендуется пациентам, ожидающим трансплантации печени, для увеличения вероятности выполнения трансплантации печени, улучшения селекции и исключения агрессивных случаев ГЦР [6,9,50,51].
- Терапия «понижения стадии» (down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений) рекомендуется пациентам с локализованным ГЦР превышающим стандартные критерии для трансплантации печени и при условии достижения объективного противоопухолевого эффекта локо-регионарной и/или системной терапии в виде уменьшения внутрипеченочной распространенности до принятых критериев трансплантации печени [45].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – 2).
Комментарии:Bridge-терапия и терапия «понижения стадии» включает аблацию, трансартериальную химиоэмболизацию, резекцию печени, лекарственную терапию или сочетание методов. Трансплантация печени после уменьшения внутрипеченочной распространенности опухоли в результате противоопухолевой терапии до принятых критериев трансплантации печени ассоциируется со значимым увеличением общей выживаемости по сравнению с использованием методов консервативного лечения.
- Рекомендуется пациентам с ГЦР и сопутствующем хроническим гепатитом В (HBsAg+, ДНК-ВГВ>2000 МЕ/мл) противовирусная терапия аналогами нуклеозидов (энтекавир** или тенофовирадифумарат или тенофовираалафенамид**); после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[52,53,125].
Уровень убедительности рекомендаций–В (уровень достоверности доказательств – 2)
- Рекомендуется пациентам с ГЦР и сопутствующим хроническим гепатитом С (РНК-ВГС+)противовирусная терапия противовирусными препаратами прямого действия при компенсированном поражении печени) https://cr.minzdrav.gov.ru/recomend/516_2, после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[54–56,126]
Уровень убедительности рекомендаций–С(уровень достоверности доказательств – 4
3.2 Методы локальной деструкции опухоли
- Рекомендуется применять методы локальной деструкции (энергетической аблации) опухоли как стандарт терапии у пациентов с ГЦР стадии BCLC 0 (солитарная опухоль до 2 см в диаметре) и стадии BCLC A (три опухоли до 3 см в диаметре) при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени)[57].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств – 1).
- Рекомендуется применять метод чрескожной деструкции ( химической аблацииэтанолом) опухоли у пациентов с ГЦР на фоне цирроза стадии BCLC 0 (солитарная опухоль до 2 см в диаметре) как метод терапии при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени) и невозможности проведения энергической аблации [58].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств – 1).
- Рекомендуется применять метод локальной деструкции ( химической аблацииэтанолом ) как дополнение к энергетической аблации при лечении опухолей диаметром более 3 см и опухолей, прилежащих к крупным сосудам (у неоперабельных больных)[59].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – 1).
- Рекомендуется рассматривать возможность применения методов локальной деструкции (энергетической и химической аблации) в сочетании с другими видами лечения, в том числе c внутриартериальной терапией и хирургическим лечением[60–62, 127].
Уровень убедительности рекомендаций –С(уровень достоверности доказательств 4).
- Рекомендуется применение методов локальной деструкции в виде энергетической и химической аблации (если это технически возможно), в случаях локального прогрессирования и локального рецидива заболевания после ранее выполненной резекции печени или аблации опухоли при невозможности выполнения хирургического лечения [63].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств 2).
Комментарии: Основным критерием при определении показаний является техническая возможность выполнения вмешательства с минимальным риском развития осложнений. Деструкции подлежат не более 5 узлов диаметром ≤3 см. Возможна деструкция узлов большего диаметра, но частота локальных рецидивов существенно увеличивается при опухолях >3 см в наибольшем измерении. В ряде случаев целесообразно выполнять аблацию после проведения предварительной трансартериальной (химио-)эмболизации опухоли печени или осуществлять энергетическую аблацию в комбинации с чрескожным внутриопухолевым введением этилового спирта (химическая аблация). Локальная деструкция противопоказана при множественном поражении печени, декомпенсированном циррозе (класса C по Child – Pugh), внепеченочных проявлениях заболевания, при наличии портального шунта, несмещаемом прилежании опухолевого узла к рядом расположенным полым органам, а также к вне(внутри-)печеночно расположенным трубчатым структурам
[64–66]. В качестве методов локальной деструкции (энергетической аблации) рекомендуется использовать радиочастотную аблацию, микроволновую аблацию и криоаблацию. В качестве метода локальной деструкции (химической аблации) рекомендуется использовать чрескожное введение этилового спирта
[67–70].
- Рекомендуется дистанционная лучевая терапия стереотаксическим методом единичных (1–3) опухолевых узлов при ГЦР стадии BCLC 0–A, в случае наличия противопоказаний к хирургическому лечению и противопоказаний к использованию методов локальной деструкции в виде энергетической или химической аблации[71,72].
Уровень убедительности рекомендаций –B(уровень достоверности доказательств – 2).
- Не рекомендуется пациентам с ГЦР послерадикального (R0) хирургического лечения адъювантная терапия мультикиназными ингибиторами в связи с отсутствием преимуществ перед другими вмешательствами в улучшении выживаемости пациентов [73].
Уровень убедительности рекомендаций –A(уровень достоверности доказательств – 2).
3.3 Трансартериальная химиоэмболизация
- Рекомендуется трансартериальная химиоэмболизация (ТАХЭ) опухолевых сосудов в качестве самостоятельного паллиативного лечения пациентам c ГЦР при нерезектабельном/неоперабельном процессе без признаков инвазии/тромбоза магистральных печеночных сосудов и без внепеченочных проявлений заболевания, в комбинации с другими методами локального и системного воздействия, а также в период ожидания трансплантации печени для улучшения контроля роста опухоли [6,8,9,74–79].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств 2).
Комментарии: согласно классификации BCLC, ТАХЭ выполняется при лечении пациентов с промежуточной (BCLCB) и ранней (BCLC А) стадиями при противопоказаниях к хирургическому лечению. Проведение ТАХЭ опухоли в печени при наличии внепеченочных проявлений опухолевого процесса не улучшает отдаленных результатов лечения. Показания и противопоказания к проведению ТАХЭ определяются врачом по рентгеноэндоваскулярным диагностике и лечению в составе мультидисциплинарного консилиума.
- Не рекомендуется ТАХЭ пациентам с ГЦР при поражении более 75% объема печени, декомпенсированном циррозе (класса C по Child – Pugh), тромбозе магистральных ветвей или ствола воротной вены, внепеченочном распространении заболевания, не купируемом асците, почечной недостаточности (уровне креатинина≥2 мг/длили клиренсе креатинина<30 мл/мин), тяжелых нарушениях свертывающей системы крови, желудочно-кишечном кровотечении за последние 3 мес., наличии портального шунта[6,80–83].
Уровень убедительности рекомендаций –А(уровень достоверности доказательств 2)
Комментарии: относительными противопоказаниями к ТАХЭ являются цирроз печени класса B по Child – Pugh (9 баллов), размер опухоли >10 см, наличие некомпенсированных сопутствующих заболеваний: нарушений функций органов сердечно-сосудистой, легочной систем, острых инфекционных заболеваний, желудочно-кишечного кровотечения, произошедшего за последние 3 мес., варикозного расширения вен пищевода/желудка IIIстепени с высоким риском кровотечения, желчной гипертензии [80,81]. Выбор метода (селективная, суперселективная, подолевая) и вида артериальной химиоэмболизации (масляная – раствор противоопухолевого препарата + # Липиодол Ультра-Флюид; комбинированная – раствор противоопухолевого препарата + # Липиодол Ультра-Флюид + микросферы для эмболизации из поливинилацетата и др.; эмболизация микросферами, элиминирующими противоопухолевого препарата (DEB – drug-elutingbeads)) зависит от клинической ситуации, технических условий и плана лечения. Наиболее часто используемые противоопухолевые препараты – доксорубицин** или эпирубицин** в разовой дозе, аналогичной курсовой дозе препарата, используемой при системном лечении.
- Рекомендуется пациентам с ГЦР оценивать эффективность ТАХЭ по данным динамической контрастной КТ/МРТ по критериям mRECIST (Приложение Г5) через 4–8 недель после процедуры [6,84].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
- Рекомендуется системная терапия пациентам с ГЦР при отсутствии эффекта от 2 последовательно выполненных сеансов ТАХЭ (при отсутствии зоны некроза в эмболизированных опухолевых узлах, появлении новых узлов в зоне воздействия) для улучшения отдаленных результатов лечения пациентов[6,8,14,80].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется повторная ТАХЭ пациентам с ГЦР при изолированном внутрипеченочном поражении в случае сохранения эффекта после ранее выполненной ТАХЭ более 6 месяцев для улучшения выживаемости пациентов[9].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
3.4 Трансартериальная радиоэмболизация
- Эндоваскулярная эмболизация сосудов при новообразованиях печени и желчевыводящих путей c применением иттрия-90 (Y90) – трансартериальная радиоэмболизация – рекомендуется пациентам с ГЦР при стадии BCLC A в качестве bridge-терапии, при стадиях BCLC B и C с тромбозом магистральных вен для улучшения результатов лечения и выживаемости пациентов[6,8,9,50,85].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: основные противопоказания к трансартериальной радиоэмболизации – поражение >70 % объема печени, наличие артериовенозного шунта.
- Рекомендуется пациентам с ГЦР в случаях, когда другие варианты локо-регионарного лечения и/или резекции не могут быть проведены для улучшения контроля роста опухоли и выживаемости пациентов[86].
Уровень убедительности рекомендаций –С (уровень достоверности доказательств – 5).
Комментарий: лучевая терапия проводится в виде конформного облучения 3D-CRT, лучевой терапии с модуляцией интенсивности (IMRT) или стереотаксического облучения (SBRT) под контролем визуализации (IGRT). Применение стереотаксической лучевой терапии представляется оптимальным. Рекомендуется использовать трех или пятидневный режим фракционирования дозы излучения до СОД 30-50Гр у пациентов с сохранной функции печени (класс А или В по Child – Pugh). SBRT можно рассматривать как альтернативу методам аблации/эмболизации когда эти методы лечения оказались безуспешными или противопоказаны. При невозможности проведения стереотаксической лучевой терапии возможно проведение лучевой терапии с РОД 1,8 Гр до СОД 45 Гр и далее бустом локально на опухоль до СОД 50-60Гр
3.6 Лекарственное лечение
Значительное расширение арсенала эффективных опций лекарственного лечения распространенного ГЦР за последние годы, особенно во второй-третьей линии лечения, в отсутствие достоверных данных по сравнительной эффективности требует взвешенного подхода, основанного на учете множества индивидуальных параметров пациента и заболевания. Для ГЦР не известно факторов прогноза эффективности иммунотерапии, ингибиторов протеинкинази цитотоксической химиотерапии.
- Системная терапия рекомендуется врачом-онкологом пациентам с ГЦР для улучшения выживаемости и контроля роста опухоли при[87–93]:
– наличии объективных признаков опухолевого процесса и удовлетворительном общем состоянии (0–1 балл по шкале ECOG (Приложение Г2));
– сохранной функции печени (класс А или В по Child – Pugh, 5–7 баллов);
– невозможности применения локальных методов лечения (резекции, трансплантации печени, (химио-) эмболизации опухолевых узлов);
– внутрипеченочном локализованном ГЦР (как терапия ожидания трансплантации);
– внепеченочном метастазировании и/или прогрессировании процесса в печени после применения локальных методов лечения.
Уровень убедительности рекомендаций –A(уровень достоверности доказательств – 1).
Комментарии: для проведения лекарственной терапии необходима морфологическая (цитологическая/гистологическая) верификация опухолевого процесса, но она не требуется, если на фоне установленного диагноза цирроза печени на мультифазной КТ или динамической контрастной МРТ опытным рентгенологом выявляется типичная для ГЦР рентгенологическая картина гиперваскулярной опухоли печени (с «вымыванием» контраста в венозной фазе).
Декомпенсация цирроза печени конкурентно влияет на общую выживаемость. Необходим мониторинг функции печени, проведение активной профилактики осложнений цирроза печени и их лечение под наблюдением гастроэнтеролога. У пациентов с ГЦР на фоне впервые выявленного декомпенсированного цирроза печени следует провести консультацию гастроэнтеролога для подбора и проведения терапии осложнений цирроза; при улучшении функции печени и удовлетворительном состоянии пациента оправдано повторное обсуждение перспектив противоопухолевого лечения на мультидисциплинарном консилиуме. У пациентов с недавно (давностью до 3 мес.) состоявшимся кровотечением, артериальным или венозным тромбозом, клинически выраженной и плохо компенсируемой сердечно-сосудистой патологией лечение ингибиторами протеинкиназ или прямых ингибиторов неоангиогенеза сопряжено с высоким риском осложнений.
При декомпенсированном циррозе (класса В/С по Child – Pugh) цитотоксическое лечение не проводится.
Вероятность реактивации вирусных гепатитов на фоне системной противоопухолевой терапии низкая, хотя в случаях HВs-положительного хронического вирусного гепатита В необходима одновременная противовирусная терапия аналогами нуклеозидов в течение всего противоопухолевого лечения.
3.6.1. Системная терапия ГЦР первой линии
- Рекомендуется в качестве предпочтительной первой линии системной терапии ГЦР комбинация PD-L1-ингибитора атезолизумаба** в дозе 1200 мг и моноклонального анти-VEGFантитела бевацизумаба** в дозе 15 мг/кг внутривенно 1 раз в 21 день для улучшения контроля роста опухоли и выживаемости пациентов[93].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств – 2).
Комментарии: лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Комбинация атезолизумаба** и бевацизумаба** по данным рандомизированного клинического исследования 3 фазы (ImBrave150) продемонстрировала достоверное преимущество перед сорафенибом** по общей выживаемости (медиана ОВ — 19,2 месvs. 13,4 мес) и выживаемости без прогрессирования (медиана 6,9 месvs. 4,3 мес). Относительными противопоказанием к терапии являются аутоиммунные заболевания, активная ко-инфекция вирусами гепатита В и С, состоявшееся кровотечение или высокий риск кровотечения из варикозно-расширенных вен пищевода и желудка.
- В качестве альтернативных опций 1 линии системной терапии ГЦР рекомендуются ингибиторы протеинкиназсорафениб** или ленватиниб** [87–90].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Опухолевый тромбоз ствола воротной вены не является противопоказанием к лечению сорафенибом**. Терапия ГЦР, прогрессирующего после трансплантации печени (на фоне иммуносупрессивной терапии), сопровождается более выраженной токсичностью. Переносимость ленватиниба** в этой группе пациентов изучена недостаточно; рекомендуется начинать с 8 мг/сут, при хорошей переносимости в течение 10–14 дней доза может быть увеличена до 12 мг/сут.
Режим применения ленватиниба** зависит от исходного веса пациента: для больных с массой тела ≥60 кг лечение начинается с дозы 12 мг/сут однократно, для пациентов с массой <60 кг – с разовой суточной дозы 8 мг.
Токсические эффекты, ассоциированные с применением сорафениба** и ленватиниба** (диарея, артериальная гипертония, ладонно-подошвенный синдром), являются биологическим предиктором лучшей выживаемости при условии продолжения терапии, целесообразно предпринять все меры по коррекции токсических эффектов, в первую очередь своевременно снизить суточную дозу препарата.
- У пациентов с начальными признаками декомпенсации цирроза печени или при противопоказаниях к использованию ингибиторов протеинкиназ в качестве альтернативы (Child-PughB, 7 баллов) рекомендуется иммунотерапия ниволумабом** для улучшения контроля роста опухоли и выживаемости пациентов в одном из рекомендованных режимов лечения[94].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
3.6.2. Системная терапия ГЦР второй и третьей линии
Все известные рандомизированные плацебо-контролируемые исследования 2 линии лечения распространенного ГЦР выполнены в популяции больных, получавших в качестве 1 линии сорафениб**. На сегодня нет данных об эффективности других опций после иммунотерапии или ленватиниба**. Поэтому выбор 2 линии терапии определяется ранее использованным вариантом лечения:
А) после иммунотерапии рассматриваются ингибиторы протеинкиназсорафениб** или ленватиниб**, регорафениб** или кабозантиниб** или рамуцирумаб** (при уровне АФП>400 нг/мл), эффективность комбинированной иммунотерапии неизвестна.
В) после ингибиторов протеинкиназ могут использоваться регорафениб**, кабозантиниб**, рамуцирумаб** или иммунотерапия.
- Рекомендуется регорафениб** в качестве 2 линии терапии ГЦР при его прогрессировании на фоне1-й линии препаратами из группы ингибиторов протеинкиназы (мультикиназными ингибиторами) (таблица2) для улучшения контроля роста опухоли и выживаемости пациентов[91].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: регорафениб**назначается, если в1-й линии терапии сорафенибом** в дозе ≥400 мг/сут была отмечена его переносимость, при условии удовлетворительного состояния пациента (ECOG 0/1)и компенсированной функции печени (классе A поChild – Pugh) в стандартном режиме – 160 мг/сут однократно в 1–21-й дни, курс 4 нед., а пациентам, имеющим факторы риска развития токсичности (на фоне приема сорафениба** в дозе 400 мг/сут эпизоды декомпенсации цирроза печени, плохо контролируемая сопутствующая патология), – в начальной дозе 120 мг/сут в 1–21-й дни 4-недельного цикла. При начале лечения в сниженной дозе при отсутствии токсичности II и последующих степеней через 10–12 дней от начала курса оправданно увеличение суточной дозы до стандартной рекомендуемой (160 мг/сут).
- Рекомендуется кабозантиниб** 60 мг в день в качестве 2-3 линии терапии ГЦР после прогрессирования на фоне терапии сорафенибом**(таблица 2)[92].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2)
- Рекомендуется в качестве 2 линии моноклональное антитело к VEGFR 2 типа рамуцирумаб** в дозе 8 мг/кг внутривенно каждые 2 недели до прогрессирования или непереносимой токсичности больным в удовлетворительном состоянии (ECOG 0/1) и при компенсированной функции печени (Child – Pugh A)[95].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарии: назначается при прогрессировании ГЦР на терапии сорафенибом** у пациентов с уровнем АФП≥400 нг/мл. Препарат назначается пациентам, удовлетворительно переносившим терапию сорафенибом** (≥400 мг/день)
- Рекомендуется терапия препаратами моноклональных антител — ингибиторами контрольных точек иммунного надзора ниволумабом** или пембролизумабом** в качестве 2-й и 3-й линий терапии прогрессирующего ГЦР, а также у пациентов, не переносящих препараты из группы ингибиторов протеинкиназ (мультикиназные ингибиторы) сорафениб**/ленватиниб**/регорафениб**/кабозантиниб**или имеющих противопоказания к терапии этими препаратами (таблица 2)для улучшения контроля роста опухоли и выживаемости пациентов[14,94,96].
Для пембролизумаба: Уровень убедительности рекомендаций – В (уровень достоверности доказательств 2)
Для ниволумаба: Уровень убедительности рекомендаций – C (уровень достоверности доказательств 4)
Комментарии: пациентам назначается ниволумаб** в одном из дозовых режимов (выбор режима не влияет на клиническую эффективность) или пембролизумаб** до клинически значимого прогрессирования опухоли. Оправдано применение ниволумаба** у пациентов с классом В цирроза печени по Child – Pugh (7–9 баллов). Нет данных о негативном влиянии иммунотерапии на течение цирроза печени.
Фиброламеллярная карцинома, как правило, нечувствительна к терапии препаратами из группы моноклональных антител к PD-1 (ингибиторам контрольных точек иммунного надзора).
- Рекомендуется иммунотерапия ГЦР, прогрессирующего на лечении ингибиторами протеинкиназ с использованием комбинации ниволумаб**+ипилимумаб** в качестве 2-й и 3-й линий терапии[97].
Уровень убедительности рекомендаций–В(уровень достоверности доказательств 3)
Комментарии: режим комбинированной иммунотерапии ниволумаб** 1 мг/кг + ипилимумаб** 3 мг/кг в/в 1 раз в 3 недели 4 курса, далее поддерживающая терапия ниволумабом** в режиме 240 мг 1 раз в 2 недели или 480 мг 1 раз в 4 недели до прогрессирования или непереносимой токсичности; в исследовании 1-2b фазы зарегистрировано 32% объективных эффектов, медиана выживаемости в группе составила 22,8 мес.
- Рекомендуется терапия противоопухолевыми цитостатическими препаратами (таблица 2) в качестве лечебной опции у пациентов с ГЦР без цирроза, например, при фиброламеллярной карциноме в качестве 2-й линии терапии для улучшения контроля роста опухоли, улучшения качества жизни пациентов[14,94,98–100].
Уровень убедительности рекомендаций –С(уровень достоверности доказательств 5)
Комментарии: применяются платиносодержащие режимы в сочетании с #гемцитабином** [99, 121, 124] (таблица 2). При смешанном гистологическом варианте – гепатохолангиоцеллюлярном раке в 1-й линии лечения предпочтение отдается цитостатической химиотерапии, поскольку считается, что прогноз жизни определяется холангиоцеллюлярным компонентом опухоли, как наиболее злокачественным. Она не увеличивает продолжительность жизни и эффективна в менее чем в 20 % случаев.
- Рекомендуется для оценки эффективности противоопухолевого лечения у пациентов с ГЦР проводить мультифазную КТ и/или МРТ (с контрастным усилением) каждые 2–3 мес. по критериям RECIST 1.1 (Приложение Г4) и/или mRECIST (для опухолевого поражения печени при циррозе) [101].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: определение уровня АФП в плазме в динамике показано пациентам с исходно высоким его значением; самостоятельного клинического значения этот показатель не имеет, однако в ряде исследований отмечена прямая корреляция эффективности проводимого лечения и изменения концентрации АФП.
3.7 Сопроводительная терапия и лечение фоновой патологии печени
- Пациентам с ГЦР рекомендуется противовирусная терапия сопутствующего хронического гепатита В (ДНК-ВГВ >2 × 102МЕ/мл) аналогами нуклеот(з) идов (энтекавир** или тенофовир**) и хронического гепатита С ингибиторами протеазы и полимеразы вируса (глекапревир/пибрентасвир** или софосбувир/велпатасвир**) одновременно с лекарственным или интервенционно-радиологическим лечением независимо от выраженности цитолитического синдрома для улучшения выживаемости пациентов. Противовирусная терапия после хирургического лечения (резекции, трансплантации печени) может улучшить отдаленные результаты[14,52–56, 148].
Уровень убедительности рекомендаций –B(уровень достоверности доказательств – 2).
Комментарии: возможно одновременное проведение системной химиотерапии и курса лечения прямыми противовирусными препаратами у пациентов с компенсированной функцией печени. Клинически значимых межлекарственных взаимодействий между прямыми противовирусными препаратами и средствами для химиотерапии ГЦР не описано.
- Рекомендуется при варикозном расширении вен пищевода/желудка II–III степени у пациентов с ГЦР на фоне цирроза печени проводить первичную профилактику желудочно-пищеводного кровотечения бета-адреноблокаторами[102,103, 128].
Уровень убедительности рекомендаций –C(уровень достоверности доказательств 4).
Комментарии: при неэффективности медикаментозного лечения варикозного расширения вен пищевода и/или желудка III степени, при угрозе кровотечения, а также для вторичной профилактики рецидивного кровотечения выполняют лигирование/склерозирование варикозно-расширенных вен [6,9,102,103, 151].
- Рекомендуется пациентам ГЦР cцирротическим асцитом и с гипоальбуминемией (менее 28 г/л) на фоне цирроза печени проводить заместительную курсовую терапию 20%-раствором альбумина человека** (100–200 мл/день) до целевого уровня >35 г/л [https://cr.minzdrav.gov.ru/recomend/715_1, 104,105].
Уровень убедительности рекомендаций –А(уровень достоверности доказательств – 2).
Комментарии: наиболее высокая вероятность развития кровотечения из варикозно-расширенных вен пищевода/желудка у пациентов с циррозом печени при опухолевом тромбозе ствола и магистральных ветвей воротной вены. Информация по лечению цирроза печени представлена в клинических рекомендациях «Цирроз и фиброз печени» https://cr.minzdrav.gov.ru/recomend/715_1)
3.8. Обезболивающая терапия
- С целью коррекции хронического болевого синдрома у пациентов с ГЦР рекомендуется лечение нестероидными противовоспалительными и противоревматическими препаратами, антидепрессантами, противоэпилептическими препаратами, папаверином и его производными, местными анестетиками, производными пиразолона, опиоидными анальгетиками, опиоидными анальгетиками со смешанным механизмом действия, анксиолитиками, антигистаминными средствами системного действия, миорелаксантами центрального действия[122, 123]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: выбор метода лечения болевого синдрома определяется степенью выраженности боли у пациента. Детальный алгоритм лечения болевого синдрома представлен в методических рекомендациях «Практические рекомендации по лечению хронического болевого синдрома у взрослых онкологических больных» (коллектив авторов: Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В., Королева И.А., Сакаева Д.Д.
Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11). 49
https://rosoncoweb.ru/standarts/RUSSCO/2021/2021-49.pdf
При выборе медикаментозной терапии болевого синдрома следует учитывать особенности метаболизма препаратов в условиях цирроза печени и/или печеночной недостаточности: нестероидные противовоспалительные препараты при продленном использовании негативно влияют на функцию печени.
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Пациентам с ГЦР после оперативных вмешательств рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств, ТАХЭ и/или химиотерапии для улучшения клинических и функциональных исходов[106].
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 3).
- С целью повышения кардиореспираторной выносливости на этапе подготовки к проведению противоопухолевого лечения пациентам с ГЦР рекомендуются занятия лечебной физкультурой (ЛФК) в домашних условиях (аэробная и анаэробная физическая нагрузка средней интенсивности) не менее 15 мин в день 6–7 раз в неделю для снижения частоты послеоперационных осложнений[106].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Пациентам с ГЦР рекомендуется нутритивная поддержка при наличии хотя бы одного из перечисленных факторов: непреднамеренное снижение массы тела на 10% и более от исходной за последние 6 мес., индекс массы тела <18,5 кг/м2, недостаточный объем принимаемой пищи (калорийность <1500 ккал/сут) для улучшения результатов лечения и выживаемости пациентов[107].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: с целью нутритивной поддержки в совокупности с проведением ЛФК является поддержание функционального состояния пациента и предотвращение развития саркопении. При этом предпочтительный способ нутритивной поддержки – пероральное питание (сиппинг). При невозможности или неадекватности перорального питания необходима установка назогастрального зонда или наложение временной гастростомы.
Калорийность рациона должна составлять 25–30 ккал на кг массы тела в сутки, доза белка – 1,0–1,5 г на кг массы тела в сутки. Необходимо удовлетворение суточной потребности в витаминах и микроэлементах. Предпочтительнее использовать готовые смеси, обогащенные белком и омега-3-полиненасыщенными жирными кислотами, в суточной дозе не менее 400 мл (готового напитка). При использовании нутритивной поддержки в течение, как минимум, 7 дней частота инфекционных осложнений и длительность госпитализации в послеоперационном периоде достоверно уменьшаются
[108].
4.2 Реабилитация при хирургическом лечении
4.2.1 Первый этап реабилитации
- Рекомендуется ранняя мобилизация и активизация пациента с ГЦР(вертикализация, дыхательная гимнастика, занятия ЛФК) под контролем инструктора, начиная с 1–2-го дня послеоперации для снижения частоты осложнений и сокращения сроков госпитализации[108,109].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Пациентам с ГЦР рекомендуется раннее начало энтерального питания (на 2-е послеоперационные сутки) с ориентацией на общие принципы нутритивной поддержки после хирургических вмешательств на органах брюшной полости для уменьшения частоты осложнений и длительности госпитализации[107].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: цель проведения ранней мобилизации пациента в совокупности с адекватной нутритивной поддержкой состоит в улучшении кардиореспираторной выносливости пациента, следствием чего является уменьшение частоты нехирургических осложнений и длительности госпитализации.
4.2.2 Второй этап реабилитации
- Пациентам рекомендуются аэробные нагрузки с постепенным увеличением их интенсивности длительностью до 150 мин в неделю, а также упражнения с сопротивлением (по 8–10 повторений на основные группы мышц) 2 раза в неделю под контролем инструктора ЛФК для улучшения качества жизни пациента и ускорения социальной реабилитации [110,111].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: целью физической нагрузки является восстановление кардиореспираторной выносливости, что препятствует развитию мышечной слабости, возникновению и прогрессированию саркопении, улучшает качество жизни пациента и ускоряет его социальную реабилитацию.
- Пациентам с ГЦР рекомендуется проведение сеансов электросна по общепринятой методике для улучшения качества жизни [112].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: целью проведения сеансов электросна является получение выраженного седативного эффекта, который уменьшает проявления астенического и депрессивного синдромов, снижает интенсивность головных болей, проявления дискинезии желчевыводящих путей, что значительно улучшает качество жизни пациента.
4.2.3 Третий этап реабилитации
- Пациентам с ГЦР, находящимся в ремиссии, в домашних условиях рекомендуются регулярные занятия ЛФК, начинающиеся с аэробной нагрузки низкой интенсивности с постепенным увеличением ее до аэробной нагрузки умеренной интенсивности в совокупности с упражнениями с сопротивлением на основные группы мышц (по 15–20 мин, по 8–10 повторений) дважды в неделю для улучшения кардиореспираторной выносливости и повышения качества жизни [113].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: целью занятий ЛФК является обеспечение сохранения мышечной массы, улучшение кардиореспираторной выносливости, повышение качества жизни и увеличение общей выживаемость. Желательное время тренировки – не менее 30 мин в день с умеренной интенсивностью несколько (большинство) дней в неделю, принимая во внимание наличие и тяжесть осложнений противоопухолевого лечения.
4.3 Реабилитация при химиотерапии
- Пациентам с ГЦР, получающим химиотерапевтическое лечение, рекомендуются занятия ЛФК с включением аэробной нагрузки средней интенсивности в домашних условиях с целью повышения кардиореспираторной выносливости[114].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- При развитии полинейропатии пациентам с ГЦР рекомендуется проведение поликомпонентной программы реабилитации, включающей в себя упражнения на тренировку баланса, низкоинтенсивную лазеротерапию, низкочастотную магнитотерапию, чрескожную электростимуляцию для уменьшения явления полинейропатии[115–118].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- В течение всего курса химиотерапии пациентам с ГЦР рекомендуется нутритивная поддержка по показаниям в режиме, совпадающем с режимом нутритивной поддержки на предоперационном этапе для сохранения мышечной массы[107].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: нутритивная поддержка необходима с целью сохранения мышечной массы, что в совокупности с посильной физической нагрузкой препятствует усилению токсичности химиотерапии.
Госпитализация
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрения на него в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами и врачами по рентгенэндоваскулярной диагностике и лечению в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациенту с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов, врачей по рентгенэндоваскулярной диагностике и лечению и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии и т. д.) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, рентгенохирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и других видов, лекарственной терапии и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется соблюдать следующую периодичность наблюдения после завершения радикального лечения по поводу ГЦР и применять следующие методы наблюдения для раннего выявления прогрессирования заболевания[6,9,14]:
1. сбор анамнеза и физикальное обследование – каждые 3–6 мес., далее 1 раз в 6–12 мес;
2. определение уровня АФП (если исходно он был повышен) – каждые 3–4 мес. в первые 2 года, далее 1 раз в 6–12 мес.;
3. УЗИ органов брюшной полости – каждые 3–4 мес.;
4. КТ или МРТ органов брюшной полости с внутривенным контрастированием – каждые 3–6 мес.;
5. рентгенография органов грудной клетки – каждые 12 мес.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания после завершения лечения с целью раннего проведения хирургического лечения резектабельных метастатических очагов, аблации и/или химиоэмболизации рецидивных опухолей, своевременного начала лекарственного противоопухолевого лечения.
- Рекомендуется соблюдать следующую периодичность и применять следующие методы наблюдения за пациентами, проходящими противоопухолевое лечение по поводу ГЦР для раннего выявления прогрессирования заболевания [6,9,14]:
1. сбор анамнеза заболевания и лечения, включая данные о сопутствующей патологии, и физикальное обследование;
2. развернутый клинический анализ крови (лейкоцитарная формула, число тромбоцитов);
3. биохимический анализ крови (определение уровня мочевины, креатинина, альбумина, глюкозы, АСТ, АЛТ, щелочной фосфатазы);
4. коагулограмма (международное нормализованное отношение или протромбиновое время);
5. определение уровня АФП – каждые 3–4 мес.;
6. УЗИ органов брюшной полости – каждые 2–3 мес.;
7. эзофагогастродуоденоскопия – каждые 6 мес.;
8. мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием – каждые 3–4 мес.;
9. рентгенография органов грудной клетки – каждые 6 мес.;
10. сцинтиграфия костей всего тела – по показаниям.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России — 1. Akinyemiju T. et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level // JAMA Oncol. 2017. Vol. 3, № 12. P. 1683.
2. Estes C. et al. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease // Hepatology. 2018. Vol. 67, № 1. P. 123–133.
3. Fattovich G. et al. Hepatocellular carcinoma in cirrhosis: Incidence and risk factors // Gastroenterology. W.B. Saunders, 2004. Vol. 127, № 5 SUPPL.
4. Карпин А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 252 p.
5. AJCCCancerStagingManual. 8th ed. / ed. Amin M.B. et al. Springer, 2017.
6. Galle P.R. et al. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma // J. Hepatol. Elsevier B.V., 2018. Vol. 69, № 1. P. 182–236.
7. Forner A., Reig M., Bruix J. Hepatocellular carcinoma // The Lancet. Lancet Publishing Group, 2018. Vol. 391, № 10127. P. 1301–1314.
8. Vogel A. et al. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. Oxford University Press, 2018. Vol. 29. P. iv238–iv255.
9. Marrero J.A. et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases // Hepatology. John Wiley and Sons Inc., 2018. Vol. 68, № 2. P. 723–750.
10. Terrault N.A. et al. AASLD guidelines for treatment of chronic hepatitis B // Hepatology. John Wiley and Sons Inc., 2016. Vol. 63, № 1. P. 261–283.
11. Chung R.T. et al. Hepatitis C guidance 2018 update: Aasld-idsa recommendations for testing, managing, and treating Hepatitis C Virus infection // Clin. Infect. Dis. Oxford University Press, 2018. Vol. 67, № 10. P. 1477–1492.
12. Waidely E. et al. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection // Analyst. Royal Society of Chemistry, 2016. Vol. 141, № 1. P. 36–44.
13. Arrieta O. et al. The progressive elevation of alpha fetoprotein for the diagnosis of hepatocellular carcinoma in patients with liver cirrhosis // BMC Cancer. 2007. Vol. 7.
14. NCCN. Clinical Practice Guidelines in Oncology. Hepatobiliary Cancers, version 4.2021. 2021.
15. Peng Y., Qi X., Guo X. Child–Pugh Versus MELD Score for the Assessment of Prognosis in Liver Cirrhosis // Medicine (Baltimore). 2016. Vol. 95, № 8. P. e2877.
16. Forner A. et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma // Hepatology. 2008. Vol. 47, № 1. P. 97–104.
17. Chou R. et al. Imaging Techniques for the Diagnosis of Hepatocellular Carcinoma // Ann. Intern. Med. 2015. Vol. 162, № 10.
18. Lee Y.J. et al. Hepatocellular carcinoma: Diagnostic performance of multidetector CT and MR imaging-a systematic review and meta-analysis // Radiology. Radiological Society of North America Inc., 2015. Vol. 275, № 1. P. 97–109.
19. Liu X. et al. Gadoxetic acid disodium–enhanced magnetic resonance imaging outperformed multidetector computed tomography in diagnosing small hepatocellular carcinoma: A meta-analysis // Liver Transplant. 2017. Vol. 23, № 12. P. 1505–1518.
20. Li J. et al. The diagnostic performance of gadoxetic acid disodium-enhanced magnetic resonance imaging and contrast-enhanced multi-detector computed tomography in detecting hepatocellular carcinoma: a meta-analysis of eight prospective studies // European Radiology. 2019. Vol. 29, № 12. P.
6519–6528.
21. Guo J. et al. Diagnostic performance of contrast-enhanced multidetector computed tomography and gadoxetic acid disodium-enhanced magnetic resonance imaging in detecting hepatocellular carcinoma: direct comparison and a meta-analysis // Abdom. Radiol. Springer New York LLC, 2016. Vol. 41, № 10. P. 1960–1972.
22. Kang T.W. et al. Use of gadoxetic acid–enhanced liver MRI and mortality in more than 30000 patients with hepatocellular Carcinoma: A nationwide analysis // Radiology. 2020. Vol. 295, № 1. P. 114–124.
23. Wang J.H. et al. Clinical Impact of Gadoxetic Acid-Enhanced Magnetic Resonance Imaging on Hepatoma Management: A Prospective Study // Dig. Dis. Sci. 2016. Vol. 61, № 4. P. 1197–1205.
24. Cerny M. et al. LI-RADS version 2018 ancillary features at MRI // Radiographics. Radiological Society of North America Inc., 2018. Vol. 38, № 7. P. 1973–2001.
25. Chernyak V. et al. LI-RADS ® algorithm: CT and MRI // Abdominal Radiology. Springer New York LLC, 2018. Vol. 43, № 1. P. 111–126.
26. Ludwig D.R. et al. Expanding the Liver Imaging Reporting and Data System (LI-RADS) v2018 diagnostic population: performance and reliability of LI-RADS for distinguishing hepatocellular carcinoma (HCC) from non-HCC primary liver carcinoma in patients who do not meet strict L // HPB. Elsevier B.V., 2019. Vol. 21, № 12. P. 1697–1706.
27. Choi J.Y., Lee J.M., Sirlin C.B. CT and MR imaging diagnosis and staging of hepatocellular carcinoma. Part II. Extracellular agents, hepatobiliary agents, and ancillary imaging features // Radiology. 2014. Vol. 273, № 1. P. 30–50.
28. Katyal S. et al. Extrahepatic Metastases of Hepatocellular Carcinoma // Radiology. 2000. Vol. 216, № 3. P. 698–703.
29. Natsuizaka M. et al. Clinical features of hepatocellular carcinoma with extrahepatic metastases // J. Gastroenterol. Hepatol. Blackwell Publishing, 2005. Vol. 20, № 11. P. 1781–1787.
30. Stewart C.J.R., Coldewey J., Stewart I.S. Comparison of fine needle aspiration cytology and needle core biopsy in the diagnosis of radiologically detected abdominal lesions // J. Clin. Pathol. 2002. Vol. 55, № 2. P. 93–97.
31. Sangiovanni A. et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis // Gut. 2010. Vol. 59, № 5. P. 638–644.
32. Intenzo C., Kim S., Lakhani P. Utility of FDG-PET/CT in Detecting Metastases from Hepatocellular Carcinoma // J. Nucl. Med. 2017. Vol. 58, Issue. P. 427.
33. Marrero J.A. et al. Prognosis of hepatocellular carcinoma: Comparison of 7 staging systems in an American cohort // Hepatology. 2005. Vol. 41, № 4. P. 707–715.
34. Cillo U. et al. Prospective validation of the Barcelona Clinic Liver Cancer staging system // J. Hepatol. 2006. Vol. 44, № 4. P. 723–731.
35. Chen C.-H. et al. Applicability of staging systems for patients with hepatocellular carcinoma is dependent on treatment method – Analysis of 2010 Taiwanese patients // Eur. J. Cancer. 2009. Vol. 45, № 9. P. 1630–1639.
36. Kumar A. et al. Hepatic arteriovenous fistulae: Role of interventional radiology // Dig. Dis. Sci. 2012. Vol. 57, № 10. P. 2703–2712.
37. Wu H. et al. Clinical characteristics of hepatic Arterioportal shunts associated with hepatocellular carcinoma // BMC Gastroenterol. 2018. Vol. 18, № 1.
38. Truty M.J., Vauthey J.-N. Surgical Resection of High-Risk Hepatocellular Carcinoma: Patient Selection, Preoperative Considerations, and Operative Technique // Ann. Surg. Oncol. 2010. Vol. 17, № 5. P. 1219–1225.
39. Pawlik T.M. Critical Appraisal of the Clinical and Pathologic Predictors of Survival After Resection of Large Hepatocellular Carcinoma // Arch. Surg. 2005. Vol. 140, № 5. P. 450.
40. Chok K.S. et al. Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma // Br. J. Surg. 2009. Vol. 96, № 1. P. 81–87.
41. Ribero D. et al. Selection for resection of hepatocellular carcinoma and surgical strategy: Indications for resection, evaluation of liver function, portal vein embolization, and resection // Annals of Surgical Oncology. 2008. Vol. 15, № 4. P. 986–992.
42. Berzigotti A. et al. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: A systematic review and meta-analysis // Hepatology. John Wiley and Sons Inc., 2015. Vol. 61, № 2. P. 526–536.
43. Mazzaferro V. et al. The long-term benefit of liver transplantation for hepatic metastases from neuroendocrine tumors // Am. J. Transplant. 2016. Vol. 16, № 10. P. 2892–2902.
44. Mazzaferro V., Battiston C., Sposito C. Pro (With Caution): Extended oncologic indications in liver transplantation // Liver Transplant. 2018. Vol. 24, № 1. P. 98–103.
45. Mazzaferro V. et al. Liver transplantation in hepatocellular carcinoma after tumour downstaging (XXL): a randomised, controlled, phase 2b/3 trial // Lancet Oncol. 2020. Vol. 21, № 7. P. 947–956.
46. Clavien P.A. et al. Recommendations for liver transplantation for hepatocellular carcinoma: An international consensus conference report // The Lancet Oncology. 2012. Vol. 13, № 1.
47. Олисов О.Д. et al. Трансплантация печени в лечении нерезектабельной гепатоцеллюлярной карциномы в отсутствие цирроза печени. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018. Vol. 28, № 4. P. 76–83.
48. Новзурбеков М.С. et al. Трансплантация и аутотрансплантация как радикальный метод лечения нерезектабельных опухолевых и паразитарных заболеваний печени // Анналы хирургической гепатологии. 2020. Vol. 25, № 4. P. 49–59.
49. Decaens T., Laurent A., Luciani A. Liver transplantation for hepatocellular carcinoma in noncirrhotic livers regardless of the number and size of tumours? // Journal of Hepatology. 2012. Vol. 57, № 2. P. 235–236.
50. Fujiki M., Aucejo F., Kim R. General overview of neo-adjuvant therapy for hepatocellular carcinoma before liver transplantation: Necessity or option? // Liver International. 2011. Vol. 31, № 8. P. 1081–1089.
- Клинические рекомендации Ассоциации онкологов России — 1. Akinyemiju T. et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level // JAMA Oncol. 2017. Vol. 3, № 12. P. 1683.
Информация
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ГЦР – гепатоцеллюлярный рак
КТ – компьютерная томография
ЛФК – лечебная физкультура
МРТ – магнитно-резонансная томография
ТАХЭ – трансартериальнаяхимиоэмболизация
УЗИ – ультразвуковое исследование
AASLD – American Association for the Study of Liver Disease, Американская ассоциация по изучению заболеваний печени
EASL – The European Association for the Study of the Liver, Европейская ассоциация по изучению печени
BCLC – Barcelona Clinic Liver Cancer (classification), Барселонская система стадирования рака печени
ECOG PS – Eastern Cooperative Oncology Group Performance Status, шкала оценки общего состояния пациента, разработанная Восточной объединенной онкологической группой
LI-RADS – LiverI maging Reportingand Data System, система отчетов и данных (интерпретации и протоколирования) визуализации печени.
RECIST – Response Evaluation Criteriain Solid Tumors, критерии оценки ответа солидных опухолей на лечение
mRECIST – modified Response Evaluation Criteriain Solid Tumors, модифицированные критерии оценки ответа солидных опухолей на лечение
PD1/PD-L1 – program medcelldeath 1/program medcelldeath 1 ligand, мембранный белок запрограммированной смерти клеток/его лиганд
TNM – (аббревиатура от Tumor, Nodus, Metastasis), международная классификация стадий злокачественных новообразований
** – жизненно необходимые и важнейшие лекарственные препараты
Термины и определения
Блокатор CTLA4 – моноклональное антитело, блокирующее антиген цитотоксических Т-лимфоцитов 4-го типа.
Блокатор PD1 – моноклональное антитело, блокирующее рецептор программируемой смерти 1.
Класс цирроза по Child–Pugh – степень выраженности нарушения функции печени (А, В, С), рассчитываемая по сумме баллов.
Компьютерная томография – метод послойной внутренней диагностики.
Магнитно-резонансная томография – метод послойной внутренней диагностики с помощью эффекта ядерного магнитного резонанса.
Позитронно-эмиссионная томография – метод радионуклидной диагностики.
Терапия «понижения стадии» – down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений.
Трансартериальнаяхимиоэмболизация – метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с цитостатиком.
Трансартериальнаярадиоэмболизация – метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с изотопом.
Ультразвуковое исследование – неинвазивное исследование организма с помощью ультразвуковых волн.
Bridge-терапия – терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации.
CTLA4 – антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула B7.1 или B7.2.
Response Evaluation CriteriainSolid Tumours – набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию.
Modified Response Evaluation Criteriain Solid Tumors – набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию методом измерения васкуляризованного компонента опухолевого узла.
Предреабилитация (prehabilitation) – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период, поздний реабилитационный период, период остаточных явлений заболевания.
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе, в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Абдурахманов Д.Т., д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии Первого МГМУ им. И.М. Сеченова.
2. Алиева С.Б., д.м.н., ведущий научный сотрудник радиологического отделения НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
3. Балахнин П.В., к.м.н., заведующий отделением рентгенохирургических методов диагностики и лечения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
4. Базин И.С., д.м.н., старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Болотина Л.В., д.м.н., заведующий отделением химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
6. Бредер В.В.,д.м.н., ведущий научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) № 17 ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России.
7. ВиршкеЭ.Р.,д.м.н., заведующий лабораторией интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
8. Гранов Д.А., д.м.н., член-корр. РАМН, академик РАН, научный руководитель РНЦРиХТ им. А.М. Гранова
9. Долгушин Б.И., чл.-корр. РАН, д.м.н., директор НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10. Косырев В.Ю.,д.м.н., ведущий научный сотрудник лаборатории интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Ледин Е. В.,к.м.н., клиническая больница № 2 АО «Группа компаний МЕДСИ».
12. ЛукъянченкоА.Б.,д.м.н., профессор, ведущий научный сотрудник рентгенодиагностического отделения НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
13. Медведева Б.М.,д.м.н., заведующий рентгенодиагностическим отделением НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
14. Мороз Е.А.,к.м.н., врач-патологоанатом отдела патологической анатомии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
15. Кармазановский Г.Г., член-корр. РАН, д.м.н, профессор, заведующий отделением рентгенологии и магнитно-резонансных исследований с кабинетом ультразвуковой диагностики ФГБУ “НМИЦ хирургии имени А.В. Вишневского” Минздрава России; профессор кафедры лучевой диагностики и терапии медико-биологического факультета ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России
16. Кудашкин Н.Е., к.м.н., научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, доцент кафедры онкологии и лучевой терапии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
17. Новрузбеков М С.,д.м.н., заведующий научным отделом трансплантации печени ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ».
18. Патютко Ю.И.,д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
19. Петкау В. В.,к.м.н., доцент кафедры онкологии УГМУ, врач-онколог клиники «УГМК-здоровье», Екатеринбург
20. Петров Л.О., к.м.н., заведующий отделением лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России
21. Подлужный Д.В.,к.м.н., заведующий отделением опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
22. Сагайдак И.В.,д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
23. Сидоров Д.В., д.м.н., заведующий абдоминальным отделением хирургического отдела МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
24. Феденко А.А., д.м.н., заведующий отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
25. Фалалеева Н.А., д.м.н., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
3. Гильмутдинова И.Р., к.м.н., врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий, заведующая отделом биомедицинских технологий и лабораторией клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
4. БулановА.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Бутенко А.В., д.м.н., профессор, заместитель главного врача по онкологической помощи ФГБНУ «Российский научный центр хирургии им. академика Б.В. Петровского»
6. Назаренко А.В., к.м.н., член Российской ассоциации терапевтических радиационных онкологов, European Society forRadiotherapy&Oncology, Российско-Американского альянса по изучению рака, представитель Российской Федерации в МАГАТЭ, врач высшей квалификационной категории.
7. Обухова О.А.,к.м.н.,врач-физиотерапевт, заведующий отделением медицинской реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания.
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения медицинской реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
10. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
11. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
12. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
13. Романов А.И., академик РАН,д.м.н., профессор, главный врач ФГБУ «Центр реабилитации» Управления делами Президента Российской Федерации.
14. Филоненко Е.В.,д.м.н., профессор, заведующий центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
Блок по организации медицинской помощи:
1. Невольских А.А.,д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
2. Иванов С.А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3. Хайлова Ж.В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1) врачи-онкологи;
2) врачи-хирурги;
3) врачи-радиологи;
4) врачи по рентгеноэндоваскулярным диагностике и лечению;
5) студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме ГЦР в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Рисунок А1. Барселонская система стадирования гепатоцеллюлярного рака [7].
ОВ – общая выживаемость; ОС – объективный статус
по шкале ECOG; ТАХЭ – трансартериальная химиоэмболизация
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте
http://grls.rosminzdrav.ru
.
Таблица 2. Режимы лекарственного лечения гепатоцеллюлярного рака
Приложение Б. Алгоритмы действий врача
Рис. Б1. Диагностический алгоритм при выявлении узловых образований в цирротической печени у пациентов группы риска развития гепатоцеллюлярного рака
Приложение В. Информация для пациента
Рекомендации по первичной профилактике гепатоцеллюлярного рака
Главным фактором риска развития рака печени является хроническое воспаление печени вследствие воздействия различных повреждающих факторов: хронических вирусных гепатитов В и С, употребления алкоголя и других токсических веществ, нарушения углеводного и жирового обмена и цирроза различной этиологии. Сочетание нескольких факторов риска увеличивает вероятность развития первичного рака печени. Вакцинация от вирусного гепатита В – важнейшее профилактическое мероприятие. Эффективная противовирусная терапия хронического гепатита С достоверно уменьшает вероятность развития рака печени.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до +38°C и выше – начать прием антибиотиков в соответствии с назначением врача-онколога.
2. При стоматите:
- механически, термически щадящая диета;
- частое (каждый час) полоскание рта отварами ромашки, шалфея, коры дуба, смазывание рта облепиховым (персиковым) маслом;
- обработка полости рта по рекомендации врача-онколога.
3. При диарее:
- исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
5. При развитии специфических для непрерывной таргетной терапии побочных эффектов – артериальной гипертензии, появлении трещин на коже рук и ног, многократной диарее, выраженной слабости – следует прекратить прием препарата и незамедлительно связаться с лечащим врачом.
Информация для пациента, получающего терапию моноклональными антителами – блокаторами CTLA4 и/или PD1/PD-L1
Своевременное взаимодействие с вашим лечащим врачом и медицинской̆ сестрой по поводу состояния вашего здоровья – важная составляющая вашей помощи медицинской команде в осуществлении настолько полной защиты вас в процессе лечения, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами CTLA4 и/или PD1, были выявлены и устранены при первом их появлении, это поможет предотвратить их переход в более тяжелые формы.
Блокаторы CTLA4 и/или МКА-блокаторы PD1/PD-L1 разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей .
Побочные явления, которые могут появиться у вас, обычно возникают в первые
12 недель лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами CTLA4 и/или PD1/PD-L1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые формы.
Если после лечения блокаторами CTLA4 и/или МКА-блокаторами PD1/PD-L1 у вас возникли какие-либо симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные эффекты терапии блокаторамиCTLA4 и/или PD1/PD-L1:
- увеличение числа актов дефекации (>2 в день) или любая диарея в ночное время, любой стул со слизью и кровью;
- боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
- красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
- желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи к солнечным лучам;
- возникновение кашля или одышки;
- усталость или сонливость;
- затрудненная концентрация внимания или спутанность сознания;
- головная боль, боль в теле или в месте опухоли;
- лихорадка (повышение температура тела до +38°C и выше);
- внезапное снижение или увеличение массы тела;
- возникновение эректильной дисфункции или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записывайте количество актов каждый день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
– стул неплотный ;
– водянистый ;
– болезненный ;
– кровянистый ;
– слизистый .
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед. до нескольких месяцев от начала лечения блокаторамиCTLA4 и/или PD1/ PD-L1. Если у вас возник любой из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской сестре.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки функции печени по Чалд-Пью
Название на русском языке: классификация тяжести цирроза печени по Чалд-Пью
Оригинальное название: Child–Pughclassification
Источник (официальный сайт разработчиков, публикация с валидацией):
1. Cholongitas E. et al. Systematic review: The model for end-stage liver disease — Should it replace Child-Pugh’s classification for assessing prognosis in cirrhosis? // Alimentary Pharmacology and Therapeutics. 2005. Vol. 22, № 11–12. P. 1079–1089.
2. Child C.G., Turcotte J.G. Surgery and portal hypertension // The Liver and Portal Hypertension. Philadelphia: Saunders, 1964. 50–58 p.
3. Pugh R.N.H. et al. Transection of the oesophagus for bleeding oesophageal varices // Br. J. Surg. 2005. Vol. 60, № 8. P. 646–649.
Назначение: определить степень выраженности нарушения функции печени.
Содержание:
Пояснения: хроническое поражение (нарушение функции) печени классифицируется как Child–Pugh класса A, В или C, в зависимости от суммы баллов, полученных для каждого параметра. Класс А: 5-6 баллов, класс В: 7-9 баллов и класс С: 10-15 баллов.
Приложение Г2. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией):
1. https://ecog-acrin.org/resources/ecog-performance-status.
2. Oken M.M., Creech R.H., Davis T.E. Toxicology and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. Cancer Clin. Trials. 1982. Vol. 5, № 6. P. 649–655.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г3. Шкала Карновского
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Оригинальная публикация:
Karnofsky DA B.J.H. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of Chemotherapeutic Agents. // Columbia Univ. Press. 1949. P. 191–205.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г4. Критерии оценки ответа опухоли на лечение
(RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1).
Оригинальное название: Response Evaluation Criteriain Solid Tumors 1.1.
Оригинальная публикация:
EisenhauerE.A. etal. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1) // Eur. J. Cancer. 2009. Vol. 45, № 2. P. 228–247.
Назначение: оценка ответа на химиотерапевтическое лечение.
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический центр медицинской радиологии» Департамента здравоохранения города Москвы и доступны на веб-сайте http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf.Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
Приложение Г5. Критерии оценки ответа опухоли на лечение
(mRECIST)
Название на русском языке: Модифицированные критерии оценки ответа опухоли на химиотерапевтическое лечение (mRECIST).
Оригинальное название: ModifiedResponseEvaluationCriteriainSolidTumors.
Оригинальная публикация:
Lencioni R., Llovet J.M. ModifiedRECIST (mRECIST) assessment for hepatocellular carcinoma // Seminars in Liver Disease. 2010. Vol. 30, № 1. P. 52–60.
Назначение: оценка ответа на таргетную терапию и локорегионарное лечение ГЦР.
Оценка проводится при помощи КТ или МРТ, исключительно в артериальную фазу сканирования. Длинник очага оценивается в той части, что наиболее усилилась постконтрастно в артериальную фазу.
- Полный ответ (Complete Response — CR) — Исчезновение любого внутриопухолевого контрастирования в артериальную фазу во всех таргетных очагах.
- Частичный ответ (Partial Response — PR) — Уменьшение суммы диаметров очагов не менее чем на 30%, оцениваемые в артериальную фазу контрастирования.
- Прогрессирование заболевания (ProgressiveDisease — PD) — Увеличение на 20% и более суммы диаметров таргетных очагов, оцениваемые в артериальную фазу контрастирования.
- Стабилизация заболевания (StableDisease — SD) — Все остальное.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Введение
Печень является самым крупным органом в организме человека и находится внутри живота, за ребрами с правой стороны тела; выполняет основные функции, чтобы поддерживать здоровье организма:
- удаляет вредные вещества из крови;
- производит ферменты и желчь, которые помогают переваривать пищу;
- превращает пищу в вещества, необходимые для жизни и роста.
Печень получает нужную кровь из двух сосудов, большинство из которых поступает из печеночной воротной вены, а остаток поступает из печеночной артерии.
Большинство первичных опухолей печени у взрослых образуются в гепатоцитах (клетках печени), и этот тип рака называется гепатоцеллюлярной карциномой (или злокачественной гепатокарциномой).
Основными факторами риска являются:
- гепатит В или С;
- алкоголизм;
- цирроз печени;
- гемохроматоз (болезнь, связанная с накоплением железа);
- ожирение;
- сахарный диабет.
Симптомы опухоли печени могут включать:
- наличие комков и/или боли на правой стороне живота;
- пожелтение кожи (желтуха),
Однако, к сожалению, у человека нет никаких явных нарушений вплоть до самых поздних стадий заболевания, и это часто делает рак печени особенно трудным для лечения (посредством хирургии, лучевой терапии, химиотерапии или трансплантации печени).
Эпидемиология
Злокачественные опухоли печени, из которых гепатоцеллюлярная карцинома является наиболее частой, представляют во всем мире одну из основных причин смерти от рака.
Заболеваемость широко варьируется в зависимости от географических районов: каждый год в мире оценивается более 350 000 новых случаев, подавляющее большинство из которых (более 70%) встречается в развивающихся странах, в Азии (южные регионы, на востоке), в Африке (Сахара и южные регионы), в западно-тихоокеанском регионе с частотой заболеваемости до 30% всех опухолей.
В Соединенных Штатах и в Европе злокачественные опухоли печени встречаются реже. По оценкам, европейская заболеваемость составляет около 2% от всех видов рака: 7 случаев на 100 000 субъектов в год у мужчин и 2 на 100 000 у женщин.
Причины и факторы риска рака печени
Медицине неизвестны причины, по которым возникает данный рак, однако известны, люди с определенными факторами риска, у которых чаще других обнаруживается карцинома печени. Были выделены следующие факторы риска, связанные с началом гепатоцеллюлярной карциномы, основным раком печени:
- Вирусные инфекции: явное доказательство связи между вирусом гепатита В, гепатитом С и риском развития гепатокарциномы является четким свидетельством исследований. Вирусы гепатита В и С передаются через кровь, половым путем или от матери ребенку во время беременности. По сравнению с общей популяцией, у лиц, инфицированных одним вирусом гепатита, общие данные оценивают увеличение риска развития гепатокарциномы примерно в 20 раз, в то время как одновременное заражение активным HCV и HBV приводит к увеличению риска примерно в 80 раз.
- Пол: гепатоцеллюлярная карцинома чаще встречается у мужского пола, чем у женского, вероятно, из-за большего злоупотребления алкоголем и курением среди мужчин.
- Злоупотребление алкоголем и курение: потребление алкоголя, например, которое может вызвать цирроз печени (> 50-70 г/день), также увеличивает заболеваемость раком печени. Курение также связано с риском первичной гепатокарциномы.
- Цирроз печени: цирроз — это состояние хронической дегенерации ткани печени, которая развивается по причинам, например, вирусной или паразитарной инфекции, злоупотребления алкоголем, аутоиммунными заболеваниями, употреблением лекарств или химического отравление, при циррозе клетки печени повреждаются и затем замещаются рубцовой тканью. Приблизительно у пяти процентов людей с циррозом развивается рак печени.
- Генетические факторы: некоторые наследственные метаболические заболевания связаны с риском развития гепатокарциномы, такой как дефицит альфа-1-антитрипсина, гемохроматоз, перцитруллинемия и накопление гликогена.
- Метаболический синдром: представлен сахарным диабетом, ожирением и ожирением печени.
- Возраст: большинство раковых заболеваний клинически проявляются после 60 лет.
- Токсичные вещества: во многих тропических странах, особенно в южной части Африки и Юго-Восточной Азии (страны с жарким влажным климатом), основным пищевым гепатотоксическим загрязнителем является афлатоксин B1, вырабатываемый грибом Aspergillus Flavus, который загрязняет многие злаки (рис, кукуруза, соя и т. д.). Винилхлорид, диоксин, мышьяк являются факторами риска развития рака печени. Использование анаболических стероидов, мужских гормонов, используемых спортсменами для повышения физической работоспособности, и оральных контрацептивов (в частности, высокодозных гормональных противозачаточных таблеток, которые больше не используются) также могут повышать риск гепатокарциномы.
Симптомы и признаки рака печени

Начальная симптоматика рака печени оставляет желать лучшего, очень часто из-за общей картины печеночной недостаточности.
На начальных этапах рак печени — это молчаливое заболевание, которое часто выявляется случайным образом, во время осмотров; первые симптомы появляются, когда уже есть серьезное повреждение ткани печени.
Кроме того, поскольку болевые рецепторы расположены на капсуле, которая покрывает орган, их стимуляция и, следовательно, боль будут возникать, когда размер печени (гепатомегалия) увеличиться, вызывая расширение капсулы, провоцируя боль в нижней правой части живота.
Признаки и симптомы, которые указывают на тяжелые заболевания печени:
- усталость и астения;
- боль в верхней правой части живота или вокруг правого лопатки;
- тошнота, отсутствие аппетита (потеря аппетита), чувство сытости даже после легкой еды;
- необъяснимая потеря веса и уменьшение мышечной массы;
- лихорадка;
- желтуха: характерная желтоватая окраска кожи и белой части глаз: это связано с проникновением желчи в кровь;
- зуд кожи;
- печеночная энцефалопатия: спутанность сознания, сонливость, кома;
- печеночно-почечный синдром: это синдром, который приводит к нарушению функции почек после печеночной недостаточности; проявляется, среди прочего, в изменениях электролита (натрия, калия и т. д.) и образовании отеков (накопление жидкости в различных тканях);
- асцит, то есть наличие жидкости в брюшной полости
- склонность к кровотечению, вызванная снижением уровня витамина К и снижением синтеза факторов свертывания крови, с кровавой рвотой, то есть рвотой с кровью из-за наличия варикозного расширения вен пищевода.
Диагностика рака печени
Чтобы сформулировать диагноз, врач, после изучения анамнеза, проведет лабораторные анализы и объективное обследование; он назначит дальнейшие диагностические анализы и биопсию печени, или агоспират, который является основным тестом для подтверждения рака печени.
После диагностики рака печени, диагностическая процедура включает в себя выполнение завершающих обследований, чтобы оценить степень новообразования.
- АФБ (альфа-фетальный белок): это гликопротеин. Увеличение значений альфа-фето-белка (АФП выше 10-15 нг/мл) может привести к подозрению на опухоль печени, но, поскольку рост этого гликопротеина может происходить и при других заболеваниях печени (хронический вирусный гепатит, цирроз) или из-за других видов рака (например, рака яичка у мужчин), а также во время беременности, тест не может считаться диагностическим.
- Трансаминазы (АСТ, АЛТ, гамма-ГТ), общий и фракционный билирубин, электрофорез белков, общие белки: эти анализы крови, которые указывают на функциональность печени.
- Ультразвуковое исследование: это неинвазивное, безрисковое исследование, полезное для определения степени опухоли (размера и количества узелков) и возможного присутствия тромбов (сгустков крови, которые закрывают сосуды) в ветвях воротной вены. Ультразвуковое исследование может быть проведено в брюшной полости и позволяет обнаружить наличие жидкости в брюшной полости (асцит) или гипертонию воротной вены.
- Биопсия печени: проводится под местной анестезией; через тонкую иглу, которая пересекает брюшную стенку, берут образец ткани печени под ультразвуковым контролем или с помощью компьютерной томографии. Отбор проб также может быть сделан с лапароскопией или через небольшой разрез брюшной полости. Взятая проба отправляется в лабораторию для гистологического исследования, что позволит сформулировать диагноз.
- Компьютерная томография (КТ): дает детальное изображение печени, близлежащих органов и кровеносных сосудов; для лучшей оценки она может быть выполнена с использованием контрастного вещества.
- Магнитно-резонансная томография (МРТ): использует вариации магнитного поля для построения изображений органов внутри тела; обеспечивает лучшую визуализацию по сравнению с КТ мягких тканей. Области, пораженные опухолью, дают изображения, которые можно отличить от областей здоровых тканей.
- Печеночная ангиография: это рентгенологическое исследование, которое включает использование контрастных веществ, вводимых в печеночную артерию; таким образом визуализируются сосуды, которые орошают печень и любые опухоли. В настоящее время этот метод играет больше терапевтическую роль (химиоэмболизация), чем диагностический, поскольку его заменяют МРТ и КТ.
- Позитронно-эмиссионная томография (ПЭТ-КТ) : эта сложная неинвазивная методика включает изучение метаболизма глюкозы в опухолевых клетках путем внутривенного введения F18 FDG-трейсера. Используется для метастатических или примитивных поражений печени.
Стадирование TNM
В случае гепатоцеллюлярной карциномы официальной системой классификации является «TNM», который указывает на стадию заболевания, где «T» указывает на объем и локальное расширение опухоли, «N» указывает на степень новообразования в регионарных лимфатических узлах и «М» наличие или отсутствие отдаленных метастазов.
Классификация гепатоцеллюлярной карциномы по TNM:
- TX: примитивная опухоль не определяется.
- T0: примитивная опухоль не видна.
- T1: одиночная опухоль без сосудистой инвазии.
- Т2: одиночная опухоль с сосудистой инвазией или множественными опухолями, ее максимальный размер не более 5 см.
- T3: множественные опухоли более 5 см в максимальном размере или опухоль с вовлечением крупной ветви воротной вены или печеночных вен.
- T4: опухоль (i) с прямой инвазией в соседние органы, кроме желчного пузыря или опухоль (i), которая пронизывает висцеральную брюшину.
- NX: не оцениваемые регионарные лимфатические узлы.
- N0: метастазы в регионарных лимфатических узлах.
- N1: метастазирование в регионарные лимфатические узлы.
- MX: метастазирование на расстоянии не установлено.
- M0: нет метастаз на расстоянии.
- М1: метастазирование на расстоянии.
Лечение рака печени

Поскольку рак печени сложно лечить, важно, чтобы пациент был направлен в специализированные центры по раку печени, где группа специалистов (хирург, онколог, радиотерапевт и патолог) сделает выбор терапии или методов лечения, принимая во внимание место и количество опухолевых масс, стадию, то есть их распространение в печени, или начали ли они распространяться за пределы органа, скорость роста опухоли, остаточная функция печени и общее состояние здоровья пациента.
Если рак диагностируется на поздней стадии, к сожалению, возможности лечения невелики, а выживаемость очень короткая.
В любом случае терапевтические возможности могут быть разными.
- Хирургия: в зависимости от степени опухоли могут быть выполнены частичные или субтотальные резекции печеночной паренхимы. Операция может оказывать заживляющее действие, если опухоль находится на ранних стадиях развития (единичные узелки или маленькие узелки, диаметр которых не превышает 2 см). Только 20% пациентов с раком печени имеют право на операцию. В крайних случаях может быть предпринята попытка трансплантации печени, но было обнаружено, что она не особенно эффективна при этом заболевании с довольно скромным увеличением выживаемости.
- Химиотерапия и лучевая терапия: если опухоль имеет значительные размеры или присутствуют отдаленные метастазы и она больше не может быть подвержена удалению. В этом случае применяются схемы химиотерапии и лучевой терапии, которые определяют выживаемость в течение нескольких месяцев. В любом случае, их функция только паллиативная (устранение симптомов и страданий пациента в терминальной стадии заболевания).
- Местное абляционное лечение: это специальные методы, которые пытаются бороться с опухолевой патологией на местном уровне. Эти процедуры также оказывают паллиативный эффект. К абляционному лечению относится:
- хемоэмболизация: методика заключается в инфузии противоопухолевых химиотерапевтических препаратов в печеночную артерию, ветви которой обеспечивают распространение опухолевой массы;
- чрескожная алкоголизация и термическая абляция: эти методы включают разрушение опухоли путем инъекции этанола или нагревания с использованием игл или зондов, введенных через брюшную стенку под ультразвуковым контролем. Этанол обладает способностью избирательно диффундировать в опухолевую массу, вызывая гибель опухолевых клеток. Тепло, производимое зондом, который вибрирует в соответствии с радиочастотами, лазером или микроволнами, вызывает гибель опухолевых клеток и нейтрализацию опухолевой массы.
Новые терапевтические методики:
- SIRT (селективная внутренняя лучевая терапия): эта методика включает внутриартериальное вливание полимерных микросфер, обогащенных иттрием 90, радиоизотопом, который испускает бета-излучение. После вливания микросферы достигают массы опухоли, остаются в ловушке в сосудах и испускают излучение, которое избирательно разрушает опухолевые клетки и спасает другие органы тела.
- Гипертермия: эта методика включает контролируемое повышение температуры органа; опухолевые клетки более чувствительны к повышению температуры, и, следовательно, может разрушить раковые клетки. Может проводиться в комбинации с химиотерапией.
- Необратимый электрофорез: это метод, который использует создание магнитных полей, генерируемых между двумя иглами, которые приводят к нетепловому разрушению клеток, на которые воздействует магнитное поле.
Выживание и прогноз при раке печени
Прогноз очень изменчив.
В случае доброкачественной опухоли печени (такой как аденома) прогноз положительный и будет проводиться только ежегодное наблюдение за заболеванием.
В случае злокачественного рака печени (т.е. гепатоцеллюлярной карциномы) прогноз, как правило, плохой и зависит главным образом от:
- своевременности постановки диагноза;
- стадии опухоли;
- распространении опухоли на локально-региональном или системном уровне;
- гистотипа опухоли (более или менее агрессивные формы той же опухоли);
- сопутствующих заболеваниях у пациента;
- ответа на лечение.
Профилактика рака печени
Избегание факторов риска может помочь предотвратить некоторые виды рака. Следующие факторы риска могут увеличить риск рака печени:
- Гепатит B и C: избегайте заражения от незащищенного полового акта, избегайте употребления наркотиков и проходите вакцинацию от вируса гепатита B (вакцинация на сегодняшний день обязательна и эффективна);
- Предотвращение курения, профилактика диабета и ожирения, вездесущие факторы риска практически при всех раковых и других заболеваниях;
- Избегайте злоупотребления алкоголя.
Если имеется цирроз или хроническое заболевание печени, важно следовать советам врача, проходить методы скрининга, которые могут диагностировать опухоль на ранней стадии.