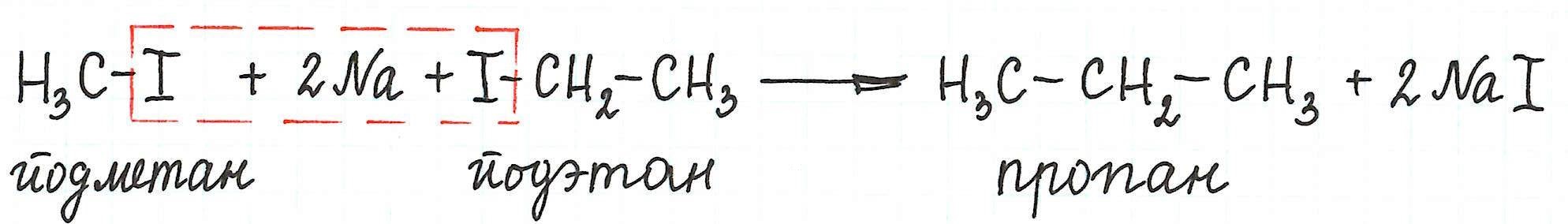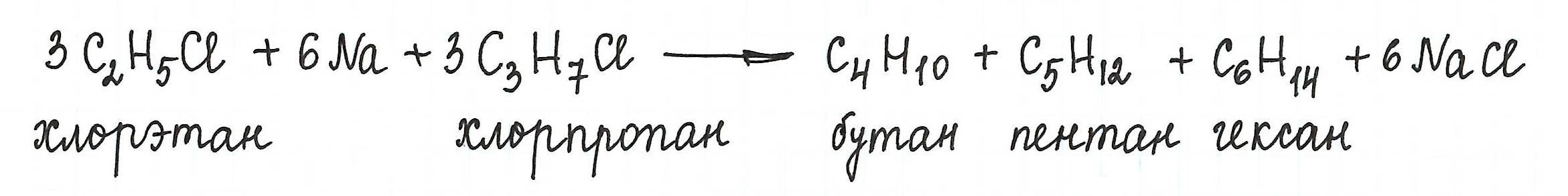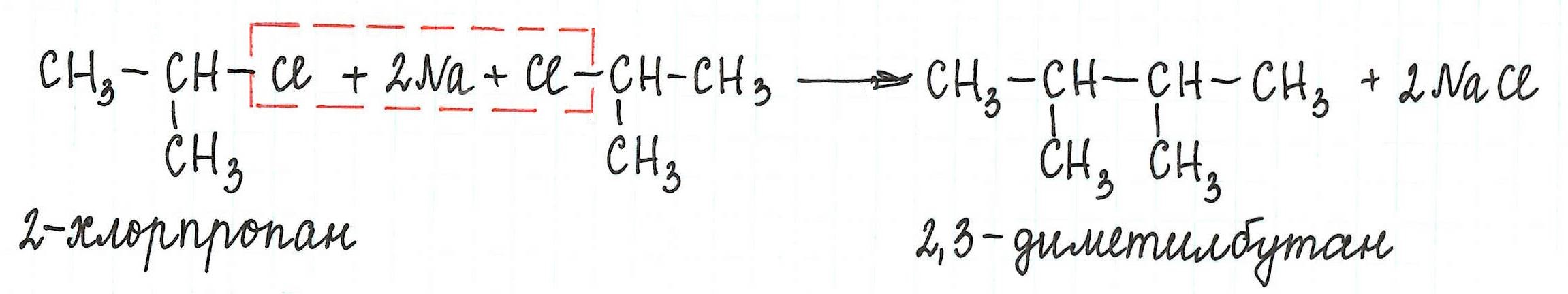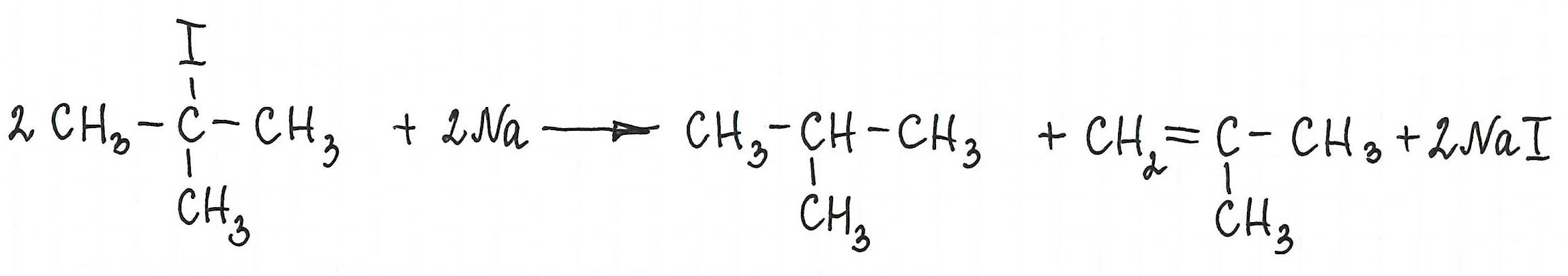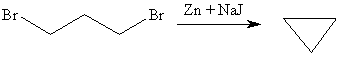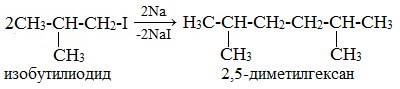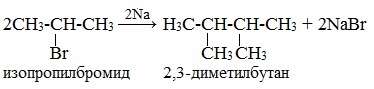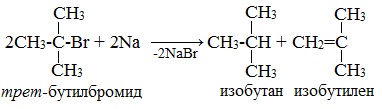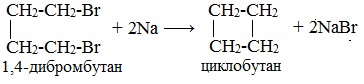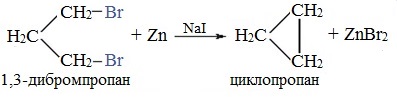From Wikipedia, the free encyclopedia
| Wurtz reaction | |
|---|---|
| Named after | Charles Adolphe Wurtz |
| Reaction type | Coupling reaction |
| Identifiers | |
| Organic Chemistry Portal | wurtz-reaction |
In organic chemistry, the Wurtz reaction, named after Charles Adolphe Wurtz, is a coupling reaction whereby two alkyl halides are treated with sodium metal to form a higher alkane.
- 2 R−X + 2 Na → R−R + 2 NaX
The reaction is of little value except for intramolecular versions. A related reaction, which combines alkyl halides with aryl halides is called the Wurtz–Fittig reaction.[1]
Mechanism[edit]
The reaction proceeds by an initial metal–halogen exchange, which is described with the following idealized stoichiometry:
- R−X + 2 M → RM + MX
This step may involve the intermediacy of radical species R·. The conversion resembles the formation of a Grignard reagent. The RM intermediates have been isolated in several cases. The radical is susceptible to diverse reactions.
The organometallic intermediate (RM) next reacts with the alkyl halide (RX) forming a new carbon–carbon covalent bond.
- RM + RX → R−R + MX
The process resembles an SN2 reaction, but the mechanism is probably complex.
Examples and reaction conditions[edit]
The reaction is intolerant of a range of functional groups which would be attacked by sodium. For similar reasons, the reaction is conducted in unreactive solvents such as ethers. In efforts to improve the reaction yields, other metals have also been tested to effect the Wurtz-like couplings: silver, zinc, iron, activated copper, indium, as well as mixture of manganese and copper chloride.
Wurtz coupling is useful in closing small, especially three-membered, rings. In the cases of 1,3-, 1,4-, 1,5-, and 1,6- dihalides, Wurtz-reaction conditions lead to formation of cyclic products, although yields are variable. Under Wurtz conditions, vicinal dihalides yield alkenes, whereas geminal dihalides convert to alkynes. Bicyclobutane was prepared this way from 1-bromo-3-chlorocyclobutane in 95% yield. The reaction is conducted in refluxing dioxane, at which temperature, the sodium is liquid.[2]
Extensions to main group compounds[edit]
Although the Wurtz reaction is only of limited value in organic synthesis, analogous couplings are useful for coupling main group halides. Hexamethyldisilane arises efficiently by treatment of trimethylsilyl chloride with sodium:
- 2 Me3SiCl + 2 Na → Me3Si−SiMe3 + 2 NaCl
Tetraphenyldiphosphine is prepared analogously:
- 2 Ph2PCl + 2 Na → Ph2P−PPh2 + 2 NaCl
Similar couplings have been applied to many main group halides. When applied to main group dihalides, rings and polymers result. Polysilanes and polystananes are produced in this way[3]
- n Me2SiCl2 + 2n Na → (Me2Si)n + 2n NaCl
See also[edit]
- Wurtz–Fittig reaction
- Ullmann reaction
Further reading[edit]
- Adolphe Wurtz (1855). «Sur une nouvelle classe de radicaux organiques». Annales de chimie et de physique. 44: 275–312.
- Adolphe Wurtz (1855). «Ueber eine neue Klasse organischer Radicale». Annalen der Chemie und Pharmacie. 96 (3): 364–375. doi:10.1002/jlac.18550960310.
- Organic-chemistry.org
- Organic Chemistry, by Morrison and Boyd
- Organic Chemistry, by Graham Solomons and Craig Fryhle, Wiley Publications
References[edit]
- ^ March Advanced Organic Chemistry 4th edition p. 535.
- ^ Gary M. Lampman, C. Aumiller (1971). «Bicyclo[1.1.0]Butane». Organic Syntheses. 51: 55. doi:10.15227/orgsyn.051.0055.
- ^ Caseri, Walter (2016). «Polystannanes: Processible molecular metals with defined chemical structures». Chemical Society Reviews. 45 (19): 5187–5199. doi:10.1039/C6CS00168H. PMID 27072831.
From Wikipedia, the free encyclopedia
| Wurtz reaction | |
|---|---|
| Named after | Charles Adolphe Wurtz |
| Reaction type | Coupling reaction |
| Identifiers | |
| Organic Chemistry Portal | wurtz-reaction |
In organic chemistry, the Wurtz reaction, named after Charles Adolphe Wurtz, is a coupling reaction whereby two alkyl halides are treated with sodium metal to form a higher alkane.
- 2 R−X + 2 Na → R−R + 2 NaX
The reaction is of little value except for intramolecular versions. A related reaction, which combines alkyl halides with aryl halides is called the Wurtz–Fittig reaction.[1]
Mechanism[edit]
The reaction proceeds by an initial metal–halogen exchange, which is described with the following idealized stoichiometry:
- R−X + 2 M → RM + MX
This step may involve the intermediacy of radical species R·. The conversion resembles the formation of a Grignard reagent. The RM intermediates have been isolated in several cases. The radical is susceptible to diverse reactions.
The organometallic intermediate (RM) next reacts with the alkyl halide (RX) forming a new carbon–carbon covalent bond.
- RM + RX → R−R + MX
The process resembles an SN2 reaction, but the mechanism is probably complex.
Examples and reaction conditions[edit]
The reaction is intolerant of a range of functional groups which would be attacked by sodium. For similar reasons, the reaction is conducted in unreactive solvents such as ethers. In efforts to improve the reaction yields, other metals have also been tested to effect the Wurtz-like couplings: silver, zinc, iron, activated copper, indium, as well as mixture of manganese and copper chloride.
Wurtz coupling is useful in closing small, especially three-membered, rings. In the cases of 1,3-, 1,4-, 1,5-, and 1,6- dihalides, Wurtz-reaction conditions lead to formation of cyclic products, although yields are variable. Under Wurtz conditions, vicinal dihalides yield alkenes, whereas geminal dihalides convert to alkynes. Bicyclobutane was prepared this way from 1-bromo-3-chlorocyclobutane in 95% yield. The reaction is conducted in refluxing dioxane, at which temperature, the sodium is liquid.[2]
Extensions to main group compounds[edit]
Although the Wurtz reaction is only of limited value in organic synthesis, analogous couplings are useful for coupling main group halides. Hexamethyldisilane arises efficiently by treatment of trimethylsilyl chloride with sodium:
- 2 Me3SiCl + 2 Na → Me3Si−SiMe3 + 2 NaCl
Tetraphenyldiphosphine is prepared analogously:
- 2 Ph2PCl + 2 Na → Ph2P−PPh2 + 2 NaCl
Similar couplings have been applied to many main group halides. When applied to main group dihalides, rings and polymers result. Polysilanes and polystananes are produced in this way[3]
- n Me2SiCl2 + 2n Na → (Me2Si)n + 2n NaCl
See also[edit]
- Wurtz–Fittig reaction
- Ullmann reaction
Further reading[edit]
- Adolphe Wurtz (1855). «Sur une nouvelle classe de radicaux organiques». Annales de chimie et de physique. 44: 275–312.
- Adolphe Wurtz (1855). «Ueber eine neue Klasse organischer Radicale». Annalen der Chemie und Pharmacie. 96 (3): 364–375. doi:10.1002/jlac.18550960310.
- Organic-chemistry.org
- Organic Chemistry, by Morrison and Boyd
- Organic Chemistry, by Graham Solomons and Craig Fryhle, Wiley Publications
References[edit]
- ^ March Advanced Organic Chemistry 4th edition p. 535.
- ^ Gary M. Lampman, C. Aumiller (1971). «Bicyclo[1.1.0]Butane». Organic Syntheses. 51: 55. doi:10.15227/orgsyn.051.0055.
- ^ Caseri, Walter (2016). «Polystannanes: Processible molecular metals with defined chemical structures». Chemical Society Reviews. 45 (19): 5187–5199. doi:10.1039/C6CS00168H. PMID 27072831.
РЕАКЦИЯ ВЮРЦА
Примеры реакции Вюрца очень популярны в задачах на цепочки превращений веществ.
Вюрц, Шарль Адольф (1817 – 1884), Франция.
Химик-органик, был у истоков создания органического синтеза.
1855г – открыл метод получения предельных углеводородов действием металлического натрия (или калия) на галогеналканы.
Этот метод носит имя ученого. Он известен под названием «реакция Вюрца» (или «синтез Вюрца»).
Подробнее об ученом здесь
Примеры межмолекулярной реакции Вюрца
*Реакцией Вюрца обычно получают алканы с четным числом атомов углерода в цепи. Причем количество углеродных атомов удваивается по сравнению с исходным веществом.
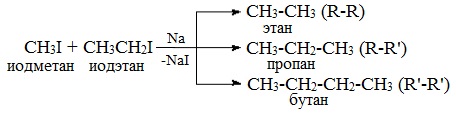
* Однако, при взаимодействии разных галогеналканов можно получить предельный углеводород с нечетным количеством атомов углерода в цепи:
* А вот взаимодействие галогеналканов с более длинной углеродной цепью приводит к образованию смеси алканов:
Отметим, что подобную смесь чрезвычайно трудно разделить на отдельные вещества.
* В результате взаимодействия галогеналканов с галогеном у вторичного атома углерода можно получить предельный углеводород разветвленного строения (однако, такие реакции используют редко):
* Примеры реакции Вюрца, в которой участвуют галогенопроизводные с галогеном у третичного атома углерода, привести не возможно: таковая не существует. В результате их взаимодействия с металлическим натрием (или калием) образуются алкан и алкен с изначальной углеродной структурой:
Примеры внутримолекулярной реакции Вюрца
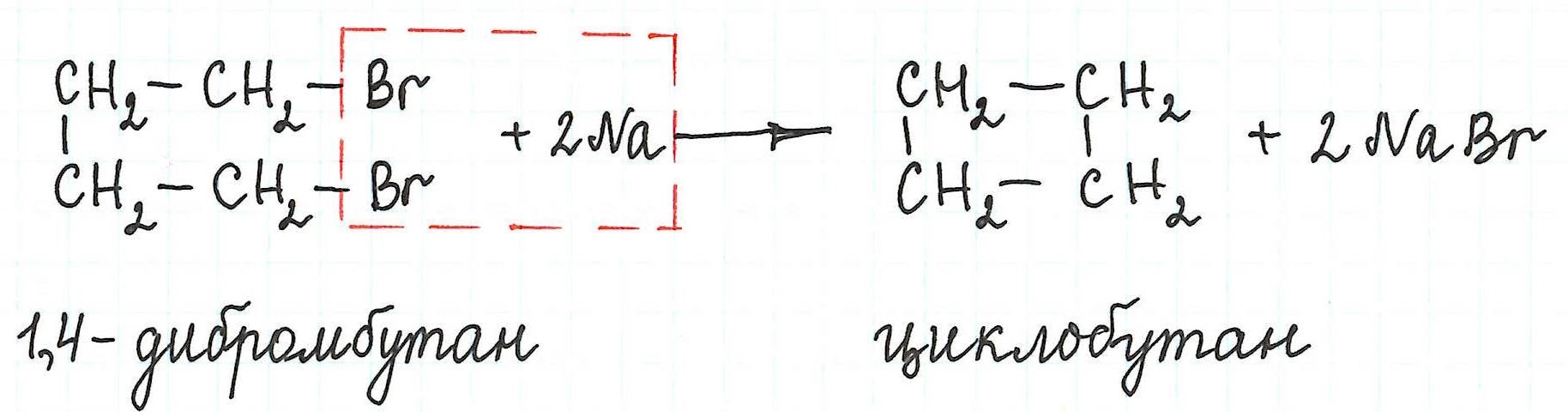
Внутримолекулярная реакция Вюрца приводит к образованию циклоалканов:
Реакция Вюрца обычно проходит при невысоких температурах и в среде эфира (например, диэтилового). Лучше, если в качестве галогеналкана будет вещество, содержащее бром или йод. Галогеналкан, в составе которого присутствует хлор, хуже вступает в подобные взаимодействия.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
РЕАКЦИЯ ВЮРЦА – химическая реакция, позволяющая получать простейшие органические соединения – предельные углеводороды.
Сама реакция Вюрца заключается в конденсации алкилгалогенидов под действием металлического Na, Li или реже K:
2RHal + 2Na ® R–R + 2NaHal.
Иногда ее трактуют как взаимодействие RNa или RLi с R’Hal.
Реакция была открыта французским химиком-органиком Шарлем Вюрцем (Wurtz Charles (1817–1884) в 1855 при попытке получения этилнатрия из хлористого этила и металлического натрия.
Несмотря на то, что реакция Вюрца приводит к образованию новой углерод-углеродной связи, она нечасто применяется в органическом синтезе. В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы, и, как видно из приведенной схемы, для получения заданного углеводорода следует брать только один алкилгалогенид, так как при конденсации двух алкилгалогенидов получается смесь всех трех возможных продуктов сочетания. Поэтому если используется алкилгалогенид и натрий, реакцией Вюрца можно получить только углеводороды с четным количеством атомов углерода. Наиболее успешно реакция Вюрца протекает с первичными алкилйодидами. Очень низкие выходы целевого продукта получают при использовании метода Вюрца для вторичных алкилгалогенидов. Реакцию обычно проводят в диэтиловом эфире. Использование углеводородов в качестве растворителей уменьшает селективность реакции.
Однако если использовать заранее приготовленное металлоорганическое соединение, например алкиллитий, то можно получить и несимметричные продукты конденсации:
RLi + R’Hal ® R – R’ + LiHal
В обоих случаях реакция сопровождается образованием большого количества побочных продуктов за счет побочных процессов. Это иллюстрирует пример взаимодействия этиллития с 2-бромоктаном:
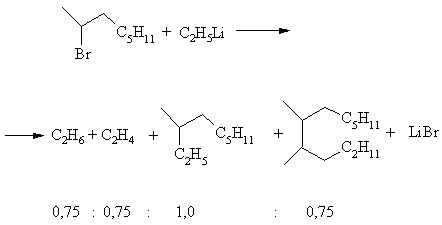
В этом случае 3-метилнонан и ряд побочных продуктов в указанных молярных соотношениях образуются как продукт реакции Вюрца.
Кроме натрия, в реакции Вюрца использовались такие металлы, как серебро, цинк, железо, медь и индий.
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций для построения карбоциклических систем. Так из 1,3-дибромпропана под действием металлического цинка и йодида натрия (в качестве промотора реакции) может быть получен циклопропан:
Можно построить и другие напряженные карбоциклические системы. Например, из 1,3-дибромадамантана, используя натрий-калиевый сплав, может быть получен 1,3-дегидроадамантан:
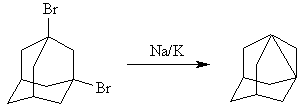
А взаимодействие 1-бром-3-хлор-циклобутана с натрием приводит к бициклобутану:
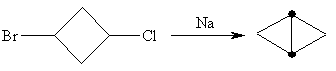
Известен ряд разновидностей реакции Вюрца, получивших свои собственные названия. Это реакция Вюрца – Фиттига и реакция Ульмана. Первая заключается в конденсации алкил- и арилгалогенида под действием натрия с образованием алкилароматического производного. В случае реакции Ульмана в конденсацию обычно вводят арилйодиды, а вместо натрия используют свежеприготовленную медь, эта реакция позволяет с высоким выходом получать различные биарильные производные, в том числе, и несимметричные, содержащие заместитель в одном из ароматических ядер:
Как полагают, механизм реакции Вюрца состоит из двух основных стадий:
1) образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
RHal + 2Na ® R–Na + NaHal,
2) взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
RHal + R–Na ® RR + NaHal.
В зависимости от природы R и условий проведения реакции вторая стадия процесса может протекать по ионному либо по радикальному механизму.
Владимир Корольков
Проверь себя!
Ответь на вопросы викторины «Неизвестные подробности»
Какой музыкальный инструмент не может звучать в закрытом помещении?
Реакция Вюрца, или синтез Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или хлориды). Приводит к увеличению углеводородной цепи (суммированию углеводородных радикалов и объединению в один больший):
2RBr + 2Na → R—R + 2NaBr
Реакция Вюрца открыта Ш. А. Вюрцем в 1855 году[1]. P.Фиттиг распространил реакцию Вюрца на область ароматических углеводородов[2]
Современный подход к реакции Вюрца
Для преодоления множества побочных процессов было предложено использовать более селективные и современные методы. Основные разработки ведутся по применению не-натриевых металлов. Для проведения реакции Вюрца используют серебро[3], цинк, железо[4] и пирофорный свинец[5]. Последний реагент позволяет проводить реакцию в присутствии карбоксильной группы.
Внутримолекулярная реакция Вюрца
В 90-х годах XIX в. Фрейнд и Густавсон предложили внутримолекулярный вариант. Так 1,3-дибромпропан с успехом может быть превращен в циклопропан действием цинка в присутствии иодида натрия, как активатора. По этому пути удалось получить бисспироциклопропан и бициклобутан[6]. Позже было предложено генерировать промежуточные соединения Гриньяра, которые впоследствии при действии трифторацетата серебра ведут к внутримолекулярному кросс-сочетанию. Этот метод неприменим для получения средних циклов.
Ссылки
- ↑ Wurz A. Ueber eine neue Klasse organischer Radicale // Justus Liebigs Annalen der Chemie. 1855. B. 96. H. 3. S. 364—375.[1]
- ↑ Tollens B., Fittig R. Ueber die Synthese der Kohlenwasserstoffe der Benzolreihe // Justus Liebigs Annalen der Chemie. 1864. B. 131. H. 3. S. 303—323.[http://onlinelibrary.wiley.com/doi/10.1002/jlac.1864131
- ↑ Nosek, J. Collect. Czech. Chem. Commun. 1964, 29, 597.
- ↑ Onsager, O. Acta Chem. Scand. , Ser. B. 1978, 32, 15.
- ↑ Azoo, G. J. Chem. Soc., C. 1968, 2403.
- ↑ Wiberg, K. Tetrahedron Lett. 1963, 2173.
Реакция Вюрца — конденсация алкилгалогенидов под действием Na (реже — Li или К) с образованием предельных углеводородов.
Реакция Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (галогеналканы).
Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами.
В результате образуется алкан с более сложной углеродной цепью.
Реакцию обычно проводят в диэтиловом эфире.
В процессе реакции Вюрца происходит удвоение углеводородного скелета молекулы и образуется насыщенный углеводород (алкан). Эта реакция находит ограниченное применение, поскольку таким путем можно получать только симметричные алканы.
В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы (например, гептаконтана C70H142).
Реакцию используют для получения углеводородов с четным числом С-атомов. Если ввести в реакцию два различных галогеналкана, то образуется смесь трех продуктов.
Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан:
Эта реакция была открыта французким химиком Ш. Вюрцем в 1855 г. при попытке получения этилнатрия из хлористого этила и металлического натрия.
В 1864г. немецкий химик Р. Фиттиг предложил реакцию, подобную реакции Вюрца, для синтеза жирноароматических углеводородов (реакция Вюрца-Фиттига).
Реакция Вюрца используется для первичных алкилгалогенидов. Для вторичных алкилгалогенидов не имеет практического значения, т.к выход целевого продукта составляет всего 10-15%.
Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом.
Внутримолекулярная реакция Вюрца
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения.
При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан:
Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан:
ВЮРЦА РЕАКЦИЯ
ВЮРЦА РЕАКЦИЯ, конденсация алкилгалогенидов под действием
Na (реже — Li или К) с образованием предельных углеводородов:
2RHal + 2Na -> R—R + 2NaHal,
где Hal — обычно Br или I. При использовании в р-ции разл. алкилгалогенидов
(RHal и R’Hal) образуется трудноразделяемая смесь всех возможных продуктов
(R—R, R’—R’, R’—R).
Вюрца реакция легко протекает, если алкилгалогенид имеет большую мол. массу,
а галоген связан с первичным атомом С. Процесс проводят при низких т-рах
в сольватирующих р-рителях. Так, в ТГФ р-ция осуществляется быстро и с
хорошим выходом уже при — 80 °С.
Предполагается, что механизм р-ции включает образование ион-радикалов
и радикалов:
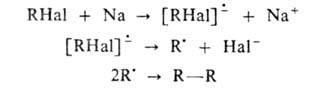
Однако факт обращения конфигурации нек-рых оптически активных алкилгалогенидов
(напр., 2-хлороктана в р-ции с Na) не исключает возможности гетеролитич.
механизма.
Р-ция открыта Ш. Вюрцем в 1855 и используется гл. обр. для получения
углеводородов с длинной углеродной цепью. В др. случаях, особенно при получении
несимметричных ал-канов, применяют разл. модификации Вюрца реакции, рассмотренные
ниже.
Для синтеза жирноароматич. соед. используют модификацию Фиттига (р-цию
Вюрца-Фиттига):
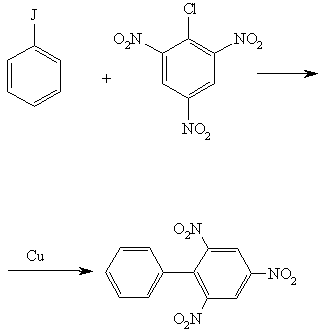
ArHal + RHal + 2Na -> Ar—R + 2NaHal
Р-ция открыта Р. Фиттигом в 1855. Часто с хорошим выходом образуются
алканы с использованием реактива Гриньяра, напр.:
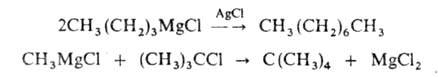
Несимметричные предельные углеводороды получают, используя медьорг.
соед.:
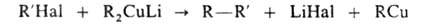
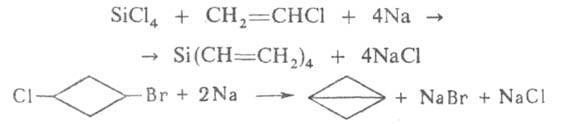
Р-цию, подобную Вюрца реакции, используют для синтеза элементоорг. соед. и бициклич.
соед., напр.:
===
Исп. литература для статьи «ВЮРЦА РЕАКЦИЯ»: Реакции металлоорганических соединений как редокс-проиессы,
М., 1981, с. 16-38. Е.Г. Тер-Габриэлям.
Страница «ВЮРЦА РЕАКЦИЯ» подготовлена по материалам химической энциклопедии.