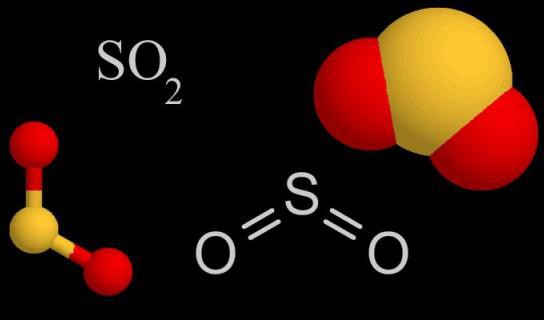
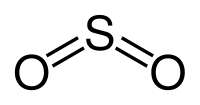
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).
Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).
Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO2 + Н2О ↔ Н2SO3. На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO2. Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.
Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
Лабораторные способы:
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O2 = SO2.
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na2SO3 + 2HCl = 2NaCl + H2SO3;
- Na2SO3 + H2SO4 (разб.) = Na2SO4 + H2SO3;
- H2SO3 = Н2О + SO2↑.
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑.
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О2 = SO2.
- Обжиг железного колчедана (пирита).
Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO2 + 2H2S = 3S + 2H2O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли — сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н2О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.
Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация
сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Оксид серы (сернистый газ, серы диоксид, ангидрид сернистый) — это бесцветный газ, имеющий в в нормальных условиях резкий характерный запах (похож на запах загорающейся спички). Сжижается под давлением при комнатной температуре. Сернистый газ растворим в воде, при этом образуется нестойкая серная кислота. Также это вещество растворяется в серной кислоте и этаноле. Это один из основных компонентов, входящих в состав вулканических газов.
Как получают сернистый газ
Получение SO2 — диоксида серы — промышленным способом заключается в сжигании серы или обжиге сульфидов (используется в основном пирит).
4FeS2 (пирит) + 11O2 = 2Fe2O3 (оксид железа) + 8SO2 (сернистый газ).
В условиях лаборатории сернистый газ можно получить путем воздействия сильных кислот на гидросульфиты и сульфиты. При этом получившаяся сернистая кислота сразу распадается на воду и сернистый газ. Например:
Na2SO3 (сульфит натрия) + H2SO4 (серная кислота) = Na2SO4 (сульфат натрия) + H2SO3 (сернистая кислота). H2SO3 (сернистая кислота) = H2O (вода) + SO2 (сернистый газ).
Третий способ получения сернистого ангидрида заключается в воздействии концентрированной серной кислоты при нагревании на малоактивные металлы. Например: Cu (медь) + 2H2SO4 (серная кислота) = CuSO4 (сульфат меди) + SO2 (диоксид серы) + 2H2O (вода).
Химические свойства диоксида серы
Формула сернистого газа — SO2. Это вещество относится к кислотный оксидам.
1. Диоксид серы растворяется в воде, при этом образуется сернистая кислота. В обычных условиях данная реакция обратима.
SO2 (диоксид серы) + H2O (вода) = H2SO3 (сернистая кислота).
2. С щелочами диоксид серы образует сульфиты. Например: 2NaOH (гидроксид натрия) + SO2 (сернистый газ) = Na2SO3 (сульфит натрия) + H2O (вода).
3. Химическая активность сернистого газа достаточно велика. Наиболее выражены восстановительные свойства сернистого ангидрида. В таких реакциях степень окисления серы повышается. Например: 1) SO2 (диоксид серы) + Br2 (бром) + 2H2O (вода) = H2SO4 (серная кислота) + 2HBr (бромоводород); 2) 2SO2 (диоксид серы) + O2 (кислород) = 2SO3 (сульфит); 3) 5SO2 (диоксид серы) + 2KMnO4 (перманганат калия) + 2H2O (вода) = 2H2SO4 (серная кислота) + 2MnSO4 (сульфат марганца) + K2SO4 (сульфат калия).
Последняя реакция — это пример качественной реакции на SO2 и SO3. Происходит обесцвечивание раствора фиолетового цвета).
4. В условиях присутствия сильных восстановителей сернистый ангидрид может проявлять свойства окислительные. Например, для того чтобы в металлургической промышленности извлечь серу из отходящих газов, используют восстановление диоксида серы оксидом углерода (CO): SO2 (диоксид серы) + 2CO (оксид углерода) = 2CO2 (диоксид углерода) + S (сера).
Также окислительные свойства этого вещества используют в целях получения фосфорноваристой ксилоты: PH3 (фосфин) + SO2 (сернистый газ) = H3PO2 (фосфорноваристая кислота) + S (сера).
Где применяют сернистый газ
В основном диоксид серы используют для получения кислоты серной. Также его применяют как консервант (Е-220) в производстве слабоалкогольных напитков (вино и другие напитки средней ценовой категории). Благодаря свойству этого газа убивать различные микроорганизмы, им окуривают складские помещения и овощехранилища. Помимо этого, оксид серы используют для отбеливания шерсти, шелка, соломы (тех материалов, которые нельзя отбелить хлором). В лабораториях сернистый газ применяют в качестве растворителя и в целях получения различных солей кислоты сернистой.
Физиологическое воздействие
Сернистый газ обладает сильными токсическими свойствами. Симптомы отравления — это кашель, насморк, охриплость голоса, своеобразный привкус во рту, сильное першение в горле. При вдыхании диоксида серы в высоких концентрациях возникает затруднение глотания и удушье, расстройство речи, тошнота и рвота, возможно развитие острого отека легких.
ПДК сернистого газа: — в помещении — 10 мг/м³; — среднесуточная максимально-разовая в атмосферном воздухе — 0,05 мг/м³.
Чувствительность к диоксиду серы у отдельных людей, растений и животных различна. Например, среди деревьев наиболее устойчивы дуб и береза, а наименее — ель и сосна.
- СЕРНИСТЫЙ ГАЗ
-
СЕРНИСТЫЙ ГАЗ (сернистый ангидрид, двуокись серы) (SO2), бесцветный токсичный газ с резким запахом. Применяется в производстве СЕРНОЙ КИСЛОТЫ, а также в качестве хладагента, отбеливателя и консерванта. Свойства: температура плавления -75,5 °С, температура кипения -10,0 °С; плотность 2,2 (плотность воздуха равна 1).
Научно-технический энциклопедический словарь.
Смотреть что такое «СЕРНИСТЫЙ ГАЗ» в других словарях:
-
СЕРНИСТЫЙ ГАЗ — СЕРНИСТЫЙ ГАЗ, сернистый ангидрид, S02, бесцветный газ с резким раздражающим запахом, уд. в. 2,23. Находит применение в промышленности для беления различных продуктов: сукна, шелка, бумажной массы, перьев, соломы, воска, щетины, конского волоса,… … Большая медицинская энциклопедия
-
СЕРНИСТЫЙ ГАЗ — СЕРНИСТЫЙ ГАЗ … Большая политехническая энциклопедия
-
сернистый газ — Газ, содержащий органические сернистые соединения, которые имеют склонность вызывать коррозию металлического оборудования, с которым он контактирует при нормальных условиях переработки. [СТ РК ИСО 1998 1 2004 (ИСО 1998 1:1998, IDT)] Тематики… … Справочник технического переводчика
-
сернистый газ — sieringosios dujos statusas T sritis chemija apibrėžtis Dujos, turinčios metalų koroziją sukeliančių sieros junginių. atitikmenys: angl. sour gas rus. высокосернистый газ; кислый газ; сернистый газ … Chemijos terminų aiškinamasis žodynas
-
сернистый газ — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
-
Сернистый газ — сернистый ангидрид (см.) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
СЕРНИСТЫЙ ГАЗ — сернистый ангидрид, получается при горении серы; удушлив, растворяется в воде. Применяется для обеззараживания незагруженных (во избежание порчи зерна и муки) зернохранилищ и др. помещений от вредных насекомых и грызунов. Расходуется в количестве … Сельскохозяйственный словарь-справочник
-
сернистый газ — сернистый ангидрид, двуокись серы … Cловарь химических синонимов I
-
Сернистый газ — SO2, то же, что Сернистый ангидрид … Большая советская энциклопедия
-
СЕРНИСТЫЙ ГАЗ — см. Серы диоксид … Большой энциклопедический политехнический словарь

- СЕРНИСТЫЙ ГАЗ
-
= сернистый ангидрид (см.).
Брокгауз и Ефрон.
Энциклопедия Брокгауза и Ефрона.
2012
СЕРНИСТЫЙ ГАЗ
- СЕРНИСТЫЙ ГАЗ
- СЕРНИСТЫЙ ГАЗ, сернистый ангидрид, S02,~ бесцветный газ с резким раздражающим запахом, уд. в. 2,23. Находит применение в промышленности для беления различных продуктов: сукна, шелка, бумажной массы, перьев, соломы, воска, щетины, конского волоса, пищевых продуктов, для дезинфекции фруктов и консервов и т. д. В качестве побочного продукта С. г. образуется и выделяется в воздух рабочих помещений в ряде производств: серной к-ты, целлюлезы, при обжиге руд, содержащих, сернистые металлы, в травилках на металлозаводах, при производстве стекла, ультрамарина и др., весьма часто С. г. содержится в воздухе котельных и зольных помещений, где он образуется при сжигании содержащих серу углей. Данных относительно содержания S02 в воздухе рабочих помещений собрано довольно» много; количества его колеблются в широких пределах—от 0,01 до 0,3 мг на 1 л воздуха. В котельных Московской области обнаружены количества от 0,001 до 0,04 мг, в кузницах— от 0,014 до 0,05—0,1 мг; при холодной вулканизации найдены гораздо большие количества— 0,4—0,5 мг. Отравления С. г. в производственных условиях обычно носят характер легких, тяжелые отравления встречаются редко._ В СССР за годы 1924—29 зарегистрировано* 82© 472 случая как с потерей,, так и без потери трудоспособности, при этом следует учесть то обстоятельство, что в 1924/25 г. произошло совершенно случайное, не связанное с производством отравление 296 человек; в остальные годы число случаев составляло 35, 50, 75, 9. Основные причины отравлений—несчастные •случаи или плохое состояние аппаратуры. Сущность действия С. г. сводится к действию серной к-ты, т. к. SO2 при соприкосновении с влажными тканями превращается в сернистую, а, затем в серную к-ту. Благодаря своей сильной растворимости в воде S02 улавливается и следовательно оказывает основное действие на верхние дыхательные пути. Экспериментальные исследования, проведенные в Украинском ин-те патологии и гигиены труда, показали, что при остром отравлении у животных получаются резкие изменения по всему дыхательному тракту, причем особенно резко они выражены в трахее и бронхах. При хрон. отравлении (0,5 мг[л) развивается небольшой катаральный бронхит и бронхиолит. У людей непривычных концентрации С. г. 0,06 мгл воздуха настолько раздражают дыхательные пути», что пребывание в течение больше х/г—1 часа становится невозможным. У работающих постоянно в атмосфере С. г. наступает привыкание и они переносят в течение многих часов концентрации 0,1—0,2 мг на 1 л воздуха. В качестве предельно допустимой концентрации S02 в воздухе рабочих помещений НКТ СССР установил 0,02 мг/л, в исключительных случаях при кратковременном пребывании в атмосфере С. г.—0,04 мг/л. Симптомы воздействия С. г. выражаются в чихании, кашле, спазме голосовой щели, что вынуждает рабочих оставлять помещение, и этим предупреждается общее действие газов, ограничивающееся гл. обр. верхними дыхательными путями. В редких тяжелых случаях может развиться воспаление бронхов и даже -отек легких. Аналогично S02 действуют пары дымящей серной кислоты, к-рые наряду с S02 •содержат серный ангидрид S03. При вдыхании этих паров в значительной концентрации могут развиться явления более резкие, чем вышеописанные, а именно—глубокие бронхиты, отеки гортани, бронхопневмонии, в очень тяжелых •случаях отек легких. Легочные осложнения обычно развиваются не сразу, а спустя 1—2 дня после вдыхания паров. Длительное вдыхание паров дымящейся серной к-ты может вести к развитию хрон. бронхитов и конъюнктивитов.—В деле профилактики отравлений С. г. основное значение имеют полная герметизация аппаратуры и наблюдение за исправным ее состоянием; при невозможности предупредить выделение С. г. в воздух необходимы вытяжные установки непосредственно над местом выделения газов (напр. травилки) или устройство общей вентиляции, дающей возможность довести концентрацию газа в воздухе до установленных величин. Большое значение имеет рационализация производственного процесса: в травилках напр. прибавление к раствору серной к-ты и т. н. присадков (различных веществ, ускоряющих производственный процесс и одновременно уменьшающих выделение в воздух капелек и паров травильных жидкостей) резко уменьшает выделение в воздух S02. Процессы беления, часто проводимые до сих пор примитивным путем «(окуриванием), должны быть рационализиро- ваны.—Л е ч е н и е при острых отравлениях, как при отравлении другими раздражающими газами,—немедленное удаление из отравленной атмосферы, вдыхание кислорода, возбуждающие Средства И Т. Д. н. Розенбаум. Открытие в судебных случаях и определение при проф. отравления х. При исследовании внутренностей, копченого мяса, консервов и т. д. их помещают в колбу, заткнутую пробкой с двумя трубками. Одна из них соединена с аппаратом Киппа для выделения угольного ангидрида, другая с приемниками для поглощения сернистого ангидрида. Последние содержат раствор иода в присутствии йодистого калия. По вытеснении сернистого ангидрида угольным ангидридом жидкость из приемников кипятят до удаления иода, и в растворе открывают и количественно определяют серную к-ту. При другой вариации способа сернистый ангидрид вытесняют в раствор хлорноватокалиевой соли (бертолетовой соли) и определяют количество иона, получающегося восстановлением ионахлорноватой к-ты. Для открытия и количественного определения сернистого ангидрида в воздухе определенный объем последнего протягивается через поглотители (см. Яды, изолирование) раствором бертолетовой соли и определяется количество иона хлора титрованием азотнокислым серебром или нефелометрически, переведением в хлористое серебро. Лит.: Труды Украинского ин-та патологии и гигиены труда, вып. 6, Харьков, 19 28 (статьи И. Милынтейна, Кленевского и Пейсаховича). СЕРНОВОДСК—Самарский (в отличие от С. Кавказского), иначе Сергиевские Минеральные воды, серно-грязевой курорт в Бугурусланском районе Средневолжского края, в V/% %м от ст. Серные Воды Самаро-Златоуст. ж. д., на ветке Самара—Кротовка—Сургут. Курорт расположен на склоне большого горного плато (из отрогов Уральского хребта), у линии перехода его в долину живописной речки Сургут. Климат курорта умеренно-континентальный. Средняя t° воздуха в мае +15,1°, в июне + 21, 2°, в июле + + 19,5°, в августе + 17,5°, в сентябре + 14°. В эти месяцы преобладают теплые юго-восточные ветры. Хорошая инсоляция, сухость воздуха, незначительная относительная влажность создают весьма благоприятные условия для бальнеотерапии. Основные богатства курорта заключаются в 4 серных источниках, вытекающих из массива плато (известняк, гипс, доломиты) и образующих искусственное серное («фисташковое») озеро.. Лечебногрязевое хозяйство невелико. Общий дебит серных источников составляет ок. 56 тыс. гл в сутки. Источники холодные. По своему хим. составу они принадлежат к сероводородно-сульфидно-землистым водам. По содержанию свободного сероводорода Сергиевские Минводы (0,080 г свободного H2S на 1 л) относятся к типу Мацестинских. Грязь серного озера и отводящих рукавов представляет собой пластичную илистую массу черного цвета с довольно резким запахом H2S. Есть ванное здание (60 ванн) для горных ванн и грязелечебница. Следует отметить слабое пока еще техническое оборудование курорта. С 1932 года открыто новое здание поликлиники и рентген, кабинет. Больные размещаются в санаториях, пансионатах и общежитиях. Сан. состояние курорта и сан .-горная охрана оставляют желать лучшего. Показания: б-ни органов движения, страдания периферической нерв- ной системы, гинекологические и андрологи- i ческие воспалительные заболевания с характером выпотов и инфильтратов, флебиты и тромбофлебиты, хрон. интоксикации свинцом и ртутью, гуммозный сифилис и невролюес, различные формы экземы, чешуйчатый лишай, себорея и пр. Налаживается лечение б-ней обмена—подагры и ожирения, а с 1932 г. курорт ставит себе задачей использование серных ванн для лечения сердечно-сосудистых заболеваний по типу Мацесты. С 1930 г. курорт открыт круглый год, но в полностью развернутом виде он функционирует обычно с 1/VІ по 15/IХ. Лит.: Лившиц Т.,К вопросу об изменении морфологии крови под влиянием серно-грязевых процедур, Учен, записки Казанск. гос. ун-та, т. LХХХVІI, кн. 1, 19.27; о н ж е, О реакции сердечно-сосудистой системы на серно-грязевые процедуры, ibid., т. LХХХVІ, кн. 1, 1926; Николаев П., Как меняется решим сердечнососудистой системы под влиянием серно-грязевых баль-нео-процедур, Врач, дело, 1925, № 10—И; Шулпй-нов С, К вопросу о содержании свободного H2S в воде курорта Серноводска Самарской губ., Кур. дело, 1928, №6. П. Николаев.
Большая медицинская энциклопедия.
1970.
Полезное
Смотреть что такое «СЕРНИСТЫЙ ГАЗ» в других словарях:
-
СЕРНИСТЫЙ ГАЗ — (сернистый ангидрид, двуокись серы) (SO2), бесцветный токсичный газ с резким запахом. Применяется в производстве СЕРНОЙ КИСЛОТЫ, а также в качестве хладагента, отбеливателя и консерванта. Свойства: температура плавления 75,5 °С, температура… … Научно-технический энциклопедический словарь
-
СЕРНИСТЫЙ ГАЗ — СЕРНИСТЫЙ ГАЗ … Большая политехническая энциклопедия
-
сернистый газ — Газ, содержащий органические сернистые соединения, которые имеют склонность вызывать коррозию металлического оборудования, с которым он контактирует при нормальных условиях переработки. [СТ РК ИСО 1998 1 2004 (ИСО 1998 1:1998, IDT)] Тематики… … Справочник технического переводчика
-
сернистый газ — sieringosios dujos statusas T sritis chemija apibrėžtis Dujos, turinčios metalų koroziją sukeliančių sieros junginių. atitikmenys: angl. sour gas rus. высокосернистый газ; кислый газ; сернистый газ … Chemijos terminų aiškinamasis žodynas
-
сернистый газ — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
-
Сернистый газ — сернистый ангидрид (см.) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
СЕРНИСТЫЙ ГАЗ — сернистый ангидрид, получается при горении серы; удушлив, растворяется в воде. Применяется для обеззараживания незагруженных (во избежание порчи зерна и муки) зернохранилищ и др. помещений от вредных насекомых и грызунов. Расходуется в количестве … Сельскохозяйственный словарь-справочник
-
сернистый газ — сернистый ангидрид, двуокись серы … Cловарь химических синонимов I
-
Сернистый газ — SO2, то же, что Сернистый ангидрид … Большая советская энциклопедия
-
СЕРНИСТЫЙ ГАЗ — см. Серы диоксид … Большой энциклопедический политехнический словарь
Сероводород
Получение
сероводорода
- Получение из простых веществ:
S + Н2 = H2S
- Взаимодействие минеральных кислот и сульфидов металлов, расположенных в ряду напряжений левее железа:
FeS + 2HCI = H2S↑ + FeCl2
- Действие концентрированной H2SO4 (без избытка) на щелочные и щелочно-земельные металлы:
5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- Гидролиз некоторых сульфидов:
AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
- Нагревание парафина с серой:
C40H82
+ 41S = 41Н2S+40С
Видео Получение и обнаружение сероводорода
Физические
свойства и строение сероводорода
Сероводород H2S – это бинарное летучее водородное соединение соединение с серой. H2S
— бесцветный ядовитый газ, с неприятным удушливым
запахом тухлых яиц. При концентрации > 3 г/м3 вызывает смертельное отравление.
Сероводород тяжелее воздуха и легко конденсируется в бесцветную жидкость. Растворимость в воде H2S при обычной температуре составляет 2,5.
В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода представляет собой сцепленные между собой атомы H-S-H с валентным углом 92,1о.
Качественная реакция для обнаружения сероводорода
Для
обнаружения анионов S2- и сероводорода используют
реакцию газообразного H2S с Pb(NO3)2:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный
осадок.
Влажная бумага, смоченная в растворе Pb(NO3)2 чернеет в присутствии H2S из-за получения черного осадка PbS.
Химические свойства серы
H2S является сильным восстановителем
При взаимодействии H2S с окислителями образуются различные вещества — S, SО2, H2SO4
- Окисление кислородом воздуха:
2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
H2S + Br2 = S↓ + 2НВr
H2S + Cl2 → 2HCl + S↓
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
- Взаимодействие с кислотами-окислителями:
3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
- Взаимодействие со сложными окислителями:
5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
2H2S + SO2 = 2H2O + 3S
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
- Сероводородная кислота H2S двухосновная кислота и диссоциирует по двум ступеням:
1-я ступень:
H2S → Н+ + HS—
2-я ступень:
HS— → Н+ + S2-
H2S очень слабая
кислота, несмотря на это имеет характерные для кислот химические свойства. Взаимодействует:
- с активными металлами
H2S + Mg = Н2↑ + MgS
- с малоактивными металлами (Аg, Си, Нg) при совместном присутствии окислителей:
2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- с основными оксидами:
H2S + ВаО = BaS + Н2O
- со щелочами:
H2S + NaOH(недостаток) = NaHS + Н2O
H2S + 2NaOH(избыток) → Na2S + 2H2O
- с аммиаком:
H2S + 2NH3(избыток) = (NH4)2S
- с некоторыми солями сильных кислот, если образующийся сульфид металла нерастворим в воде и в сильных кислотах:
CuSO4 + H2S = CuS↓ + H2SO4
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Реакция
с нитратом свинца в растворе – это качественная реакция
на сероводород и сульфид-ионы.
Видео Взаимодействие сероводорода с нитратом свинца
Сульфиды
Получение сульфидов
- Непосредственно из простых веществ:
S + Fe → FeS
S + Mg → MgS
S + Ca → CaS
- Взаимодействие H2S с растворами щелочей:
H2S + 2NaOH = 2H2O + Na2S
H2S + NaOH = H2O + NaHS
- Взаимодействие H2S или (NH4)2S с растворами солей:
H2S + CuSO4 = CuS↓ + H2SO4
H2S + 2AgNO3 = Ag2S↓ + 2HNO3
Pb(NO3)2 + Н2S → PbS↓ + 2НNO3
ZnSO4 + Na2S → ZnS↓ + Na2SO4
- Восстановление сульфатов при прокаливании с углем:
Na2SO4 + 4С = Na2S + 4СО
Физические свойства сульфидов
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости
в воде и кислотах сульфиды классифицируют
на:
- растворимые в воде — сульфиды щелочных металлов и аммония;
- нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
- нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
- гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
По цвету сульфиды можно разделить на:
- Чёрные – HgS, Ag2S, PbS, CuS, FeS,
NiS; - Коричневые – SnS, Bi2S3;
- Оранжевые – Sb2S3, Sb2S5;
- Жёлтые – As2S3, As2S5,
SnS2, CdS; - Розовые — MnS
- Белые – ZnS, Al2S3, BaS,
CaS;
Химические свойства сульфидов
Обратимый гидролиз сульфидов
- Хорошо растворимыми в воде являются сульфиды щелочных металлов и аммония, но в водных растворах они в значительной степени подвергаются гидролизу. Реакция среды — сильнощелочная:
K2S + H2O ⇄ KHS + KOH
S2- + H2O → HS— + ОН—
- Сульфиды щелочно-земельных металлов и Mg, при взаимодействии с водой подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
2CaS + 2НОН
= Ca(HS)2 + Са(ОН)2
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
HS— + H2O → H2S↑ + ОН—
Необратимый
гидролиз сульфидов
- Сульфиды некоторых металлов (Cr2S3, Fe2S3, Al2S3) подвергаются необратимому гидролизу, полностью разлагаясь в водных растворах:
Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
Нерастворимые
сульфиды гидролизу не подвергаются
NiS + HСl ≠
- Некоторые из сульфидов растворяются в сильных кислотах:
FeS + 2HCI =
FeCl2 + H2S↑
ZnS + 2HCI =
ZnCl2 + H2S↑
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
MnS + 3HNO3 = MnSO4 + 8NO2 + 4H2O
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
- Сульфиды обладают восстановительными свойствами и вступают в реакции с окислителями:
PbS + 4H2O2 → PbSO4 + 4H2O
СuS + Cl2 → CuCl2 + S
-
Окислительный обжиг сульфидов является
важной стадией переработки сульфидного сырья в различных производствах
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2CuS + 3O2 → 2CuO + 2SO2
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
Взаимодействия
сульфидов с растворимыми солями свинца, серебра, меди являются качественными на ион S2−:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
Оксид серы
(IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Способы получения сернистого газа
- Окисление серы, сероводорода и сульфидов кислородом воздуха:
S + O2 → SO2
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
- Действие высокой температуры на сульфиты (термическое разложение):
CaSO3 = СаО + SO2↑
- Действие сильных кислот на сульфиты:
Na2SO3 + 2HCl = SO2 + Н2O + 2NaCI
- Взаимодействие концентрированной H2SO4 с восстановителями, например с неактивными металлами:
2H2SO4 + Сu = SO2↑ + CuSO4 + 2Н2O
Физические
свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
Химические свойства сернистого газа
SO2 – типичный кислотный оксид. За счет того, что сера находится в промежуточной степени окисления (+4) SO2 может проявлять свойства как окислителя так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
SO2 + H2O ↔ H2SO3
- Как
кислотный оксид, SO2 вступает
в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
SO2 + СаО = CaSO3
SO2 + Na2O → Na2SO3
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Н2O + Na2SO3
- При взаимодействии с окислителями SO2 проявляет восстановительные свойства. При этом степень окисления серы повышается:
2SO2 + O2 ↔ 2SO3
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
SO2 + 2HNO3 → H2SO4 + 2NO2
SO2 + O3 → SO3 + O2
SO2 + PbO2 → PbSO4
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Обесцвечивание раствора перманганата калия KMnO4 является качественной реакцией для обнаружения сернистого газа и сульфит-иона
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
SO2 + 2Н2S → 3S↓ + 2H2O
SO2 + 2CO → S↓ +2СО2
SO2 + С → S↓ + СO2
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Способы получения серного ангидрида
- SO3 можно получить из SO2 путем каталитического окисления последнего кислородом:
2SO2 + O2 ↔ 2SO3
- Окислением SO2 другими окислителями:
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
- Разложением сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Физические
свойства серного ангидрида
При обычных условиях SO3 представляет собой бесцветную жидкость с характерным резким
запахом. На воздухе SO3 «дымит» и сильно
поглощает влагу.
SO3 – тяжелее
воздуха, хорошо растворим в воде.
SO3 ядовит!
Химические свойства серного
ангидрида
Оксид серы (VI) – это кислотный оксид.
- Хорошо поглощает влагу и реагирует с водой образуя серную кислоту:
SO3 + H2O → H2SO4
- Как
кислотный оксид, SO3 взаимодействует с щелочами и
основными оксидами, образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
SO3 + MgO → MgSO4 (при сплавлении):
SO3 + ZnO = ZnSO4
-
SO3 проявляет
сильные окислительные свойства, так
как сера в находится в максимальной степени окисления (+6).
Вступает в реакции с восстановителями:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
- При растворении в концентрированной
серной кислоте образует олеум (раствор
SO3 в H2SO4).
Сернистая кислота (H2SO3)
Способы
получения сернистой кислоты
При растворении в воде SO2 образует слабую сернистую кислоту, которая сразу частично разлагается:
SO2 + H2O ↔ H2SO3
Физические
свойства сернистой кислоты
Сернистая кислота H2SO3 – двухосновная кислородсодержащая кислота. При обычных условиях неустойчива.
Валентность серы
в сернистой кислоте равна IV, а степень окисления
+4.
Химические свойства сернистой кислоты
Общие свойства
кислот
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
H2SO3 ↔ HSO3— + H+
- средние – сульфиты
HSO3—↔ SO32- + H+
- Сернистая кислота самопроизвольно распадается на SO2 и H2O:
H2SO3 ↔ SO2 + H2O
Соли сернистой кислоты, сульфиты и гидросульфиты
Способы
получения сульфитов
Соли сернистой кислоты получаются при взаимодействии SO2 с щелочами и оксидами щелочных и щелочноземельных металлов:
SO2 + СаО = CaSO3
SO2 + Na2O → Na2SO3
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Н2O + Na2SO3
Физические
свойства сульфитов
Сульфиты
щелочных металлов и аммония растворимы в воде, сульфиты остальных металлов — нерастворимы
или не существуют.
Гидросульфиты
металлов хорошо растворимы в Н2O, а некоторые из
них, такие как Ca(HSO3)2 существуют
только в растворе.
Химические свойства сульфитов
Cернистая кислота – двухосновная, образует нормальные (средние) соли — сульфиты Mex(SO3)y и кислые соли — гидросульфиты Me(HSO3)x.
- Водные растворы сульфитов подвергаются гидролизу. Реакция среды – щелочная (окрашивают лакмус в синий цвет):
SO3— + Н2O = HSO3— + ОН—
Na2SO3 + Н2O = NaHSO3 + NaOH
Реакции, протекающие без изменения степени окисления:
- Реакция с сильными кислотами:
Na2SO3 + 2HCl = 2NaCl +
SO2↑ + Н2O
NaHSO3 + HCl = NaCl + SO2↑ + Н2O
- Термическое разложение сульфитов:
CaSO3 = СаО + SO2↑
- Нормальные сульфиты в водных растворах, при избытке SO2, переходят в гидросульфиты:
CaSO3 + SO2 + Н2O = Ca(HSO3)2
- Ионно-обменные реакции с другими солями, протекающие с образованием нерастворимых сульфитов:
Na2SO3 + ZnCl2 = ZnSO3↓ + 2NaCl
Окислительно-восстановительные реакции
Сульфиты, также как и SO2, могут быть как восстановителями, так и окислителями, т.к. атомы серы в анионах находятся в промежуточной степени окисления +4
- Окисление водных растворов сульфитов, и гидросульфитов до сульфатов:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Na2SO3 + HNO3 = 2NaNO3 + SO2 + H2O
- Твердые сульфиты при хранении на воздухе также медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
- При нагревании сухих сульфитов с активными восстановителями (С, Mg, Al, Zn) сульфиты превращаются в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
- При нагревании сухих сульфитов до высоких температур сульфиты диспропорционируют, превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
Серная кислота (H2SO4)
Способы
получения серной кислоты
В промышленности серную кислоту производят из серы, сульфидов
металлов, сероводорода и др.
Наиболее часто серную кислоту получают из пирита FeS2.
Основные стадии получения серной кислоты включают:
1.Обжиг пирита в кислороде в печи для обжига с получением сернистого газа:
4FeS2 +
11O2 → 2Fe2O3 +
8SO2 + Q
2. Очистка полученного сернистого газа от примесей в циклоне, электрофильтре.
3. Осушка сернистого газа в сушильной башне
4. Нагрев очищенного газа в теплообменнике.
5. Окисление сернистого газа в серный ангидрид в контактном аппарате:
2SO2 + O2 ↔ 2SO3 + Q
6. Поглощение серного ангидрида серной кислотой в поглотительной башне – получение олеума.
Физические
свойства, строение серной кислоты
При обычных условиях серная кислота – тяжелая бесцветная маслянистая жидкость, хорошо растворимая в воде. Максимальная плотность равна 1,84 г/мл
При растворении серной кислоты в воде выделяется большое количество теплоты. Поэтому, по правилам безопасности в лаборатории при приготовлении разбавленного раствора серной кислоты во избежание разбрызгивания необходимо наливать серную кислоту в воду тонкой струйкой по стеклянной палочке при постоянном перемешивании. Но не наоборот!
Валентность серы в серной кислоте равна VI.
Качественные
реакции для обнаружения серной кислоты и сульфат ионов
Для обнаружения сульфат-ионов используют реакцию с растворимыми солями бария. В результате взаимодействия, образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видео Взаимодействие хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион).
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота, образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
- Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени и достаточно по второй ступени:
H2SO4 ⇄ H+ + HSO4–
HSO4– ⇄ H+ + SO42–
Характерны все свойства кислот:
- Реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами и аммиаком:
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
H2SO4 + NH3 → NH4HSO4
- Вытесняет более слабые кислоты из их солей в растворе (карбонаты, сульфиды и др.) и летучие кислоты из их солей (кроме солей HBr и HI):
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
- Концентрированная серная кислота реагирует с твердыми солями, например нитратом натрия, хлорида натрия.
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
- Вступает в обменные реакции с солями:
H2SO4 + BaCl2 → BaSO4 + 2HCl
- Взаимодействует с металлами:
Разбавленная серная кислота взаимодействует с металлами, расположенными в ряду напряжения металлов до водорода. В результате реакции образуются соль и водород:
H2SO4(разб.) + Fe → FeSO4 + H2
H2SO4 + Zn = ZnSO4
+ H2
Концентрированная серная кислота — сильный окислитель. Реакция с металлами протекает без вытеснения водорода из кислоты. В зависимости от активности металла образуются различные продукты реакции:
- Активные металлы и цинк при обычной температуре с концентрированной серной кислотой образуют соль, сероводород (или серу) и воду:
H2SO4 + Na = Na2SO4 + Н2S↑ + H2O
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
- Металлы средней активности с концентрированной H2SO4 образуют соль, серу и воду:
4H2SO4 + 3Mg → 3MgSO4 + S + 4H2O
-
Такие металлы, как железо Fe,
алюминий Al, хром Cr пассивируются концентрированной
серной кислотой на холоде. При нагревании,
при удалении оксидной пленки реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2 (SO4)3 + Н2S↑ + 6H2O
- Неактивные металлы восстанавливают концентрированную серную кислоту до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
- В реакциях с неметаллами концентрированная серная кислота также проявляет окислительные свойства:
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O (комнатная температура)
H2SO4(конц.) + H2S = S↓ + SО2↑ + 2Н2О (при нагревании)
H2SO4(конц.) + 2HBr = Br2 + SO2 + 2H2O
- Концентрированная серная кислота широко используется в химических процессах как водоотнимающий агент, т.к. проявляет сильное водоотнимающее действие. В органической химии ее используют при получении спиртов, простых и сложных эфиров, альдегидов и т.д.
Соли серной кислоты, сульфаты, гидросульфаты
Способы
получения солей серной кислоты
Сульфаты можно получить при взаимодействии серной кислоты с металлами,
оксидами, гидроксидами (см. Химические свойства серной кислоты). А также при
взаимодействии с другими солями, если продуктом реакции является нерастворимое
соединение.
Физические
свойства солей серной кислоты
Кристаллы разного цвета. Многие средние и кислые сульфаты растворимы
в воде. Плохо растворяются или не растворяются в воде сульфаты многозарядных
щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких
щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца.
Средние сульфаты щелочных металлов термически устойчивы. Кислые
сульфаты щелочных металлов при нагревании разлагаются.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова
соль
CaSO4 ∙ 2H2O − гипс
2CaSO4 xH2O –
алебастр
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O −
кристаллическая сода
KАl(SO4)2 x 12H2O
– алюмокалиевые квасцы.
Химические свойства солей серной кислоты
Разложение сульфатов на различные классы соединений в зависимости от металла, входящего в состав соли.
- Сульфаты щелочных металлов плавятся без разложения.
- Кислые сульфаты щелочных металлов разлагаются с отщеплением воды:
2KHSO4 → K2S2O7
+ H2O↑.
- Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4
= ZnO + SO3
FeSO4
= 2Fe2O3 + 4SO2 + O2
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
- Сульфаты тяжёлых или малоактивных металлов разлагаются с образованием металла и кислорода:
HgSO4 = Hg + SO2 + O2
- Некоторые сульфаты проявляют окислительные свойства и вступают в реакции с простыми веществами:
CaSO4 +
C = CaO + SO2 + CO
BaSO4 +
4C = BaS + 4CO
Сернистый газ, или оксид серы((IV)), образуется при сгорании серы, сероводорода или обжиге сульфидов:
При обычных условиях это бесцветный газ с характерным запахом. Ядовит.
Сернистый газ хорошо растворяется в воде — в (1) объёме воды при (0) °С может раствориться до (80) объёмов сернистого газа, а при комнатной температуре — до (40) объёмов. При этом происходит реакция с водой, и образуется сернистая кислота:
Оксид серы((IV)) проявляет и другие свойства кислотных оксидов: реагирует со щелочами, основными оксидами c образованием солей:
Степень окисления серы в оксиде — (+4). Это промежуточное значение, поэтому в окислительно-восстановительных реакциях он может быть и окислителем, и восстановителем. Так, свойства восстановителя проявляются в реакции с кислородом:
Свойства окислителя сернистый газ проявляет в реакции с сероводородом:
Оксид серы((IV)) выделяется в атмосферу при сжигании разных видов топлива и загрязняет её.
Рис. (1). Загрязнение воздуха
Сернистая кислота и её соли
Сернистая кислота
H2SO3
представляет собой водный раствор оксида серы((IV)) и в свободном состоянии не выделена. Это слабая двухосновная кислота, которая образует два ряда солей. Средние её соли называются сульфитами (
Na2SO3,CaSO3
), а кислые — гидросульфитами (
NaHSO3,Ca(HSO3)2
).
Сернистая кислота и её соли, так же как и оксид серы((IV)), в окислительно-восстановительных реакциях проявляют двойственные свойства — могут быть и окислителями, и восстановителями.
Сернистый газ уничтожает микроорганизмы, поэтому применяется для дезинфекции помещений, оборудования. Используется он как отбеливающее средство в производстве бумаги, тканей. Для отбеливания используются и соли: сульфит и гидросульфит натрия.
Источники:
Рис. 1. Загрязнение воздуха
https://cdn.pixabay.com/photo/2020/03/07/21/59/power-station-4911010_960_720.jpg
Серни́стый газ (окси́д се́ры (IV), диокси́д се́ры, двуокись серы, серни́стый ангидри́д) — соединение серы с кислородом состава SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (загорающейся спички). Растворяется в воде с образованием нестойкой сернистой кислоты. Растворяется также в этаноле и се́рной кислоте. Под давлением сжижается уже при комнатной температуре.
-
У этого термина существуют и другие значения, см. Оксид серы.
Сернистый газ — один из главных компонентов вулканических газов. В высоких концентрациях имеет раздражающее действие, токсичен, вызывает насморк, кашель, охриплость, сильное першение в горле и характерный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
Тем не менее, сернистый газ широко используется в пищевой промышленности в качестве консерванта Е220. Он убивает микроорганизмы, поэтому им окуривают овощехранилища и склады, а также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Сернистый газ в афоризмах и кратких цитатахПравить
|
|
Ни удушливые газы, ни сернистый дым, ни зола, взвеваемая ветром, не могли остановить меня.[1] |
|
|
…ныне давно небывавшая гостья в Сибири ― холера ― унесла много жертв из населения, не побоявшись и сернистых ядовитых газов.[2] |
| — Александр Черкасов, «На Алтае: Записки городского головы», 1884 |
|
|
― Вот что я придумал, ― заявил Каштанов: ― нужно отравить или оглушить муравьёв <…> сернистым газом.[3] |
| — Владимир Обручев, «Плутония», 1924 |
|
|
Известно, что серная кислота получается окислением сернистого ангидрида SO2 в серный ангидрид SO3 с последующим присоединением воды.[5] |
| — Б. Казаков, Е. Грузинов, «Четырежды открытый». Элемент № 23: ванадий, 1969 |
|
|
Большой интерес вызвал вопрос, что же «выплевывают» вулканы Ио? Приборы «Вояджера-1» уверенно назвали только двуокись серы.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Попробуем представить себе артезианский колодец, в котором вместо воды — сера и её двуокись.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
на «вояджеровских» снимках отчетливо различимы и эскарпы, и сопутствующие им яркие и темные потоки всех описанных выше форм и очертаний, и области, засыпанные слоями «сернистокислого» снега.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Общий объем поступлений сернистого газа, или диоксида серы (S02), в атмосферу Земли в разных источниках обычно оценивается от 100 млн. до 150 млн. т. в год.[8] |
| — Владимир Максаковский. «Географическая картина мира» (Книга I. Общая характеристика мира), 2003 |
|
|
Диоксид серы и оксиды азота в воздухе соединяются с парами воды, концентрируясь в первую очередь у основания облаков. Затем вместе с дождями (туманами) они выпадают на землю…[8] |
| — Владимир Максаковский. «Географическая картина мира» (Книга I. Общая характеристика мира), 2003 |
|
|
Одна из главных загадок ― наличие в атмосфере планеты <Венеры> значительных количеств двуокиси серы SO2. Из малых составляющих атмосферы этот газ наиболее обилен, что противоречит результатам химических моделей…[9] |
| — Дмитрий Титов, ««Венера-Экспресс» — первая европейская миссия к планете Венера», 2006 |
Сернистый газ в научной и научно-популярной прозеПравить
|
|
В пестролистных растениях цвет зависит от присутствия в соке клеточек ярких растворов, которые маскируют, скрывают зеленые зерна хлорофилла, но под микроскопом эти зерна нетрудно обнаружить. Еще легче обнаружить их следующим образом: стоит обмакнуть красный или почти чёрный лист какого-нибудь Coleus или другого пестролистного растения в слабый раствор сернистой кислоты, и он тотчас позеленеет. Это зависит от того, что сернистая кислота, обесцвечивая красный раствор, не действует на хлорофилл.[10] |
| — Климент Тимирязев, «Растение как источник силы», 1875 |
|
|
Изучая автоускоряющуюся медленную реакцию окисления сероводорода H2S, Эмануэль, Павлов и я в этом году показали, что продуктами этой давно известной реакции является не только SO2 (сернистый газ) и Н2O, но в весьма значительных количествах появляется и такой «экзотический» продукт, как SO. В первых стадиях реакции SO появляется в очень большом количестве, достигая 7% от исходного вещества и до 40% от превращенного к этому моменту H2S, и лишь в конечных стадиях SO исчезает, переходя в SO2. |
| — Николай Семёнов, «Теория цепных реакций», 1940 |
|
|
Диоксид серы хорошо растворяется в воде (около 40 объемов в 1 объеме воды при 20°С); при этом частично происходит реакция с водой и образуется сернистая кислота: |
| — Николай Глинка, «Общая химия», 1950-е |
|
|
Молекула SO2 построена аналогично молекуле озона. Ядра составляющих ее атомов образуют равнобедренный треугольник. <…> |
| — Николай Глинка, «Общая химия», 1950-е |
|
|
Контактный способ производства серной кислоты применяется в промышленности с 1875 года. В печи сжигается пирит ― самое дешевое пока сырье ― или сера. Образующийся сернистый газ последовательно проходит через несколько очистительных башен 2 и электрофильтров, в которых из него удаляются твердые частицы. Для еще лучшей очистки от пыли газ промывается в башне водой и сушится серной кислотой в следующей башне. От мышьяковистых соединений сернистый газ очищается в камере и затем поступает в подогреватель, где смешивается с воздухом. Температура смеси ― 400-500°C. После подогрева смесь направляется в контактный аппарат. Здесь она проходит через слой так называемой контактной массы, в состав которой входят 4-6% катализатора. SO2 взаимодействует с кислородом и превращается в SO3. Серный ангидрид улавливается концентрированной серной кислотой в поглотительной башне, и насыщенная серным ангидридом «дымящаяся» серная кислота (олеум) стекает в сборники, а оттуда идёт на склад.[13] |
| — Михайлов Г., Казбек-Казиев В., «Серная кислота», 1967 |
|
|
Таким образом, в основе процесса лежат отщепление одного атома кислорода от молекулы NO2, окисление этим кислородом сернистого ангидрида, окисление NO снова до NO2 и его повторное использование. Какой из описанных способов лучше? Безусловно, контактный. Нитрозным способом получают 75-78%-ную кислоту, а контактным ― купоросное масло (92-94% H2SO4) и олеум (100%-ная кислота, насыщенная серным ангидридом). Доля контактной серной кислоты в общем объеме сернокислотного производства непрерывно возрастает.[13] |
| — Михайлов Г., Казбек-Казиев В., «Серная кислота», 1967 |
|
|
…в начале первой мировой войны химикам вновь пришлось обратиться к элементу №23. В эти годы сражающимся странам потребовались громадные количества серной кислоты. Ведь без неё невозможно получить нитроклетчатку ― основу боевых порохов. Известно, что серная кислота получается окислением сернистого ангидрида SO2 в серный ангидрид SO3 с последующим присоединением воды. Однако SO2 непосредственно с кислородом реагирует крайние медленно. Окисление сернистого ангидрида может происходить при восстановлении двуокиси азота (на этой реакции основан нитрозный способ производства серной кислоты), но более чистая и концентрированная кислота получается, если реакцию окисления SO2 в SO3 проводить в присутствии некоторых твёрдых катализаторов (контактный метод производства). Первым катализатором сернокислотного контактного производства была дорогостоящая платина. Её, естественно, не хватало, требовались заменители. Ими оказались пятиокись ванадия V2O5 и некоторые соли ванадиевых кислот, например Ag3VO4. Они почти с таким же успехом, как и платина, ускоряют окисление SO2 в SO3, но обходятся значительно дешевле, да и требуется их меньше. И главное, они не боятся контактных ядов, выводящих из строя платиновые катализаторы.[5] |
| — Б. Казаков, Е. Грузинов, «Четырежды открытый». Элемент № 23: ванадий, 1969 |
|
|
Большой интерес вызвал вопрос, что же «выплевывают» вулканы Ио? Приборы «Вояджера-1» уверенно назвали только двуокись серы. Подозрительно, например, полное отсутствие воды, ведь у нас на Земле вулканы извергают ее столько, что, по некоторым гипотезам, чуть ли не все моря и океаны обязаны им своим существованием. Может быть, Ио так долго и усердно извергала влагу из своих недр, что её запасы просто исчерпались?[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Попробуем представить себе артезианский колодец, в котором вместо воды — сера и её двуокись. Найдя подходящую трещину или расселину, они, конечно, не преминут выбраться на белый свет, так что потоки серы и ее производных из недр здесь вполне в состоянии порождать уступы и ступени, простирающиеся на многие сотни километров.[7] |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
А давление атмосферы на Ио, как мы знаем, очень низкое (около 10~2 Па), так что есть чему выбить пробку из этой космической бутылки — скорость выделения газов должна достигать 350 м/с. |
| — Борис Силкин, «Странный мир Ио», 1982 |
|
|
Монооксид серы является вторым по распространенности газом, наблюдаемым в атмосфере Ио, спутника Юпитера. Наземные наблюдения миллиметровых волн в среднем по полушарию дают соотношение SO/SO2 3-10% по объёму. Наблюдаемая численность согласуется с образованием SO в результате фотолиза <разложения воздействием света> SO2. С другой стороны, низкое давление Ио (~10-9 бар), неравномерная атмосфера SO2, по крайней мере частично, обусловлены вулканическим выделением газа <…>. Газообразный SO2 наблюдался в дымовых шлейфах извержений и над вулканически активными регионами <…>. В этой работе мы показываем, что высокотемпературные вулканические газы, выделяющиеся из магм, могут создавать наблюдаемое содержание SO в атмосфере Ио.[14] |
| — Михаил Золотов, Брюс Фигли, «Вулканическое образование монооксида серы (SO) на Ио», 1998 |
|
|
Общий объем поступлений сернистого газа, или диоксида серы (S02), в атмосферу Земли в разных источниках обычно оценивается от 100 млн. до 150 млн. т. в год, оксида азота ― около 100 млн т. С попаданием в атмосферу соединений серы, а также азота непосредственно связана становящаяся все более актуальной проблема так называемых кислотных (кислых) дождей. Механизм их образования очень прост. Диоксид серы и оксиды азота в воздухе соединяются с парами воды, концентрируясь в первую очередь у основания облаков. Затем вместе с дождями (туманами) они выпадают на землю фактически в виде разбавленных серной и азотной кислот. Такие осадки резко нарушают нормы кислотности почвы, ухудшают водообмен растений, способствуя высыханию лесов, особенно хвойных. Попадая в реки и озера, они угнетающе действуют на их фауну и флору, нередко приводя к полному уничтожению биологической жизни ― от рыб до микроорганизмов. Большой вред они наносят и различным конструкционным материалам, ускоряя коррозию металлов, разрушение исторических и архитектурных памятников.[8] |
| — Владимир Максаковский. «Географическая картина мира» (Книга I. Общая характеристика мира), 2003 |
|
|
Одна из главных загадок ― наличие в атмосфере планеты <Венеры> значительных количеств двуокиси серы SO2. Из малых составляющих атмосферы этот газ наиболее обилен, что противоречит результатам химических моделей, которые предсказывают быстрое связывание SO2 минералами поверхности. Его большое содержание может косвенно свидетельствовать о работе активных вулканов, которые постоянно пополняют запасы двуокиси серы в атмосфере, однако пока нет убедительного доказательства их наличия на планете.[9] |
| — Дмитрий Титов, ««Венера-Экспресс» — первая европейская миссия к планете Венера», 2006 |
Сернистый газ в публицистике и документальной прозеПравить
|
|
Но есть другие газы и пары, которые можно назвать ядовитыми, так как они непосредственно оказывают гибельное, токсическое действие на центральные органы нервной системы (мозг) или на кровь. В числе их следует упомянуть угольную кислоту, окись углерода, сероводород, сернистый углерод, сернистую кислоту, анилин, мышьяковистый водород, ртутные пары и т. д.[15] |
| — Фёдор Эрисман, «Профессиональная гигиена», 1908 |
|
|
Капиталистическая печать скупо и скромно сообщает о несчастных случаях с пешеходами и жильцами квартир, окна которых выходят на уличные магистрали. А ведь случаи отравления угарным газом улицы далеко не редки в таких городах, как Нью-Йорк или Чикаго. Воздух этих городов разрушает даже металл и камень! Из вытяжных труб химических заводов наружу вылетают сернистые и фтористые соединения, мышьяковистый водород и т. д.[16] |
| — Михаил Калинушкин, «Чистый воздух», 1951 |
|
|
Однако даже после обработки сока известью и углекислым газом в нем остается еще немало красящих веществ. Обесцветить сок полностью помогает сернистый ангидрид (SO2). Операция эта называется сульфитацией от латинского названия серы ― Sulfur. Сернистый ангидрид, растворяясь в воде, образует сернистую кислоту. Та окисляется в серную кислоту и выделяет свободный водород. В нем-то всё и дело! Водород связывает хромофоры ― цветообразующие группы окрашенных веществ, и сами вещества становятся бесцветными.[17] |
| — Израиль Вольпер, «Сахар: сладкий, горький, соленый», 1965 |
|
|
У кадмиевых покрытий есть еще одна любопытная особенность: в чистой атмосфере сельских местностей они обладают значительно большей коррозийной устойчивостью, чем в атмосфере промышленных районов. Особенно быстро такое покрытие выходит из строя, если в воздухе повышенное содержание сернистого или серного ангидридов.[18] |
| — Борис Горзев, «Ещё о кадмии», 1970 |
|
|
Чтобы воспрепятствовать проведению занятий, левые студенты прибегли к испытанному средству — химической обструкции. Для этого использовались разнообразные вещества во всех трёх состояних — жидком, твёрдом и газообразном. |
| — Яна Седова, «Октябрический режим», 2017 |
Сернистый газ в мемуарах, письмах и дневниковой прозеПравить
|
|
Сильный серный запах захватывает дыхание: кругом меня опять темно; резкий ветер, дующий здесь непрерывно, убедил меня, что вершина вулкана ― самое прохладное место в Неаполе. <…> Несколько секунд вулкан дрожал под моими ногами и снова все погрузилось во мрак; но глухое клокотание в жерле не умолкало и тяжело движущаяся лава разливала кругом себя красноватое зарево. Я чувствовал неодолимое влечение к этому грозному деятелю природы; мне хотелось заглянуть в лабораторию, где работают ее таинственные силы, я был от этой мастерской так недалеко… Ни удушливые газы, ни сернистый дым, ни зола, взвеваемая ветром, не могли остановить меня.[1] |
| — Константин Ушинский, «Детский мир», 1864 |
|
|
Надо заметить, что в Сузунском заводе много десятков тысяч сернистых руд обрабатывают в пожогах, так что в это время отделяется большое количество сернистой кислоты и нередко по всему селению пахнет тухлыми яйцами, а возгонная сера тонким желтоватым налетом садится поблизости пожогов, что в особенности заметно на дождевых лужах. От таких сернистых отделений поблизости завода не живут куры и пропадают вместе с некоторыми злаками, растущими в огородах. Вся медная посуда и серебряные вещи чернеют до того, что их трудно отчистить; по этому случаю пожоги по возможности делаются осенью и зимою.[2] |
| — Александр Черкасов, «На Алтае: Записки городского головы», 1884 |
|
|
Вследствие этого всегда говорили и думали, что жители Сузунского завода застрахованы от разных эпидемий, но это неверно по многим наблюдениям; а ныне давно небывавшая гостья в Сибири ― холера ― унесла много жертв из населения, не побоявшись и сернистых ядовитых газов.[2] |
| — Александр Черкасов, «На Алтае: Записки городского головы», 1884 |
|
|
Взобраться на вулкан <Алагёз> можно со стороны так называемого восточного прорыва. Он имеет четыре вершинки, с каждой из которых открывается вид вниз, на кратер. Что же в конце концов происходит с лавой при её извержении? Мы встречаемся прежде всего в кратере с огромным количеством квасцов. Квасцы ― это химическое перерождение лавы, т. е. полевого шпата, под влиянием сернистого газа и воды.[20] |
| — Мариэтта Шагинян, Дневник, сентябрь 1927 |
|
|
Обилие вкраплений серного колчедана в коренных породах района и характер пласта глубоких россыпей позволили мне предложить следующее объяснение золотоносности. Анализы кубиков колчедана как из серного шлиха, собранного на золотопромывальных машинах, так и выбитых прямо из горных пород, показали, что они содержат большее или меньшее количество золота. Очевидно сернистые газы, выделявшиеся из остывавших массивов гранита и отложившие эти кубики в осадочных породах, содержали также золото.[21] |
| — Владимир Обручев, «Мои путешествия по Сибири», 1948 |
|
|
Дыхание затруднено как высотою, так и недостатком кислорода и избытком фтора, хлора и серных окислов. Как было бы жутко здесь, не будь перед нами сверкающей огненной горы, осыпающейся огнём во тьме ночи и влекущей вперед. Усталость исчезает, как бы сгорает в праздничном огне…[22] |
| — Александр Святловский, «Тектоника Камчатки», 1967 |
|
|
…в те дни, когда вдруг просыпалась Этна, извергая из своих семи кратеров огонь и дым и швыряя в небо раскалённые каменные бомбы, заставляя трескаться землю, обжигая лавой виноградники и обволакивая остров клубами сернистых газов, озарёнными снизу отсветами преисподней… Кто знает, какая нечеловеческая сила разрушила циклопические постройки древней Сицилии? И почему иные из них остались почти нетронутыми, не поверженными во прах?[6] |
| — Валентин Катаев, «Алмазный мой венец», 1977 |
Сернистый газ в беллетристике и художественной прозеПравить
|
|
Из этих поясов в изобилии вытекала вода, уже довольно горячая, так как температура на достигнутой глубине дошла до 45°. Работа становилась более трудной и без вентиляции была бы совершенно невозможной. Атмосфера в нижнем отделении шахты уже напоминала хорошую баню и была наполнена парами воды с сернистым запахом. Насосы опять работали непрерывно, компрессор вдувал холодный воздух, и тем не менее температура держалась около 27°.[23] |
| — Владимир Обручев, «Тепловая шахта», 1920 |
|
|
― Вот что я придумал, ― заявил Каштанов: ― нужно отравить или оглушить муравьев ядовитыми газами, чтобы они оставались в оцепенении в течение времени, необходимого нам для поисков наших вещей в муравейнике. Такими газами являются хлор, бром и сернистый газ. Следовательно, нужно прежде всего найти материал для приготовления достаточного количества газов. Хлор можно добыть из поваренной соли, которая имеется в море. Бром, вероятно, имеется в золе водорослей, растущих в этом мире, но добыть его будет еще труднее, чем хлор. Всего легче было бы приготовить сернистый газ, если мы только найдем серу, серный колчедан или другую сернистую руду. Свинцовый блеск мы уже видели в ущелье птеродактилей; может быть, он найдется и здесь, в утёсах возвышенности.[3] |
| — Владимир Обручев, «Плутония», 1924 |
|
|
Я никогда по-настоящему не любил младенцев; от их криков всегда становится неуютно. А Дая всегда мне говорила, что младенцы только для этого и существуют. Я любил её… |
| — Джордж Эффинджер, «Среда, 15 ноября 1967 года» 1971 |
Сернистый газ в стихахПравить
|
|
Вновь собиралась страсть в прыжок, |
| — Сергей Петров, «В дыму морозном тёплый дом…», 12 августа 1942 |
ИсточникиПравить
- ↑ 1 2 Ушинский К.Д. Собрание сочинений в одиннадцати томах. Том 4. Детский мир и Хрестоматия. — Москва-Ленинград, «Издательство Академии педагогических наук РСФСР», 1948 г.
- ↑ 1 2 3 А. А. Черкасов На Алтае: Записки городского головы. — Барнаул, 2004 г.
- ↑ 1 2 Обручев В.А. «Плутония. Земля Санникова». — М.: Машиностроение, 1982 г.
- ↑ 1 2 Катаев В.П. Избранные стихотворения. Москва, «Астрель», 2009 г.
- ↑ 1 2 Б. Казаков, Е. Грузинов, Элемент № 23: ванадий (Четырежды открытый). ― М.: «Химия и жизнь», № 4, 1966 г.
- ↑ 1 2 Катаев В.П. Трава забвенья. — Москва, «Вагриус», 1997 г.
- ↑ 1 2 3 4 5 6 Борис Силкин. «Странный мир Ио». — М.: «Химия и жизнь», № 4, 1982 г.
- ↑ 1 2 3 В. П. Максаковский. Географическая картина мира. — М.: Дрофа, 2008
- ↑ 1 2 Д. Титов. «Венера-Экспресс» — первая европейская миссия к планете Венера. — М.: «Наука и жизнь», № 1, 2006 г.
- ↑ К.А.Тимирязев. «Жизнь растения» (по изданию 1919 года). — М.: Сельхозгиз, 1936 г.
- ↑ Семёнов Н. Н. Теория цепных реакций (из статьи «Теория горения»). — М.: «Наука и жизнь» № 8-9, 1940 г.
- ↑ 1 2 Н. Л. Глинка. Общая химия: Учебное пособие для вузов (под. ред. В.А.Рабиновича, издание 16-е, исправленное и дополненное). ― Л.: Химия, 1973 г. ― 720 стр.
- ↑ 1 2 Михайлов Г., Казбек-Казиев В., Серная кислота. ― М.: «Химия и жизнь», № 5, 1967 г.
- ↑ Mikhail Yu. Zolotov and Bruce Fegley, Jr. Volcanic Production of Sulfur Monoxide (SO) on Io. — Vernadsky Institute of Geochemistry and Analytical Chemistry, Russian Academy of Sciences, Kosygin Str. 19, Moscow 117975, Russia, 1998.
- ↑ Ф.Ф.Эрисман. Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ Михаил Калинушкин. Чистый воздух — М.: «Техника — молодежи», № 1, 1951 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
- ↑ Борис Горзев. Ещё о кадмии (редакционная колонка). — М.: «Химия и жизнь», № 9, 1970 год
- ↑ Я. А. Седова. Октябрический режим. Том второй. — М.: издательство Алгоритм, 2017 г.
- ↑ Мариэтта Шагинян. Дневники. 1917—1931. — Л.: Издательство писателей в Ленинграде, 1932 г.
- ↑ Обручев В.А., «Мои путешествия по Сибири». — М., Л.: Изд-во АН СССР, 1948 г.
- ↑ Святловский А. Е.. «Очерк истории четвертичного вулканизма и тектоники Камчатки». — М.: «Наука», 1968 г. 218с.
- ↑ Обручев В.А. «Путешествие в прошлое и будущее»: повести и рассказы. ― М.: Наука, 1965 г.
- ↑ С. В. Петров, Собрание стихотворений. В 2 книгах, — М.: Водолей Publishers, 2008 г.
См. такжеПравить
- Сера
- Закись серы
- Моноокись серы
- Олеум
- Серная кислота
- Сероводород
- Серный дождь
- Медный купорос
- Купоросное масло
- Колчедан
- Кислотный дождь
- Ад
- Вулканы