From Wikipedia, the free encyclopedia
This article is about the chemical compound. For the use of zinc sulfate as a medication, see Zinc sulfate (medical use).

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Zinc sulfate |
|
| Other names
White vitriol |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.904 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
ZnSO4 |
| Molar mass | 161.44[1] g/mol (anhydrous) 179.47 g/mol (monohydrate) 287.53 g/mol (heptahydrate) |
| Appearance | white powder |
| Odor | odorless |
| Density | 3.54 g/cm3 (anhydrous) 2.072 g/cm3 (hexahydrate) |
| Melting point | 680 °C (1,256 °F; 953 K) decomposes (anhydrous) 100 °C (heptahydrate) 70 °C, decomposes (hexahydrate) |
| Boiling point | 740 °C (1,360 °F; 1,010 K) (anhydrous) 280 °C, decomposes (heptahydrate) |
|
Solubility in water |
57.7 g/100 mL, anhydrous (20 °C) (In aqueous solutions with a pH < 5)[2] |
| Solubility | alcohols |
|
Magnetic susceptibility (χ) |
−45.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.658 (anhydrous), 1.4357 (heptahydrate) |
| Thermochemistry | |
|
Std molar |
120 J·mol−1·K−1[3] |
|
Std enthalpy of |
−983 kJ·mol−1[3] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H318, H410 |
|
Precautionary statements |
P264, P270, P273, P280, P301+P312, P305+P351+P338, P310, P330, P391, P501 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 1698 |
| Related compounds | |
|
Other cations |
Cadmium sulfate Manganese sulfate |
|
Related compounds |
Copper(II) sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc sulfate describes a family of inorganic compounds with the formula ZnSO4(H2O)x. All are colorless solids. The most common form includes water of crystallization as the heptahydrate,[4] with the formula ZnSO4·7H2O. It was historically known as «white vitriol». Zinc sulfate and its hydrates are colourless solids.
Uses[edit]
Manufacturing[edit]
The main application of the heptahydrate is as a coagulant in the production of rayon. It is also a precursor to the pigment lithopone. It is also used as an electrolyte for zinc electroplating, as a mordant in dyeing, and as a preservative for skins and leather.
Nutrition[edit]
Zinc sulfate is used to supply zinc in animal feeds, fertilizers, toothpaste, and agricultural sprays. Zinc sulfate,[5] like many zinc compounds, can be used to control moss growth on roofs.[6]
Zinc sulfate can be used to supplement zinc in the brewing process. Zinc is a necessary nutrient for optimal yeast health and performance, although it is not a necessary supplement for low-gravity beers, as the grains commonly used in brewing already provide adequate zinc. It is a more common practice when pushing yeast to their limit by increasing alcohol content beyond their comfort zone. Before modern stainless steel, brew Kettles, fermenting vessels and after wood, zinc was slowly leached by the use of copper kettles. A modern copper immersion chiller is speculated to provide trace amounts of zinc; thus care must be taken when adding supplemental zinc so as not to cause excess. Side effects include «…increased acetaldehyde and fusel alcohol production due to high yeast growth when zinc concentrations exceed 5 ppm. Excess zinc can also cause soapy or goaty flavors.»[7][8][9]
Zinc sulfate is a potent inhibitor of sweetness perception for most sweet-tasting substances.[10]
Medicine[edit]
It is used as a dietary supplement to treat zinc deficiency and to prevent the condition in those at high risk.[11] Side effects of excess supplementation may include abdominal pain, vomiting, headache, and tiredness.[12] it is also used together with oral rehydration therapy (ORT) and an astringent.[4]
Production, reactions, structure[edit]
Aqueous solutions of zinc sulfate consist of the aquo complex [Zn(H2O)6]2+.
Zinc sulfate is produced by treating virtually any zinc-containing material (metal, minerals, oxides) with sulfuric acid.[4]
Specific reactions include the reaction of the metal with aqueous sulfuric acid:
- Zn + H2SO4 + 7 H2O → ZnSO4·7H2O + H2
Pharmaceutical-grade zinc sulfate is produced by treating high-purity zinc oxide with sulfuric acid:
- ZnO + H2SO4 + 6 H2O → ZnSO4·7H2O
In aqueous solution, all forms of zinc sulfate behave identically. These aqueous solutions consist of the metal aquo complex [Zn(H2O)6]2+ and SO2−
4 ions. Barium sulfate forms when these solutions are treated with solutions of barium ions:
- ZnSO4 + BaCl2 → BaSO4 + ZnCl2
With a reduction potential of −0.76 V, zinc(II) reduces only with difficulty.
When heated above 680 °C, zinc sulfate decomposes into sulfur dioxide gas and zinc oxide fume, both of which are hazardous.[13]
The heptahydrate is isostructural with ferrous sulfate heptahydrate. The solid consists of [Zn(H2O)6]2+ ions interacting with sulfate and one water of crystallization by hydrogen bonds. Anhydrous zinc sulfate is isomorphous with anhydrous copper(II) sulfate. It exists as the mineral zincosite.[14] A monohydrate is known.[15] The hexahydrate is also recognized.[16]
Minerals[edit]
As a mineral, ZnSO4•7H2O is known as goslarite. Zinc sulfate occurs as several other minor minerals, such as zincmelanterite, (Zn,Cu,Fe)SO4·7H2O (structurally different from goslarite). Lower hydrates of zinc sulfate are rarely found in nature: (Zn,Fe)SO4·6H2O (bianchite), (Zn,Mg)SO4·4H2O (boyleite), and (Zn,Mn)SO4·H2O (gunningite).
Safety[edit]
Zinc sulfate powder is an eye irritant. Ingestion of trace amounts is considered safe, and zinc sulfate is added to animal feed as a source of essential zinc, at rates of up to several hundred milligrams per kilogram of feed. Excess ingestion results in acute stomach distress, with nausea and vomiting appearing at 2–8 mg/kg of body weight.[17]
References[edit]
- ^ https://webbook.nist.gov/cgi/cbook.cgi?ID=C7733020&Mask=8
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b c Dieter M. M. Rohe; Hans Uwe Wolf (2005). «Zinc Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: John Wiley & Sons. doi:10.1002/14356007.a28_537. ISBN 978-3527306732.
- ^ «Zinc Sulphate». Chemical & Fertilizer Expert. Retrieved 15 September 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ «Moss on Roofs» (PDF). Community Horticultural Fact Sheet #97. Washington State University King County Extension. Archived from the original (PDF) on 22 December 2015.
- ^ «Metallurgy for Homebrewers». Brew Your Own Magazine.
- ^ «The Effect of Zinc on Fermentation Performance». Braukaiser blog.
- ^ Šillerová, Silvia; Lavová, Blažena; Urminská, Dana; Poláková, Anežka; Vollmannová, Alena; Harangozo, Ľuboš (February 2012). «Preparation of Zinc Enriched Yeast (Saccharomyces cerevisiae) by Cultivation With Different Zinc Salts». Journal of Microbiology, Biotechnology and Food Sciences. 1 (Special issue): 689–695. ISSN 1338-5178.
- ^ Keast, R. S.J.; Canty, T. M.; Breslin, P. A. (2004). «Oral Zinc Sulfate Solutions Inhibit Sweet Taste Perception». Chemical Senses. 29 (6): 513–521. doi:10.1093/chemse/bjh053. PMID 15269123.
- ^ British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. p. 700. ISBN 9780857111562.
- ^ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). WHO Model Formulary 2008. World Health Organization. p. 351. hdl:10665/44053. ISBN 9789241547659.
- ^ «Zinc Sulphate Zinc Sulfate MSDS Sheet of Manufacturers». Mubychem.com. 5 May 2013. Retrieved 8 June 2013.
- ^ Wildner, M.; Giester, G. (1988). «Crystal Structure refinements of synthetic chalcocyanite (CUSO4) and zincosite (ZnSO4)». Mineralogy and Petrology. 39 (3–4): 201–209. Bibcode:1988MinPe..39..201W. doi:10.1007/BF01163035. S2CID 93701665.
- ^ Wildner, M.; Giester, G. (1991). «The Crystal Structures of Kieserite-Type Compounds. I. Crystal Structures of Me(II)SO4*H2O (Me = Mn, Fe, Co, Ni, Zn)». Neues Jahrbuch für Mineralogie — Monatshefte. 1991: 296–306.
- ^ Spiess, M.; Gruehn, R. (1979). «Beiträge zum thermischen Verhalten von Sulfaten. II. Zur thermischen Dehydratisierung des ZnSO4•7H2O und zum Hochtemperaturverhalten von wasserfreiem ZnSO4». Zeitschrift für Anorganische und Allgemeine Chemie. 456: 222–240. doi:10.1002/zaac.19794560124.
- ^ «Scientific Opinion on safety and efficacy of zinc compounds (E6) as feed additives for all animal species: Zinc sulphate monohydrate». EFSA Journal. European Food Safety Authority (EFSA). 10 (2): 2572. February 2012. doi:10.2903/j.efsa.2012.2572.
From Wikipedia, the free encyclopedia
This article is about the chemical compound. For the use of zinc sulfate as a medication, see Zinc sulfate (medical use).

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Zinc sulfate |
|
| Other names
White vitriol |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.904 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
ZnSO4 |
| Molar mass | 161.44[1] g/mol (anhydrous) 179.47 g/mol (monohydrate) 287.53 g/mol (heptahydrate) |
| Appearance | white powder |
| Odor | odorless |
| Density | 3.54 g/cm3 (anhydrous) 2.072 g/cm3 (hexahydrate) |
| Melting point | 680 °C (1,256 °F; 953 K) decomposes (anhydrous) 100 °C (heptahydrate) 70 °C, decomposes (hexahydrate) |
| Boiling point | 740 °C (1,360 °F; 1,010 K) (anhydrous) 280 °C, decomposes (heptahydrate) |
|
Solubility in water |
57.7 g/100 mL, anhydrous (20 °C) (In aqueous solutions with a pH < 5)[2] |
| Solubility | alcohols |
|
Magnetic susceptibility (χ) |
−45.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.658 (anhydrous), 1.4357 (heptahydrate) |
| Thermochemistry | |
|
Std molar |
120 J·mol−1·K−1[3] |
|
Std enthalpy of |
−983 kJ·mol−1[3] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H318, H410 |
|
Precautionary statements |
P264, P270, P273, P280, P301+P312, P305+P351+P338, P310, P330, P391, P501 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 1698 |
| Related compounds | |
|
Other cations |
Cadmium sulfate Manganese sulfate |
|
Related compounds |
Copper(II) sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc sulfate describes a family of inorganic compounds with the formula ZnSO4(H2O)x. All are colorless solids. The most common form includes water of crystallization as the heptahydrate,[4] with the formula ZnSO4·7H2O. It was historically known as «white vitriol». Zinc sulfate and its hydrates are colourless solids.
Uses[edit]
Manufacturing[edit]
The main application of the heptahydrate is as a coagulant in the production of rayon. It is also a precursor to the pigment lithopone. It is also used as an electrolyte for zinc electroplating, as a mordant in dyeing, and as a preservative for skins and leather.
Nutrition[edit]
Zinc sulfate is used to supply zinc in animal feeds, fertilizers, toothpaste, and agricultural sprays. Zinc sulfate,[5] like many zinc compounds, can be used to control moss growth on roofs.[6]
Zinc sulfate can be used to supplement zinc in the brewing process. Zinc is a necessary nutrient for optimal yeast health and performance, although it is not a necessary supplement for low-gravity beers, as the grains commonly used in brewing already provide adequate zinc. It is a more common practice when pushing yeast to their limit by increasing alcohol content beyond their comfort zone. Before modern stainless steel, brew Kettles, fermenting vessels and after wood, zinc was slowly leached by the use of copper kettles. A modern copper immersion chiller is speculated to provide trace amounts of zinc; thus care must be taken when adding supplemental zinc so as not to cause excess. Side effects include «…increased acetaldehyde and fusel alcohol production due to high yeast growth when zinc concentrations exceed 5 ppm. Excess zinc can also cause soapy or goaty flavors.»[7][8][9]
Zinc sulfate is a potent inhibitor of sweetness perception for most sweet-tasting substances.[10]
Medicine[edit]
It is used as a dietary supplement to treat zinc deficiency and to prevent the condition in those at high risk.[11] Side effects of excess supplementation may include abdominal pain, vomiting, headache, and tiredness.[12] it is also used together with oral rehydration therapy (ORT) and an astringent.[4]
Production, reactions, structure[edit]
Aqueous solutions of zinc sulfate consist of the aquo complex [Zn(H2O)6]2+.
Zinc sulfate is produced by treating virtually any zinc-containing material (metal, minerals, oxides) with sulfuric acid.[4]
Specific reactions include the reaction of the metal with aqueous sulfuric acid:
- Zn + H2SO4 + 7 H2O → ZnSO4·7H2O + H2
Pharmaceutical-grade zinc sulfate is produced by treating high-purity zinc oxide with sulfuric acid:
- ZnO + H2SO4 + 6 H2O → ZnSO4·7H2O
In aqueous solution, all forms of zinc sulfate behave identically. These aqueous solutions consist of the metal aquo complex [Zn(H2O)6]2+ and SO2−
4 ions. Barium sulfate forms when these solutions are treated with solutions of barium ions:
- ZnSO4 + BaCl2 → BaSO4 + ZnCl2
With a reduction potential of −0.76 V, zinc(II) reduces only with difficulty.
When heated above 680 °C, zinc sulfate decomposes into sulfur dioxide gas and zinc oxide fume, both of which are hazardous.[13]
The heptahydrate is isostructural with ferrous sulfate heptahydrate. The solid consists of [Zn(H2O)6]2+ ions interacting with sulfate and one water of crystallization by hydrogen bonds. Anhydrous zinc sulfate is isomorphous with anhydrous copper(II) sulfate. It exists as the mineral zincosite.[14] A monohydrate is known.[15] The hexahydrate is also recognized.[16]
Minerals[edit]
As a mineral, ZnSO4•7H2O is known as goslarite. Zinc sulfate occurs as several other minor minerals, such as zincmelanterite, (Zn,Cu,Fe)SO4·7H2O (structurally different from goslarite). Lower hydrates of zinc sulfate are rarely found in nature: (Zn,Fe)SO4·6H2O (bianchite), (Zn,Mg)SO4·4H2O (boyleite), and (Zn,Mn)SO4·H2O (gunningite).
Safety[edit]
Zinc sulfate powder is an eye irritant. Ingestion of trace amounts is considered safe, and zinc sulfate is added to animal feed as a source of essential zinc, at rates of up to several hundred milligrams per kilogram of feed. Excess ingestion results in acute stomach distress, with nausea and vomiting appearing at 2–8 mg/kg of body weight.[17]
References[edit]
- ^ https://webbook.nist.gov/cgi/cbook.cgi?ID=C7733020&Mask=8
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b c Dieter M. M. Rohe; Hans Uwe Wolf (2005). «Zinc Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: John Wiley & Sons. doi:10.1002/14356007.a28_537. ISBN 978-3527306732.
- ^ «Zinc Sulphate». Chemical & Fertilizer Expert. Retrieved 15 September 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ «Moss on Roofs» (PDF). Community Horticultural Fact Sheet #97. Washington State University King County Extension. Archived from the original (PDF) on 22 December 2015.
- ^ «Metallurgy for Homebrewers». Brew Your Own Magazine.
- ^ «The Effect of Zinc on Fermentation Performance». Braukaiser blog.
- ^ Šillerová, Silvia; Lavová, Blažena; Urminská, Dana; Poláková, Anežka; Vollmannová, Alena; Harangozo, Ľuboš (February 2012). «Preparation of Zinc Enriched Yeast (Saccharomyces cerevisiae) by Cultivation With Different Zinc Salts». Journal of Microbiology, Biotechnology and Food Sciences. 1 (Special issue): 689–695. ISSN 1338-5178.
- ^ Keast, R. S.J.; Canty, T. M.; Breslin, P. A. (2004). «Oral Zinc Sulfate Solutions Inhibit Sweet Taste Perception». Chemical Senses. 29 (6): 513–521. doi:10.1093/chemse/bjh053. PMID 15269123.
- ^ British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. p. 700. ISBN 9780857111562.
- ^ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). WHO Model Formulary 2008. World Health Organization. p. 351. hdl:10665/44053. ISBN 9789241547659.
- ^ «Zinc Sulphate Zinc Sulfate MSDS Sheet of Manufacturers». Mubychem.com. 5 May 2013. Retrieved 8 June 2013.
- ^ Wildner, M.; Giester, G. (1988). «Crystal Structure refinements of synthetic chalcocyanite (CUSO4) and zincosite (ZnSO4)». Mineralogy and Petrology. 39 (3–4): 201–209. Bibcode:1988MinPe..39..201W. doi:10.1007/BF01163035. S2CID 93701665.
- ^ Wildner, M.; Giester, G. (1991). «The Crystal Structures of Kieserite-Type Compounds. I. Crystal Structures of Me(II)SO4*H2O (Me = Mn, Fe, Co, Ni, Zn)». Neues Jahrbuch für Mineralogie — Monatshefte. 1991: 296–306.
- ^ Spiess, M.; Gruehn, R. (1979). «Beiträge zum thermischen Verhalten von Sulfaten. II. Zur thermischen Dehydratisierung des ZnSO4•7H2O und zum Hochtemperaturverhalten von wasserfreiem ZnSO4». Zeitschrift für Anorganische und Allgemeine Chemie. 456: 222–240. doi:10.1002/zaac.19794560124.
- ^ «Scientific Opinion on safety and efficacy of zinc compounds (E6) as feed additives for all animal species: Zinc sulphate monohydrate». EFSA Journal. European Food Safety Authority (EFSA). 10 (2): 2572. February 2012. doi:10.2903/j.efsa.2012.2572.
ЦИНКА СУЛЬФАТ
- ЦИНКА СУЛЬФАТ
-
ZnSO4, бесцв. кристаллы ромбич. сингонии (а = 0,6731 нм, b =0,8581 нм, с =0,4760 нм, z = 4, пространств. группа Рпта); плотн. 3,54 г/см 3;
99,14 Дж/(моль x К);
-982,01 кДж/моль;
110,62 Дж/(моль x К); при нагр. до 600-800
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Смотреть что такое «ЦИНКА СУЛЬФАТ» в других словарях:
-
ЦИНКА СУЛЬФАТ — Zinci suifas. Синонимы: сульфат цинка, сернокислый цинк. Свойства. Бесцветные, прозрачные, призматические кристаллы или мелкокристаллический порошок вяжущий на вкус, без запаха. Растворим в воде (1:0,75) и в глицерине (1:10), не растворяется в с … Отечественные ветеринарные препараты
-
ЦИНКА СУЛЬФАТ — (сернокислый цинк) ZnSO4, бесцветные кристаллы. Растворяется в воде. Из растворов кристаллизуется ZnSO4 . 7H2O цинковый купорос. Применяют в производстве вискозы, глазурей, для защиты древесины от гниения … Большой Энциклопедический словарь
-
цинка сульфат — ZnSO4, бесцветные кристаллы. Растворяется в воде. Из растворов кристаллизуется ZnSO4·7Н2О цинковый купорос. Применяют в производстве вискозы, глазурей, для защиты древесины от гниения. * * * ЦИНКА СУЛЬФАТ ЦИНКА СУЛЬФАТ (сернокислый цинк), ZnSO4 … Энциклопедический словарь
-
цинка сульфат — cinko sulfatas statusas T sritis chemija formulė ZnSO₄ atitikmenys: angl. zinc sulfate rus. цинк сернокислый; цинка сульфат ryšiai: sinonimas – cinko tetraoksosulfatas … Chemijos terminų aiškinamasis žodynas
-
ЦИНКА СУЛЬФАТ — (Zinci sulfas; ФХ), антисептическое, вяжущее и противовоспалительное средство. Бесцветные прозрачные кристаллы или мелкокристаллический порошок без запаха. Очень легко растворим в воде. 20% ный раствор Ц. с. прижигает ткань. Применяют в виде… … Ветеринарный энциклопедический словарь
-
ЦИНКА СУЛЬФАТ — (zinc sulphate) препарат, применяющийся для лечения заболеваний, связанных с дефицитом цинка в организме. Назначается внутрь. Торговые названия: солвацинк (Solvazinc), Z спан спансула (Z Span Spansule) … Толковый словарь по медицине
-
Цинка Сульфат (Zinc Sulphate) — препарат, применяющийся для лечения заболеваний, связанных с дефицитом цинка в организме. Назначается внутрь. Торговые названия: солвацинк (Solvazinc), Z спан спансула (Z Span Spansule). Источник: Медицинский словарь … Медицинские термины
-
Цинка сульфат — сернокислый цинк, ZnSO4, бесцветные кристаллы, плотность 3,74 г/см3. Растворимость в воде (%): 29,4 (0 °С), 37,7 (99 °С). Из растворов при температуре ниже 38,8 °С кристаллизуется ZnSO4․7H2O (цинковый купорос), в пределах от 38,8 °С до 70 … Большая советская энциклопедия
-
ЦИНКА СУЛЬФАТ — ZnSO4, бесцв. кристаллы. Растворяется в воде. Из р ров кристаллизуется ZnSO4*7H2O цинковый купорос. Применяют в произ ве вискозы, глазурей, для защиты древесины от гниения … Естествознание. Энциклопедический словарь
-
ЦИНКА СУЛЬФАТ — сернокислый цинк, ZnSO4, цинковое микроудобрение. Бесцветное кристаллич. в во, растворимое в воде, содержит 21,8 22,5% Zn. Получают выпариванием и кристаллизацией из р ров. Применяют на почвах, бедных цинком, дерново подзолистых, карбонатных… … Сельско-хозяйственный энциклопедический словарь
Содержание
Структурная формула
Русское название
Цинка сульфат
Английское название
Zinc sulfate
Латинское название вещества Цинка сульфат
Zinci sulfas (род. Zinci sulfatis)
Фармакологическая группа вещества Цинка сульфат
Характеристика
Бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса, без запаха. На воздухе выветривается. Очень легко растворим в воде, практически нерастворим в этаноле, медленно растворим в глицерине (1:10). Водные растворы имеют кислую реакцию.
Фармакологическое действие
—
антисептическое, вяжущее, иммуномодулирующее, подсушивающее.
Фармакология
Ионы цинка коагулируют белки с образованием альбуминатов. В зависимости от глубины проникновения развивается подсушивающий, вяжущий и раздражающий эффекты, последний обусловливает рвоту (раздражение соответствующих зон слизистой желудка и рефлекторное возбуждение рвотного центра). Противомикробная активность является следствием коагуляции белков микроорганизмов. В микроколичествах резорбируется и субстратно стимулирует ряд ферментных систем — щелочную фосфатазу, АПФ, алкогольдегидрогеназу, супероксиддисмутазу, карбоангидразу и др.
Применение вещества Цинка сульфат
Конъюнктивит, ларингит, уретрит, вагинит — местно; необходимость вызывания рвоты — внутрь в высоких дозах; дефицит цинка в организме с нарушениями анаболических, иммунологических и др. процессов (профилактика и лечение) — внутрь; гипогонадизм, гнездное облысение, детский церебральный паралич, заболевания печени, сахарный диабет, диффузные болезни соединительной ткани и др. (в составе комплексной терапии) — внутрь.
Противопоказания
Гиперчувствительность.
Побочные действия вещества Цинка сульфат
Тошнота, рвота, диарея (при приеме высоких доз внутрь).
Передозировка
Лихорадка, нарушения функции легких, дегидратация, дисбаланс электролитов в плазме, летаргия, расстройства мышечных движений, почечная недостаточность.
Способ применения и дозы
Местно. При конъюнктивитах — глазные капли 0,1–0,5%, при ларингите — смазывание или пульверизация 0,25–0,5% раствором, при уретритах и вагинитах — спринцевания 0,1–0,5% раствором.
Внутрь. Для профилактики гипоцинкемии — 10–15 мг в сутки (физиологическая потребность организма в цинке), с лечебной целью — 20–50 мг 2–3 раза в день, в качестве рвотного средства — 100–300 мг однократно.
Торговые названия с действующим веществом Цинка сульфат
- Как правильно пишется слово «цинк»
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова урду (существительное):
Ассоциации к слову «сульфат»
Ассоциации к слову «цинк»
Синонимы к словосочетанию «сульфат цинка»
Предложения со словосочетанием «сульфат цинка»
- И обязательно добавляют микроэлементы, которые предварительно надо развести в небольшом количестве горячей воды: 240 г сульфата железа, 4 г сульфата меди, 8 г сульфата цинка, 12 г сульфата марганца, 12 г борной кислоты, 5 г молибденовой кислоты.
- Для этого использовались глухие мыши; мыши, у которых обонятельный эпителий был разрушен при помощи сульфата цинка; применялись также разные прозрачные и непрозрачные перегородки.
- Местно – смазывание участков мокнутия 1 % водным раствором бриллиантовой зелени; 0,25 % раствором сульфата цинка, крепким чаем; наложение дезинфицирующих мазей (висмутовая, таниновая) и стероидных кремов.
- (все предложения)
Смотрите также
Сульфа́т ци́нка, сернокислый цинк, ZnSO4 — цинковая соль серной кислоты.
Все значения словосочетания «сульфат цинка»
-
И обязательно добавляют микроэлементы, которые предварительно надо развести в небольшом количестве горячей воды: 240 г сульфата железа, 4 г сульфата меди, 8 г сульфата цинка, 12 г сульфата марганца, 12 г борной кислоты, 5 г молибденовой кислоты.
-
Для этого использовались глухие мыши; мыши, у которых обонятельный эпителий был разрушен при помощи сульфата цинка; применялись также разные прозрачные и непрозрачные перегородки.
-
Местно – смазывание участков мокнутия 1 % водным раствором бриллиантовой зелени; 0,25 % раствором сульфата цинка, крепким чаем; наложение дезинфицирующих мазей (висмутовая, таниновая) и стероидных кремов.
- (все предложения)
- сульфат магния
- сульфат железа
- сульфат кальция
- сульфат бария
- сульфат натрия
- (ещё синонимы…)
- натрий
- (ещё ассоциации…)
- металл
- циновка
- химия
- гроб
- таблица
- (ещё ассоциации…)
- Разбор по составу слова «сульфат»
- Разбор по составу слова «цинк»
- Как правильно пишется слово «цинк»
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Карбонат натрия 4 буквы
Автор Даша задал вопрос в разделе Лингвистика
Химия: как пишется и получил лучший ответ
Ответ от Дмитрий Лысов[эксперт]
Гидроксид меди(I) СuОН как индивидуальное соед. не получен. При взаимод. солей Сu(I) с щелочами в р-ре образуется гидратированный оксид Сu2О.xН2О
Гидроксид меди (II) Cu(OH)2 – вещество голубого цвета, существует в аморфной и кристаллической формах, кристаллическая решетка ромбическая, плотность 3,37
Хлористоводородная кислота, HCl, сильная одноосновная кислота, раствор хлористого водорода в воде. Соляная кислота — бесцветная жидкость с острым запахом
Сульфат железа (II) FeSO4. Токсичные, очень гигроскопичные парамагнитные …железа в разбавленной азотной кислоте, либо обработкой раствора сульфата железа
Гидроксид цинка Zn(OH)2. В кристаллическом состоянии существует в виде пяти модификаций, из которых при комнатной температуре только e-Zn(ОН)2 устойчива
Гидрокси́д алюми́ния Al(OH)3 (а также H3AlO3 и HAlO2) — соединение алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты.
сульфат натрия Na2SО4.
Карбонат калия (углекислый калий, поташ) K2CO3 – средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде
Ответ от Грустный ангел[гуру]
незнаююююююююююю
Ответ от Mistika[эксперт]
Гидроксид меди: Сu(ОН)2
Соляная кислота: HCL2
Раствор сульфата железа: Fe(OH)SO4
ГИДРОКСИД ЦИНКА: Zn(OH)2
Гидроксид алюминия: Аl(ОН)3
Хлорид натрия: NaCl
Раствор сульфата натрия: Na2SO4
Карбонат калия: К2СО3
Ответ от Дарья Петровская[мастер]
Cu(OH)2;HCl;FeSO4;Zn(OH)2;Al(OH)3;NaCl;Na2SO4;K2CO3
Цифры ставятся как нижний индекс предшевствующих букв.
Ответ от Gin[гуру]
Гидроксид меди(II) Сu(ОН)2
соляная кислота HCl
раствор сульфата железа FeSO4
ГИДРОКСИД ЦИНКА Zn(OH)2
гидроксид алюминич Al(OH)
хлорид натрия NaCl
раствор сульфата натрия Na2 SO4
карбонат калия K2CO3
Ответ от Комсомолка[гуру]
)) если бы ты у меня спросила это лет так 7 назад, я бы тебя по химии в МГУ подготовила …а сейчас мозги не те.
Всё, что помню : 1) Cu(OH)2, 2) H2SO3 или H2CO3 или HCl 3) Fe2(SO)4 — может быть.. 4) Zn OH — не помню степени, 5) Al(OH)3
6) NaCl 7) Na2 SO4 или как-то так K2CO3 — спасибо за повод потренировать память 🙂
Ответ от Atlas[гуру]
УУУ, уж коль не знаешь настолько ЭЛЕМЕНТАРНЫХ вещей, тут уж ничего не поможет.
Ответ от Al Vin[гуру]
1)CU(OH)2 2)HCl 3)FeSO4 4)Zn(OH)2 5)Al2(OH)3 6) NaCl 7)Na2So4 K2CO3
Ответ от Пользователь удален[гуру]
Cu(OH)2 HCl FeSO4 Zn(OH)2 Al(OH)3 NaCl Na2SO4 K2CO3
Ответ от 3 ответа[гуру]
Привет! Вот подборка тем с похожими вопросами и ответами на Ваш вопрос: Химия: как пишется
Таймлесс 3 Изумрудная книга на Википедии
Посмотрите статью на википедии про Таймлесс 3 Изумрудная книга
Даша
Профи
(793),
закрыт
14 лет назад
Дмитрий Лысов
Профи
(793)
14 лет назад
Гидроксид меди(I) СuОН как индивидуальное соед. не получен. При взаимод. солей Сu(I) с щелочами в р-ре образуется гидратированный оксид Сu2О.xН2О
Гидроксид меди (II) Cu(OH)2 – вещество голубого цвета, существует в аморфной и кристаллической формах, кристаллическая решетка ромбическая, плотность 3,37
Хлористоводородная кислота, HCl, сильная одноосновная кислота, раствор хлористого водорода в воде. Соляная кислота — бесцветная жидкость с острым запахом
Сульфат железа (II) FeSO4. Токсичные, очень гигроскопичные парамагнитные …железа в разбавленной азотной кислоте, либо обработкой раствора сульфата железа
Гидроксид цинка Zn(OH)2. В кристаллическом состоянии существует в виде пяти модификаций, из которых при комнатной температуре только e-Zn(ОН)2 устойчива
Гидрокси́д алюми́ния Al(OH)3 (а также H3AlO3 и HAlO2) — соединение алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты.
сульфат натрия Na2SО4.
Карбонат калия (углекислый калий, поташ) K2CO3 – средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде
Комсомолка
Мастер
(1731)
14 лет назад
))) если бы ты у меня спросила это лет так 7 назад, я бы тебя по химии в МГУ подготовила …а сейчас мозги не те.
Всё, что помню : 1) Cu(OH)2, 2) H2SO3 или H2CO3 или HCl 3) Fe2(SO)4 — может быть.. 4) Zn OH — не помню степени, 5) Al(OH)3
6) NaCl 7) Na2 SO4 или как-то так K2CO3 — спасибо за повод потренировать память
КомсомолкаМастер (1731)
14 лет назад
Ух ты…пока писала — уже другие ответили.. не ожидала , что мало ошибок сделаю ..Мастерство , видать, не пропьешь. Яж ведь на инженера САПР отучилась5 лет..химия мне была вообще никаким боком ))))
mistika
Профи
(748)
14 лет назад
Гидроксид меди: Сu(ОН)2
Соляная кислота: HCL2
Раствор сульфата железа: Fe(OH)SO4
ГИДРОКСИД ЦИНКА: Zn(OH)2
Гидроксид алюминия: Аl(ОН)3
Хлорид натрия: NaCl
Раствор сульфата натрия: Na2SO4
Карбонат калия: К2СО3
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Цинка сульфат
- Брутто формула
- Фармакологическая группа вещества Цинка сульфат
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Цинка сульфат
- Противопоказания
- Побочные действия вещества Цинка сульфат
- Передозировка
- Способ применения и дозы
- Торговые названия с действующим веществом Цинка сульфат
Структурная формула
Русское название
Цинка сульфат
Английское название
Zinc sulfate
Латинское название вещества Цинка сульфат
Zinci sulfas (род. Zinci sulfatis)
Фармакологическая группа вещества Цинка сульфат
Фармакологическое действие
—
антисептическое, вяжущее, иммуномодулирующее, подсушивающее.
Характеристика
Бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса, без запаха. На воздухе выветривается. Очень легко растворим в воде, практически нерастворим в этаноле, медленно растворим в глицерине (1:10). Водные растворы имеют кислую реакцию.
Фармакология
Ионы цинка коагулируют белки с образованием альбуминатов. В зависимости от глубины проникновения развивается подсушивающий, вяжущий и раздражающий эффекты, последний обусловливает рвоту (раздражение соответствующих зон слизистой желудка и рефлекторное возбуждение рвотного центра). Противомикробная активность является следствием коагуляции белков микроорганизмов. В микроколичествах резорбируется и субстратно стимулирует ряд ферментных систем — щелочную фосфатазу, АПФ, алкогольдегидрогеназу, супероксиддисмутазу, карбоангидразу и др.
Применение вещества Цинка сульфат
Конъюнктивит, ларингит, уретрит, вагинит — местно; необходимость вызывания рвоты — внутрь в высоких дозах; дефицит цинка в организме с нарушениями анаболических, иммунологических и др. процессов (профилактика и лечение) — внутрь; гипогонадизм, гнездное облысение, детский церебральный паралич, заболевания печени, сахарный диабет, диффузные болезни соединительной ткани и др. (в составе комплексной терапии) — внутрь.
Противопоказания
Гиперчувствительность.
Побочные действия вещества Цинка сульфат
Тошнота, рвота, диарея (при приеме высоких доз внутрь).
Передозировка
Лихорадка, нарушения функции легких, дегидратация, дисбаланс электролитов в плазме, летаргия, расстройства мышечных движений, почечная недостаточность.
Способ применения и дозы
Местно. При конъюнктивитах — глазные капли 0,1–0,5%, при ларингите — смазывание или пульверизация 0,25–0,5% раствором, при уретритах и вагинитах — спринцевания 0,1–0,5% раствором.
Внутрь. Для профилактики гипоцинкемии — 10–15 мг в сутки (физиологическая потребность организма в цинке), с лечебной целью — 20–50 мг 2–3 раза в день, в качестве рвотного средства — 100–300 мг однократно.
Торговые названия с действующим веществом Цинка сульфат
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Цинктерал |
1112.00 |
| Цинктерал®-Тева |
от 291.00 до 1384.00 |
Сульфат цинка, 7-водный ГОСТ 4174-77
ZnSO4·7H2O
Сульфат цинка, сернокислый цинк, ZnSO4 — цинковая соль серной кислоты.
Бесцветные кристаллы, плотность 3,74 г/см³. Растворимость в воде (%): 29,4 (0 °C), 37,7 (99 °C). Из растворов при температуре ниже 38,8 °C кристаллизуется ZnSO4·7H2O (цинковый купорос), в пределах от 38,8 °C до 70 °C — ZnSO4·6H2O, выше 70 °C образуется моногидрат ZnSO4·H2O. Последний обезвоживается при 238 °C. Сульфат цинка в интервале 600—900 °C разлагается на ZnO и SO3. Слабые растворы сульфата цинка мутнеют при гидролизе вследствие выделения осадка 3Zn(OH)2·ZnSO4·4H2O.
| Физические свойства | |
|---|---|
| Молярная масса |
161.47 г/моль |
| Плотность |
3.8 г/см³ |
| Термические свойства | |
| Т. плав. |
680 °C |
| Т. кип. |
740 °C |
| Химические свойства | |
| Растворимость в воде |
22 г/100 мл |
ЦИНКА СУЛЬФАТ
ZnSO4, бесцв. кристаллы ромбич. сингонии (а = 0,6731 нм, b =0,8581 нм, с =0,4760 нм, z = 4, пространств. группа Рпта); плотн. 3,54 г/см 3;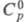
ЦИНКА СУЛЬФИД →← ЦИНКА СПЛАВЫ
Смотреть что такое ЦИНКА СУЛЬФАТ в других словарях:
ЦИНКА СУЛЬФАТ
сернокислый цинк, ZnSO4, бесцветные кристаллы, плотность 3,74 г/см3. Растворимость в воде (%): 29,4 (0 °С), 37,7 (99 °С). Из растворов при темп… смотреть
ЦИНКА СУЛЬФАТ
ЦИНКА СУЛЬФАТ, сернокислый цинк,
ZnSO4, бесцветные кристаллы, плотность 3.74 г/см3.
Растворимость
в воде (% ): 29,4 (О °С), 37,7 (99 °С). Из раствор… смотреть
ЦИНКА СУЛЬФАТ
ЦИНКА СУЛЬФАТ. Zinci suifas.Синонимы: сульфат цинка,сернокислый цинк.Свойства.Бесцветные,прозрачные,призматические кристаллы или мелкокристаллический п… смотреть
ЦИНКА СУЛЬФАТ
ЦИНКА СУЛЬФАТ (Zinci sulfas).
Синоним: Zincum sulfuricum.
Бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса, без запаха. Очень легко растворим в воде, нерастворим в спирте. Водные растворы имеют кислую реакцию.
Применяют как антисептическое и вяжущее средство при конъюнктивитах (глазные капли О, 1 — 0, 25 — 0, 5 %), хроническом катаральном ларингите (смазывание или пульверизация 0, 25 — 0, 5 % раствором), для спринцеваний при уретритах и вагинитах (0, 1 — 0, 5 %).
В редких случаях цинка сульфат назначают внутрь как рвотное (О, 1 0, 3 г на прием). Рвота при введении внутрь цинка сульфата имеет рефлекторный характер. Она не устраняется при разрушении пусковой зоны. (см. Рвотные и противорвотные препараты).
В ы с ш а я р а з о в а я д о з а для взрослых внутрь (как рвотное) — 1 г (однократно).
При гнездном облысении у детей назначают цинка сульфат внутрь по 0, 02 — 0, 05 г 2 — 3 раза в день (после еды), но в связи с плохой переносимостью (тошнота, тяжесть в надчревной области и др.) переходят на применение цинка окиси.
Формы выпуска: порошок; глазные капли (0, 25 % или 0, 5 % раствор цинка сульфата и кислоты борной 2 %) во 10 мл в стеклянных флаконах; выпускается также в виде глазных капель в полиэтиленовых тюбиках-капельницах (по 1, 5 мл в упаковке по 2 тюбика).
Хранение: список Б. В хорошо укупоренной таре.
Rp.: Sol. Zinci sulfatis 0, 25% 10 ml
D.S. Глазные капли; по 2 капли 2 раза в день
Rp.: Sol. Zinci sulfatis 0, 25 %
Sol. Ac. borici 2 %
D.S. Глазные капли; по 1 — 2 капли в глаз 2 раза в день (в тюбиках-капельницах по 1, 5 мл)… смотреть
ЦИНКА СУЛЬФАТ
ци́нка сульфа́т (Zinci sulfas; ФХ), антисептическое, вяжущее и противовоспалительное средство. Бесцветные прозрачные кристаллы или мелкокристаллический… смотреть
ЦИНКА СУЛЬФАТ
сернокислый цинк, ZnSO4, цинковое микроудобрение. Бесцветное кристаллич. в-во, растворимое в воде, содержит 21,8—22,5% Zn. Получают выпариванием и крис… смотреть
ЦИНКА СУЛЬФАТ
ЦИНКА СУЛЬФАТ (сернокислый цинк), ZnSO4, бесцветные кристаллы. Растворяется в воде. Из растворов кристаллизуется ZnSO4 · 7H2O — цинковый купорос. Применяют в производстве вискозы, глазурей, для защиты древесины от гниения.<br><br><br>… смотреть
ЦИНКА СУЛЬФАТ
ЦИНКА СУЛЬФАТ (сернокислый цинк) — ZnSO4, бесцветные кристаллы. Растворяется в воде. Из растворов кристаллизуется ZnSO4 . 7H2O — цинковый купорос. Применяют в производстве вискозы, глазурей, для защиты древесины от гниения.<br>… смотреть
ЦИНКА СУЛЬФАТ
ZnSO4, бесцв. кристаллы. Растворяется в воде. Из р-ров кристаллизуется ZnSO4*7H2O — цинковый купорос. Применяют в произ-ве вискозы, глазурей, для защит… смотреть
ЦИНКА СУЛЬФАТ
— (сернокислый цинк) — ZnSO4, бесцветные кристаллы.Растворяется в воде. Из растворов кристаллизуется ZnSO4 . 7H2O — цинковыйкупорос. Применяют в производстве вискозы, глазурей, для защиты древесиныот гниения…. смотреть
ЦИНКА СУЛЬФАТ
(zinc sulphate) препарат, применяющийся для лечения заболеваний, связанных с дефицитом цинка в организме. Назначается внутрь. Торговые названия: солвацинк (Solvazinc), Z спан спансула (Z Span Spansule)…. смотреть
ЦИНКА СУЛЬФАТ (ZINC SULPHATE)
препарат, применяющийся для лечения заболеваний, связанных с дефицитом цинка в организме. Назначается внутрь. Торговые названия: солвацинк (Solvazinc), Z спан спансула (Z Span Spansule).
Источник: «Медицинский словарь»… смотреть
ЦИНКА СУЛЬФАТ (СЕРНОКИСЛЫЙ ЦИНК)
ЦИНКА СУЛЬФАТ (сернокислый цинк), ZnSO4, бесцветные кристаллы. Растворяется в воде. Из растворов кристаллизуется ZnSO4 · 7H2O — цинковый купорос. Применяют в производстве вискозы, глазурей, для защиты древесины от гниения…. смотреть
ЦИНКА СУЛЬФАТ (СЕРНОКИСЛЫЙ ЦИНК)
ЦИНКА СУЛЬФАТ (сернокислый цинк) , ZnSO4, бесцветные кристаллы. Растворяется в воде. Из растворов кристаллизуется ZnSO4 · 7H2O — цинковый купорос. Применяют в производстве вискозы, глазурей, для защиты древесины от гниения…. смотреть



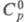 99,14 Дж/(моль x К);
99,14 Дж/(моль x К);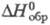 -982,01 кДж/моль;
-982,01 кДж/моль;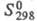 110,62 Дж/(моль x К); при нагр. до 600-800
110,62 Дж/(моль x К); при нагр. до 600-800 