From Wikipedia, the free encyclopedia

Crystals of CuSO4·5H2O |
|

Portion of the structure of the pentahydrate Cu(H2O)2+4 centers) |
|

Unit cell of the crystal structure of CuSO4·5H2O |
|
| Names | |
|---|---|
| IUPAC name
Copper(II) sulfate |
|
Other names
Copper Sulphate pentahydrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.952 |
| EC Number |
|
|
Gmelin Reference |
8294 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CuSO4 (anhydrous) CuSO4·5H2O (pentahydrate) |
| Molar mass | 159.60 g/mol (anhydrous)[2] 249.685 g/mol (pentahydrate)[2] |
| Appearance | gray-white (anhydrous) blue (pentahydrate) |
| Density | 3.60 g/cm3 (anhydrous)[2] 2.286 g/cm3 (pentahydrate)[2] |
| Melting point | 110 °C (230 °F; 383 K) decomposes
560 °C decomposes[2](pentahydrate) Fully decomposes at 590 °C (anhydrous) |
| Boiling point | decomposes to cupric oxide at 650 °C |
|
Solubility in water |
1.055 molal (10 °C) 1.26 molal (20 °C) 1.502 molal (30 °C)[3] |
| Solubility | anhydrous insoluble in ethanol[2] pentahydrate |
|
Magnetic susceptibility (χ) |
1330·10−6 cm3/mol |
|
Refractive index (nD) |
1.724–1.739 (anhydrous)[4] 1.514–1.544 (pentahydrate)[5] |
| Structure | |
|
Crystal structure |
Orthorhombic (anhydrous, chalcocyanite), space group Pnma, oP24, a = 0.839 nm, b = 0.669 nm, c = 0.483 nm.[6] Triclinic (pentahydrate), space group P1, aP22, a = 0.5986 nm, b = 0.6141 nm, c = 1.0736 nm, α = 77.333°, β = 82.267°, γ = 72.567°[7] |
| Thermochemistry | |
|
Std molar |
5 J/(K·mol) |
|
Std enthalpy of |
−769.98 kJ/mol |
| Pharmacology | |
|
ATC code |
V03AB20 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
| NFPA 704 (fire diamond) |
2 0 1 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
300 mg/kg (oral, rat)[9]
87 mg/kg (oral, mouse) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[8] |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[8] |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[8] |
| Safety data sheet (SDS) | anhydrous pentahydrate |
| Related compounds | |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Copper(II) sulfate, also known as copper sulphate, is an inorganic compound with the chemical formula CuSO4. It forms hydrates CuSO4·nH2O, where n can range from 1 to 7. The pentahydrate (n = 5), a bright blue crystal, is the most commonly encountered hydrate of copper(II) sulfate. Older names for the pentahydrate include blue vitriol, bluestone,[10] vitriol of copper,[11] and Roman vitriol.[12] It exothermically dissolves in water to give the aquo complex [Cu(H2O)6]2+, which has octahedral molecular geometry. The structure of the solid pentahydrate reveals a polymeric structure wherein copper is again octahedral but bound to four water ligands. The Cu(II)(H2O)4 centers are interconnected by sulfate anions to form chains.[13] Anhydrous copper sulfate is a light grey powder.
Preparation and occurrence[edit]
Preparation of copper(II) sulfate by electrolyzing sulfuric acid, using copper electrodes
Copper sulfate is produced industrially by treating copper metal with hot concentrated sulfuric acid or copper oxides with dilute sulfuric acid. For laboratory use, copper sulfate is usually purchased. Copper sulfate can also be produced by slowly leaching low-grade copper ore in air; bacteria may be used to hasten the process.[14]
Commercial copper sulfate is usually about 98% pure copper sulfate, and may contain traces of water. Anhydrous copper sulfate is 39.81 percent copper and 60.19 percent sulfate by mass, and in its blue, hydrous form, it is 25.47% copper, 38.47% sulfate (12.82% sulfur) and 36.06% water by mass. Four types of crystal size are provided based on its usage: large crystals (10–40 mm), small crystals (2–10 mm), snow crystals (less than 2 mm), and windswept powder (less than 0.15 mm).[14]
Chemical properties[edit]
Copper(II) sulfate pentahydrate decomposes before melting. It loses two water molecules upon heating at 63 °C (145 °F), followed by two more at 109 °C (228 °F) and the final water molecule at 200 °C (392 °F).[15][16]
The chemistry of aqueous copper sulfate is simply that of copper aquo complex, since the sulfate is not bound to copper in such solutions. Thus, such solutions react with concentrated hydrochloric acid to give tetrachlorocuprate(II):
- Cu2+ + 4 Cl− → [CuCl4]2−
Similarly treatment of such solutions with zinc gives metallic copper, as described by this simplified equation:[17]
- CuSO4 + Zn → Cu + ZnSO4
A further illustration of such «single metal replacement reactions» occurs when a piece of iron is submerged in a solution of copper sulfate:
- Fe + CuSO4 → FeSO4 + Cu
In high school and general chemistry education, copper sulfate is used as an electrolyte for galvanic cells, usually as a cathode solution. For example, in a zinc/copper cell, copper ion in copper sulfate solution absorbs electron from zinc and forms metallic copper.[18]
- Cu2+ + 2e− → Cu (cathode), E°cell = 0.34 V
Copper sulfate is commonly included in teenager chemistry sets and undergraduate experiments.[19] It is often used to grow crystals in schools and in copper plating experiments, despite its toxicity. Copper sulfate is often used to demonstrate an exothermic reaction, in which steel wool or magnesium ribbon is placed in an aqueous solution of CuSO4. It is used to demonstrate the principle of mineral hydration. The pentahydrate form, which is blue, is heated, turning the copper sulfate into the anhydrous form which is white, while the water that was present in the pentahydrate form evaporates. When water is then added to the anhydrous compound, it turns back into the pentahydrate form, regaining its blue color.[20] Copper(II) sulfate pentahydrate can easily be produced by crystallization from solution as copper(II) sulfate, which is hygroscopic.
Uses[edit]
As a fungicide and herbicide[edit]
Copper sulfate has been used for control of algae in lakes and related fresh waters subject to eutrophication. It «remains the most effective algicidal treatment».[21][22]
Bordeaux mixture, a suspension of copper(II) sulfate (CuSO4) and calcium hydroxide (Ca(OH)2), is used to control fungus on grapes, melons, and other berries.[23] It is produced by mixing a water solution of copper sulfate and a suspension of slaked lime.
A dilute solution of copper sulfate is used to treat aquarium fishes for parasitic infections,[24] and is also used to remove snails from aquariums and zebra mussels from water pipes.[25] Copper ions are highly toxic to fish, however. Most species of algae can be controlled with very low concentrations of copper sulfate.
Analytical reagent[edit]
Several chemical tests utilize copper sulfate. It is used in Fehling’s solution and Benedict’s solution to test for reducing sugars, which reduce the soluble blue copper(II) sulfate to insoluble red copper(I) oxide. Copper(II) sulfate is also used in the Biuret reagent to test for proteins.
Copper sulfate is used to test blood for anemia. The blood is dropped into a solution of copper sulfate of known specific gravity—blood with sufficient hemoglobin sinks rapidly due to its density, whereas blood which sinks slowly or not at all has an insufficient amount of hemoglobin.[26] Clincally relevant, however, modern laboratories utilize automated blood analyzers for accurate quantitative hemoglobin determinations, as opposed to older qualitative means.[citation needed]
In a flame test, the copper ions of copper sulfate emit a deep green light, a much deeper green than the flame test for barium.
Organic synthesis[edit]
Copper sulfate is employed at a limited level in organic synthesis.[27] The anhydrous salt is used as a dehydrating agent for forming and manipulating acetal groups.[28] The hydrated salt can be intimately mingled with potassium permanganate to give an oxidant for the conversion of primary alcohols.[29]
Rayon production[edit]
Reaction with ammonium hydroxide yields tetraamminecopper(II) sulfate or Schweizer’s reagent which was used to dissolve cellulose in the industrial production of Rayon.
Niche uses[edit]
Copper(II) sulfate has attracted many niche applications over the centuries. In industry copper sulfate has multiple applications. In printing it is an additive to book-binding pastes and glues to protect paper from insect bites; in building it is used as an additive to concrete to improve water resistance and discourage anything from growing on it. Copper sulfate can be used as a coloring ingredient in artworks, especially glasses and potteries.[30] Copper sulfate is also used in firework manufacture as a blue coloring agent, but it is not safe to mix copper sulfate with chlorates when mixing firework powders.[31]
Lowering a copper etching plate into the copper sulfate solution
Copper sulfate was once used to kill bromeliads, which serve as mosquito breeding sites.[32] Copper sulfate is used as a molluscicide to treat bilharzia in tropical countries.[30]
- Art
In 2008, the artist Roger Hiorns filled an abandoned waterproofed council flat in London with 75,000 liters of copper(II) sulfate water solution. The solution was left to crystallize for several weeks before the flat was drained, leaving crystal-covered walls, floors and ceilings. The work is titled Seizure.[33] Since 2011, it has been on exhibition at the Yorkshire Sculpture Park.[34]
- Etching
Copper(II) sulfate is used to etch zinc or copper plates for intaglio printmaking.[35][36]
It is also used to etch designs into copper for jewelry, such as for Champlevé.[37]
- Dyeing
Copper(II) sulfate can be used as a mordant in vegetable dyeing. It often highlights the green tints of the specific dyes.[citation needed]
- Electronics
An aqueous solution of copper(II) sulfate is often used as the resistive element in liquid resistors.[citation needed]
Other forms of copper sulfate[edit]
Anhydrous copper(II) sulfate can be produced by dehydration of the commonly available pentahydrate copper sulfate. In nature, it is found as the very rare mineral known as chalcocyanite.[38] The pentahydrate also occurs in nature as chalcanthite. Other rare copper sulfate minerals include bonattite (trihydrate),[39] boothite (heptahydrate),[40] and the monohydrate compound poitevinite.[41][42] There are numerous other, more complex, copper(II) sulfate minerals known, with environmentally important basic copper(II) sulfates like langite and posnjakite.[42][43][44]
Forms of copper(II) sulfate
-
Anhydrous CuSO4
-
Copper(II) sulfate monohydrate
-
Copper(II) sulfate pentahydrate
-
The rare mineral boothite (CuSO4·7H2O)
Toxicological effects[edit]
Copper(II) salts have an LD50 of 100 mg/kg.[45][46] It is harmless enough to be a routine component of high school experiments and to be used widely in swimming lakes to control algae.
Copper(II) sulfate was used in the past as an emetic.[47] It is now considered too toxic for this use.[48] It is still listed as an antidote in the World Health Organization’s Anatomical Therapeutic Chemical Classification System.[49]
See also[edit]
- Chalcanthum
- Vitriol
References[edit]
- ^ Varghese, J. N.; Maslen, E. N. (1985). «Electron density in non-ideal metal complexes. I. Copper sulphate pentahydrate». Acta Crystallogr. B. 41: 184–190. doi:10.1107/S0108768185001914.
- ^ a b c d e f g Haynes, p. 4.62
- ^ Haynes, p. 5.199
- ^ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C., eds. (2003). «Chalcocyanite» (PDF). Handbook of Mineralogy. Vol. V. Borates, Carbonates, Sulfates. Chantilly, VA, US: Mineralogical Society of America. ISBN 978-0962209741.
- ^ Haynes, p. 10.240
- ^ Kokkoros, P. A.; Rentzeperis, P. J. (1958). «The crystal structure of the anhydrous sulphates of copper and zinc». Acta Crystallographica. 11 (5): 361–364. doi:10.1107/S0365110X58000955.
- ^ Bacon, G. E.; Titterton, D. H. (1975). «Neutron-diffraction studies of CuSO4 · 5H2O and CuSO4 · 5D2O». Z. Kristallogr. 141 (5–6): 330–341. Bibcode:1975ZK….141..330B. doi:10.1524/zkri.1975.141.5-6.330.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Cupric sulfate. US National Institutes of Health
- ^ «Copper (II) sulfate MSDS». Oxford University. Archived from the original on 2007-10-11. Retrieved 2007-12-31.
- ^ Antoine-François de Fourcroy, tr. by Robert Heron (1796) «Elements of Chemistry, and Natural History: To which is Prefixed the Philosophy of Chemistry». J. Murray and others, Edinburgh. Page 348.
- ^ Oxford University Press, «Roman vitriol», Oxford Living Dictionaries. Accessed on 2016-11-13
- ^ Ting, V. P.; Henry, P. F.; Schmidtmann, M.; Wilson, C. C.; Weller, M. T. (2009). «In situ neutron powder diffraction and structure determination in controlled humidities». Chem. Commun. 2009 (48): 7527–7529. doi:10.1039/B918702B. PMID 20024268.
- ^ a b «Uses of Copper Compounds: Copper Sulphate». copper.org. Copper Development Association Inc. Retrieved 10 May 2015.
- ^ Andrew Knox Galwey; Michael E. Green (1999). Thermal decomposition of ionic solids. Elsevier. pp. 228–229. ISBN 978-0-444-82437-0.
- ^ Wiberg, Egon; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. p. 1263. ISBN 978-0-12-352651-9.
- ^ Ray Q. Brewster, Theodore Groening (1934). «P-Nitrophenyl Ether». Organic Syntheses. 14: 66. doi:10.15227/orgsyn.014.0066.
- ^ Zumdahl, Steven; DeCoste, Donald (2013). Chemical Principles. Cengage Learning. pp. 506–507. ISBN 978-1-285-13370-6.
- ^ Rodríguez, Emilio; Vicente, Miguel Angel (2002). «A Copper-Sulfate-Based Inorganic Chemistry Laboratory for First-Year University Students That Teaches Basic Operations and Concepts». Journal of Chemical Education. 79 (4): 486. Bibcode:2002JChEd..79..486R. doi:10.1021/ed079p486.
- ^ «Process for the preparation of stable copper(II) sulfate monohydrate applicable as trace element additive in animal fodders». Retrieved 2009-07-07.
- ^ Van Hullebusch, E.; Chatenet, P.; Deluchat, V.; Chazal, P. M.; Froissard, D.; Lens, P. N.L.; Baudu, M. (2003). «Fate and forms of Cu in a reservoir ecosystem following copper sulfate treatment (Saint Germain les Belles, France)». Journal de Physique IV (Proceedings). 107: 1333–1336. doi:10.1051/jp4:20030547.
- ^ Haughey, M. (2000). «Forms and fate of Cu in a source drinking water reservoir following CuSO4 treatment». Water Research. 34 (13): 3440–3452. doi:10.1016/S0043-1354(00)00054-3.
- ^ Martin, Hubert (1933). «Uses of Copper Compounds: Copper Sulfate’s Role in Agriculture». Annals of Applied Biology. 20 (2): 342–363. doi:10.1111/j.1744-7348.1933.tb07770.x. Retrieved 2007-12-31.
- ^ «All About Copper Sulfate». National Fish Pharmaceuticals. Retrieved 2007-12-31.
- ^ «With Zebra mussels here to stay, Austin has a plan to avoid stinky drinking water». KXAN Austin. 2020-10-26. Retrieved 2020-10-28.
- ^ Estridge, Barbara H.; Anna P. Reynolds; Norma J. Walters (2000). Basic Medical Laboratory Techniques. Thomson Delmar Learning. p. 166. ISBN 978-0-7668-1206-2.
- ^ Hoffman, R. V. (2001). «Copper(II) Sulfate». Copper(II) Sulfate, in Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rc247. ISBN 978-0471936237.
- ^ Philip J. Kocienski (2005). Protecting Groups. Thieme. p. 58. ISBN 978-1-58890-376-1.
- ^ Jefford, C. W.; Li, Y.; Wang, Y. «A Selective, Heterogeneous Oxidation using a Mixture of Potassium Permanganate and Cupric Sulfate: (3aS,7aR)-Hexahydro-(3S,6R)-Dimethyl-2(3H)-Benzofuranone». Organic Syntheses.; Collective Volume, vol. 9, p. 462
- ^ a b Copper Development Association. «Uses of Copper Compounds: Table A — Uses of Copper Sulphate». copper. Copper Development Association Inc. Retrieved 12 May 2015.
- ^ Partin, Lee. «The Blues: Part 2». skylighter. Skylighter.Inc. Archived from the original on 21 December 2010. Retrieved 12 May 2015.
- ^ Despommier; Gwadz; Hotez; Knirsch (June 2005). Parasitic Disease (5 ed.). NY: Apple Tree Production L.L.C. pp. Section 4.2. ISBN 978-0970002778. Retrieved 12 May 2015.
- ^ «Seizure». Artangel.org.uk. Retrieved 2021-10-05.
- ^ «Roger Hiorns: Seizure». Yorkshire Sculpture Park. Archived from the original on 2015-02-22. Retrieved 2015-02-22.
- ^ greenart.info, Bordeau etch, 2009-01-18, retrieved 2011-06-02.
- ^ ndiprintmaking.ca, The Chemistry of using Copper Sulfate Mordant, 2009-04-12, retrieved 2011-06-02.
- ^ http://mordent.com/etch-howto/, How to Electrolytically etch in copper, brass, steel, nickel silver or silver, retrieved 2015-05-2015.
- ^ «Chalcocyanite». www.mindat.org.
- ^ «Bonattite». www.mindat.org.
- ^ «Boothite». www.mindat.org.
- ^ «Poitevinite». www.mindat.org.
- ^ a b «List of Minerals». www.ima-mineralogy.org. March 21, 2011.
- ^ «Langite». www.mindat.org.
- ^ «Posnjakite». www.mindat.org.
- ^ Windholz, M., ed. 1983. The Merck Index. Tenth edition. Rahway, NJ: Merck and Company.
- ^ Guidance for reregistration of pesticide products containing copper sulfate. Fact sheet no. 100., Washington, DC: U.S. Environmental Protection Agency, Office of Pesticide Programs, 1986
- ^ Holtzmann, N. A.; Haslam, R. H. (July 1968). «Elevation of serum copper following copper sulfate as an emetic». Pediatrics. 42 (1): 189–93. doi:10.1542/peds.42.1.189. PMID 4385403. S2CID 32740524.
- ^ Olson, Kent C. (2004). Poisoning & drug overdose. New York: Lange Medical Mooks/McGraw-Hill. p. 175. ISBN 978-0-8385-8172-8.
- ^ V03AB20 (WHO)
Bibliography[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. ISBN 978-1439855119.
External links[edit]
Media related to Copper(II) sulfate at Wikimedia Commons
- International Chemical Safety Card 0751
- International Chemical Safety Card 1416
- National Pollutant Inventory – Copper and compounds fact sheet
From Wikipedia, the free encyclopedia

Crystals of CuSO4·5H2O |
|

Portion of the structure of the pentahydrate Cu(H2O)2+4 centers) |
|

Unit cell of the crystal structure of CuSO4·5H2O |
|
| Names | |
|---|---|
| IUPAC name
Copper(II) sulfate |
|
Other names
Copper Sulphate pentahydrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.952 |
| EC Number |
|
|
Gmelin Reference |
8294 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CuSO4 (anhydrous) CuSO4·5H2O (pentahydrate) |
| Molar mass | 159.60 g/mol (anhydrous)[2] 249.685 g/mol (pentahydrate)[2] |
| Appearance | gray-white (anhydrous) blue (pentahydrate) |
| Density | 3.60 g/cm3 (anhydrous)[2] 2.286 g/cm3 (pentahydrate)[2] |
| Melting point | 110 °C (230 °F; 383 K) decomposes
560 °C decomposes[2](pentahydrate) Fully decomposes at 590 °C (anhydrous) |
| Boiling point | decomposes to cupric oxide at 650 °C |
|
Solubility in water |
1.055 molal (10 °C) 1.26 molal (20 °C) 1.502 molal (30 °C)[3] |
| Solubility | anhydrous insoluble in ethanol[2] pentahydrate |
|
Magnetic susceptibility (χ) |
1330·10−6 cm3/mol |
|
Refractive index (nD) |
1.724–1.739 (anhydrous)[4] 1.514–1.544 (pentahydrate)[5] |
| Structure | |
|
Crystal structure |
Orthorhombic (anhydrous, chalcocyanite), space group Pnma, oP24, a = 0.839 nm, b = 0.669 nm, c = 0.483 nm.[6] Triclinic (pentahydrate), space group P1, aP22, a = 0.5986 nm, b = 0.6141 nm, c = 1.0736 nm, α = 77.333°, β = 82.267°, γ = 72.567°[7] |
| Thermochemistry | |
|
Std molar |
5 J/(K·mol) |
|
Std enthalpy of |
−769.98 kJ/mol |
| Pharmacology | |
|
ATC code |
V03AB20 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
| NFPA 704 (fire diamond) |
2 0 1 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
300 mg/kg (oral, rat)[9]
87 mg/kg (oral, mouse) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[8] |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[8] |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[8] |
| Safety data sheet (SDS) | anhydrous pentahydrate |
| Related compounds | |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Copper(II) sulfate, also known as copper sulphate, is an inorganic compound with the chemical formula CuSO4. It forms hydrates CuSO4·nH2O, where n can range from 1 to 7. The pentahydrate (n = 5), a bright blue crystal, is the most commonly encountered hydrate of copper(II) sulfate. Older names for the pentahydrate include blue vitriol, bluestone,[10] vitriol of copper,[11] and Roman vitriol.[12] It exothermically dissolves in water to give the aquo complex [Cu(H2O)6]2+, which has octahedral molecular geometry. The structure of the solid pentahydrate reveals a polymeric structure wherein copper is again octahedral but bound to four water ligands. The Cu(II)(H2O)4 centers are interconnected by sulfate anions to form chains.[13] Anhydrous copper sulfate is a light grey powder.
Preparation and occurrence[edit]
Preparation of copper(II) sulfate by electrolyzing sulfuric acid, using copper electrodes
Copper sulfate is produced industrially by treating copper metal with hot concentrated sulfuric acid or copper oxides with dilute sulfuric acid. For laboratory use, copper sulfate is usually purchased. Copper sulfate can also be produced by slowly leaching low-grade copper ore in air; bacteria may be used to hasten the process.[14]
Commercial copper sulfate is usually about 98% pure copper sulfate, and may contain traces of water. Anhydrous copper sulfate is 39.81 percent copper and 60.19 percent sulfate by mass, and in its blue, hydrous form, it is 25.47% copper, 38.47% sulfate (12.82% sulfur) and 36.06% water by mass. Four types of crystal size are provided based on its usage: large crystals (10–40 mm), small crystals (2–10 mm), snow crystals (less than 2 mm), and windswept powder (less than 0.15 mm).[14]
Chemical properties[edit]
Copper(II) sulfate pentahydrate decomposes before melting. It loses two water molecules upon heating at 63 °C (145 °F), followed by two more at 109 °C (228 °F) and the final water molecule at 200 °C (392 °F).[15][16]
The chemistry of aqueous copper sulfate is simply that of copper aquo complex, since the sulfate is not bound to copper in such solutions. Thus, such solutions react with concentrated hydrochloric acid to give tetrachlorocuprate(II):
- Cu2+ + 4 Cl− → [CuCl4]2−
Similarly treatment of such solutions with zinc gives metallic copper, as described by this simplified equation:[17]
- CuSO4 + Zn → Cu + ZnSO4
A further illustration of such «single metal replacement reactions» occurs when a piece of iron is submerged in a solution of copper sulfate:
- Fe + CuSO4 → FeSO4 + Cu
In high school and general chemistry education, copper sulfate is used as an electrolyte for galvanic cells, usually as a cathode solution. For example, in a zinc/copper cell, copper ion in copper sulfate solution absorbs electron from zinc and forms metallic copper.[18]
- Cu2+ + 2e− → Cu (cathode), E°cell = 0.34 V
Copper sulfate is commonly included in teenager chemistry sets and undergraduate experiments.[19] It is often used to grow crystals in schools and in copper plating experiments, despite its toxicity. Copper sulfate is often used to demonstrate an exothermic reaction, in which steel wool or magnesium ribbon is placed in an aqueous solution of CuSO4. It is used to demonstrate the principle of mineral hydration. The pentahydrate form, which is blue, is heated, turning the copper sulfate into the anhydrous form which is white, while the water that was present in the pentahydrate form evaporates. When water is then added to the anhydrous compound, it turns back into the pentahydrate form, regaining its blue color.[20] Copper(II) sulfate pentahydrate can easily be produced by crystallization from solution as copper(II) sulfate, which is hygroscopic.
Uses[edit]
As a fungicide and herbicide[edit]
Copper sulfate has been used for control of algae in lakes and related fresh waters subject to eutrophication. It «remains the most effective algicidal treatment».[21][22]
Bordeaux mixture, a suspension of copper(II) sulfate (CuSO4) and calcium hydroxide (Ca(OH)2), is used to control fungus on grapes, melons, and other berries.[23] It is produced by mixing a water solution of copper sulfate and a suspension of slaked lime.
A dilute solution of copper sulfate is used to treat aquarium fishes for parasitic infections,[24] and is also used to remove snails from aquariums and zebra mussels from water pipes.[25] Copper ions are highly toxic to fish, however. Most species of algae can be controlled with very low concentrations of copper sulfate.
Analytical reagent[edit]
Several chemical tests utilize copper sulfate. It is used in Fehling’s solution and Benedict’s solution to test for reducing sugars, which reduce the soluble blue copper(II) sulfate to insoluble red copper(I) oxide. Copper(II) sulfate is also used in the Biuret reagent to test for proteins.
Copper sulfate is used to test blood for anemia. The blood is dropped into a solution of copper sulfate of known specific gravity—blood with sufficient hemoglobin sinks rapidly due to its density, whereas blood which sinks slowly or not at all has an insufficient amount of hemoglobin.[26] Clincally relevant, however, modern laboratories utilize automated blood analyzers for accurate quantitative hemoglobin determinations, as opposed to older qualitative means.[citation needed]
In a flame test, the copper ions of copper sulfate emit a deep green light, a much deeper green than the flame test for barium.
Organic synthesis[edit]
Copper sulfate is employed at a limited level in organic synthesis.[27] The anhydrous salt is used as a dehydrating agent for forming and manipulating acetal groups.[28] The hydrated salt can be intimately mingled with potassium permanganate to give an oxidant for the conversion of primary alcohols.[29]
Rayon production[edit]
Reaction with ammonium hydroxide yields tetraamminecopper(II) sulfate or Schweizer’s reagent which was used to dissolve cellulose in the industrial production of Rayon.
Niche uses[edit]
Copper(II) sulfate has attracted many niche applications over the centuries. In industry copper sulfate has multiple applications. In printing it is an additive to book-binding pastes and glues to protect paper from insect bites; in building it is used as an additive to concrete to improve water resistance and discourage anything from growing on it. Copper sulfate can be used as a coloring ingredient in artworks, especially glasses and potteries.[30] Copper sulfate is also used in firework manufacture as a blue coloring agent, but it is not safe to mix copper sulfate with chlorates when mixing firework powders.[31]
Lowering a copper etching plate into the copper sulfate solution
Copper sulfate was once used to kill bromeliads, which serve as mosquito breeding sites.[32] Copper sulfate is used as a molluscicide to treat bilharzia in tropical countries.[30]
- Art
In 2008, the artist Roger Hiorns filled an abandoned waterproofed council flat in London with 75,000 liters of copper(II) sulfate water solution. The solution was left to crystallize for several weeks before the flat was drained, leaving crystal-covered walls, floors and ceilings. The work is titled Seizure.[33] Since 2011, it has been on exhibition at the Yorkshire Sculpture Park.[34]
- Etching
Copper(II) sulfate is used to etch zinc or copper plates for intaglio printmaking.[35][36]
It is also used to etch designs into copper for jewelry, such as for Champlevé.[37]
- Dyeing
Copper(II) sulfate can be used as a mordant in vegetable dyeing. It often highlights the green tints of the specific dyes.[citation needed]
- Electronics
An aqueous solution of copper(II) sulfate is often used as the resistive element in liquid resistors.[citation needed]
Other forms of copper sulfate[edit]
Anhydrous copper(II) sulfate can be produced by dehydration of the commonly available pentahydrate copper sulfate. In nature, it is found as the very rare mineral known as chalcocyanite.[38] The pentahydrate also occurs in nature as chalcanthite. Other rare copper sulfate minerals include bonattite (trihydrate),[39] boothite (heptahydrate),[40] and the monohydrate compound poitevinite.[41][42] There are numerous other, more complex, copper(II) sulfate minerals known, with environmentally important basic copper(II) sulfates like langite and posnjakite.[42][43][44]
Forms of copper(II) sulfate
-
Anhydrous CuSO4
-
Copper(II) sulfate monohydrate
-
Copper(II) sulfate pentahydrate
-
The rare mineral boothite (CuSO4·7H2O)
Toxicological effects[edit]
Copper(II) salts have an LD50 of 100 mg/kg.[45][46] It is harmless enough to be a routine component of high school experiments and to be used widely in swimming lakes to control algae.
Copper(II) sulfate was used in the past as an emetic.[47] It is now considered too toxic for this use.[48] It is still listed as an antidote in the World Health Organization’s Anatomical Therapeutic Chemical Classification System.[49]
See also[edit]
- Chalcanthum
- Vitriol
References[edit]
- ^ Varghese, J. N.; Maslen, E. N. (1985). «Electron density in non-ideal metal complexes. I. Copper sulphate pentahydrate». Acta Crystallogr. B. 41: 184–190. doi:10.1107/S0108768185001914.
- ^ a b c d e f g Haynes, p. 4.62
- ^ Haynes, p. 5.199
- ^ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C., eds. (2003). «Chalcocyanite» (PDF). Handbook of Mineralogy. Vol. V. Borates, Carbonates, Sulfates. Chantilly, VA, US: Mineralogical Society of America. ISBN 978-0962209741.
- ^ Haynes, p. 10.240
- ^ Kokkoros, P. A.; Rentzeperis, P. J. (1958). «The crystal structure of the anhydrous sulphates of copper and zinc». Acta Crystallographica. 11 (5): 361–364. doi:10.1107/S0365110X58000955.
- ^ Bacon, G. E.; Titterton, D. H. (1975). «Neutron-diffraction studies of CuSO4 · 5H2O and CuSO4 · 5D2O». Z. Kristallogr. 141 (5–6): 330–341. Bibcode:1975ZK….141..330B. doi:10.1524/zkri.1975.141.5-6.330.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Cupric sulfate. US National Institutes of Health
- ^ «Copper (II) sulfate MSDS». Oxford University. Archived from the original on 2007-10-11. Retrieved 2007-12-31.
- ^ Antoine-François de Fourcroy, tr. by Robert Heron (1796) «Elements of Chemistry, and Natural History: To which is Prefixed the Philosophy of Chemistry». J. Murray and others, Edinburgh. Page 348.
- ^ Oxford University Press, «Roman vitriol», Oxford Living Dictionaries. Accessed on 2016-11-13
- ^ Ting, V. P.; Henry, P. F.; Schmidtmann, M.; Wilson, C. C.; Weller, M. T. (2009). «In situ neutron powder diffraction and structure determination in controlled humidities». Chem. Commun. 2009 (48): 7527–7529. doi:10.1039/B918702B. PMID 20024268.
- ^ a b «Uses of Copper Compounds: Copper Sulphate». copper.org. Copper Development Association Inc. Retrieved 10 May 2015.
- ^ Andrew Knox Galwey; Michael E. Green (1999). Thermal decomposition of ionic solids. Elsevier. pp. 228–229. ISBN 978-0-444-82437-0.
- ^ Wiberg, Egon; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. p. 1263. ISBN 978-0-12-352651-9.
- ^ Ray Q. Brewster, Theodore Groening (1934). «P-Nitrophenyl Ether». Organic Syntheses. 14: 66. doi:10.15227/orgsyn.014.0066.
- ^ Zumdahl, Steven; DeCoste, Donald (2013). Chemical Principles. Cengage Learning. pp. 506–507. ISBN 978-1-285-13370-6.
- ^ Rodríguez, Emilio; Vicente, Miguel Angel (2002). «A Copper-Sulfate-Based Inorganic Chemistry Laboratory for First-Year University Students That Teaches Basic Operations and Concepts». Journal of Chemical Education. 79 (4): 486. Bibcode:2002JChEd..79..486R. doi:10.1021/ed079p486.
- ^ «Process for the preparation of stable copper(II) sulfate monohydrate applicable as trace element additive in animal fodders». Retrieved 2009-07-07.
- ^ Van Hullebusch, E.; Chatenet, P.; Deluchat, V.; Chazal, P. M.; Froissard, D.; Lens, P. N.L.; Baudu, M. (2003). «Fate and forms of Cu in a reservoir ecosystem following copper sulfate treatment (Saint Germain les Belles, France)». Journal de Physique IV (Proceedings). 107: 1333–1336. doi:10.1051/jp4:20030547.
- ^ Haughey, M. (2000). «Forms and fate of Cu in a source drinking water reservoir following CuSO4 treatment». Water Research. 34 (13): 3440–3452. doi:10.1016/S0043-1354(00)00054-3.
- ^ Martin, Hubert (1933). «Uses of Copper Compounds: Copper Sulfate’s Role in Agriculture». Annals of Applied Biology. 20 (2): 342–363. doi:10.1111/j.1744-7348.1933.tb07770.x. Retrieved 2007-12-31.
- ^ «All About Copper Sulfate». National Fish Pharmaceuticals. Retrieved 2007-12-31.
- ^ «With Zebra mussels here to stay, Austin has a plan to avoid stinky drinking water». KXAN Austin. 2020-10-26. Retrieved 2020-10-28.
- ^ Estridge, Barbara H.; Anna P. Reynolds; Norma J. Walters (2000). Basic Medical Laboratory Techniques. Thomson Delmar Learning. p. 166. ISBN 978-0-7668-1206-2.
- ^ Hoffman, R. V. (2001). «Copper(II) Sulfate». Copper(II) Sulfate, in Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rc247. ISBN 978-0471936237.
- ^ Philip J. Kocienski (2005). Protecting Groups. Thieme. p. 58. ISBN 978-1-58890-376-1.
- ^ Jefford, C. W.; Li, Y.; Wang, Y. «A Selective, Heterogeneous Oxidation using a Mixture of Potassium Permanganate and Cupric Sulfate: (3aS,7aR)-Hexahydro-(3S,6R)-Dimethyl-2(3H)-Benzofuranone». Organic Syntheses.; Collective Volume, vol. 9, p. 462
- ^ a b Copper Development Association. «Uses of Copper Compounds: Table A — Uses of Copper Sulphate». copper. Copper Development Association Inc. Retrieved 12 May 2015.
- ^ Partin, Lee. «The Blues: Part 2». skylighter. Skylighter.Inc. Archived from the original on 21 December 2010. Retrieved 12 May 2015.
- ^ Despommier; Gwadz; Hotez; Knirsch (June 2005). Parasitic Disease (5 ed.). NY: Apple Tree Production L.L.C. pp. Section 4.2. ISBN 978-0970002778. Retrieved 12 May 2015.
- ^ «Seizure». Artangel.org.uk. Retrieved 2021-10-05.
- ^ «Roger Hiorns: Seizure». Yorkshire Sculpture Park. Archived from the original on 2015-02-22. Retrieved 2015-02-22.
- ^ greenart.info, Bordeau etch, 2009-01-18, retrieved 2011-06-02.
- ^ ndiprintmaking.ca, The Chemistry of using Copper Sulfate Mordant, 2009-04-12, retrieved 2011-06-02.
- ^ http://mordent.com/etch-howto/, How to Electrolytically etch in copper, brass, steel, nickel silver or silver, retrieved 2015-05-2015.
- ^ «Chalcocyanite». www.mindat.org.
- ^ «Bonattite». www.mindat.org.
- ^ «Boothite». www.mindat.org.
- ^ «Poitevinite». www.mindat.org.
- ^ a b «List of Minerals». www.ima-mineralogy.org. March 21, 2011.
- ^ «Langite». www.mindat.org.
- ^ «Posnjakite». www.mindat.org.
- ^ Windholz, M., ed. 1983. The Merck Index. Tenth edition. Rahway, NJ: Merck and Company.
- ^ Guidance for reregistration of pesticide products containing copper sulfate. Fact sheet no. 100., Washington, DC: U.S. Environmental Protection Agency, Office of Pesticide Programs, 1986
- ^ Holtzmann, N. A.; Haslam, R. H. (July 1968). «Elevation of serum copper following copper sulfate as an emetic». Pediatrics. 42 (1): 189–93. doi:10.1542/peds.42.1.189. PMID 4385403. S2CID 32740524.
- ^ Olson, Kent C. (2004). Poisoning & drug overdose. New York: Lange Medical Mooks/McGraw-Hill. p. 175. ISBN 978-0-8385-8172-8.
- ^ V03AB20 (WHO)
Bibliography[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. ISBN 978-1439855119.
External links[edit]
Media related to Copper(II) sulfate at Wikimedia Commons
- International Chemical Safety Card 0751
- International Chemical Safety Card 1416
- National Pollutant Inventory – Copper and compounds fact sheet
У этого термина существуют и другие значения, см. Сульфат меди.
| Сульфат меди(II) | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Меди(II) сульфат |
| Традиционные названия | Медный купорос |
| Химическая формула | CuSO4 |
| Физические свойства | |
| Молярная масса | 159,61 г/моль |
| Плотность | 3,60 г/см³ |
| Термические свойства | |
| Химические свойства | |
| pKa | 5·10−3 |
| Растворимость в воде | 31,6 г/100 мл |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | Триклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| RTECS | GL8800000 |
Кристаллогидрат сульфата меди CuSO4 · 5H2O
Сульфат меди(II) (CuSO4) — медная соль серной кислоты, белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос.
Содержание
- 1 Получение
- 1.1 Очистка
- 2 Физические свойства
- 2.1 Строение кристаллогидрата
- 2.2 Термическое воздействие
- 2.3 Растворимость
- 3 Химические свойства
- 3.1 Диссоциация
- 3.2 Реакция замещения
- 3.3 Реакция с растворимыми основаниями (щелочами)
- 3.4 Реакция обмена с другими солями
- 3.5 Прочее
- 4 Применение
- 5 Токсикология
- 5.1 Токсикологические данные
- 5.2 Первая помощь при отравлении
- 5.3 Безопасность
- 6 Производители и поставщики
- 7 Нахождение в природе
- 8 См. также
- 9 Примечания
Получение
В промышленности получают растворением Cu и медных отходов в разб. H2SO4 при продувании воздуха; растворением CuO в H2SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.
В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
Температура не должна превышать 60 градусов Цельсия, так как образуется побочный продукт:
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди (II) серной кислотой:
Очистка
Обычно технический сульфат меди загрязнен сульфатом железа (II). Реактив Ч. Д. А. не содержит ионов Fe2+. Реактив загрязнен изоморфически и его невозможно очистить простой перекристаллизацией. В нашем случае можно окислить Fe2+ до Fe3+ кипячением полученного раствора сульфата меди с PbO2. Fe2(SO4)3 не формирует изоморфическую смесь с сульфатом меди. После кипячения раствор фильтруют. А потом кристаллизацией получают чистый сульфат меди.
Физические свойства
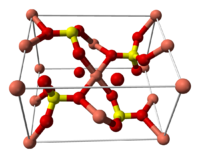
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Растворимость CuSO4, г/100 г H2O
Термическое воздействие
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
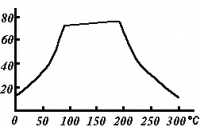
Растворимость
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80-200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5·10−3.
Химические свойства
Диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах cульфат меди (II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов.
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu2+ окрашивает пламя в зеленый цвет.
Применение
Кристаллы сульфата меди (II), выращенные в домашних условиях
Монокристалл сульфата меди (II), выращенный в домашних условиях
Сульфат меди(II) — наиболее важная соль меди — часто служит исходным сырьём для получения других соединений. Например, гидроксида меди (II) — Cu(OH)2 — вещества, необходимого для качественных реакций на глюкозу, глицерин.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят обезвоживание этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордоской смеси с известковым молоком — от грибковых заболеваний и виноградной тли. Для этих целей сульфат меди (II) имеется в розничной торговле.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология
Токсикологические данные
Сульфат меди (II) относится к классу опасности 1 (малоопасное вещество), как вещество, содержащее сульфат-ион. С другой же стороны, на стограммовой упаковке сульфата меди, поступающей в розничную продажу, указан класс опасности 2 (высокоопасное вещество). Смертельная доза медного купороса составляет от 8 до 30 граммов для взрослого человека перорально (через рот)[1][2] . Летальная доза зависит от состояния здоровья человека, от его массы, от иммунитета именно к данному веществу и от других факторов.
Первая помощь при отравлении
При попадании вещества на кожу необходимо снять его ватой или куском ткани, затем обмыть прохладной водой с мылом. При попадании в глаза необходимо обильно промыть их проточной водой. При попадании через дыхательные пути нужно вывести пострадавшего на свежий воздух, прополоскать рот водой. При попадании в желудочно-кишечный тракт необходимо промыть желудок пострадавшего 0,1%-ым раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1-2 ложки, вызвать рвоту, дать мочегонное.
Безопасность
При обращении с сульфатом меди (II) в бытовых условиях стоит быть очень осторожным, иначе можно нанести непоправимый вред здоровью[3]. При приготовлении растворов желательно использовать резиновые или одноразовые полиэтиленовые перчатки, очки, резиновые сапоги и также настоятельно рекомендуется использовать респиратор. Ни в коем случае не использовать пищевую посуду. Приготовление раствора и использование медного купороса стоит производить в отсутствие детей и животных. Во время использования нельзя пить, курить, принимать пищу. После работы лицо и руки вымыть с мылом, прополоскать рот.
Хранить в сухом прохладном месте при температуре от −30 до +30 °C, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте. Запрещается хранение вещества в поврежденной упаковке.
Производители и поставщики
Сульфат меди (II), как средство от гниения, сорняков и т. д. находится в розничной продаже в супермаркетах и хозяйственных магазинах. Чаще всего на прилавках можно найти упаковку весом в 100 граммов. Производство данной продукции осуществляется компанией ЗАО Фирма «Август». Также медный купорос можно найти в химических магазинах разной фасовки. Обычно это пластиковые банки весом в 1 кг или полиэтиленовые мешки весом в 500 г.
Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO4 ∙ 5H2O
См. также
- Халькантит
- Сульфаты
- Медь
- Соединения меди
- Купорос
- Пищевые добавки
- Сульфат меди(I)
Примечания
- ↑ http://chemister.ru/Toxicology/toxic_dose.htm
- ↑ http://dna.com.ua/83-med.html
- ↑ http://vredno-ili-net.ru/ostalnoe/vreden-li-mednyj-kuporos.html
|
Соединения меди |
|---|
|
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) • |
|
Купоросы |
|---|
|
Ванадиевый купорос (VSO4·7H2) • Железный купорос (FeSO4·7H2O) • Кобальтовый купорос (CoSO4·7H2O) • Медный купорос (CuSO4·5H2O) • Никелевый купорос (NiSO4·7H2O) • Свинцовый купорос (PbSO4) • Хромовый купорос (CrSO4·7H2O) • Цинковый купорос (ZnSO4·7H2O) |
|
Сульфаты |
|---|
|
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2) |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|

Сульфат меди (II) CuSO4∙5H2O(синонимы: пентагидрат сульфата меди , кальцантит ,медный купорос, регистрационный номер CAS 7758-99-8 молек. масса 249.682)
Основной сульфат меди CuSO4∙3Cu(OH)2 (синонимы: сульфат гидроксида меди, купроксат, трехосновной сульфат меди, Регистрационный номер CAS1333-22-8 молек. масса 452.2874)
Встречаются в природе в виде минералов халькантита и брошантита.
Получение сульфата меди: сульфат меди получают действием слабой H2SO4 на Cu, CuO, колчеданные огарки, сульфирующим обжигом Cu2S:
Cu+2H2SO4→CuSO4+SO2+2H2O
В лаборатории препарат CuSO4∙5H2O, соответствующий реактиву квалификации х.ч., можно получить растворением чистой меди в смеси серной и азотной кислот:
3Cu+2HNO3+3H2SO4→3CuSO4+2NO+4H2O
Свойства: Соли меди с кислородсодержащими кислотами устойчивы. Сульфат меди(I) получают в виде белого порошка при взаимодействии Cu2O с концентрированной кислотой.
В безводном состоянии сульфат меди(I) представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях.
Водный раствор сульфата меди имеет характерный сине-голубой цвет, Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+, поэтому, такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содержат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы. В таком виде он называется медным купоросом.
Медный купорос полностью обезвоживается при температуре выше 2580С. При действии сухого аммиака(NH3) на CuSO4 образуется CuSO4∙5NH3обменивающий во влажном воздухе NH3 на H2O.
С сульфатами щелочных металлов CuSO4 образует двойные соли типа MeSO4∙CuSO4∙6H2O.
При действии Na2CO3 на растворы медного купороса образуется карбонат гидроксомеди(II) (CuOH)2CO3, который в природе встречается в виде минерала малахита, имеющего красивый изумрудно-зеленый цвет:
2CuSO4+2Na2CO3+H2O→CuCO3∙Cu(OH)2+2Na2SO4+CO2
Применение сульфата меди: в гальванотехнике, для консервирования дерева, для изготовления минеральных красок, для обогащения руд, в производстве искусственного волокна, для получения других соединений меди, как инсектицид( в чистом виде и в составе сложных препаратов: бордосской жидкости-смесь с известью). Сульфатная соль представляет собой сильное рвотное средство и используется как противоядие при отравлении фосфором. Его также можно использовать для предотвращения роста водорослей.
ГОСТ4165-78 Реактивы. Медь(II) сернокислая 5-водная.;
ГОСТ19347-99 Купорос медный. Технические условия.;
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Сульфат меди(II)
Брутто-формула:
CuO4S
CAS# 7758-98-7
Названия
Русский:
- Меди(II) сульфат(IUPAC)
- Медный купорос
- Сульфат меди(II) [Wiki]
English:
- Copper Sulfate
- Copper(II) sulfate(IUPAC) [Wiki]
- Cupric sulfate
- EINECS:215-568-7
Варианты формулы:
Cu^2+_(x1,h,N0)O^-`|S<`-O`^->`|O|=O
Cu^2+O`^-_(A-20,d-)S`|O|<_(A110,w+)O`^->\O
Реакции, в которых участвует Сульфат меди(II)
-
Cu + 2H2SO4 -> CuSO4 + SO2″|^» + 2H2O
-
{M}O + H2{A} -> {M}{A} + H2O
, где M =
Cu Ca Mg Ba Sr Hg Mn Cr Ni Fe Zn Pb Co; A =
SO4 -
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
2NaI + 2CuSO4 + Na2SO3 + H2O -> 2CuI»|v» + 2Na2SO4 + H2SO4
-
{M}(NO3)2 + H2SO4 -> {M}SO4 + 2HNO3
, где M =
Mg Ca Ba Sr Zn Cd Mn Cu Hg Ni
Химическое соединение
|
||
| Названия | ||
|---|---|---|
| Название IUPAC Сульфат меди (II) | ||
| Другие названия Сульфат меди. Голубой купорос (пентагидрат). Блюстоун ( пентагидрат). Бонаттит (тригидратный минерал). Бутит (гептагидратный минерал). Халькантит (пентагидратный минерал). Халькоцианит (минерал) Пентагидрат медного сульфата | ||
| Идентификаторы CAS | ||
| Номер |
|
|
| 3D-модель (JSmol ) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.952 |
|
| Номер ЕС |
|
|
| Номер E | E519 (регуляторы кислотности,…) | |
| KEGG |
|
|
| PubChem CID |
|
|
| номер RTECS |
|
|
| UNII |
|
|
| CompTox Dashboard (EPA ) |
|
|
InChI
|
||
УЛЫБКИ
|
||
| Свойства | ||
| Химическая формула | CuSO 4 (безводный). CuSO 4 · 5H 2 O (пентагидрат) | |
| Молярная масса | 159,60 г / моль (безводный). 249,685 г / моль (пентагидрат) | |
| Внешний вид | серо-белый (безводный). синий (пентагидрат) | |
| Плотность | 3,60 г / см (безводный). 2,286 г / см (пентагидрат) | |
| Плавление точка | 110 ° C (230 ° F; 383 K) разлагается (· 5H 2 O), если пентагидрат. <560 °C decomposes if anhydrous | |
| Точка кипения | разлагается | |
| Растворимость в воде | 1,055 моль (10 ° C). 1,26 моль (20 ° C). 1,502 моль (30 ° C) | |
| Растворимость | безводный. нерастворимый в этаноле
пентагидрат. растворим в метанол. 10,4 г / л (18 ° C). нерастворим в этаноле, нерастворим в ацетоне |
|
| Магнитная восприимчивость (χ) | + 1330 · 10 см / моль | |
| Показатель преломления (nD) | 1,724–1,739 (безводный). 1,514–1,544 (пентагидрат) | |
| Структура | ||
| Кристаллическая структура | Орторомбическая (безводный, халькоцианит), пространственная группа Pnma, oP24, a = 0,839 нм, b = 0,669 нм, c = 0,483 нм.. Triclinic (пентагидрат), пространственная группа P1, aP22, a = 0,5986 нм, b = 0,6141 нм, c = 1,0736 нм, α = 77,333 °, β = 82,267 °, γ = 72,567 ° | |
| Термохимия | ||
| Стандартная молярная. энтропия (S 298) | 5 ДжК моль | |
| Стандартная энтальпия образования. (ΔfH298) | -769,98 кДж / моль | |
| Фармакология | ||
| Код ATC | V03AB20 (WHO ) | |
| Опасности | ||
| Паспорт безопасности | безводный. пентагидрат | |
| пиктограммы GHS |   |
|
| NFPA 704 (огненный алмаз) |  0 2 1 0 2 1 |
|
| Температура вспышки | Невоспламеняющийся | |
| Смертельная доза или концентрация (LD, LC): | ||
| LD50(средняя доза ) | 300 мг / кг (перорально, крыса)
87 мг / кг (перорально, мышь) |
|
| NIOSH (пределы воздействия на здоровье в США): | ||
| PEL (допустимый) | TWA 1 мг / м (как Cu) | |
| REL (рекомендуется) | TWA 1 мг / м (в виде Cu) | |
| IDLH (непосредственная опасность) | TWA 100 мг / м (в виде Cu) | |
| Родственные соединения | ||
| Прочие катионы | Сульфат железа (II). Сульфат марганца (II). Сульфат никеля (II). Сульфат цинка | |
| Если не указано иное, данные приведены для материалов в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | ||
| Справочные данные ink | ||
Медь (II) сульфат, также известный как сульфат меди, представляют собой неорганические соединения с химической формулой Cu SO4 (H2O)x, где x может находиться в диапазоне от 0 до 5. Пентагидрат (x = 5) — наиболее распространенная форма. Старые названия этого соединения включают голубой купорос, голубой камень, медный купорос и римский купорос .
пентагидрат (CuSO 4 · 5H 2 O), наиболее часто встречающаяся соль, имеет ярко-синий цвет. Он экзотермически растворяется в воде с образованием акво-комплекса [Cu (H 2O)6], который имеет октаэдрическую молекулярную геометрию. Структура твердого пентагидрата раскрывается полимерная структура, в которой медь также является октаэдрической, но связана с четырьмя водными лигандами. Центры Cu (II) (H 2O)4связаны между собой сульфат-анионами с образованием цепей. Безводный сульфат меди представляет собой светло-серый порошок.
Содержание
- 1 Получение и возникновение
- 2 Химические свойства
- 2.1 Обучение химии
- 3 Использование
- 3.1 В качестве фунгицида и гербицида
- 3.2 Аналитический реагент
- 3.3 Органический синтез
- 3.4 Ниша использует
- 3.4.1 Искусство
- 3.4.2 Травление
- 3.4.3 Крашение
- 3.4.4 Электроника
- 4 Проблемы медицины и здравоохранения
- 5 Другая форма меди сульфаты
- 6 Токсикологические эффекты
- 6.1 Экологическая токсичность
- 7 См. также
- 8 Ссылки
- 9 Библиография
- 10 Внешние ссылки
Получение и возникновение

Сульфат меди получают в промышленных масштабах путем обработки металлической меди горячей концентрированной серной кислотой или ее оксидов разбавленной серной кислотой. Для лабораторного использования обычно покупают медный купорос. Сульфат меди можно также получить путем медленного выщелачивания медной руды с низким содержанием меди на воздухе; для ускорения процесса можно использовать бактерии.
Коммерческий сульфат меди обычно представляет собой сульфат меди с чистотой около 98% и может содержать следы воды. Безводный сульфат меди состоит из 39,81% меди и 60,19% сульфата по массе, а в голубой водной форме он состоит из 25,47% меди, 38,47% сульфата (12,82% серы) и 36,06% воды по массе. В зависимости от его использования предусмотрены четыре размера кристаллов: крупные кристаллы (10–40 мм), мелкие кристаллы (2–10 мм), снежные кристаллы (менее 2 мм) и ветреный порошок (менее 0,15 мм).
Химические свойства
Пентагидрат сульфата меди (II) разлагается перед плавлением. Он теряет две молекулы воды при нагревании до 63 ° C (145 ° F), затем еще две при 109 ° C (228 ° F) и последнюю молекулу воды при 200 ° C (392 ° F). Дегидратация протекает за счет разложения фрагмента тетрааквакоппера (2+), две противоположные аквагруппы теряются с образованием фрагмента диаквакоппера (2+). Второй этап обезвоживания происходит, когда две последние аквагруппы теряются. Полное обезвоживание происходит, когда последняя несвязанная молекула воды теряется. При 650 ° C (1202 ° F) сульфат меди (II) разлагается на оксид меди (II) (CuO) и триоксид серы (SO 3).
Сульфат меди реагирует с концентрированным соляной кислоты для получения тетрахлоркупрата (II):
- Cu + 4 Cl → CuCl. 4
Обучение химии
Сульфат меди обычно входит в детские наборы химии. Он часто используется для выращивают кристаллы в школах и в экспериментах по меднению, несмотря на его токсичность. Сульфат меди часто используется для демонстрации экзотермической реакции, в которой стальная вата Лента или магния помещается в водный раствор CuSO 4. Она используется для демонстрации принципа гидратации минералов. Форма пентагидрата, которая имеет синий цвет, нагревается, превращая сульфат меди в безводную форму, которая имеет белый цвет, в то время как вода, которая присутствовала в форме пентагидрата, испаряется. Когда вода затем добавляется к безводной соединение, он снова превращается в т пентагидратная форма, возвращающая свой синий цвет, известна как голубой купорос. Пентагидрат сульфата меди (II) может быть легко получен путем кристаллизации из раствора в виде сульфата меди (II), который гигроскопичен.
На иллюстрации «реакции замещения одного металла» железо погружено в раствор меди. сульфат. Железо реагирует с образованием сульфата железа (II) и осаждения меди.
- Fe + CuSO 4 → FeSO 4 + Cu
В средней школе и в общем химическом образовании сульфат меди используется в качестве электролита для гальванических элементов, обычно в виде катодного раствора.. Например, в цинко-медном элементе ион меди в растворе сульфата меди поглощает электроны из цинка и образует металлическую медь.
- Cu + 2e → Cu (катод) E ° ячейка = 0,34V
Используется
В качестве фунгицида и гербицида
Пентагидрат сульфата меди используется в качестве фунгицида. Однако некоторые грибы способны адаптироваться к повышенным уровням ионов меди.
Бордоская смесь, суспензия сульфата меди (II) (CuSO 4) и гидроксида кальция (Ca (OH) 2), используется для борьбы с грибком на винограде, дынях и других ягодах. Его получают путем смешивания водного раствора сульфата меди и суспензии гашеной извести.
соединения Чешунта, коммерческой смеси сульфата меди и карбоната аммония (снято с производства), используется в садоводство для предотвращения выцветания рассады. В качестве несельскохозяйственного гербицида он используется для борьбы с инвазивными водными растениями и корнями растений, расположенных рядом с водопроводными трубами. Он используется в плавательных бассейнах как альгицид. Разбавленный раствор медного купороса используется для лечения аквариумных рыб от паразитарных инфекций, а также для удаления улиток из аквариумов. Однако ионы меди очень токсичны для рыб. Большинство видов водорослей можно контролировать с помощью очень низких концентраций сульфата меди.
Аналитический реагент
В нескольких химических тестах используется сульфат меди. Он используется в растворе Фелинга и растворе Бенедикта для проверки восстанавливающих сахаров, которые восстанавливают растворимый синий сульфат меди (II) до нерастворимого красного меди. (I) оксид. Сульфат меди (II) также используется в реагенте биурета для тестирования белков.
Сульфат меди используется для анализа крови на анемию. Кровь проверяют, помещая ее в раствор сульфата меди с известным удельным весом — кровь, которая содержит достаточное количество гемоглобина, быстро тонет из-за своей плотности, тогда как кровь не тонет и не тонет. медленно имеет недостаточное количество гемоглобина.
В испытании пламенем его ионы меди излучают темно-зеленый свет, гораздо более глубокий зеленый, чем испытание пламенем для барий.
Органический синтез
Сульфат меди используется в ограниченном количестве в органическом синтезе. Безводная соль используется в качестве дегидратирующего агента для образования и управления ацетальными группами. Гидратированная соль может быть тщательно смешана с перманганатом калия, чтобы получить окислитель для превращения первичных спиртов.
Ниша использует
Сульфат меди (II) занимает много ниш приложения на протяжении веков. В промышленности сульфат меди находит множество применений. В полиграфии это добавка к переплетным пастам и клеям для защиты бумаги от укусов насекомых; в строительстве он используется в качестве добавки к бетону для обеспечения водонепроницаемости и дезинфицирующих свойств. Сульфат меди можно использовать в качестве окрашивающего ингредиента в произведениях искусства, особенно в очках и гончарных изделиях. Сульфат меди также используется в производстве фейерверков в качестве синего красителя, но смешивать сульфат меди с хлоратами при смешивании порошков для фейерверков небезопасно.

Сульфат меди был когда-то использовались для уничтожения бромелий, которые служат местом размножения комаров. Сульфат меди используется в качестве моллюскицида для лечения бильгарции в тропических странах.
Art
В 2008 году художник Роджер Хайорнс залил заброшенную водонепроницаемую муниципальная квартира в Лондоне с 75 000 литров раствора сульфата меди. Раствор оставляли кристаллизоваться на несколько недель, прежде чем осушить квартиру, оставив кристалл на стенах, полах и потолках. Работа называется «Захват». С 2011 года он выставляется в Йоркширском парке скульптур.
Офорт
Сульфат меди используется для травления цинковых или медных пластин для глубокой печати. Он также используется для протравливания рисунков на меди для ювелирных изделий, например, для Champlevé.
окрашивания
Сульфат меди может использоваться в качестве протравы при растительном крашении. Он часто выделяет зеленые оттенки определенных красителей.
Электроника
Водный раствор сульфата меди часто используется в качестве резистивного элемента в жидких резисторах.
Вопросы медицины и здравоохранения
Использовался сульфат меди в прошлом как рвотное средство. Сейчас он считается слишком токсичным для такого использования. Он по-прежнему указан как антидот в Анатомо-терапевтической химической классификации Всемирной организации здравоохранения .
Другая форма сульфатов меди
Безводная медь (II) сульфат представляет собой белое твердое вещество. Его можно получить путем дегидратации обычно доступного пентагидрата сульфата меди. В природе он встречается как очень редкий минерал, известный как. Пентагидрат также встречается в природе как халькантит. Два других сульфата меди включают остатки этих редких минералов: бонаттит (тригидрат) и бутит (гептагидрат).
- Безводный сульфат меди (II)
Безводный CuSO 4.
Модель, заполняющая пространство, безводная CuSO 4.
Редкий (голубоватый) минерал бутит (CuSO 4 · 7H 2 O)
Токсикологические эффекты
Сульфат меди является раздражителем. Обычно люди могут получить токсическое воздействие сульфата меди через глаза или кожу, а также через вдыхание порошков и пыли. Контакт с кожей может вызвать зуд или экзему. Попадание в глаза сульфата меди может вызвать конъюнктивит, воспаление подкладки века, изъязвление и помутнение роговицы.
при пероральном воздействии, сульфат меди умеренно токсичен. Согласно исследованиям, самая низкая доза сульфата меди, оказавшая токсическое действие на человека, составляет 11 мг / кг. Из-за его раздражающего действия на желудочно-кишечный тракт рвота автоматически запускается при приеме внутрь сульфата меди. Однако если в желудке задерживается сульфат меди, симптомы могут быть серьезными. После проглатывания 1–12 граммов сульфата меди могут возникнуть такие признаки отравления, как металлический привкус во рту, жгучая боль в груди, тошнота, диарея, рвота, головная боль, прекращение мочеиспускания, что приводит к пожелтению кожных покровов. В случае отравления сульфатом меди также может произойти повреждение мозга, желудка, печени или почек.
Экологическая токсичность
Сульфат меди хорошо растворим в воде и поэтому легко распределяется в среда. Медь в почве может быть получена из промышленных, автомобильных и архитектурных материалов. Согласно исследованиям, сульфат меди существует в основном на поверхности почвы и имеет тенденцию связывать органические вещества. Чем более кислая почва, тем меньше происходит связывание.
См. Также
- Chalcanthum
- Vitriol
Ссылки
Библиография
- Haynes, William M., ed. (2011). CRC Справочник по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-1439855119.
Внешние ссылки
- Международная карта химической безопасности 0751
- Международный Карта химической безопасности 1416
- Национальный реестр загрязнителей — Информационный бюллетень по меди и соединениям
Медный купорос
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
- Cu + 2H2SO4 → CuSO4 + SO2 ↑ + 2H2O
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
- 5Cu + 4H2SO4 → 3CuSO4 + Cu2S ↓ + 4H2O
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
- Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10-4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см3. При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Растворимость CuSO4, г/100 г H2O
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
- 2CuSO4 → t 2CuO + 2SO2 + O2
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10−3.
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
- CuSO4 → Cu2+ + SO42−
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
- CuSO4 + Zn → Cu ↓ + ZnSO4
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
- CuSO4 + 2KOH → Cu(OH)2 ↓ + K2SO4
- CuSO4 + 2LiOH → Cu(OH)2 ↓ + Li2SO4
- CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
Сокращённое ионное уравнение (Правило Бертолле)
- Cu2+ + 2OH− → Cu(OH)2 ↓
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-
- CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
- CuSO4 + K2S → CuS ↓ + K2SO4
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu2+ окрашивает пламя в зелёный цвет.
Производство и применение
Друза кристаллов пентагидрата сульфата меди(II) CuSO4 · 5H2O, выращенная в домашних условиях
Монокристалл пентагидрата
Сульфат меди (II) — важнейшая из солей меди. Часто служит исходным сырьём для получения других соединений меди.
Безводный сульфат меди — хороший влагопоглотитель и может быть использован для абсолютирования этанола, осушения газов (в том числе воздуха) и как индикатор влажности.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей, а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. Для обеззараживания ран деревьев используется 1%-ный раствор (100 г на 10 л), который втирается в предварительно зачищенные поврежденные участки. Против фитофтороза томатов и картофеля производятся опрыскивания посадок 0,2 % раствором (20 г на 10 л) при первых признаках заболевания, а также для профилактики при угрозе возникновения болезни (например, в сырую влажную погоду). Раствором сульфата меди поливается почва для обеззараживания и восполнения недостатка серы и меди (5 г на 10 л). Однако чаще медный купорос применяется в составе бордоской жидкости — основного сульфата меди CuSO4·3Cu(OH)2 против грибковых заболеваний и виноградной филлоксеры. Для этих целей сульфат меди(II) имеется в розничной торговле.
Для борьбы с цветением воды в водохранилищах также используется химическая обработка медным купоросом.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и в составе прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В быту применяют для выведения пятен ржавчины на потолке после затоплений.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология
Сульфат меди(II) является соединением с умеренной токсичностью и относится к классу опасности 4 (малоопасное вещество). Смертельная доза медного купороса составляет от 45 до 125 граммов для взрослого человека перорально (при проглатывании), в зависимости от массы, состояния здоровья, иммунитета к избытку меди и от других факторов. Признаки отравления становится заметным при разовом потреблении более 0,5 г соединения внутрь (т. н. токсическая доза). LD50 для крыс 612,9 мг/кг. Картина отравления при вдыхании аэрозолей более сложна.
Попадание на кожу сухого вещества безопасно, но его необходимо смыть. Аналогично при попадании растворов и увлажненного твердого вещества. При попадании в глаза необходимо обильно промыть их проточной водой (слабой струей). При попадании в желудочно-кишечный тракт твердого вещества или концентрированных растворов необходимо промыть желудок пострадавшего 0,1 % раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1—2 ложки, вызвать рвоту, дать мочегонное. Кроме того, попадание в рот и желудок безводного вещества может вызвать термические ожоги.
Слабые растворы сульфата меди при приёме внутрь действуют как сильное рвотное средство и иногда применяются для провоцирования рвоты.
При работе с порошками и пылью сульфата меди (II), следует соблюдать осторожность и не допускать их пыления, необходимо использовать маску или респиратор, а после работы вымыть лицо. Острая токсическая доза при вдыхании аэрозоля — 11 мг/кг. При попадании сульфата меди через дыхательные пути в виде аэрозоля нужно вывести пострадавшего на свежий воздух, прополоскать рот водой и промыть крылья носа.
Хранить вещество следует в сухом прохладном месте, в плотно закрытой жесткой пластиковой или стеклянной упаковке, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте.












![mathsf{2CuSO_4 xrightarrow[]{^ot} 2CuO + 2SO_2 + O_2}](https://dic.academic.ru/dic.nsf/ruwiki/3b263af760ea620184767f698f4678c0.png)








 Структура пентагидрата
Структура пентагидрата Кристаллы CuSO 4 · 5H 2O
Кристаллы CuSO 4 · 5H 2O