| Сульфат серебра | |
|---|---|
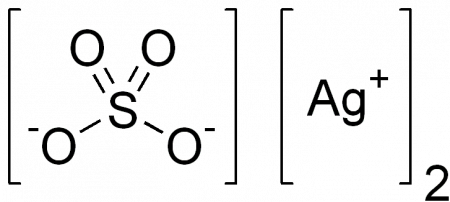 |
|
| Систематическое название | Сульфат серебра I |
| Химическая формула | Ag2SO4 |
| Внешний вид | белые кристаллы |
| Молярная масса | 311,8 г/моль |
| Температура плавления | 660 °C (933,15 К) |
| Температура разложения | 750—1100 °C |
| Фазовые переходы | 427 °C (ромб. → гекс.) |
| Плотность | 5,45 г/см³ |
| Растворимость в воде | 0,79 г/100 мл |
| LD50 | 5000 мг/кг |
| Кристаллическая решётка | Орторомбическая |
| Стандартная энтальпия образования | −715 кДж/моль |
| Энтальпия плавления | +16,74 кДж/моль |
| Стандартная молярная энтропия | +200 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −618 кДж/моль |
| Регистрационный номер CAS | 10294-26-5 |
| Регистрационный номер EC | 233-653-7 |
| R-фразы | R41 |
| S-фразы | S22; S26; S39 |
| H-фразы | H318 |
| P-фразы | P260; P280; P305 + P351 + P338; P313 |
| Пиктограммы опасности |  |
| Пиктограммы опасности СГС | 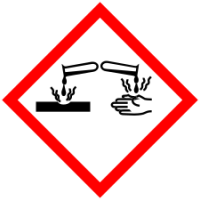 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Растворимость сульфата серебра в воде при разных температурах
Сульфат серебра (сульфат серебра I) — неорганическое вещество с формулой Ag2SO4, соль серебра в степени окисления +1 и серной кислоты.
Бесцветные кристаллы со временем темнеющие от воздействия света. Плохо растворим в воде.
Применяется в качестве стандартного вещества для тепловой калибровки калориметров и иногда для бактерицидной обработки воды.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Окислительно-восстановительные реакции
- 2.2 Обменные реакции
- 3 Получение
- 4 Применение
- 4.1 Калориметрия
- 5 Физиологическое действие
Физические свойства
При нормальных условиях сульфат серебра — белое кристаллическое вещество, малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решётки. Температура фазового перехода из ромбической формы в гексагональную — 427 °C.
При 660 °C плавится без разложения.
Химические свойства
Окислительно-восстановительные реакции
При температуре 750−1100 °C сульфат серебра разлагается с выделением металлического серебра:
- Ag2SO4 ⟶ 2 Ag + SO2 + O2
Также металлическое серебро восстанавливается из сульфата при нагревании последнего в токе водорода выше 200 °C:
- Ag2SO4 + H2 ⟶ 2 Ag + H2SO4
или при нагревании с сульфидом серебра выше 300 °C:
- Ag2SO4 + Ag2S ⟶ 4 Ag + 2 SO2
Обменные реакции
Сульфат серебра растворяется в концентрированном водном растворе аммиака с образованием комплекса:
- Ag2SO4 + 4 (NH3 ⋅ H2O) ⟶ [Ag(NH3)2]2SO4 + 4 H2O
При небольшом (до 50 °C) нагревании сульфат серебра растворяется в концентрированной серной кислоте с образованием гидросульфата серебра:
- Ag2SO4 + H2SO4 ⟶ 2 AgHSO4
При взаимодействии с концентрированной соляной кислотой выпадает осадок хлорида серебра:
- Ag2SO4 + 2 HCl ⟶ 2 AgCl ↓ + H2SO4
При взаимодействии с концентрированной щёлочью выпадает осадок оксида серебра (I):
- Ag2SO4 + 2 KOH ⟶ K2SO4 + Ag2O ↓ + H2O
Получение
Сульфат серебра может быть получен нагреванием металлического серебра с диоксидом серы и кислородом выше 450 °C:
- 2 Ag + SO2 + O2 ⟶ Ag2SO4
Взаимодействием металлического серебра с горячей концентрированной серной кислотой:
- 2 Ag + 2 H2SO4 ⟶ Ag2SO4 ↓ + SO2 ↑ + 2 H2O
Осаждением из растворов в реакциях ионного обмена, например:
- 2 AgNO3 + Na2SO4 ⟶ Ag2SO4 ↓ + 2 NaNO3
Вытеснением концентрированной серной кислотой летучих соединений водорода из солей:
- 2 AgX + H2SO4 ⟶ Ag2SO4 ↓ + 2 HX ↑ , где X = F, Br, I, CN.
Применение
Применяется для бактерицидной обработки воды.
Калориметрия
Сульфат серебра используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Физиологическое действие
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
LD50 5000 мг/кг.
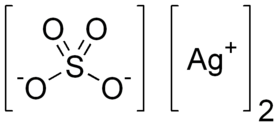
| Сульфат серебра | |
|---|---|
 |
|
| Систематическое название | Сульфат серебра(I) |
| Химическая формула | Ag2SO4 |
| Внешний вид | Бесцветные кристаллы |
| Свойства | |
| Молярная масса | 311,8 г/моль |
| Температура плавления | 660 °C (933,15 К) |
| Температура разложения | 750—1100 °C |
| Фазовые переходы |
427 °C (ромб. → гекс.) |
| Плотность | 5,45 г/см³ |
| Растворимость в воде | 0,79 г/100 мл |
| Токсикологические данные | |
| LD50 | 5000 мг/кг |
| Структура | |
| Кристаллическая решётка | Орторомбическая |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −715 кДж/моль |
| Энтальпия плавления | +16,74 кДж/моль |
| Стандартная молярная энтропия | +200 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −618 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 10294-26-5 |
| Регистрационный номер EC | 233-653-7 |
| Безопасность | |
| R-фразы | R41 |
| S-фразы | S22; S26; S39 |
| H-фразы | H318 |
| P-фразы | P260; P280; P305 + P351 + P338; P313 |
| Пиктограммы опасности |
|
| Пиктограммы опасности СГС |
|
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Растворимость сульфата серебра в воде при разных температурах
Сульфа́т серебра́ (сульфа́т серебра́ (I), химическая формула — Ag2SO4) — неорганическая серебряная соль серной кислоты.
При стандартных условиях, сульфат серебра — это бесцветные кристаллы со временем темнеющие от воздействия света.
Применяется в качестве стандартного вещества для тепловой калибровки калориметров и иногда для бактерицидной обработки воды.
Физические свойства
При нормальных условиях сульфат серебра — белое кристаллическое вещество, малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решётки. Температура фазового перехода из ромбической формы в гексагональную — 427 °C.
При 660 °C плавится без разложения.
Химические свойства
Окислительно-восстановительные реакции
Разложение (при температуре 750−1100 °C) с выделением металлического серебра:
- [math]displaystyle{ mathsf{Ag_2SO_4 longrightarrow 2 Ag + SO_2 + O_2}. }[/math]
Нагревание в токе водорода (выше 200 °C) приводит к восстановлению металлического серебра из сульфата:
- [math]displaystyle{ mathsf{Ag_2SO_4 + H_2 longrightarrow 2 Ag + H_2SO_4}, }[/math]
Нагревание сульфата серебра с сульфидом серебра (выше 300 °C) приводит к восстановлению металлического серебра:
- [math]displaystyle{ mathsf{Ag_2SO_4 + Ag_2S longrightarrow 4 Ag + 2 SO_2}. }[/math]
Обменные реакции
Растворение сульфата в концентрированном водном растворе аммиака приводит к образованию комплексного соединения — сульфата диамминсеребра(I):
- [math]displaystyle{ mathsf{Ag_2SO_4 + 4 (NH_3 cdot H_2O) longrightarrow [Ag(NH_3)_2]_2SO_4 + 4 H_2O}. }[/math]
Растворение соли при небольшом нагревании (до 50 °C) в концентрированной серной кислоте приводит к образованию гидросульфата серебра:
- [math]displaystyle{ mathsf{Ag_2SO_4 + H_2SO_4 longrightarrow 2 AgHSO_4}. }[/math]
Взаимодействие с концентрированной соляной кислотой приводит к выпадению осадка хлорида серебра:
- [math]displaystyle{ mathsf{Ag_2SO_4 + 2 HCl longrightarrow 2 AgCl downarrow + H_2SO_4}. }[/math]
Взаимодействие с концентрированной щёлочью приводит к выпадению осадка оксида серебра (I):
- [math]displaystyle{ mathsf{Ag_2SO_4 + 2 KOH longrightarrow K_2SO_4 + Ag_2O downarrow + H_2O}. }[/math]
Получение
Нагревание металлического серебра с диоксидом серы и кислородом (выше 450 °C):
- [math]displaystyle{ mathsf{2 Ag + SO_2 + O_2 longrightarrow Ag_2SO_4}. }[/math]
Осаждение из растворов в реакциях ионного обмена:
- [math]displaystyle{ mathsf{2 AgNO_3 + Na_2SO_4 longrightarrow Ag_2SO_4 downarrow + 2 NaNO_3}. }[/math]
Вытеснение концентрированной серной кислотой летучих соединений водорода из солей:
- [math]displaystyle{ mathsf{2 AgX + H_2SO_4 longrightarrow Ag_2SO_4 downarrow + 2 HX uparrow} }[/math], где [math]displaystyle{ mathsf{X = F, Br, I, Cl}. }[/math]
Применение
|
|
Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
Применяется для бактерицидной обработки воды.
Калориметрия
Сульфат серебра используется в качестве химического стандарта для калибровки калориметров по температуре и теплоемкости.
Физиологическое действие
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
LD50 5000 мг/кг.
Источники
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник. — М.: Дрофа, 2006.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник. — М.: Дрофа, 2007.
- Merck Safety Data Sheet − Silver sulfate (pdf)
From Wikipedia, the free encyclopedia
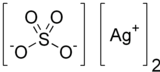
|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Silver(I) sulfate |
|
| Other names
Disilver sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.581 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ag2SO4 |
| Molar mass | 311.79 g·mol−1 |
| Appearance | Colorless solid |
| Odor | Odorless |
| Density | 5.45 g/cm3 (25 °C) 4.84 g/cm3 (660 °C)[1] |
| Melting point | 652.2–660 °C (1,206.0–1,220.0 °F; 925.4–933.1 K)[1][5] |
| Boiling point | 1,085 °C (1,985 °F; 1,358 K)[3][5] decomposition |
|
Solubility in water |
0.57 g/100 mL (0 °C) 0.69 g/100 mL (10 °C) 0.83 g/100 mL (25 °C) 0.96 g/100 mL (40 °C) 1.33 g/100 mL (100 °C)[2] |
|
Solubility product (Ksp) |
1.2·10−5[1] |
| Solubility | Dissolves in aq. acids, alcohols, acetone, ether, acetates, amides[2] Insoluble in ethanol[3] |
| Solubility in sulfuric acid | 8.4498 g/L (0.1 molH2SO4/LH2O)[2] 25.44 g/100 g (13 °C) 31.56 g/100 g (24.5 °C) 127.01 g/100 g (96 °C)[3] |
| Solubility in ethanol | 7.109 g/L (0.5 nEtOH/H2O)[2] |
| Solubility in acetic acid | 7.857 g/L (0.5 nAcOH/H2O)[2] |
|
Magnetic susceptibility (χ) |
−9.29·10−5 cm3/mol[1] |
|
Refractive index (nD) |
nα = 1.756 nβ = 1.775 nγ = 1.782[4] |
| Structure | |
|
Crystal structure |
Orthorhombic, oF56[4] |
|
Space group |
Fddd, No. 70[4] |
|
Point group |
2/m 2/m 2/m[4] |
|
Lattice constant |
a = 10.2699(5) Å, b = 12.7069(7) Å, c = 5.8181(3) Å[4] α = 90°, β = 90°, γ = 90° |
| Thermochemistry | |
|
Heat capacity (C) |
131.4 J/mol·K[1] |
|
Std molar |
200.4 J/mol·K [1] |
|
Std enthalpy of |
−715.9 kJ/mol[1] |
|
Gibbs free energy (ΔfG⦵) |
−618.4 kJ/mol [1] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  [6] [6]
|
|
Signal word |
Danger |
|
Hazard statements |
H318, H410[6] |
|
Precautionary statements |
P273, P280, P305+P351+P338, P501[6] |
| NFPA 704 (fire diamond) |
[5] 2 0 1 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Silver sulfate is the inorganic compound with the formula Ag2SO4. It is a white solid with low solubility in water.
Preparation and structure[edit]
Silver sulfate precipitates as a solid when an aqueous solution of silver nitrate is treated with sulfuric acid:
- 2 AgNO3 + H2SO4 → Ag2SO4 + 2 HNO3
It is purified by recrystallization from concentrated sulfuric acid, a step that expels traces of nitrate.[7]
Silver sulfate and anhydrous sodium sulfate adopt the same structure.[8]
Silver(II) sulfate[edit]
The synthesis of silver(II) sulfate (AgSO4) with a divalent silver ion instead of a monovalent silver ion was first reported in 2010[9] by adding sulfuric acid to silver(II) fluoride (HF escapes). It is a black solid that decomposes exothermally at 120 °C with evolution of oxygen and the formation of the pyrosulfate.
AgF2+H2SO4 →AgSO4 +2HF
References[edit]
- ^ a b c d e f g h Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d e Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York: D. Van Nostrand Company. pp. 622–623.
- ^ a b c Anatolievich, Kiper Ruslan. «silver sulfate». Retrieved 2014-07-19.
- ^ a b c d e Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (June 1976). «13». Standard X-ray Diffraction Powder Patterns. Vol. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ^ a b c «MSDS of Silver sulfate». Fisher Scientific, Inc. Retrieved 2014-07-19.
- ^ a b c Sigma-Aldrich Co., Silver sulfate. Retrieved on 2014-07-19.
- ^ O. Glemser; R. Sauer (1963). «Copper (I) Sulfate». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2pages=1042. NY, NY: Academic Press.
- ^ Zachariasen, W. H. (1932). «Note on the Crystal Structure of Silver Sulphate, Ag2SO4«. Zeitschrift für Kristallographie — Crystalline Materials. 82 (1–6): 161–162. doi:10.1524/zkri.1932.82.1.161. S2CID 101362527.
- ^ Malinowski, P.; Derzsi, M.; Mazej, Z.; Jagličić, Z.; Gaweł, B.; Lasocha, W.; Grochala, W. (2010). «Ag(II)SO(4): A Genuine Sulfate of Divalent Silver with Anomalously Strong One-Dimensional Antiferromagnetic Interactions». Angewandte Chemie International Edition in English. 49 (9): 1683–1686. doi:10.1002/anie.200906863. PMID 20084660.
From Wikipedia, the free encyclopedia
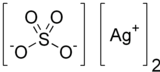
|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Silver(I) sulfate |
|
| Other names
Disilver sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.581 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ag2SO4 |
| Molar mass | 311.79 g·mol−1 |
| Appearance | Colorless solid |
| Odor | Odorless |
| Density | 5.45 g/cm3 (25 °C) 4.84 g/cm3 (660 °C)[1] |
| Melting point | 652.2–660 °C (1,206.0–1,220.0 °F; 925.4–933.1 K)[1][5] |
| Boiling point | 1,085 °C (1,985 °F; 1,358 K)[3][5] decomposition |
|
Solubility in water |
0.57 g/100 mL (0 °C) 0.69 g/100 mL (10 °C) 0.83 g/100 mL (25 °C) 0.96 g/100 mL (40 °C) 1.33 g/100 mL (100 °C)[2] |
|
Solubility product (Ksp) |
1.2·10−5[1] |
| Solubility | Dissolves in aq. acids, alcohols, acetone, ether, acetates, amides[2] Insoluble in ethanol[3] |
| Solubility in sulfuric acid | 8.4498 g/L (0.1 molH2SO4/LH2O)[2] 25.44 g/100 g (13 °C) 31.56 g/100 g (24.5 °C) 127.01 g/100 g (96 °C)[3] |
| Solubility in ethanol | 7.109 g/L (0.5 nEtOH/H2O)[2] |
| Solubility in acetic acid | 7.857 g/L (0.5 nAcOH/H2O)[2] |
|
Magnetic susceptibility (χ) |
−9.29·10−5 cm3/mol[1] |
|
Refractive index (nD) |
nα = 1.756 nβ = 1.775 nγ = 1.782[4] |
| Structure | |
|
Crystal structure |
Orthorhombic, oF56[4] |
|
Space group |
Fddd, No. 70[4] |
|
Point group |
2/m 2/m 2/m[4] |
|
Lattice constant |
a = 10.2699(5) Å, b = 12.7069(7) Å, c = 5.8181(3) Å[4] α = 90°, β = 90°, γ = 90° |
| Thermochemistry | |
|
Heat capacity (C) |
131.4 J/mol·K[1] |
|
Std molar |
200.4 J/mol·K [1] |
|
Std enthalpy of |
−715.9 kJ/mol[1] |
|
Gibbs free energy (ΔfG⦵) |
−618.4 kJ/mol [1] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  [6] [6]
|
|
Signal word |
Danger |
|
Hazard statements |
H318, H410[6] |
|
Precautionary statements |
P273, P280, P305+P351+P338, P501[6] |
| NFPA 704 (fire diamond) |
[5] 2 0 1 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Silver sulfate is the inorganic compound with the formula Ag2SO4. It is a white solid with low solubility in water.
Preparation and structure[edit]
Silver sulfate precipitates as a solid when an aqueous solution of silver nitrate is treated with sulfuric acid:
- 2 AgNO3 + H2SO4 → Ag2SO4 + 2 HNO3
It is purified by recrystallization from concentrated sulfuric acid, a step that expels traces of nitrate.[7]
Silver sulfate and anhydrous sodium sulfate adopt the same structure.[8]
Silver(II) sulfate[edit]
The synthesis of silver(II) sulfate (AgSO4) with a divalent silver ion instead of a monovalent silver ion was first reported in 2010[9] by adding sulfuric acid to silver(II) fluoride (HF escapes). It is a black solid that decomposes exothermally at 120 °C with evolution of oxygen and the formation of the pyrosulfate.
AgF2+H2SO4 →AgSO4 +2HF
References[edit]
- ^ a b c d e f g h Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d e Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York: D. Van Nostrand Company. pp. 622–623.
- ^ a b c Anatolievich, Kiper Ruslan. «silver sulfate». Retrieved 2014-07-19.
- ^ a b c d e Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (June 1976). «13». Standard X-ray Diffraction Powder Patterns. Vol. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ^ a b c «MSDS of Silver sulfate». Fisher Scientific, Inc. Retrieved 2014-07-19.
- ^ a b c Sigma-Aldrich Co., Silver sulfate. Retrieved on 2014-07-19.
- ^ O. Glemser; R. Sauer (1963). «Copper (I) Sulfate». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2pages=1042. NY, NY: Academic Press.
- ^ Zachariasen, W. H. (1932). «Note on the Crystal Structure of Silver Sulphate, Ag2SO4«. Zeitschrift für Kristallographie — Crystalline Materials. 82 (1–6): 161–162. doi:10.1524/zkri.1932.82.1.161. S2CID 101362527.
- ^ Malinowski, P.; Derzsi, M.; Mazej, Z.; Jagličić, Z.; Gaweł, B.; Lasocha, W.; Grochala, W. (2010). «Ag(II)SO(4): A Genuine Sulfate of Divalent Silver with Anomalously Strong One-Dimensional Antiferromagnetic Interactions». Angewandte Chemie International Edition in English. 49 (9): 1683–1686. doi:10.1002/anie.200906863. PMID 20084660.
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время.
Вы можете также связаться с преподавателем напрямую:
8(906)72 3-11-5 2
Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте.
Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши.
Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить».
Этим вы поможете сделать сайт лучше.
К сожалению, регистрация на сайте пока недоступна.
На сайте есть сноски двух типов:
Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего.
Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения.
Здесь вы можете выбрать параметры отображения органических соединений.
Химические свойства серебра
В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов.
При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий.
Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок :
Ag → Ag⁺ + е, φ0 = + 0,799В
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl.
Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III).
Соединения серебра
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag2О
Черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag⁺. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
2AgOH = Ag2O + Н2О.
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185—190°С Ag2О разлагается на элементы. Перекись водорода легко восстанавливается Ag2О уже при комнатной температуре:
В водном растворе аммиака Ag2О растворяется с образованием комплексного соединения:
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра
Малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид AgI выпадают в осадок при введении в раствор, содержащий ионы Ag⁺ (например, раствор AgNO3), ионов Сl⁻, Вr⁻ и I⁻. Их произведения растворимости составляют соответственно 1,8 • 10⁻¹º (AgCI), 5,3 • 10⁻¹³ (AgBr) и 8,3 •10⁻¹⁷ (AgI).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °с.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN⁻, S2O²3⁻, SO²3⁻ Cl⁻, NH3, CS(NH2)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN⁻ = Ag (CN)F + Сl⁻;
AgCl + 2S2C²3⁻ = Ag (S2O2)³2⁻ + Сl⁻;
AgCl + 2NH4OH = Ag(NH3)2+ + Сl⁻ + 2H2O.
Вследствие образования комплексов с ионами Сl³⁻ хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
AgCl + Сl⁻ = AgCl⁻ 2.
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7•10³⁻моль/л (0,72 г/л Ag) против 1,3•10⁻⁵ в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в ре-зультате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) .хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид AgI
Наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN⁻ и S2O²3⁻ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI⁻2.
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувст-вительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид:
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgI
К галогенидам серебра очень близок по своим свойствам цианид AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag⁺, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3•10⁻¹⁶) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Нитрат серебра
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNО3 получают действием азотной кислоты на металлическое серебро:
3Ag + 4HNO3 = 3AgNО3 + NO + 2H2О.
Нитрат серебpa представляет собой бесцветные негигроскопичные кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgNО3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100 °С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2SO4
Может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2Н2O.
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660°С. При температуре выше 1000°С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25°С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4.
Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3• 10⁻⁵º). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха;
4Ag + 2H2S + O2 = 2Ag2S + 2Н2O
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN⁻ ⇄ 2Ag(CN)⁻2 + S²⁻
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN⁻ и удаление ионов S²⁻ окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Ag2S + О2 = 2Ag + SО2
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN⁻ + О2 + 2Н2О = 4Ag(CN)7 + 4ОН⁻
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III),образуя комплексные катионы Ag[CS(NH2)2]⁺2
Статья на тему химические свойства серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
источники:
http://acetyl.ru/o/nag12s1o41.php
http://znaesh-kak.com/q/s/%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D1%81%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%B0
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Сульфат серебра
Из Википедии — свободной энциклопедии
Растворимость сульфата серебра в воде при разных температурах
Сульфа́т серебра́ (сульфа́т серебра́ (I), химическая формула — Ag2SO4) — неорганическая серебряная соль серной кислоты.
При стандартных условиях, сульфат серебра — это бесцветные кристаллы со временем темнеющие от воздействия света.
Применяется в качестве стандартного вещества для тепловой калибровки калориметров и иногда для бактерицидной обработки воды.
Физические свойства
При нормальных условиях сульфат серебра — белое кристаллическое вещество, малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решётки. Температура фазового перехода из ромбической формы в гексагональную — 427 °C.
При 660 °C плавится без разложения.
Химические свойства
Окислительно-восстановительные реакции
Разложение (при температуре 750−1100 °C) с выделением металлического серебра:
Нагревание в токе водорода (выше 200 °C) приводит к восстановлению металлического серебра из сульфата:
Нагревание сульфата серебра с сульфидом серебра (выше 300 °C) приводит к восстановлению металлического серебра:
Обменные реакции
Растворение сульфата в концентрированном водном растворе аммиака приводит к образованию комплексного соединения — сульфата диамминсеребра(I):
Растворение соли при небольшом нагревании (до 50 °C) в концентрированной серной кислоте приводит к образованию гидросульфата серебра:
Взаимодействие с концентрированной соляной кислотой приводит к выпадению осадка хлорида серебра:
Взаимодействие с концентрированной щёлочью приводит к выпадению осадка оксида серебра (I):
Получение
Нагревание металлического серебра с диоксидом серы и кислородом (выше 450 °C):
Осаждение из растворов в реакциях ионного обмена:
Вытеснение концентрированной серной кислотой летучих соединений водорода из солей:
, где
Применение
Применяется для бактерицидной обработки воды.
Калориметрия
Сульфат серебра используется в качестве химического стандарта для калибровки калориметров по температуре и теплоемкости.
Физиологическое действие
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
LD50 5000 мг/кг.
Источники
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник. — М.: Дрофа, 2006.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник. — М.: Дрофа, 2007.
- Merck Safety Data Sheet − Silver sulfate (pdf)
Эта страница в последний раз была отредактирована 12 января 2022 в 15:28.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат серебра
Брутто-формула:
Ag2O4S
CAS# 10294-26-5
Категории:
Неорганические соли
PubChem CID: 159865
| ChemSpider ID: 140554
Названия
Русский:
- Сульфат серебра [Wiki]
- Сульфат серебра(I)
English:
- Disilver monosulfate
- Disilver sulfate
- Disilver(1+) sulfate
- EINECS:233-653-7
- Silver sulfate [Wiki]
- Silver sulfate (Ag2SO4)
- Sulfuric acid silver salt (1:2)
- Sulfuric acid,silver(1+) salt (1:2)
- disilver;sulfate(IUPAC)
Варианты формулы:
Ag2SO4
Ag(+1)2S(+6)O(-2)4
Ag^+O`^-/S<_qq4O><_pp4O>/O^-Ag^+
Ag^+O//S`|O|<_(A75,w+)O^->dO^-/0Ag^+
Химический состав
Реакции, в которых участвует Сульфат серебра
-
Ag2SO4 -> 2Ag + SO2″|^» + O2″|^»
-
2AgNO3 + {M}2SO4 -> Ag2SO4 + 2{M}NO3
, где M =
Na K -
2{M}NO3 + H2SO4 -> {M}2SO4 + 2HNO3
, где M =
Li Na K Rb Ag -
Ag2SO4 + Ba(ClO4)2 -> 2AgClO4 + BaSO4″|v»
-
2AgSCN + 3H2SO4 + 2H2O -> 2CSO + 2NH4HSO4 + Ag2SO4
И ещё 13 реакций…











![{displaystyle {mathsf {Ag_{2}SO_{4}+4 (NH_{3}cdot H_{2}O)longrightarrow [Ag(NH_{3})_{2}]_{2}SO_{4}+4 H_{2}O}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/71c366603c94665dab0cf9c806862b94e68b3bbc)






