| Сульфид меди (II) | |
|---|---|
 |
|
| Систематическое наименование |
Сульфид меди (II) |
| Традиционные названия | Сульфид меди, моносульфид меди |
| Хим. формула | CuS |
| Рац. формула | CuS |
| Состояние | твёрдое |
| Молярная масса | 95,61 г/моль |
| Плотность | 4,6 г/см³ |
| Показатель преломления | 1,45 |
| Рег. номер CAS | 1317-40-4 |
| PubChem | 14831 |
| Рег. номер EINECS | 215-271-2 |
| SMILES |
S=[Cu] |
| InChI |
1S/Cu.S BWFPGXWASODCHM-UHFFFAOYSA-N |
| RTECS | GL8912000 |
| ChEBI | 51110 |
| ChemSpider | 14145 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид меди (II) (моносульфид меди) — CuS, неорганическое бинарное соединение двухвалентной меди с серой. Чёрное, нерастворимое в воде и разбавленных растворах кислот вещество. Встречается в природе в виде редкого минерала ковеллина.
Получают прямым взаимодействием элементов или обменной реакцией солей двухвалентной меди с водорастворимыми сульфидами.
Полученный сухим путём (теплота образования из элементов 12 ккал/моль)
сульфид меди довольно хорошо проводит электрический ток (а ниже 1,66 K
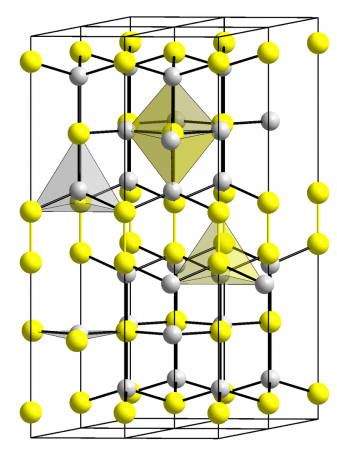
становится сверхпроводником). Рентгеноструктурное исследование его кристаллов выявило их совершенно особую и сложную структуру: Одна треть атомов меди находится
в центрах треугольников из атомов серы [d (CuS) = 2,19 Å], а две трети — в центрах тетраэдров [d (CuS) = 2,32 Å]; кроме того, две трети атомов серы представлены группировками S2 ([S2]2−), подобными имеющимся в пирите. В связи с этим строение кристалла CuS можно было бы уточнённо выразить формулой CuI4 CuII2 [S−12]2S−22.
Около 400 °C наступает заметное разложение сульфида по схеме 2CuS == Cu2S + S
(давление диссоциации при 450 °C равно 80 мм рт. ст.). Известны также полисульфидные
производные меди Cu2Sn (где n = 3 ÷ 6; а также CuS2) и её селенид CuSe (теплота образования из элементов 10 ккал/моль). Взаимодействием CuSO4 с насыщенным серой раствором полисульфида могут быть получены довольно устойчивые красные кристаллы тиосолей типа MCuS. (где M – NH4, K, Rb, Cs). Наименее растворима из них соль цезия.
Получение
Na2S+CuSO4=CuS+Na2SO4
From Wikipedia, the free encyclopedia
(Redirected from Copper sulphide)
Copper sulfides describe a family of chemical compounds and minerals with the formula CuxSy. Both minerals and synthetic materials comprise these compounds. Some copper sulfides are economically important ores.
Prominent copper sulfide minerals include Cu2S (chalcocite) and CuS (covellite). In the mining industry, the minerals bornite or chalcopyrite, which consist of mixed copper-iron sulfides, are often referred to as «copper sulfides». In chemistry, a «binary copper sulfide» is any binary chemical compound of the elements copper and sulfur. Whatever their source, copper sulfides vary widely in composition with 0.5 ≤ Cu/S ≤ 2, including numerous non-stoichiometric compounds.
Known copper sulfides[edit]
The naturally occurring mineral binary compounds of copper and sulfur are listed below. Investigations of covellite (CuS) indicate that there are other metastable Cu-S phases still to be fully characterised.[1]
- CuS2, villamaninite[2] or (Cu,Ni,Co,Fe)S
2[3] - CuS, covellite,[2] copper monosulfide
- Cu9S8 (Cu1.12S), yarrowite[4]
- Cu39S28 (Cu1.39S) spionkopite[4]
- Cu8S5 (Cu1.6S), geerite[5]
- Cu7S4 (Cu1.75S), anilite[2]
- Cu9S5 (Cu1.8S), digenite[2]
- Cu58S32 (Cu1.8S), roxbyite[6]
- Cu31S16 (Cu1.96S), djurleite[2]
- Cu2S, chalcocite[2]
Classes of copper sulfides[edit]
Copper sulfides can be classified into three groups:
Monosulfides, 1.6 ≤ Cu/S ≤ 2: their crystal structures consist of isolated sulfide anions that are closely related to either hcp or fcc lattices, without any direct S-S bonds. The copper ions are distributed in a complicated manner over interstitial sites with both trigonal as well as distorted tetrahedral coordination and are rather mobile. Therefore, this group of copper sulfides shows ionic conductivity at slightly elevated temperatures. In addition, the majority of its members are semiconductors.
Mixed monosulfide and disulfide compounds of copper contain both monosulfide (S2−) as well as disulfide (S2)n− anions. Their crystal structures usually consist of alternating hexagonal layers of monosulfide and disulfide anions with Cu cations in trigonal and tetrahedral interstices. CuS, for example, can be written as Cu3(S2)S. Several nonstoichiometric compounds with Cu:S ratios between 1.0 and 1.4 also contain both monosulfide as well as disulfide ions. Depending on their composition, these copper sulfides are either semiconductors or metallic conductors.
At very high pressures, a copper disulfide, CuS2, can be synthesized. Its crystal structure is analogous to that of pyrite, with all sulfur atoms occurring as S-S units. Copper disulfide is a metallic conductor due to the incomplete occupancy of the sulfur p band. Different stoichiometric compositions can be obtained by changing the redox atmosphere of the synthetic environment.[6]
Oxidation states of copper and sulfur[edit]
The bonding in copper sulfides cannot be correctly described in terms of a simple oxidation state formalism because the Cu-S bonds are somewhat covalent rather than ionic in character, and have a high degree of delocalization resulting in complicated electronic band structures. Although many textbooks (e.g.[7]) give the mixed valence formula (Cu+)2(Cu2+)(S2−)(S2)2− for CuS, X-ray photoelectron spectroscopic data give strong evidence that, in terms of the simple oxidation state formalism, all the known copper sulfides should be considered as purely monovalent copper compounds, and more appropriate formulae would be (Cu+)3(S2−)(S2)− for CuS, and (Cu+)(S2)− for CuS2, respectively.[8][9][10]
[11][12]
Further evidence that the assignment of the so-called «valence hole» should be to the S2 units in these two formulae is the length of the S-S bonds, which are significantly shorter in CuS (0.207 nm) and CuS2 (0.203 nm) than in the «classical» disulfide Fe2+(S2)2− (0.218 nm). This bond length difference has been ascribed to the higher bond order in (S-S)− compared to (S-S)2− due to electrons being removed from a π* antibonding orbital.[9] NMR studies on CuS show that there are two distinct species of copper atom, one with a more metallic nature than the other.[13] This apparent discrepancy with the X-ray photo-electron spectrum data simply highlights the problem that NMR has in assigning oxidation states in a mixed-valence compound. The issue of the valence of copper in sulfides (as well as selenides and tellurides) continues to be revisited in the literature. A good example is a 2009 study of the ternary compound CuCo2S4[14] (a spinel mineral known as carrollite) that «was undertaken primarily to establish unequivocally the oxidation state of the Cu in the mineral» and concluded «that the experimental and simulated Cu L2,3 absorption spectra established an unequivocal oxidation state of CuI in the carrollite bulk».
See also[edit]
- Copper(I) sulfide
- Copper(II) sulfide
References[edit]
- J.C.W. Folmer Holes in the valence band of copper chalcogenides Thesis 1981 Groningen State University (Neth).
- ^ Whiteside, L.S; Goble, R.J (1986). «Structural and compositional changes in copper sulfide during leaching and dissolution». The Canadian Mineralogist. 24 (2): 247–258.
- ^ a b c d e f Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ http://rruff.geo.arizona.edu/doclib/hom/villamaninite.pdf Handbook of Mineralogy
- ^ a b Copper sulfides from Alberta; yarrowite Cu9S8 and spionkopite Cu39S28 R. J. Goble, The Canadian Mineralogist; (1980); 18; 4; 511-518
- ^ Goble, R.J.; Robinson, G. (1980). «Geerite, Cu1.60S, a new copper sulfide from Dekalb Township, New York». The Canadian Mineralogist. 18 (4): 519–523.
- ^ Mumme, W. G.; Gable, R. W.; Petricek, V. (2012-04-01). «The Crystal Structure of Roxybyite, Cu58S32«. The Canadian Mineralogist. Mineralogical Association of Canada. 50 (2): 423–430. doi:10.3749/canmin.50.2.423. ISSN 0008-4476.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Folmer, J.C.W; Jellinek, F (1980). «The valence of copper in sulphides and selenides: An X-ray photoelectron spectroscopy study». Journal of the Less Common Metals. Elsevier BV. 76 (1–2): 153–162. doi:10.1016/0022-5088(80)90019-3. ISSN 0022-5088.
- ^ a b Folmer, J.C.W.; Jellinek, F.; Calis, G.H.M. (1988). «The electronic structure of pyrites, particularly CuS2 and Fe1−xCuxSe2: An XPS and Mössbauer study». Journal of Solid State Chemistry. Elsevier BV. 72 (1): 137–144. doi:10.1016/0022-4596(88)90017-5. ISSN 0022-4596.
- ^ Romero-Jaime, A.K.; Vargas-Hernández, D.; Acosta-Enríquez, M.C.; Tánori-Córdova, J.C.; Valenzuela-Badilla, J.; Castillo, S.J. (March 2020). «Novel route for simplified and efficient synthesis of spiky-like copper sulfide nanoballs by soft chemistry method and their basic physicochemical characterizations». Materials Science in Semiconductor Processing. 107: 104830. doi:10.1016/j.mssp.2019.104830.
- ^ Goh, Siew Wei; Buckley, Alan N.; Lamb, Robert N. (2006). «Copper(II) sulfide?». Minerals Engineering. Elsevier BV. 19 (2): 204–208. doi:10.1016/j.mineng.2005.09.003. ISSN 0892-6875.
- ^ Goh, Siew Wei; Buckley, Alan N.; Lamb, Robert N.; Rosenberg, Richard A.; Moran, Damian (2006). «The oxidation states of copper and iron in mineral sulfides, and the oxides formed on initial exposure of chalcopyrite and bornite to air». Geochimica et Cosmochimica Acta. Elsevier BV. 70 (9): 2210–2228. doi:10.1016/j.gca.2006.02.007. ISSN 0016-7037.
- ^ Saito, Shin-hachiro; Kishi, Hideki; Nié, Kohji; Nakamaru, Hisakazu; Wagatsuma, Fumihiko; Shinohara, Takeshi (1997-06-01). «63Cu NMR studies of copper sulfide». Physical Review B. American Physical Society (APS). 55 (21): 14527–14535. doi:10.1103/physrevb.55.14527. ISSN 0163-1829.
- ^ Electronic environments in carrollite, CuCo2S4, determined by soft X-ray photoelectron and absorption spectroscopy
Alan N. Buckley, William M. Skinner, Sarah L. Harmer, Allan Pring and Liang-Jen Fan
Geochimica et Cosmochimica Acta
Volume 73, Issue 15, 1 August 2009, Pages 4452-4467
External links[edit]
- Copper sulfides mineral information and data
From Wikipedia, the free encyclopedia
(Redirected from Copper sulphide)
Copper sulfides describe a family of chemical compounds and minerals with the formula CuxSy. Both minerals and synthetic materials comprise these compounds. Some copper sulfides are economically important ores.
Prominent copper sulfide minerals include Cu2S (chalcocite) and CuS (covellite). In the mining industry, the minerals bornite or chalcopyrite, which consist of mixed copper-iron sulfides, are often referred to as «copper sulfides». In chemistry, a «binary copper sulfide» is any binary chemical compound of the elements copper and sulfur. Whatever their source, copper sulfides vary widely in composition with 0.5 ≤ Cu/S ≤ 2, including numerous non-stoichiometric compounds.
Known copper sulfides[edit]
The naturally occurring mineral binary compounds of copper and sulfur are listed below. Investigations of covellite (CuS) indicate that there are other metastable Cu-S phases still to be fully characterised.[1]
- CuS2, villamaninite[2] or (Cu,Ni,Co,Fe)S
2[3] - CuS, covellite,[2] copper monosulfide
- Cu9S8 (Cu1.12S), yarrowite[4]
- Cu39S28 (Cu1.39S) spionkopite[4]
- Cu8S5 (Cu1.6S), geerite[5]
- Cu7S4 (Cu1.75S), anilite[2]
- Cu9S5 (Cu1.8S), digenite[2]
- Cu58S32 (Cu1.8S), roxbyite[6]
- Cu31S16 (Cu1.96S), djurleite[2]
- Cu2S, chalcocite[2]
Classes of copper sulfides[edit]
Copper sulfides can be classified into three groups:
Monosulfides, 1.6 ≤ Cu/S ≤ 2: their crystal structures consist of isolated sulfide anions that are closely related to either hcp or fcc lattices, without any direct S-S bonds. The copper ions are distributed in a complicated manner over interstitial sites with both trigonal as well as distorted tetrahedral coordination and are rather mobile. Therefore, this group of copper sulfides shows ionic conductivity at slightly elevated temperatures. In addition, the majority of its members are semiconductors.
Mixed monosulfide and disulfide compounds of copper contain both monosulfide (S2−) as well as disulfide (S2)n− anions. Their crystal structures usually consist of alternating hexagonal layers of monosulfide and disulfide anions with Cu cations in trigonal and tetrahedral interstices. CuS, for example, can be written as Cu3(S2)S. Several nonstoichiometric compounds with Cu:S ratios between 1.0 and 1.4 also contain both monosulfide as well as disulfide ions. Depending on their composition, these copper sulfides are either semiconductors or metallic conductors.
At very high pressures, a copper disulfide, CuS2, can be synthesized. Its crystal structure is analogous to that of pyrite, with all sulfur atoms occurring as S-S units. Copper disulfide is a metallic conductor due to the incomplete occupancy of the sulfur p band. Different stoichiometric compositions can be obtained by changing the redox atmosphere of the synthetic environment.[6]
Oxidation states of copper and sulfur[edit]
The bonding in copper sulfides cannot be correctly described in terms of a simple oxidation state formalism because the Cu-S bonds are somewhat covalent rather than ionic in character, and have a high degree of delocalization resulting in complicated electronic band structures. Although many textbooks (e.g.[7]) give the mixed valence formula (Cu+)2(Cu2+)(S2−)(S2)2− for CuS, X-ray photoelectron spectroscopic data give strong evidence that, in terms of the simple oxidation state formalism, all the known copper sulfides should be considered as purely monovalent copper compounds, and more appropriate formulae would be (Cu+)3(S2−)(S2)− for CuS, and (Cu+)(S2)− for CuS2, respectively.[8][9][10]
[11][12]
Further evidence that the assignment of the so-called «valence hole» should be to the S2 units in these two formulae is the length of the S-S bonds, which are significantly shorter in CuS (0.207 nm) and CuS2 (0.203 nm) than in the «classical» disulfide Fe2+(S2)2− (0.218 nm). This bond length difference has been ascribed to the higher bond order in (S-S)− compared to (S-S)2− due to electrons being removed from a π* antibonding orbital.[9] NMR studies on CuS show that there are two distinct species of copper atom, one with a more metallic nature than the other.[13] This apparent discrepancy with the X-ray photo-electron spectrum data simply highlights the problem that NMR has in assigning oxidation states in a mixed-valence compound. The issue of the valence of copper in sulfides (as well as selenides and tellurides) continues to be revisited in the literature. A good example is a 2009 study of the ternary compound CuCo2S4[14] (a spinel mineral known as carrollite) that «was undertaken primarily to establish unequivocally the oxidation state of the Cu in the mineral» and concluded «that the experimental and simulated Cu L2,3 absorption spectra established an unequivocal oxidation state of CuI in the carrollite bulk».
See also[edit]
- Copper(I) sulfide
- Copper(II) sulfide
References[edit]
- J.C.W. Folmer Holes in the valence band of copper chalcogenides Thesis 1981 Groningen State University (Neth).
- ^ Whiteside, L.S; Goble, R.J (1986). «Structural and compositional changes in copper sulfide during leaching and dissolution». The Canadian Mineralogist. 24 (2): 247–258.
- ^ a b c d e f Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ http://rruff.geo.arizona.edu/doclib/hom/villamaninite.pdf Handbook of Mineralogy
- ^ a b Copper sulfides from Alberta; yarrowite Cu9S8 and spionkopite Cu39S28 R. J. Goble, The Canadian Mineralogist; (1980); 18; 4; 511-518
- ^ Goble, R.J.; Robinson, G. (1980). «Geerite, Cu1.60S, a new copper sulfide from Dekalb Township, New York». The Canadian Mineralogist. 18 (4): 519–523.
- ^ Mumme, W. G.; Gable, R. W.; Petricek, V. (2012-04-01). «The Crystal Structure of Roxybyite, Cu58S32«. The Canadian Mineralogist. Mineralogical Association of Canada. 50 (2): 423–430. doi:10.3749/canmin.50.2.423. ISSN 0008-4476.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Folmer, J.C.W; Jellinek, F (1980). «The valence of copper in sulphides and selenides: An X-ray photoelectron spectroscopy study». Journal of the Less Common Metals. Elsevier BV. 76 (1–2): 153–162. doi:10.1016/0022-5088(80)90019-3. ISSN 0022-5088.
- ^ a b Folmer, J.C.W.; Jellinek, F.; Calis, G.H.M. (1988). «The electronic structure of pyrites, particularly CuS2 and Fe1−xCuxSe2: An XPS and Mössbauer study». Journal of Solid State Chemistry. Elsevier BV. 72 (1): 137–144. doi:10.1016/0022-4596(88)90017-5. ISSN 0022-4596.
- ^ Romero-Jaime, A.K.; Vargas-Hernández, D.; Acosta-Enríquez, M.C.; Tánori-Córdova, J.C.; Valenzuela-Badilla, J.; Castillo, S.J. (March 2020). «Novel route for simplified and efficient synthesis of spiky-like copper sulfide nanoballs by soft chemistry method and their basic physicochemical characterizations». Materials Science in Semiconductor Processing. 107: 104830. doi:10.1016/j.mssp.2019.104830.
- ^ Goh, Siew Wei; Buckley, Alan N.; Lamb, Robert N. (2006). «Copper(II) sulfide?». Minerals Engineering. Elsevier BV. 19 (2): 204–208. doi:10.1016/j.mineng.2005.09.003. ISSN 0892-6875.
- ^ Goh, Siew Wei; Buckley, Alan N.; Lamb, Robert N.; Rosenberg, Richard A.; Moran, Damian (2006). «The oxidation states of copper and iron in mineral sulfides, and the oxides formed on initial exposure of chalcopyrite and bornite to air». Geochimica et Cosmochimica Acta. Elsevier BV. 70 (9): 2210–2228. doi:10.1016/j.gca.2006.02.007. ISSN 0016-7037.
- ^ Saito, Shin-hachiro; Kishi, Hideki; Nié, Kohji; Nakamaru, Hisakazu; Wagatsuma, Fumihiko; Shinohara, Takeshi (1997-06-01). «63Cu NMR studies of copper sulfide». Physical Review B. American Physical Society (APS). 55 (21): 14527–14535. doi:10.1103/physrevb.55.14527. ISSN 0163-1829.
- ^ Electronic environments in carrollite, CuCo2S4, determined by soft X-ray photoelectron and absorption spectroscopy
Alan N. Buckley, William M. Skinner, Sarah L. Harmer, Allan Pring and Liang-Jen Fan
Geochimica et Cosmochimica Acta
Volume 73, Issue 15, 1 August 2009, Pages 4452-4467
External links[edit]
- Copper sulfides mineral information and data
Моносульфид CuS — сине-черные кристаллы (см. табл.); т. пл. 502 °С (инконгруэнтно); С 0 р 47,86 ДжДмоль . К); S0298 66,6 Дж/(моль . К); при нагр. в вакууме выше ~300°С разлагается до Cu2S и паров S; на воздухе легко окисляется до СuО, в присут. влаги-до CuSO4; произведение р-римости 6,3.10-36 .
ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ СУЛЬФИДОВ МЕДИ

* DH0 перехода a ->b при 103 °С. ** DH0 перехода b->g при 437°С.
С у л ь ф и д м е д и(I) (гемисульфид) Cu2S-черновато-серые кристаллы; существует в трех модификациях — a, b, g; т-ры перехода a-> b 103°С, b->g 437°С (при содержании 33,33 ат. % Си); для a-Cu2S: C0p >76,37 ДжДмольХК); 0298 121,0 ДжДмоль . К); для g-Cu2S: С 0p 85,08 ДжДмоль . К); т. пл. 1129°С; DH0 пл 11,3 кДж/моль. g-Cu2S при нагр. в вакууме выше ~700°С диссоциирует с образованием Си и паров S, ур-ние температурной зависимости давления пара S: lg p(мм рт. ст.) = Ч 15845/T + 9,11; произведение р-римости 2,5 х х 10 -48. При нагр. на воздухе все модификации Cu2S окисляются до CuSO4, CuO, SO2. Для Cu2S характерна нестехиометрия. Область гомогенности b-Cu2S 33,33-33,44 ат. % Сu (93-103 °С), g-Cu2S 33,33-36,4 ат. % Сu (507 °С). Известны нестехиометрич. фазы: Cu2-xS с 0=< х=< =<0,02, 0,03 =< х =<0,04, 0,04 < x < 0,1; Cu1,8S. Сульфид Cu1,8S существует в неск. кристаллич. модификациях, нек-рые из них метастабильны; ниже 33 °С разлагается на Cu7S4 и Cu1,96S. Фазы в области составов Cu2S-Cu1,8S-полупроводники p-типа, b-Cu2S имеет также ионную проводимость; ширина запрещенной зоны для a-Cu2S 1,26 эВ (80 К), b-Cu2S 1,7-2 эВ, g-Cu2S 1,3 эВ.
Известен малоустойчивый CuS2 с кубич. кристаллич. решеткой ( а =0,580 нм, 2 =4, плотн. 4,24 г/см ).
Все М. с. практически не раств. в воде, разб. H2SO4, соляной к-те, раств. в царской водке, HNO3; Cu2S и CuS диамагнитны.
М. с. встречаются в природе в виде минералов ковеллина CuS, халькозина (или медного блеска) a-Cu2S, a-Cu2S + + b-Cu2S, джарлеита Cu1,97S, дигенита Cu1,8S, анилита Cu7S4, халькопирита CuFeS2, борнита Cu5FeS4.
Получают М. с. из Си и S при нагр. в вакуумированных кварцевых ампулах, CuS-также осаждением из водных р-ров солей Cu(II) при действии H2S в слабокислой среде; монокристаллы Cu2S выращивают зонной плавкой. Ковел-лин, халькозин, борнит, халькопирит-сырье в произ-ве Сu, CuSO4; CuS-пигмент в красках; Cu2S-компонент медного штейна при пирометаллургич. получении Сu, полупроводник, компонент полупроводниковых сплавов. М. с. токсичны; для аэрозолей ПДК 4 мг/м 3.
Лит.: Самсонов Г. В., Дроздова С. В., Сульфиды, М., 1972, с. 32 38; Полупроводниковые халькогениды и сплавы на их основе, М., 1975.
И. Н. Один.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфид меди(II)
Брутто-формула:
CuS
CAS# 1317-40-4
Категории:
Неорганические соли
PubChem CID: 14831
| NSC 47694
| CHEBI:51110
| MolPort-003-930-618
| ChemSpider ID: 145403
| CB6765538
Названия
Русский:
- Сульфид меди(II) [Wiki]
- моносульфид меди
English:
- CI 77450
- CI Pigment Blue 34
- Copper Blue
- Copper monosulfide [Wiki]
- Copper sulfide (CuS)
- Copper sulphide
- Copper(2+) sulfide(IUPAC)
- Copper(II) sulfide
- Covellite [Wiki]
- Cupric sulfide
- EINECS:215-271-2
- Horace Vernet’s Blue
- Oil Blue
- copper sulfide
- sulfanylidenecopper(IUPAC)
- thioxocopper
Варианты формулы:
CuS
Cu=S
Cu^2+_(x1.4,N0)S^2-
Вещества, имеющие отношение…
Анион:
Сульфиды
Химический состав
Реакции, в которых участвует Сульфид меди(II)
-
CuSO4 + H2S -> CuS»|v» + H2SO4
-
Cu{X}2 + {M}2S -> CuS»|v» + 2{M}{X}
, где X =
Cl Br F I (NO3) (CH3COO); M =
Na K Li Rb Cs -
2Cu2S + S2 -> 4CuS
-
2CuS «200-450^oC»—> Cu2S + S
-
2CuS + H2 «600-700^oC»—> Cu2S + H2S
И ещё 2 реакции…
Сульфид меди(II) (моносульфид меди) — CuS, неорганическое бинарное соединение двухвалентной меди с серой. Чёрное, нерастворимое в воде и разбавленных растворах кислот вещество. Встречается в природе в виде редкого минерала ковеллина.
Получают прямым взаимодействием элементов или обменной реакцией солей двухвалентной меди с водорастворимыми сульфидами.
Полученный сухим путём (теплота образования из элементов 12 ккал/моль)
сульфид меди довольно хорошо проводит электрический ток (а ниже 1,66 K
становится сверхпроводником). Рентгеноструктурное исследование его кристаллов выявило их совершенно особую и сложную структуру: Одна треть атомов меди находится
в центрах треугольников из атомов серы [d (CuS) = 2,19 Å], а две трети — в центрах
тетраэдров [d (CuS) = 2,32 Å]; кроме того, две трети атомов серы представлены группировками S2 ([S2]2−), подобными имеющимся в пирите. В связи с этим строение кристалла CuS можно было бы уточнённо выразить формулой
![{displaystyle {stackrel {I}{mbox{Cu}}}_{4}{stackrel {II}{mbox{Cu}}}_{2}[{stackrel {-1}{mbox{S}}}_{2}]_{2}{stackrel {-2}{mbox{S}}}_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a5e2a17abdcd886c07f83dc5583d0396502bbe6)
Около 400 °C наступает заметное разложение сульфида по схеме 2CuS == Cu2S + S
(давление диссоциации при 450 °C равно 80 мм рт. ст.). Известны также полисульфидные
производные меди Cu2Sn (где n = 3 ÷ 6; а также CuS2) и её селенид CuSe (теплота образования из элементов 10 ккал/моль). Взаимодействием CuSO4 с насыщенным серой раствором полисульфида могут быть получены довольно устойчивые красные кристаллы тиосолей типа MCuS. (где M — NH4, K, Rb, Cs). Наименее растворима из них соль цезия.[1]
Получение
Примечания
- ↑ Некрасов Б. В. Основы общей химии, — Т. II, — М.: Химия, 1973. — с. 274—275
* Бетехтин А. Г. Группа ковеллина // Курс минералогии: учебное пособие. — М.: КДУ, 2007. — С. 226—228. — 721 с. Архивная копия от 29 мая 2014 на Wayback Machine
Эта страница в последний раз была отредактирована 11 августа 2022 в 09:24.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
| Сульфид меди(II) | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Сульфид меди(II) |
| Традиционные названия | Сульфид меди, моносульфид меди |
| Хим. формула | CuS |
| Рац. формула | CuS |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 95,61 г/моль |
| Плотность | 4,6 г/см³ |
| Оптические свойства | |
| Показатель преломления | 1,45 |
| Классификация | |
| Рег. номер CAS | 1317-40-4 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид меди(II) (моносульфид меди) — CuS, неорганическое бинарное соединение двухвалентной меди с серой. Чёрное, нерастворимое в воде и разбавленных растворах кислот вещество. Встречается в природе в виде редкого минерала ковеллина.
Получают прямым взаимодействием элементов или обменной реакцией солей двухвалентной меди с водорастворимыми сульфидами.
Полученный сухим путём (теплота образования из элементов 12 ккал/моль)
сульфид меди довольно хорошо проводит электрический ток (а ниже 1,66 K
становится сверхпроводником). Рентгеноструктурное исследование его кристаллов выявило их совершенно особую и сложную структуру: Одна треть атомов меди находится
в центрах треугольников из атомов серы [d (CuS) = 2,19 Å], а две трети — в центрах
тетраэдров [d (CuS) = 2,32 Å]; кроме того, две трети атомов серы представлены группировками S2 ([S2]2−), подобными имеющимся в пирите. В связи с этим строение кристалла CuS можно было бы уточнённо выразить формулой
[math]displaystyle{ stackrel{I}{mbox {Cu}}_{4} stackrel{II}{mbox {Cu}}_{2} [stackrel{-1}{mbox {S}}_{2}]_{2} stackrel{-2}{mbox {S}}_{2} }[/math].
Около 400 °C наступает заметное разложение сульфида по схеме 2CuS == Cu2S + S
(давление диссоциации при 450 °C равно 80 мм рт. ст.). Известны также полисульфидные
производные меди Cu2Sn (где n = 3 ÷ 6; а также CuS2) и её селенид CuSe (теплота образования из элементов 10 ккал/моль). Взаимодействием CuSO4 с насыщенным серой раствором полисульфида могут быть получены довольно устойчивые красные кристаллы тиосолей типа MCuS. (где M — NH4, K, Rb, Cs). Наименее растворима из них соль цезия.[1]
Получение
- [math]displaystyle{ mathsf{Na_2S+ CuSO_4 rightarrow CuS + Na_2SO_4} }[/math]
Примечания
- ↑ Некрасов Б. В. Основы общей химии, — Т. II, — М.: Химия, 1973. — с. 274—275
* Бетехтин А. Г. Группа ковеллина // Курс минералогии: учебное пособие. — М.: КДУ, 2007. — С. 226—228. — 721 с. Архивная копия от 29 мая 2014 на Wayback Machine

