У этого термина существуют и другие значения, см. Сульфиды ртути.
Киноварь
| Сульфид ртути(II) | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Сульфид ртути(II) |
| Традиционные названия | Сульфид ртути, киноварь (α-HgS), метациннабарит (β-HgS) |
| Химическая формула | HgS |
| Эмпирическая формула | HgS |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 232,66 г/моль |
| Плотность | (α-HgS): 8,19 г/см3 (β-HgS): 7,73 г/см³ |
| Термические свойства | |
| Энтальпия образования (ст. усл.) | -59 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1344-48-5 |
Сульфид ртути(II) — неорганическое бинарное соединение ртути с серой, имеющее химическую формулу HgS. Нерастоворимо в воде.
Существует в двух модификациях: α-HgS (тригональная сингония) и β-HgS (кубическая сингония). Первая, ярко-красная, при нагревании свыше 345 °C превращается во вторую, имеющую чёрный цвет. В природе α-модификация распространена в виде рудного ртутного минерала киновари, β-модификация — минерал метациннабарит.
Также сульфид ртути входит в состав следующих минералов:
- акташит — смешанный сульфид ртути, меди и мышьяка.
- гвадалкацарит — (Hg,Zn)S.
- ливингстонит — HgSb4S8.
- опофрит — Hg(S,Se).
- сауковит — (Hg,Cd)S.
- шватцит — смешанный сульфид ртути, меди и сурьмы.
Физические свойства
Получение
Взаимодействие металлической ртути и элементарной серы (реакция демеркуризации)
Hg + S = HgS↓
Химические свойства
Применение
Киноварь является основной рудой ртути и добывается в промышленных объёмах.
С древних времён природный сульфид ртути (киноварь) широко использовался как красный пигмент для производства красок, однако в связи с токсичностью ртути, его применение в этом качестве в настоящий момент ограничено.
Сульфид ртути вследствие его крайне низкой летучести и растворимости в воде применяется как соединение, образование которого служит одним из методов демеркуризации.
Соединение является мощным фунгицидом и может использоваться для обработки бетонных строительных конструкций в целях профилактики грибковых поражений.
From Wikipedia, the free encyclopedia
This article is about the mercuric salt. For the mercurous salt, see mercury(I) sulfide.

|
|
| Names | |
|---|---|
| IUPAC name
Mercury sulfide |
|
| Other names
Cinnabar |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ECHA InfoCard | 100.014.270 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 2025 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
HgS |
| Molar mass | 232.66 g/mol |
| Density | 8.10 g/cm3 |
| Melting point | 580 °C (1,076 °F; 853 K) decomposes |
|
Solubility in water |
insoluble |
| Band gap | 2.1 eV (direct, α-HgS) [1] |
|
Magnetic susceptibility (χ) |
−55.4·10−6 cm3/mol |
|
Refractive index (nD) |
w=2.905, e=3.256, bire=0.3510 (α-HgS) [2] |
| Thermochemistry | |
|
Std molar |
78 J·mol−1·K−1[3] |
|
Std enthalpy of |
−58 kJ·mol−1[3] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
   
|
|
Signal word |
Warning |
|
Hazard statements |
H300, H310, H317, H330, H373, H410 |
|
Precautionary statements |
P261, P272, P280, P302+P352, P321, P333+P313, P363, P501 |
| NFPA 704 (fire diamond) |
4 0 0 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | Fisher Scientific |
| Related compounds | |
|
Other anions |
Mercury oxide Mercury selenide Mercury telluride |
|
Other cations |
Zinc sulfide Cadmium sulfide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Mercury sulfide, or mercury(II) sulfide is a chemical compound composed of the chemical elements mercury and sulfur. It is represented by the chemical formula HgS. It is virtually insoluble in water.[4]
Crystal structure[edit]
Structure of a-HgS looking at the a-axis
Structure of a-HgS looking at the c-axis
HgS is dimorphic with two crystal forms:
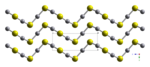
- red cinnabar (α-HgS, trigonal, hP6, P3221) is the form in which mercury is most commonly found in nature. Cinnabar has rhombohedral crystal system. Crystals of red are optically active. This is caused by the Hg-S helices in the structure.[5]
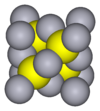
- black metacinnabar (β-HgS) is less common in nature and adopts the zinc blende (T2d—F43m) crystal structure.
Preparation and chemistry[edit]
β-HgS precipitates as a black solid when Hg(II) salts are treated with H2S. The reaction is conveniently conducted with an acetic acid solution of mercuric acetate. With gentle heating of the slurry, the black polymorph converts to the red form.[6] β-HgS is unreactive to all but concentrated acids.[4]
Mercury is produced from the cinnabar ore by roasting in air and condensing the vapour.[4]
- HgS → Hg + S
Uses[edit]
Cinnabar (red portion of specimen) from Nevada, US.
When α-HgS is used as a red pigment, it is known as vermilion. The tendency of vermilion to darken has been ascribed to conversion from red α-HgS to black β-HgS. However β-HgS was not detected at excavations in Pompeii, where originally red walls darkened, and was attributed to the formation of Hg-Cl compounds (e.g., corderoite, calomel, and terlinguaite) and calcium sulfate, gypsum.[7]
As the mercury cell as used in the chlor-alkali industry (Castner–Kellner process) is being phased out over concerns over mercury emissions, the metallic mercury from these setups is converted into mercury sulfide for underground storage.
With the band gap of 2.1eV and its stability, it is possible to be used as photo-electrochemical cells[8]
See also[edit]
- Mercury poisoning
- Mercury(I) sulfide (mercurous sulfide), Hg
2S
References[edit]
- ^ L. I. Berger, Semiconductor Materials (1997) CRC Press ISBN 0-8493-8912-7
- ^ Webminerals
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 1406. ISBN 978-0-08-022057-4.
- ^ A. M. Glazer, K. Stadnicka (1986). «On the origin of optical activity in crystal structures». J. Appl. Crystallogr. 19 (2): 108–122. doi:10.1107/S0021889886089823.
- ^ Newell, Lyman C.; Maxson, R. N.; Filson, M. H. (1939). «Red Mercuric Sulfide». Inorganic Syntheses. Inorganic Syntheses. Vol. 1. pp. 19–20. doi:10.1002/9780470132326.ch7. ISBN 9780470132326.
- ^
Cotte, M; Susini J; Metrich N; Moscato A; Gratziu C; Bertagnini A; Pagano M (2006). «Blackening of Pompeian Cinnabar Paintings: X-ray Microspectroscopy Analysis». Anal. Chem. 78 (21): 7484–7492. doi:10.1021/ac0612224. PMID 17073416. - ^ Davidson, R. S.; Willsher, C. J. (March 1979). «Mercury(II) sulphide: a photo-stable semiconductor». Nature. 278 (5701): 238–239. doi:10.1038/278238a0. ISSN 1476-4687.
From Wikipedia, the free encyclopedia
This article is about the mercuric salt. For the mercurous salt, see mercury(I) sulfide.

|
|
| Names | |
|---|---|
| IUPAC name
Mercury sulfide |
|
| Other names
Cinnabar |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ECHA InfoCard | 100.014.270 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 2025 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
HgS |
| Molar mass | 232.66 g/mol |
| Density | 8.10 g/cm3 |
| Melting point | 580 °C (1,076 °F; 853 K) decomposes |
|
Solubility in water |
insoluble |
| Band gap | 2.1 eV (direct, α-HgS) [1] |
|
Magnetic susceptibility (χ) |
−55.4·10−6 cm3/mol |
|
Refractive index (nD) |
w=2.905, e=3.256, bire=0.3510 (α-HgS) [2] |
| Thermochemistry | |
|
Std molar |
78 J·mol−1·K−1[3] |
|
Std enthalpy of |
−58 kJ·mol−1[3] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
   
|
|
Signal word |
Warning |
|
Hazard statements |
H300, H310, H317, H330, H373, H410 |
|
Precautionary statements |
P261, P272, P280, P302+P352, P321, P333+P313, P363, P501 |
| NFPA 704 (fire diamond) |
4 0 0 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | Fisher Scientific |
| Related compounds | |
|
Other anions |
Mercury oxide Mercury selenide Mercury telluride |
|
Other cations |
Zinc sulfide Cadmium sulfide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Mercury sulfide, or mercury(II) sulfide is a chemical compound composed of the chemical elements mercury and sulfur. It is represented by the chemical formula HgS. It is virtually insoluble in water.[4]
Crystal structure[edit]
Structure of a-HgS looking at the a-axis
Structure of a-HgS looking at the c-axis
HgS is dimorphic with two crystal forms:
- red cinnabar (α-HgS, trigonal, hP6, P3221) is the form in which mercury is most commonly found in nature. Cinnabar has rhombohedral crystal system. Crystals of red are optically active. This is caused by the Hg-S helices in the structure.[5]
- black metacinnabar (β-HgS) is less common in nature and adopts the zinc blende (T2d—F43m) crystal structure.
Preparation and chemistry[edit]
β-HgS precipitates as a black solid when Hg(II) salts are treated with H2S. The reaction is conveniently conducted with an acetic acid solution of mercuric acetate. With gentle heating of the slurry, the black polymorph converts to the red form.[6] β-HgS is unreactive to all but concentrated acids.[4]
Mercury is produced from the cinnabar ore by roasting in air and condensing the vapour.[4]
- HgS → Hg + S
Uses[edit]
Cinnabar (red portion of specimen) from Nevada, US.
When α-HgS is used as a red pigment, it is known as vermilion. The tendency of vermilion to darken has been ascribed to conversion from red α-HgS to black β-HgS. However β-HgS was not detected at excavations in Pompeii, where originally red walls darkened, and was attributed to the formation of Hg-Cl compounds (e.g., corderoite, calomel, and terlinguaite) and calcium sulfate, gypsum.[7]
As the mercury cell as used in the chlor-alkali industry (Castner–Kellner process) is being phased out over concerns over mercury emissions, the metallic mercury from these setups is converted into mercury sulfide for underground storage.
With the band gap of 2.1eV and its stability, it is possible to be used as photo-electrochemical cells[8]
See also[edit]
- Mercury poisoning
- Mercury(I) sulfide (mercurous sulfide), Hg
2S
References[edit]
- ^ L. I. Berger, Semiconductor Materials (1997) CRC Press ISBN 0-8493-8912-7
- ^ Webminerals
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 1406. ISBN 978-0-08-022057-4.
- ^ A. M. Glazer, K. Stadnicka (1986). «On the origin of optical activity in crystal structures». J. Appl. Crystallogr. 19 (2): 108–122. doi:10.1107/S0021889886089823.
- ^ Newell, Lyman C.; Maxson, R. N.; Filson, M. H. (1939). «Red Mercuric Sulfide». Inorganic Syntheses. Inorganic Syntheses. Vol. 1. pp. 19–20. doi:10.1002/9780470132326.ch7. ISBN 9780470132326.
- ^
Cotte, M; Susini J; Metrich N; Moscato A; Gratziu C; Bertagnini A; Pagano M (2006). «Blackening of Pompeian Cinnabar Paintings: X-ray Microspectroscopy Analysis». Anal. Chem. 78 (21): 7484–7492. doi:10.1021/ac0612224. PMID 17073416. - ^ Davidson, R. S.; Willsher, C. J. (March 1979). «Mercury(II) sulphide: a photo-stable semiconductor». Nature. 278 (5701): 238–239. doi:10.1038/278238a0. ISSN 1476-4687.
| Сульфид ртути II | |
|---|---|
| Систематическое наименование |
Сульфид ртути II |
| Традиционные названия | Киноварь (α), метациннабарит (β), гиперциннабарит (γ) |
| Хим. формула | HgS |
| Рац. формула | HgS |
| Состояние | твёрдое |
| Молярная масса | 232,66 г/моль |
| Плотность | (α) 8,09; (β) 7,73 г/см³ |
| Температура | |
| • плавления | 820 °C |
| Мол. теплоёмк. | (α) 48,41; (β) 48,50 Дж/(моль·К) |
| Энтальпия | |
| • образования | (α) − 57,6; (β) − 49,4 кДж/моль |
| Рег. номер CAS | 1344-48-5 |
| PubChem | 62402 |
| Рег. номер EINECS | 215-696-3 |
| SMILES |
S=[Hg] |
| InChI |
1S/Hg.S QXKXDIKCIPXUPL-UHFFFAOYSA-N |
| ChemSpider | 56188 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид ртути II (моносульфид ртути) — неорганическое бинарное соединение ртути с серой, имеющее химическую формулу Hg1−x S.
При атмосферном давлении существует в трех полиморфных модификациях: тригональной α-HgS (киноварь), стабильной до 345 °C, кубической β-HgS (метациннабарит), стабильной в интервале от 315 до 481 °C, и гексагональной γ-HgS (гиперциннабарит), стабильной от 470 °C до температуры конгруэнтного плавления 820 °C. Первая из них ярко-красного цвета, вторая имеет чёрный цвет. При давлении 21 ГПа возникает четвертая модификация, имеющая кубическую структуру.
Содержание
- 1 Физические свойства и фазовые равновесия
- 2 Получение
- 3 Химические свойства
- 4 Нахождение в природе
- 5 Этимология
- 6 Применение
Физические свойства и фазовые равновесия
Все модификации являются фазами переменного состава, область гомогенности α-HgS при 315 °C доходит до ~ 4 мол. %. Области гомогенности всех фаз смещены в сторону серы, поэтому модификации сульфида ртути могут быть описаны как фазы с недостатком катионообразователя: Hg1−xS , x⩾0.
| Фаза | Минералогическое название | Простр. группа | Структурный тип | Стабильна в интервале, °C |
|---|---|---|---|---|
| α — HgS | киноварь | P3121 | собственный | до 345 |
| β — HgS | метациннабарит | F4¯3m | α — ZnS (сфалерит) | 315 — 481 |
| γ — HgS | гиперциннабарит | гекс. | 470 — 820 | |
| δ — HgS | (нет) | Fm3¯m | NaCl | высокого давления |
Модификации α и β являются полупроводниками. Красная окраска киновари обусловлена большой величиной запрещенной зоны (соответствующей краю поглощения ок. 590 нм). β-Модификация является узкозонным полупроводником; как и все сфалеритоподобные соединения, она имеет прямозонную структуру.
| Фза | Прарметры решетки | z | ρ , г/см3 | Eg , эВ | μn , см2/(В·с) | |
|---|---|---|---|---|---|---|
| a, нм | c, нм | |||||
| α — HgS | 0,4145 — 0,4162 | 0,9460 — 0,9530 | 3 | 8,09 | 2,1 | 45 ( ∥c), 13 (⊥c ) |
| β — HgS | 0,586 | 4 | 7,73 | 0,15 | 250 | |
| γ — HgS | 0,701 | 1,413 | ||||
| Примечание: z — число стехиометрических единиц в ячейке; ρ — плотность; Eg — ширина запрещенной зоны; μn — подвижность электронов проводимости |
Переход α-фазы в β-фазу при атмосферном давлении происходит в интервале температур 315 — 345 °C; область сосуществования фаз ограничена трехфазными равновесиями: эвтектоидным
- α + L(S) ⇄ β
и перитектическим
- α ⇄ L(Hg) + β.
Здесь L(S) — жидкость на основе серы; L(Hg) — жидкость на основе ртути. Переход β-фазы в γ-фазу происходит в интервале температур 470 — 481 °C; область сосуществования фаз ограничена трехфазными равновесиями: эвтектоидным
- β + L(S) ⇄ γ
и перитектическим
- β ⇄ L(Hg) + γ.
γ-Фаза плавится конгруэнтно при 820 °C.
Получение
Все модификации моносульфида ртути можно получить прямым синтезом из простых веществ при соответствующих температурах и контролируемом давлении пара. Монокристаллы получают выращиванием из расплавов или осаждением из паровой фазы. Киноварь можно также получить растиранием ртути с кристаллической серой при комнатной температуре.
При осаждении сероводородом из растворов солей ртути II осаждается черная β-модификация HgS, метастабильная при комнатной температуре. При постепенном пропускании сероводорода через раствор хлорида ртути вначале образуется белый осадок сульфохлорида:
-
- 3 HgCl2 + 2 H2S → Hg3S2Cl2 ↓ + 4 HCl
который постепенно переходит в желтый, бурый и, наконец, черный сульфид ртути:
-
- Hg3S2Cl2 + H2S → 3 HgS ↓ + 2 HCl
Обработкой растворами полисульфидов щелочных металлов черный сульфид ртути переводят в красную модификацию.
Химические свойства
Киноварь и метациннабарит малорастворимы в воде: произведения растворимости их при 25 °C составляют соответственно: 4,0⋅10−53 и 1,6⋅10−5. Киноварь необычайно инертна к кислотам и щелочам и растворяется лишь в царской водке.
При нагревании в инертной атмосфере киноварь возгоняется, при окислении на воздухе чернеет вследствие образования металлической ртути:
-
- HgS + O2 → Hg + SO2
Нахождение в природе
В природе α-модификация распространена в виде минерала киновари, β-модификация встречается в виде минерала метациннабарита. Многие минералы являются твердыми растворами или соединениями моносульфида ртути с другими халькогенидами, например:
- гвадалкацарит — (Hg, Zn)S;
- сауковит — (Hg, Cd)S;
- опофрит — Hg(S, Se);
- акташит — Cu6Hg3As5S12;
- ливингстонит — HgSb4S8.
Киноварь является основной рудой ртути и добывается в промышленных объёмах.
Этимология
В русском языке название киноварь восходит к др.-греч. κιννάβαρι, лат. cinnabari. При этом в латинском языке слово cinnabari означает красную краску не столько минерального, сколько растительного происхождения — «драконову кровь», извлекаемую из сока некоторых растений, например, Calamus Draco. Корень κιννα- вообще означает красный или красно-коричневый цвета, с чем связаны названия κιννάμωμον (κίνναμον), cinnamoma — корица.
Применение
С древних времён киноварь широко использовалась как красный пигмент для производства красок, однако в связи с токсичностью ртути, его применение в этом качестве в настоящий момент ограничено.
Сульфид ртути вследствие его крайне низкой летучести и нерастворимости в воде применяется как соединение, образование которого служит одним из методов демеркуризации.
Соединение является мощным фунгицидом и может использоваться для обработки бетонных строительных конструкций в целях профилактики грибковых поражений.
Как широкозонный полупроводник α-модификация используется для создания полупроводниковых детекторов ионизирующего излучения, в особенности гамма-квантов, так как благодаря высокой плотности и высокому среднему заряду ядра эффективно поглощает гамма-излучение. На основе сульфида ртути II получают полупроводниковые твердые растворы путем замещения как в катионной (например, Hg1−xCdxS), так и в анионной (например, HgS1−xSex) подрешетках.
У этого термина существуют и другие значения, см. Сульфиды ртути.
| Сульфид ртути(II) | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Сульфид ртути (II) |
| Традиционные названия |
Киноварь (α), метациннабарит (β), гиперциннабарит (γ) |
| Хим. формула | HgS |
| Рац. формула | HgS |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 232,66 г/моль |
| Плотность |
(α) 8,09; (β) 7,73 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 820 °C |
| Мол. теплоёмк. |
(α) 48,41; (β) 48,50 Дж/(моль·К) |
| Энтальпия | |
| • образования |
(α) − 57,6; (β) − 49,4 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1344-48-5 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид ртути (II) (моносульфид ртути) — неорганическое бинарное соединение ртути с серой, имеющее химическую формулу [math]displaystyle{ text{Hg}_{1 — x}text{S} }[/math].
При атмосферном давлении существует в трех полиморфных модификациях: тригональной α-HgS (киноварь), стабильной до 345 °C, кубической β-HgS (метациннабарит), стабильной в интервале от 315 до 481 °C, и гексагональной γ-HgS (гиперциннабарит), стабильной от 470 °C до температуры конгруэнтного плавления 820 °C. Первая из них ярко-красного цвета, вторая имеет чёрный цвет. При давлении 21 ГПа возникает четвертая модификация, имеющая кубическую структуру [1].
Физические свойства и фазовые равновесия
Все модификации являются фазами переменного состава, область гомогенности α-HgS при 315 °C доходит до ~ 4 мол. %. Области гомогенности всех фаз смещены в сторону серы, поэтому модификации сульфида ртути могут быть описаны как фазы с недостатком катионообразователя: [math]displaystyle{ text{Hg}_{1 — x}text{S}, x geqslant 0 }[/math].
| Фаза | Минералогическое название | Простр. группа | Структурный тип | Стабильна в интервале, °C |
|---|---|---|---|---|
| [math]displaystyle{ alphatext{-}text{Hg}text{S} }[/math] | киноварь | [math]displaystyle{ P3_121 }[/math] | собственный | до 345 |
| [math]displaystyle{ betatext{-}text{Hg}text{S} }[/math] | метациннабарит | [math]displaystyle{ Fbar{4}3m }[/math] | [math]displaystyle{ alphatext{-}text{Zn}text{S} }[/math] (сфалерит) | 315 — 481 |
| [math]displaystyle{ gammatext{-}text{Hg}text{S} }[/math] | гиперциннабарит | гекс. | 470 — 820 | |
| [math]displaystyle{ deltatext{-}text{Hg}text{S} }[/math] | (нет) | [math]displaystyle{ Fmbar{3}m }[/math] | [math]displaystyle{ text{Na}text{Cl} }[/math] | высокого давления |
Модификации α и β являются полупроводниками. Красная окраска киновари обусловлена большой величиной запрещенной зоны (соответствующей краю поглощения ок. 590 нм). β-Модификация является узкозонным полупроводником; как и все сфалеритоподобные соединения, она имеет прямозонную структуру.
| Фза | Параметры решетки | [math]displaystyle{ z }[/math] | [math]displaystyle{ rho }[/math], г/см3 | [math]displaystyle{ E_g }[/math], эВ | [math]displaystyle{ mu_n }[/math], см2/(В·с) | |
|---|---|---|---|---|---|---|
| [math]displaystyle{ a }[/math], нм | [math]displaystyle{ c }[/math], нм | |||||
| [math]displaystyle{ alphatext{-}text{Hg}text{S} }[/math] | 0,4145 — 0,4162 | 0,9460 — 0,9530 | 3 | 8,09 | 2,1 | 45 ([math]displaystyle{ parallel,c }[/math]), 13 ([math]displaystyle{ perp c }[/math]) |
| [math]displaystyle{ betatext{-}text{Hg}text{S} }[/math] | 0,586 | 4 | 7,73 | 0,15 | 250 | |
| [math]displaystyle{ gammatext{-}text{Hg}text{S} }[/math] | 0,701 | 1,413 | ||||
| Примечание: [math]displaystyle{ z }[/math] — число стехиометрических единиц в ячейке; [math]displaystyle{ rho }[/math] — плотность; [math]displaystyle{ E_g }[/math] — ширина запрещенной зоны; [math]displaystyle{ mu_n }[/math] — подвижность электронов проводимости |
Переход α-фазы в β-фазу при атмосферном давлении происходит в интервале температур 315 — 345 °C; область сосуществования фаз ограничена трехфазными равновесиями: эвтектоидным
- [math]displaystyle{ alpha + L(text{S}) rightleftarrows beta }[/math]
и перитектическим
- [math]displaystyle{ alpha rightleftarrows L(text{Hg}) + beta }[/math].
Здесь [math]displaystyle{ L(text{S}) }[/math] — жидкость на основе серы; [math]displaystyle{ L(text{Hg}) }[/math] — жидкость на основе ртути. Переход β-фазы в γ-фазу происходит в интервале температур 470 — 481 °C; область сосуществования фаз ограничена трехфазными равновесиями: эвтектоидным
- [math]displaystyle{ beta + L(text{S}) rightleftarrows gamma }[/math]
и перитектическим
- [math]displaystyle{ beta rightleftarrows L(text{Hg}) + gamma }[/math].
γ-Фаза плавится конгруэнтно при 820 °C.
Получение
Все модификации моносульфида ртути можно получить прямым синтезом из простых веществ при соответствующих температурах и контролируемом давлении пара. Монокристаллы получают выращиванием из расплавов или осаждением из паровой фазы. Киноварь можно также получить растиранием ртути с кристаллической серой при комнатной температуре.
При осаждении сероводородом из растворов солей ртути (II) осаждается черная β-модификация HgS, метастабильная при комнатной температуре. При постепенном пропускании сероводорода через раствор хлорида ртути вначале образуется белый осадок сульфохлорида:
-
- [math]displaystyle{ mathsf{3HgCl_2 + 2H_2S rightarrow Hg_3S_2Cl_2downarrow + 4HCl} }[/math]
который постепенно переходит в желтый, бурый и, наконец, черный сульфид ртути [4]:
-
- [math]displaystyle{ mathsf{Hg_3S_2Cl_2 + H_2S rightarrow 3HgSdownarrow + 2HCl} }[/math].
Обработкой растворами полисульфидов щелочных металлов черный сульфид ртути переводят в красную модификацию.
Химические свойства
Киноварь и метациннабарит малорастворимы в воде: произведения растворимости их при 25 °C составляют соответственно: 4,0⋅10−53 и 1,6⋅10−5[5]. Киноварь необычайно инертна к кислотам и щелочам и растворяется лишь в царской водке.
При нагревании в инертной атмосфере киноварь возгоняется, при окислении на воздухе чернеет вследствие образования металлической ртути:
-
- [math]displaystyle{ mathsf{HgS + O_2 rightarrow Hg + SO_2} }[/math]
Нахождение в природе
В природе α-модификация распространена в виде минерала киновари, β-модификация встречается в виде минерала метациннабарита. Многие минералы являются твердыми растворами или соединениями моносульфида ртути с другими халькогенидами, например:
- гвадалкацарит — (Hg, Zn)S;
- сауковит — (Hg, Cd)S;
- опофрит — Hg(S, Se);
- акташит — Cu6Hg3As5S12;
- ливингстонит — HgSb4S8.
Киноварь является основной рудой ртути и добывается в промышленных объёмах.
Этимология
В русском языке название киноварь восходит к др.-греч. κιννάβαρι, лат. cinnabari [6]. При этом в латинском языке слово cinnabari означает красную краску не столько минерального, сколько растительного происхождения — «драконову кровь», извлекаемую из сока некоторых растений, например, Calamus Draco [7]. Корень κιννα- вообще означает красный или красно-коричневый цвета [8], с чем связаны названия κιννάμωμον (κίνναμον), cinnamoma — корица.
Применение
С древних времён киноварь широко использовалась как красный пигмент для производства красок, однако в связи с токсичностью ртути, его применение в этом качестве в настоящий момент ограничено.
Сульфид ртути вследствие его крайне низкой летучести и нерастворимости в воде применяется как соединение, образование которого служит одним из методов демеркуризации.
Соединение является мощным фунгицидом и может использоваться для обработки бетонных строительных конструкций в целях профилактики грибковых поражений.
Как широкозонный полупроводник α-модификация используется для создания полупроводниковых детекторов ионизирующего излучения, в особенности гамма-квантов, так как благодаря высокой плотности и высокому среднему заряду ядра эффективно поглощает гамма-излучение [9].
На основе сульфида ртути (II) получают полупроводниковые твердые растворы путем замещения как в катионной (например, [math]displaystyle{ text{Hg}_{1-x}text{Cd}_xtext{S} }[/math]), так и в анионной (например, [math]displaystyle{ text{Hg}text{S}_{1-x}text{Se}_x }[/math]) подрешетках.
Примечания
- ↑ 1,0 1,1 1,2 Диаграммы состояния двойных металлических систем: Справочник / Под ред. Н. П. Лякишева. — М.: Машиностроение, 1997. — Т. 2. — 1024 с. — ISBN 5-217-01569-1.
- ↑
Физические величины: Справочник / Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с. — ISBN 5-283-04013-5. - ↑ Химическая энциклопедия.
- ↑ Неорганическая химия / Под ред. Ю. Д. Третьякова. — М.: Академия, 2004. — Т. 3: Химия переходных элементов. — 368 с. — ISBN 5-7695-1436-1.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. — 6-е изд., перераб. и доп. — М.: Химия, 1989. — 448 с. — ISBN 5-7245-0000-0.
- ↑ Фасмер М. Этимологический словарь русского языка / Пер. с нем. и доп. О. Н. Трубачева. — 2-е изд., стер. — М.: Прогресс, 1986. — Т. 2. — 672 с.
- ↑ Дворецкий И. Х. Латинско-русский словарь. — 2-е изд., перераб. и доп. — М.: Русский язык, 1976. — 1096 с.
- ↑ Дворецкий И. Х. Древнегреческо-русский словарь / Под ред. С. И. Соболевского. — М.: Гос. изд-во иностр. и нац. словарей, 1958. — Т. 1. — 1043 с.
- ↑
A. Delin. First-principles calculations of the II-VI semiconductor β-HgS: Metal or semiconductor (англ.). — 2002. — Vol. 65. — Iss. 15. — P. 153205. — doi:10.1103/PhysRevB.65.153205.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- Бовина Л. А. и др. Физика соединений AIIBVI / Под ред. А. Н. Георгобиани, М. К. Шейнкмана. — М.: Наука, 1986. — 319 с.
 |
|
 |
|
| Имена | |
|---|---|
| Название ИЮПАК Сульфид ртути | |
| Другие имена Cinnabar. Vermilion | |
| Идентификаторы | |
| Номер CAS |
|
| ECHA InfoCard | 100.014.270 |
| PubChem CID |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
| Свойства | |
| Химическая формула | HgS |
| Молярная масса | 232,66 г / моль |
| Плотность | 8,10 г / см |
| Температура плавления | 580 ° C (1076 ° F; 853 K) разлагается |
| Растворимость в воде | нерастворим |
| Ширина запрещенной зоны | 2,1 эВ (прямое, α-HgS) |
| Магнитная восприимчивость (χ) | -55,4 · 10 см / моль |
| Показатель преломления (nD) | w = 2,905, e = 3,256, двойное излучение = 0,3510 (α-HgS) |
| Термохимия | |
| Стандартная молярная. энтропия (S 298) | 78 Дж · моль · K |
| Стандартная энтальпия образования. образования (ΔfH298) | −58 кДж · моль |
| Опасности | |
| Паспорт безопасности | ICSC 0981 |
| Классификация ЕС (DSD) (устарело) | Очень токсично ( T+). Опасно для окружающей среды (N) |
| R-фразы (устаревшие) | R26 / 27/28, R33, R50 / 53 |
| S-фразы (устаревшие) | (S1 / 2), S13, S28, S45, S60, S61 |
| NFPA 704 (огненный алмаз) |  1 3 0 1 3 0 |
| Температура вспышки | Невоспламеняющиеся |
| Родственные соединения | |
| Другие анионы | Оксид ртути. Селенид ртути. Теллурид ртути |
| Прочие катионы | Сульфид цинка. Сульфид кадмия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Сульфид ртути, сульфид ртути, сульфид ртути или сульфид ртути (II) является химическим веществом составной состав f химические элементы ртуть и сера. Он представлен химической формулой HgS. Он практически нерастворим в воде.
Содержание
- 1 Кристаллическая структура
- 2 Получение и химия
- 3 Использование
- 4 См. Также
- 5 Ссылки
Кристаллическая структура

HgS диморфен с двумя кристаллическими формами:
- красная киноварь (α-HgS, тригональный, hP6, P3221), форма, в которой ртуть чаще всего встречается в природе.
- черный, метациннабар (β-HgS), менее распространен в природе и использует кристалл цинковой обманки (Td-F43m) структура.
Кристаллы красного, α-HgS, оптически активны. Это вызвано наличием спиралей Hg-S в структуре.
Получение и химический состав
β-HgS осаждается в виде черного порошка, когда H2S барботируется через растворы Hg (II) соли. β-HgS не реагирует со всеми кислотами, кроме концентрированных.. Металлическая ртуть производится из киновари руды путем обжига на воздухе и конденсации пара.
Используется
Когда α-HgS используется в качестве красного пигмента, он известен как киноварь. Склонность киновари к потемнению была приписана превращению красного α-HgS в черный β-HgS. Однако β-HgS не был обнаружен при раскопках в Помпеях, где первоначально красные стены потемнели, и был приписан образованию соединений Hg-Cl (например, кордероит, каломель и терлингваит ) и сульфат кальция, гипс.
В качестве ртутного элемента, используемого в хлорщелочной промышленности (процесс Кастнера – Келлнера ), используется будучи выведен из обращения из-за опасений по поводу выбросов ртути, металлическая ртуть из этих установок превращается в сульфид ртути для подземного хранения.
См. Также
- Отравление ртутью
- Сульфид ртути (I) (сульфид ртути), Hg. 2S
Ссылки
- ^L. И. Бергер, Полупроводниковые материалы (1997) CRC Press ISBN 0-8493-8912-7
- ^Webminerals
- ^ Зумдал, Стивен С. (2009). Химические принципы 6-е изд. Компания Houghton Mifflin. п. A22. ISBN 978-0-618-94690-7.
- ^ Гринвуд, Норман Н. ; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press. п. 1406. ISBN 978-0-08-022057-4. Cite имеет пустой неизвестный параметр:
| 1 =() - ^AM Glazer, K. Stadnicka (1986). «О происхождении оптической активности в кристаллических структурах». J. Appl. Cryst. 19 (2): 108–122. doi : 10.1107 / S0021889886089823.
- ^Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Advanced Неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^Cotte, M; Susini J; Metrich N; Moscato A; Gratziu C ; Bertagnini A; Pagano M (2006). «Почернение картин из помпейской киновари: анализ рентгеновской микроскопии». Anal. Chem. 78 (21): 7484–7492. doi : 10.1021 / ac0612224. PMID 17073416.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфид ртути(II)
Брутто-формула:
HgS
CAS# 1344-48-5
Категории:
Неорганические соли
PubChem CID: 62402
| ChemSpider ID: 56188
Названия
Русский:
- Сульфид ртути
- Сульфид ртути(II) [Wiki]
- киноварь (α-HgS)
- метациннабарит (β-HgS)
English:
- Almaden
- C.I. 77766
- Cinnabar [Wiki]
- Ethiops mineral
- Mercuric sulfide black
- Mercuric sulfide red
- Mercury monosulfide
- Mercury sulfide [Wiki]
- Mercury(2+) sulfide
- Monomercury sulfide
- Orange vermilion
- Pigment red 106
- Red Cinnabar
- Red mercuricsulfide
- Red mercury sulphide
- Scarlet vermilion
- Vermilion [Wiki]
- Vermilion (HgS)
- Vermillion
- b-Mercuric sulfide
- mercuric sulfide
- mercury sulphide
- mercury(II) sulfide
- sulfanylidenemercury(IUPAC)
Варианты формулы:
HgS
Hg(+2)S(-2)
Hg=S
S=Hg
Вещества, имеющие отношение…
Анион:
Сульфиды
Химический состав
Реакции, в которых участвует Сульфид ртути(II)
-
Hg + S -> HgS»|v»
-
HgCl2 + H2S + 2NH3 -> HgS + 2NH4Cl
-
(CH3COO)2Hg + H2S -> HgS + 2CH3COOH
-
2Cs + HgS -> Cs2S + Hg
-
2BiI3 + 3HgS «T»-> Bi2S3 + 3HgI2