| Сероуглерод | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
сульфид углерода(IV) | |
| Традиционные названия | Сероуглерод | |
| Хим. формула | CS2 | |
| Физические свойства | ||
| Состояние | бесцветная жидкость | |
| Молярная масса | 76.1 г/моль | |
| Плотность | 1.26 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | −111.6 °C | |
| • кипения | 46 °C | |
| • разложения | 300 °C | |
| • самовоспламенения | 90 °C | |
| Энтальпия | ||
| • образования | 89,41 (ж) кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | (при 20 °C) 0.29 г/100 мл | |
| Оптические свойства | ||
| Показатель преломления | 1.6295 | |
| Структура | ||
| Кристаллическая структура | линейная | |
| Дипольный момент | 0 Д | |
| Классификация | ||
| SMILES |
S=C=S |
|
| RTECS | FF6650000 | |
| Безопасность | ||
| ЛД50 | 3188 мг/кг | |
| Пиктограммы ECB |
|
|
| NFPA 704 |
4 3 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сероуглерод(сульфид углерода IV) CS2 — соединение серы с углеродом.
Свойства
Чистый сероуглерод представляет собой бесцветную жидкость с приятным «эфирным» запахом. Технический продукт, полученный сульфидированием угля, имеет неприятный «редечный» запах. Молекула CS2 линейна, длина связи С—S = 0,15529 нм; энергия диссоциации 1149 кДж/моль.
Сероуглерод токсичен, огнеопасен, имеет самый широкий диапазон концентрационных пределов взрываемости[1].
- [math]displaystyle{ mathsf{CS_2 + 3O_2 rightarrow CO_2uparrow + 2SO_2uparrow} }[/math]
Подобно диоксиду углерода, CS2 является кислотным ангидридом и при взаимодействии с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3). При реакции с щелочами образуются соли дитиоугольной кислоты и продукты их диспропорционирования.
Однако сероуглерод, в отличие от диоксида углерода, проявляет большую реакционную способность по отношению к нуклеофилам и легче восстанавливается.
Так, сероуглерод способен реагировать с C-нуклеофилами, его взаимодействие с фенолятами активированных метиларилкетонов идет с образованием бис-тиолятов арилвинилкетонов, которые могут быть проалкилированы до бис-алкилтиоарилвинилкетонов; эта реакция имеет препаративное значение[2]:
-
- [math]displaystyle{ mathsf{PyCOCH_3 + CS_2 + 2ttext{-}BuOK rightarrow PyCOCHtext{=}C(S^-K^+)_2 + 2ttext{-}BuOH} }[/math]
-
- [math]displaystyle{ mathsf{PyCOCHtext{=}C(S^-K^+) + 2MeI rightarrow PyCOCHtext{=}C(SMe)_2 + 2KI} }[/math]
При взаимодействии с натрием в диметилформамиде сероуглерод образует 1,3-дитиол-2-тион-4,5-дитиолят натрия, использующийся в качестве предшественника в синтезе тетратиафульваленов[3]:
При взаимодействии с первичными или вторичными аминами в щелочной среде образуются соли дитиокарбаматы:
- [math]displaystyle{ mathsf{2R_2NH + CS_2 rightarrow [R_2NH_2^+][R_2NCS_2^-]} }[/math]
Для растворимых дитиокарбаматов характерно образование комплексов с металлами, что используется в аналитической химии. Они также имеют большое промышленное значение в качестве катализаторов вулканизации каучука.
Со спиртовыми растворами щелочей образует ксантогенаты:
- [math]displaystyle{ mathsf{RONa + CS_2 rightarrow [Na^+][ROCS_2^-]} }[/math]
Такими сильными окислителями, как, например, перманганат калия, сероуглерод разлагается с выделением серы.
С оксидом серы (VI) сероуглерод взаимодействует с образованием сульфоксида углерода:
- [math]displaystyle{ mathsf{CS_2 + 3SO_3 rightarrow COS + 4SO_2uparrow} }[/math]
С оксидом хлора(I) образует фосген:
- [math]displaystyle{ mathsf{CS_2 + 3Cl_2O rightarrow COCl_2uparrow + 2SOCl_2} }[/math]
Сероуглерод хлорируется в присутствии катализаторов до перхлорметилмеркаптана CCl3SCl[4], использующегося в синтезе тиофосгена CSCl2:
- [math]displaystyle{ mathsf{2CS_2 + 5Cl_2 rightarrow 2CCl_3SCl + S_2Cl_2} }[/math]
- [math]displaystyle{ mathsf{CCl_3SCl xrightarrow[]{[H]} CSCl_2 + 2HCluparrow} }[/math]
Избытком хлора сероуглерод хлорируется до четырёххлористого углерода:
- [math]displaystyle{ mathsf{CSCl_2 + 2Cl_2 rightarrow CCl_4 + S_2Cl_2} }[/math]
Фторирование сероуглерода фторидом серебра в ацетонитриле ведет к образованию трифторметилтиолята серебра, эта реакция имеет препаративное значение[5]
При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:
- [math]displaystyle{ mathsf{CS_2 + 2H_2O rightarrow CO_2uparrow + 2H_2Suparrow} }[/math]
Получение
В промышленности получают по реакции метана с парами серы в присутствии силикагеля при 500—700 °C в камере из хромоникелевой стали:
- [math]displaystyle{ mathsf{CH_4 + 4S rightarrow CS_2 + 2H_2Suparrow} }[/math]
Также сероуглерод можно получить взаимодействием древесного угля и паров S при 750—1000 °C.
Применение
Хорошо растворяет жиры, масла, смолы, каучук, используют как экстрагент; растворяет серу, фосфор, иод, нитрат серебра.
Большая часть (80 %) производимого сероуглерода идёт в производство вискозы — сырья в производстве вискозного волокна («искусственного шелка»). Его применяют для получения различных химических веществ (ксантогенатов, четырёххлористого углерода, роданидов).
Токсическое действие
Сероуглерод ядовит. Полулетальная доза при поступлении внутрь составляет 3188 мг/кг. Высокотоксичная концентрация в воздухе — свыше 10 мг/л. Оказывает местное раздражающее, резорбтивное действия. Обладает психотропными, нейротоксическими свойствами, которые связаны с его наркотическим воздействием на центральную нервную систему.
При отравлении возникают головная боль, головокружение, судороги, потеря сознания. Бессознательное состояние может сменяться психическим и двигательным возбуждением. Могут наблюдаться рецидивы судорог с потерей сознания, угнетение дыхания. При приёме внутрь наступают тошнота, рвота, боли в животе. При контакте с кожей наблюдаются гиперемия и химические ожоги.
Первая помощь и лечение
Прежде всего необходимо удалить пострадавшего из поражённой зоны. При попадании сероуглерода внутрь необходимо выполнить промывание желудка с использованием зонда, форсированный диурез, ингаляцию кислорода. Обычно проводят симптоматическую терапию. При судорогах вводят 10 мг диазепама внутривенно.
Примечания
- ↑ Кипер Руслан. [www.chemister.ru/Chemie/records.htm Рекорды веществ] (недоступная ссылка). Рекорды для неорганических веществ. www.chemister.ru (Дата последнего изменения 13.10.2010). Дата обращения: 17 октября 2010. Архивировано 11 января 2012 года.
- ↑ Kevin T. Potts et al. 2,2′ : 6′,2′ -Terpyridine. Org. Synth. 1986, 64, 189 DOI: 10.15227/orgsyn.064.0189
- ↑ Thomas K. Hansen et al. 4,5-Dibenzoyl-1,3-dithiole-1-thione. Org. Synth. 1996, 73, 270 DOI: 10.15227/orgsyn.073.0270
- ↑ Губен И. Методы органической химии. Том 3 — М.: Химическая литература, 1935. — 676 c.
- ↑ Jiansheng Zhu et al. Preparation of N-Trifluoromethylthiosaccharin: A Shelf-Stable Electrophilic Reagent for Trifluoromethylthiolation. Org. Synth. 2017, 94, 217—233 DOI: 10.15227/orgsyn.094.0217
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.
 |
|
 |
|
| Имена | |
|---|---|
| Название IUPAC Метанедитион | |
| Другие названия Бисульфид углерода | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.767 |
| Номер EC |
|
| KEGG |
|
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| номер ООН | 1 131 |
| Панель управления CompTox (EPA ) |
|
InChI
|
|
SMILES
|
|
| Свойства | |
| Химическая формула | CS2 |
| Молярная масса | 76,13 г · моль |
| Внешний вид | Бесцветная жидкость. Загрязнение: светло-желтое |
| Запах | Хлороформ (чистый). Грязный (коммерческий) |
| Плотность | 1,539 г / см (-186 ° C). 1,2927 г / см (0 ° C). 1,266 г / см (25 ° C) |
| Температура плавления | — 111,61 ° С (-168,90 ° F; 161,54 K) |
| Температура кипения | 46,24 ° C (115,23 ° F; 319,39 K) |
| Растворимость в воде | 2,58 г / л (0 ° C). 2,39 г / л (10 ° C). 2,17 г / л (20 ° C). 0,14 г / л (50 ° C) |
| Растворимость | Растворим в спирте, эфире, бензол, масло, CHCl 3, CCl 4 |
| Растворимость в муравьиной кислоте | 4,66 г / 100 г |
| Растворимость в диметилсульфоксиде | 45 г / 100 г (20,3 ° C) |
| Давление пара | 48,1 кПа (25 ° C). 82,4 кПа (40 ° C) |
| Магнитная восприимчивость (χ) | -42,2 · 10 см / моль |
| Показатель преломления (nD) | 1,627 |
| Вязкость | 0,436 сП (0 ° C). 0,363 сП (20 ° C) |
| Структура | |
| Молекулярная форма | Линейный |
| Дипольный момент | 0 D (20 ° C) |
| Термохимия | |
| Теплоемкость (C) | 75,73 Дж / (моль · К) |
| Стандартная молярная. энтропия (S 298) | 151 Дж / (моль · К) |
| Стандартная энтальпия образования. (ΔfH298) | 88,7 кДж / моль |
| свободная энергия Гиббса (ΔfG˚) | 64,4 кДж / моль |
| Стандартная энтальпия. горения (ΔcH298) | 1687,2 кДж / моль |
| Хаза rds | |
| Паспорт безопасности | См.: страница данных |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасно |
| Предупреждения об опасности GHS | H225, H315, H319, H361, H372 |
| Меры предосторожности GHS | P210, P281, P305 + 351 + 338, P314 . ICSC 0022 |
| Вдыхание опасность | Раздражающий; токсичный |
| Глаз опасность | Раздражающий |
| Кожа опасность | Раздражающий |
| NFPA 704 (огненный алмаз) |  4 3 0 4 3 0 |
| Вспышка точка | −43 ° C (−45 ° F; 230 K) |
| Самовоспламенение. температура | 102 ° C (216 ° F; 375 K) |
| Пределы взрываемости | 1,3–50 % |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 3188 мг / кг (крыса, перорально) |
| LC50(средняя концентрация ) | >1670 ppm (крыса, 1 час). 15500 частей на миллион (крыса, 1 час). 3000 частей на миллион (крыса, 4 часа). 3500 частей на миллион (крыса, 4 часа). 7911 частей на миллион (крыса, 2 часа). 3165 частей на миллион (мышь, 2 ч) |
| LCLo(самый низкий опубликованный ) | 4000 ppm (человек, 30 мин) |
| NIOSH (пределы воздействия на здоровье США): | |
| PEL (допустимый) | TWA 20 ppm C 30 ppm 100 ppm (30-минутный максимум) |
| REL (рекомендуется) | TWA 1 ppm (3 мг / м) ST 10 ppm (30 мг / м) [кожа] |
| IDLH (Непосредственная опасность) | 500 ppm |
| Родственные соединения | |
| Родственные соединения | Диоксид углерода. Карбонилсульфид. Диселенид углерода |
| Страница дополнительных данных | |
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr) и т. Д. |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ |
| Спектральный данные | UV, IR, ЯМР, MS |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Дисульфид углерода, также обозначаемый как сероуглерод, представляет собой бесцветную летучую жидкость по формуле CS2. Соединение часто используется в качестве строительного блока в органической химии, а также в качестве промышленного и химического неполярного растворителя. Он имеет запах «эфира «, но коммерческие образцы обычно загрязнены дурно пахнущими примесями.
Содержание
- 1 Возникновение, производство, свойства
- 1.1 Растворитель
- 2 Реакции
- 2.1 С нуклеофилами
- 2.2 Восстановление
- 2.3 Хлорирование
- 2.4 Координационная химия
- 3 Полимеризация
- 4 Использование
- 4.1 Использование в нише
- 5 Воздействие на здоровье
- 6 История
- 7 См. Также
- 8 Ссылки
- 9 Внешние ссылки
Возникновение, производство, свойства
Небольшие количества сероуглерода выделяются вулканическими извержениями и болота. CS 2 когда-то производился путем объединения углерода (или кокса ) и серы при высоких температурах.
- C + 2S → CS 2
При более низкой температуре реакции, требующей всего 600 ° C, в качестве источника углерода используется природный газ в присутствии силикагеля или оксид алюминия катализаторы :
- 2 CH 4 + S 8 → 2 CS 2 + 4 H 2S
Реакция аналогично горению метана.
Мировое производство / потребление сероуглерода составляет примерно один миллион тонн, при этом Китай потребляет 49%, за ним следует Индия с 13%, в основном это производство вискозного волокна. Производство в США в 2007 году составило 56 000 тонн.
Растворитель
Дисульфид углерода является растворителем для фосфора, серы, селена, брома, йод, жиры, смолы, каучук и асфальт. Он был использован для очистки однослойных углеродных нанотрубок.
Reactions
CS2легко воспламеняется. Его сгорание дает диоксид серы согласно этой идеальной стехиометрии:
- CS2+ 3 O 2 → CO 2 + 2 SO 2
с нуклеофилами
По сравнению с изоэлектронным диоксидом углерода CS 2 является более слабым электрофилом. Хотя, однако, реакции нуклеофилов с CO 2 очень обратимы и продукты выделяются только с очень сильными нуклеофилами, реакции с CS 2 термодинамически более предпочтительны, позволяя образовывать продукты с менее реактивные нуклеофилы. Например, амины дают дитиокарбаматы :
- 2 R 2 NH + CS 2 → [R 2NH2] [R 2 NCS 2]
Ксантаты образуются аналогичным образом из алкоксидов :
- RONa + CS 2 → [Na] [ROCS 2]
Эта реакция является основой производства регенерированной целлюлозы, основной ингредиент вискозы, вискозы и целлофана. Как ксантогенаты, так и родственные тиоксантаты (полученные в результате обработки CS 2 тиолатами натрия ) используются в качестве флотационных агентов при переработке полезных ископаемых.
Сульфид натрия дает тритиокарбонат :
- Na2S + CS 2 → [Na] 2 [CS 3]
Дисульфид углерода не гидролизуется легко, хотя процесс катализируется ферментом дисульфидгидролазой.
Восстановление
Восстановление сероуглерода натрием дает 1,3-дитиол-2-тион-4,5-дитиолат натрия вместе с тритиокарбонатом натрия :
- 4 Na + 4 CS 2 → Na 2C3S5+ Na 2CS3
Хлорирование
Хлорирование CS 2 обеспечивает путь к четыреххлористому углероду :
- CS2+ 3 Cl2 → CCl 4+ S2Cl2
. Это преобразование происходит через посредство тиофосгена, CSCl 2.
Координационная химия
CS2является лигандом для многих комплексов металлов, образующих пи-комплексы. Одним из примеров является Cp Co (η -CS 2) (P Me 3).
Полимеризация
CS2полимеризуется при фотолизе или под высоким давлением с образованием нерастворимого материала. названный car-sul или «черный Бриджмена», названный в честь первооткрывателя полимера, Перси Уильямса Бриджмена. Тритиокарбонатные (-SC (S) -S-) связи частично составляют основу полимера, который является полупроводником.
Использует
Основными видами промышленного использования сероуглерода, на которые приходится 75% годового производства, является производство вискозного волокна и целлофановая пленка.
Это также ценный промежуточный продукт в химическом синтезе четыреххлористого углерода. Он широко используется в синтезе сероорганических соединений, таких как метамнатрий, ксантаты, дитиокарбаматы, которые используются в экстрактивной металлургии и химии каучуков.
Нише используется
Может использоваться в фумигация герметичных складов, герметичных квартирных хранилищ с, бункеры, элеваторы, железнодорожные вагоны, трюмы, баржи и зерновые мельницы. Сульфид углерода также используется в качестве инсектицида для фумигации зерна, питомников, консервирования свежих фруктов и дезинфицирующего средства для почвы от насекомых и нематод.
Воздействие на здоровье
Дисульфид углерода связан с как острые, так и хронические формы отравлений с разнообразными симптомами. Типичное рекомендуемое ПДК составляет 30 мг / м, 10 частей на миллион. Возможные симптомы включают, помимо прочего, покалывание или онемение, потерю аппетита, нечеткость зрения, судороги, мышечную слабость, боль, нейрофизиологическое нарушение, приапизм, эректильная дисфункция, психоз, кератит и смерть от дыхательной недостаточности.
Профессиональное воздействие сероуглерода связано с сердечно-сосудистые заболевания, в частности инсульт.
История
В 1796 году немецкий химик Вильгельм Август Лампадиус (1772–1842) впервые получил сероуглерод путем нагревания пирит с влажным углем. Он назвал это «жидкой серой» (flüssig Schwefel). Окончательно состав сероуглерода был определен в 1813 году группой шведского химика Йенса Якоба Берцелиуса (1779–1848) и швейцарско-британского химика Александра Марсе (1770–1822).. Их анализ соответствовал эмпирической формуле CS 2.
См. Также
- Моносульфид углерода
- Субсульфид углерода
- Диселенид углерода
- 1949 г. Пожар в туннеле в Голландии, авария с грузовиком с сероуглеродом.
Ссылки
Внешние ссылки
- Австралийский национальный перечень загрязнителей: сероуглерод
- CDC — Карманное руководство NIOSH по химическим опасностям — сероуглерод
- Inno Motion Engineering
- Агентство по токсичным веществам Регистр заболеваний Заявление об уровне содержания сероуглерода в области общественного здравоохранения, 1996.
- Ресурсы по сероуглероду от Национального института безопасности и гигиены труда
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1.
Показано записей: 1.
Сероуглерод
Брутто-формула:
CS2
CAS# 75-15-0
Названия
Русский:
- Сероуглерод [Wiki]
- углерода(IV) сульфид
English:
- Carbon bisulfide
- Carbon disulfide [Wiki]
- Carbon disulphide
- Dithiocarbonic anhydride
- methanedithione(IUPAC)
German:
- Kohlenstoffdisulfid [Wiki]
- Schwefelkohlenstoff
العربية:
- ثنائي كبريتيد الكربون(IUPAC) [Wiki]
- كبريت الكربون
Español:
French:
- Disulfure de carbone(IUPAC)
- Sulfure de carbone [Wiki]
Italiano:
- Solfuro di carbonio [Wiki]
- disolfuro di carbonio
日本語:
Português:
- Anidrido ditiocarbônico
- Dissulfeto de carbono(IUPAC) [Wiki]
- Sulfureto de Carbono
中文:
Варианты формулы:
Реакции, в которых участвует Сероуглерод
-
CS2 + 2H2S + 8Cu -> CH4 + 4Cu2S
-
2La2S3 + 3CO2 → 2La2O3 + 3CS2
-
2Sc2O3 + 3CS2 «T»-> 2Sc2S3 + 3CO2
-
2Y2O3 + 3CS2 «T»-> 2Y2S3 + 3CO2
-
2NH3 + CS2 -> NH4SCN + H2S
Имена и идентификаторы
| наименование товара | Сероуглерод |
| Синонимы | Спирт серы; Углекислый газ; бисульфид углерода; Сульфид углерода; Сульфид углерода (CS2); Сульфид углерода; Сульфид углерода; очищенный; Бисульфид углерода |
| Номер CAS Registry | 75-15-0 |
| Молекулярная формула | CS2 |
| Молекулярная масса | 76.14 |
| EINECS | 200-843-6 |
| Другие номера реестра | ; |
| Имена IUPA, InChI, InChI Key, Canonical SMILES, И т.д.: | Имена IUPA, InChI, InChI Key, Canonical SMILES, И т.д. |
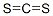 |
Химические и физические свойства
| Температура плавления | -112–111 ° C (лит.) |
| Точка кипения | 46 ° C (лит.) |
| Плотность | 1.266 г / мл при 25 ° C |
| плотность пара | 2.67 (против воздуха) |
| давление газа | 5.83 фунтов на кв. Дюйм (20 ° C) |
| Показатель преломления | n20 / Д 1.627 (светится.) |
| Точка возгорания | −29 ° F |
| Хранилище | 2-8 ° C |
| Solubulity | Растворим в спирте, эфире, бензоле, масле, хлороформе и четыреххлористом углероде. |
| форма | жидкость |
| Цвет | ≤10 (APHA) |
| Относительная полярность | 0.065 |
| Предел взрываемости | 1-60% (V), |
| Растворимость воды | 2.9 г / л (20 ºC) |
| Точка замерзания | -110.3 ℃ |
| Merck | 14,1811 |
| Стабильность: | Стабильная. Чрезвычайно огнеопасно. Очень изменчивый Обратите внимание на низкую температуру вспышки и очень широкие пределы взрываемости. Беречь от жары, трения, ударов, солнечных лучей. Бурно реагирует с фтором, азидными растворами, цинковой пылью, жидким хлором в присутствии железа. Несовместим с сильными окислителями, азидами, алюминием, цинком, чаще всего встречается |
| Дополнительные свойства от PubChem | Топологическая полярная поверхность, моноизотопная масса и т. Д. |
| Справочник по химии NIST | Дисульфид углерода (75-15-0) |
| Система регистрации веществ EPA | Дисульфид углерода (75-15-0) |
| Коды опасности | Р, Т |
| R-фраза | 11-36/38-48/23-62-63-39/23/24/25-23/24/25-48/20-40-36/37/38-19 |
| S Фраза | 16-33-36/37-45-7-26 |
| RIDADR | UN 1131 3 / PG 1 |
| WGK Германия | 2 |
| RTECS | FF6650000 |
| ЗКТВ | Да |
| Класс хранения | 3 |
| Группа упаковки | I |
| Данные о вредных веществах | 75-15-0 (данные о вредных веществах) |
Литература |
Патенты |
Транспортировка, хранение и использование |
| Применение | Нет информации |
Спектральные свойства |
Утвержденные производители |
|
| Хотите, чтобы вас указали в списке одобренных производителей (бесплатное обслуживание, но требуется одобрение)? | Пожалуйста, скачайте и заполните эта форма и отправить обратно [электронная почта защищена] |
Свяжитесь с нами для получения другой помощи |
|
| Свяжитесь с нами для получения других услуг, таких как передача технологий, синтетическая литература, поиск поставщиков, реклама и т. Д. | Нажмите здесь, чтобы связаться ChemWhat |
| Сероуглерод | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
углерода(IV) сульфид |
| Традиционные названия | Сероуглерод |
| Хим. формула | CS2 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 76.1 г/моль |
| Плотность | 1.26 г/см³ |
| Термические свойства | |
| Т. плав. | −111.6 °C |
| Т. кип. | 46 °C |
| Т. разл. | −30 °C |
| Т. свспл. | 90 °C |
| Энтальпия образования | 89,41 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °C) 0.29 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1.6295 |
| Структура | |
| Кристаллическая структура | линейная |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 75-15-0 |
| PubChem | 6348 |
| Рег. номер EINECS | 200-843-6 |
| SMILES |
S=C=S |
| Рег. номер EC | 200-843-6 |
| RTECS | FF6650000 |
| ChemSpider | 6108 |
| Безопасность | |
| ЛД50 | 3188 мг/кг |
| Токсичность |
4 3 0 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сероуглерод CS2 — соединение серы с углеродом.
Содержание
- 1 Свойства
- 2 Получение
- 3 Применение
- 4 Токсическое действие
- 5 Первая помощь и лечение
- 6 Примечания
- 7 Литература
Свойства[править | править вики-текст]
Чистый сероуглерод представляет собой бесцветную жидкость с приятным «эфирным» запахом. Технический продукт, полученный сульфидированием угля, имеет неприятный «редечный» запах. Молекула CS2 линейна, длина связи С—S = 0,15529 нм; энергия диссоциации 1149 кДж/моль.
Сероуглерод токсичен, огнеопасен, имеет самый широкий диапазон концентрационных пределов взрываемости[1].
Подобно диоксиду углерода, CS2 является кислотным ангидридом и при взаимодействии с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3). При реакции с щелочами образуются соли дитиоугольной кислоты и продукты их диспропорционирования.
Однако, сероуглерод, в отличие от диоксида углерода, проявляет большую реакционную способность по отношению к нуклеофилам и легче восстанавливается. Такими сильными окислителями, как, например, перманганат калия, сероуглерод разлагается с выделением серы.
С оксидом серы (VI) сероуглерод взаимодействует с образованием сульфоксида углерода:
С оксидом хлора(I) образует фосген:
При взаимодействии с первичными или вторичными аминами в щелочной среде, образуются соли дитиокарбаматы:
Для растворимых дитиокарбаматов характерно образование комплексов с металлами, что используется в аналитической химии. Они также имеют большое промышленное значение в качестве катализаторов вулканизации каучука.
Со спиртовыми растворами щелочей образует ксантогенаты:
Серуглерод хлорируется в присутствии катализаторов до перхлорметилмеркаптана CCl3SCl, использующегося в синтезе тиофосгена CSCl2:
Избытком хлора сероуглерод хлорируется до четыреххлористого углерода:
При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:
Получение[править | править вики-текст]
В промышленности получают по реакции метана с парами серы в присутствии силикагеля при 500—700 °C в камере из хромоникелевой стали:
Также сероуглерод можно получить взаимодействием древесного угля и паров S при 750—1000 °C.
Применение[править | править вики-текст]
Хорошо растворяет жиры, масла, смолы, каучук, используют как экстрагент; растворяет серу, фосфор, иод, нитрат серебра.
Большая часть (80 %) производимого сероуглерода идет в производство вискозы — сырья в производстве вискозного волокна («искусственного шелка»). Его применяют для получения различных химических веществ (ксантогенатов, четыреххлористого углерода, роданидов).
Токсическое действие[править | править вики-текст]
Сероуглерод очень ядовит. Смертельная доза при поступлении внутрь составляет 1 г. Высокотоксичная концентрация в воздухе — свыше 10 мг/л. Оказывает местное раздражающее, резорбтивное действия. Обладает психотропными, нейротоксическими свойствами, которые связаны с его наркотическим воздействием на центральную нервную систему.
При отравлении возникают головная боль, головокружение, судороги, потеря сознания. Бессознательное состояние может сменяться психическим и двигательным возбуждением. Могут наблюдаться рецидивы судорог с потерей сознания, угнетение дыхания. При приеме внутрь наступают тошнота, рвота, боли в животе. При контакте с кожей наблюдаются гиперемия и химические ожоги.
Первая помощь и лечение[править | править вики-текст]
Прежде всего, необходимо удалить пострадавшего из пораженной зоны. При попадании сероуглерода внутрь необходимо выполнить промывание желудка с использованием зонда, форсированный диурез, ингаляцию кислорода. Обычно проводят симптоматическую терапию. При судорогах вводят 10 мг диазепама внутривенно.
Примечания[править | править вики-текст]
- ↑ Кипер Руслан. Рекорды веществ (рус.). Рекорды для неорганических веществ(недоступная ссылка — история). www.chemister.ru (Дата последнего изменения 13.10.2010). Проверено 17 октября 2010. Архивировано из первоисточника 11 января 2012.
Литература[править | править вики-текст]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.
«CS2» перенаправляется сюда. Для использования в других целях, см CS2 (значения) .

|
|

|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Метанедитион |
|
| Другие имена
Сероуглерод |
|
| Идентификаторы | |
|
Количество CAS |
|
|
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ChemSpider |
|
| ECHA InfoCard |
100.000.767 |
| Номер ЕС |
|
| КЕГГ |
|
|
PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
| Номер ООН | 1131 |
|
Панель управления CompTox ( EPA ) |
|
|
ИнЧИ
|
|
|
Улыбки
|
|
| Характеристики | |
|
Химическая формула |
C S 2 |
| Молярная масса | 76,13 г · моль -1 |
| Появление | Бесцветная жидкость нечистая: светло-желтая |
| Запах |
Хлороформ (чистый) Фол (коммерческий) |
| Плотность | 1,539 г / см 3 (-186 ° C) 1,2927 г / см 3 (0 ° C) 1,266 г / см 3 (25 ° C) |
| Температура плавления | -111,61 ° С (-168,90 ° F, 161,54 К) |
| Точка кипения | 46,24 ° С (115,23 ° F, 319,39 К) |
|
Растворимость в воде |
2,58 г / л (0 ° C) 2,39 г / л (10 ° C) 2,17 г / л (20 ° C) 0,14 г / л (50 ° C) |
| Растворимость | Растворим в спирте , эфире , бензоле , масле , CHCl 3 , CCl 4 |
| Растворимость в муравьиной кислоте | 4,66 г / 100 г |
| Растворимость в диметилсульфоксиде | 45 г / 100 г (20,3 ° С) |
| Давление газа | 48,1 кПа (25 ° C) 82,4 кПа (40 ° C) |
|
Магнитная восприимчивость (χ) |
−42,2 · 10 −6 см 3 / моль |
|
Показатель преломления ( n D ) |
1,627 |
| Вязкость | 0,436 сП (0 ° C) 0,363 сП (20 ° C) |
| Состав | |
|
Молекулярная форма |
Линейный |
|
Дипольный момент |
0 Д (20 ° С) |
| Термохимия | |
|
Теплоемкость ( C ) |
75,73 Дж / (моль · К) |
|
Стандартная мольная |
151 Дж / (моль · К) |
|
Std энтальпия |
88,7 кДж / моль |
|
Свободная энергия Гиббса (Δ f G ) |
64,4 кДж / моль |
|
Std энтальпии |
1687,2 кДж / моль |
| Опасности | |
| Паспорт безопасности | См .: страницу данных |
| Пиктограммы GHS |
  
|
| Сигнальное слово GHS | Опасность |
|
Формулировки опасности GHS |
H225 , H315 , H319 , H361 , H372 |
|
Меры предосторожности GHS |
P210 , P281 , P305 + 351 + 338 , P314 ICSC 0022 |
| Опасность при вдыхании | Раздражает; ядовитый |
| Опасность для глаз | Раздражающий |
| Опасность для кожи | Раздражающий |
| NFPA 704 (огненный алмаз) |
3 4 0 |
| точка возгорания | -43 ° С (-45 ° F, 230 К) |
|
самовоспламенения |
102 ° С (216 ° F, 375 К) |
| Пределы взрываемости | 1,3–50% |
| Смертельная доза или концентрация (LD, LC): | |
|
LD 50 ( средняя доза ) |
3188 мг / кг (крыса, перорально) |
|
ЛК 50 ( средняя концентрация ) |
> 1670 частей на миллион (крыса, 1 час) 15500 частей на миллион (крыса, 1 час) 3000 частей на миллион (крыса, 4 часа) 3500 частей на миллион (крыса, 4 часа) 7911 частей на миллион (крыса, 2 часа) 3165 частей на миллион (мышь, 2 часа) |
|
LC Lo ( самый низкий опубликованный ) |
4000 частей на миллион (человек, 30 мин) |
| NIOSH (пределы воздействия на здоровье в США): | |
|
PEL (Допустимо) |
TWA 20 ppm C 30 ppm 100 ppm (максимум 30 минут) |
|
REL (рекомендуется) |
TWA 1 ppm (3 мг / м 3 ) ST 10 ppm (30 мг / м 3 ) [кожа] |
|
IDLH (Непосредственная опасность) |
500 частей на миллион |
| Родственные соединения | |
|
Родственные соединения |
Двуокись углерода Сульфид углерода Диселенид углерода |
| Страница дополнительных данных | |
|
Структура и |
Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. |
|
Термодинамические |
Фазовое поведение твердое тело – жидкость – газ |
|
Спектральные данные |
УФ , ИК , ЯМР , МС |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Сероуглерод , также обозначаемый как сероуглерод , представляет собой нейротоксичную бесцветную летучую жидкость с формулой CS 2 . Соединение часто используются в качестве строительного блока в области органической химии , а также в промышленном и химическом неполярном растворителе . Он имеет запах, напоминающий эфир , но коммерческие образцы обычно загрязнены примесями с неприятным запахом.
Возникновение, производство, свойства
Небольшие количества сероуглерода выделяются извержениями вулканов и болотами . Когда-то CS 2 производился путем сочетания углерода (или кокса ) и серы при высоких температурах.
- C + 2S → CS 2
При более низкотемпературной реакции, требующей всего 600 ° C, в качестве источника углерода используется природный газ в присутствии катализаторов на основе силикагеля или оксида алюминия :
- 2 СН 4 + S 8 → 2 CS 2 + 4 H 2 S
Реакция аналогична горению метана.
Мировое производство / потребление сероуглерода составляет примерно один миллион тонн, при этом Китай потребляет 49%, за ним следует Индия с 13%, в основном это касается производства вискозного волокна. Производство в США в 2007 году составило 56 000 тонн.
Растворитель
Дисульфид углерода является растворителем фосфора , серы, селена , брома , йода , жиров , смол , каучука и асфальта . Он был использован для очистки однослойных углеродных нанотрубок.
Реакции
CS 2 легко воспламеняется. Его сгорание дает диоксид серы в соответствии с этой идеальной стехиометрией:
- CS 2 + 3 O 2 → CO 2 + 2 SO 2
С нуклеофилами
По сравнению с изоэлектронным диоксидом углерода CS 2 является более слабым электрофилом . Однако в то время как реакции нуклеофилов с CO 2 очень обратимы и продукты выделяются только с очень сильными нуклеофилами, реакции с CS 2 термодинамически более предпочтительны, позволяя образовывать продукты с менее реакционноспособными нуклеофилами. Например, амины дают дитиокарбаматы :
- 2 R 2 NH + CS 2 → [R 2 NH 2 + ] [R 2 NCS 2 — ]
Ксантаты образуются из алкоксидов аналогичным образом :
- RONa + CS 2 → [Na + ] [ROCS 2 — ]
Эта реакция лежит в основе производства регенерированной целлюлозы , основного ингредиента вискозы , вискозы и целлофана . Как ксантогенаты, так и родственные тиоксантаты (полученные в результате обработки CS 2 тиолатами натрия ) используются в качестве флотационных агентов при переработке полезных ископаемых.
Сульфид натрия дает тритиокарбонат :
- Na 2 S + CS 2 → [Na + ] 2 [CS 3 2– ]
Дисульфид углерода не гидролизуется легко, хотя процесс катализируется ферментом дисульфид-гидролазой .
Снижение
Восстановление сероуглерода натрием дает 1,3-дитиол-2-тион-4,5- дитиолат натрия вместе с тритиокарбонатом натрия :
- 4 Na + 4 CS 2 → Na 2 C 3 S 5 + Na 2 CS 3
Хлорирование
Хлорирование CS 2 приводит к образованию четыреххлористого углерода :
- CS 2 + 3 Cl 2 → CCl 4 + S 2 Cl 2
Это превращение происходит через тиофосген , CSCl 2 .
Координационная химия
CS 2 является лигандом для многих комплексов металлов, образующих пи-комплексы. Одним из примеров является Cp Co ( η 2 -CS 2 ) (P Me 3 ).
Полимеризация
CS 2 полимеризуется при фотолизе или под высоким давлением, давая нерастворимый материал, называемый кар-сульф или «черный Бриджмена», названный в честь первооткрывателя полимера Перси Уильямса Бриджмена . Тритиокарбонатные (-SC (S) -S-) связи частично составляют основу полимера, который является полупроводником .
Использует
Основное промышленное использование сероуглерода, на которое приходится 75% годового производства, — это производство вискозного волокна и целлофановой пленки.
Это также ценный промежуточный продукт в химическом синтезе четыреххлористого углерода . Он широко используется в синтезе сероорганических соединений, таких как метамнатрий , ксантаты и дитиокарбаматы , которые используются в добывающей металлургии и химии каучука.
Ниша использует
Сероуглерод инсектицид объявление из 1896 года вопроса о The American Elevator и Grain Trade журнале
Его можно использовать для фумигации герметичных складских помещений, герметичных плоских хранилищ, бункеров, элеваторов, железнодорожных вагонов, судовых трюмов, барж и зерновых мельниц. Сульфид углерода также используется в качестве инсектицида для фумигации зерна, питомников, для консервирования свежих фруктов и в качестве дезинфицирующего средства для почвы от насекомых и нематод .
Воздействие на здоровье
Сероуглерод был связан как с острыми, так и с хроническими формами отравлений с разнообразным спектром симптомов.
Концентрации 500-3000 мг / м3 вызывают острое и подострое отравление, вызывая набор в основном неврологических и психиатрических симптомов, называемых энцефалопатией сульфокарбонической . Симптомы включают острый психоз (маниакальный бред , галлюцинации ), параноидальные идеи, потерю аппетита, желудочно-кишечные и сексуальные расстройства, полиневрит, миопатию и изменения настроения (включая раздражительность и гнев). Эффекты, наблюдаемые при более низких концентрациях, включают неврологические проблемы ( энцефалопатия , психомоторные и психологические расстройства, полиневрит , нарушения нервной проводимости), проблемы со зрением (жжение в глазах, аномальные световые реакции, повышение офтальмологического давления), проблемы с сердцем (повышенная смертность от сердечных заболеваний, стенокардии. , высокое кровяное давление ) и репродуктивные проблемы (учащение выкидышей, неподвижная или деформированная сперма) и снижение иммунного ответа.
Воздействие сероуглерода на рабочем месте также связано с сердечно-сосудистыми заболеваниями , особенно с инсультом .
В 2000 году ВОЗ считала, что вред для здоровья маловероятен при уровнях ниже 100 мкг / м 3 , и установила это в качестве ориентировочного уровня. Сульфид углерода может ощущаться при уровне запаха выше 200 мкг / м 3 , и ВОЗ рекомендовала сенсорную норму ниже 20 мкг / м 3 . Установлено, что воздействие сероуглерода вредно для здоровья в концентрациях 30 мг / м 3 и выше. При концентрациях 20-25 мг / м 3 наблюдались изменения функции центральной нервной системы . Имеются также сообщения о вреде для здоровья при концентрации 10 мг / м 3 при воздействии в течение 10–15 лет, но отсутствие достоверных данных об уровнях воздействия в прошлом делает сомнительной связь этого вреда с результатами концентраций 10 мг / м 3 . Измеренная концентрация 10 мг / м 3 может быть эквивалентна концентрации в общей окружающей среде 1 мг / м 3 .
Источники окружающей среды
Основным источником сероуглерода в окружающей среде являются вискозные фабрики. Большинство глобальных выбросы сероуглерода происходят из производства вискозы, по состоянию на 2008. Других источников включают в себя производство целлофана , четыреххлористый углерод , технический углерод и восстановление серы. При производстве сероуглерода также выделяется сероуглерод.
По состоянию на 2004 год около 250 г дисульфида углерода выбрасывается на килограмм произведенного вискозы. На килограмм произведенной сажи выделяется около 30 г дисульфида углерода. На килограмм извлеченной серы выделяется около 0,341 г дисульфида углерода.
Япония снизила выбросы сероуглерода на килограмм произведенного вискоза, но в других странах-производителях района, включая Китай, выбросы считаются неконтролируемыми (на основе глобального моделирования и крупномасштабных измерений концентрации в свободном воздухе). Производство вискозы является стабильным или снижается, за исключением Китая, где оно увеличивается по состоянию на 2004 год. При производстве технического углерода в Японии и Корее используются мусоросжигательные печи для уничтожения около 99% сероуглерода, который в противном случае выбрасывался бы. При использовании в качестве растворителя выбросы в Японии составляют около 40% используемого сероуглерода; в других странах средний показатель составляет около 80%.
В большинстве вискозных производств используется сульфид углерода. Единственным исключением является искусственный шелк, изготовленный с использованием процесса лиоцелл , в котором используется другой растворитель; по состоянию на 2018 год лиоцелл не получил широкого распространения, потому что он дороже, чем вискозный процесс. Вискозный медь также не использует сероуглерод.
Историческое и текущее воздействие
Промышленные рабочие, работающие с сероуглеродом, подвергаются высокому риску. Выбросы также могут нанести вред здоровью людей, живущих рядом с районными предприятиями.
Опасения по поводу воздействия сероуглерода имеют давнюю историю. Примерно в 1900 году сероуглерод стал широко использоваться в производстве вулканизированной резины . Психоз, вызванный сильным воздействием, был очевиден сразу (о нем сообщалось при 6-месячном воздействии). Одна печально известная резиновая фабрика установила решетки на окнах, чтобы рабочие не выскочили насмерть. Его использование в США в качестве яда для нор тяжелее воздуха для суслика Ричардсона также привело к сообщениям о психозах. Систематического медицинского исследования по этому вопросу не публиковалось, а знания не передавались в районную промышленность.
Первое крупное эпидемиологическое исследование районных рабочих было проведено в США в конце 1930-х годов и обнаружило довольно серьезные последствия у 30% рабочих. Данные о повышенном риске сердечных приступов и инсультов появились в 1960-х годах. Courtaulds , крупный производитель искусственного шелка, приложил все усилия, чтобы предотвратить публикацию этих данных в Великобритании. Средние концентрации на отобранных вискозных заводах снизились с примерно 250 мг / м3 в 1955-1965 годах до примерно 20-30 мг / м3 в 1980-х годах (только данные США?). С тех пор производство вискозы переместилось в развивающиеся страны, особенно в Китай, Индонезию и Индию.
Уровни инвалидности на современных заводах по состоянию на 2016 год неизвестны. Текущие производители, использующие процесс вискозы, не предоставляют никакой информации о вреде для своих рабочих.
История
В 1796 году немецкий химик Вильгельм Август Лампадиус (1772–1842) впервые получил сероуглерод путем нагревания пирита с влажным древесным углем. Он назвал это «жидкой серой» ( flüssig Schwefel ). Состав сероуглерода был окончательно определен в 1813 году группой шведского химика Йенса Якоба Берцелиуса (1779–1848) и швейцарско-британского химика Александра Марсе (1770–1822). Их анализ соответствовал эмпирической формуле CS 2 .
Смотрите также
- Моносульфид углерода
- Субсульфид углерода
- Диселенид углерода
- 1949 г. Пожар в туннеле в Голландии , авария с грузовиком, перевозившим сероуглерод.
использованная литература
внешние ссылки
- Австралийский национальный кадастр загрязнителей: сероуглерод
- CDC — Карманное руководство NIOSH по химическим опасностям — сероуглерод
- Инно Моушн Инжиниринг
- Заявление Агентства по токсичным веществам и регистрации заболеваний по сероуглероду , 1996 г.
- Ресурсы по дисульфиду углерода от Национального института безопасности и гигиены труда
- Блан, Поль Дэвид (2016). Поддельный шелк: смертельная история вискозы . Нью-Хейвен: издательство Йельского университета. п. 328. ISBN 9780300204667.
Сероуглерод
Другие названия: сульфид углерода(IV). Сероуглерод — неорганическое соединение с химической формулой CS2. Физические свойства
Химические свойства и методы полученияСписок использованной литературы
|
Химическая формула: Молярная масса: 76,141 г/моль. |
Информация о статье: Просмотров: 4863 Оценка информации: 5.0 з 5 Количество голосов — 1
|












![mathsf{2R_2NH + CS_2 rightarrow [R_2NH_2^+][R_2NCS_2^-]}](https://web.archive.org/web/20150602112414im_/https://upload.wikimedia.org/math/2/c/b/2cb01c4568308a6bcffe0da703f78956.png)
![mathsf{RONa + CS_2 rightarrow [Na^+][ROCS_2^-]}](https://web.archive.org/web/20150602112414im_/https://upload.wikimedia.org/math/8/2/9/82977c80766444a1f5c9ce4fd13ced43.png)

![mathsf{CCl_3SCl xrightarrow[]{[H]} CSCl_2 + 2HCl}](https://web.archive.org/web/20150602112414im_/https://upload.wikimedia.org/math/a/e/1/ae17cb12d7e1414522ab09af1e722bbb.png)





