Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
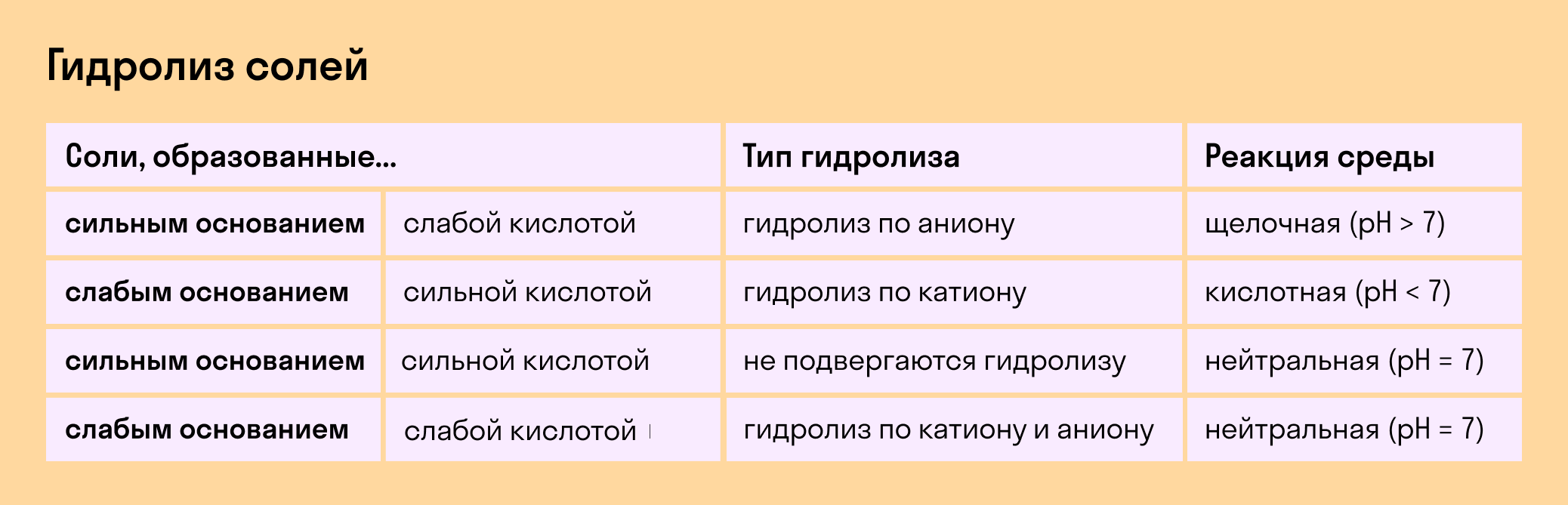
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
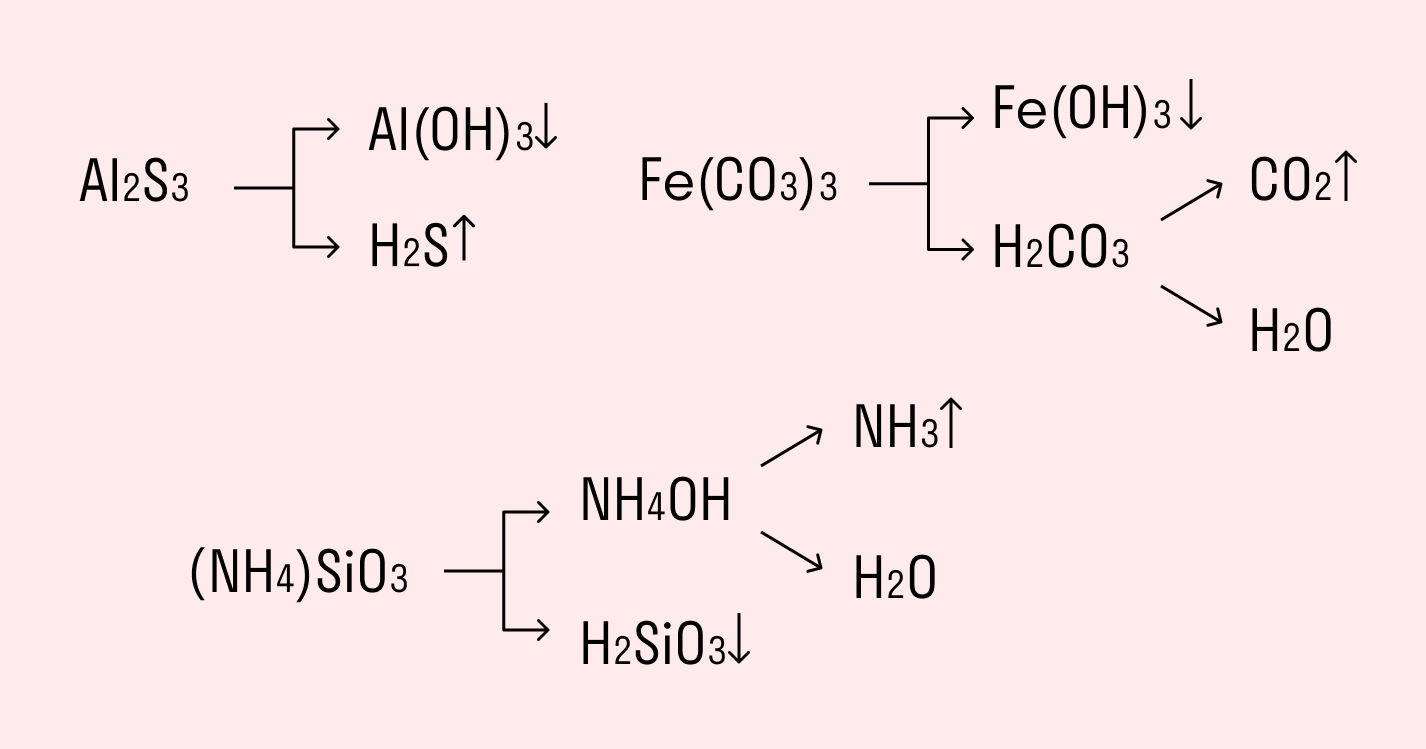
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
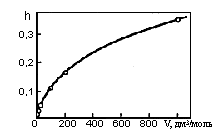
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
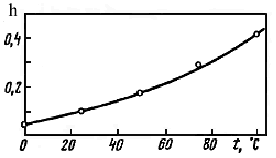
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
163
Создан на
16 января, 2022 От Admin
Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) K2CO3
2) Cu(NO3)2
3) Li2SO4
4) НClO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KF
2) LiNO3
3) (NH4)2SО4
4) H2SО4
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Аl(NO3)3
2) NH3
3) CH3COONH4
4) HClO3
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) CuSO4
2) NaOH
3) K2SO3
4) Ca(NO3)2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) HCOOH
2) CH3COOK
3) Sr(OH)2
4) KI
Запишите номера веществ в порядке убывания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HF
2) HI
3) CaCrO4
4) Cs3PO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HI
2) H2S
3) Na2Cr2O7
4) KNO2
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) BaBr2
3) KOH
4) FeCl3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Рb(NO3)2
2) Ca(ClO)2
3) NaI
4) KOH
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2SO4
2) Fe(NO3)2
3) K2SO3
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
Ваша оценка
The average score is 27%
Правила составления уравнений гидролиза солей
Алгоритм написания уравнений гидролиза
Гидролиз по катиону
1. Определяем тип гидролиза. Необходимо написать уравнение диссоциации соли.
Гидролиз сульфата меди(II): CuSO4 = Cu 2+ + SO4 2–
Соль образована катионом слабого основания и анионом сильной кислоты. Гидролиз по катиону.
2. Записываем ионное уравнение гидролиза, определяем среду:
Cu 2+ + HOH CuOH + + H + ;
образуется катион гидроксомеди(II) и ион водорода, среда кислая
3. Составляем молекулярное уравнение. Из положительных и отрицательных частиц находящихся в растворе, записываются нейтральные частицы, существующие только на бумаге. В данном случае из CuOH + SO4 2– составляем (CuOH)2SO4. Для уравнивания числа ионов меди необходимо перед сульфатом меди поставить коэффициент два. Получаем:
Продукт реакции относится к группе основных солей: сульфат гидроксомеди(II).
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Гидролиз солей
Гидролиз (от греч. 

Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут и, следовательно, в реакцию гидролиза не вступают.
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможны три типа гидролиза:
• гидролиз по катиону (в реакцию с водой вступает только катион);
• гидролиз по аниону (в реакцию с водой вступает только анион);
• совместный гидролиз (в реакцию с водой вступает и катион, и анион).
Гидролиз по катиону. Как катион может взаимодействовать с водой? Учитель сам должен решить, рассматривать ли ему этот вопрос в общем виде или (в менее сильном классе) на конкретном примере. Отмечаем, что катион – это положительно заряженная частица, а молекула воды полярна, условно можно представить ее состоящей из положительно заряженного атома водорода и отрицательно заряженной гидроксильной группы. Какую же часть молекулы воды оторвет и присоединит к себе катион? Ученики с удовольствием отвечают: «Гидроксильную группу!» Ответ подтверждаем записью уравнения, отмечая обратимость реакции:
M n+ + H–OH 
Написав формулу образовавшейся частицы, тут же обсуждаем, что это за частица, будет ли она иметь заряд и какой, приходим к выводу, что, как правило, это гидроксокатион. А что останется от молекулы воды? Какую реакцию водного раствора обусловливает избыток этих частиц? Какова будет реакция индикатора? А теперь проверим нашу гипотезу (следует демонстрация опыта).
После этого школьники могут самостоятельно сделать вывод: гидролиз по катиону приводит к образованию гидроксокатионов и кислой среды раствора.
Отмечаем, что иногда (при n = 1) вместо гидроксокатионов получаем молекулы слабого основания. А может ли гидроксокатион вступить в реакцию со следующей молекулой воды? Сообщаем, что это будет вторая ступень гидролиза, что каждая следующая ступень протекает в тысячи раз слабее, чем предыдущая, что даже первая ступень протекает обычно на доли процента. Поэтому, как правило, рассматривается только первая ступень гидролиза.
Гидролиз по аниону разбираем аналогично, записывая уравнение:
An n– + H–OH 
Подводим учеников к выводу: гидролиз по аниону приводит к образованию гидроанионов и щелочной среды раствора.
Совместный гидролиз. Из самого названия следует, что в этом случае в растворе протекают две выше рассмотренные реакции. Предлагаем школьникам проанализировать их и сделать вывод о реакции среды. Опровергаем (можно экспериментом) представление о том, что среда будет нейтральной. Одинаковое число ионов водорода и гидроксид-ионов существует только на бумаге. На самом деле здесь протекают две независимые обратимые реакции, и каких ионов в растворе окажется больше – зависит от степени протекания каждой реакции. А это, в свою очередь, зависит от того, что слабее – кислота или основание. Если слабее основание, то в большей степени будет протекать гидролиз по катиону и среда раствора будет кислой. Если слабее кислота – наоборот. Как исключение возможен случай, когда среда будет почти нейтральной, но это только исключение.
Одновременно обращаем внимание учащихся на то, что связывание гидроксид-ионов и ионов водорода в воду приводит к уменьшению их концентрации в растворе. Предлагаем вспомнить принцип Ле Шателье и подумать, как это повлияет на равновесие. Подводим их к выводу, что при совместном гидролизе степень его протекания будет значительно выше и в отдельных случаях это может привести к полному гидролизу.
Полный гидролиз. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно в какой-то степени растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты.
Если вернуться к обычным солям, то полностью гидролизующиеся соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)) нельзя получить реакциями обмена в водных растворах. Вместо ожидаемых продуктов в результате реакции мы получим продукты гидролиза. Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основный карбонат меди (CuOH)2CO3.
В таблице растворимости для полностью гидролизующихся солей стоит прочерк. Однако прочерк может стоять по другим причинам: вещество не изучено, разлагается в ходе окислительно-восстановительной реакции и т.п. Некоторые прочерки, иногда встречающиеся в таблице растворимости, вызывают удивление. Так, сульфид бария хорошо известен и растворим, как и сульфиды других щелочно-земельных металлов. Гидролиз этих солей протекает только по аниону.
Алгоритм написания уравнений гидролиза
Когда школьники поняли суть реакции гидролиза, даем (а лучше составляем вместе с ними) алгоритм написания уравнений гидролиза. Рассмотрим его на конкретных примерах.

1. Определяем тип гидролиза. На этом этапе школьники могут написать уравнение диссоциации соли:
CuSO4 = Cu 2+ + 
Можно дать им «правило цепочки»: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu 2+ + H–OH 
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем:
2CuSO4 + 2H2O 
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)». (Не надо приставки «ди», не говорим же мы «сульфат динатрия».) Назвать эту соль «гидроксосульфат меди», на наш взгляд, значит нарушить всю логику номенклатуры солей. Разве есть в растворе или в узлах кристаллической решетки частица «гидроксосульфат»? Нет! А катион гидроксомеди есть. В дальнейшем этот подход распространяется на номенклатуру комплексных солей.

1. Определяем тип гидролиза:
Рубидий – щелочной металл, его гидроксид – сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, – слабая кислота. Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:



Продукты – гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Rb3PO4 + H2O 
Получили кислую соль – гидрофосфат рубидия.

1. Определяем тип гидролиза:
Соль образована катионом слабого основания и анионами слабой кислоты. Идет совместный гидролиз.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al 3+ + H–OH 
CH3COO – + H–OH 
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3. Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O 
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Факторы, влияющие на степень гидролиза
Поскольку гидролиз – обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, то давление практически не влияет. Исключается из рассмотрения вода, т.к. ее концентрация в водных растворах практически постоянна
(
55 моль/л). Так, для примеров 1 и 2 выражения констант равновесия (констант гидролиза) имеют вид:
Температура. Поскольку реакция гидролиза эндотермическая, повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье повышение концентрации ионов водорода для реакции, рассмотренной в примере 1, приведет к смещению равновесия влево, т.е. степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции, рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо (в соответствии с принципом Ле Шателье), но степень гидролиза уменьшается.
Понять это помогает константа равновесия. При добавлении соли, т.е. фосфат-ионов в примере 2, равновесие будет смещаться вправо, концентрации гидрофосфат- и гидроксид-ионов будут возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что, для того чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH – ]/[
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно, при разбавлении равновесие смещается в сторону протекания этой реакции, т.е. вправо, степень гидролиза возрастает. К этому же выводу приведет рассмотрение константы гидролиза.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди в примере 1 раствора гидроксида натрия содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и по принципу Ле Шателье равновесие в системе сместится вправо, степень гидролиза возрастет. Если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза), а влево из-за связывания ионов меди в практически нерастворимый сульфид меди.
Практическое применение
На практике с гидролизом учителю приходится сталкиваться, например, при приготовлении растворов гидролизующихся солей, в частности ацетата свинца. Обычная методика: в колбу наливаем воду, засыпаем соль, взбалтываем. Остается белый осадок. Добавляем еще воды, взбалтываем – осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше…
Причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим, – это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия – разбавление, нагревание – только усиливают степень гидролиза.
Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов и, поскольку главным образом мешает гидролиз по катиону, добавить кислоты, лучше соответствующей, т.е. уксусной.
В других случаях степень гидролиза желательно увеличить. Например, чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающийся гидролизу. В результате происходит полный гидролиз, и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются, и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
Гидролиз в заданиях ЕГЭ по химии
ВОПРОС А26 (2003 г.). Фенолфталеин можно использовать для обнаружения в водном растворе соли:
1) ацетата алюминия; 2) нитрата калия; 3) сульфата алюминия; 4) силиката натрия.

1) ацетат алюминия рассмотрен выше, идет совместный гидролиз, среда получается слабокислая;
2) нитрат калия образован сильными кислотой и основанием, гидролиз не идет, среда нейтральная;
3) сульфат алюминия образован сильной кислотой и слабым основанием, гидролиз идет по катиону, среда получается кислая;
4) силикат натрия образован слабой кислотой и сильным основанием, гидролиз идет по аниону, среда получается щелочная:



Ответ. 4.
ВОПРОС A29 (демонстрационный вариант, 2005 г.). Среда раствора карбоната калия:
1) щелочная; 2) кислая; 3) нейтральная; 4) слабокислая.

Ответ. 1.
ВОПРОС B5 (демонстрационный вариант, 2005 г.). Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли.
| Формула соли: | CCCCC | Ионное уравнение: |
| 1) CuSO4; | а) CH3COO – + H2O  CH3COOH + OH – ; CH3COOH + OH – ; |
|
| 2) K2CO3; | б)  + H2O + H2O  NH3•H2O + H + ; NH3•H2O + H + ; |
|
| 3) CH3COONa; | в) Сu 2+ + H2O  Cu(OH) + + H + ; Cu(OH) + + H + ; |
|
| 4) (NH4)2SO4. | г)  + H2O + H2O  H H  + OH – ; + OH – ; |
|
д) Сu 2+ + 2H2O  Cu(OH)2 +2H + . Cu(OH)2 +2H + . |

Ответ. 1 – в; 2 – г; 3 – а; 4 – б.
ВОПРОС В3 (2004 г.). Установите соответствие между условиями и состоянием химического равновесия процесса гидролиза солей.
Условия смещения равновесия:
1) нагревание раствора;
2) добавление продуктов гидролиза;
3) охлаждение раствора;
4) разбавление раствора.
а) смещается влево;
б) смещается вправо;
в) не смещается.

Ответ. 1 – б; 2 – а; 3 – а; 4 – б.
ВОПРОС С1 (2004 г.). Как скажется на состоянии химического равновесия в системе
Zn 2+ + H2O 
2) добавление KOH;
3) нагревание раствора?

H2SO4 = 2H + + 
повышение концентрации ионов водорода приводит по принципу Ле Шателье к смещению равновесия в системе влево;
2) добавление KOH:
гидроксид-ионы связывают ионы водорода в малодиссоциирующее вещество – воду
(H + + OH – = H2O); снижение концентрации ионов водорода приводит по принципу Ле Шателье к смещению равновесия в системе вправо;
3) нагревание раствора по принципу Ле Шателье приводит к смещению равновесия в сторону протекания эндотермической реакции, т.е. вправо.
Ответ на все три элемента вопроса оценивался в 3 балла.
Попробуйте самостоятельно ответить на следующие вопросы.
ВОПРОС А26 (2003 г.). Между собой водные растворы сульфата и фосфата натрия можно различить с помощью:
1) гидроксида натрия;
2) серной кислоты;
3) фенолфталеина;
4) фосфорной кислоты.
ВОПРОС В3 (2003 г.). Установите соответствие между названиями солей и средой их растворов.
1) нитрит калия;
2) сульфат железа(II);
3) карбонат калия;
4) хлорид алюминия.
а) кислая;
б) нейтральная;
в) щелочная.
ВОПРОС В3 (2004 г.). Установите соответствие между формулой соли и способностью этой соли к гидролизу.
Способность к гидролизу:
а) гидролиз по катиону;
б) гидролиз по аниону;
в) гидролиз по катиону и аниону;
г) гидролизу не подвергается.
ВОПРОС С1 (2003 г.). Сульфид-ион – типичный протолит. Напишите уравнение протолиза (гидролиза) сульфид-иона в водном растворе по первой ступени. Укажите среду этого раствора. Как скажется добавление гидроксида натрия на степень протолиза сульфид-ионов?
Подводя итог, отметим, что в рамках школьного курса в реакциях гидролиза солей нет ничего чрезмерно сложного для понимания школьника. Здесь используются общие правила написания ионных уравнений, общие представления о смещении химического равновесия, общий подход к номенклатуре солей, краткий и удобный алгоритм написания уравнений. Хочется надеяться, что изложенный материал поможет вам и вашим ученикам.
источники:
http://chemege.ru/gidroliz/
http://him.1sept.ru/article.php?ID=200501003
Определение гидролиза
Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад».
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
Гидролиз солей — это реакция взаимодействия ионов соли с Н+ и ОН− ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает в себя часть гидроксида и часть кислоты. За часть гидроксида отвечает катион металла, а за кислоту — анион кислотного остатка.
Например:
-
сульфат меди CuSO4 состоит из основания Cu(ОН)2 и кислоты H2SO4;
-
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
-
карбонат натрия Na2CO3 состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H+ или гидроксильная группа OH− .
Запоминаем!
Важное условие гидролиза — наличие в составе соли слабого иона.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH = XOH + HY
В данном случае:
-
XY — формула соли;
-
HOH — вода;
-
XH — кислотный остаток;
-
HOY — основание.
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Важно!
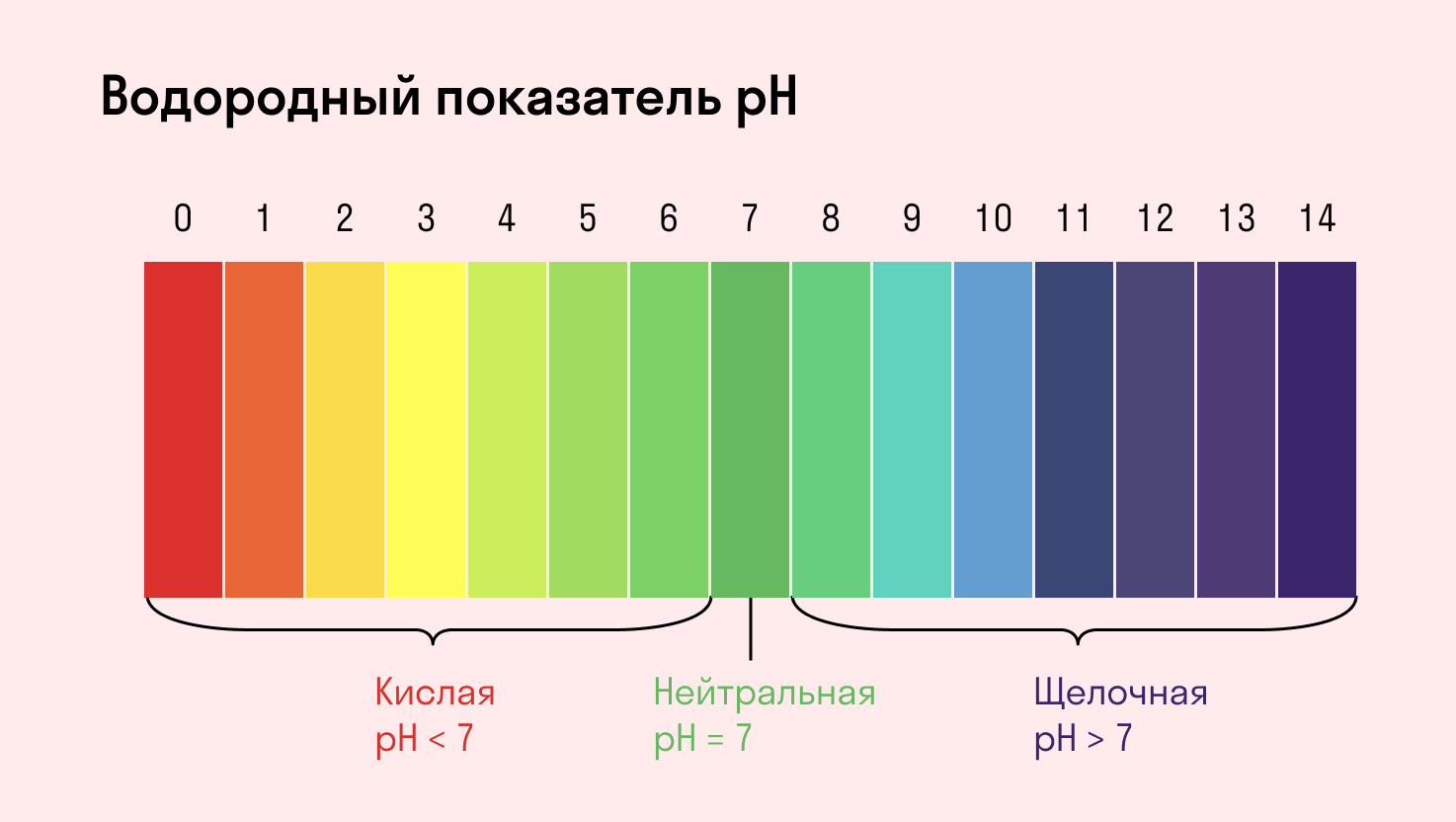
В учебном материале и в задачах вместо словосочетания «среда раствора» можно встретить «водородный показатель pH». По сути это одно и то же. В нейтральной среде pH = 7, в кислой среде с избытком положительно заряженных ионов водорода H+ — pH меньше 7, а в щелочной среде с избытком отрицательно заряженных ионов OH− — pH больше 7.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона гидроксида. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Пример:
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4+ связывает ионы воды OH−.
Молекулярное уравнение: NH4NO3 + H2O ↔ NH3 · H2O + HNO3
Ионное уравнение: NH4+ + NO3− + HOH ↔ NH4OH + H+ + NO3−
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H+ в молекуле воды. В итоге получается раствор с повышенным содержанием OH−.
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Пример:
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2− связывает ионы воды H+.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K+ + NO2− + HOH ↔ HNO2 + K+ + OH−
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Среда водного раствора: нейтральная.
Реакция индикаторов: могут не изменить свой цвет.
Пример:
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4+ + CN− + HOH ↔ NH4OH + HCN
Среда в данном случае будет нейтральной.
Обобщим все эти сведения в таблице гидролиза солей.
Важно!
При взаимодействии гидрофосфатов с водой среда всегда будет щелочной. Дигидрофосфаты, гидросульфиты и гидросульфаты всегда дают кислую среду, независимо от силы основания. Например, гидросульфит натрия имеет сильное основание и слабую кислоту, исходя из чего можно было бы предположить образование щелочной среды. Но ввиду особенностей диссоциации в водном растворе pH будет меньше 7 (кислая среда).
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
-
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
-
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: KHCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Важно!
Определить среду водного раствора, получившегося в результате гидролиза кислых солей, бывает непросто. В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Al2S3+ 6H2O= 2AL(OH)3↓ + 3H2S↑
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимый гидролиз имеет место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
CaC2+ 2H2O= Ca(OH)2+ C2H2↑
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h = nгидр/nобщ.* 100%
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
-
температура, при которой происходит процесс;
-
концентрация водного раствора;
-
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
-
Назовите необходимое условие для гидролиза.
-
Какие типы гидролиза вы знаете?
-
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
-
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
-
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
-
Как воздействует на гидролиз разбавление раствора водой?
-
Как определяется количество ступеней гидролиза?
-
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
-
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
-
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Гидролиз солей
Общие понятия
Гидролиз (от греч. – вода и
– разложение) – это разложение водой.
Гидролиз солей – это взаимодействие ионов соли с
водой с образованием малодиссоциирующих частиц.
Давая такое определение реакции гидролиза, мы
подчеркиваем, что соли в растворе находятся в
виде ионов и движущей силой реакции является
образование малодиссоциирующих частиц (общее
правило для многих реакций в растворах).
Всегда ли ионы способны образовывать с водой
малодиссоциирующие частицы? Разбирая этот
вопрос с учениками, отмечаем, что катионы
сильного основания и анионы сильной кислоты
таких частиц образовать не могут и,
следовательно, в реакцию гидролиза не вступают.
Какие типы гидролиза возможны? Поскольку соль
состоит из катиона и аниона, то возможны три типа
гидролиза:
• гидролиз по катиону (в реакцию с водой
вступает только катион);
• гидролиз по аниону (в реакцию с водой вступает
только анион);
• совместный гидролиз (в реакцию с водой
вступает и катион, и анион).
Гидролиз по катиону. Как катион может
взаимодействовать с водой? Учитель сам должен
решить, рассматривать ли ему этот вопрос в общем
виде или (в менее сильном классе) на конкретном
примере. Отмечаем, что катион – это положительно
заряженная частица, а молекула воды полярна,
условно можно представить ее состоящей из
положительно заряженного атома водорода и
отрицательно заряженной гидроксильной группы.
Какую же часть молекулы воды оторвет и
присоединит к себе катион? Ученики с
удовольствием отвечают: «Гидроксильную группу!»
Ответ подтверждаем записью уравнения, отмечая
обратимость реакции:
Mn+ + H–OH MOH(n–1)+ + H+.
Написав формулу образовавшейся частицы, тут же
обсуждаем, что это за частица, будет ли она иметь
заряд и какой, приходим к выводу, что, как правило,
это гидроксокатион. А что останется от молекулы
воды? Какую реакцию водного раствора
обусловливает избыток этих частиц? Какова будет
реакция индикатора? А теперь проверим нашу
гипотезу (следует демонстрация опыта).
После этого школьники могут самостоятельно
сделать вывод: гидролиз по катиону приводит к
образованию гидроксокатионов и кислой среды
раствора.
Отмечаем, что иногда (при n = 1) вместо
гидроксокатионов получаем молекулы слабого
основания. А может ли гидроксокатион вступить в
реакцию со следующей молекулой воды? Сообщаем,
что это будет вторая ступень гидролиза, что
каждая следующая ступень протекает в тысячи раз
слабее, чем предыдущая, что даже первая ступень
протекает обычно на доли процента. Поэтому, как
правило, рассматривается только первая ступень
гидролиза.
Гидролиз по аниону разбираем
аналогично, записывая уравнение:
Ann– + H–OH HAn(n–1)– + OH–.
Подводим учеников к выводу: гидролиз по
аниону приводит к образованию гидроанионов и
щелочной среды раствора.
Совместный гидролиз. Из самого
названия следует, что в этом случае в растворе
протекают две выше рассмотренные реакции.
Предлагаем школьникам проанализировать их и
сделать вывод о реакции среды. Опровергаем (можно
экспериментом) представление о том, что среда
будет нейтральной. Одинаковое число ионов
водорода и гидроксид-ионов существует только на
бумаге. На самом деле здесь протекают две
независимые обратимые реакции, и каких ионов в
растворе окажется больше – зависит от степени
протекания каждой реакции. А это, в свою очередь,
зависит от того, что слабее – кислота или
основание. Если слабее основание, то в большей
степени будет протекать гидролиз по катиону и
среда раствора будет кислой. Если слабее кислота
– наоборот. Как исключение возможен случай,
когда среда будет почти нейтральной, но это
только исключение.
Одновременно обращаем внимание учащихся на то,
что связывание гидроксид-ионов и ионов водорода
в воду приводит к уменьшению их концентрации в
растворе. Предлагаем вспомнить принцип Ле
Шателье и подумать, как это повлияет на
равновесие. Подводим их к выводу, что при
совместном гидролизе степень его протекания
будет значительно выше и в отдельных случаях это
может привести к полному гидролизу.
Полный гидролиз. Для полного
протекания гидролиза нужно, чтобы соль была
образована очень слабой кислотой и очень слабым
основанием. Кроме того, желательно, чтобы один из
продуктов гидролиза уходил из сферы реакции в
виде газа. (Малорастворимые вещества, остающиеся
в контакте с раствором, вообще говоря, не уходят
из сферы реакции, поскольку все равно в какой-то
степени растворимы.) Поэтому полному гидролизу
подвергаются обычно соли газообразных или
неустойчивых кислот: сероводородной, угольной,
отчасти сернистой. К ним примыкают вещества,
которые в обычном понимании уже не являются
солями: нитриды, фосфиды, карбиды, ацетилениды,
бориды. Полностью гидролизуются также
алкоголяты.
Если вернуться к обычным солям, то полностью
гидролизующиеся соли (карбонаты, сульфиды
алюминия, хрома(III), железа(III)) нельзя получить
реакциями обмена в водных растворах. Вместо
ожидаемых продуктов в результате реакции мы
получим продукты гидролиза. Гидролиз осложняет
протекание многих других реакций обмена. Так, при
взаимодействии карбоната натрия с сульфатом
меди в осадок обычно выпадает основный карбонат
меди (CuOH)2CO3.
В таблице растворимости для полностью
гидролизующихся солей стоит прочерк. Однако
прочерк может стоять по другим причинам:
вещество не изучено, разлагается в ходе
окислительно-восстановительной реакции и т.п.
Некоторые прочерки, иногда встречающиеся в
таблице растворимости, вызывают удивление. Так,
сульфид бария хорошо известен и растворим, как и
сульфиды других щелочно-земельных металлов.
Гидролиз этих солей протекает только по аниону.
Алгоритм написания уравнений гидролиза
Когда школьники поняли суть реакции гидролиза,
даем (а лучше составляем вместе с ними) алгоритм
написания уравнений гидролиза. Рассмотрим его на
конкретных примерах.
Пример 1. Гидролиз
сульфата меди(II)
1. Определяем тип гидролиза. На
этом этапе школьники могут написать уравнение
диссоциации соли:
CuSO4 = Cu2+ + .
Можно дать им «правило цепочки»: цепочка рвется
по слабому звену, гидролиз идет по иону слабого
электролита.
Соль образована катионом слабого основания
(подчеркиваем) и анионом сильной кислоты. Идет
гидролиз по катиону.
2. Пишем ионное уравнение гидролиза,
определяем среду:
Cu2+ + H–OH
CuOH+ + H+.
Образуется катион гидроксомеди(II) и ион
водорода, среда – кислая.
3. Составляем молекулярное
уравнение. Надо учитывать, что составление
такого уравнения есть некоторая формальная
задача. Из положительных и отрицательных частиц,
находящихся в растворе, мы составляем
нейтральные частицы, существующие только на
бумаге. В данном случае мы можем составить
формулу (CuOH)2SO4, но для этого наше
ионное уравнение мы должны мысленно умножить на
два. Получаем:
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4.
Обращаем внимание, что продукт реакции
относится к группе основных солей. Названия
основных солей, как и названия средних, следует
составлять из названий аниона и катиона, в данном
случае соль назовем «сульфат гидроксомеди(II)».
(Не надо приставки «ди», не говорим же мы «сульфат
динатрия».) Назвать эту соль «гидроксосульфат
меди», на наш взгляд, значит нарушить всю логику
номенклатуры солей. Разве есть в растворе или в
узлах кристаллической решетки частица
«гидроксосульфат»? Нет! А катион гидроксомеди
есть. В дальнейшем этот подход распространяется
на номенклатуру комплексных солей.
Пример 2. Гидролиз
ортофосфата рубидия
1. Определяем тип гидролиза:
Rb3PO4 = 3Rb+ + PO43–.
Рубидий – щелочной металл, его гидроксид –
сильное основание, фосфорная кислота, особенно
по своей третьей стадии диссоциации, отвечающей
образованию фосфатов, – слабая кислота. Идет
гидролиз по аниону.
2. Пишем ионное уравнение гидролиза,
определяем среду:
+ H–OH
+ OH–.
Продукты – гидрофосфат- и гидроксид-ионы, среда
– щелочная.
3. Составляем молекулярное
уравнение:
Rb3PO4 + H2O Rb2HPO4 + RbOH.
Получили кислую соль – гидрофосфат рубидия.
Пример 3. Гидролиз
ацетата алюминия
1. Определяем тип гидролиза:
Al(CH3COO)3 = Al3+ + 3CH3COO–.
Соль образована катионом слабого основания и
анионами слабой кислоты. Идет совместный
гидролиз.
2. Пишем ионные уравнения гидролиза,
определяем среду:
Al3+ + H–OH
AlOH2+ + H+,
CH3COO– + H–OH CH3COOH + OH–.
Учитывая, что гидроксид алюминия очень слабое
основание, предположим, что гидролиз по катиону
будет протекать в большей степени, чем по аниону.
Следовательно, в растворе будет избыток ионов
водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное
уравнение реакции. Обе реакции обратимы, никак
друг с другом не связаны, и такое суммирование
бессмысленно.
3. Составляем молекулярное
уравнение:
Al(CH3COO)3 + H2O AlOH(CH3COO)2 + CH3COOH.
Это тоже формальное упражнение, для тренировки
в составлении формул солей и их номенклатуре.
Полученную соль назовем ацетат
гидроксоалюминия.
Факторы, влияющие на степень гидролиза
Поскольку гидролиз – обратимая реакция, то на
состояние равновесия гидролиза влияют
температура, концентрации участников реакции,
добавки посторонних веществ. Если в реакции не
участвуют газообразные вещества, то давление
практически не влияет. Исключается из
рассмотрения вода, т.к. ее концентрация в водных
растворах практически постоянна
(~55 моль/л). Так, для примеров 1 и 2 выражения
констант равновесия (констант гидролиза) имеют
вид:
Температура. Поскольку реакция
гидролиза эндотермическая, повышение
температуры смещает равновесие в системе вправо,
степень гидролиза возрастает.
Концентрация продуктов гидролиза. В
соответствии с принципом Ле Шателье повышение
концентрации ионов водорода для реакции,
рассмотренной в примере 1, приведет к смещению
равновесия влево, т.е. степень гидролиза будет
уменьшаться. Также будет влиять увеличение
концентрации гидроксид-ионов для реакции,
рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого
фактора приводит к парадоксальному выводу:
равновесие в системе смещается вправо (в
соответствии с принципом Ле Шателье), но степень
гидролиза уменьшается.
Понять это помогает константа равновесия. При
добавлении соли, т.е. фосфат-ионов в примере 2,
равновесие будет смещаться вправо, концентрации
гидрофосфат- и гидроксид-ионов будут возрастать.
Но из рассмотрения константы равновесия этой
реакции ясно, что, для того чтобы увеличить
концентрацию гидроксид-ионов вдвое, нам надо
концентрацию фосфат-ионов увеличить в 4 раза!
Ведь значение константы должно быть неизменным.
А это значит, что степень гидролиза, под которой
можно понимать отношение [OH–]/[], уменьшится вдвое.
Разбавление. Этот фактор означает
одновременное уменьшение концентрации всех
частиц в растворе (не считая воды). В соответствии
с принципом Ле Шателье такое воздействие
приводит к смещению равновесия в сторону
реакции, идущей с увеличением числа частиц.
Реакция гидролиза протекает (без учета воды!) с
увеличением числа частиц. Следовательно, при
разбавлении равновесие смещается в сторону
протекания этой реакции, т.е. вправо, степень
гидролиза возрастает. К этому же выводу приведет
рассмотрение константы гидролиза.
Добавки посторонних веществ могут
влиять на положение равновесия в том случае,
когда эти вещества реагируют с одним из
участников реакции. Так, при добавлении к
раствору сульфата меди в примере 1 раствора
гидроксида натрия содержащиеся в нем
гидроксид-ионы будут взаимодействовать с ионами
водорода. В результате их концентрация
уменьшится, и по принципу Ле Шателье равновесие в
системе сместится вправо, степень гидролиза
возрастет. Если к тому же раствору добавить
раствор сульфида натрия, то равновесие сместится
не вправо, как можно было бы ожидать (взаимное
усиление гидролиза), а влево из-за связывания
ионов меди в практически нерастворимый сульфид
меди.
Практическое применение
На практике с гидролизом учителю приходится
сталкиваться, например, при приготовлении
растворов гидролизующихся солей, в частности
ацетата свинца. Обычная методика: в колбу
наливаем воду, засыпаем соль, взбалтываем.
Остается белый осадок. Добавляем еще воды,
взбалтываем – осадок не исчезает. Добавляем из
чайника горячей воды – осадка кажется еще
больше…
Причина в том, что одновременно с растворением
идет гидролиз соли, и белый осадок, который мы
видим, – это уже продукты гидролиза –
малорастворимые основные соли. Все наши
дальнейшие действия – разбавление, нагревание –
только усиливают степень гидролиза.
Как же подавить гидролиз? Не нагревать, не
готовить слишком разбавленных растворов и,
поскольку главным образом мешает гидролиз по
катиону, добавить кислоты, лучше
соответствующей, т.е. уксусной.
В других случаях степень гидролиза желательно
увеличить. Например, чтобы сделать щелочной
моющий раствор бельевой соды более активным, мы
его нагреваем – степень гидролиза карбоната
натрия при этом возрастает.
Важную роль играет гидролиз в процессе
обезжелезивания воды методом аэрации. При
насыщении воды кислородом содержащийся в ней
гидрокарбонат железа(II) окисляется до соли
железа(III), значительно сильнее подвергающийся
гидролизу. В результате происходит полный
гидролиз, и железо отделяется в виде осадка
гидроксида железа(III).
На этом же основано применение солей алюминия в
качестве коагулянтов в процессах очистки воды.
Добавляемые в воду соли алюминия в присутствии
гидрокарбонат-ионов полностью гидролизуются, и
объемистый гидроксид алюминия коагулирует,
увлекая с собой в осадок различные примеси.
Гидролиз в заданиях ЕГЭ по химии
ВОПРОС А26 (2003 г.). Фенолфталеин
можно использовать для обнаружения в водном
растворе соли:
1) ацетата алюминия; 2) нитрата калия; 3) сульфата
алюминия; 4) силиката натрия.
Фенолфталеин
– индикатор на щелочную среду, в которой он
принимает малиновую окраску (возможно, для
многих камнем преткновения в этом вопросе стало
незнание окрасок индикаторов: фенолфталеина,
лакмуса, метилоранжа). В растворе соли щелочная
среда может возникнуть при гидролизе по аниону.
Анализируем:
1) ацетат алюминия рассмотрен выше, идет
совместный гидролиз, среда получается
слабокислая;
2) нитрат калия образован сильными кислотой и
основанием, гидролиз не идет, среда нейтральная;
3) сульфат алюминия образован сильной кислотой
и слабым основанием, гидролиз идет по катиону,
среда получается кислая;
4) силикат натрия образован слабой кислотой и
сильным основанием, гидролиз идет по аниону,
среда получается щелочная:
+ H2O
H
+ OH–.
Ответ. 4.
ВОПРОС A29 (демонстрационный
вариант, 2005 г.). Среда раствора карбоната калия:
1) щелочная; 2) кислая; 3) нейтральная; 4)
слабокислая.
Рассмотрение
аналогичное.
Ответ. 1.
ВОПРОС B5 (демонстрационный
вариант, 2005 г.). Установите соответствие между
формулой соли и ионным уравнением гидролиза этой
соли.
Пример не
слишком удачного вопроса. С одной стороны, трудно
на него не ответить, исходя из простого
сопоставления формул в левой и правой колонках
(про гидролиз можно при этом ничего не знать). С
другой стороны, оба ионных уравнения для катиона
меди можно считать правильными, но уравнение д)
мы бы назвали суммарным для двух стадий
гидролиза и отметили бы, что степень протекания
реакции по нему чрезвычайно мала. Только на
основе этого мы выберем уравнение в).
Ответ. 1 – в; 2 – г; 3 – а; 4 – б.
ВОПРОС В3 (2004 г.). Установите
соответствие между условиями и состоянием
химического равновесия процесса гидролиза
солей.
Условия смещения равновесия:
1) нагревание раствора;
2) добавление продуктов гидролиза;
3) охлаждение раствора;
4) разбавление раствора.
Химическое равновесие:
а) смещается влево;
б) смещается вправо;
в) не смещается.
Используем
установленные выше закономерности.
Ответ. 1 – б; 2 – а; 3 – а; 4 – б.
ВОПРОС С1 (2004 г.). Как скажется на
состоянии химического равновесия в системе
Zn2+ + H2O ZnOH+ + H+ – Q:
1) добавление H2SO4;
2) добавление KOH;
3) нагревание раствора?
Ответ обоснуйте.
При ответе на
этот вопрос надо учитывать, что добавляемые
вещества – электролиты. Поставляемые ими ионы
могут как непосредственно влиять на равновесие,
так и взаимодействовать с одним из ионов,
участвующих в обратимой реакции:
1) добавление H2SO4:
H2SO4 = 2H+ + ,
повышение концентрации ионов водорода
приводит по принципу Ле Шателье к смещению
равновесия в системе влево;
2) добавление KOH:
KOH = K+ + OH–,
гидроксид-ионы связывают ионы водорода в
малодиссоциирующее вещество – воду
(H+ + OH– = H2O); снижение
концентрации ионов водорода приводит по
принципу Ле Шателье к смещению равновесия в
системе вправо;
3) нагревание раствора по принципу Ле Шателье
приводит к смещению равновесия в сторону
протекания эндотермической реакции, т.е. вправо.
Ответ на все три элемента вопроса
оценивался в 3 балла.
Попробуйте самостоятельно ответить на
следующие вопросы.
ВОПРОС А26 (2003 г.). Между собой
водные растворы сульфата и фосфата натрия можно
различить с помощью:
1) гидроксида натрия;
2) серной кислоты;
3) фенолфталеина;
4) фосфорной кислоты.
ВОПРОС В3 (2003 г.). Установите
соответствие между названиями солей и средой их
растворов.
Название соли:
1) нитрит калия;
2) сульфат железа(II);
3) карбонат калия;
4) хлорид алюминия.
Среда раствора:
а) кислая;
б) нейтральная;
в) щелочная.
ВОПРОС В3 (2004 г.). Установите
соответствие между формулой соли и способностью
этой соли к гидролизу.
Формула соли:
1) Zn(CH3COO)2;
2) NaBr;
3) Li2S;
4) (NH4)2SO4.
Способность к гидролизу:
а) гидролиз по катиону;
б) гидролиз по аниону;
в) гидролиз по катиону и аниону;
г) гидролизу не подвергается.
ВОПРОС С1 (2003 г.). Сульфид-ион –
типичный протолит. Напишите уравнение протолиза
(гидролиза) сульфид-иона в водном растворе по
первой ступени. Укажите среду этого раствора. Как
скажется добавление гидроксида натрия на
степень протолиза сульфид-ионов?
* * *
Подводя итог, отметим, что в рамках школьного
курса в реакциях гидролиза солей нет ничего
чрезмерно сложного для понимания школьника.
Здесь используются общие правила написания
ионных уравнений, общие представления о смещении
химического равновесия, общий подход к
номенклатуре солей, краткий и удобный алгоритм
написания уравнений. Хочется надеяться, что
изложенный материал поможет вам и вашим
ученикам.
Автор будет благодарен за возможные замечания
и ответит на возникшие вопросы, с которыми можно
обратиться к нему по адресу: kontren@narod.ru.
Г.М.МОЖАЕВ,
старший преподаватель
химического факультета
Тюменского государственного университета
Гидролиз
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Гидролиз – это взаимодействие ионов растворенного вещества с молекулами воды:
X++H2O ↔ XOH+H+
Y—+H2O ↔ HY+OH—
Для нерастворимых веществ гидролиз не идет.
(На самом деле не бывает совершенно нерастворимых соединений, лишь вещества с очень низкой растворимостью. Но при сдаче экзамена за школьный курс растворимостью в таких случаях мы пренебрегаем.)
Сильные кислоты и основания в водных растворах в значительной степени диссоциированны:
NaOH ↔ Na+ + OH—
H2SO4 ↔ H+ + HSO4—
Это означает, что катионам щелочей и анионам сильных кислот выгодно существовать в растворе в виде ионов.
Для слабых кислот диссоциация происходит намного слабее. Например, в растворе азотистой кислоты значительно больше молекул, чем ионов, образовавшихся в результате диссоциации. Слабым электролитам выгоднее существовать в недиссоциированной форме.
Таким образом, гидролиз протекает по слабому (аниону слабой кислоты или катиону слабого основания).
1) Соль образована сильными основанием и кислотой:
NaCl, Ba(NO3)2, RbClO4 и т.д.
Гидролиз не идет, среда нейтральная, pH = 7, [H+]=[OH—] окраска индикаторов: фенолфталеин – бесцветный, лакмус фиолетовый – фиолетовый, метиловый оранжевый – оранжевый.
2) Соль образована сильным основанием и слабой кислотой:
NaF, K3PO4, (CH3COO)2Ba.
Гидролиз описывается уравнением:
F—+H2O ↔ HF+OH—. В результате гидролиза по аниону возрастает концентрация гидроксид-ионов в растворе, среда щелочная, pH > 7, [H+] < [OH—] окраска индикаторов: фенолфталеин – малиновый, лакмус фиолетовый — синий, метиловый оранжевый – желтый.
3) Соль образована слабым основанием и сильной кислотой:
NH4NO3, CuCl2, FeSO4.
Гидролиз описывается уравнением:
NH4+ + H2O ↔ H++ NH4OH.
В результате гидролиза по катиону возрастает концентрация протонов водорода в растворе, среда кислая, pH < 7, [H+] > [OH—] окраска индикаторов: фенолфталеин – бесцветный, лакмус фиолетовый — красный, метиловый оранжевый –розовый.
4) Соль образована слабым основанием и слабой кислотой:
NH4F, (CH3COO)2Cu, Ni(NO2)2.
Гидролиз описывается уравнениями:
F— + H2O ↔ HF + OH—, и
H+ + OH— ↔ H2O.
Гидролиз идет и по катиону, и по аниону, среда нейтральная, pH = 7, [H+]=[OH—] окраска индикаторов: фенолфталеин – бесцветный, лакмус фиолетовый – фиолетовый, метиловый оранжевый – оранжевый.
4а) Полный гидролиз – один из видов гидролиза и по катиону, и по аниону. Вещества, разлагающиеся в воде, необратимо гидролизуются:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Если в реакции обмена должно образоваться вещество, отмеченное в таблице растворимостей «?» или «-», в результате образуется смесь продуктов его гидролиза:
3Na2S + 2AlCl3 + 6H2O → 6NaCl + 2Al(OH)3 + 3H2S↑.
Таким образом, гидролизу подвержены только растворимые соли (или разлагающиеся водой, в этом случае гидролиз необратим), среду определяет «сильный» — катион сильного основания или анион сильной кислоты, а гидролиз идет по слабому.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Гидролиз» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
07.02.2023
Особое
место среди обменных реакций занимает
гидролиз. В
общем случае гидролиз – это разложение
веществ водой. Вода – одно из самых
активных веществ. Она действует на самые
различные классы соединений:
соли, углеводы, белки, эфиры, жиры и т.
д. При гидролизе соединений неметаллов
обычно образуются две кислоты, например:
PCl3
+ 3 H2O
= H3PO3
+ 3 HCl
При
этом изменяется кислотность растворов
по сравнению с кислотностью растворителя.
В
неорганической химии чаще всего
приходится иметь дело с гидролизом
солей, т.е. с обменным взаимодействием
ионов соли с молекулами воды, в результате
которого смещается равновесие
электролитической диссоциации воды.
Гидролизом
соли называется
обратимое взаимодействие ионов соли с
ионами воды, приводящее к изменению
равновесия между ионами водорода и
гидроксида в растворе.
Гидролиз
является результатом поляризационного
взаимодействия ионов соли с их гидратной
оболочкой в водном растворе. Чем
значительнее это взаимодействие, тем
интенсивнее протекает гидролиз. Упрощенно
сущность процесса гидролиза можно
представить следующим образом.
Катионы
Кn+
связываются в растворе с гидратирующими
их молекулами воды донорно-акцепторной
связью; донором являются атомы кислорода
молекулы воды, имеющие две неподеленные
электронные пары, акцептором — катионы,
имеющие свободные атомные орбитали.
Чем больше заряд катиона и чем меньше
его размер, тем значительнее поляризующее
действие Кn+
на Н2O.
Анионы
Аn‾
связываются с молекулами воды водородной
связью. Сильное воздействие анионов
может привести к полному отрыву протона
от молекулы Н2O
– водородная связь становится ковалентной.
В результате образуется кислота или
анион типа HS‾,
НСО3‾
и т. п.
Взаимодействие
анионов An‾
с протонами тем значительнее, чем больше
заряд аниона и меньше его радиус. Таким
образом, интенсивность взаимодействия
вещества с водой определяется силой
поляризующего влияния Кn+
и Аn‾
на молекулы Н2O.
Так, катионы элементов побочных подгрупп
и непосредственно следующих за ними
элементов подвергаются более интенсивному
гидролизу, чем другие ионы одинаковых
с ними заряда и радиуса, так как ядра
первых менее эффективно экранируются
d-электронами.
Гидролиз – процесс
обратный реакции нейтрализации.
Если реакция нейтрализации процесс
экзотермический и необратимый, то
гидролиз – процесс эндотермический и
обратимый.
Реакция нейтрализации:
2 KOH
+ H2SO3
→ K2SO3
+ 2 H2O
сильный
слабый сильный слабый
2 OH‾
+ H2SO3
= SO32-
+ 2 H2O
Реакция гидролиза:
K2SO3+
H2O
↔ KOH
+ KHSO3
SO32-
+ HOH
↔ HSO3‾
+ OH‾
При гидролизе
смещается равновесие диссоциации воды
вследствие связывания одного из ее
ионов (Н+
или ОН—)
в слабый электролит соли. При связывании
ионов Н+
в растворе накапливаются ионы ОН−,
реакция среды будет щелочная, а при
связывании ионов ОН−
накапливаются ионы Н+
— среда будет кислая.
Различают четыре
варианта действия воды на соли.
1. Если катионы и
анионы имеют небольшие заряды и большие
размеры, то их поляризующее влияние на
молекулы воды невелико, т. е. взаимодействие
соли с H2O
практически не происходит. Это относится
к катионам, гидроксиды которых являются
щелочами (например, K+
и Са2+)
и к анионам сильных кислот (например,
Сl‾ и NО3‾).
Следовательно, соли,
образованные сильным основанием и
сильной кислотой, гидролизу не
подвергаются.
В этом случае равновесие диссоциации
воды
H2O
↔ H+
+ OH‾
в присутствии
ионов соли практически не нарушается.
Поэтому растворы таких солей нейтральны
(pH ≈ 7).
2. Если соль
образована катионом сильного основания
и анионом слабой кислоты
(S2-,
CO32-,
CN‾ и др.), то происходит
гидролиз по аниону.
Пример – гидролиз соли СН3СООК.
Ионы соли СН3СОО−
и К+
взаимодействуют с ионами Н+
и ОН− из
воды. При этом ацетат-ионы (СН3СОО−)
связываются с ионами водорода (Н+)
в молекулы слабого электролита — уксусной
кислоты (CH3COOH),
а ионы ОН−
накапливаются
в растворе, сообщая ему щелочную реакцию,
так как ионы К+
не могут связать ионы ОН−
(КОН является
сильным электролитом), pH
> 7.
Молекулярное
уравнение гидролиза:
СН3СООК
+ H2O
↔ КОН + СН3ООН
Полное
ионное уравнение гидролиза:
К+
+ СН3СОО−
+ НОН ↔
K+
+ ОН−
+ СН3СООН
сокращенное
ионное уравнение гидролиза:
СН3СОО−
+ НОН
↔
ОН−
+ СН3СООН
Гидролиз соли Na2S
протекает ступенчато. Соль образована
сильным основанием (NaOH)
и слабой двухосновной кислотой (H2S).
В этом случае анион соли S2−
связывает ионы Н+
воды, в
растворе накапливаются ионы ОН−.
Уравнение в сокращенной ионной и
молекулярной форме имеет вид:
I. S2−
+ НОН
↔ HS−
+ ОН−
Na2S
+ Н2О
↔
NaHS
+ NaOH
II. HS−
+ НОН
↔ H2S
+ ОН−
NaHS + Н2О
↔ NaOH
+ H2S
Вторая
ступень гидролиза практически не
проходит при обычных условиях, так
как, накапливаясь, ионы ОН−
сообщают раствору сильнощелочную
реакцию, что приводит к реакции
нейтрализации, сдвигу равновесия влево
в
соответствии с принципом Ле Шателье.
Поэтому гидролиз солей, образованных
сильным основанием и слабой кислотой,
подавляется прибавлением щелочи.
Чем больше
поляризующее влияние анионов, тем
интенсивнее гидролиз. В соответствии
с законом действия масс это означает,
что гидролиз протекает тем интенсивнее,
чем слабее кислота.
3. Если соль
образована катионом слабого основания
и анионом сильной кислоты, то происходит
гидролиз по катиону.
Например, это имеет место при гидролизе
соли NH4Cl
(NH4ОH
— слабое основание, НСl
— сильная кислота). Отбросим ион Сl−,
так как он с катионом воды дает сильный
электролит, тогда уравнение гидролиза
примет следующий вид:
NH4+
+ НОН
↔ NH4OH
+ Н+
(сокращенное
ионное уравнение)
NH4Cl
+ Н2О
↔ NH4OH
+ НСl
(молекулярное уравнение)
Из сокращенного
уравнения видно, что ионы ОН−
воды связываются в слабый электролит,
ионы Н+
накапливаются
в растворе и cреда становится кислой
(pH
< 7). Добавление кислоты к раствору
(введение продукта реакции катионов
H+)
сдвигает равновесие влево.
Гидролиз соли,
образованной многокислотным основанием
(например, Zn(NO3)2)
протекает ступенчато по катиону слабого
основания.
I. Zn2+
+ НОН
↔ ZnOH+
+ H+
(сокращенное ионное уравнение)
Zn(NO3)2
+ Н2О
↔ ZnOHNO3
+ HNO3
(молекулярное
уравнение)
Ионы ОН−
связываются в слабое основание ZnOH+,
ионы Н+
накапливаются.
Вторая ступень
гидролиза практически не происходит
при обычных условиях,
так как в результате накопления ионов
H+ в
растворе создается сильнокислая среда
и равновесие реакции гидролиза по 2-ой
ступени смещено влево:
II. ZnOH+
+ НОН
↔ Zn(OH)2
+ H+
(сокращенное ионное уравнение)
ZnOHNO3
+ Н2О
↔ Zn(OH)2
+ HNO3
(молекулярное
уравнение)
Очевидно, чем
слабее основание, тем полнее идет
гидролиз.
4. Соль,
образованная катионом слабого основания
и анионом слабой кислоты, подвергается
гидролизу по катиону и по аниону.
Примером служит процесс гидролиза соли
СН3СООNH4.
Запишем уравнение в ионной форме:
NH4+
+ CH3COO−
+ НОН ↔ NH4OH
+ СН3СООН
Гидролиз таких
солей протекает очень сильно, поскольку
в результате его образуются и слабое
основание, и слабая кислота.
Реакция среды в
этом случае зависит от сравнительной
силы основания и кислоты, т.е. от их
констант диссоциации (KД):
-
если KД
(основания)
> KД
(кислоты)
, то pH
> 7;
-
если KД
(основания) < KД
(кислоты), то pH
< 7.
В случае гидролиза
CH3COONH4:
KД
(NH4OH)
= 1,8·10-5;
KД
(CH3COOH)=1,8·10-5,
поэтому реакция
водного раствора этой соли будет почти
нейтральной (pH
≈ 7).
Если основание и
кислота, образующие соль, являются не
только слабыми электролитами, но и
малорастворимы или неустойчивы и
разлагаются с образованием летучих
продуктов, то в этом случае гидролиз
соли протекает по всем ступеням до
конца, т.е. до образования слабого
труднорастворимого основания и слабой
кислоты. В этом случае речь идет о
необратимом
или полном гидролизе.
Именно полный
гидролиз является причиной того, что
водные растворы некоторых солей
приготовить нельзя, например Сr2(CO3)3,
Al2S3
и др.
Например:
Al2S3
+ 6H2O
→ 2Al(OH)3↓
+ 3H2S↑
Поэтому сульфид
алюминия не может существовать в виде
водных растворов, может быть получен
только «сухим способом», например,
из элементов при высокой температуре:
2Al
+ 3S
–t°→
Al2S3,
и должен храниться
в герметических сосудах, исключающих
попадание влаги.
Реакцией обмена
в водном растворе такие соединения
нельзя получить. При взаимодействии
солей А13+,
Сr3+
и Fe3+
в растворе с сульфидами и карбонатами
в осадок выпадают не сульфиды и карбонаты
этих катионов, а их гидроксиды:
2AlCl3
+3Na2S
+6Н2О
→ 3Н2S↑
+ 2Аl(ОН)3↓
+6NaCl
2CrCl3
+ 3Na2CO3
+ 3H2O
→ 2Сr(ОН)3↓
+ 3СO2↑
+ 6NaCl
В
рассмотренных примерах происходит
взаимное усиление гидролиза двух солей
(АlСl3
и Na2S
или СrСl3
и Nа2СО3)
и реакция идет до конца, так как продукты
реакции выделяются из раствора в виде
осадка и газа.
Гидролиз солей в
ряде случаев может протекать очень
сложно. (Простые уравнения реакции
гидролиза в общепринятой записи часто
являются условными.) Продукты гидролиза
можно установить лишь на основании
аналитического исследования. К примеру,
продуктами гидролиза солей, содержащих
многозарядные катионы, могут быть
полиядерные комплексы. Так, если в
раствоpax Hg2+
содержатся только одноядерные комплексы,
то в растворах Fe3+
помимо комплексов [FeOH]2+
и [Fe(OH)2]+
обнаруживается двухъядерный комплекс
[Fe2(OH)2]4+;
в растворах Ве2+
в основном образуются многоядерные
комплексы состава [Ве3(OH)3]3+;
в растворах Sn2+
образуются комплексные ионы [Sn3(OH)4]2+,
[Sn2(OH)2]2+,
[SnOH]+;
в растворах Bi3+
наряду с [ВiOН]2+
находятся комплексные ионы состава
[Bi6(OH)12]6+.
Реакции гидролиза, приводящие к
образованию полиядерных комплексов,
можно представить следующим образом:
mMk+
+ nH2О
↔ Мm(OН)n(mk
— n)+ + nН+,
где m изменяется
от 1 до 9, а n
может принимать значения от 1 до 15. Такого
рода реакции возможны для катионов
более чем 30 элементов. Установлено, что
каждому заряду иона в большинстве
случаев отвечает определенная форма
комплекса. Так, для ионов М2+
характерна форма димеров [M2(OH)]3+,
для ионов М3+
– [M2(OH)2]4+,
а для М4+
– форма [M2(OH)3]5+
и более сложные, например [Zr4(OH)8]8+
.
При высоких
температурах и больших значениях рН
образуются и оксокомплексы:
2MOH ↔ MOM + H2O
или
Например,
BiCl3
+ H2O
«
Bi(OH)2Cl
+ 2HCl
Катион Bi(OH)2+
легко теряет молекулу воды, образуя
катион висмутила ВiO+,
который с хлорид-ионом дает белый
кристаллический осадок:
Bi(OH)2Cl
®BiOCl↓
+ H2O.
Структурно
полиядерные комплексы можно представить
в виде октаэдров, соединенных между
собой по вершине, ребру или грани
посредством различных мостиков (О, ОН
и др.).
Сложный состав
имеют продукты гидролиза карбонатов
ряда металлов. Так, при взаимодействии
растворимых солей Mg2+,
Cu2+,
Zn2+,
Рb2+
с карбонатом натрия образуются не
средние карбонаты, а менее растворимые
гидроксокарбонаты,
например Сu2(ОН)2СО3,
Zn5(ОН)6(СО3)2,
Рb3(ОН)2(СО3)2.
В качестве примера можно привести
реакции:
5MgSO4
+ 5Na2CO3
+ Н2O
→ Мg5(ОН)2(СО3)4↓
+ 5Na2SO4
+ СO2↑
2Cu(NO3)2
+ 2Na2CO3
+ H2O
→ Cu2(OH)2CO3↓
+ 4NaNO3
+ CO2↑
Количественно
гидролиз характеризуется степенью
гидролиза h
и константой гидролиза КГ.
Степень гидролиза
показывает, какая часть соли, содержащаяся
в растворе (СМ),
подверглась гидролизу (СМгид)
и рассчитывается как отношение:
h
= СМ
гид
/ СМ (100%).
Очевидно, что для
обратимого процесса гидролиза h
< 1 (<100%), а для необратимого гидролиза
h
= 1 (100%).
Кроме природы соли, степень гидролиза
зависит от концентрации соли и температуры
раствора.
В растворах с
умеренной концентрацией растворенного
вещества степень гидролиза при комнатной
температуре обычно невелика. Для солей,
образованных сильным основанием и
сильной кислотой, она практически равна
нулю; для солей, образованных слабым
основанием и сильной кислотой или
сильным основанием и слабой кислотой,
она составляет ≈ 1%. Так, для 0,01 М раствора
NH4Cl
h
= 0,01%; для 0,1 н. раствора CH3COONH4
h
≈ 0,5%.
Гидролиз
– процесс обратимый, поэтому к нему
применим закон действующих масс.
Константа
гидролиза есть константа равновесия
процесса гидролиза,
и по своему физическому смыслу определяет
степень необратимости гидролиза. Чем
больше КГ,
тем необратимее гидролиз. КГ
имеет свое выражение для каждого случая
гидролиза.
Выведем
выражение для константы гидролиза соли
слабой кислоты и сильного основания на
примере NaCN:
NaCN
+ H2O
↔ NaOH + HCN;
Na+
+ CN–
+H2O
↔ Na+
+ OH–
+ HCN;
CN–
+ H2O
↔ HCN + OH–
Кравн
= [HCN][OH–]
/ [CN–][H2O].
[H2O]
имеет наибольшую величину, которая в
ходе реакции практически не изменяется,
поэтому ее можно условно считать
постоянной. Тогда помножив числитель
и знаменатель на концентрацию протонов
и введя постоянную концентрацию воды
в константу, получим:
Кравн
[H2O]
=
KW
/ КД(кисл)
= KГ
так
как [HCN] / [H+][CN–]
= 1/ КД(кисл)
Поскольку KW
величина
постоянная
и равна 10-14
, очевидно, что чем меньше КД
слабой кислоты, анион которой входит в
состав соли, тем больше KГ.
Аналогично, для
соли, гидролизующейся по катиону
(например NH4Cl),
получим:
NH4+
+ H2O
↔ NH4OH
+ H+
(сокращенное уравнение гидролиза)
Кравн
= [NH4OH][H+]
/ [NH4+][H2O]
KГ
= Кравн
[H2O]
= KW
/ КД(осн)
В этом выражении
числитель и знаменатель дроби умножили
на [OH–].
Очевидно, что чем меньше КД
слабого основания, катион которого
входит в состав соли, тем больше KГ.
Если соль образована
слабым основанием и слабой кислотой
(на примере NH4CN),
то сокращенное уравнение гидролиза
имеет вид:
NH4+
+ CN–
+ H2O
↔ NH4OH
+ HCN
Кравн
=
[NH4OH]
[HCN]
/ [NH4+][CN–],
В этом выражении
для Кравн
числитель и знаменатель дроби умножаем
на [H+]·[OH–],
поэтому выражение для KГ
принимает
вид:
KГ
= KW
/ (КД(кислоты)
КД(осн)).
Как следует из
приведенных выражений, константа
гидролиза обратно пропорциональна
константе диссоциации слабого электролита,
участвующего в образовании соли (если
в образовании соли участвуют два слабых
электролита, то KГ
обратно пропорциональна произведению
их констант диссоциации).
Рассмотрим гидролиз
многозарядного иона. Возьмем Na2CO3.
I. CO32-
+ H2O
«
HCO3–
+ OH–
KГ(I)
= [HCO3–][OH–]
/ [CO32-][H2O]
× ([H+]
/ [H+])
= KW
/ КД(II),
то есть в выражение
для константы гидролиза по первой
ступени в знаменатель входит вторая
константа диссоциации, и для второй
ступени гидролиза
-
HCO3–
+ H2O
«
H2CO3+
OH–
KГ(II)
= [H2CO3][OH–]
/ [HCO3–][H2O]
× ([H+]
/ [H+])
= KW
/ КД(I)
KД(I)
= 4×10-7 KД(II)
=
2.5×10-8
KГ(II)
= 5.6×10-11 KГ(I)
= 1.8×10-4
Таким образом,
KГ(I)
>> KГ(II),
константа, а следовательно, и степень
первой стадии гидролиза много больше
последующих.
Степень гидролиза
является величиной аналогичной степени
диссоциации. Взаимосвязь степени и
константы гидролиза аналогична таковой
для степени и константы диссоциации.
Если в общем случае
исходную концентрацию аниона слабой
кислоты обозначить через Со
(моль/л), то Соh
(моль/л) – концентрация той части аниона
A–,
которая подверглась гидролизу и
образовалось Соh
(моль/л) слабой кислоты HA и Соh
(моль/л) гидроксидных групп.
A–
+ H2O
↔ HA
+ OH–,
Со-Соh
Соh
Соh
тогда KГ
= [HA][OH–]
/ [A–]
= Соh·Соh
/ (Со-Соh)
= Соh2
/ (1-h).
П
<< 1 KГ
= Соh2
h
= √КД
/ Со.
Очень похоже на
закон разбавления Оствальда.
Можно рассчитать
pH раствора, если известны Со
и h.
Учитывая, что
[HA] = [OH–]
= Соh,
получим:
K
= Соh·Соh
/ Со
= [OH–]2/
Со,
откуда
[OH–]
= √КГ·Со.
Аналогично, можно
показать, что при гидролизе по катиону
[
= √КГ·Со.
Таким образом,
способность солей подвергаться гидролизу
зависит от двух факторов:
-
свойств ионов,
образующих соль; -
внешних факторов.
Как сдвинуть
равновесие гидролиза?
1) Добавление
одноименных ионов.
Поскольку при обратимом гидролизе
устанавливается динамическое равновесие,
то в соответствии с законом действия
масс равновесие можно сместить в ту или
иную сторону введением в раствор кислоты
или основания. Введение кислоты (катионов
Н+)
подавляет гидролиз по катиону, добавление
щелочи (анионов OH–)
подавляет гидролиз по аниону. Этим часто
пользуются для усиления или подавления
процесса гидролиза.
2) Из формулы для
h
видно, что разбавление
способствует гидролизу.
Рост степени гидролиза карбоната натрия
Na2CO3
+ НОН ↔
NaHCO3
+ NaOH
при разбавлении
раствора иллюстрирует рис. 20.
Рис. 20. Зависимость
степени гидролиза Na2CO3
от разбавления при 20°С
3) Повышение
температуры способствует гидролизу.
Константа диссоциации воды увеличивается
при повышении температуры в большей
степени, чем константы диссоциации
продуктов гидролиза — слабых кислот и
оснований, поэтому при нагревании
степень гидролиза возрастает. К этому
выводу легко прийти и иначе: так как
реакция нейтрализации экзотермична
(DH=
–56 кДж/моль), то гидролиз, будучи
противоположным ей процессом, эндотермичен,
поэтому в соответствии с принципом Ле
Шателье нагревание вызывает усиление
гидролиза. Рис. 21 иллюстрирует влияние
температуры на гидролиз хлорида хрома
(III)
СrСl3
+ НОН ↔
CrOHCl2
+ НСl
Рис. 21. Зависимость
степени гидролиза СrСl3
от температуры
В химической
практике весьма распространен гидролиз
по катиону солей, образованных
многозарядным катионом и однозарядным
анионом, например АlС13.
В растворах этих солей менее диссоциированное
соединение образуется в результате
присоединения одного гидроксид-иона к
иону металла. Учитывая, что ион Аl3+
в растворе гидратирован, первую стадию
гидролиза можно выразить уравнением
[Al(H2O)6]3+
+ HOH ↔ [Al(H2O)5OH]2+
+ H3O+
При обычной
температуре гидролиз солей многозарядных
катионов практически ограничивается
этой стадией. При нагревании происходит
гидролиз по второй ступени:
[Al(H2O)5OH]2+
+ HOH
↔ [Al(H2O)4(OH)2]+
+ H3O+
Таким образом,
кислая реакция водного раствора соли
объясняется тем, что гидратированный
катион теряет протон и аквагруппа Н2O
превращается в гидроксогруппу ОН‾. В
рассмотренном процессе могут образоваться
и более сложные комплексы, например
[Al6(OH)15]3+,
а также комплексные ионы вида [AlO(OH)4]3-
и [АlO2(ОН)2]3-.
Содержание различных продуктов гидролиза
зависит от условий проведения реакции
(концентрация раствора, температура,
присутствие других веществ). Имеет
значение также длительность протекания
процесса, так как равновесие при гидролизе
солей многозарядных катионов обычно
достигается медленно.
Пособие
для учащихся «Гидролиз»
Данное пособие предназначено для учащихся 11 класса.
Тема «Гидролиз солей» вызывает некоторые затруднения у учащихся. Пособие
содержит теоретический материал по теме «Гидролиз». Представлен алгоритм
составления уравнений реакций гидролиза, разбираются примеры решения заданий
по теме «Гидролиз солей»,приведены таблицы: «Сильные и слабые электролиты»,
«Индикаторы», «Таблица растворимости».
Составлены задания для самостоятельной работы учащихся. Пособие поможет
ученикам при выполнении лабораторной работы, по выполнению домашней работы;
позволит более полно усвоить тему.
Успешное выполнение
заданий по теме: «Гидролиз солей» невозможно без знания теоретического
материала.
1.Необходимо повторить
правила пользования таблицей растворимости:
Чтобы
определить,растворима ли соль,по вертикале в таблице находим
катион,образовавший соль.По горизонтали соответствующий анион. Если на их
пересечении стоит буква Р-соль растворима,следовательно в водном растворе
диссоциирует на ионы.Если –буква Н- вещество нерастворимо,на ионы не
диссоциирует.
2.Необходимо повторить понятия :
«электролиты», «неэлектролиты», «сильные электролиты»,
«слабые электролиты»
Электролиты-это
вещества растворы или расплавы которых проводят электрический ток. NaCl,
H2SO4,
NaOH
Неэлектролиты-это
вещества, водные растворы или расплавы которых не проводят электрический
ток. Кислород O2,
азот N2,
водород H2,многие
органические вещества – спирты, глюкоза, сахароза, бензол и др.
Сильные электролиты-полность диссоциируют
на ионы
Сильные электролиты (α
→ 1 или 100%)
1) сильные кислоты (H2SO4,
HCl,
HNO3,
HClO4,
HClO3,
HBr,
HI
и др.)
2) щелочи (NaOH,
KOH,
LiOH,
Ba(OH)2,
Ca(OH)2
и др.)
3)растворимые соли
Слабые электролиты -неполность
диссоциируют на ионы
Слабые электролиты (α
→ 0)
1) cлабые
кислоты (H2S,
H2CO3,
H2SiO3,
HNO2,
H3PO4,
H2SO3,
HCN,
HF,
CH3COOH и др.)
2) нерастворимые в воде основания (Cu(OH)2,
Fe(OH)3
и др.)
3) гидроксид аммония NH4OH
3.Следует знать
цвет индикаторов в различных средах
|
Название |
Окраска индикатора в среде |
||
|
Кислая [H+]* > [OH-] |
Нейтральная [H+] = [OH-] |
Щелочная [OH-] > [H+] |
|
|
Лакмус |
красный |
фиолетовый |
синий |
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Метилоранж |
розовый |
оранжевый |
желтый |
4.Знания о том,как
диссоциируют вещества ,относящиеся к различным классам неорганических
соединений помогут в написании уравнений гидролиза
Кислоты
– электролиты, которые при диссоциации образуют только один вид катионов –
катионы водорода Н+ Уравнение
электролитической диссоциации сильных кислот:
HCl ↔ H+ + Cl—
H2SO4 ↔ 2H+ + SO42-
Слабые
многоосновные кислоты диссоциируют ступенчато.
H2CO3
↔ H+ + HCO3— К1
> K2
HCO3—
↔ H+ + CO32-
Основания —
электролиты, которые при диссоциации образуют только один вид анионов —
гидроксид-ионы ОН Уравнение диссоциации сильных
оснований (щелочей)
NaOH ↔ Na+ +
OH—
Ba(OH)2 ↔ Ba2+
+ 2OH—
Слабые многокислотные
основания диссоциируют ступенчато.
Fe(OH)2 ↔ FeOH+
+ OH— К1
> K2
FeOH+
↔ Fe2+
+ OH—
Средние
(нормальные) соли – сильные электролиты, образующие
при диссоциации катионы металла и анионы кислотного остатка.
Al2(SO4)3
↔ 2Al3+
+ 3SO42-
Основные соли
– электролиты, которые при диссоциации образуют анионы кислотного остатка и
сложные катионы, состоящие из атомов металла и гидроксогрупп ОН-.
Fe(OH)Cl ↔ Fe(OH)+
+ Cl— (α = 1)
Fe(OH)+
↔ Fe2+
+ OH—
(α <<1)
5.Изучить
теоретический материал по теме: «Гидролиз солей»
Соли – это соединения,
образующие при диссоциации в водном растворе положительно заряженные ионы
металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме
них, ионы водорода и гидроксид-ионы. В водном растворе эти ионы гидратированы
– окружены молекулами воды.
Водные растворы многих
солей имеют кислую или щелочную среду. Причиной этого явления является гидролиз
–это взаимодействие ионов соли с водой,приводящее к образованию слабого
электролита
Причина гидролиза –
электролитическая диссоциация соответствующих солей и воды.
По отношению к воде соли можно
разделить на 4 группы:
1.Соли,
образованные катионом сильного основания и анионом слабой кислоты.
Гидролиз такого типа
называют гидролизом по аниону. Среда раствора щелочная,лакмус синий.
Пример:гидролиз соли фосфата натрия(Na3PO4
). Соль образована сильным
основанием-гидроксидом калия и слабой кислотой-фосфорной.
Na3PO4
⇄3Na+
+ PO43-
Н2О ⇄Н+
+ ОН—
3Na+
+ PO43-
+ Н2О⇄
НРО42-+ОН— +3Na+
PO43-
+ НОН ⇄ НРО42-+ОН—
Na3PO4 + Н2О ⇄ Na2НРО4 + КОН
2.Соли,
образованные катионом слабого основания и анионом сильной кислоты.
Гидролиз такого типа
называют гидролизом катиону.Среда кислая,лакмус красный Пример: гидролиз соли
сульфата меди(2)- CuSO4
CuSO4
⇄
Cu2++
SO42-
Н2О ⇄Н+
+ ОН—
Cu2++
SO42-
+ Н2О ⇄
CuOH+
+H+
Cu+2 + НОН
⇄
CuOH+ +H+ + SO42- 2CuSO4+2H2O ⇄
(CuOH)2SO4 + H2SO4
3.Соли,
образованные катионом сильного основания и анионом сильной кислоты. Соль гидролизу не
подвергается, диссоциирует на ионы в водном
растворе. В этом случае. среда нейтральная, лакмус фиолетовый.
4.Соли,
образованные катионом слабого основания и анионом слабой кислоты.
Гидролиз
такого типа называют гидролизом по катиону и аниону. В
этом случае характер среды определяют по степени диссоциации кислоты и
основания, образовавших соль. Если степень диссоциации кислоты больше степени
диссоциации основания, то среда будет слабокислой. И ,наоборот ,если степень
диссоциации основания больше степени диссоциации кислоты, то
среда-слабощелочная.
Пример необратимого гидролиза: Al2S3
+ H2O
à
Al(OH)3¯
+ H2S
Особого внимания заслуживает совместный гидролиз.
Соли в водном
растворе полностью гидролизованы.
Пример:
2AlCl3 +3K2S +
6H2O à2Al(OH)3¯
+3H2S↑ + 6KCl
Алгоритм составления уравнений реакций гидролиза:
1.
Определить
какой по силе кислотой и каким основанием по силе образована соль.
2.
Записать
уравнение диссоциации соли,затем уравнение диссоциации молекулы воды.
3.
Выписать
формулу иона слабого электролита и написать уравнение взаимодействия его с
одной молекулой воды; в результате получится краткое ионно-молекулярное
уравнение гидролиза
4.
Записать
уравнение реакции гидролиза в молекулярном виде. Указать характер среды и цвет
индикатора лакмуса
Рассмотрим
,как пользуясь алгоритмом составления уравнения гидролиза, выполнить задание.
Пример
№1
Составить
уравнение реакции гидролиза соли, образованной сильным основанием и слабой
кислотой-сульфида натрия(Na2S)
1.Соль образована
гидроксидом натрия-сильным основанием и слабой кислотой-сероводородной.
2.Определить тип
гидролиза, среду и цвет индикатора.
Гидролиз по аниону Среда
щелочная ,лакмус синий.
3.Записать уравнение
диссоциации соли и воды
Na2 S⇄ →
2Na+ + S2-
H2O⇄ H++
OH—
4.Записать ионное
уравнение гидролиза
2Na+
+ S2-
+ H2O⇄
HS—
+2Na+
+ OH—
5.Составить молекулярное
уравнение
Na2
S+
H2O⇄
NaHS
+ Na OH
Пример №2
Составить уравнение
реакции гидролиза хлорида меди (2).
1.Рассмотрим состав
соли: соль образована слабым основанием гидроксидом меди(2) и сильной кислотой
–соляной.
2.Определить тип
гидролиза, среду и цвет индикатора.
Гидролиз по
катиону, среда кислая, лакмус красный.
3.Записать уравнение
диссоциации соли и воды
CuCl2 ⇄Cu2+
+2Cl— H2O⇄ H++
OH—
4.Записать ионное
уравнение гидролиза
Cu2+
+2Cl—
+ H2O⇄
Cu OH+
+2Cl—
+ H+
5.Составить молекулярное
уравнение
CuCl2
+ H2O⇄
Cu OHCl
+ HCl
В тестовых заданиях или в заданиях на соответствие, составленных по типу
заданий ЕГЭ встречаются обозначения среды посредством использования значений
водородного показателя. Необходимо помнить:
PH
> 7- среда щелочная, концентрация ионов гидроксогруппы больше концентрации
ионов водорода ; PH < 7- среда
кислая, концентрация ионов водорода больше концентрации гидроксид-ионов; PH
= 7- среда нейтральная; концентрация ионов водорода равна концентрации
гидроксид-ионов.
Количественно гидролиз характеризуется степенью гидролиза. Она
показывает сколько молекул вещества от общего числа молекул подвергается
гидролизу. Степень гидролиза зависит от температуры, природы вещества,
концентрации раствора. Если повысить температуру-это усилит гидролиз, так
как это эндотермическая реакция .При разбавлении водой гидролиз усиливается.
Если гидролиз по аниону-повышение концентрации гидроксид-ионов будет ослаблять
гидролиз.
Если гидролиз по катиону-повышение концентрации ионов водорода ослабит гидролиз.
Предположим
соль- хлорид меди (2).Она гидролизуется по катиону, так как образована слабым
основанием –гидроксидом меди(2) и сильной кислотой-соляной. Чтобы усилить
гидролиз этой соли ,нужно нагреть раствор; добавить воды; добавить
щелочь-раствор(делаем выбор).
Пример № 3
Определить формулу
соли, если значение PH=7 : хлорид магния,
сульфат натрия; бромид алюминия.
1.MgCl2
–соль образована слабым основанием и сильной кислотой;
гидролиз по катиону, среда кислая PH<7;
2.Na2
SO4—
соль образована сильным основанием и сильной кислотой; среда нейтральная PH=7.
3.AlBr3—
соль образована сильной кислотой и слабым основанием; гидролиз по катиону;PH<7
Задания
для самостоятельной работы :
1.Задания для закрепления знаний, умений
определять характер среды и цвет индикатора
|
Формула |
Характер |
Цвет |
|
1.хлорид |
||
|
2.сульфит |
||
|
3.силикат |
||
|
4.фосфат |
||
|
5. |
2.
|
Название |
Характер |
Тип |
|
1. сульфат |
||
|
2. фосфат |
||
|
3.хлорид |
||
|
4.карбонат |
||
|
5. нитрат |
3.
|
Формула |
Характер |
Значение PH |
|
1.Cu(NO3)2 |
||
|
2 Na2S |
||
|
3 K3PO4 |
||
|
4 K2SO3 |
||
|
5 Na2SO4 |
4.
|
Соль |
Сила |
Сила |
|
1.Cu(NO3)2 |
||
|
2 Na2S |
||
|
3 K3PO4 |
||
|
4 K2SO3 |
||
|
5 Na2SO4 |
Задания для самостоятельной домашней
работы по теме: «Гидролиз солей»
1.
Составьте
уравнения реакций гидролиза солей в молекулярном и ионном виде:
а) нитрат
меди(2); б)сульфат меди; в) карбонат калия; г)фосфат натрия;
д) сульфат
натрия; е) нитрат магния; ж) ацетат натрия; з) хлорид меди
(2);
и) нитрит
натрия; к) сульфид калия.
Определить характер
среды и цвет лакмуса.
Тест по теме: «Гидролиз солей»
Вариант
1.
1.Гидролиз-это…….
а)
окислительно-восстановительная реакция. идущая на электродах под действием
электрического тока;
б) реакция между
ионами соли и ионами воды, приводящая к образованию слабого электролита;
в) реакция, при
которой из одного сложного вещества образуется несколько простых;
г)реакция при
которой атомы простого вещества замещают атомы сложного.
2. Выберите формулу сильного электролита:
уксусная кислота ; гидроксид натрия; ацетат натрия; кремниевая кислота;
угольная кислота; сероводородная кислота; гидроксид магния.
3.Соль образована сильной кислотой и
сильным основанием. Определите характер среды: кислая, щелочная; нейтральная.
4. Дана соль-
сульфид аммония. Определите тип гидролиза:
а) гидролиз по
аниону; б) гидролиз по катиону;
в) гидролиз по
катиону и аниону; г) гидролизу не подвергается.
5. Гидролиз соли по
катиону .Каким основанием и какой кислотой по силе образована эта соль:
а)сильной кислотой
и сильным основанием; б)слабой кислотой и слабым основанием;
в)слабой кислотой и
сильным основанием; г)сильным основанием и слабой кислотой;
6.Сильный
электролит-это..
а)вещество, которое
при растворении в воде или расплавлении полностью диссоциирует на ионы
б) вещество,
которое при растворении в воде или расплавлении неполностью диссоциирует на
ионы
в)вещество, которое
не диссоциирует на ионы.
7.Водородный показатель
равен 7. Какова окраска лакмуса?
а)синяя
б)красная,
в)фиолетовая
Вариант
2.
1. Дана соль-
хлорид железа(2). Определите тип гидролиза:
а)гидролиз по
аниону; б)гидролиз по катиону;
в)гидролиз по
катиону и аниону; г)гидролизу не подвергается.
2. Выберите формулу слабого электролита:
гидроксид натрия; гидроксид бария; уксусная кислота; соляная кислота, азотная
кислота.
3. Соль образована слабой кислотой и
сильным основанием. Определите характер среды: кислая, щелочная; нейтральная.
4. Дана соль-
карбонат аммония. Определите тип гидролиза:
а)гидролиз по
аниону; б)гидролиз по катиону;
в)гидролиз по
катиону и аниону; г)гидролизу не подвергается.
5. Гидролиз соли по
катиону. Каким основанием и какой кислотой по силе образована эта соль:
а)сильной кислотой
и сильным основанием; б)слабой кислотой и слабым основанием;
в)слабой кислотой и
сильным основанием; г)сильным основанием и слабой кислотой;
6.Слабый электролит-это..
а)вещество, которое
при растворении в воде или расплавлении полностью диссоциирует на ионы
б) вещество,
которое при растворении в воде или расплавлении неполностью диссоциирует на
ионы
в)вещество, которое не диссоциирует на
ионы
7.Водородный
показатель меньше 7. Какова окраска лакмуса?
а)синяя
б)красная, в)фиолетовая
Задания на соответствие:
1.Соедините формулы из левого столбика с
окраской индикатора лакмуса в правом столбике:
K2CO3
красный
ZnCl2
фиолетовый
KCl
синий
2.Соедините формулы из левого столбика со
значением водородного показателя в правом столбике:
Na2S
PH=7
Al(NO3)3 PH>7
CuSO4 PH<7
NaBr
3.Фенолфталеин можно использовать для обнаружения
в водном растворе соли:
Нитрат
калия фенолфталеин
Сульфат алюминия
Силикат калия
4.Установите соответствие:
Нитрат
магния щелочная
Карбонат калия нейтральная
Бромид
меди(2) кислая
Сульфит калия
5.В водных растворах не подвергается
гидролизу: сульфат натрия. сульфид натрия, хлорид цинка, карбонат калия.
6.В водных растворах происходит гидролиз
по аниону:
Карбонат натрия ,нитрат магния, хлорид
натрия.
7. В водных растворах происходит гидролиз
по катиону:
Сульфит калия, хлорид цинка, бромид калия.
8. Укажите ионное уравнение реакции
хлорида меди(2):
а) СO32-
+H2
O→HCO3
+OH—
б) Cu2+ +H2O
→CuOH+
+H+
в)NH4+ +
H2O → NH3* H2O + H+
Самостоятельная работа
Вариант 1
1.Определите среду раствора солей. формулы
приведены ниже: KCl, NaF,
ZnSO4,
CrCl3,
MgSO4,
LiNO3.
2.Составьте уравнения реакций гидролиза
солей: нитрита натрия, сульфида натрия, карбоната лития, нитрата
железа(3).Определите среду и цвет индикатора.
Вариант 2
1.Определите среду раствора солей. формулы
приведены ниже: AlCl3,
Na2SO3,
Zn(NO3)2,
NaCl,
Na2
SiO3,
K2S.
2. Составьте уравнения реакций гидролиза
солей: нитрата меди(2),силиката калия, сульфата алюминия, хлорида цинка.
Вариант 3
1.Определите среду раствора солей. формулы
приведены ниже:K2S,
CuSO4,
Ba(NO3
)2 , ZnCl2,
Na3
PO4.
2. Составьте уравнения реакций гидролиза
солей: фосфата натрия ,хлорида магния, карбоната аммония, нитрита натрия.
Вариант 4
1.Определите среду раствора солей. формулы
приведены ниже: Al(NO3)3,
K2SO3,
NaCl,
K3PO4,
Na 2CO3
2.Составьте уравнения реакций гидролиза
солей: сульфида аммония, силиката натрия, бромида алюминия, нитрата меди(2).
Литература:
1.Учебник «Химия
для профессий и специальностей технического профиля «О.С.Габриэлян ;И.Г.
Остроумов-М. Академия; 2012
2.Настольная книга
учителя химии 11 класс часть 1 О.С. Габриелян, Г.Г. Лясова,А.Г.
Введенская.-М.: Дрофа,2003.-320с.