| Водород | |
|---|---|
| Газ без цвета, запаха и вкуса | |

Водород в разрядной трубке |
|
| Название, символ, номер | Водород / Hydrogenium (H), 1 |
| Атомная масса (молярная масса) |
[1,00784; 1,00811]а. е. м. (г/моль) |
| Электронная конфигурация | 1s1 |
| Радиус атома | 53 пм |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
| Электроотрицательность | 2,20 (шкала Полинга) |
| Степени окисления | +1, 0, −1 |
| Энергия ионизации (первый электрон) |
1311,3 (13,595) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ |
| Температура плавления | 14,01 K; −259,14 °C |
| Температура кипения | 20,28 K; −252,87 °C |
| Уд. теплота плавления | 0,117 кДж/моль |
| Уд. теплота испарения | 0,904 кДж/моль |
| Молярная теплоёмкость | 28,47 Дж/(K·моль) |
| Молярный объём | 14,1 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a = 3,780 c = 6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Номер CAS | 12385-13-6 |
Водород (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Содержание
- 1 История открытия
- 2 Происхождение названия
- 3 Распространённость
- 3.1 Во Вселенной
- 3.2 Земная кора и живые организмы
- 4 Получение
- 4.1 В промышленности
- 4.2 В лаборатории
- 4.3 Очистка
- 4.4 Стоимость
- 5 Физические свойства
- 6 Изотопы
- 6.1 Свойства изотопов
- 7 Химические свойства
- 7.1 Взаимодействие со щелочными и щёлочноземельными металлами
- 7.2 Взаимодействие с оксидами металлов
- 7.3 Гидрирование органических соединений
- 8 Геохимия водорода
- 9 Меры предосторожности
- 10 Применение
- 10.1 Химическая промышленность
- 10.2 Нефтеперерабатывающая промышленность
- 10.3 Пищевая и косметическая промышленность
- 10.4 Химические лаборатории
- 10.5 Авиационная промышленность
- 10.6 Метеорология
- 10.7 Топливо
- 10.8 Электроэнергетика
- 10.9 Прочее
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород.
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода.
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Распространённость
Во Вселенной
Распространение ионизированного водорода в межзвёздной среде в различных частях нашей Галактики. Изображение в диапазоне H-альфа.
В настоящее время водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.
Получение
Основная статья: Производство водорода
См. также: Биотехнологическое получение водорода
В промышленности
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа. Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO2. Себестоимость водорода из природного газа оценивается в 1,5-3 доллара за 1 кг.
- Конверсия метана с водяным паром при 1000 °C:
-
- CH4 + H2O ⇄ CO + 3H2
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
-
- H2O + C ⇄ CO↑ + H2↑
- Электролиз водных растворов солей:
-
- 2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
- Электролиз водных растворов гидроксидов активных металлов (преимущественно, гидроксида калия)
-
- 2H2O →4e− 2H2↑ + O2↑
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной.
- Каталитическое окисление кислородом:
-
- 2CH4 + O2 ⇄ 2CO + 4H2
- Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
- Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
-
- Zn + H2SO4 → ZnSO4 + H2↑
- Взаимодействие кальция с водой:
-
- Ca + 2H2O → Ca(OH)2 + H2↑
- Гидролиз гидридов:
-
- NaH + H2O → NaOH + H2↑
- Действие щелочей на цинк или алюминий:
-
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
-
- Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
- С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
-
- 2H3O+ + 2e− → 2H2O + H2↑
Очистка
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ).
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 H2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Стоимость
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Физические свойства
Эмиссионный спектр излучения атомов водорода на фоне сплошного спектра в видимой области
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — H2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9⋅106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-H2, 0,21 % орто-H2.
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением.
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация параводорода в смеси в зависимости от температуры
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы
Основная статья: Изотопы водорода
Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Наиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2H (ядро состоит из одного протона и одного нейтрона) и тритий 3H (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3. Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
-
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице.
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1⋅10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Доля диссоциировавших молекул водорода при атмосферном давлении в зависимости от температуры
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
-
- H2 → 2H− 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
-
- Ca + H2 → CaH2
и с единственным неметаллом — фтором, образуя фтороводород:
-
- F2 + H2 → 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
-
- O2 + 2H2 → 2H2O
Записанное уравнение отражает восстановительные свойства водорода.
-
- CuO + H2 → H2O + Cu
С галогенами образует галогеноводороды:
-
- H2 + F2 → 2HF , реакция протекает со взрывом в темноте и при любой температуре,
-
- H2 + Cl2 → 2HCl , реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
-
- C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
-
- 2Na + H2 → 2NaH
-
- Ca + H2 → CaH2
-
- Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
-
- CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
-
- Fe2O3 + 3H2 → 2Fe + 3H2O
-
- WO3 + 3H2 → W + 3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
R−CH = CH−R′ + H2 → R−CH2−CH2−R′
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё. Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3−22 гигатонн/год).
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду.
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Применение
Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Около 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Нефтеперерабатывающая промышленность
В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов. Для этих целей используется порядка 37 % всего производимого в мире водорода.
Пищевая и косметическая промышленность
При производстве саломаса (твёрдый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Химические лаборатории
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удалённых мест.
Топливо
Водород используют в качестве ракетного топлива. Ввиду крайне узкого диапазона температур (менее 7 кельвинов), при котором водород остаётся жидкостью, на практике чаще используется смесь жидкой и твёрдой фаз .
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Электроэнергетика
Водород применяется для охлаждения мощных электрических генераторов.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Водород / Hydrogenium (H), 1 |
||
| Атомная масса (молярная масса) |
1,00794 а. е. м. (г/моль) |
||
| Электронная конфигурация |
1s1 |
||
| Радиус атома |
53 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
32 пм |
||
| Радиус иона |
54 (−1 e) пм |
||
| Электроотрицательность |
2,20[1] (шкала Полинга) |
||
| Степени окисления |
1,0, −1 |
||
| Энергия ионизации (первый электрон) |
1311,3 (13,595) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
0,0000899 (при 273 K (0 °C)) г/см³ |
||
| Температура плавления |
14,01 K |
||
| Температура кипения |
20,28 K |
||
| Теплота плавления |
0,117 кДж/моль |
||
| Теплота испарения |
0,904 кДж/моль |
||
| Молярная теплоёмкость |
14,235[2] Дж/(K·моль) |
||
| Молярный объём |
14,1 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
гексагональная |
||
| Параметры решётки |
a=3,780 c=6,167 Å |
||
| Отношение c/a |
1,631 |
||
| Температура Дебая |
110 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) 0,1815 Вт/(м·К) |
Водоро́д — первый элемент периодической системы элементов; обозначается символом H. Название представляет собой кальку с латинского: лат. Hydrogenium (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «порождающий воду». Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен[2]. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Распространённость
- 3.1 Во Вселенной
- 3.2 Земная кора и живые организмы
- 4 Получение
- 4.1 В промышленности
- 4.2 В лаборатории
- 5 Физические свойства
- 6 Изотопы
- 7 Свойства изотопов
- 8 Химические свойства
- 8.1 Взаимодействие со щелочными и щёлочноземельными металлами
- 8.2 Взаимодействие с оксидами металлов (как правило, d-элементов)
- 8.3 Гидрирование органических соединений
- 9 Геохимия водорода
- 10 Меры предосторожности
- 11 Экономика
- 12 Применение
- 12.1 Химическая промышленность
- 12.2 Пищевая промышленность
- 12.3 Авиационная промышленность
- 12.4 Топливо
- 13 Интересные факты
- 14 См. также
- 15 Примечания
- 16 Литература
- 17 Ссылки
История
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова .
Распространённость
Во Вселенной
Водород — самый распространённый элемент во Вселенной[3]. На его долю приходится около 92 % всех атомов (около 8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
В промышленности
- Электролиз водных растворов солей:
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- Конверсия с водяным паром при 1000 °C:
- Каталитическое окисление кислородом:
- Крекинг и риформинг углеводородов в процессе переработки нефти.
- Из природного газа.
В лаборатории
- Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
- Взаимодействие кальция с водой:
- Гидролиз гидридов:
- Действие щелочей на цинк или алюминий:
- С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
Физические свойства
Спектр излучения водорода
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Изотопы
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %[4]. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет[4]. Тритий содержится в природе в очень малых количествах.
В литературе[4] также приводятся данные об изотопах водорода с массовыми числами 4—7 и периодами полураспада 10−22—10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[5].
| Температура плавления, K |
Температура кипения, K |
Тройная точка, K / kPa |
Критическая точка, K / kPa |
Плотность жидкий / газ, кг/м³ |
|
|---|---|---|---|---|---|
| H2 | 13,96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 16,65 | 22,13 | 16,6 / 12,8 | 35,91 / 1,48 | 114,0 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,23 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и парамодификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице[4][6].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)·10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1·10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)·10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)·10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
Он может «отнимать» кислород от некоторых оксидов, например:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
-
, реакция протекает со взрывом в темноте и при любой температуре,
-
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением[7]. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объему. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако, следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг[8]. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
- При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
- При производстве маргарина из жидких растительных масел.
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ, класс «Прочие»). Входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции.[источник не указан 658 дней]
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающую среду и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Интересные факты
- Хорватское название водорода — Vodik, ввёл в употребление филолог Богослав Шулек.
См. также
- Атом водорода
- Жидкий водород
- Соединения водорода
- Антиводород
- Водородная энергетика
- Молекула водорода
- Молекулярный ион водорода
Примечания
- ↑ Hydrogen: electronegativities (англ.). Webelements. Проверено 15 июля 2010.
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 400—402. — 623 с. — 100 000 экз.
- ↑ Книга рекордов Гиннесса для химических веществ
- ↑ 1 2 3 4 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0
- ↑ G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ Правилов А. М. Фотопроцессы в молекулярных газах. М.: Энергоатомиздат, 1992.
- ↑ Аркадий Шварц Снова о водороде Вестник online № 19(356) 15 сентября 2004
Литература
- Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов /Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. — М.: Издательство «Экзамен»,2005.
- Учебный справочник школьника. Учебное издание. — М.: Дрофа, 2001.
- Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006 ISBN 5-02-025114-3
Ссылки
| Портал «Химия» | |
| Водород в Викисловаре? | |
| Водород на Викискладе? |
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| Водород | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Нейтроний | Гелий → | ||||||||||||||||||||
|
||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||

Свечение водорода в газоразрядной трубке |
||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||
| Название, символ, номер | Водоро́д / Hydrogenium (H), 1 | |||||||||||||||||||
| Группа, период, блок |
1, 1, s-элемент |
|||||||||||||||||||
| Атомная масса (молярная масса) |
[1,00784; 1,00811][комм 1][1] а. е. м. (г/моль) | |||||||||||||||||||
| Электронная конфигурация | 1s1 | |||||||||||||||||||
| Радиус атома | 53 пм | |||||||||||||||||||
| Химические свойства | ||||||||||||||||||||
| Ковалентный радиус | 32 пм | |||||||||||||||||||
| Радиус иона | 54 (−1 e) пм | |||||||||||||||||||
| Электроотрицательность | 2,20[2] (шкала Полинга) | |||||||||||||||||||
| Степени окисления | -1, 0, +1 | |||||||||||||||||||
| Энергия ионизации (первый электрон) |
1311,3 (13,595) кДж/моль (эВ) | |||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ | |||||||||||||||||||
| Температура плавления | 14,01 K; −259,14 °C | |||||||||||||||||||
| Температура кипения | 20,28 K; −252,87 °C | |||||||||||||||||||
| Тройная точка | 13,96 К (−259,19°C), 7.205[4] кПа | |||||||||||||||||||
| Критическая точка | 32,24 К, 1,30[5] МПа | |||||||||||||||||||
| Уд. теплота плавления | 0,117 кДж/моль | |||||||||||||||||||
| Уд. теплота испарения | 0,904 кДж/моль | |||||||||||||||||||
| Молярная теплоёмкость | 28,47[3] Дж/(K·моль) | |||||||||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | |||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||
| Структура решётки | гексагональная | |||||||||||||||||||
| Параметры решётки | a = 3,780 c = 6,167 Å | |||||||||||||||||||
| Отношение c/a | 1,631 | |||||||||||||||||||
| Температура Дебая | 110 K | |||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) | |||||||||||||||||||
| Номер CAS | 12385-13-6 | |||||||||||||||||||
| Эмиссионный спектр | ||||||||||||||||||||
|
|
||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||
|
Основная статья: Изотопы водорода
|
Водоро́д (химический символ — H, от лат. hydrogenium) — химический элемент первого периода периодической таблицы химических элементов Д. И. Менделеева, с атомным номером 1.
Одноатомная форма водорода — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы. Самый лёгкий из элементов периодической таблицы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен).
Ядро самого распространённого изотопа — протия — состоит из одного только протона и не содержит нейтронов.
При стандартной температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ (химическая формула — H2), который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен[3]. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород[7][8].
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой, «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода[9][10].
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал[11]:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Распространённость
Во Вселенной

В настоящее время водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %)[12]. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха[13][14]).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %[15].
Получение
В промышленности
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа[16]. Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO2. Себестоимость водорода, полученного из природного газа, оценивается в 1,5-3 доллара за 1 кг.
- Конверсия метана с водяным паром при 1000 °C:
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- Электролиз водных растворов солей:
- Электролиз водных растворов гидроксидов активных металлов (преимущественно гидроксида калия)[17] (англ.)
-
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной[17] (англ.) или без мембраны http://kyivtoulouse.univ.kiev.ua/journal/index.php/fruajc/article/view/201 Архивная копия от 5 февраля 2020 на Wayback Machine.
- Каталитическое окисление метана кислородом:
- Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
- Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
- Взаимодействие кальция с водой:
- Гидролиз гидридов:
- Действие щелочей на цинк или алюминий:
- С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
Очистка
В промышленности реализованы несколько способов очистки водорода из водородосодержащего сырья (т. н. водородсодержащий газ — ВСГ)[18]. Водородсодержащий газ (Hydrogen containing gas) — это газ с высоким содержанием водорода (10 % и выше). Переход на сжигание водородсодержащих газов (ВСГ, HCG) — один из способов снижения выбросов углекислого газа в атмосферу.
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80—85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 Н2/сут. Образуется водород высокой чистоты — 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты — 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95—96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Стоимость
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг[19]. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Физические свойства
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[20]. Шары, наполненные водородом, также стремятся вверх. Водород использовался для воздухоплавания, но из-за взрывоопасности от водорода отказались в пользу гелия. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа, за счёт чего быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9⋅106 Дж/кг, малорастворим в воде — 18,8 мл/л при н.у. Растворимость водорода в воде возрастает с увеличением давления и снижается с увеличением температуры.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода: температура −240,2 °C, давление 12,8 атм, критическая плотность 0,0312 г/см³ и критический объём 66,95—68,9 см³/моль (0,033 м³/кг). Указанными значениями критических параметров объясняются трудности при ожижении водорода.
В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2[⇨].
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
Металлический водород
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[21]. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением[22][23].
Спиновые изомеры
Спиновые изомеры молекулярного водорода
Равновесная мольная концентрация параводорода в смеси в зависимости от температуры
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород.
Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположны друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить спиновые изомеры водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25[24]. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы
Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Наиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2Н (ядро состоит из одного протона и одного нейтрона) и тритий 3Н (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно[25]. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3[25]. Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с[25].
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[26].
-
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице[25][27].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1⋅10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Доля диссоциировавших молекул водорода при атмосферном давлении в зависимости от температуры
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому окислительная способность водорода проявляется в реакциях с активными металлами, как правило, при повышенных температуре и давлении. При обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
-
, реакция протекает со взрывом в темноте и при любой температуре,
-
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё.[источник не указан 3550 дней] Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.[источник не указан 3550 дней]
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях[28][29].
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3—22 гигатонн/год)[30][31][32].
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду[33][34].
Меры предосторожности

Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации.[источник не указан 1045 дней] Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Применение
Водород сегодня применяется во многих областях.
Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка (гидрогенизация ненасыщенных углеводородов и гидросульфирование) и синтез метанола | 35 % |
| Производство полупроводников | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Более 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола[36]. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Топливно-энергетический комплекс
В нефтепереработке около 37 % мирового выпуска водорода используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов[36].
Водород используют и в качестве ракетного топлива. Ввиду крайне узкого диапазона температур (менее 7 кельвинов), при котором водород остаётся жидкостью, на практике чаще используется смесь жидкой и твёрдой фаз.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Транспорт
Водород используется в качестве топлива для серийно выпускаемых автомобилей на Водородных топливных элементах: Toyota Mirai, Hyundai Nexo. Американская компания[37] представила линейку коммерческих автомобилей на водороде, а также пикап Nikola Badger с запасом хода 960 км[38]
Компания Alstom в 2018 году запустила в Германии первый коммерческий поезд на топливных элементах Coradia iLint, способный проходить 1000 км на одном резервуаре с водородом. Поезда совершают 100-километровые рейсы со скоростью до 140 километров в час[39].
Электроэнергетика
В электроэнергетике водород применяется для охлаждения мощных электрических генераторов[40].
Пищевая и косметическая промышленность
При производстве саломаса (твёрдый жир, производимый из растительных масел) используется около 2 % мирового выпуска водорода. Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки под номером E949.
Лабораторное
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости[41].
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удалённых мест[42].
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.
См. также
Антиводород
Примечания
- Комментарии
- ↑ Указан диапазон значений атомной массы в связи с различной распространённостью изотопов в природе.
- Источники
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Hydrogen: electronegativities (англ.). Webelements. Дата обращения: 15 июля 2010. Архивировано 27 июня 2010 года.
- ↑ 1 2 Водород // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 400—402. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Фёдоров П. И., Тройная точка, 1998, с. 12.
- ↑ Хазанова Н. Е., Критическое состояние, 1990, с. 543.
- ↑ Standard atomic weights of the elements 2021 (IUPAC Technical Report) (англ.) — IUPAC, 1960. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1515/PAC-2019-0603
- ↑ Boyle, R. (1672). «Tracts written by the Honourable Robert Boyle containing new experiments, touching the relation betwixt flame and air…» London.
- ↑ Winter, M. Hydrogen: historical information. WebElements Ltd (2007). Дата обращения: 5 февраля 2008. Архивировано 10 апреля 2008 года.
- ↑ Musgrave, A. Why did oxygen supplant phlogiston? Research programmes in the Chemical Revolution // Method and appraisal in the physical sciences (англ.) / Howson, C.. — Cambridge University Press, 1976. — (The Critical Background to Modern Science, 1800–1905).
- ↑ Cavendish, Henry. Three Papers, Containing Experiments on Factitious Air, by the Hon. Henry Cavendish, F. R. S (англ.) // Philosophical Transactions : journal. — 1766. — 12 May (vol. 56). — P. 141—184. — doi:10.1098/rstl.1766.0019. — Bibcode: 1766RSPT…56..141C. — JSTOR 105491.
- ↑ Севергин В. М. Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел. СПб.: Издание Имп. АН, 1801. C. 2.
- ↑ Н. Гринвуд, А. Эрншо. Химия элементов: в 2 томах. — БИНОМ. Лаборатория знаний, 2008. — Т. 1. — С. 11. — 607 с. — (Лучший зарубежный учебник). — ISBN 978-5-94774-373-9.
- ↑ Gribbin, John. Science. A History (1543-2001). — L.: Penguin Books, 2003. — 648 с. — ISBN 978-0-140-29741-6.
- ↑ Source for figures: Carbon dioxide, NOAA Earth System Research Laboratory Архивная копия от 25 декабря 2018 на Wayback Machine, (updated 2010.06). Methane, IPCC TAR table 6.1 Архивная копия от 15 июня 2007 на Wayback Machine, (updated to 1998). The NASA total was 17 ppmv over 100 %, and CO2 was increased here by 15 ppmv. To normalize, N2 should be reduced by about 25 ppmv and O2 by about 7 ppmv.
- ↑ Хорнак Д. П. Основы МРТ. Дата обращения: 23 августа 2013. Архивировано 9 февраля 2014 года.
- ↑ «Перепись ВОДОРОДА» Журнал «Газпром», сентябрь 2019, стр 42-43. Дата обращения: 22 октября 2019. Архивировано 22 октября 2019 года.
- ↑ 1 2 Da Rosa, Aldo Vieira. Fundamentals of renewable energy processes. — Amsterdam: Elsevier Academic Press, 2005. — С. 370. — xvii, 689 pages с. — ISBN 0120885107.
- ↑ А.К.Мановян. Технология переработки природных энергоносителей. — Москва: Химия, КолосС, 2004. — 456 с. — ISBN 5-98109-004-9, 5-9532-0219-97.
- ↑ Аркадий Шварц. Снова о водороде Архивная копия от 30 сентября 2010 на Wayback Machine. Вестник online № 19(356) 15 сентября 2004.
- ↑ Мыльные пузыри с водородом Архивная копия от 26 июля 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов.
- ↑ Неограническая химия. Том 2. Химия непереходных элементов / под ред. акад. Ю. Д. Третьякова. — Москва: Академия, 2004. — 368 с. — ISBN 5-7695-1436-1.
- ↑ Dias Ranga P., Silvera Isaac F. Observation of the Wigner-Huntington transition to metallic hydrogen // Science. — 2017. — 26 января (т. 355, № 6326). — С. 715—718. — ISSN 0036-8075. — doi:10.1126/science.aal1579. [исправить]
- ↑ Алексей Понятов. Десять крупнейших событий 2017 года в физике и астрономии. Стабильный металлический водород // Наука и жизнь. — 2018. — № 1. — С. 9. Архивировано 12 января 2018 года.
- ↑ Фаркаш Л. Орто- и параводород. [[Успехи физических наук]], т. 15, вып. 3. 1935 г. Дата обращения: 22 сентября 2018. Архивировано 22 сентября 2018 года.
- ↑ 1 2 3 4 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ Züttel A., Borgschulte A., Schlapbach L. Hydrogen as a Future Energy Carrier. — Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0.
- ↑ Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — doi:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ Портнов Александр. Вулканы — месторождения водорода. Архивная копия от 6 июня 2013 на Wayback Machine / Промышленные ведомости, № 10—12, октябрь—декабрь 2010.
- ↑ Гресов А. И., Обжиров А. И., Яцук А. В. К вопросу водородоносности угольных бассейнов Дальнего востока/ Вестник КРАУНЦ. Науки о Земле. 2010, № 1, Выпуск 15. С. 19—32.
- ↑ http://www.atmos-chem-phys.net/11/3375/2011/acp-11-3375-2011.pdf Архивная копия от 21 мая 2013 на Wayback Machine A new estimation of the recent tropospheric molecular hydrogen budget using atmospheric observations and variational inversion] doi:10.5194/acp-11-3375-2011, 2011 «The main sources of H2 are photochemical production by the transformation of formaldehyde (HCHO) in the atmosphere and incomplete combustion processes. Photolysis of HCHO, a product in the oxidation chain of methane and other volatile organic compounds (VOCs) accounts for 31 to 77 Tg yr−1 and represents half of the total H2 source. Fossil fuel and biomass burning emissions, two incomplete combustion sources, account for similar shares of the global H2 budget (5−25 Tg yr−1). H2 emissions (3−22 Tg yr−1) originating from nitrogen fixation in the continental and marine biosphere complete the sources. H2 oxidation by free hydroxyl radicals (OH) and enzymatic H2 destruction in soils must balance these sources because tropospheric H2 does not show a significant long term trend (Grant et al., 2010)»
- ↑ Chemistry of the Natural Atmosphere Архивная копия от 10 декабря 2017 на Wayback Machine pages 207—201, table 4.14
- ↑ Global environmental impacts of the hydrogen economy Архивная копия от 5 декабря 2014 на Wayback Machine page 61 table 1
- ↑ David C. Catling and Kevin J. Zahnle, The Planetary Air Leak. As Earth’s atmosphere slowly trickles away into space, will our planet come to look like Venus? Архивная копия от 2 февраля 2014 на Wayback Machine //SCIENTIFIC AMERICAN, May 2009
- ↑ Ferronsky V. I., Denisik S. A., Ferronsky S. V. Chapter 8. Global Dynamics of the Earth // Jacobi Dynamics: Many-Body Problem in Integral Characteristics. — (Astrophysics and Space Science Library. Vol. 130). — Springer Science & Business Media, 1986. — P. 296. — ISBN 9027724180, 9789027724182.
- ↑ Olu Ajayi-Oyakhire. Hydrogen – Untapped Energy? Institution of Gas Engineers and Managers. Institution of Gas Engineers and Managers (2012). Дата обращения: 24 марта 2018. Архивировано из оригинала 17 апреля 2018 года.
- ↑ 1 2 Р. В. Радченко, А. С. Мокрушин, В. В. Тюльпа. Водород в энергетике. — Екатеринбург: Издательство Уральского университета, 2014. — С. 24. — 229 с. — ISBN 978-5-7996-1316-7.
- ↑ Nikola Архивная копия от 13 февраля 2020 на Wayback Machine
- ↑ Nikola Badger. Дата обращения: 14 февраля 2020. Архивировано 13 февраля 2020 года.
- ↑ Первый водородный поезд в Германии. Дата обращения: 14 февраля 2020. Архивировано 24 января 2020 года.
- ↑ Принцип действия и конструкция синхронных машин. Дата обращения: 9 июня 2014. Архивировано 13 сентября 2014 года.
- ↑ Helium - what is the current cost to labs? www.peakscientific.com. Дата обращения: 17 ноября 2015. Архивировано 18 ноября 2015 года.
- ↑ А.А. Иванов (руководитель разработки). Наставление гидрометеорологическим постам и станциям. Выпуск 4. Росгидромет. Росгидромет (16 июля 2003). Дата обращения: 24 марта 2018. Архивировано 3 июня 2021 года.
Литература
- Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006. ISBN 5-02-025114-3.
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов. — М.: Издательство «Экзамен», 2005.
- Фёдоров П. И. Тройная точка // Химическая энциклопедия. — Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 12.
- Хазанова Н. Е. Критическое состояние // Химическая энциклопедия. — Советская энциклопедия, 1990. — Т. 2: Даф — Мед. — С. 541—543.
- Chart of the Nuclides. — 17th. — Knolls Atomic Power Laboratory, 2010. — ISBN 978-0-9843653-0-2.
- Newton, David E. The Chemical Elements. — New York: Franklin Watts (англ.) (рус., 1994. — ISBN 978-0-531-12501-4.
- Rigden, John S. Hydrogen: The Essential Element. — Cambridge, Massachusetts: Harvard University Press, 2002. — ISBN 978-0-531-12501-4.
- Romm, Joseph, J. The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate (англ.). — Island Press (англ.) (рус., 2004. — ISBN 978-1-55963-703-9.
- Scerri, Eric. The Periodic System, Its Story and Its Significance (англ.). — New York: Oxford University Press, 2007. — ISBN 978-0-19-530573-9.
Ссылки
- Hydrogen Архивная копия от 10 января 2016 на Wayback Machine at The Periodic Table of Videos (University of Nottingham)
- Ferreira-Aparicio, P.; Benito, M. J.; Sanz, J. L. New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers (англ.) // Catalysis Reviews : journal. — 2005. — Vol. 47, no. 4. — P. 491—588. — doi:10.1080/01614940500364958.
Эта страница в последний раз была отредактирована 9 февраля 2023 в 03:20.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
1. Положение водорода в периодической системе химических элементов
2. Электронное строение водорода
3. Физические свойства
4. Способы получения
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с активными металлами
5.1.2. Взаимодействие с серой
5.1.3. Взаимодействие с кремнием
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с оксидами металлов
5.2.2. Взаимодействие с органическими веществами
6. Применение водорода
Водородные соединения металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с водой
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с окислителями
Летучие водородные соединения
1. Строение молекулы и физические свойства
2. Способы получения силана
3. Способы получения аммиака
4. Способы получения фосфина
5. Способы получения сероводорода
6. Химические свойства силана
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии:
+1H 1s1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
Ca + H2 → CaH2
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
H2 + S → H2S
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
3Н2 + N2 → 2NH3
1.5. В специальных условиях водород реагирует с углеродом.
C + 2H2 → CH4
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2H2 + O2 → 2H2O
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например, водород взаимодействует с оксидом азота (I):
N2O + H2 = N2 + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например, при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Ca + H2 → CaH2
Химические свойства
1. Солеобразные гидриды легко разлагаются водой.
Например, гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например, гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например, гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором:
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
SiН4 + 2О2 = SiO2 + 2Н2О
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
3. Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
4. Силан при нагревании разлагается:
SiH4 → Si + 2H2
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Вода
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами.
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
Mg + 2H2O → Mg(OH)2 + H2
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
2Al + 6H2O = 2Al(OH)3 +3H2
- металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
Fe + 4Н2O → Fe3O4 + 4Н2
- металлы, расположенные в ряду активности от после Н, не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении):
Н2O + СаО = Са(OH)2
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
P2O5 + 3H2O = 2H3PO4
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком:
Например, сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой.
Например, фосфид кальция разлагается водой:
Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑
6. Бинарные соединения неметаллов также гидролизуются водой.
Например, фосфид хлора (V) разлагается водой:
PCl5 + 4H2O → H3PO4 + 5HCl
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
| Водород | |
|---|---|
| Атомный номер | 1 |
| Внешний вид простого вещества | газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
1,00794 а.е.м. (г/моль) |
| Радиус атома | 79 пм |
|
Энергия ионизации (первый электрон) |
1311,3 кДж/моль (эВ) |
| Электронная конфигурация | 1s1 |
| Химические свойства | |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
|
Электроотрицательность (по Полингу) |
2,20 |
| Электродный потенциал | |
| Степени окисления | 1, −1 |
| Термодинамические свойства простого вещества | |
|
Плотность вещества |
0,0000899 (при 273K (0 °C)) г/см³ |
| Молярная теплоёмкость | 14,235 Дж/(K·моль) |
| Теплопроводность | 0,1815 Вт/(м·K) |
| Температура плавления | 14,01K |
| Теплота плавления | 0,117 кДж/моль |
| Температура кипения | 20,28K |
| Теплота испарения | 0,904 кДж/моль |
| Молярный объём | 14,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,780 c=6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
Водород является первым элементом периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Трое из пяти изотопов водорода имеют собственные названия: 1H— протий (Н), 2H— дейтерий (D) и 3H— тритий (радиоактивен) (T).
Простое вещество водород— H2— лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История водорода
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и М. В. Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Г. Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия водород
Лавуазье дал водороду название hydrogène (отὕδωρ— «вода» и γενναω— «рождаю»)— «рождающий воду». Русское наименование «водород» предложил химик М.Ф.Соловьев в 1824 году— по аналогии с ломоносовским «кислородом».
Распространённость водорода
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1%— это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%.
Получение Водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода— реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 +2Н2O =CO2↑ +4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Получение водорода в промышленности
1.Электролиз водных растворов солей:
2NaCl +2H2O → H2↑ +2NaOH +Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O +C ⇄ H2↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:
CH4 +H2O ⇄ CO↑ +3H2↑ (1000°C)
Каталитическое окисление кислородом:
2CH4 +O2 ⇄ 2CO↑ +4H2↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие кальция с водой:|
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов:
NaH +H2O → NaOH +H2↑
4.Действие щелочей на цинк или алюминий:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ +2e— → H2↑ +2H2O
Дополнительная информация про Водород
Биореактор для производства водорода
Физические свойства Водорода
Спектр излучения водорода
Эмиссионный спектр водорода
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9·106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H— протий (Н), 2Н— дейтерий (D), 3Н— тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1и 2. Содержание их в природе соответственно составляет 99,9885±0,0070% и 0,0115 ± 0,0070%. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4— 7и периодами полураспада 10−22— 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
Температура плавления, K |
Температура кипения, K |
Тройная точка, K /kPa |
Критическая точка, K /kPa |
Плотность жидкий /газ, кг/м³ |
|
|---|---|---|---|---|---|
| H2 | 13.95 | 20,39 | 13,96 /7,3 | 32,98 /1,31 | 70,811 /1,316 |
| HD | 16,60 | 22,13 | 16,60 /12,8 | 35,91 /1,48 | 114,80 /1,802 |
| HT | 22,92 | 17,63 /17,7 | 37,13 /1,57 | 158,62 /2,310 | |
| D2 | 18,62 | 23,67 | 18,73 /17,1 | 38,35 /1,67 | 162,50 /2,230 |
| DT | 24.38 | 19,71 /19,4 | 39,42 /1,77 | 211,54 /2,694 | |
| T2 | 25,04 | 20,62 /21,6 | 40,44 /1,85 | 260,17 /3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 =2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca +Н2 =СаН2
и с единственным неметаллом— фтором, образуя фтороводород:
- F2 +H2 =2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 +2Н2 =2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
- CuO +Н2 =Cu +Н2O
Записанное уравнение отражает восстановительные свойства водорода.
- N2 +3H2 → 2NH3
С галогенами образует галогеноводороды:
- F2 +H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 +H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
- C +2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
- 2Na +H2 → 2NaH
- Ca +H2 → CaH2
- Mg +H2 → MgH2
Гидриды— солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 +2H2O → Ca(OH)2 +2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
- CuO +H2 → Cu +H2O
- Fe2O3 +3H2 → 2Fe +3H2O
- WO3 +3H2 → W+3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
 |
Водород при смеси с воздухом образует взрывоопасную смесь— так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21%. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение. Взрывоопасные концентрации водорода с кислородом возникают от 4% до 96% объёмных. При смеси с воздухом от 4% до 75(74)% объёмных. |
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
При производстве маргарина из жидких растительных масел.
Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XXв. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Водород, Hydrogenium, Н (1)
Как горючий (воспламеняемый) воздух водород известен довольно давно. Его получали действием кислот на металлы, наблюдали горение и взрывы гремучего газа Парацельс, Бойль, Лемери и другие ученые XVI— XVIII вв. С распространением теории флогистона некоторые химики пытались получить водород в качестве «свободного флогистона». В диссертации Ломоносова «О металлическом блеске» описано получение водорода действием «кислотных спиртов» (например, «соляного спирта», т. е. соляной кислоты) на железо и другие металлы; русский ученый первым (1745) выдвинул гипотезу, о том что водород («горючий пар»— vapor inflammabilis) представляет собой флогистон. Кавендиш, подробно исследовавший свойства водорода, выдвинул подобную же гипотезу в 1766 г. Он называл водород «воспламеняемым воздухом», полученным из «металлов» (Inflammable air from metals), и полагал, как и все флогистики, что при растворении в кислотах металл теряет свой флогистон. Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Номенклатурная комиссия 1787 г. приняла словопроизводство Hydrogene от геннао, рождаю. В «Таблице простых тел» Лавуазье водород (Hydrogene) упомянут в числе пяти (свет, теплота, кислород, азот, водород) «простых тел, относящихся ко всем трем царствам природы и которые следует рассматривать как элементы тел»; в качестве старых синонимов названия Hydrogene Лавуазье называет горючий газ (Gaz inflammable), основание горючего газа. В русской химической литературе конца XVIII и начала XIX в. встречаются два рода названий водорода: флогистические (горючий газ, горючий воздух, воспламенительный воздух, загораемый воздух) и антифлогистические (водотвор, водотворное существо, водотворный гас, водородный гас, водород). Обе группы слов представляют собой переводы французских названий водорода.
Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч.— другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч.— третий.
Содержание:
Водород как химический элемент:
В 1766 г. английский ученый Г. Кавендиш открыл «горючий воздух». В 1783 г. в Париже Ж. Шарлем был запущен шар, заполненный водородом (рис. 25), в 1787 г. А. Лавуазье объяснил, что открытый Г. Кавендишем «горючий воздух» входит в состав воды, и дал ему название «gidrogenium» (Hydrogenium), что означает «рождающий воду». В настоящее время водород обозначается первой буквой этого слова — Н.
- Химический знак — Н.
- Формула простого вещества —
- Валентность — 1.
- Относительная атомная масса — 1,0078.
- Относительная молекулярная масса
В свободном виде водород встречается на Земле в малом количестве.
Он выделяется вместе с другими газами при вулканическом извержении и добыче нефти. Но он широко распространен в виде соединений. Водород — это элемент, образующий наибольшее число соединений. Он составляет 0,88% общей массы земной коры и воздуха. Он составляет 1/9 часть массы молекулы воды, входит в состав всех растительных и животных организмов, нефти, природных газов, ряда минералов.
Определение водорода
Водород — самый распространенный во Вселенной элемент. Он составляет основную часть массы Солнца и других звезд. Водород входит в состав газообразных туманностей, межзвездного газа, звезд во Вселенной, где его атомы превращаются в атомы гелия. Этот процесс происходит с выделением энергии (термоядерная реакция), что служит для многих звезд, в том числе и Солнца, основным источником энергии.
Рис.23 Полет воздушного шара, заполненного водородом. Париж, 1783 г.
Эта энергия необходима для многих природных процессов. Солнечная энергия согревает Землю, приводит в движение воздушные массы атмосферы и воду рек, морей и океанов, обеспечивает процесс фотосинтеза у зеленых растений, наконец, является основным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минералов, метана и углеводородов нефти, различных гидроксидов, растительной и животной биомассы, органического вещества почвы.
Водород и кислоты
Среди соединений водорода, встречающихся в природе, особое место занимают кислоты (кислые воды).
Вспомните услаждающий вкус газированной воды и других прохладительных напитков или сок урюка и кислый вкус ревеня в жаркий летний день. Наверное, каждый знает кисловатый вкус лимона. В природе встречается очень много кислот.
В плодах цитрусовых (лимон, апельсин, мандарин) содержится лимонная кислота, в свежих фруктах (яблоки, айва, фанат) — яблочная кислота, в листьях щавеля и подорожника — щавелевая кислота, в брюшке у муравьев (а также в яде пчел) — муравьиная кислота, в газированной воде содержится угольная кислота.
Многие для приготовления пищи, а особенно печеного, используют уксусную кислоту, которая также применяется для приготовления консервов из овощей. Известно, что уксусную кислоту можно получить брожением винограда или яблок. Если вы будете наблюдать за прокисанием молока, то узнаете, что причиной этого является молочная кислота. В сельской местности готовят силос, в результате чего образуются молочная, масляная и другие кислоты. Для всех вышеназванных кислот характерен кислый вкус, и все они являются соединениями водорода.
Такие вещества, как лакмус, метилоранж, универсальный индикатор, по-разному окрашиваются в растворах кислот: лакмус краснеет, метилоранж становится розовым, универсальный индикатор приобретает красную окраску (рис. 26).
При взаимодействии металлов (магний, цинк, железо, медь) с растворами кислот (неорганических кислот, полученных синтетическим путем) реакция протекает по-разному, в частности, магний вытесняет водород из кислоты быстрее, цинк и железо — медленнее, а медь вообще не вытесняет.
Значит, кислоты — это вещества, которые обладают следующими общими свойствами:
- растворы кислот обладают кислым вкусом (в этом можно убедиться на примере природных кислот; пробовать на вкус синтетические кислоты опасно для жизни);
- растворы кислот изменяют окраску индикаторов;
- водные растворы почти всех кислот, взаимодействуя с целым рядом химически активных металлов, теряют водород.
Помимо натуральных есть еще синтетические кислоты, производимые химической промышленностью, которые также являются водородными соединениями. Всем известно, что при желудочно-кишечных расстройствах по указанию врача необходимо принимать слабый раствор соляной кислоты, или то, что серная кислота применяется в аккумуляторных батареях автомобилей.
Кислоты — это сложные вещества, которые обладают некоторыми общими свойствами.
Вещества, меняющие свою окраску в зависимости от специфических свойств соединений, называются индикаторами.
Рис. 26. Влияние растворов кислот на индикаторы
Получение водорода
Валентность водорода всегда постоянна и равна 1. Поэтому в соединениях, состоящих из двух элементов (бинарных соединениях), одним из которых является водород, число его атомов показывает валентность другого элемента:
Следовательно, благодаря тому что водород обладает постоянной валентностью, по нему легко определить валентность других элементов.
Рис. 27. Вытеснение водорода цинком из соляной кислоты
Получение водорода в лаборатории
В лаборатории водород получают в результате взаимодействия цинка или железа с соляной кислотой (рис. 27):
Для этого используют специальную установку или аппарат Киппа (рис. 28).
Аппарат Киппа в любое время готов к работе, которую можно прекратить также в любой момент.
Аппарат состоит из сосуда А и воронки Б и представляет собой соединенные между собой шарообразные и полушарообразные полые резервуары. При установлении воронки Б между ее концом и узкой частью соединения шара и полушара возникает щель. Через тубус В засыпаются кусочки металла такого размера, чтобы они не проходили через шель. В воронку наливается раствор кислоты, который заполняет полушар и достигает, проходя через щель, кусочки металла. Затем подача кислоты прекращается. Между металлом и кислотой протекает реакция, начинает выделяться газ, который выводится наружу посредством газоотводной трубки Г с пробкой, установленной на тубусе. По окончании опыта кран Г закрывается. В результате перекрывается путь для выхода газа. Газ, собираясь, оказывает давление на кислоту, кислота начинает подниматься по воронке, не соприкасаясь с кусочками металла, и в результате реакция прекращается. В шарообразной части сосуда можно хранить водород для его последующего использования.
В случае отсутствия аппарата Киппа из имеющейся в лаборатории посуды можно легко изготовить специальную установку. Принцип ее работы такой же, как и у аппарата Киппа.
Рис. 28. Составные части аппарата Киппа (а); заменяющая его специальная установка (б); работа аппарата Киппа (в)
Получение водорода в промышленности
В связи с тем, что водород широко применяется в народном хозяйстве, мы познакомимся с промышленными способами его получения. Водород как простое вещество встречается в природе в незначительном количестве. Чтобы получать его в промышленных масштабах, используют самые распространенные в природе соединения. К таким соединениям относятся вода и метан, являющийся основной составной частью природного газа. Из них водород получают следующим образом:
Водород его формула и молярная масса
Как простое вещество водород состоит из двух атомов 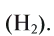
Физические свойства. Водород — это газ без цвета, вкуса и запаха, плохо растворяется в воде (в 1 л при нормальных условиях растворяется 21,5 мл), хорошо растворяется в некоторых металлах (никель, палладий, платина). Это самый легкий газ — в 14,5 раз легче воздуха. Температура кипения -252,6°С; при -259, ГС образуются прозрачные кристаллы.
Химические свойства водорода
При обычной температуре активность молекулярного водорода небольшая, но атомарный водород очень активен.
Водород образует летучие соединения почти со всеми неметаллами. В зависимости от активности неметалла реакция протекает быстро или медленно.
1. Со фтором он взаимодействует уже при комнатной температуре:
2. С хлором вступает в реакцию на свету, а при нагревании взрывается (в темноте и без нагревания соединяется медленно):
3. При обычных условиях с кислородом не взаимодействует. Смесь водорода и кислорода в объемном соотношении 2:1 называется «гремучим газом», который при внешнем воздействии взрывается. Водород горит в кислороде:
При этой реакции температура может достичь 3000°С.
Со многими неметаллами водород вступает в реакцию при высоких температуре и давлении, в присутствии катализаторов (например, с серой и азотом).
1. При высоких температурах водород восстанавливает (вытесняет) металлы из их оксидов:
2. Щелочные и щелочноземельные металлы образуют с водородом при высоких температурах солеподобные соединения — гидриды:
Атомарный водород при комнатной температуре вступает в реакцию с серой, мышьяком, фосфором, кислородом, восстанавливает металлы из оксидов.
Водород как экологически чистое топливо и его использование
Водород — это топливо будущего, которое при горении образует только воду и не загрязняет окружающую среду, поэтому имеет огромные перспективы в качестве экологически чистого топлива.
Термоядерные реакции превращения водорода в гелий, протекающие на Солнце, являются единственным неисчерпаемым источником энергии для многих природных процессов. Если решится проблема управления этим процессом в искусственных условиях, то человечество будет обладать неиссякаемыми источниками энергии.
Водород используется в большом количестве в химической промышленности для производства аммиака. Основная часть этого аммиака используется для получения удобрений и азотной кислоты. Помимо этого водород расходуется на производство метилового спирта и хлористого водорода (соляной кислоты), гидрогенизацию (насыщение водородом) жиров и масел, угля и нефтепродуктов. При гидрогенизации масел образуется маргарин, а благодаря гидрогенизации угля и нефтепродуктов получают легкое топливо.
Температура водородо-кислородного пламени (~3000°С) позволяет резать и паять тугоплавкие металлы и кварц. Применение водорода в металлургии позволяет получать металлы, хорошо очищенные от оксидов и галогенидов. Жидкий водород используется в технике низких температур, в реактивной технике — как самое высокоэффективное топливо. Водород имеет огромное значение при получении атомной энергии и проведении научных исследований.
Вычисление водорода
В химических реакциях наряду с жидкими и твердыми веществами участвуют и газы. Осуществление расчетов с газообразными веществами происходит обычно в единицах объема
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Например, в 22,4 л любого газообразного вещества при 0°С и 101,325 кПа содержится 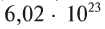
Плотность газа р — это отношение молярной массы газа (М) к его молярному объему
Относительная плотность газов рассчитывается как отношение их молекулярных масс по уравнению:
Вычисление объема газов по уравнениям химических реакций
Пример №1
Какой объем занимают 6,8 г 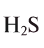
Решение:
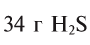
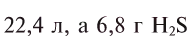
Решая пропорцию, находим:
Ответ: 4,48 л.
Пример №2
Какой объем водорода при нормальных условиях выделится при растворении 3,25 г цинка в избытке соляной кислоты?
Решение:
Напишем уравнение реакции и уравняем его:
Составим на основе уравнения реакции пропорцию и решим задачу:
Ответ: 1,12 л.
Пример №3
Какой объем водорода необходим для восстановления 28,8 г FeO? Решение:
Составим уравнение реакции:
Из уравнения реакции видно, что на восстановление 1 моля (72 г) FeO нужен 1 моль (22,4 л) водорода.
Для восстановления 72 г FeO необходимо 22,4 л
Ответ: 8,96 л.
Пример №4
Для получения кислорода в лабораторных условиях используют термическое разложение бертолетовой соли. Какой объем кислорода и какое количество КС1 образуется из 4,9 г этой соли при нормальных условиях?
Решение:
Напишем уравнение реакции разложения бертолетовой соли 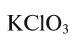
Ответ: 1,344 л 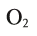
Вычисление объемных соотношений газов по химическим уравнениям
Пример №5
В каком объемном соотношении необходимо взять водород и кислород, чтобы они прореагировали без остатка? Какой объем кислорода вступает в реакцию с 10 л водорода?
Решение:
1) Напишем уравнение реакции взаимодействия кислорода с водородом:
2Н2 + 02 = 2Н20.
Из уравнения известно, что 2 моля водорода без остатка реагируют с 1 молем кислорода.
2 моля водорода занимают объем 44,8 л, а 1 моль кислорода — 22,4 л. Объемные соотношения составят:
Следовательно, водород вступает без остатка в реакцию с кислородом при объемных соотношениях, составляющих небольшие целые числа — 2:1, т.е. 2 л водорода без остатка реаг ируют с 1 л кислорода.
2) Найдем объем кислорода, вступающего в реакцию с 10 л водорода. С 2 л водорода взаимодействует 1 л кислорода,
с 10 л — х л. х = 5 л.
Ответ: 2:1; 5л
Вычисление абсолютной и относительной плотности газов
Пример №6
Рассчитайте абсолютную плотность фтористого водорода и его относительную плотность по водороду.
Решение:
1) Найдем плотность HF.
Молярная масса 1 моля HF — 20 г, а молярный объем — 22,4 л,
2) Найдем относительную плотность HF по
Пример №7
Относительная плотность паров серы по азоту при комнатной температуре равна 9,14. Определите формулу паров серы.
Решение:
Определим молярную массу паров серы.
Если относительная молекулярная масса паров серы равна 256, то, поделив ее на относительную атомную массу серы — 32, мы получим число атомов в молекуле паров серы, т.е. 256 : 32 = 8.
Значит, формула паров серы —
Распространение водорода в природе и его получение
Влейте в пробирку немного разбавленной серной или соляной кислоты и опустите туда 2-3 кусочка цинка или алюминия. Подождите, когда из пробирки выйдет весь воздух, и потом подожгите полученный водород. Что вы наблюдаете? Запишите уравнение реакции.
Общая характеристика:
Распространение в природе
На земном шаре водород по массе составляет 1%. Элемент водорода содержится в составе большинства органических соединений. Водород считается самым распространённым химическим элементом во вселенной (в космосе). Примерно 50% Солнца и все звёзды состоят в основном из водорода. Как вы знаете, в природе существует три изотопа водорода — Протий: 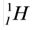
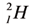
Наиболее широко распространённым в природе является Протий, наименее встречаемым — Дейтерий и в минимальном количестве, редко встречаемым — Тритий.
Впервые водород в чистом виде был получен английским учёным Г.Кавендишем в 1766 году.
Английский ученый. В 1766 году им был получен водород в чистом виде.Ученый вначале принял водород вследствие его легкости за флогистон.
Получение в лаборатории
1) В результате разложения воды под действием электрического тока.
2) В результате вступления в реакцию некоторых металлов (Li, Na, К, Mg, Са, Ва, Al, Zn, Fe) с кислотами (кроме разбавленной и концентрированной 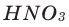
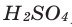
Сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка, называются кислотами. Атомы или группа атомов, соединённых с водородом в молекуле кислоты, называются кислотными остатками.
Составим уравнение реакции с металлом цинком (таблица 1).
1 моль любого металла выделяет мольное количество 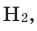
Полученные в результате реакции сложные вещества (хлорид цинка и сульфат цинка) называются солями. Соли — это сложные вещества, состоящие из атома металла и кислотного остатка.
Формулы солей составляются по валентности металла и кислотного остатка. Произношение названий солей основано на названиях металла и кислотного остатка. Например, 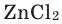
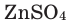
При собирании водорода путём вытеснения воздуха конец газоотводной трубки вставляется в опрокинутый отверстием вниз сосуд (рис. 2).
Для проверки наличия водорода к концу газоотводной трубы подносят небольшую пробирку (на 10-20 секунд), затем, держа ее отверстием вниз, приближают к огню. Раздавшийся при этом взрывоподобный звук или гудение свидетельствуют о наличии водорода
3) В результате реакции активных металлов (Li, Na, К, Са, Ва и др.) с водой. Поскольку эти реакции протекают бурно, а порой и со взрывами, следует брать небольшой кусочек металла, а пробирку, в которой проводится опыт, закрыть воронкой. Во время реакции из молекулы воды вытесняется лишь 1 атом водорода и в результате получается одновалентная гидроксилъная группа (ОН). В свою очередь, гидроксильная группа, соединяясь с атомом металла, образует новое вещество.
Число гидроксильной группы в основаниях зависит от валентности металла.
Полученные в результате этих реакций сложные вещества называются основаниями или гидроксидами. Сложные вещества, состоящие из атома металла и гидроксильной группы, называются основаниями. Названия оснований читаются так: вначале произносится слово «гидроксид», а затем название металла. Если металл имеет переменную валентность, то его валентность отмечается (таблица 3).
Получение в промышленности
Водород в промышленности получают в результате разложения воды под действием постоянного тока:
Другие способы получения водорода в промышленности будут изучены в старших классах.
Свойства и применение водорода

Обратите внимание на картинки. Каким образом на первой картинке шары остаются в воздухе? С какой целью на изображениях шаров на второй картинке даны формулы газов? Поясните свои соображения.
Физические свойства
В свободном состоянии водород образует газ, состоящий из молекул 
Химические свойства
Реакция с неметаллами. В обычных условиях водород химически неактивен. Его молекула отличается устойчивостью. Для разложения 1 моля молекул водорода на атомы требуется 420 к Дж энергии. Из неметаллов водород в обычных условиях вступает в реакцию только со фтором. Во время реакции водорода с кислородом или с воздухом происходит громкий взрыв. После реакции на стенках сосуда образуются капельки воды. Смесь из 2-х объемов водорода 
При горении водородного газа выделяется большое количество теплоты и температура достигает 3000 
Водород горит не только в кислороде, но и в хлоре, смесь с которым также вызывает взрыв.
Полученный хлороводород является веществом в газообразном состоянии, его водный раствор называется соляной кислотой.
Если пробирку с расплавленной серой заполнить водородом, то будет ощущаться запах тухлых яиц, свидетельствующий об образовании нового газа — сероводорода:
Широкое применение на практике находит также вещество под названием аммиак 
Водород непосредственно не взаимодействует с неметаллами Si и Р (в том числе и с инертными газами Не, Ne, Ar, Kr, Хе).
Реакции с металлами. Водород вступает в реакции соединения также с активными металлами. При этом образуются твердые вещества — гидриды (NaH, 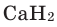
Среди металлов бериллий (Be) и алюминий (А1) в непосредственное взаимодействие с водородом не вступают.
Реакции со сложными веществами. Получение ряда металлов в металлургической промышленности основано на реакциях взаимодействия водорода с оксидами данных металлов. При высокой температуре водород притягивает к себе кислород из состава оксидов малоактивных металлов (Zn, Cr, Fe, Cu и др.), вытесняя и выталкивая металлы в свободном состоянии, т.е. он освобождает (восстанавливает) металлы из их оксидов (из-за получения свободного металла масса исходного твёрдого вещества уменьшается).
Применение
Водород считается самым чистым топливом будущего, так как при сгорании он выделяет большое количество тепловой энергии и продуктом его сгорания являются лишь водяные пары, атмосфера при этом не загрязняется. Водород также используется при превращении жидкого масла (растительное масло) в твердое (маргарин), в качестве топлива, при получении, резке и сварке металлов, синтезе аммиака и метанола и др. Применение водорода показано в нижеприведённой схеме. Поскольку водород является самым легким газом, его также используют при наполнении аэростатов (рис. 1).
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Оксиды в химии
- Перспективы химического производства
- Типы химических реакций в химии
- Атом в химии
- Кислород как химический элемент
|
||||
| Внешний вид простого вещества | ||||
|---|---|---|---|---|
|
|
||||
| Свойства атома | ||||
| Название, символ, номер |
Водород / Hydrogenium (H), 1 |
|||
| Атомная масса (молярная масса) |
[1,00784; 1,00811][комм 1][1] а. е. м. (г/моль) |
|||
| Электронная конфигурация |
1s1 |
|||
| Радиус атома |
53 пм |
|||
| Химические свойства | ||||
| Ковалентный радиус |
32 пм |
|||
| Радиус иона |
54 (−1 e) пм |
|||
| Электроотрицательность |
2,20[2] (шкала Полинга) |
|||
| Степени окисления |
1,0, −1 |
|||
| Энергия ионизации (первый электрон) |
1311,3 (13,595) кДж/моль (эВ) |
|||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) |
0,0000899 (при 273 K (0 °C)) г/см³ |
|||
| Температура плавления |
14,01K; -259,14 °C; -434,45 °F |
|||
| Температура кипения |
20,28K; -252,87 °C; -423,17 °F |
|||
| Уд. теплота плавления |
0,117 кДж/моль |
|||
| Уд. теплота испарения |
0,904 кДж/моль |
|||
| Молярная теплоёмкость |
28,47[3] Дж/(K·моль) |
|||
| Молярный объём |
14,1 см³/моль |
|||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки |
гексагональная |
|||
| Параметры решётки |
a=3,780 c=6,167 Å |
|||
| Отношение c/a |
1,631 |
|||
| Температура Дебая |
110 K |
|||
| Прочие характеристики | ||||
| Теплопроводность |
(300 K) 0,1815 Вт/(м·К) |
|||
| Номер CAS |
12385-13-6 |
|||
| Эмиссионный спектр | ||||
|
|
Водоро́д — первый элемент периодической системы элементов; обозначается символом H. Название представляет собой кальку с латинского: лат. Hydrogenium (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «порождающий воду». Широко распространён в природе.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен[3]. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Распространённость
- 3.1 Во Вселенной
- 3.2 Земная кора и живые организмы
- 4 Получение
- 4.1 В промышленности
- 4.2 В лаборатории
- 4.3 Очистка
- 5 Физические свойства
- 6 Изотопы
- 7 Свойства изотопов
- 8 Химические свойства
- 8.1 Взаимодействие со щелочными и щёлочноземельными металлами
- 8.2 Взаимодействие с оксидами металлов (как правило, d-элементов)
- 8.3 Гидрирование органических соединений
- 9 Геохимия водорода
- 10 Меры предосторожности
- 11 Экономика
- 12 Применение
- 12.1 Химическая промышленность
- 12.2 Пищевая промышленность
- 12.3 Авиационная промышленность
- 12.4 Метеорология
- 12.5 Топливо
- 12.6 Электроэнергетика
- 13 Интересные факты
- 14 См. также
- 15 Комментарии
- 16 Примечания
- 17 Литература
История[править | править вики-текст]
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом, он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия[править | править вики-текст]
А. Л. Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «рождающий воду».
В 1801 году последователь А. Л. Лавуазье академик В. М. Севергин называл его «водотворное вещество», он писал[4]:
«Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление»
Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова.
Распространённость[править | править вики-текст]
Во Вселенной[править | править вики-текст]
Водород — самый распространённый элемент во Вселенной[5]. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %)[6]. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы[править | править вики-текст]
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха[7][8]).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 63 %.[9]
Получение[править | править вики-текст]
В промышленности[править | править вики-текст]
- Конверсия с водяным паром при 1000 °C:
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- Электролиз водных растворов солей:
- Каталитическое окисление кислородом:
- Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории[править | править вики-текст]
- Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
- Взаимодействие кальция с водой:
- Гидролиз гидридов:
- Действие щелочей на цинк или алюминий:
- С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
Очистка[править | править вики-текст]
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ). [10].
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158°С и давлении 4 МПа. Чистота очищенного водорода составляет 93-94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространен в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0-3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 г. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн нм3 Н2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Физические свойства[править | править вики-текст]
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[11]. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлегкий металл, компонент легкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[12].
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация пара-водорода в смеси в зависимости от температуры
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесная смесь (орто-пара 75:25). Без катализатора превращение происходит медленно, что даёт возможность изучить свойства обеих модификаций. В условиях межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы[править | править вики-текст]
Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Водород в природе встречается в виде трёх изотопов, которые имеют индивидуальные названия и химические символы: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %[13]. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет[13]. Тритий содержится в природе в очень малых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами. Тритий претерпевает бета-распад, превращаясь в редкий стабильный изотоп гелия 3He.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с[13].
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в смеси молекул из чистого дейтерия D2 ещё меньше. Отношение концентраций молекул HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[14].
| Температура плавления, K |
Температура кипения, K |
Тройная точка, K / кПа |
Критическая точка, K / МПа |
Плотность жидкий / газ, кг/м³ |
|
|---|---|---|---|---|---|
| H2 | 13,96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 16,65 | 22,13 | 16,6 / 12,8 | 35,91 / 1,48 | 114,0 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,23 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и парамодификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов[править | править вики-текст]
Свойства изотопов водорода представлены в таблице[13][15].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)·10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1·10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)·10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)·10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства[править | править вики-текст]
Доля диссоциировавших молекул водорода
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
-
— 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
Он может «отнимать» кислород от некоторых оксидов, например:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
-
, реакция протекает со взрывом в темноте и при любой температуре,
-
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами[править | править вики-текст]
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов (как правило, d-элементов)[править | править вики-текст]
Оксиды восстанавливаются до металлов:
Гидрирование органических соединений[править | править вики-текст]
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких, как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода[править | править вики-текст]
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё.[источник не указан 1386 дней] Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.[источник не указан 1386 дней]
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях [16][17].
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 Тгр/год), неполного сгорания различных топлив и биомасс (по 5—25 Тгр/год), в процессе фиксации азота микроорганизмами из воздуха (3−22 Тгр/год).[18][19][20].
Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду.[21][22]
Меры предосторожности[править | править вики-текст]
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Сегодня также исследуется малоизученное свойство самовозгорания водорода при резком понижении давления[источник не указан 334 дня].
Экономика[править | править вики-текст]
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне $2—7 за кг[23]. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Применение[править | править вики-текст]
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность[править | править вики-текст]
- При производстве аммиака, метанола, мыла и пластмасс.
- В качестве газа-носителя в газовой хроматографии. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку скорость расхода газа обычно недостаточна для достижения опасных концентраций в помещении. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.[24]
Пищевая промышленность[править | править вики-текст]
- При производстве маргарина из жидких растительных масел.
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ, класс «Прочие»). Входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции.[источник не указан 2214 дней]
Авиационная промышленность[править | править вики-текст]
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология[править | править вики-текст]
Используется в метеорологии для заполнения шаропилотных оболочек.
Топливо[править | править вики-текст]
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водород в ДВС меньше загрязняет окружающую среду локально (использование водорода в этом качестве затрудняет низкая эффективность его получения и сопряжённых дополнительных расходов на его сжатие, транспортировку), но так же, как и бензиновые/дизельные аналоги, потребляет и деградирует моторное масло и все остальные неэкологичные материалы, присущие двигателям внутреннего сгорания. В смысле экологии электромобили значительно лучше, перспективен также двигатель Стирлинга.[источник не указан 1549 дней]
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Электроэнергетика[править | править вики-текст]
Водород применяется для охлаждения мощных электрических генераторов[25].
Интересные факты[править | править вики-текст]
- Хорватское название водорода — Vodik, ввёл в употребление филолог Богослав Шулек.
См. также[править | править вики-текст]
- Атом водорода
- Жидкий водород
- Металлический водород
- Соединения водорода
- Антиводород
- Водородная энергетика
- Молекула водорода
- Молекулярный ион водорода
Комментарии[править | править вики-текст]
- ↑ Указан диапазон значений атомной массы в связи с различной распространённостью изотопов в природе.
Примечания[править | править вики-текст]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Hydrogen: electronegativities (англ.). Webelements. Проверено 15 июля 2010.
- ↑ 1 2 Водород // Химическая энциклопедия: в 5 т / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: Абл—Дар. — С. 400—402. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Севергин В. М. Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел. СПб.: Издание Имп. АН, 1801. C. 2.
- ↑ Книга рекордов Гиннесса для химических веществ
- ↑ Н. Гринвуд, А. Эрншо. Химия элементов: в 2 томах. — БИНОМ. Лаборатория знаний, 2008. — Т. 1. — С. 11. — 607 с. — (Лучший зарубежный учебник). — ISBN 978-5-94774-373-9.
- ↑ Gribbin, John. Science. A History (1543-2001). — L.: Penguin Books, 2003. — 648 с. — ISBN 978-0-140-29741-6.
- ↑ Source for figures: Carbon dioxide, NOAA Earth System Research Laboratory, (updated 2010.06). Methane, IPCC TAR table 6.1, (updated to 1998). The NASA total was 17 ppmv over 100 %, and CO2 was increased here by 15 ppmv. To normalize, N2 should be reduced by about 25 ppmv and O2 by about 7 ppmv.
- ↑ Хорнак Д. П. Основы МРТ
- ↑ А.К.Мановян. Технология переработки природных энергоносителей. — Москва: Химия, КолосС, 2004. — 456 с. — ISBN 5-98109-004-9, 5-9532-0219-97.
- ↑ Мыльные пузыри с водородом — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Под ред. акад. Ю. Д. Третьякова. Неограническая химия. Том 2. Химия непереходных элементов.. — Москва: Академия, 2004. — 368 с. — ISBN 5-7695-1436-1.
- ↑ 1 2 3 4 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001. Bibcode: 2003NuPhA.729….3A.
- ↑ Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0
- ↑ G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003. Bibcode: 2003NuPhA.729..337A.
- ↑ Александр Портнов. Вулканы — месторождения водорода. / Промышленные ведомости, № 10-12 октябрь, декабрь 2010
- ↑ Гресов А. И., Обжиров А. И., Яцук А. В. К вопросу водородоносности угольных бассейнов Дальнего востока/ Вестник КРАУНЦ. Науки о Земле. 2010, № 1, Выпуск 15. С.19-32.
- ↑ http://www.atmos-chem-phys.net/11/3375/2011/acp-11-3375-2011.pdf A new estimation of the recent tropospheric molecular hydrogen budget using atmospheric observations and variational inversion] doi:10.5194/acp-11-3375-2011, 2011 «The main sources of H2 are photochemical production by the transformation of formaldehyde (HCHO) in the atmosphere and incomplete combustion processes. Photolysis of HCHO, a product in the oxidation chain of methane and other volatile organic compounds (VOCs) accounts for 31 to 77 Tg yr−1 and represents half of the total H2 source. Fossil fuel and biomass burning emissions, two incomplete combustion sources, account for similar shares of the global H2 budget (5−25 Tg yr−1). H2 emissions (3−22 Tg yr−1) originating from nitrogen fixation in the continental and marine biosphere complete the sources. H2 oxidation by free hydroxyl radicals (OH) and enzymatic H2 destruction in soils must balance these sources because tropospheric H2 does not show a significant long term trend (Grant et al., 2010)»
- ↑ Chemistry of the Natural Atmosphere pages 207—201, table 4.14
- ↑ Global environmental impacts of the hydrogen economy page 61 table 1
- ↑ David C. Catling and Kevin J. Zahnle, The Planetary Air Leak. As Earth’s atmosphere slowly trickles away into space, will our planet come to look like Venus? //SCIENTIFIC AMERICAN, May 2009
- ↑ http://books.google.ru/books?id=7cBTwb9PETsC&pg=PA296 ISBN 90-277-2418-0, 1987, page 296 chapter 8 table VII «Time (in years) of dissipation of gases from the Earth’s atmosphere at different temperatures»
- ↑ Аркадий Шварц Снова о водороде Вестник online № 19(356) 15 сентября 2004
- ↑ Helium — what is the current cost to labs?. www.peakscientific.com. Проверено 17 ноября 2015.
- ↑ Принцип действия и конструкция синхронных машин
Литература[править | править вики-текст]
- Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов /Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. — М.: Издательство «Экзамен»,2005.
- Учебный справочник школьника. Учебное издание. — М.: Дрофа, 2001.
- Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006 ISBN 5-02-025114-3
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
|

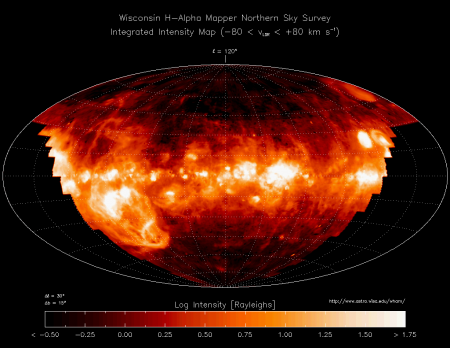
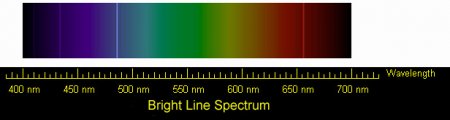


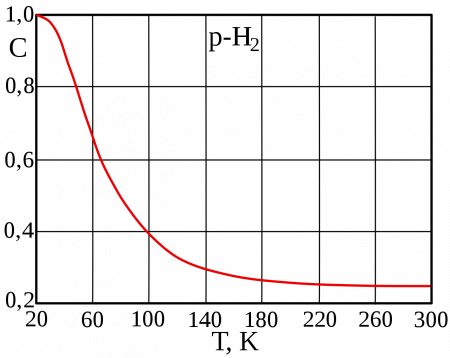
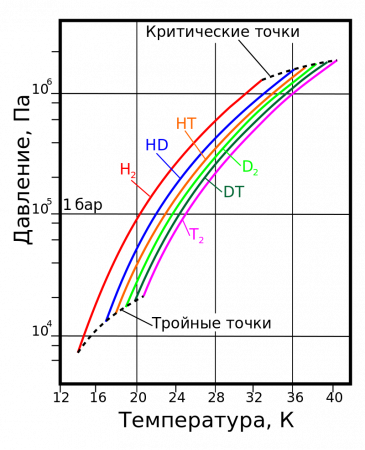
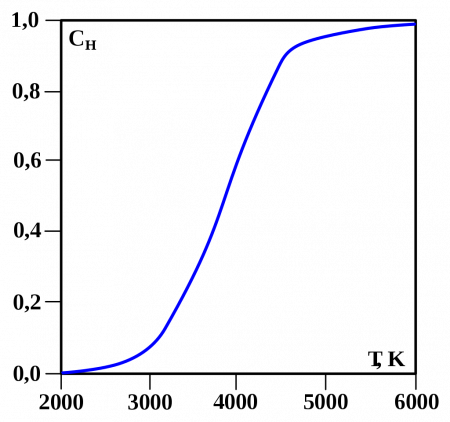









![mathsf{2Al + 2NaOH + 6H_2O rightarrow 2Na[Al(OH)_4] + 3H_2uparrow}](https://dic.academic.ru/dic.nsf/ruwiki/5be90d7490aac370d9837e83e3067d2a.png)
![mathsf{Zn + 2KOH + 2H_2O rightarrow K_2[Zn(OH)_4] + H_2uparrow}](https://dic.academic.ru/dic.nsf/ruwiki/b979c07b20d6f36bcfd32fbff37d637e.png)


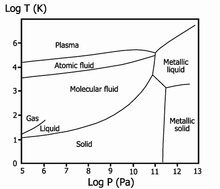

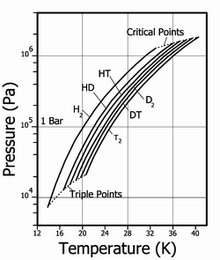







 , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре, , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.












![{displaystyle {ce {2H2O ->[4e^{-}] 2H2 ^ + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bfd0a4659edb19836248c5e04532377ec8f41ec6)




![{displaystyle {ce {2Al + 2NaOH + 6H2O -> 2Na[Al(OH)4] + 3H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/84f7a05865559a196245e28733d1bf2484c8869b)
![{displaystyle {ce {Zn + 2KOH + 2H2O -> K2[Zn(OH)4] + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f189643478d6d572c065da234fc21a7f5a9244fb)





















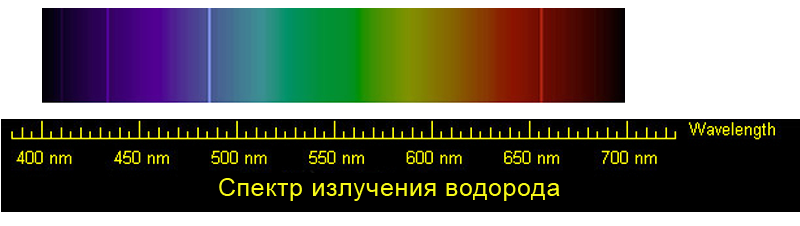

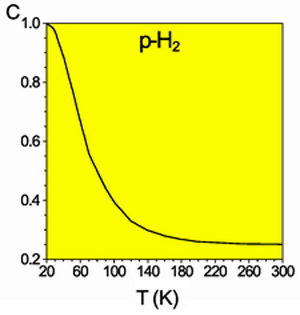
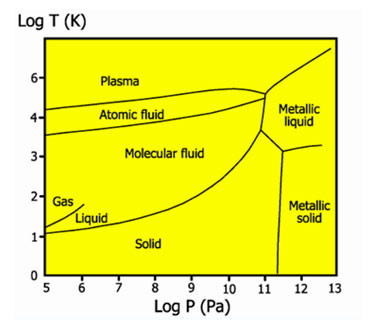
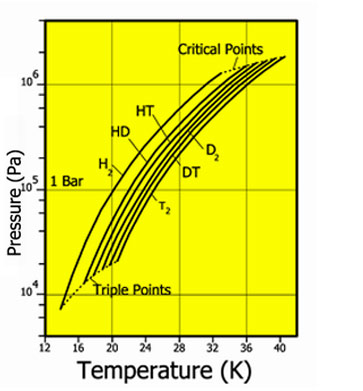
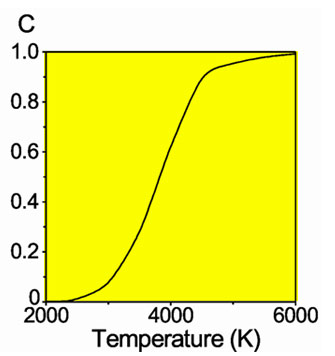
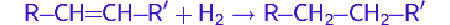

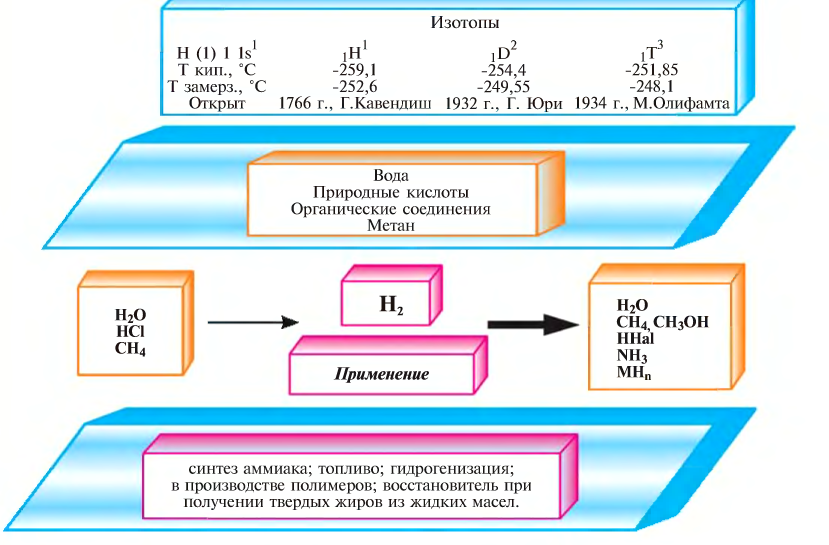

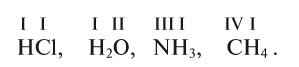

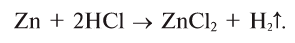
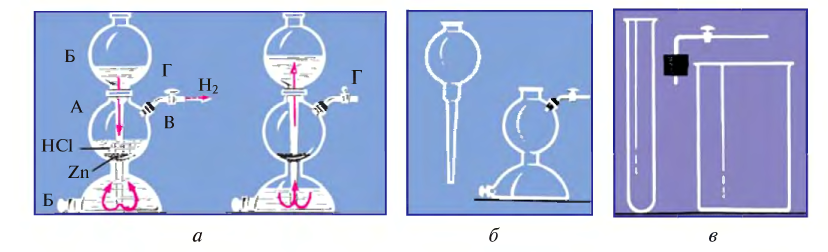

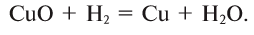
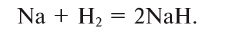
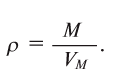
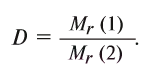
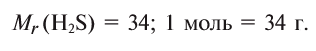
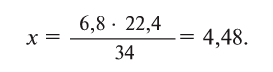
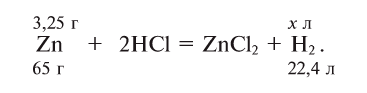
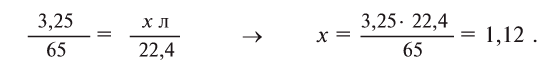
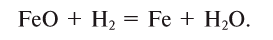
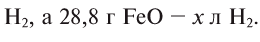
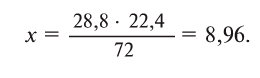
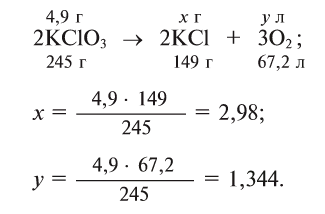
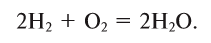
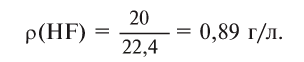
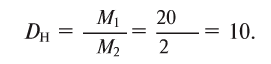
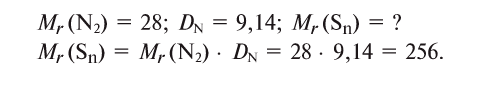
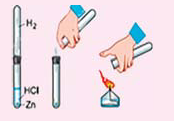
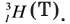

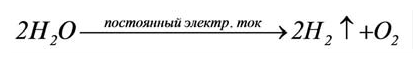

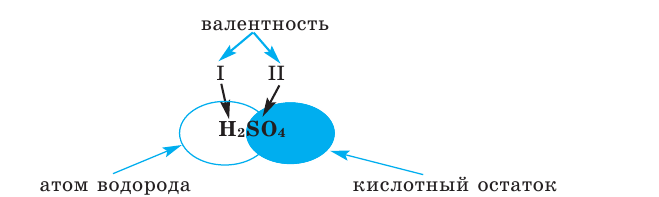
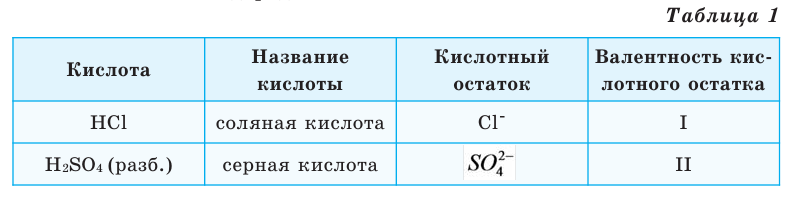
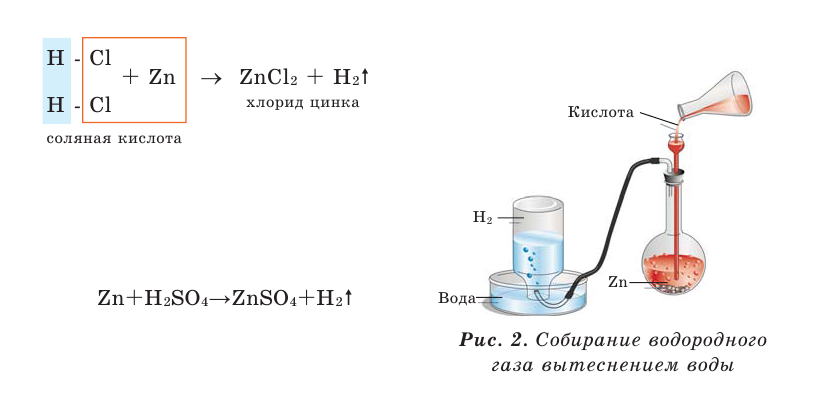
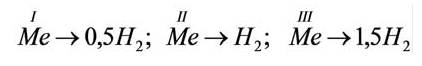
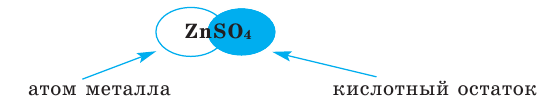

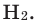
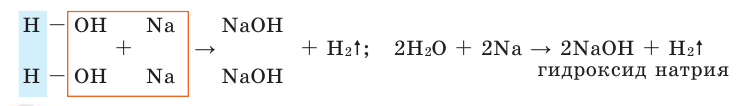



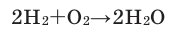
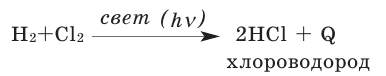
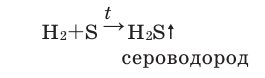
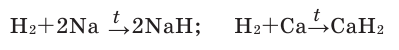
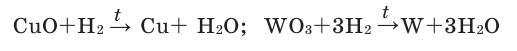










![mathsf{2Al + 2NaOH + 6H_2O rightarrow 2Na[Al(OH)_4] + 3H_2uparrow}](https://web.archive.org/web/20170330170713im_/https://wikimedia.org/api/rest_v1/media/math/render/svg/2323744551d91b19524bec3579ea18f4c123b2df)
![mathsf{Zn + 2KOH + 2H_2O rightarrow K_2[Zn(OH)_4] + H_2uparrow}](https://web.archive.org/web/20170330170713im_/https://wikimedia.org/api/rest_v1/media/math/render/svg/0072f3244fe174a99a8a1ac7abf2cc016fdf3c38)






















