Диагностические критерии
Госпитальная пневмония:
признаки вновь возникшего инфильтрата лёгочной ткани в сочетании с признаками его инфекционной природы:
— развитие лихорадки;
— отделение гнойной мокроты;
— лейкоцитоз;
— снижение оксигенации.
Сочетание данных о новом участке инфильтрации лёгочной ткани с двумя из трёх основных признаков (температура > 38 º С, гнойная мокрота, лейкоцитоз) в качестве диагностического критерия пневмонии имеет при патологоанатомической верификации 69% чувствительность и 75% специфичность.
Аускультативные признаки пневмонии являются вспомогательным диагностическим критерием.
“Золотым стандартом” лучевой диагностики пневмонии является компьютерная томография. Предпочтительно использование метода у пациентов с высоким риском и осложнениями пневмонии.
Источник:
Kalil AC, Metersky ML, Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America
and the American Thoracic Society. Clin Infect Dis. 2016 Sep 1;63(5):e61-e111.
PMCID: PMC4981759
Структура диагноза
|
Место развития |
Локализация |
Дыхательная недостаточность**** |
Определения степеней дыхательной недостаточности (в диагнозе не указываются) |
||
|
Внебольничная |
очаговая, в _ доле __ легкого, |
пневмония |
этиология*** ± антиботико- резистентность |
ДН 0 ст. |
нет одышки |
|
Госпитальная* |
очагово – сливная, … |
ДН I ст. |
появление одышки при повышенной нагрузке, |
||
|
Госпитальная, вентиляторассоциированная** |
…сторонняя …..долевая |
ДН II ст. |
появление одышки при обычной нагрузке, |
||
|
субтотальная, тотальная |
ДН III ст. |
появление одышки в состоянии покоя. |
* Развившаяся спустя ≥ 48 часов после поступления в стационар, у пациентов, которым не проводилась интубация
** Развившаяся спустя ≥ 48 — 72 часа после эндотрахеальной интубации.
*** Сокращение названий микроорганизмов на сайте http://www.antibiotic.ru
**** Степень ДН не указывается в диагнозе вентиляторассоциированной пневмонии.
Примеры формулировки диагноза
Пример 1: Внебольничная очаговая пневмония в нижней доле левого легкого. ДН 0.
Пример 2: Внебольничная правосторонняя нижнедолевая пневмония вызванная S. pneumoniae. Правосторонний экссудативный плеврит. ДН 1 ст.
Пример 3: Двусторонняя очагово–сливная пневмония в нижних долях обоих легких, верхней доле правого легкого, справа – абсцедирующая (абсцесс в S3), вызванная K. pneumoniae, S. pneumoniae; ДН – 2 ст. Хронический алкоголизм.
Также:
Воспаление легких
Версия: Справочник заболеваний MedElement
Категории МКБ:
Пневмония без уточнения возбудителя (J18)
Разделы медицины:
Пульмонология
Общая информация
Краткое описание
Пневмония (воспаление легких) — наименование группы различных по этиологии, патогенезу и морфологической характеристике острых локальных инфекционных заболеваний легких с преимущественным поражением респираторных отделов (альвеолы, бронхиолы) и внутриальвеолярной экссудацией.
Примечание. Из данной рубрики и всех подрубрик (J18 -) исключены:
— Другие интерстициальные легочные болезни с упоминанием о фиброзе (J84.1);
— Интерстициальная легочная болезнь, неуточненная (J84.9);
— Абсцесс легкого с пневмонией (J85.1);
— Болезни легкого, вызванные внешними агентами (J60-J70) в том числе:
— Пневмонит, вызванный твердыми веществами и жидкостями (J69 -);
— Острые интерстициальные легочные нарушения, вызванные лекарственными средствами (J70.2);
— Хронические интерстициальные легочные нарушения, вызванные лекарственными средствами (J70.3);
— Легочные интерстициальные нарушения, вызванные лекарственными средствами, неуточненные (J70.4);
— Легочные осложнения анестезии в период беременности (O29.0);
— Аспирационный пневмонит, вследствие анестезии во время процесса родов и родоразрешения (O74.0);
— Легочные осложнения вследствие применения анестезии в послеродовом периоде (O89.0);
— Врожденная пневмония неуточненная (P23.9);
— Неонатальный аспирационный синдром неуточненный (P24.9).
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Пневмонии подразделяются на следующие виды:
— крупозные (плевропневмонии, с поражением доли легкого);
— очаговые (бронхопневмонии, с поражением прилежащих к бронхам альвеол);
— интерстициальные;
— острые;
— хронические.
Примечание. Следует учитывать, что крупозное воспаление легких является только одной из форм пневмококковой пневмонии и не встречается при пневмониях иной природы, а интерстициальное воспаление легочной ткани по современной классификации отнесено к альвеолитам.
Разделение пневмоний на острые и хронические применяется не во всех источниках, поскольку считается, что в случае так называемой хронической пневмонии речь, как правило, идет о повторных острых инфекционных процессах в легких одной и той же локализации.
В зависимости от возбудителя:
— пневмококковые;
— стрептококковые;
— стафилококковые;
— хламидиазные;
— микоплазменные;
— фридлендеровские.
В клинической практике далеко не всегда удается идентифицировать возбудителя, поэтому принято выделять:
1. Пневмонии внебольничные (другие названия — бытовые, домашние амбулаторные) — приобретенные вне больничного учреждения.
2. Пневмонии госпитальные (нозокомиальные, внутрибольничные) — развиваются через 2 и более суток пребывания пациента в стационаре при отсутствии клинико-рентгенологических признаков поражения легких при поступлении.
3. Пневмонии у лиц с иммунодефицитными состояниями.
4. Атипичные пневмонии.
По механизму развития:
— первичные;
— вторичные — развившиеся в связи с другим патологическим процессом (аспирационные, застойные, посттравматические, иммунодефицитные, инфарктные, ателектатические).
Этиология и патогенез
Возникновение пневмонии в подавляющем большинстве случаев связано с аспирацией микробов (чаще — сапрофитов) из ротоглотки; реже происходит инфицирование гемато- и лимфогенным путем или из соседних очагов инфекции.
В качестве возбудителя воспаления легких выступают пневмо-, стафило- и стрептококк, палочка Пфейффера, иногда кишечная палочка, клебсиелла пневмонии, протей, гемофильная и синегнойная палочки, легионелла, палочка чумы, возбудитель Ку-лихорадки — риккетсия Бернета, некоторые вирусы, вирусно-бактериальные ассоциации, бактероиды, микоплазмы, грибы, пневмоциста, бранхамелла, ацинобактерии, аспергиллы и аэромонас.
Химические и физические агенты: воздействие на легкие химических веществ, термических факторов (ожог или охлаждение), радиоактивного излучения. Химические и физические агенты как этиологические факторы обычно сочетаются с инфекционными.
Пневмонии могут возникнуть вследствие аллергических реакций в легких или быть проявлением системного заболевания (интерстициальные пневмонии при заболеваниях соединительной ткани).
Возбудители попадают в легочную ткань бронхогенным, гематогенным и лимфогенным путями из верхних дыхательных путей, как правило, при присутствии в них острых или хронических очагов инфекции, и из инфекционных очагов в бронхах (хронический бронхит, бронхоактазы). Вирусная инфекция способствует активации бактериальной инфекции и возникновению бактериальных очаговых или долевых пневмоний.
Хроническая пневмония может стать следствием неразрешившейся острой пневмонии при замедлении и прекращении резорбции экссудата в альвеолах и формировании пневмосклероза, воспалительно-клеточных изменений в интерстициальной ткани нередко иммунологического характера (лимфоцитарная и плазмоклеточная инфильтрация).
Переходу острых пневмоний в хроническую форму или их затяжному течению способствуют иммунологические нарушения, обусловленные повторной респираторной вирусной инфекцией, хронической инфекцией верхних дыхательных путей (хронические тонзиллиты, синуситы и другие) и бронхов, метаболическими нарушениями при сахарном диабете, хроническом алкоголизме и прочем.
Внебольничные пневмонии развиваются, как правило, на фоне нарушения защитных механизмов бронхолегочной системы (часто после перенесенного гриппа). Типичные их возбудители — пневмококки, стрептококки, гемофильная палочка и другие.
В возникновении госпитальных пневмоний имеют значение подавление кашлевого рефлекса и повреждение трахео-бронхиального дерева во время операции искусственной вентиляции легких, трахеостомии, бронхоскопии; нарушение гуморального и тканевого иммунитета вследствие тяжелого заболевания внутренних органов, а также сам факт пребывания больных в стационаре. В этом случае в роли возбудителя, как правило, выступает грамотрицательная флора (кишечная палочка, протей, клебсиелла, синегнойная палочка), стафилококки и другие.
Внутрибольничные пневмонии нередко протекают более тяжело по сравнению с внебольничными, отличаются большей вероятностью развития осложнений и более высокой летальностью. У людей с иммунодефицитными состояниями (при онкологических заболеваниях, вследствие химиотерапии, при ВИЧ-инфекции) возбудителями пневмонии могут стать такие грамотрицательные микроорганизмы, как стафилококк, грибы, пневмоцисты, цитомегаловирусы и прочие.
Атипичные пневмонии более часто возникают у молодых людей, а также у путешественников, зачастую носят эпидемический характер, возможные возбудители — хламидии, легионеллы, микоплазмы.
Эпидемиология
Пневмонии являются одними из наиболее распространенных острых инфекционных заболеваний. Заболеваемость внебольничной пневмонией у взрослых составляет от 1 до 11,6‰ — молодой и средний возраст, 25-44‰ — старшая возрастная группа.
Факторы и группы риска
Факторы риска затяжного течения пневмонии:
— возраст старше 55 лет;
— алкоголизм;
— курение;
— наличие сопутствующих инвалидизирующих заболеваний внутренних органов (застойная сердечная недостаточность,
ХОБЛ
, сахарный диабет и другие);
— вирулентные возбудители заболевания (L.pneumophila, S.aureus, грамотрицательные энтеробактерии);
— мультилобарная инфильтрация;
— тяжелое течение внебольничной пневмонии;
— клиническая неэффективность проводимого лечения (лейкоцитоз и лихорадка сохраняются);
— вторичная
бактериемия
.
Клиническая картина
Клинические критерии диагностики
лихорадка свыше 4 дней, тахипноэ, одышка, физикальные признаки пневмонии.
Cимптомы, течение
Симптомы и течение пневмонии зависят от этиологии, характера и фазы течения, морфологического субстрата болезни и его распространенности в легких, а также наличия осложнений (
плеврит
, легочное нагноение и других).
Крупозная пневмония
Как правило, имеет острое начало, которому нередко предшествует охлаждение.
Больной испытывает озноб; температура тела поднимается до 39–40о С, реже до 38о С или 41о С; боль при дыхании на стороне пораженного легкого усиливается при кашле. Кашель вначале сухой, далее с гнойной или «ржавой» вязкой мокротой с примесью крови. Аналогичное или не столь бурное начало болезни возможно в исходе острого респираторного заболевания или на фоне хронического бронхита.
Состояние больного обычно тяжелое. Кожные покровы лица гиперемированы и цианотичны. С самого начала болезни наблюдается учащенное, поверхностное дыхание, с раздуванием крыльев носа. Часто отмечается герпетическая инфекция.
В результате воздействия антибактериальных препаратов наблюдается постепенное (литическое) снижение температуры.
Грудная клетка отстает в акте дыхания на стороне пораженного легкого. В зависимости от морфологической стадии болезни перкуссия пораженного легкого обнаруживает притупленный тимпанит (стадия прилива), укорочение (притупление) легочного звука (стадия красного и серого опеченения) и легочный звук (стадия разрешения).
При аускультации в зависимости от стадии морфологических изменений соответственно выявляют усиленное везикулярное дыхание и
crepitatio indux
, бронхиальное дыхание и везикулярное или ослабленное везикулярное дыхание, на фоне которого выслушивается crepitatio redus.
В фазу опеченения присутствуют усиленное голосовое дрожание и бронхофония. Из-за неравномерности развития морфологических изменений в легких перкуторная и аускультативная картины могут быть пестрыми.
Вследствие поражения плевры (парапневмоническмй серозно-фибринозный плеврит) выслушивается шум трения плевры.
В разгар болезни пульс учащенный, мягкий, соответствует сниженному АД. Нередки приглушение I тона и акцент II тона на легочной артерии. Повышается СОЭ.
При рентгенологическом исследовании определяется гомогенное затенение всей пораженной доли или ее части, особенно на боковых рентгенограммах. Рентгеноскопия может оказаться недостаточной в первые часы болезни. У лиц, страдающих алкоголизмом, чаще наблюдается атипичное течение заболевания.
Пневмококковая крупозная пневмония
Характеризуется острым началом с резким повышением температуры до 39-40˚ С, сопровождающимся ознобом и потливостью. Также появляются головная боль, значительная слабость, вялость. При выраженной гипертермии и интоксикации может наблюдаться такая церебральная симптоматика как сильная головная боль, рвота, оглушенность больного или спутанность сознания и даже миненгеальные симптомы.
В грудной клетке на стороне воспаления рано возникает боль. Нередко при пневмонии плевральная реакция выражена очень сильно, поэтому боль в груди составляет основную жалобу и требует оказания неотложной помощи. Отличительная особенность плевральной боли при пневмонии заключается в ее связи с дыханием и кашлем: происходит резкое усиление боли при вдохе и кашлевом толчке. В первые дни могут появиться кашель с выделением ржавой от примеси эритроцитов мокроты, иногда необильное кровохарканье.
При осмотре нередко обращает на себя внимание вынужденное положение больного: часто он лежит именно на стороне воспаления. Лицо обычно гиперемировано, иногда лихорадочный румянец больше выражен на щеке, соответствующей стороне поражения. Характерная одышка (до 30-40 дыханий в минуту) сочетается с цианозом губ и раздуванием крыльев носа.
В ранний период болезни нередко возникают пузырьковые высыпания на губах (herpes labialis).
При обследовании грудной клетки обычно выявляется отставание пораженной стороны при дыхании — больной как бы жалеет сторону воспаления из-за сильных плевральных болей.
Над зоной воспаления при перкуссии легких определяется ускорение перкуторного звука, дыхание приобретает бронхиальный оттенок, рано появляются мелкопузырчатые влажные крепитирующие хрипы. Характерны тахикардия — до 10 ударов в 1 минуту — и некоторое снижение артериального давления. Нередки приглушение I и акцент II тона на легочной артерии. Выраженная плевральная реакция иногда сочетается с рефлекторной болью в соответствующей половине живота, болезненностью при пальпации в его верхних отделах.
Иктеричность
слизистых оболочек и кожных покровов может появляться вследствие разрушения эритроцитов в пораженной доле легкого и, возможно, образования очаговых некрозов в печени.
Характерен нейтрофильный лейкоцитоз; его отсутствие (тем более
лейкопения
) может быть прогностически неблагоприятным признаком. Повышается СОЭ. При рентгенологическом исследовании определяется гомогенное затемнение всей пораженной доли и ее части, особенно заметное на боковых рентгенограммах. В первые часы болезни рентгеноскопия может оказаться неинформативной .
При очаговой пневмококковой пневмонии симптоматика, как правило, менее выражена. Наблюдаются подъем температуры до 38-38,5˚С, кашель — сухой или с отделением слизисто-гнойной мокроты, вероятно появление боли при кашле и глубоком дыхании, объективно выявляются признаки воспаления легочной ткани, выраженные в той или иной степени в зависимости от обширности и расположения (поверхностного или глубокого) очага воспаления; чаще всего выявляется фокус крепитирующих хрипов.
Стафилококковая пневмония
Может протекать аналогично пневмококковой. Однако, чаще она имеет более тяжелое течение, сопровождаясь деструкцией легких с образованием тонкостенных воздушных полостей, абсцессов легких. С явлениями выраженной интоксикации протекает стафилококковая (обычно многоочаговая) пневмония, осложняющая вирусную инфекцию бронхолегочной системы (вирусно-бактериальная пневмония). Во время эпидемий гриппа частота вирусно-бактериальных пневмоний значительно возрастает.
Для такого рода пневмонии типичен выраженный интоксикационный синдром, который проявляется гипертермией, ознобом,
гиперемией
кожных покровов и слизистых оболочек, головной болью, головокружением, тахикардией, выраженной одышкой, тошнотой, рвотой, кровохарканьем.
При тяжелом инфекционно-токсическом шоке развивается сосудистая недостаточность (АД 90–80; 60–50 мм рт. ст, бледность кожных покровов, холодные конечности, появление липкого пота).
По мере прогрессирования интоксикационного синдрома появляются церебральные расстройства, нарастание сердечной недостаточности, нарушения ритма сердца, развитие шокового легкого, гепаторенального синдрома,
ДВС-синдрома
, токсического энтероколита. Такие пневмонии могут привести к быстрому летальному исходу.
Стрептококковая пневмония развивается остро, в некоторых случаях — в связи с перенесенной ангиной или при сепсисе. Болезнь сопровождается лихорадкой, кашлем, болью в грудной клетке, одышкой. Часто обнаруживается значительный плевральный выпот; при торакоцентезе получают серозную, серозно-геморрагическую или гнойную жидкость.
Пневмония, вызванная клебсиеллой пневмонии (палочкой Фридлендера)
Встречается сравнительно редко (чаще при алкоголизме, у ослабленных больных, на фоне снижения иммунитета). Наблюдается тяжелое течение; летальность достигает 50%.
Протекает с выраженными явлениями интоксикации, быстрым развитием дыхательной недостаточности. Мокрота зачастую желеобразная, вязкая, с неприятным запахом пригорелого мяса, но может быть гнойной или ржавого цвета.
Скудная аускультативная симптоматика, характерно полидолевое распространение с более частым, по сравнению с пневмококковыми пневмониями, вовлечением верхних долей. Типичны образование абсцессов и осложнение
эмпиемой
.
Легионеллезная пневмония
Более часто развивается у людей, проживающих в помещениях с кондиционерами, а также занятых на земляных работах. Характерно острое начало с высокой температурой, одышкой, брадикардией. Заболевание имеет тяжелое течение, часто сопровождается таким осложнением, как поражение кишечника (появляются болевые ощущения, диарея). В анализах выявляются значительное повышение СОЭ, лейкоцитоз, нейтрофилез.
Микоплазменная пневмония
Заболеванию чаще подвержены молодые люди в тесно взаимодействующих коллективах, более распространено в осенне-зимний период. Имеет постепенное начало, с катаральными явлениями. Характерным является несоответствие между выраженной интоксикацией (лихорадка, резкое недомогание, головная и мышечная боль) и отсутствием или слабой выраженностью симптомов поражения органов дыхания (локальные сухие хрипы, жесткое дыхание). Нередко наблюдаются кожные высыпания, гемолитическая анемия. На рентгенограмме часто выявляются интерстициальные изменения и усиление легочного рисунка. Микоплазменные пневмонии, как правило, не сопровождаются лейкоцитозом, наблюдается умеренное повышение СОЭ.
Вирусная пневмония
При вирусных пневмониях могут наблюдаться субфебрилитет, познабливание, ринофарингит, осиплость голоса, признаки
миокардита
, конъюктивит. В случае тяжелой гриппозной пневмонии появляются выраженная итоксикация, токсический отек легких, кровохарканье. В процессе обследования нередко выявляется лейкoпения при нормальной или повышенной СОЭ. При рентгенологическом исследовании определяются деформация и сетчатость легочного рисунка. Вопрос наличия чисто вирусных пневмоний является спорным и признается не всеми авторами.
Диагностика
Пневмония обычно распознается на основании характерной клинической картины болезни — совокупности ее легочных и внелегочных проявлений, а также рентгенологической картины.
Диагноз ставится на основании следующих клинических признаков:
1. Легочные — кашель, одышка, выделение мокроты (может быть слизистой, слизисто-гнойной и другой), боль при дыхании, наличие локальных клинических признаков (бронхиальное дыхание, притупление перкуторного звука, крепитирующие хрипы, шум трения плевры);
2. Внелегочные — остро возникшая лихорадка, клинические и лабораторные признаки интоксикации.
Рентгенологическое исследование органов грудной клетки в двух проекциях проводится для уточнения диагноза. Выявляет инфильтрат в легких. При пневмонии отмечаются усиление везикулярного дыхания иногда с очагами бронхиального, крепитация, мелко- и среднепузырчатые хрипы, очаговые затемнения на рентгенограммах.
Фибробронхоскопия или другие методы инвазивной диагностики выполняются при подозрении на туберкулез легких при отсутствии продуктивного кашля; при «обструктивной пневмонии» на почве бронхогенной карциномы, аспирированного инородного тела бронха и т.д.
Вирусную или риккетсиозную этиологию заболевания можно предположить по несоответствию между остро возникающими инфекционно-токсическими явлениями и минимальными изменениями в органах дыхания при непосредственном исследовании (рентгенологическое исследование выявляет очаговые или интерстициальные тени в легких).
Следует принимать во внимание, что пневмонии могут протекать атипично у больных пожилого возраста, страдающих тяжелыми соматическими заболеваниями или выраженным иммунодефицитом. У подобных пациентов может отсутствовать лихорадка, при этом у них преобладают внелегочные симптомы (нарушения со стороны центральной нервной системы и др.), а также слабо выражены или отсутствуют физикальные признаки легочного воспаления, затруднено определение возбудителя пневмонии.
Подозрение на пневмонию у пожилых и ослабленных больных должно появляться тогда, когда активность больного значительно снижается без видимых причин. У пациента нарастает слабость, он все время лежит и перестает двигаться, становится равнодушным и сонливым, отказывается от еды. Внимательный осмотр всегда выявляет значительную одышку и тахикардию, иногда наблюдаются односторонний румянец щеки, сухой язык. Аускультация легких обычно обнаруживает фокус звонких влажных хрипов.
Лабораторная диагностика
1. Клинический анализ крови. Данные анализа не позволяют сделать вывод о потенциальном возбудителе пневмонии. Лейкоцитоз более 10-12х109/л указывает на высокую вероятность бактериальной инфекции, а лейкопения ниже 3х109/л или лейкоцитоз выше 25х109/л являются неблагоприятными прогностическими признаками.
2. Биохимические анализы крови не дают специфической информации, но могут указать на поражение ряда органов (систем) с помощью обнаруживаемых отклонений.
3. Определение газового состава артериальной крови необходимо для пациентов с явлениями дыхательной недостаточности.
4. Микробиологические исследования проводятся перед началом лечения для установления этиологического диагноза. Осуществляется исследование мокроты или мазков из глотки, гортани, бронхов на бактерии, включая вирусы, микобактерии туберкулеза, микоплазму пневмонии и риккетсии; используют также иммунологические методы. Рекомендуется бактериоскопия с окраской по Граму и посев мокроты, получаемой при глубоком откашливании.
5. Исследование плевральной жидкости. Проводится при наличии плеврального
выпота
и условий безопасного проведения пункции (визуализация на латерограмме свободно смещаемой жидкости с толщиной слоя больше 1 см).
Дифференциальный диагноз
Дифференциальный диагноз необходимо проводить со следующими заболеваниями и патологическими состояниями:
1. Туберкулез легких.
2. Новообразования: первичный рак легкого (особенно так называемая пневмоническая форма бронхиолоальвеолярного рака), эндобронхиальные метастазы, аденома бронха, лимфома.
3. Тромбоэмболия легочной артерии и инфаркт легкого.
4. Иммунопатологические заболевания: системные васкулиты, волчаночный пневмонит, аллергический бронхолегочный аспергиллез, облитерирующий бронхолит с организующейся пневмонией, идиопатический легочный фиброз, эозинофильная пневмония, бронхоцентрический гранулематоз.
5. Прочие заболевания и патологические состояния: застойная сердечная недостаточность, лекарственная (токсическая) пневмопатия, аспирация инородного тела, саркоидоз, легочный альвеолярный протеиноз, липоидная пневмония, округлый ателектаз.
В дифференциальной диагностике пневмонии наибольшее значение придается тщательно собранному анамнезу.
При остром бронхите и обострении хронического бронхита в сравнении с пневмонией менее выражена интоксикация. При рентгенологическом исследовании не выявляются очаги затемнения.
Туберкулезный экссудативный плеврит может начинаться так же остро, как и пневмония: укорочение перкуторного звука и бронхиальное дыхание над областью коллабированного к корню легкого могут имитировать долевую пневмонию. Ошибки позволит избежать тщательная перкуссия, выявляющая книзу от притупления тупой звук и ослабленное дыхание (при эмпиеме — ослабленное бронхиальное дыхание). Осуществить дифференциацию помогают плевральная пункция с последующим исследованием экссудата и рентгенограмма в боковой проекции (выявляется интенсивная тень в подмышечной области).
В отличие от нейтрофильного лейкоцитоза при долевой (реже очаговой) пневмонии гемограмма при экссудативном плеврите туберкулезной этиологии, как правило, не изменена.
В отличие от долевых и сегментарных пневмоний при туберкулезном инфильтрате или очаговом туберкулезе обычно отмечается менее острое начало заболевания. Пневмония разрешается в ближайшие 1,5 недели под влиянием неспецифической терапии, в то время как туберкулезный процесс не поддается такому быстрому воздействию даже при туберкулостотической терапии.
Для милиарного туберкулеза характерна тяжелая интоксикация с высокой лихорадкой при слабо выраженных физикальных симптомах, поэтому требуется его дифференциация с мелкоочаговой распространенной пневмонией.
Острая пневмония и обструктивный пневмонит при бронхогенном раке могут начинаться остро на фоне видимого благополучия, нередко после охлаждения отмечаются лихорадка, озноб, боль в грудной клетке. Однако при обструктивном пневмоните кашель чаще сухой, приступообразный, впоследствии с отделением небольшого количества мокроты и кровохарканьем. В неясных случаях уточнить диагноз позволяет только бронхоскопия.
При вовлечении в воспалительный процесс плевры, происходит раздражение заложенных в ней окончаний правого диафрагмального и нижних межреберных нервов, которые также участвуют в иннервации верхних отделов передней брюшной стенки и органов брюшной полости. Это обусловливает распространение болей на верхние отделы живота.
При их пальпации ощущается болезненность, особенно в области правого верхнего квадранта живота, при поколачивании по правой реберной дуге происходит усиление болей. Больных пневмонией нередко направляют в хирургические отделения с диагнозом аппендицита, острого холецистита, прободной язвы желудка. В этих ситуациях осуществить диагностику помогает отсутствие у большинства больных симптомов раздражения брюшины и напряжения брюшных мышц. Следует, однако, учитывать, что и этот признак не является абсолютным.
Осложнения
Возможные осложнения пневмонии:
1. Легочные: экссудативный плеврит,
пиопневмоторакс
, абсцедирование, отек легких;
2. Внелегочные: инфекционно-токсический шок, перикардит, миокардит, психоз, сепсис и прочие.
Экссудативный плеврит проявляется выраженной тупостью и ослаблением дыхания на пораженной стороне, отставанием нижней части грудной клетки на пораженной стороне при дыхании.
Абсцедирование характеризуется нарастающей интоксикацией, появляется обильный ночной пот, температура приобретает гектический характер с суточными размахами до 2о С и более. Диагноз абсцесса легкого становится очевидным в результате прорыва гнойника в бронх и отхождения большого количества гнойной зловонной мокроты. О прорыве гнойника в плевральную полость и осложнении пневмонии развитием пиопневмоторакса могут свидетельствовать резкое ухудшение состояния, нарастание боли в боку при дыхании, значительное усиление одышки и тахикардии, падение АД.
В появлении отека легких при пневмонии важную роль играет токсическое повреждение легочных капилляров с повышением сосудистой проницаемости. Появление сухих и особенно влажных хрипов над здоровым легким на фоне усиления одышки и ухудшения состояния больного свидетельствует об угрозе развития отека легких.
Признаком возникновения инфекционно-токсического шока следует считать появление стойкой тахикардии, особенно свыше 120 ударов в 1 минуту. Развитие шока характеризуется сильным ухудшением состояния, появлением резкой слабости, в некоторых случаях — снижением температуры. Черты лица больного заостряются, кожа приобретает серый оттенок, усиливается цианоз, значительно нарастает одышка, пульс становится частым и малым, АД падает ниже 90/60 мм рт.ст., прекращается мочеотделение.
Лица, злоупотребляющие алкоголем, чаще подвержены психозу на фоне пневмонии. Он сопровождается зрительными и слуховыми галлюцинациями, двигательным и психическим возбуждением, дезориентацией во времени и пространстве.
Перикардиты, эндокардиты, менингиты в настоящий момент являются редкими осложнениями.
Лечение
При неустановленном возбудителе лечение определяется:
1. Условиями возникновения пневмонии (внебольничная/нозокомиальная/аспирационная/застойная).
2. Возрастом пациента (больше/меньше 65 лет), для детей (до года/ после года).
3. Тяжестью заболевания.
4. Местом лечения (амбулатория /отделение общего профиля/ отделение интенсивной терапии).
5. Морфологией (бронхопневмония/очаговая пневмония).
Подробнее см. подрубрику «Бактериальная пневмония неуточненная» (J15.9).
Пневмонии при ХОБЛ, бронхиальной астме, бронхоэктатической болезни и пр. рассмотрены в других подрубриках и требуют отдельного подхода.
В разгар болезни пациентам показаны постельный режим, щадящая (механически и химически) диета, включающая ограничение поваренной соли и достаточное количество витаминов, особенно А и С. Постепенно с исчезновением или значительным уменьшением явлений интоксикации расширяют режим, при отсутствии противопоказаний (болезни сердца, органов пищеварения) больного переводят на диету №15, предусматривающую увеличение в рационе источников витаминов и кальция, кисломолочных напитков (особенно при лечении антибиотиками), исключение жирных и трудноперевариваемых продуктов и блюд.
Медикаментозная терапия
Для бактериологического исследования производится взятие мокроты, мазков, смывов. После этого начинают этиотропную терапию, которая проводится под контролем клинической эффективности, с учетом высеянной микрофлоры и ее чувствительности к антибиотикам.
При нетяжелом течении пневмонии у амбулаторных больных предпочтение отдается антибиотикам для приема внутрь, при тяжелом течении антибиотики вводятся внутримышечно или внутривенно (возможен переход на пероральный путь введения при улучшении состояния).
При возникновении пневмонии у молодых пациентов без хронических болезней можно начать лечение с пеницилина (6-12 млн ЕД в сутки). У больных хроническими обструктивными заболеваниями легких предпочтительно применение аминопенициллинов (ампициллин 0,5 г 4 раза в сутки внутрь, 0,5-1 г 4 раза в сутки парентерально, амоксициллин 0,25-0,5 г 3 раза в сутки). При непереносимости пенициллинов в нетяжелых случаях используют макролиды — эритромицин (0,5 г внутрь 4 раза в сутки), азитромицин (сумамед -,5 г в сутки), рокситромицин (рулид — 150 мг 2 раза в сутки) и др. В случае развития пневмонии у больных хроническим алкоголизмом и тяжелыми соматическими заболеваниями, а также у пациентов преклонного возраста, проводят терапию цефалоспоринами II — III поколения, комбинацией пенициллинов с ингибиторами беталактамаз.
При двудолевых пневмониях, а также пневмониях, сопровождающихся тяжелым течением с выраженными явлениями интоксикации, и при неустановленном возбудителе применяют комбинацию антибиотиков (ампиокс или цефалоспорины II-III поколения в сочетании с аминогликозидами — например, гентамицином или нетромицином), используют фторхинолоны, карбапенемы.
При внутрибольничных пневмониях используют цефалоспорины III поколения (цефотаксим, цефуроксим, цефтриаксон), фторхинолоны (офлоксацин, ципрофлоксацин, пефлоксацин), аминогликозиды (гентамицин, нетромицин), ванкомицин, карбапенемы, а также, при определении возбудителя, противогрибковые средства. У лиц с иммунодефецитными состояниями при проведении эмпирической терапии пневмонии выбор лекарственных средств определяется возбудителем. При атипичных пневмониях (микоплазменных, легионелезных, хламидиазных) используют макролиды, тетрациклины (тетрациклин 0,3-0,5 г 4 раза в сутки, доксициклин 0,2 г в сутки в 1-2 приема).
Эффективность лечения антибиотиками при пневмониях, в основном выявляется к концу первых суток, но не позднее трех дней их применения. По истечении этого срока при отсутствии терапевтического эффекта назначенный препарат следует заменить другим. Показателями эффективности терапии считаются нормализация температуры тела, исчезновение или уменьшение признаков интоксикации. При неосложненной внебольничной пневмонии антибиотикотерапия осуществляется до стойкой нормализации температуры тела (обычно около 10 дней), при осложненном течении заболевания и внутрибольничных пневмониях длительность антибиотикотерапии определяется индивидуально.
При тяжелых вирусно-бактериальных пневмониях, показано введение специфического донорского противогриппозного гамма-глобулина по 3–6 мл, при необходимости осуществляется повторное введение каждые 4–6 часов, в первые 2 дня болезни.
Кроме антибиототикотерапии, проводится симптоматическое и патогенетическое лечение пневмонии. В случае дыхательной недостаточности используется кислородотерапия, При высокой, тяжело переносимой лихорадке, а также при выраженной плевральной боли показаны нестероидные противовоспалительные средства (парацетамол, вольтарен и др.); для коррекции микроциркуляторных нарушений применяют гепарин (до 20 000 ЕД в сутки).
Больных помещают в палаты интенсивной терапии при тяжелом течении острых и обострении хронических пневмоний, осложненных острой или хронической дыхательной недостаточностью. Может быть проведен бронхоскопический дренаж, при артериальной гиперкапнии — вспомогательная искусственная вентиляция легких. В случае развития отека легких, инфекционно-токсического шока и других тяжелых осложнений лечение больных пневмонией ведется совместно с реаниматологом.
Пациентов, перенесших пневмонию и выписанных из стационара в период клинического выздоровления или ремиссии, следует взять под диспансерное наблюдение. Для проведения реабилитации они могут быть направлены в санатории.
Прогноз
В основной массе случаев при внебольничной пневмонии у иммунокомпетентных пациентов молодого и среднего возраста на 2-4-й день лечения наблюдается нормализация температуры тела, а рентгенологическое «выздоровление» наступает в сроки до 4 недель.
Прогноз при пневмониях стал более благоприятным к концу XX века, однако, остается серьезным при пневмониях, вызванных стафилококком и клебсиеллой пневмонии (палочкой Фридлендера), при часто рецидивирующих хронических пневмониях, осложненных обструктивным процессом, дыхательной и легочно-сердечной недостаточностью, а также при развитии пневмонии у лиц с тяжелыми болезнями сердечно-сосудистой и других систем. В этих случаях летальность от пневмонии остается высокой.
Шкала PORT
У всех без исключения пациентов с внебольничной пневмонией рекомендуется изначально определить, есть ли повышенный риск осложнений и смерти у пациента (класс II-V) или нет (класс I).
Шаг 1. Стратификация пациентов на класс риска I и классы риска II-V
|
На момент осмотра |
|
|
Возраст > 50 лет |
Да/нет |
|
Нарушения сознания |
Да/нет |
|
ЧСС > = 125 уд./мин. |
Да/нет |
|
Частота дыхания > 30/мин. |
Да/нет |
|
Систолическое АД < 90 мм рт.ст. |
Да/нет |
|
Температура тела < 35о С или > = 40о С |
Да/нет |
|
В анамнезе |
|
|
Злокачественное новообразование |
Да/нет |
|
Застойная сердечная недостаточность |
Да/нет |
|
Цереброваскулярное заболевание |
Да/нет |
|
Заболевание почек |
Да/нет |
|
Заболевание печени |
Да/нет |
Примечание. При наличии хотя бы одного «Да», следует перейти к следующему шагу. Если все ответы «Нет», пациента можно отнести к классу риска I.
Шаг 2. Балльная оценка степени риска
|
Характеристика больного |
Оценка в баллах |
|
Демографические факторы |
|
|
Возраст, мужчины |
+ возраст (лет) |
|
Возраст, женщины |
+ возраст (лет) |
|
Пребывание в домах престарелых |
10 |
|
Сопутствующие заболевания |
|
|
Злокачественное новообразование |
+30 |
|
Заболевание печени |
+20 |
|
Застойная сердечная недостаточность |
+10 |
|
Цереброваскулярное заболевание |
+10 |
|
Заболевание почек |
+10 |
|
Данные физикального обследования |
|
|
Нарушение сознания |
+20 |
|
ЧСС > = 125/мин. |
+20 |
|
Частота дыхания > 30/мин. |
+20 |
|
Систолическое АД < 90 мм рт.ст. |
+15 |
|
Температура тела < 35о С или > = 40о С |
+10 |
|
Данные лабораторных и инструментальных исследований |
|
|
pH артериальной крови |
+30 |
|
Уровень азоты мочевины > = 9 ммоль/л |
+20 |
|
Уровень натрия < 130 ммоль/л |
+20 |
|
Уровень глюкозы > = 14 ммоль/л |
+10 |
|
Гематокрит < 30% |
+10 |
|
PaO2 < 60 мм рт. ст. |
+10 |
|
Наличие плеврального выпота |
+10 |
Примечание. В графе «Злокачественные новообразования» учитываются случаи опухолевых заболеваний, манифестирующих активным течением или диагностированных в течение последнего года, исключая базальноклеточный и плоскоклеточный рак кожи.
В графе «Заболевания печени» учитываются случаи клинически и/или гистологически диагностированного цирроза печени и активного хронического гепатита.
В графе «Хроническая сердечная недостаточность» учитываются случаи сердечной недостаточности вследствие систолической или диастолической дисфункции левого желудочка, подтвержденные данными анамнеза, физического обследования, результатами рентгенографии органов грудной клетки, эхокардиографии, сцинтиграфии миокарда или вентрикулографии.
В графе «Цереброваскулярные заболевания» учитываются случаи недавно перенесенного инсульта, транзиторной ишемической атаки и остаточные явления после перенесенного острого нарушения мозгового кровообращения, подтвержденные КТ или МРТ головного мозга.
В графе «Заболевания почек» учитываются случаи анамнестически подтвержденных хронических заболеваний почек и повышения концентрации креатинина/азота мочевины в сыворотке крови.
Шаг 3. Оценка риска и выбор места лечения больных
|
Сумма баллов |
Класс риска |
Степень риска |
30-дневная летальность1 % |
Место лечения2 |
|
< 51> |
I |
Низкая |
0,1 |
Амбулаторно |
|
51-70 |
II |
Низкая |
0,6 |
Амбулаторно |
|
71-90 |
III |
Низкая |
0,9-2,8 |
Амбулаторно под тщательным контролем или непродолжительная госпитализация3 |
|
91-130 |
IV |
Средняя |
8,2-9,3 |
Госпитализация |
|
> 130 |
V |
Высокая |
27,0-29,2 |
Госпитализация (ОРИТ) |
Примечание.
1 По данным Medisgroup Study (1989), PORT Validation Study (1991)
2 E.A.Halm, A.S. Teirstein (2002)
3 Госпитализация показана при нестабильном состоянии пациента, отсутствии ответа на пероральную терапию, наличии социальных факторов
Госпитализация
Показания к госпитализации:
1. Возраст старше 70 лет, выраженный инфекционно-токсический синдром (частота дыхательных движений составляет более 30 в 1 мин., АД ниже 90/60 мм рт.ст., температура тела выше 38,5о С).
2. Наличие тяжелых сопутствующих заболеваний (хронические обструктивные заболевания легких, сахарный диабет, застойная сердечная недостаточность, тяжелые заболевания печени и почек, хронический алкоголизм, токсикомания и другие).
3. Подозрение на вторичную пневмонию (застойная сердечная недостаточность, возможные тромбоэмболия легочных артерий, аспирация, и другое).
4. Развитие таких осложнений, как плеврит, инфекционно-токсический шок, абсцедирование, нарушения сознания.
5. Социальные показания (отсутствует возможность организовать необходимый уход и лечение на дому).
6. Неэффективность амбулаторной терапии в течение 3 дней.
При легком течении и благоприятных бытовых условиях лечение пневмоний может осуществляться на дому, но основная масса больных пневмонией нуждается в стационарном лечении.
Больных с долевыми и другими пневмониями и выраженным инфекционно-токсическим синдромом следует экстренно госпитализировать. Выбор места лечения и (частично) прогноз может быть выполнен согласно шкал оценки состояния CURB-65/CRB-65.
Шкалы CURB-65 and CRB-65 для внебольничной пневмонии
|
Фактор |
Баллы |
|
Спутанность сознания |
1 |
|
Уровень содержания азота мочевины в крови > = 19 мг/дл |
1 |
|
Частота дыхания > = 30/мин. |
1 |
|
Систолическое АД < 90 мм рт. ст |
1 |
|
Возраст > = 50 |
1 |
|
Всего |
|
CURB-65 (баллы) |
Смертность (%) |
Рекомендация |
|
0 |
0,6 |
Низкий риск, возможно амбулаторное лечение |
|
1 |
2,7 |
|
|
2 |
6,8 |
Непродолжительная госпитализация или тщательное амбулаторное наблюдение |
|
3 |
14 |
Тяжелая пневмония, госпитализация или наблюдение в ОРИТ |
|
4 или 5 |
27,8 |
|
CRB-65 (баллы) |
Смертность (%) |
Рекомендация |
|
0 |
0,9 |
Очень низкий риск смертности, обычно не требует госпитализации |
|
1 |
5,2 |
Неопределенный риск, требует госпитализации |
|
2 |
12 |
|
|
3 или 4 |
31,2 |
Высокий риск смерти, срочная госпитализация |
Профилактика
С целью профилактики внебольничной пневмонии применяют пневмококковую и гриппозную вакцины.
Пневмококковую вакцину следует вводить при наличии высокого риска развития пневмококковых инфекций (согласно рекомендациям Комитета советников по иммунизационной практике):
— лицам старше 65 лет;
— лицам в возрасте от 2 до 64 лет с заболеваниями внутренних органов (хронические заболевания сердечно-сосудистой системы, хронические бронхолегочные заболевания, сахарный диабет, алкоголизм, хронические заболевания печени);
— лицам в возрасте от 2 до 64 лет с функциональной или органической
аспленией
(с серповидноклеточной анемией, после спленэктомии);
— лицам от 2 лет с иммунодефицитными состояниями.
Введение гриппозной вакцины эффективно для предупреждения развития гриппа и его осложнений (в том числе пневмонии) у здоровых лиц моложе 65 лет. У лиц в возрасте 65 лет и старше вакцинация умеренно эффективна.
Информация
Источники и литература
-
Полный справочник практикующего врача /под редакцией Воробьева А.И., 10 издание, 2010
- стр. 183-187
-
Российский терапевтический справочник /под редакцией акад.РАМН Чучалина А.Г., 2007
- стр. 96-100
-
www.monomed.ru
- Электронный медицинский справочник
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
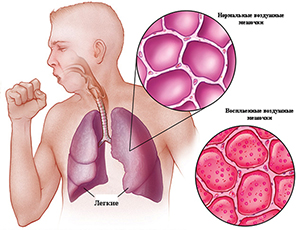
Пневмония относится к числу наиболее распространенных острых заболеваний, это — группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации.
Внебольничная пневмония (синонимы: домашняя, амбулаторная) — это острое заболевание, возникшее во внебольничных условиях, сопровождающееся симптомами инфекции нижних дыхательных путей (температура, кашель, боли в груди, одышка) и «свежими» очагово-инфильтративными изменениями в легких при отсутствии очевидной диагностической альтернативы.
Причинами развития воспалительной реакции в респираторных отделах легких могут быть как снижение эффективности защитных механизмов организма, так и массивность дозы микроорганизмов и/или их повышенная вирулентность. Аспирация содержимого ротоглотки — основной путь инфицирования респираторных отделов легких, а значит и основной патогенетический механизм развития пневмонии. В нормальных условиях ряд микроорганизмов, например Streptococcus pneumoniae, могут колонизировать ротоглотку, но нижние дыхательные пути при этом остаются стерильными.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой, колонизующей верхние отделы дыхательных путей. Из многочисленных микроорганизмов лишь некоторые, обладающие повышенной вирулентностью, способны при попадании в нижние отделы дыхательных путей вызывать воспалительную реакцию.
Такими типичными возбудителями внебольничной пневмонии являются:
- Streptococcus pneumoniae;
- Haemophilus influenzae.
Определенное значение в этиологии внебольничной пневмонии имеют атипичные микроорганизмы, хотя точно установить их этиологическую значимость сложно:
- Chlamydophila (Chlamydia) pneumoniae;
- Mycoplazma pneumoniae;
- Legionella pneumophila.
К типичным, но редким возбудителям внебольничной пневмонии относятся:
- Staphylococcus aureus;
- Klebsiella pneumoniae, реже другие энтеробактерии;
- Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп.
Препаратами выбора при лечении пневмококковой пневмонии являются беталактамные антибиотики — бензилпенициллин, аминопенициллины, в том числе защищенные; цефалоспорины II-III поколения. Также высокоэффективны новые фторхинолоны (левофлоксацин, моксифлоксацин).
Достаточно высокой антипневмококковой активностью и клинической эффективностью обладают макролидные антибиотики (эритромицин, рокситромицин, кларитромицин, азитромицин, спирамицин, мидекамицин, ) и линкозамиды. Но все же макролидные антибиотики при этой пневмонии являются резервными средствами при непереносимости бета-лактамов.
Haemophilus influenzae — клинически значимый возбудитель пневмонии, особенно у курильщиков и больных ХОБЛ (хроническая обструктивная болезнь легких). Высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины (амоксициллин), «защищенные» аминопенициллины (амоксициллин/ клавуланат), цефалоспорины II-IV поколений, карбапенемы, фторхинолоны (ранние — ципрофлоксацин, офлоксацин и новые — левофлоксацин, моксифлоксацин, гатифлоксацин).
Chlamydophila (Chlamydia) pneumoniae и Mycoplazma pneumoniae — обычно характеризуются нетяжелым течением. Микоплазменные пневмонии — чаще встречается у лиц моложе 40 лет. Средствами выбора для лечения этих пневмоний являются макролиды и доксициклин. Также высокоэффективны новые фторхинолоны.
Legionella pneumophila — обычно характеризуется тяжелым течением. Препаратом выбора для лечения легионеллезной пневмонии являются макролидные антибиотики (эритромицин, кларитромицин, азитромицин). Высокоэффективны также ранние и новые фторхинолоны.
Staphylococcus aureus — нечастый возбудитель внебольничной пневмонии, однако его значение возрастает у пожилых людей, у лиц принимающих наркотики, злоупотребляющих алкоголем, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также эффективны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae и другие энтеробактерии — очень редкие возбудители внебольничной пневмонии, имеют этиологическое значение лишь у некоторых категорий пациентов (пожилой возраст, сахарный диабет, застойная сердечная недостаточность, цирроз печени). Наиболее высокой природной активностью в отношении этих возбудителей обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Подозрение на пневмонию должно возникать при наличии у больного лихорадки в сочетании с жалобами на кашель, одышку, отделение мокроты и/или боли в груди. Больные часто жалуются на немотивированную слабость, утомляемость, сильное потоотделение, особенно по ночам.
Такие признаки пневмонии, как остролихорадочное начало, боли в груди и.т.д. могут отсутствовать — особенно у ослабленных больных и лиц пожилого возраста.
При указании на легионеллезную пневмонию длительность антибактериальной терапии составляет 21 день. При внебольничной пневмонии крайне важным является проведение быстрой оценки тяжести состояния больных с целью выделения пациентов, требующих проведения неотложной интенсивной терапии. Выделение больных с тяжелой пневмонией в отдельную группу представляется крайне важным, учитывая высокий уровень летальности, наличие, как правило, у пациентов тяжелой фоновой патологии, особенности этиологии заболевания и особые требования к антибактериальной терапии.
Поздняя диагностика и задержка с началом антибактериальной терапии (более 8 часов) обусловливает худший прогноз заболевания.
К сожалению, пневмония может иметь различные осложнения, такие как:
- плевральный выпот;
- эмпиема плевры (скопление гноя в плевральной полости);
- деструкция/абсцедирование легочной ткани (формирование ограниченных полостей в легочной ткани);
- острая дыхательная недостаточность;
- инфекционно-токсический шок;
- сепсис;
- перикардит, миокардит (заболевания сердца);
- нефрит (заболевание почек) и другие.
При пневмонии нужно проводить дифференциальный диагноз с такими заболеваниями как:
- туберкулез легких;
- новообразования (первичный рак легкого, эндобронхиальные метастазы, аденома бронха, лимфома);
- тромбоэмболия легочной артерии и инфаркт легкого;
- иммунопатологические заболевания (идиопатический легочный фиброз, эозинофильная пневмония, бронхоцентрический гранулематоз, облитерирующий бронхиолит с организующейся пневмонией, аллергический бронхолегочный аспергиллез, волчаночный пневмонит, системные васкулиты);
- прочие заболевания/патологические состояния (застойная сердечная недостаточность, лекарственная (токсическая) пневмопатия, аспирация инородного тела, саркоидоз, легочный альвеолярный протеиноз; липоидная пневмония, округлый ателектаз).
В заключении надо сказать, что поставить диагноз, определить степень тяжести заболевания и прогноз может только врач. При наличии у больного повышенной температуры тела, сухого кашля или кашля с отделением мокроты, одышки, боли в груди, немотивированной слабости, утомляемости, сильном потоотделении, особенно по ночам, обратитесь к врачу-терапевту.
Собственная лаборатория и инструментальная база «СМ-Клиника» позволяет быстро провести диагностику и поставить диагноз пневмонии. Вам будет назначено своевременное лечение пневмонии, индивидуальное для каждого, с учетом тяжести заболевания, возраста, сопутствующих заболеваний. Врач-терапевт поможет Вам снова стать здоровым.
Внебольничная пневмония – инфекционное заболевание, которое характеризуется воспалительным процессом в лёгких. Заболевание чаще всего развивается во время эпидемий гриппа и острых респираторно-вирусных инфекций. Пациентов с легким течением воспаления легких можно лечить амбулаторно. При средней и тяжелой степени пневмонии их госпитализируют в клинику терапии.
Причины внебольничной пневмонии
Внебольничные пневмонии условно разделяют на 3 группы:
- воспаление лёгких, не требующее госпитализации;
- пневмонии, требующие госпитализации больных в стационар;
- пневмонии, требующие госпитализации пациентов в отделения интенсивной терапии.
В зависимости от особенностей инфицирования различают следующие формы воспаления легких:
- Внебольничная пневмония (развивается вне лечебного учреждения);
- Внутригоспитальная пневмония (возникает спустя 48 часов после поступления в стационар при отсутствии инфекционного заболевания в инкубационном периоде на момент госпитализации);
- Аспирационная пневмония (развивается у лиц с тяжелыми нарушениями иммунитета).
Виды внебольничных пневмоний
В зависимости от типа возбудителя, вызвавшего патологический процесс, различают следующие виды внебольничной пневмонии:
- Бактериальную – воспаление дыхательных путей вызывает пневмококк (бактерия пневмонии), стафилококки, гемофильная палочка, хламидии, микоплазмы;
- Вирусную – возникает под воздействием вируса гриппа, парагриппа, аденовирусов, риновирусов, респираторно-синцитиальные вирусов, возбудителей кори, коклюша, краснухи, вируса эпштейна-барр, цитомегаловирусной инфекции;
- Грибковую – вызывают грибки рода кандида, аспергилл;
- Пневмонию, вызванную простейшими микроорганизмами.
- Смешанная пневмония является одним из сложных видов воспаления лёгких. Её вызывают ассоциации различных микроорганизмов.
- Внегоспитальная пневмония появляется и развивается в домашних условиях. О госпитальной пневмонии говорят в том случае, когда воспаление лёгких развилось у пациента, который пребывает в стационаре не менее 48 часов.
По локализации бактериальная пневмония может быть правосторонней, левосторонней, или двухсторонней. При очаговом воспалении поражается небольшой участок легкого. Сливная бактериальная пневмония характеризуется объединением нескольких мелких очагов в крупные. Долевая пневмония характеризуется бактериальным воспалением одной доли легкого, при сегментарной пневмонии воспалительный процесс находится в пределах одного или нескольких сегментов. Воспалительный процесс может локализоваться в сегменте или доле легкого. Очаговая пневмония часто развивается на фоне болезней дыхательных путей.
При сегментарной пневмонии происходит воспаление бронхолегочного сегмента. Этот вид пневмонии начинается выраженными клиническими проявлениями: высокой температурой тела, сильной лихорадкой, кашлем, выраженной интоксикацией организма, болью в области грудной клетки и живота.
Долевая пневмония может быть верхнедолевой, центральной и нижнедолевой. Наиболее тяжелое течение заболевания при верхнедолевой пневмонии. Долевая пневмония характеризуется острым началом заболевания, сильным ознобом, высокой температурой, лихорадкой, головной болью, потливостью, одышкой, сильным кашлем, болью в области груди со стороны пораженного органа дыхания.
Кашель в начальной стадии заболевания сухой, с развитием воспалительного процесса усиливается выделение мокроты, которая приобретает вязкую слизистую консистенцию, может иметь примесь крови. При тяжелом течении заболевания развивается острая дыхательная недостаточность, интоксикация организма, цианоз носогубного треугольника.
Симптомы и диагностика внебольничной пневмонии
Воспаление лёгких (внебольничная пневмония) проявляется такими клиническими симптомами, как слабость, утомляемость, тошнота, отсутствие аппетита, нарушение сознания. Пациентов беспокоит кашель с выделением мокроты, боль в грудной клетке.
- Внебольничная пневмония проявляется следующими основными симптомами:
- Кашлевыми позывами и расслаблением дыхательных путей;
- Повышением температуры тела;
- Выделением мокроты различной интенсивности;
- Болезненными ощущениями в области грудины;
- Общей слабостью;
- Повышением потоотделения, преимущественно в ночные часы.
Внебольничная полисегментарная пневмония отличается более острым течением, чем очаговая, продолжительным инкубационным периодом. Данная форма заболевания требует незамедлительного лечения, так как осложняется развитием дыхательной недостаточности.
При осмотре пациента врач может выявить цианоз, отставание одной половины грудной клетки во время дыхания. Во время перкуссии определяется укорочение звука над очагом поражения. При аускультации выслушивается ослабленное или бронхиальное дыхание, крепитация, сухие или влажные хрипы.
Диагноз пневмонии считается установленным, если у пациента на фоне выявления на рентгенограмме инфильтрата в легочной ткани имеется не менее двух клинических признаков:
- острое начало заболевания с высокой температурой тела;
- кашель с отделением мокроты;
- физикальные признаки уплотнения легочной ткани;
- лейкоцитоз.
Особенности клинического течения
Симптомы и лечение бактериальной пневмонии находятся в прямой зависимости от возбудителя воспаления лёгких. Клиническая картина пневмококковой пневмонии складывается из следующих синдромов:
- Интоксикационного;
- Общевоспалительного;
- Бронхолегочного;
- Плеврального.
Воспаление лёгких, обусловленное пневмококковой инфекцией, обычно протекает в виде крупозной и очаговой пневмонии. Крупозная бактериальная пневмония начинается остро, с внезапного повышения температуры тела до 38-40°С, потрясающего озноба, лихорадочного румянца на щеках. Выражены признаки интоксикации: слабость, боль в мышцах, головная боль, потеря аппетита. Учащается сердцебиение, появляется одышка.
Пациенты отмечают боль в груди на стороне поражения при кашле и дыхании. Кашель сначала сухой, а затем становится влажным, с отделением коричневой мокроты. Крупозная пневмония характеризуется тяжелым течением. Часто встречаются следующие осложнения:
- Острая дыхательная недостаточность;
- Плеврит;
- Абсцесс лёгкого;
- Эмпиема плевры.
- Реже развиваются внелегочные и генерализованные осложнения: эндокардит, менингит, нефрит, сепсис.
Началу очаговой пневмококковой пневмонии предшествует острое респираторное вирусное заболевание. Сохраняется высокая утомляемость, общая слабость, сильная потливость. Симптоматика выражена слабее, чем при крупозном воспалении легких. Лихорадка не высокая и менее продолжительная, кашель умеренный и не столь болезненный. Течение очаговой бактериальной пневмонии обычно среднетяжелое, редко возникают осложнения.
Для стафилококковой пневмонии характерны деструктивные поражения легких с образованием отдельных полостей. Различают следующие формы стафилококкового воспаления лёгких:
- Первичное (бронхогенное);
- Лёгочно-плевральное;
- Абсцедирующее;
- Инфильтративно-буллезное;
- Метастатическую деструкцию легких.
Заболевание начинается остро, с повышения температуры тела до высоких цифр. Пациентов беспокоит озноб, кашель с выделением гнойной или кровянистой мокроты, боль в грудной клетке. Появляется цианоз и одышка.
В зависимости от возраста пациента причиной воспаления легких могут быть различные возбудители:
- У малышей до полугода наиболее частой причиной развития пневмонии становится заражение пневмококком, реже смешанные инфекции – пневмококки и гемофильная палочка. Очень редко развиваются атипичные пневмонии, вызываемые нетипичным возбудителем и отличающиеся течением заболевания;
- У детей школьного возраста наиболее часто развивается атипичная пневмония, вызванная хламидиями, микоплазмами. Реже встречается пневмония пневмококковая. Вирусная пневмония на фоне гриппа чаще диагностируется у детей;
- У взрослых пациентов заболевание вызывается различными бактериальными возбудителями, реже встречается вирусная пневмония.
- Предрасположенностью к заболеванию страдают люди с ослабленным иммунитетом, часто переутомляющиеся, подвергаемые стрессу, находящиеся в состоянии депрессии, болезненные, плохо питающиеся.
Клиническая картина пневмонии зависит от уровня поражения легкого и распространенности патологического процесса. Наиболее часто врачи сталкиваются с очаговыми пневмониями. Они начинаются постепенно, в течение 3-5 дней. Вначале появляются следующие симптомы:
- Малопродуктивный кашель;
- Выраженная общая слабость;
- Головная боль;
- Повышение температуры до субфебрильных цифр;
- Потливость;
- Разбитость в теле;
- Боли в грудной клетке, связанные с дыханием.
При осмотре терапевты выявляют достаточно скудные физикальные данные. Кожа приобретает бледно-серый оттенок, становится влажной. При пальпации над очагом поражения может определяться усиление голосового дрожания, а при перкуссии – притупление легочного звука.
Особенности иммунной системы при воспалении легких
Организм человека более устойчив к внешним раздражителям при условии нормально функционирующей иммунной системы. Иммунная система является защитным барьером между организмом и чужеродными агентами извне. Несмотря на то, что ежедневно человек сталкивается с тысячей инфекционных агентов, лишь некоторые люди, контактирующие с ними, подвержены развитию заболеваний. К ним относятся:
- Люди пожилого возраста и дети до 3-х лет. У этих категорий людей развитие пневмонии обусловлено физиологическим снижением иммунитета;
- Пациенты с врожденными заболеваниями (синдромом Ди Джорджи, болезнью Брутона, гипогаммаглобулинемией, пороками сердца);
- Лица с вторичным иммунодефицитом (ВИЧ- инфекцией). Самые тяжелые атипичные виды пневмонии (микоплазменная, пневмоцистная) протекают у людей с этим диагнозом. Лечение может затянуться на месяц и более, а последствия могут быть неблагоприятными и абсолютно непредвиденными;
- Неблагополучные слои населения. Люди этого класса предрасположены к болезни в связи с неудовлетворительными условиями проживания, отсутствием сбалансированного питания и средств на лечение недуга.
Группы пациентов, страдающих внебольничной пневмонией
Выделяют 4 группы пациентов с пневмонией. К первой группе относятся больные с легким течением заболевания, не требующие госпитализации, не имеющие сопутствующих заболеваний, не принимавшие ранее антибиотики. У них возбудителями заболевания являются пневмококк, микоплазма, клостридии, гемофильная палочка и респираторные вирусы.
Ко второй группе относятся пациенты с легким течением воспаления лёгких, не требующие госпитализации, имеющие сопутствующую патологию (застойную сердечную недостаточность, хроническую обструктивную болезнь лёгких, сахарный диабет, диффузные заболевания печени или почек с нарушением функции, психические расстройства, хронический алкоголизм, опухоли) и принимающие антибиотики в течение последних трёх месяцев. У данной группы пациентов пневмонию преимущественно вызывают антибиотикоустойчивые штаммы пневмококков, гемофильная палочка, золотистый стафилококк.
Пациентов ІІІ группы с воспалением лёгких средней степени тяжести госпитализируют в клинику терапии. Пневмония у них обусловлена пневмококком, гемофильной палочкой, атипичными возбудителями или смешанной микрофлорой.
К четвёртой группе относятся больные тяжёлой пневмонией. Их госпитализируют в отделение реанимации и интенсивной терапии. Спектр микробной флоры у пациентов включает пневмококк, гемофильную палочку, золотистый стафилококк, микоплазму пневмонии.
Пневмония без лечения антибактериальными препаратами заканчивается осложнениями. Антибиотики назначают сразу же после установки диагноза, не дожидаясь результатов бактериологического исследования. Антибактериальный препарат выбирают эмпирическим путём, основываясь на данных физикального и рентгенологического обследования. Для пациентов І группы достаточным является приём антибиотиков через рот. Им проводят монотерапию аминопенициллинами или макролидами. При невозможности применения амоксициллина или макролидов назначают альтернативные антибиотики – фторхинолоны III–IV поколения. При неэффективности амоксициллина в качестве резервного препарата применяют макролид или доксициклин. В случае малой эффективности макролида в качестве стартовой терапии используют амоксициллин или фторхинолоны III–IV поколения. Если установлена микоплазменная или хламидийная природа заболевания препаратами выбора являются макролидные антибиотики (Сумамед).
Пациентам второй группы также назначают антибиотики для приёма внутрь:
- Защищённый аминопенициллин (амоксициллин клавуланат);
- Цефалоспорин II поколения (цефуроксим аксетил);
- Фторхинолоны III–IV поколения.
Если у пациента нарушено всасывание препарата в желудочно-кишечном тракте, антибиотики вводят внутривенно или внутримышечно.
Оценку эффективности терапии антибиотиками первого ряда проводят через 48-72 часа. При позитивной динамике заболевания назначенную антибактериальную терапию продолжают. Наличие отрицательной динамики или отсутствие улучшения является основанием считать лечение неэффективным.
Лечение пациентов третьей группы проводят в клинике терапии. Им назначают комбинированную антибиотикотерапию, состоящую из парентерального введения, бета-лактамов в комбинации с макролидом. У большинства пациентов при отсутствии нарушения всасывания в пищеварительном тракте макролидный антибиотик применяют перорально. При отсутствии клинического эффекта бета-лактамный антибиотик заменяют фторхинолоном III–IV поколения или карбапенемом.
Лечение больных IV группы проводят в отделении реанимации и интенсивной терапии. Если у пациента отсутствуют факторы риска инфицирования синегнойной палочкой, назначают защищённые аминопенициллины или цефалоспорины III поколения в комбинации с макролидным препаратом. На первом этапе лечения антибиотики вводят внутримышечно или внутривенно. После стабилизации состояния пациентам эти же препараты назначают внутрь. Продолжительность терапии в этой группе составляет 7-14 дней.
Лечение и профилактика внебольничной пневмонии
Большая часть пациентов имеющих признаки внебольничной пневмонии может лечиться в амбулаторных условиях. Антибиотик выбирают эмпирически, до получения результатов микробиологического исследования, поскольку любая задержка антибактериальной терапии пневмоний сопровождается повышенным риском развития осложнений.
Выбор стартовой терапии зависит от тяжести заболевания и клинических признаков воспаления лёгких. Для лечения лёгкой формы пневмонии в амбулаторных условиях врачи назначают пероральный амоксициллин и амоксициллина клавуланат. При подозрении на пневмонию, вызванную атипичными возбудителями, используют пероральные макролиды или респираторные фторхинолоны (левофлоксацин, моксифлоксацин).
В клинике терапии пульмонологи назначают комплексное лечение внебольничной пневмонии. Показаниями к парентеральной антибактериальной терапии являются:
- нарушение сознания;
- тяжёлая пневмония;
- нарушение глотательного рефлекса;
- функциональные или анатомические причины нарушенного всасывания.
При нетяжелой пневмонии врачи используют амоксициллина клавуланат, ампициллин, парентеральные цефалоспорины II и III поколений. Альтернативными препаратами являются внутривенные макролиды и респираторные фторхинолоны. При подозрении на аспирационную пневмонию назначают амоксициллина клавуланат или комбинацию b-лактамов с клиндамицином или метронидазолом.
При тяжёлой пневмонии применяют комбинацию цефалоспоринов III поколения и макролидов. Альтернативным режимом является сочетание фторхинолонов с цефалоспоринами III поколения. После получения адекватного ответа на парентеральное введение антибактериальных препаратов переходят на пероральные антибиотики.
Продолжительность антибиотикотерапии
Протокол лечения пневмонии у взрослых определяет критерии эффективности и продолжительность лечения антибиотиками. Лечение считается эффективным, если в течение 48-72 часов снижается температура тела, уменьшается интоксикация и дыхательная недостаточность. При тяжёлом течении пневмонии в случае положительной динамики лечение антибиотиками завершают в течение 7-10 дней. Пациентам с тяжелым течением воспаления лёгких антибактериальные препараты вводят не менее 10 дней. Если есть доказательства, что возбудителем пневмонии является микоплазма или хламидии, антибактериальную терапию проводят в течение 14 дней.
Согласно протоколам лечения пневмонии, у взрослых критериями эффективности антибиотикотерапии являются:
- Отсутствие интоксикации;
- Температура тела ниже 37,5оС;
- Отсутствие гнойной мокроты;
- Количество лейкоцитов в периферической крови меньше 10×109/л;
- Отсутствие отрицательной динамики на рентгенограммах.
Патогенетическая и симптоматическая терапия
Пневмония часто развивается на фоне выраженного иммунодефицита. Реактивность организма снижают некоторые антибиотики. Пациентам с тяжелым и затяжным течением пневмонии пульмонологи Юсуповской больницы назначают препараты иммуномодулирующего действия:
- Интерферон;
- Левамизол;
- Зимозан;
- Т-активин.
Больным вирусной пневмонией вводят противогриппозный γ-глобулин, назначают противовирусные препараты. Пациенты могут делать ингаляции фитонцидов (сок чеснока или лука готовят непосредственно перед процедурой и разбавляют изотоническим раствором хлорида натрия).
Для восстановления бронхиальной проходимости применяют средства, разжижающие бронхиальный секрет (внутрь N-ацетилцистеин, амброксол, бромгексин) и бронхолитические препараты. Бронхолитики вводят с помощью ультразвуковых ингаляторов (небулайзеров). При затяжном течении воспаления лёгких восстанавливают бронхиальный дренаж с помощью бронхоскопической санации.
Симптоматическая терапия при пневмонии заключается в назначении следующих лекарственных средств:
- Противокашлевых препаратов (кодеина, либексина, тусупрекс, стоптуссина);
- Отхаркивающих средств (настоя травы термопсиса, корня алтея);
- Муколитических препаратов (мукалтина, лазолвана, флуимуцила).
В случае плохой переносимости высокой температуры тела назначают жаропонижающие средства (анальгин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты). Больным с сопутствующей патологией сердечно-сосудистой системы делают инъекции сульфокамфокаина, кордиамина, а при сердечной недостаточности применяют сердечные гликозиды.
В случае деструкции легочного инфильтрата и выраженной интоксикации проводят дезинтоксикационную терапию (внутривенно вводят реополиглюкин, гемодез и другие растворы).
Внебольничная пневмония у детей
Внебольничные пневмонии часто встречаются в педиатрической практике. Воспаление лёгких у детей вызывают бактерии, вирусы, грибы, паразиты. Довольно часто в мокроте встречается смешанная микрофлора. По распространённости патологического процесса различают очаговую, очагово-сливную, сегментарную, полисегментарную, долевую и интерстициальную пневмонию.
Наиболее частыми симптомами пневмонии у детей является повышение температуры тела, озноб, потеря аппетита, кашель, учащение или нарушение дыхания. Иногда детей беспокоит боль в грудной клетке, возникает рвота.
В анализе крови определяется выраженный лейкоцитоз и высокая скорость оседания эритроцитов. На рентгенограмме видна однородная инфильтрация. Для пневмококковой пневмонии характерна гомогенная тень, имеющая четкие границы, а при воспалении легких, вызванном микоплазмой, тень неоднородная, без чётких границ.
Лечение внебольничной пневмонии у большинства детей может быть организовано дома. Показаниями для госпитализации являются:
- возраст до 6 месяцев;
- тяжелое течение внебольничной пневмонии;
- наличие тяжелых фоновых заболеваний;
- отсутствие условий для лечения на дому;
- отсутствие положительной динамики в течение 48 часов антибактериальной терапии.
Выбор антибактериальной терапии проводится индивидуально. После установки диагноза врачи назначают наиболее эффективные и безопасные антибиотики в возрастных дозах.
Последствия внебольничной пневмонии
Пневмония может вызывать осложнения со стороны органов дыхания и внелегочной локализации. К легочным последствиям пневмонии относят:
- Плевриты;
- Кровотечения;
- Гангрена и абсцесс лёгкого;
- Дыхательная недостаточность;
- Бронхообструктивный синдром.
К внелегочным последствиям пневмонии относятся патология сердечно-сосудистой системы, синдром диссеминированного внутрисосудистого свертывания, инфекционно-токсический шок, менингит, энцефалит, отклонения в психическом здоровье. Наиболее тяжелым осложнением пневмонии является сепсис.
Причины неблагоприятных последствий
Неблагоприятные последствия пневмонии чаще развиваются у пациентов, которые поздно обратились в больницу или имеют сопутствующие заболевания. Наиболее часто осложнения воспаления лёгких развиваются у людей следующих категорий:
- Детей;
- Лиц пожилого и преклонного возраста;
- Пациентов с иммунодефицитными состояниями, в том числе ВИЧ-инфицированных;
- Лиц без определённого места жительства;
- Больных сахарным диабетом, бронхиальной астмой, пороками сердца;
- Людей, которые не имеют возможности самостоятельно передвигаться.
Неблагоприятные последствия воспаления легких могут быть после тотальной пневмонии.
Лечение и профилактика последствий
Лечение пациентов с осложнениями пневмонии врачи Юсуповской больницы проводят, придерживаясь федеральных и европейских рекомендаций. Стартовую антибактериальную терапию пневмонии начинают сразу же после установки диагноза. Для лечения пациентов, которые входят в группу риска развития осложнений, применяют новейшие антибиотики, к которым чувствительны возбудители пневмонии. Если в течение 3-4 дней не наблюдается положительной динамики, схему лечения антибиотиками меняют. Антибактериальные препараты вводят внутримышечно и внутривенно капельно или струйно.
Внебольничная пневмония – это серьезное заболевание, которое ежегодно уносит жизни тысяч людей, по большей части вследствие несвоевременного обращения к специалисту или несоблюдения прописанных врачом правил. Важно не пренебрегать своим здоровьем, а найти доктора, которому можно доверить его без страха за свою жизнь. Врачи Юсуповской больницы помогут пациенту побороть болезнь и приложат все силы, для того чтобы процесс выздоровления прошел в краткие сроки и без осложнений. Записаться на консультацию возможно онлайн или позвонив по номеру телефона контакт-центра.

Клинические рекомендации
Внебольничная пневмония
ПРОЕКТ
МКБ 10: J13-J18
Год утверждения клинических рекомендаций (частота пересмотра):
2018 (пересмотр каждые 3 года)
ID
URL
Профессиональные ассоциации:
-
Российское респираторное общество
-
Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии
Согласованы
-
Научным советом Министерства Здравоохранения Российской Федерации
___ _______201_ г.
Список сокращений
АБП — антибактериальный препарат
АБР — антибиотикорезистентность
АМП — антимикробный препарат
АПС — активированный протеин С
БА — бронхиальная астма
БАЛ — бронхо-альвеолярный лаваж
БЛРС — бета-лактамазы расширенного спектра
ВП — внебольничная пневмония
ГКС — глюкокортикостероиды
ГКСФ — гранулоцит-колониестимулирующий фактор
ГМКСФ — гранулоцит-макрофаг-колониестимулирующий фактор
ИВЛ — искусственная вентиляция легких
ДН — дыхательная недостаточность
ИГ — иммуноглобулин
ИЛ — интерлейкин
ИТФ — ингибитор тканевого фактора
КТ — компьютерная томография
ЛС — лекарственное средство
МПК — минимальная подавляющая концентрация
НА — норадреналин
НВЛ — неинвазивная вентиляция легких
НЛР — нежелательная лекарственная реакция
ОРДСВ — острый респираторный дистресс-синдром взрослых
ОРИТ — отделение реанимации и интенсивной терапии
ПОН — полиорганная недостаточность
ПРП — пенициллинорезистентный S. pneumoniae
ПЧП — пенициллин-чувствительный S. pneumoniae
ПЦР — полимеразная цепная реакция
РКИ — рандомизированное клиническое исследование
ЛПУ — лечебно-профилактическое учреждение
СВР — системная воспалительная реакция
СД — сахарный диабет
СВР — системная воспалительная реакция
СШ — септический шок
ТЭЛА — тромбоэмболия легочной артерии
УЗИ — ультразвуковое исследование
ФНО — фактор некроза опухоли
ХОБЛ — хроническая обструктивная болезнь легких
ХСН — хроническая сердечная недостаточность
ЭКМО — экстракорпоральная мембранная оксигенация
B.cepacia — Burkholderia cepacia
B.pertussis — Bordetella pertussis
C.pneumoniae — Chlamydophila pneumoniae
С.burnetii — Coxiella burnetii
C.psittaci — Chlamydophila psittaci
Candida spp. — род Candida
CLSI — Институт клинических и лабораторных стандартов США
E.coli — Escherichia coli
Enterobacterales — семейство Enterobacterales
Enterococcus spp. — род Enterococcus
H.influenzae — Haemophilus influenzae
K.pneumoniae — Klebsiella pneumoniae
L.pneumophila — Legionella pneumophila
Legionella spp. — род Legionella
M.pneumoniae — Mycoplasma pneumoniae
M.catarrhalis — Moraxella catarrhalis
MRSA — метициллинорезистентный Staphylococcus aureus
MSSA — метициллин-чувствительный Staphylococcus aureus
Neisseria spp. — род Neisseria
P.aeruginosa — Pseudomonas aeruginosa
PEEP — положительное давление на выдохе
S.aureus — Staphylococcus aureus
S.pneumoniae — Streptococcus pneumoniae
Staphylococcus spp. — род Staphylococcus
1.Краткая информация
1.1.Определение
Пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации []. Пневмонии четко обособлены от других очаговых воспалительных заболеваний легких неинфекционного происхождения, вызываемых физическими (лучевой пневмонит) или химическими факторами, имеющих аллергическое (эозинофильная пневмония) или сосудистое (инфаркт легкого) происхождение.
Наиболее важный с клинической точки зрения принцип предусматривает подразделение пневмонии на внебольничную (ВП) и нозокомиальную (НП). Внебольничной считают пневмонию, развившуюся вне стационара, либо диагности- рованную в первые 48 ч с момента госпитализации [].
В некоторых странах в отдельную группу выделяют пневмонии, связанные с оказанием медицинской помощи. К данной группе относят случаи развития заболевания у обитателей домов престарелых и других учреждений длительного ухода, при наличии госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, пациентов, получавших в/в инфузионную терапию (в том числе системными антибиотиками), подвергавшихся сеансам диализа или лечению ран в домашних условиях впредшествующие 30 дней []. Предположение о том, что такие пациенты отличаются высоким риском инфицирования полирезистеными бактериальными возбудителями (ПРВ) и, соответственно, должны лечиться как лица с НП, не нашло четкого подтверждения в современных исследованиях []. В связи с этим российские эксперты на данном этапе считают нецелесообразным внедрение отдельного термина “пневмония, связанная с оказанием медицинской помощи” в клиническую практику. Лечение данной группы пациентов осуществляется в соответствии с клиническими рекомендациями по ВП, а указанные выше факторы, наряду с другими, учитываются при выборе режима антибактериальной терапии (АБТ).
ВП у пациентов с выраженной иммуносупрессией, включая лиц с ВИЧ-инфекцией, врожденными иммунодефицитами, получающих химиотерапию и/или иммунодепрес- санты, реципиентов трансплантатов донорских органов и тканей отличаются от общей популяции по этиологии, характеру течения и прогнозу и не рассматриваются в рамках настоящих рекомендаций.
1.2.Этиология и патогенез
1.2.1.Этиология
Перечень потенциальных возбудителей ВП включает более 100 микроорганизмов (бактерии, вирусы, грибы, простейшие). Однако большинство случаев заболевания ассоциируется с относительно небольшим кругом патогенов, к которым относят S. pneumoniae, M. pneumoniae, C. pneumoniae, _H. influenzae,_ респираторные вирусы, энтеробактерии, S. aureus и L. pneumophila [].
S. pneumoniae – самый частый возбудитель, на его долю приходится до 30-50% случаев ВП установленной этиологии – таблица 1. При нетяжелом течении ВП актуальными являются M. pneumoniae и C. pneumoniae — их доля в этиологической структуре суммарно достигает 20-30%. Нетипируемая H. influenzae чаще вызывает ВП у пациентов с сопутствующей хронической обструктивной болезнью легких (ХОБЛ); K. pneumoniae и E. coli (реже других представителей семейства Enterobacterales) выявляют преимущественно у лиц с хроническими сопутствующими заболеваниями, такими как сахарный диабет (СД), хроническая сердечная недостаточность (ХСН), алкоголизм, цирроз печени и тяжелой ВП [].
S. aureus чаще ассоциируется с развитием ВП у лиц пожилого возраста, в/в наркоманов, на фоне или после перенесенного гриппа; P. aeruginosa – с муковисцидозом, бронхоэктазами, применением системных глюкокортикостероидов (ГКС) в фармакодинамических дозах, предшествующей длительной АБТ [].
Удельный вес L. pneumophila, очевидно, является невысоким в общей популяции в РФ, однако значимость данного возбудителя существенно увеличивается при тяжелой ВП и наличии определенных факторов риска – таблица 2.
Вероятность инфицирования анаэробами может возрастать у лиц с доказанной или предполагаемой аспирацией, обусловленной эпизодами нарушения сознания при судорогах, некоторых неврологических заболеваниях (например, инсульт), дисфагии, алкоголизме [].
Частота встречаемости других бактериальных возбудителей — C. psittaci, S. pyogenes, B. pertussis и др. обычно не превышает 2-3%, а поражения легких, вызванные эндемичными микромицетами в России встречаются чрезвычайно редко [].
ВП помимо бактериальных возбудителей могут вызывать респираторные вирусы, наиболее часто вирусы гриппа, коронавирусы, риносинцитиальный вирус (РС вирус), метапневмовирус человека, бокавирус человека []. Частота выявления респираторных вирусов у пациентов с ВП носит выраженный сезонный характер и возрастает в холодное время года. Различают первичную вирусную пневмонию (развивается в результате непосредственного вирусного поражения легких) и вторичную бактериальную пневмонию, которая может сочетаться с первичным вирусным поражением легких или быть самостоятельным поздним осложнением респираторной вирусной инфекции (в первую очередь гриппа).
Вбольшинстве случаев ВП, вызываемые респираторными вирусами, характеризуются нетяжелым течением, однако у лиц пожилого и старческого возраста, при наличии сопутствующих бронхолегочных, сердечно-сосудистых заболеваний или иммунодефицита они могут ассоциироваться с развитием тяжелых, угрожающих жизни осложнений [].
У 10-30% пациентов с ВП выявляется смешанная или ко-инфекция, которая может быть вызвана ассоциацией различных бактериальных возбудителей (например, S. pneumoniae с H. influenzae или M. pneumoniae), либо их сочетанием с респираторными вирусами. По данным ряда исследований, ВП, вызванная ассоциацией возбудителей, имеет тенденцию к более тяжелому течению и худшему прогнозу [].
|
Частота выявления, % |
|||
|
Возбудитель |
Амбулаторно |
Стационар |
ОРИТ |
|
S.pneumoniae |
38 |
27 |
28 |
|
M.pneumoniae |
8 |
5 |
2 |
|
H.influenzae |
13 |
6 |
7 |
|
C.pneumoniae |
21 |
11 |
4 |
|
S.aureus |
1,5 |
3 |
9 |
|
Enterobacterales |
0 |
4 |
9 |
|
P.aeruginosa |
1 |
3 |
4 |
|
Legionella spp. |
0 |
5 |
12 |
|
C.burnetii |
1 |
4 |
7 |
|
Респираторные вирусы |
17 |
12 |
3 |
|
Не установлен |
50 |
41 |
45 |
Для некоторых микроорганизмов (S. viridans, S. epidermidis и другие коагулаза- негативные стафилококки, Enterococcus spp., Neisseria spp., Candida spp.) нехарактерно развитие бронхолегочного воспаления. Их выделение из мокроты с высокой степенью вероятности свидетельствует о контаминации материала микрофлорой верхних отделов дыхательных путей.
Необходимо отметить тот факт, что, несмотря на расширение возможностей для микробиологической диагностики, примерно у половины пациентов с ВП этиологический диагноз остается неустановленным.
| Заболевание/фактор риска | Вероятные возбудители |
|---|---|
|
ХОБЛ/курение |
H. influenzae, S. pneumoniae, |
|
Декомпенсированный СД |
S. pneumoniae, S. aureus, энтеробактерии |
|
Эпидемия гриппа |
Вирус гриппа, S. pneumoniae, S. aureus, H. influenzae |
|
Алкоголизм |
S. pneumoniae, анаэробы, энтеробактерии (чаще K. pneumoniae) |
|
Подтвержденная или предполагаемая аспирация |
Энтеробактерии, анаэробы |
|
Бронхоэктазы, муковисцидоз |
P. aeruginosa, B. cepacia, S. aureus |
|
Использование внутривенных наркотиков |
S. aureus, анаэробы, S. pneumoniae |
|
Контакт с кондиционерами, увлажнителями воздуха, системами охлаждения воды, недавнее (<2 нед) морское путешествие/проживание в гостинице |
Legionella spp. |
|
Тесный контакт с птицами |
С. psittaci |
|
Тесный контакт с домашними животными (например, работа на ферме) |
С. burnetii |
|
Коклюшеподобный кашель > 2 недель |
B. pertussis |
|
Локальная бронхиальная обструкция (например, бронхогенная карцинома) |
Анаэробы, S. pneumoniae, H. influenzae, S. aureus |
|
Пребывание в домах престарелых |
S. pneumoniae, энтеробактерии, H.influenzae, S. aureus, C. pneumoniae, анаэробы |
|
Вспышка в организованном коллективе |
S. pneumoniae, M. pneumoniae, C. pneumoniae, вирус гриппа |
1.2.2.Резистентность возбудителей к АМП
Сточки зрения выбора режимов эмпирической АБТ при ВП наибольшее клиническое значение представляет локальный мониторинг антибиотикорезистентности (АБР) S. pneumoniae и H. influenzae.
S. pneumoniae
Актуальной проблемой в мире является распространение среди пневмококков изолятов со сниженной чувствительностью к β-лактамным антибактериальным препаратам (АБП), в первую очередь пенициллинам, и рост устойчивости к макролидам. Данные мониторинга чувствительности клинических штаммов S. pneumoniae в РФ, выделенные у пациентов с внебольничными респираторными инфекциями в 2010-13 гг. представлены в таблице 3. Отличительной чертой РФ является высокий уровень резистентности S. pneumoniae к тетрациклинам и ко-тримоксазолу, что может быть связано с неоправданно высокой частотой их применения для лечения респираторных инфекций в XX-начале XXI вв. Уровень устойчивости пневмококков к пенициллину и аминопенициллинам остается относительно невысоким (4,7 и 1,4% нечувствительных изолятов, соответственно). Частота выявления S. pneumoniae, резистентных к цефтриаксону составляет 5,3%, а доля умеренно резистентных – 2,8%. Большинство пневмококков, включая пенициллинорезистентные (ПРП), сохраняют чувствительность к цефтаролину и карбапенемам, все – к линезолиду, ванкомицину, респираторным фторхинолонам –. Резистентность S. pneumoniae к различным макролидам и линкозамидам варьирует в пределах 18,2-27,4%; большинство макролидорезистентных пневмококков демонстрируют устойчивость к клиндамицину, что может свидетельствовать о преобладании в РФ MLSB-фенотипа резистентности, обусловленного модификацией мишени и определяющего устойчивость S. pneumoniae ко всем макролидам, включая 16-членные.
|
АБ препарат |
Распределение изолятов по категориям |
МПК, мг/л |
|||
|
Ч |
УР |
Р |
50% |
90% |
|
|
Бензилпенициллин |
95,3% |
4% |
0,7% |
0,03 |
1 |
|
Амоксициллин |
96,3% |
2,3% |
1,4% |
0,03 |
1 |
|
Цефтриаксон |
91,9% |
2,8% |
5,3% |
0,03 |
1 |
|
Цефтаролин |
99,8% |
-* |
-* |
0,008 |
0,125 |
|
Азитромицин |
72,6% |
2,1% |
25,3% |
0,06 |
128 |
|
Кларитромицин |
72,8% |
4,4% |
22,8% |
0,03 |
128 |
|
Клиндамицин |
81,8% |
0,9% |
17,2% |
0,03 |
32 |
|
Левофлоксацин |
100,0% |
0 |
0 |
0,5 |
1,0 |
|
Моксифлоксацин |
100,0% |
0 |
0 |
0,06 |
0,125 |
|
Тетрациклин |
65,3% |
2,6% |
32,1% |
0,125 |
16 |
|
Ко-тримоксазол |
46,7% |
24,2% |
29,1% |
1 |
8 |
|
Линезолид |
100,0% |
-* |
-* |
0,5 |
1 |
|
Ванкомицин |
100,0% |
-* |
-* |
0,25 |
0,25 |
|
Эртапенем |
99,1% |
0,9% |
0 |
0,015 |
0,5 |
Примечание: Ч – чувствительные, УР – умеренно резистентные, Р – резистентные (критерии CLSI, 2014 г.); * не применимо, нет критериев интерпретации
H. influenzae
Наибольшее клиническое значение в мире имеет рост устойчивости H. influenzae к аминопенициллинам, который чаще всего обусловлен продукцией β-лактамаз, гидролизующих данную группу АБП. Уровень устойчивости к аминопенициллинам среди клинических штаммов H. influenzae, выделенных в РФ у пациентов с внебольничными респираторными инфекциями остается относительно невысоким (10% нечувствительных изолятов). Цефалоспорины III поколения сохраняют активность в отношении большинства изолятов H. influenzae; не выявлено штаммов, устойчивых к фторхинолонам – таблица 4. Наиболее высокий уровень резистентности H. influenzae зарегистрирован к ко-тримоксазолу (33,6% нечувствительных изолятов).
|
АБ препарат |
Распределение изолятов по категориям |
МПК, мг/л |
|||
|
Ч |
УР |
Р |
50% |
90% |
|
|
Амоксициллин |
90% |
0 |
10% |
0,125 |
1,0 |
|
Амоксициллин/клавуланат |
99,1% |
0 |
0,9% |
0,25 |
0,5 |
|
Цефотаксим |
100% |
0 |
0 |
0,008 |
0,03 |
|
Левофлоксацин |
100,0% |
0 |
0 |
0,015 |
0,03 |
|
Моксифлоксацин |
100,0% |
0 |
0 |
0,015 |
0,125 |
|
Тетрациклин |
98,2% |
0 |
1,8% |
0,5 |
0,5 |
|
Ко-тримоксазол |
66,4% |
4,5% |
29,1% |
0,25 |
16,0 |
Примечание: Ч – чувствительные, УР – умеренно резистентные, Р – резистентные (критерии CLSI, 2014 г.)
Несмотря на общие тенденции, профиль устойчивости респираторных возбудителей может отличаться в отдельных регионах, поэтому при выборе препаратов наиболее целесообразно руководствоваться локальными данными резистентности микроорганизмов к АМП. Кроме того, необходимо учитывать индивидуальные факторы риска АБР.
Факторами риска выявления ПРП являются возраст старше 65 лет, недавняя (<3 мес.) терапия β-лактамными АМП, серьезные хронические сопутствующие заболевания, алкоголизм, иммунодецифит или иммуносупрессивная терапия, тесный контакт с детьми, посещающими дошкольные учреждения [].
Вероятность инфицирования макролидорезистентными S. pneumoniae возрастает у пожилых пациентов, при применении данной группы АМП в ближайшие 3 месяца, недавнем использовании пенициллинов или ко-тримоксазола, ВИЧ-инфекции, тесном контакте с лицами, колонизированными резистентными изолятами [].
Ключевым фактором риска выявления резистентных к фторхинолонам S. pneumoniae является их неоднократное использование в анамнезе [].
Проблемой, способной оказать существенное влияние на стратегию эмпирической АБТ тяжелой ВП, является распространение внебольничных метициллинорезистентных S. aureus (CA-MRSA), отличающихся высокой вирулентностью вследствие продукции лейкоцидина Пантона-Валентина []. Инфицирование CA-MRSA часто встречается у молодых ранее здоровых лиц, характеризуется развитием тяжелой некротизирующей пневмонии, серьезных осложнений (пневмоторакс, абсцессы, эмпиема плевры, лейкопения и др.) и высокой летальностью []. CA-MRSA устойчивы к большинству β-лактамов, но обычно сохраняют чувствительность к другим классам АБП (линкозамиды, фторхинолоны, ко-тримоксазол). В РФ описаны случаи носительства и развития пневмоний у детей, вызванных CA-MRSA []. Однако, масштаб проблемы, в том числе актуальность данного возбудителя для взрослых с ВП на данный момент окончательно не определена. Следует отметить, что в целом для РФ характерно распространение во внебольничных условиях не CA-MRSA, а типичных нозокомиальных штаммов MRSA []. Факторами риска инфицирования MRSA являются колонизация или инфекция, вызванная данным возбудителем в анамнезе, недавно перенесенные оперативные вмешательства, госпитализации или пребывание в доме престарелых, наличие постоянного внутривенного катетера, диализ, предшествующая АБТ [].
Требует также тщательного мониторинга распространение среди внебольничных энтеробактерий изолятов, вырабатывающих β-лактамазы расширенного спектра (БЛРС), что определяет их нечувствительность к цефалоспоринам III-IV поколения, а также появление в РФ устойчивости M. pneumoniae к макролидам [].
1.2.3.Патогенез
Известно четыре патогенетических механизма, которые могут обуславливать развитие ВП []:
-
аспирация секрета ротоглотки;
-
вдыхание аэрозоля, содержащего микроорганизмы;
-
гематогенное распространение микроорганизмов из внелегочного очага инфекции;
-
непосредственное распространение инфекции из соседних пораженных органов или в результате инфицирования при проникающих ранениях грудной клетки.
Аспирация секрета ротоглотки – основной путь инфицирования респираторных отделов легких и основной патогенетический механизм развития ВП []. В нормальных условиях ряд микроорганизмов, например анаэробы, S. pneumoniae, H. influenzae могут колонизировать ротоглотку, но нижние отделы дыхательных путей остаются в большинстве случаев стерильными. Микроаспирация секрета ротоглотки – физиологический феномен, наблюдающийся у многих здоровых лиц, преимущественно во время сна. Однако кашлевой рефлекс, мукоцилиарный клиренс, антибактериальная активность альвеолярных макрофагов и секреторных иммуноглобулинов обеспечивают элиминацию инфицированного секрета из нижних отделов дыхательных путей и поддерживают их стерильность. При повреждении механизмов «самоочищения» трахеобронхиального дерева создаются благоприятные условия для развития пневмонии. В отдельных случаях самостоятельным патогенетическим фактором могут быть массивность дозы микроорганизмов или проникновение в респираторные отделы легких даже единичных высоковирулентных изолятов.
Сучетом особенностей патогенеза ВП очевидно, что ее этиология в подавляющем большинстве случаев связана с микрофлорой верхних отделов дыхательных путей, состав которой зависит от внешней среды, возраста пациента, сопутствующих заболеваний, предшествующей АБТ.
Ингаляция микробного аэрозоля встречается реже, данный механизм играет основную роль при инфицировании нижних отделов дыхательных путей облигатными патогенами, например Legionella spp.
Причины, обуславливающие при прочих равных условиях развитие тяжелой ВП, окончательно не ясны. Это может быть связано как с возбудителем, так и с особенностями пациента. Со стороны микроорганизма ключевое значение имеет наличие определенных факторов вирулентности, например, продукция лейкоцидина Пантона-Валентина у CA- MRSA и механизмов защиты от действия иммунной системы (например, полисахаридная капсула S. pneumoniae, затрудняющая фагоцитоз) [].
Со стороны макроорганизма риск тяжелой ВП, помимо известных факторов (сопутствующие заболевания бронхолегочной системы, злоупотребление алкоголем, дефицит питания и др.), возрастает при наличии ряда генетически обусловленных дефектов со стороны иммунной системы [].
Упациентов с легионеллезной пневмонией выявлено снижение активности маннозо-связывающего лектина, важного фактора врожденного иммунитета; некоторые полиморфизмы гена FCGR2A определяют предрасположенность к инвазивным пневмококковым инфекциям, включая развитие тяжелой ВП с бактериемией, а гена IFITM3, играющего важную роль в ограничении репликации вирусов, ответственны за тяжелое течение гриппа при инфицировании вирусом H1N1pdm2009 [].
1.3. Эпидемиология
ВП относятся к числу наиболее распространенных острых инфекционных заболеваний. Согласно данным официальной статистики (Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека), заболеваемость ВП в 2016 г. составила 418,02 на 100 тыс. населения с ростом этого показателя по сравнению с 2015 г. на 24% []. Наиболее высокие цифры заболеваемости отмечены в Дальневосточном и Уральском федеральным округах (560,84 и 505,31 на 100 тыс. населения, соответственно) [].
Согласно данным зарубежных эпидемиологических исследований, заболеваемость ВП у взрослых (≥ 18 лет) колеблется в широком диапазоне: у лиц молодого и среднего возраста она составляет 1-11,6‰; в старших возрастных группах — 25-44‰ []. В США ежегодно регистрируется 5-6 млн. случаев ВП, из них около 1 млн. человек нуждаются в госпитализации [].
Вструктуре смертности от болезней органов дыхания в РФ в 2015 г. на долю пневмоний приходилось 49,9%; смертность в 2016 г. составила 21 на 100 тыс. населения []. Вероятность неблагоприятного исхода при ВП зависит от многих факторов – возраста пациента, тяжести течения, сопутствующих заболеваний []. Летальность является наименьшей (1-3%) у лиц молодого и среднего возраста без сопутствующих заболеваний инетяжелом течении ВП. Напротив, у пациентов пожилого и старческого возраста, при наличии серьезной сопутствующей патологии (ХОБЛ, злокачественные новообразования, алкоголизм, СД, ХСН и др.), а также в случаях тяжелой ВП этот показатель возрастает до 15-58% [].
Основной причиной смерти больных с тяжелой ВП является рефрактерная гипоксемия, септический шок (СШ) и полиорганная недостаточность (ПОН) []. В проспективных исследованиях основными факторами, ассоциированными с неблагоприятным прогнозом больных с тяжелой ВП были: возраст > 70 лет, проведение ИВЛ, двусторонняя локализация пневмонии, сепсис и инфицирование P. aeruginosa [].
Анализ российских данных свидетельствует о том, что дополнительным фактором риска неблагоприятного прогноза является также позднее обращение пациентов за медицинской помощью [].
1.4.Кодирование по МКБ
Всоответствии с Международной классификацией болезней, травм и причин смерти X пересмотра (МКБ X), ВП кодируется в рубриках — J13-J16 и J18 – таблица 5. В основе МКБ X лежит этиологическая классификация пневмоний. Однако, ряд объективных и субъективных факторов (невозможность получить качественный клинический материал, недостаточная информативность и значительная продолжи- тельность традиционных микробиологических исследований, распространенная практика самолечения/профилактического приема АБП и др.) являются причиной того, что этиология заболевания верифицируется менее чем у половины пациентов.
| Рубрика | Нозологическая форма |
|---|---|
|
J13 |
Пневмония, вызванная Streptococcus pneumoniae |
|
J14 |
Пневмония, вызванная Haemophilus influenzae |
|
J15 |
Бактериальная пневмония, не классифицированная в других рубриках |
|
J15.0 |
Пневмония, вызванная Klebsiella pneumoniae |
|
J15.1 |
Пневмония, вызванная Pseudomonas spp. |
|
J15.2 |
Пневмония, вызванная Staphylococcus spp. |
|
J15.3 |
Пневмония, вызванная стрептококками группы В |
|
J15.4 |
Пневмония, вызванная другими стрептококками |
|
J15.5 |
Пневмония, вызванная Escherichia coli |
|
J15.6 |
Пневмония, вызванная другими аэробными грамотрицательными бактериями |
|
J15.7 |
Пневмония, вызванная Mycoplasma pneumoniae |
|
J15.8 |
Другие бактериальные пневмонии |
|
J15.9 |
Бактериальная пневмония неуточненной этиологии |
|
J16 |
Пневмония, вызванная возбудителями, не классифицированными в других рубриках (исключены: орнитоз – А70, пневмоцистная пневмония – В59) |
|
J16.0 |
Пневмония, вызванная Chlamydia spp. |
|
J16.8 |
Пневмония, вызванная другими установленными возбудителями |
|
J17* |
Пневмония при заболеваниях, классифицированных в других рубриках |
|
J17.0* |
Пневмония при заболеваниях бактериальной природы, классифицированных в других рубриках (пневмония при: актиномикозе – А42.0, сибирской язве – А22.1, гонорее – А54.8, нокардиозе – А43.0, сальмонеллезе – А022.2, туляремии – А721.2, брюшном тифе – А031.), коклюше – А37.) |
|
J17.1* |
Пневмония при вирусных заболеваниях, классифицированных в других рубриках (пневмония при: цитомегаловирусной болезни – В25.0, кори – В05.2, краснухе – В06.8, ветряной оспе – В01.2) |
|
J17.2* |
Пневмония при микозах |
|
J17.3* |
Пневмония при паразитозах |
|
J17.8* |
Пневмония при заболеваниях, классифицированных в других рубриках (пневмония при: орнитозе – А70, Ку-лихорадке – А78, острой ревматической лихорадке – 100, спирохитозе – А69.8) |
|
J18 |
Пневмония без уточнения возбудителя |
* указаны пневмонии при заболеваниях, классифицированных в других рубриках
5.Классификация
Помимо указанных ранее принципов классификации пневмоний — этиология, место и условия возникновения (внебольничная и нозокомиальная), состояние иммунитета (пневмония у пациентов без существенных нарушений иммунитета и выраженной иммуносупрессией) важное значение приобретает оценка тяжести ВП, в частности, выделение в особую группу лиц с тяжелым течением заболевания.
Тяжелая ВП – это особая форма заболевания, характеризующаяся выраженной дыхательной недостаточностью (ДН), как правило, в сочетании с признаками сепсиса и органной дисфункции. Тяжелая ВП ассоциируется с быстрым прогрессированием симптомов заболевания, большей частотой клинических неудач и высокой летальностью []. Такие больные нуждаются в неотложной госпитализации в ОРИТ.
Для выявления лиц, нуждающихся в неотложной госпитализации в ОРИТ, используются критерии Американского торакального общества/Американского общества по инфекционным болезням (ATS/IDSA), шкала SMART-COP и ее модификации. Подробное описание алгоритмов и шкал оценки тяжести ВП и определения прогноза представлено в разделе “Диагностика” и Приложении 3.
Спрактических позиций целесообразно выделять группы больных ВП, которые нуждаются в разных режимах эмпирической АБТ. Такая стратификация основана на наличии сопутствующих заболеваний, эпидемиологическом анамнезе и предшествующей АБТ (см. подробнее в разделе “Лечение”).
2.Диагностика
Диагностические исследования при ВП направлены на верификацию диагноза, идентификацию возбудителя, оценку тяжести течения и прогноза заболевания, выявление осложнений.
Диагностический алгоритм при подозрении на ВП включает сбор анамнеза, оценку жалоб, физическое обследование, комплекс лабораторных и инструментальных исследований, объем которых определяется тяжестью течения ВП, наличием и характером осложнений, сопутствующими заболеваниями.
2.1.Жалобы и анамнез
-
У всех больных с подозрением на ВП рекомендуется провести оценку жалоб, социального статуса и семейно-бытовых условий, собрать полный медицинский, эпидемиологический и профессиональный анамнез.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Подозрение на ВП должно возникать при наличии у больного лихорадки в сочетании с жалобами на острый кашель, одышку, отделение мокроты и/или боль в грудной клетке, связанную с дыханием или кашлем []. Пациенты с ВП часто жалуются на немотивированную слабость, утомляемость, ознобы, сильное потоотделение по ночам. Развитию ВП могут предшествовать симптомы поражение верхних дыхательных путей (боли в горле, насморк и др.). При тяжелой ВП клиническая картина может дополняться развитием СШ, острой ДН и другой органной дисфункции.
У лиц пожилого и старческого возраста характерные для ВП жалобы могут отсутствовать, а на первый план в клинической картине заболевания выходит синдром интоксикации: сонливость или беспокойство, спутанность сознания, анорексия, тошнота, рвота []. Нередко пневмония у данной категории пациентов “дебютирует” симптомами декомпенсации хронических сопутствующих заболеваний (СД, ХСН и др.) []. Изменению классической картины заболевания также способствует самолечение АБП [].
Несмотря на наличие определенных особенностей в клинической картине и течении ВП разной этиологии (например, для пневмококковой характерны острое начало, высокая лихорадка, боли в грудной клетке, для легионеллезной – диарея, неврологическая симптоматика, для микоплазменной — мышечные и головные боли, симптомы поражения верхних дыхательных путей), каких-либо закономерностей, позволяющих с высокой степенью надежности предсказать возбудителя заболевания без использования дополнительных методов исследования в настоящее время не существует [].
Сбор анамнеза, оценка социального статуса и семейно-бытовых условий важны для уточнения факторов риска инфицирования определенными возбудителями ВП (табл. 2) и дифференциальной диагностики пневмонии с другими заболеваниями. Например, тесный контакт с птицами может быть источником инфицирования С. psittaci, работа на ферме — С. burnetii. Недавний морской круиз повышает риск развития болезни легионеров, пребывание в отдельных странах и регионах, особенно контакт с местными медицинскими учреждениями, может быть фактором риска инфицирования полирезистеными возбудителями. Ряд хронических сопутствующих заболеваний при ВП относится к независимым предикторам неблагоприятного прогноза (см. более подробно раздел “Оценка тяжести и прогноза”).
2.2.Физическое обследование
-
У всех больных ВП рекомендуется провести общий осмотр, измерить показатели жизнедеятельности (ЧДД, ЧСС, АД, температура тела) и выполнить детальное обследование грудной клетки.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Данные, получаемые при физическом обследовании, зависят от многих факторов, включая распространенность и локализацию пневмонической инфильтрации, степень тяжести ВП, возраст пациента, наличие сопутствующих заболеваний. Классическими объективными признаками являются отставание пораженной стороны грудной клетки при дыхании, усиление голосового дрожания, укорочение (притупление) перкуторного звука над пораженным участком легкого, появление бронхиального дыхания, наличие фокуса мелкопузырчатых хрипов или крепитации, усиление бронхофонии []. Нужно иметь ввиду, что у части пациентов объективные признаки могут отличаться от типичных или вообще отсутствовать, что не исключает диагноза ВП.
2.3.Лабораторная диагностика
-
Всем больным ВП рекомендуется развернутый общий анализ крови с определением уровня эритроцитов, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Данные общего анализа крови не являются специфичными и не позволяют высказаться о потенциальном возбудителе ВП. Однако лейкоцитоз >10-12×109/л с повышением уровня нейтрофилов и/или палочкоядерный сдвиг >10%, нейтрофильно- лимфоцитарное соотношение > 20, указывают на высокую вероятность бактериальной инфекции; лейкопения <4×109/л, тромбоцитопения <100×1012/л и гематокрит <30% являются неблагоприятными прогностическими признаками при ВП [].
Госпитализированным больным ВП рекомендуется:
-
Биохимический анализ крови (мочевина, креатинин, электролиты, печеночные ферменты, билирубин, глюкоза, альбумин);
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Биохимический анализ крови не дает какой-либо специфической информации при ВП, но обнаруживаемые отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопутствующих заболеваний и развитие осложнений, имеют определенное прогностическое значение, имеют значение при выборе ЛС и/или режима их дозирования [].
-
Исследование уровня С-реактивного белка (СРБ) в сыворотке крови;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при ВП [], его концентрация в сыворотке существенно выше у пациентов с пневмококковой и легионеллезной пневмонией в сравнении с ВП, вызванной респираторными вирусами и другими “атипичными” возбудителями []. Отсутствие значимого снижения уровня СРБ на фоне АБТ у госпитализированных пациентов с ВП является предиктором более высокой летальности [].
Наиболее ценным с практической точки зрения является исследование уровня СРБ упациентов с неопределенным диагнозом ВП (отсутствие воспалительной инфильтрации упациентов с характерным анамнезом, жалобами и локальными симптомами); при концентрации >100 мг/л его специфичность в подтверждении диагноза превышает 90% [].
Количественное исследование другого воспалительного биомаркера — прокальцитонина не продемонстрировало значимых преимуществ при ВП по сравнению с СРБ []; учитывая высокую стоимость и ограниченную доступность теста в РФ его рутинное использование не рекомендуется.
-
Исследование плевральной жидкости (определение рН, активности ЛДГ, содержания белка, цитологическое исследование).
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Исследование проводится при наличии плеврального выпота и условий безопасного проведения плевральной пункции (визуализация на латерограмме свободно смещаемой жидкости с толщиной слоя > 1,0 см).
При наличии острой ДН с SрO2 < 90% по данным пульсоксиметрии и во всех случаях тяжелой ВП рекомендуется:
-
Исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
При тяжелой ВП рекомендуется:
-
Коагулограмма с определением протромбинового времени, МНО, АЧТВ.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Микробиологическая диагностика при ВП включает культуральное исследование мокроты и других респираторных образцов – трахеальный аспират (ТА), бронхоальвео- лярный лаваж (БАЛ) и др., венозной крови, экспресс-тесты по выявлению пневмокок- ковой и легионеллезной антигенурии, ПЦР-диагностику для выявления некультиви- руемых/трудно культивируемых бактериальных возбудителей и респираторных вирусов, иммуносерологические исследования [].
-
При лечении ВП в амбулаторных условиях микробиологические исследования рутинно не проводятся.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Вданной группе пациентов микробиологические исследования, направленные на верификацию этиологического диагноза при ВП недостаточно информативны, они не оказывают существенного влияния на тактику лечения и прогноз []. Выбор режима стартовой АБТ осуществляется эмпирически с учетом региональных эпидемиологических данных, результатов мониторинга АБР ключевых возбудителей и индивидуальных особеннностей пациента [].
Всем госпитализированным пациентам с ВП рекомендуется:
-
Бактериоскопия и культуральное исследование респираторного образца — мокрота или ТА (у пациентов, находящихся на ИВЛ);
Комментарии:
Образец свободно отделяемой мокроты должен быть получен у всех пациентов с продуктивным кашлем в как можно более ранние сроки с момента госпитализации и до начала АБТ []. При непродуктивном кашле может быть предпринята попытка получения индуцированной мокроты. В случае интубации и начала ИВЛ для культурального исследования вместо мокроты должен быть получен ТА.
Первый этап исследования предполагает бактериоскопию мазка, окрашенного по Граму для оценки качества образца и пригодности для дальнейших исследований. Диагностический критерий качественной мокроты – наличие более 25 сегментоядерных лейкоцитов и не более 10 эпителиальных клеток в поле зрения при просмотре, как минимум, 20 полей зрения (под увеличением Х100). При несоответствии критериям качественной мокроты дальнейшее культуральное исследование образца нецелесообразно, так как в этом случае изучаемый материал может быть значительно контаминирован содержимым ротовой полости [].
Выявление в мазке большого количества грамположительных или грамотри- цательных микроорганизмов с типичной морфологией (ланцетовидных грамположи- тельных диплококков – S. pneumoniae; слабо окрашенных грамотрицательных коккобацилл – H. influenzae и т.п.) может служить ориентиром для выбора эмпирической АБТ [].
Культуральное исследование предполагает посев клинических образцов на селективные и дифференциально-диагностические среды, их последующую идентификацию с помощью различных методов (биохимические тесты, время-пролетная масс-спектрометрия) и определение чувствительности выделенных изолятов к АБП. В соответствии с российскими клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам» [].
Интерпретация результатов культурального исследования мокроты и ТА должна проводиться с учетом бактериоскопии и клинических данных, так как данные образцы могут быть контаминированы микрофлорой полости рта и верхних дыхательных путей [].
-
Микробиологическое исследование образца плевральной жидкости при наличии плеврального выпота и показаний к плевральной пункции.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Исследование плевральной жидкости предусматривает бактериоскопию мазка, окрашенного по Граму или другими методами с последующим культуральным исследованием, направленным на выделение аэробных и анаэробных возбудителей. Принципы выявления и идентификации микроорганизмов аналогичны исследованию других респираторных образцов []. Так как плевральная жидкость в норме стерильна, данный образец при соблюдении правил получения, хранения и транспортировки отличается 100% специфичностью [].
При тяжелой ВП объем микробиологических исследований должен быть расширен идополнительно включать:
-
Культуральное исследование двух образцов венозной крови;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Бактериемия встречается при инфицировании разными возбудителями (энтеробактерии, P. aeruginosa, S. aureus), но наиболее характерна для ВП пневмококковой этиологии []. Культуральное исследование крови при высокой специфичности отличается низкой чувствительностью — частота положительных результатов гемокультуры варьирует от 5 до 30% []. Информативность исследования зависит от соблюдения правил получения, хранения и транспортировки клинических образцов. В частности, получение образцов крови на фоне АБТ как минимум в 2 раза снижает частоту положительной гемокультуры [].
-
Исследование респираторного образца (мокрота, мазок из носоглотки и задней стенки глотки и др.) на грипп методом ПЦР во время эпидемии гриппа в регионе или наличии соответствующих клинических и/или эпидемиологических данных;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Ранняя диагностика вирусов гриппа играет важную роль при выбора режима эмпирической терапии. Основным методом идентификации вирусов гриппа в настоящее время является ПЦР и ее модификации []. Существующие тест-системы позволяют выявлять вирусы гриппа А и В, определить субтип вирусов гриппа А, например, выявить пандемический вариант A/H1N1pdm2009 и высоко патогенный вирус гриппа птиц А/H5N []. Существуют экспресс-тесты для выявления антигенов гриппа А и Б в респираторных образцах, основанные на иммуноферментном анализе (ИФА) или иммунохроматографическом методе []. Их основным преимуществом является возможность выполнения “у постели больного” и быстрота получения результата. Однако, они характеризуются вариабельной чувствительностью и специфичностью, в связи с чем могут использоваться только в качестве скрининговых тестов с необходимостью дальнейшего подтверждения результатов исследования более точными методами, в частности ПЦР [].
Правила получения, хранения и транспортировки клинических образцов в микробиологическую лабораторию для этиологической диагностики ВП указаны в Приложении 4.
-
Экспресс-тесты по выявлению пневмококковой и легионеллезной антигенурии.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Для диагностики ВП, вызванной L. pneumophila серогруппы I разработаны иммунохроматографический тест и тест на основе ИФА. Чувствительность иммунохроматографического теста для выявления L. pneumophila у пациентов с ВП составляет 70-95%, специфичность достигает 95% []. Отрицательный тест не исключает окончательно диагноза легионеллезной пневмонии, так как он не валидирован для выявления L. pneumophila других серогрупп и легионелл других видов. Однако, по данным эпидемиологических исследований, на долю L. pneumophila серогруппы I приходится не менее 80% случаев внебольничного легионеллеза []. ПЦР не входит в стандарт диагностики легионеллезной ВП, но может быть рекомендована для исследования инвазивных респираторных образцов у больных с иммунодефицитом при подозрении на инфицирование другими видами Legionella spp. (не L. pneumophila), либо L. pneumophila, не относящимися к серогруппе I []. Культуральное исследование респираторных образцов с целью выявления Legionella spp., несмотря на 100% специфичность метода, в рутинной практике не рекомендуется, так как является дорогостоящим и трудоемким методом, чувствительность метода существенно варьирует в зависимости от исследуемого материала и квалификации персонала микробиологической лаборатории [].
Для экспресс-диагностики пневмококковой ВП используется иммунохроматогра- фический тест, предусматривающий выявление пневмококкового клеточного полисахарида в моче []. Тест демонстрирует приемлемую чувствительность (50-80%) и достаточно высокую специфичность (>90%) при ВП у взрослых по сравнению с культуральными методами []. Его использование особенно важно при невозможности получения качественного респираторного образца и обследовании пациентов, получавших системную АБТ.
Ключевыми преимуществами экспресс-тестов являются быстрота получения результата, доступность клинического материала для исследования, возможность выполнения после начала АБТ без существенного снижения информативности []. Однако, экспресс-тесты остаются положительными в течение нескольких недель после перенесенного эпизода ВП, поэтому они имеют диагностическую ценность только при наличии клинических проявлений заболевания. Экспресс-тест на пневмококовую антигенурию может быть ложноположительным при носительстве S. pneumoniae и у лиц с ХОБЛ [].
-
При ВП не рекомендуется рутинное использование методов идентификации M. pneumoniae, C. pneumoniae, редких бактериальных возбудителей и респиратор- ных вирусов (кроме вирусов гриппа).
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Целесообразность выполнения исследований, направленных на выявление M. pneumoniae и C. pneumonia должна определяться клиническими показаниями для конкретного пациента и/или эпидемиологической обстановкой в регионе/ЛПУ. Основной метод диагностики микоплазменной пневмонии — ПЦР и ее модификации, в частности ПЦР в реальном времени (ПЦР-РТ), для выявления C. pneumoniae используются молекулярные и серологические методы исследования []. В РФ доступны мультиплексные тест-системы, предполагающие одновременное выявление в исследуемом материале ДНК M. pneumoniae и С. pneumoniae []. Предпочтительно исследовать клинический материал из нижних дыхательных путей (мокрота, БАЛ, ТА), при невозможности их получения — объединенный мазок из носоглотки и задней стенки глотки [].
Современные методы обнаружения респираторных вирусов основаны на выявлении РНК/ДНК возбудителей с помощью ПЦР и антигенов методами иммуно- хроматографии, ИФА, иммунофлюоресценции []. Методы по обнаружению специфических антител в сыворотке крови (реакция связывания комплемента, реакция торможения гемагглютиниции, ИФА и др.) сохраняют значение в основном для ретроспективной диагностики, культуральное исследование с целью выявления и идентификации респираторных вирусов рутинно не проводится. В настоящее время доступны мультиплексные ПЦР тест-системы, предусматривающие одновременное выявление РНК/ДНК нескольких респираторных вирусов, в частности, РС-вируса, метапневмовируса и бокавируса человека, вирусов парагриппа, аденовирусов, коронавирусов, риновирусов [].
-
При ВП не рекомендуется микробиологическое исследование инвазивных респираторных образцов — бронхоальвеолярный лаваж (БАЛ), биоптаты, полученные путем «защищенной» браш-биопсии.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Исследование инвазивных респираторных образцов не имеет каких-либо преимуществ по сравнению с неинвазивными образцами и должно быть ограничено отдельными клиническими ситуациями, например, наличие факторов риска инфицирования редкими и/или трудно выявляемыми другими методами возбудителями, неэффективность АБТ у пациентов с тяжелым течением заболевания [].
При исследовании инвазивных респираторных образцов и выделении условно- патогенных микроорганизмов важное значение приобретает микробная нагрузка — клинически значимыми считаются возбудители, выделенные из БАЛ в количестве > 104 КОЕ/мл, биоптата, полученного с помощью защищенных щеток — > 103 КОЕ/мл [].
2.4.Инструментальная диагностика
Инструментальная диагностика при ВП включает лучевые методы исследования (рентгенография, компьютерная томография органов грудной полости), пульсоксиметрию, ультразвуковые исследования, фибробронхоскопию, электрокардиографическое исследование (ЭКГ).
Всем пациентам с подозрением на ВП рекомендуется:
-
Обзорная рентгенография органов грудной полости в передней прямой и боковой проекциях (при неизвестной локализации воспалительного процесса целесообразно выполнять снимок в правой боковой проекции);
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Рентгенологическое исследование направлено на выявление признаков воспалительного процесса в легких, их распространенности, локализации, наличия осложнений. Большое значение имеет дифференциальная диагностика выявленных в легких изменений с другими патологическими процессами, имеющими сходные с пневмонией клинические проявления [].
Основной рентгенологический признак ВП — локальное снижение воздушности легочной ткани (инфильтрация) за счет накопления воспалительного экссудата в респираторных отделах []. Изменения чаще носят односторонний характер, распространяются на один или два бронхолегочных сегмента. Рентгенологическая картина ВП определяется типом инфильтрации легочной ткани и стадией воспалительного процесса.
Альвеолярный тип инфильтрации (консолидация) при пневмонии наблюдается при заполнении воспалительным экссудатом воздухосодержащих альвеол, альвеолярных мешков, альвеолярных ходов и респираторных бронхиол. В результате часть легочной ткани становится безвоздушной. Отличительной особенностью является средняя интенсивность тени уплотненного участка легкого, тканевая плотность при КТ, а также видимость в зоне уплотнения воздушных просветов бронхов (симптом воздушной бронхографии). Такой тип изменений определяется как плевропневмония. Плевро- пневмония чаще встречается при инфицировании бактериальными возбудителями, особенно пневмококком.
Интерстициальный тип инфильтрации (матовое стекло) наблюдается при заполнении воспалительным экссудатом межальвеолярных пространств. При рентгеноло- гическом исследовании характеризуется низкой (малой) интенсивностью тени уплотненного участка. Более достоверно симптом матового стекла определяется при высокоразрешающей КТ легких – видимость стенок бронхов и элементов сосудистого рисунка в зоне инфильтрации. Такие пневмонические инфильтраты обычно определяются как интерстициальные. Обычно они не имеют отчетливой симптоматики при физическом обследовании и могут быть не видны при рентгенографии. Чаще интерстициальные пневмонические инфильтраты возникают при небактериальных пневмониях.
Очаговый тип инфильтрации отличается неоднородной структурой, состоящей из многочисленных полиморфных, центрилобулярных очагов с нечеткими контурами, часто сливающихся друг с другом. В основе данного типа инфильтрации лежит переход воспалительного процесса из мелких внутридольковых бронхов в окружающую их легочную ткань. Такие изменения определяются как бронхопневмония. Двухсторонние диффузные изменения могут возникать при небактериальной инфекции нижних дыхательных путей.
В практической работе полноформатная пленочная рентгенография часто заменяется крупнокадровой флюорографией или цифровой флюорографией, которая в этих случаях выполняется в аналогичных проекциях. У большинства пациентов флюорография позволяет подтвердить или исключить наличие воспалительного процесса влегочной ткани, особенно при распространении его на один или несколько бронхолегочных сегментов. При сомнительных результатах флюорографии целесообразно выполнение полноформатной рентгенографии [].
Несмотря на некоторые особенности, установление этиологии пневмонии по рентгенологической картине (характер, расположение воспалительной инфильтрации и др.) в большинстве случаев невозможно.
Всем пациентам с подозрением на ВП рекомендуется:
-
Пульсоксиметрия с измерением SpO2 для выявления ДН и оценки выраженности гипоксемии;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Пульсоксиметрия является простым и надежным скрининговым методом, позволяющим выявлять пациентов с гипоксемией, нуждающихся в респираторной поддержке и оценивать ее эффективность [].
Всем госпитализированным пациентам с ВП рекомендуется:
-
ЭКГ в стандартных отведениях.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Данное исследование не несет в себе какой-либо специфической информации при ВП. Однако, в настоящее время известно, что ВП помимо декомпенсации хронических сопутствующих заболеваний увеличивает риск развития нарушений ритма и острого коронарного синдрома (ОКС) [].
-
Всем пациентом с ВП в случае подозрения на наличие парапневмонического экссудативного плеврита рекомендуется трансторакальное ультразвуковое исследование грудной полости.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Плевральный выпот (как правило, ограниченного характера) осложняет течение ВП в 10-25% случаев []. УЗИ позволяет с высокой чувствительностью и специфичностью определять наличие плеврального выпота, оценивать его характеристики (вероятный транссудат или экссудат), выявлять пациентов с подозрением на наличие эмпиемы плевры [].
Впоследние годы появились данные о возможности использования УЗИ легких для выявления легочной консолидации (выполняется по специальному протоколу). Неинвазивность, быстрота выполнения, доступность, отсутствие необходимости в транспортировке больных позволяют рассматривать УЗИ легких как перспективный “прикроватный” метод диагностики пневмонии, который особенно актуален у больных ОРИТ [].
-
КТ органов грудной полости не является обязательным методом исследования при ВП и выполняется только при наличии определенных показаний;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Участи больных ВП рентгенологическая картина не типична или клинические проявления, сходные с пневмонией, обусловлены другим патологическим процессом. В этих случаях полезными могут быть другие методы лучевой диагностики, в первую очередь КТ органов грудной полости.
Показания к КТ:
-
Отсутствие изменений в легких на рентгеновских снимках у пациента с вероятным диагнозом пневмонии.
-
Нетипичные для ВП изменения на рентгенограммах.
-
Рецидивирующая пневмония или затяжная пневмония, при которой длительность существования инфильтративных изменений в легочной ткани превышает один месяц (в обоих случаях причиной повторного возникновения или длительного сохранения изменений в легочной ткани может являться стеноз крупного бронха, обусловленный, в том числе, и злокачественным новообразованием).
Стандарт для исследования лёгких — спиральная КТ. Стандартное томографическое исследование в режиме лёгочного сканирования с толщиной среза 10 мм дополняют КТ высокого разрешения.
-
Рентгеноскопия не является обязательным и рутинным методом исследования при ВП, выполняется только при наличии определенных показаний.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Рентгеноскопия не является обязательной и, тем более, первичной методикой рентгенологического исследования больных ВП. Применение рентгеноскопии ограничено клиническими ситуациями, в которых необходимо дифференцировать изменения в легочной ткани и скопления жидкости в плевральной полости. Изменение положения тела при рентгеноскопии позволяет выявить смещение свободного плеврального выпота и наметить место для выполнения плевральной пункции. Однако в настоящее время эта задача чаще решается с помощью других методов исследования, поэтому частота применения рентгеноскопии значительно уменьшилась.
-
Фибробронхоскопия не является обязательным методом исследования при ВП, выполняется только при наличии определенных показаний. Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Фибробронхоскопия используется в большинстве случаев как инструмент дифференциальной диагностики ВП с другими заболеваниями и не является обязательным методом исследования. Ее проведение с диагносттической целью может обсуждаться при наличии показаний к микробиологическому исследовнию инваливзых респираторных образцов (БАЛ, образец, полученный при помощи “защищенной” браш-биопсии) [].
Учитывая разнообразие возможных клинических сценариев, в том числе необходимость дифференциальной диагностики ВП с разными по этиологии и патогенезу заболеваниями, выявления и оценки степени выраженности декомпенсации хронических сопутствующих заболеваний, конкретный объем лабораторного и инструментального обследования должен определяться для каждого пациента индивидуально [].
2.5.Критерии диагноза ВП
Диагноз ВП является определенным при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и, по крайней мере, двух клинических признаков из числа следующих:
а) остро возникшая лихорадка в начале заболевания (t° > 38,0°С);
б) кашель с мокротой;
в) физические признаки (фокус крепитации/мелкопузырчатых хрипов, бронхиальное дыхание, укорочение перкуторного звука);
г) лейкоцитоз > 10·109/л и/или палочкоядерный сдвиг (> 10%).
При этом необходимо учитывать и вероятность терапевтической альтернативы — известных синдромосходных заболеваний/патологических состояний.
Отсутствие или недоступность рентгенологического подтверждения очаговой инфильтрации в легких делает диагноз ВП неточным/неопределенным. При этом диагноз заболевания основывается на учете данных эпидемиологического анамнеза, жалоб и соответствующих локальных признаков.
Если при обследовании пациента с лихорадкой, жалобами на кашель, одышку, отделение мокроты и/или боли в грудной клетке, связанные с дыханием рентгеноло- гическое исследование органов грудной полости оказывается недоступным и отсутствует соответствующая локальная симптоматика (укорочение перкуторного звука над пораженным участком легкого, локально выслушиваемое бронхиальное дыхание, фокус звучных мелкопузырчатых хрипов/крепитации, усиление бронхофонии и голосового дрожания), то предположение о ВП становится маловероятным.
2.6.Оценка тяжести ВП и прогноза
Важное значение при ВП имеет определение прогноза и тяжести течения заболевания, так как это определяет выбор места лечения (амбулаторно, госпитализация в отделение общего профиля или ОРИТ), объем диагностических и лечебных процедур.
-
Всем амбулаторным пациентам с ВП для оценки прогноза рекомендуется использовать шкалу CURB/CRB-65; у госпитализированных пациентов наряду с CURB/CRB-65 может использоваться индекс тяжести пневмонии/шкала PORT.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Шкала CURB-65 включает анализ 5 признаков: 1) нарушение сознания, обусловленное пневмонией; 2) повышение уровня азота мочевины > 7 ммоль/л; 3) тахипноэ ≥ 30/мин; 4) снижение систолического артериального давления < 90 мм рт.ст. или диастолического ≤ 60 мм рт.ст.; 5) возраст больного ≥ 65 лет. Наличие каждого признака оценивается в 1 балл, общая сумма может варьировать от 0 до 5 баллов, риск летального исхода возрастает по мере увеличения суммы баллов (Приложение 3). CRB-65 отличается отсутствием в критериях оценки азота мочевины [].
Шкала PORT является более трудоемким и сложным инструментом оценки прогноза при ВП. Она содержит 20 клинических, лабораторных и рентгенологических признаков; класс риска определяется путем стратификации больного в одну из пяти групп. Для этого используется 2-х ступенчатая система подсчета баллов, которая основана на анализе значимых с точки зрения прогноза демографических, клинико-лабораторных и рентгенологических признаков (Приложение 3). Показатели 30-дневной летальности при оценке по шкале PORT варьируются от 0,1– 0,4% для I и до 27,0–31,1% — для V класса риска [].
Основное значение прогностических шкал заключается в возможности выделить больных ВП с низким риском неблагоприятного прогноза, которые не требуют госпитализации и могут лечиться в амбулаторных условиях []. К ним относятся пациенты 1 группы по шкалам CURB-65/CRB-65 и I-II класса риска по шкале PORT. Напротив, прогноз является чрезвычайно неблагоприятным при наличии > 3 баллов по шкале CURB/CRB-65 или принадлежности больных к классу риска V по шкале PORT. Такие пациенты требуют обязательной и неотложной госпитализации в ОРИТ.
При использовании прогностических шкал необходимо учитывать ряд известных ограничений:
-
они не разрабатывались для оценки тяжести ВП и могут неадекватно оценивать необходимость госпитализации в ОРИТ;
-
шкалы недостаточно полно учитывают функциональный статус пациента, влияние сопутствующих заболеваний и их декомпенсации на тяжесть состояния пациента и прогноз: декомпенсация внелегочной хронической патологии наблюдается у 40% лиц, госпитализированных с ВП, у половины из них признаки органной дисфункции отмечаются уже в первые сутки пребывания в стационаре;
-
шкалы не учитывают социально-экономические факторы, в том числе возможность получения адекватной медицинской помощи и ухода в амбулаторных условиях.
-
Для оценки тяжести и определения показаний к госпитализации в ОРИТ всем госпитализированным пациентам с ВП рекомендуется использовать критерии IDSA/ATS или шкалу SMART-COP.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Критерии IDSA/ATS (Американского торакального общества и Американского общества инфекционных болезней) основаны на использовании двух «больших» и девяти «малых» критериев – таблица 6.
Наличие одного «большого» или трех «малых» критериев являются показанием к госпитализации пациента в ОРИТ.
Шкала SMART-COP выявляет пациентов, нуждающихся в интенсивной респираторной поддержке и инфузии вазопрессоров с целью поддержания адекватного уровня АД []. Шкала SMART-COP предусматривает балльную оценку клинических, лабораторных, физических и рентгенологических признаков с определением вероятностной потребности в указанных выше интенсивных методах лечения — Приложение 3. Риск потребности в ИВЛ или назначении вазопрессоров является высоким при наличии 5 и более баллов по шкале SMART-COP.
Существует модифицированный вариант шкалы SMRT-CО, который не требует определения таких параметров, как уровень альбумина, PaO2 и pH артериальной крови []. Риск потребности в ИВЛ или назначении вазопрессоров является высоким при наличии 3 и более баллов по шкале SMRT-CO.
Шкала SMART-COP/ SMRT-CO при оценке потребности госпитализации в ОРИТ не уступает критериям IDSA/ATS [].
|
«Большие» критерии:
|
|
«Малые» критерии1:
|
1 Могут учитываться дополнителельные критерии – гипогликемия (у пациентов без СД), гипонатриемия, необъяснимы другими причинами метаболический ацидоз/повышение уровня лактата, цирроз, аспления, передозировка/резкое прекращение приема алкоголя у зависимых пациентов
2 остаточный азот мочевины = мочевина, ммоль/л/2,14
3.Лечение
3.1.Общие рекомендации
Лечение пациентов с ВП предполагает комплекс мероприятий, включающих назначение АМП, адекватную респираторную поддержку, применение по показаниям неантибактериальных ЛС и профилактику осложнений []. Чрезвычайно важным является своевременное выявление и лечение декомпенсации/обострения сопутствующих заболеваний [].
3.2.Характеристика основных классов АМП
β-лактамные антибиотики
β-лактамным антибиотикам принадлежит важная роль в лечении пациентов с ВП, что обусловлено их мощным бактерицидным действием в отношении ряда ключевых возбудителей ВП, в первую очередь S. pneumoniae, низкой токсичностью, многолетним опытом эффективного и безопасного применения []. Несмотря на рост резистентности S.pneumoniae к пенициллину, β-лактамы сохраняют высокую клиническую эффектив- ность при ВП, вызванной ПРП. В большинстве исследований у пациентов без тяжелых нарушений иммунитета не установлено связи между резистентностью к пенициллину и худшими исходами лечения ВП.
Наибольшее значение при терапии ВП у амбулаторных пациентов имеют амоксициллин и его комбинации с ингибиторами β-лактамаз — амоксициллин/клавуланат, амоксициллин/сульбактам.
Амоксициллин обладает высокой активностью в отношении S. pneumoniae, действует на штаммы H. influenzae, не продуцирующие β-лактамазы, отличается благоприятным профилем безопасности.
Преимуществом ингибиторозащищенных аминопенициллинов (ИЗП) является активность в отношении β-лактамазопродуцирующих штаммов H. influenzae, ряда энтеробактерий, метициллин-чувствительных штаммов S. aureus и неспорообразующих анаэробов, продуцирующих чувствительные к ингибиторам β-лактамазы. Амоксициллин иамоксициллин/клавуланат при дозировании из расчета 80-90 мг/кг/сутки по амоксициллину сохраняют активность в отношении ПРП, вызывающих ВП. Оксациллин может назначаться при ВП, вызванной метициллин-чувствительным S. aureus.
Ключевыми препаратами для лечения госпитализированных пациентов с ВП являются цефалоспорины III поколения – цефотаксим и цефтриаксон, которые обладают высокой активностью в отношении S. pneumoniae, в том числе ряда ПРП, H. influenzae, ряда энтеробактерий. Важным фармакокинетическим преимуществом цефтриаксона является длительный период полувыведения, позволяющий вводить его однократно в сутки. Среди пероральных цефалоспоринов III поколения при ВП может использоваться цефдиторен, который по своим фармакодинамическим характеристикам сходен с цефтриаксоном. Одним из недостатков цефалоспоринов III поколения является низкая природная активность в отношении S. aureus.
Наиболее существенным преимуществом цефтаролина (цефалоспорин из группы антиMRSA цефемов) является высокая активность в отношении S. pneumoniae, в т.ч. изолятов, резистентных к аминопенициллинам, цефтриаксону, макролидам и фторхинолонам, а также действие на MRSA [].
Цефалоспорины III поколения с антисинегнойной активностью (цефтазидим, цефоперазон/сульбактам) используются при инфицировании P. aeruginosa; цефазолин может назначаться при ВП, вызванной метициллин-чувствительным S. aureus.
Среди карбапенемов ключевое место в режимах эмпирической АБТ ВП принадлежит эртапенему, обладающему высокой активностью в отношении большинства “типичных” бактериальных возбудителей, за исключением MRSA и P. aeruginosa. Имипенем и меропенем являются препаратами выбора при подозрении на инфицирование P. aeruginosa. Все карбапенемы могут использоваться у пациентов с факторами риска аспирации, данная группа АБП сохраняет активность против БЛРС-продуцирующих энтеробактерий.
Достаточно высокой активностью в отношении пневмококков, неспорообразующих анаэробов и грамотрицательных бактерий, включая P. aeruginosa, обладает пиперациллин/ тазобактам. Он помет использоваться в режимах эмпирической терапии тяжелой ВП у пациентов с факторами риска синегнойной инфекции и при наличии аспирации.
Основным недостатком всех β-лактамных антибиотиков является отсутствие или низкая активность в отношении M. pneumoniae, L.pneumophila, хламидий и хламидофил.
Макролиды
Основным достоинством макролидов является высокая природная активность в отношении «атипичных» микроорганизмов, таких как M. pneumoniae, C. pneumoniae, L.pneumophila. Современные макролиды, к которым относят в первую очередь азитромицин и кларитромицин, характеризуются благоприятным профилем безопасности, удобством приема и отсутствием перекрестной аллергии с β-лактамными антибиотиками. Макролиды используются при лечении легионеллезной пневмонии, являются препаратами выбора при ВП, вызванной M.pneumoniae, C.pneumoniae, C. psittaci.
Как показал ряд ретроспективных и проспективных исследований, применение макролидов в комбинации с β-лактамами по сравнению с монотерапией β-лактамами у больных тяжелой ВП (в том числе пневмококковой бактериемией) улучшало прогноз, что может быть связано с наличием у макролидов дополнительных неантимикробных эффектов (противовоспалительная, иммуномодулирующая активность).
В нескольких наблюдательных исслеваниях и основанном на их результатах метаанализе у пациентов с тяжелой ВП комбинация β-лактамного антибиотика с макролидом обеспечивала лучший прогноз в сравнении с комбинацией β-лактам + фторхинолон [].
Имеются сообщения о неэффективности макролидов при устойчивости к ним S. pneumoniae in vitro, которые в большинстве случаев наблюдались при тяжелом течении ВП с бактериемией. Кроме того, следует учитывать невысокую природную активность макролидов в отношении H. influenzae и практически полное отсутствие таковой в отношении энтеробактерий.
Фторхинолоны
Среди препаратов данной группы наибольшее значение при ВП имеют так называемые респираторные хинолоны (РХ) левофлоксацин, моксифлоксацин и гемифлоксацин, которые действуют практически на все ключевые возбудители ВП, включая ПРП, β-лактамазопродуцирующие штаммы H. influenzae, причём их активность в отношении микоплазм, хламидофил и S.aureus существенно выше по сравнению с фторхинолонами предыдущего поколения (ципрофлоксацин, офлоксацин и др.).
Хорошие микробиологические характеристики препаратов сочетаются с благоприятными фармакокинетическими параметрами (длительный период полувыведения, обеспечивающий возможность применения однократно в сутки, высокие концентрации в бронхиальном секрете и легочной ткани).
Хинолоны являются препаратами выбора при болезни легионеров, наряду с макролидами могут использоваться при лечении ВП, вызванной M. pneumoniae, C. pneumoniae, C. psittaci. Ципрофлоксацин и левофлоксацин применяются у пациентов с факторами риска/подтвержденным инфицированием P. aeruginosa.
Препараты других групп
Среди тетрациклинов наиболее приемлемым, учитывая фармакокинетические особенности, переносимость и удобство применения является доксициклин. Он характеризуется хорошей активностью в отношении M.pneumoniae, C.pneumoniae и невысоким уровнем вторичной резистентности H. influenzae в РФ. Высокая частота выделения тетрациклинорезистентных штаммов S. pneumoniae в России не позволяет рассматривать его в качестве препарата выбора для эмпирической терапии ВП.
Ванкомицин характеризуется высокой активностью в отношении полирези- стентных грамположительных микроорганизмов, в первую очередь MRSA и S. pneumoniae. Препарат может назначаться пациентам с предполагаемым или подтвержденным инфицированием MRSA, а также использоваться у пациентов с пневмококковой пневмонией, вызванной полирезистентными S. pneumoniae. Следует отметить, что ванкомицин отличает вариабельная фармакокинетика, его применение должно сопровождаться проведением терапевтического лекарственного мониторинга; в случае инфицирования изолятами S. aureus с МПК >1,5 мкг/мл возрастает риск клинической неудачи при стандартном режиме дозирования.
Основное клиническое значение линезолида при ВП, как и ванкомицина, связано с высокой активностью в отношении S. pneumoniae (в т.ч. ПРП) и MRSA. Наряду с ванкомицином линезолид может использоваться у пациентов с пневмококковой пневмонией, включая случаи инфицирования ПРП, а также назначаться пациентам с MRSA-инфекцией. Преимуществами линезолида в случае инфицирования MRSA по сравнению с ванкомицином является меньший риск нефротоксического эффекта, более предсказуемая фармакокинетика, а также наличие пероральной ЛФ с высокой биодоступностью, что позволяет использовать препарат в режиме ступенчатой терапии.
Среди аминогликозидов у пациентов с тяжелой ВП определенное значение имеют препараты II-III поколения (амикацин, гентамицин и др.), обладающие значимой активностью против P. aeruginosa. Следует отметить, что аминогликозиды не активны в отношении S. pneumoniae, создают низкие концентрации в бронхиальном секрете и мокроте, для них характерно развитие ряда серьезных нежелательных лекарственных реакций. В связи с этим показания к применению данной группы ЛС у пациентов с ВП строго ограничены – они могут назначаться как компонент эмпирической терапии у пациентов с факторами риска инфицирования P. aeruginosa, либо использоваться для этиотропной терапии инфекций, вызванных P. aeruginosa, Acinetobacter spp. (также в комбинации с β-лактамами или фторхинолонами).
Линкозамиды (в первую очередь клиндамицин) могут использоваться при подтвержденном инфицировании MSSA, а также предполагаемой аспирации (в составе комбинированной терапии). Сравнительная активность АБП в отношении ключевых бактериальных возбудителей тяжелой ВП представлена в таблице 7.
Противовирусные препараты
Среди противовирусных препаратов наибольшее клиническое значение при ВП принадлежит ингибиторам нейраминидазы – оселтамивиру и занамивиру, обладающих высокой активностью в отношении вирусов гриппа А и Б.
Использование ингибиторов нейраминидазы критически больным пациентам, инфицированным вирусами гриппа улучшает прогноз, а также сокращает продолжительность выделения вируса, причем эффективность препаратов выше при их раннем назначении (<48 ч с момента появления симптомов). Среди циркулирующих в настоящее время вирусов гриппа А (H3N2, H1N1) устойчивые к оселтамивиру изоляты встречаются редко, они, как правило, сохраняют чувствительность к занамивиру.
Оселтамивир и занамивир обладают сопоставимой эффективностью при гриппе, однако у критически больных пациентов, нуждающихся в ИВЛ препаратом выбора является выпускающийся в пероральной лекарственной форме оселтамивир. Занамивир также должен с осторожностью применяться у пациентов с ХОБЛ и бронхиальной астмой ввиду потенциального риска усиления бронхообструкции.
| Название АМП | ПЧП | ПРП | H. influenzae | M. pneumoniae C. pneumoniae | Legionella spp. | S. aureus (MSSA) | S. aureus (MRSA) | Enterobac- terales | P. aeruginosa | Анаэробы1 |
|---|---|---|---|---|---|---|---|---|---|---|
|
Аминопенициллины |
+++ |
++ |
++ |
0 |
0 |
0 |
0 |
0 |
0 |
+ |
|
Амоксициллин/клавуланат, ампициллин/сульбактам |
+++ |
++ |
+++ |
0 |
0 |
++ |
0 |
+ |
0 |
+++ |
|
Пиперациллин/тазобактам |
+++ |
0 |
+++ |
0 |
0 |
++ |
0 |
+++ |
+++ |
+++ |
|
Оксациллин |
+ |
0 |
0 |
0 |
0 |
+++ |
0 |
0 |
0 |
0 |
|
Цефотаксим, цефтриаксон, цефдиторен |
+++ |
++ |
+++ |
0 |
0 |
+ |
0 |
++ |
0 |
+ |
|
Цефтазидим |
+ |
0 |
+++ |
0 |
0 |
0 |
0 |
++ |
+++ |
+ |
|
Цефоперазон/сульбактам |
+ |
0 |
+++ |
0 |
0 |
0 |
0 |
+++ |
++ |
++ |
|
Цефепим |
+++ |
++ |
+++ |
0 |
0 |
+++ |
0 |
++ |
+++ |
+ |
|
Цефтаролин |
+++ |
+++ |
+++ |
0 |
0 |
+++ |
++ |
++ |
0 |
+ |
|
Эртапенем |
+++ |
++ |
+++ |
0 |
0 |
++ |
0 |
+++ |
0 |
+++ |
|
Имипенем, меропенем |
+++ |
++ |
+++ |
0 |
0 |
+++ |
0 |
+++ |
+++ |
+++ |
|
Макролиды |
++ |
+ |
+ |
+++ |
+++ |
++ |
0 |
0 |
0 |
0 |
|
Моксифлоксацин, гемифлоксацин |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+ |
++ |
+ |
++ |
|
Левофлоксацин |
++ |
++ |
+++ |
+++ |
+++ |
++ |
+ |
++ |
++ |
0 |
|
Ципрофлоксацин |
+ |
+ |
+++ |
++ |
+++ |
+ |
0 |
+++ |
+++ |
0 |
|
Ванкомицин |
++ |
++ |
0 |
0 |
0 |
++ |
+++ |
0 |
0 |
0 |
|
Линезолид |
+++ |
+++ |
+ |
0 |
0 |
+++ |
+++ |
0 |
0 |
0 |
|
Аминогликозиды II-III |
0 |
0 |
+ |
0 |
0 |
+ |
0 |
+++ |
++ |
0 |
|
Клиндамицин |
++ |
+ |
+ |
0 |
0 |
+++ |
+ |
0 |
0 |
+++ |
Примечание: +++ высокая активность, подтверждённая клиническими данными, может быть препаратом выбора; ++ активность, подтверждённая клиническими данными, может быть препаратом альтернативы, + низкая активность АМП; 0 отсутствие клинически значимой активности (в некоторых случаях активность только in vitro);
1 при отсутствии активности против грам(-) анаэробов препарат
расценивается как неактивный
3.3.Лечение амбулаторных пациентов
-
Всем пациентам с определенным диагнозом ВП в как можно более короткие сроки должны назначаться системные АБП;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Системная АБТ ВП при своевременном назначении и адекватном выборе препаратов улучшает прогноз []. Несмотря на возможность первично вирусных пневмоний у взрослых, надежных способов их дифференциальной диагностики с бактериальными в настоящее время не существует [].
-
У пациентов с ВП, не нуждающихся в госпитализации, целесообразно назначение пероральных лекарственных форм АБП;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Парентеральные АБП при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными, при этом создает угрозу развития постинъекционных осложнений и требуют дополнительных затрат на введение [].
-
Выбор препаратов для стартовой АБТ осуществляется эмпирически с учетом факторов, определяющих спектр потенциальных возбудителей и профиль АБР;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Рекомендации по выбору АБП для эмпирической терапии ВП у амбулаторных больных представлены в таблице 8.
Метаанализ рандомизированных клинических исследований (РКИ), сравнивавший АБП разных классов: макролиды, фторхинолоны, цефалоспорины и аминопенициллины у амбулаторных пациентов >18 лет не выявил существенных различий между ними по эффективности и безопасности []. Стратификация больных и рекомендации по выбору АБП в большей степени отражают национальные эпидемиологические данные АБР ключевых возбудителей, их потенциальное экологическое влияние, а также учитывают затратную эффективность ЛС в РФ.
Среди пациентов, которые могут получать лечение в амбулаторных условиях, выделяют 2 группы. В первую группу включены пациенты без хронических сопутствующих заболеваний, не принимавшие за последние 3 мес. системные АБП ≥ 2 дней и не имеющие других факторов риска инфицирования редкими и/или ПРВ: пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, в/в инфузионная терапия, наличие сеансов диализа или лечение ран в домашних условиях в предшествующие 30 дней.
-
АБП выбора у пациентов без сопутствующих заболеваний и других факторов риска инфицирования редкими и/или ПРВ является амоксициллин, альтернативными — макролиды;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Амоксициллин сохраняет высокую активность в отношении ключевого возбудителя ВП в данной группе пациентов – S. pneumoniae, а частота выделения нечувствительных к нему изолятов H. influenzae остается невысокой []. Несмотря на то, что аминопенициллины in vitro не перекрывают весь спектр потенциальных возбудителей ВП (в частности, не действуют на M. pneumoniae и C. pneumoniae), в РКИ они не уступали по эффективности макролидам и респираторным фторхинолонам [].
Всвязи с быстрым и существенным ростом устойчивости S. pneumoniae к макролидам в РФ их назначение в качестве препаратов первого ряда не рекомендуется ввиду риска клинических неудач. Макролиды могут применяться при невозможности назначить амоксициллин (индивидуальная непереносимость, аллергические реакции немедленного типа на β-лактамы в анамнезе). Их назначение может также рассматриваться при наличии клинических/эпидемиологических данных, которые с высокой степенью вероятности свидетельствуют о ВП, вызванной M. pneumoniae или C. pneumoniae.
Во вторую группу включены больные ВП с сопутствующими заболеваниями (ХОБЛ, СД, ХСН, хроническая болезнь почек (ХБП) с снижением скорости клубочковой фильтрации, цирроз печени, алкоголизм, наркомания, истощение) и/или принимавшими за последние 3 мес АМП ≥2 дней и/или имеющими других факторы риска инфицирования редкими и/или ПРВ, которые указаны выше.
-
АБП выбора у пациентов с сопутствующими заболеваниями и/или другими факторами риска инфицирования редкими и/или ПРВ являются ИЗП (амоксициллин/клавуланат и др.), альтернативными – РХ и цефдиторен;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Поскольку вероятность этиологической роли грамотрицательных бактерий (в том числе обладающих некоторыми механизмами вторичной АБР) у этих больных возрастает, вкачестве АБП выбора им рекомендуются ИЗП (амоксициллин/клувуланат, амоксициллин/сульбактам, ампициллин/сульбактам). Альтернативой является применение РХ (левофлоксацин, моксифлоксацин, гемифлоксацин) или цефдиторена. Фторхинолоны in vitro имеют определенные преимущества перед ИЗП (более высокая активность в отношении энтеробактерий, действие на M. pneumoniae, C. pneumoniae, ПРП), однако это не находит подтверждения в сравнительных РКИ []. Кроме того, такой подход к применению фторхинолонов обусловлен необходимостью уменьшить селекцию АБР и возможность их использования при неэффективности АМП первого ряда [].
Несмотря на определенную роль “атипичных” возбудителей в этиологии ВП у пациентов данной группы, рутинное назначение комбинации β-лактамного АБП и макролида не рекомендуется, так как на сегодняшний день не доказано, что такая стратегия улучшает исходы лечения при возможном увеличении риска нежелательных лекарственных реакции (НЛР) и селекции АБР [].
Рекомендации по режиму дозирования АБП представлены в таблице 13.
-
У всех пациентов через 48-72 ч после начала лечения необходимо оценить эффективность и безопасность стартового режима АБТ.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Основными критериями эффективности АБТ в эти сроки являются снижение температуры, уменьшение выраженности интоксикационного синдрома и основных клинических симптомов ВП, в первую очередь одышки.
Если у пациента сохраняется лихорадка и интоксикационный синдром, либо прогрессируют симптомы и признаки ВП или развиваются осложнения, АБТ следует расценивать как неэффективную. В этом случае, а также появлении НЛР, требующих отмены АБП, необходимо пересмотреть тактику лечения и повторно оценить целесообразность госпитализации пациента.
-
Длительность АБТ определяется индивидуально; при решении вопроса об отмене АБП рекомендуется руководствоваться критериями достаточности АБТ (см. комментарии).
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Оптимальная продолжительность применения АБП при ВП до настоящего времени не определена и зависит от различных факторов – возраста, сопутствующих заболеваний, наличия осложнений, скорости “ответа” на стартовую АБТ и др.
Метаанализы РКИ, оценивавшие исходы лечения у пациентов с нетяжелой ВП относительно коротким (<7 дней) и более длительным (>7 дней) курсом АБТ не выявили существенных различий между группами []. В отдельных исследованиях при неосложненной ВП была продемонстрирована эффективность и более коротких курсов АБТ [].
К критериям достаточности АБТ ВП относят следующие:
-
стойкое снижение температуры тела <37,2ºС в течение не менее 48 ч;
-
отсутствие интоксикационного синдрома;
-
частота дыхания <20/мин (у пациентов без хронической ДН);
-
отсутствие гнойной мокроты (за исключением пациентов с ее постоянной продукцией);
-
количество лейкоцитов в крови <10 х 109/л, нейтрофилов <80%, юных форм <6%.
Обычно при таком подходе длительность применения АБП не превышает 7 дней. В то же время следует отметить, что короткие кусы АБТ могут быть недостаточно эффективными у пациентов пожилого и старческого возраста, с хроническими сопутствующими заболеваниями, при медленном клиническом “ответе” на лечение, атакже в случаях ВП, вызванной такими возбудителями как S. aureus, P. aeruginosa [].
Сохранение отдельных клинических, лабораторных симптомов и признаков ВП не является абсолютным показанием к продолжению АБТ или ее модификации – таблица 9.
Вподавляющем большинстве случаев их разрешение происходит самостоятельно или на фоне симптоматической терапии.
Рентгенологические признаки ВП разрешаются медленнее клинических симптомов и лабораторных изменений, поэтому контрольная рентгенография ОГП не используется для оценки достаточности АБТ.
Обратное развитие воспалительного процесса связано со снижением интенсивности тени инфильтрации вплоть до полного ее исчезновения []. Длительность обратного развития пневмонии может различаться в широких пределах, но обычно составляет 3-4 недели. Контрольное рентгенологическое исследование в эти сроки позволяет выявить нормальную картину или остаточные изменения в легких в виде локальных участков уплотнения легочной ткани или деформации легочного рисунка.
| Группа | Наиболее частые возбудители | Препараты выбора | Альтернатива |
|---|---|---|---|
|
Нетяжелая ВП у пациентов без сопутствующих заболеваний1, не принимавших за последние 3 мес АМП ≥2 дней и не имеющих других факторов риска2 |
S. pneumoniae |
Амоксициллин внутрь |
Макролид внутрь3 |
|
Нетяжелая ВП у пациентов с сопутствующими заболеваниями1 и/или принимавшими за последние 3 мес АМП ≥2 дней и/или имеющих другие факторы риска2 |
S. pneumoniae |
ИЗП |
РХ (левофлоксацин, |
Примечание: ИЗП – ингибиторозащищенный аминопенициллин, РХ – респираторный хинолон
1 ХОБЛ, СД, ХСН, ХБП, цирроз печени, алкоголизм, наркомания, истощение
2 К факторам риска инфицирования редкими и/или полирезистентными возбудителями относят пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, в/в инфузионная терапия, наличие сеансов диализа или лечение ран в домашних условиях в предшествующие 30 дней.
3 В районах с высоким (>25%) уровнем устойчивости S. pneumoniae к макролидам (определяется по эритромицину) следует рассмотреть возможность применения РХ или доксициклина Следует отдавать предпочтение наиболее изученным при ВП макролидам с улучшенными фармакокинетическими свойствами (азитромицин, кларитромицин)
| Симптом/признак | Пояснения |
|---|---|
|
Стойкий субфебрилитет в пределах 37,0-37,2ºС |
При отсутствии других признаков бактериальной инфекции может быть проявлением неинфекционного воспаления, постинфекционной астении, а также лекарственной лихорадки |
|
Кашель |
Может наблюдаться в течение 1-2 месяцев после перенесенной ВП, особенно у курящих и пациентов с ХОБЛ |
|
Хрипы при аускультации |
Могут наблюдаться в течение 3-4 недель и более после перенесенной ВП и отражают естественное течение заболевания |
|
Сохраняющаяся слабость, потливость |
Проявления постинфекционной астении |
|
Сохранение остаточных изменений на рентгенограмме (инфильтрация, усиление легочного рисунка) |
Могут наблюдаться в течение 1-2 месяцев после перенесенной ВП |
Пациенты с ВП могут получать парацетамол и НПВС в качестве жаропонижающих ЛС или аналгетиков (при наличии выраженного болевого синдрома, обусловленного плевритом), а также ЛС, улучшающие реологию бронхиального секрета (например, амброксол, ацетилцистеин). Однако данная терапия при ВП является симптоматической и не влияет на прогноз.
3.4.Лечение госпитализированных пациентов
При госпитализации пациента с ВП необходимо, прежде всего, решить вопрос о месте лечения — отделение общего профиля или ОРИТ. Крайне важным является быстрое выявление признаков тяжелой ВП, так как данные пациенты требуют неотложной помощи в условиях ОРИТ (см. раздел “оценка тяжести и прогноза при ВП”).
3.4.1.Антимикробная терапия
-
Всем пациентам с определенным диагнозом ВП в как можно более короткие сроки должны назначаться системные АБП; при подозрении на тяжелую ВП назначение АМП является неотложным.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
При тяжелой ВП отсрочка c началом АБТ на 4 ч и более существенно ухудшает прогноз []. В случае развития СШ как осложнения ВП время начала АБТ целесообразно сократить до 1 ч [].
-
АБТ ВП у госпитализированных пациентов должна начинаться с парентеральных лекарственных форм; при тяжелой ВП необходимо внутривенное введение АБП.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
У госпитализированных пациентов подразумевается более тяжелое течение ВП, поэтому целесообразно начинать терапию с парентеральных АБП. Стартовая АБТ тяжелой ВП предполагает внутривенное введение АМП, т.к. данный путь доставки обеспечивает наиболее высокую и предсказуемую биодоступность, не зависящую от полноты и скорости всасывания препаратов в ЖКТ []. В дальнейшем по мере клинической стабилизации возможет перевод пациента на пероральный прием АБП в рамках концепции ступенчатой терапии.
При нетяжелом течении ВП в случае госпитализации пациента по немедицинским показаниям допускается сразу назначение АБП внутрь.
-
Выбор препаратов для стартовой АМТ осуществляется эмпирически с учетом тяжести ВП и факторов, определяющих спектр потенциальных возбудителей и профиль АБР.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Рекомендации по выбору АБП для эмпирической терапии нетяжелой ВП представлены в таблице 10.
У госпитализированных пациентов возможно применение широкого круга АБП — ампициллина, ИЗП, цефалоспоринов с высокой антипневмококковой активностью (цефотаксим, цефтриаксон, цефтаролин), эртапенема, респираторных фторхинолонов, демонстрирующих в целом в РКИ сопоставимую эффективность []. Стратификация больных аналогична таковой для амбулаторных пациентов, учитывает спектр потенциальных возбудителей, факторы риска инфицирования ПРВ, а выбор препаратов — потенциальное экологическое влияние разных режимов АБТ и их затратную эффективность в РФ.
Кпервой группе относят пациентов без хронических сопутствующих заболеваний ифакторов риска инфицирования редкими и/или ПРВ, второй – с наличием таковых (прием системных АБП ≥ 2 дней в течение последних 3 мес., пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, в/в инфузионная терапия, наличие сеансов диализа или лечение ран в домашних условиях в предшествующие 30 дней).
-
АБП выбора у пациентов без сопутствующих заболеваний и других факторов риска инфицирования редкими и/или ПРВ является ампициллин, альтернативными – ИЗП и РХ;
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Наиболее частыми “типичными” бактериальными возбудителями ВП у данной категории пациентов являются S. pneumoniae и H. influenza, в отношении которых ампициллин сохраняет высокую активность []. В связи с этим рутинное назначение АБП более широкого спектра пациентам первой группы нецелесообразно. Респираторные фторхинолоны могут применяться при невозможности назначить аминопенициллины (индивидуальная непереносимость, аллергические реакции немедленного типа на β-лактамы в анамнезе), ИЗП – при низкой приверженности терапии ампициллином, который требует 4-х кратного введения в сутки (см. раздел “Рекомендации по режиму дозирования АМП”).
-
АБП выбора у пациентов с сопутствующими заболеваниями и другими факторами риска инфицирования редкими и/или ПРВ является ИЗП, цефалоспорины III поколения (цефотаксим, цефтриаксон), РХ, у отдельных категорий пациентов — цефтаролин и эртапенем.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Несмотря на различия в спектре активности in vitro рекомендованные режимы АБТ уданной категории пациентов обладают сопоставимой эффективностью []. В регионах с высокой распространенностью ПРП, при наличии индивидуальных факторов риска инфицирования ПРП определенные преимущества может иметь цефтаролин []. У пожилых пациентов с множественной сопутствующей патологией и высоким риском неблагоприятного прогноза, наличии факторов риска аспирации, обитателей домов престарелых можно ожидает белее высокую эффективность при назначении эртапенема [].
При развитии ВП у пациентов с гриппом предпочтительны препараты с высокой активностью против S. aureus.
Несмотря на наличие когортных проспективных и ретроспективных исследований, демонстрирующих опреедленные преимущества комбинации β-лактам+макролид по сравнению с монотерапией β-лактамными АБП у госпитализированных больных, рутинное назначение комбинированной АБТ при нетяжелой ВП нецелесообразно в связи с риском селекции АБР.
| Группа | Наиболее частые возбудители | Препараты выбора | Альтернатива |
|---|---|---|---|
|
Нетяжелая ВП у пациентов без сопутствующих заболеваний1, не принимавших за последние 3 мес АМП ≥2 дней и не имеющих других факторов риска2 |
S. pneumoniae |
Ампициллин в/в, в/м |
ИЗП (амоксициллин/ клавуланат, амоксициллин/сульбактам, ампициллин/сульбактам) в/в, в/м |
|
Нетяжелая ВП у пациентов с сопутствующими заболеваниями1 и/или принимавшими за последние 3 мес АМП ≥2 дней и/или имеющих другие факторы риска2 |
S. pneumoniae |
ИЗП (амоксициллин/ клавуланат, амоксициллин/сульбактам, |
Примечание: ИЗП – ингибиторозащищенный аминопенициллин, ЦС – цефалоспорин, РХ- респираторный хинолон
1ХОБЛ, СД, ХСН, ХБП, цирроз печени, алкоголизм, наркомания, истощение
2К факторам риска инфицирования редкими и/или полирезистентными возбудителями относят пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, в/в инфузионная терапия, наличие сеансов диализа или лечение ран в домашних условиях в предшествующие 30 дней
3Предпочтителен при высокой распространенности ПРП в регионе или наличии индивидуальных факторов риска инфицирования
4Использовать по ограниченным показаниям – пациенты из учреждений длительного ухода, наличие факторов риска аспирации, пожилой и старческий возраст с множественной сопутствующей патологией
Выбор режима эмпирической АМТ тяжелой ВП зависит от наличия факторов риска инфицирования P. aeruginosa и предполагаемой/документированной аспирации – таблица 11.
-
АБТ выбора у пациентов без факторов риска инфицирования P. aeruginosa и предполагаемой/документированной аспирации является комбинация ИЗП, ЦС без антисинегнойной активности, РХ или эртапенема с макролидом; альтернативой — комбинация РХ с цефотаксимом или цефтриаксоном.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Упациентов без факторов риска эмпирическая АБТ предусматривает назначение препаратов, активных в отношении наиболее вероятных “типичных” бактериальных возбудителей (в первую очередь S. pneumoniae) и L. pneumophila [].
Рекомендованные режимы терапии в целом характеризуются сопоставимой эффективностью, выбор конкретного β-лактама может определяться рядом дополни- тельных факторов – сопутствующими заболеваниями, наличием препаратов в ЛПУ, затратной эффективностью.
Имеются данные отдельных клинических исследований о сопоставимой эффективности монотерапии РХ с комбинированной терапией (β-лактамный антибиотик + макролид, β-лактамный антибиотик + фторхинолон) у пациентов с тяжелой ВП []. Однако, подобные исследования немногочисленны, большая часть из них носила нерандомизированный характер, либо не включала наиболее тяжелых пациентов, поэтому более надежной, особенно у больных, находящихся в критическом состоянии (интубация, септический шок) остается комбинированная АБТ.
-
АБТ выбора у пациентов с факторами риска инфицирования P. aeruginosa является комбинация β-лактамного АБП с антисинегнойной активностью с ципрофлоксацином или левофлоксацином; альтернативой — комбинация β-лактамного АБП с антисинегнойной активностью с аминогликозидами II- III поколения и макролидами, либо РХ.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
-
АМП выбора у пациентов с документированной/предполагаемой аспирацией являются ингибиторозащищенные β-лактамы, карбапенемы; альтернатива — комбинация ЦС III поколения без антисинегнойной активности с клиндамицином или метронидазолом.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Рутинное назначение препаратов, активных в отношении MRSA (ванкомицин, линезолид) в режимах эмпирической АБТ тяжелой ВП не рекомендуется ввиду ожидаемой низкой распространенности возбудителя в РФ.
-
По показаниям всем госпитализированным пациентам с ВП дополнительно к АБП могут назначаться противовирусные препараты, активные против вирусов гриппа.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Наибольшее клиническое значение при ВП имеет инфицирование вирусами гриппа. В дополнение к АБП у пациентов с клиническими симптомами, предполагающими инфицирование вирусами гриппа, рекомендуется назначение ингибиторов нейраминидазы – осельтамивира или занамивира. Ингибиторы нейраминидазы могут назначаться эмпирически пациентам с ВП, находящимся в критическом состоянии в период сезонного подъема заболеваемости гриппом в регионе. При эмпирическом назначении терапию целесообразно отменить в случае отрицательного результата исследования респираторных образцов на грипп методом ПЦР.
Рекомендации по режиму дозирования АМП представлены в таблице 13.
-
У всех пациентов через 48-72 ч после начала лечения необходимо оценить эффективность и безопасность стартового режима АБТ.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Как и при лечении амбулаторных пациентов, основными критериями эффективности АБТ в эти сроки являются снижение температуры, уменьшение выраженности интоксикационного синдрома и основных клинических симптомов ВП, ДН, проявлений ПОН.
Если у пациента сохраняется лихорадка и интоксикационный синдром, прогрессируют симптомы и признаки ВП или развиваются осложнения, АБТ следует расценивать как неэффективную. В этом случае, а также появлении НЛР, требующих отмены АБП, необходимо пересмотреть тактику лечения, повторно оценить тяжесть ВП и целесообразность перевода в ОРИТ.
При неэффективности АБТ на втором этапе необходимо провести обследование пациента для уточнения диагноза, выявления возможных осложнений ВП и проанализировать результаты доступных к этому моменту микробиологических исследований.
-
Всем пациентам при достижении критериев клинической стабильности целесообразно рассмотреть возможность перевода с парентерального на пероральный прием АБП в рамках концепции ступенчатой терапии.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Ступенчатая АБТ предполагает двухэтапное применение АБП, при котором лечение начинается с внутривенного введения ЛС с последующим переходом на пероральный прием того же препарата, либо АБП с сходным спектром активности и механизмом действия [].
Цель ступенчатой терапии заключается в уменьшении длительности парентеральной АБТ, что обеспечивает сокращение сроков пребывания пациента в стационаре и риска осложнений, уменьшение стоимости лечения при сохранении высокой клинической эффективности []. Оптимальным вариантом ступенчатой АБТ является последовательное использование двух лекарственных форм (для парентерального введения и приема внутрь) одного и того же АБП. Возможно последовательное применение препаратов, близких по своим антимикробным свойствам. Важнейшим критерием выбора АБП для второго этапа ступенчатой терапии является высокая и предсказуемая биодоступность при приеме внутрь [].
Для ступенчатой терапии можно использовать следующие АБП: амоксициллин/ клавуланат, ампициллин/сульбактам, амоксициллин/сульбактам левофлоксацин, моксифлок-сацин, кларитромицин, азитромицин, линезолид, клиндамицин. Для некоторых АБП, не имеющих ЛФ для перорального применения, возможна замена на близкие по антимикробному спектру препараты (например, цефотаксим, цефтриаксон → цефдиторен, амоксициллин/ клавуланат, ампициллин → амоксициллин).
Переход с парентерального на пероральный режим АБТ должен осуществляться при стабилизации гемодинамических показателей пациента, снижении температуры тела и улучшении клинических симптомов и признаков ВП [].
При принятии решения о переводе на пероральный прием АБП целесообразно использовать следующие критерии:
-
Снижение температуры тела до субфебрильных цифр (<37,8ºC) при двух измерениях с интервалом 8 ч;
-
Отсутствие нарушений сознания;
-
Частота дыхания < 24/мин
-
Частота сердечных сокращений < 100/мин
-
Систолическое АД > 90 мм рт ст
-
SpO2 > 90% или PaO2 > 60 мм рт ст (артериальная кровь);
-
Отсутствие нарушений всасывания в ЖКТ.
Возможность перехода на пероральный способ введения АБП появляется в среднем через 2-4 дня с момента начала лечения [].
| 1. Пациенты без факторов риска инфицирования P. aeruginosa1 и аспирации |
|---|
|
Цефтриаксон, цефотаксим, цефтаролин, амоксициллин/клавуланат, ампициллин/сульбактам, эртапенем в/в + азитромицин или кларитромицин в/в |
|
2. Пациенты с факторами риска инфицирования P. aeruginosa1 |
|
Пиперациллин/тазобактам, цефепим, меропенем, имипене в/в |
|
3.Пациенты с подтвержденной/предполагаемой аспирацией |
|
Амоксициллин/клавуланат, ампициллин/сульбактам, пиперациллин/тазобактам, эртапенем, меропенем, имипенем/циластатин в/в |
|
При наличии показаний всем пациентам дополнительно к АБТ могут назначаться осельтамивир4 внутрь или занамивир ингаляционно (см. комментарии в тексте) |
|
1 длительная терапия системными ГКС в фармакодинамических дозах, муковисцидоз, вторичные бронхоэктазы, недавний прием системных АБП |
-
Длительность АБТ нетяжелой ВП определяется индивидуально, при тяжелой ВП неточненной этиологии должна составлять не менее 10 дней; при решении вопроса об отмене АБП рекомендуется руководствоваться критериями достаточности АБТ (см. комментарии).
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Оптимальная продолжительность применения АБП у госпитализированных пациентов с ВП до настоящего времени не определена. Метаанализ исследований, оценивавший исходы лечения у пациентов с ВП относительно коротким (<7 дней) и более длительным (>7 дней) курсом АБТ не выявил различий между группами, однако в него не включались пациенты, госпитализированные в ОРИТ []. В связи с этим, по мнению экспертов, при тяжелой ВП неуточненной этиологии продолжительность АБТ должна составлять не менее 10 дней.
Выбор оптимальной продолжительности АБТ у пациентов с нетяжелой ВП зависит от различных факторов – возраста, сопутствующих заболеваний, наличия осложнений, скорости “ответа” на стартовую АБТ, характеристик назначенного АБП, выявляемых возбудителей.
Более длительные курсы АБТ (14-21 день) рекомендуются при развитии осложнений заболевания (эмпиема, абсцесс), наличии внелегочных очагов инфекции, инфицировании такими возбудителями, как S.aureus, Legionella spp., неферментирующие микроорганизмы (P.aeruginosa и др.) [].
При решении вопроса об отмене рекомендуется руководствоваться следующими критериями достаточтости АБТ:
К критериям достаточности АБТ ВП относят следующие:
-
стойкое снижение температуры тела <37,2ºС в течение не менее 48 ч;
-
отсутствие интоксикационного синдрома;
-
частота дыхания <20/мин (у пациентов без хронической ДН);
-
отсутствие гнойной мокроты (за исключением пациентов с ее постоянной продукцией);
-
количество лейкоцитов в крови <10 х 109/л, нейтрофилов <80%, юных форм <6%;
-
отсутствие отрицательной динамики на рентгенограмме ОГП (при ее выполнении в указанные сроки).
Сохранение отдельных клинических, лабораторных симптомов и признаков ВП не является абсолютным показанием к продолжению АБТ или ее модификации – таблица 9. В подавляющем большинстве случаев их разрешение происходит самостоятельно или на фоне симптоматической терапии.
Длительность применения противовирусных препаратов (оселтамивир, занамивир) обычно составляет 5-10 дней [].
Рентгенологические признаки ВП разрешаются медленнее клинических симптомов и лабораторных изменений. Обратное развитие воспалительного процесса связано со снижением интенсивности тени инфильтрации вплоть до полного ее исчезновения [].
Длительность обратного развития пневмонии может различаться в широких пределах, но обычно составляет 3-4 недели. Контрольное рентгенологическое исследование в эти сроки позволяет выявить нормальную картину или остаточные изменения в легких в виде локальных участков уплотнения легочной ткани или деформации легочного рисунка.
Однако, в случае длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматики необходимо провести дифференциальную диагностику ВП с другими заболеваниями.
3.5.Этиотропная АБТ ВП
Рекомендации по выбору АБП в случае выявления конкретного возбудителя ВП представлены в таблице 12. Следует отметить, что, несмотря на эмпирический выбор АБП для стартовой терапии, у госпитализированных пациентов, особенно при тяжелом течении ВП, должны быть предприняты максимальные усилия, направленные на установление этиологии ВП с последующей де-эскалацией АБТ и назначением препаратов, наиболее активных в отношении выявленного возбудителя [].
| Возбудитель | Препараты выбора | Альтернативные препараты |
|---|---|---|
|
S. pneumoniae |
Амоксициллин |
ЦС: |
|
S. pneumoniae |
Амоксициллин в высокой дозе |
Ванкомицин |
|
C. pneumoniae, |
Доксициклин |
ФХ: |
|
M. pneumoniae |
Макролиды |
ФХ: |
|
H. influenzae |
ИЗП: |
Карбапенемы: |
|
S.aureus |
Оксациллин |
ФХ: |
|
S.aureus метициллино-резистентные штаммы |
Линезолид |
Ванкомицин |
|
Legionella spp. |
Левофлоксацин ± Рифампицин |
Доксициклин ± Рифампицин |
|
Enterobacteriaceae (БЛРС -) |
ЦС: |
Карбапенемы: |
|
Enterobacteriaceae (БЛРС +) |
Карбапенемы: |
Пиперациллин/тазобактам |
|
P. aeruginosa |
Карбапенемы: |
|
|
C. burnetii |
Доксициклин |
ФХ: |
Примечание: АГ – аминогликозиды, ИЗП – ингибиторозащищенные пенициллины, ФХ – фторхинолоны, ЦС – цефалоспорины
1 только при подтвержденной чувствительности возбудителя
| АМП | Режим дозирования |
|---|---|
|
Азитромицин |
0,5 г внутрь каждые 24 ч (3-дневный курс) |
|
Амикацин |
15-20 мг/кг/сут в/в каждые 24 ч |
|
Амоксициллин |
0,5 г внутрь каждые 8 ч или 1 г внутрь каждые 12 ч |
|
Амоксициллин/клавуланат |
0,5 г внутрь каждые 8 ч или 0,875 г внутрь каждые 12 ч |
|
Амоксициллин/сульбактам |
0,5 г внутрь каждые 8 ч или 0,875 г внутрь каждые 12 ч, |
|
Ампициллин |
1,0-2,0 г в/в, в/м каждые 6 ч |
|
Ампициллин/сульбактам |
1,5-3 г в/в, в/м каждые 6-8 ч |
|
Ванкомицин |
15-20 мг/кг в/в каждые 12 ч |
|
Гемифлоксацин |
0,32 г внутрь каждые 24 ч |
|
Гентамицин |
3-5 мг/кг/сут в/в каждые 24 ч |
|
Доксициклин |
0,2 г внутрь каждые 12 ч |
|
Занамивир |
10 мг ингаляционно каждые 12 ч |
|
Имипенем |
1 г в/в каждые 6-8 ч |
|
Кларитромицин |
0,5 г внутрь каждые 12 ч |
|
Клиндамицин |
0,6-0,9 г в/в каждые 8 ч |
|
Левофлоксацин |
0,5 г внутрь или в/в каждые 12-24 ч |
|
Линезолид |
0,6 г внутрь или в/в каждые 12 ч |
|
Меропенем |
1-2 г в/в каждые 8 ч (возможна 3-х часовая инфузия) |
|
Метронидазол |
0,5 г внутрь каждые 8 ч |
|
Моксифлоксацин |
0,4 г внутрь или в/в каждые 24 ч |
|
Оксациллин |
2,0 г в/в, в/м каждые 4-6 ч |
|
Осельтамивир |
75-150 мг внутрь каждые 12 ч |
|
Офлоксацин |
0,4 г внутрь или в/в каждые 12 ч |
|
Пиперациллин/тазобактам |
4,5 г в/в каждые 6-8 ч |
|
Рифампицин |
0,45-0,6 г внутрь или в/в каждые 24 ч |
|
Тобрамицин |
3-5 мг/кг/сут в/в каждые 24 ч |
|
Цефазолин |
2,0 г в/в, в/м каждые 8-12 ч |
|
Цефдиторен |
0,4 г внутрь каждые 12 ч |
|
Цефепим |
2,0 г в/в каждые 8-12 ч |
|
Цефоперазон/сульбактам |
4 г в/в, в/м каждые 12 ч |
|
Цефотаксим |
1,0-2,0 г в/в, в/м каждые 6-8 ч |
|
Цефтазидим |
2,0 г в/в, в/м каждые 8 ч |
|
Цефтаролин |
0,6 г в/в каждые 12 ч |
|
Цефтриаксон |
1,0-2,0 г в/в, в/м каждые 12-24 ч |
|
Ципрофлоксацин |
0,5-0,75 г внутрь каждые 12 ч |
|
Эртапенем |
1 г в/в или в/м каждые 24 ч |
3.4.2.Респираторная поддержка
Острая ДН является ведущей причиной летальности пациентов с ВП, в связи с чем адекватная респираторная поддержка – важнейший компонент лечения данной группы пациентов наряду с системной АБТ []. По данным проспективных исследований, госпитальная летальность у пациентов с ВП, нуждающихся в проведении ИВЛ, составляет 46% [].
-
Респираторная поддержка показана всем пациентам с ВП при РаО2 < 55 мм рт.ст. или SрO2 < 88% (при дыхании воздухом).
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Главной задачей лечения острой ДН является обеспечение нормальной оксигенации организма, т.к. выраженная гипоксия обладает потенциально летальными эффектами []. Оптимальным является поддержание SрO2 в пределах 88-95% или PaO2 – в пределах 55-80 мм рт ст.
Гипоксемия при ВП чаще всего коррегируется ингаляциями кислорода, по показаниям используются другие методы — неинвазивная вентиляция легких (НВЛ), искусственная вентиляция легких (ИВЛ), в отдельных случаях — экстракорпоральная мембранная оксигенация (ЭКМО) [].
-
В случае умеренной гипоксемии (SpO2 80-88%) при условии достаточного респираторного усилия больного, сохраненном сознании гипоксемию следует коррегировать ингаляциями кислорода.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Кислородотерапия проводится при помощи простой носовой маски (FiO2 45-50%) или маски с расходным мешком (FiO2 75-90%).
Если не достигаются «целевые» параметры оксигенации (см. выше), либо их достижение сопровождается нарастанием респираторного ацидоза и выраженной работой дыхания больного, следует рассмотреть вопрос о вентиляции легких []. Кислородотерапия не должна использоваться вместо респираторной поддержки, если есть абсолютные показания к ее применению.
Показания к ИВЛ при острой ДН на фоне ВП представлены в таблице 14.
-
ИВЛ показана всем пациентам с ВП при остановке дыхания, нарушении сознания, психомоторном возбуждении или нестабильной гемодинамике.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Подходы к ИВЛ при ВП без выраженной асимметрии между легкими существенно не отличаются от тактики при ОРДСВ − используется тактика протективной вентиляции легких (с использованием малых VT и подхода «открытого легкого»), что позволяет значительно уменьшить риск вентилятор-ассоциированного повреждения легких [].
Особую сложность представляет проблема проведения вентиляционного пособия больным с острой ДН на фоне несимметричного (унилатерального) поражения легких. При массивном поражении одного легкого наблюдается значительное различие легочного комплайенса − более низкое в пораженном легком и более высокое в здоровом, или менее пораженном легком. В такой ситуации пораженное (более жесткое) легкое получает меньшую часть дыхательного объема. Использование положительного давления на выдохе (РЕЕР) в данной ситуации, как правило, неэффективно, и может даже быть вредно: для того чтобы расправить альвеолы в пораженном легком, необходим такой уровень РЕЕР, что возможно перерастяжение здоровых альвеол, приводящее к снижению общего комплайенса легких и повышению риска баротравмы []. Предложено несколько подходов для улучшения оксигенации у больного с односторонней пневмонией: использование фармакологических препаратов (ингаляционный оксид азота); периодическое придание больному положения на здоровом боку (decubitus lateralis); раздельная вентиляция легких с учетом разного комплайенса и различной потребности РЕЕР в здоровом и «больном» легком [].
|
Абсолютные: |
|
|
|
|
Относительные: |
|
|
|
|
Альтернативой традиционной респираторной поддержке является НВЛ — вентиляционное пособие без постановки искусственных дыхательных путей (интубационной или трахеостомической трубок), что позволяет позволяющая избежать развития многих инфекционных и механических осложнений ИВЛ и, в то же время, обеспечить эффективное восстановление газообмена и достижение разгрузки дыхательной мускулатуры у больных с острой ДН []. Показания для НВЛ представлены в таблице 15.
-
Следует рассмотреть возможность использования НВЛ вместо ИВЛ у пациентов с сохраненным сознанием, способности кооперации с врачом и стабильной гемодинамике.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Для проведения НВЛ при ВП необходим строгий отбор больных. Применение НВЛ при тяжелой ВП особенно обосновано у больных с фоновым заболеванием ХОБЛ, при условии хорошего дренирования дыхательных путей и на ранних этапах развития острой ДН []. Предикторами неуспеха НВЛ при ВП являются []:
-
PaO2/FiO2 ≤ 127 мм рт.ст. при поступлении;
-
PaO2/FiO2 ≤ 149 мм рт.ст. после 1 ч НВЛ
НВЛ также может быть использована для отлучения больных от респиратора после длительной инвазивной респираторной поддержки [].
|
|
|
-
В случаях крайне тяжелой ДН и рефрактерной гипоксемии у пациентов с тяжелой ВП следует рассмотреть возможность проведения ЭКМО.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Быстрота прогрессирования острой ДН у больных с тяжелой ВП диктует необходимость осуществить заблаговременный контакт с центром, располагающим возможностями проведения ЭКМО. ЭКМО проводится в отделениях, имеющих опыт использования данной технологии: стационары, в которых есть специалисты, в т.ч. хирурги, перфузиологи, владеющие техникой канюлизации центральный сосудов и настройкой ЭКМО []. Показания и противопоказания к ЭКМО представлены на таблице 16.
|
Потенциальные показания к ЭКМО |
|
|
Противопоказания к ЭКМО |
|
1 Характер персистирования зависит от динамики процесса (несколько часов для быстропрогрессирующих состояний и до 48 часов в случае стабилизации)
3.4.4.Неантибактериальная терапия
Среди ЛС, относящихся к адъювантной терапии ВП, наибольший интерес представляют системные ГКС, внутривенные иммуноглобулины (ИГ), некоторые иммуностимуляторы.
Глюкокортикостероиды
Целесообразность назначения ГКС рассматривается в первую очередь при тяжелой ВП, осложненной СШ. При прогрессирующем системном воспалении, возникшем в результате инфекции и сопровождающемся развитием органных нарушений, ГКС способствуют ограничению его деструктивного влияния с помощью различных геномных и негеномных эффектов [].
Среди ГКС в терапии СШ предпочтение отдается гидрокортизону. Выбор данного ЛС обусловлен тем, что, наряду с общими эффектами, гидрокортизон является синтетическим аналогом кортизола, которому принадлежит ключевая роль в поддержание естественной адаптивной реакции на стресс, регуляции сосудистого тонуса и поддержании целостности эндотелия []. В наибольшей степени позитивный гемодинамический эффект гидрокортизона наблюдается у лиц с относительной надпочечниковой недостаточностью [].
-
Назначение гидрокортизона в дозе 200-300 мг/сутки рекомендуется пациентам с ВП, осложненной СШ < 1 сут., рефрактерном СШ или необходимости использования норадреналина (НА) в дозе, превышающей 0,5 мкг/кг/мин.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Ввыполненных к настоящему времени метаанализах применение гидрокортизона у пациентов с СШ сопровождалось более быстрым и устойчивым регрессом индекса тяжести органной дисфункции, статистически значимым увеличением доли больных, вышедших из шока, сокращением длительности вазопрессорной поддержки и ИВЛ, уменьшением сроков пребывания в ОРИТ []. При этом не выявлено увеличения риска таких клинически значимых НЛР ГКС, как суперинфекции, желудочно-кишечные кровотечения и полинейропатия [].
Среди предлагаемых режимов наиболее обоснованным выглядит инфузионный путь введения гидрокортизона со скоростью 10 мг/час после нагрузочной дозы 100 мг. Через 2 дня необходимо оценить эффект от включения ГКС в схему терапии ТВП; длительность их назначения не должна превышать 7 дней.
-
Рутинное использование ГКС у пациентов с ОРДС без СШ, их назначене другим категориям больных тяжелой ВП не рекомендуется.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
В последнее десятилетие усилились дискуссии по поводу целесообразности добавления низких доз ГКС в терапию ОРДСВ у больных без СШ. Этому способствовало, содной стороны, появление новых сведений о роли ГКС — в частности, активация ГКС- рецепторов на альвеоцитах, макрофагах и ряде циркулирующих клеток стала рассматриваться в качестве важнейшего шага для восстановления локального гомеостаза при остром повреждении лёгких []. С другой стороны, интерес к ГКС вырос в связи с эпидемическими вспышками новых вирусных инфекций (тяжёлый острый респираторный синдром, птичий и свиной грипп), при которых острое повреждение лёгких является ведущим патологическим синдромом [].
Внескольких РКИ показано, что пролонгированное введение метилпреднизолона в низких дозах (1 мг/кг/сутки), наряду со снижением содержания ряда провоспалительных цитокинов в крови и/или БАЛ приводило к более быстрому приросту коэффициента оксигенации, сопровождающемуся статистически значимым сокращением длительности ИВЛ []. При этом пациенты на фоне введения ГКС имели сравнимую с контрольной группой частоту таких НЛР, как суперинфекции и кровотечения [].
Втоже время необходимо принять во внимание тот факт, что пациенты с инфекционной природой ОРДС входили в данные исследования субпопуляционно, и только около половины из них приходилось на лиц с пневмонией []. Осторожное отношение к назначению ГКС при ОРДСВ связано с неопределённостью временного окна для начала терапии, оптимального препарата (гидрокортизон, метилпреднизолон) и режима его дозирования.
Продолжается изучение возможностей использования ГКС у пациентов с тяжелой ВП без проявлений СШ, однако их клинические преимущества остаются противоречивыми.
Иммуноглобулины
Использование ИГ при терапии инфекций, осложненных сепсисом основано на разнообразных эффектах: нейтрализация бактериальных токсинов и ряда других компонентов клеточной стенки, повышение клиренса липополисахарида, опсонизация бактерий, способствующая их фагоцитозу и ускорению процесса антиген-презентации, снижение бактериальной колонизации, ограничение митогенной способности бактерий, ослабление воспалительного ответа за счёт снижения секреции провоспалительных медиаторов и связывания циркулирующих цитокинов, восстановление реактивности клеток при феномене «иммунного паралича» [].
Наибольшие перспективы при лечении сепсиса связаны с использованием поликлональных ИГ, которые в ходе метаанализа РКИ продемонстрировали снижение относительного риска смерти по сравнению с плацебо, при этом более высокая эффективность выявлена для препаратов, обогащенных IgM [].
-
Рутинное применение внутривенных ИГ у пациентов с тяжелой ВП, осложненной сепсисом нецелесообразно ввиду ограниченной доказательной базы и гетерогенности исследуемой популяции больных
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Несмотря на положительные результаты РКИ, однозначно рекомендовать применение внутривенных ИГ пациентам с ВП, осложненной сепсисом преждевременно. Это связано со следующими ограничениями имеющейся доказательной базы: крайняя разнородность групп по основной нозологии и небольшое количество пациентов во многих РКИ, различные конечные точки оценки эффективности, разные режимы дозирования ИГ (от 0,5 до 2,0 г/кг на курс терапии), разные препараты [].
Гетерогенность септических больных по особенностям течения системного воспаления, тяжести органно-системных нарушений и прогнозу требует поиска и выделения субпопуляций больных, в которых назначение ИГ способно оказать наиболее значимый эффект.
Вкачестве подходов для скрининга и выделения пациентов с наиболее высокой ожидаемой пользой от назначения ИГ следует использовать шкалы тяжести общего состояния, тяжести органных расстройств, детекцию в крови эндотоксина.
Иммуностимуляция
Внастоящее время благодаря внедрению современных технологий интенсивной терапии большинство пациентов с тяжёлым инфекциями, в том числе осложнёнными СШ, переживает первую фазу системного воспаления – неконтролируемое гипервоспаление []. Однако, у некоторых из них через несколько дней или недель может формироваться состояние, которое характеризуются пониженной реактивностью в отношении любого повреждающего фактора.
Для сепсис-индуцированной иммуносупрессии характерно снижение фагоцитарной активности моноцитов, их антигенпрезентирующей способности, торможение синтеза провоспалительных цитокинов и увеличение секреции антивоспалительных медиаторов и негативных костимулирующих молекул. Среди последних особое значение имеет моноцитарно-макрофагальный протеин PD-1 (programmed death 1), который индуцирует апоптоз, повышает секрецию ИЛ-10, блокирует пролиферацию Т-лимфоцитов []. Помимо дисфункции лимфоцитов у данной категории больных наблюдается обусловленное апоптозом снижение количества как Т, так и В-клеток [].
Установленные изменения при СШ явились основанием для проведения экспериментальных и клинических исследований ЛС, способных восстанавливать активность лейкоцитов, в том числе гранулоцит-колониестимулирующего фактора (ГКСФ) и гранулоцит-макрофаг-колониестимулирующего фактора (ГМКСФ).
Интерес к ГКСФ связан с его способностью усиливать фагоцитоз, образование и созревание нейтрофилов []. Эффекты ГМКСФ заключаются в индукции пролиферации и дифференцировки нейтрофилов, моноцитов, макрофагов, дендритных клеток, повышении экспрессии HLA-DR рецепторов на моноцитах, увеличении продукции провоспали- тельных цитокинов в ответ на стимуляцию эндотоксином [].
Эффективность ГКСФ и ГМКСФ изучалась в ряде РКИ при сепсисе с различной локализацией первичного очага. Следует отметить, что мета-анализ РКИ не выявил повышения выживаемости при добавлении к терапии ГКСФ и ГМКСФ. Однако в группе активной терапии по сравнению с плацебо отмечалось более быстрое разрешение проявлений системной воспалительной реакции (СВР) [].
Эффективность ГКСФ и ГМКСФ исследовалась отдельно при ТВП с развитием сепсиса и СШ. Позитивные результаты, выражающиеся в повышении выживаемости, получены только в одном исследовании, включавшем 18 пациентов с тяжелой ВП, осложнившейся формированием сепсиса и СШ []. При этом пациенты контрольной группы оказались тяжелее по шкале АРАСНЕ II – 31 vs 25 баллов, и имели более высокое исходное содержание в крови ИЛ-6.
-
Рутинное назначение ГКСФ и ГМКСФ при тяжелой ВП на основании клинических критериев сепсиса нецелесообразно.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Результаты исследований свидетельствуют о том, что ориентация на критерии сепсиса/тяжёлого сепсиса/СШ при определении показаний к назначению ГКСФ и ГМКСФ недостаточна, поскольку в исследование попадают пациенты с различными проявлениями иммунологической дисфункции, в том числе и без иммуносупрессии [].
Для успешного выбора кандидатов к проведению иммуностимуляции необходимо понимание фенотипа воспалительного ответа. В настоящее время мы не располагаем необходимыми фундаментальными знаниями и диагностическими критериями, раскрывающими особенности ответа макроорганизма на инфекцию, и, соответственно, не можем надлежащим образом индивидуализировать иммунотерапию у постели больного.
Статины
Статины являются ключевой группой гиполипидемических ЛС, что обусловлено их способностью обратимо ингибировать редуктазу ГМГ-КоА — ключевой фермент биосинтеза холестерина у человека []. В последнее время появились исследования о наличии у статинов дополнительного противовоспалительного и иммуномодулирующего действия, связанного с блокадой синтеза мевалоната. Мевалонат является прекурсором популяции изопреноидов, влияющих на распределение клеточных мембранных протеинов ссигнальными свойствами, в том числе контролирующих реакцию воспаления. Статины снижают провоспалительный потенциал лейкоцитов, ограничивая либерацию цитокинов, хемокинов и других реактантов острой фазы воспаления [].
-
Назначение статинов как препаратов с противовоспалтельной активностью при ВП не рекомендуется.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Преимущества включения данной группы ЛС в комплексную терапию ВП изучались в семи исследованиях, при этом в пяти из них показано снижение летальности в группе статинов []. Однако доказательств, позволяющих рекомендовать рутинное использование статинов при инфекциях, включая ВП, пока недостаточно, т.к. большинство исследований по дизайну являлись наблюдательными, носили ретроспективный характер, при оценке эффективности в них использовались различные конечные точки и длительность приема препаратов.
Кроме того, ВП не является официально зарегистрированным показанием для применения данной группы ЛС.
-
Всем пациентам с тяжелой ВП показано назначение парентеральных антикоагулянтов.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
При тяжелой ВП повышается риск системных тромбоэмболий []. С целью профилактики на весь период ограниченной двигательно активности (постельный режим) рекомендуется назначение низкомолекулярных гепаринов или нефракционированного гепарина в профилактических дозах.
-
Всем пациентам с тяжелой ВП показано назначение антисекреторных препаратов (ингибиторы протонной помпы, Н2-блокаторы) для профилактика “стрессовых” язв.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
4.Реабилитация
Внастоящее время не разработана.
5.Профилактика и диспансерное наблюдение
Наиболее эффективными средствами вторичной профилактики ВП в настоящее время являются пневмококковые и гриппозные вакцины.
Сцелью специфической профилактики инвазивных пневмококковых инфекций, в том числе пневмококковой ВП с бактериемией у взрослых используется 23-валентная неконъюгированная вакцина, содержащая очищенные капсулярные полисахаридные антигены 23 серотипов S. pneumoniae и 13-валентная пневмококковая конъюгированная вакцина [].
-
Вакцинация пневмококковыми вакцинами рекомендуется всем пациентам с высоким риском развития инвазивных пневмококковых инфекций.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Кгруппам высокого риска развития инвазивных пневмококковых инфекций относятся:
— Пациенты в возрасте 65 лет и старше;
— Лица с сопутствующими хроническими заболеваниями бронхолегочной (ХОБЛ, бронхиальная астма в сочетании с хроническим бронхитом и эмфиземой, принимающих длительно системные ГКС), сердечно-сосудистой систем (ИБС, ХСН, кардиомиопатии и др.), СД, хроническими заболеваниями печени (включая цирроз), ХБП, нефротическим синдромом, алкоголизмом, кохлеарными имплантами, ликвореей, функциональной или органической аспленией (серповидно-клеточная анемия, спленэктомия);
— Пациенты с иммунодефицитом (ВИЧ-инфекция, злокачественные новообразо- вания, иммуносупрессивная терапия и др.);
— Лица, проживающие в домах престарелых и других учреждениях закрытого типа;
— Курильщики.
-
Пациенты > 65 лет и иммунокомпрометированные пациенты старше 50 лет должны быть первоначально вакцинированы однократно конъюгированной, а затем (не ранее чем через 8 нед) полисахаридной пневмококковой вакциной.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
К иммунокомпрометированным относятся лица с с врождёнными и приобретёнными иммунодефицитами (в т.ч. ВИЧ-инфекцией и ятрогенными иммунодефицитами); пациенты, страдающие нефротическим синдромом/ХБП и требующие диализа; лица с кохлеарными имплантами (или подлежащие кохлеарной имплантации); ликвореей; пациенты, страдающие гемобластозами и получающие иммуносупрессивную терапию; лица с врождённой или приобретённой (анатомической или функциональной) аспленией; гемоглобинопатиями (в т.ч. серповидно-клеточной анемией); находящиеся в листе ожидания на трансплантацию органов или после таковой.
-
Пациентам 18-64 лет, не относящимся к группе иммунокомпрометированных рекомендуется вакцинация полисахаридной пневмококковой вакциной однократно.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
-
Пациентам > 65 лет и иммунокомпрометированным пациентам, получившим ранее конъюгированную вакцину рекомендуется ревакцинация полисахаридной пневмококковой вакциной каждые 5 лет.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
-
Введение гриппозной вакцины рекомендуется всем пациентам с высоким риском осложненного течения гриппа.
Уровень убедительности рекомендаций I (Уровень достоверности доказательств С) [].
Комментарии:
Кгруппам риска осложненного течения гриппа относятся: — Пациенты в возрасте 65 лет и старше;
— Лица с сопутствующими хроническими заболеваниями бронхолегочной, сердечно-сосудистой системы, СД, заболеваниями почек, крови, нервной системы (эпилепсия, миопатии и др.);
— Лица с иннупосупрессией (включая ВИМ и прием иммунодепрессантов);
— Беременные;
— Пациенты с морбидным ожирением (индекс массы тела ≥40 кг/м2);
— Лица, проживающие в домах престарелых и других учреждениях закрытого типа
Вакцинация также рекомендуется медицинским работникам, осуществляющим лечение и уход за лицами, входящими в группы высокого риска осложнений гриппа. Вакцинация гриппозной вакциной проводится ежегодно, оптимальное время для проведения вакцинации — октябрь-первая половина ноября []. Предпочтение у взрослых следует отдавать инактивированным вакцинам [].
Следует отметить, что при наличии показаний обе вакцины (пневмококковая и гриппозная) могут вводиться одновременно без увеличения частоты НЛР или снижения иммунного ответа [].
Так как ВП является острым заболеванием, в диспансеризации такие пациенты не нуждаются. Следует, однако, отметить, что у пациентов после ВП в течение года риск смерти остается повышенным по сравнению с общей популяцией []. Одной из причин может являться развитие/декомпенация сердечно-сосудистых заболеваний, провоцирую- щихся эпизодом ВП.
6.Дополнительная информация, влияющая на течение и исход
6.1.Осложнения ВП
Кчислу осложнений ВП относятся: парапневмонический плеврит; эмпиема плевры; абсцесс легкого; ОРДСВ; острая ДН; СШ; ПОН; ателектазы; вторичная бактериемия с гематогенными очагами диссеминации — менингит, абсцессы головного мозга и печени, кожи и мягких тканей, эндокардит, перикардит); миокардит; нефрит и др. [].
Абсцесс легкого — патологический процесс инфекционной этиологии, характеризующийся формированием более или менее ограниченной полости в легочной ткани (> 2 см в диаметре) вследствие ее некроза и последующего гнойного расплавления [].
Развитие абсцесса легкого как осложнения ВП связывают, прежде всего, с анаэробными возбудителями — Bacteroides spp., F. nucleatum, Peptostreptococcus spp. и др. – нередко в сочетании с энтеробактериями или S. aureus []. В качестве препаратов выбора для эмпирической терапии используют ИЗП (амоксициллин/клавуланат, ампициллин/ сульбактам, амоксициллин/сульбактам), цефоперазон/сульбактам или пиперациллин/ тазобактам. Альтернативные режимы — комбинация цефалоспоринов III-IV поколения (цефотаксим, цефтриаксон, цефепим) или фторхинолонов с клиндамицином или метронидазолом, либо монотерапия карбапенемами.
Длительность АБТ определяется индивидуально с учетом клинико-лабораторных и рентгенологических данных, но, как правило, составляет не менее 2 (в среднем 3-4) недель []. У части пациентов консервативное лечение дополняется чрезкожным или эндоскопическим дренированием абсцесса, одним из показаний к является неэффективность АБТ [].
Эмпиема плевры (гнойный плеврит) — патологический процесс, характеризующийся скоплением гноя в плевральной полости и являющийся неблагоприятным вариантом течения экссудативного плеврита [].
При эмпиеме, ассоциированной с ВП (с абсцессом легкого или без него), наиболее часто выявляются стрептококки, в т.ч. S. pneumoniae и анаэробы (Bacteroides spp., Fusobacterium spp., Peptostreptococcus spp.); более редкими возбудителями являются S.aureus и энтеробактерии [].
Для эмпирической терапии эмпиемы как осложнения ВП или при стерильном гнойном выпоте препаратами выбора являются ИЗП (амоксициллин/клавуланат, ампициллин/сульбактам, амоксициллин/сульбактам), цефоперазон/сульбактам, пиперациллин/тазобактам; к альтернативным режимам АБТ относятся цефалоспорины III- IV поколений или фторхинолоны, назначаемые в комбинации с линкозамидами или метронидазолом, карбапенемы [].
При эмпиеме плевры целесообразно начинать с в/в введения АБП, в дальнейшем при стабилизации состояния возможен их пероральный прием. Продолжительность АБТ определяется индивидуально с учетом клинико-лабораторных и рентгенологических данных, но обычно составляет не менее 2 нед []. Как правило, наряду с АБТ приходится прибегать к торакотомическому дренированию, и в редких случаях – к торакоскопии и декортикации.
6.2.Пациенты с ВП, на отвечающие на лечение
Убольшинства больных ВП через 3-5 дней эффективной терапии отмечается снижение температуры тела и постепенный регресс основных клинических проявлений заболевания, а также лабораторных маркеров воспаления и органной дисфункции (тяжелая ВП).
Вто же время часть пациентов с пневмонией, особенно при тяжелом течении, не отвечает на лечение, что может проявляться прогрессированием ДН и необходимостью проведения ИВЛ, развитием СШ, усугублением проявлений ПОН.
Отсутствие ответа на терапию в ранние сроки помимо очевидных причин, таких как неадекватная АБТ и инфузионная терапия, недостаточная респираторная поддержка, в большинстве случаев связано с развитием осложнений пневмонии, декомпенсацией сопутствующих заболеваний и/или сменой возбудителя/нозокомиальной суперинфекцией []. Такие пациенты требуют тщательного мониторинга, т.к. летальность в группе не ответивших на лечение существенно возрастает.
При неэффективности стартовой терапии необходимо провести дополнительные лабораторные и инструментальные исследования с целью выявления осложнений ВП, декомпенсации сопутствующих заболеваний, пересмотреть режим АБТ с учетом полученных результатов микробиологических исследований, оценить необходимость интенсификации респираторной поддержки и показания к адъювантной фармакотерапии (тяжелая ВП).
Неэффективность АБТ у амбулаторных пациентов при ее адекватном выборе должно рассматриваться как одно из показаний к госпитализации [].
Уряда пациентов может отмечаться более медленное разрешение клинических симптомов ВП с отсроченным достижением показателей клинической стабильности; это может сопровождаться отсутствием рентгенологического разрешения очагово-инфильтра- тивных изменений в легких или их прогрессированием (медленно разрешающаяся или неразрешающаяся пневмония) [].
Кфакторам риска неадекватного (позднего) ответа на лечение относят пожилой возраст (> 65 лет), наличие хронических сопутствующих заболеваний (ХОБЛ, ХСН, почечная и печеночная дисфункция, злокачественные новообразования, СД и др.), мультилобарная инфильтрация, наличие полостей деструкции, экссудативного плеврита или эмпиемы плевры, лейкопения, бактериемия, выявление высоковирулентных возбудителей (L. pneumophila, энтеробактерии), особенно при наличии факторов риска инфицирования ПРВ, внелегочные очаги инфекции, нерациональная эмпирическая АБТ.
Схема обследования пациента с медленно разрешающейся ВП представлена на рисунке 2.

Рис. 2 Схема обследования пациента с медленно разрешающейся (затяжной) ВП
Упациентов с медленно разрешающейся ВП, помимо поиска потенциальных причин неэффективности лечения, важное значение приобретает дифференциальная диагностика с другими инфекционными и неинфекционными заболеваниями, которые могут протекать под маской пневмонии.
6.3. Дифференциальная диагностика
ВП приходится дифференцировать более чем с 100 заболеваниями различной этиологии инфекционной и неинфекционной природы, включая инфильтративный туберкулез легких, злокачественные новообразования и метастазы в легочную паренхиму, ТЭЛА, обострение ХОБЛ и БА, декомпенсацию ХСН, лекарственные поражения легких, васкулиты – таблица 17 [].
|
Новообразования
|
|
ТЭЛА и инфаркт легкого |
|
Иммунопатологические заболевания
|
|
Прочие заболевания/патологические состояния
|
Для туберкулеза легких характерна большая длительность симптомов (недели и месяцы), незначительный лейкоцитоз (< 12х109/л в сочетании с лимфопенией и моноцитозом), низкие концентрации биомаркеров воспаления, чаще встречается инфильтрация верхних долей лёгких. В отличие от пневмонии при туберкулезе легких не происходит быстрого регресса клинических симптомов на фоне адекватной АБТ [].
Сцелью скрининга при подозрении на туберкулез может использоваться внутрикожный диагностический тест, содержащий антигены M. tuberculosis (диаскинтест), квантифероновый тест и его аналоги, культуральное исследование и/или ПЦР-диагностика клинических образцов (мокрота, БАЛ, плевральная жидкость) на M. tuberculosis; бактериоскопия мазков мокроты, окрашенных по Цилю-Нильсену, характеризуется низкой чувствительностью [].
При внезапном развитии или быстром прогрессировании ДН наряду с жалобами на кашель и/или дискомфорт в грудной клетке важно исключить ТЭЛА и инфаркт- пневмонию; “золотым” стандартом при этом является КТ-ангиопульмонография. При сборе анамнеза следует учитывать наличие факторов риска ТЭЛА (недавнее оперативное вмешательство, тромбоз глубоких вен, злокачественное новообразование, длительный постельный режим, гиподинамия и др.), особенности клинической картины (кровохарканье, выраженная инспираторная одышка до степени удушья), результаты инструментальных (признаки перегрузки правых отделов сердца при эхокардиографии, выбухание лёгочного конуса, зоны олигемии, дисковидные ателектазы, фокусы уплотнения при рентгенографии органов грудной полости) и лабораторных исследований (нормальный уровень D-димера в сыворотке крови с высокой вероятностью исключает ТЭЛА) [].
7.Критерии качества медицинской помощи (госпитализированные пациенты)
| № п/п | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
|---|---|---|---|
|
1. |
Выполнен осмотр врача-терапевта и/или врача-пульмонолога не позднее 1 ч (15 мин при тяжелой пневмонии) с момента поступления в стационар |
2 |
В |
|
2. |
Выполнена пульсоксиметрия не позднее 30 минут с момента поступления в стационар |
2 |
B |
|
3. |
Выполнена рентгенография ОГП в передней прямой и боковой проекциях не позднее 1 ч с момента поступления в стационар |
2 |
A |
|
4. |
Выполнен общий (клинический) анализ крови развернутый |
2 |
A |
|
5. |
Выполнен биохимический анализ крови (мочевина, креатинин, электролиты, печеночные ферменты, билирубин, глюкоза, альбумин) |
2 |
A |
|
6. |
Выполнено бактериологическое исследование мокроты или трахеального аспирата (у пациентов на ИВЛ) у госпитализированных больных |
2 |
B |
|
7. |
Выполнены тесты на пневмококковую и легионеллезную антигенурию (тяжелая пневмония) |
2 |
B |
|
8. |
Выполнено культуральное исследование двух образцов крови (тяжелая пневмония) |
2 |
А |
|
9. |
Введение первой дозы АМП не позднее 4 ч (1 ч при тяжелой пневмонии) с момента установления диагноза |
2 |
А |
|
10. |
Назначена стартовая АБТ в соответствии с клиническими рекомендациями |
2 |
А |
|
11. |
Назначена оксигенотерапия при SpО2 ниже 88% |
1 |
A |
|
12. |
Проведена терапия, направленной на коррекцию циркуляторных нарушений (введение инфзионных растворов, по показаниям -вазопрессоров и системных ГКС ) при СШ |
2 |
A |
|
13. |
Достигнута стойкая нормализация температуры тела (>72 часов) |
2 |
B |
|
14. |
Выполнен перевод на пероральный прием АБП при достижении критериев клинической стабильности |
2 |
A |
8.Список литературы
-
Abraham E., Reinhart K., Opal S., et al. OPTIMIST Trial Study Group: Efficacy and safety of tifacogin (recombinant tissue factor inhibitor) in severe sepsis: a randomized controlled trial. JAMA 2003, 290:238-247.
-
Alejandria M.,Lansang MA., Dans L.,et al. Intravenous immunoglobulin for treting sepsis and septic shock. Cochrane Database Syst Rev 2002 (1):CD001090.
-
Angus D.C., Marrie T.J., Obrosky D.S., et al. Severe community-acquired pneumonia: use of intensive care services and evaluation of American and British Thoracic Society diagnostic criteria. Am J Respir Crit Care Med 2002; 166: 717–23.
-
Annane D. Corticosteroids for severe sepsis: an evidence- based guide for physicians. Ann Intensive Care 2011; 1: 7-13.
-
Annane D., Bellissant E., Bollaert P-E., et al. Corticosteroids in treatment severe sepsis and septic shock in adults. A systematic review. JAMA 2009; 301(22): 2362-2375.
-
Annane D., Sebille V., Bellisant E., et al. Effect of low doses of corticosteroids in septic schock patients with or without early acute respiratory distress syndrome. Crit Care Med 2006; 34: 22-30.
-
Annane D., Sebille V., Charpentier C., et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA 2002;288:862-871.
-
Barbera J.A., Iglesia H., Cabello et al. Inhaled nitric oxide reduce intrapulmonary shunt in acute severe pneumonia. Am J Respir Crit Care Med 2000; 161 (Suppl): A849.
-
Bo L., Wang F., Zhu J., et al. Granulocyte-colony stimulating factor(G-CSF) and Granulocyte- macrophage colony stimulating factor(GM-CSF) for sepsis: meta-analysis. Crit Care 2011; 15: R58.
-
Bone R.C., Balk R.A., Cerra F.B. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis: the ACCP/SCCM consensus conference committee. Chest 1992; 101: 1644-1655.
-
Bridges C.B., Coyne-Beasley T., on behalf of the Advisory Committee on Immunization Practices. Advisory Committee on Immunization Practices Recommended Immunization Schedule for Adults Aged 19 Years or Older: United States, 2014. Ann Intern Med 2014; 160: 190-197.
-
Chalmers J.D., Singanayagam A., Murray M.P., et al. Prior statin use is associated with improved outcomes in community-acquired pneumonia. Am J Med 2008; 121: 1002–1007.
-
Charles P.G.P., Wolfe R., Whitby M., et al. SMART-COP: a tool for predicting the need for intensive respiratory or vasopressor support in community-acquired pneumonia. Clin Infect Dis 2008; 47: 375-384.
-
Cheng A.C., Stephens D.P., Currie B.J. Granulocyte-Colony Stimulating Factor (G-CSF) as an adjunct to antibiotics in the treatment of pneumonia in adults. Cochrane Database Syst Rev 2007, (2): CD004400.
-
Confalonieri M., Potena A., Carbone G., et al. Acute respiratory failure in patients with severe community-acquired pneumonia. A prospective randomized evaluation of noninvasive ventilation. Am J Respir Crit Care Med 1999; 160: 1585-1591.
-
Cronin L., Cook D., Carlet J., et al. Corticosteroid treatment for sepsis: a critical appraisal and meta-analysis of the literature. Crit Care Med 1995; 23:1430-1439.
-
Ehrchen J., Steimuller L., Barczyk K., et al. Glucocorticoids induce differentiation of specefically activated anti-inflammatory subtype of human monocytes. Blood 2007; 109(3): 1265-1274.
-
Ewig S., Schafer H., Torres A. Severity assessment in community-acquired pneumonia. Eur Respir J 2000; 16: 1193-1201.
-
Ewig S., Woodhead M., Torres A. Towards a sensible comprehension of severe community- acquired pneumonia. Intensive Care Med 2011; 37: 214–223.
-
Fine M.J., Smith M.A., Carson C.A., et al. Prognosis and outcomes of patients with community- acquired pneumonia. A meta-analysis. JAMA 1996; 275:134-141.
-
Fine M.J., Auble T.E., Yealy D.M., et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Engl J Med 1997; 336: 243-50.
-
Haque K.N., Remo C., Bahakim H. Comparison of two types of intravenous immunoglobulins in the treatment of neonatal sepsis. Clin Exp Immunol 1995; 101: 328–33.
-
Huang T.-S., Shyu Y.-C., Chen H.-Y., et al. Effect of parenteral selenium supplementation in critically ill patients: a systematic review and meta-analysis. PLos One 2013; 8(1): e54431.
-
Jolliet P., Abajo B., Pasquina P., et al. Non-invasive pressure support ventilation in severe community-acquired pneumonia. Intensive Care Med 2001; 27: 812- 821.
-
Kellum J., Kong L., Fink M., et al. Undestanding the inflammatory cytokin response in pneumonia and sepsis. Arch Intern Med 2007; 167: 1655-1663.
-
Kim D.-K., Poudel B. Tools to Detect Influenza Virus. Yonsei Med J 2013; 54(3): 560-566.
-
Kopterides P., Falagas M. Statins for sepsis: a critical and update review. Clin Microbiol Inf 2009; 15: 325-334.
-
Kozlov R., Dekhnich A., Edelstein M., et al. Summary of comparative in vitro ceftaroline activity against major bacterial pathogens in Russia (2008-2012): results of multicenter study (Cerberus study). Proceedings of IDWeek 2013, San Francisco, CA, US. 2-6 October 2013, Abstract # 713.
-
Kreymann K.G., de Heer G., Nierhaus A., at al. Use polyclonal immunoglobulin as adjunctive therapy for severe sepsis and septic shock. Crit Care Med 2007; 35: 2677-2685.
-
Laupland K., Rirpatrick A., Delaney A. Polyclonal immunoglobulin for treatment severe sepsis and septic shock in crically ill audults. A systematic review and meta-analysis. Crit Care Med 2007; 35: 2686-2692.
-
Lim W.S., Baudouin S.V., George R.C., et al. British Thoracic Society guidelines for the management of community-acquired pneumonia in adults – update 2009. Thorax 2009; 64 (Suppl III): iii1-55.
-
Lim W.S., van der Eerden M.M., Laing R., et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax 2003; 58: 377- 82.
-
Mandell L.M., Wunderink R.G, Anzueto A., et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community- Acquired Pneumonia in Adults. Clin Infect Dis 2007; 44 (Suppl 2): S27-72.
-
Marik P. Glucocorticods in sepsis: dissecting facts from fiction. Crit Care 2011;15:158.
-
Marik P., Pastores S., Annane D., et al. Recommendation for the diagnosis and management of corticosteroid insufficiency in critically ill patients: Consensus statements from an international task force by American College of Critical Care Medicine. Crit Care Med 2008; 36(6): 1937-1949.
-
Martín-Loeches I., Lisboa T., Rodríguez A., et al. Combination antibiotic therapy with macrolides improves survival in intubated patients with community-acquired pneumonia. Intensive Care Med. 2010; 36: 612–620.
-
McArthur J., Quasney M. The role of selenium in sepsis. Open Iflamm Journal 2011; 4(S1): 115- 119.
-
Meduri U., Golden E., Freire A., et al. Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial. Chest 2007; 131: 954-963.
-
Meisel C., Schefold J.C., Pschowski R., et al.Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression: a double-blind, randomized, placebo-controlled multicenter trial. Am J Respir Crit Care Med 2009; 180:640-648.
-
Menendez R., Torres A., Reyes S., et al. Initial management of pneumonia and sepsis: factors associated with improved outcome. Eur Respir J 2012; 39: 156–162.
-
Minneci P., Deans K., Eichacker P., et al. The effects of steroids during sepsis depend on dose and severety of illness: an updated meta-analysis. Clin Microbiol Inf 2009; 15:308-318.
-
Mortensen E.M., Coley C.M., Singer D.E., et al. Causes of death for patients with community- acquired pneumonia: results from the Pneumonia Patient Outcomes Research Team cohort study. Arch Intern Med 2002;162:1059–64.
-
Pascual F.E., Matthay M.A., Bacchetti P., et al. Assessment of prognosis in patients with community-acquired pneumonia who require mechanical ventilation. Chest 2000; 117(2): 503– 12.
-
Pavia A.T. What is the Role of Respiratory Viruses in Community-Acquired Pneumonia? What is the Best Therapy for Influenza and Other Viral Causes of Community-Acquired Pneumonia? Infect Dis Clin N Am 2013; 27: 157–175.
-
Ranieri M., Thompson T., Barie P., et al. Drotrecogin alfa (activated) in adults with septic shock. NEJM 2012; 366: 2055–2064.
-
Rehn T., Cidlowski J. Antiflammatory action of glucocorticoids: new mechanisms for old drugs. NEJM 2005; 353:1711-1723.
-
Restrepo M.I., Mortensen E.M., Velez J.A., et al. A comparative study of community-acquired pneumonia patients admitted to the ward and the ICU. Chest 2008; 133: 610–7.
-
Rodriguez A., Lisboa T., Blot S., et al. Mortality ICU patients with bacterial community acquired pneumonia: when antibiotics are not enough. ICM 2009; 35: 430-438.
-
Shedel I., Dreilhausen U., Nentwig B. Treatment of gram-negative septic shock with an immunoglobulin preparation: a prospective, randomazed clinical trial. Crit Care Med 1991; 19: 1104-1113.
-
Sibila O., Meduri U., Mortensen E.M., et al. Improving the 2007 Infectious Disease Society of America/American Thoracic Society severe community-acquired pneumonia criteria to predict intensive care unit admission. Journal of Critical Care 2013; 28: 284–290.
-
Sibila O., Restrepo M.I., Anzueto A. What is the Best Antimicrobial Treatment for Severe Community-Acquired Pneumonia (Including the Role of Steroids and Statins and Other Immunomodulatory Agents). Infect Dis Clin N Am 2013; 27: 133–147.
-
Sligl W., Miner DA., Sundurr S. et al. Safety and efficacy of corticosteroids for the treatment of septic shock: sistematic review and meta-analysis.CID 2009;49:93-101.
-
Sligl W.I., Asadi L., Eurich D.T., et al. Macrolides and Mortality in Critically Ill Patients With Community-Acquired Pneumonia: A Systematic Review and Meta-Analysis. Crit Care Med 2014; 42: 420–432.
-
Sligl W.I., Marrie T.J. Severe Community-Acquired Pneumonia. Crit Care Clin 2013; 29: 563-601.
-
Snijders D., Daniels J.M., de Graaff C.S., et al. Efficacy of corticosteroids in community-acquired pneumonia: a randomized double-blinded clinical trial. Am J Respir Crit Care Med 2010; 181: 975- 982.
-
Sprung C., Annane D.,Keh D., et al. Hydrocortisone therapy for patients with septic shock. NEJM 2008; 358: 111-124.
-
Tejerina E., Frutos V., Restrepo M.I., et al. Prognosis factors and outcome of community- acquired pneumonia needing mechanical ventilation. J Crit Care 2005; 20: 56–65.
-
The National Heart, Lung and Blood institute ARDS clinical trial Network. Efficacy and safety corticosteroids to persistent ARDS. NEJM 2006; 354:1671–1684.
-
Thomas A.R., Bryce T.L. Ventilation in the patient with unilateral lung disease. Crit Care Clinics 1998; 14: 743-773.
-
Torres A., Blasi F., Peetermans W.E., et al. The aetiology and antibiotic management of community-acquired pneumonia in adults in Europe: a literature review. Eur J Clin Microbiol Infect Dis. doi 10.1007/s10096-014-2067-1
-
Turgeon F., Hutton B., Fergusson D.A., et al. Meta-analysis: Intravenous immunoglobulin in crically ill audult patients with sepsis. Ann Int Med 2007; 146: 193 — 203.
-
Vincent J.L., Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. Intensive Care Medicine 1996; 22: 707-710.
-
Vincent J.L., Opal S., Marshall J., et al. Sepsis definition: time to change. Lancet 2013; 381: 774- 775.
-
Welte T., Torres A., Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2010. doi:10.1136/thx.2009.129502.
-
Woodhead M., Blasi F., Ewig S. and the ERS/ESCMID Task Force. Guidelines for the management of adult lower respiratory tract infections. Clin Microbiol Infect 2011; 17 (Suppl. 6): 1-59.
-
Wunderink R., Laterre P-F.,Francois B., et al. Recombinant tissue factor pathway inhibitor in severe CAP. Am J Respir Crit Care Med 2011; 183: 1561-1568.
-
Wunderink R.G., Waterer G.W. Community-Acquired Pneumonia. N Engl J Med 2014; 370: 543-51.
-
Wysocki M., Antonelli M. Noninvasive mechanical ventilation in acute hypoxaemic respiratory failure. Eur Respir J 2001; 18: 209-220.
-
Zangrillo A., Biondi-Zoccai G., Landoni G., et al. Extracorporeal membrane oxygenation (ECMO) in patients with H1N1 influenza infection: a systematic review and meta-analysis including 8 studies and 266 patients receiving ECMO. Critical Care 2013; 17: R30.
-
Ежлова Е.Б., Демина Ю.В., Шеенков Н.В., и соавт. Лабораторная диагностика внебольничных пневмоний. Методические указания МУК 4.2.3115 -13. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. Москва, 2013.
-
Заболеваемость населения России в 2012 году. Статистические материалы. Москва, 2013.
-
Иванчик Н.В., Козлов С.Н., Рачина С.А., и соавт. Этиология фатальных внебольничных пневмоний у взрослых. Пульмонология 2008; 6: 53-58.
-
Рачина С.А., Козлов Р.С. Современные подходы к микробиологической диагностике при внебольничной пневмонии. Пульмонология 2010; №5: 5-14.
-
Рачина С.А., Козлов Р.С., Шаль Е.П., и соавт. Анализ антибактериальной терапии госпитализированных пациентов с внебольничной пневмонией в различных регионах РФ: уроки многоцентрового фармакоэпидемиологического исследования Клин микробиол антимикроб химиотер 2009; 11: 66-78.
-
Рачина С.А., Козлов Р.С., Шаль Е.П., и соавт. Структура бактериальных возбудителей внебольничной пневмонии в многопрофильных стационарах г. Смоленска. Пульмонология 2011; 1: 5-18.
-
Руднов В.А., Дрозд А.В, Гусев Е.Ю. Закономерности формирования системной воспалительной реакции при внебольничной пневмонии. Уральский медицинский журнал 2007; №6: 27-31.
-
Руднов В.А., Фесенко А.А., Дрозд А.В. Сравнительный анализ информационной значимости шкал для оценки тяжести состояния больных с внебольничной пневмонией, госпитализированных в ОРИТ. Клин микробиол антимикроб химиотер 2007; 9: 330-336.
-
Сивая О.В., Козлов Р.С., Кречикова О.И., и соавт. Антибиотикорезистентность Haemophilus influenzae в России: результаты многоцентрового проспективного исследования ПеГАС. Клин микробиол антимикроб химиотер 2014; 16: 57-69.
-
Справочник по антимикробной химиотерапии. Выпуск 3. Под ред. Р.С. Козлова, А.В. Дехнича. Смоленск: МАКМАХ, 2013.
-
Трифанова Н.М., Лещенко И.В. Факторы риска летального исхода при тяжелой внебольничной пневмонии. Уральский медицинский журнал 2008; 13: 114-121.
-
Фесенко О.В., Синопальников А.И. Современные системы оценки внебольничной пневмонии тяжёлого течения: перспективы и ограничения. Клин микробиол антимикроб химиотер 2011; 13: 204-213.
-
Чучалин А.Г., Синопальников А.И., Козлов Р.С., и соавт. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике (пособие для врачей). Клин микробиол антимикроб химиотер 2010; 12: 186-225.
Приложение 1. Состав рабочей группы
Чучалин Александр Григорьевич, Председатель Правления РРО, академик РАН, профессор, д.м.н.
Синопальников Александр Игревич, Заведующий кафедрой пульмонологии ГБОУ ДО “Российская медицинская академия последипломного образования” Министерства здравоохранения РФ, Вице-президент МАКМАХ, профессор, д.м.н.
Козлов Роман Сергеевич, Директор научно-исследовательского института антимикробной химиотерапии, и.о. ректора ГБОУ ВО «Смоленский государственный медицинский университет» Министерства здравоохранения РФ, Президент МАКМАХ, Член-корр. РАН, профессор, д.м.н.
Авдеев Сергей Николаевич, Заместитель директора ФГБУ «НИИ пульмонологии» ФМБА России, главный внештатный пульмонолог Минздрава РФ Член-корр. РАН, профессор, д.м.н.
Тюрин Игорь Евгеньевич, Заведующий кафедрой заведующий кафедрой рентгенологии и радиологии ГБОУ ДО “Российская медицинская академия последипломного образования” Министерства здравоохранения РФ, главный внештатный специалист по лучевой диагностике Минздрава РФ, профессор, д.м.н.
Руднов Владимир Александрович, Заведующий кафедрой анестезиологии и реаниматологии ФГБУ ВО “Уральский государственный медицинский университет”, руководитель службы анестезиологии и реанимации ГБУЗ СО «Свердловский областной онкологический диспансер», Вице-президент МАКМАХ, профессор, д.м.н.
Рачина Светлана Александровна, Доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. академика В.С Моисеева ФГАО ВО “Российский университет дружбы народов”, д.м.н.
Фесенко Оксана Вадимовна, Профессор кафедры пульмонологии ГБОУ ДПО “Российская медицинская академия последипломного образования” Министерства здравоохранения РФ, д.м.н.
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение 2. Методология разработки клинических рекомендаций
Представленные Рекомендации разработаны на основе Российских рекомендаций по диагностике и лечению внебольничной пневмонии у взрослых 2010 г. четвертого пересмотра, Российских клинических рекомендаций по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых 2014 г., рекомендаций английских, американских и европейских экспертов по диагностике и лечению внебольничной пневмоини у взрослых 2007-2012 гг.
Целевая аудитория данных клинических рекомендаций:
терапевты,
пульмонологи,
врачи общей практики,
реаниматологи,
клинические фармакологи
Вданных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Уровни убедительности рекомендаций и достоверности доказательств
| I | Доказательства и/или единое мнение, что диагностическая процедура или вид лечения являются эффективными и полезными. |
|---|---|
|
II |
Противоречивые данные и мнения об эффективности/пользе лечения |
|
II a |
Соотношение данных/ мнений в пользу эффективности/пользы лечения |
|
II b |
Соотношение данных/ мнений в отношении эффективности/пользы не совсем установлены. |
|
III |
Данные или единое мнение, что лечение/ процедура не является полезным, эффективным, а в ряде случаев может быть даже опасным. |
| A | Данные получены по результатам множества рандомизированных клинических исследований или мета-анализов. |
|---|---|
|
B |
Данные получены по результатам 1-го рандомизированного исследования или масштабных исследований с неопределенными результатами. |
|
C |
Единое мнение экспертов и/или небольшие неконтролируемые исследования, ретроспективные исследования, регистры |
Порядок обновления клинических рекомендаций
Клинические рекомендации обновляются каждые 3 года.
Связанные документы
Данные клинические рекомендации разработаны с учётом следующих нормативно-правовых документов:
Приказ Минздрава России от 15.11.2012 № 516н «Об утверждении Порядка оказания медицинской помощи по профилю «пульмонология»
Приказ Минздрава России от 7 июля 2015 г. N 422ан «Об утверждении критериев оценки качества медицинской помощи»
Постановлением Правительства Российской Федерации «О порядке и условиях признания лица инвалидом» от 20 февраля 2006гю №95 (в ред. Постановлений Правительства РФ от 07.04.2008 № 247, от 30.12.2009 № 1121, от 06.02.2012 №89, от 16.04.2012 № 318, от 04.09.2012 № 882). Изменения, которые вносятся в Правила признания лица инвалидом, утвержденные Постановлением Правительства Российской Федерации от 7 апреля 2008г. № 24
Приказ Министерства Здравоохранения и Социального развития Российской Федерации от 17 декабря 2015 г. № 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
Приложение 3. Шкалы и алгоритмы оценки прогноза при ВП, определения критериев госпитализации в ОРИТ и выявления органной дисфункции
I. Шкала PORT (PSI) [1]
Алгоритм оценки риска неблагоприятного прогноза

| Параметр | Баллы |
|---|---|
|
Демографические характеристики |
|
|
Мужчина |
возраст (лет) |
|
Женщина |
возраст (лет) — 10 |
|
Пребывание в доме престарелых/ учреждении длительного ухода |
+ 10 |
|
Сопутствующие заболевания |
|
|
Злокачественное новообразование |
+ 30 |
|
Серьезные хронические заболевания печени |
+ 20 |
|
Застойная сердечная недостаточность |
+ 10 |
|
Цереброваскулярные заболевания |
+ 10 |
|
Серьезные хронические заболевания почек |
+ 10 |
|
Физикальные признаки |
|
|
Нарушение сознания |
+ 20 |
|
Частота дыхания ≥ 30/мин |
+ 20 |
|
Систолическое давление < 90 мм рт.ст. |
+ 20 |
|
Температура < 35°С или ≥ 40°С |
+ 15 |
|
Пульс ≥ 125/мин |
+ 10 |
|
Лабораторные и рентгенологические данные |
|
|
рН артериальной крови < 7,35 |
+ 30 |
|
Мочевина сыворотки крови > 10,7 ммоль/л |
+ 20 |
|
Натрий сыворотки крови < 130 ммоль/л |
+ 20 |
|
Глюкоза сыворотки крови > 14 ммоль/л |
+ 10 |
|
Гематокрит < 30% |
+ 10 |
|
РаО2 < 60 мм рт.ст. или SaO2 < 90% |
+ 10 |
|
Плевральный выпот |
+ 10 |
| Класс риска | I | II | III | IV | V |
|---|---|---|---|---|---|
|
Число баллов |
— |
< 70 |
71–90 |
91–130 |
> 130 |
|
Летальность, % |
0,1–0,4 |
0,6–0,7 |
0,9–2,8 |
8,5–9,3 |
27–31,1 |
|
Место лечения |
Амбулаторно |
Амбулаторно |
Кратковре- менная госпитализация |
Стационар |
Стационар (ОРИТ) |
II. Шкала CURB/CRB-65 [2]
I. Алгоритм оценки риска неблагоприятного прогноза и выбора места лечения при ВП по шкале CURB-65

II. Алгоритм оценки риска неблагоприятного исхода и выбора места лечения при ВП по шкале CRB-65

III. Шкала SMART-COP/SMRT-CO [3]
I.Оцениваемые параметры в шкале SMART-COP/SMRT-CO
| Значение показателя | Баллы | |
|---|---|---|
|
S |
Систолическое АД< 90 мм рт. ст. |
2 |
|
M |
Мультилобарная инфильтрация на рентгенограмме ОГК |
1 |
|
A |
Содержание альбумина в плазме крови < 3,5 г/дл* |
1 |
|
R |
ЧДД > 25/мин в возрасте < 50 лет и > 30/мин в возрасте > 50 лет |
1 |
|
T |
ЧСС > 125/мин |
1 |
|
C |
Нарушение сознания |
1 |
|
O |
Оксигенация: PaO2* < 70 мм рт. ст. или SpO2 < 94% или PaO2/FiO2 <333 в возрасте < 50 лет PaO2* < 60 мм рт. ст. или SpO2 < 90% или PaO2/FiO2 <250 в возрасте > 50 лет |
2 |
|
P |
pH* артериальной крови < 7,35 |
2 |
|
Общее кол-во баллов |
* Не оцениваются в шкале SMRT-CO
II. Интерпретация SMART-COP
| Баллы | Потребность в респираторной поддержке и вазопрессорах |
|---|---|
|
0-2 |
Низкий риск |
|
3-4 |
Средний риск (1 из |
|
5-6 |
Высокий риск (1 из 3) |
|
>7 |
Очень высокий риск (2 из 3) |
III. Интерпретация SMRT-CO
| Баллы | Потребность в респираторной поддержке и вазопрессорах |
|---|---|
|
0 |
Очень низкий риск |
|
1 |
Низкий риск (1 из 20) |
|
2 |
Средний риск (1 из 10) |
|
3 |
Высокий риск (1 из 6) |
|
>4 |
Высокий риск (1 из 3) |
Приложение 4. Правила получения клинического материала для микробиологического исследования при ВП
Правила получения венозной крови для культурального исследования
-
Для сбора крови используются специальные герметично закрывающиеся стеклянные флаконы или флаконы из ударопрочного автоклавируемого пластика двух видов, содержащие питательную среду (для выявления аэробов и анаэробов).
-
С целью бактериологического исследования до АБТ забираются 2 образца венозной крови с интервалом 20-30 минут из различных периферических вен — например, левой и правой локтевой вены. Один образец помещается во флакон для выделения аэробов, другой для выделения анаэробов.
-
Объем крови при каждой венепункции должен составлять не менее 10 мл.
-
При получении образцов крови необходимо соблюдать следующую последовательность действий:
-
Произвести дезинфекцию кожи в месте венепункции циркулярными движениями от центра к периферии дважды 70% раствором спирта или 1-2% раствором йода.
-
Дождаться полного высыхания дезинфектанта. Не касаться места венепункции после обработки кожи.
-
Произвести получение крови шприцем и асептически перенести ее во флакон с транспортной средой непосредственно через резиновую пробку.
-
Удалить оставшийся йод с поверхности кожи после венепункции, чтобы избежать ожога.
-
-
До момента транспортировки образец вместе с направлением хранится при комнатной температуре или в термостате. Необходимо стремиться к тому, чтобы время доставки образца в лабораторию не превышало 2 ч.
Правила получения свободно отделяемой мокроты для культурального исследования
-
Для сбора мокроты необходимо использовать стерильные герметично закрывающиеся пластиковые контейнеры.
-
Перед сбором мокроты необходимо попросить пациента тщательно прополоскать рот кипяченой водой. Если мокрота собирается утром – лучше собирать ее натощак.
-
Пациент должен хорошо откашляться и собрать отделяемое из нижних дыхательных путей (не слюну!) в стерильный контейнер.
-
Продолжительность хранения мокроты при комнатной температуре не должна превышать 2 ч. При невозможности доставки в указанный срок образец может хранится в холодильнике при температуре +4-8°C до 24 ч.
-
Для облегчения процедуры сбора мокроты и повышения качества собираемого образца целесообразно использовать памятки для пациентов.
Для получения индуцированной мокроты можно использовать следующие приемы:
-
Дренажные положения (постуральный дренаж).
-
Упражнения дыхательной гимнастики.
-
Вибрационный массаж грудной клетки.
-
Ультразвуковые ингаляции в течение 15-20 минут с использованием гипертонического раствора хлорида натрия в концентрации 3-7%. У пациентов с бронхиальной астмой ингаляции должны проводиться с осторожностью, для предупреждения бронхоспазма целесообразно предварительно провести ингаляцию 200-400 мкг сальбутамола.
Правила получения трахеального аспирата для культурального исследования
-
Для получения трахеального аспирата используют систему для сбора содержимого трахеобронхиального дерева через эндотрахеальную трубку.
-
С этой целью стерильный катетер вакуум-аспиратора соединяют с клапанным вакуум- контролем с заглушкой на системе, другой конец системы подсоединяют к эндотрахеальной трубке.
-
Включают вакуум-аспиратор и собирают в пробирку системы содержимое трахеобронхиального дерева в количестве не менее 1 мл. Время сбора трахеального аспирата не должно превышать 5-10 секунд.
-
Отсоединяют аспиратор, эндотрахеальную трубку от системы, снимают крышку со встроенными катетерами и закрывают пробирку дополнительной завинчивающейся крышкой.
-
Продолжительность хранения трахеального аспирата при комнатной температуре не должна превышать 2 ч. При невозможности доставки в указанный срок образец может хранится в холодильнике при температуре +4-8°C до 24 ч.
Правила получения плевральной жидкости для культурального исследования
-
Очистите выбранный участок кожи 70% этиловым спиртом; затем продезинфицируйте его 1-2 % раствором иода; избыток иода удалите марлевой салфеткой, смоченной 70% спиртом во избежание ожога кожи пациента.
-
С тщательным соблюдением правил асептики выполните чрезкожную аспирацию для получения пробы плевральной жидкости.
-
Удалите любые пузырьки воздуха из шприца и немедлено перенесите пробу в стерильный пластиковый контейнер, плотно закроете его крышкой.
-
Продолжительность хранения плеврального пунктата при комнатной температуре не должна превышать 2 ч. При невозможности доставки в указанный срок образец может хранится в холодильнике при температуре +4-8°C до 24 ч.
Правила получения респираторных мазков для обследования на грипп методом ПЦР
-
Перед процедурой нельзя в течение 6 ч использовать медикаменты, орошающие носоглотку или ротоглотку и препараты для рассасывания во рту.
-
Мазки у пациента берут двумя разными зондами сначала со слизистой нижнего носового хода, а затем из ротоглотки, при этом концы зондов с тампонами после взятия мазков последовательно помещаются в одну пробирку объемом 1,5-2 мл с 0,5 мл транспортной среды.
-
Для получения респираторного мазка со слизистой носоглотки, если полость носа заполнена слизью, рекомендуется провести высмаркивание.
-
Сухой стерильный зонд из полистирола с вискозным тампоном или назофарингеальный велюр-тампон на пластиковом аппликаторе вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (5 см).
-
После получения материала конец зонда с тампоном опускают на глубину 1 см в стерильную одноразовую пробирку с транспортной средой, и конец зонда отламывают, придерживая крышкой пробирки. Пробирку герметично закрывают.
-
Для получения респираторного мазка из ротоглотки необходимо предварительно прополоскать полость рта кипяченой водой комнатной температуры.
-
Мазки из ротоглотки берут сухим стерильным зондом из полистирола с вискозным тампоном вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки, аккуратно прижимая язык пациента шпателем.
-
После получения материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с транспортной средой и зондом с мазком из носоглотки. Конец зонда с тампоном (1 см) отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
-
Транспортировка образца в лабораторию осущесвляется в течение 2 ч при комнатной температуре. Допускается хранение образца в течение 3 сут. при температуре 2–8°С.
Самым частым возбудителем пневмонии является пневмококк (бактерия, относящаяся к группе стрептококков). От 30 до 50% всех пневмоний вызвано именно пневмококком. Также, достаточно часто пневмонию вызывают микоплазма и хламидия (pneumoniae)-20-30%. У людей, страдающих хроническими заболеваниями (сахарный диабет, хроническая обструктивная болезнь легких, хроническая сердечная недостаточность и др.) пневмонию могут вызвать и другие бактерии. Вызвать пневмонию способны и вирусы, наиболее часто это вирус гриппа, коронавирусы, риносинцитиальный вирус и другие. При этом вирусная пневмония может быть, как первичная, вызванная непосредственно вирусом, так и вторичная бактериальная, которая может сочетаться с первичным вирусным поражением легких так и быть самостоятельным поздним осложнением вирусной инфекции.
В основном клиника пневмонии имеет достаточно характерные симптомы, позволяющие врачу заподозрить этот диагноз. Чаще всего это кашель (сухой или с выделением мокроты), повышение температуры тела, может быть боль в грудной клетке, одышка, слабость, потливость. Однако, у некоторых пациентов, например, у пожилых, клиническая картина может быть достаточно стертой и преобладают симптомы интоксикации (резкая слабость, отсутствие аппетита, сонливость, заторможенность или беспокойство, даже спутанность сознания, когда человек дезориентирован или «заговаривается»). При этом температура может повышаться до невысоких цифр.
После расспроса и осмотра пациента, для подтверждения диагноза пневмонии, назначается развернутый клинический анализ крови и рентгенография органов грудной клетки в прямой и боковой проекции. Кроме того, желательно также определять уровень СРБ в крови потому, что доказана связь между уровнем повышения СРБ и тяжестью течения пневмонии, распространенностью воспалительной инфильтрации в легких и прогнозом лечения.
В большинстве случаев, при классическом течении пневмонии, выполнение компьютерной томографии не требуется. При лечении внебольничной пневмонии в амбулаторных условиях микробиологическое исследование мокроты чаще всего не проводится так как в основном не оказывает существенного влияния на выбор антибактериальных препаратов.
Установив диагноз внебольничной пневмонии, врач назначает лечение. При современном уровне медицины лечение внебольничной пневмонии чаще всего проводится в амбулаторных условиях. Основная группа препаратов — это антибиотики широкого спектра действия. Выбор антибактериального препарата, его дозировка и длительность применения — это прерогатива только врача. Самолечение в случае внебольничной пневмонии может привести к ухудшению состояния, развитию осложнений и в конечном счете к удлинению сроков выздоровления.
Кроме того, при внебольничной пневмонии могут быть назначены муколитики или противокашлевые препараты (при мучительном сухом кашле). Назначение иммуномодуляторов, витаминов, пробиотиков при лечении пневмонии не имеет доказанной эффективности.
Обычно, у пациентов, находящихся на амбулаторном режиме возникает много «бытовых» вопросов:
- Могу ли я принять душ? Да, если нет высокой температуры и резкой слабости, головокружения. Вы даже можете помыть голову.
- Можно ли мне выходить на улицу, я чувствую себя значительно лучше. Да можно позволить себе прогулки на свежем воздухе.
- Я же пью антибиотики, мне нужно принимать пробиотики или выпить противогрибковый препарат? Нет, в 99% случаев этого не требуется
Эффективность назначенной антибактериальной терапии оценивается в течение 48-72 часов. За это время, если антибактериальный препарат «работает», снижается температура тела (ниже чем 37.5), улучшается общее самочувствие (появляется аппетит, уменьшается общая слабость). Оптимальная продолжительность антибактериальной терапии при внебольничной пневмонии не превышает 7 дней. Однако, длительность приема антибиотика определяет только врач. Антибактериальная терапия не приводит к рассасыванию воспалительного экссудата в альвеолах, поэтому курс лечения антибиотиками значительно меньше, чем срок рассасывания пневмонического фокуса рентгенологически.
«Красные флаги» в течении внебольничной пневмонии:
- сохраняющееся повышение температуры тела выше 38 гр. на фоне лечения антибактериальным препаратом более 72 часов.
- нарастающая одышка (частота дыхательных движений более 30 в мин).
- резкое снижение А/Д ниже 90/60 мм.рт.ст.
- появление или усиление имеющейся ранее боли в груди при дыхании.
- появление кровохарканья (примесь крови в мокроте)
- нарушение сознания.
- снижение уровня сатурации в крови (если у Вас дома есть пульсоксиметр) ниже 92%
В этих случаях нужно немедленно вызывать СМП для решения вопроса о госпитализации.
Дополнительно вопрос о стационарном лечении даже при отсутствии «красных флагов» должен быть рассмотрен в следующих случаях:
- возраст пациента старше 60 лет;
- наличие сопутствующих заболеваний (хроническая обструктивная болезнь легких, тяжелое или крайне тяжелое течение с дыхательной недостаточностью, бронхоэктатическая болезнь с частыми обострениями, злокачественные новообразования, сахарный диабет, хроническая почечная недостаточность и некоторые другие).
В большинстве случаев при внебольничной пневмонии у иммунокомпетентных пациентов молодого или среднего возраста нормализация температуры тела происходит на 2-4-й день лечения, а рентгенологическое «выздоровление» наступает в срок 2-4 нед. Поэтому контрольная рентгенография легких выполняется в среднем не ранее, чем через 10 дней от начала лечения.
Профилактика
Самой эффективной профилактикой тяжёлых и осложнённых форм пневмонии является вакцинация от пневмококковой инфекции.
Внебольничная пневмония
Статьи
Опубликовано в журнале:
Медицина для всех
№ 2 (17), 2000 — »» КЛИНИЧЕСКАЯ МИКРОБИОЛОГИЯ И АНТИМИКРОБНАЯ ТЕРАПИЯ
А.И. СИНОПАЛЬНИКОВ, доктор медицинских наук, профессор, кафедра терапии. АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
Согласно современным данным, около 75% всех назначений антибиотиков приходится на инфекции верхних (отит, синусит, фарингит) и нижних (обострение хронического бронхита, пневмония) инфекций дыхательных путей. В этой связи представляется чрезвычайно актуальной разработка подходов к рациональной антибактериальной терапии респираторных инфекций, прежде всего пневмонии, как патологии, имеющей наибольшее медико-социальное значение.
Пневмония — острое инфекционное заболевание преимущественно бактериальной этиологии, характеризующееся очаговым поражением респираторных отделов легких с внутриальвеолярной экссудацией, выявляемым при объективном и рентгенологическом обследовании, выраженными в различной степени лихорадочной реакцией и интоксикацией.
Классификация
В настоящее время с клинической точки зрения наиболее предпочтительна классификация пневмонии, учитывающая условия, в которых развилось заболевание, особенности инфицирования легочной ткани, а также состояние иммунологической реактивности организма больного. Правильный учет перечисленных факторов облегчает врачу этиологическую ориентированность в большинстве случаев заболевания.
В соответствии с этой классификацией выделяют следующие виды пневмонии:
- внебольничная (приобретенная вне лечебного учреждения) пневмония (синонимы: домашняя, амбулаторная);
- нозокомиальная (приобретенная в лечебном учреждении) пневмония (Госпитальная пневмония — симптомокомплекс, характеризующийся появлением спустя 48 часов и более от момента госпитализации нового легочного инфильтрата в сочетании с клиническими данными, подтверждающими его инфекционную природу (новая волна лихорадки, гнойная мокрота, лейкоцитоз и др.) и при исключении инфекций, которые находились в инкубационном периоде при поступлении больного в стационар) (синонимы: внутрибольничная, госпитальная);
- аспирационная пневмония;
- пневмония у лиц с тяжелыми дефектами иммунитета (врожденный иммунодефицит, ВИЧ-инфекция, ятрогенная иммуносупрессия).
Наиболее практически значимым является подразделение пневмоний на внебольничные (внебольнично приобретенные) и нозокомиальные (приобретенные в стационаре). Необходимо подчеркнуть, что такое подразделение никак не связано с тяжестью течения заболевания. Основным и единственным критерием разграничения является то окружение, в котором развилась пневмония.
Основные возбудители внебольничной пневмонии
Этиология внебольничной пневмонии связана главным образом с нормальной микрофлорой «нестерильных» отделов верхних дыхательных путей (Аспирация (микроаспирация) содержимого ротоглотки — основной путь инфицирования респираторных отделов легких, а значит, основной патогенетический механизм развития пневмонии, как внебольничной, так и госпитальной. Другие патогенетические механизмы развития пневмонии — вдыхание микробного аэрозоля, гематогенное распространение возбудителя, непосредственное распространение инфекции из соседних пораженных тканей — менее актуальны). Из множества видов микроорганизмов, колонизирующих верхние дыхательные пути, лишь некоторые, обладающие повышенной вирулентностью, способны при проникновении в респираторные отделы легких вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Перечень типичных бактериальных возбудителей внебольничной пневмонии представлен в табл. 1.
Таблица 1 Этиологическая структура внебольничной пневмонии
| Возбудитель | Частота обнаружения |
| Streptococcus pneumoniae | 30,5% (7-76%) |
| Mycoplasma pneumoniae | 12,5% (0-24%) |
| Chlamydia (Chlamydophila) pneumoniae | 12,5% (0-24%) |
| Legionella pneumophila | 4,8% (0-14%) |
| Haemophilus influenzae | 4,5% (1-16%) |
| Возбудители семейства Enterobacteriaceae | 3,0% (0-28%) |
| Staphylococcus aureus | 0,5% (0-4%) |
| Другие возбудители | 2,0% (0-6%) |
| Возбудитель не обнаружен | 39,5% (3-75%) |
Пневмококки (Streptococcus pneumoniae) остаются самым частым возбудителем внебольничной пневмонии. Два других часто выявляемых возбудителя — М.pneumoniae и C.pneumoniae — наиболее актуальны у лиц молодого и среднего возраста (до 20-30%); их этиологический «вклад» в старших возрастных группах более скромный (1-3%). L.pneumophila — нечастый возбудитель внебольничной пневмонии, однако легионеллезная пневмония занимает второе место после пневмококковой по частоте смертельных исходов заболевания. H.influenzae чаще вызывает пневмонию у курильщиков и больных хроническим бронхитом/хронической обструктивной болезнью легких. Escherichia coli, Klebsielia pneumoniae (редко другие представители семейства Enterobacteriaceae) — неактуальные возбудители пневмонии, как правило, у больных с известными факторами риска (сахарный диабет, застойная сердечная недостаточность, почечная, печеночная недостаточность и др.). S. aureus — наиболее вероятно связать развитие внебольничной пневмонии с этим возбудителем у лиц пожилого возраста, наркоманов, больных, переносящих грипп, и др.
Чрезвычайно важным является разделение внебольничной пневмонии по степени тяжести — на нетяжелую и тяжелую (Критерии тяжелого течения пневмонии: общее тяжелое состояние больного (цианоз, спутанность сознания, бред, температура тела > 39°С); острая дыхательная недостаточность (одышка — число дыханий > 30/мин, при спонтанном дыхании — рO2 < 60 мм рт.ст, SaO2 < 90%); кордиоваскулярноя недостаточность (тахикардия, не соответствующая степени выраженности лихорадки, систолическое АД < 90 мм рт.ст. и/или диастолическое АД < 60 мм рт.ст.); дополнительные критерии (гиперлейкоцитоз > 20*109/л или лейкопения < 4*109/л, двусторонняя или многодолевая инфильтрация легких, кавитация, массивный плевральный выпот, азот мочевины > 10,7 ммоль/л)). Среди возбудителей нетяжелой внебольничной пневмонии доминируют S.pneumoniae, М.pneumoniae, C.pneumoniae и H.influenzae, тогда как актуальными возбудителями тяжелой пневмонии наряду с пневмококком являются L.pneumophila, Enterobacteriaceae, S.aureus.
Рациональная антибактериальная терапия внебольничной пневмонии
1. Активность антибиотиков против основных возбудителей заболевания
В качестве препаратов выбора приведены антибиотики, предназначенные как для применения внутрь, так и для парентерального введения. Их назначение определяется тяжестью течения внебольничной пневмонии.
При возможности лечения в амбулаторных условиях (нетяжелая внебольничная пневмония) предпочтение следует отдавать приему антибактериальных препаратов внутрь.
S.pneumoniae. Стандартом антипневмококковой антибактериальной терапии являются бензилпенициллин и аминопенициллины. По фармакокинетическим характеристикам амоксициллин предпочтительнее ампициллина (в 2 раза лучше всасывается из желудочно-кишечного тракта). Бета-лактамные антибиотики других групп по уровню антипневмококковой активности не превосходят указанные препараты. Вопрос о выборе антибиотика при лечении пенициллинрезистентной пневмококковой инфекции до конца еще не решен. Согласно имеющимся ограниченным данным, бензилпенициллин и аминопенициллины сохраняют клиническую эффективность при инфекциях, вызванных умеренно устойчивыми и устойчивыми к пенициллину пневмококками, однако, возможно, применение цефалоспоринов 3-го поколения (цефотаксим, цефтриаксон) в таких случаях предпочтительнее. Как свидетельствуют результаты отдельных исследований, резистентность пневмококков к пенициллину и другим бета-лактамам не является существенной проблемой для России.
Из числа пневмонии исключены острые очаговые поражения респираторных отделов легких неинфекиионнои природы, сосудистого происхождения, а также входящие в симптомокомплекс отдельных высококонтагиозных инфекции (чума, брюшной тиф, грипп, сап и др.) и туберкулеза.
Высокой антипневмококковой активностью обладают макролидные антибиотики. Между 14-членными (эритромицин, кларитромицин, рокситромицин) и 15-членными (азитромицин) макролидами наблюдают полную перекрестную резистентность, при этом часть штаммов S.pneumoniae может сохранять чувствительность к 16-членным макролидам (спирамицин, джозамицин, мидекамицин). Распространенность резистентных к эритромицину пневмококков в нашей стране невелика (< 5%).
Доступные в России фторхинолоны (В настоящее время фторхинолоны с антипневмококковой активностью — так называемые респираторные фторхинолоны — (спарфлоксацин, левофлоксацин, моксифлоксацин, гатифлоксацин и др.) в России не зарегиcтрированы) (офлоксацин, ципрофлоксацин) характеризуются незначительной активностью в отношении пневмококков.
Роль тетрациклинов и особенно ко-тримоксазола как антипневмококковых препаратов ограничена вследствие распространения приобретенной устойчивости к ним возбудителя.
H.intiuenzae. Высокоактивны против гемофильной палочки аминопенициллины. Однако в настоящее время до 30% штаммов возбудителя продуцируют бета-лактамазы широкого спектра, способные разрушать природные и полусинтетические пенициллины, цефалоспорины 1-го поколения, частично цефаклор. В этой связи средствами выбора в лечении внебольничной пневмонии, вызванной штаммами H.influenzae, продуцирующими бета-лактамазы, являются «защищенные» аминопенициллины (амоксициллин/клавулановая кислота, ампициллин/сульбактам) и цефалоспорины 2-го поколения.
Высокоактивны в отношении гемофильной палочки фторхинолоны, устойчивость к ним встречается редко.
Макролиды обладают незначительной, но клинически значимой активностью.
S.aureus. Средствами выбора для лечения инфекций нижних дыхательных путей, вызванных S.aureus (с учетом продукции бета-лактамаз большинством штаммов), являются оксациллин, «защищенные» аминопенициллины, цефалоспорины 1-2-го поколения.
M.pneumoniae, C.pneumoniae. Средствами выбора для лечения микоплазменной и хламидийной пневмонии являются макролиды и тетрациклины (доксициклин). Достоверных сведений о приобретенной резистентности микроорганизмов к этим антибиотикам нет. Определенной активностью против этих внутриклеточных микроорганизмов обладают распространенные фторхинолоны (офлоксацин, ципрофлоксацин).
Legionella spp. (прежде всего L.pneumophila). Препаратом выбора для лечения легионеллезной пневмонии является эритромицин. Вероятно, равными ему по эффективности могут быть и другие макролиды (данные ограничены). Имеются сведения, обосновывающие включение рифампицина в терапию легионеллезной пневмонии в комбинации с макролидами. Высокоактивны и клинически эффективны распространенные фторхинолоны (офлоксацин, ципрофлоксацин).
Enferobacteriaceae spp. Этиологическая роль представителей семейства Enterobacteriaceae (чаще всего E.соli и Kiebsiella pneumoniae) в развитии внебольничной пневмонии неоднозначна (см. выше). Механизмы развития устойчивости (бета-лактамазы) распространенных во внебольничных условиях микроорганизмов не оказывают влияния на цефалоспорины 3-го поколения, что делает их средствами выбора.
2. Эмпирическая антибактериальная терапия внебольничной пневмонии
Среди пациентов с внебольничной пневмонией целесообразно выделить группы со сходной этиологией заболевания и, соответственно, нуждающихся в сходной антибактериальной терапии. В тех случаях, когда это возможно, выделяются антибиотики первого выбора и альтернативные (см. табл. 2).
Таблица 2 Эмпирическая антибактериальная терапия внебольничной пневмонии
| Особенности нозологической формы | Наиболее актуальные возбудители | Препараты выбора | Альтернативные препараты | Комментарии |
| Нетяжелые пневмонии у пациентов в возрасте до 60 лет без сопутствующих заболеваний | S.pneurnoniae, М.pneumoniae, Н.influenzae, С.pneumoniae | Оральные аминопенициллины или макролиды | Доксициклин | Микробиологическая диагностика (?)1 |
| Пациенты в возрасте >60 лет с сопутствующими заболеваниями | S.pneurnoniae, Н.influenzae, Enterobacteriaceae, Legionella spp., С.pneumoniae | «Защищенные» оральные аминопенициллины +/- оральные макролиды. Оральные цефалоспорины 2-го поколения +/- оральные макролиды | — | Микробиологическая диагностика (?)1 |
| Пациенты с клинически тяжелыми пневмониями независимо от возраста | S. pneumoniae, Legionella spp., Enterobacteriaceae, Staphylococcus aureus, С.pneumoniae | Парентеральные цефалоспорины 3-го поколения2 + парентеральные макролиды | Парентеральныe фторхинолоны3 | Целесообразны микробиологическое исследование мокроты, гемокультура, серологическая диагностика |
Примечания. 1Рутинная микробиологическая диагностика недостаточно информативна и не оказывает существенного влияния на выбор антибактериального перпатата.
2При тяжелом течении пневмонии использовать максимальные дозы цефотаксима или цефтриаксона.
3Офлоксацин или ципрофлоксацин.
3. Дозы и кратность введения антибиотиков
Дозы основных антибактериальных препаратов и кратность их введения взрослым больным внебольничной пневмонией представлены в табл. 3.
Таблица 3. Дозы антибактериальных препаратов и кратность их введения при внебольничной пневмонии
| Антибиотики | Доза (для взрослых) |
| Бензилпенициллин | 1-3 млн ЕД в/в с интервалом 4 ч |
| Оксациллин | 2,0 г внутривенно с интервалом 4-6 ч |
| Ампициллин | 0,5-1,0 г внутрь с интервалом 6-8 ч |
| Амоксициллин | 0,5-1,0 г внутрь с интервалом 8 ч |
| Амоксициллин/клавулановая кислота | 500 мг внутрь с интервалом 6-8 ч |
| Амоксициллин/клавулановая кислота | 1,0-2,0 г внутривенно с интервалом 6-8 ч |
| Ампициллин/сульбактам (сультамициллин) | 750,0 мг внутрь с интервалом 12 ч |
| Ампициллин/сульбактам (сультамициллин) | 1,0-2,0 г внутривенно с интервалом 8-12 ч |
| Цефазолин | 1,0-2,0 г внутривенно с интервалом 12 ч |
| Цефуроксим натрий | 0,75-1,5 г внутривенно с интервалом 8 ч |
| Цефуроксим-аксетил | 500 мг внутрь с интервалом 12 ч |
| Цефаклор | 500 мг внутрь и интервалом 8 ч |
| Цефотаксим | 1,0-2,0 г внутривенно с интервалом 4-8 ч |
| Цефтриаксон | 1,0-2,0 г внутривенно однократно в сутки |
| Эритромицин | 1,0 г внутривенно с интервалом 6 ч |
| Эритромицин | 500 мг внутрь с интервалом 6 ч |
| Кларитромицин | 500 мг внутривенно с интервалом 12 ч |
| Кларитромицин | 500 мг внутрь с интервалом 12 ч |
| Спирамицин | 1,5-3,0 млн ME (0,75-1,5 г) внутривенно с интервалом 12 ч |
| Спирамицин | 3 млн ME (1,0 г) внутрь с интервалом 12 ч |
| Азитромицин | 3-дневный курс: по 0,5 г внутрь с интервалом 24 ч; 5-дневный курс: 0,5 г в первый день, затем по 0,25 г с интервалом 24 ч |
| Мидекамицин | 400 мг внутрь с интервалом 8 ч |
| Ципрофлоксацин | 400 мг внутривенно с интервалом 12 ч |
| Офлоксацин | 400 мг внутривенно с интервалом 12 ч |
| Рифампицин | 500 мг внутривенно с интервалом 12 ч |
| Доксициклин | 200 мг внутрь с интервалом 24 ч |
4. Пути введения антибиотиков
В лечении нетяжелой внебольничной пневмонии предпочтение следует отдавать антибиотикам для приема внутрь. Напротив, при тяжелом течение заболевания антибиотики вводят внутривенно. Впрочем, в последнем случае высокоэффективным может оказаться и ступенчатая антибактериальная терапия, которая предполагает переход с парентерального на непарентеральный (обычно перорольный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента. Основная идея ступенчатой терапии заключается в уменьшении длительности парентерального введения антибактериального препарата, что минимизирует стоимость лечения и сокращает сроки пребывания больного в стационаре при сохранении высокой терапевтической эффективности. Оптимальным вариантом ступенчатой терапии является последовательное использованием двух лекарственных форм (для парентерального введения и приема внутрь) одного и того же антибиотика, что обеспечивает преемственность лечения. Переход с парентерального на пероральный способ применения антибиотика следует осуществлять при стабилизации течения или улучшении клинической картины заболевания:
- уменьшение интенсивности кашля;
- уменьшение объема экспекторируемой мокроты;
- уменьшение одышки;
- нормальная температура тела при ее двух последовательных измерениях с интервалом 8 часов.
На практике возможность перехода на пероральный способ введения антибиотика появляется в среднем через 2-3 дня после начала лечения.
5. Длительность антибактериальной терапии
При неосложненной внебольничной пневмонии антибактериальная терапия может быть завершена по достижении стойкой нормализации температуры тела (в течение 3-4 дней). При таком подходе длительность лечения обычно составляет 7-10 дней.
При наличии клинических и/или эпидемиологических данных о микоплазменной/хламидийной или легионеллезной пневмонии продолжительность антибактериальной терапии должна быть большей (риск рецидива инфекции) — 2-3 недели и 3 недели, соответственно.
Длительность введения антибактериальных препаратов при осложненных внебольничных пневмониях определяют индивидуально.
Сохранение отдельных клинических, лабораторных и/или рентгенологических признаков пневмонии не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. В большинстве случаев их разрешение происходит самопроизвольно или под влиянием симптоматической терапии.
Вместе с тем при длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматике необходимо провести ряд дополнительных исследований (повторные бактериологические исследования мокроты/бронхиального секрета, фибробронхоскопия, КТ органов грудной клетки, перфузионное сканирование легких/окклюзионная ультразвуковая флебография и др.) , в том числе и для исключения ряда серьезных синдромосходных заболеваний/ патологических состояний: локальная бронхиальная обструкция (карцинома), туберкулез, тромбоэмболия легочной артерии, застойная сердечная недостаточность и др.
6. Основные ошибки антибактериальной терапии
Широкое использование в Российской Федерации аминогликозидов /гентамицин и др.) при лечении внебольничной пневмонии.
Антибиотики этой группы реально не обладают антипневмококковой активностью.
Широкое использование ко-тримоксазола в терапии внебольничной пневмонии.
Распространенность в России штаммов S.pneumoniae, резистентных к препарату; частые кожные аллергические реакции, наличие более безопасных препаратов.
Частая смена антибиотиков в процессе лечения, «объясняемая» опасностью развития резистентности.
Показаниями для замены антибиотиков являются: а) клиническая неэффективность, о которой можно судить через 48-72 часа терапии; б) развитие серьезных нежелательных явлений, требующих отмены антибиотика; в) высокая потенциальная токсичность антибиотика (например, аминогликозиды), ограничивающая длительность его применения.
Продолжение (и модификация) антибактериальной терапии при сохранении отдельных рентгенологических и/или лабораторных признаков заболевания (очагово-инфильтративные изменения в легких, ускорение COЭ и т.д.) вплоть до их полного исчезновения.
Основным критерием для прекращения антибактериальной терапии является регресс клинических проявлений внебольничной пневмонии (прежде всего стойкая апирексия). Сохранение же отдельных лабораторных и/или рентгенологических признаков болезни не является абсолютным показанием к продолжению антибактериальной терапии (см. выше).
Частое назначение антибиотиков с нистатином.
Отсутствие доказательств клинической эффективности нистатина при кандидозе у больных внебольничной пневмонией без иммунодефицита, необоснованные экономические затраты.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)