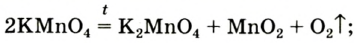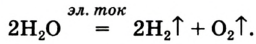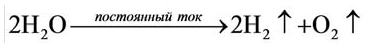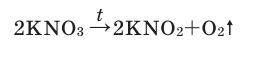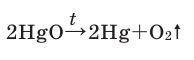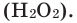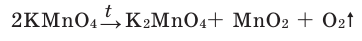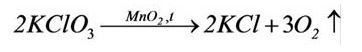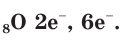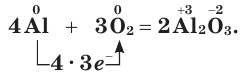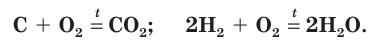Liquid oxygen boiling (O2) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxygen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allotropes | O2, O3 (ozone) and more (see Allotropes of oxygen) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | gas: colorless liquid and solid: pale blue |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(O) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abundance | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| in the Earth’s crust | 461000 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxygen in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
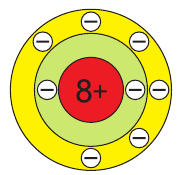
| Atomic number (Z) | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 16 (chalcogens) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | (O2) 54.36 K (−218.79 °C, −361.82 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | (O2) 90.188 K (−182.962 °C, −297.332 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 1.429 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.141 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 54.361 K, 0.1463 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 154.581 K, 5.043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | (O2) 0.444 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | (O2) 6.82 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | (O2) 29.378 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, −1, 0, +1, +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 3.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 66±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of oxygen |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubic
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 330 m/s (gas, at 27 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 26.58×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +3449.0×10−6 cm3/mol (293 K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Michael Sendivogius Carl Wilhelm Scheele (1604, 1771) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Named by | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of oxygen
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Oxygen is the chemical element with the symbol O and atomic number 8. It is a member of the chalcogen group in the periodic table, a highly reactive nonmetal, and an oxidizing agent that readily forms oxides with most elements as well as with other compounds. Oxygen is Earth’s most abundant element, and after hydrogen and helium, it is the third-most abundant element in the universe. At standard temperature and pressure, two atoms of the element bind to form dioxygen, a colorless and odorless diatomic gas with the formula O
2. Diatomic oxygen gas currently constitutes 20.95% of the Earth’s atmosphere, though this has changed considerably over long periods of time. Oxygen makes up almost half of the Earth’s crust in the form of oxides.[3]
All plants, animals, and fungus need oxygen for cellular respiration, which extracts energy by the reaction of oxygen with molecules derived from food and produces carbon dioxide as a waste product. In tetrapods breathing brings oxygen into the lungs where gas exchange takes place, carbon dioxide diffuses out of the blood, and oxygen diffuses into the blood. The body’s circulatory system transports the oxygen the cells, where cellular respiration takes place.[4][5]
Many major classes of organic molecules in living organisms contain oxygen atoms, such as proteins, nucleic acids, carbohydrates, and fats, as do the major constituent inorganic compounds of animal shells, teeth, and bone. Most of the mass of living organisms is oxygen as a component of water, the major constituent of lifeforms. Oxygen is continuously replenished in Earth’s atmosphere by photosynthesis, which uses the energy of sunlight to produce oxygen from water and carbon dioxide. Oxygen is too chemically reactive to remain a free element in air without being continuously replenished by the photosynthetic action of living organisms. Another form (allotrope) of oxygen, ozone (O
3), strongly absorbs ultraviolet UVB radiation and the high-altitude ozone layer helps protect the biosphere from ultraviolet radiation. However, ozone present at the surface is a byproduct of smog and thus a pollutant.
Oxygen was isolated by Michael Sendivogius before 1604, but it is commonly believed that the element was discovered independently by Carl Wilhelm Scheele, in Uppsala, in 1773 or earlier, and Joseph Priestley in Wiltshire, in 1774. Priority is often given for Priestley because his work was published first. Priestley, however, called oxygen «dephlogisticated air», and did not recognize it as a chemical element. The name oxygen was coined in 1777 by Antoine Lavoisier, who first recognized oxygen as a chemical element and correctly characterized the role it plays in combustion.
Common uses of oxygen include production of steel, plastics and textiles, brazing, welding and cutting of steels and other metals, rocket propellant, oxygen therapy, and life support systems in aircraft, submarines, spaceflight and diving.
History of study
Early experiments
One of the first known experiments on the relationship between combustion and air was conducted by the 2nd century BCE Greek writer on mechanics, Philo of Byzantium. In his work Pneumatica, Philo observed that inverting a vessel over a burning candle and surrounding the vessel’s neck with water resulted in some water rising into the neck.[6] Philo incorrectly surmised that parts of the air in the vessel were converted into the classical element fire and thus were able to escape through pores in the glass. Many centuries later Leonardo da Vinci built on Philo’s work by observing that a portion of air is consumed during combustion and respiration.[7]
In the late 17th century, Robert Boyle proved that air is necessary for combustion. English chemist John Mayow (1641–1679) refined this work by showing that fire requires only a part of air that he called spiritus nitroaereus.[8] In one experiment, he found that placing either a mouse or a lit candle in a closed container over water caused the water to rise and replace one-fourteenth of the air’s volume before extinguishing the subjects.[9] From this, he surmised that nitroaereus is consumed in both respiration and combustion.
Mayow observed that antimony increased in weight when heated, and inferred that the nitroaereus must have combined with it.[8] He also thought that the lungs separate nitroaereus from air and pass it into the blood and that animal heat and muscle movement result from the reaction of nitroaereus with certain substances in the body.[8] Accounts of these and other experiments and ideas were published in 1668 in his work Tractatus duo in the tract «De respiratione».[9]
Phlogiston theory
Robert Hooke, Ole Borch, Mikhail Lomonosov, and Pierre Bayen all produced oxygen in experiments in the 17th and the 18th century but none of them recognized it as a chemical element.[10] This may have been in part due to the prevalence of the philosophy of combustion and corrosion called the phlogiston theory, which was then the favored explanation of those processes.[11]
Established in 1667 by the German alchemist J. J. Becher, and modified by the chemist Georg Ernst Stahl by 1731,[12] phlogiston theory stated that all combustible materials were made of two parts. One part, called phlogiston, was given off when the substance containing it was burned, while the dephlogisticated part was thought to be its true form, or calx.[7]
Highly combustible materials that leave little residue, such as wood or coal, were thought to be made mostly of phlogiston; non-combustible substances that corrode, such as iron, contained very little. Air did not play a role in phlogiston theory, nor were any initial quantitative experiments conducted to test the idea; instead, it was based on observations of what happens when something burns, that most common objects appear to become lighter and seem to lose something in the process.[7]
Discovery
Polish alchemist, philosopher, and physician Michael Sendivogius (Michał Sędziwój) in his work De Lapide Philosophorum Tractatus duodecim e naturae fonte et manuali experientia depromti (1604) described a substance contained in air, referring to it as ‘cibus vitae’ (food of life,[13]) and according to Polish historian Roman Bugaj, this substance is identical with oxygen.[14] Sendivogius, during his experiments performed between 1598 and 1604, properly recognized that the substance is equivalent to the gaseous byproduct released by the thermal decomposition of potassium nitrate. In Bugaj’s view, the isolation of oxygen and the proper association of the substance to that part of air which is required for life, provides sufficient evidence for the discovery of oxygen by Sendivogius.[14] This discovery of Sendivogius was however frequently denied by the generations of scientists and chemists which succeeded him.[13]
It is also commonly claimed that oxygen was first discovered by Swedish pharmacist Carl Wilhelm Scheele. He had produced oxygen gas by heating mercuric oxide (HgO) and various nitrates in 1771–72.[15][16][7] Scheele called the gas «fire air» because it was then the only known agent to support combustion. He wrote an account of this discovery in a manuscript titled Treatise on Air and Fire, which he sent to his publisher in 1775. That document was published in 1777.[17]
In the meantime, on August 1, 1774, an experiment conducted by the British clergyman Joseph Priestley focused sunlight on mercuric oxide contained in a glass tube, which liberated a gas he named «dephlogisticated air».[16] He noted that candles burned brighter in the gas and that a mouse was more active and lived longer while breathing it. After breathing the gas himself, Priestley wrote: «The feeling of it to my lungs was not sensibly different from that of common air, but I fancied that my breast felt peculiarly light and easy for some time afterwards.»[10] Priestley published his findings in 1775 in a paper titled «An Account of Further Discoveries in Air», which was included in the second volume of his book titled Experiments and Observations on Different Kinds of Air.[7][18] Because he published his findings first, Priestley is usually given priority in the discovery.
The French chemist Antoine Laurent Lavoisier later claimed to have discovered the new substance independently. Priestley visited Lavoisier in October 1774 and told him about his experiment and how he liberated the new gas. Scheele had also dispatched a letter to Lavoisier on September 30, 1774, which described his discovery of the previously unknown substance, but Lavoisier never acknowledged receiving it. (A copy of the letter was found in Scheele’s belongings after his death.)[17]
Lavoisier’s contribution
Lavoisier conducted the first adequate quantitative experiments on oxidation and gave the first correct explanation of how combustion works.[16] He used these and similar experiments, all started in 1774, to discredit the phlogiston theory and to prove that the substance discovered by Priestley and Scheele was a chemical element.
In one experiment, Lavoisier observed that there was no overall increase in weight when tin and air were heated in a closed container.[16] He noted that air rushed in when he opened the container, which indicated that part of the trapped air had been consumed. He also noted that the tin had increased in weight and that increase was the same as the weight of the air that rushed back in. This and other experiments on combustion were documented in his book Sur la combustion en général, which was published in 1777.[16] In that work, he proved that air is a mixture of two gases; ‘vital air’, which is essential to combustion and respiration, and azote (Gk. ἄζωτον «lifeless»), which did not support either. Azote later became nitrogen in English, although it has kept the earlier name in French and several other European languages.[16]
Etymology
Lavoisier renamed ‘vital air’ to oxygène in 1777 from the Greek roots ὀξύς (oxys) (acid, literally «sharp», from the taste of acids) and -γενής (-genēs) (producer, literally begetter), because he mistakenly believed that oxygen was a constituent of all acids.[19] Chemists (such as Sir Humphry Davy in 1812) eventually determined that Lavoisier was wrong in this regard, but by then the name was too well established.[20]
Oxygen entered the English language despite opposition by English scientists and the fact that the Englishman Priestley had first isolated the gas and written about it. This is partly due to a poem praising the gas titled «Oxygen» in the popular book The Botanic Garden (1791) by Erasmus Darwin, grandfather of Charles Darwin.[17]
Later history
John Dalton’s original atomic hypothesis presumed that all elements were monatomic and that the atoms in compounds would normally have the simplest atomic ratios with respect to one another. For example, Dalton assumed that water’s formula was HO, leading to the conclusion that the atomic mass of oxygen was 8 times that of hydrogen, instead of the modern value of about 16.[21] In 1805, Joseph Louis Gay-Lussac and Alexander von Humboldt showed that water is formed of two volumes of hydrogen and one volume of oxygen; and by 1811 Amedeo Avogadro had arrived at the correct interpretation of water’s composition, based on what is now called Avogadro’s law and the diatomic elemental molecules in those gases.[22][a]
The first commercial method of producing oxygen was chemical, the so-called Brin process involving a reversible reaction of barium oxide. It was invented in 1852 and commercialized in 1884, but was displaced by newer methods in early 20th century.
By the late 19th century scientists realized that air could be liquefied and its components isolated by compressing and cooling it. Using a cascade method, Swiss chemist and physicist Raoul Pierre Pictet evaporated liquid sulfur dioxide in order to liquefy carbon dioxide, which in turn was evaporated to cool oxygen gas enough to liquefy it. He sent a telegram on December 22, 1877, to the French Academy of Sciences in Paris announcing his discovery of liquid oxygen.[23] Just two days later, French physicist Louis Paul Cailletet announced his own method of liquefying molecular oxygen.[23] Only a few drops of the liquid were produced in each case and no meaningful analysis could be conducted. Oxygen was liquefied in a stable state for the first time on March 29, 1883, by Polish scientists from Jagiellonian University, Zygmunt Wróblewski and Karol Olszewski.[24]
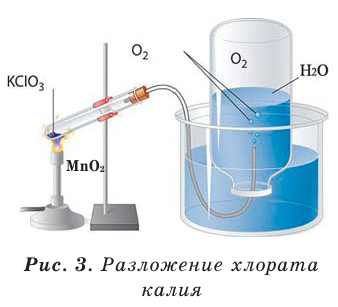
An experiment setup for preparation of oxygen in academic laboratories
In 1891 Scottish chemist James Dewar was able to produce enough liquid oxygen for study.[25] The first commercially viable process for producing liquid oxygen was independently developed in 1895 by German engineer Carl von Linde and British engineer William Hampson. Both men lowered the temperature of air until it liquefied and then distilled the component gases by boiling them off one at a time and capturing them separately.[26] Later, in 1901, oxyacetylene welding was demonstrated for the first time by burning a mixture of acetylene and compressed O
2. This method of welding and cutting metal later became common.[26]
In 1923, the American scientist Robert H. Goddard became the first person to develop a rocket engine that burned liquid fuel; the engine used gasoline for fuel and liquid oxygen as the oxidizer. Goddard successfully flew a small liquid-fueled rocket 56 m at 97 km/h on March 16, 1926, in Auburn, Massachusetts, US.[26][27]
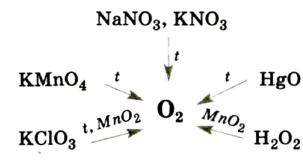
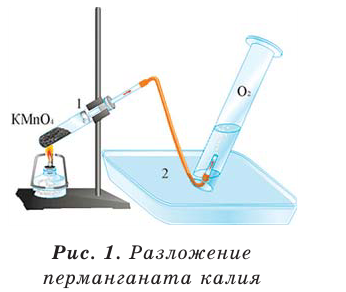
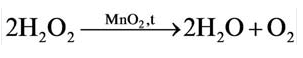
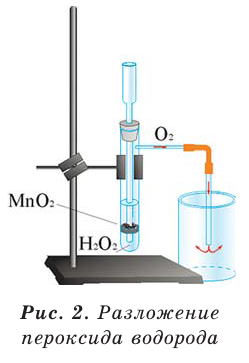
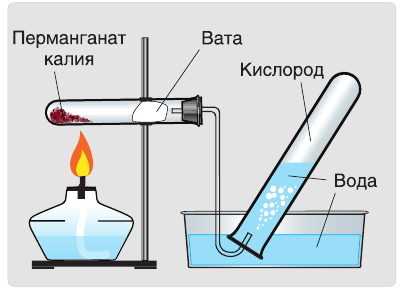
In academic laboratories, oxygen can be prepared by heating together potassium chlorate mixed with a small proportion of manganese dioxide.[28]
Oxygen levels in the atmosphere are trending slightly downward globally, possibly because of fossil-fuel burning.[29]
Characteristics
Properties and molecular structure
Orbital diagram, after Barrett (2002),[30] showing the participating atomic orbitals from each oxygen atom, the molecular orbitals that result from their overlap, and the aufbau filling of the orbitals with the 12 electrons, 6 from each O atom, beginning from the lowest-energy orbitals, and resulting in covalent double-bond character from filled orbitals (and cancellation of the contributions of the pairs of σ and σ* and π and π* orbital pairs).
At standard temperature and pressure, oxygen is a colorless, odorless, and tasteless gas with the molecular formula O
2, referred to as dioxygen.[31]
As dioxygen, two oxygen atoms are chemically bound to each other. The bond can be variously described based on level of theory, but is reasonably and simply described as a covalent double bond that results from the filling of molecular orbitals formed from the atomic orbitals of the individual oxygen atoms, the filling of which results in a bond order of two. More specifically, the double bond is the result of sequential, low-to-high energy, or Aufbau, filling of orbitals, and the resulting cancellation of contributions from the 2s electrons, after sequential filling of the low σ and σ* orbitals; σ overlap of the two atomic 2p orbitals that lie along the O–O molecular axis and π overlap of two pairs of atomic 2p orbitals perpendicular to the O–O molecular axis, and then cancellation of contributions from the remaining two 2p electrons after their partial filling of the π* orbitals.[30]
This combination of cancellations and σ and π overlaps results in dioxygen’s double-bond character and reactivity, and a triplet electronic ground state. An electron configuration with two unpaired electrons, as is found in dioxygen orbitals (see the filled π* orbitals in the diagram) that are of equal energy—i.e., degenerate—is a configuration termed a spin triplet state. Hence, the ground state of the O
2 molecule is referred to as triplet oxygen.[32][b] The highest-energy, partially filled orbitals are antibonding, and so their filling weakens the bond order from three to two. Because of its unpaired electrons, triplet oxygen reacts only slowly with most organic molecules, which have paired electron spins; this prevents spontaneous combustion.[33]
Liquid oxygen, temporarily suspended in a magnet owing to its paramagnetism
In the triplet form, O
2 molecules are paramagnetic. That is, they impart magnetic character to oxygen when it is in the presence of a magnetic field, because of the spin magnetic moments of the unpaired electrons in the molecule, and the negative exchange energy between neighboring O
2 molecules.[25] Liquid oxygen is so magnetic that, in laboratory demonstrations, a bridge of liquid oxygen may be supported against its own weight between the poles of a powerful magnet.[34][c]
Singlet oxygen is a name given to several higher-energy species of molecular O
2 in which all the electron spins are paired. It is much more reactive with common organic molecules than is normal (triplet) molecular oxygen. In nature, singlet oxygen is commonly formed from water during photosynthesis, using the energy of sunlight.[35] It is also produced in the troposphere by the photolysis of ozone by light of short wavelength[36] and by the immune system as a source of active oxygen.[37] Carotenoids in photosynthetic organisms (and possibly animals) play a major role in absorbing energy from singlet oxygen and converting it to the unexcited ground state before it can cause harm to tissues.[38]
Allotropes
The common allotrope of elemental oxygen on Earth is called dioxygen, O
2, the major part of the Earth’s atmospheric oxygen (see Occurrence). O2 has a bond length of 121 pm and a bond energy of 498 kJ/mol.[39] O2 is used by complex forms of life, such as animals, in cellular respiration. Other aspects of O
2 are covered in the remainder of this article.
Trioxygen (O
3) is usually known as ozone and is a very reactive allotrope of oxygen that is damaging to lung tissue.[40] Ozone is produced in the upper atmosphere when O
2 combines with atomic oxygen made by the splitting of O
2 by ultraviolet (UV) radiation.[19] Since ozone absorbs strongly in the UV region of the spectrum, the ozone layer of the upper atmosphere functions as a protective radiation shield for the planet.[19] Near the Earth’s surface, it is a pollutant formed as a by-product of automobile exhaust.[40] At low earth orbit altitudes, sufficient atomic oxygen is present to cause corrosion of spacecraft.[41]
The metastable molecule tetraoxygen (O
4) was discovered in 2001,[42][43] and was assumed to exist in one of the six phases of solid oxygen. It was proven in 2006 that this phase, created by pressurizing O
2 to 20 GPa, is in fact a rhombohedral O
8 cluster.[44] This cluster has the potential to be a much more powerful oxidizer than either O
2 or O
3 and may therefore be used in rocket fuel.[42][43] A metallic phase was discovered in 1990 when solid oxygen is subjected to a pressure of above 96 GPa[45] and it was shown in 1998 that at very low temperatures, this phase becomes superconducting.[46]
Physical properties
Oxygen discharge (spectrum) tube
Oxygen dissolves more readily in water than in nitrogen, and in freshwater more readily than in seawater. Water in equilibrium with air contains approximately 1 molecule of dissolved O
2 for every 2 molecules of N
2 (1:2), compared with an atmospheric ratio of approximately 1:4. The solubility of oxygen in water is temperature-dependent, and about twice as much (14.6 mg/L) dissolves at 0 °C than at 20 °C (7.6 mg/L).[10][47] At 25 °C and 1 standard atmosphere (101.3 kPa) of air, freshwater can dissolve about 6.04 milliliters (mL) of oxygen per liter, and seawater contains about 4.95 mL per liter.[48] At 5 °C the solubility increases to 9.0 mL (50% more than at 25 °C) per liter for freshwater and 7.2 mL (45% more) per liter for sea water.
| 5 °C | 25 °C | |
|---|---|---|
| Freshwater | 9.00 | 6.04 |
| Seawater | 7.20 | 4.95 |
Oxygen condenses at 90.20 K (−182.95 °C, −297.31 °F) and freezes at 54.36 K (−218.79 °C, −361.82 °F).[49] Both liquid and solid O
2 are clear substances with a light sky-blue color caused by absorption in the red (in contrast with the blue color of the sky, which is due to Rayleigh scattering of blue light). High-purity liquid O
2 is usually obtained by the fractional distillation of liquefied air.[50] Liquid oxygen may also be condensed from air using liquid nitrogen as a coolant.[51]
Liquid oxygen is a highly reactive substance and must be segregated from combustible materials.[51]
The spectroscopy of molecular oxygen is associated with the atmospheric processes of aurora and airglow.[52] The absorption in the Herzberg continuum and Schumann–Runge bands in the ultraviolet produces atomic oxygen that is important in the chemistry of the middle atmosphere.[53] Excited-state singlet molecular oxygen is responsible for red chemiluminescence in solution.[54]
Table of thermal and physical properties of oxygen (O2) at atmospheric pressure:[55][56]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg °C) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m °C) | Thermal diffusivity (m^2/s) | Prandtl Number |
| 100 | 3.945 | 0.962 | 7.64E-06 | 1.94E-06 | 0.00925 | 2.44E-06 | 0.796 |
| 150 | 2.585 | 0.921 | 1.15E-05 | 4.44E-06 | 0.0138 | 5.80E-06 | 0.766 |
| 200 | 1.93 | 0.915 | 1.48E-05 | 7.64E-06 | 0.0183 | 1.04E-05 | 0.737 |
| 250 | 1.542 | 0.915 | 1.79E-05 | 1.16E-05 | 0.0226 | 1.60E-05 | 0.723 |
| 300 | 1.284 | 0.92 | 2.07E-05 | 1.61E-05 | 0.0268 | 2.27E-05 | 0.711 |
| 350 | 1.1 | 0.929 | 2.34E-05 | 2.12E-05 | 0.0296 | 2.90E-05 | 0.733 |
| 400 | 0.962 | 1.0408 | 2.58E-05 | 2.68E-05 | 0.033 | 3.64E-05 | 0.737 |
| 450 | 0.8554 | 0.956 | 2.81E-05 | 3.29E-05 | 0.0363 | 4.44E-05 | 0.741 |
| 500 | 0.7698 | 0.972 | 3.03E-05 | 3.94E-05 | 0.0412 | 5.51E-05 | 0.716 |
| 550 | 0.6998 | 0.988 | 3.24E-05 | 4.63E-05 | 0.0441 | 6.38E-05 | 0.726 |
| 600 | 0.6414 | 1.003 | 3.44E-05 | 5.36E-05 | 0.0473 | 7.35E-05 | 0.729 |
| 700 | 0.5498 | 1.031 | 3.81E-05 | 6.93E-05 | 0.0528 | 9.31E-05 | 0.744 |
| 800 | 0.481 | 1.054 | 4.15E-05 | 8.63E-05 | 0.0589 | 1.16E-04 | 0.743 |
| 900 | 0.4275 | 1.074 | 4.47E-05 | 1.05E-04 | 0.0649 | 1.41E-04 | 0.74 |
| 1000 | 0.3848 | 1.09 | 4.77E-05 | 1.24E-04 | 0.071 | 1.69E-04 | 0.733 |
| 1100 | 0.3498 | 1.103 | 5.06E-05 | 1.45E-04 | 0.0758 | 1.96E-04 | 0.736 |
| 1200 | 0.3206 | 1.0408 | 5.33E-05 | 1.661E-04 | 0.0819 | 2.29E-04 | 0.725 |
| 1300 | 0.296 | 1.125 | 5.88E-05 | 1.99E-04 | 0.0871 | 2.62E-04 | 0.721 |
Isotopes and stellar origin
Late in a massive star’s life, 16O concentrates in the O-shell, 17O in the H-shell and 18O in the He-shell.
Naturally occurring oxygen is composed of three stable isotopes, 16O, 17O, and 18O, with 16O being the most abundant (99.762% natural abundance).[57]
Most 16O is synthesized at the end of the helium fusion process in massive stars but some is made in the neon burning process.[58] 17O is primarily made by the burning of hydrogen into helium during the CNO cycle, making it a common isotope in the hydrogen burning zones of stars.[58] Most 18O is produced when 14N (made abundant from CNO burning) captures a 4He nucleus, making 18O common in the helium-rich zones of evolved, massive stars.[58]
Thirteen radioisotopes have been characterized, ranging from 11O to 26O.[59] The most stable are 15O with a half-life of 122.24 seconds and 14O with a half-life of 70.606 seconds.[57] All of the remaining radioactive isotopes have half-lives that are less than 27 s and the majority of these have half-lives that are less than 83 milliseconds.[57] The most common decay mode of the isotopes lighter than 16O is β+ decay[60][61][62] to yield nitrogen, and the most common mode for the isotopes heavier than 18O is beta decay to yield fluorine.[57]
Occurrence
| Z | Element | Mass fraction in parts per million | |
|---|---|---|---|
| 1 | Hydrogen | 739,000 | 71 × mass of oxygen (red bar) |
| 2 | Helium | 240,000 | 23 × mass of oxygen (red bar) |
| 8 | Oxygen | 10,400 | |
| 6 | Carbon | 4,600 | |
| 10 | Neon | 1,340 | |
| 26 | Iron | 1,090 | |
| 7 | Nitrogen | 960 | |
| 14 | Silicon | 650 | |
| 12 | Magnesium | 580 | |
| 16 | Sulfur | 440 |
Oxygen is the most abundant chemical element by mass in the Earth’s biosphere, air, sea and land. Oxygen is the third most abundant chemical element in the universe, after hydrogen and helium.[64] About 0.9% of the Sun’s mass is oxygen.[16] Oxygen constitutes 49.2% of the Earth’s crust by mass[65] as part of oxide compounds such as silicon dioxide and is the most abundant element by mass in the Earth’s crust. It is also the major component of the world’s oceans (88.8% by mass).[16] Oxygen gas is the second most common component of the Earth’s atmosphere, taking up 20.8% of its volume and 23.1% of its mass (some 1015 tonnes).[16][66][d] Earth is unusual among the planets of the Solar System in having such a high concentration of oxygen gas in its atmosphere: Mars (with 0.1% O
2 by volume) and Venus have much less. The O
2 surrounding those planets is produced solely by the action of ultraviolet radiation on oxygen-containing molecules such as carbon dioxide.
Cold water holds more dissolved O
2.
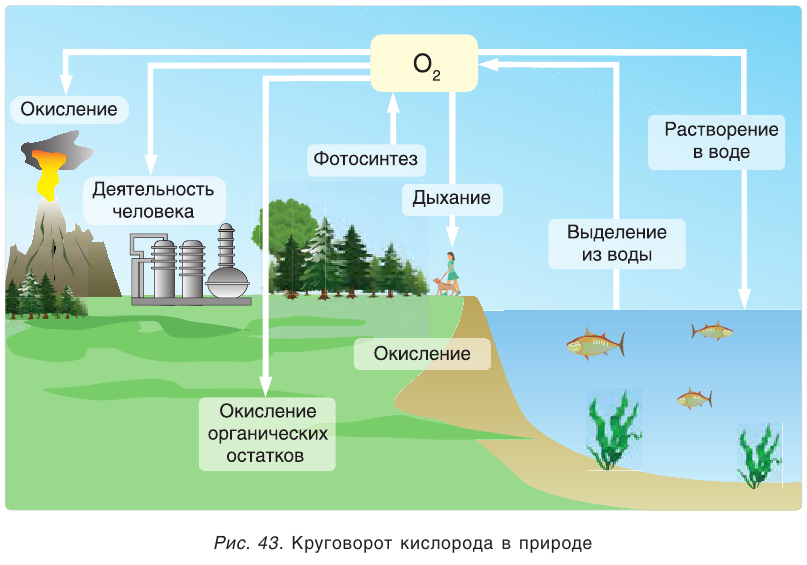
The unusually high concentration of oxygen gas on Earth is the result of the oxygen cycle. This biogeochemical cycle describes the movement of oxygen within and between its three main reservoirs on Earth: the atmosphere, the biosphere, and the lithosphere. The main driving factor of the oxygen cycle is photosynthesis, which is responsible for modern Earth’s atmosphere. Photosynthesis releases oxygen into the atmosphere, while respiration, decay, and combustion remove it from the atmosphere. In the present equilibrium, production and consumption occur at the same rate.[67]
Free oxygen also occurs in solution in the world’s water bodies. The increased solubility of O
2 at lower temperatures (see Physical properties) has important implications for ocean life, as polar oceans support a much higher density of life due to their higher oxygen content.[68] Water polluted with plant nutrients such as nitrates or phosphates may stimulate growth of algae by a process called eutrophication and the decay of these organisms and other biomaterials may reduce the O
2 content in eutrophic water bodies. Scientists assess this aspect of water quality by measuring the water’s biochemical oxygen demand, or the amount of O
2 needed to restore it to a normal concentration.[69]
Analysis
Paleoclimatologists measure the ratio of oxygen-18 and oxygen-16 in the shells and skeletons of marine organisms to determine the climate millions of years ago (see oxygen isotope ratio cycle). Seawater molecules that contain the lighter isotope, oxygen-16, evaporate at a slightly faster rate than water molecules containing the 12% heavier oxygen-18, and this disparity increases at lower temperatures.[70] During periods of lower global temperatures, snow and rain from that evaporated water tends to be higher in oxygen-16, and the seawater left behind tends to be higher in oxygen-18. Marine organisms then incorporate more oxygen-18 into their skeletons and shells than they would in a warmer climate.[70] Paleoclimatologists also directly measure this ratio in the water molecules of ice core samples as old as hundreds of thousands of years.
Planetary geologists have measured the relative quantities of oxygen isotopes in samples from the Earth, the Moon, Mars, and meteorites, but were long unable to obtain reference values for the isotope ratios in the Sun, believed to be the same as those of the primordial solar nebula. Analysis of a silicon wafer exposed to the solar wind in space and returned by the crashed Genesis spacecraft has shown that the Sun has a higher proportion of oxygen-16 than does the Earth. The measurement implies that an unknown process depleted oxygen-16 from the Sun’s disk of protoplanetary material prior to the coalescence of dust grains that formed the Earth.[71]
Oxygen presents two spectrophotometric absorption bands peaking at the wavelengths 687 and 760 nm. Some remote sensing scientists have proposed using the measurement of the radiance coming from vegetation canopies in those bands to characterize plant health status from a satellite platform.[72] This approach exploits the fact that in those bands it is possible to discriminate the vegetation’s reflectance from its fluorescence, which is much weaker. The measurement is technically difficult owing to the low signal-to-noise ratio and the physical structure of vegetation; but it has been proposed as a possible method of monitoring the carbon cycle from satellites on a global scale.
Biological production and role of O2
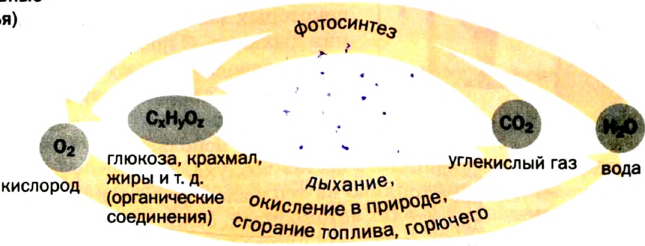
Photosynthesis and respiration
Photosynthesis splits water to liberate O
2 and fixes CO
2 into sugar in what is called a Calvin cycle.
In nature, free oxygen is produced by the light-driven splitting of water during oxygenic photosynthesis. According to some estimates, green algae and cyanobacteria in marine environments provide about 70% of the free oxygen produced on Earth, and the rest is produced by terrestrial plants.[73] Other estimates of the oceanic contribution to atmospheric oxygen are higher, while some estimates are lower, suggesting oceans produce ~45% of Earth’s atmospheric oxygen each year.[74]
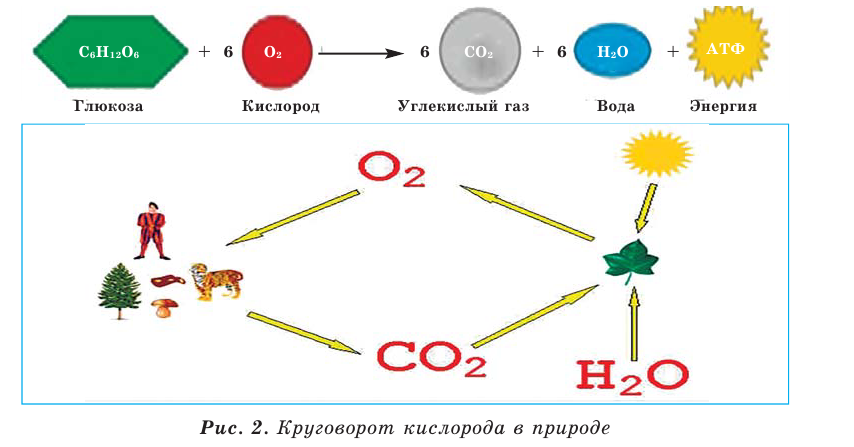
A simplified overall formula for photosynthesis is[75]
- 6 CO2 + 6 H
2O + photons → C
6H
12O
6 + 6 O
2
or simply
- carbon dioxide + water + sunlight → glucose + dioxygen
Photolytic oxygen evolution occurs in the thylakoid membranes of photosynthetic organisms and requires the energy of four photons.[e] Many steps are involved, but the result is the formation of a proton gradient across the thylakoid membrane, which is used to synthesize adenosine triphosphate (ATP) via photophosphorylation.[76] The O
2 remaining (after production of the water molecule) is released into the atmosphere.[f]
Oxygen is used in mitochondria in the generation of ATP during oxidative phosphorylation. The reaction for aerobic respiration is essentially the reverse of photosynthesis and is simplified as
- C
6H
12O
6 + 6 O
2 → 6 CO2 + 6 H
2O + 2880 kJ/mol
In vertebrates, O
2 diffuses through membranes in the lungs and into red blood cells. Hemoglobin binds O
2, changing color from bluish red to bright red[40] (CO
2 is released from another part of hemoglobin through the Bohr effect). Other animals use hemocyanin (molluscs and some arthropods) or hemerythrin (spiders and lobsters).[66] A liter of blood can dissolve 200 cm3 of O
2.[66]
Until the discovery of anaerobic metazoa,[77] oxygen was thought to be a requirement for all complex life.[78]
Reactive oxygen species, such as superoxide ion (O−
2) and hydrogen peroxide (H
2O
2), are reactive by-products of oxygen use in organisms.[66] Parts of the immune system of higher organisms create peroxide, superoxide, and singlet oxygen to destroy invading microbes. Reactive oxygen species also play an important role in the hypersensitive response of plants against pathogen attack.[76] Oxygen is damaging to obligately anaerobic organisms, which were the dominant form of early life on Earth until O
2 began to accumulate in the atmosphere about 2.5 billion years ago during the Great Oxygenation Event, about a billion years after the first appearance of these organisms.[79][80]
An adult human at rest inhales 1.8 to 2.4 grams of oxygen per minute.[81] This amounts to more than 6 billion tonnes of oxygen inhaled by humanity per year.[g]
Living organisms
| Unit | Alveolar pulmonary gas pressures |
Arterial blood oxygen | Venous blood gas |
|---|---|---|---|
| kPa | 14.2 | 11[h]-13[h] | 4.0[h]-5.3[h] |
| mmHg | 107 | 75[82]-100[82] | 30[83]-40[83] |
The free oxygen partial pressure in the body of a living vertebrate organism is highest in the respiratory system, and decreases along any arterial system, peripheral tissues, and venous system, respectively. Partial pressure is the pressure that oxygen would have if it alone occupied the volume.[84]
Build-up in the atmosphere
O
2 build-up in Earth’s atmosphere: 1) no O
2 produced; 2) O
2 produced, but absorbed in oceans & seabed rock; 3) O
2 starts to gas out of the oceans, but is absorbed by land surfaces and formation of ozone layer; 4–5) O
2 sinks filled and the gas accumulates
Free oxygen gas was almost nonexistent in Earth’s atmosphere before photosynthetic archaea and bacteria evolved, probably about 3.5 billion years ago. Free oxygen first appeared in significant quantities during the Paleoproterozoic eon (between 3.0 and 2.3 billion years ago).[85] Even if there was much dissolved iron in the oceans when oxygenic photosynthesis was getting more common, it appears the banded iron formations were created by anoxyenic or micro-aerophilic iron-oxidizing bacteria which dominated the deeper areas of the photic zone, while oxygen-producing cyanobacteria covered the shallows.[86] Free oxygen began to outgas from the oceans 3–2.7 billion years ago, reaching 10% of its present level around 1.7 billion years ago.[85][87]
The presence of large amounts of dissolved and free oxygen in the oceans and atmosphere may have driven most of the extant anaerobic organisms to extinction during the Great Oxygenation Event (oxygen catastrophe) about 2.4 billion years ago. Cellular respiration using O
2 enables aerobic organisms to produce much more ATP than anaerobic organisms.[88] Cellular respiration of O
2 occurs in all eukaryotes, including all complex multicellular organisms such as plants and animals.
Since the beginning of the Cambrian period 540 million years ago, atmospheric O
2 levels have fluctuated between 15% and 30% by volume.[89] Towards the end of the Carboniferous period (about 300 million years ago) atmospheric O
2 levels reached a maximum of 35% by volume,[89] which may have contributed to the large size of insects and amphibians at this time.[90]
Variations in atmospheric oxygen concentration have shaped past climates. When oxygen declined, atmospheric density dropped, which in turn increased surface evaporation, causing precipitation increases and warmer temperatures.[91]
At the current rate of photosynthesis it would take about 2,000 years to regenerate the entire O
2 in the present atmosphere.[92]
In the field of astrobiology and in the search for extraterrestrial life oxygen is a strong biosignature. That said it might not be a definite biosignature, being possibly produced abiotically on celestial bodies with processes and conditions (such as a peculiar hydrosphere) which allow free oxygen,[93][94][95] like with Europa’s and Ganymede’s thin
oxygen atmospheres.[96]
Industrial production
One hundred million tonnes of O
2 are extracted from air for industrial uses annually by two primary methods.[17] The most common method is fractional distillation of liquefied air, with N
2 distilling as a vapor while O
2 is left as a liquid.[17]
The other primary method of producing O
2 is passing a stream of clean, dry air through one bed of a pair of identical zeolite molecular sieves, which absorbs the nitrogen and delivers a gas stream that is 90% to 93% O
2.[17] Simultaneously, nitrogen gas is released from the other nitrogen-saturated zeolite bed, by reducing the chamber operating pressure and diverting part of the oxygen gas from the producer bed through it, in the reverse direction of flow. After a set cycle time the operation of the two beds is interchanged, thereby allowing for a continuous supply of gaseous oxygen to be pumped through a pipeline. This is known as pressure swing adsorption. Oxygen gas is increasingly obtained by these non-cryogenic technologies (see also the related vacuum swing adsorption).[97]
Oxygen gas can also be produced through electrolysis of water into molecular oxygen and hydrogen. DC electricity must be used: if AC is used, the gases in each limb consist of hydrogen and oxygen in the explosive ratio 2:1. A similar method is the electrocatalytic O
2 evolution from oxides and oxoacids. Chemical catalysts can be used as well, such as in chemical oxygen generators or oxygen candles that are used as part of the life-support equipment on submarines, and are still part of standard equipment on commercial airliners in case of depressurization emergencies. Another air separation method is forcing air to dissolve through ceramic membranes based on zirconium dioxide by either high pressure or an electric current, to produce nearly pure O
2 gas.[69]
Storage
Oxygen and MAPP gas compressed-gas cylinders with regulators
Oxygen storage methods include high-pressure oxygen tanks, cryogenics and chemical compounds. For reasons of economy, oxygen is often transported in bulk as a liquid in specially insulated tankers, since one liter of liquefied oxygen is equivalent to 840 liters of gaseous oxygen at atmospheric pressure and 20 °C (68 °F).[17] Such tankers are used to refill bulk liquid-oxygen storage containers, which stand outside hospitals and other institutions that need large volumes of pure oxygen gas. Liquid oxygen is passed through heat exchangers, which convert the cryogenic liquid into gas before it enters the building. Oxygen is also stored and shipped in smaller cylinders containing the compressed gas; a form that is useful in certain portable medical applications and oxy-fuel welding and cutting.[17]
Applications
Medical
Uptake of O
2 from the air is the essential purpose of respiration, so oxygen supplementation is used in medicine. Treatment not only increases oxygen levels in the patient’s blood, but has the secondary effect of decreasing resistance to blood flow in many types of diseased lungs, easing work load on the heart. Oxygen therapy is used to treat emphysema, pneumonia, some heart disorders (congestive heart failure), some disorders that cause increased pulmonary artery pressure, and any disease that impairs the body’s ability to take up and use gaseous oxygen.[98]
Treatments are flexible enough to be used in hospitals, the patient’s home, or increasingly by portable devices. Oxygen tents were once commonly used in oxygen supplementation, but have since been replaced mostly by the use of oxygen masks or nasal cannulas.[99]
Hyperbaric (high-pressure) medicine uses special oxygen chambers to increase the partial pressure of O
2 around the patient and, when needed, the medical staff.[100] Carbon monoxide poisoning, gas gangrene, and decompression sickness (the ‘bends’) are sometimes addressed with this therapy.[101] Increased O
2 concentration in the lungs helps to displace carbon monoxide from the heme group of hemoglobin.[102][103] Oxygen gas is poisonous to the anaerobic bacteria that cause gas gangrene, so increasing its partial pressure helps kill them.[104][105] Decompression sickness occurs in divers who decompress too quickly after a dive, resulting in bubbles of inert gas, mostly nitrogen and helium, forming in the blood. Increasing the pressure of O
2 as soon as possible helps to redissolve the bubbles back into the blood so that these excess gasses can be exhaled naturally through the lungs.[98][106][107] Normobaric oxygen administration at the highest available concentration is frequently used as first aid for any diving injury that may involve inert gas bubble formation in the tissues. There is epidemiological support for its use from a statistical study of cases recorded in a long term database.[108][109][110]
Life support and recreational use
An application of O
2 as a low-pressure breathing gas is in modern space suits, which surround their occupant’s body with the breathing gas. These devices use nearly pure oxygen at about one-third normal pressure, resulting in a normal blood partial pressure of O
2. This trade-off of higher oxygen concentration for lower pressure is needed to maintain suit flexibility.[111][112]
Scuba and surface-supplied underwater divers and submariners also rely on artificially delivered O
2. Submarines, submersibles and atmospheric diving suits usually operate at normal atmospheric pressure. Breathing air is scrubbed of carbon dioxide by chemical extraction and oxygen is replaced to maintain a constant partial pressure. Ambient pressure divers breathe air or gas mixtures with an oxygen fraction suited to the operating depth. Pure or nearly pure O
2 use in diving at pressures higher than atmospheric is usually limited to rebreathers, or decompression at relatively shallow depths (~6 meters depth, or less),[113][114] or medical treatment in recompression chambers at pressures up to 2.8 bar, where acute oxygen toxicity can be managed without the risk of drowning. Deeper diving requires significant dilution of O
2 with other gases, such as nitrogen or helium, to prevent oxygen toxicity.[113]
People who climb mountains or fly in non-pressurized fixed-wing aircraft sometimes have supplemental O
2 supplies.[i] Pressurized commercial airplanes have an emergency supply of O
2 automatically supplied to the passengers in case of cabin depressurization. Sudden cabin pressure loss activates chemical oxygen generators above each seat, causing oxygen masks to drop. Pulling on the masks «to start the flow of oxygen» as cabin safety instructions dictate, forces iron filings into the sodium chlorate inside the canister.[69] A steady stream of oxygen gas is then produced by the exothermic reaction.
Oxygen, as a mild euphoric, has a history of recreational use in oxygen bars and in sports. Oxygen bars are establishments found in the United States since the late 1990s that offer higher than normal O
2 exposure for a minimal fee.[115] Professional athletes, especially in American football, sometimes go off-field between plays to don oxygen masks to boost performance. The pharmacological effect is doubted; a placebo effect is a more likely explanation.[115] Available studies support a performance boost from oxygen enriched mixtures only if it is inhaled during aerobic exercise.[116]
Other recreational uses that do not involve breathing include pyrotechnic applications, such as George Goble’s five-second ignition of barbecue grills.[117]
Industrial
Smelting of iron ore into steel consumes 55% of commercially produced oxygen.[69] In this process, O
2 is injected through a high-pressure lance into molten iron, which removes sulfur impurities and excess carbon as the respective oxides, SO
2 and CO
2. The reactions are exothermic, so the temperature increases to 1,700 °C.[69]
Another 25% of commercially produced oxygen is used by the chemical industry.[69] Ethylene is reacted with O
2 to create ethylene oxide, which, in turn, is converted into ethylene glycol; the primary feeder material used to manufacture a host of products, including antifreeze and polyester polymers (the precursors of many plastics and fabrics).[69]
Most of the remaining 20% of commercially produced oxygen is used in medical applications, metal cutting and welding, as an oxidizer in rocket fuel, and in water treatment.[69] Oxygen is used in oxyacetylene welding, burning acetylene with O
2 to produce a very hot flame. In this process, metal up to 60 cm (24 in) thick is first heated with a small oxy-acetylene flame and then quickly cut by a large stream of O
2.[118]
Compounds
Water (H
2O) is the most familiar oxygen compound.
The oxidation state of oxygen is −2 in almost all known compounds of oxygen. The oxidation state −1 is found in a few compounds such as peroxides.[119] Compounds containing oxygen in other oxidation states are very uncommon: −1/2 (superoxides), −1/3 (ozonides), 0 (elemental, hypofluorous acid), +1/2 (dioxygenyl), +1 (dioxygen difluoride), and +2 (oxygen difluoride).[120]
Oxides and other inorganic compounds
Water (H
2O) is an oxide of hydrogen and the most familiar oxygen compound. Hydrogen atoms are covalently bonded to oxygen in a water molecule but also have an additional attraction (about 23.3 kJ/mol per hydrogen atom) to an adjacent oxygen atom in a separate molecule.[121] These hydrogen bonds between water molecules hold them approximately 15% closer than what would be expected in a simple liquid with just van der Waals forces.[122][j]
Oxides, such as iron oxide or rust, form when oxygen combines with other elements.
Due to its electronegativity, oxygen forms chemical bonds with almost all other elements to give corresponding oxides. The surface of most metals, such as aluminium and titanium, are oxidized in the presence of air and become coated with a thin film of oxide that passivates the metal and slows further corrosion. Many oxides of the transition metals are non-stoichiometric compounds, with slightly less metal than the chemical formula would show. For example, the mineral FeO (wüstite) is written as 
Oxygen is present in the atmosphere in trace quantities in the form of carbon dioxide (CO
2). The Earth’s crustal rock is composed in large part of oxides of silicon (silica SiO
2, as found in granite and quartz), aluminium (aluminium oxide Al
2O
3, in bauxite and corundum), iron (iron(III) oxide Fe
2O
3, in hematite and rust), and calcium carbonate (in limestone). The rest of the Earth’s crust is also made of oxygen compounds, in particular various complex silicates (in silicate minerals). The Earth’s mantle, of much larger mass than the crust, is largely composed of silicates of magnesium and iron.
Water-soluble silicates in the form of Na
4SiO
4, Na
2SiO
3, and Na
2Si
2O
5 are used as detergents and adhesives.[124]
Oxygen also acts as a ligand for transition metals, forming transition metal dioxygen complexes, which feature metal–O
2. This class of compounds includes the heme proteins hemoglobin and myoglobin.[125] An exotic and unusual reaction occurs with PtF
6, which oxidizes oxygen to give O2+PtF6−, dioxygenyl hexafluoroplatinate.[126]
Organic compounds
Acetone is an important feeder material in the chemical industry.
Oxygen
Carbon
Hydrogen
Among the most important classes of organic compounds that contain oxygen are (where «R» is an organic group): alcohols (R-OH); ethers (R-O-R); ketones (R-CO-R); aldehydes (R-CO-H); carboxylic acids (R-COOH); esters (R-COO-R); acid anhydrides (R-CO-O-CO-R); and amides (R-C(O)-NR
2). There are many important organic solvents that contain oxygen, including: acetone, methanol, ethanol, isopropanol, furan, THF, diethyl ether, dioxane, ethyl acetate, DMF, DMSO, acetic acid, and formic acid. Acetone ((CH
3)
2CO) and phenol (C
6H
5OH) are used as feeder materials in the synthesis of many different substances. Other important organic compounds that contain oxygen are: glycerol, formaldehyde, glutaraldehyde, citric acid, acetic anhydride, and acetamide. Epoxides are ethers in which the oxygen atom is part of a ring of three atoms. The element is similarly found in almost all biomolecules that are important to (or generated by) life.
Oxygen reacts spontaneously with many organic compounds at or below room temperature in a process called autoxidation.[127] Most of the organic compounds that contain oxygen are not made by direct action of O
2. Organic compounds important in industry and commerce that are made by direct oxidation of a precursor include ethylene oxide and peracetic acid.[124]
Safety and precautions
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |

|
|
Hazard statements |
H272 |
|
Precautionary statements |
P220, P244, P370+P376, P403 |
| NFPA 704 (fire diamond) |
0 0 1 OX |
The NFPA 704 standard rates compressed oxygen gas as nonhazardous to health, nonflammable and nonreactive, but an oxidizer. Refrigerated liquid oxygen (LOX) is given a health hazard rating of 3 (for increased risk of hyperoxia from condensed vapors, and for hazards common to cryogenic liquids such as frostbite), and all other ratings are the same as the compressed gas form.[128]
Toxicity
Main symptoms of oxygen toxicity[129]
Oxygen gas (O
2) can be toxic at elevated partial pressures, leading to convulsions and other health problems.[113][k][130] Oxygen toxicity usually begins to occur at partial pressures more than 50 kilopascals (kPa), equal to about 50% oxygen composition at standard pressure or 2.5 times the normal sea-level O
2 partial pressure of about 21 kPa. This is not a problem except for patients on mechanical ventilators, since gas supplied through oxygen masks in medical applications is typically composed of only 30–50% O
2 by volume (about 30 kPa at standard pressure).[10]
At one time, premature babies were placed in incubators containing O
2-rich air, but this practice was discontinued after some babies were blinded by the oxygen content being too high.[10]
Breathing pure O
2 in space applications, such as in some modern space suits, or in early spacecraft such as Apollo, causes no damage due to the low total pressures used.[111][131] In the case of spacesuits, the O
2 partial pressure in the breathing gas is, in general, about 30 kPa (1.4 times normal), and the resulting O
2 partial pressure in the astronaut’s arterial blood is only marginally more than normal sea-level O
2 partial pressure.[132]
Oxygen toxicity to the lungs and central nervous system can also occur in deep scuba diving and surface supplied diving.[10][113] Prolonged breathing of an air mixture with an O
2 partial pressure more than 60 kPa can eventually lead to permanent pulmonary fibrosis.[133] Exposure to an O
2 partial pressures greater than 160 kPa (about 1.6 atm) may lead to convulsions (normally fatal for divers). Acute oxygen toxicity (causing seizures, its most feared effect for divers) can occur by breathing an air mixture with 21% O
2 at 66 m (217 ft) or more of depth; the same thing can occur by breathing 100% O
2 at only 6 m (20 ft).[133][134][135][136]
Combustion and other hazards
The interior of the Apollo 1 Command Module. Pure O
2 at higher than normal pressure and a spark led to a fire and the loss of the Apollo 1 crew.
Highly concentrated sources of oxygen promote rapid combustion. Fire and explosion hazards exist when concentrated oxidants and fuels are brought into close proximity; an ignition event, such as heat or a spark, is needed to trigger combustion.[33] Oxygen is the oxidant, not the fuel.
Concentrated O
2 will allow combustion to proceed rapidly and energetically.[33] Steel pipes and storage vessels used to store and transmit both gaseous and liquid oxygen will act as a fuel; and therefore the design and manufacture of O
2 systems requires special training to ensure that ignition sources are minimized.[33] The fire that killed the Apollo 1 crew in a launch pad test spread so rapidly because the capsule was pressurized with pure O
2 but at slightly more than atmospheric pressure, instead of the 1⁄3 normal pressure that would be used in a mission.[l][138]
Liquid oxygen spills, if allowed to soak into organic matter, such as wood, petrochemicals, and asphalt can cause these materials to detonate unpredictably on subsequent mechanical impact.[33]
See also
- Geological history of oxygen
- Hypoxia (environmental) for O
2 depletion in aquatic ecology - Ocean deoxygenation
- Hypoxia (medical), a lack of oxygen
- Limiting oxygen concentration
- Oxygen compounds
- Oxygen plant
- Oxygen sensor
Notes
- ^ These results were mostly ignored until 1860. Part of this rejection was due to the belief that atoms of one element would have no chemical affinity towards atoms of the same element, and part was due to apparent exceptions to Avogadro’s law that were not explained until later in terms of dissociating molecules.
- ^ An orbital is a concept from quantum mechanics that models an electron as a wave-like particle that has a spatial distribution about an atom or molecule.
- ^ Oxygen’s paramagnetism can be used analytically in paramagnetic oxygen gas analysers that determine the purity of gaseous oxygen. («Company literature of Oxygen analyzers (triplet)». Servomex. Archived from the original on March 8, 2008. Retrieved December 15, 2007.)
- ^ Figures given are for values up to 80 km (50 mi) above the surface
- ^ Thylakoid membranes are part of chloroplasts in algae and plants while they simply are one of many membrane structures in cyanobacteria. In fact, chloroplasts are thought to have evolved from cyanobacteria that were once symbiotic partners with the progenitors of plants and algae.
- ^ Water oxidation is catalyzed by a manganese-containing enzyme complex known as the oxygen evolving complex (OEC) or water-splitting complex found associated with the lumenal side of thylakoid membranes. Manganese is an important cofactor, and calcium and chloride are also required for the reaction to occur. (Raven 2005)
- ^ (1.8 grams/min/person)×(60 min/h)×(24 h/day)×(365 days/year)×(6.6 billion people)/1,000,000 g/t=6.24 billion tonnes
- ^ a b c d Derived from mmHg values using 0.133322 kPa/mmHg
- ^ The reason is that increasing the proportion of oxygen in the breathing gas at low pressure acts to augment the inspired O
2 partial pressure nearer to that found at sea-level. - ^ Also, since oxygen has a higher electronegativity than hydrogen, the charge difference makes it a polar molecule. The interactions between the different dipoles of each molecule cause a net attraction force.
- ^ Since O
2‘s partial pressure is the fraction of O
2 times the total pressure, elevated partial pressures can occur either from high O
2 fraction in breathing gas or from high breathing gas pressure, or a combination of both. - ^ No single ignition source of the fire was conclusively identified, although some evidence points to an arc from an electrical spark.[137]
References
- ^ «Standard Atomic Weights: Oxygen». CIAAW. 2009.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Atkins, P.; Jones, L.; Laverman, L. (2016).Chemical Principles, 7th edition. Freeman. ISBN 978-1-4641-8395-9
- ^ Hall, John (2011). Guyton and Hall textbook of medical physiology (12th ed.). Philadelphia, Pa.: Saunders/Elsevier. p. 5. ISBN 978-1-4160-4574-8.
- ^ Pocock, Gillian; Richards, Christopher D. (2006). Human physiology : the basis of medicine (3rd ed.). Oxford: Oxford University Press. p. 311. ISBN 978-0-19-856878-0.
- ^ Jastrow, Joseph (1936). Story of Human Error. Ayer Publishing. p. 171. ISBN 978-0-8369-0568-7. Archived from the original on October 1, 2021. Retrieved August 23, 2020.
- ^ a b c d e Cook & Lauer 1968, p. 499.
- ^ a b c Chisholm, Hugh, ed. (1911). «Mayow, John» . Encyclopædia Britannica. Vol. 17 (11th ed.). Cambridge University Press. pp. 938–39.
- ^ a b «John Mayow». World of Chemistry. Thomson Gale. 2005. ISBN 978-0-669-32727-4. Archived from the original on April 17, 2020. Retrieved December 16, 2007.
- ^ a b c d e f Emsley 2001, p. 299
- ^ Best, Nicholas W. (2015). «Lavoisier’s ‘Reflections on Phlogiston’ I: Against Phlogiston Theory». Foundations of Chemistry. 17 (2): 137–51. doi:10.1007/s10698-015-9220-5. S2CID 170422925.
- ^ Morris, Richard (2003). The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press. ISBN 978-0-309-08905-0.
- ^ a b Marples, Frater James A. «Michael Sendivogius, Rosicrucian, and Father of Studies of Oxygen» (PDF). Societas Rosicruciana in Civitatibus Foederatis, Nebraska College. pp. 3–4. Archived (PDF) from the original on May 8, 2020. Retrieved May 25, 2018.
- ^ a b Bugaj, Roman (1971). «Michał Sędziwój – Traktat o Kamieniu Filozoficznym». Biblioteka Problemów (in Polish). 164: 83–84. ISSN 0137-5032. Archived from the original on October 1, 2021. Retrieved August 23, 2020.
- ^ «Oxygen». RSC.org. Archived from the original on January 28, 2017. Retrieved December 12, 2016.
- ^ a b c d e f g h i Cook & Lauer 1968, p. 500
- ^ a b c d e f g h Emsley 2001, p. 300
- ^ Priestley, Joseph (1775). «An Account of Further Discoveries in Air». Philosophical Transactions. 65: 384–94. doi:10.1098/rstl.1775.0039.
- ^ a b c Parks, G. D.; Mellor, J. W. (1939). Mellor’s Modern Inorganic Chemistry (6th ed.). London: Longmans, Green and Co.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 793. ISBN 978-0-08-037941-8.
- ^ DeTurck, Dennis; Gladney, Larry; Pietrovito, Anthony (1997). «Do We Take Atoms for Granted?». The Interactive Textbook of PFP96. University of Pennsylvania. Archived from the original on January 17, 2008. Retrieved January 28, 2008.
- ^ Roscoe, Henry Enfield; Schorlemmer, Carl (1883). A Treatise on Chemistry. D. Appleton and Co. p. 38.
- ^ a b Daintith, John (1994). Biographical Encyclopedia of Scientists. CRC Press. p. 707. ISBN 978-0-7503-0287-6.
- ^ Papanelopoulou, Faidra (2013). «Louis Paul Cailletet: The liquefaction of oxygen and the emergence of low-temperature research». Notes and Records of the Royal Society of London. 67 (4): 355–73. doi:10.1098/rsnr.2013.0047. PMC 3826198.
- ^ a b Emsley 2001, p. 303
- ^ a b c «Oxygen». How Products are Made. The Gale Group, Inc. 2002. Archived from the original on April 3, 2019. Retrieved December 16, 2007.
- ^ «Goddard-1926». NASA. Archived from the original on November 8, 2007. Retrieved November 18, 2007.
- ^ Flecker, Oriel Joyce (1924). A school chemistry. MIT Libraries. Oxford, Clarendon press. p. 30.
- ^ Scripps Institute. «Atmospheric Oxygen Research». Archived from the original on July 25, 2017. Retrieved October 8, 2011.
- ^ a b Jack Barrett, 2002, «Atomic Structure and Periodicity», (Basic concepts in chemistry, Vol. 9 of Tutorial chemistry texts), Cambridge, UK: Royal Society of Chemistry, p. 153, ISBN 0854046577. See Google Books. Archived May 30, 2020, at the Wayback Machine accessed January 31, 2015.
- ^ «Oxygen Facts». Science Kids. February 6, 2015. Archived from the original on May 7, 2020. Retrieved November 14, 2015.
- ^ Jakubowski, Henry. «Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen». Biochemistry Online. Saint John’s University. Archived from the original on October 5, 2018. Retrieved January 28, 2008.
- ^ a b c d e Werley, Barry L., ed. (1991). ASTM Technical Professional training. Fire Hazards in Oxygen Systems. Philadelphia: ASTM International Subcommittee G-4.05.
- ^ «Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet». University of Wisconsin-Madison Chemistry Department Demonstration lab. Archived from the original on December 17, 2007. Retrieved December 15, 2007.
- ^ Krieger-Liszkay, Anja (October 13, 2004). «Singlet oxygen production in photosynthesis». Journal of Experimental Botany. 56 (411): 337–346. doi:10.1093/jxb/erh237. PMID 15310815.
- ^ Harrison, Roy M. (1990). Pollution: Causes, Effects & Control (2nd ed.). Cambridge: Royal Society of Chemistry. ISBN 978-0-85186-283-5.
- ^ Wentworth, Paul; McDunn, J. E.; Wentworth, A. D.; Takeuchi, C.; Nieva, J.; Jones, T.; Bautista, C.; Ruedi, J. M.; Gutierrez, A.; Janda, K. D.; Babior, B. M.; Eschenmoser, A.; Lerner, R. A. (December 13, 2002). «Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation». Science. 298 (5601): 2195–2219. Bibcode:2002Sci…298.2195W. doi:10.1126/science.1077642. PMID 12434011. S2CID 36537588. Archived from the original on December 12, 2020. Retrieved December 6, 2019.
- ^ Hirayama, Osamu; Nakamura, Kyoko; Hamada, Syoko; Kobayasi, Yoko (1994). «Singlet oxygen quenching ability of naturally occurring carotenoids». Lipids. 29 (2): 149–150. doi:10.1007/BF02537155. PMID 8152349. S2CID 3965039.
- ^ Chieh, Chung. «Bond Lengths and Energies». University of Waterloo. Archived from the original on December 14, 2007. Retrieved December 16, 2007.
- ^ a b c Stwertka, Albert (1998). Guide to the Elements (Revised ed.). Oxford University Press. pp. 48–49. ISBN 978-0-19-508083-4.
- ^ «Atomic oxygen erosion». Archived from the original on June 13, 2007. Retrieved August 8, 2009.
- ^ a b Cacace, Fulvio; de Petris, Giulia; Troiani, Anna (2001). «Experimental Detection of Tetraoxygen». Angewandte Chemie International Edition. 40 (21): 4062–65. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493.
- ^ a b Ball, Phillip (September 16, 2001). «New form of oxygen found». Nature News. Archived from the original on October 21, 2013. Retrieved January 9, 2008.
- ^ Lundegaard, Lars F.; Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge; et al. (2006). «Observation of anO
8 molecular lattice in the phase of solid oxygen». Nature. 443 (7108): 201–04. Bibcode:2006Natur.443..201L. doi:10.1038/nature05174. PMID 16971946. S2CID 4384225. - ^ Desgreniers, S.; Vohra, Y. K.; Ruoff, A. L. (1990). «Optical response of very high density solid oxygen to 132 GPa». J. Phys. Chem. 94 (3): 1117–22. doi:10.1021/j100366a020.
- ^ Shimizu, K.; Suhara, K.; Ikumo, M.; Eremets, M. I.; et al. (1998). «Superconductivity in oxygen». Nature. 393 (6687): 767–69. Bibcode:1998Natur.393..767S. doi:10.1038/31656. S2CID 205001394.
- ^ «Air solubility in water». The Engineering Toolbox. Archived from the original on April 4, 2019. Retrieved December 21, 2007.
- ^ Evans, David Hudson; Claiborne, James B. (2005). The Physiology of Fishes (3rd ed.). CRC Press. p. 88. ISBN 978-0-8493-2022-4.
- ^ Lide, David R. (2003). «Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements». CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton, Florida: CRC Press. ISBN 978-0-8493-0595-5.
- ^ «Overview of Cryogenic Air Separation and Liquefier Systems». Universal Industrial Gases, Inc. Archived from the original on October 21, 2018. Retrieved December 15, 2007.
- ^ a b «Liquid Oxygen Material Safety Data Sheet» (PDF). Matheson Tri Gas. Archived from the original (PDF) on February 27, 2008. Retrieved December 15, 2007.
- ^ Krupenie, Paul H. (1972). «The Spectrum of Molecular Oxygen». Journal of Physical and Chemical Reference Data. 1 (2): 423–534. Bibcode:1972JPCRD…1..423K. doi:10.1063/1.3253101. S2CID 96242703. Archived from the original on October 1, 2021. Retrieved January 11, 2020.
- ^ Guy P. Brasseur; Susan Solomon (January 15, 2006). Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Springer Science & Business Media. pp. 220–. ISBN 978-1-4020-3824-2. Archived from the original on February 2, 2017. Retrieved July 2, 2015.
- ^ Kearns, David R. (1971). «Physical and chemical properties of singlet molecular oxygen». Chemical Reviews. 71 (4): 395–427. doi:10.1021/cr60272a004.
- ^ Holman, Jack P. (2002). Heat transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559. OCLC 46959719.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of heat and mass transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282. OCLC 62532755.
- ^ a b c d «Oxygen Nuclides / Isotopes». EnvironmentalChemistry.com. Archived from the original on July 12, 2012. Retrieved December 17, 2007.
- ^ a b c Meyer, B. S. (September 19–21, 2005). Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen (PDF). Workgroup on Oxygen in the Earliest Solar System. Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. Gatlinburg, Tennessee. 9022. Archived (PDF) from the original on December 29, 2010. Retrieved January 22, 2007.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ «NUDAT 13O». Archived from the original on June 9, 2022. Retrieved July 6, 2009.
- ^ «NUDAT 14O». Archived from the original on June 7, 2022. Retrieved July 6, 2009.
- ^ «NUDAT 15O». Archived from the original on June 7, 2022. Retrieved July 6, 2009.
- ^ Croswell, Ken (1996). Alchemy of the Heavens. Anchor. ISBN 978-0-385-47214-2. Archived from the original on May 13, 2011. Retrieved December 2, 2011.
- ^ Emsley 2001, p. 297
- ^ «Oxygen». Los Alamos National Laboratory. Archived from the original on October 26, 2007. Retrieved December 16, 2007.
- ^ a b c d Emsley 2001, p. 298
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 602. ISBN 978-0-08-037941-8.
- ^ From The Chemistry and Fertility of Sea Waters by H.W. Harvey, 1955, citing C.J.J. Fox, «On the coefficients of absorption of atmospheric gases in sea water», Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey notes that according to later articles in Nature, the values appear to be about 3% too high.
- ^ a b c d e f g h Emsley 2001, p. 301
- ^ a b Emsley 2001, p. 304
- ^ Hand, Eric (March 13, 2008). «The Solar System’s first breath». Nature. 452 (7185): 259. Bibcode:2008Natur.452..259H. doi:10.1038/452259a. PMID 18354437. S2CID 789382.
- ^ Miller, J. R.; Berger, M.; Alonso, L.; Cerovic, Z.; et al. (2003). Progress on the development of an integrated canopy fluorescence model. Geoscience and Remote Sensing Symposium, 2003. IGARSS ’03. Proceedings. 2003 IEEE International. Vol. 1. pp. 601–603. CiteSeerX 10.1.1.473.9500. doi:10.1109/IGARSS.2003.1293855. ISBN 0-7803-7929-2.
- ^ Fenical, William (September 1983). «Marine Plants: A Unique and Unexplored Resource». Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). DianePublishing. p. 147. ISBN 978-1-4289-2397-3. Archived from the original on March 25, 2015. Retrieved August 23, 2020.
- ^ Walker, J. C. G. (1980). The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag.
- ^ Brown, Theodore L.; LeMay, Burslen (2003). Chemistry: The Central Science. Prentice Hall/Pearson Education. p. 958. ISBN 978-0-13-048450-5.
- ^ a b Raven 2005, 115–27
- ^ Danovaro R; Dell’anno A; Pusceddu A; Gambi C; et al. (April 2010). «The first metazoa living in permanently anoxic conditions». BMC Biology. 8 (1): 30. doi:10.1186/1741-7007-8-30. PMC 2907586. PMID 20370908.
- ^ Ward, Peter D.; Brownlee, Donald (2000). Rare Earth: Why Complex Life is Uncommon in the Universe. Copernicus Books (Springer Verlag). p. 217. ISBN 978-0-387-98701-9.
- ^ «NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago» (Press release). NASA. September 27, 2007. Archived from the original on March 13, 2008. Retrieved March 13, 2008.
- ^ Zimmer, Carl (October 3, 2013). «Earth’s Oxygen: A Mystery Easy to Take for Granted». The New York Times. Archived from the original on May 16, 2020. Retrieved October 3, 2013.
- ^ «Flow restrictor for measuring respiratory parameters». Archived from the original on May 8, 2020. Retrieved August 4, 2019.
- ^ a b
Normal Reference Range Table Archived December 25, 2011, at the Wayback Machine from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease. - ^ a b The Medical Education Division of the Brookside Associates—> ABG (Arterial Blood Gas) Archived August 12, 2017, at the Wayback Machine Retrieved on December 6, 2009
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ a b Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. (2013). «Atmospheric oxygenation three billion years ago». Nature. 501 (7468): 535–38. Bibcode:2013Natur.501..535C. doi:10.1038/nature12426. PMID 24067713. S2CID 4464710.
- ^ Iron in primeval seas rusted by bacteria Archived March 11, 2020, at the Wayback Machine, ScienceDaily, April 23, 2013
- ^ Campbell, Neil A.; Reece, Jane B. (2005). Biology (7th ed.). San Francisco: Pearson – Benjamin Cummings. pp. 522–23. ISBN 978-0-8053-7171-0.
- ^ Freeman, Scott (2005). Biological Science, 2nd. Upper Saddle River, NJ: Pearson – Prentice Hall. pp. 214, 586. ISBN 978-0-13-140941-5.
- ^ a b Berner, Robert A. (1999). «Atmospheric oxygen over Phanerozoic time». Proceedings of the National Academy of Sciences of the USA. 96 (20): 10955–57. Bibcode:1999PNAS…9610955B. doi:10.1073/pnas.96.20.10955. PMC 34224. PMID 10500106.
- ^ Butterfield, N. J. (2009). «Oxygen, animals and oceanic ventilation: An alternative view». Geobiology. 7 (1): 1–7. doi:10.1111/j.1472-4669.2009.00188.x. PMID 19200141. S2CID 31074331.
- ^ Poulsen, Christopher J.; Tabor, Clay; White, Joseph D. (2015). «Long-term climate forcing by atmospheric oxygen concentrations». Science. 348 (6240): 1238–41. Bibcode:2015Sci…348.1238P. doi:10.1126/science.1260670. PMID 26068848. S2CID 206562386. Archived from the original on July 13, 2017. Retrieved June 12, 2015.
- ^ Dole, Malcolm (1965). «The Natural History of Oxygen». The Journal of General Physiology. 49 (1): 5–27. doi:10.1085/jgp.49.1.5. PMC 2195461. PMID 5859927.
- ^ Paul Scott Anderson (January 3, 2019). «Oxygen and life: a cautionary tale». Archived from the original on January 22, 2021. Retrieved December 29, 2020.
- ^ Luger R, Barnes R (February 2015). «Extreme water loss and abiotic O2 buildup on planets throughout the habitable zones of M dwarfs». Astrobiology. 15 (2): 119–43. arXiv:1411.7412. Bibcode:2015AsBio..15..119L. doi:10.1089/ast.2014.1231. PMC 4323125. PMID 25629240.
- ^ Wordsworth, Robin; Pierrehumbert, Raymond (April 1, 2014). «Abiotic oxygen-dominated atmospheres on terrestrial habitable zone planets». The Astrophysical Journal. 785 (2): L20. arXiv:1403.2713. Bibcode:2014ApJ…785L..20W. doi:10.1088/2041-8205/785/2/L20. S2CID 17414970.
- ^ Hall, D.T.; Feldman, P.D.; et al. (1998). «The Far-Ultraviolet Oxygen Airglow of Europa and Ganymede». The Astrophysical Journal. 499 (1): 475–81. Bibcode:1998ApJ…499..475H. doi:10.1086/305604.
- ^ «Non-Cryogenic Air Separation Processes». UIG Inc. 2003. Archived from the original on October 3, 2018. Retrieved December 16, 2007.
- ^ a b Cook & Lauer 1968, p. 510
- ^ Sim MA; Dean P; Kinsella J; Black R; et al. (2008). «Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated». Anaesthesia. 63 (9): 938–40. doi:10.1111/j.1365-2044.2008.05536.x. PMID 18540928. S2CID 205248111.
- ^ Stephenson RN; Mackenzie I; Watt SJ; Ross JA (1996). «Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy». Undersea Hyperb Med. 23 (3): 185–88. PMID 8931286. Archived from the original on August 11, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Undersea and Hyperbaric Medical Society. «Indications for hyperbaric oxygen therapy». Archived from the original on September 12, 2008. Retrieved September 22, 2008.
- ^ Undersea and Hyperbaric Medical Society. «Carbon Monoxide». Archived from the original on July 25, 2008. Retrieved September 22, 2008.
- ^ Piantadosi CA (2004). «Carbon monoxide poisoning». Undersea Hyperb Med. 31 (1): 167–77. PMID 15233173. Archived from the original on February 3, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Hart GB; Strauss MB (1990). «Gas Gangrene – Clostridial Myonecrosis: A Review». J. Hyperbaric Med. 5 (2): 125–44. Archived from the original on February 3, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Zamboni WA; Riseman JA; Kucan JO (1990). «Management of Fournier’s Gangrene and the role of Hyperbaric Oxygen». J. Hyperbaric Med. 5 (3): 177–86. Archived from the original on February 3, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Undersea and Hyperbaric Medical Society. «Decompression Sickness or Illness and Arterial Gas Embolism». Archived from the original on July 5, 2008. Retrieved September 22, 2008.
- ^ Acott, C. (1999). «A brief history of diving and decompression illness». South Pacific Underwater Medicine Society Journal. 29 (2). Archived from the original on September 5, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Longphre, JM; Denoble, PJ; Moon, RE; Vann, RD; Freiberger, JJ (2007). «First aid normobaric oxygen for the treatment of recreational diving injuries» (PDF). Undersea & Hyperbaric Medicine. 34 (1): 43–49. PMID 17393938. S2CID 3236557. Archived from the original (PDF) on October 1, 2018 – via Rubicon Research Repository.
- ^ «Emergency Oxygen for Scuba Diving Injuries». Divers Alert Network. Archived from the original on April 20, 2020. Retrieved October 1, 2018.
- ^ «Oxygen First Aid for Scuba Diving Injuries». Divers Alert Network Europe. Archived from the original on June 10, 2020. Retrieved October 1, 2018.
- ^ a b Morgenthaler GW; Fester DA; Cooley CG (1994). «As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations». Acta Astronautica. 32 (1): 39–49. Bibcode:1994AcAau..32…39M. doi:10.1016/0094-5765(94)90146-5. PMID 11541018.
- ^ Webb JT; Olson RM; Krutz RW; Dixon G; Barnicott PT (1989). «Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures». Aviat Space Environ Med. 60 (5): 415–21. doi:10.4271/881071. PMID 2730484.
- ^ a b c d Acott, C. (1999). «Oxygen toxicity: A brief history of oxygen in diving». South Pacific Underwater Medicine Society Journal. 29 (3). Archived from the original on December 25, 2010. Retrieved September 21, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Longphre, J. M.; Denoble, P. J.; Moon, R. E.; Vann, R. D.; et al. (2007). «First aid normobaric oxygen for the treatment of recreational diving injuries». Undersea Hyperb. Med. 34 (1): 43–49. PMID 17393938. Archived from the original on June 13, 2008. Retrieved September 21, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ a b Bren, Linda (November–December 2002). «Oxygen Bars: Is a Breath of Fresh Air Worth It?». FDA Consumer Magazine. U.S. Food and Drug Administration. 36 (6): 9–11. PMID 12523293. Archived from the original on October 18, 2007. Retrieved December 23, 2007.
- ^ «Ergogenic Aids». Peak Performance Online. Archived from the original on September 28, 2007. Retrieved January 4, 2008.
- ^ «George Goble’s extended home page (mirror)». Archived from the original on February 11, 2009. Retrieved March 14, 2008.
- ^ Cook & Lauer 1968, p. 508
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8., p. 28
- ^ IUPAC: Red Book. Archived July 9, 2018, at the Wayback Machine pp. 73, 320.
- ^ Maksyutenko, P.; Rizzo, T. R.; Boyarkin, O. V. (2006). «A direct measurement of the dissociation energy of water». J. Chem. Phys. 125 (18): 181101. Bibcode:2006JChPh.125r1101M. doi:10.1063/1.2387163. PMID 17115729.
- ^ Chaplin, Martin (January 4, 2008). «Water Hydrogen Bonding». Archived from the original on October 10, 2007. Retrieved January 6, 2008.
- ^ Smart, Lesley E.; Moore, Elaine A. (2005). Solid State Chemistry: An Introduction (3rd ed.). CRC Press. p. 214. ISBN 978-0-7487-7516-3.
- ^ a b Cook & Lauer 1968, p. 507
- ^ Crabtree, R. (2001). The Organometallic Chemistry of the Transition Metals (3rd ed.). John Wiley & Sons. p. 152. ISBN 978-0-471-18423-2.
- ^ Cook & Lauer 1968, p.505
- ^ Cook & Lauer 1968, p. 506
- ^ «NFPA 704 ratings and id numbers for common hazardous materials» (PDF). Riverside County Department of Environmental Health. Archived (PDF) from the original on July 11, 2019. Retrieved August 22, 2017.
- ^ Dharmeshkumar N Patel; Ashish Goel; SB Agarwal; Praveenkumar Garg; et al. (2003). «Oxygen Toxicity» (PDF). Indian Academy of Clinical Medicine. 4 (3): 234. Archived from the original (PDF) on September 22, 2015. Retrieved April 26, 2009.
- ^ Cook & Lauer 1968, p. 511
- ^ Wade, Mark (2007). «Space Suits». Encyclopedia Astronautica. Archived from the original on December 13, 2007. Retrieved December 16, 2007.
- ^ Martin, Lawrence. «The Four Most Important Equations In Clinical Practice». GlobalRPh. David McAuley. Archived from the original on September 5, 2018. Retrieved June 19, 2013.
- ^ a b Wilmshurst P (1998). «Diving and oxygen». BMJ. 317 (7164): 996–99. doi:10.1136/bmj.317.7164.996. PMC 1114047. PMID 9765173.
- ^ Donald, Kenneth (1992). Oxygen and the Diver. England: SPA in conjunction with K. Donald. ISBN 978-1-85421-176-7.
- ^ Donald K. W. (1947). «Oxygen Poisoning in Man: Part I». Br Med J. 1 (4506): 667–72. doi:10.1136/bmj.1.4506.667. PMC 2053251. PMID 20248086.
- ^ Donald K. W. (1947). «Oxygen Poisoning in Man: Part II». Br Med J. 1 (4507): 712–17. doi:10.1136/bmj.1.4507.712. PMC 2053400. PMID 20248096.
- ^ Report of Apollo 204 Review Board NASA Historical Reference Collection, NASA History Office, NASA HQ, Washington, DC
- ^ Chiles, James R. (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. New York: HarperCollins Publishers Inc. ISBN 978-0-06-662082-4.
General references
- Cook, Gerhard A.; Lauer, Carol M. (1968). «Oxygen». In Clifford A. Hampel (ed.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 499–512. LCCN 68-29938.
- Emsley, John (2001). «Oxygen». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England: Oxford University Press. pp. 297–304. ISBN 978-0-19-850340-8.
- Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). Biology of Plants (7th ed.). New York: W. H. Freeman and Company Publishers. pp. 115–27. ISBN 978-0-7167-1007-3.
External links
This audio file was created from a revision of this article dated 23 June 2008, and does not reflect subsequent edits.
- Oxygen at The Periodic Table of Videos (University of Nottingham)
- Oxidizing Agents > Oxygen
- Oxygen (O2) Properties, Uses, Applications
- Roald Hoffmann article on «The Story of O»
- WebElements.com – Oxygen
- Oxygen on In Our Time at the BBC
- Scripps Institute: Atmospheric Oxygen has been dropping for 20 years

Liquid oxygen boiling (O2) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxygen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allotropes | O2, O3 (ozone) and more (see Allotropes of oxygen) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | gas: colorless liquid and solid: pale blue |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(O) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abundance | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| in the Earth’s crust | 461000 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxygen in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 16 (chalcogens) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | (O2) 54.36 K (−218.79 °C, −361.82 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | (O2) 90.188 K (−182.962 °C, −297.332 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 1.429 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.141 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 54.361 K, 0.1463 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 154.581 K, 5.043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | (O2) 0.444 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | (O2) 6.82 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | (O2) 29.378 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, −1, 0, +1, +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 3.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 66±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of oxygen |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubic
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 330 m/s (gas, at 27 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 26.58×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +3449.0×10−6 cm3/mol (293 K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Michael Sendivogius Carl Wilhelm Scheele (1604, 1771) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Named by | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of oxygen
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Oxygen is the chemical element with the symbol O and atomic number 8. It is a member of the chalcogen group in the periodic table, a highly reactive nonmetal, and an oxidizing agent that readily forms oxides with most elements as well as with other compounds. Oxygen is Earth’s most abundant element, and after hydrogen and helium, it is the third-most abundant element in the universe. At standard temperature and pressure, two atoms of the element bind to form dioxygen, a colorless and odorless diatomic gas with the formula O
2. Diatomic oxygen gas currently constitutes 20.95% of the Earth’s atmosphere, though this has changed considerably over long periods of time. Oxygen makes up almost half of the Earth’s crust in the form of oxides.[3]
All plants, animals, and fungus need oxygen for cellular respiration, which extracts energy by the reaction of oxygen with molecules derived from food and produces carbon dioxide as a waste product. In tetrapods breathing brings oxygen into the lungs where gas exchange takes place, carbon dioxide diffuses out of the blood, and oxygen diffuses into the blood. The body’s circulatory system transports the oxygen the cells, where cellular respiration takes place.[4][5]
Many major classes of organic molecules in living organisms contain oxygen atoms, such as proteins, nucleic acids, carbohydrates, and fats, as do the major constituent inorganic compounds of animal shells, teeth, and bone. Most of the mass of living organisms is oxygen as a component of water, the major constituent of lifeforms. Oxygen is continuously replenished in Earth’s atmosphere by photosynthesis, which uses the energy of sunlight to produce oxygen from water and carbon dioxide. Oxygen is too chemically reactive to remain a free element in air without being continuously replenished by the photosynthetic action of living organisms. Another form (allotrope) of oxygen, ozone (O
3), strongly absorbs ultraviolet UVB radiation and the high-altitude ozone layer helps protect the biosphere from ultraviolet radiation. However, ozone present at the surface is a byproduct of smog and thus a pollutant.
Oxygen was isolated by Michael Sendivogius before 1604, but it is commonly believed that the element was discovered independently by Carl Wilhelm Scheele, in Uppsala, in 1773 or earlier, and Joseph Priestley in Wiltshire, in 1774. Priority is often given for Priestley because his work was published first. Priestley, however, called oxygen «dephlogisticated air», and did not recognize it as a chemical element. The name oxygen was coined in 1777 by Antoine Lavoisier, who first recognized oxygen as a chemical element and correctly characterized the role it plays in combustion.
Common uses of oxygen include production of steel, plastics and textiles, brazing, welding and cutting of steels and other metals, rocket propellant, oxygen therapy, and life support systems in aircraft, submarines, spaceflight and diving.
History of study
Early experiments
One of the first known experiments on the relationship between combustion and air was conducted by the 2nd century BCE Greek writer on mechanics, Philo of Byzantium. In his work Pneumatica, Philo observed that inverting a vessel over a burning candle and surrounding the vessel’s neck with water resulted in some water rising into the neck.[6] Philo incorrectly surmised that parts of the air in the vessel were converted into the classical element fire and thus were able to escape through pores in the glass. Many centuries later Leonardo da Vinci built on Philo’s work by observing that a portion of air is consumed during combustion and respiration.[7]
In the late 17th century, Robert Boyle proved that air is necessary for combustion. English chemist John Mayow (1641–1679) refined this work by showing that fire requires only a part of air that he called spiritus nitroaereus.[8] In one experiment, he found that placing either a mouse or a lit candle in a closed container over water caused the water to rise and replace one-fourteenth of the air’s volume before extinguishing the subjects.[9] From this, he surmised that nitroaereus is consumed in both respiration and combustion.
Mayow observed that antimony increased in weight when heated, and inferred that the nitroaereus must have combined with it.[8] He also thought that the lungs separate nitroaereus from air and pass it into the blood and that animal heat and muscle movement result from the reaction of nitroaereus with certain substances in the body.[8] Accounts of these and other experiments and ideas were published in 1668 in his work Tractatus duo in the tract «De respiratione».[9]
Phlogiston theory
Robert Hooke, Ole Borch, Mikhail Lomonosov, and Pierre Bayen all produced oxygen in experiments in the 17th and the 18th century but none of them recognized it as a chemical element.[10] This may have been in part due to the prevalence of the philosophy of combustion and corrosion called the phlogiston theory, which was then the favored explanation of those processes.[11]
Established in 1667 by the German alchemist J. J. Becher, and modified by the chemist Georg Ernst Stahl by 1731,[12] phlogiston theory stated that all combustible materials were made of two parts. One part, called phlogiston, was given off when the substance containing it was burned, while the dephlogisticated part was thought to be its true form, or calx.[7]
Highly combustible materials that leave little residue, such as wood or coal, were thought to be made mostly of phlogiston; non-combustible substances that corrode, such as iron, contained very little. Air did not play a role in phlogiston theory, nor were any initial quantitative experiments conducted to test the idea; instead, it was based on observations of what happens when something burns, that most common objects appear to become lighter and seem to lose something in the process.[7]
Discovery
Polish alchemist, philosopher, and physician Michael Sendivogius (Michał Sędziwój) in his work De Lapide Philosophorum Tractatus duodecim e naturae fonte et manuali experientia depromti (1604) described a substance contained in air, referring to it as ‘cibus vitae’ (food of life,[13]) and according to Polish historian Roman Bugaj, this substance is identical with oxygen.[14] Sendivogius, during his experiments performed between 1598 and 1604, properly recognized that the substance is equivalent to the gaseous byproduct released by the thermal decomposition of potassium nitrate. In Bugaj’s view, the isolation of oxygen and the proper association of the substance to that part of air which is required for life, provides sufficient evidence for the discovery of oxygen by Sendivogius.[14] This discovery of Sendivogius was however frequently denied by the generations of scientists and chemists which succeeded him.[13]
It is also commonly claimed that oxygen was first discovered by Swedish pharmacist Carl Wilhelm Scheele. He had produced oxygen gas by heating mercuric oxide (HgO) and various nitrates in 1771–72.[15][16][7] Scheele called the gas «fire air» because it was then the only known agent to support combustion. He wrote an account of this discovery in a manuscript titled Treatise on Air and Fire, which he sent to his publisher in 1775. That document was published in 1777.[17]
In the meantime, on August 1, 1774, an experiment conducted by the British clergyman Joseph Priestley focused sunlight on mercuric oxide contained in a glass tube, which liberated a gas he named «dephlogisticated air».[16] He noted that candles burned brighter in the gas and that a mouse was more active and lived longer while breathing it. After breathing the gas himself, Priestley wrote: «The feeling of it to my lungs was not sensibly different from that of common air, but I fancied that my breast felt peculiarly light and easy for some time afterwards.»[10] Priestley published his findings in 1775 in a paper titled «An Account of Further Discoveries in Air», which was included in the second volume of his book titled Experiments and Observations on Different Kinds of Air.[7][18] Because he published his findings first, Priestley is usually given priority in the discovery.
The French chemist Antoine Laurent Lavoisier later claimed to have discovered the new substance independently. Priestley visited Lavoisier in October 1774 and told him about his experiment and how he liberated the new gas. Scheele had also dispatched a letter to Lavoisier on September 30, 1774, which described his discovery of the previously unknown substance, but Lavoisier never acknowledged receiving it. (A copy of the letter was found in Scheele’s belongings after his death.)[17]
Lavoisier’s contribution
Lavoisier conducted the first adequate quantitative experiments on oxidation and gave the first correct explanation of how combustion works.[16] He used these and similar experiments, all started in 1774, to discredit the phlogiston theory and to prove that the substance discovered by Priestley and Scheele was a chemical element.
In one experiment, Lavoisier observed that there was no overall increase in weight when tin and air were heated in a closed container.[16] He noted that air rushed in when he opened the container, which indicated that part of the trapped air had been consumed. He also noted that the tin had increased in weight and that increase was the same as the weight of the air that rushed back in. This and other experiments on combustion were documented in his book Sur la combustion en général, which was published in 1777.[16] In that work, he proved that air is a mixture of two gases; ‘vital air’, which is essential to combustion and respiration, and azote (Gk. ἄζωτον «lifeless»), which did not support either. Azote later became nitrogen in English, although it has kept the earlier name in French and several other European languages.[16]
Etymology
Lavoisier renamed ‘vital air’ to oxygène in 1777 from the Greek roots ὀξύς (oxys) (acid, literally «sharp», from the taste of acids) and -γενής (-genēs) (producer, literally begetter), because he mistakenly believed that oxygen was a constituent of all acids.[19] Chemists (such as Sir Humphry Davy in 1812) eventually determined that Lavoisier was wrong in this regard, but by then the name was too well established.[20]
Oxygen entered the English language despite opposition by English scientists and the fact that the Englishman Priestley had first isolated the gas and written about it. This is partly due to a poem praising the gas titled «Oxygen» in the popular book The Botanic Garden (1791) by Erasmus Darwin, grandfather of Charles Darwin.[17]
Later history
John Dalton’s original atomic hypothesis presumed that all elements were monatomic and that the atoms in compounds would normally have the simplest atomic ratios with respect to one another. For example, Dalton assumed that water’s formula was HO, leading to the conclusion that the atomic mass of oxygen was 8 times that of hydrogen, instead of the modern value of about 16.[21] In 1805, Joseph Louis Gay-Lussac and Alexander von Humboldt showed that water is formed of two volumes of hydrogen and one volume of oxygen; and by 1811 Amedeo Avogadro had arrived at the correct interpretation of water’s composition, based on what is now called Avogadro’s law and the diatomic elemental molecules in those gases.[22][a]
The first commercial method of producing oxygen was chemical, the so-called Brin process involving a reversible reaction of barium oxide. It was invented in 1852 and commercialized in 1884, but was displaced by newer methods in early 20th century.
By the late 19th century scientists realized that air could be liquefied and its components isolated by compressing and cooling it. Using a cascade method, Swiss chemist and physicist Raoul Pierre Pictet evaporated liquid sulfur dioxide in order to liquefy carbon dioxide, which in turn was evaporated to cool oxygen gas enough to liquefy it. He sent a telegram on December 22, 1877, to the French Academy of Sciences in Paris announcing his discovery of liquid oxygen.[23] Just two days later, French physicist Louis Paul Cailletet announced his own method of liquefying molecular oxygen.[23] Only a few drops of the liquid were produced in each case and no meaningful analysis could be conducted. Oxygen was liquefied in a stable state for the first time on March 29, 1883, by Polish scientists from Jagiellonian University, Zygmunt Wróblewski and Karol Olszewski.[24]
An experiment setup for preparation of oxygen in academic laboratories
In 1891 Scottish chemist James Dewar was able to produce enough liquid oxygen for study.[25] The first commercially viable process for producing liquid oxygen was independently developed in 1895 by German engineer Carl von Linde and British engineer William Hampson. Both men lowered the temperature of air until it liquefied and then distilled the component gases by boiling them off one at a time and capturing them separately.[26] Later, in 1901, oxyacetylene welding was demonstrated for the first time by burning a mixture of acetylene and compressed O
2. This method of welding and cutting metal later became common.[26]
In 1923, the American scientist Robert H. Goddard became the first person to develop a rocket engine that burned liquid fuel; the engine used gasoline for fuel and liquid oxygen as the oxidizer. Goddard successfully flew a small liquid-fueled rocket 56 m at 97 km/h on March 16, 1926, in Auburn, Massachusetts, US.[26][27]
In academic laboratories, oxygen can be prepared by heating together potassium chlorate mixed with a small proportion of manganese dioxide.[28]
Oxygen levels in the atmosphere are trending slightly downward globally, possibly because of fossil-fuel burning.[29]
Characteristics
Properties and molecular structure
Orbital diagram, after Barrett (2002),[30] showing the participating atomic orbitals from each oxygen atom, the molecular orbitals that result from their overlap, and the aufbau filling of the orbitals with the 12 electrons, 6 from each O atom, beginning from the lowest-energy orbitals, and resulting in covalent double-bond character from filled orbitals (and cancellation of the contributions of the pairs of σ and σ* and π and π* orbital pairs).
At standard temperature and pressure, oxygen is a colorless, odorless, and tasteless gas with the molecular formula O
2, referred to as dioxygen.[31]
As dioxygen, two oxygen atoms are chemically bound to each other. The bond can be variously described based on level of theory, but is reasonably and simply described as a covalent double bond that results from the filling of molecular orbitals formed from the atomic orbitals of the individual oxygen atoms, the filling of which results in a bond order of two. More specifically, the double bond is the result of sequential, low-to-high energy, or Aufbau, filling of orbitals, and the resulting cancellation of contributions from the 2s electrons, after sequential filling of the low σ and σ* orbitals; σ overlap of the two atomic 2p orbitals that lie along the O–O molecular axis and π overlap of two pairs of atomic 2p orbitals perpendicular to the O–O molecular axis, and then cancellation of contributions from the remaining two 2p electrons after their partial filling of the π* orbitals.[30]
This combination of cancellations and σ and π overlaps results in dioxygen’s double-bond character and reactivity, and a triplet electronic ground state. An electron configuration with two unpaired electrons, as is found in dioxygen orbitals (see the filled π* orbitals in the diagram) that are of equal energy—i.e., degenerate—is a configuration termed a spin triplet state. Hence, the ground state of the O
2 molecule is referred to as triplet oxygen.[32][b] The highest-energy, partially filled orbitals are antibonding, and so their filling weakens the bond order from three to two. Because of its unpaired electrons, triplet oxygen reacts only slowly with most organic molecules, which have paired electron spins; this prevents spontaneous combustion.[33]
Liquid oxygen, temporarily suspended in a magnet owing to its paramagnetism
In the triplet form, O
2 molecules are paramagnetic. That is, they impart magnetic character to oxygen when it is in the presence of a magnetic field, because of the spin magnetic moments of the unpaired electrons in the molecule, and the negative exchange energy between neighboring O
2 molecules.[25] Liquid oxygen is so magnetic that, in laboratory demonstrations, a bridge of liquid oxygen may be supported against its own weight between the poles of a powerful magnet.[34][c]
Singlet oxygen is a name given to several higher-energy species of molecular O
2 in which all the electron spins are paired. It is much more reactive with common organic molecules than is normal (triplet) molecular oxygen. In nature, singlet oxygen is commonly formed from water during photosynthesis, using the energy of sunlight.[35] It is also produced in the troposphere by the photolysis of ozone by light of short wavelength[36] and by the immune system as a source of active oxygen.[37] Carotenoids in photosynthetic organisms (and possibly animals) play a major role in absorbing energy from singlet oxygen and converting it to the unexcited ground state before it can cause harm to tissues.[38]
Allotropes
The common allotrope of elemental oxygen on Earth is called dioxygen, O
2, the major part of the Earth’s atmospheric oxygen (see Occurrence). O2 has a bond length of 121 pm and a bond energy of 498 kJ/mol.[39] O2 is used by complex forms of life, such as animals, in cellular respiration. Other aspects of O
2 are covered in the remainder of this article.
Trioxygen (O
3) is usually known as ozone and is a very reactive allotrope of oxygen that is damaging to lung tissue.[40] Ozone is produced in the upper atmosphere when O
2 combines with atomic oxygen made by the splitting of O
2 by ultraviolet (UV) radiation.[19] Since ozone absorbs strongly in the UV region of the spectrum, the ozone layer of the upper atmosphere functions as a protective radiation shield for the planet.[19] Near the Earth’s surface, it is a pollutant formed as a by-product of automobile exhaust.[40] At low earth orbit altitudes, sufficient atomic oxygen is present to cause corrosion of spacecraft.[41]
The metastable molecule tetraoxygen (O
4) was discovered in 2001,[42][43] and was assumed to exist in one of the six phases of solid oxygen. It was proven in 2006 that this phase, created by pressurizing O
2 to 20 GPa, is in fact a rhombohedral O
8 cluster.[44] This cluster has the potential to be a much more powerful oxidizer than either O
2 or O
3 and may therefore be used in rocket fuel.[42][43] A metallic phase was discovered in 1990 when solid oxygen is subjected to a pressure of above 96 GPa[45] and it was shown in 1998 that at very low temperatures, this phase becomes superconducting.[46]
Physical properties
Oxygen discharge (spectrum) tube
Oxygen dissolves more readily in water than in nitrogen, and in freshwater more readily than in seawater. Water in equilibrium with air contains approximately 1 molecule of dissolved O
2 for every 2 molecules of N
2 (1:2), compared with an atmospheric ratio of approximately 1:4. The solubility of oxygen in water is temperature-dependent, and about twice as much (14.6 mg/L) dissolves at 0 °C than at 20 °C (7.6 mg/L).[10][47] At 25 °C and 1 standard atmosphere (101.3 kPa) of air, freshwater can dissolve about 6.04 milliliters (mL) of oxygen per liter, and seawater contains about 4.95 mL per liter.[48] At 5 °C the solubility increases to 9.0 mL (50% more than at 25 °C) per liter for freshwater and 7.2 mL (45% more) per liter for sea water.
| 5 °C | 25 °C | |
|---|---|---|
| Freshwater | 9.00 | 6.04 |
| Seawater | 7.20 | 4.95 |
Oxygen condenses at 90.20 K (−182.95 °C, −297.31 °F) and freezes at 54.36 K (−218.79 °C, −361.82 °F).[49] Both liquid and solid O
2 are clear substances with a light sky-blue color caused by absorption in the red (in contrast with the blue color of the sky, which is due to Rayleigh scattering of blue light). High-purity liquid O
2 is usually obtained by the fractional distillation of liquefied air.[50] Liquid oxygen may also be condensed from air using liquid nitrogen as a coolant.[51]
Liquid oxygen is a highly reactive substance and must be segregated from combustible materials.[51]
The spectroscopy of molecular oxygen is associated with the atmospheric processes of aurora and airglow.[52] The absorption in the Herzberg continuum and Schumann–Runge bands in the ultraviolet produces atomic oxygen that is important in the chemistry of the middle atmosphere.[53] Excited-state singlet molecular oxygen is responsible for red chemiluminescence in solution.[54]
Table of thermal and physical properties of oxygen (O2) at atmospheric pressure:[55][56]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg °C) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m °C) | Thermal diffusivity (m^2/s) | Prandtl Number |
| 100 | 3.945 | 0.962 | 7.64E-06 | 1.94E-06 | 0.00925 | 2.44E-06 | 0.796 |
| 150 | 2.585 | 0.921 | 1.15E-05 | 4.44E-06 | 0.0138 | 5.80E-06 | 0.766 |
| 200 | 1.93 | 0.915 | 1.48E-05 | 7.64E-06 | 0.0183 | 1.04E-05 | 0.737 |
| 250 | 1.542 | 0.915 | 1.79E-05 | 1.16E-05 | 0.0226 | 1.60E-05 | 0.723 |
| 300 | 1.284 | 0.92 | 2.07E-05 | 1.61E-05 | 0.0268 | 2.27E-05 | 0.711 |
| 350 | 1.1 | 0.929 | 2.34E-05 | 2.12E-05 | 0.0296 | 2.90E-05 | 0.733 |
| 400 | 0.962 | 1.0408 | 2.58E-05 | 2.68E-05 | 0.033 | 3.64E-05 | 0.737 |
| 450 | 0.8554 | 0.956 | 2.81E-05 | 3.29E-05 | 0.0363 | 4.44E-05 | 0.741 |
| 500 | 0.7698 | 0.972 | 3.03E-05 | 3.94E-05 | 0.0412 | 5.51E-05 | 0.716 |
| 550 | 0.6998 | 0.988 | 3.24E-05 | 4.63E-05 | 0.0441 | 6.38E-05 | 0.726 |
| 600 | 0.6414 | 1.003 | 3.44E-05 | 5.36E-05 | 0.0473 | 7.35E-05 | 0.729 |
| 700 | 0.5498 | 1.031 | 3.81E-05 | 6.93E-05 | 0.0528 | 9.31E-05 | 0.744 |
| 800 | 0.481 | 1.054 | 4.15E-05 | 8.63E-05 | 0.0589 | 1.16E-04 | 0.743 |
| 900 | 0.4275 | 1.074 | 4.47E-05 | 1.05E-04 | 0.0649 | 1.41E-04 | 0.74 |
| 1000 | 0.3848 | 1.09 | 4.77E-05 | 1.24E-04 | 0.071 | 1.69E-04 | 0.733 |
| 1100 | 0.3498 | 1.103 | 5.06E-05 | 1.45E-04 | 0.0758 | 1.96E-04 | 0.736 |
| 1200 | 0.3206 | 1.0408 | 5.33E-05 | 1.661E-04 | 0.0819 | 2.29E-04 | 0.725 |
| 1300 | 0.296 | 1.125 | 5.88E-05 | 1.99E-04 | 0.0871 | 2.62E-04 | 0.721 |
Isotopes and stellar origin
Late in a massive star’s life, 16O concentrates in the O-shell, 17O in the H-shell and 18O in the He-shell.
Naturally occurring oxygen is composed of three stable isotopes, 16O, 17O, and 18O, with 16O being the most abundant (99.762% natural abundance).[57]
Most 16O is synthesized at the end of the helium fusion process in massive stars but some is made in the neon burning process.[58] 17O is primarily made by the burning of hydrogen into helium during the CNO cycle, making it a common isotope in the hydrogen burning zones of stars.[58] Most 18O is produced when 14N (made abundant from CNO burning) captures a 4He nucleus, making 18O common in the helium-rich zones of evolved, massive stars.[58]
Thirteen radioisotopes have been characterized, ranging from 11O to 26O.[59] The most stable are 15O with a half-life of 122.24 seconds and 14O with a half-life of 70.606 seconds.[57] All of the remaining radioactive isotopes have half-lives that are less than 27 s and the majority of these have half-lives that are less than 83 milliseconds.[57] The most common decay mode of the isotopes lighter than 16O is β+ decay[60][61][62] to yield nitrogen, and the most common mode for the isotopes heavier than 18O is beta decay to yield fluorine.[57]
Occurrence
| Z | Element | Mass fraction in parts per million | |
|---|---|---|---|
| 1 | Hydrogen | 739,000 | 71 × mass of oxygen (red bar) |
| 2 | Helium | 240,000 | 23 × mass of oxygen (red bar) |
| 8 | Oxygen | 10,400 | |
| 6 | Carbon | 4,600 | |
| 10 | Neon | 1,340 | |
| 26 | Iron | 1,090 | |
| 7 | Nitrogen | 960 | |
| 14 | Silicon | 650 | |
| 12 | Magnesium | 580 | |
| 16 | Sulfur | 440 |
Oxygen is the most abundant chemical element by mass in the Earth’s biosphere, air, sea and land. Oxygen is the third most abundant chemical element in the universe, after hydrogen and helium.[64] About 0.9% of the Sun’s mass is oxygen.[16] Oxygen constitutes 49.2% of the Earth’s crust by mass[65] as part of oxide compounds such as silicon dioxide and is the most abundant element by mass in the Earth’s crust. It is also the major component of the world’s oceans (88.8% by mass).[16] Oxygen gas is the second most common component of the Earth’s atmosphere, taking up 20.8% of its volume and 23.1% of its mass (some 1015 tonnes).[16][66][d] Earth is unusual among the planets of the Solar System in having such a high concentration of oxygen gas in its atmosphere: Mars (with 0.1% O
2 by volume) and Venus have much less. The O
2 surrounding those planets is produced solely by the action of ultraviolet radiation on oxygen-containing molecules such as carbon dioxide.
Cold water holds more dissolved O
2.
The unusually high concentration of oxygen gas on Earth is the result of the oxygen cycle. This biogeochemical cycle describes the movement of oxygen within and between its three main reservoirs on Earth: the atmosphere, the biosphere, and the lithosphere. The main driving factor of the oxygen cycle is photosynthesis, which is responsible for modern Earth’s atmosphere. Photosynthesis releases oxygen into the atmosphere, while respiration, decay, and combustion remove it from the atmosphere. In the present equilibrium, production and consumption occur at the same rate.[67]
Free oxygen also occurs in solution in the world’s water bodies. The increased solubility of O
2 at lower temperatures (see Physical properties) has important implications for ocean life, as polar oceans support a much higher density of life due to their higher oxygen content.[68] Water polluted with plant nutrients such as nitrates or phosphates may stimulate growth of algae by a process called eutrophication and the decay of these organisms and other biomaterials may reduce the O
2 content in eutrophic water bodies. Scientists assess this aspect of water quality by measuring the water’s biochemical oxygen demand, or the amount of O
2 needed to restore it to a normal concentration.[69]
Analysis
Paleoclimatologists measure the ratio of oxygen-18 and oxygen-16 in the shells and skeletons of marine organisms to determine the climate millions of years ago (see oxygen isotope ratio cycle). Seawater molecules that contain the lighter isotope, oxygen-16, evaporate at a slightly faster rate than water molecules containing the 12% heavier oxygen-18, and this disparity increases at lower temperatures.[70] During periods of lower global temperatures, snow and rain from that evaporated water tends to be higher in oxygen-16, and the seawater left behind tends to be higher in oxygen-18. Marine organisms then incorporate more oxygen-18 into their skeletons and shells than they would in a warmer climate.[70] Paleoclimatologists also directly measure this ratio in the water molecules of ice core samples as old as hundreds of thousands of years.
Planetary geologists have measured the relative quantities of oxygen isotopes in samples from the Earth, the Moon, Mars, and meteorites, but were long unable to obtain reference values for the isotope ratios in the Sun, believed to be the same as those of the primordial solar nebula. Analysis of a silicon wafer exposed to the solar wind in space and returned by the crashed Genesis spacecraft has shown that the Sun has a higher proportion of oxygen-16 than does the Earth. The measurement implies that an unknown process depleted oxygen-16 from the Sun’s disk of protoplanetary material prior to the coalescence of dust grains that formed the Earth.[71]
Oxygen presents two spectrophotometric absorption bands peaking at the wavelengths 687 and 760 nm. Some remote sensing scientists have proposed using the measurement of the radiance coming from vegetation canopies in those bands to characterize plant health status from a satellite platform.[72] This approach exploits the fact that in those bands it is possible to discriminate the vegetation’s reflectance from its fluorescence, which is much weaker. The measurement is technically difficult owing to the low signal-to-noise ratio and the physical structure of vegetation; but it has been proposed as a possible method of monitoring the carbon cycle from satellites on a global scale.
Biological production and role of O2
Photosynthesis and respiration
Photosynthesis splits water to liberate O
2 and fixes CO
2 into sugar in what is called a Calvin cycle.
In nature, free oxygen is produced by the light-driven splitting of water during oxygenic photosynthesis. According to some estimates, green algae and cyanobacteria in marine environments provide about 70% of the free oxygen produced on Earth, and the rest is produced by terrestrial plants.[73] Other estimates of the oceanic contribution to atmospheric oxygen are higher, while some estimates are lower, suggesting oceans produce ~45% of Earth’s atmospheric oxygen each year.[74]
A simplified overall formula for photosynthesis is[75]
- 6 CO2 + 6 H
2O + photons → C
6H
12O
6 + 6 O
2
or simply
- carbon dioxide + water + sunlight → glucose + dioxygen
Photolytic oxygen evolution occurs in the thylakoid membranes of photosynthetic organisms and requires the energy of four photons.[e] Many steps are involved, but the result is the formation of a proton gradient across the thylakoid membrane, which is used to synthesize adenosine triphosphate (ATP) via photophosphorylation.[76] The O
2 remaining (after production of the water molecule) is released into the atmosphere.[f]
Oxygen is used in mitochondria in the generation of ATP during oxidative phosphorylation. The reaction for aerobic respiration is essentially the reverse of photosynthesis and is simplified as
- C
6H
12O
6 + 6 O
2 → 6 CO2 + 6 H
2O + 2880 kJ/mol
In vertebrates, O
2 diffuses through membranes in the lungs and into red blood cells. Hemoglobin binds O
2, changing color from bluish red to bright red[40] (CO
2 is released from another part of hemoglobin through the Bohr effect). Other animals use hemocyanin (molluscs and some arthropods) or hemerythrin (spiders and lobsters).[66] A liter of blood can dissolve 200 cm3 of O
2.[66]
Until the discovery of anaerobic metazoa,[77] oxygen was thought to be a requirement for all complex life.[78]
Reactive oxygen species, such as superoxide ion (O−
2) and hydrogen peroxide (H
2O
2), are reactive by-products of oxygen use in organisms.[66] Parts of the immune system of higher organisms create peroxide, superoxide, and singlet oxygen to destroy invading microbes. Reactive oxygen species also play an important role in the hypersensitive response of plants against pathogen attack.[76] Oxygen is damaging to obligately anaerobic organisms, which were the dominant form of early life on Earth until O
2 began to accumulate in the atmosphere about 2.5 billion years ago during the Great Oxygenation Event, about a billion years after the first appearance of these organisms.[79][80]
An adult human at rest inhales 1.8 to 2.4 grams of oxygen per minute.[81] This amounts to more than 6 billion tonnes of oxygen inhaled by humanity per year.[g]
Living organisms
| Unit | Alveolar pulmonary gas pressures |
Arterial blood oxygen | Venous blood gas |
|---|---|---|---|
| kPa | 14.2 | 11[h]-13[h] | 4.0[h]-5.3[h] |
| mmHg | 107 | 75[82]-100[82] | 30[83]-40[83] |
The free oxygen partial pressure in the body of a living vertebrate organism is highest in the respiratory system, and decreases along any arterial system, peripheral tissues, and venous system, respectively. Partial pressure is the pressure that oxygen would have if it alone occupied the volume.[84]
Build-up in the atmosphere
O
2 build-up in Earth’s atmosphere: 1) no O
2 produced; 2) O
2 produced, but absorbed in oceans & seabed rock; 3) O
2 starts to gas out of the oceans, but is absorbed by land surfaces and formation of ozone layer; 4–5) O
2 sinks filled and the gas accumulates
Free oxygen gas was almost nonexistent in Earth’s atmosphere before photosynthetic archaea and bacteria evolved, probably about 3.5 billion years ago. Free oxygen first appeared in significant quantities during the Paleoproterozoic eon (between 3.0 and 2.3 billion years ago).[85] Even if there was much dissolved iron in the oceans when oxygenic photosynthesis was getting more common, it appears the banded iron formations were created by anoxyenic or micro-aerophilic iron-oxidizing bacteria which dominated the deeper areas of the photic zone, while oxygen-producing cyanobacteria covered the shallows.[86] Free oxygen began to outgas from the oceans 3–2.7 billion years ago, reaching 10% of its present level around 1.7 billion years ago.[85][87]
The presence of large amounts of dissolved and free oxygen in the oceans and atmosphere may have driven most of the extant anaerobic organisms to extinction during the Great Oxygenation Event (oxygen catastrophe) about 2.4 billion years ago. Cellular respiration using O
2 enables aerobic organisms to produce much more ATP than anaerobic organisms.[88] Cellular respiration of O
2 occurs in all eukaryotes, including all complex multicellular organisms such as plants and animals.
Since the beginning of the Cambrian period 540 million years ago, atmospheric O
2 levels have fluctuated between 15% and 30% by volume.[89] Towards the end of the Carboniferous period (about 300 million years ago) atmospheric O
2 levels reached a maximum of 35% by volume,[89] which may have contributed to the large size of insects and amphibians at this time.[90]
Variations in atmospheric oxygen concentration have shaped past climates. When oxygen declined, atmospheric density dropped, which in turn increased surface evaporation, causing precipitation increases and warmer temperatures.[91]
At the current rate of photosynthesis it would take about 2,000 years to regenerate the entire O
2 in the present atmosphere.[92]
In the field of astrobiology and in the search for extraterrestrial life oxygen is a strong biosignature. That said it might not be a definite biosignature, being possibly produced abiotically on celestial bodies with processes and conditions (such as a peculiar hydrosphere) which allow free oxygen,[93][94][95] like with Europa’s and Ganymede’s thin
oxygen atmospheres.[96]
Industrial production
One hundred million tonnes of O
2 are extracted from air for industrial uses annually by two primary methods.[17] The most common method is fractional distillation of liquefied air, with N
2 distilling as a vapor while O
2 is left as a liquid.[17]
The other primary method of producing O
2 is passing a stream of clean, dry air through one bed of a pair of identical zeolite molecular sieves, which absorbs the nitrogen and delivers a gas stream that is 90% to 93% O
2.[17] Simultaneously, nitrogen gas is released from the other nitrogen-saturated zeolite bed, by reducing the chamber operating pressure and diverting part of the oxygen gas from the producer bed through it, in the reverse direction of flow. After a set cycle time the operation of the two beds is interchanged, thereby allowing for a continuous supply of gaseous oxygen to be pumped through a pipeline. This is known as pressure swing adsorption. Oxygen gas is increasingly obtained by these non-cryogenic technologies (see also the related vacuum swing adsorption).[97]
Oxygen gas can also be produced through electrolysis of water into molecular oxygen and hydrogen. DC electricity must be used: if AC is used, the gases in each limb consist of hydrogen and oxygen in the explosive ratio 2:1. A similar method is the electrocatalytic O
2 evolution from oxides and oxoacids. Chemical catalysts can be used as well, such as in chemical oxygen generators or oxygen candles that are used as part of the life-support equipment on submarines, and are still part of standard equipment on commercial airliners in case of depressurization emergencies. Another air separation method is forcing air to dissolve through ceramic membranes based on zirconium dioxide by either high pressure or an electric current, to produce nearly pure O
2 gas.[69]
Storage
Oxygen and MAPP gas compressed-gas cylinders with regulators
Oxygen storage methods include high-pressure oxygen tanks, cryogenics and chemical compounds. For reasons of economy, oxygen is often transported in bulk as a liquid in specially insulated tankers, since one liter of liquefied oxygen is equivalent to 840 liters of gaseous oxygen at atmospheric pressure and 20 °C (68 °F).[17] Such tankers are used to refill bulk liquid-oxygen storage containers, which stand outside hospitals and other institutions that need large volumes of pure oxygen gas. Liquid oxygen is passed through heat exchangers, which convert the cryogenic liquid into gas before it enters the building. Oxygen is also stored and shipped in smaller cylinders containing the compressed gas; a form that is useful in certain portable medical applications and oxy-fuel welding and cutting.[17]
Applications
Medical
Uptake of O
2 from the air is the essential purpose of respiration, so oxygen supplementation is used in medicine. Treatment not only increases oxygen levels in the patient’s blood, but has the secondary effect of decreasing resistance to blood flow in many types of diseased lungs, easing work load on the heart. Oxygen therapy is used to treat emphysema, pneumonia, some heart disorders (congestive heart failure), some disorders that cause increased pulmonary artery pressure, and any disease that impairs the body’s ability to take up and use gaseous oxygen.[98]
Treatments are flexible enough to be used in hospitals, the patient’s home, or increasingly by portable devices. Oxygen tents were once commonly used in oxygen supplementation, but have since been replaced mostly by the use of oxygen masks or nasal cannulas.[99]
Hyperbaric (high-pressure) medicine uses special oxygen chambers to increase the partial pressure of O
2 around the patient and, when needed, the medical staff.[100] Carbon monoxide poisoning, gas gangrene, and decompression sickness (the ‘bends’) are sometimes addressed with this therapy.[101] Increased O
2 concentration in the lungs helps to displace carbon monoxide from the heme group of hemoglobin.[102][103] Oxygen gas is poisonous to the anaerobic bacteria that cause gas gangrene, so increasing its partial pressure helps kill them.[104][105] Decompression sickness occurs in divers who decompress too quickly after a dive, resulting in bubbles of inert gas, mostly nitrogen and helium, forming in the blood. Increasing the pressure of O
2 as soon as possible helps to redissolve the bubbles back into the blood so that these excess gasses can be exhaled naturally through the lungs.[98][106][107] Normobaric oxygen administration at the highest available concentration is frequently used as first aid for any diving injury that may involve inert gas bubble formation in the tissues. There is epidemiological support for its use from a statistical study of cases recorded in a long term database.[108][109][110]
Life support and recreational use
An application of O
2 as a low-pressure breathing gas is in modern space suits, which surround their occupant’s body with the breathing gas. These devices use nearly pure oxygen at about one-third normal pressure, resulting in a normal blood partial pressure of O
2. This trade-off of higher oxygen concentration for lower pressure is needed to maintain suit flexibility.[111][112]
Scuba and surface-supplied underwater divers and submariners also rely on artificially delivered O
2. Submarines, submersibles and atmospheric diving suits usually operate at normal atmospheric pressure. Breathing air is scrubbed of carbon dioxide by chemical extraction and oxygen is replaced to maintain a constant partial pressure. Ambient pressure divers breathe air or gas mixtures with an oxygen fraction suited to the operating depth. Pure or nearly pure O
2 use in diving at pressures higher than atmospheric is usually limited to rebreathers, or decompression at relatively shallow depths (~6 meters depth, or less),[113][114] or medical treatment in recompression chambers at pressures up to 2.8 bar, where acute oxygen toxicity can be managed without the risk of drowning. Deeper diving requires significant dilution of O
2 with other gases, such as nitrogen or helium, to prevent oxygen toxicity.[113]
People who climb mountains or fly in non-pressurized fixed-wing aircraft sometimes have supplemental O
2 supplies.[i] Pressurized commercial airplanes have an emergency supply of O
2 automatically supplied to the passengers in case of cabin depressurization. Sudden cabin pressure loss activates chemical oxygen generators above each seat, causing oxygen masks to drop. Pulling on the masks «to start the flow of oxygen» as cabin safety instructions dictate, forces iron filings into the sodium chlorate inside the canister.[69] A steady stream of oxygen gas is then produced by the exothermic reaction.
Oxygen, as a mild euphoric, has a history of recreational use in oxygen bars and in sports. Oxygen bars are establishments found in the United States since the late 1990s that offer higher than normal O
2 exposure for a minimal fee.[115] Professional athletes, especially in American football, sometimes go off-field between plays to don oxygen masks to boost performance. The pharmacological effect is doubted; a placebo effect is a more likely explanation.[115] Available studies support a performance boost from oxygen enriched mixtures only if it is inhaled during aerobic exercise.[116]
Other recreational uses that do not involve breathing include pyrotechnic applications, such as George Goble’s five-second ignition of barbecue grills.[117]
Industrial
Smelting of iron ore into steel consumes 55% of commercially produced oxygen.[69] In this process, O
2 is injected through a high-pressure lance into molten iron, which removes sulfur impurities and excess carbon as the respective oxides, SO
2 and CO
2. The reactions are exothermic, so the temperature increases to 1,700 °C.[69]
Another 25% of commercially produced oxygen is used by the chemical industry.[69] Ethylene is reacted with O
2 to create ethylene oxide, which, in turn, is converted into ethylene glycol; the primary feeder material used to manufacture a host of products, including antifreeze and polyester polymers (the precursors of many plastics and fabrics).[69]
Most of the remaining 20% of commercially produced oxygen is used in medical applications, metal cutting and welding, as an oxidizer in rocket fuel, and in water treatment.[69] Oxygen is used in oxyacetylene welding, burning acetylene with O
2 to produce a very hot flame. In this process, metal up to 60 cm (24 in) thick is first heated with a small oxy-acetylene flame and then quickly cut by a large stream of O
2.[118]
Compounds
Water (H
2O) is the most familiar oxygen compound.
The oxidation state of oxygen is −2 in almost all known compounds of oxygen. The oxidation state −1 is found in a few compounds such as peroxides.[119] Compounds containing oxygen in other oxidation states are very uncommon: −1/2 (superoxides), −1/3 (ozonides), 0 (elemental, hypofluorous acid), +1/2 (dioxygenyl), +1 (dioxygen difluoride), and +2 (oxygen difluoride).[120]
Oxides and other inorganic compounds
Water (H
2O) is an oxide of hydrogen and the most familiar oxygen compound. Hydrogen atoms are covalently bonded to oxygen in a water molecule but also have an additional attraction (about 23.3 kJ/mol per hydrogen atom) to an adjacent oxygen atom in a separate molecule.[121] These hydrogen bonds between water molecules hold them approximately 15% closer than what would be expected in a simple liquid with just van der Waals forces.[122][j]
Oxides, such as iron oxide or rust, form when oxygen combines with other elements.
Due to its electronegativity, oxygen forms chemical bonds with almost all other elements to give corresponding oxides. The surface of most metals, such as aluminium and titanium, are oxidized in the presence of air and become coated with a thin film of oxide that passivates the metal and slows further corrosion. Many oxides of the transition metals are non-stoichiometric compounds, with slightly less metal than the chemical formula would show. For example, the mineral FeO (wüstite) is written as 
Oxygen is present in the atmosphere in trace quantities in the form of carbon dioxide (CO
2). The Earth’s crustal rock is composed in large part of oxides of silicon (silica SiO
2, as found in granite and quartz), aluminium (aluminium oxide Al
2O
3, in bauxite and corundum), iron (iron(III) oxide Fe
2O
3, in hematite and rust), and calcium carbonate (in limestone). The rest of the Earth’s crust is also made of oxygen compounds, in particular various complex silicates (in silicate minerals). The Earth’s mantle, of much larger mass than the crust, is largely composed of silicates of magnesium and iron.
Water-soluble silicates in the form of Na
4SiO
4, Na
2SiO
3, and Na
2Si
2O
5 are used as detergents and adhesives.[124]
Oxygen also acts as a ligand for transition metals, forming transition metal dioxygen complexes, which feature metal–O
2. This class of compounds includes the heme proteins hemoglobin and myoglobin.[125] An exotic and unusual reaction occurs with PtF
6, which oxidizes oxygen to give O2+PtF6−, dioxygenyl hexafluoroplatinate.[126]
Organic compounds
Acetone is an important feeder material in the chemical industry.
Oxygen
Carbon
Hydrogen
Among the most important classes of organic compounds that contain oxygen are (where «R» is an organic group): alcohols (R-OH); ethers (R-O-R); ketones (R-CO-R); aldehydes (R-CO-H); carboxylic acids (R-COOH); esters (R-COO-R); acid anhydrides (R-CO-O-CO-R); and amides (R-C(O)-NR
2). There are many important organic solvents that contain oxygen, including: acetone, methanol, ethanol, isopropanol, furan, THF, diethyl ether, dioxane, ethyl acetate, DMF, DMSO, acetic acid, and formic acid. Acetone ((CH
3)
2CO) and phenol (C
6H
5OH) are used as feeder materials in the synthesis of many different substances. Other important organic compounds that contain oxygen are: glycerol, formaldehyde, glutaraldehyde, citric acid, acetic anhydride, and acetamide. Epoxides are ethers in which the oxygen atom is part of a ring of three atoms. The element is similarly found in almost all biomolecules that are important to (or generated by) life.
Oxygen reacts spontaneously with many organic compounds at or below room temperature in a process called autoxidation.[127] Most of the organic compounds that contain oxygen are not made by direct action of O
2. Organic compounds important in industry and commerce that are made by direct oxidation of a precursor include ethylene oxide and peracetic acid.[124]
Safety and precautions
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |

|
|
Hazard statements |
H272 |
|
Precautionary statements |
P220, P244, P370+P376, P403 |
| NFPA 704 (fire diamond) |
0 0 1 OX |
The NFPA 704 standard rates compressed oxygen gas as nonhazardous to health, nonflammable and nonreactive, but an oxidizer. Refrigerated liquid oxygen (LOX) is given a health hazard rating of 3 (for increased risk of hyperoxia from condensed vapors, and for hazards common to cryogenic liquids such as frostbite), and all other ratings are the same as the compressed gas form.[128]
Toxicity
Main symptoms of oxygen toxicity[129]
Oxygen gas (O
2) can be toxic at elevated partial pressures, leading to convulsions and other health problems.[113][k][130] Oxygen toxicity usually begins to occur at partial pressures more than 50 kilopascals (kPa), equal to about 50% oxygen composition at standard pressure or 2.5 times the normal sea-level O
2 partial pressure of about 21 kPa. This is not a problem except for patients on mechanical ventilators, since gas supplied through oxygen masks in medical applications is typically composed of only 30–50% O
2 by volume (about 30 kPa at standard pressure).[10]
At one time, premature babies were placed in incubators containing O
2-rich air, but this practice was discontinued after some babies were blinded by the oxygen content being too high.[10]
Breathing pure O
2 in space applications, such as in some modern space suits, or in early spacecraft such as Apollo, causes no damage due to the low total pressures used.[111][131] In the case of spacesuits, the O
2 partial pressure in the breathing gas is, in general, about 30 kPa (1.4 times normal), and the resulting O
2 partial pressure in the astronaut’s arterial blood is only marginally more than normal sea-level O
2 partial pressure.[132]
Oxygen toxicity to the lungs and central nervous system can also occur in deep scuba diving and surface supplied diving.[10][113] Prolonged breathing of an air mixture with an O
2 partial pressure more than 60 kPa can eventually lead to permanent pulmonary fibrosis.[133] Exposure to an O
2 partial pressures greater than 160 kPa (about 1.6 atm) may lead to convulsions (normally fatal for divers). Acute oxygen toxicity (causing seizures, its most feared effect for divers) can occur by breathing an air mixture with 21% O
2 at 66 m (217 ft) or more of depth; the same thing can occur by breathing 100% O
2 at only 6 m (20 ft).[133][134][135][136]
Combustion and other hazards
The interior of the Apollo 1 Command Module. Pure O
2 at higher than normal pressure and a spark led to a fire and the loss of the Apollo 1 crew.
Highly concentrated sources of oxygen promote rapid combustion. Fire and explosion hazards exist when concentrated oxidants and fuels are brought into close proximity; an ignition event, such as heat or a spark, is needed to trigger combustion.[33] Oxygen is the oxidant, not the fuel.
Concentrated O
2 will allow combustion to proceed rapidly and energetically.[33] Steel pipes and storage vessels used to store and transmit both gaseous and liquid oxygen will act as a fuel; and therefore the design and manufacture of O
2 systems requires special training to ensure that ignition sources are minimized.[33] The fire that killed the Apollo 1 crew in a launch pad test spread so rapidly because the capsule was pressurized with pure O
2 but at slightly more than atmospheric pressure, instead of the 1⁄3 normal pressure that would be used in a mission.[l][138]
Liquid oxygen spills, if allowed to soak into organic matter, such as wood, petrochemicals, and asphalt can cause these materials to detonate unpredictably on subsequent mechanical impact.[33]
See also
- Geological history of oxygen
- Hypoxia (environmental) for O
2 depletion in aquatic ecology - Ocean deoxygenation
- Hypoxia (medical), a lack of oxygen
- Limiting oxygen concentration
- Oxygen compounds
- Oxygen plant
- Oxygen sensor
Notes
- ^ These results were mostly ignored until 1860. Part of this rejection was due to the belief that atoms of one element would have no chemical affinity towards atoms of the same element, and part was due to apparent exceptions to Avogadro’s law that were not explained until later in terms of dissociating molecules.
- ^ An orbital is a concept from quantum mechanics that models an electron as a wave-like particle that has a spatial distribution about an atom or molecule.
- ^ Oxygen’s paramagnetism can be used analytically in paramagnetic oxygen gas analysers that determine the purity of gaseous oxygen. («Company literature of Oxygen analyzers (triplet)». Servomex. Archived from the original on March 8, 2008. Retrieved December 15, 2007.)
- ^ Figures given are for values up to 80 km (50 mi) above the surface
- ^ Thylakoid membranes are part of chloroplasts in algae and plants while they simply are one of many membrane structures in cyanobacteria. In fact, chloroplasts are thought to have evolved from cyanobacteria that were once symbiotic partners with the progenitors of plants and algae.
- ^ Water oxidation is catalyzed by a manganese-containing enzyme complex known as the oxygen evolving complex (OEC) or water-splitting complex found associated with the lumenal side of thylakoid membranes. Manganese is an important cofactor, and calcium and chloride are also required for the reaction to occur. (Raven 2005)
- ^ (1.8 grams/min/person)×(60 min/h)×(24 h/day)×(365 days/year)×(6.6 billion people)/1,000,000 g/t=6.24 billion tonnes
- ^ a b c d Derived from mmHg values using 0.133322 kPa/mmHg
- ^ The reason is that increasing the proportion of oxygen in the breathing gas at low pressure acts to augment the inspired O
2 partial pressure nearer to that found at sea-level. - ^ Also, since oxygen has a higher electronegativity than hydrogen, the charge difference makes it a polar molecule. The interactions between the different dipoles of each molecule cause a net attraction force.
- ^ Since O
2‘s partial pressure is the fraction of O
2 times the total pressure, elevated partial pressures can occur either from high O
2 fraction in breathing gas or from high breathing gas pressure, or a combination of both. - ^ No single ignition source of the fire was conclusively identified, although some evidence points to an arc from an electrical spark.[137]
References
- ^ «Standard Atomic Weights: Oxygen». CIAAW. 2009.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Atkins, P.; Jones, L.; Laverman, L. (2016).Chemical Principles, 7th edition. Freeman. ISBN 978-1-4641-8395-9
- ^ Hall, John (2011). Guyton and Hall textbook of medical physiology (12th ed.). Philadelphia, Pa.: Saunders/Elsevier. p. 5. ISBN 978-1-4160-4574-8.
- ^ Pocock, Gillian; Richards, Christopher D. (2006). Human physiology : the basis of medicine (3rd ed.). Oxford: Oxford University Press. p. 311. ISBN 978-0-19-856878-0.
- ^ Jastrow, Joseph (1936). Story of Human Error. Ayer Publishing. p. 171. ISBN 978-0-8369-0568-7. Archived from the original on October 1, 2021. Retrieved August 23, 2020.
- ^ a b c d e Cook & Lauer 1968, p. 499.
- ^ a b c Chisholm, Hugh, ed. (1911). «Mayow, John» . Encyclopædia Britannica. Vol. 17 (11th ed.). Cambridge University Press. pp. 938–39.
- ^ a b «John Mayow». World of Chemistry. Thomson Gale. 2005. ISBN 978-0-669-32727-4. Archived from the original on April 17, 2020. Retrieved December 16, 2007.
- ^ a b c d e f Emsley 2001, p. 299
- ^ Best, Nicholas W. (2015). «Lavoisier’s ‘Reflections on Phlogiston’ I: Against Phlogiston Theory». Foundations of Chemistry. 17 (2): 137–51. doi:10.1007/s10698-015-9220-5. S2CID 170422925.
- ^ Morris, Richard (2003). The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press. ISBN 978-0-309-08905-0.
- ^ a b Marples, Frater James A. «Michael Sendivogius, Rosicrucian, and Father of Studies of Oxygen» (PDF). Societas Rosicruciana in Civitatibus Foederatis, Nebraska College. pp. 3–4. Archived (PDF) from the original on May 8, 2020. Retrieved May 25, 2018.
- ^ a b Bugaj, Roman (1971). «Michał Sędziwój – Traktat o Kamieniu Filozoficznym». Biblioteka Problemów (in Polish). 164: 83–84. ISSN 0137-5032. Archived from the original on October 1, 2021. Retrieved August 23, 2020.
- ^ «Oxygen». RSC.org. Archived from the original on January 28, 2017. Retrieved December 12, 2016.
- ^ a b c d e f g h i Cook & Lauer 1968, p. 500
- ^ a b c d e f g h Emsley 2001, p. 300
- ^ Priestley, Joseph (1775). «An Account of Further Discoveries in Air». Philosophical Transactions. 65: 384–94. doi:10.1098/rstl.1775.0039.
- ^ a b c Parks, G. D.; Mellor, J. W. (1939). Mellor’s Modern Inorganic Chemistry (6th ed.). London: Longmans, Green and Co.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 793. ISBN 978-0-08-037941-8.
- ^ DeTurck, Dennis; Gladney, Larry; Pietrovito, Anthony (1997). «Do We Take Atoms for Granted?». The Interactive Textbook of PFP96. University of Pennsylvania. Archived from the original on January 17, 2008. Retrieved January 28, 2008.
- ^ Roscoe, Henry Enfield; Schorlemmer, Carl (1883). A Treatise on Chemistry. D. Appleton and Co. p. 38.
- ^ a b Daintith, John (1994). Biographical Encyclopedia of Scientists. CRC Press. p. 707. ISBN 978-0-7503-0287-6.
- ^ Papanelopoulou, Faidra (2013). «Louis Paul Cailletet: The liquefaction of oxygen and the emergence of low-temperature research». Notes and Records of the Royal Society of London. 67 (4): 355–73. doi:10.1098/rsnr.2013.0047. PMC 3826198.
- ^ a b Emsley 2001, p. 303
- ^ a b c «Oxygen». How Products are Made. The Gale Group, Inc. 2002. Archived from the original on April 3, 2019. Retrieved December 16, 2007.
- ^ «Goddard-1926». NASA. Archived from the original on November 8, 2007. Retrieved November 18, 2007.
- ^ Flecker, Oriel Joyce (1924). A school chemistry. MIT Libraries. Oxford, Clarendon press. p. 30.
- ^ Scripps Institute. «Atmospheric Oxygen Research». Archived from the original on July 25, 2017. Retrieved October 8, 2011.
- ^ a b Jack Barrett, 2002, «Atomic Structure and Periodicity», (Basic concepts in chemistry, Vol. 9 of Tutorial chemistry texts), Cambridge, UK: Royal Society of Chemistry, p. 153, ISBN 0854046577. See Google Books. Archived May 30, 2020, at the Wayback Machine accessed January 31, 2015.
- ^ «Oxygen Facts». Science Kids. February 6, 2015. Archived from the original on May 7, 2020. Retrieved November 14, 2015.
- ^ Jakubowski, Henry. «Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen». Biochemistry Online. Saint John’s University. Archived from the original on October 5, 2018. Retrieved January 28, 2008.
- ^ a b c d e Werley, Barry L., ed. (1991). ASTM Technical Professional training. Fire Hazards in Oxygen Systems. Philadelphia: ASTM International Subcommittee G-4.05.
- ^ «Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet». University of Wisconsin-Madison Chemistry Department Demonstration lab. Archived from the original on December 17, 2007. Retrieved December 15, 2007.
- ^ Krieger-Liszkay, Anja (October 13, 2004). «Singlet oxygen production in photosynthesis». Journal of Experimental Botany. 56 (411): 337–346. doi:10.1093/jxb/erh237. PMID 15310815.
- ^ Harrison, Roy M. (1990). Pollution: Causes, Effects & Control (2nd ed.). Cambridge: Royal Society of Chemistry. ISBN 978-0-85186-283-5.
- ^ Wentworth, Paul; McDunn, J. E.; Wentworth, A. D.; Takeuchi, C.; Nieva, J.; Jones, T.; Bautista, C.; Ruedi, J. M.; Gutierrez, A.; Janda, K. D.; Babior, B. M.; Eschenmoser, A.; Lerner, R. A. (December 13, 2002). «Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation». Science. 298 (5601): 2195–2219. Bibcode:2002Sci…298.2195W. doi:10.1126/science.1077642. PMID 12434011. S2CID 36537588. Archived from the original on December 12, 2020. Retrieved December 6, 2019.
- ^ Hirayama, Osamu; Nakamura, Kyoko; Hamada, Syoko; Kobayasi, Yoko (1994). «Singlet oxygen quenching ability of naturally occurring carotenoids». Lipids. 29 (2): 149–150. doi:10.1007/BF02537155. PMID 8152349. S2CID 3965039.
- ^ Chieh, Chung. «Bond Lengths and Energies». University of Waterloo. Archived from the original on December 14, 2007. Retrieved December 16, 2007.
- ^ a b c Stwertka, Albert (1998). Guide to the Elements (Revised ed.). Oxford University Press. pp. 48–49. ISBN 978-0-19-508083-4.
- ^ «Atomic oxygen erosion». Archived from the original on June 13, 2007. Retrieved August 8, 2009.
- ^ a b Cacace, Fulvio; de Petris, Giulia; Troiani, Anna (2001). «Experimental Detection of Tetraoxygen». Angewandte Chemie International Edition. 40 (21): 4062–65. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493.
- ^ a b Ball, Phillip (September 16, 2001). «New form of oxygen found». Nature News. Archived from the original on October 21, 2013. Retrieved January 9, 2008.
- ^ Lundegaard, Lars F.; Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge; et al. (2006). «Observation of anO
8 molecular lattice in the phase of solid oxygen». Nature. 443 (7108): 201–04. Bibcode:2006Natur.443..201L. doi:10.1038/nature05174. PMID 16971946. S2CID 4384225. - ^ Desgreniers, S.; Vohra, Y. K.; Ruoff, A. L. (1990). «Optical response of very high density solid oxygen to 132 GPa». J. Phys. Chem. 94 (3): 1117–22. doi:10.1021/j100366a020.
- ^ Shimizu, K.; Suhara, K.; Ikumo, M.; Eremets, M. I.; et al. (1998). «Superconductivity in oxygen». Nature. 393 (6687): 767–69. Bibcode:1998Natur.393..767S. doi:10.1038/31656. S2CID 205001394.
- ^ «Air solubility in water». The Engineering Toolbox. Archived from the original on April 4, 2019. Retrieved December 21, 2007.
- ^ Evans, David Hudson; Claiborne, James B. (2005). The Physiology of Fishes (3rd ed.). CRC Press. p. 88. ISBN 978-0-8493-2022-4.
- ^ Lide, David R. (2003). «Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements». CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton, Florida: CRC Press. ISBN 978-0-8493-0595-5.
- ^ «Overview of Cryogenic Air Separation and Liquefier Systems». Universal Industrial Gases, Inc. Archived from the original on October 21, 2018. Retrieved December 15, 2007.
- ^ a b «Liquid Oxygen Material Safety Data Sheet» (PDF). Matheson Tri Gas. Archived from the original (PDF) on February 27, 2008. Retrieved December 15, 2007.
- ^ Krupenie, Paul H. (1972). «The Spectrum of Molecular Oxygen». Journal of Physical and Chemical Reference Data. 1 (2): 423–534. Bibcode:1972JPCRD…1..423K. doi:10.1063/1.3253101. S2CID 96242703. Archived from the original on October 1, 2021. Retrieved January 11, 2020.
- ^ Guy P. Brasseur; Susan Solomon (January 15, 2006). Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Springer Science & Business Media. pp. 220–. ISBN 978-1-4020-3824-2. Archived from the original on February 2, 2017. Retrieved July 2, 2015.
- ^ Kearns, David R. (1971). «Physical and chemical properties of singlet molecular oxygen». Chemical Reviews. 71 (4): 395–427. doi:10.1021/cr60272a004.
- ^ Holman, Jack P. (2002). Heat transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559. OCLC 46959719.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of heat and mass transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282. OCLC 62532755.
- ^ a b c d «Oxygen Nuclides / Isotopes». EnvironmentalChemistry.com. Archived from the original on July 12, 2012. Retrieved December 17, 2007.
- ^ a b c Meyer, B. S. (September 19–21, 2005). Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen (PDF). Workgroup on Oxygen in the Earliest Solar System. Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. Gatlinburg, Tennessee. 9022. Archived (PDF) from the original on December 29, 2010. Retrieved January 22, 2007.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ «NUDAT 13O». Archived from the original on June 9, 2022. Retrieved July 6, 2009.
- ^ «NUDAT 14O». Archived from the original on June 7, 2022. Retrieved July 6, 2009.
- ^ «NUDAT 15O». Archived from the original on June 7, 2022. Retrieved July 6, 2009.
- ^ Croswell, Ken (1996). Alchemy of the Heavens. Anchor. ISBN 978-0-385-47214-2. Archived from the original on May 13, 2011. Retrieved December 2, 2011.
- ^ Emsley 2001, p. 297
- ^ «Oxygen». Los Alamos National Laboratory. Archived from the original on October 26, 2007. Retrieved December 16, 2007.
- ^ a b c d Emsley 2001, p. 298
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 602. ISBN 978-0-08-037941-8.
- ^ From The Chemistry and Fertility of Sea Waters by H.W. Harvey, 1955, citing C.J.J. Fox, «On the coefficients of absorption of atmospheric gases in sea water», Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey notes that according to later articles in Nature, the values appear to be about 3% too high.
- ^ a b c d e f g h Emsley 2001, p. 301
- ^ a b Emsley 2001, p. 304
- ^ Hand, Eric (March 13, 2008). «The Solar System’s first breath». Nature. 452 (7185): 259. Bibcode:2008Natur.452..259H. doi:10.1038/452259a. PMID 18354437. S2CID 789382.
- ^ Miller, J. R.; Berger, M.; Alonso, L.; Cerovic, Z.; et al. (2003). Progress on the development of an integrated canopy fluorescence model. Geoscience and Remote Sensing Symposium, 2003. IGARSS ’03. Proceedings. 2003 IEEE International. Vol. 1. pp. 601–603. CiteSeerX 10.1.1.473.9500. doi:10.1109/IGARSS.2003.1293855. ISBN 0-7803-7929-2.
- ^ Fenical, William (September 1983). «Marine Plants: A Unique and Unexplored Resource». Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). DianePublishing. p. 147. ISBN 978-1-4289-2397-3. Archived from the original on March 25, 2015. Retrieved August 23, 2020.
- ^ Walker, J. C. G. (1980). The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag.
- ^ Brown, Theodore L.; LeMay, Burslen (2003). Chemistry: The Central Science. Prentice Hall/Pearson Education. p. 958. ISBN 978-0-13-048450-5.
- ^ a b Raven 2005, 115–27
- ^ Danovaro R; Dell’anno A; Pusceddu A; Gambi C; et al. (April 2010). «The first metazoa living in permanently anoxic conditions». BMC Biology. 8 (1): 30. doi:10.1186/1741-7007-8-30. PMC 2907586. PMID 20370908.
- ^ Ward, Peter D.; Brownlee, Donald (2000). Rare Earth: Why Complex Life is Uncommon in the Universe. Copernicus Books (Springer Verlag). p. 217. ISBN 978-0-387-98701-9.
- ^ «NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago» (Press release). NASA. September 27, 2007. Archived from the original on March 13, 2008. Retrieved March 13, 2008.
- ^ Zimmer, Carl (October 3, 2013). «Earth’s Oxygen: A Mystery Easy to Take for Granted». The New York Times. Archived from the original on May 16, 2020. Retrieved October 3, 2013.
- ^ «Flow restrictor for measuring respiratory parameters». Archived from the original on May 8, 2020. Retrieved August 4, 2019.
- ^ a b
Normal Reference Range Table Archived December 25, 2011, at the Wayback Machine from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease. - ^ a b The Medical Education Division of the Brookside Associates—> ABG (Arterial Blood Gas) Archived August 12, 2017, at the Wayback Machine Retrieved on December 6, 2009
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ a b Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. (2013). «Atmospheric oxygenation three billion years ago». Nature. 501 (7468): 535–38. Bibcode:2013Natur.501..535C. doi:10.1038/nature12426. PMID 24067713. S2CID 4464710.
- ^ Iron in primeval seas rusted by bacteria Archived March 11, 2020, at the Wayback Machine, ScienceDaily, April 23, 2013
- ^ Campbell, Neil A.; Reece, Jane B. (2005). Biology (7th ed.). San Francisco: Pearson – Benjamin Cummings. pp. 522–23. ISBN 978-0-8053-7171-0.
- ^ Freeman, Scott (2005). Biological Science, 2nd. Upper Saddle River, NJ: Pearson – Prentice Hall. pp. 214, 586. ISBN 978-0-13-140941-5.
- ^ a b Berner, Robert A. (1999). «Atmospheric oxygen over Phanerozoic time». Proceedings of the National Academy of Sciences of the USA. 96 (20): 10955–57. Bibcode:1999PNAS…9610955B. doi:10.1073/pnas.96.20.10955. PMC 34224. PMID 10500106.
- ^ Butterfield, N. J. (2009). «Oxygen, animals and oceanic ventilation: An alternative view». Geobiology. 7 (1): 1–7. doi:10.1111/j.1472-4669.2009.00188.x. PMID 19200141. S2CID 31074331.
- ^ Poulsen, Christopher J.; Tabor, Clay; White, Joseph D. (2015). «Long-term climate forcing by atmospheric oxygen concentrations». Science. 348 (6240): 1238–41. Bibcode:2015Sci…348.1238P. doi:10.1126/science.1260670. PMID 26068848. S2CID 206562386. Archived from the original on July 13, 2017. Retrieved June 12, 2015.
- ^ Dole, Malcolm (1965). «The Natural History of Oxygen». The Journal of General Physiology. 49 (1): 5–27. doi:10.1085/jgp.49.1.5. PMC 2195461. PMID 5859927.
- ^ Paul Scott Anderson (January 3, 2019). «Oxygen and life: a cautionary tale». Archived from the original on January 22, 2021. Retrieved December 29, 2020.
- ^ Luger R, Barnes R (February 2015). «Extreme water loss and abiotic O2 buildup on planets throughout the habitable zones of M dwarfs». Astrobiology. 15 (2): 119–43. arXiv:1411.7412. Bibcode:2015AsBio..15..119L. doi:10.1089/ast.2014.1231. PMC 4323125. PMID 25629240.
- ^ Wordsworth, Robin; Pierrehumbert, Raymond (April 1, 2014). «Abiotic oxygen-dominated atmospheres on terrestrial habitable zone planets». The Astrophysical Journal. 785 (2): L20. arXiv:1403.2713. Bibcode:2014ApJ…785L..20W. doi:10.1088/2041-8205/785/2/L20. S2CID 17414970.
- ^ Hall, D.T.; Feldman, P.D.; et al. (1998). «The Far-Ultraviolet Oxygen Airglow of Europa and Ganymede». The Astrophysical Journal. 499 (1): 475–81. Bibcode:1998ApJ…499..475H. doi:10.1086/305604.
- ^ «Non-Cryogenic Air Separation Processes». UIG Inc. 2003. Archived from the original on October 3, 2018. Retrieved December 16, 2007.
- ^ a b Cook & Lauer 1968, p. 510
- ^ Sim MA; Dean P; Kinsella J; Black R; et al. (2008). «Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated». Anaesthesia. 63 (9): 938–40. doi:10.1111/j.1365-2044.2008.05536.x. PMID 18540928. S2CID 205248111.
- ^ Stephenson RN; Mackenzie I; Watt SJ; Ross JA (1996). «Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy». Undersea Hyperb Med. 23 (3): 185–88. PMID 8931286. Archived from the original on August 11, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Undersea and Hyperbaric Medical Society. «Indications for hyperbaric oxygen therapy». Archived from the original on September 12, 2008. Retrieved September 22, 2008.
- ^ Undersea and Hyperbaric Medical Society. «Carbon Monoxide». Archived from the original on July 25, 2008. Retrieved September 22, 2008.
- ^ Piantadosi CA (2004). «Carbon monoxide poisoning». Undersea Hyperb Med. 31 (1): 167–77. PMID 15233173. Archived from the original on February 3, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Hart GB; Strauss MB (1990). «Gas Gangrene – Clostridial Myonecrosis: A Review». J. Hyperbaric Med. 5 (2): 125–44. Archived from the original on February 3, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Zamboni WA; Riseman JA; Kucan JO (1990). «Management of Fournier’s Gangrene and the role of Hyperbaric Oxygen». J. Hyperbaric Med. 5 (3): 177–86. Archived from the original on February 3, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Undersea and Hyperbaric Medical Society. «Decompression Sickness or Illness and Arterial Gas Embolism». Archived from the original on July 5, 2008. Retrieved September 22, 2008.
- ^ Acott, C. (1999). «A brief history of diving and decompression illness». South Pacific Underwater Medicine Society Journal. 29 (2). Archived from the original on September 5, 2011. Retrieved September 22, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Longphre, JM; Denoble, PJ; Moon, RE; Vann, RD; Freiberger, JJ (2007). «First aid normobaric oxygen for the treatment of recreational diving injuries» (PDF). Undersea & Hyperbaric Medicine. 34 (1): 43–49. PMID 17393938. S2CID 3236557. Archived from the original (PDF) on October 1, 2018 – via Rubicon Research Repository.
- ^ «Emergency Oxygen for Scuba Diving Injuries». Divers Alert Network. Archived from the original on April 20, 2020. Retrieved October 1, 2018.
- ^ «Oxygen First Aid for Scuba Diving Injuries». Divers Alert Network Europe. Archived from the original on June 10, 2020. Retrieved October 1, 2018.
- ^ a b Morgenthaler GW; Fester DA; Cooley CG (1994). «As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations». Acta Astronautica. 32 (1): 39–49. Bibcode:1994AcAau..32…39M. doi:10.1016/0094-5765(94)90146-5. PMID 11541018.
- ^ Webb JT; Olson RM; Krutz RW; Dixon G; Barnicott PT (1989). «Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures». Aviat Space Environ Med. 60 (5): 415–21. doi:10.4271/881071. PMID 2730484.
- ^ a b c d Acott, C. (1999). «Oxygen toxicity: A brief history of oxygen in diving». South Pacific Underwater Medicine Society Journal. 29 (3). Archived from the original on December 25, 2010. Retrieved September 21, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Longphre, J. M.; Denoble, P. J.; Moon, R. E.; Vann, R. D.; et al. (2007). «First aid normobaric oxygen for the treatment of recreational diving injuries». Undersea Hyperb. Med. 34 (1): 43–49. PMID 17393938. Archived from the original on June 13, 2008. Retrieved September 21, 2008.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ a b Bren, Linda (November–December 2002). «Oxygen Bars: Is a Breath of Fresh Air Worth It?». FDA Consumer Magazine. U.S. Food and Drug Administration. 36 (6): 9–11. PMID 12523293. Archived from the original on October 18, 2007. Retrieved December 23, 2007.
- ^ «Ergogenic Aids». Peak Performance Online. Archived from the original on September 28, 2007. Retrieved January 4, 2008.
- ^ «George Goble’s extended home page (mirror)». Archived from the original on February 11, 2009. Retrieved March 14, 2008.
- ^ Cook & Lauer 1968, p. 508
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8., p. 28
- ^ IUPAC: Red Book. Archived July 9, 2018, at the Wayback Machine pp. 73, 320.
- ^ Maksyutenko, P.; Rizzo, T. R.; Boyarkin, O. V. (2006). «A direct measurement of the dissociation energy of water». J. Chem. Phys. 125 (18): 181101. Bibcode:2006JChPh.125r1101M. doi:10.1063/1.2387163. PMID 17115729.
- ^ Chaplin, Martin (January 4, 2008). «Water Hydrogen Bonding». Archived from the original on October 10, 2007. Retrieved January 6, 2008.
- ^ Smart, Lesley E.; Moore, Elaine A. (2005). Solid State Chemistry: An Introduction (3rd ed.). CRC Press. p. 214. ISBN 978-0-7487-7516-3.
- ^ a b Cook & Lauer 1968, p. 507
- ^ Crabtree, R. (2001). The Organometallic Chemistry of the Transition Metals (3rd ed.). John Wiley & Sons. p. 152. ISBN 978-0-471-18423-2.
- ^ Cook & Lauer 1968, p.505
- ^ Cook & Lauer 1968, p. 506
- ^ «NFPA 704 ratings and id numbers for common hazardous materials» (PDF). Riverside County Department of Environmental Health. Archived (PDF) from the original on July 11, 2019. Retrieved August 22, 2017.
- ^ Dharmeshkumar N Patel; Ashish Goel; SB Agarwal; Praveenkumar Garg; et al. (2003). «Oxygen Toxicity» (PDF). Indian Academy of Clinical Medicine. 4 (3): 234. Archived from the original (PDF) on September 22, 2015. Retrieved April 26, 2009.
- ^ Cook & Lauer 1968, p. 511
- ^ Wade, Mark (2007). «Space Suits». Encyclopedia Astronautica. Archived from the original on December 13, 2007. Retrieved December 16, 2007.
- ^ Martin, Lawrence. «The Four Most Important Equations In Clinical Practice». GlobalRPh. David McAuley. Archived from the original on September 5, 2018. Retrieved June 19, 2013.
- ^ a b Wilmshurst P (1998). «Diving and oxygen». BMJ. 317 (7164): 996–99. doi:10.1136/bmj.317.7164.996. PMC 1114047. PMID 9765173.
- ^ Donald, Kenneth (1992). Oxygen and the Diver. England: SPA in conjunction with K. Donald. ISBN 978-1-85421-176-7.
- ^ Donald K. W. (1947). «Oxygen Poisoning in Man: Part I». Br Med J. 1 (4506): 667–72. doi:10.1136/bmj.1.4506.667. PMC 2053251. PMID 20248086.
- ^ Donald K. W. (1947). «Oxygen Poisoning in Man: Part II». Br Med J. 1 (4507): 712–17. doi:10.1136/bmj.1.4507.712. PMC 2053400. PMID 20248096.
- ^ Report of Apollo 204 Review Board NASA Historical Reference Collection, NASA History Office, NASA HQ, Washington, DC
- ^ Chiles, James R. (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. New York: HarperCollins Publishers Inc. ISBN 978-0-06-662082-4.
General references
- Cook, Gerhard A.; Lauer, Carol M. (1968). «Oxygen». In Clifford A. Hampel (ed.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 499–512. LCCN 68-29938.
- Emsley, John (2001). «Oxygen». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England: Oxford University Press. pp. 297–304. ISBN 978-0-19-850340-8.
- Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). Biology of Plants (7th ed.). New York: W. H. Freeman and Company Publishers. pp. 115–27. ISBN 978-0-7167-1007-3.
External links
This audio file was created from a revision of this article dated 23 June 2008, and does not reflect subsequent edits.
- Oxygen at The Periodic Table of Videos (University of Nottingham)
- Oxidizing Agents > Oxygen
- Oxygen (O2) Properties, Uses, Applications
- Roald Hoffmann article on «The Story of O»
- WebElements.com – Oxygen
- Oxygen on In Our Time at the BBC
- Scripps Institute: Atmospheric Oxygen has been dropping for 20 years
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Кислоро́д / Oxygenium (Oxygen)(O), 8 |
||
| Атомная масса (молярная масса) |
15,9994 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[He] 2s2 2p4 |
||
| Радиус атома |
60 (48) пм |
||
| Химические свойства | |||
| Ковалентный радиус |
73 пм |
||
| Радиус иона |
132 (-2e) пм |
||
| Электроотрицательность |
3,44 (шкала Полинга) |
||
| Электродный потенциал |
0 |
||
| Степени окисления |
-2, −1, -½, -⅓, 0, ½, +1, +2 |
||
| Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
0,00142897 г/см³ |
||
| Температура плавления |
54,8 К (-218,35 °C) |
||
| Температура кипения |
90,19 К (-182,96 °C) |
||
| Теплота плавления |
0,444 кДж/моль |
||
| Теплота испарения |
3,4099 кДж/моль кДж/моль |
||
| Молярная теплоёмкость |
29,4[1] Дж/(K·моль) |
||
| Молярный объём |
14,0 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
моноклинная |
||
| Параметры решётки |
a=5,403 b=3,429 c=5,086 β=135,53 Å |
||
| Температура Дебая |
155 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) 0,027 Вт/(м·К) |
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
- 1 История открытия
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 6.1 Фториды кислорода
- 7 Применение
- 7.1 В металлургии
- 7.2 Сварка и резка металлов
- 7.3 Ракетное топливо
- 7.4 В медицине
- 7.5 В пищевой промышленности
- 7.6 В химической промышленности
- 7.7 В сельском хозяйстве
- 8 Биологическая роль кислорода
- 9 Токсические производные кислорода
- 10 Изотопы
- 11 См. также
- 12 Примечания
- 13 Ссылки
История открытия
Официально считается[2][3], что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Получение
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при τ = 100 °C):
Физические свойства
Холодная вода содержит больше растворенного O2.
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[4].
- β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[4].
- γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[4].
Ещё три фазы образуются при высоких давлениях:
- δ-О2 интервал температур 20-240 К и давление 6-8 ГПа, оранжевые кристаллы;
- ε-О4 давление от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-Оn давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- Некоторые оксиды поглощают кислород:
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
- В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- Озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
Фториды кислорода
- Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.)[5] OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон).
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Дополнительные сведения: Медицина
Медицинский кислород хранится в металлических газовых баллонах высокого давления (для сжатых или сжиженных газов) голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 ати. Объём кислорода в этом случае равен 100 × 2 = 200 литров[6].
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[7], как пропеллент и упаковочный газ.
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), аммиака в окислы азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горение.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода: от 12О до 24О. Все радиоактивные изотопы кислорода имеют малый период полураспада, а 12O распадается за 5,8·10−22 секунды.
См. также
| Кислород на Викискладе? |
- Категория:Соединения кислорода
- Жидкий кислород
- Озон
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 387. — 671 с. — 100 000 экз.
- ↑ J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- ↑ W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ 1 2 3 Inorganic Crystal Structure Database
- ↑ Margaret-Jane Crawford и Thomas M. Klapötke The trifluorooxonium cation, OF3+ (англ.) // Journal of Fluorine Chemistry. — 1999. — В. 2. — Т. 99. — С. 151-156. — DOI:10.1016/S0022-1139(99)00139-6
- ↑ Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28-33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4
- ↑ Food-Info.net : E-numbers : E948 : Oxygen.
Ссылки
- Кислород на Webelements (англ.)
- Кислород в Популярной библиотеке химических элементов
- Твердый кислород при сверхбольших давлениях: образование молекул О4
- Выяснено магнитное упорядочение оранжевого кислорода
- Магнитный коллапс в твердом кислороде
- Растворимость кислорода в воде TWT department of MPEI: Live Calculations by MAS
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
|
||||
| Внешний вид простого вещества | ||||
|---|---|---|---|---|
|
|
||||
| Свойства атома | ||||
| Название, символ, номер | Кислоро́д / Oxygenium (Oxygen)(O), 8 | |||
| Атомная масса (молярная масса) |
[15,99903; 15,99977][комм 1][1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [He] 2s2 2p4 | |||
| Радиус атома | 60 (48) пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 73 пм | |||
| Радиус иона | 132 (-2e) пм | |||
| Электроотрицательность | 3,44 (шкала Полинга) | |||
| Электродный потенциал | 0 | |||
| Степени окисления | -2, −1, -½, -⅓, 0, ½, +1, +2 | |||
| Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) |
газ: 1,42897 кг/м³ жидкость: 1,141 г/см³ |
|||
| Температура плавления | 54,8 К (-218,35 °C) | |||
| Температура кипения | 90,19 К (-182,96 °C) | |||
| Уд. теплота плавления | 0,444 кДж/моль | |||
| Уд. теплота испарения | 3,4099 кДж/моль | |||
| Молярная теплоёмкость | 29,4[2] Дж/(K·моль) | |||
| Молярный объём | 14,0 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | моноклинная | |||
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å | |||
| Температура Дебая | 155 K | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 0,027 Вт/(м·К) | |||
| Номер CAS | 7782-44-7 | |||
| Эмиссионный спектр | ||||
|
|
Кислоро́д (O от лат. Oxygenium) — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород[3]. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
- 1 История открытия
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 4.1 Перегонка жидкого воздуха
- 4.2 Разложение кислородсодержащих веществ
- 4.3 Электролиз водных растворов
- 4.4 Реакция перекисных соединений с углекислым газом
- 5 Физические свойства
- 6 Химические свойства
- 6.1 Фториды кислорода
- 7 Применение
- 7.1 В металлургии
- 7.2 Сварка и резка металлов
- 7.3 Компонент ракетного топлива
- 7.4 В медицине
- 7.5 В пищевой промышленности
- 7.6 В химической промышленности
- 7.7 В сельском хозяйстве
- 8 Биологическая роль кислорода
- 9 Токсические производные кислорода
- 10 Токсичность кислорода
- 11 Изотопы
- 12 См. также
- 13 Комментарии
- 14 Примечания
- 15 Ссылки
История открытия
Официально считается[4][5], что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород[6].
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн[7]). Однако до появления первых фотосинтезирующих архей 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня[8][9].
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими[10].
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму[11]. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время[12].
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. При этом около 60 % кислорода, производимого лесами и зелёными растениями, расходуется на процессы гниения и разложения в самих лесах и растительных зонах[13].
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[14][нет в источнике]. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере[15].
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %[6].
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад[16].
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Для соблюдения баланса объемов поглощенного углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Физические свойства
В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20-40 об/об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[17].
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[17].
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[17].
Ещё три фазы образуются при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4[18] или O8[19][20], существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространенная степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений в реакциях горения:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- Некоторые оксиды поглощают кислород:
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−
2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- Неорганические озониды содержат ион O−
3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
В этой реакции, кислород проявляет восстановительные свойства.
Фториды кислорода
- Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щелочи:
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.)[21] OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3[22][23].
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Компонент ракетного топлива
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров[24].
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[25], как пропеллент и упаковочный газ.
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горения.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом.
Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие, как синглетный кислород, пероксид водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), пероксид водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Токсичность кислорода
Длительное вдыхание чистого кислорода может иметь опасные последствия для организма. Безопасно длительно дышать при обычном давлении смесями содержащими до 60% кислорода. Дыхание 90% кислородом в течение 3 суток приводит к тахикардии, рвоте, пневмонии, судорогам. При повышении давления токсическое действие кислорода ускоряется и усиливается. Молодые люди более чувствительны к токсическому действию кислорода, чем пожилые. [26]
Изотопы
Кислород имеет три устойчивых изотопа: 16O, 17O и 18O, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16O связано с тем, что ядро атома 16O состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода с массовыми числами от 12O до 28O. Все радиоактивные изотопы кислорода имеют малый период полураспада, наиболее долгоживущий из них 15O с периодом полураспада ~120 секунд. Наиболее краткоживущий изотоп 12O имеет период полураспада 5,8·10−22 секунд.
См. также
| Кислород в Викисловаре | |
| Кислород на Викискладе |
- Категория:Соединения кислорода
- Жидкий кислород
- Озон
Комментарии
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 387. — 671 с. — 100 000 экз.
- ↑ Дикислород // Большая Энциклопедия Нефти Газа
- ↑ J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- ↑ W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ 1 2 Кнунянц И. Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 387-389. — 671 с. — 100 000 экз.
- ↑ Я. А. Угай. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — С. 432-435. — 527 с.
- ↑ Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. Atmospheric oxygenation three billion years ago (англ.). — Nature, 2013. — Iss. 501. — No. 7468. — P. 535–538. — DOI:10.1038/nature12426. — PMID 24067713.
- ↑ Campbell, Neil A.; Reece, Jane B. Biology, 7th Edition. — San Francisco: Pearson – Benjamin Cummings, 2005. — С. 522–23. — ISBN 0-8053-7171-0.
- ↑ Freeman, Scott. Biological Science, 2nd. — Upper Saddle River, NJ: Pearson – Prentice Hall, 2005. — P. 214, 586. — ISBN Biological Science, 2nd.
- ↑ Berner, Robert A. Atmospheric oxygen over Phanerozoic time. — Proceedings of the National Academy of Sciences of the USA, 1999. — DOI:10.1073/pnas.96.20.10955. — PMID 10500106.
- ↑ Butterfield, N. J. Oxygen, animals and oceanic ventilation: An alternative view (англ.). — Geobiology, 2009. — Iss. 7. — No. 1. — P. 1-7. — DOI:10.1111/j.1472-4669.2009.00188.x. — PMID 19200141.
- ↑ «Лёгкие планеты» находятся в океане
- ↑ Образование кислорода в природе и получение его в технике. © Зооинженерный факультет МСХА
- ↑ Dole, Malcolm. The Journal of General Physiology (англ.). — 1965. — Iss. 49. — No. 1. — DOI:10.1085/jgp.49.1.5. — PMID 5859927.
- ↑ ТАСС: Наука — Учёные: кислород в атмосфере Земли появился на 800 млн лет раньше, чем считалось ранее
- ↑ 1 2 3 Inorganic Crystal Structure Database
- ↑ Yu. A. Freiman, H. J. Jodl. Solid oxygen // Physics Reports. — 2004. — Т. 401, № 1–4. — С. 1–228. — DOI:10.1016/j.physrep.2004.06.002.
- ↑ Hiroshi Fujihisa, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya, and Kazumasa Honda. O8 Cluster Structure of the Epsilon Phase of Solid Oxygen // Phys. Rev. Lett.. — 2006. — Т. 97. — С. 085503. — DOI:10.1103/PhysRevLett.97.085503.
- ↑ Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers, Paul Loubeyre. Observation of an O8 molecular lattice in the ε phase of solid oxygen // Nature. — 2006. — Т. 443. — С. 201-204. — DOI:10.1038/nature05174.
- ↑ Margaret-Jane Crawford и Thomas M. Klapötke. The trifluorooxonium cation, OF3+ (англ.) // Journal of Fluorine Chemistry. — 1999. — Vol. 99, iss. 2. — P. 151-156. — DOI:10.1016/S0022-1139(99)00139-6.
- ↑ Curie P., Curie M. (1899). «Effets chimiques produits par les rayons de Becquerel». Comptes rendus de l’Académie des Sciences 129: 823-825.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28-33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4.
- ↑ Food-Info.net: E-numbers: E948 : Oxygen.
- ↑ Вредные химические вещества: Неорганические соединения элементов V-VIII групп. Справочник. — Л., 1989. — С. 150-170
Ссылки
- Кислород на Webelements (англ.)
- Кислород в Популярной библиотеке химических элементов
- Твёрдый кислород при сверхбольших давлениях: образование молекул O4
- Выяснено магнитное упорядочение оранжевого кислорода
- Магнитный коллапс в твёрдом кислороде
- Растворимость кислорода в воде TWT department of MPEI: Live Calculations by MAS
- Учёным удалось напрямую получить молекулы кислорода из углекислого газа
- Российским кислородом дышит весь мир: О проблемах сохранения леса (недоступная ссылка)
Содержание:
Кислород как химический элемент:
Кислород — самый распространенный элемент на Земле.
Дыхание, горение, многие процессы в живой и неживой природе, а также в технике протекают в присутствии кислорода как простого вещества.
Кислород, являясь самым распространенным элементом в земной коре, считается одним из самых необходимых элементов для жизнедеятельности на Земле.
Кислород был открыт в 1774 г. Дж. Пристли и независимо от него — К. Шееле, но как новое вещество его подробно охарактеризовал А. Лавуазье.
Название «кислород» предложено А. Лавуазье. По-латыни (oxygenium) оно означает «рождающий кислоты». Химическим знаком его была взята первая буква латинского названия. Порядковый номер кислорода в периодической системе — 8, а относительная атомная масса равна 15,9994
В свободном виде кислород встречается в атмосферном воздухе, а в связанном виде, т.е. в виде соединений, входит в состав воды, минералов и других веществ, составляющих горные породы, а также растительные и животные организмы. В земной коре масса кислорода составляет 47%. Объемная доля молекулярного кислорода в воздухе составляет 20,94%. В воде масса связанного кислорода составляет 89%.
Кислород как простое вещество
Получение:
В лаборатории кислород получают следующими способами.
1. Термическим разложением перманганата калия:
2. Термическим разложением бертолетовой соли в присутствии катализатора:
3. Термическим разложением нитратов щелочных металлов:
4. Электролизом воды (рис. 19):
Рис. 19. При электролизе воды образуется один объем кислорода и два объема 4
5. Пероксид водорода в присутствии катализатора оксида марганца (IV) разлагается на воду и кислород (рис. 20):
В промышленности кислород получают электролизом воды или из жидкого воздуха.
Рис. 20. Разложение 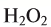
Понятие о катализаторах:
Если обратить внимание на реакцию получения кислорода посредством разложения пероксида водорода, то можно увидеть, что этот процесс осуществляется очень быстро в присутствии черного порошка — оксида марганца (IV) — 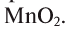
Если отделить фильтрованием порошок, находящийся на дне сосуда, и высушить его, то можно заметить, что его исходные масса и свойства не изменились. Им можно пользоваться при разложении других образцов пероксида водорода.
Вещества, участвующие в химической реакции и ускоряющие ее, но которые при этом не расходуются и не изменяются, называются катализаторами.
Процесс, протекающий в присутствии катализатора, называется катализом.
Рис. 21. Притяжение кислорода к магниту
Физические свойства:
Молекула кислорода состоит из двух атомов и как простое вещество выражается формулой 02. Относительная молекулярная масса равна 32. При обычных условиях кислород — газ без цвета, вкуса и запаха. Он немного тяжелее воздуха (1 л кислорода весит 1,43 г, а 1 л воздуха — 1,293 г). Кислород мало растворяется в воде: при 0°С в 1 л — 49 мл кислорода, при 20°С в 1л — 31 мл кислорода. Приблизительно при 1500°С кислород расщепляется на атомы. При —183°С кислород превращается в голубоватую жидкость. Жидкий кислород способен притягиваться к магниту (рис. 21).
Озон:
При пропускании через кислород или воздух электрической искры (или грозового разряда) образуется новое вещество с характерным запахом — озон. Возможность получения озона из чистого кислорода доказывает, что он является его аллотропическим видоизменением и состоит из атомов кислорода:
Озон постоянно образуется в стратосфере (слой атмосферы на высоте 23—25 км от Земли) под действием ультрафиолетовых лучей, а также в результате окисления смолистых веществ хвойных растений. Озоновый слой составляет в толщину 2—4,5 мм, он защищает Землю от губительной солнечной радиации (вредных лучей). Нарушение целостности озонового слоя чрезвычайно опасно для жизни на Земле. Поэтому ученые постоянно проводят исследования по изучению причин появления озоновых дыр и мер по их предупреждению.
Озон разъедает резину, обесцвечивает масло и бумагу, убивает бактерии. Он используется при усовершенствовании технологических процессов в промышленности, при очистке дымовых газов, промышленных и бытовых стоков, а также при дезинфекции питьевой воды.
Озон — газ голубого цвета с характерным запахом, в воде растворяется лучше, чем кислород (при 0°С в 1 л воды 490 мл).
Озон легко разлагается:
В лаборатории озон получают с помощью озонатора.
Озон отделяют от кислорода путем сильного вымораживания (озон кипит при температуре -111,9°С).
Озон ядовит. Его количество в воздухе не должно превышать 
Серебро не взаимодействует с кислородом, но при взаимодействии с озоном дает оксид.
Химические свойства кислорода:
Кислород (после фтора) — самый активный неметалл.
Кислород поддерживает горение.
Кислород соединяется почти со всеми металлами (окисляет их), кроме золота, серебра, платины и металлов группы платины:
Кислород вступает в реакцию также со всеми неметаллами, кроме галогенов (элементов VII группы главной подгруппы), образуя оксиды:
Кислород также вступает в реакцию со сложными органическими и неорганическими веществами:
Оксиды — это вещества, образующиеся в результате взаимодействия кислорода и большинства простых или сложных веществ.
В оксидах кислород двухвалентен.
Биологическое значение кислорода
Кислород считается важным биогенным элементом. Он составляет 45% сухой биомассы растений. Процесс дыхания живых организмов на Земле непосредственно связан с кислородом. Кислород также является источником озонового слоя, задерживающего опасные солнечные лучи. Роль кислорода огромна при распаде и гниении умерших организмов. Процесс фотосинтеза также нельзя представить без кислорода. Он составляет 65% тела человека.
Применение кислорода
Кислород широко применяется в медицине, при обеспечении жизнедеятельности в подводных и космических аппаратах, при осуществлении процессов дыхания, горения и гниения, для создания высоких температур в производственных процессах, в производстве химических веществ, в качестве окислителя топлива в различных агрегатах. Кислород хранится в 40-литровых голубых баллонах (вес тары 80 кг) при давлении 150-160 атм и объеме 6-7 
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате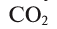
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде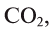
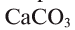
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Кислород и воздух
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси. Кислород, азот и инертные газы являются постоянными составляющими воздуха, они встречаются в любом месте почти в одинаковом количестве. Содержание же углекислого газа, паров воды и пыли изменяется в зависимости от условий.
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд. Твердые частицы воздуха (пыль) служат основой для образования дождевых капель (в состав пыли входят минеральные вещества, частицы угля, растительная пыль и различные бактерии).
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота. Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Оксиген
Это первый элемент, который вы будете подробно изучать. Из периодической системы Д. И. Менделеева можно получить такие сведения о нем:
- • символ Оксигена — О;
- • порядковый номер элемента — 8;
- • Оксиген находится во 2-м периоде, в VI группе;
- • относительная атомная масса элемента — 16 (точное значение — 15,999).
Значение порядкового номера элемента указывает на то, что атом Оксигена содержит 8 электронов, а заряд ядра атома равен +8.
Оксиген — неметаллический элемент, поскольку его простые вещества кислород 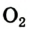
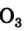
Вам известно, что Оксиген имеет постоянное значение валентности — 2. Атом этого элемента легко присоединяет 2 электрона и превращается в простой ион 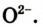
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 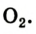
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот |  |
78,09 | 75,51 |
| Кислород |  |
20,95 | 23,15 |
| Аргон |  |
0,93 | 1,28 |
| углекислый газ |  |
0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52). Когда горение фосфора прекратится, вода займет примерно 1/5 часть объема бутылки. Этот объем занимал в воздухе кислород, который вступил в реакцию с фосфором.
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Физические свойства кислорода
В обычных условиях кислород — бесцветный газ, который не имеет запаха и вкуса. При охлаждении до -183 °С превращается в голубую жидкость, которая при температуре -219 °С затвердевает, образуя синие кристаллы. Кислород в 1,1 раза тяжелее воздуха. Он плохо растворяется в воде, но этого достаточно для существования в природных водоемах рыб, других живых существ, которые дышат растворенным кислородом.
Жидкий кислород, как и железо, притягивается к магниту.
Вывод:
Оксиген — неметаллический элемент. В природе распространено его простое вещество кислород, а также вода и другие соединения. На кислород приходится немногим более 1/5 объема воздуха.Кислород — газ без запаха и вкуса, необходимый для дыхания; он поддерживает горение.
Открытие кислорода
Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A.-JI. Лавуазье исследовал кислород и дал ему название oxygen.
Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).
Рис. 53.Обнаружение кислорода:
а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде
Получение кислорода в промышленности
Неисчерпаемым источником кислорода является воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет -196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий
Рис. 54.Получение кислорода нагреванием меркурий
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
- калий перманганат
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
Небольшое количество катализатора — манган
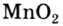
Получение кислорода разложением гидроген пероксида
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 

Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
Лабораторные методы получения кислорода
В природе кислород образуется вследствие фотосинтеза в зеленых листьях растений. Упрощенная схема этого процесса такова:
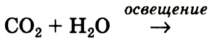
Выводы:
Кислород был открыт в конце XVIII в. несколькими учеными. Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.
Химические свойства кислорода
Химические свойства каждого вещества проявляются в химических реакциях при его участии.
Кислород — один из наиболее активных неметаллов. Но в обычных условиях он реагирует с немногими веществами. Его реакционная способность существенно возрастает с повышением температуры.
Реакции кислорода с простыми веществами
Кислород реагирует, как правило, при нагревании, с большинством неметаллов и почти со всеми металлами.
Реакция с углем (углеродом)
Известно, что уголь, нагретый на воздухе до высокой температуры, загорается. Это свидетельствует о протекании химической реакции вещества с кислородом. Теплоту, которая выделяется при этом, используют, например, для обогрева домов в сельской местности.
Основным продуктом сгорания угля является углекислый газ. Его химическая формула —
Карбон образует простые вещества — графит и алмаз. Они имеют общее название — углерод — и взаимодействуют с кислородом при нагревании согласно приведенному химическому уравнению
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)
Если ложку с горящей серой поместить в сосуд с кислородом, то сера будет гореть более ярким пламенем, чем на воздухе (рис. 56, в). Это можно объяснить тем, что молекул 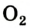
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Реакция с фосфором
Фосфор, как и сера, горит в кислороде интенсивнее, чем на воздухе (рис. 57). Продуктом реакции является белое твердое вещество — фосфор
Реакция с магнием. Раньше эту реакцию использовали фотографы для создания яркого освещения («магниевая вспышка») при фотосъемке. В химической лаборатории соответствующий опыт проводят так. Металлическим пинцетом берут магниевую ленту и поджигают на воздухе. Магний сгорает ослепительно-белым пламенем (рис. 58, б); смотреть на него нельзя! В результате реакции образуется белое твердое вещество. Это соединение Магния с Оксигеном; его название — магний оксид.
Рис. 58. Магний (а) и его горение на воздухе (б)
Реакции кислорода со сложными веществами
Кислород может взаимодействовать с некоторыми оксигенсодержащими соединениями. Например, угарный газ СО горит на воздухе с образованием углекислого газа:
Немало реакций кислорода со сложными веществами мы осуществляем в повседневной жизни, сжигая природный газ (метан), спирт, древесину, бумагу, керосин и др. При их горении образуются углекислый газ и водяной пар:
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов —
Каждый оксид имеет химическое название, а некоторые — еще и традиционные, или тривиальные
Таблица 4
Формулы и названия некоторых оксидов
| Формула | Название | |
|---|---|---|
| традиционное (тривиальное) | химическое | |
| СаО | Негашеная известь | Кальций оксид |
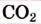 |
Углекислый газ | Карбон оксид оксид |
| СО | Угарный газ | Карбон оксид оксид |
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Горение и кислород
Рассмотренные в предыдущем параграфе реакции с участием кислорода сопровождаются одинаковыми внешними эффектами.
Химическую реакцию, во время которой выделяется теплота и появляется пламя, называют горением.
Пламя возникает вследствие свечения раскаленных частиц веществ, которые сгорают или образуются во время реакции.
Для того чтобы горючее вещество воспламенилось, необходимы такие условия:
- наличие кислорода (воздуха);
- нагревание вещества до температуры самовозгорания (для бензина она составляет 220 °С, сухой древесины — 250—300 °С, бумаги — 440 °С, угля — свыше 600 °С).
Кислород поддерживает горение веществ, но сам не горит.
Если не выполняется хотя бы одно из этих условий, то горение не происходит. Это учитывают во время работы с огнеопасными веществами, а также при тушении пожаров.
Погасить огонь можно, залив горящее вещество или предмет водой, засыпав его песком или землей, накрыв одеялом или направив на него струю углекислого газа (он не поддерживает горения и тяжелее воздуха) (рис. 63).
Рис. 63. Гашение пламени:
а — водой; б — песком; в — углекислым газом
В лабораториях, на предприятиях с этой целью используют огнетушители (рис. 64).
Рис. 64. Огнетушитель (а)и его использование (б)
Окисление и кислород
Взаимодействие веществ с кислородом не всегда сопровождается их горением. Большинство таких реакций происходят медленно, иногда — незаметно. Вещество, которое взаимодействует с кислородом, подвергается окислению, т. е. изменяется при участии кислорода.
Медленным окислением веществ обусловлено появление ржавчины на железе, прокисание молока, прогорание масла, порча многих других продуктов питания.
Реакции веществ с кислородом, которые не сопровождаются горением, используют в цветной металлургии, химической промышленности.
Кислород, поступая через легкие в организм животного или человека, окисляет различные вещества, в том числе и те, которые постоянно поступают вместе с пищей.
Выводы:
При взаимодействии некоторых веществ с кислородом происходит их горение — химическое превращение с выделением теплоты и появлением пламени.
Условиями, необходимыми для горения, являются наличие кислорода и достижение веществом определенной температуры. Для того чтобы погасить пламя, необходимо устранить хотя бы одно из этих условий.
Любую реакцию вещества с кислородом называют окислением. Многие из таких реакций происходят медленно и не сопровождаются появлением пламени.
Круговорот оксигена в природе
Каждое мгновение на Земле происходит множество физических и химических превращений. Эти изменения в природе являются циклическими, т. е. периодически повторяющимися.
Часть изменений, которые происходят с веществами на планете, обусловлена химическими реакциями.
Совокупность процессов, происходящих в природе, при которых атомы или ионы элемента в результате реакций переходят от одних веществ к другим, называют круговоротом элемента.
Если главным веществом в круговороте Оксигена выбрать кислород, то можно выделить такие звенья круговорота (схема 8):
- расходование, или связывание, кислорода (процессы дыхания, сгорания топлива и горючего, окисление различных веществ в природе, в технологических процессах);
- взаимопревращение оксигенсодержащих соединений;
- образование кислорода (процесс фотосинтеза, разложение воды в верхних слоях атмосферы). Неизменность содержания кислорода в атмосфере свидетельствует о том, что процессы связывания и выделения кислорода компенсируют друг друга.
Схема 8. Круговорот Оксигена(основные звенья)
Оксиген способствует круговороту других элементов, поскольку образует с ними многочисленные соединения.
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки). Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.
Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
Рис. 66. Баллон с кислородом
Во время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 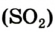
Биологическая роль кислорода
Кислород необходим живым существам для дыхания. Попадая через легкие в организм, этот газ соединяется с гемоглобином (компонент крови) и поступает во все органы и ткани. При участии кислорода происходят различные реакции. Некоторые из них сопровождаются выделением теплоты; благодаря этому поддерживается постоянная температура тела.
Выводы:
В природе атомы Оксигена в результате химических реакций постоянно переходят от одних веществ к другим; происходит круговорот этого элемента.
Кислород широко используется в промышленности, технике, медицине, а в составе воздуха — в теплоэнергетике, автотранспорте, других областях.
Кислород необходим живым существам. Попадая в организм во время дыхания, он принимает участие во многих химических реакциях. Кислород также является продуктом фотосинтеза.
Отравление угарным газом СО происходит потому, что он реагирует с гемоглобином, и поступление кислорода в организм прекращается.
Распространение кислорода в природе и его получение
Что происходит с вами, оставаясь в закрытом помещении, без воздуха? Какие газы и сколько процентов содержится в составе воздуха, которым мы дышим?
Общая характеристика:
Распространение кислорода в природе:
Кислород был открыт в 1772 году шведским ученым Карлом Шееле. Это самый распространенный в природе элемент. Примерно 49,4% массы земной коры приходится на долю кислорода. Кислород в атмосфере земного шара (по массе 23%, по объёму 21%) и в природных водах существует в растворённом виде.
Наличие кислорода в атмосферном воздухе впервые было установлено А.Лавуазье в 1774 году. Кроме кислорода в воздухе содержится 78% по объему и 75,5% по массе азота (
Кислород в виде соединений является основной составной частью почвы, воды, горных пород, руд, минералов. Он входит в состав всех живых организмов (растений, животных и т.д.). Приблизительно 65% человеческого тела составляет элемент кислород.
В природных соединениях встречается три изотопа 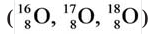
Французский химик. В 1774 году экспериментальным путем доказал состав воздуха.
Получение кислорода в лаборатории
Кислород получают в лаборатории в результате разложения воды под действием постоянного электрического тока:
В результате разложения нитрата калия. Впервые кислород был открыт К.Шееле в 1772 году в результате реакции разложения нитрата калия.
В результате разложения оксида ртути (II). В 1774 году кислород был получен английским ученым Джозефом Пристли путем нагревания оксида ртути (II) 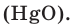
В настоящее время самыми удобными для получения кислорода в лабораторных условиях веществами являются известный в народе под названием «марганцовка» перманганат калия (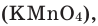
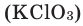
В результате разложения перманганата калия (рис. 1).
В результате разложения пероксида водорода 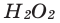
Вещества, которые ускоряют ход химических реакций, сохраняя при этом свое количество после реакции без изменения, называются катализаторами.
В результате разложения хлората калия (Бертолетова соль) при участии оксида марганца (IV) (рис. 3).
Без участия оксида марганца (IV) 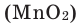
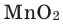
Получение кислорода в промышленности
В промышленности кислород в большом количестве получают при дистилляции сжиженного воздуха. Очистив воздух от пыли, влаги и углекислого газа, его сжижают путем сжатия под высоким давлением и охлаждения. Температуру сжиженного и охлажденного до — 200 


Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 
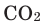
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (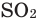
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (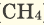
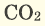
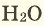
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода. Кроме того, в громадных количествах атмосферный кислород тратится при сжигании топлива, на процессы гниения, при вулканических извержениях (рис. 1).
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Кислород — химический элемент и простое вещество
В периодической системе элементов кислород О расположен во втором периоде в VIА-группе. Кроме него в эту группу входят еще три неметалла — сера S, селен Se и теллур Te, а также один металл — полоний Po.
Кислород в природе
Кислород составляет почти половину массы земной коры (49 %). Он входит в состав самых разнообразных соединений: воды, оксидов, солей и т. д. Этот элемент является неотъемлемой частью живой материи — тканей растений и животных.
Основным источником кислорода на Земле является атмосферный воздух, в котором на долю кислорода приходится около 21 % по объему. Несмотря на колоссальные масштабы потребления кислорода (процессы горения, дыхания, промышленные потребности и т. д.), содержание 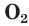
Процессы, происходящие в природе с участием кислорода, называются по-разному. Энергичное окисление с выделением тепла и света — горение, медленное окисление железа — ржавление, поглощение кислорода из воздуха живыми организмами — дыхание.
Строение атома кислорода
В атоме кислорода 8 электронов, которые располагаются на двух электронных слоях (рис. 44):
На внешнем электронном слое у атома кислорода находится 6 электронов, следовательно, до завершения этого слоя ему не хватает 2 электронов. Поэтому в своих
соединениях с металлами и водородом кислород обычно проявляет степень окисления, равную –2, как, например, в оксиде железа FeO. Кислород — второй по электроотрицательности химический элемент после фтора, поэтому только атомы фтора способны отнимать у него электроны. Положительную степень окисления +2 кислород проявляет только в соединении со фтором 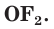
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 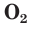
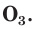
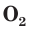
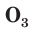
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности. Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Когда мы загораем на солнце, на нашу кожу падают «мягкие» ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 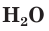
Химические свойства кислорода
Из-за высокой химической активности простое вещество кислород взаимодействует с большинством простых веществ и многими сложными веществами. Практически во всех своих реакциях кислород выступает в качестве окислителя.
Основными продуктами реакций кислорода с простыми веществами обычно являются оксиды. Окисление некоторых металлов происходит даже без нагревания, например:
Но для протекания большинства реакций кислорода с металлами требуется нагревание, иногда значительное.
При окислении кислородом неметаллов обычно выделяется большое количество теплоты, как, например, при горении углерода и водорода:
Кислород легко окисляет и многие сложные вещества. Например, известный вам из курса химии 7-го и 8-го классов оксид углерода(II) окисляется до углекислого газа:
При окислении сульфида цинка образуются два оксида — оксид цинка и оксид серы(IV):
Окисляются кислородом и органические вещества, например метан:
При этом, как правило, также образуются оксиды. Высокая окислительная способность кислорода является основой горения всех видов топлива.
С химическими свойствами озона вы познакомитесь в 11-м классе.
Применение кислорода и озона
Применение кислорода основано на его окислительных свойствах и свойстве поддерживать дыхание. Как окислитель он широко используется в металлургии, химической промышленности, других технологических процессах. Кислород применяют в качестве окислителя топлива в ракетных двигателях (рис. 47).
С участием кислорода совершается один из важнейших процессов жизнедеятельности живых организмов — дыхание. Окисление кислородом жиров, белков и углеводов служит источником энергии для живых организмов.
Озон используется для озонирования воздуха и питьевой воды, обезвреживания промышленных сточных вод, как дезинфицирующее средство в медицине, в качестве отбеливающего средства (рис. 48).
Атомы кислорода имеют на внешнем электронном слое по 6 электронов.
В соединениях с другими элементами кислород чаще всего проявляет степень окисления –2.
Известны две аллотропные модификации кислорода: кислород 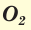
Кислород реагирует со многими простыми и сложными веществами.
Практически во всех реакциях кислород выступает в качестве окислителя.
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Место химии в системе наук
- Перспективы химического производства
- Типы химических реакций в химии
- Атом в химии
| Кислород | |
|---|---|
| Атомный номер | 8 |
| Внешний вид простого вещества |
газ без цвета, вкуса и запаха голубоватая жидкость (при низких температурах) |
| Свойства атома | |
|
Атомная масса (молярная масса) |
15,9994 а. е. м. (г/моль) |
| Радиус атома | 60 (48) пм |
|
Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p4 |
| Химические свойства | |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
|
Электроотрицательность (по Полингу) |
3,44 |
| Электродный потенциал | 0 |
| Степени окисления | -2, −1, 0 ,+1, +2, -½ |
| Термодинамические свойства простого вещества | |
| Плотность | 0,00142897 г/см³ |
| Молярная теплоёмкость | 29,4 Дж/(K·моль) |
| Теплопроводность | 0,027 Вт/(м·K) |
| Температура плавления | 54,8 K |
| Теплота плавления | 0,444 кДж/моль |
| Температура кипения | 90,19 K |
| Теплота испарения | 3,4099 кДж/моль кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å |
| Отношение c/a | — |
| Температура Дебая | 155 K |
| O | 8 |
| 15,9994 | |
| [He]2s22p4 | |
| Кислород |
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
История открытия
Схема атома кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO (t) → 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (l’oxygène), предложенного А. Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 %(по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Получение
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий. При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
В лабораторных условиях получают также каталитическим разложением пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно также получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑
Катализатором также выступает MnO2.
Физические свойства
Холодная вода содержит больше растворенного O2
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (темп. кипения −182,98 °C) это бледно-голубая жидкость.
Фазовая диаграмма O2
Твердый кислород (темп. плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° .
β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å .
Ещё три фазы образуются при высоких давлениях:
δ-О2 интервал температур до 300 К и давление 6-10 ГПа, оранжевые кристаллы;
ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от темно красного до чёрного, моноклинная сингония;
ζ-О2 давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
4K + O2 → 2K2O
2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 → 2NO2
Окисляет большинство органических соединений:
CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определенных условиях можно провести мягкое окисление органического соединения:
CH3CH2OH + O2 → CH3COOH + H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.
— Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 → Na2O2
— Некоторые окислы поглощают кислород:
2BaO + O2 → 2BaO2
— По принципам горения, разработанным А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
H2 + O2 → H2O2
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2 —). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:
Na2O2 + O2 → 2NaO2
Озониды содержат ион O3 — со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:
КОН(тв.) + О3 → КО3 + КОН + O2
Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
PtF6 + O2 → O2PtF6
Фториды кислорода
Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
2F2 + 2NaOH → OF2 + 2NaF + H2O
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Кислород поддерживает процессы дыхания, горения, гниения. В свободном виде элемент существует в двух аллотропных модификациях:O2 и O3 (озон).
Применение кислорода
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, в виде кислородных коктейлей, кислородных подушек и т. д.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
Биологическая роль кислорода
Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037% и 0,204% от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Имеются радиоактивные изотопы 11О, 13О, 14О (период полураспада 74 сек), 15О (Т1/2=2,1 мин), 19О (Т1/2=29,4 сек), 20О (противоречивые данные по периоду полураспада от 10 мин до 150 лет).
Дополнительная информация
Кислород, Oxygenium, O (8)
Открытие кислорода (Oxygen, франц. Oxygene, нем. Sauerstoff) ознаменовало начало современного периода развития химии. С глубокой древности было известно, что для горения необходим воздух, однако многие века процесс горения оставался непонятным. Лишь в XVII в. Майов и Бойль независимо друг от друга высказали мысль, что в воздухе содержится некоторая субстанция, которая поддерживает горение, но эта вполне рациональная гипотеза не получила тогда развития, так как представление о горении, как о процессе соединения горящего тела с некой составной частью воздуха, казалось в то время противоречащим столь очевидному акту, как то, что при горении имеет место разложение горящего тела на элементарные составные части. Именно на этой основе на рубеже XVII в. возникла теория флогистона, созданная Бехером и Шталем. С наступлением химико-аналитического периода развития химии (вторая половина XVIII в.) и возникновением «пневматической химии» — одной из главных ветвей химико-аналитического направления — горение, а также дыхание вновь привлекли к себе внимание исследователей. Открытие различных газов и установление их важной роли в химических процессах явилось одним из главных стимулов для систематических исследований процессов горения веществ, предпринятых Лавуазье. Кислород был открыт в начале 70-х годов XVIII в.
Первое сообщение об этом открытии было сделано Пристлеем на заседании Английского королевского общества в 1775 г. Пристлей, нагревая красную окись ртути большим зажигательным стеклом, получил газ, в котором свеча горела более ярко, чем в обычном воздухе, а тлеющая лучина вспыхивала. Пристлей определил некоторые свойства нового газа и назвал его дефлогистированным воздухом (daphlogisticated air). Однако двумя годами ранее Пристлея (1772) Шееле тоже получал кислород разложением окиси ртути и другими способами. Шееле назвал этот газ огненным воздухом (Feuerluft). Сообщение же о своем открытии Шееле смог сделать лишь в 1777 г.
В 1775 г. Лавуазье выступил перед Парижской академией наук с сообщением, что ему удалось получить «наиболее чистую часть воздуха, который нас окружает», и описал свойства этой части воздуха. Вначале Лавуазье называл этот «воздух» эмпирейным, жизненным (Air empireal, Air vital) основанием жизненного воздуха (Base де l’air vital). Почти одновременное открытие кислорода несколькими учеными в разных странах вызвало споры о приоритете. Особенно настойчиво признания себя первооткрывателем добивался Пристлей. По существу споры эти не окончились до сих пор. Подробное изучение свойств кислорода и его роли в процессах горения и образования окислов привело Лавуазье к неправильному выводу о том, что этот газ представляет собой кислотообразующее начало. В 1779 г. Лавуазье в соответствии с этим выводом ввел для кислорода новое название — кислото образующий принцип (principe acidifiant ou principe oxygine). Фигурирующее в этом сложном названии слово oxygine Лавуазье произвел от греч.- кислота и «я произвожу».
Кислород – самый распространенный на Земле химический элемент:
земная кора содержит 47% кислорода
мировой океан состоит из кислорода на 85%
Кроме этого, кислород – основной участник обмена веществ в живых организмах – дыхания и фотосинтеза.
В таблице приведены основные сведения о кислороде.
|
Химический элемент |
Простое вещество |
|
Название «Oxygenium» произошло от двух слов, в переводе «рождающий кислоты» Химический знак – О Атомный номер – 8 Расположение в периодической системе – 2 период, VI группа Типичный неметалл (сильный окислитель) Атомная масса – 16 а. е. м. Валентность – 2 Степени окисления – –2; 0; +1; +2 |
Химическая формула – O2 Молекулярная масса – 32 а. е. м. Бесцветный газ без запаха; светло-голубая жидкость; синие кристаллы Температура кипения – –183 °С Температура плавления – –218 °С |
В жидком состоянии кислород имеет голубой цвет, поэтому на всех формулах мы его будем обозначать голубым!
Изучением кислорода занимались несколько учёных примерно в одно и то же время.
Официально первооткрывателем кислорода считается англичанин Джозеф Пристли (1774 год).
Однако установлен факт, что в свое время Леонардо да Винчи изучал химию кислорода, не подозревая тогда, что он является элементом.
Название «кислород» в русский язык ввёл Михаил Ломоносов, который также ввёл в употребление термин «кислота», который в те времена обозначал оксид – соединение элемента с кислородом.
Поэтому истинное значение названия «кислород» переводится как «рождающий оксиды». Некоторое время в России кислород называли «кислотвор».
Химический элемент кислород образует два простых вещества: кислород (O2) и озон (O3).
Эта информация доступна зарегистрированным пользователям
Кислород активно участвует в обмене веществ, именно ему обязана наша планета возникновением на ней жизни.
Атмосфера содержит 21 % кислорода.
Считается, что несколько сотен миллионов лет назад концентрация кислорода в атмосфере была почти в 2 раза выше – около 40%.
Количество кислорода в воздухе ниже 8% является угрозой для жизни человека.
В отличие от кислорода, озон даже в газообразном состоянии имеет голубой цвет, в жидком – насыщенный фиолетовый, в твёрдом – почти чёрный.
Эта информация доступна зарегистрированным пользователям
Озон (O3) образуется из кислорода при воздействии ионизирующих излучений: радиации или жестких ультрафиолетовых лучей (это свойство кислорода было открыто в 1899 году учеными Пьером и Марией Кюри).
Он образуется в атмосфере под воздействием разрядов молнии, а также при работе бытовой техники, например, лазерных принтеров.
При этом вы можете чувствовать характерный запах – это и есть запах озона.
Слово «озон» с греческого языка так и переводится: «пахну».
Озон также способен в некоторой степени задерживать ультрафиолетовые лучи. Это его свойство является одним из факторов существования жизни на Земле.
Кислород и озон являются парамагнетиками – это значит, что они притягиваются к магниту.
Это заметно при проведении опытов с жидкими кислородом и озоном.
Эта информация доступна зарегистрированным пользователям
Существует два способа получения кислорода:
- разложение химических соединений (в лаборатории чаще всего кислород получают разложением перманганата калия или пероксида водорода)
- выделение кислорода из воздуха.
Эта информация доступна зарегистрированным пользователям
Качественной реакцией на кислород является его способность зажигать тлеющую лучину.
Эта информация доступна зарегистрированным пользователям
Кислород – очень активное вещество, при нормальных условиях он взаимодействует почти со всеми простыми веществами, кроме нескольких.
В чистом кислороде горят даже на первый взгляд негорючие материалы, например, железо.
Эта информация доступна зарегистрированным пользователям
Реакции взаимодействия веществ с кислородом называются реакциями окисления.
Сложные вещества, состоящие из атомов двух химических элементов, один из которых – кислород, называются оксидами.
В этом правиле есть единственное исключение: соединения кислорода и фтора называются фторидами кислорода, поскольку окислителем («отнимающим электроны») здесь является не кислород, а химически более активный фтор.
Многие оксиды имеют собственные («тривиальные») названия.
Наиболее часто встречающиеся нам в обыденной жизни оксиды приведены в таблице.
|
Химическая формула |
Систематическое название |
Тривиальное название |
|
H2O |
Оксид водорода |
Вода |
|
H2O2 |
Пероксид водорода |
Перекись водорода |
|
CO |
Оксид углерода (II) |
Угарный газ |
|
CO2 |
Оксид углерода (IV) |
Углекислый газ |
|
N2O |
Оксид азота (I) |
Веселящий газ |
|
Al2O3 |
Оксид алюминия |
Корунд |
|
SiO2 |
Оксид кремния (IV) |
Песок |
|
SO2 |
Оксид серы (IV) |
Сернистый газ |
|
CaO |
Оксид кальция |
Негашеная известь |
Кислород также способен окислять и сложные вещества.
В абсолютном большинстве случаев подобные реакции сопровождаются выделением большого количества энергии в виде света и тепла – это реакции горения.
Надо помнить, что кислород поддерживает горение, а не горит сам.
Эта информация доступна зарегистрированным пользователям
Кислород в промышленности получают фракционной перегонкой воздуха.
Применяется он везде: от медицины для дыхания тяжелобольных до окислителя ракетного топлива.
Хранят и перевозят кислород в баллонах голубого цвета.
Эта информация доступна зарегистрированным пользователям
На схеме приведены лишь основные сферы применения кислорода, на деле их гораздо больше.
Более 60 % производимого в промышленности кислорода потребляет металлургия – он используется для выплавки металлов из руды.
Через нагретую до высокой температуры смесь руды и кокса продувают кислород, в результате чего природная руда: сульфиды и более сложные соединения металлов превращаются в оксиды, из которых извлечь чистый металл гораздо проще.
Эта информация доступна зарегистрированным пользователям
Кислородные коктейли широко используются в санаториях и домах отдыха в качестве тонизирующего средства, для повышения иммунитета.
На подводных лодках используют три различных источника кислорода: сжиженный кислород в баллонах, электролиз морской воды, из пероксида калия.
Последняя реакция особенно интересна тем, что пероксид калия реагирует с углекислым газом с выделением кислорода:
Эта информация доступна зарегистрированным пользователям
Этот способ применяется чаще остальных, потому что баллоны – это дополнительная масса, а при электролизе воды выделяется также взрывоопасный водород.
Эта информация доступна зарегистрированным пользователям



























 Газ без цвета, вкуса и запаха;
Газ без цвета, вкуса и запаха;




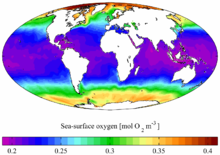
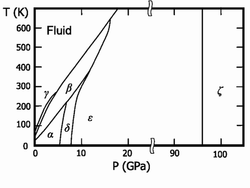











































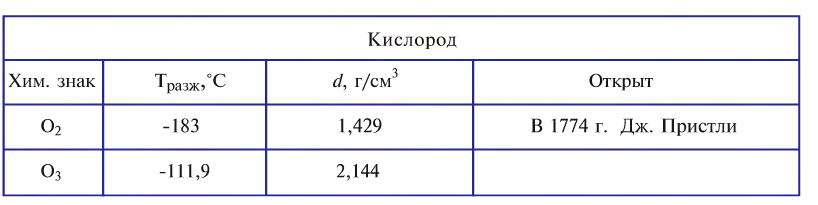
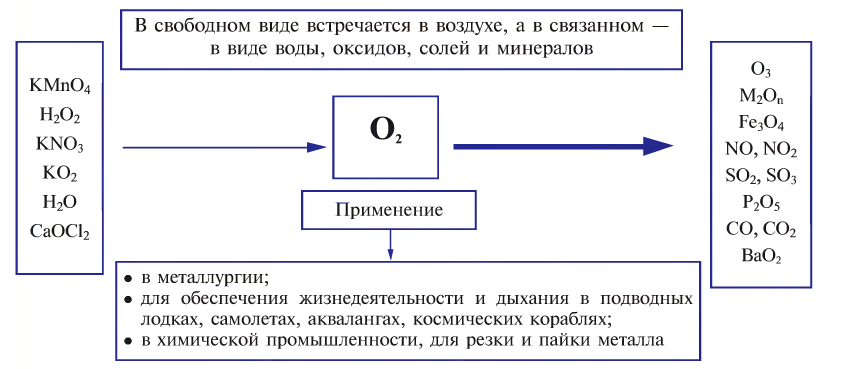
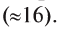
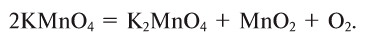
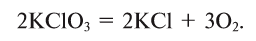
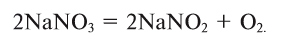
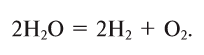

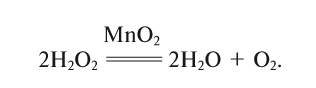
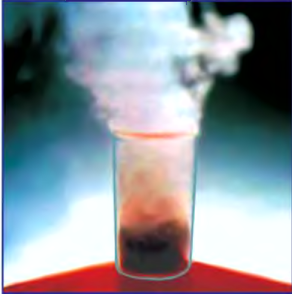
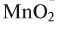

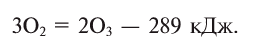
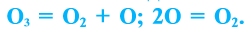
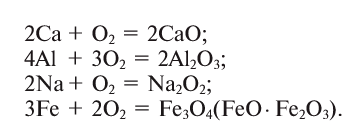
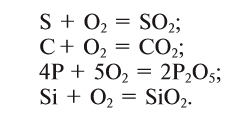
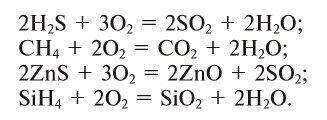

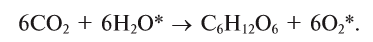
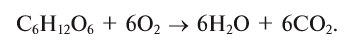


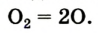
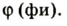
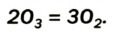
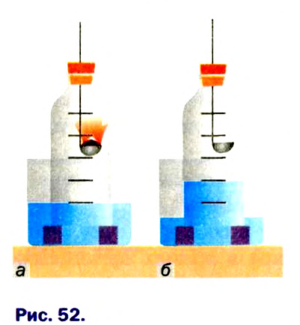

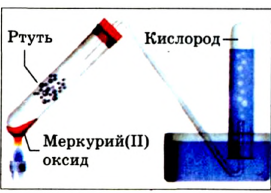
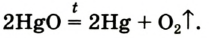
 (бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)