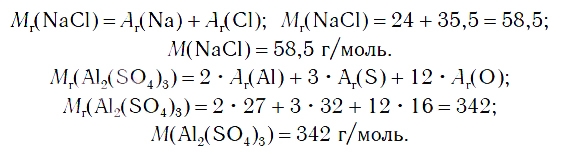В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
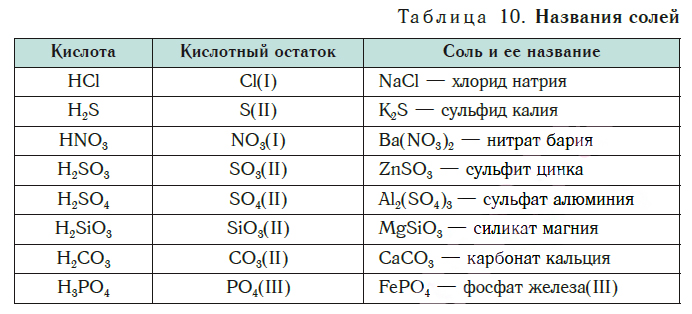
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.

Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.

Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2

Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.


Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
Соли: классификация, номенклатура, способы получения
«Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь»
А. Дистервег (немецкий педагог)
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир.
С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса –солей.
I. Понятие о солях
Такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в XVII веке. Именно в это время такие учёные, как Я. Ван Гельмонт (1580–1644), О. Тахений (1620–1699) и Г. Руэль (1703–1770), развили представление о том, что существует отдельный класс веществ — соли, которые можно рассматривать как продукт взаимодействия кислот с основаниями.
Соли — сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Составление формул солей:
II. Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля (1703–1770). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
|
Средние |
Кислые |
Основные |
Двойные |
Смешанные |
Комплексные |
|
Соли, в состав которых входят металл и кислотный остаток |
Соли, в состав которых, кроме металла и кислотного остатка, входят атомы водорода |
Соли, в состав которых, кроме металла и кислотного остатка, входят гидроксогруппы ОН |
Продукты полного замещения атомов водорода двух- или многоосновной кислоты двумя различными металлами |
||
|
Na2SO4 |
NaHSO4 |
Mg(OH)Cl |
K2NaPO4 |
Ca-OCl2 |
Na[Al(OH)4] |
III. Названия солей
- Для средней соли — название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4(валентность I).
Na2SO4— сульфат натрия,
CuSO4— сульфат меди (II)
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обратите внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
- Для основной соли –«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
Mg(OH)Cl — гидроксохлорид магния
Fe(OH)(NO3)2 — гидроксонитрат железа(III);
Fe(OH)2NO3 — дигидроксонитрат железа(III).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди(II) (CuOH)2CO3, образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Кроме принятых в науке названий, для многих солей в широком обиходе сохраняются тривиальные названия, то есть названия, которые были присвоены веществам до того, как учёные установили единую номенклатуру.
Тривиальные названия большей частью связаны либо с какими-то особыми свойствами веществ, либо с областями их применения. Многие из этих названий были присвоены солям алхимиками. В таблице приведены обобщённые сведения о наиболее часто встречающихся в литературе тривиальных названиях солей.
|
Тривиальное название соли |
Химическая формула соли |
Систематическое название соли |
| Адский камень | AgNO3 | нитрат серебра |
| Алебастр | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Берлинская лазурь | KFe[Fe(CN)6] | гексацианоферрат(II) железа(III)-калия |
| Бланфикс | BaSO4 | сульфат бария |
| Бура | Na2B4O7⋅10H2O | декагидрат тетрабората натрия |
| Бура ювелирная | Na2B4O7⋅5H2O | пентагидрат тетрабората натрия |
| Гипс | CaSO4⋅2H2O | дигидрат сульфата кальция |
| Гипс жжёный | CaSO4⋅0,5H2O | полугидрат сульфата кальция |
| Гипс строительный | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Золото сусальное | SnS2 | сульфид олова(IV) |
| Квасцы железоаммонийные | NH4Fe(SO4)2⋅12H2O | додекагидрат сульфата железа(III)-аммония |
| Купорос медный | CuSO4⋅5H2O | пентагидрат сульфата меди(II) |
| Ляпис | AgNO3 | нитрат серебра |
| Марганцовка | KMnO4 | перманганат калия |
| Мел | CaCO3 | карбонат кальция |
| Нашатырь | NH4Cl | хлорид аммония |
| Патина | (CuOH)2CO3 | гидроксокарбонат меди(II) |
| Поташ | K2CO3 | карбонат калия |
| Преципитат | CaHPO4⋅2H2O | дигидрат гидрофосфата кальция |
| Растворимое стекло | Na2SiO3⋅9H2O | нонагидрат силиката натрия |
| Свинцовый сахар | (CH3COO)2Pb⋅3H2O | тригидрат ацетата свинца(II) |
| Селитра аммиачная (аммонийная) | NH4NO3 | нитрат аммония |
| Селитра калийная (индийская) | KNO3 | нитрат калия |
| Селитра кальциевая (норвежская) | Ca(NO3)2 | нитрат кальция |
| Селитра натриевая (чилийская) | NaNO3 | нитрат натрия |
| Сода кальцинированная (стиральная) | Na2CO3 | карбонат натрия |
| Сода кристаллическая | Na2CO3⋅10H2O | декагидрат карбоната натрия |
| Сода питьевая | NaHCO3 | гидрокарбонат натрия |
| Сода пищевая | NH4HCO3 | гидрокарбонат аммония |
| Соль Мора | (NH4)2Fe(SO4)2⋅6H2O | гексагидрат сульфата железа(II)-диаммония |
| Соль английская (горькая) | MgSO4⋅7H2O | гептагидрат сульфата магния |
| Соль бертолетова | KClO3 | хлорат калия |
| Соль глауберова | Na2SO4⋅10H2O | декагидрат сульфата натрия |
| Соль жёлтая кровяная | K4[Fe(CN)6]⋅10H2O | декагидрат гексацианоферрата(II) калия |
| Соль поваренная | NaCl | хлорид натрия |
| Соль красная кровяная | K3[Fe(CN)6] | гексацианоферрат(III) калия |
| Сулема | HgCl2 | хлорид ртути |
| Суперфосфат двойной | Ca(H2PO4)2⋅H2O | моногидрат дигидрофосфата кальция |
| Суперфосфат простой | Ca(H2PO4)2⋅2CaSO4 | |
| Турнбулева синь | KFe[Fe(CN)6] | гексацианоферрат(III) железа(II)-калия |
| Хлорная известь | CaOCl2 | гипохлорит-хлорид кальция |
| Хромпик | K2Cr2O7 | дихромат калия |
| Щёлок | K2CO3 | карбонат калия |
IV. Получение
|
1. Из металлов: металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) = соль + Н2 Zn +2 HCl = ZnCl2 + H2 Металл1 + соль1 = металл2 + соль2 Видео: «Взаимодействие металлов с солями» Примечание: (металл2 стоит в ряду активности правее) Fe + CuCl2 = FeCl2 + Cu |
|
2.Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + H2O основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
|
3. Реакция нейтрализации: кислота + основание = соль + вода HCl + NaOH = NaCl + H2O |
|
4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 +AgCl↓ соль1 + щелочь = нерастворимое основание + соль 2 CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 соль1 + кислота1 = кислота2 + соль2 2NaCl + H2SO4 = 2HCl + Na2SO4 Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода. |
Это интересно
“Зеркало мира”

V. Тренажеры
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»
Проверь себя: “Соотнесите формулы солей, расположенных слева с их названиями”
VI. Задания для закрепления
Задание №1. Дайте названия следующим солям:
NaCl, KNO3, FeCl3, Li2SO4, KHSO4, BaOHCl, CaSO3, NaH2PO4, CuCl2
Задание №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задание №3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
ЦОРы
Видео: “Составление формул солей”
Видео: «Взаимодействие металлов с солями»
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- 8-11 класс: Умскул, Годограф, Знанио.
- Английский: Инглекс, Puzzle, Novakid.
- Взрослым: Skillbox, Нетология, Geekbrains, Яндекс, Otus, SkillFactory.
Соли
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Соли по своему составу похожи на кислоты, только вместо атомов водорода – ионы металлов. Поэтому их можно назвать продуктами замещения атомов водорода в кислоте на ионы металлов. Например, поваренную соль NaCl можно рассматривать как продукт замещения водорода в соляной кислоте HCl на ион натрия.
Заряд иона натрия равен 1+, а заряд иона хлора 1-. Поскольку это соединение электрически нейтрально, формула поваренной соли Na⁺Cl⁻. Если нужно вывести формулу сульфида алюминия (III), делается это следующим образом:
- Записывают заряды ионов, входящих в соединение: Al3+S2-. Заряд иона алюминия равен 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты H2S, он равен 2-.
- Находят наименьшее общее кратное значений зарядов для ионов алюминия и серы (3 и 2), оно равно 6.
- Находят индексы, разделив наименьшее общее кратное на значения зарядов, и записывают формулу:
Аналогичным образом выводят формулы солей со сложными ионами кислородсодержащих кислот. Например, выведем формулу кальциевой соли фосфорной кислоты – фосфата кальция. Используя таблицу Менделеева, определяем, что заряд иона кальция, который является элементом главной подгруппы II группы (IIA группы), равен 2+. Из формулы фосфорной кислоты H3PО4 определяем заряд иона, образованного кислотным остатком: . Отсюда получаем формулу фосфата кальция:
(читается «кальций три, пэ-о-четыре дважды»).
Легко понять, что формулы для солей выводятся по зарядам ионов точно так же, как формулы для бинарных соединений по валентности и степеням окисления составляющих элементов.
Вы уже рассмотрели, как образуются названия солей бескислородных кислот, когда знакомились с номенклатурой бинарных соединений: соли HCl называются хлоридами, а соли H2S – сульфидами.
Название солей кислородсодержащих кислот составляется из двух слов: название иона, образованного кислотным остатком, в именительном падеже и название иона металла в родительном. Названия ионов кислотных остатков образуются из корней названий элементов с суффиксами -aт для высшей степени окисления и -ит для низшей степени окисления атомов неметаллов, которые образуют сложный ион остатка кислородсодержащей кислоты.
Например, соли азотной кислоты HNO3 называются нитратами: KNO3 – нитрат калия, а соли азотистой кислоты HNO2 нитритами: Ca(NO2)2 – нитрит кальция. Если металл имеет разные степени окисления, то они записываются в скобках римской цифрой, например: Fe2+SO3 – сульфит железа (II), – сульфат железа (III).
По растворимости в воде соли делятся на растворимые (P), нерастворимые (H) и малорастворимые (M). Чтобы определить растворимость солей, используют таблицу растворимости кислот, оснований и солей в воде. Если этой таблицы нет под рукой, можно воспользоваться следующими правилами:
- Растворимы все соли азотной кислоты – нитраты.
- Растворимы все соли соляной кислоты – хлориды, кроме AgCl (H), PbCl2 (M).
- Растворимы все соли серной кислоты – сульфаты, кроме BaSO4 (H), PbSO4 (H), CaSO4 (M), Ag2SO4 (M).
- Растворимы соли натрия и калия.
- Нерастворимы все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и K+.
Рассмотрим растворимую натриевую соль бескислородной соляной кислоты – хлорид натрия NaCl – и нерастворимые кальциевые соли угольной и фосфорной кислот – карбонат кальция CaCO3 и фосфат кальция Ca3(PO4)2.
Хлорид натрия NaCl
Хлорид натрия NaCl – хорошо растворимая соль в воде, известная как поваренная соль. Без этой соли жизнь растений, животных и человека была бы невозможна, поскольку она обеспечивает основные физиологические процессы в организмах: соль в крови создаёт необходимые условия для существования кровяных телец, в мышцах она определяет способность к возбуждению, в желудке образует соляную кислоту, без которой переваривание и усвоение пищи было бы невозможным.
С древних времен известно, что соль необходима для жизни. Её важность отображается в многочисленных пословицах, поговорках, обычаях. «Хлеб да соль» – одно из пожеланий русских людей, подчёркивающее, что соль так же важна, как и хлеб. Хлеб и соль стали символами гостеприимства и сердечного радушия русского народа.
Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не долго: за год один человек съедает 3–5,5 кг соли, поэтому за два года двое съедают пуд соли (16 кг).Слово соль входит в названия многих городов и поселков, таких как Соликамск, Соль-Илецк, Усолье, Усолье-Сибирское, Солт-Лейк-Сити, Солтвиль и Зальцбург и т. д.
Соль образует толстые отложения в земной коре. Например, в Соль-Ирецке толщина слоя соли превышает 1,5 километра. Соли в озере Баскунчак в Астрахани хватит нашей стране на 400 лет. Воды морей и океанов содержат большое количество соли. С помощью соли, добытой из Мирового океана, можно покрыть всю сушу земного шара слоем в 130 метров. Во многих странах Азии и Африки соль часто добывают из соляных озёр, а в европейских странах – из соляных шахт.
Хлорид натрия широко используется в химической промышленности при производстве натрия, хлора и соляной кислоты, в медицине, в кулинарии и при консервировании пищевых продуктов (соление и квашение овощей).
Карбонат кальция CaCO3
Карбонат кальция CaCO3 – нерастворимая в воде соль, из которой многие морские животные (моллюски, раки, простейшие) строят свои покровы тела – раковины и кораллы. Остатки коралловых полипов образуют тропические острова (атоллы) и коралловые рифы. Самым известным из них является Большой Барьерный риф в Австралии. В течение миллионов лет эти раковины, отложившиеся на дне вод, после смерти своих «хозяев», образовывали толстые слои соединений кальция, из которых образовались породы, известные как известняк CaCO3.
Кроме того, мрамор и мел, полученные из карьеров и меловых гор, имеют ту же формулу. Известняк используется для производства негашёной и гашёной извести, и в строительстве. Мрамор используется для изготовления статуй и отделки станций метро.
Наземные животные используют карбонат кальция для создания своего скелета – внутренней опоры для своих мягких тканей, вес которых в десять раз превышает вес самой опоры.
Фосфат кальция Ca3(PO4)2 – нерастворимая в воде соль является основой минералов фосфоритов и апатитов. Они используются для производства фосфатных удобрений, без которых высокие урожаи в сельском хозяйстве были бы невозможны. Фосфат кальция также является компонентом костей животных.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- 8-11 класс: Умскул, Годограф, Знанио.
- Английский: Инглекс, Puzzle, Novakid.
- Взрослым: Skillbox, Нетология, Geekbrains, Яндекс, Otus, SkillFactory.