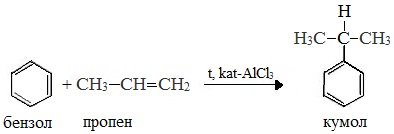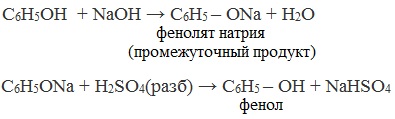1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
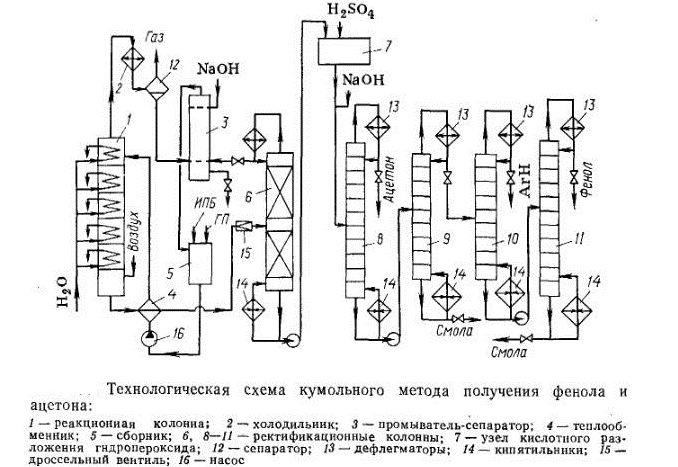
Получение фенолов
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
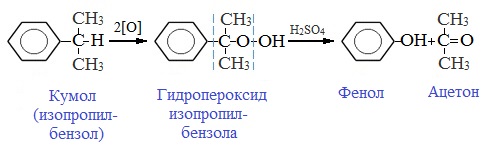
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Получение фенола в промышленности
1. Кумольный способ
(СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
1 стадия – получение кумола
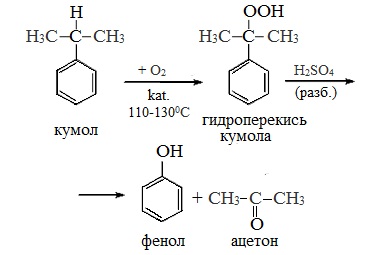
2 стадия – каталитическое окисление
2. Из каменноугольной смолы (как побочный продукт – выход небольшой)
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами
или с водяным паром
4. Сплавлением солей аренсульфокислот с твёрдыми щелочами
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд феноло
Химические свойства спиртов
Способы получения спиртов
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:
Строение фенолов
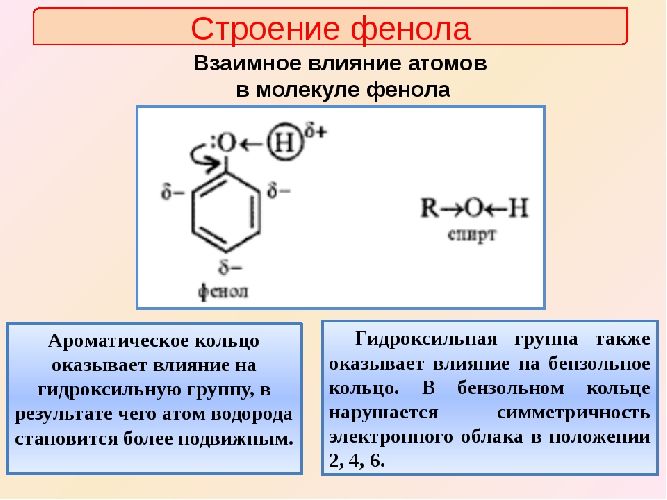
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
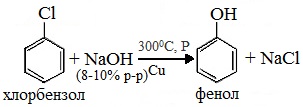
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
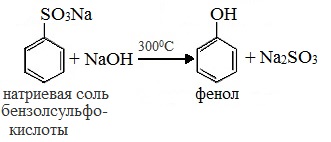
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Промышленные способы получения фенола
1. Из каменноугольной смолы.
Каменноугольная смола образуется при коксовании каменного угля и представляет собой смесь нескольких сотен органических веществ. Одним из продуктов переработки этой смеси и является фенол.
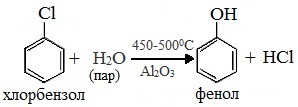
2. Из хлорбензола.
Фенол получают при действии гидроксида натрия на хлорбензол при повышенных температуре и давлении. Процесс протекает в две стадии. Сначала образуется фенолят натрия, так как получившийся фенол реагирует с гидроксидом натрия:
C6H5Cl+2NaOH⟶t,pC6H5ONa+NaCl+H2O.
Затем на фенолят действуют сильной кислотой и вытесняют фенол:
2C6H5ONa+H2SO4→2C6H5OH+Na2SO4.
3. Из кумола.
Кумольный способ получения фенола состоит из нескольких стадий. Сначала проводят реакцию бензола с пропеном и синтезируют кумол (изопропилбензол):
C6H6+CH2=CH−CH3⟶H3PO4C6H5CH(CH3)2.
Потом полученный кумол окисляют кислородом воздуха и получают из него гидропероксид изопропилбензола.
Образовавшийся гидропероксид разлагают серной кислотой. Образуются ценные продукты — фенол и ацетон.
Растворы фенола используются как бактерицидное средство для дезинфекции помещений.
Большое количество фенола расходуется для производства полимеров, из которых изготавливают пластмассы и синтетические волокна.
Из фенола получают лекарственные препараты, красители, ядохимикаты, взрывчатые вещества.
Фенол — ядовитое вещество. Опасны также его производные. Поэтому важной проблемой является предотвращение попадания фенола в окружающую среду.
Способы получения фенолов
1. Коксование
каменного угля. Основная
цель этого процесса состоит в производстве
металлургического кокса. Побочно
образуются жидкие продукты коксования
и газ. Перегонкой жидких продуктов
коксования наряду с бензолом, толуолом
и нафталином получают фенол, тиофен,
пиридин и их гомологи, а также более
сложные аналоги с конденсированными
ядрами. Доля каменноугольного фенола
по сравнению с получаемым кумольным
методом незначительна.
2. Замещение галогена в ароматических соединениях.

Замещение галогена
на гидроксильную группу протекает в
жестких условиях и известно как
«Дау»-процесс (1928 г.)
Раньше
этим способом получали фенол (из
хлорбензола), но теперь его значение
снизилось в связи с разработкой более
экономичных способов, не связанных с
затратами хлора и щелочи и образованием
большого количества сточных вод.
В
активированных галогенаренах (содержащих
наряду с галогеном нитрогруппу в о–
и п-положениях)
замещение галогена протекает в более
мягких условиях:

Это можно объяснить
электроноакцепторным влиянием
нитрогруппы, которая оттягивает на себя
электронную плотность бензольного
кольца и таким образом участвует в
стабилизации σ-комплекса:

3. Способ Рашига.
Это
видоизмененный хлорный метод: бензол
подвергается окислительному хлорированию
действием хлористого водорода и воздуха,
и затем, не выделяя образовавшийся
хлорбензол, гидролизуют его водяным
паром в присутствии солей меди. В
результате хлор вообще не расходуется,
а суммарный процесс сводится к окислению
бензола в фенол:

4. Сульфонатный
способ. Фенолы
можно получить с хорошим выходом при
сплавлении ароматических сульфокислот
Ar-SO3H
со смесью гидроксидов натрия и калия
(реакция
щелочного плавления)
при 300С
с последующей нейтрализацией образующегося
алкоголята путем добавления кислоты:

Метод эксплуатируется
в промышленности до сих пор (для получения
фенола) и используется в лабораторной
практике.
5. Кумольный
метод. Первое
крупное производство фенола кумольным
методом было осуществлено в 1949 г. в
Советском Союзе. Метод был разработан
Р.Ю. Удрисом, Б.Д. Круталовым и др.; в
настоящее время это основной метод
получения фенола и ацетона.
Метод включает
две стадии: окисление изопропилбензола
(кумола) кислородом воздуха до
гидропероксида и его кислотное разложение:
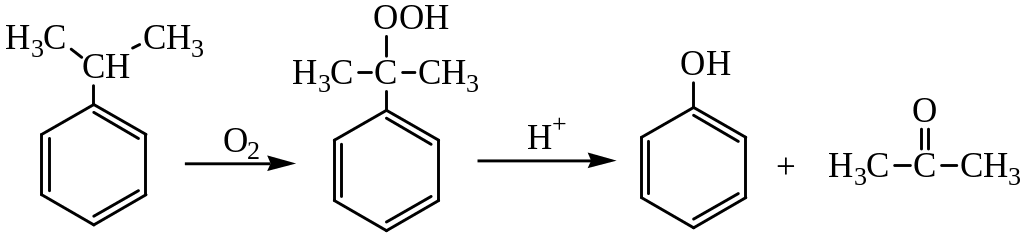
Преимуществом
данного метода является отсутствие
побочных продуктов и высокая потребность
в конечных продуктах – феноле и ацетоне.
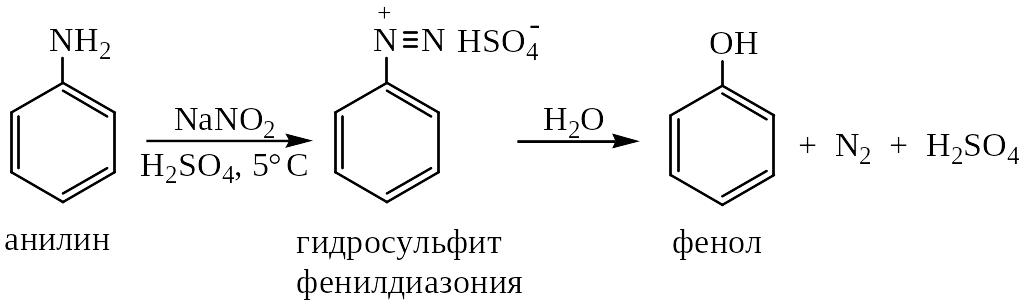
6. Из солей
диазония. Метод
заключается в нагревании солей диазония
в разбавленной серной кислоте, что
приводит к гидролизу – замене диазогруппы
на гидроксигруппу. Синтез весьма удобен
для получения гидроксиаренов в
лабораторных условиях:
Строение фенолов
Строение и
распределение электронной плотности
в молекуле фенола можно изобразить
следующей схемой:

Дипольный момент
фенола составляет 1.55 Д и направлен в
сторону бензольного кольца. Гидроксильная
группа по отношению к бензольному кольцу
проявляет –I
эффект и +М эффект. Так как мезомерный
эффект гидроксигруппы преобладает над
индукционным, сопряжение неподеленных
электронных пар атома кислорода с
-орбиталями
бензольного кольца оказывает
электронодонорное влияние на ароматическую
систему, что повышает ее реакционную
способность в реакциях электрофильного
замещения.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Получение фенола

4.4
Средняя оценка: 4.4
Всего получено оценок: 419.
4.4
Средняя оценка: 4.4
Всего получено оценок: 419.
Фенол относится к ароматическим углеводородам и образует гомологический ряд. Вещество имеет схожее строение с бензолом, но отличается наличием группы -ОН. Главный способ получения фенола – окисление кумола.
Строение и свойства
Молекула фенола содержит бензольное кольцо. Один атом водорода замещён гидроксильной группой. Молекулярная формула фенола – C6H5OH.
При замещении атомов водорода предельными углеводородными радикалами фенол образует гомологический ряд. Общая формула гомологов – CnH2n-7OH, где n – не меньше шести.
Для гомологов фенола, как и для гомологов бензола, характерна структурная изомерия по положению углеводородного радикала в бензольном кольце и по строению заместителей.
Фенолы классифицируются по количеству гидроксильных групп на четыре вида:
- аренолы (одноатомные);
- арендиолы (двухатомные);
- арентриолы (трёхатомные);
- многоатомные.
Фенол – кристаллическое бесцветное вещество. Кристаллы напоминают мелкие иголки. Соединение быстро розовеет на воздухе. Фенол токсичен: оставляет ожоги на коже.
Помимо фенолов и его гомологов, содержащих одно бензольное кольцо, существуют схожие по строению и свойствам многоядерные соединения. Нафтолы содержат два бензольных кольца, антролы – три, фенантролы – четыре, бензотетролы – пять.
Получение
Фенол получают в промышленности окислением ароматических углеводородов, а также выделением из каменноугольной смолы. Основные способы получения фенола представлены в таблице.
|
Способ |
Описание |
Уравнение |
|
Из кумола |
Безотходная технология, позволяющая получить до 99 % полезных продуктов. Сырьём являются бензол и пропилен, из которых получают кумол. Далее кумол подвергают окислению при высокой температуре в присутствии катализатора до образования гидропероксид кумола. Это вещество подвергается разложению в кислой среде (чаще используется разбавленная серная кислота). В результате образуются фенол и ацетон. Побочным продуктом является α-метилстирол (изопренилбензол) |
– С6Н6 + СН3-СН=СН2 (t, AlCl3) → C9H12; – C9H12 + О2 (кат. 110-130°С) → C6H5C(CH3)2OOH; – C6H5C(CH3)2OOH → C6H5OH + CH3-C(O)-CH3 |
|
Из толуола |
Получают примерно 6 % фенола. При окислении кислородом воздуха в присутствии катализатора образуется бензойная кислота. Полученное вещество окисляют солями меди (II) на воздухе в присутствии водяного пара |
– 2C6H5CH3 + 3O2 → 2C6H5COOH + 2H2O; – C6H5COOH → C6H5OH + CO2 |
|
Из галогенбензолов |
Например, из хлорбензола в присутствии катализатора при нагревании со щёлочью или водой образуется фенол |
– С6Н5-Сl + NaOH (300°С, Cu) → C6H5-OH + NaCl; – С6Н5-Сl + H2O (450-500°C, Al2O3) → C6H5-OH + HCl |
|
Из каменноугольной смолы |
Небольшое количество получают из обработанной щёлочью каменноугольной смолы. В результате образуются феноляты – соли фенола. Затем их обрабатывают кислотой до выделения фенола |
– C6H5OH + NaOH → C6H5-ONa + H2O; – C6H5-ONa + H2SO4 (разбав.) → C6H5-OH + NaHSO4 |
|
Из ароматических сульфокислот |
Сплавление сульфокислот с твёрдыми щелочами с образованием феноксидов, которые обрабатываются сильными кислотами |
C6H5SO3Na + NaOH (300°C) → C6H5-OH + Na2SO3 |
Фенол используется для производства других химических соединений, а также для дезинфекции.
Что мы узнали?
Фенол – бесцветное кристаллическое вещество с токсичными свойствами. Отличается от бензола гидроксильной группой. Имеет формулу C6H5OH. При присоединении углеводородных радикалов образует гомологический ряд с общей формулой CnH2n-7OH. Фенол получают в промышленности из кумола, толуола, галогенбензолов, каменноугольной смолы и ароматических сульфокислот. Кумольный способ самый производительный: можно получить до 99 % полезных веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Алексей Беляев
5/5
-
Галина Коноплёва
5/5
-
Максим Александров
4/5
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 419.
А какая ваша оценка?