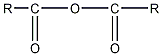1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Глутаровая кислота дает обычные производные карбоновой кислоты и, подобно янтарной кислоте, при нагревании образует циклический ангидрид [c.190]
Двухосновные кислоты с четырьмя и пятью атомами углерода в молекуле, т. е. янтарная и глутаровая кислоты, при нагревании отщепляют элементы воды и дают внутренние циклические ангидриды [c.272]
Глутаровой кислоты ангидрид И-17а Гуанидиния карбонат М-25 [c.656]
Для кислот алифатических и ароматических характерно декар-боксилирование (отщепление СОа) с образованием углеводородов. Так, из ацетата натрия при сплавлении со щелочью образуется метан, из бензоата натрия — бензол. При нагревании двухосновные кислоты ведут себя различно в зависимости от взаимного расположения карбоксильных групп малоновая кислота и ее гомологи легко отщепляют СО2, образуя соответствующую монокарбоновую кислоту. Янтарная, глутаровая кислоты и их гомологи превращаются в циклические ангидриды, при этом выделяется вода. Адипиновая и пимелиновая кислоты и их гомологи образуют циклические кетоны — циклопентаноны, циклогексаноны. [c.223]
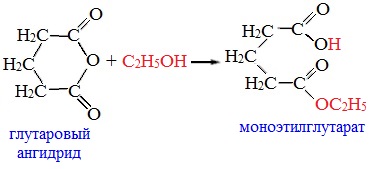
Глутаровая кислота при нагревании превращается в циклический глутаровый ангидрид, содержащий в цикле шесть атомов [c.175]
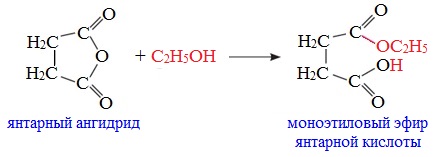
Полуэфиры дикарбоновых кислот. — Моноэфиры янтарной и глутаровой кислот легко получаются при кипячении соответствующих ангидридов с метанолом или этанолом в отсутствие катализаторов. Замещенная кислота, в которой одна карбоксильная гр>/ п-па экранирована в большей степени, чем другая, например фенил янтарная кислота I, может быть превращена в р-моноэфир 11 частичной этерификацией по Фишеру или (с лучшим выходом) метанолизом ангидрида III [c.70]
Дикарбоновые кислоты с карбоксильными группами в положениях 1,4 и 1,5 (например, янтарная и глутаровая кислоты) при нагревании свыше 200°С образуют внутренние циклические ангидриды [c.161]
Известны также перекисные инициаторы, которые могут быть использованы для получения жидких полимеров с концевыми карбоксильными группами [11, 37]. К таким инициаторам относятся перекиси янтарной или глутаровой кислот, которые могут быть получены из ангидрида янтарной кислоты или из ангидрида глутаровой кислоты путем взаимодействия с перекисью водО рода [38]. [c.424]
Гораздо легче из соответствующих дикарбоновых кислот образуются циклические ангидриды с пяти- и шестичленными кольцами. Так, например, фталевая кислота при нагревании до 180°С переходит в ангидрид. (Напишите аналогичные реакции для ма-леиновой, янтарной и глутаровой кислот. Почему нельзя перевести в ангидрид фумаровую кислоту ) [c.99]
Глутаровая кислота также образует циклический ангидрид [c.202]
Циклический ангидрид образует также глутаровая кислота. Другие дикарбоновые кислоты способны циклизоваться, образуя кетопы [c.146]
РЕАКЦИИ АНГИДРИДОВ ЗАМЕЩЕННЫХ ГЛУТАРОВЫХ КИСЛОТ [c.256]
К образованию высокополимерных соединений приводят также реакции получения ангидридов двухосновных кислот, высших, чем глутаровая кислота. Ангидрид адипиновой кислоты может быть получен и в мономерной (циклической) и в полимерной (линейной) формах двухосновные кислоты с более длинной цепью между карбоксильными группами, чем у адипиновой кислоты, образуют исключительно полимерные ангидриды. Такие полимерные ангидриды (полиангидриды) и.меют строение [c.573]
СНЗ-С0/ ангидрид глутарОвой кислоты [c.168]
Способность янтарной и глутаровой кислот давать циклические ангидриды можно легко объяснить, пользуясь тетраэдрической моделью Вант-Гоффа. При расположении атомов углерода в виде клешни (см. рис. 24, з и б на стр. 162) конечные звенья цепи из четырех, а особенно из пяти атомов будут весьма близко подходить друг к другу. Если на концах этой цепи находятся гидроксильные группы (как, например, у янтарной и глутаровой кислот), то кислород, валентные связи которого направлены под некоторым углом (см, стр. 65), легко замкнет кольцо. [c.272]
Пиромеллитовая кислота получается из меллитовой кислоты путем нагревания ее с бисульфитом калия и серной кислотой [3] действием спиртового раствора едкого кали на а,р-дибромдиэтиловый эфир глутаровой кислоты [4] из ксилолов путем ацилирования л-ксилола уксусным ангидридом в присутствии хлористого алюминия с последующим восстановлением полученного кетона, повторным ацилированием, восстановлением и окислением [5] хлорметилированием ж, -ксилолов с последующим окислением азотной кислотой и воздухом полученных хлорметилированных производных ксилолов [6] окислением дуриловой кислоты [7], октагидроантрацена [8] и дурола [9] перманганатом калия в щелочной среде дуро-ла азотной кислотой [10], кислородом воздуха над катализатором [II]. Описан и ряд других методов, но все они не имеют практического значения. [c.96]
Напишите структурные формулы следующих соединений К-соли кислого этилового эфира малоновой кислоты, полунитрила адипиновой кислоты, диамида глутаровой кислоты, ангидрида янтарной кислоты. [c.44]
Ангидрид метилянтарнои кислоты. Нитрил глутаровой кислоты (глу- [c.629]
Совершенно иначе ведут себя оба следующих члена ряда—янтарная и глутаровая кислоты. При нагревании, а также при обработке хлористым ацетилом или уксусны.м ангидридом они теряют воду, образуя пяти- или соответственно шестнчленный циклический ангидрид [c.337]
Напишите структурные формулы а) кальциевой соли пропионовой кислоты б) ангидрида изовалериановой кислоты е) пропилового эфира валериановой кислоты г) винилацетата д) акрплоинтри-ла е) а-бромкротоновой кислоты ж) хлорангидрида бензойной кислоты з) бензилового эфира бензойной кислоты и) амида глутаровой кислоты к) дибутнло-вого эфира фталевой кислоты. [c.91]
Другая схема синтеза лиоресала основана на конденсации АгСНО ацетоуксусным эфиром. Последовательно получают производные дикарбоновой (глутаровой) кислоты (26, 27), ее циклического ангидрида (28) и имида (29). Затем щелочным гидролизом имид (29) превращают в моноамид 3-арилглутаровой кислоты (30). Его обрабатывают бромом и про- [c.45]
Параллельные опыты, в которых янтарная и глутаровая кислоты в течение определенного времени при 25 °С о()рабатывались 1,1 моль уксусного ангидрида в тетрагидрофуране, после чего циклические ангидриды для выделения превращались в и-толуидидокислоты, показали, что глутаровый ангидрид образуется быстрее янтарного (Вигас и Фи-зер, неопубликованные данные). [c.65]
В циклических ангидридах любого размера кольцевой атом кислорода фикси1)аван в пространстве вследствие появления на нем частичного положительного заряда под влиянием соседних поляризованных карбонильных групп. Наблюдаемая большая скорость циклизации глутаровой кислоты по сравнению с янтарной (см. 15.20) обусловлена различием в пространственном напряжении в молекуле IV имеется два Н Н-взаимодействия (на расстоянии 2,ЗА), тогда как в молекуле V —только одно (на расстоянии 2,бА) [c.101]
Ангидрид глутаровой кислоты [70GJ. Глутаровую кислоту осторожна нагревают до 40° G с двойным количеством ацетилхлорида и после прекращен выделения НС1 перегоняют в вакууме т. кип. 150° С (10 мм рт. ст.у, т. пл. 56—57е С (из эфира). [c.359]
Многочасовым нагреванием глутаровой кислоты с двойным или тройнвд количеством SO Ia получают ангидрид с выходом 78% от теоретического [764] [c.359]
Ранее а-фенилглутаровую кислоту получали гидролизом и декарбоксилированием диэтилового эфира а-фенил-а-карбэтокси-глутаровой кислоты (образуюш,егося прн алкилировании диэтилового эфира фенилмалоновой кислоты этиловым эфиром -иодпро-пионовой кислоты) при ПОМОШ.И соляной кислоты . Ангидрид ее может быть получен из кислоты непосредственной перегонкой в вакууме однако при применении уксусного ангидрида получается более чистый препарат. [c.59]
По этому способу может быть также получена у-бензоилмас-ляная кислота. Ангидрид глутаровой кислоты (0,68 мол.) растворяют в части взятых для реакции 350 г бензола и раствор прибавляют к остальному количеству бензола, в котором предварительно суспендируют хлористый алюминий температуру при этом поддерживают в течение 1,5 часа (включая и время прибавления расг твора) ниже 15° таким путем получают 80—85% теоретического выхода 7-бензоилмасляной кислоты с т. пл. 125—126°. [c.96]
В 2-литровую круглодонную трехгорлую колбу, снабженную мешалкой и двумя холодильниками с широкой внутренней трубкой, помещают 200 мл 50%-ной азотной кислоты и 0,25 г пятиокиси ванадия. Колбу нагревают до 65—70° на водяной бане (термометр в воде) и добавляют 1 мл циклопентанона. Начало окисления заметно по образованию бурых паров. Водяную баню отнимают и из капельной воронки через холодильник добавляют 42 г (за вычетом 1 мл) циклопентанона со скоростью 1 капли в 3 сек. Благодаря теплоте реакции температура реакционной массы поддерживается при 70°. Если температура падает ниже 70°, то окисление прекращается до тех пор, пока не накопится значительное количество кетона, и тогда реакция может пойти почти с силою взрыва. В этом.случае или к случае, когда температура слишком высока, образуется большое количество янтарной кислоты. По добавлении всего количества циклопентанона вновь ставят водяную баню и смесь нагревают до кипения. Затем содержимое колбы выливают в вытяжном шкафу в фарфоровую чашку и упаривают раствор наполовину. По охлаждении глутаровую кислоту отфильтровывают и упаривание раствора повторяют еще дважды. В последней порции кислота окрашена в желтоватый цвет однако эту окраску можно уничтожить, промыв вещество разбавленной соляной кислотой. Неочищенная глутаровая кислота — белого цвета вес ее 50—55 г (80—85%) т. пл. 92—94°. Если в результате недостаточного контроля температуры образовалось некоторое количество янтарной кислоты, то она выделяется в первой порции. Удобнее собирать маточные растворы от нескольких опытов и обрабатывать их в отдельности таким путем удается получить глутаровой кислоты в каждом опыте на 2—3 г больше. Если желают получить более чистый продукт, его перекристаллизовывают из бензола. Кислота, полученная по указанной выше прописи, содержит следы азотной кислоты однако она вполне пригодна для превращения в ее ангидрид. При отсутствии катализатора получаемый выход на 10% меньше (Ч. Ф. X. Аллен и Болл, частное сообщение). [c.174]
Механизм (10.19) показывает, что карбоксилат-ион и сложноэфирная группировка должны быть соответствующим образом ориентированы в пространстве. Только в этом случае катализ будет эффективным. Когда взаимодействие между ними понижает вращательную степень свободы, скорость внутримолекулярной реакции увеличивается. Важность этого утверждения (и, следовательно, значение юонформационных эффектов во внутримолекулярных процессах) легко проследить на примере гидролиза ряда моно-п-бромфениловых эфиров дикарбоновых кислот (табл. 10.1) [16]. В то время как константы скорости гидролиза промежуточных ангидридов не зависят от строения субстратов, константы скорости образования ангидридов, напротив, очень чувствительны к структурным эффектам. Например, при переходе от моноэфира глутаровой кислоты к моноэфиру янтарной кислоты (потеря одного атома углерода и одной свободно вращающейся С—С-связи) константа скорости возрастает [c.260]
Основы неорганической химии для студентов нехимических специальностей (1989) — [
c.190
]
Органическая химия. Т.2 (1970) — [
c.65
,
c.71
]
Основания глобального анализа (1983) — [
c.0
]
Органическая химия Углубленный курс Том 2 (1966) — [
c.62
,
c.68
]
Органическая химия Издание 3 (1980) — [
c.238
]
Образование галогенангидридов и их свойства
Гидроксил карбоксильной группы может
быть замещен галогеном; при этом
образуются галогенангидриды карбоновых
кислот. Наиболее часто применяются
хлорангидриды; они образуются, например,
при действии на кислоты пятихлористого
фосфора PCl5:
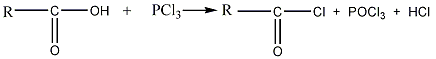
карбоновая кислота хлорангидрид
карбоновой кислоты
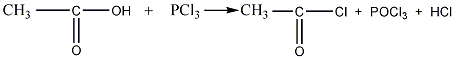
уксусная кислота хлорангидрид
уксусной кислоты
В галогенангидридах галоген соединен
с радикалом кислоты – ацилом, поэтому
их иначе называют галогенацилами или
ацилгалогенидами. В частности, хлорангидрид
уксусной кислоты называется хлористым
ацетилом или ацетилхлоридом. Он
представляет собой бесцветную дымящую
на воздухе жидкость с Ткип. 55 оС.
Галогенангидриды – очень реакционноспособные
вещества; их применяют для разнообразных
синтезов, при которых галоген обменивается
на различные группы и образуются другие
производные кислот. При действии воды
происходит гидролиз галогенангидридов
и они разлагаются, образуя карбоновую
кислоту и галогеноводород:
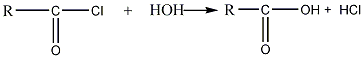
хлорангидрид кислота
С хлорангидридами низших кислот реакция
протекает уже на холоду, обычно бурно,
с выделением тепла.
Образование ангидридов и их свойства
1. При отщеплении
молекулы воды от двух молекул кислоты
образуются ангидриды карбоновых кислот.
Реакция протекает под влиянием
катализатора, над которым пропускают
пары кислот, и может быть в общем виде
представлена схемой:
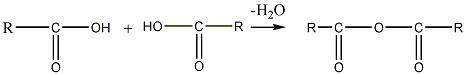
кислота кислота
ангидрид
Как видно из общей формулы (
),
ангидриды представляют собой производные
кислот, состоящие из двух соединенных
через кислород кислотных остатков
(ацилов).
2. Ангидриды получают
также действием галогенангидрида
кислоты на соль той же кислоты:
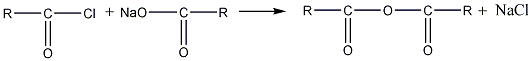
хлорангидрид соль
ангидрид
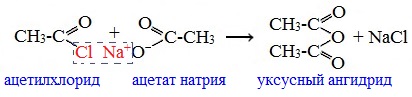
Большое практическое значение имеет
ангидрид уксусной кислоты, или уксусный
ангидрид (ацетангидрид). Он может быть
получен из хлористого ацетила и ацетата
натрия:
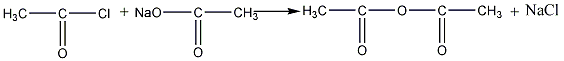
хлористый ацетил ацетат натрия
ацетангидрид
3. В настоящее время
ангидрид получают действием карбоновой
кислоты на кетен:
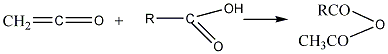
кетен карбоновая кислота
ангидрид
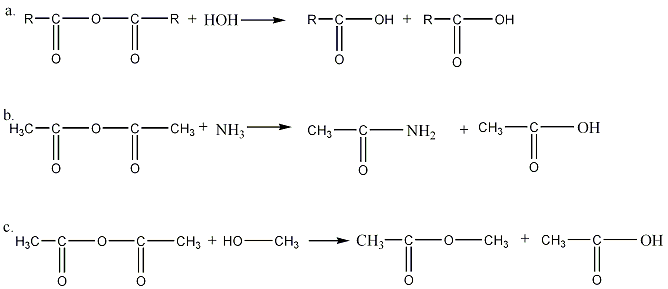
Ангидриды кислот, подобно галогенангидридам,
очень реакционноспособны; они разлагаются
соединениями с активны водородом,
образуя производное кислоты и свободную
кислоту. При действии воды ангидриды
гидролизуются на две молекулы кислоты
(а), под действием аммиака образуются
соответствующие амины (b),
воздействием спирта можно получить
соответствующий сложный эфир (c):
4. Двухосновные
кислоты с четырьмя и пятью атомами
углерода в молекуле, т. е. янтарная и
глутаровая кислоты, при нагревании
отщепляют элементы воды и дают внутренние
циклические ангидриды:
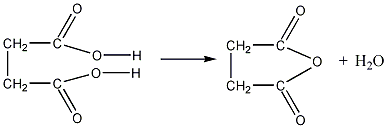
янтарная кислота ангидрид янтарной
кислоты
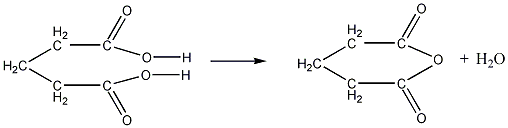
глутаровая кислота ангидрид глутаровой
кислоты
Способность янтарной и глутаровой
кислот давать циклические ангидриды
легко объяснима при рассмотрении
пространственных моделей. Так как
валентный угол в тетраэдрическом атоме
углерода равен 109°28′, то углеродная цепь
из четырех или пяти атомов может быть
изогнута в виде клешни, концы которой
близко подходят друг к другу. Если на
концах этой цепи находятся карбоксильные
группы (как, например, у янтарной и
глутаровой кислот), то при таком близком
расположении они, отщепляя молекулу
воды, замыкают цикл. В результате
образуется устойчивый пяти- или
шестичленный цикл. Циклические ангидриды
при реакции с аммиаком легко дают
циклические амиды, обладающие кислотными
свойствами:
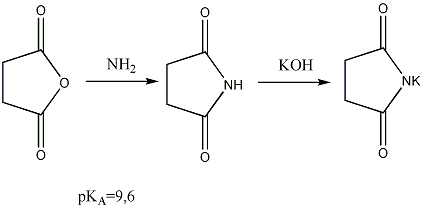
Непредельные карбоновые кислоты
Состав непредельных одноосновных кислот
с одной двойной связью можно выразить
общей формулой СnН2n-1СООН.
Как и для любых бифункциональных
соединений, для них характерны реакции
как кислот, так и олефинов. а, З-Непредельные
кислоты несколько превосходят по силе
соответствующие жирные кислоты, так
как двойная связь, находящаяся рядом с
карбоксильной группой, усиливает ее
кислотные свойства.
Акриловая кислота. В технике акриловую
кислоту получают из этиленоксида и
синильной кислоты через этиленциангидрин:
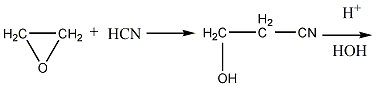
этиленоксид этиленциангидрид
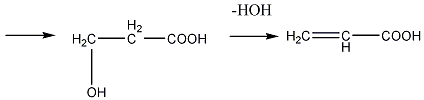
β-оксипропионовая кислота
Номенклатура:
Ангидриды называют следующим образом
– первое слово ангидрид, а второе –
название карбоновой кислоты от которой
образован ангидрид.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
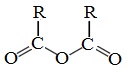
Ангидридами называют производные карбоновых кислот, у которых атом водорода карбоксильной группы замещен на ацильную группу.
Классификация. Номенклатура
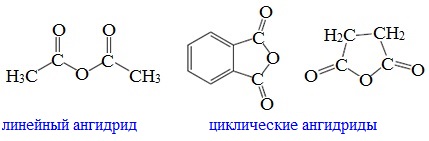
Ангидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот:
Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
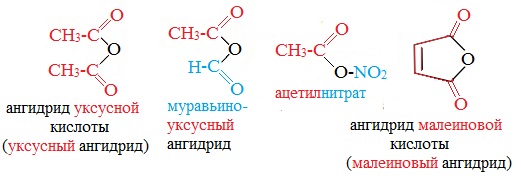
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
Способы получения
1. Дегидратация карбоновых кислот
Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3).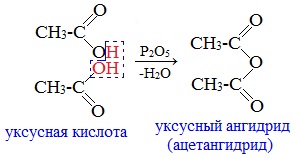
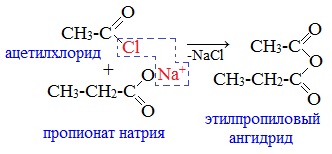
2. Взаимодействием галогенангидридов с солями карбоновых кислот
Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот:
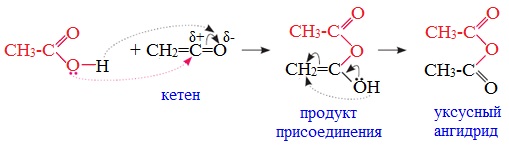
3. Взаимодействие карбоновых кислот с кетенами
Ангидриды получают при взаимодействии карбоновых кислот с кетенами:
Данный метод используется в промышленности для получения уксусного ангидрида.
Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен.
Физические свойства
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
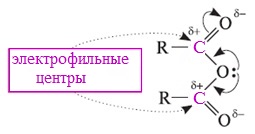
Характеристика реакционной способности
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами. Связи в молекулах ангидридов карбоновых кислот сильно поляризованы.
Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы:
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп.
Химические свойства
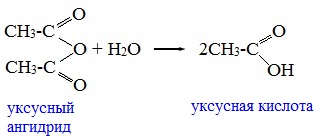
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
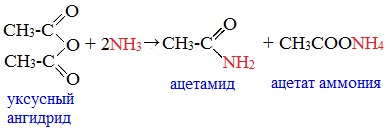
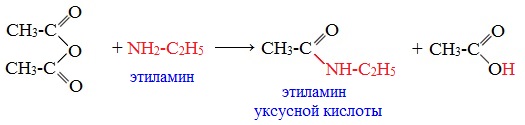
2. Взаимодействие с аммиаком (аммонолиз)
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
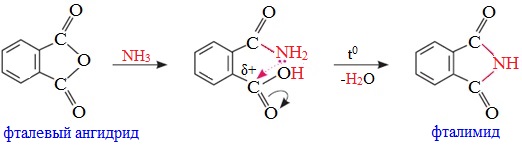
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
3. Взаимодействие со спиртами (алкоголиз)
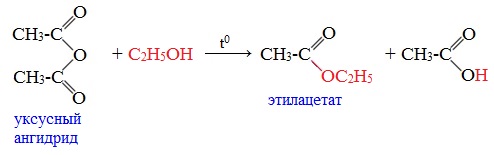
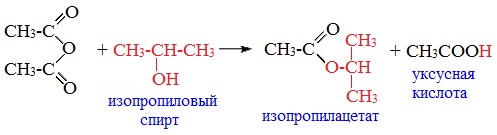
При обработке линейных ангидридов спиртами образуются сложные эфиры:
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
4. Реакции α-водородного атома
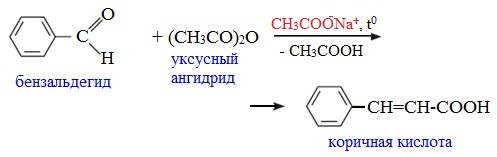
Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты.
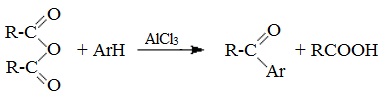
5. Образование ароматических кетонов
При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса):
Отдельные представители
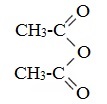
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
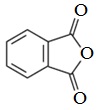
Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.
-
Реактивы
Глутаровый ангидрид
- Печать
Глутаровый ангидрид ТУ 6-09-0541-79
C5H6O3
Дигидро-2H-пиран-2,6(3H)-дион
Физико-химические свойства. C5H6O3. М.м. 114,10. Бесцветные кристаллы. Т. пл. 56,5°, т. кип. 303°. Реагирует с водой и спиртами. Растворяется в бензоле и толуоле.
Получение. Дегидратацией глутаровой кислоты.
Применение. Ацилирующий агент.
Токсическое действие. Раздражает слизистые глаз и дыхательных путей.

Содержание
- Физические свойства
- Химические свойства
- Биологическая роль
- Получение
- Применение
- Безопасность
Глутаровая кислота — двухосновная предельная карбоновая кислота.
| Глутаровая кислота | |
|---|---|
| Общие | |
| Систематическое наименование |
Глутаровая кислота, Пентандиовая кислота |
| Хим. формула | C5H8O4 |
| Рац. формула | НООС(СН2)3СООН |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 132 г/моль |
| Плотность | 1,42 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 95-98 °C |
| • кипения | 200 (при 20 мм.рт.ст) °C |
| Давление пара | 2⋅10−5 атм |
| Химические свойства | |
| Константа диссоциации кислоты |
K1 4,6⋅10−5; K2 5,34⋅10−6 |
| Растворимость | |
| • в воде | 63,9 г/100 мл |
| Классификация | |
| Рег. номер CAS | 110-94-1 |
| PubChem | 743 |
| Рег. номер EINECS | 203-817-2 |
| SMILES |
C(CC(=O)O)CC(=O)O |
| InChI |
1S/C5H8O4/c6-4(7)2-1-3-5(8)9/h1-3H2,(H,6,7)(H,8,9) JFCQEDHGNNZCLN-UHFFFAOYSA-N |
| ChEBI | 17859 |
| ChemSpider | 723 |
Физические свойства
Бесцветные кристаллы практически без запаха. Обладает достаточно высокой растворимостью в воде (63,9 г в 100 мл), по сравнению с адипиновой кислотой (~1,5 г в 100 мл). Также растворима в спирте, хлороформе, эфире и бензоле.
Химические свойства
Глутаровая кислота является двухосновной карбоновой кислотой средней силы (pKa1=4.34, pKa2=5.27).
Образует средние и кислые соли, и два ряда сложных эфиров.
Образует циклический глутаровый ангидрид при длительном нагревании. Нагревание аммониевой соли глутаровой кислоты приводит к получению циклического имида.
Биологическая роль
Кето-производное глутаровой кислоты — α-кетоглутаровая кислота (α-кетоглутарат) является важным биологическим соединением. Эта кетокислота образуется при дезаминировании глутамата, и является одним из промежуточных продуктов цикла Кребса.
Получение
В промышленности получают окислением циклопентанона азотной кислотой в присутствии оксида ванадия(V).
В лаборатории может быть получена:
- гидролизом γ-бутиролактона цианидом калия с последующим гидролизом образоващейся цианкарбоновой кислоты,;
- гидролизом динитрила глутаровой кислоты, полученного по реакции 1,3-дибромпропана с цианидом калия;
- гидролизом и последующим окислением дигидропирана азотной кислотой;
- из диэтилфумарата и формальдегида с последующим гидролизом и декарбоксилированием полупродуктов.
Применение
Используется:
- в производстве полимеров, типа полиэстера и полиамидов;
- для получения 1,5-пентандиола (широко применяемый пластификатор) гидрированием.
Безопасность
Может вызывать раздражение кожи и глаз. Давление паров (2 Па) при комнатной температуре крайне мало для нанесения вреда дыхательным путям, но глутаровая кислота может вызывать их раздражение при ингаляции аэрозоля.