Значение слова «дисбактериоз»
Дисбактерио́з (также дисбио́з) (от др.-греч. δυσ- — приставка, отрицающая положительный смысл слова или усиливающая отрицательный — и «бактерия») — представляет собой состояние микробного дисбаланса на теле или внутри него. При этом сам по себе дисбактериоз не является болезнью, но может иногда являться следствием какой-либо болезни.
Все значения слова «дисбактериоз»
Предложения со словом «дисбактериоз»
-
Затем в 70-х гг. были разработаны и внедрены в практику отечественные бифидумбактерин и лактобактерин, нашедшие широкое применение в лечении дисбактериоза кишечника.
-
А сейчас пора перейти к проявлениям и способам лечения дисбактериоза.
-
Также они замедляют образование раффинозы, которая вызывает гнилостные процессы в кишечнике и провоцирует развитие дисбактериоза.
- (все предложения)
Синонимы к слову «дисбактериоз»
- зашлакованность
- авитаминоз
- гиповитаминоз
- анемия
- стоматит
- (ещё синонимы…)
Диcбактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Дисбактериоз, или дисбиоз – это качественное и количественное изменение микрофлоры в организме. Для него характерно увеличение или резкое уменьшение бактерий, снижение их разнообразия. Дисбактериоз может возникнуть на любом участке, где присутствуют бактерии, включая кожу, влагалище, ротовую полость и т.д.
Но чаще всего под дисбактериозом подразумевают нарушение микрофлоры кишечника.
Микрофлора играет важную роль в поддержании работы иммунной системы, но существует и обратная связь – при серьезном снижении иммунитета возникает дисбактериоз.
Причины появления дисбактериоза
В кишечнике человека присутствует от 70 до 80% клеток иммунной системы. Поэтому любая нестабильность кишечной микрофлоры может нарушить естественные защитные механизмы организма, настроенные против болезней и недомоганий.
Дисбактериоз кишечника связан не только с кишечными расстройствами, но и с множеством других состояний, на первый взгляд не относящихся к пищеварению, – кожными проблемами (акне, экзема), неврологическими расстройствами и т.д.
Среди причин развития дисбактериоза отмечают:
- Увеличение числа болезнетворных бактерий и дрожжевых грибов (например, кандида) и недостаток полезных микроорганизмов.
- Проникновение микроорганизмов, в норме находящихся в толстом отделе кишечника, в тонкий кишечник. Это происходит при хронических заболеваниях, характеризующихся поражением слизистой оболочки желудочно-кишечного тракта (болезнь Крона или неспецифический язвенный колит).
- К другим факторам врачи относят генетическую предрасположенность, несбалансированное питание с низким содержанием клетчатки, но с высоким содержанием сахара и обработанных продуктов, физический и психологический стресс, чрезмерное потребление алкоголя, частое применение антибактериальных препаратов и средств от изжоги, плохую гигиену полости рта.
Классификация дисбактериоза
По причине появления:
- Дисбактериоз у практически здоровых лиц:
- возрастной дисбактериоз – изменения микрофлоры у людей пожилого возраста;
- сезонный дисбактериоз – изменения микрофлоры в холодное время года;
- нутритивный дисбактериоз – связанный с несбалансированным питанием;
- профессиональный дисбактериоз – при различных профессиональных вредностях.
- Дисбактериоз, сопровождающий различные заболевания органов пищеварения (желудка, поджелудочной железы, печени и желчевыводящих путей, кишечника, при синдроме мальабсорбции (нарушенном всасывании питательных веществ)).
- Дисбактериоз при других заболеваниях:
- инфекционных,
- иммунодефицитных,
- при гипо- и авитаминозах (уменьшенном поступлении в организм или плохой усвояемости необходимых витаминов),
- при интоксикациях и воздействии на организм человека радионуклидов (радиоактивных изотопов, которые можно встретить в местах с повышенным радиационным фоном, в ограниченном количестве и под строгим контролем они используются для диагностики и лечения некоторых заболеваний).
- Лекарственный дисбактериоз. Возникает вследствие приема антибиотиков, иммунодепрессантов, антацидов, антисекреторных, слабительных средств, химиотерапии и других лекарственных препаратов.
- Стрессорный дисбактериоз. Возникает как результат длительного эмоционального или физического стресса.
По клиническим формам:
- Бессимптомная форма дисбактериоза.
- Локальная, или местная форма дисбактериоза. Наблюдается при развитии локального воспалительного процесса в кишечнике (у больного появляются симптомы колита или энтерита – воспалительных заболеваний толстого или тонкого кишечника).
- Распространенная форма дисбактериоза. Проявляется выраженными нарушениями пищеварения.
По степени тяжести (определяется количеством и составом бактерий):
- 1-я степень тяжести;
- 2-я степень тяжести;
- 3-я степень тяжести;
- 4-я степень тяжести.
Симптомы дисбактериоза
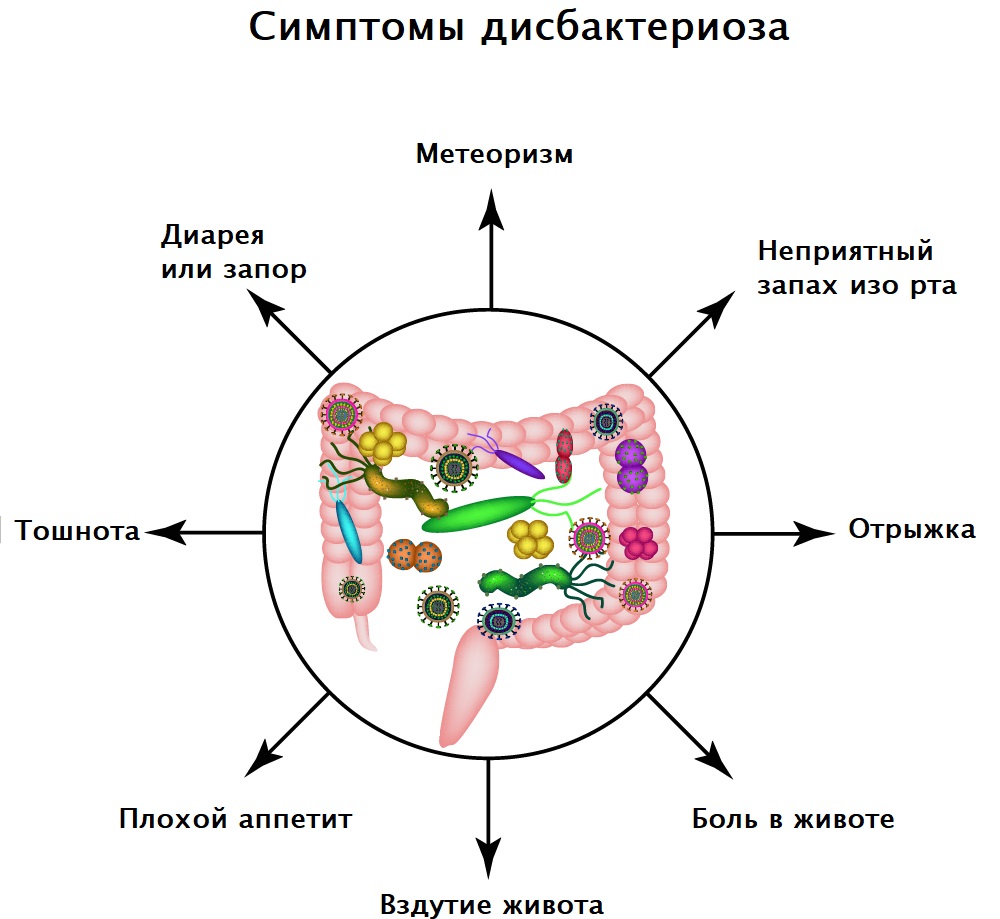
Симптомы дисбактериоза зависят от формы и степени тяжести течения заболевания. Пациенты могут предъявлять жалобы на расстройство желудка, тошноту, диарею или запор, повышенное газообразование и вздутие живота, снижение аппетита, необъяснимую усталость и проблемы с концентрацией внимания, неприятный запах изо рта, высыпания на коже.
Диагностика заболевания
При постановке диагноза врач обращает внимание на жалобы, симптомы заболевания и результаты осмотра. Но для оценки степени тяжести дисбактериоза обычно требуются лабораторные и инструментальные обследования.
- Клинический анализ крови с развернутой лейкоцитарной формулой.
- Биохимический анализ крови для оценки степени тяжести интоксикации (общий белок, белковые фракции, С-реактивный белок, АЛТ, АСТ, ЛДГ, креатинин, электролиты: калий, натрий, хлор, кальций).
Общий белок (в крови) (Protein total)
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок.
Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР.
Краткая характеристика определяемого вещества Общий бе�…
С-реактивный белок (СРБ, CRP)
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме.
Синонимы: Анализ крови на СРБ; С-реактивн�…
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определя�…
Калий, натрий, хлор в сыворотке крови (К+, Potassium, Na+, Sodium, Сl-, Chloride, Serum)
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl.
Краткая характеристика определяемых �…
Кальций общий (Ca, Calcium total)
Общий кальций – это основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функция�…
- Анализ кала на дисбактериоз.
- Копрограмма.
Копрограмма (Koprogramma, Stool)
Синонимы: Общий анализ кала. Stool analysis, Fecal analysis.
Краткая характеристика исследования «Копрограмма»
Кал – конечный продукт, образующийся в результате сло�…
- Ультразвуковое исследование органов брюшной полости.
К каким врачам обращаться
Лечением дисбактериоза кишечника занимаются врачи-гастроэнтерологи, но если дисбактериоз вызван другими заболеваниями или больного беспокоит дисбактериоз иной локализации, потребуется консультация других специалистов: врача-гинеколога, невролога, эндокринолог, дерматолога.
Лечение дисбактериоза
Терапия дисбактериоза направлена не только на излечение заболевания, но и на повышение иммунитета организма.
Первостепенное значение имеет диета, исключающая острую, жареную, копченую пищу, продукты с высоким содержанием сахара, быстрые углеводы, некоторые фрукты (яблоки, бананы, виноград), молочные продукты, но допускающая кисломолочные, поскольку они содержат пробиотики и стимулируют рост полезных микроорганизмов.
Предпочтение следует отдавать продуктам, богатым пищевыми волокнами (хлеб из муки грубого помола, крупы, кроме белого риса, овощи и зелень, сухофрукты).
Медикаментозное лечение дисбактериоза обычно включает антибактериальные синтетические средства (кишечные антисептики), бактериофаги, пробиотики, пребиотики. Антибиотики назначают в случае распространенной формы дисбактериоза, выраженной интоксикации, длительной диареи, лабораторно доказанного микробного заражения кишечника, при тяжелом иммунодефиците. Препарат, дозу, кратность и путь введения рекомендует врач.
Для купирования диареи, боли в животе, уменьшения вздутия принимают препараты симптоматической терапии.
Осложнения
Дисбактериоз негативно влияет на иммунную систему и ослабляет защитные силы организма. В результате повышается восприимчивость к инфекционным и простудным заболеваниям.
Нарушение кишечной микрофлоры ведет к проблемам с обменом веществ, обострениям эндокринологических заболеваний.
Доказана связь между психическим здоровьем и дисбактериозом. Депрессии и повышенная тревожность могут возникнуть на фоне дисбактериоза или же их течение может усугубляться.
У женщин дисбактериоз кишечника способен привести к нарушению нормальной микрофлоры влагалища, что чревато развитием бактериального вагиноза, кандидоза и других заболеваний мочеполовой системы.
Профилактика дисбактериоза
Для профилактики дисбактериоза необходимо следить за рационом питания, обязательно включать в него пищу, богатую клетчаткой и пищевыми волокнами, кисломолочные продукты.
Если по медицинским показаниям врачи назначают антибиотики, то их прием следует сопровождать пробиотиками и пребиотиками, а в ряде случаев противогрибковыми препаратами.
Источники:
- Броновец. И.Н. Дисбактериоз кишечника: диагностика, профилактика и лечение // Медицинские новости. — 2016. — №11. — С. 56-58.
- Кривущев Б.И. Дисбактериоз и пробиотики // ЗР. 2010. № 3. С. 75-78.
- Ардатская М.Д., Бельмер С.В., Добрица В.П., Захаренко С.М., Лазебник Л.Б., Минушкин О.Н., Орешко Л.С., Ситкин С.И., Ткаченко Е.И., Суворов А.Н., Хавкин А.И., Шендеров Б.А. Дисбиоз (дисбактериоз) кишечника: современное состояние проблемы. Комплексная диагностика и лечебная коррекция // ЭиКГ. 2015. № 5 (117). С. 13-43.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
2409
05 Марта
-
13066
01 Марта
-
13064
23 Февраля
Похожие статьи
Сибирская язва
Сибирская язва, или антракс: причины появления, симптомы, диагностика и способы лечения.
Лептоспироз
Лептоспироз: причины появления, симптомы, диагностика и способы лечения.
Листериоз
Листериоз: причины появления, симптомы, диагностика и способы лечения.
Демодекоз
Демодекоз: причины появления, симптомы, диагностика и способы лечения.
Дисбактериоз
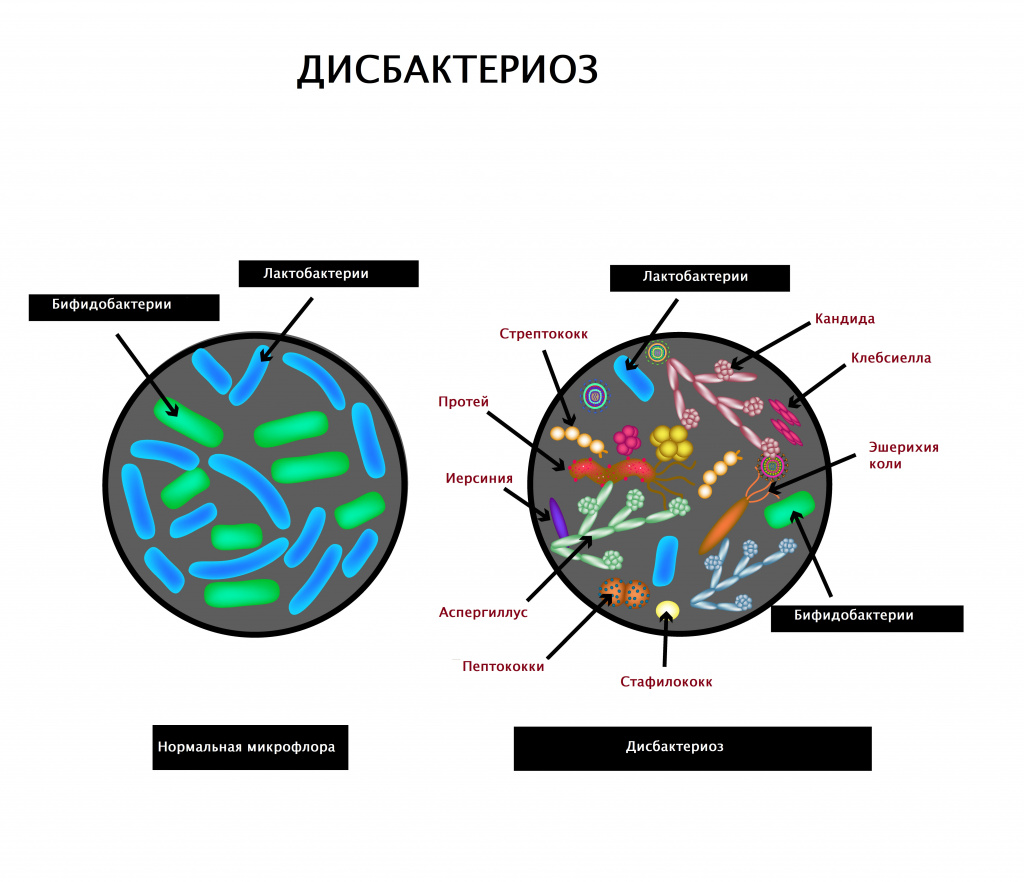
Дисбактериоз – это состояние, вызываемое нарушением микрофлоры кишечника, связанное с изменением видового состава бактерий. При дисбактериозе количество полезных бифидо и лактобактерий сокращается, а количество патогенных (болезнетворных) микроорганизмов возрастает. Патология сопутствует многим болезням органов пищеварения, длительному или неконтролируемому употреблению антибиотиков, иммунодепрессантов, воздействию вредных факторов окружающей среды. Проявляется запорами, поносами, плохим аппетитом, сном, болями в животе, кожными высыпаниями. В особо тяжелых случаях бактерии желудочно-кишечного тракта могут быть обнаружены в крови, что угрожает развитием сепсиса.
Общие сведения
Дисбактериоз (дисбиоз) кишечника – заболевание, характеризующееся патологическим изменением состава нормальной флоры кишечника, способствующее нарушению функционирования кишечника.
Причины
Дисбактериоз кишечника практически никогда не бывает первичной патологией, а развивается вследствие тех или иных нарушений работы органов или систем, либо под влиянием приема препаратов и веществ, негативно действующих на микроорганизмы.
- Ятрогенный дисбактериоз кишечника возникает вследствие приема лекарственных средств, подавляющих жизнедеятельность микроорганизмов (антибиотики, сульфаниламидные препараты, гормональные средства, цитостатики и др.). Также дисбактериоз может стать результатом оперативного вмешательства.
- Неправильное питание, недостаток в рационе необходимых компонентов, его несбалансированность, присутствие разного рода химических добавок, способствующих подавлению флоры, сбои в режиме питания, резкое изменение характера рациона.
- Психологические стрессы разного рода.
- Инфекционные заболевания кишечника.
- Другие заболевания пищеварительных органов (панкреатит, гепатит, гастрит и др.).
- Иммунные расстройства, эндокринные заболевания, нарушения обмена.
- Нарушение биоритмов, акклиматизация.
- Нарушение кишечной моторики.
Патогенез
В кишечнике взрослого человека в норме содержится порядка 2-3 кг различных микроорганизмов (около 500 видов). Это бактерии-симбиониты, принимающие непосредственное участие в акте пищеварения. В здоровом организме качественный и количественный индивидуальный состав микрофлоры пребывает в состоянии физиологического равновесия – нормобиоценоза (эубиоза). При изменениях в составе кишечной флоры разрушается это равновесие, что негативно сказывается на способности кишечника к пищеварению.
Нормальными функциями кишечника являются:
- трофическая функция – обеспечение организма питательными веществами;
- энергетическая функция – поставка АТФ, энергообесечение кишечного эпителия;
- перистальтическая функция – химическая регуляция перистальтики;
- регенеративная функция – участие в дифференциации клеток при обновлении эпителиальной выстилки кишечника;
- участие в поддержании ионного баланса;
- формирование газового состава в кишечнике;
- участие в биохимический процессах в кишечнике – деактивация ядов, активация лекарственных средств, образование биологически активных веществ, нейротрансмиттеров, сигнальных маркеров и др;
- защитная функция – участие в местном иммунитете, выработка иммуноглобулина, цитопротекция, обеспечение устойчивости эпителия к патогенным и канцерогенным факторам, захват вирусов, считывание геномов патологических микроорганизмов;
- участие в метаболизме белков, жиров, желчных кислот и многих других важнейших составляющих питания, синтез витаминов группы В, пантотеновой кислоты;
- поддержание постоянства физико-химической среды кишечника.
Симптомы дисбактериоза
- Диспепсический синдром – диарея (иногда – чередование запоров и поносов), метеоризм, вздутие живота, отрыжка и неприятный привкус во рту, урчание в кишечнике.
- У многиx (особенно у детей), страдающих кишечным дисбактериозом, возникают не характерные ранее аллергические реакций на продукты питания. Реакции могут быть как обычного аллергического характера (крапивница, кожный зуд, бронхоспазм, ангионевротический отек), так и кишечного (жидкий пенящийся стул, резкая боль в животе, тошнота вплоть до рвоты, понижение артериального давления).
- Синдром мальабсорбции – нарушение всасывания в кишечнике различных необходимых питательных веществ проявляется недостаточностью субстратов обмена – белково-энергетическая недостаточность, различные гиповитаминозы, в первую очередь, как правило, по группе витаминов В, анемия, нарушения ионного баланса, недостаточность кальция и др.
- Интоксикация организма – слабость, отсутствие аппетита, субфебрилитет, головные боли.
- Снижение иммунитета – учащение инфекционных заболеваний (ОРЗ, ОРВИ, герпес), грибковые заболевания.
Диагностика
Диагностику кишечного дисбактериоза в клинической гастроэнтерологии начинают с выявления характерных диспепсических нарушений на основании жалоб, проводят физикальный осмотр. При диагностике, как правило, симптомы дисбактериоза проявляются на фоне первичной патологии, либо таковая присутствует в анамнезе. Обязательно обращают внимание на имевшее место лечение препаратами, подавляющими микрофлору.
Наиболее специфичная методика лабораторной диагностики кишечного дисбактериоза – анализ на дисбактериоз и бакпосев кала. Дисбактериоз тонкого кишечника диагностируется с помощью бактериологического исследования соскоба или аспирата тощей кишки, но в силу трудоемкости эта методика применяется только в случаях сомнительности других диагностических критериев. Косвенные признаки дисбактериоза кишечника может продемонстрировать копрограмма, биохимия каловых масс, газо-жидкостный анализ.
Лечение дисбактериоза
Лечение осуществляется врачом-гастроэнтерологом и подразумевает терапию по нескольким направлениям – патогенетическое лечение (искоренение причины возникновения заболевания), коррекция возникшего патологического состояния пищеварения, снятие острых симптомов заболевания, укрепление защитных свойств и восстановление нормального биоценоза в кишечнике.
- Патогенетическая терапия направлена на первичную патологию, а также включает в себя меры по восстановлению моторных функций кишечника, снятие возникшего воспаления, проведение заместительной ферментной терапии.
- Больным кишечным дисбактериозом показана диета №4 (модификации в зависимости от состояния), способствующая нормализации деятельности кишечника, уменьшению активности гнилостных процессов. Питание должно быть тщательно сбалансировано по составу нутриентов и энергетической составляющей. Обязательно соблюдение баланса содержания белков, жиров, углеводов, снабжение организма витаминами и микроэлементами, достаточным количеством жидкости. Необходимо обращать внимание на режим питания, его соответствие биоритмам.
- Включение в рацион продуктов, содержащих пищевые волокна, живые бактериальные культуры.
- Коррекция состава микрофлоры с помощью селективных невсасывающихся антибактериальных препаратов (рифаксимин), кишечных антисептиков (нифуроксазид), препаратов, содержащих культуры-антагонисты патогенной кишечной флоры, бактериофаги.
- Для восстановления иммунитета применяют иммуномодуляторы (препараты эхинацеи, нуклеиновые кислоты и др.).
Восстановление нормальной микрофлоры проводят с помощью:
- пробиотиков (препаратов, содержащих живые культуры необходимых микроорганизмов);
- пребиотиков (веществ, способствующих росту и размножению полезной флоры);
- синбиотиков (комплексные препараты, содержащие как сами микроорганизмы, так и необходимые для их развития компоненты).
Прогноз и профилактика
При своевременном лечении прогноз благоприятный. Профилактика дисбактериоза кишечника для здоровых людей подразумевает правильное питание с соблюдением режима, присутствие в рационе продуктов, содержащих полезные микроорганизмы (кисломолочные продукты, вещества, содержащие бифидо- и ацидофильные бактерии, пища и напитки, на основе заквасок). Обязательна сбалансированность питания по составу необходимых организму веществ, витаминов и микроэлементов.
Для младенцев оптимальной профилактикой дисбактериоза является грудное вскармливание, формирующее нормобиоценоз и иммунитет ребенка. Грудное молоко имеет оптимальный состав пребиотиков для развития здоровой микрофлоры кишечника.
Поскольку дисбактериоз кишечника чаще всего возникает вследствие употребления лекарственных препаратов антибактериальнго действия, то в таких случаях профилактикой этого заболевания выступает рациональное назначение фармакологических средств, комплексный подход к лечению инфекций – назначение препаратов согласно проведенным антибиотикограммам, определенной степени резистентности того или иного возбудителя к антибиотикам, параллельный прием препаратов для коррекции биоценоза кишечника.
При длительном лечении антибиотиками обязательно включать в терапию специальную диету, содержащую продукты, богатые полезными бактериями, противогрибковую и иммуностимулирующую, а также антигистаминную терапию.
Дисбактериоз — лечение в Москве
Опубликовано: 25.08.2021 12:53:00 Обновлено: 31.08.2021 Просмотров: 55341

Дисбактериоз – качественное и количественное изменение микрофлоры в организме на любом его участке, включая кожные покровы, кишечник, полость рта, влагалище и другие области, населяемые микроорганизмами. Патология встречается при многих заболеваниях, длительном или неконтролируемом употреблении антибиотиков и иммунодепрессантов, развивается под влиянием вредных факторов окружающей среды.
Состояние опасно сопутствующим снижением иммунитета, нарушением барьерной функции кожи и слизистых оболочек, через которые патогенная флора проникает во внутренние органы.
Диагноз «дисбактериоз» отсутствует в международной классификации болезней и выставляется докторами исключительно Российской Федерации и стран СНГ. Дисбактериоз — это не заболевание, а синдром, функциональное расстройство, сопровождаемое нарушением баланса микрофлоры. Самая распространенная форма патологии – дисбактериоз кишечника.
Роль микробиоты в организме
Микробиота – это экосистема, внутри которой уживаются более семи тысяч видов микроорганизмов, включая бактерии, вирусы, бактериофаги, простейшие, археи и грибы. Они живут на кожных покровах, слизистых оболочках, в пищеварительном тракте и играют важную роль в поддержании иммунитета.
Кишечное сообщество находится в симбиозе с организмом хозяина и выполняет множество функций:
- участвует в пищеварении, способствуя переработке пищи и лучшему усвоению питательных веществ;
- стимулирует рост клеток кишечной стенки – энтероцитов;
- поддерживает иммунитет в активном состоянии;
- не допускает роста опасных микроорганизмов, способных вызвать воспаление и инфекционный процесс;
- контролирует метаболические процессы, энергетический и жировой обмены;
- синтезирует биологически активные вещества, участвующие в гормональной и нейрорегуляции.
При снижении количества полезных микроорганизмов, таких как бифидо- и лактобактерии, кишечная палочка и других, занимаемые ими ранее участки активно заселяют патогенные бактерии – преимущественно пептококки, грибы рода Кандида, стафилококки и клостридии.
Причины дисбиоза
Дисбактериоз никогда не возникает первично, он развивается вследствие дисфункции органов и систем либо под действием медикаментов и химических веществ, отрицательно влияющих на микроорганизмы.
Предрасполагают к нарушению микрофлоры следующие факторы:
- острый и хронический стресс;
- чрезмерная физическая нагрузка;
- неблагоприятные экологические условия, вредные производственные факторы;
- генетическая предрасположенность;
- иммунодефицитные состояния;
- беременность и гормональный дисбаланс, например, гиперандрогения у женщин;
- нарушение биоритмов, акклиматизация;
- активный прием антибиотиков, цитостатиков, сульфаниламидов, заместительная гормональная терапия;
- травмы и воспалительные заболевания, сопровождающиеся активацией иммунитета.
Одна из причин кожного дисбактериоза – чрезмерная гигиена, применение агрессивных уходовых средств, смывающих защитный водно-жировой слой с эпителия.
Микробиота кишечника страдает в следующих случаях:
- присутствие в пище разного рода химических добавок – солей натрия и сернистой кислоты, наночастиц металлов и антибиотиков;
- голодание либо резкое изменение рациона, обилие в нем животных жиров и белков, сахара, крахмала, недостаток клетчатки, витаминов и минеральных веществ;
- инфекционные процессы, глистная инвазия в кишечнике;
- снижение пищеварительной функции внутренних органов при панкреатите, гепатите, гастрите и других заболеваниях;
- нарушение моторики кишечника;
- хирургические вмешательства на органах ЖКТ.
Классификация дисбактериоза
Самой распространенной формой патологии считается кишечный дисбактериоз.
К внекишечным формам можно отнести дисбиоз:
- кожи;
- половых органов;
- мочевыделительных путей;
- ротовой полости;
- органов дыхания.
Также, в зависимости от длительности процесса и выраженности симптомов, выделяют острый и хронический дисбактериоз.
Степень тяжести определяется количеством и составом бактерий в процессе лабораторной диагностики:
- I степень — недостаток представителей нормальной микрофлоры;
- II степень — преобладание условно-патогенных микроорганизмов;
- III степень — присоединение патогенной флоры.
Кишечный дисбактериоз протекает в три стадии:
- Латентный дисбиоз. Клинические проявления патологии отсутствуют. Нарушение микрофлоры выявляется только по результатам анализов.
- Локальная или местная форма дисбиоза. Сопровождается симптоматикой колита или энтероколита.
- Стадия развития осложнений. Появляются признаки инсулинорезистентности, нейровегетативных нарушений, хронического колита, дерматита и вагинита.
Симптомы нарушенной микрофлоры
Проявления дисбактериоза зависят от локализации пораженной микробиоты. Для кишечной формы патологии характерны следующие симптомы:
- Диспепсический синдром – расстройство стула, иногда с чередованием запора и диареи, метеоризм, вздутие живота, отрыжка и неприятный привкус во рту, урчание в кишечнике.
- Повышенная чувствительность к определенной пище, в особенности к злакам и молочным продуктам, а также аллергическая реакция на переносимые ранее продукты. Наиболее часто встречается при дисбактериозе у детей. Проявления могут быть различными: крапивница, кожный зуд, приступы удушья, ангионевротический отек, жидкий пенящийся стул, резкая боль в животе, тошнота вплоть до рвоты, понижение артериального давления.
- Синдром мальабсорбции – нарушение всасывания питательных веществ проявляется их недостаточностью в организме. Развивается симптоматика белково-энергетической недостаточности, гиповитаминозов, преимущественно витаминов группы В, анемии, нарушения ионного баланса, дефицита кальция.
- Интоксикационный синдром. Характерны слабость, снижение аппетита, повышение температуры тела, головная боль.
- Частые ОРЗ, ОРВИ, обострения герпетической инфекции, грибковые заболевания вследствие снижения иммунитета.
Проявления дисбактериоза кишечника у взрослых зависят от пола пациента. У женщин болезненные ощущения в животе усиливаются перед менструацией. Наблюдается повышенная активность сальных желез, на лице и на теле появляются высыпания. Слизистая оболочка влагалища раздражается, больную беспокоит зуд и жжение вульвы. Кожа становится сухой, дряблой и шелушится. Дисбактериоз кишечника у мужчин сопровождается ухудшением потенции, проблемами с мочеиспусканием.
По мере прогрессирования дисбактериоза присоединяются и симптомы осложнений.
При нейропсихическом расстройстве появляются слабость, апатия, тревожность, пониженное настроение, снижение концентрации внимания и стрессоустойчивости, навязчивые мысли, судороги.
Для инсулинорезистентности характерны прибавка в весе, высокая концентрация глюкозы и липидов крови, ощущение тяжести в правом подреберье. При генерализованной воспалительной или аутоиммунной реакции возможно появление боли в суставах, сыпи на коже, примеси слизи либо крови в испражнениях, повышения температуры тела, озноба, быстрой утомляемости.
Для кожного дисбиоза характерны сыпь на теле, дряблость, краснота, зуд, сухость либо избыточная жирность кожных покровов. При дисбактериозе влагалища проявляются молочница – творожистые выделения белого цвета, жжение и зуд в области наружных половых органов. При дисбалансе флоры ротовой полости прогрессируют стоматит, пародонтоз и кариес, ощущаются неприятный привкус и запах изо рта, появляется белый налет на языке.
Осложнения дисбиоза
Дисбиоз — синдром, способствующий развитию многих болезней. Научно подтверждена его связь со следующими патологиями:
- нейропсихические расстройства: депрессия, болезнь Альцгеймера, рассеянный склероз, шизофрения, аутизм, болезнь Паркинсона;
- инсулинорезистентность, дислипидемия, ожирение, сахарный диабет 2 типа, артериальная гипертензия, жировой гепатоз печени;
- аутоиммунные патологии: сахарный диабет I типа, ревматоидный артрит, системная красная волчанка, первичный склерозирующий холангит;
- аллергические заболевания: бронхиальная астма, атопический дерматит, аллергия на пищевые продукты;
- системные воспаления: болезнь Крона, неспецифический язвенный колит, синдром раздраженного кишечника, целиакия и колоректальный рак;
- заражение венерическими заболеваниями, в том числе ВИЧ-инфекцией;
- при генитальном дисбактериозе во время беременности – преждевременные роды;
- сердечно-сосудистые заболевания вследствие активации патогенных бактерий пародонта, способствующих атеросклеротическим процессам и развитию ИБС;
- аденокарцинома и плоскоклеточный рак пищевода при дисбактериозе полости рта.
Диагностика дисбактериоза
Диагноз ставится на основании жалоб больного, характерной симптоматики и данных осмотра. Для определения тяжести процесса и подбора тактики лечения проводятся лабораторные и инструментальные исследования:
- Общий клинический анализ крови. Обращают внимание на признаки анемии, уровень лейкоцитов в крови и их распределение по видам.
- Биохимический анализ крови. Выполняется для определения степени выраженности интоксикации и нарушения обмена веществ вследствие их неправильного всасывания в кишечнике.
- Общий анализ кала. Оценка физических и химических свойств кала, а также разнообразных компонентов и включений различного происхождения – копрограмма.
- Анализ кала на дисбактериоз. Бактериологический посев – это биологическое исследование испражнений с целью определения состава и количества микроорганизмов, обитающих в пищеварительном тракте человека. Также проводится биохимический анализ кала на предмет маркеров дисбиоза, таких как метаболиты летучих жирных кислот, производимых микроорганизмами.
- УЗИ брюшной полости. Визуальная оценка состояния органов пищеварения.
- Определение чувствительности патогенной флоры к бактериофагам. Проводится преимущественно детям перед назначением соответствующего лечения.
Лечение дисбактериоза
Важную роль в нормализации микрофлоры и работы органов пищеварения играет пересмотр рациона, режима питания. Таким больным рекомендован стол №4. Диета при дисбактериозе предполагает отказ от:
- острой и жареной пищи, копченых деликатесов;
- продуктов, насыщенных сахарами;
- быстроусвояемых углеводов;
- яблок, бананов, винограда;
- а также ограничение молочных продуктов.
Полезными для микрофлоры считаются продукты, обогащенные клетчаткой – цельнозерновая выпечка, крупы, за исключением белого риса, овощи, листовая зелень и сушеные фрукты. Рекомендована также кисломолочная продукция, содержащая пребиотики и стимулирующая рост полезной микрофлоры.
Консервативное лечение дисбактериоза предполагает применение:
- Противомикробных средств синтетического происхождения – кишечных антисептиков.
- Пробиотиков. Это готовые лакто-бифидопробиотики в дозах свыше 109 в одной капсуле.
- Пребиотиков. Представляют собой вещества, способствующие росту и размножению полезной флоры.
- Синбиотиков. Комплексные препараты, содержащие как сами микроорганизмы, так и необходимые для их развития компоненты.
- Бактериофагов. Эффективны для борьбы с инфекцией при второй степени дисбаланса микрофлоры. Метод лечения чаще используют при дисбактериозе у грудничка, когда противопоказано применение антибиотиков.
- Иммуномодуляторов. Применяются для восстановления иммунитета.
- Антибиотиков. Назначаются при распространенной форме дисбактериоза – в случае выраженных симптомов интоксикации, продолжительной диареи, тяжелого иммунодефицита и лабораторно-подтвержденного дисбиоза третьей степени.
Также применяются средства патогенетической терапии для восстановления моторики кишечника, уменьшения воспаления и восстановления ферментной активности органов пищеварения. Для облегчения проявлений диареи, боли в животе, метеоризма назначаются препараты симптоматической терапии.
Профилактика
Профилактика дисбактериоза включает сбалансированное питание, активный образ жизни, минимизацию стрессов и факторов, способных спровоцировать кишечное расстройство и дисбаланс микрофлоры.
Для предотвращения нарушения микрофлоры у новорожденных рекомендуется отдавать предпочтение естественному родоразрешению и грудному вскармливанию.
Дисбактериоз (дисбиоз) и нормофлора
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ (ДИСБИОЗ)
СОДЕРЖАНИЕ
- Некоторые термины и определения
- Определение дисбактериоза (дисбиоза) и его влияния на иммунитет и болезни хозяина
- Понятия «дисбактериоз» (дисбиоз) и «синдром избыточного бактериального роста»
- Проявления дисбактериоза через нарушение функций микробиоты
- Почему важно устранять дисбактериоз?
- Микробиота в норме и при патологии. Роль дисбиотической микробиоты в патогенезе различных заболеваний
В последнее время термин «дисбактериоз» часто заменяют «дисбиозом», скорее из-за того, что 1-й термин указывает на бактерии, хотя микробиота содержит также археи, вирусы, грибы и др. эукариоты. Поэтому термин «дисбиоз» универсален и используется как у нас, так и зарубежом, однако, как будет описано ниже, ряд авторов в него вкладывают немного иной смысл (системный)…
Дисбиоз, также называемый дисбактериозом (понятия в литературе обычно тождественны — ред.) характеризуется как нарушение гомеостаза микробиоты, вызванное дисбалансом микрофлоры, изменениями функционального состава и метаболической активности ее представителей (микроорганизмов) или сдвигом в их локальном распределении. Например, часть микробиоты человека, такая как флора кожи, кишечная флора или флора влагалища, может стать нарушенной, при этом обычно доминирующие виды становятся недостаточно представленными и обычно вытесняются и замещаются другими видами, как правило, представителями условно-патогенной микробиоты (не всегда, т.к. может наблюдаться только истощение микробиоты).
Понятие «дисбактериоз» тесно связано с понятием «нормофлора».
«Российский отраслевой стандарт по дисбактериозу кишечника» предлагает следующее определение нормофлоры: это «качественное и количественное соотношение разнообразных популяций микробов отдельных органов и систем, поддерживающих биохимическое, метаболическое и иммунологическое равновесие макроорганизма, необходимое для сохранения здоровья человека». С этих позиций организм человека в целом (равно как и каждый биотоп) и населяющая его микрофлора представляют собой микроэкологическую саморегулирующуюся систему, все компоненты которой (макроорганизм и микробные популяции) выполняют взаимополезные функции и находятся в состоянии симбиоза, способствуя созданию динамическоого равновесия в системе, называемого эубиозом.
Т. обр., можно сказать кратко: Дисбактериоз — это нарушение нормофлоры — ред.
«Дисбактериоз» — термин, которым принято определять нарушение видового и количественного состава микробных популяций (нормофлоры) в определенном биотопе. Нарушение состава микробных популяций может быть кратковременным и обратимым (например, после курса антибактериальной терапии); при этом не влияет на функции макроорганизма в целом и его гомеостаз, т.е. не нарушает состояния эубиоза.
«Колонизационная резистентность» – это совокупность механизмов, обеспечивающих постоянство видового и количественного составов микробных популяций в определенном биотопе, препятствующих размножению условно-патогенной и патогенной флоры и ее транслокации во внутреннюю среду организма, а также способствующих стабильности микроэкологической системы «макрорганизм–микрофлора».
Термин «дисбиоз», с точки зрения ряда авторов, является антагонистом термина «эубиоз». Его следует понимать как нарушение состояния эубиоза, т. е. нарушение стабильности экосистемы, приводящее к изменению биохимического, метаболического и иммунологического равновесия организма хозяина. Таким образом, разница в терминах «дисбактериоз» и «дисбиоз» обусловлена тем, что они относятся к разным системам: дисбактериоз – непосредственно к микрофлоре, определяя ее нарушения, а состояние дисбиоза является следствием дисбактериоза, определяет нестабильность микроэкологической системы и приводит к нарушению гомеостаза организма человека, его метаболического и иммунологического статуса.
Кратковременное нарушение состава микрофлоры в любом биотопе совсем не обязательно приводит к дисбиозу, требующему соответствующей коррекции. Крайним проявлением дисбактериоза и дисбиоза, их клинически манифестной формой можно считать антибиотикоассоциированную диарею и псевдомембранозный колит.
Применение понятия «дисбактериоз кишечника» также под вопросом (хотя в литературе оно используется часто и обычно означает толсто-кишечный дисбактериоз, если не указано иное), т.к. можно говорить только о дисбактериозе определенного биотопа: толстой кишки, тонкой кишки, желудка или пищевода, поскольку в каждом из них имеется своя доминирующая микрофлора. В клинической практике в качестве исследуемого субстрата используются обычно фекалии, отражающие состояние полостной флоры толстой кишки, поэтому и следует говорить только о нарушении ее микробиоты, т.е. о дисбактериозе толстой кишки.
Процесс может, однако, на этом не закончиться. Изменение биоценоза одного биотопа влечет за собой транслокацию микроорганизмов в нехарактерные биотопы и снижение колонизационной резистентности как отдельных биотопов, так и всей микроэкологической системы «человек–микрофлора». Проявлением такой транслокации микрофлоры может служить синдром избыточного бактериального роста (СИБР) в тонкой кишке с повышением микробной обсемененности последней более 104 КОЕ/1мл кишечного содержимого. С этих позиций СИБР можно считать дисбактериозом тонкой кишки.
Определение дисбактериоза и его влияния на иммунитет и болезни хозяина
Charisse Petersen and June L Round
Defining dysbiosis and its influence on host immunity and disease
Cell Microbiol. 2014 Jul; 16(7): 1024–1033
Резюме. Развитие иммунной системы млекопитающих зависит от инструкций резидентных комменсальных микроорганизмов. Заболевания, связанные с аномальными иммунными реакциями на антигены окружающей среды и собственного организма, быстро нарастают в течение последних 50 лет. Эти заболевания включают воспалительные заболевания кишечника (ВЗК), рассеянный склероз (РС), диабет I типа (СД1), аллергию и астму. Наблюдение за тем, что люди с иммунно-опосредованными заболеваниями имеют другое микробное сообщество по сравнению со здоровыми людьми, позволяет предположить, что патогенез возникает из-за неправильного обучения иммунной системы микробиотой. Однако при наличии сотен различных микроорганизмов в нашем теле трудно понять, какие из них способствуют здоровью и, что еще более важно, каким образом? Микробиологи, изучающие патогенные организмы, уже давно придерживаются постулатов Коха о прямой связи определенного заболевания с конкретным микробом, поднимая вопрос о том, может ли это быть верно и для отношений комменсал–хозяин. Новые данные подтверждают, что на сбалансированный иммунный ответ влияет не один или два доминирующих организма, индуцирующих здоровье хозяина, а состав всего сообщества микробных резидентов. Таким образом, возмущения в структуре сложных комменсальных сообществ (называемые дисбактериозом) могут приводить к недостаточному образованию иммунной системы хозяина и последующему развитию иммуноопосредованных заболеваний. Здесь мы рассмотрим литературу, которая описывает причины дисбактериоза и механизмы, выработанные хозяином для предотвращения этих изменений в структуре сообщества. Основываясь на этих исследованиях, мы будем классифицировать различные типы дисбактериоза и определять, как коллекции микроорганизмов могут влиять на реакцию хозяина. Это исследование имеет широкие последствия для будущих методов лечения, которые выходят за рамки введения одного организма для поддержания здоровья. Мы предполагаем, что выявление механизмов восстановления здоровой сложной микробиоты после возникновения дисбиоза — процесса, который мы будем называть ребиозом, — будет иметь основополагающее значение для лечения сложных иммунных заболеваний.
Что такое дисбактериоз?
Наши современные знания об архитектуре здоровой микробиоты получены в результате многочисленных исследований у людей без явных признаков заболевания (Huttenhower et al., 2012). Эта структура включает Bacteroidetes и Firmicutes как доминирующие бактериальные типы, присутствующие в образцах стула, а также протеобактерии и актинобактерии, которые имеют небольшое, но постоянное присутствие у большинства людей. В широком смысле дисбактериоз — это любое изменение состава резидентных комменсальных сообществ относительно сообщества, обнаруженного у здоровых людей. В последнее десятилетие в ряде исследований были зафиксированы значительные изменения в структуре микробных сообществ у мышиных моделей воспалительных заболеваний кишечника и пациентов c ВЗК, такими как болезнь Крона, язвенный колит (ЯК) (Frank et al., 2007), диабет (Karlsson et al., 2013), астма (Abrahamsson et al., 2013), аллергии и даже аутизм (Parracho et al., 2005). Учитывая растущее значение микробиоты для развития хозяина, предполагается, что эти наблюдаемые изменения микробного состава являются факторами, способствующими возникновению и/или персистенции многих из этих заболеваний.
Существует множество способов воздействия на структуру микробного сообщества. Это включает в себя генетику хозяина, диету, инфекцию или медицинские вмешательства (например, антибиотики). Гигиеническая гипотеза первоначально предполагала, что использование антибиотиков и изменения образа жизни, ограничивающие воздействие микробов, предрасполагают население развитых стран к аутоиммунным заболеваниям (Strachan, 2000). Поэтому было высказано предположение, что из-за неспособности провести различие между патогеном и комменсалом, антибиотики нарушают структуру микробиоты и, следовательно, коэволюционные отношения между нашей иммунной системой и симбионтами, которые мы принимаем. С тех пор было проведено значительное количество исследований, посвященных изучению функциональной важности микробиоты и влияния лечения антибиотиками на ее архитектуру (Ubeda et al., 2010; Buffie et al., 2012; Cho and Blaser, 2012). Интересно, что антибиотики, обычно используемые в клинике, оказывают существенное влияние на наших обитателей микробов (Таблица 1). Важно отметить, что многие антибиотики оказывают длительное воздействие на микробиоту, что приводит к постоянной гибели некоторых организмов, тогда как другие перерастают и сохраняются. В то время как эти исследования документировали дисбактериоз в контексте заболевания или использования антибиотиков, недавние исследования начали выявлять причинно-следственную связь между дисбиозом и прогрессированием заболевания. В совокупности эти исследования теперь позволяют нам лучше понять, что такое дисбиоз, и начать классифицировать его на три типа, которые будут подробно обсуждаться здесь. К ним относятся (I) потеря полезных микробных организмов, (II) размножение патобионтов или потенциально вредных микроорганизмов и (III) потеря общего микробного разнообразия (рис. 1). Эти три типа дисбактериоза не являются взаимоисключающими и могут происходить одновременно. Этот обзор предназначен для того, чтобы помочь обобщить текущие данные, чтобы дать более четкое понимание того, что такое дисбиоз и как он влияет на здоровье, развитие иммунной системы и болезни.

Рисунок 1. Потеря полезных микробов, размножение патобионтов и потеря разнообразия — это события, которые охватывают дисбиоз. При здоровых гомеостатических условиях микробиота состоит из разнообразных организмов, которые, как известно, способствуют развитию и здоровью хозяина. Однако экологические нарушения, такие как использование антибиотиков или диета, могут привести к нарушениям в структуре микробного сообщества. Эти нарушения могут привести к гибели организмов, полезных для хозяина, и последующему чрезмерному росту комменсалов, которые могут причинить вред, которые называются патобионтами. Доминирование микробиоты патобионтами может привести к воспалению и патологии. Кроме того, многочисленные исследования описывают разнообразие вкладов, вносимых различными членами микробиоты. Зачастую это не является избыточным воздействием на здоровье хозяина, поэтому полная потеря разнообразия в микробиоте может также влиять на прогрессирование или тяжесть заболевания и, таким образом, также представляет собой событие дисбактериоза.
Таблица 1. Вызванные антибиотиками изменения в микробиоте
|
Антибиотик |
Изменения в микробиоте |
|||
|
Наименование |
Активность / спектр |
Снижение разнообразия |
Потеря сообщества |
Расширение сообщества |
|
Амоксициллин |
β-Лактамный антибиотик: ингибирует синтез пептидогликанов Расширенный спектр |
Bifidobacterium C,a |
Lactobacillus spp., Enterococcus spp., Enterobacteriaceae spp. NR,b |
|
|
Ванкомицин |
Гликопептид: ингибирует перекрестную связь пептидогликанов |
Широко распространенные сокращения M & NM, c |
Lactobacillus spp., Enterococcus spp., группа D Streptococcus M,d Bacteroidales, Ruminobcoccaceae, Lachnospiraceae, Clostridiales M&NM,e Tenericutes, Turicibacteria NM, Lactobacillus plantarum, Faecalibacterium prausnitzii, Eubacterium hallii, Clostridium cluster IV и XIVa, Escherichia coli, Haemophilus spp., Serratia C,f |
Enterobacteriaceae M,d Lactobacillaceae, Verrucomicrobiaceae NM,e Paenibacillaceae, Firmicutes, Anaeroplasmataceae M,e |
|
Ципрофлоксацин |
Хинолин: ингибирует репликацию ДНК Широкий спектр |
Распространенные сокращения C,g |
Clostridiales, Fecaelibacterium spp. C,g |
|
|
Цефалоспорин (Цефазолин) |
β-Лактамный антибиотик: ингибирует синтез пептидогликанов Узкий спектр |
Firmicutes C,f |
Actinobacteria (Slackia и Bifidobacterium), Betaproteobacteria, Streptococcus spp., Roseburia, Eubacterium C |
|
|
Стрептомицин |
Аминогликозид: ингибирует синтез пептидов Узкий спектр |
Lactobacillus spp, Enterococcus spp., группа D Streptococcus M,d |
Enterobacteriaceae M,d |
Антибиотики, обычно используемые в клинике, приводят к изменениям в составе микробиоты. Эта таблица описывает, как различные антибиотики влияют на конкретные бактериальные сообщества. М, мышь; NM, новорожденная мышь; NR, новорожденная крыса; С, клиника.
aMangin et al. (2010) Anaerobe 16: 433–438.
bSchumann et al. (2005) Physiol Genomics.
cSekirov et al. (2008) Infect Immun.
dRussell et al. (2012) EMBO Rep.
eVreize et al. (2013) J Hepatol.
fPerez-Cobas et al. (2013) Gut.
gDethlefsen et al. (2008) PLoS Biol.
Потеря полезных микробных организмов
Стало хорошо известно, что микробиота играет важную роль в созревании и развитии соответствующих иммунных реакций кишечника (Round and Mazmanian, 2009; Cho and Blaser, 2012; Hooper et al., 2012). Недавние исследования начали выявлять организмы и их механизмы, ответственные за стимулирование иммунного развития в организме хозяина. Иммунный ответ должен быть тщательно сбалансирован между воспалением, необходимым для эрадикации патогена, и толерантными реакциями, которые предотвращают нежелательные иммунные реакции по отношению к собственной ткани и комменсалам. Толерантные механизмы, выработанные хозяином, включают выработку слизи и антимикробных пептидов для создания барьера между тканью хозяина и микробами (Johansson et al., 2008; 2011,; Vaishnava et al., 2011), модификацию бактериальных продуктов, чтобы сделать их менее иммуногенными (Bates et al., 2007), продуцирование антител, которые могут непосредственно связываться с микробной функцией и влиять на нее (Fagarasan and Honjo, 2003; Peterson et al., 2007; Slack et al., 2012) и противовоспалительные Т-клетки. Интересно, что были выявлены специфические представители микробиоты, которые могут непосредственно координировать многие аспекты иммунного ответа хозяина.
Толерантность к собственной ткани и резидентным комменсалам частично регулируется специализированным подмножеством Т-лимфоцитов, называемых Т-регуляторными клетками (Tregs) (Josefowicz et al., 2012). Эти клетки маркируются экспрессией транскрипционного фактора Foxp3 (Fontenot et al., 2003). Мутации в гене Foxp3 приводят к потере развития Treg как у мышей, так и у людей, а также последующему воспалению и аутоиммунитету в полиорганных участках, демонстрируя важность популяций Treg для здоровья хозяина. Несколько исследований выявили резидентные микроорганизмы, которые способны индуцировать эти типы клеток в кишечнике хозяина (Round and Mazmanian, 2010; Atarashi et al., 2011). Начальные эксперименты показали, что функция Treg-клеток нарушается у мышей без микробов и может быть восстановлена либо моноассоциацией с человеческими комменсальными бактериями Bacteriodes fragilis, либо с определенной смесью штаммов Clostridium из групп IV и XIVa. Колонизация животных с любым из этих организмов защищает животных от колита в Treg-зависимом образе через определенные механизмы. Штаммы Clostridium индуцируют экспрессию TGF-β из эпителиальных клеток кишечника (IECs) для усиления дифференцировки индуцибельных Treg-клеток толстой кишки (Atarashi et al., 2013); в то время как B. fragilis использует капсульный полисахарид PSA, который связывается с TLR2 как на дендритных клетках, так и на Т-клетках, чтобы индуцировать IL-10 и усиливать супрессивную способность Tregs (Round et al., 2011; Shen et al., 2012). Сообщалось также, что другие штаммы Бактериодов увеличивают общее количество Treg в толстой кишке, включая B. caccae, B. thetaiotaomicron и B. vulgaris, хотя это и не наблюдается во всех системах (Faith et al., 2014). Некоторые другие штаммы комменсальных бактерий развили способность индуцировать Treg и обеспечивать защиту от воспалительных заболеваний. К ним относятся многочисленные штаммы лактобацилл, такие как L. acidophilus и несколько штаммов бифидобактерий, включая B. breve, что, вероятно, делает индукцию Tregs общим механизмом, используемым бактериями для индуцирования толерантности в кишечнике. Механизмы, с помощью которых многие из этих организмов влияют на биологию Treg, остаются непроверенными, но, вероятно, включают бактериальные производные продукты, такие как короткоцепочечные жирные кислоты (SCFAs) (Schmidt et al., 2010). SCFAs — это микробиологические продукты ферментации пищевых волокон, которые включают пропионат, ацетат, бутират и формиат. Эти продукты были показаны несколькими группами, которые отвечают за регулирование пула Treg в толстой кишке и обеспечивают защиту от экспериментального колита (Arpaia et al., 2013; Furusawa et al., 2013; Smith et al., 2013). Бутират и пропионат, но не ацетат, по-видимому, являются наиболее заметными SCFAs, способными управлять реакциями Treg. Бутират, в частности, способен блокировать гистоновые деацетилазы (HDACs), которые способствуют конденсации ДНК и тем самым могут регулировать экспрессию генов. Интересно, что если Т-клетки обрабатывают бутиратом в условиях, индуцирующих Treg in vitro, наблюдается заметное увеличение ацетилирования промоторной области Foxp3, а также энхансерных элементов, что позволяет экспрессировать Foxp3. SCFAs воспринимаются хозяином через различные рецепторы, включая связанные с G-белком рецепторы GPCR43 и GPR109a (Smith et al., 2013; Singh et al., 2014). Неудивительно, что экспрессия GPCR43 повышается на Tregs, особенно в тканях кишечника (Smith et al., 2013). Следовательно, потеря этих рецепторов приводит к восприимчивости животных к воспалению толстой кишки и раку толстой кишки.
В то время как Tregs являются ключевым компонентом индукции толерантности в кишечнике, у комменсальных организмов появились другие механизмы для подавления воспаления. Пациенты с ВЗК имеют повышенные уровни воспалительных цитокинов, таких как TNF-α и IP-10. Как обсуждалось выше, уровням этих цитокинов часто противодействует индукция Tregs, и этот механизм используется хозяином для поддержания гомеостаза в кишечнике. Однако недавно группа раскрыла механизм, с помощью которого комменсальные бактерии могут непосредственно уменьшать воспаление, воздействуя на сами цитокины. Lactobacillus paracasei и L. casei кодируют протеазу, называемую лактоцептин, которая специфически разрушает воспалительный цитокин IP-10 (von Schillde et al., 2012). Деградация секретируемого и связанного с клетками IP-10 приводит к снижению рекрутирования лимфоцитов во время илеита на животных. Таким образом, члены микробиоты разработали способы прямого противодействия эффектам воспалительного ответа хозяина и, следовательно, непосредственную помощь в поддержании кишечного гомеостаза.
В отличие от Т-клеток, которые распознают белковые антигены, инвариантные клетки NKT (iNKT) распознают липидные антигены и играют важную роль в врожденном и адаптивном воспалении. Интересно, что развитие этих типов клеток динамически регулируется микробиотой, так что безмикробные мыши (GF) имеют повышенное количество этих клеток в кишечнике (Olszak et al., 2012). Животные, содержащие повышенное количество клеток iNKT, более восприимчивы к колиту, поэтому определение того, как микробиота функционирует для подавления количества клеток iNKT в кишечнике, может привести к важному терапевтическому вмешательству. Недавнее сообщение продемонстрировало, что моноассоциация бесплодных мышей с B. fragilis достаточна для подавления развития этой популяции (An et al., 2014). B. fragilis содержит ген с высокой гомологией к ферментам, участвующим в биогенезе сфиноглипидов. Делеция этого гена в B. fragilis предотвращает подавление развития клеток iNKT, указывая на то, что B. fragilis использует эти липиды для влияния на биологию клеток iNKT. Действительно, исследователи очистили сфинголипиды от B. fragilis и показали, что они способны снижать активацию iNKT-клеток и защищать животных от болезней. Важно отметить, что раннее воздействие B. fragilis необходимо для ингибирования развития iNKT-клеток, а моноколонирование взрослых безмикробных мышей недостаточно для защиты от колита. Как обсуждалось ранее, B. fragilis также способен модулировать ответы Treg (Ochoa-Reparaz et al., 2010; Round and Mazmanian, 2010). Эти исследования показывают, что один комменсальный организм может обладать несколькими механизмами, чтобы положительно влиять на биологию хозяина, и подчеркивает сложность и близость отношений хозяин-комменсал.
Клинические исследования обеспечивают поддержку этих исследований на животных. Независимый от культуры анализ пациентов с Болезнью Крона (БК) и язвенным колитом (ЯК) выявил явную потерю симбионтов, находящихся в слизистой оболочке толстой кишки, по сравнению со здоровыми людьми. В частности, потеря групп Clostridium XIVa и IV наблюдается в образцах фекалий и слизистой оболочки у пациентов с ВЗК (Gophna et al., 2006; Frank et al., 2007). Эти наблюдаемые сокращения наблюдались постоянно, независимо от того, активно ли у пациентов наблюдались клинические симптомы или в период ремиссии, и не были ли они коррелированы с недавними антибиотиками. Это показывает, что потеря полезных микробов является основной проблемой, а не просто отражением увеличения воспаления или лечения. Противоречивые результаты были зарегистрированы для типов бактерий. Используя слизистые ткани из тонкого кишечника и толстой кишки от 190 пациентов, которые включали равное количество пациентов с БК и ЯК и здоровых контролей, Frank et al. идентифицировали приблизительно 800–1600 OTUs и наблюдали значительное снижение OTUs и относительной численности Bacteroidetes у пациентов с ВЗК. В других исследованиях, включающих идентификацию микроорганизмов из образцов фекалий, наблюдалось увеличение числа Bacteroidetes у пациентов с ВЗК (Mangin et al., 2004; Gophna et al., 2006). Это, однако, может отражать различия в культуральных и независимых методах исследований, глубине отбора проб микробной последовательности или различий между тканями и фекалиями. В совокупности эти исследования определяют важные пути, по которым комменсальные бактерии положительно влияют на биологию млекопитающих, поэтому потеря этих организмов представляет собой важный аспект дисбактериоза.
Расширение патобионтов
Микробиота также содержит членов, способных причинить вред хозяину. Эти организмы были названы патобионтами для обозначения их способности вызывать патологию (Chow and Mazmanian, 2010). Патобионты обычно содержатся на низком уровне в здоровой кишке и не вызывают проблем у иммунокомпетентных хозяев; Тем не менее, есть несколько примеров, что рост этих организмов может способствовать заболеванию. Таким образом, экспансия патобионтов представляет собой вторую категорию дисбактериоза.
Чаще всего сообщается о распространении патобионтов среди протеобактерий и, в частности, семейства Enterobacteriaceae, в состав которого входят такие члены, как Escherichia coli, Shigella и Klebsiella (Lupp et al., 2007). Это верно для нескольких мышиных моделей колита, включая модели животных, несущих мутации в генах, которые связаны с ВЗК (Ayres et al., 2012). В частности, делеция TLR5, Toll-подобного рецептора (TLR), ответственного за распознавание жгутиковых белков, приводит к слабому воспалению, колиту и метаболическому синдрому с неполной пенетрантностью (Vijay-Kumar et al., 2010; Carvalho et al., 2012; Cullender et al., 2013). Эти фенотипы болезни теряются, когда животные повторно выводятся с микробиотой из Лаборатории Джексона, что предполагает роль состава микробиоты в развитии болезни. Чтобы идентифицировать микробные сообщества, связанные с колитом у животных с дефицитом TLR5, микробиоту сравнивали между колитическими и неколитическими животными TLR5−/− (−/− означает дефицит – ред.). Интересно, что у животных, у которых развился спонтанный колит, протеобактерии имели трехкратное увеличение. Что еще более важно, было обнаружено, что члены Enterobacteriaceae, такие как E.coli, преимущественно связаны со слизистой оболочкой и способны проникать в ткани. Чтобы продемонстрировать потребность в E. coli для индукции колита у животных TLR5−/−, животных TLR5−/− и животных дикого типа (WT) лечили антибиотиками, а затем обрабатывали адгезивным инвазивным штаммом E.coli (AIEC). Животные TLR5−/− были неспособны управлять уровнями этих жгутиконосых бактерий и имели в 10 раз большую бактериальную нагрузку. Более того, все животные TLR5−/−, получавшие этот штамм, скончались от колита, что свидетельствует о том, что E. coli было достаточно для возникновения колита в отсутствие TLR5.
Klebsiella pneumonia и Proteus mirabilis, оба члена семейства Enterobacteriaceae, также расширялись, вызывая колит у мышей Т-bet−/− X Rag2−/− (Garrett et al., 2007). У Rag-дефицитных животных отсутствуют Т- или В-клетки, и поэтому скрещивание этих мышей вызывает недостаток Т-bet в клетках врожденной иммунной системы. Интересно, что эти виды нуждались в неповрежденной микробиоте для индукции заболевания и не были достаточны, чтобы вызвать колит самостоятельно. В качестве последнего примера, когда животных лечат антибиотиками и впоследствии вызывают колит с использованием DSS, происходит расширение штамма E.coli с множественной лекарственной устойчивостью, который способен проникать через слизистую оболочку кишечника и вызывать сепсис (Ayres et al., 2012). Многочисленные исследования показали, как эти организмы способны эксплуатировать воспаленную окружающую среду и расширять свою численность, и эти механизмы были рассмотрены в других местах (Spees et al., 2013). Важно отметить, что расширение Enterobacteriaceae также наблюдается у пациентов, страдающих от БК и ЯК, в образцах как тканей, так и фекалий (Frank et al., 2007), что согласуется с тем, что наблюдается на моделях мышей; тем не менее, необходимо проделать большую работу, чтобы лучше понять, действительно ли эти организмы вызывают заболевание или просто усугубляют прогрессирование заболевания.
Сообщалось, что другие типы организмов расширяются в других животных моделях иммунодефицита. NLRP6 является членом нуклеотидсвязывающего домена олигомеризации белковых рецепторов (NLRs), класса цитоплазматических рецепторов, которые распознают бактериальные продукты. NLRP6−/− мыши имеют повышенное обилие Prevotella spp. и TM7 и очень чувствительны к колиту, индуцированному декстраном сульфата натрия (DSS) (Elinav et al., 2011). Колит передается при совместном содержании NLRP6−/− и WT-мышей, что приводит к повышенной восприимчивости к заболеванию у WT-животных. Таким образом, дефицит NLRP6 не требуется для патологии, а скорее позволяет расширить подмножество организмов, способствующих воспалению.
Наконец, в то время как подавляющее большинство наших микробных обитателей являются бактериями, млекопитающие также колонизируются грибковыми и вирусными представителями. В общем, дрожжи не подвержены лечению антибиотиками, и одним из распространенных побочных эффектов применения антибиотиков является рост штаммов дрожжей, таких как Candida albicans. Недавнее исследование подчеркнуло важность контроля чрезмерного роста грибков для здоровья кишечника путем изучения роли дектина-1 в кишечнике (Iliev et al., 2012). Дектин-1 представляет собой рецептор, который распознает альфа-маннаны из клеточной стенки дрожжей, и мыши с дефицитом этого рецептора более восприимчивы к DSS-колиту, который можно лечить с помощью флуконазола, противогрибкового препарата, который не нацелен на бактерии. Эти данные указывают на то, что разрастание дрожжей может усугубить заболевание, и наша иммунная система разработала элегантные механизмы для регулирования популяций дрожжей в кишечнике. Аналогичным образом, исследование показало, что лечение животных антибиотиками допускает чрезмерный рост C. albicans, что повышает концентрацию простагландина E2 в плазме (PGE2) (Kim et al., 2014). Увеличение PGE2 вызывает у этих животных склонность к аллергии, которая может быть подавлена, когда синтез PGE2 блокируется. Таким образом, лечение антибиотиками может привести к росту грибковых видов в кишечнике, которые могут влиять на внекишечные заболевания у хозяина. Вирусные члены нашей микробиоты только начинают определяться, представляя новых игроков в сложной взаимосвязи между генетическими факторами и факторами окружающей среды, которые приводят к заболеванию. Полиморфизмы в гене ATG16L1 создают в два раза более высокий риск развития ВЗК. Когда мыши содержат гипоморфную мутацию в ATG16L1, они испытывают гистологические нарушения и повышенный колит, как у пациентов с болезнью Крона, которые несут полиморфизмы в пределах одного и того же гена (Cadwell et al., 2010). Интересно, что хроническая инфекция специфическим штаммом норовируса мыши необходима для наблюдаемого фенотипа у мышей. Хотя это не является примером расширения, оно подчеркивает вероятность неизвестных вирусных патобионтов, играющих роль в развитии заболеваний, связанных с дисбиозом.
Маловероятно, что экспансия патобионтов сама по себе может вызвать заболевание, поскольку десятилетия исследований были посвящены выявлению единственного организма, способного вызывать ВЗК, и не было обнаружено ни одного. Поддерживая это, у субклинических близнецов и ближайших членов семьи есть микробиота, которая напоминает микробиоту родственного пациента с ВЗК; однако ни один из этих инфекционных агентов не обладал способностью вызывать ВЗК у здорового человека. Следовательно, возможно, что сопутствующее сокращение полезных микробов или потеря разнообразия также должны произойти, чтобы способствовать заболеванию. В совокупности эти исследования показывают как хорошо охарактеризованные, так и недавно обнаруженные патобионты, способны оказывать вредное воздействие на хозяина, когда им предоставляется возможность расширяться.
Потеря разнообразия: чем больше, тем лучше
Имеются данные, свидетельствующие о том, что члены микробиоты вносят разнообразный и не избыточный вклад в здоровье хозяина. Например, некоторые организмы способствуют развитию противовоспалительных сетей, в то время как другие вызывают защитные воспалительные реакции. Кроме того, в то время как некоторые взаимодействия хозяина и микроба могут инициироваться несколькими видами, другие включают более уникальные отношения с исключительными членами сообщества (Faith et al., 2014). Поэтому для получения максимальной пользы для здоровья от микробиоты может потребоваться более сложная и разнообразная коллекция организмов, и, действительно, несколько недавних экспериментов подтверждают эту идею. Таким образом, важным аспектом дисбактериоза может быть также потеря общего микробного разнообразия.
Как обсуждалось выше, функция регуляторных клеток Treg нарушена у животных без микробов. Чтобы идентифицировать организмы, которые дополняют этот дефицит, для колонизации безмикробных животных использовали разведенные образцы стула человека, обогащенные устойчивыми к хлороформу бактериями. Интересно, что эти виды Clostridia, содержащие более 30 различных штаммов, вызывали трехкратное распространение Tregs в кишечнике по сравнению с неколонизированными контролями. Важно, что индукция Treg внутри хозяина была снижена, когда у мышей был колонизирован только один штамм из этой коллекции Clostridia, по сравнению с животными, колонизированными более чем 15 различными штаммами Clostridia. Эти данные позволяют предположить, что большее разнообразие организмов, даже в пределах одного семейства, может максимально стимулировать развитие клеток хозяина (Atarashi et al., 2011; 2013). Усиливают ли эти штаммы активность Treg по одному и тому же пути или действуют через различные механизмы, остается неясным, но будет важно для нашего понимания того, как эти организмы влияют на здоровье хозяина.
Раннее воздействие этих разнообразных сообществ микробов, по-видимому, является дополнительным аспектом поддержания здоровых взаимоотношений хозяина и микробиоты (Cho and Blaser, 2012; Cho et al., 2012). Изотип антител, IgE, связан с аллергическими реакциями, и у животных с повышенной концентрацией IgE развивается обострение аллергического заболевания. Несмотря на снижение всех других изотипов, IgE значительно повышен в сыворотке крови мышей без микробов, что указывает на специфическую потребность микробиоты в подавлении этого антитела (Cahenzli et al., 2013). Колонизация безмикробных мышей в раннем возрасте с помощью сложной микробиоты снижает уровень IgE и предотвращает аллергию; однако, если безмикробные животные колонизируются во взрослом возрасте, подавление уровня IgE не происходит. Чтобы лучше понять минимальное микробное разнообразие, необходимое для подавления IgE, безмикробные мыши были сначала колонизированы одним видом, E. coli, который был неспособен подавлять уровни IgE. Би-колонизация двумя видами, Lactobacillus murinus и Parabacteriodes distasonis, также не смогла подавить уровень IgE. Когда безмикробные животные были колонизированы восемью различными организмами, включавшими L. murinus и P. distasonis, половина животных все еще демонстрировала гиперпродукцию IgE. Подавление IgE было очевидно только тогда, когда животные были колонизированы до 40 различными штаммами бактерий. Вместе взятые, эти исследования показывают, что для получения максимальной пользы для хозяина требуется большее разнообразие микробных организмов.
В то время как многие исследования обнаружили корреляции с изменениями в обилии микробиоты и аллергии, лишь немногие исследования смогли изучить микробиоту в раннем возрасте, а затем проследить за теми же детьми, чтобы выяснить, не развивается ли у них заболевание. Однако в недавнем исследовании удалось собрать образцы микробиоты у детей в течение первой недели жизни и снова через 1 месяц и 12 месяцев после рождения (Abrahamsson et al., 2013). Затем эти же дети были обследованы на наличие аллергических заболеваний и астмы в возрасте семи лет. Интересно, что все дети, у которых развилась астма, имели более низкие микробные различия в раннем возрасте по сравнению с неастматическими детьми, что позволяет предположить, что микробное разнообразие в раннем возрасте может защитить от болезни в более позднем периоде развития. По-прежнему необходимо проводить тщательные исследования; однако эти исследования показывают, что увеличение микробного разнообразия лучше. Хотя мы уже обсуждали три различных типа дисбактериоза, вполне вероятно, что дисбактериоз охватывает все три из этих проявлений одновременно, чтобы влиять на болезнь.
Ребиоз: возвращение микробного сообщества к здоровому состоянию
Несколько исследований в настоящее время показали, что замена полезных видов бактерий может защитить и даже вылечить болезни в модельных системах животных и человеческих пациентов (Mazmanian et al., 2008; Sokol et al., 2008; Ochoa-Reparaz et al., 2010; Round and Mazmanian, 2010). У людей это было лучше всего установлено для инфекций Clostridium difficile (Aas et al., 2003). Инфекция C. difficile является основной причиной антибиотико-ассоциированной диареи и становится все более тяжелым бременем для здравоохранения (Kachrimanidou and Malisiovas, 2011). Инфекции С. difficile могут вызвать широкий спектр заболеваний, включая тяжелую диарею, псевдомембранозный колит и токсический мегаколон. Инфекцию обычно лечат ванкомицином или метронидазолом, однако в 25-30% случаев следует рецидив заболевания, причем с каждым рецидивом возрастает вероятность повторного рецидива. Интересно, что при использовании антибиотика более узкого спектра действия, который наносит меньший ущерб микробиоте, наблюдается более низкая частота рецидивов C. difficile, что позволяет предположить, что микробиота может играть защитную роль во время инфекции. В настоящее время было показано на обеих моделях мышей и, что более важно, на людях, что трансплантация фекальной микробиоты (FMT) от здорового донора может помочь вытеснить инфекцию C. difficile и предотвратить рецидивы. После того как большое количество неконтролируемых исследований продемонстрировало высокие показатели успеха FMT в разрешении инфекций C. difficile, рандомизированное исследование недавно показало 81% успеха после одной трансплантации с 98% успеха после второй (van Nood et al., 2013; Vrieze et al., 2013; Pamer, 2014). Эти исследования подчеркивают потенциальную терапевтическую ценность выявления способов восстановления «здоровой» микробиоты, процесса, который мы будем называть ребиозом.
Существует несколько потенциальных подходов-кандидатов для ребиоза, помимо описанного выше FMT. Многочисленные исследования были направлены на выявление функциональных членов микробиоты, которые могут культивироваться и поэтому использоваться в качестве пробиотиков либо в виде таблеток, либо встраиваться в пищевые продукты. Учитывая важность микробного разнообразия, вполне вероятно, что ни один отдельный организм не будет работать наиболее эффективно, а наоборот, сложный ассортимент организмов обеспечит максимальную пользу. Действительно, йогурты и пробиотики начинают включать в себя несколько штаммов организмов. Недостатком этой терапии является то, что она опирается на способность культивировать эти организмы в лаборатории, однако, по оценкам, только 20-30% этих организмов можно культивировать, а это означает, что большая, вероятно, очень важная составляющая микробиоты не будет отбираться. Другим методом поддержания или восстановления здоровой микробиоты потенциально может быть использование пребиотиков, которые являются неперевариваемыми ингредиентами, стимулирующими рост и активность определенных групп бактерий. Существует несколько известных веществ, отвечающих этим критериям, таких как инулин, но для определения наилучших источников питания для микробиоты требуется большая работа (прим. ред.: здесь стоит отметить, что некоторые бактерии, такие как молочные P. freudenreichii, обладают пребиотическим (бифидогенным) эффектом неуглеводной природы за счет особых бифидогенных стимуляторов роста (BGS), что делает их перспективными пробиотиками как в монокультуре, так и в пробиотической смеси). Более глубокое понимание того, как иммунные пути хозяина влияют на структуру микробного сообщества, может также открыть новые возможности для совершенствования методов лечения манипулированием микробными сообществами. Иммунные системы млекопитающих приобрели изящные механизмы для усиления антиген-специфического иммунитета против патогенов и поэтому могут также использовать аналогичные механизмы для контроля микробиоты. Если это правда, то можно было бы разработать методы лечения, которые нацелены на конкретные микробы, сохраняя при этом всю остальную микробиоту неповрежденной. Микробиота представляет собой важный аспект здоровья человека, который мы только начинаем понимать; поэтому предстоит еще много работы, чтобы понять терапевтическую ценность этих микробных симбионтов.
Понятия «дисбактериоз» (дисбиоз) и «синдром избыточного бактериального роста»
Согласно различным этапам учения о микробиоценозе кишечника было принято несколько определений «дисбактериоза». Необходимо помнить о том, что дисбиоз – понятие более широкое, включающее в себя не только наличие изменений со стороны бактериального пула микроорганизмов, но и вирусов, простейших, грибов. Кроме того, понятие дисбиоза применяется для обозначения нарушений состава микробиоты в разных биотопах организма человека. В настоящем разделе речь идет о нарушениях микрофлоры кишечника, так как она является наиболее представительной и функционально значимой.
Термин «дисбактериоз» ввел впервые в микробиологическую практику в 1916 г. А. Ниссле для обозначения изменений микрофлоры в организме животного под влиянием всевозможных факторов.
Впервые термин дисбактериоз был введен A.Nissle в 1916 году, который под дисбактериозом первоначально понимал изменения, касающиеся только кишечной палочки. Перетц Л.Г. (1962 г.) определял дисбактериоз как патологическое состояние кишечной микрофлоры, которое характеризуется уменьшением общего количества типичных кишечных палочек, понижением их антагонистической и ферментативной активности, появлением лактозонегативных эшерихий и кишечных палочек, дающих гемолиз на кровяном агаре, увеличением количества гнилостных, гноеродных, спороносных и других видов микробов.

До настоящего времени широко использовалось и другое определение дисбактериоза как состояния, характеризующегося нарушением подвижного равновесия кишечной микрофлоры и возникновением качественных и количественных изменений в микробном пейзаже кишечника (Красноголовец В.Н., 1989). Некоторыми авторами дисбактериоз (не только кишечника, но и др. нестерильных полостей и трактов) рассматривался как изменение микробиоценозов различных биотопов человеческого организма, выражающихся в нарушении инфраструктурного отношения анаэробы/аэробы, популяционных изменениях численности и состава микробных видов биотопов, в т.ч. появление нерезидентных для данного биотопа видов (контаминация, транслокация), изменения их метаболической активности и являющиеся следствием и/или одним из патогенетических механизмов многих патологических состояний.
В отраслевом стандарте (Приказ МЗ РФ №231 от 2003 г.) «Протокол ведения больных. Дисбактериоз кишечника» под дисбактериозом кишечника понимают клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений с возможным развитием желудочно-кишечных расстройств. Термин «дисбактериоз» присутствует только в отечественной литературе.
Как видно из представленных определений «дисбактериоз» — не столько клиническое понятие, сколько микробиологический (лабораторный) термин, и по своей сути является следствием воздействия неблагоприятных факторов, в т.ч. различных заболеваний. В зарубежной литературе применяется термин Bacterial overgrowth syndrome – синдром избыточного бактериального роста, включающий в себя изменение количественного и видового состава микроорганизмов, характерных для биотопа, и в ряде случаев включает феномены контаминации и транслокации. Основное отличие понятия «синдром избыточного бактериального роста» (СИБР) от термина «дисбактериоз кишечника» заключается не столько в терминологических нюансах, сколько в том содержании, которое в него вкладывается: при синдроме избыточного бактериального роста бактерий речь идет не об изменении «микробного пейзажа» толстой кишки, а об изменении состава микрофлоры тонкой кишки (для всех случаев удобнее использовать термин «Дисбиоз» (dysbiosis), т.к. он универсален и используется как у нас, так и за рубежом — ред.)
Синдром избыточного бактериального роста (СИБР) — это обсеменение проксимальных отделов тонкой кишки свыше 104 КОЕ/мл кишечного содержимого за счет условно-патогенной микрофлоры, поступающей из верхних отделов желудочно-кишечного тракта (или верхних дыхательных путей) или вследствие ретроградной транслокации микробиоты толстой кишки.
К причинам синдрома избыточного бактериального роста можно отнести: снижение желудочной секреции, нарушение функции или резекция илеоцекального клапана, нарушение кишечного переваривания и всасывания, нарушение иммунитета, непроходимость кишечника, последствия оперативных вмешательств (синдром приводящей петли, энтероэнтероанастомозы, структурные нарушения стенки кишечника (Парфенов А.И., 1999).
См. отдельно:
Синдром избыточного бактериального роста (СИБР) в тонкой кишке
В практическом отношении следует подчеркнуть, что самостоятельных нозологических единиц — «дисбактериоз» и «синдром избыточного бактериального роста» в Международная классификация болезней десятого пересмотра МКБ-10 (принятой 43-ей Всемирной Ассамблеей Здравоохранения) – нет.
ПРОЯВЛЕНИЯ ДИСБАКТЕРИОЗА ЧЕРЕЗ НАРУШЕНИЕ ФУНКЦИЙ МИКРОБИОТЫ
На рисунке схематически указаны важные функции кишечной микробиоты, нарушение которых созависимо с развитием патологий
Не случайно возникло выражение: «Мы то, что мы едим». Ведь именно микрофлоре принадлежат регуляторные и защитные функции системы пищеварения ЖКТ, а далее (через кровоток) и всего организма в целом. Именно нормофлора обеспечивает усвоение организмом адекватного количества всех полезных нутриентов и вывод из него токсинов, в т.ч. за счет непосредственной утилизации вредных биологически активных соединений.
Для многих может оказаться открытием, но наш иммунитет полностью (!) зависит от состояния микрофлоры желудочно-кишечного тракта. Именно здоровой микрофлоре кишечника (в т.ч. микрофлоре кожных покровов и слизистых) принадлежит ведущая роль (!) в становлении иммунитета у грудных детей и его поддержание в нормальном состоянии у взрослых. Здоровую микрофлору называют нормофлорой.
Нормофлорой называют соотношение разнообразных популяций микробов отдельных органов и систем, поддерживающее биохимическое, метаболическое и иммунологическое равновесие, необходимое для сохранения здоровья человека.
Мало кто знает, что нарушение именно нормофлоры (дисбактериоз), несмотря на свою вторичность, может стать причиной таких болезней, как: аллергические заболевания (атонический дерматит, бронхиальная астма и пр.), частые острые респираторные инфекции, задержка нарастания и падение массы тела, отставание в физическом развитии, стоматит, молочница, пиелиты, холециститы, язвенный колит, энтероколит, вялотекущие пневмонии, а также различные алиментарные заболевания (т.к. бактерии непосредственно регулируют пищеварительные процессы, в т.ч. процессы кишечного всасывания наиважнейших микронутриентов — витминов и минералов).
Сегодня микрофлора ЖКТ уже рассматривается как своеобразный самостоятельный орган в организме хозяина. Уже доказано, что количество и соотношение различных видов микроорганизмов в кишечнике в той или иной степени влияет на состояние абсолютно всех (!) основных жизненных систем нашего организма, к которым относятся: 1. Иммунная система, 2. Сердечно-сосудистая система, 3. Центральная нервная система, 4. Пищеварительная система, 5. Мочеполовая система, 6. Дыхательная и 7. Опорно-двигательная.
Важно!

Итак, согласно ОСТу 91500.11.0004-2003, дисбактериоз кишечника рассматривается как клинико-лабораторный синдром, возникающий при ряде заболеваний и клинических ситуаций, характеризующийся изменением качественного и / или количественного состава нормальной микрофлоры, метаболическими и иммунными нарушениями, сопровождающимися у части больных клиническими проявлениями.
Считается, что дисбактериоз кишечника всегда вторичен и опосредован основным заболеванием. Именно этим объясняется отсутствие такого диагноза, как «дисбиоз» или «дисбактериоз кишечника» в Международном классификаторе заболеваний человека (МКБ-10), принятом в нашей стране, как и во всем мире. Необходимо, прежде всего, устранить вызывающие дисбактериоз кишечника причины или лечить основное заболевание.
Опосредованность дисбактериоза только лишь заболеваниями из МКБ-10 — весьма неверное утверждение.
Потребление некачественных или вредных пищевых продуктов, неблагоприятная окружающая среда, психо-физические нагрузки, в т.ч. режим сна и отдыха — все это и многое другое, что нельзя назвать болезнью, может так или иначе вызывать дисбиоз, который в свою очередь уже может привести к серьезным патологическим состояниям.
Стоит отметить, что в коррекции кишечной микробиоты современные врачи видят один из обязательных методов профилактики и лечения многих болезней. Это подтверждается тем, что без устранения дисбиозов сегодня трудно добиться позитивных результатов в лечении патологий по таким направлениям, как гастроэнтерология, дерматология, урология, гинекология, репродуктология, педиатрия, отоларингология.
По данным литературы, можно констатировать, что у 100 % больных как с патологией ЖКТ, так и при патологии других органов и систем диагностируются значительные изменения со стороны микрофлоры и ее активности.
При хронических заболеваниях расстройство процесса всасывания в кишечнике обусловлено дистрофическими, атрофическими и склеротическими изменениями эпителия и слизистой оболочки кишки. При этом укорачиваются и уплощаются ворсины и крипты, уменьшается число микроворсинок, в стенке кишки разрастается фиброзная ткань, нарушается крово- и лимфообращение. Уменьшение общей всасывательной поверхности и всасывательной способности приводит к нарушению процессов кишечного всасывания.
Этот патологический процесс характеризуется истончением слизистой оболочки кишки, потерей дисахаридаз щеточной каемкой, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишечнику.
Среди наиболее частых причин дисбактериоза толстой кишки можно выделить:
1..Неблагоприятные внешние воздействия, ослабляющие защитные механизмы организма: экстремальные климатогеографические условия, загрязнение биосферы ксенобиотиками (бытовыми и промышленными загрязнителями), ионизирующая радиация, рентгенотерапия и рентгенологические исследования, хирургические вмешательства, терапия химиопрепаратами, антибиотиками, иммунодепрессантами, стероидными гормонами.
2..Неполноценное питание, стресс.
3..Инфекционные заболевания.
4..Течение хронических заболеваний: заболеваний желудка, протекающих с ахлоргидрией, синдром раздраженного кишечника, хронического панкреатита, В12-фолиеводефицитной анемии, злокачественных новообразований, резекции желудка и тонкой кишки, нарушения перистальтики, ревматические заболевания, сахарный диабет и др. Отрицательные проявления дисбиозной микрофлоры приведены в табл. 1.
Табл. 1. Отрицательные проявления дисбиозной микрофлоры
|
Функция |
Механизм реализации |
|
Источник инфекции |
Гнойно-септические и др. болезни |
|
Сенсибилизирующая |
Аллергические проявления |
|
Банк генов, часто ассоциированных с «островами» патогенности и лекарственной устойчивостью |
Формирование патогенных клонов путем конъюгации, трансдукции и трансформации |
|
Мутагенная и канцерогенная активность |
Возникновение и развитие опухолей |
При превышении некоторой пороговой величины отрицательно воздействующих на организм токсических факторов микробиоценоз выходит из состояния равновесия, что приводит к развитию микроэкологических и иммунных нарушений. Рост и развитие условно-патогенных микробов может быть связан с формированием измененных клонов, несущих генетические детерминанты «островов» патогенности и генов лекарственной устойчивости, ассоциированных с адгезивными, цитотоксическими и энтеротоксическими свойствами бактерий.
Типичные микроэкологические нарушения при дисбиозе кишечника у взрослых представлены в табл. 2.
*Табл. 2. Степени микробиологических нарушений при дисбактериозе кишечника у взрослых
|
Возраст |
Характер изменений |
|
1-я степень микробиологических нарушений |
|
|
До 60 лет |
Снижение содержания бифидобактерий до 108–107 КОЕ/г, лактобактерий до 106–105 КОЕ/г, типичных эшерихий до 106–105 КОЕ/г, возможно повышение содержания типичных эшерихий до 109–1010 КОЕ/г |
|
Старше 60 лет |
Снижение содержания бифидобактерий до 107–106 КОЕ/г, лактобактерий до 105–104 КОЕ/г, типичных эшерихий до 106–105 КОЕ/г, возможно повышение содержания типичных эшерихий до 109–1010 КОЕ/г |
|
2-я степень микробиологических нарушений |
|
|
До 60 лет |
Снижение содержания бифидобактерий до 107 и ниже КОЕ/г, лактобактерий до 105 и ниже КОЕ/г, повышение содержания гемолитических эшерихий или других условно-патогенных бактерий до концентрации 105–107 КОЕ/г или обнаружение ассоциаций условно-патогенных микроорганизмов в концентрации 104–105 КОЕ/г |
|
Старше 60 лет |
Снижение содержания бифидобактерий до 106 и ниже КОЕ/г, лактобактерий до 104 и ниже КОЕ/г; повышение содержания гемолитических эшерихий или других условно-патогенных бактерий до концентрации 104–105 КОЕ/г |
|
3-я степень микробиологических нарушений |
|
|
До 60 лет |
Снижение содержания бифидобактерий до 107 и ниже КОЕ/г, лактобактерий до 105 КОЕ/г и ниже, обнаружение ассоциаций условно-патогенных микроорганизмов в концентрации 106–107 КОЕ/г и выше |
|
Старше 60 лет |
Снижение содержания бифидобактерий до 106 и ниже КОЕ/г, лактобактерий до 104 и ниже КОЕ/г, обнаружение ассоциаций условно-патогенных микроорганизмов в концентрации 106–107 КОЕ/г и выше |
Небольшое отступление (комментарий)
*В таблице 1 при описании степеней микробиолологических нарушений «упор» сделан на бифидофлору, т.к. часто (особенно при различных патологиях) наблюдается тотальное уменьшение ее представителей в ЖКТ, особенно если речь касается толстого кишечника. Однако это очень упрощенное представление о дисбиозе кишечника и дается лишь как пример, т.к. в реальности затрагивается обширный класс микроорганизмов, и для каждого случая (патологии), в т.ч. для каждого участка пишеварительного тракта, имеется свой «микробный пейзаж». В этом можно убедиться, посетив раздел о газовой хроматографии масс-спектрометрии микробных маркеров (ГХ-МС) — методике выявления дисбиотических нарушений микробиоты в различных биотопах организма. Там можно ознакомиться и с другими проявлениями дисбактериоза, которые характеризуются иными изменениями в балансе микроорганизмов, связанными с различными патологиями. Более детально об этом можно узнать из раздела литературы по ГХ-МС для врачей. Есть также обзорные статьи, где систематизированы данные о дисбиозе и роли микробиоты в патогенезе болезней.
Для примера, ниже на рисунке изображена диаграмма, показывающая дисбиотические изменения в тонком кишечнике по результатам МСММ.
На рисунке: Диаграмма масс-спектрометрии микробных маркеров в крови у больных себорейным дерматитом
Продолжение…
Фазы и стадии дисбактериоза
Различают фазы и стадии синдрома дисбактериоза кишечника (табл. 3). При субкомпенсированной и, особенно, декомпенсированной стадиях дисбактериоза кишечника наиболее часто происходят снижение колонизационной резистентности и угнетение функций иммунной системы организма с возникновением дисметаболических состояний и извращенных иммунологических реакций.
Табл. 3. Фазы и стадии дисбактериоза кишечника
|
Фаза |
Стадии |
|
Латентная (субклиническая) |
Компенсированная |
|
Клиническая |
Субкомпенсированная |
|
Клиническая |
Декомпенсированная |
Параллелизм клинических проявлений и степени выраженности дисбиотических изменений имеется не всегда. В ряде случаев при выраженных нарушениях в микрофлоре кишечника никаких клинических проявлений нет, и наоборот – выраженные клинические проявления сопровождаются незначительными изменениями в микрофлоре.
Клинические проявления дисбактериоза зависят от нарушений в микрофлоре макроорганизма (варианта лидирующего условнопатогенного агента или их ассоциации) и от его компенсаторных возможностей. Причины появления симптомов заболевания – снижение колонизационной резистентности слизистой кишечника, снижение детоксикационной функции кишечной микрофлоры, нарушение иммунного статуса организма.
Основными клиническими проявлениями дисбактериоза кишечника являются:
нарушение общего состояния (интоксикация, обезвоживание); снижение массы тела; симптомы поражения слизистых оболочек желудочно-кишечного тракта; нарушения пищеварения в различных отделах желудочно-кишечного тракта.
Клинические проявления дисбактериоза кишечника у взрослых:
I. Симптомы со стороны желудочнокишечного тракта:
- снижение или отсутствие аппетита, металлический привкус во рту;
- тошнота, рвота;
- боль в животе (тупая или схваткообразная) самостоятельная и при пальпации;
- отрыжка, аэрофагия;
- метеоризм, урчание, вздутие живота;
- чувство неполного опорожнения кишечника, императивные позывы на дефекацию;
- запор, понос, чередование запора и поноса;
- каловые массы:
- в виде пробкообразного стула (кашицеобразный или жидкий кал с твердой первой порцией его, иногда с примесью слизи);
- овечий кал (при запоре) с примесью слизи;
- гнилостный или кислый запах каловых масс.
II. Гиповитаминоз: заеды, сухость кожи и слизистых.
III. Аллергический синдром: зуд кожи и слизистых, аллергические высыпания на коже.
IV. Общие симптомы: утомляемость, слабость, головные боли, нарушение сна.
Прим. ред.: Согласно новейшим исследованиям, живущие в кишечнике человека бактерии связаны со многими болезнями, в т.ч. раковыми и тяжелыми аутоиммунными заболеваниями, такими как рассеянный склероз, диабет, болезнь Крона, неспецифический язвенный колит и др. При этом наблюдаются значительные изменения в кишечном микробиоме, и в ряде исследований на животных коррекция микрофлоры в положительную сторону изменяла метаболизм и снижала воспалительные процессы. Учёные надеются, что корректируя видовой состав кишечной микрофлоры человека, врачи смогут добиться улучшения состояния больных, и возможно предотвратить развитие этих болезней.
ЛЕЧИТЬ НАДО И СРОЧНО!
КОРРЕКЦИЯ КИШЕЧНОГО МИКРОБИОМА
В лечении дисбактериоза кишечника используются следующие группы препаратов:
антибактериальные средства и антисептики, пробиотики, пребиотики, синбиотики, пищеварительные ферменты, регуляторы моторики кишечника, стимуляторы реактивности организма, энтеросорбенты.
Для стабилизации нормальной микрофлоры применяются препараты, которые принято подразделять на пробиотики, пребиотики и синбиотики.
Микроорганизмы, входящие в состав пробиотиков, непатогенны, нетоксичны, содержатся в достаточном количестве, сохраняют жизнеспособность при прохождении через ЖКТ и при хранении. Темы пробиотиков, пребиотиков и синбиотиков рассмотрены в других разделах сайта. Отметим лишь, что одними из эффективных биокорректоров являются препараты-пробиотики с физиологичными для человека бифидобактериями, а также классическими (молочными) пропионовокислыми бактериями (ПКБ), обладающими бифидогенными свойствами.
Действующее начало бифидопрепаратов – это живые клетки бифидобактерий, которые обладают антагонистической активностью в отношении широкого спектра патогенных и условно-патогенных бактерий, основное назначение – обеспечение нормализации микрофлоры открытых полостей организма хозяина. Как известно, бо́льшая бифидобактерий располагается в толстой кишке, являясь ее основной пристеночной и просветной микрофлорой. Ранее в многочисленных исследованиях была показана положительная роль бифидобактерий и продуктов их метаболизма – короткоцепочечных жирных кислот в регуляции перистальтики кишечника. Отмечено, например, что препараты со штаммами Bifidobacterium longum, эффективны в лечебных и профилактических целях для коррекции частоты и улучшения консистенции стула, как при функциональных кишечных расстройствах, так и у практически здоровых людей. Одним из таких препаратов является Концентрат бифидобактерий жидкий, содержащий биомасу бифидобактерий Bifidobacterium longum B379M в активной форме.
Использовался материал: Бакумов П.А., Козыренко Ю.В., Скиндер О.А., Кочетова Е.И.. Проблема дисбактериоза кишечника. Основные подходы к коррекции / Лекарственный вестник №2 (58), 2015. — Том 9, с.38-43; Минушкин О.Н., Ардатская М.Д. Дисбактериоз (Дисбиоз) кишечника: современное представление, диагностика и лечебная коррекция / Учебно-методическое пособие: ФГУ «УНМЦ» Управления делами Президента РФ. — Москва, 2008, С.50
ПОЧЕМУ ВАЖНО УСТРАНЯТЬ ДИСБАКТЕРИОЗ?
На рисунке обозначены зависимости между различными патологиями и значительными (подтвержденными) изменениями кишечной микробиоты
Итак, нарушения микробной экологии человека называется дисбактериозом (дисбиозом). Дисбактериоз – это снижение количества полезных микроорганизмов и развитие условно-патогенной и патогенной микрофлоры. В профилактике и лечении дисбактериоза важное значение приобрела пробиотикотерапия. О её важности можно судить по тому, какие последствия может вызвать т.н. «вторичный синдром».
Дисбактериоз может быть вызван следующими факторами:
- Нерациональное питание;
- Стрессы
- Фармакологические препараты, особенно антибиотики;
- Красители, пищевые добавки, консерванты, усилители вкуса и др.
- Неблагоприятная экология (воздух, вода и др.);
- Бытовая химия;
- Бытовые приборы;
- Радиация;
- Курение и др. вредные привычки.
Развитие условно-патогенных и патогенных микроорганизмов оказывает вредное воздействие на организм человека:
- Выделяют токсины, которые отравляют организм;
- Вызывают инфекционные заболевания;
- Вызывают метеоризм;
- Разрушают естественный барьер, защищающий организм от аллергенов и токсинов;
- Являются биологическими канцерогенами;
- Подавляют иммунитет;
- Вызывают хронические воспаления стенок кишечника и окружающиъх тканей.
Дисбактериоз нарушает функции организма, снижает его адаптационные возможности и устойчивость к различным внешним факторам. Следует отметить, что в последние годы получены новые данные, свидетельствующие, что при дисбактериозе меняется структура и функции мозга.
Дисбактериоз способен также вызывать (или отягчать) различные заболевания и прочие нарушения гомеостаза в организме (уже как первичный фактор):
- Аллергические реакции
- Развитие атеросклероза
- Развитие диабета 2-го типа
- Нарушение гормонального баланса
- Желудочно-кишечные заболевания
- Подверженность различным бактериально-вирусным инфекциям и простудным заболеваниям
- Плохая усвояемость пищи
- Плохое самочувствие
- Преждевременное старение и др.
Таким образом, дисбактериоз приводит к ухудшению качества жизни человека и сокращает её продолжительность. Это происходит во многом из-за того, что дисбактериоз выступает уже как первичный фактор в плане отягчения сущестующих заболевний, а также развития новых патологий. Вот почему так важно устранять дисбактериоз.
Следует отметить, что в настоящее время по данным Министерства здравоохранения Российской Федерации у 90% населения наблюдается нарушение микробиома и эти нарушения имеют тенденцию к увеличению.
МИКРОБИОТА В НОРМЕ И ПРИ ПАТОЛОГИИ. РОЛЬ ДИСБИОТИЧЕСКОЙ МИКРОБИОТЫ В ПАТОГЕНЕЗЕ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЙ
Как сообщалось, дисбиоз кишечного микробного сообщества связан с некоторыми заболеваниями, включая воспалительные заболевания кишечника [1-3], ожирение [4-6], диабет [7-9], аллергию [10,11], синдром раздраженного кишечника (СРК) [12], колоректальный рак [13-16], цирроз печени [17-19], неалкогольный стеатогепатит [20,21], расстройства нервного развития [22,23], сердечно-сосудистые расстройства [24], желчнокаменная болезнь [25], диарея [26], недоедание [27], болезни почек [28] и полипы толстой кишки [29]. Литература →
Для лучшего понимания темы кишечного дисбактериоза (дисбиоза) необходимо иметь более расширенные знания о микробиоме кишечника и его взаимодействии с организмом хозяина как в норме, так и при патологии. Для этой цели предлагаем ознакомиться с дополнительным материалом, где затронуты такие темы, как ожирение, диабет, воспалительные заболевания кишечника, инсулинорезистентность, неалкогольная жировая болезнь печени, сердечно-сосудистые заболевания и т.д.
Дополнительный материал:
Обновляемая информация: Новости и обзор литературы
Основные постоянные ссылки:
МИКРОБИОМ и ВЗК
МИКРОБИОМ И РАК
МИКРОБИОМ, СЕРДЦЕ И СОСУДЫ
МИКРОБИОМ И ПЕЧЕНЬ
МИКРОБИОМ И ПОЧКИ
МИКРОБИОМ И ЛЕГКИЕ
МИКРОБИОМ И ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
МИКРОБИОМ И ЩИТОВИДНАЯ ЖЕЛЕЗА
МИКРОБИОМ И КОЖНЫЕ БОЛЕЗНИ
МИКРОБИОМ И КОСТИ
МИКРОБИОМ И ОЖИРЕНИЕ
МИКРОБИОМ И САХАРНЫЙ ДИАБЕТ
МИКРОБИОМ И ФУНКЦИИ МОЗГА
Кое-что архивное:
- Микробиота кишечника и хроническое системное воспаление низкой степени
- Взаимодействие между иммунной системой и микробиотой при воспалительных заболеваниях кишечника
- Синдром раздраженного кишечника и кишечный микробиом
- Болезни, лекарства и дисбактериоз: понимание микробных сигнатур при метаболических заболеваниях и медицинских вмешательствах
- Кишечный дисбиоз и иммунометаболические нарушения
- Дисбиотическое нарушение кишечной проницаемости
- Роль кишечной микробиоты в гомеостазе кишечника и заболеваниях человека
- Взаимосвязь между различными патологиями и изменениями кишечной микробиоты
- Роль микробиоты в иммунитете и воспалении
- ВЗК, микробиота и иммунитет слизистой оболочки
- Микробиом, метаболом и воспалительное заболевание кишечника (ВЗК)
- Дисбиоз кишечника во время гриппа способствует легочной пневмококковой суперинфекции через измененную продукцию КЦЖК, в частности, уксусной кислоты
- Неалкогольная жировая болезнь печени (НАЖБП), микробиом и пробиотики
- Эффективность пробиотиков и синбиотиков в профилактике хирургических инфекций
- Дисбиоз кишечника и хроническая болезнь почек
- Микробиота и иммуноопосредованные кожные заболевания
- Микробиомная ассоциация с воспалением и болью коленного сустава (микробиом может стать терапевтической мишенью при боли в суставах, связанной с остеоартрозом)
- Пробиотики и пребиотики для улучшения состояния при СД 1 типа
- Дисбиоз и развитие сахарного диабета 2-го типа
- Влияние кишечной микробиоты на здоровье поджелудочной железы (панкреатит, диабет, рак)
- Роль кишечной микробиоты при этиопатогенезе ВЗК
- Рак толстой кишки и кишечные бактерии
- Рак молочной железы и его связь с микробиотой
- Кишечный микробиом и сердечно-сосудистые заболевания.
- Кишечный микробиом и нервная анорексия
- Формирование кишечной микробиоты ребенка
- Влияние микрофлоры на функции мозга
- Остеоартрит кисти и кишечный дисбактериоз
- Взаимосвязи между микробиомами полости рта и кишечника
- Связь между дисбактериозом кишечника, вызванным диетой с высоким содержанием жиров, и потерей слуха
Получить больше информации о понятии «микробиом» и его функциональной роли в норме и при патологии в организме можно также из дополнительного подраздела в разделе «Микробиом человека«, а также из др. разделов и статей на нашем сайте, по запросу в поиске по сайту
Известно, что кишечный дисбиоз проявляется при самых различных патологиях и усугубляет течение заболеваний. Во многих исследованиях дисбактериоз рассматривается как потенциальная мишень для пробиотикотерапии, с целью улучшения состояния пациента. Отдельный интерес здесь вызывают т.н. аутоиммунные заболевания, о части из которых выше уже даны ссылки (например, ВЗК, Диабет 1 типа, артрит). Дополнительно о данных патологических состояниях (например, о системной красной волчанке, целиакии и т.п.) и сопутствующем им дисбактериозе можно ознакомиться в разделе «Микрофлора и аутоиммунные заболевания«.
К разделу: Микробиом человека
Ранние статьи о дисбактериозе:
- Общие сведения о дисбактериозе
- Дисбиоз как синдром общей или экологической патологии
- Дисбактериоз – что это? (pdf)
ПАРУ СЛОВ О ЗАПОРАХ, ДИАРЕЕ
Запор или диарея, являясь следствием дисбактериоза и взаимообуславливающих синдромов и заболеваний, таких как: синдром раздраженного кишечника (СРК) — это расстройство моторики кишечника, антибиотико-ассоциированная диарея, инфекционная диарея, воспалительные заболевания кишечника, диарея путешественников, синдром «ленивого кишечника» и т.д. эффективно устраняются при помощи пробиотиков. Бесспорно, что для лечения и профилактики острой и хронической диареи различного генеза целесообразно назначать препараты, влияющие на микробный пейзаж кишечника, т.е. пробиотики, ингибирующие рост патогенных бактерий. Эти микроорганизмы при естественном способе введения оказывают положительное действие на физиологические и метаболические функции, а также биохимические и иммунные реакции организма хозяина через оптимизацию его микроэкологического статуса.
АНАЛИЗЫ НА ДИСБАКТЕРИОЗ
1. Анализ кала на дисбактериоз
Если вдруг Вы заподозрили у себя симптомы дисбактериоза (особенно при диарее, подозрении на опасную кишечную инфекцию), то сегодня при желании можно, а иногда срочно необходимо сделать анализ кала (микрофлоры толстого кишечника) на дисбактериоз (на наличие патогенов), т.е. сделать бактериологический посев. Если же проблемы со здоровьем имеются, но не имеют очевидных (выявленных) причин, в т.ч. очевидной связи с состоянием кишечной микрофлоры, (не выражаются проблемами со стулом и др. аномальными проявлениями со стороны ЖКТ), однако накопившиеся данные научных (медицинских) исследований подобную связь отслеживают, то анализ кишечной микробиоты может стать незаменимым инструментом (здесь многое зависит от квалификации лечащего врача) в диагностике заболевания. При этом следует учесть, что проблема с кишечным микробиомом состоит в том, что мы можем выращивать в лаборатории менее 5% видов микробов, остальные просто слишком привередливы (хотя это спорный вопрос). Именно поэтому, для подобной диагностики бакпосев, как культурально зависимый способ анализа микробиоты не подходит. Здесь нужны культурально независимые методы исследования.
2. Анализ кишечной микробиоты с помощью культурально независимых методов исследования

Литература:
- Manichanh C, et al. Reduced diversity of faecal microbiota in Crohn’s disease revealed by a metagenomic approach. Gut 2006; 55: 205-211 [PMID: 16188921 DOI: 10.1136/ gut.2005.073817]
- Ray K. et al. IBD. Understanding gut microbiota in new-onset Crohn’s disease. Nat Rev Gastroenterol Hepatol 2014; 11: 268
- Bye W, et al. Overgrowth of the indigenous gut microbiome and irritable bowel syndrome. World J Gastroenterol 2014; 20: 2449-2455
- Le Chatelier E, et al. Richness of human gut microbiome correlates with metabolic markers. Nature 2013; 500: 541-546
- Tarantino G. Gut microbiome, obesity-related comorbidities, and low-grade chronic inflammation. J Clin Endocrinol Metab 2014; 99: 2343-2346
- Ohtani N, Yoshimoto S, Hara E. Obesity and cancer: a gut microbial connection. Cancer Res 2014; 74: 1885-1889
- Qin J, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 2012; 490: 55-60
- de Goffau MC, et al. Aberrant gut microbiota composition at the onset of type 1 diabetes in young children. Diabetologia 2014; 57: 1569-1577
- Tilg H, Moschen AR. Microbiota and diabetes: an evolving relationship. Gut 2014; 63: 1513-1521
- Abrahamsson TR, et al. Low diversity of the gut microbiota in infants with atopic eczema. J Allergy Clin Immunol 2012; 129: 434-440, 440.e1-e2
- Abrahamsson TR, et al. Low gut microbiota diversity in early infancy precedes asthma at school age. Clin Exp Allergy 2014; 44: 842-850
- Carroll IM, et al. Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome. Neurogastroenterol Motil 2012; 24: 521-530, e248
- Ahn J, et al. Human gut microbiome and risk for colorectal cancer. J Natl Cancer Inst 2013; 105: 1907-1911
- Ou J, et al. Diet, microbiota, and microbial metabolites in colon cancer risk in rural Africans and African Americans. Am J Clin Nutr 2013; 98: 111-120
- Candela M, et al. Inflammation and colorectal cancer, when microbiota-host mutualism breaks. World J Gastroenterol 2014; 20: 908-922
- Yang T, et al. Microbiota impact on the epigenetic regulation of colorectal cancer. Trends Mol Med 2013; 19: 714-725
- Chen Y, et al. Characterization of fecal microbial communities in patients with liver cirrhosis. Hepatology 2011; 54: 562-572
- Wei X, et al. Abnormal fecal microbiota community and functions in patients with hepatitis B liver cirrhosis as revealed by a metagenomic approach. BMC Gastroenterol 2013; 13: 175
- Qin N, et al. Alterations of the human gut microbiome in liver cirrhosis. Nature 2014; 513: 59-64
- Zhu L, et al. Characterization of gut microbiomes in nonalcoholic steatohepatitis (NASH) patients: a connection between endogenous alcohol and NASH. Hepatology 2013; 57: 601-609
- Miura K, et al. Role of gut microbiota and Tolllike receptors in nonalcoholic fatty liver disease. World J Gastroenterol 2014; 20: 7381-7391
- Hsiao EY, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell 2013; 155: 1451-1463
- Flight MH. Neurodevelopmental disorders: the gutmicrobiome- brain connection. Nat Rev Neurosci 2014; 15: 65
- Karlsson FH, et al. Symptomatic atherosclerosis is associated with an altered gut metagenome. Nat Commun 2012; 3: 1245
- Wu T, et al. Gut microbiota dysbiosis and bacterial community assembly associated with cholesterol gallstones in large-scale study. BMC Genomics 2013; 14: 669
- Pop M, et al. Diarrhea in young children from low-income countries leads to large-scale alterations in intestinal microbiota composition. Genome Biol 2014; 15: R76
- Subramanian S, et al. Persistent gut microbiota immaturity in malnourished Bangladeshi children. Nature 2014; 510: 417-421
- Ramezani A, et al. The gut microbiome, kidney disease, and targeted interventions. J Am Soc Nephrol 2014; 25: 657-670
- Brim H, et al. Microbiome analysis of stool samples from African Americans with colon polyps. PLoS One 2013; 8: e81352
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИКАРДИО
- ПРОБИОТИКИ С ПНЖК
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА ЖКТ
- ДИСБИОЗ КИШЕЧНИКА
- МИКРОБИОМ и ВЗК
- МИКРОБИОМ И РАК
- МИКРОБИОМ, СЕРДЦЕ И СОСУДЫ
- МИКРОБИОМ И ПЕЧЕНЬ
- МИКРОБИОМ И ПОЧКИ
- МИКРОБИОМ И ЛЕГКИЕ
- МИКРОБИОМ И ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И ЩИТОВИДНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И КОЖНЫЕ БОЛЕЗНИ
- МИКРОБИОМ И КОСТИ
- МИКРОБИОМ И ОЖИРЕНИЕ
- МИКРОБИОМ И САХАРНЫЙ ДИАБЕТ
- МИКРОБИОМ И ФУНКЦИИ МОЗГА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОБИОМ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- КОРОТКОЦЕПОЧЕЧНЫЕ ЖИРНЫЕ КИСЛОТЫ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- МИКРОБИОМ И ПРЕЦИЗИОННОЕ ПИТАНИЕ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ