Как правильно пишется словосочетание «иммунная система»
- Как правильно пишется слово «иммунный»
- Как правильно пишется слово «система»
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: выскребенный — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «система»
Синонимы к словосочетанию «иммунная система»
Предложения со словосочетанием «иммунная система»
- Лейкоциты – это клетки иммунной системы человека, которые отвечают за защиту нашего организма.
- Природные свойства чеснока и лука излечивают болезнь и в тоже время активизируют работу иммунной системы организма.
- Кроме того, все виды грибов нарушают работу иммунной системы организма, что увеличивает склонность к паразитарным инфекциям и онкологии.
- (все предложения)
Цитаты из русской классики со словосочетанием «иммунная система»
- — Знаю, слышал… Только я хотел бы сказать тебе слова два о твоей системе.
- Японцы так хорошо устроили у себя внутреннее управление, что совет не может сделать ничего без сиогуна, сиогун без совета и оба вместе без удельных князей. И так система их держится и будет держаться на своих искусственных основаниях до тех пор, пока не помогут им ниспровергнуть ее… американцы или хоть… мы!
- Система залогов и перезалогов, продажа лесных и других угодий, находившая при покойном Петьке лишь робкое себе применение, сделалась основанием всех финансовых операций Ольги Сергеевны.
- (все
цитаты из русской классики)
Сочетаемость слова «система»
- нервная система
солнечная система
иммунная система - система управления
система образования
система безопасности - работа нервной системы
создание системы
развитие системы - система работает
система рухнет
система существует - создать систему
войти в систему
иметь систему - (полная таблица сочетаемости)
Значение словосочетания «иммунная система»
-
Имму́нная систе́ма — система органов, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознаёт множество разнообразных возбудителей — от вирусов до паразитических червей — и отличает их от биомолекул собственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина. (Википедия)
Все значения словосочетания ИММУННАЯ СИСТЕМА
Афоризмы русских писателей со словом «система»
- Создать язык невозможно, ибо его творит народ; филологи только открывают его законы и приводят их в систему, а писатели только творят на нем сообразно с сими законами.
- Свое собственное, вольное и свободное хотенье, свой собственный, хотя бы и самый дикий каприз, своя фантазия, раздраженная иногда хоть бы даже до сумасшествия, — вот это-то все и есть та самая, самая выгодная выгода, которая ни под какую классификацию не подходит и от которой все теории и системы постоянно разлетаются к черту. И с чего это взяли все эти мудрецы, что человеку надо какого-то нормального, какого-то добродетельного хотения? С чего это непременно вообразили они, что человеку надо непременно благоразумно выгодного хотенья? Человеку надо — одного самостоятельного хотенья, чего бы эта самостоятельность ни стоила и к чему бы ни привела.
- Англичанин молчалив, равнодушен, говорит, как читает, не обнаруживая никогда быстрых душевных стремлений, которые потрясают электрически всю нашу физическую систему.
- (все афоризмы русских писателей)
Отправить комментарий
Дополнительно
The immune system is a network of biological processes that protects an organism from diseases. It detects and responds to a wide variety of pathogens, from viruses to parasitic worms, as well as cancer cells and objects such as wood splinters, distinguishing them from the organism’s own healthy tissue. Many species have two major subsystems of the immune system. The innate immune system provides a preconfigured response to broad groups of situations and stimuli. The adaptive immune system provides a tailored response to each stimulus by learning to recognize molecules it has previously encountered. Both use molecules and cells to perform their functions.
Nearly all organisms have some kind of immune system. Bacteria have a rudimentary immune system in the form of enzymes that protect against virus infections. Other basic immune mechanisms evolved in ancient plants and animals and remain in their modern descendants. These mechanisms include phagocytosis, antimicrobial peptides called defensins, and the complement system. Jawed vertebrates, including humans, have even more sophisticated defense mechanisms, including the ability to adapt to recognize pathogens more efficiently. Adaptive (or acquired) immunity creates an immunological memory leading to an enhanced response to subsequent encounters with that same pathogen. This process of acquired immunity is the basis of vaccination.
Dysfunction of the immune system can cause autoimmune diseases, inflammatory diseases and cancer. Immunodeficiency occurs when the immune system is less active than normal, resulting in recurring and life-threatening infections. In humans, immunodeficiency can be the result of a genetic disease such as severe combined immunodeficiency, acquired conditions such as HIV/AIDS, or the use of immunosuppressive medication. Autoimmunity results from a hyperactive immune system attacking normal tissues as if they were foreign organisms. Common autoimmune diseases include Hashimoto’s thyroiditis, rheumatoid arthritis, diabetes mellitus type 1, and systemic lupus erythematosus. Immunology covers the study of all aspects of the immune system.
Layered defense[edit]
The immune system protects its host from infection with layered defenses of increasing specificity. Physical barriers prevent pathogens such as bacteria and viruses from entering the organism.[1] If a pathogen breaches these barriers, the innate immune system provides an immediate, but non-specific response. Innate immune systems are found in all animals.[2] If pathogens successfully evade the innate response, vertebrates possess a second layer of protection, the adaptive immune system, which is activated by the innate response.[3] Here, the immune system adapts its response during an infection to improve its recognition of the pathogen. This improved response is then retained after the pathogen has been eliminated, in the form of an immunological memory, and allows the adaptive immune system to mount faster and stronger attacks each time this pathogen is encountered.[4][5]
| Innate immune system | Adaptive immune system |
|---|---|
| Response is non-specific | Pathogen and antigen specific response |
| Exposure leads to immediate maximal response | Lag time between exposure and maximal response |
| Cell-mediated and humoral components | Cell-mediated and humoral components |
| No immunological memory | Exposure leads to immunological memory |
| Found in nearly all forms of life | Found only in jawed vertebrates |
Both innate and adaptive immunity depend on the ability of the immune system to distinguish between self and non-self molecules. In immunology, self molecules are components of an organism’s body that can be distinguished from foreign substances by the immune system.[6] Conversely, non-self molecules are those recognized as foreign molecules. One class of non-self molecules are called antigens (originally named for being antibody generators) and are defined as substances that bind to specific immune receptors and elicit an immune response.[7]
Surface barriers[edit]
Several barriers protect organisms from infection, including mechanical, chemical, and biological barriers. The waxy cuticle of most leaves, the exoskeleton of insects, the shells and membranes of externally deposited eggs, and skin are examples of mechanical barriers that are the first line of defense against infection.[8] Organisms cannot be completely sealed from their environments, so systems act to protect body openings such as the lungs, intestines, and the genitourinary tract. In the lungs, coughing and sneezing mechanically eject pathogens and other irritants from the respiratory tract. The flushing action of tears and urine also mechanically expels pathogens, while mucus secreted by the respiratory and gastrointestinal tract serves to trap and entangle microorganisms.[9]
Chemical barriers also protect against infection. The skin and respiratory tract secrete antimicrobial peptides such as the β-defensins.[10] Enzymes such as lysozyme and phospholipase A2 in saliva, tears, and breast milk are also antibacterials.[11][12] Vaginal secretions serve as a chemical barrier following menarche, when they become slightly acidic, while semen contains defensins and zinc to kill pathogens.[13][14] In the stomach, gastric acid serves as a chemical defense against ingested pathogens.[15]
Within the genitourinary and gastrointestinal tracts, commensal flora serve as biological barriers by competing with pathogenic bacteria for food and space and, in some cases, changing the conditions in their environment, such as pH or available iron. As a result, the probability that pathogens will reach sufficient numbers to cause illness is reduced.[16]
Innate immune system[edit]
Microorganisms or toxins that successfully enter an organism encounter the cells and mechanisms of the innate immune system. The innate response is usually triggered when microbes are identified by pattern recognition receptors, which recognize components that are conserved among broad groups of microorganisms,[17] or when damaged, injured or stressed cells send out alarm signals, many of which are recognized by the same receptors as those that recognize pathogens.[18] Innate immune defenses are non-specific, meaning these systems respond to pathogens in a generic way.[19] This system does not confer long-lasting immunity against a pathogen. The innate immune system is the dominant system of host defense in most organisms,[2] and the only one in plants.[20]
Immune sensing[edit]
Cells in the innate immune system use pattern recognition receptors to recognize molecular structures that are produced by pathogens.[21] They are proteins expressed, mainly, by cells of the innate immune system, such as dendritic cells, macrophages, monocytes, neutrophils and epithelial cells[19][22] to identify two classes of molecules: pathogen-associated molecular patterns (PAMPs), which are associated with microbial pathogens, and damage-associated molecular patterns (DAMPs), which are associated with components of host’s cells that are released during cell damage or cell death.[23]
Recognition of extracellular or endosomal PAMPs is mediated by transmembrane proteins known as toll-like receptors (TLRs).[24] TLRs share a typical structural motif, the leucine rich repeats (LRRs), which give them a curved shape.[25] Toll-like receptors were first discovered in Drosophila and trigger the synthesis and secretion of cytokines and activation of other host defense programs that are necessary for both innate or adaptive immune responses. Ten toll-like receptors have been described in humans.[26]
Cells in the innate immune system have pattern recognition receptors, which detect infection or cell damage, inside. Three major classes of these «cytosolic» receptors are NOD–like receptors, RIG (retinoic acid-inducible gene)-like receptors, and cytosolic DNA sensors.[27]
Innate immune cells[edit]
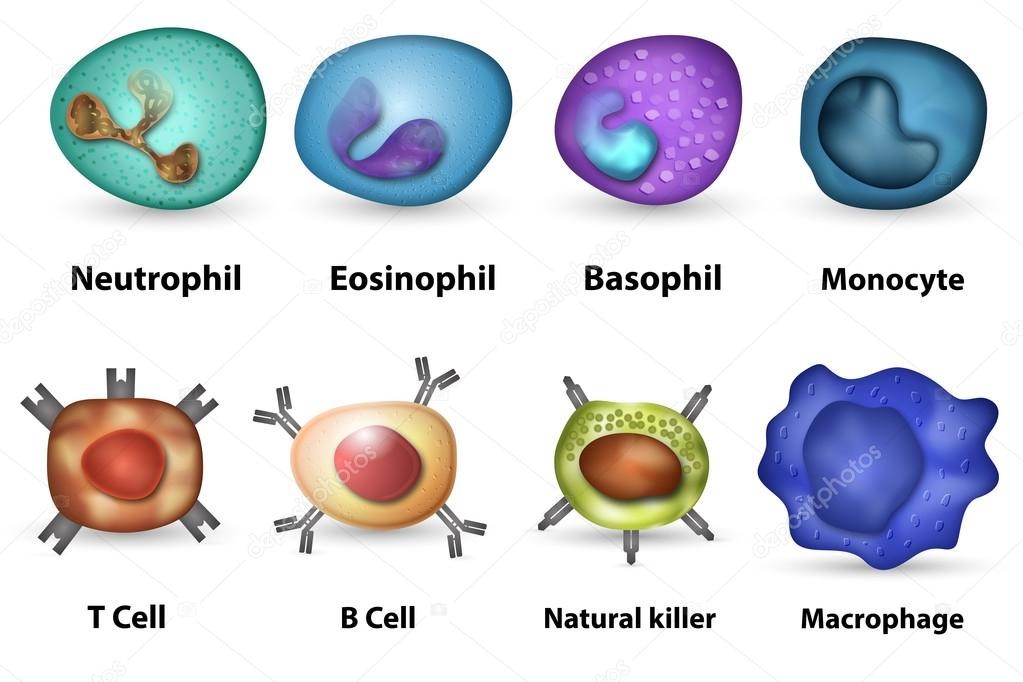
Some leukocytes (white blood cells) act like independent, single-celled organisms and are the second arm of the innate immune system. The innate leukocytes include the «professional» phagocytes (macrophages, neutrophils, and dendritic cells). These cells identify and eliminate pathogens, either by attacking larger pathogens through contact or by engulfing and then killing microorganisms. The other cells involved in the innate response include innate lymphoid cells, mast cells, eosinophils, basophils, and natural killer cells.[28]
Phagocytosis is an important feature of cellular innate immunity performed by cells called phagocytes that engulf pathogens or particles. Phagocytes generally patrol the body searching for pathogens, but can be called to specific locations by cytokines.[29] Once a pathogen has been engulfed by a phagocyte, it becomes trapped in an intracellular vesicle called a phagosome, which subsequently fuses with another vesicle called a lysosome to form a phagolysosome. The pathogen is killed by the activity of digestive enzymes or following a respiratory burst that releases free radicals into the phagolysosome.[30][31] Phagocytosis evolved as a means of acquiring nutrients, but this role was extended in phagocytes to include engulfment of pathogens as a defense mechanism.[32] Phagocytosis probably represents the oldest form of host defense, as phagocytes have been identified in both vertebrate and invertebrate animals.[33]
Neutrophils and macrophages are phagocytes that travel throughout the body in pursuit of invading pathogens.[34] Neutrophils are normally found in the bloodstream and are the most abundant type of phagocyte, representing 50% to 60% of total circulating leukocytes.[35] During the acute phase of inflammation, neutrophils migrate toward the site of inflammation in a process called chemotaxis, and are usually the first cells to arrive at the scene of infection. Macrophages are versatile cells that reside within tissues and produce an array of chemicals including enzymes, complement proteins, and cytokines, while they can also act as scavengers that rid the body of worn-out cells and other debris, and as antigen-presenting cells (APCs) that activate the adaptive immune system.[36]
Dendritic cells are phagocytes in tissues that are in contact with the external environment; therefore, they are located mainly in the skin, nose, lungs, stomach, and intestines.[37] They are named for their resemblance to neuronal dendrites, as both have many spine-like projections. Dendritic cells serve as a link between the bodily tissues and the innate and adaptive immune systems, as they present antigens to T cells, one of the key cell types of the adaptive immune system.[37]
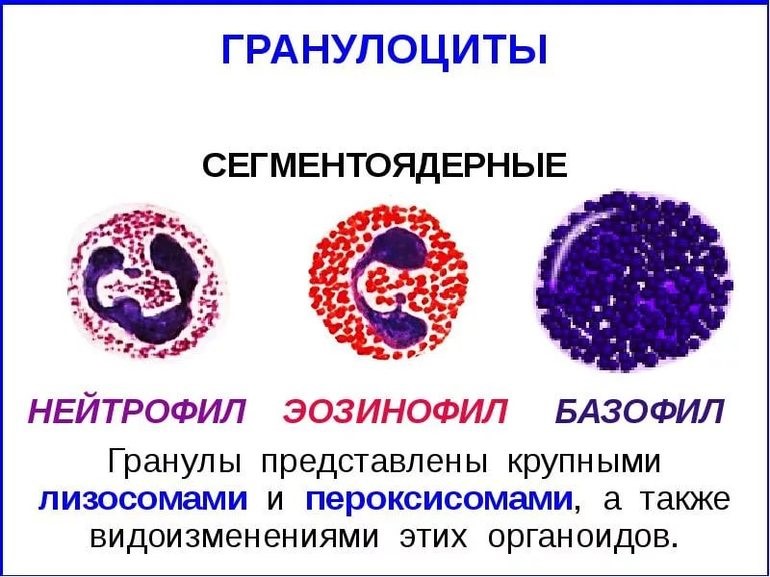
Granulocytes are leukocytes that have granules in their cytoplasm. In this category are neutrophils, mast cells, basophils, and eosinophils. Mast cells reside in connective tissues and mucous membranes, and regulate the inflammatory response.[38] They are most often associated with allergy and anaphylaxis.[35] Basophils and eosinophils are related to neutrophils. They secrete chemical mediators that are involved in defending against parasites and play a role in allergic reactions, such as asthma.[39]
Innate lymphoid cells (ILCs) are a group of innate immune cells that are derived from common lymphoid progenitor and belong to the lymphoid lineage. These cells are defined by absence of antigen specific B or T cell receptor (TCR) because of the lack of recombination activating gene. ILCs do not express myeloid or dendritic cell markers.[40]
Natural killer cells (NK cells) are lymphocytes and a component of the innate immune system which does not directly attack invading microbes.[41] Rather, NK cells destroy compromised host cells, such as tumor cells or virus-infected cells, recognizing such cells by a condition known as «missing self.» This term describes cells with low levels of a cell-surface marker called MHC I (major histocompatibility complex)—a situation that can arise in viral infections of host cells.[42] Normal body cells are not recognized and attacked by NK cells because they express intact self MHC antigens. Those MHC antigens are recognized by killer cell immunoglobulin receptors which essentially put the brakes on NK cells.[43]
Inflammation[edit]
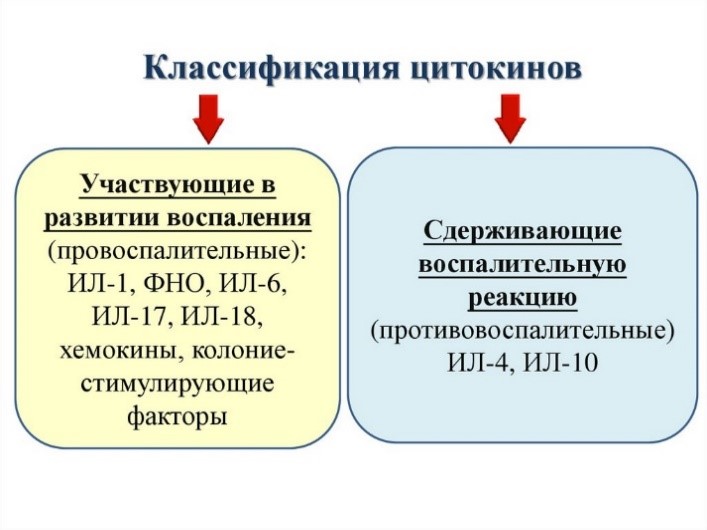
Inflammation is one of the first responses of the immune system to infection.[44] The symptoms of inflammation are redness, swelling, heat, and pain, which are caused by increased blood flow into tissue. Inflammation is produced by eicosanoids and cytokines, which are released by injured or infected cells. Eicosanoids include prostaglandins that produce fever and the dilation of blood vessels associated with inflammation, and leukotrienes that attract certain white blood cells (leukocytes).[45][46] Common cytokines include interleukins that are responsible for communication between white blood cells; chemokines that promote chemotaxis; and interferons that have anti-viral effects, such as shutting down protein synthesis in the host cell.[47] Growth factors and cytotoxic factors may also be released. These cytokines and other chemicals recruit immune cells to the site of infection and promote healing of any damaged tissue following the removal of pathogens.[48] The pattern-recognition receptors called inflammasomes are multiprotein complexes (consisting of an NLR, the adaptor protein ASC, and the effector molecule pro-caspase-1) that form in response to cytosolic PAMPs and DAMPs, whose function is to generate active forms of the inflammatory cytokines IL-1β and IL-18.[49]
Humoral defenses[edit]
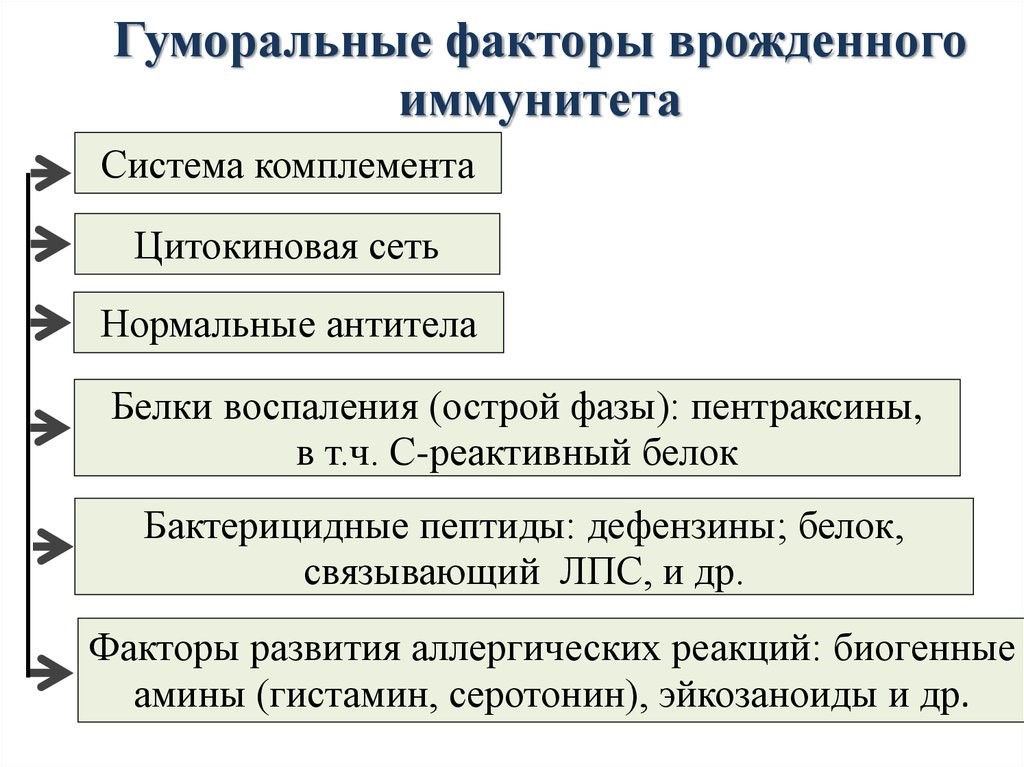
The complement system is a biochemical cascade that attacks the surfaces of foreign cells. It contains over 20 different proteins and is named for its ability to «complement» the killing of pathogens by antibodies. Complement is the major humoral component of the innate immune response.[50][51] Many species have complement systems, including non-mammals like plants, fish, and some invertebrates.[52] In humans, this response is activated by complement binding to antibodies that have attached to these microbes or the binding of complement proteins to carbohydrates on the surfaces of microbes. This recognition signal triggers a rapid killing response.[53] The speed of the response is a result of signal amplification that occurs after sequential proteolytic activation of complement molecules, which are also proteases. After complement proteins initially bind to the microbe, they activate their protease activity, which in turn activates other complement proteases, and so on. This produces a catalytic cascade that amplifies the initial signal by controlled positive feedback.[54] The cascade results in the production of peptides that attract immune cells, increase vascular permeability, and opsonize (coat) the surface of a pathogen, marking it for destruction. This deposition of complement can also kill cells directly by disrupting their plasma membrane.[50]
Adaptive immune system[edit]
Overview of the processes involved in the primary immune response
The adaptive immune system evolved in early vertebrates and allows for a stronger immune response as well as immunological memory, where each pathogen is «remembered» by a signature antigen.[55] The adaptive immune response is antigen-specific and requires the recognition of specific «non-self» antigens during a process called antigen presentation. Antigen specificity allows for the generation of responses that are tailored to specific pathogens or pathogen-infected cells. The ability to mount these tailored responses is maintained in the body by «memory cells». Should a pathogen infect the body more than once, these specific memory cells are used to quickly eliminate it.[56]
Recognition of antigen[edit]
The cells of the adaptive immune system are special types of leukocytes, called lymphocytes. B cells and T cells are the major types of lymphocytes and are derived from hematopoietic stem cells in the bone marrow.[57] B cells are involved in the humoral immune response, whereas T cells are involved in cell-mediated immune response. Killer T cells only recognize antigens coupled to Class I MHC molecules, while helper T cells and regulatory T cells only recognize antigens coupled to Class II MHC molecules. These two mechanisms of antigen presentation reflect the different roles of the two types of T cell. A third, minor subtype are the γδ T cells that recognize intact antigens that are not bound to MHC receptors.[58] The double-positive T cells are exposed to a wide variety of self-antigens in the thymus, in which iodine is necessary for its thymus development and activity.[59] In contrast, the B cell antigen-specific receptor is an antibody molecule on the B cell surface and recognizes native (unprocessed) antigen without any need for antigen processing. Such antigens may be large molecules found on the surfaces of pathogens, but can also be small haptens (such as penicillin) attached to carrier molecule.[60] Each lineage of B cell expresses a different antibody, so the complete set of B cell antigen receptors represent all the antibodies that the body can manufacture.[57] When B or T cells encounter their related antigens they multiply and many «clones» of the cells are produced that target the same antigen. This is called clonal selection.[61]
Antigen presentation to T lymphocytes[edit]
Both B cells and T cells carry receptor molecules that recognize specific targets. T cells recognize a «non-self» target, such as a pathogen, only after antigens (small fragments of the pathogen) have been processed and presented in combination with a «self» receptor called a major histocompatibility complex (MHC) molecule.[62]
Cell mediated immunity[edit]
There are two major subtypes of T cells: the killer T cell and the helper T cell. In addition there are regulatory T cells which have a role in modulating immune response.[63]
Killer T cells[edit]
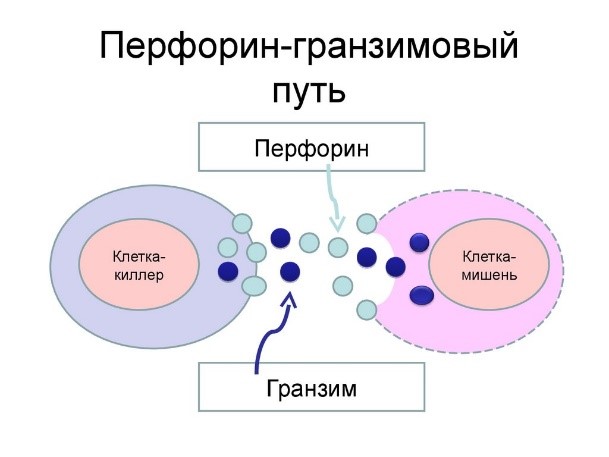
Killer T cells are a sub-group of T cells that kill cells that are infected with viruses (and other pathogens), or are otherwise damaged or dysfunctional.[64] As with B cells, each type of T cell recognizes a different antigen. Killer T cells are activated when their T-cell receptor binds to this specific antigen in a complex with the MHC Class I receptor of another cell. Recognition of this MHC:antigen complex is aided by a co-receptor on the T cell, called CD8. The T cell then travels throughout the body in search of cells where the MHC I receptors bear this antigen. When an activated T cell contacts such cells, it releases cytotoxins, such as perforin, which form pores in the target cell’s plasma membrane, allowing ions, water and toxins to enter. The entry of another toxin called granulysin (a protease) induces the target cell to undergo apoptosis.[65] T cell killing of host cells is particularly important in preventing the replication of viruses. T cell activation is tightly controlled and generally requires a very strong MHC/antigen activation signal, or additional activation signals provided by «helper» T cells (see below).[65]
Helper T cells[edit]
Helper T cells regulate both the innate and adaptive immune responses and help determine which immune responses the body makes to a particular pathogen.[66][67] These cells have no cytotoxic activity and do not kill infected cells or clear pathogens directly. They instead control the immune response by directing other cells to perform these tasks.[68]
Helper T cells express T cell receptors that recognize antigen bound to Class II MHC molecules. The MHC:antigen complex is also recognized by the helper cell’s CD4 co-receptor, which recruits molecules inside the T cell (such as Lck) that are responsible for the T cell’s activation. Helper T cells have a weaker association with the MHC:antigen complex than observed for killer T cells, meaning many receptors (around 200–300) on the helper T cell must be bound by an MHC:antigen to activate the helper cell, while killer T cells can be activated by engagement of a single MHC:antigen molecule. Helper T cell activation also requires longer duration of engagement with an antigen-presenting cell.[69] The activation of a resting helper T cell causes it to release cytokines that influence the activity of many cell types. Cytokine signals produced by helper T cells enhance the microbicidal function of macrophages and the activity of killer T cells.[70] In addition, helper T cell activation causes an upregulation of molecules expressed on the T cell’s surface, such as CD40 ligand (also called CD154), which provide extra stimulatory signals typically required to activate antibody-producing B cells.[71]
Gamma delta T cells[edit]
Gamma delta T cells (γδ T cells) possess an alternative T-cell receptor (TCR) as opposed to CD4+ and CD8+ (αβ) T cells and share the characteristics of helper T cells, cytotoxic T cells and NK cells. The conditions that produce responses from γδ T cells are not fully understood. Like other ‘unconventional’ T cell subsets bearing invariant TCRs, such as CD1d-restricted natural killer T cells, γδ T cells straddle the border between innate and adaptive immunity.[72] On one hand, γδ T cells are a component of adaptive immunity as they rearrange TCR genes to produce receptor diversity and can also develop a memory phenotype. On the other hand, the various subsets are also part of the innate immune system, as restricted TCR or NK receptors may be used as pattern recognition receptors. For example, large numbers of human Vγ9/Vδ2 T cells respond within hours to common molecules produced by microbes, and highly restricted Vδ1+ T cells in epithelia respond to stressed epithelial cells.[58]
Humoral immune response[edit]
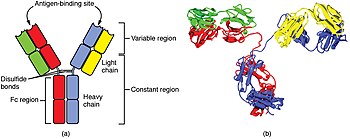
An antibody is made up of two heavy chains and two light chains. The unique variable region allows an antibody to recognize its matching antigen.[73]
A B cell identifies pathogens when antibodies on its surface bind to a specific foreign antigen.[74] This antigen/antibody complex is taken up by the B cell and processed by proteolysis into peptides. The B cell then displays these antigenic peptides on its surface MHC class II molecules. This combination of MHC and antigen attracts a matching helper T cell, which releases lymphokines and activates the B cell.[75] As the activated B cell then begins to divide, its offspring (plasma cells) secrete millions of copies of the antibody that recognizes this antigen. These antibodies circulate in blood plasma and lymph, bind to pathogens expressing the antigen and mark them for destruction by complement activation or for uptake and destruction by phagocytes. Antibodies can also neutralize challenges directly, by binding to bacterial toxins or by interfering with the receptors that viruses and bacteria use to infect cells.[76]
Newborn infants have no prior exposure to microbes and are particularly vulnerable to infection. Several layers of passive protection are provided by the mother. During pregnancy, a particular type of antibody, called IgG, is transported from mother to baby directly through the placenta, so human babies have high levels of antibodies even at birth, with the same range of antigen specificities as their mother.[77] Breast milk or colostrum also contains antibodies that are transferred to the gut of the infant and protect against bacterial infections until the newborn can synthesize its own antibodies.[78] This is passive immunity because the fetus does not actually make any memory cells or antibodies—it only borrows them. This passive immunity is usually short-term, lasting from a few days up to several months. In medicine, protective passive immunity can also be transferred artificially from one individual to another.[79]
Immunological memory[edit]
When B cells and T cells are activated and begin to replicate, some of their offspring become long-lived memory cells. Throughout the lifetime of an animal, these memory cells remember each specific pathogen encountered and can mount a strong response if the pathogen is detected again. This is «adaptive» because it occurs during the lifetime of an individual as an adaptation to infection with that pathogen and prepares the immune system for future challenges. Immunological memory can be in the form of either passive short-term memory or active long-term memory.[80]
Physiological regulation[edit]
The time-course of an immune response begins with the initial pathogen encounter, (or initial vaccination) and leads to the formation and maintenance of active immunological memory.
The immune system is involved in many aspects of physiological regulation in the body. The immune system interacts intimately with other systems, such as the endocrine[81][82] and the nervous[83][84][85] systems. The immune system also plays a crucial role in embryogenesis (development of the embryo), as well as in tissue repair and regeneration.[86]
Hormones[edit]
Hormones can act as immunomodulators, altering the sensitivity of the immune system. For example, female sex hormones are known immunostimulators of both adaptive[87] and innate immune responses.[88] Some autoimmune diseases such as lupus erythematosus strike women preferentially, and their onset often coincides with puberty. By contrast, male sex hormones such as testosterone seem to be immunosuppressive.[89] Other hormones appear to regulate the immune system as well, most notably prolactin, growth hormone and vitamin D.[90][91]
Vitamin D[edit]
Although cellular studies indicate that vitamin D has receptors and probable functions in the immune system, there is no clinical evidence to prove that vitamin D deficiency increases the risk for immune diseases or vitamin D supplementation lowers immune disease risk.[92] A 2011 United States Institute of Medicine report stated that «outcomes related to … immune functioning and autoimmune disorders, and infections … could not be linked reliably with calcium or vitamin D intake and were often conflicting.»[93]: 5
Sleep and rest[edit]
The immune system is affected by sleep and rest, and sleep deprivation is detrimental to immune function.[94] Complex feedback loops involving cytokines, such as interleukin-1 and tumor necrosis factor-α produced in response to infection, appear to also play a role in the regulation of non-rapid eye movement (REM) sleep.[95] Thus the immune response to infection may result in changes to the sleep cycle, including an increase in slow-wave sleep relative to REM sleep.[96]
In people with sleep deprivation, active immunizations may have a diminished effect and may result in lower antibody production, and a lower immune response, than would be noted in a well-rested individual.[97] Additionally, proteins such as NFIL3, which have been shown to be closely intertwined with both T-cell differentiation and circadian rhythms, can be affected through the disturbance of natural light and dark cycles through instances of sleep deprivation. These disruptions can lead to an increase in chronic conditions such as heart disease, chronic pain, and asthma.[98]
In addition to the negative consequences of sleep deprivation, sleep and the intertwined circadian system have been shown to have strong regulatory effects on immunological functions affecting both innate and adaptive immunity. First, during the early slow-wave-sleep stage, a sudden drop in blood levels of cortisol, epinephrine, and norepinephrine causes increased blood levels of the hormones leptin, pituitary growth hormone, and prolactin. These signals induce a pro-inflammatory state through the production of the pro-inflammatory cytokines interleukin-1, interleukin-12, TNF-alpha and IFN-gamma. These cytokines then stimulate immune functions such as immune cell activation, proliferation, and differentiation. During this time of a slowly evolving adaptive immune response, there is a peak in undifferentiated or less differentiated cells, like naïve and central memory T cells. In addition to these effects, the milieu of hormones produced at this time (leptin, pituitary growth hormone, and prolactin) supports the interactions between APCs and T-cells, a shift of the Th1/Th2 cytokine balance towards one that supports Th1, an increase in overall Th cell proliferation, and naïve T cell migration to lymph nodes. This is also thought to support the formation of long-lasting immune memory through the initiation of Th1 immune responses.[99]
During wake periods, differentiated effector cells, such as cytotoxic natural killer cells and cytotoxic T lymphocytes, peak to elicit an effective response against any intruding pathogens. Anti-inflammatory molecules, such as cortisol and catecholamines, also peak during awake active times. Inflammation would cause serious cognitive and physical impairments if it were to occur during wake times, and inflammation may occur during sleep times due to the presence of melatonin. Inflammation causes a great deal of oxidative stress and the presence of melatonin during sleep times could actively counteract free radical production during this time.[99][100]
Physical exercise[edit]
Physical exercise has a positive effect on the immune system and depending on the frequency and intensity, the pathogenic effects of diseases caused by bacteria and viruses are moderated.[101] Immediately after intense exercise there is a transient immunodepression, where the number of circulating lymphocytes decreases and antibody production declines. This may give rise to a window of opportunity for infection and reactivation of latent virus infections,[102] but the evidence is inconclusive.[103][104]
Changes at the cellular level[edit]
During exercise there is an increase in circulating white blood cells of all types. This is caused by the frictional force of blood flowing on the endothelial cell surface and catecholamines affecting β-adrenergic receptors (βARs).[102] The number of neutrophils in the blood increases and remains raised for up to six hours and immature forms are present. Although the increase in neutrophils («neutrophilia») is similar to that seen during bacterial infections, after exercise the cell population returns to normal by around 24 hours.[102]
The number of circulating lymphocytes (mainly natural killer cells) decreases during intense exercise but returns to normal after 4 to 6 hours. Although up to 2% of the cells die most migrate from the blood to the tissues, mainly the intestines and lungs, where pathogens are most likely to be encountered.[102]
Some monocytes leave the blood circulation and migrate to the muscles where they differentiate and become macrophages.[102] These cells differentiate into two types: proliferative macrophages, which are responsible for increasing the number of stem cells and restorative macrophages, which are involved their maturing to muscle cells.[105]
Repair and regeneration[edit]
The immune system, particularly the innate component, plays a decisive role in tissue repair after an insult. Key actors include macrophages and neutrophils, but other cellular actors, including γδ T cells, innate lymphoid cells (ILCs), and regulatory T cells (Tregs), are also important. The plasticity of immune cells and the balance between pro-inflammatory and anti-inflammatory signals are crucial aspects of efficient tissue repair. Immune components and pathways are involved in regeneration as well, for example in amphibians such as in axolotl limb regeneration. According to one hypothesis, organisms that can regenerate (e.g., axolotls) could be less immunocompetent than organisms that cannot regenerate.[106]
Disorders of human immunity[edit]
Failures of host defense occur and fall into three broad categories: immunodeficiencies,[107] autoimmunity,[108] and hypersensitivities.[109]
Immunodeficiencies[edit]
Immunodeficiencies occur when one or more of the components of the immune system are inactive. The ability of the immune system to respond to pathogens is diminished in both the young and the elderly, with immune responses beginning to decline at around 50 years of age due to immunosenescence.[110][111] In developed countries, obesity, alcoholism, and drug use are common causes of poor immune function, while malnutrition is the most common cause of immunodeficiency in developing countries.[111] Diets lacking sufficient protein are associated with impaired cell-mediated immunity, complement activity, phagocyte function, IgA antibody concentrations, and cytokine production. Additionally, the loss of the thymus at an early age through genetic mutation or surgical removal results in severe immunodeficiency and a high susceptibility to infection.[112] Immunodeficiencies can also be inherited or ‘acquired’.[113] Severe combined immunodeficiency is a rare genetic disorder characterized by the disturbed development of functional T cells and B cells caused by numerous genetic mutations.[114] Chronic granulomatous disease, where phagocytes have a reduced ability to destroy pathogens, is an example of an inherited, or congenital, immunodeficiency. AIDS and some types of cancer cause acquired immunodeficiency.[115][116]
Autoimmunity[edit]
Overactive immune responses form the other end of immune dysfunction, particularly the autoimmune diseases. Here, the immune system fails to properly distinguish between self and non-self, and attacks part of the body. Under normal circumstances, many T cells and antibodies react with «self» peptides.[117] One of the functions of specialized cells (located in the thymus and bone marrow) is to present young lymphocytes with self antigens produced throughout the body and to eliminate those cells that recognize self-antigens, preventing autoimmunity.[74] Common autoimmune diseases include Hashimoto’s thyroiditis,[118] rheumatoid arthritis,[119] diabetes mellitus type 1,[120] and systemic lupus erythematosus.[121]
Hypersensitivity[edit]
Hypersensitivity is an immune response that damages the body’s own tissues. It is divided into four classes (Type I – IV) based on the mechanisms involved and the time course of the hypersensitive reaction. Type I hypersensitivity is an immediate or anaphylactic reaction, often associated with allergy. Symptoms can range from mild discomfort to death. Type I hypersensitivity is mediated by IgE, which triggers degranulation of mast cells and basophils when cross-linked by antigen.[122]
Type II hypersensitivity occurs when antibodies bind to antigens on the individual’s own cells, marking them for destruction. This is also called antibody-dependent (or cytotoxic) hypersensitivity, and is mediated by IgG and IgM antibodies.[122] Immune complexes (aggregations of antigens, complement proteins, and IgG and IgM antibodies) deposited in various tissues trigger Type III hypersensitivity reactions.[122] Type IV hypersensitivity (also known as cell-mediated or delayed type hypersensitivity) usually takes between two and three days to develop. Type IV reactions are involved in many autoimmune and infectious diseases, but may also involve contact dermatitis. These reactions are mediated by T cells, monocytes, and macrophages.[122]
Idiopathic inflammation[edit]
Inflammation is one of the first responses of the immune system to infection,[44] but it can appear without known cause.
Inflammation is produced by eicosanoids and cytokines, which are released by injured or infected cells. Eicosanoids include prostaglandins that produce fever and the dilation of blood vessels associated with inflammation, and leukotrienes that attract certain white blood cells (leukocytes).[45][46] Common cytokines include interleukins that are responsible for communication between white blood cells; chemokines that promote chemotaxis; and interferons that have anti-viral effects, such as shutting down protein synthesis in the host cell.[47] Growth factors and cytotoxic factors may also be released. These cytokines and other chemicals recruit immune cells to the site of infection and promote healing of any damaged tissue following the removal of pathogens.[48]
Manipulation in medicine[edit]
The immune response can be manipulated to suppress unwanted responses resulting from autoimmunity, allergy, and transplant rejection, and to stimulate protective responses against pathogens that largely elude the immune system (see immunization) or cancer.[123]
Immunosuppression[edit]
Immunosuppressive drugs are used to control autoimmune disorders or inflammation when excessive tissue damage occurs, and to prevent rejection after an organ transplant.[124][125]
Anti-inflammatory drugs are often used to control the effects of inflammation. Glucocorticoids are the most powerful of these drugs and can have many undesirable side effects, such as central obesity, hyperglycemia, and osteoporosis.[126] Their use is tightly controlled. Lower doses of anti-inflammatory drugs are often used in conjunction with cytotoxic or immunosuppressive drugs such as methotrexate or azathioprine.
Cytotoxic drugs inhibit the immune response by killing dividing cells such as activated T cells. This killing is indiscriminate and other constantly dividing cells and their organs are affected, which causes toxic side effects.[125] Immunosuppressive drugs such as cyclosporin prevent T cells from responding to signals correctly by inhibiting signal transduction pathways.[127]
Immunostimulation[edit]
Claims made by marketers of various products and alternative health providers, such as chiropractors, homeopaths, and acupuncturists to be able to stimulate or «boost» the immune system generally lack meaningful explanation and evidence of effectiveness.[128]
Vaccination[edit]
Polio vaccination in Egypt
Long-term active memory is acquired following infection by activation of B and T cells. Active immunity can also be generated artificially, through vaccination. The principle behind vaccination (also called immunization) is to introduce an antigen from a pathogen to stimulate the immune system and develop specific immunity against that particular pathogen without causing disease associated with that organism.[129] This deliberate induction of an immune response is successful because it exploits the natural specificity of the immune system, as well as its inducibility. With infectious disease remaining one of the leading causes of death in the human population, vaccination represents the most effective manipulation of the immune system mankind has developed.[57][130]
Many vaccines are based on acellular components of micro-organisms, including harmless toxin components.[129] Since many antigens derived from acellular vaccines do not strongly induce the adaptive response, most bacterial vaccines are provided with additional adjuvants that activate the antigen-presenting cells of the innate immune system and maximize immunogenicity.[131]
Tumor immunology[edit]
Another important role of the immune system is to identify and eliminate tumors. This is called immune surveillance. The transformed cells of tumors express antigens that are not found on normal cells. To the immune system, these antigens appear foreign, and their presence causes immune cells to attack the transformed tumor cells. The antigens expressed by tumors have several sources;[132] some are derived from oncogenic viruses like human papillomavirus, which causes cancer of the cervix,[133] vulva, vagina, penis, anus, mouth, and throat,[134] while others are the organism’s own proteins that occur at low levels in normal cells but reach high levels in tumor cells. One example is an enzyme called tyrosinase that, when expressed at high levels, transforms certain skin cells (for example, melanocytes) into tumors called melanomas.[135][136] A third possible source of tumor antigens are proteins normally important for regulating cell growth and survival, that commonly mutate into cancer inducing molecules called oncogenes.[132][137][138]
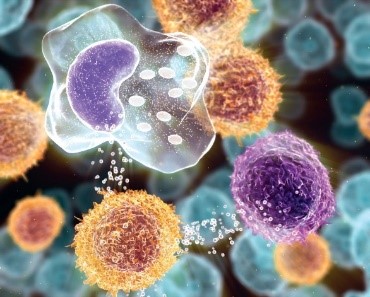
Macrophages have identified a cancer cell (the large, spiky mass). Upon fusing with the cancer cell, the macrophages (smaller white cells) inject toxins that kill the tumor cell. Immunotherapy for the treatment of cancer is an active area of medical research.[139]
The main response of the immune system to tumors is to destroy the abnormal cells using killer T cells, sometimes with the assistance of helper T cells.[136][140] Tumor antigens are presented on MHC class I molecules in a similar way to viral antigens. This allows killer T cells to recognize the tumor cell as abnormal.[141] NK cells also kill tumorous cells in a similar way, especially if the tumor cells have fewer MHC class I molecules on their surface than normal; this is a common phenomenon with tumors.[142] Sometimes antibodies are generated against tumor cells allowing for their destruction by the complement system.[137]
Some tumors evade the immune system and go on to become cancers.[143][144] Tumor cells often have a reduced number of MHC class I molecules on their surface, thus avoiding detection by killer T cells.[141][143] Some tumor cells also release products that inhibit the immune response; for example by secreting the cytokine TGF-β, which suppresses the activity of macrophages and lymphocytes.[143][145] In addition, immunological tolerance may develop against tumor antigens, so the immune system no longer attacks the tumor cells.[143][144]
Paradoxically, macrophages can promote tumor growth[146] when tumor cells send out cytokines that attract macrophages, which then generate cytokines and growth factors such as tumor-necrosis factor alpha that nurture tumor development or promote stem-cell-like plasticity.[143] In addition, a combination of hypoxia in the tumor and a cytokine produced by macrophages induces tumor cells to decrease production of a protein that blocks metastasis and thereby assists spread of cancer cells.[143] Anti-tumor M1 macrophages are recruited in early phases to tumor development but are progressively differentiated to M2 with pro-tumor effect, an immunosuppressor switch. The hypoxia reduces the cytokine production for the anti-tumor response and progressively macrophages acquire pro-tumor M2 functions driven by the tumor microenvironment, including IL-4 and IL-10.[147] Cancer immunotherapy covers the medical ways to stimulate the immune system to attack cancer tumors.[148]
Predicting immunogenicity[edit]
Some drugs can cause a neutralizing immune response, meaning that the immune system produces neutralizing antibodies that counteract the action of the drugs, particularly if the drugs are administered repeatedly, or in larger doses. This limits the effectiveness of drugs based on larger peptides and proteins (which are typically larger than 6000 Da).[149] In some cases, the drug itself is not immunogenic, but may be co-administered with an immunogenic compound, as is sometimes the case for Taxol. Computational methods have been developed to predict the immunogenicity of peptides and proteins, which are particularly useful in designing therapeutic antibodies, assessing likely virulence of mutations in viral coat particles, and validation of proposed peptide-based drug treatments. Early techniques relied mainly on the observation that hydrophilic amino acids are overrepresented in epitope regions than hydrophobic amino acids;[150] however, more recent developments rely on machine learning techniques using databases of existing known epitopes, usually on well-studied virus proteins, as a training set.[151] A publicly accessible database has been established for the cataloguing of epitopes from pathogens known to be recognizable by B cells.[152] The emerging field of bioinformatics-based studies of immunogenicity is referred to as immunoinformatics.[153] Immunoproteomics is the study of large sets of proteins (proteomics) involved in the immune response.[154]
Evolution and other mechanisms[edit]
Evolution of the immune system[edit]
It is likely that a multicomponent, adaptive immune system arose with the first vertebrates, as invertebrates do not generate lymphocytes or an antibody-based humoral response.[155] Many species, however, use mechanisms that appear to be precursors of these aspects of vertebrate immunity. Immune systems appear even in the structurally simplest forms of life, with bacteria using a unique defense mechanism, called the restriction modification system to protect themselves from viral pathogens, called bacteriophages.[156] Prokaryotes (bacteria and archea) also possess acquired immunity, through a system that uses CRISPR sequences to retain fragments of the genomes of phage that they have come into contact with in the past, which allows them to block virus replication through a form of RNA interference.[157][158] Prokaryotes also possess other defense mechanisms.[159][160] Offensive elements of the immune systems are also present in unicellular eukaryotes, but studies of their roles in defense are few.[161]
Pattern recognition receptors are proteins used by nearly all organisms to identify molecules associated with pathogens. Antimicrobial peptides called defensins are an evolutionarily conserved component of the innate immune response found in all animals and plants, and represent the main form of invertebrate systemic immunity.[155] The complement system and phagocytic cells are also used by most forms of invertebrate life. Ribonucleases and the RNA interference pathway are conserved across all eukaryotes, and are thought to play a role in the immune response to viruses.[162]
Unlike animals, plants lack phagocytic cells, but many plant immune responses involve systemic chemical signals that are sent through a plant.[163] Individual plant cells respond to molecules associated with pathogens known as pathogen-associated molecular patterns or PAMPs.[164] When a part of a plant becomes infected, the plant produces a localized hypersensitive response, whereby cells at the site of infection undergo rapid apoptosis to prevent the spread of the disease to other parts of the plant. Systemic acquired resistance is a type of defensive response used by plants that renders the entire plant resistant to a particular infectious agent.[163] RNA silencing mechanisms are particularly important in this systemic response as they can block virus replication.[165]
Alternative adaptive immune system[edit]
Evolution of the adaptive immune system occurred in an ancestor of the jawed vertebrates. Many of the classical molecules of the adaptive immune system (for example, immunoglobulins and T-cell receptors) exist only in jawed vertebrates. A distinct lymphocyte-derived molecule has been discovered in primitive jawless vertebrates, such as the lamprey and hagfish. These animals possess a large array of molecules called Variable lymphocyte receptors (VLRs) that, like the antigen receptors of jawed vertebrates, are produced from only a small number (one or two) of genes. These molecules are believed to bind pathogenic antigens in a similar way to antibodies, and with the same degree of specificity.[166]
Manipulation by pathogens[edit]
The success of any pathogen depends on its ability to elude host immune responses. Therefore, pathogens evolved several methods that allow them to successfully infect a host, while evading detection or destruction by the immune system.[167] Bacteria often overcome physical barriers by secreting enzymes that digest the barrier, for example, by using a type II secretion system.[168] Alternatively, using a type III secretion system, they may insert a hollow tube into the host cell, providing a direct route for proteins to move from the pathogen to the host. These proteins are often used to shut down host defenses.[169]
An evasion strategy used by several pathogens to avoid the innate immune system is to hide within the cells of their host (also called intracellular pathogenesis). Here, a pathogen spends most of its life-cycle inside host cells, where it is shielded from direct contact with immune cells, antibodies and complement. Some examples of intracellular pathogens include viruses, the food poisoning bacterium Salmonella and the eukaryotic parasites that cause malaria (Plasmodium spp.) and leishmaniasis (Leishmania spp.). Other bacteria, such as Mycobacterium tuberculosis, live inside a protective capsule that prevents lysis by complement.[170] Many pathogens secrete compounds that diminish or misdirect the host’s immune response.[167] Some bacteria form biofilms to protect themselves from the cells and proteins of the immune system. Such biofilms are present in many successful infections, such as the chronic Pseudomonas aeruginosa and Burkholderia cenocepacia infections characteristic of cystic fibrosis.[171] Other bacteria generate surface proteins that bind to antibodies, rendering them ineffective; examples include Streptococcus (protein G), Staphylococcus aureus (protein A), and Peptostreptococcus magnus (protein L).[172]
The mechanisms used to evade the adaptive immune system are more complicated. The simplest approach is to rapidly change non-essential epitopes (amino acids and/or sugars) on the surface of the pathogen, while keeping essential epitopes concealed. This is called antigenic variation. An example is HIV, which mutates rapidly, so the proteins on its viral envelope that are essential for entry into its host target cell are constantly changing. These frequent changes in antigens may explain the failures of vaccines directed at this virus.[173] The parasite Trypanosoma brucei uses a similar strategy, constantly switching one type of surface protein for another, allowing it to stay one step ahead of the antibody response.[174] Masking antigens with host molecules is another common strategy for avoiding detection by the immune system. In HIV, the envelope that covers the virion is formed from the outermost membrane of the host cell; such «self-cloaked» viruses make it difficult for the immune system to identify them as «non-self» structures.[175]
History of immunology[edit]
Paul Ehrlich (1854–1915) was awarded a Nobel Prize in 1908 for his contributions to immunology.[176]
Immunology is a science that examines the structure and function of the immune system. It originates from medicine and early studies on the causes of immunity to disease. The earliest known reference to immunity was during the plague of Athens in 430 BC. Thucydides noted that people who had recovered from a previous bout of the disease could nurse the sick without contracting the illness a second time.[177] In the 18th century, Pierre-Louis Moreau de Maupertuis experimented with scorpion venom and observed that certain dogs and mice were immune to this venom.[178] In the 10th century, Persian physician al-Razi (also known as Rhazes) wrote the first recorded theory of acquired immunity,[179][180] noting that a smallpox bout protected its survivors from future infections. Although he explained the immunity in terms of «excess moisture» being expelled from the blood—therefore preventing a second occurrence of the disease—this theory explained many observations about smallpox known during this time.[181]
These and other observations of acquired immunity were later exploited by Louis Pasteur in his development of vaccination and his proposed germ theory of disease.[182] Pasteur’s theory was in direct opposition to contemporary theories of disease, such as the miasma theory. It was not until Robert Koch’s 1891 proofs, for which he was awarded a Nobel Prize in 1905, that microorganisms were confirmed as the cause of infectious disease.[183] Viruses were confirmed as human pathogens in 1901, with the discovery of the yellow fever virus by Walter Reed.[184]
Immunology made a great advance towards the end of the 19th century, through rapid developments in the study of humoral immunity and cellular immunity.[185] Particularly important was the work of Paul Ehrlich, who proposed the side-chain theory to explain the specificity of the antigen-antibody reaction; his contributions to the understanding of humoral immunity were recognized by the award of a joint Nobel Prize in 1908, along with the founder of cellular immunology, Elie Metchnikoff.[176] In 1974, Niels Kaj Jerne developed the immune network theory; he shared a Nobel Prize in 1984 with Georges J. F. Köhler and César Milstein for theories related to the immune system.[186][187]
See also[edit]
- Fc receptor
- Immune system receptors
- Immunostimulator
- Neuroimmune system
- Original antigenic sin – when the immune system uses immunological memory upon encountering a slightly different pathogen
- Plant disease resistance
- Polyclonal response
- Tumor antigens
References[edit]
Citations[edit]
- ^ Sompayrac 2019, p. 1.
- ^ a b Litman GW, Cannon JP, Dishaw LJ (November 2005). «Reconstructing immune phylogeny: new perspectives». Nature Reviews. Immunology. 5 (11): 866–79. doi:10.1038/nri1712. PMC 3683834. PMID 16261174.
- ^ Sompayrac 2019, p. 4.
- ^ Restifo NP, Gattinoni L (October 2013). «Lineage relationship of effector and memory T cells». Current Opinion in Immunology. 25 (5): 556–63. doi:10.1016/j.coi.2013.09.003. PMC 3858177. PMID 24148236.
- ^ Kurosaki T, Kometani K, Ise W (March 2015). «Memory B cells». Nature Reviews. Immunology. 15 (3): 149–59. doi:10.1038/nri3802. PMID 25677494. S2CID 20825732.
- ^ Sompayrac 2019, p. 11.
- ^ Sompayrac 2019, p. 146.
- ^ Alberts et al. 2002, sec. «Pathogens Cross Protective Barriers to Colonize the Host».
- ^ Boyton RJ, Openshaw PJ (2002). «Pulmonary defences to acute respiratory infection». British Medical Bulletin. 61 (1): 1–12. doi:10.1093/bmb/61.1.1. PMID 11997295.
- ^ Agerberth B, Gudmundsson GH (2006). «Host antimicrobial defence peptides in human disease». Current Topics in Microbiology and Immunology. 306: 67–90. doi:10.1007/3-540-29916-5_3. ISBN 978-3-540-29915-8. PMID 16909918.
- ^ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O’Callaghan RJ (September 2001). «Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus». Investigative Ophthalmology & Visual Science. 42 (10): 2347–54. PMID 11527949.
- ^ Hankiewicz J, Swierczek E (December 1974). «Lysozyme in human body fluids». Clinica Chimica Acta; International Journal of Clinical Chemistry. 57 (3): 205–09. doi:10.1016/0009-8981(74)90398-2. PMID 4434640.
- ^ Fair WR, Couch J, Wehner N (February 1976). «Prostatic antibacterial factor. Identity and significance». Urology. 7 (2): 169–77. doi:10.1016/0090-4295(76)90305-8. PMID 54972.
- ^ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH (June 2003). «Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli». The Biochemical Journal. 372 (Pt 2): 473–83. doi:10.1042/BJ20030225. PMC 1223422. PMID 12628001.
- ^ Smith JL (2003). «The role of gastric acid in preventing foodborne disease and how bacteria overcome acid conditions». J Food Prot. 66 (7): 1292–1303. doi:10.4315/0362-028X-66.7.1292. PMID 12870767.
- ^ Gorbach SL (February 1990). «Lactic acid bacteria and human health». Annals of Medicine. 22 (1): 37–41. doi:10.3109/07853899009147239. PMID 2109988.
- ^ Medzhitov R (October 2007). «Recognition of microorganisms and activation of the immune response». Nature. 449 (7164): 819–26. Bibcode:2007Natur.449..819M. doi:10.1038/nature06246. PMID 17943118. S2CID 4392839.
- ^ Matzinger P (April 2002). «The danger model: a renewed sense of self» (PDF). Science. 296 (5566): 301–05. Bibcode:2002Sci…296..301M. doi:10.1126/science.1071059. PMID 11951032. S2CID 13615808.
- ^ a b Alberts et al. 2002, Chapter: «Innate Immunity».
- ^ Iriti 2019, p. xi.
- ^ Kumar H, Kawai T, Akira S (February 2011). «Pathogen recognition by the innate immune system». International Reviews of Immunology. 30 (1): 16–34. doi:10.3109/08830185.2010.529976. PMID 21235323. S2CID 42000671.
- ^ Schroder K, Tschopp J (March 2010). «The inflammasomes». Cell. 140 (6): 821–32. doi:10.1016/j.cell.2010.01.040. PMID 20303873. S2CID 16916572.
- ^ Sompayrac 2019, p. 20.
- ^ Beutler B, Jiang Z, Georgel P, Crozat K, Croker B, Rutschmann S, Du X, Hoebe K (2006). «Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large». Annual Review of Immunology. 24: 353–89. doi:10.1146/annurev.immunol.24.021605.090552. PMID 16551253. S2CID 20991617.
- ^ Botos I, Segal DM, Davies DR (April 2011). «The structural biology of Toll-like receptors». Structure. 19 (4): 447–59. doi:10.1016/j.str.2011.02.004. PMC 3075535. PMID 21481769.
- ^ Vijay K (June 2018). «Toll-like receptors in immunity and inflammatory diseases: Past, present, and future». Int Immunopharmacol. 59: 391–412. doi:10.1016/j.intimp.2018.03.002. PMC 7106078. PMID 29730580.
- ^ Thompson MR, Kaminski JJ, Kurt-Jones EA, Fitzgerald KA (June 2011). «Pattern recognition receptors and the innate immune response to viral infection». Viruses. 3 (6): 920–40. doi:10.3390/v3060920. PMC 3186011. PMID 21994762.
- ^ Sompayrac 2019, pp. 1–4.
- ^ Alberts et al. 2002, sec. «Phagocytic Cells Seek, Engulf, and Destroy Pathogens».
- ^ Ryter A (1985). «Relationship between ultrastructure and specific functions of macrophages». Comparative Immunology, Microbiology and Infectious Diseases. 8 (2): 119–33. doi:10.1016/0147-9571(85)90039-6. PMID 3910340.
- ^ Langermans JA, Hazenbos WL, van Furth R (September 1994). «Antimicrobial functions of mononuclear phagocytes». Journal of Immunological Methods. 174 (1–2): 185–94. doi:10.1016/0022-1759(94)90021-3. PMID 8083520.
- ^ May RC, Machesky LM (March 2001). «Phagocytosis and the actin cytoskeleton». Journal of Cell Science. 114 (Pt 6): 1061–77. doi:10.1242/jcs.114.6.1061. PMID 11228151. Archived from the original on 31 March 2020. Retrieved 6 November 2009.
- ^ Salzet M, Tasiemski A, Cooper E (2006). «Innate immunity in lophotrochozoans: the annelids» (PDF). Current Pharmaceutical Design. 12 (24): 3043–50. doi:10.2174/138161206777947551. PMID 16918433. S2CID 28520695. Archived from the original (PDF) on 31 March 2020.
- ^ Zen K, Parkos CA (October 2003). «Leukocyte-epithelial interactions». Current Opinion in Cell Biology. 15 (5): 557–64. doi:10.1016/S0955-0674(03)00103-0. PMID 14519390.
- ^ a b Stvrtinová, Jakubovský & Hulín 1995, Chapter: Inflammation and Fever.
- ^ Rua R, McGavern DB (September 2015). «Elucidation of monocyte/macrophage dynamics and function by intravital imaging». Journal of Leukocyte Biology. 98 (3): 319–32. doi:10.1189/jlb.4RI0115-006RR. PMC 4763596. PMID 26162402.
- ^ a b Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). «Antigen presentation and T cell stimulation by dendritic cells». Annual Review of Immunology. 20 (1): 621–67. doi:10.1146/annurev.immunol.20.100301.064828. PMID 11861614.
- ^ Krishnaswamy, Ajitawi & Chi 2006, pp. 13–34.
- ^ Kariyawasam HH, Robinson DS (April 2006). «The eosinophil: the cell and its weapons, the cytokines, its locations». Seminars in Respiratory and Critical Care Medicine. 27 (2): 117–27. doi:10.1055/s-2006-939514. PMID 16612762.
- ^ Spits H, Cupedo T (2012). «Innate lymphoid cells: emerging insights in development, lineage relationships, and function». Annual Review of Immunology. 30: 647–75. doi:10.1146/annurev-immunol-020711-075053. PMID 22224763.
- ^ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L (2016). «The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk». Journal of Immunology Research. 2016: 1376595. doi:10.1155/2016/1376595. PMC 5204097. PMID 28078307.
- ^ Bertok & Chow 2005, p. 17.
- ^ Rajalingam 2012, Chapter: Overview of the killer cell immunoglobulin-like receptor system.
- ^ a b Kawai T, Akira S (February 2006). «Innate immune recognition of viral infection». Nature Immunology. 7 (2): 131–37. doi:10.1038/ni1303. PMID 16424890. S2CID 9567407.
- ^ a b Miller SB (August 2006). «Prostaglandins in health and disease: an overview». Seminars in Arthritis and Rheumatism. 36 (1): 37–49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ^ a b Ogawa Y, Calhoun WJ (October 2006). «The role of leukotrienes in airway inflammation». The Journal of Allergy and Clinical Immunology. 118 (4): 789–98, quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ^ a b Le Y, Zhou Y, Iribarren P, Wang J (April 2004). «Chemokines and chemokine receptors: their manifold roles in homeostasis and disease» (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ^ a b Martin P, Leibovich SJ (November 2005). «Inflammatory cells during wound repair: the good, the bad and the ugly». Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ Platnich JM, Muruve DA (February 2019). «NOD-like receptors and inflammasomes: A review of their canonical and non-canonical signaling pathways». Archives of Biochemistry and Biophysics. 670: 4–14. doi:10.1016/j.abb.2019.02.008. PMID 30772258. S2CID 73464235.
- ^ a b Rus H, Cudrici C, Niculescu F (2005). «The role of the complement system in innate immunity». Immunologic Research. 33 (2): 103–12. doi:10.1385/IR:33:2:103. PMID 16234578. S2CID 46096567.
- ^ Degn SE, Thiel S (August 2013). «Humoral pattern recognition and the complement system». Scandinavian Journal of Immunology. 78 (2): 181–93. doi:10.1111/sji.12070. PMID 23672641.
- ^ Bertok & Chow 2005, pp. 112–113.
- ^ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP (1996). «Control of the complement system». Advances in Immunology. 61: 201–283. doi:10.1016/S0065-2776(08)60868-8. ISBN 978-0-12-022461-6. PMID 8834497.
- ^ Sim RB, Tsiftsoglou SA (February 2004). «Proteases of the complement system» (PDF). Biochemical Society Transactions. 32 (Pt 1): 21–27. doi:10.1042/BST0320021. PMID 14748705. S2CID 24505041. Archived from the original (PDF) on 2 March 2019.
- ^ Pancer Z, Cooper MD (2006). «The evolution of adaptive immunity». Annual Review of Immunology. 24 (1): 497–518. doi:10.1146/annurev.immunol.24.021605.090542. PMID 16551257.
- ^ Sompayrac 2019, p. 38.
- ^ a b c Janeway 2005.
- ^ a b Holtmeier W, Kabelitz D (2005). «gammadelta T cells link innate and adaptive immune responses». Chemical Immunology and Allergy. 86: 151–83. doi:10.1159/000086659. ISBN 3-8055-7862-8. PMID 15976493.
- ^ Venturi S, Venturi M (September 2009). «Iodine, thymus, and immunity». Nutrition. 25 (9): 977–79. doi:10.1016/j.nut.2009.06.002. PMID 19647627.
- ^ Janeway, Travers & Walport 2001, sec. 12-10.
- ^ Sompayrac 2019, pp. 5–6.
- ^ Sompayrac 2019, pp. 51–53.
- ^ Sompayrac 2019, pp. 7–8.
- ^ Harty JT, Tvinnereim AR, White DW (2000). «CD8+ T cell effector mechanisms in resistance to infection». Annual Review of Immunology. 18 (1): 275–308. doi:10.1146/annurev.immunol.18.1.275. PMID 10837060.
- ^ a b Radoja S, Frey AB, Vukmanovic S (2006). «T-cell receptor signaling events triggering granule exocytosis». Critical Reviews in Immunology. 26 (3): 265–90. doi:10.1615/CritRevImmunol.v26.i3.40. PMID 16928189.
- ^ Abbas AK, Murphy KM, Sher A (October 1996). «Functional diversity of helper T lymphocytes». Nature. 383 (6603): 787–93. Bibcode:1996Natur.383..787A. doi:10.1038/383787a0. PMID 8893001. S2CID 4319699.
- ^ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG (2006). «Helper T cell-regulated B cell immunity». Current Topics in Microbiology and Immunology. 311: 59–83. doi:10.1007/3-540-32636-7_3. ISBN 978-3-540-32635-9. PMID 17048705.
- ^ Sompayrac 2019, p. 8.
- ^ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH (November 2002). «Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation». Proceedings of the National Academy of Sciences of the United States of America. 99 (23): 15006–11. Bibcode:2002PNAS…9915006K. doi:10.1073/pnas.232058599. PMC 137535. PMID 12419850.
- ^ Alberts et al. 2002, Chapter. «Helper T Cells and Lymphocyte Activation».
- ^ Grewal IS, Flavell RA (1998). «CD40 and CD154 in cell-mediated immunity». Annual Review of Immunology. 16 (1): 111–35. doi:10.1146/annurev.immunol.16.1.111. PMID 9597126.
- ^ Girardi M (January 2006). «Immunosurveillance and immunoregulation by gammadelta T cells». The Journal of Investigative Dermatology. 126 (1): 25–31. doi:10.1038/sj.jid.5700003. PMID 16417214.
- ^ «Understanding the Immune System: How it Works» (PDF). National Institute of Allergy and Infectious Diseases (NIAID). Archived from the original (PDF) on 3 January 2007. Retrieved 1 January 2007.
- ^ a b Sproul TW, Cheng PC, Dykstra ML, Pierce SK (2000). «A role for MHC class II antigen processing in B cell development». International Reviews of Immunology. 19 (2–3): 139–55. doi:10.3109/08830180009088502. PMID 10763706. S2CID 6550357.
- ^ Parker DC (1993). «T cell-dependent B cell activation». Annual Review of Immunology. 11: 331–60. doi:10.1146/annurev.iy.11.040193.001555. PMID 8476565.
- ^ Murphy & Weaver 2016, Chapter 10: The Humoral Immune Response.
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (May 1999). «Dynamics of immunoglobulins at the feto-maternal interface» (PDF). Reviews of Reproduction. 4 (2): 81–89. doi:10.1530/ror.0.0040081. PMID 10357095. S2CID 31099552. Archived from the original (PDF) on 30 January 2021.
- ^ Van de Perre P (July 2003). «Transfer of antibody via mother’s milk». Vaccine. 21 (24): 3374–76. doi:10.1016/S0264-410X(03)00336-0. PMID 12850343.
- ^ Keller MA, Stiehm ER (October 2000). «Passive immunity in prevention and treatment of infectious diseases». Clinical Microbiology Reviews. 13 (4): 602–14. doi:10.1128/CMR.13.4.602-614.2000. PMC 88952. PMID 11023960.
- ^ Sompayrac 2019, p. 98.
- ^ Wick G, Hu Y, Schwarz S, Kroemer G (October 1993). «Immunoendocrine communication via the hypothalamo-pituitary-adrenal axis in autoimmune diseases». Endocrine Reviews. 14 (5): 539–63. doi:10.1210/edrv-14-5-539. PMID 8262005.
- ^ Kroemer G, Brezinschek HP, Faessler R, Schauenstein K, Wick G (June 1988). «Physiology and pathology of an immunoendocrine feedback loop». Immunology Today. 9 (6): 163–5. doi:10.1016/0167-5699(88)91289-3. PMID 3256322.
- ^ Trakhtenberg EF, Goldberg JL (October 2011). «Immunology. Neuroimmune communication». Science. 334 (6052): 47–8. Bibcode:2011Sci…334…47T. doi:10.1126/science.1213099. PMID 21980100. S2CID 36504684.
- ^ Veiga-Fernandes H, Mucida D (May 2016). «Neuro-Immune Interactions at Barrier Surfaces». Cell. 165 (4): 801–11. doi:10.1016/j.cell.2016.04.041. PMC 4871617. PMID 27153494.
- ^ «Neuroimmune communication». Nature Neuroscience. 20 (2): 127. February 2017. doi:10.1038/nn.4496. PMID 28092662.
- ^ Wilcox SM, Arora H, Munro L, Xin J, Fenninger F, Johnson LA, Pfeifer CG, Choi KB, Hou J, Hoodless PA, Jefferies WA (2017). «The role of the innate immune response regulatory gene ABCF1 in mammalian embryogenesis and development». PLOS ONE. 12 (5): e0175918. Bibcode:2017PLoSO..1275918W. doi:10.1371/journal.pone.0175918. PMC 5438103. PMID 28542262.
- ^ Wira, Crane-Godreau & Grant 2004, Chapter: Endocrine regulation of the mucosal immune system in the female reproductive tract.
- ^ Lang TJ (December 2004). «Estrogen as an immunomodulator». Clinical Immunology. 113 (3): 224–30. doi:10.1016/j.clim.2004.05.011. PMID 15507385.
Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y (July 1999). «Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle». Molecular Human Reproduction. 5 (7): 656–61. doi:10.1093/molehr/5.7.656. PMID 10381821.
Cutolo M, Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). «Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity». Lupus. 13 (9): 635–38. doi:10.1191/0961203304lu1094oa. PMID 15485092. S2CID 23941507.
King AE, Critchley HO, Kelly RW (February 2000). «Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial protective role». Molecular Human Reproduction. 6 (2): 191–96. doi:10.1093/molehr/6.2.191. PMID 10655462. - ^ Fimmel S, Zouboulis CC (2005). «Influence of physiological androgen levels on wound healing and immune status in men». The Aging Male. 8 (3–4): 166–74. doi:10.1080/13685530500233847. PMID 16390741. S2CID 1021367.
- ^ Dorshkind K, Horseman ND (June 2000). «The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency». Endocrine Reviews. 21 (3): 292–312. doi:10.1210/edrv.21.3.0397. PMID 10857555.
- ^ Nagpal S, Na S, Rathnachalam R (August 2005). «Noncalcemic actions of vitamin D receptor ligands». Endocrine Reviews. 26 (5): 662–87. doi:10.1210/er.2004-0002. PMID 15798098.
- ^ «Vitamin D — Fact Sheet for Health Professionals». Office of Dietary Supplements, US National Institutes of Health. 17 August 2021. Retrieved 31 March 2022.
- ^ Institute of Medicine (2011). «8, Implications and Special Concerns». In Ross AC, Taylor CL, Yaktine AL, Del Valle HB (eds.). Dietary Reference Intakes for Calcium and Vitamin D. The National Academies Collection: Reports funded by the National Institutes of Health. National Academies Press. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Bryant PA, Trinder J, Curtis N (June 2004). «Sick and tired: Does sleep have a vital role in the immune system?». Nature Reviews. Immunology. 4 (6): 457–67. doi:10.1038/nri1369. PMID 15173834. S2CID 29318345.
- ^ Krueger JM, Majde JA (May 2003). «Humoral links between sleep and the immune system: research issues». Annals of the New York Academy of Sciences. 992 (1): 9–20. Bibcode:2003NYASA.992….9K. doi:10.1111/j.1749-6632.2003.tb03133.x. PMID 12794042. S2CID 24508121.
- ^ Majde JA, Krueger JM (December 2005). «Links between the innate immune system and sleep». The Journal of Allergy and Clinical Immunology. 116 (6): 1188–98. doi:10.1016/j.jaci.2005.08.005. PMID 16337444.
- ^ Taylor DJ, Kelly K, Kohut ML, Song KS (2017). «Is Insomnia a Risk Factor for Decreased Influenza Vaccine Response?». Behavioral Sleep Medicine. 15 (4): 270–287. doi:10.1080/15402002.2015.1126596. PMC 5554442. PMID 27077395.
- ^ Krueger JM (2008). «The role of cytokines in sleep regulation». Current Pharmaceutical Design. 14 (32): 3408–16. doi:10.2174/138161208786549281. PMC 2692603. PMID 19075717.
- ^ a b Besedovsky L, Lange T, Born J (January 2012). «Sleep and immune function». Pflügers Archiv. 463 (1): 121–37. doi:10.1007/s00424-011-1044-0. PMC 3256323. PMID 22071480.
- ^ «Can Better Sleep Mean Catching fewer Colds?». Archived from the original on 9 May 2014. Retrieved 28 April 2014.
- ^ da Silveira MP, da Silva Fagundes KK, Bizuti MR, Starck É, Rossi RC, de Resende E, Silva DT (February 2021). «Physical exercise as a tool to help the immune system against COVID-19: an integrative review of the current literature». Clinical and Experimental Medicine. 21 (1): 15–28. doi:10.1007/s10238-020-00650-3. PMC 7387807. PMID 32728975.
- ^ a b c d e Peake JM, Neubauer O, Walsh NP, Simpson RJ (May 2017). «Recovery of the immune system after exercise» (PDF). Journal of Applied Physiology. 122 (5): 1077–1087. doi:10.1152/japplphysiol.00622.2016. PMID 27909225. S2CID 3521624.
- ^ Campbell JP, Turner JE (2018). «Debunking the Myth of Exercise-Induced Immune Suppression: Redefining the Impact of Exercise on Immunological Health Across the Lifespan». Frontiers in Immunology. 9: 648. doi:10.3389/fimmu.2018.00648. PMC 5911985. PMID 29713319.
- ^ Simpson RJ, Campbell JP, Gleeson M, Krüger K, Nieman DC, Pyne DB, Turner JE, Walsh NP (2020). «Can exercise affect immune function to increase susceptibility to infection?». Exercise Immunology Review. 26: 8–22. PMID 32139352.
- ^ Minari AL, Thomatieli-Santos RV (January 2022). «From skeletal muscle damage and regeneration to the hypertrophy induced by exercise: what is the role of different macrophage subsets?». American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 322 (1): R41–R54. doi:10.1152/ajpregu.00038.2021. PMID 34786967. S2CID 244369441.
- ^ Godwin JW, Pinto AR, Rosenthal NA (January 2017). «Chasing the recipe for a pro-regenerative immune system». Seminars in Cell & Developmental Biology. Innate immune pathways in wound healing/Peromyscus as a model system. 61: 71–79. doi:10.1016/j.semcdb.2016.08.008. PMC 5338634. PMID 27521522.
- ^ Sompayrac 2019, pp. 120–24.
- ^ Sompayrac 2019, pp. 114–18.
- ^ Sompayrac 2019, pp. 111–14.
- ^ Aw D, Silva AB, Palmer DB (April 2007). «Immunosenescence: emerging challenges for an ageing population». Immunology. 120 (4): 435–46. doi:10.1111/j.1365-2567.2007.02555.x. PMC 2265901. PMID 17313487.
- ^ a b Chandra RK (August 1997). «Nutrition and the immune system: an introduction». The American Journal of Clinical Nutrition. 66 (2): 460S–63S. doi:10.1093/ajcn/66.2.460S. PMID 9250133.
- ^ Miller JF (July 2002). «The discovery of thymus function and of thymus-derived lymphocytes». Immunological Reviews. 185 (1): 7–14. doi:10.1034/j.1600-065X.2002.18502.x. PMID 12190917. S2CID 12108587.
- ^ Reece 2011, p. 967.
- ^ Burg M, Gennery AR (2011). «Educational paper: The expanding clinical and immunological spectrum of severe combined immunodeficiency». Eur J Pediatr. 170 (5): 561–571. doi:10.1007/s00431-011-1452-3. PMC 3078321. PMID 21479529.
- ^ Joos L, Tamm M (2005). «Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy». Proceedings of the American Thoracic Society. 2 (5): 445–48. doi:10.1513/pats.200508-097JS. PMID 16322598.
- ^ Copeland KF, Heeney JL (December 1996). «T helper cell activation and human retroviral pathogenesis». Microbiological Reviews. 60 (4): 722–42. doi:10.1128/MMBR.60.4.722-742.1996. PMC 239461. PMID 8987361.
- ^ Miller JF (1993). «Self-nonself discrimination and tolerance in T and B lymphocytes». Immunologic Research. 12 (2): 115–30. doi:10.1007/BF02918299. PMID 8254222. S2CID 32476323.
- ^
This article incorporates text from this source, which is in the public domain: «Hashimoto’s disease». Office on Women’s Health, U.S. Department of Health and Human Services. 12 June 2017. Archived from the original on 28 July 2017. Retrieved 17 July 2017.
- ^ Smolen JS, Aletaha D, McInnes IB (October 2016). «Rheumatoid arthritis» (PDF). Lancet. 388 (10055): 2023–2038. doi:10.1016/S0140-6736(16)30173-8. PMID 27156434. S2CID 37973054.
- ^ Farhy LS, McCall AL (July 2015). «Glucagon — the new ‘insulin’ in the pathophysiology of diabetes». Current Opinion in Clinical Nutrition and Metabolic Care. 18 (4): 407–14. doi:10.1097/mco.0000000000000192. PMID 26049639. S2CID 19872862.
- ^ «Handout on Health: Systemic Lupus Erythematosus». www.niams.nih.gov. February 2015. Archived from the original on 17 June 2016. Retrieved 12 June 2016.
- ^ a b c d Ghaffar A (2006). «Immunology – Chapter Seventeen: Hypersensitivity States». Microbiology and Immunology On-line. University of South Carolina School of Medicine. Retrieved 29 May 2016.
- ^ Sompayrac 2019, pp. 83–85.
- ^ Ciccone 2015, Chapter 37.
- ^ a b Taylor AL, Watson CJ, Bradley JA (October 2005). «Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy». Critical Reviews in Oncology/Hematology. 56 (1): 23–46. doi:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ^ Barnes PJ (March 2006). «Corticosteroids: the drugs to beat». European Journal of Pharmacology. 533 (1–3): 2–14. doi:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ^ Masri MA (July 2003). «The mosaic of immunosuppressive drugs». Molecular Immunology. 39 (17–18): 1073–77. doi:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ^ Hall H (July–August 2020). «How You Can Really Boost Your Immune System». Skeptical Inquirer. Amherst, New York: Center for Inquiry. Archived from the original on 21 January 2021. Retrieved 21 January 2021.
- ^ a b Reece 2011, p. 965.
- ^ Death and DALY estimates for 2002 by cause for WHO Member States. Archived 21 October 2008 at the Wayback Machine World Health Organization. Retrieved on 1 January 2007.
- ^ Singh M, O’Hagan D (November 1999). «Advances in vaccine adjuvants». Nature Biotechnology. 17 (11): 1075–81. doi:10.1038/15058. PMID 10545912. S2CID 21346647.
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (January 2006). «Cytotoxic T cells». The Journal of Investigative Dermatology. 126 (1): 32–41. doi:10.1038/sj.jid.5700001. PMID 16417215.
- ^ Boon T, van der Bruggen P (March 1996). «Human tumor antigens recognized by T lymphocytes». The Journal of Experimental Medicine. 183 (3): 725–29. doi:10.1084/jem.183.3.725. PMC 2192342. PMID 8642276.
- ^ Ljubojevic S, Skerlev M (2014). «HPV-associated diseases». Clinics in Dermatology. 32 (2): 227–34. doi:10.1016/j.clindermatol.2013.08.007. PMID 24559558.
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G (March 2000). «T-cell recognition of melanoma-associated antigens». Journal of Cellular Physiology. 182 (3): 323–31. doi:10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-#. PMID 10653598. S2CID 196590144.
- ^ a b Romero P, Cerottini JC, Speiser DE (2006). «The human T cell response to melanoma antigens». Advances in Immunology. 92: 187–224. doi:10.1016/S0065-2776(06)92005-7. ISBN 978-0-12-373636-9. PMID 17145305.
- ^ a b Guevara-Patiño JA, Turk MJ, Wolchok JD, Houghton AN (2003). «Immunity to cancer through immune recognition of altered self: studies with melanoma». Advances in Cancer Research. 90: 157–77. doi:10.1016/S0065-230X(03)90005-4. ISBN 978-0-12-006690-2. PMID 14710950.
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G (March 2001). «A listing of human tumor antigens recognized by T cells». Cancer Immunology, Immunotherapy. 50 (1): 3–15. doi:10.1007/s002620000169. PMID 11315507. S2CID 42681479.
- ^ Morgan RA, Dudley ME, Wunderlich JR, et al. (October 2006). «Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes». Science. 314 (5796): 126–29. Bibcode:2006Sci…314..126M. doi:10.1126/science.1129003. PMC 2267026. PMID 16946036.
- ^ Gerloni M, Zanetti M (June 2005). «CD4 T cells in tumor immunity». Springer Seminars in Immunopathology. 27 (1): 37–48. doi:10.1007/s00281-004-0193-z. PMID 15965712. S2CID 25182066.
- ^ a b Seliger B, Ritz U, Ferrone S (January 2006). «Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation». International Journal of Cancer. 118 (1): 129–38. doi:10.1002/ijc.21312. PMID 16003759. S2CID 5655726.
- ^ Hayakawa Y, Smyth MJ (2006). «Innate immune recognition and suppression of tumors». Advances in Cancer Research. 95: 293–322. doi:10.1016/S0065-230X(06)95008-8. ISBN 978-0-12-006695-7. PMID 16860661.
- ^ a b c d e f Syn NL, Teng MW, Mok TS, Soo RA (December 2017). «De-novo and acquired resistance to immune checkpoint targeting». The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ a b Seliger B (2005). «Strategies of tumor immune evasion». BioDrugs. 19 (6): 347–54. doi:10.2165/00063030-200519060-00002. PMID 16392887. S2CID 1838144.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (September 2006). «Targeting tumor-related immunosuppression for cancer immunotherapy». Endocrine, Metabolic & Immune Disorders Drug Targets. 6 (3): 233–7. doi:10.2174/187153006778250019. PMID 17017974.
- ^ Stix G (July 2007). «A malignant flame. Understanding chronic inflammation, which contributes to heart disease, Alzheimer’s and a variety of other ailments, may be a key to unlocking the mysteries of cancer» (PDF). Scientific American. 297 (1): 60–67. Bibcode:2007SciAm.297a..60S. doi:10.1038/scientificamerican0707-60. PMID 17695843. Archived from the original (PDF) on 16 July 2011.
- ^ Cervantes-Villagrana RD, Albores-García D, Cervantes-Villagrana AR, García-Acevez SJ (18 June 2020). «Tumor-induced Neurogenesis and Immune Evasion as Targets of Innovative Anti-Cancer Therapies». Signal Transduct Target Ther. 5 (1): 99. doi:10.1038/s41392-020-0205-z. PMC 7303203. PMID 32555170.
- ^ Yang Y (September 2015). «Cancer immunotherapy: harnessing the immune system to battle cancer». The Journal of Clinical Investigation. 125 (9): 3335–7. doi:10.1172/JCI83871. PMC 4588312. PMID 26325031.
- ^ Baker MP, Reynolds HM, Lumicisi B, Bryson CJ (October 2010). «Immunogenicity of protein therapeutics: The key causes, consequences and challenges». Self/Nonself. 1 (4): 314–322. doi:10.4161/self.1.4.13904. PMC 3062386. PMID 21487506.
- ^ Welling GW, Weijer WJ, van der Zee R, Welling-Wester S (September 1985). «Prediction of sequential antigenic regions in proteins». FEBS Letters. 188 (2): 215–18. doi:10.1016/0014-5793(85)80374-4. PMID 2411595.
- ^ Söllner J, Mayer B (2006). «Machine learning approaches for prediction of linear B-cell epitopes on proteins». Journal of Molecular Recognition. 19 (3): 200–08. doi:10.1002/jmr.771. PMID 16598694. S2CID 18197810.
- ^ Saha S, Bhasin M, Raghava GP (2005). «Bcipep: a database of B-cell epitopes». BMC Genomics. 6: 79. doi:10.1186/1471-2164-6-79. PMC 1173103. PMID 15921533.
- ^ Flower DR, Doytchinova IA (2002). «Immunoinformatics and the prediction of immunogenicity». Applied Bioinformatics. 1 (4): 167–76. PMID 15130835.
- ^ Kanduc D (September 2019). «From hepatitis C virus immunoproteomics to rheumatology via cross-reactivity in one table». Current Opinion in Rheumatology. 31 (5): 488–492. doi:10.1097/BOR.0000000000000606. PMID 31356379. S2CID 198982175.
- ^ a b Flajnik MF, Kasahara M (January 2010). «Origin and evolution of the adaptive immune system: genetic events and selective pressures». Nature Reviews. Genetics. 11 (1): 47–59. doi:10.1038/nrg2703. PMC 3805090. PMID 19997068.
- ^ Bickle TA, Krüger DH (June 1993). «Biology of DNA restriction». Microbiological Reviews. 57 (2): 434–50. doi:10.1128/MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (March 2007). «CRISPR provides acquired resistance against viruses in prokaryotes». Science. 315 (5819): 1709–12. Bibcode:2007Sci…315.1709B. doi:10.1126/science.1138140. hdl:20.500.11794/38902. PMID 17379808. S2CID 3888761.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J (August 2008). «Small CRISPR RNAs guide antiviral defense in prokaryotes». Science. 321 (5891): 960–64. Bibcode:2008Sci…321..960B. doi:10.1126/science.1159689. PMC 5898235. PMID 18703739.
- ^ Hille F, Charpentier E (November 2016). «CRISPR-Cas: biology, mechanisms and relevance». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 371 (1707): 20150496. doi:10.1098/rstb.2015.0496. PMC 5052741. PMID 27672148.
- ^ Koonin EV (February 2017). «Evolution of RNA- and DNA-guided antivirus defense systems in prokaryotes and eukaryotes: common ancestry vs convergence». Biology Direct. 12 (1): 5. doi:10.1186/s13062-017-0177-2. PMC 5303251. PMID 28187792.
- ^ Bayne CJ (2003). «Origins and evolutionary relationships between the innate and adaptive arms of immune systems». Integr. Comp. Biol. 43 (2): 293–99. doi:10.1093/icb/43.2.293. PMID 21680436.
- ^ Stram Y, Kuzntzova L (June 2006). «Inhibition of viruses by RNA interference». Virus Genes. 32 (3): 299–306. doi:10.1007/s11262-005-6914-0. PMC 7088519. PMID 16732482.
- ^ a b Schneider D. «Innate Immunity – Lecture 4: Plant immune responses» (PDF). Stanford University Department of Microbiology and Immunology. Retrieved 1 January 2007.
- ^ Jones JD, Dangl JL (November 2006). «The plant immune system». Nature. 444 (7117): 323–29. Bibcode:2006Natur.444..323J. doi:10.1038/nature05286. PMID 17108957.
- ^ Baulcombe D (September 2004). «RNA silencing in plants». Nature. 431 (7006): 356–63. Bibcode:2004Natur.431..356B. doi:10.1038/nature02874. PMID 15372043. S2CID 4421274.
- ^ Alder MN, Rogozin IB, Iyer LM, Glazko GV, Cooper MD, Pancer Z (December 2005). «Diversity and function of adaptive immune receptors in a jawless vertebrate». Science. 310 (5756): 1970–73. Bibcode:2005Sci…310.1970A. doi:10.1126/science.1119420. PMID 16373579.
- ^ a b Finlay BB, McFadden G (February 2006). «Anti-immunology: evasion of the host immune system by bacterial and viral pathogens». Cell. 124 (4): 767–82. doi:10.1016/j.cell.2006.01.034. PMID 16497587. S2CID 15418509.
- ^ Cianciotto NP (December 2005). «Type II secretion: a protein secretion system for all seasons». Trends in Microbiology. 13 (12): 581–88. doi:10.1016/j.tim.2005.09.005. PMID 16216510.
- ^ Winstanley C, Hart CA (February 2001). «Type III secretion systems and pathogenicity islands». Journal of Medical Microbiology. 50 (2): 116–26. doi:10.1099/0022-1317-50-2-116. PMID 11211218.
- ^ Finlay BB, Falkow S (June 1997). «Common themes in microbial pathogenicity revisited». Microbiology and Molecular Biology Reviews. 61 (2): 136–69. doi:10.1128/mmbr.61.2.136-169.1997. PMC 232605. PMID 9184008.
- ^ Kobayashi H (2005). «Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections». Treatments in Respiratory Medicine. 4 (4): 241–53. doi:10.2165/00151829-200504040-00003. PMID 16086598. S2CID 31788349.
- ^ Housden NG, Harrison S, Roberts SE, Beckingham JA, Graille M, Stura E, Gore MG (June 2003). «Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus» (PDF). Biochemical Society Transactions. 31 (Pt 3): 716–18. doi:10.1042/BST0310716. PMID 12773190. S2CID 10322322. Archived from the original (PDF) on 2 March 2019.
- ^ Burton DR, Stanfield RL, Wilson IA (October 2005). «Antibody vs. HIV in a clash of evolutionary titans». Proceedings of the National Academy of Sciences of the United States of America. 102 (42): 14943–48. Bibcode:2005PNAS..10214943B. doi:10.1073/pnas.0505126102. PMC 1257708. PMID 16219699.
- ^ Taylor JE, Rudenko G (November 2006). «Switching trypanosome coats: what’s in the wardrobe?». Trends in Genetics. 22 (11): 614–20. doi:10.1016/j.tig.2006.08.003. PMID 16908087.
- ^ Cantin R, Méthot S, Tremblay MJ (June 2005). «Plunder and stowaways: incorporation of cellular proteins by enveloped viruses». Journal of Virology. 79 (11): 6577–87. doi:10.1128/JVI.79.11.6577-6587.2005. PMC 1112128. PMID 15890896.
- ^ a b «The Nobel Prize in Physiology or Medicine 1908». The Nobel Prize. Retrieved 8 January 2007.
- ^ Retief FP, Cilliers L (January 1998). «The epidemic of Athens, 430–426 BC». South African Medical Journal = Suid-Afrikaanse Tydskrif vir Geneeskunde. 88 (1): 50–53. PMID 9539938.
- ^ Ostoya P (1954). «Maupertuis et la biologie». Revue d’histoire des sciences et de leurs applications. 7 (1): 60–78. doi:10.3406/rhs.1954.3379.
- ^ Doherty M, Robertson MJ (December 2004). «Some early Trends in Immunology». Trends in Immunology. 25 (12): 623–31. doi:10.1016/j.it.2004.10.008. PMID 15530829.
- ^ Silverstein 1989, p. 6.
- ^ Silverstein 1989, p. 7.
- ^ Plotkin SA (April 2005). «Vaccines: past, present and future». Nature Medicine. 11 (4 Suppl): S5–11. doi:10.1038/nm1209. PMC 7095920. PMID 15812490.
- ^ The Nobel Prize in Physiology or Medicine 1905 Archived 10 December 2006 at the Wayback Machine Nobelprize.org Retrieved on 8 January 2009.
- ^ Major Walter Reed, Medical Corps, U.S. Army Walter Reed Army Medical Center. Retrieved on 8 January 2007.
- ^ Metchnikoff E (1905). Immunity in Infective Diseases (Full Text Version: Internet Archive). Translated by Binnie FG. Cambridge University Press. LCCN 68025143.
history of humoral immunity.
- ^ «Niels K. Jerne». The Nobel Prize. Retrieved 27 November 2020.
- ^ Yewdell J (4 October 2003). «He put the Id in Idiotype». EMBO Reports (Book review). 4 (10): 931. doi:10.1038/sj.embor.embor951. PMC 1326409.
General bibliography[edit]
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. ISBN 978-0-8153-3218-3.
- Bertok L, Chow D (2005). Bertok L, Chow D (eds.). Natural Immunity. Vol. 5 (1st ed.). ISBN 978-0-44451-755-5.
- Iriti M (2019). Plant Innate Immunity 2.0. Basel: MDPI. doi:10.3390/books978-3-03897-581-6. ISBN 978-3-03897-580-9. OCLC 1105775088.
- Ciccone CD (2015). Pharmacology in Rehabilitation (Contemporary Perspectives in Rehabilitation) (5th ed.). F.A. Davis Company. ISBN 978-0-80364-029-0.
- Janeway CA, Travers P, Walport M (2001). Immunobiology (5th ed.). Garland Science.
- Janeway CA (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4.
- Krishnaswamy G, Ajitawi O, Chi DS (2006). «The human mast cell: an overview». Mast Cells. Methods in Molecular Biology. Vol. 315. pp. 13–34. doi:10.1385/1-59259-967-2:013. ISBN 1-59259-967-2. PMID 16110146.
- Murphy K, Weaver C (2016). Immunobiology (9 ed.). Garland Science. ISBN 978-0-8153-4505-3.
- Rajalingam R (2012). Immunogenetics. Methods in Molecular Biology. Vol. 882. pp. 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- Reece J (2011). Campbell biology. Frenchs Forest, N.S.W: Pearson Australia. ISBN 978-1-4425-3176-5. OCLC 712136178.
- Silverstein AM (1989). A History of Immunology. Academic Press. ISBN 978-0-08-092583-7.
- Sompayrac L (2019). How the immune system works. Hoboken, NJ: Wiley-Blackwell. ISBN 978-1-119-54212-4. OCLC 1083261548.
- Stvrtinová V, Jakubovský J, Hulín I (1995). Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press.
- Wira CR, Crane-Godreau M, Grant K (2004). Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.). Mucosal Immunology. San Francisco: Elsevier. ISBN 0-12-491543-4.
Further reading[edit]
- Dettmer P (2021). Immune: A Journey into the Mysterious System that Keeps You Alive. Philip Laibacher (illustrations). New York: Random House. ISBN 9780593241318. OCLC 1263845194. Archived from the original on 24 November 2021. Retrieved 4 January 2022. (The book’s sources are only online.) A popular science explanation of the immune system.
External links[edit]
- Microbiology and Immunology On-Line Textbook – from the University of South Carolina School of Medicine (undergraduate level)
The immune system is a network of biological processes that protects an organism from diseases. It detects and responds to a wide variety of pathogens, from viruses to parasitic worms, as well as cancer cells and objects such as wood splinters, distinguishing them from the organism’s own healthy tissue. Many species have two major subsystems of the immune system. The innate immune system provides a preconfigured response to broad groups of situations and stimuli. The adaptive immune system provides a tailored response to each stimulus by learning to recognize molecules it has previously encountered. Both use molecules and cells to perform their functions.
Nearly all organisms have some kind of immune system. Bacteria have a rudimentary immune system in the form of enzymes that protect against virus infections. Other basic immune mechanisms evolved in ancient plants and animals and remain in their modern descendants. These mechanisms include phagocytosis, antimicrobial peptides called defensins, and the complement system. Jawed vertebrates, including humans, have even more sophisticated defense mechanisms, including the ability to adapt to recognize pathogens more efficiently. Adaptive (or acquired) immunity creates an immunological memory leading to an enhanced response to subsequent encounters with that same pathogen. This process of acquired immunity is the basis of vaccination.
Dysfunction of the immune system can cause autoimmune diseases, inflammatory diseases and cancer. Immunodeficiency occurs when the immune system is less active than normal, resulting in recurring and life-threatening infections. In humans, immunodeficiency can be the result of a genetic disease such as severe combined immunodeficiency, acquired conditions such as HIV/AIDS, or the use of immunosuppressive medication. Autoimmunity results from a hyperactive immune system attacking normal tissues as if they were foreign organisms. Common autoimmune diseases include Hashimoto’s thyroiditis, rheumatoid arthritis, diabetes mellitus type 1, and systemic lupus erythematosus. Immunology covers the study of all aspects of the immune system.
Layered defense[edit]
The immune system protects its host from infection with layered defenses of increasing specificity. Physical barriers prevent pathogens such as bacteria and viruses from entering the organism.[1] If a pathogen breaches these barriers, the innate immune system provides an immediate, but non-specific response. Innate immune systems are found in all animals.[2] If pathogens successfully evade the innate response, vertebrates possess a second layer of protection, the adaptive immune system, which is activated by the innate response.[3] Here, the immune system adapts its response during an infection to improve its recognition of the pathogen. This improved response is then retained after the pathogen has been eliminated, in the form of an immunological memory, and allows the adaptive immune system to mount faster and stronger attacks each time this pathogen is encountered.[4][5]
| Innate immune system | Adaptive immune system |
|---|---|
| Response is non-specific | Pathogen and antigen specific response |
| Exposure leads to immediate maximal response | Lag time between exposure and maximal response |
| Cell-mediated and humoral components | Cell-mediated and humoral components |
| No immunological memory | Exposure leads to immunological memory |
| Found in nearly all forms of life | Found only in jawed vertebrates |
Both innate and adaptive immunity depend on the ability of the immune system to distinguish between self and non-self molecules. In immunology, self molecules are components of an organism’s body that can be distinguished from foreign substances by the immune system.[6] Conversely, non-self molecules are those recognized as foreign molecules. One class of non-self molecules are called antigens (originally named for being antibody generators) and are defined as substances that bind to specific immune receptors and elicit an immune response.[7]
Surface barriers[edit]
Several barriers protect organisms from infection, including mechanical, chemical, and biological barriers. The waxy cuticle of most leaves, the exoskeleton of insects, the shells and membranes of externally deposited eggs, and skin are examples of mechanical barriers that are the first line of defense against infection.[8] Organisms cannot be completely sealed from their environments, so systems act to protect body openings such as the lungs, intestines, and the genitourinary tract. In the lungs, coughing and sneezing mechanically eject pathogens and other irritants from the respiratory tract. The flushing action of tears and urine also mechanically expels pathogens, while mucus secreted by the respiratory and gastrointestinal tract serves to trap and entangle microorganisms.[9]
Chemical barriers also protect against infection. The skin and respiratory tract secrete antimicrobial peptides such as the β-defensins.[10] Enzymes such as lysozyme and phospholipase A2 in saliva, tears, and breast milk are also antibacterials.[11][12] Vaginal secretions serve as a chemical barrier following menarche, when they become slightly acidic, while semen contains defensins and zinc to kill pathogens.[13][14] In the stomach, gastric acid serves as a chemical defense against ingested pathogens.[15]
Within the genitourinary and gastrointestinal tracts, commensal flora serve as biological barriers by competing with pathogenic bacteria for food and space and, in some cases, changing the conditions in their environment, such as pH or available iron. As a result, the probability that pathogens will reach sufficient numbers to cause illness is reduced.[16]
Innate immune system[edit]
Microorganisms or toxins that successfully enter an organism encounter the cells and mechanisms of the innate immune system. The innate response is usually triggered when microbes are identified by pattern recognition receptors, which recognize components that are conserved among broad groups of microorganisms,[17] or when damaged, injured or stressed cells send out alarm signals, many of which are recognized by the same receptors as those that recognize pathogens.[18] Innate immune defenses are non-specific, meaning these systems respond to pathogens in a generic way.[19] This system does not confer long-lasting immunity against a pathogen. The innate immune system is the dominant system of host defense in most organisms,[2] and the only one in plants.[20]
Immune sensing[edit]
Cells in the innate immune system use pattern recognition receptors to recognize molecular structures that are produced by pathogens.[21] They are proteins expressed, mainly, by cells of the innate immune system, such as dendritic cells, macrophages, monocytes, neutrophils and epithelial cells[19][22] to identify two classes of molecules: pathogen-associated molecular patterns (PAMPs), which are associated with microbial pathogens, and damage-associated molecular patterns (DAMPs), which are associated with components of host’s cells that are released during cell damage or cell death.[23]
Recognition of extracellular or endosomal PAMPs is mediated by transmembrane proteins known as toll-like receptors (TLRs).[24] TLRs share a typical structural motif, the leucine rich repeats (LRRs), which give them a curved shape.[25] Toll-like receptors were first discovered in Drosophila and trigger the synthesis and secretion of cytokines and activation of other host defense programs that are necessary for both innate or adaptive immune responses. Ten toll-like receptors have been described in humans.[26]
Cells in the innate immune system have pattern recognition receptors, which detect infection or cell damage, inside. Three major classes of these «cytosolic» receptors are NOD–like receptors, RIG (retinoic acid-inducible gene)-like receptors, and cytosolic DNA sensors.[27]
Innate immune cells[edit]
Some leukocytes (white blood cells) act like independent, single-celled organisms and are the second arm of the innate immune system. The innate leukocytes include the «professional» phagocytes (macrophages, neutrophils, and dendritic cells). These cells identify and eliminate pathogens, either by attacking larger pathogens through contact or by engulfing and then killing microorganisms. The other cells involved in the innate response include innate lymphoid cells, mast cells, eosinophils, basophils, and natural killer cells.[28]
Phagocytosis is an important feature of cellular innate immunity performed by cells called phagocytes that engulf pathogens or particles. Phagocytes generally patrol the body searching for pathogens, but can be called to specific locations by cytokines.[29] Once a pathogen has been engulfed by a phagocyte, it becomes trapped in an intracellular vesicle called a phagosome, which subsequently fuses with another vesicle called a lysosome to form a phagolysosome. The pathogen is killed by the activity of digestive enzymes or following a respiratory burst that releases free radicals into the phagolysosome.[30][31] Phagocytosis evolved as a means of acquiring nutrients, but this role was extended in phagocytes to include engulfment of pathogens as a defense mechanism.[32] Phagocytosis probably represents the oldest form of host defense, as phagocytes have been identified in both vertebrate and invertebrate animals.[33]
Neutrophils and macrophages are phagocytes that travel throughout the body in pursuit of invading pathogens.[34] Neutrophils are normally found in the bloodstream and are the most abundant type of phagocyte, representing 50% to 60% of total circulating leukocytes.[35] During the acute phase of inflammation, neutrophils migrate toward the site of inflammation in a process called chemotaxis, and are usually the first cells to arrive at the scene of infection. Macrophages are versatile cells that reside within tissues and produce an array of chemicals including enzymes, complement proteins, and cytokines, while they can also act as scavengers that rid the body of worn-out cells and other debris, and as antigen-presenting cells (APCs) that activate the adaptive immune system.[36]
Dendritic cells are phagocytes in tissues that are in contact with the external environment; therefore, they are located mainly in the skin, nose, lungs, stomach, and intestines.[37] They are named for their resemblance to neuronal dendrites, as both have many spine-like projections. Dendritic cells serve as a link between the bodily tissues and the innate and adaptive immune systems, as they present antigens to T cells, one of the key cell types of the adaptive immune system.[37]
Granulocytes are leukocytes that have granules in their cytoplasm. In this category are neutrophils, mast cells, basophils, and eosinophils. Mast cells reside in connective tissues and mucous membranes, and regulate the inflammatory response.[38] They are most often associated with allergy and anaphylaxis.[35] Basophils and eosinophils are related to neutrophils. They secrete chemical mediators that are involved in defending against parasites and play a role in allergic reactions, such as asthma.[39]
Innate lymphoid cells (ILCs) are a group of innate immune cells that are derived from common lymphoid progenitor and belong to the lymphoid lineage. These cells are defined by absence of antigen specific B or T cell receptor (TCR) because of the lack of recombination activating gene. ILCs do not express myeloid or dendritic cell markers.[40]
Natural killer cells (NK cells) are lymphocytes and a component of the innate immune system which does not directly attack invading microbes.[41] Rather, NK cells destroy compromised host cells, such as tumor cells or virus-infected cells, recognizing such cells by a condition known as «missing self.» This term describes cells with low levels of a cell-surface marker called MHC I (major histocompatibility complex)—a situation that can arise in viral infections of host cells.[42] Normal body cells are not recognized and attacked by NK cells because they express intact self MHC antigens. Those MHC antigens are recognized by killer cell immunoglobulin receptors which essentially put the brakes on NK cells.[43]
Inflammation[edit]
Inflammation is one of the first responses of the immune system to infection.[44] The symptoms of inflammation are redness, swelling, heat, and pain, which are caused by increased blood flow into tissue. Inflammation is produced by eicosanoids and cytokines, which are released by injured or infected cells. Eicosanoids include prostaglandins that produce fever and the dilation of blood vessels associated with inflammation, and leukotrienes that attract certain white blood cells (leukocytes).[45][46] Common cytokines include interleukins that are responsible for communication between white blood cells; chemokines that promote chemotaxis; and interferons that have anti-viral effects, such as shutting down protein synthesis in the host cell.[47] Growth factors and cytotoxic factors may also be released. These cytokines and other chemicals recruit immune cells to the site of infection and promote healing of any damaged tissue following the removal of pathogens.[48] The pattern-recognition receptors called inflammasomes are multiprotein complexes (consisting of an NLR, the adaptor protein ASC, and the effector molecule pro-caspase-1) that form in response to cytosolic PAMPs and DAMPs, whose function is to generate active forms of the inflammatory cytokines IL-1β and IL-18.[49]
Humoral defenses[edit]
The complement system is a biochemical cascade that attacks the surfaces of foreign cells. It contains over 20 different proteins and is named for its ability to «complement» the killing of pathogens by antibodies. Complement is the major humoral component of the innate immune response.[50][51] Many species have complement systems, including non-mammals like plants, fish, and some invertebrates.[52] In humans, this response is activated by complement binding to antibodies that have attached to these microbes or the binding of complement proteins to carbohydrates on the surfaces of microbes. This recognition signal triggers a rapid killing response.[53] The speed of the response is a result of signal amplification that occurs after sequential proteolytic activation of complement molecules, which are also proteases. After complement proteins initially bind to the microbe, they activate their protease activity, which in turn activates other complement proteases, and so on. This produces a catalytic cascade that amplifies the initial signal by controlled positive feedback.[54] The cascade results in the production of peptides that attract immune cells, increase vascular permeability, and opsonize (coat) the surface of a pathogen, marking it for destruction. This deposition of complement can also kill cells directly by disrupting their plasma membrane.[50]
Adaptive immune system[edit]
Overview of the processes involved in the primary immune response
The adaptive immune system evolved in early vertebrates and allows for a stronger immune response as well as immunological memory, where each pathogen is «remembered» by a signature antigen.[55] The adaptive immune response is antigen-specific and requires the recognition of specific «non-self» antigens during a process called antigen presentation. Antigen specificity allows for the generation of responses that are tailored to specific pathogens or pathogen-infected cells. The ability to mount these tailored responses is maintained in the body by «memory cells». Should a pathogen infect the body more than once, these specific memory cells are used to quickly eliminate it.[56]
Recognition of antigen[edit]
The cells of the adaptive immune system are special types of leukocytes, called lymphocytes. B cells and T cells are the major types of lymphocytes and are derived from hematopoietic stem cells in the bone marrow.[57] B cells are involved in the humoral immune response, whereas T cells are involved in cell-mediated immune response. Killer T cells only recognize antigens coupled to Class I MHC molecules, while helper T cells and regulatory T cells only recognize antigens coupled to Class II MHC molecules. These two mechanisms of antigen presentation reflect the different roles of the two types of T cell. A third, minor subtype are the γδ T cells that recognize intact antigens that are not bound to MHC receptors.[58] The double-positive T cells are exposed to a wide variety of self-antigens in the thymus, in which iodine is necessary for its thymus development and activity.[59] In contrast, the B cell antigen-specific receptor is an antibody molecule on the B cell surface and recognizes native (unprocessed) antigen without any need for antigen processing. Such antigens may be large molecules found on the surfaces of pathogens, but can also be small haptens (such as penicillin) attached to carrier molecule.[60] Each lineage of B cell expresses a different antibody, so the complete set of B cell antigen receptors represent all the antibodies that the body can manufacture.[57] When B or T cells encounter their related antigens they multiply and many «clones» of the cells are produced that target the same antigen. This is called clonal selection.[61]
Antigen presentation to T lymphocytes[edit]
Both B cells and T cells carry receptor molecules that recognize specific targets. T cells recognize a «non-self» target, such as a pathogen, only after antigens (small fragments of the pathogen) have been processed and presented in combination with a «self» receptor called a major histocompatibility complex (MHC) molecule.[62]
Cell mediated immunity[edit]
There are two major subtypes of T cells: the killer T cell and the helper T cell. In addition there are regulatory T cells which have a role in modulating immune response.[63]
Killer T cells[edit]
Killer T cells are a sub-group of T cells that kill cells that are infected with viruses (and other pathogens), or are otherwise damaged or dysfunctional.[64] As with B cells, each type of T cell recognizes a different antigen. Killer T cells are activated when their T-cell receptor binds to this specific antigen in a complex with the MHC Class I receptor of another cell. Recognition of this MHC:antigen complex is aided by a co-receptor on the T cell, called CD8. The T cell then travels throughout the body in search of cells where the MHC I receptors bear this antigen. When an activated T cell contacts such cells, it releases cytotoxins, such as perforin, which form pores in the target cell’s plasma membrane, allowing ions, water and toxins to enter. The entry of another toxin called granulysin (a protease) induces the target cell to undergo apoptosis.[65] T cell killing of host cells is particularly important in preventing the replication of viruses. T cell activation is tightly controlled and generally requires a very strong MHC/antigen activation signal, or additional activation signals provided by «helper» T cells (see below).[65]
Helper T cells[edit]
Helper T cells regulate both the innate and adaptive immune responses and help determine which immune responses the body makes to a particular pathogen.[66][67] These cells have no cytotoxic activity and do not kill infected cells or clear pathogens directly. They instead control the immune response by directing other cells to perform these tasks.[68]
Helper T cells express T cell receptors that recognize antigen bound to Class II MHC molecules. The MHC:antigen complex is also recognized by the helper cell’s CD4 co-receptor, which recruits molecules inside the T cell (such as Lck) that are responsible for the T cell’s activation. Helper T cells have a weaker association with the MHC:antigen complex than observed for killer T cells, meaning many receptors (around 200–300) on the helper T cell must be bound by an MHC:antigen to activate the helper cell, while killer T cells can be activated by engagement of a single MHC:antigen molecule. Helper T cell activation also requires longer duration of engagement with an antigen-presenting cell.[69] The activation of a resting helper T cell causes it to release cytokines that influence the activity of many cell types. Cytokine signals produced by helper T cells enhance the microbicidal function of macrophages and the activity of killer T cells.[70] In addition, helper T cell activation causes an upregulation of molecules expressed on the T cell’s surface, such as CD40 ligand (also called CD154), which provide extra stimulatory signals typically required to activate antibody-producing B cells.[71]
Gamma delta T cells[edit]
Gamma delta T cells (γδ T cells) possess an alternative T-cell receptor (TCR) as opposed to CD4+ and CD8+ (αβ) T cells and share the characteristics of helper T cells, cytotoxic T cells and NK cells. The conditions that produce responses from γδ T cells are not fully understood. Like other ‘unconventional’ T cell subsets bearing invariant TCRs, such as CD1d-restricted natural killer T cells, γδ T cells straddle the border between innate and adaptive immunity.[72] On one hand, γδ T cells are a component of adaptive immunity as they rearrange TCR genes to produce receptor diversity and can also develop a memory phenotype. On the other hand, the various subsets are also part of the innate immune system, as restricted TCR or NK receptors may be used as pattern recognition receptors. For example, large numbers of human Vγ9/Vδ2 T cells respond within hours to common molecules produced by microbes, and highly restricted Vδ1+ T cells in epithelia respond to stressed epithelial cells.[58]
Humoral immune response[edit]
An antibody is made up of two heavy chains and two light chains. The unique variable region allows an antibody to recognize its matching antigen.[73]
A B cell identifies pathogens when antibodies on its surface bind to a specific foreign antigen.[74] This antigen/antibody complex is taken up by the B cell and processed by proteolysis into peptides. The B cell then displays these antigenic peptides on its surface MHC class II molecules. This combination of MHC and antigen attracts a matching helper T cell, which releases lymphokines and activates the B cell.[75] As the activated B cell then begins to divide, its offspring (plasma cells) secrete millions of copies of the antibody that recognizes this antigen. These antibodies circulate in blood plasma and lymph, bind to pathogens expressing the antigen and mark them for destruction by complement activation or for uptake and destruction by phagocytes. Antibodies can also neutralize challenges directly, by binding to bacterial toxins or by interfering with the receptors that viruses and bacteria use to infect cells.[76]
Newborn infants have no prior exposure to microbes and are particularly vulnerable to infection. Several layers of passive protection are provided by the mother. During pregnancy, a particular type of antibody, called IgG, is transported from mother to baby directly through the placenta, so human babies have high levels of antibodies even at birth, with the same range of antigen specificities as their mother.[77] Breast milk or colostrum also contains antibodies that are transferred to the gut of the infant and protect against bacterial infections until the newborn can synthesize its own antibodies.[78] This is passive immunity because the fetus does not actually make any memory cells or antibodies—it only borrows them. This passive immunity is usually short-term, lasting from a few days up to several months. In medicine, protective passive immunity can also be transferred artificially from one individual to another.[79]
Immunological memory[edit]
When B cells and T cells are activated and begin to replicate, some of their offspring become long-lived memory cells. Throughout the lifetime of an animal, these memory cells remember each specific pathogen encountered and can mount a strong response if the pathogen is detected again. This is «adaptive» because it occurs during the lifetime of an individual as an adaptation to infection with that pathogen and prepares the immune system for future challenges. Immunological memory can be in the form of either passive short-term memory or active long-term memory.[80]
Physiological regulation[edit]
The time-course of an immune response begins with the initial pathogen encounter, (or initial vaccination) and leads to the formation and maintenance of active immunological memory.
The immune system is involved in many aspects of physiological regulation in the body. The immune system interacts intimately with other systems, such as the endocrine[81][82] and the nervous[83][84][85] systems. The immune system also plays a crucial role in embryogenesis (development of the embryo), as well as in tissue repair and regeneration.[86]
Hormones[edit]
Hormones can act as immunomodulators, altering the sensitivity of the immune system. For example, female sex hormones are known immunostimulators of both adaptive[87] and innate immune responses.[88] Some autoimmune diseases such as lupus erythematosus strike women preferentially, and their onset often coincides with puberty. By contrast, male sex hormones such as testosterone seem to be immunosuppressive.[89] Other hormones appear to regulate the immune system as well, most notably prolactin, growth hormone and vitamin D.[90][91]
Vitamin D[edit]
Although cellular studies indicate that vitamin D has receptors and probable functions in the immune system, there is no clinical evidence to prove that vitamin D deficiency increases the risk for immune diseases or vitamin D supplementation lowers immune disease risk.[92] A 2011 United States Institute of Medicine report stated that «outcomes related to … immune functioning and autoimmune disorders, and infections … could not be linked reliably with calcium or vitamin D intake and were often conflicting.»[93]: 5
Sleep and rest[edit]
The immune system is affected by sleep and rest, and sleep deprivation is detrimental to immune function.[94] Complex feedback loops involving cytokines, such as interleukin-1 and tumor necrosis factor-α produced in response to infection, appear to also play a role in the regulation of non-rapid eye movement (REM) sleep.[95] Thus the immune response to infection may result in changes to the sleep cycle, including an increase in slow-wave sleep relative to REM sleep.[96]
In people with sleep deprivation, active immunizations may have a diminished effect and may result in lower antibody production, and a lower immune response, than would be noted in a well-rested individual.[97] Additionally, proteins such as NFIL3, which have been shown to be closely intertwined with both T-cell differentiation and circadian rhythms, can be affected through the disturbance of natural light and dark cycles through instances of sleep deprivation. These disruptions can lead to an increase in chronic conditions such as heart disease, chronic pain, and asthma.[98]
In addition to the negative consequences of sleep deprivation, sleep and the intertwined circadian system have been shown to have strong regulatory effects on immunological functions affecting both innate and adaptive immunity. First, during the early slow-wave-sleep stage, a sudden drop in blood levels of cortisol, epinephrine, and norepinephrine causes increased blood levels of the hormones leptin, pituitary growth hormone, and prolactin. These signals induce a pro-inflammatory state through the production of the pro-inflammatory cytokines interleukin-1, interleukin-12, TNF-alpha and IFN-gamma. These cytokines then stimulate immune functions such as immune cell activation, proliferation, and differentiation. During this time of a slowly evolving adaptive immune response, there is a peak in undifferentiated or less differentiated cells, like naïve and central memory T cells. In addition to these effects, the milieu of hormones produced at this time (leptin, pituitary growth hormone, and prolactin) supports the interactions between APCs and T-cells, a shift of the Th1/Th2 cytokine balance towards one that supports Th1, an increase in overall Th cell proliferation, and naïve T cell migration to lymph nodes. This is also thought to support the formation of long-lasting immune memory through the initiation of Th1 immune responses.[99]
During wake periods, differentiated effector cells, such as cytotoxic natural killer cells and cytotoxic T lymphocytes, peak to elicit an effective response against any intruding pathogens. Anti-inflammatory molecules, such as cortisol and catecholamines, also peak during awake active times. Inflammation would cause serious cognitive and physical impairments if it were to occur during wake times, and inflammation may occur during sleep times due to the presence of melatonin. Inflammation causes a great deal of oxidative stress and the presence of melatonin during sleep times could actively counteract free radical production during this time.[99][100]
Physical exercise[edit]
Physical exercise has a positive effect on the immune system and depending on the frequency and intensity, the pathogenic effects of diseases caused by bacteria and viruses are moderated.[101] Immediately after intense exercise there is a transient immunodepression, where the number of circulating lymphocytes decreases and antibody production declines. This may give rise to a window of opportunity for infection and reactivation of latent virus infections,[102] but the evidence is inconclusive.[103][104]
Changes at the cellular level[edit]
During exercise there is an increase in circulating white blood cells of all types. This is caused by the frictional force of blood flowing on the endothelial cell surface and catecholamines affecting β-adrenergic receptors (βARs).[102] The number of neutrophils in the blood increases and remains raised for up to six hours and immature forms are present. Although the increase in neutrophils («neutrophilia») is similar to that seen during bacterial infections, after exercise the cell population returns to normal by around 24 hours.[102]
The number of circulating lymphocytes (mainly natural killer cells) decreases during intense exercise but returns to normal after 4 to 6 hours. Although up to 2% of the cells die most migrate from the blood to the tissues, mainly the intestines and lungs, where pathogens are most likely to be encountered.[102]
Some monocytes leave the blood circulation and migrate to the muscles where they differentiate and become macrophages.[102] These cells differentiate into two types: proliferative macrophages, which are responsible for increasing the number of stem cells and restorative macrophages, which are involved their maturing to muscle cells.[105]
Repair and regeneration[edit]
The immune system, particularly the innate component, plays a decisive role in tissue repair after an insult. Key actors include macrophages and neutrophils, but other cellular actors, including γδ T cells, innate lymphoid cells (ILCs), and regulatory T cells (Tregs), are also important. The plasticity of immune cells and the balance between pro-inflammatory and anti-inflammatory signals are crucial aspects of efficient tissue repair. Immune components and pathways are involved in regeneration as well, for example in amphibians such as in axolotl limb regeneration. According to one hypothesis, organisms that can regenerate (e.g., axolotls) could be less immunocompetent than organisms that cannot regenerate.[106]
Disorders of human immunity[edit]
Failures of host defense occur and fall into three broad categories: immunodeficiencies,[107] autoimmunity,[108] and hypersensitivities.[109]
Immunodeficiencies[edit]
Immunodeficiencies occur when one or more of the components of the immune system are inactive. The ability of the immune system to respond to pathogens is diminished in both the young and the elderly, with immune responses beginning to decline at around 50 years of age due to immunosenescence.[110][111] In developed countries, obesity, alcoholism, and drug use are common causes of poor immune function, while malnutrition is the most common cause of immunodeficiency in developing countries.[111] Diets lacking sufficient protein are associated with impaired cell-mediated immunity, complement activity, phagocyte function, IgA antibody concentrations, and cytokine production. Additionally, the loss of the thymus at an early age through genetic mutation or surgical removal results in severe immunodeficiency and a high susceptibility to infection.[112] Immunodeficiencies can also be inherited or ‘acquired’.[113] Severe combined immunodeficiency is a rare genetic disorder characterized by the disturbed development of functional T cells and B cells caused by numerous genetic mutations.[114] Chronic granulomatous disease, where phagocytes have a reduced ability to destroy pathogens, is an example of an inherited, or congenital, immunodeficiency. AIDS and some types of cancer cause acquired immunodeficiency.[115][116]
Autoimmunity[edit]
Overactive immune responses form the other end of immune dysfunction, particularly the autoimmune diseases. Here, the immune system fails to properly distinguish between self and non-self, and attacks part of the body. Under normal circumstances, many T cells and antibodies react with «self» peptides.[117] One of the functions of specialized cells (located in the thymus and bone marrow) is to present young lymphocytes with self antigens produced throughout the body and to eliminate those cells that recognize self-antigens, preventing autoimmunity.[74] Common autoimmune diseases include Hashimoto’s thyroiditis,[118] rheumatoid arthritis,[119] diabetes mellitus type 1,[120] and systemic lupus erythematosus.[121]
Hypersensitivity[edit]
Hypersensitivity is an immune response that damages the body’s own tissues. It is divided into four classes (Type I – IV) based on the mechanisms involved and the time course of the hypersensitive reaction. Type I hypersensitivity is an immediate or anaphylactic reaction, often associated with allergy. Symptoms can range from mild discomfort to death. Type I hypersensitivity is mediated by IgE, which triggers degranulation of mast cells and basophils when cross-linked by antigen.[122]
Type II hypersensitivity occurs when antibodies bind to antigens on the individual’s own cells, marking them for destruction. This is also called antibody-dependent (or cytotoxic) hypersensitivity, and is mediated by IgG and IgM antibodies.[122] Immune complexes (aggregations of antigens, complement proteins, and IgG and IgM antibodies) deposited in various tissues trigger Type III hypersensitivity reactions.[122] Type IV hypersensitivity (also known as cell-mediated or delayed type hypersensitivity) usually takes between two and three days to develop. Type IV reactions are involved in many autoimmune and infectious diseases, but may also involve contact dermatitis. These reactions are mediated by T cells, monocytes, and macrophages.[122]
Idiopathic inflammation[edit]
Inflammation is one of the first responses of the immune system to infection,[44] but it can appear without known cause.
Inflammation is produced by eicosanoids and cytokines, which are released by injured or infected cells. Eicosanoids include prostaglandins that produce fever and the dilation of blood vessels associated with inflammation, and leukotrienes that attract certain white blood cells (leukocytes).[45][46] Common cytokines include interleukins that are responsible for communication between white blood cells; chemokines that promote chemotaxis; and interferons that have anti-viral effects, such as shutting down protein synthesis in the host cell.[47] Growth factors and cytotoxic factors may also be released. These cytokines and other chemicals recruit immune cells to the site of infection and promote healing of any damaged tissue following the removal of pathogens.[48]
Manipulation in medicine[edit]
The immune response can be manipulated to suppress unwanted responses resulting from autoimmunity, allergy, and transplant rejection, and to stimulate protective responses against pathogens that largely elude the immune system (see immunization) or cancer.[123]
Immunosuppression[edit]
Immunosuppressive drugs are used to control autoimmune disorders or inflammation when excessive tissue damage occurs, and to prevent rejection after an organ transplant.[124][125]
Anti-inflammatory drugs are often used to control the effects of inflammation. Glucocorticoids are the most powerful of these drugs and can have many undesirable side effects, such as central obesity, hyperglycemia, and osteoporosis.[126] Their use is tightly controlled. Lower doses of anti-inflammatory drugs are often used in conjunction with cytotoxic or immunosuppressive drugs such as methotrexate or azathioprine.
Cytotoxic drugs inhibit the immune response by killing dividing cells such as activated T cells. This killing is indiscriminate and other constantly dividing cells and their organs are affected, which causes toxic side effects.[125] Immunosuppressive drugs such as cyclosporin prevent T cells from responding to signals correctly by inhibiting signal transduction pathways.[127]
Immunostimulation[edit]
Claims made by marketers of various products and alternative health providers, such as chiropractors, homeopaths, and acupuncturists to be able to stimulate or «boost» the immune system generally lack meaningful explanation and evidence of effectiveness.[128]
Vaccination[edit]
Polio vaccination in Egypt
Long-term active memory is acquired following infection by activation of B and T cells. Active immunity can also be generated artificially, through vaccination. The principle behind vaccination (also called immunization) is to introduce an antigen from a pathogen to stimulate the immune system and develop specific immunity against that particular pathogen without causing disease associated with that organism.[129] This deliberate induction of an immune response is successful because it exploits the natural specificity of the immune system, as well as its inducibility. With infectious disease remaining one of the leading causes of death in the human population, vaccination represents the most effective manipulation of the immune system mankind has developed.[57][130]
Many vaccines are based on acellular components of micro-organisms, including harmless toxin components.[129] Since many antigens derived from acellular vaccines do not strongly induce the adaptive response, most bacterial vaccines are provided with additional adjuvants that activate the antigen-presenting cells of the innate immune system and maximize immunogenicity.[131]
Tumor immunology[edit]
Another important role of the immune system is to identify and eliminate tumors. This is called immune surveillance. The transformed cells of tumors express antigens that are not found on normal cells. To the immune system, these antigens appear foreign, and their presence causes immune cells to attack the transformed tumor cells. The antigens expressed by tumors have several sources;[132] some are derived from oncogenic viruses like human papillomavirus, which causes cancer of the cervix,[133] vulva, vagina, penis, anus, mouth, and throat,[134] while others are the organism’s own proteins that occur at low levels in normal cells but reach high levels in tumor cells. One example is an enzyme called tyrosinase that, when expressed at high levels, transforms certain skin cells (for example, melanocytes) into tumors called melanomas.[135][136] A third possible source of tumor antigens are proteins normally important for regulating cell growth and survival, that commonly mutate into cancer inducing molecules called oncogenes.[132][137][138]
Macrophages have identified a cancer cell (the large, spiky mass). Upon fusing with the cancer cell, the macrophages (smaller white cells) inject toxins that kill the tumor cell. Immunotherapy for the treatment of cancer is an active area of medical research.[139]
The main response of the immune system to tumors is to destroy the abnormal cells using killer T cells, sometimes with the assistance of helper T cells.[136][140] Tumor antigens are presented on MHC class I molecules in a similar way to viral antigens. This allows killer T cells to recognize the tumor cell as abnormal.[141] NK cells also kill tumorous cells in a similar way, especially if the tumor cells have fewer MHC class I molecules on their surface than normal; this is a common phenomenon with tumors.[142] Sometimes antibodies are generated against tumor cells allowing for their destruction by the complement system.[137]
Some tumors evade the immune system and go on to become cancers.[143][144] Tumor cells often have a reduced number of MHC class I molecules on their surface, thus avoiding detection by killer T cells.[141][143] Some tumor cells also release products that inhibit the immune response; for example by secreting the cytokine TGF-β, which suppresses the activity of macrophages and lymphocytes.[143][145] In addition, immunological tolerance may develop against tumor antigens, so the immune system no longer attacks the tumor cells.[143][144]
Paradoxically, macrophages can promote tumor growth[146] when tumor cells send out cytokines that attract macrophages, which then generate cytokines and growth factors such as tumor-necrosis factor alpha that nurture tumor development or promote stem-cell-like plasticity.[143] In addition, a combination of hypoxia in the tumor and a cytokine produced by macrophages induces tumor cells to decrease production of a protein that blocks metastasis and thereby assists spread of cancer cells.[143] Anti-tumor M1 macrophages are recruited in early phases to tumor development but are progressively differentiated to M2 with pro-tumor effect, an immunosuppressor switch. The hypoxia reduces the cytokine production for the anti-tumor response and progressively macrophages acquire pro-tumor M2 functions driven by the tumor microenvironment, including IL-4 and IL-10.[147] Cancer immunotherapy covers the medical ways to stimulate the immune system to attack cancer tumors.[148]
Predicting immunogenicity[edit]
Some drugs can cause a neutralizing immune response, meaning that the immune system produces neutralizing antibodies that counteract the action of the drugs, particularly if the drugs are administered repeatedly, or in larger doses. This limits the effectiveness of drugs based on larger peptides and proteins (which are typically larger than 6000 Da).[149] In some cases, the drug itself is not immunogenic, but may be co-administered with an immunogenic compound, as is sometimes the case for Taxol. Computational methods have been developed to predict the immunogenicity of peptides and proteins, which are particularly useful in designing therapeutic antibodies, assessing likely virulence of mutations in viral coat particles, and validation of proposed peptide-based drug treatments. Early techniques relied mainly on the observation that hydrophilic amino acids are overrepresented in epitope regions than hydrophobic amino acids;[150] however, more recent developments rely on machine learning techniques using databases of existing known epitopes, usually on well-studied virus proteins, as a training set.[151] A publicly accessible database has been established for the cataloguing of epitopes from pathogens known to be recognizable by B cells.[152] The emerging field of bioinformatics-based studies of immunogenicity is referred to as immunoinformatics.[153] Immunoproteomics is the study of large sets of proteins (proteomics) involved in the immune response.[154]
Evolution and other mechanisms[edit]
Evolution of the immune system[edit]
It is likely that a multicomponent, adaptive immune system arose with the first vertebrates, as invertebrates do not generate lymphocytes or an antibody-based humoral response.[155] Many species, however, use mechanisms that appear to be precursors of these aspects of vertebrate immunity. Immune systems appear even in the structurally simplest forms of life, with bacteria using a unique defense mechanism, called the restriction modification system to protect themselves from viral pathogens, called bacteriophages.[156] Prokaryotes (bacteria and archea) also possess acquired immunity, through a system that uses CRISPR sequences to retain fragments of the genomes of phage that they have come into contact with in the past, which allows them to block virus replication through a form of RNA interference.[157][158] Prokaryotes also possess other defense mechanisms.[159][160] Offensive elements of the immune systems are also present in unicellular eukaryotes, but studies of their roles in defense are few.[161]
Pattern recognition receptors are proteins used by nearly all organisms to identify molecules associated with pathogens. Antimicrobial peptides called defensins are an evolutionarily conserved component of the innate immune response found in all animals and plants, and represent the main form of invertebrate systemic immunity.[155] The complement system and phagocytic cells are also used by most forms of invertebrate life. Ribonucleases and the RNA interference pathway are conserved across all eukaryotes, and are thought to play a role in the immune response to viruses.[162]
Unlike animals, plants lack phagocytic cells, but many plant immune responses involve systemic chemical signals that are sent through a plant.[163] Individual plant cells respond to molecules associated with pathogens known as pathogen-associated molecular patterns or PAMPs.[164] When a part of a plant becomes infected, the plant produces a localized hypersensitive response, whereby cells at the site of infection undergo rapid apoptosis to prevent the spread of the disease to other parts of the plant. Systemic acquired resistance is a type of defensive response used by plants that renders the entire plant resistant to a particular infectious agent.[163] RNA silencing mechanisms are particularly important in this systemic response as they can block virus replication.[165]
Alternative adaptive immune system[edit]
Evolution of the adaptive immune system occurred in an ancestor of the jawed vertebrates. Many of the classical molecules of the adaptive immune system (for example, immunoglobulins and T-cell receptors) exist only in jawed vertebrates. A distinct lymphocyte-derived molecule has been discovered in primitive jawless vertebrates, such as the lamprey and hagfish. These animals possess a large array of molecules called Variable lymphocyte receptors (VLRs) that, like the antigen receptors of jawed vertebrates, are produced from only a small number (one or two) of genes. These molecules are believed to bind pathogenic antigens in a similar way to antibodies, and with the same degree of specificity.[166]
Manipulation by pathogens[edit]
The success of any pathogen depends on its ability to elude host immune responses. Therefore, pathogens evolved several methods that allow them to successfully infect a host, while evading detection or destruction by the immune system.[167] Bacteria often overcome physical barriers by secreting enzymes that digest the barrier, for example, by using a type II secretion system.[168] Alternatively, using a type III secretion system, they may insert a hollow tube into the host cell, providing a direct route for proteins to move from the pathogen to the host. These proteins are often used to shut down host defenses.[169]
An evasion strategy used by several pathogens to avoid the innate immune system is to hide within the cells of their host (also called intracellular pathogenesis). Here, a pathogen spends most of its life-cycle inside host cells, where it is shielded from direct contact with immune cells, antibodies and complement. Some examples of intracellular pathogens include viruses, the food poisoning bacterium Salmonella and the eukaryotic parasites that cause malaria (Plasmodium spp.) and leishmaniasis (Leishmania spp.). Other bacteria, such as Mycobacterium tuberculosis, live inside a protective capsule that prevents lysis by complement.[170] Many pathogens secrete compounds that diminish or misdirect the host’s immune response.[167] Some bacteria form biofilms to protect themselves from the cells and proteins of the immune system. Such biofilms are present in many successful infections, such as the chronic Pseudomonas aeruginosa and Burkholderia cenocepacia infections characteristic of cystic fibrosis.[171] Other bacteria generate surface proteins that bind to antibodies, rendering them ineffective; examples include Streptococcus (protein G), Staphylococcus aureus (protein A), and Peptostreptococcus magnus (protein L).[172]
The mechanisms used to evade the adaptive immune system are more complicated. The simplest approach is to rapidly change non-essential epitopes (amino acids and/or sugars) on the surface of the pathogen, while keeping essential epitopes concealed. This is called antigenic variation. An example is HIV, which mutates rapidly, so the proteins on its viral envelope that are essential for entry into its host target cell are constantly changing. These frequent changes in antigens may explain the failures of vaccines directed at this virus.[173] The parasite Trypanosoma brucei uses a similar strategy, constantly switching one type of surface protein for another, allowing it to stay one step ahead of the antibody response.[174] Masking antigens with host molecules is another common strategy for avoiding detection by the immune system. In HIV, the envelope that covers the virion is formed from the outermost membrane of the host cell; such «self-cloaked» viruses make it difficult for the immune system to identify them as «non-self» structures.[175]
History of immunology[edit]
Paul Ehrlich (1854–1915) was awarded a Nobel Prize in 1908 for his contributions to immunology.[176]
Immunology is a science that examines the structure and function of the immune system. It originates from medicine and early studies on the causes of immunity to disease. The earliest known reference to immunity was during the plague of Athens in 430 BC. Thucydides noted that people who had recovered from a previous bout of the disease could nurse the sick without contracting the illness a second time.[177] In the 18th century, Pierre-Louis Moreau de Maupertuis experimented with scorpion venom and observed that certain dogs and mice were immune to this venom.[178] In the 10th century, Persian physician al-Razi (also known as Rhazes) wrote the first recorded theory of acquired immunity,[179][180] noting that a smallpox bout protected its survivors from future infections. Although he explained the immunity in terms of «excess moisture» being expelled from the blood—therefore preventing a second occurrence of the disease—this theory explained many observations about smallpox known during this time.[181]
These and other observations of acquired immunity were later exploited by Louis Pasteur in his development of vaccination and his proposed germ theory of disease.[182] Pasteur’s theory was in direct opposition to contemporary theories of disease, such as the miasma theory. It was not until Robert Koch’s 1891 proofs, for which he was awarded a Nobel Prize in 1905, that microorganisms were confirmed as the cause of infectious disease.[183] Viruses were confirmed as human pathogens in 1901, with the discovery of the yellow fever virus by Walter Reed.[184]
Immunology made a great advance towards the end of the 19th century, through rapid developments in the study of humoral immunity and cellular immunity.[185] Particularly important was the work of Paul Ehrlich, who proposed the side-chain theory to explain the specificity of the antigen-antibody reaction; his contributions to the understanding of humoral immunity were recognized by the award of a joint Nobel Prize in 1908, along with the founder of cellular immunology, Elie Metchnikoff.[176] In 1974, Niels Kaj Jerne developed the immune network theory; he shared a Nobel Prize in 1984 with Georges J. F. Köhler and César Milstein for theories related to the immune system.[186][187]
See also[edit]
- Fc receptor
- Immune system receptors
- Immunostimulator
- Neuroimmune system
- Original antigenic sin – when the immune system uses immunological memory upon encountering a slightly different pathogen
- Plant disease resistance
- Polyclonal response
- Tumor antigens
References[edit]
Citations[edit]
- ^ Sompayrac 2019, p. 1.
- ^ a b Litman GW, Cannon JP, Dishaw LJ (November 2005). «Reconstructing immune phylogeny: new perspectives». Nature Reviews. Immunology. 5 (11): 866–79. doi:10.1038/nri1712. PMC 3683834. PMID 16261174.
- ^ Sompayrac 2019, p. 4.
- ^ Restifo NP, Gattinoni L (October 2013). «Lineage relationship of effector and memory T cells». Current Opinion in Immunology. 25 (5): 556–63. doi:10.1016/j.coi.2013.09.003. PMC 3858177. PMID 24148236.
- ^ Kurosaki T, Kometani K, Ise W (March 2015). «Memory B cells». Nature Reviews. Immunology. 15 (3): 149–59. doi:10.1038/nri3802. PMID 25677494. S2CID 20825732.
- ^ Sompayrac 2019, p. 11.
- ^ Sompayrac 2019, p. 146.
- ^ Alberts et al. 2002, sec. «Pathogens Cross Protective Barriers to Colonize the Host».
- ^ Boyton RJ, Openshaw PJ (2002). «Pulmonary defences to acute respiratory infection». British Medical Bulletin. 61 (1): 1–12. doi:10.1093/bmb/61.1.1. PMID 11997295.
- ^ Agerberth B, Gudmundsson GH (2006). «Host antimicrobial defence peptides in human disease». Current Topics in Microbiology and Immunology. 306: 67–90. doi:10.1007/3-540-29916-5_3. ISBN 978-3-540-29915-8. PMID 16909918.
- ^ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O’Callaghan RJ (September 2001). «Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus». Investigative Ophthalmology & Visual Science. 42 (10): 2347–54. PMID 11527949.
- ^ Hankiewicz J, Swierczek E (December 1974). «Lysozyme in human body fluids». Clinica Chimica Acta; International Journal of Clinical Chemistry. 57 (3): 205–09. doi:10.1016/0009-8981(74)90398-2. PMID 4434640.
- ^ Fair WR, Couch J, Wehner N (February 1976). «Prostatic antibacterial factor. Identity and significance». Urology. 7 (2): 169–77. doi:10.1016/0090-4295(76)90305-8. PMID 54972.
- ^ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH (June 2003). «Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli». The Biochemical Journal. 372 (Pt 2): 473–83. doi:10.1042/BJ20030225. PMC 1223422. PMID 12628001.
- ^ Smith JL (2003). «The role of gastric acid in preventing foodborne disease and how bacteria overcome acid conditions». J Food Prot. 66 (7): 1292–1303. doi:10.4315/0362-028X-66.7.1292. PMID 12870767.
- ^ Gorbach SL (February 1990). «Lactic acid bacteria and human health». Annals of Medicine. 22 (1): 37–41. doi:10.3109/07853899009147239. PMID 2109988.
- ^ Medzhitov R (October 2007). «Recognition of microorganisms and activation of the immune response». Nature. 449 (7164): 819–26. Bibcode:2007Natur.449..819M. doi:10.1038/nature06246. PMID 17943118. S2CID 4392839.
- ^ Matzinger P (April 2002). «The danger model: a renewed sense of self» (PDF). Science. 296 (5566): 301–05. Bibcode:2002Sci…296..301M. doi:10.1126/science.1071059. PMID 11951032. S2CID 13615808.
- ^ a b Alberts et al. 2002, Chapter: «Innate Immunity».
- ^ Iriti 2019, p. xi.
- ^ Kumar H, Kawai T, Akira S (February 2011). «Pathogen recognition by the innate immune system». International Reviews of Immunology. 30 (1): 16–34. doi:10.3109/08830185.2010.529976. PMID 21235323. S2CID 42000671.
- ^ Schroder K, Tschopp J (March 2010). «The inflammasomes». Cell. 140 (6): 821–32. doi:10.1016/j.cell.2010.01.040. PMID 20303873. S2CID 16916572.
- ^ Sompayrac 2019, p. 20.
- ^ Beutler B, Jiang Z, Georgel P, Crozat K, Croker B, Rutschmann S, Du X, Hoebe K (2006). «Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large». Annual Review of Immunology. 24: 353–89. doi:10.1146/annurev.immunol.24.021605.090552. PMID 16551253. S2CID 20991617.
- ^ Botos I, Segal DM, Davies DR (April 2011). «The structural biology of Toll-like receptors». Structure. 19 (4): 447–59. doi:10.1016/j.str.2011.02.004. PMC 3075535. PMID 21481769.
- ^ Vijay K (June 2018). «Toll-like receptors in immunity and inflammatory diseases: Past, present, and future». Int Immunopharmacol. 59: 391–412. doi:10.1016/j.intimp.2018.03.002. PMC 7106078. PMID 29730580.
- ^ Thompson MR, Kaminski JJ, Kurt-Jones EA, Fitzgerald KA (June 2011). «Pattern recognition receptors and the innate immune response to viral infection». Viruses. 3 (6): 920–40. doi:10.3390/v3060920. PMC 3186011. PMID 21994762.
- ^ Sompayrac 2019, pp. 1–4.
- ^ Alberts et al. 2002, sec. «Phagocytic Cells Seek, Engulf, and Destroy Pathogens».
- ^ Ryter A (1985). «Relationship between ultrastructure and specific functions of macrophages». Comparative Immunology, Microbiology and Infectious Diseases. 8 (2): 119–33. doi:10.1016/0147-9571(85)90039-6. PMID 3910340.
- ^ Langermans JA, Hazenbos WL, van Furth R (September 1994). «Antimicrobial functions of mononuclear phagocytes». Journal of Immunological Methods. 174 (1–2): 185–94. doi:10.1016/0022-1759(94)90021-3. PMID 8083520.
- ^ May RC, Machesky LM (March 2001). «Phagocytosis and the actin cytoskeleton». Journal of Cell Science. 114 (Pt 6): 1061–77. doi:10.1242/jcs.114.6.1061. PMID 11228151. Archived from the original on 31 March 2020. Retrieved 6 November 2009.
- ^ Salzet M, Tasiemski A, Cooper E (2006). «Innate immunity in lophotrochozoans: the annelids» (PDF). Current Pharmaceutical Design. 12 (24): 3043–50. doi:10.2174/138161206777947551. PMID 16918433. S2CID 28520695. Archived from the original (PDF) on 31 March 2020.
- ^ Zen K, Parkos CA (October 2003). «Leukocyte-epithelial interactions». Current Opinion in Cell Biology. 15 (5): 557–64. doi:10.1016/S0955-0674(03)00103-0. PMID 14519390.
- ^ a b Stvrtinová, Jakubovský & Hulín 1995, Chapter: Inflammation and Fever.
- ^ Rua R, McGavern DB (September 2015). «Elucidation of monocyte/macrophage dynamics and function by intravital imaging». Journal of Leukocyte Biology. 98 (3): 319–32. doi:10.1189/jlb.4RI0115-006RR. PMC 4763596. PMID 26162402.
- ^ a b Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). «Antigen presentation and T cell stimulation by dendritic cells». Annual Review of Immunology. 20 (1): 621–67. doi:10.1146/annurev.immunol.20.100301.064828. PMID 11861614.
- ^ Krishnaswamy, Ajitawi & Chi 2006, pp. 13–34.
- ^ Kariyawasam HH, Robinson DS (April 2006). «The eosinophil: the cell and its weapons, the cytokines, its locations». Seminars in Respiratory and Critical Care Medicine. 27 (2): 117–27. doi:10.1055/s-2006-939514. PMID 16612762.
- ^ Spits H, Cupedo T (2012). «Innate lymphoid cells: emerging insights in development, lineage relationships, and function». Annual Review of Immunology. 30: 647–75. doi:10.1146/annurev-immunol-020711-075053. PMID 22224763.
- ^ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L (2016). «The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk». Journal of Immunology Research. 2016: 1376595. doi:10.1155/2016/1376595. PMC 5204097. PMID 28078307.
- ^ Bertok & Chow 2005, p. 17.
- ^ Rajalingam 2012, Chapter: Overview of the killer cell immunoglobulin-like receptor system.
- ^ a b Kawai T, Akira S (February 2006). «Innate immune recognition of viral infection». Nature Immunology. 7 (2): 131–37. doi:10.1038/ni1303. PMID 16424890. S2CID 9567407.
- ^ a b Miller SB (August 2006). «Prostaglandins in health and disease: an overview». Seminars in Arthritis and Rheumatism. 36 (1): 37–49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ^ a b Ogawa Y, Calhoun WJ (October 2006). «The role of leukotrienes in airway inflammation». The Journal of Allergy and Clinical Immunology. 118 (4): 789–98, quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ^ a b Le Y, Zhou Y, Iribarren P, Wang J (April 2004). «Chemokines and chemokine receptors: their manifold roles in homeostasis and disease» (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ^ a b Martin P, Leibovich SJ (November 2005). «Inflammatory cells during wound repair: the good, the bad and the ugly». Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ Platnich JM, Muruve DA (February 2019). «NOD-like receptors and inflammasomes: A review of their canonical and non-canonical signaling pathways». Archives of Biochemistry and Biophysics. 670: 4–14. doi:10.1016/j.abb.2019.02.008. PMID 30772258. S2CID 73464235.
- ^ a b Rus H, Cudrici C, Niculescu F (2005). «The role of the complement system in innate immunity». Immunologic Research. 33 (2): 103–12. doi:10.1385/IR:33:2:103. PMID 16234578. S2CID 46096567.
- ^ Degn SE, Thiel S (August 2013). «Humoral pattern recognition and the complement system». Scandinavian Journal of Immunology. 78 (2): 181–93. doi:10.1111/sji.12070. PMID 23672641.
- ^ Bertok & Chow 2005, pp. 112–113.
- ^ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP (1996). «Control of the complement system». Advances in Immunology. 61: 201–283. doi:10.1016/S0065-2776(08)60868-8. ISBN 978-0-12-022461-6. PMID 8834497.
- ^ Sim RB, Tsiftsoglou SA (February 2004). «Proteases of the complement system» (PDF). Biochemical Society Transactions. 32 (Pt 1): 21–27. doi:10.1042/BST0320021. PMID 14748705. S2CID 24505041. Archived from the original (PDF) on 2 March 2019.
- ^ Pancer Z, Cooper MD (2006). «The evolution of adaptive immunity». Annual Review of Immunology. 24 (1): 497–518. doi:10.1146/annurev.immunol.24.021605.090542. PMID 16551257.
- ^ Sompayrac 2019, p. 38.
- ^ a b c Janeway 2005.
- ^ a b Holtmeier W, Kabelitz D (2005). «gammadelta T cells link innate and adaptive immune responses». Chemical Immunology and Allergy. 86: 151–83. doi:10.1159/000086659. ISBN 3-8055-7862-8. PMID 15976493.
- ^ Venturi S, Venturi M (September 2009). «Iodine, thymus, and immunity». Nutrition. 25 (9): 977–79. doi:10.1016/j.nut.2009.06.002. PMID 19647627.
- ^ Janeway, Travers & Walport 2001, sec. 12-10.
- ^ Sompayrac 2019, pp. 5–6.
- ^ Sompayrac 2019, pp. 51–53.
- ^ Sompayrac 2019, pp. 7–8.
- ^ Harty JT, Tvinnereim AR, White DW (2000). «CD8+ T cell effector mechanisms in resistance to infection». Annual Review of Immunology. 18 (1): 275–308. doi:10.1146/annurev.immunol.18.1.275. PMID 10837060.
- ^ a b Radoja S, Frey AB, Vukmanovic S (2006). «T-cell receptor signaling events triggering granule exocytosis». Critical Reviews in Immunology. 26 (3): 265–90. doi:10.1615/CritRevImmunol.v26.i3.40. PMID 16928189.
- ^ Abbas AK, Murphy KM, Sher A (October 1996). «Functional diversity of helper T lymphocytes». Nature. 383 (6603): 787–93. Bibcode:1996Natur.383..787A. doi:10.1038/383787a0. PMID 8893001. S2CID 4319699.
- ^ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG (2006). «Helper T cell-regulated B cell immunity». Current Topics in Microbiology and Immunology. 311: 59–83. doi:10.1007/3-540-32636-7_3. ISBN 978-3-540-32635-9. PMID 17048705.
- ^ Sompayrac 2019, p. 8.
- ^ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH (November 2002). «Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation». Proceedings of the National Academy of Sciences of the United States of America. 99 (23): 15006–11. Bibcode:2002PNAS…9915006K. doi:10.1073/pnas.232058599. PMC 137535. PMID 12419850.
- ^ Alberts et al. 2002, Chapter. «Helper T Cells and Lymphocyte Activation».
- ^ Grewal IS, Flavell RA (1998). «CD40 and CD154 in cell-mediated immunity». Annual Review of Immunology. 16 (1): 111–35. doi:10.1146/annurev.immunol.16.1.111. PMID 9597126.
- ^ Girardi M (January 2006). «Immunosurveillance and immunoregulation by gammadelta T cells». The Journal of Investigative Dermatology. 126 (1): 25–31. doi:10.1038/sj.jid.5700003. PMID 16417214.
- ^ «Understanding the Immune System: How it Works» (PDF). National Institute of Allergy and Infectious Diseases (NIAID). Archived from the original (PDF) on 3 January 2007. Retrieved 1 January 2007.
- ^ a b Sproul TW, Cheng PC, Dykstra ML, Pierce SK (2000). «A role for MHC class II antigen processing in B cell development». International Reviews of Immunology. 19 (2–3): 139–55. doi:10.3109/08830180009088502. PMID 10763706. S2CID 6550357.
- ^ Parker DC (1993). «T cell-dependent B cell activation». Annual Review of Immunology. 11: 331–60. doi:10.1146/annurev.iy.11.040193.001555. PMID 8476565.
- ^ Murphy & Weaver 2016, Chapter 10: The Humoral Immune Response.
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (May 1999). «Dynamics of immunoglobulins at the feto-maternal interface» (PDF). Reviews of Reproduction. 4 (2): 81–89. doi:10.1530/ror.0.0040081. PMID 10357095. S2CID 31099552. Archived from the original (PDF) on 30 January 2021.
- ^ Van de Perre P (July 2003). «Transfer of antibody via mother’s milk». Vaccine. 21 (24): 3374–76. doi:10.1016/S0264-410X(03)00336-0. PMID 12850343.
- ^ Keller MA, Stiehm ER (October 2000). «Passive immunity in prevention and treatment of infectious diseases». Clinical Microbiology Reviews. 13 (4): 602–14. doi:10.1128/CMR.13.4.602-614.2000. PMC 88952. PMID 11023960.
- ^ Sompayrac 2019, p. 98.
- ^ Wick G, Hu Y, Schwarz S, Kroemer G (October 1993). «Immunoendocrine communication via the hypothalamo-pituitary-adrenal axis in autoimmune diseases». Endocrine Reviews. 14 (5): 539–63. doi:10.1210/edrv-14-5-539. PMID 8262005.
- ^ Kroemer G, Brezinschek HP, Faessler R, Schauenstein K, Wick G (June 1988). «Physiology and pathology of an immunoendocrine feedback loop». Immunology Today. 9 (6): 163–5. doi:10.1016/0167-5699(88)91289-3. PMID 3256322.
- ^ Trakhtenberg EF, Goldberg JL (October 2011). «Immunology. Neuroimmune communication». Science. 334 (6052): 47–8. Bibcode:2011Sci…334…47T. doi:10.1126/science.1213099. PMID 21980100. S2CID 36504684.
- ^ Veiga-Fernandes H, Mucida D (May 2016). «Neuro-Immune Interactions at Barrier Surfaces». Cell. 165 (4): 801–11. doi:10.1016/j.cell.2016.04.041. PMC 4871617. PMID 27153494.
- ^ «Neuroimmune communication». Nature Neuroscience. 20 (2): 127. February 2017. doi:10.1038/nn.4496. PMID 28092662.
- ^ Wilcox SM, Arora H, Munro L, Xin J, Fenninger F, Johnson LA, Pfeifer CG, Choi KB, Hou J, Hoodless PA, Jefferies WA (2017). «The role of the innate immune response regulatory gene ABCF1 in mammalian embryogenesis and development». PLOS ONE. 12 (5): e0175918. Bibcode:2017PLoSO..1275918W. doi:10.1371/journal.pone.0175918. PMC 5438103. PMID 28542262.
- ^ Wira, Crane-Godreau & Grant 2004, Chapter: Endocrine regulation of the mucosal immune system in the female reproductive tract.
- ^ Lang TJ (December 2004). «Estrogen as an immunomodulator». Clinical Immunology. 113 (3): 224–30. doi:10.1016/j.clim.2004.05.011. PMID 15507385.
Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y (July 1999). «Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle». Molecular Human Reproduction. 5 (7): 656–61. doi:10.1093/molehr/5.7.656. PMID 10381821.
Cutolo M, Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). «Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity». Lupus. 13 (9): 635–38. doi:10.1191/0961203304lu1094oa. PMID 15485092. S2CID 23941507.
King AE, Critchley HO, Kelly RW (February 2000). «Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial protective role». Molecular Human Reproduction. 6 (2): 191–96. doi:10.1093/molehr/6.2.191. PMID 10655462. - ^ Fimmel S, Zouboulis CC (2005). «Influence of physiological androgen levels on wound healing and immune status in men». The Aging Male. 8 (3–4): 166–74. doi:10.1080/13685530500233847. PMID 16390741. S2CID 1021367.
- ^ Dorshkind K, Horseman ND (June 2000). «The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency». Endocrine Reviews. 21 (3): 292–312. doi:10.1210/edrv.21.3.0397. PMID 10857555.
- ^ Nagpal S, Na S, Rathnachalam R (August 2005). «Noncalcemic actions of vitamin D receptor ligands». Endocrine Reviews. 26 (5): 662–87. doi:10.1210/er.2004-0002. PMID 15798098.
- ^ «Vitamin D — Fact Sheet for Health Professionals». Office of Dietary Supplements, US National Institutes of Health. 17 August 2021. Retrieved 31 March 2022.
- ^ Institute of Medicine (2011). «8, Implications and Special Concerns». In Ross AC, Taylor CL, Yaktine AL, Del Valle HB (eds.). Dietary Reference Intakes for Calcium and Vitamin D. The National Academies Collection: Reports funded by the National Institutes of Health. National Academies Press. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Bryant PA, Trinder J, Curtis N (June 2004). «Sick and tired: Does sleep have a vital role in the immune system?». Nature Reviews. Immunology. 4 (6): 457–67. doi:10.1038/nri1369. PMID 15173834. S2CID 29318345.
- ^ Krueger JM, Majde JA (May 2003). «Humoral links between sleep and the immune system: research issues». Annals of the New York Academy of Sciences. 992 (1): 9–20. Bibcode:2003NYASA.992….9K. doi:10.1111/j.1749-6632.2003.tb03133.x. PMID 12794042. S2CID 24508121.
- ^ Majde JA, Krueger JM (December 2005). «Links between the innate immune system and sleep». The Journal of Allergy and Clinical Immunology. 116 (6): 1188–98. doi:10.1016/j.jaci.2005.08.005. PMID 16337444.
- ^ Taylor DJ, Kelly K, Kohut ML, Song KS (2017). «Is Insomnia a Risk Factor for Decreased Influenza Vaccine Response?». Behavioral Sleep Medicine. 15 (4): 270–287. doi:10.1080/15402002.2015.1126596. PMC 5554442. PMID 27077395.
- ^ Krueger JM (2008). «The role of cytokines in sleep regulation». Current Pharmaceutical Design. 14 (32): 3408–16. doi:10.2174/138161208786549281. PMC 2692603. PMID 19075717.
- ^ a b Besedovsky L, Lange T, Born J (January 2012). «Sleep and immune function». Pflügers Archiv. 463 (1): 121–37. doi:10.1007/s00424-011-1044-0. PMC 3256323. PMID 22071480.
- ^ «Can Better Sleep Mean Catching fewer Colds?». Archived from the original on 9 May 2014. Retrieved 28 April 2014.
- ^ da Silveira MP, da Silva Fagundes KK, Bizuti MR, Starck É, Rossi RC, de Resende E, Silva DT (February 2021). «Physical exercise as a tool to help the immune system against COVID-19: an integrative review of the current literature». Clinical and Experimental Medicine. 21 (1): 15–28. doi:10.1007/s10238-020-00650-3. PMC 7387807. PMID 32728975.
- ^ a b c d e Peake JM, Neubauer O, Walsh NP, Simpson RJ (May 2017). «Recovery of the immune system after exercise» (PDF). Journal of Applied Physiology. 122 (5): 1077–1087. doi:10.1152/japplphysiol.00622.2016. PMID 27909225. S2CID 3521624.
- ^ Campbell JP, Turner JE (2018). «Debunking the Myth of Exercise-Induced Immune Suppression: Redefining the Impact of Exercise on Immunological Health Across the Lifespan». Frontiers in Immunology. 9: 648. doi:10.3389/fimmu.2018.00648. PMC 5911985. PMID 29713319.
- ^ Simpson RJ, Campbell JP, Gleeson M, Krüger K, Nieman DC, Pyne DB, Turner JE, Walsh NP (2020). «Can exercise affect immune function to increase susceptibility to infection?». Exercise Immunology Review. 26: 8–22. PMID 32139352.
- ^ Minari AL, Thomatieli-Santos RV (January 2022). «From skeletal muscle damage and regeneration to the hypertrophy induced by exercise: what is the role of different macrophage subsets?». American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 322 (1): R41–R54. doi:10.1152/ajpregu.00038.2021. PMID 34786967. S2CID 244369441.
- ^ Godwin JW, Pinto AR, Rosenthal NA (January 2017). «Chasing the recipe for a pro-regenerative immune system». Seminars in Cell & Developmental Biology. Innate immune pathways in wound healing/Peromyscus as a model system. 61: 71–79. doi:10.1016/j.semcdb.2016.08.008. PMC 5338634. PMID 27521522.
- ^ Sompayrac 2019, pp. 120–24.
- ^ Sompayrac 2019, pp. 114–18.
- ^ Sompayrac 2019, pp. 111–14.
- ^ Aw D, Silva AB, Palmer DB (April 2007). «Immunosenescence: emerging challenges for an ageing population». Immunology. 120 (4): 435–46. doi:10.1111/j.1365-2567.2007.02555.x. PMC 2265901. PMID 17313487.
- ^ a b Chandra RK (August 1997). «Nutrition and the immune system: an introduction». The American Journal of Clinical Nutrition. 66 (2): 460S–63S. doi:10.1093/ajcn/66.2.460S. PMID 9250133.
- ^ Miller JF (July 2002). «The discovery of thymus function and of thymus-derived lymphocytes». Immunological Reviews. 185 (1): 7–14. doi:10.1034/j.1600-065X.2002.18502.x. PMID 12190917. S2CID 12108587.
- ^ Reece 2011, p. 967.
- ^ Burg M, Gennery AR (2011). «Educational paper: The expanding clinical and immunological spectrum of severe combined immunodeficiency». Eur J Pediatr. 170 (5): 561–571. doi:10.1007/s00431-011-1452-3. PMC 3078321. PMID 21479529.
- ^ Joos L, Tamm M (2005). «Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy». Proceedings of the American Thoracic Society. 2 (5): 445–48. doi:10.1513/pats.200508-097JS. PMID 16322598.
- ^ Copeland KF, Heeney JL (December 1996). «T helper cell activation and human retroviral pathogenesis». Microbiological Reviews. 60 (4): 722–42. doi:10.1128/MMBR.60.4.722-742.1996. PMC 239461. PMID 8987361.
- ^ Miller JF (1993). «Self-nonself discrimination and tolerance in T and B lymphocytes». Immunologic Research. 12 (2): 115–30. doi:10.1007/BF02918299. PMID 8254222. S2CID 32476323.
- ^
This article incorporates text from this source, which is in the public domain: «Hashimoto’s disease». Office on Women’s Health, U.S. Department of Health and Human Services. 12 June 2017. Archived from the original on 28 July 2017. Retrieved 17 July 2017.
- ^ Smolen JS, Aletaha D, McInnes IB (October 2016). «Rheumatoid arthritis» (PDF). Lancet. 388 (10055): 2023–2038. doi:10.1016/S0140-6736(16)30173-8. PMID 27156434. S2CID 37973054.
- ^ Farhy LS, McCall AL (July 2015). «Glucagon — the new ‘insulin’ in the pathophysiology of diabetes». Current Opinion in Clinical Nutrition and Metabolic Care. 18 (4): 407–14. doi:10.1097/mco.0000000000000192. PMID 26049639. S2CID 19872862.
- ^ «Handout on Health: Systemic Lupus Erythematosus». www.niams.nih.gov. February 2015. Archived from the original on 17 June 2016. Retrieved 12 June 2016.
- ^ a b c d Ghaffar A (2006). «Immunology – Chapter Seventeen: Hypersensitivity States». Microbiology and Immunology On-line. University of South Carolina School of Medicine. Retrieved 29 May 2016.
- ^ Sompayrac 2019, pp. 83–85.
- ^ Ciccone 2015, Chapter 37.
- ^ a b Taylor AL, Watson CJ, Bradley JA (October 2005). «Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy». Critical Reviews in Oncology/Hematology. 56 (1): 23–46. doi:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ^ Barnes PJ (March 2006). «Corticosteroids: the drugs to beat». European Journal of Pharmacology. 533 (1–3): 2–14. doi:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ^ Masri MA (July 2003). «The mosaic of immunosuppressive drugs». Molecular Immunology. 39 (17–18): 1073–77. doi:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ^ Hall H (July–August 2020). «How You Can Really Boost Your Immune System». Skeptical Inquirer. Amherst, New York: Center for Inquiry. Archived from the original on 21 January 2021. Retrieved 21 January 2021.
- ^ a b Reece 2011, p. 965.
- ^ Death and DALY estimates for 2002 by cause for WHO Member States. Archived 21 October 2008 at the Wayback Machine World Health Organization. Retrieved on 1 January 2007.
- ^ Singh M, O’Hagan D (November 1999). «Advances in vaccine adjuvants». Nature Biotechnology. 17 (11): 1075–81. doi:10.1038/15058. PMID 10545912. S2CID 21346647.
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (January 2006). «Cytotoxic T cells». The Journal of Investigative Dermatology. 126 (1): 32–41. doi:10.1038/sj.jid.5700001. PMID 16417215.
- ^ Boon T, van der Bruggen P (March 1996). «Human tumor antigens recognized by T lymphocytes». The Journal of Experimental Medicine. 183 (3): 725–29. doi:10.1084/jem.183.3.725. PMC 2192342. PMID 8642276.
- ^ Ljubojevic S, Skerlev M (2014). «HPV-associated diseases». Clinics in Dermatology. 32 (2): 227–34. doi:10.1016/j.clindermatol.2013.08.007. PMID 24559558.
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G (March 2000). «T-cell recognition of melanoma-associated antigens». Journal of Cellular Physiology. 182 (3): 323–31. doi:10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-#. PMID 10653598. S2CID 196590144.
- ^ a b Romero P, Cerottini JC, Speiser DE (2006). «The human T cell response to melanoma antigens». Advances in Immunology. 92: 187–224. doi:10.1016/S0065-2776(06)92005-7. ISBN 978-0-12-373636-9. PMID 17145305.
- ^ a b Guevara-Patiño JA, Turk MJ, Wolchok JD, Houghton AN (2003). «Immunity to cancer through immune recognition of altered self: studies with melanoma». Advances in Cancer Research. 90: 157–77. doi:10.1016/S0065-230X(03)90005-4. ISBN 978-0-12-006690-2. PMID 14710950.
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G (March 2001). «A listing of human tumor antigens recognized by T cells». Cancer Immunology, Immunotherapy. 50 (1): 3–15. doi:10.1007/s002620000169. PMID 11315507. S2CID 42681479.
- ^ Morgan RA, Dudley ME, Wunderlich JR, et al. (October 2006). «Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes». Science. 314 (5796): 126–29. Bibcode:2006Sci…314..126M. doi:10.1126/science.1129003. PMC 2267026. PMID 16946036.
- ^ Gerloni M, Zanetti M (June 2005). «CD4 T cells in tumor immunity». Springer Seminars in Immunopathology. 27 (1): 37–48. doi:10.1007/s00281-004-0193-z. PMID 15965712. S2CID 25182066.
- ^ a b Seliger B, Ritz U, Ferrone S (January 2006). «Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation». International Journal of Cancer. 118 (1): 129–38. doi:10.1002/ijc.21312. PMID 16003759. S2CID 5655726.
- ^ Hayakawa Y, Smyth MJ (2006). «Innate immune recognition and suppression of tumors». Advances in Cancer Research. 95: 293–322. doi:10.1016/S0065-230X(06)95008-8. ISBN 978-0-12-006695-7. PMID 16860661.
- ^ a b c d e f Syn NL, Teng MW, Mok TS, Soo RA (December 2017). «De-novo and acquired resistance to immune checkpoint targeting». The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ a b Seliger B (2005). «Strategies of tumor immune evasion». BioDrugs. 19 (6): 347–54. doi:10.2165/00063030-200519060-00002. PMID 16392887. S2CID 1838144.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (September 2006). «Targeting tumor-related immunosuppression for cancer immunotherapy». Endocrine, Metabolic & Immune Disorders Drug Targets. 6 (3): 233–7. doi:10.2174/187153006778250019. PMID 17017974.
- ^ Stix G (July 2007). «A malignant flame. Understanding chronic inflammation, which contributes to heart disease, Alzheimer’s and a variety of other ailments, may be a key to unlocking the mysteries of cancer» (PDF). Scientific American. 297 (1): 60–67. Bibcode:2007SciAm.297a..60S. doi:10.1038/scientificamerican0707-60. PMID 17695843. Archived from the original (PDF) on 16 July 2011.
- ^ Cervantes-Villagrana RD, Albores-García D, Cervantes-Villagrana AR, García-Acevez SJ (18 June 2020). «Tumor-induced Neurogenesis and Immune Evasion as Targets of Innovative Anti-Cancer Therapies». Signal Transduct Target Ther. 5 (1): 99. doi:10.1038/s41392-020-0205-z. PMC 7303203. PMID 32555170.
- ^ Yang Y (September 2015). «Cancer immunotherapy: harnessing the immune system to battle cancer». The Journal of Clinical Investigation. 125 (9): 3335–7. doi:10.1172/JCI83871. PMC 4588312. PMID 26325031.
- ^ Baker MP, Reynolds HM, Lumicisi B, Bryson CJ (October 2010). «Immunogenicity of protein therapeutics: The key causes, consequences and challenges». Self/Nonself. 1 (4): 314–322. doi:10.4161/self.1.4.13904. PMC 3062386. PMID 21487506.
- ^ Welling GW, Weijer WJ, van der Zee R, Welling-Wester S (September 1985). «Prediction of sequential antigenic regions in proteins». FEBS Letters. 188 (2): 215–18. doi:10.1016/0014-5793(85)80374-4. PMID 2411595.
- ^ Söllner J, Mayer B (2006). «Machine learning approaches for prediction of linear B-cell epitopes on proteins». Journal of Molecular Recognition. 19 (3): 200–08. doi:10.1002/jmr.771. PMID 16598694. S2CID 18197810.
- ^ Saha S, Bhasin M, Raghava GP (2005). «Bcipep: a database of B-cell epitopes». BMC Genomics. 6: 79. doi:10.1186/1471-2164-6-79. PMC 1173103. PMID 15921533.
- ^ Flower DR, Doytchinova IA (2002). «Immunoinformatics and the prediction of immunogenicity». Applied Bioinformatics. 1 (4): 167–76. PMID 15130835.
- ^ Kanduc D (September 2019). «From hepatitis C virus immunoproteomics to rheumatology via cross-reactivity in one table». Current Opinion in Rheumatology. 31 (5): 488–492. doi:10.1097/BOR.0000000000000606. PMID 31356379. S2CID 198982175.
- ^ a b Flajnik MF, Kasahara M (January 2010). «Origin and evolution of the adaptive immune system: genetic events and selective pressures». Nature Reviews. Genetics. 11 (1): 47–59. doi:10.1038/nrg2703. PMC 3805090. PMID 19997068.
- ^ Bickle TA, Krüger DH (June 1993). «Biology of DNA restriction». Microbiological Reviews. 57 (2): 434–50. doi:10.1128/MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (March 2007). «CRISPR provides acquired resistance against viruses in prokaryotes». Science. 315 (5819): 1709–12. Bibcode:2007Sci…315.1709B. doi:10.1126/science.1138140. hdl:20.500.11794/38902. PMID 17379808. S2CID 3888761.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J (August 2008). «Small CRISPR RNAs guide antiviral defense in prokaryotes». Science. 321 (5891): 960–64. Bibcode:2008Sci…321..960B. doi:10.1126/science.1159689. PMC 5898235. PMID 18703739.
- ^ Hille F, Charpentier E (November 2016). «CRISPR-Cas: biology, mechanisms and relevance». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 371 (1707): 20150496. doi:10.1098/rstb.2015.0496. PMC 5052741. PMID 27672148.
- ^ Koonin EV (February 2017). «Evolution of RNA- and DNA-guided antivirus defense systems in prokaryotes and eukaryotes: common ancestry vs convergence». Biology Direct. 12 (1): 5. doi:10.1186/s13062-017-0177-2. PMC 5303251. PMID 28187792.
- ^ Bayne CJ (2003). «Origins and evolutionary relationships between the innate and adaptive arms of immune systems». Integr. Comp. Biol. 43 (2): 293–99. doi:10.1093/icb/43.2.293. PMID 21680436.
- ^ Stram Y, Kuzntzova L (June 2006). «Inhibition of viruses by RNA interference». Virus Genes. 32 (3): 299–306. doi:10.1007/s11262-005-6914-0. PMC 7088519. PMID 16732482.
- ^ a b Schneider D. «Innate Immunity – Lecture 4: Plant immune responses» (PDF). Stanford University Department of Microbiology and Immunology. Retrieved 1 January 2007.
- ^ Jones JD, Dangl JL (November 2006). «The plant immune system». Nature. 444 (7117): 323–29. Bibcode:2006Natur.444..323J. doi:10.1038/nature05286. PMID 17108957.
- ^ Baulcombe D (September 2004). «RNA silencing in plants». Nature. 431 (7006): 356–63. Bibcode:2004Natur.431..356B. doi:10.1038/nature02874. PMID 15372043. S2CID 4421274.
- ^ Alder MN, Rogozin IB, Iyer LM, Glazko GV, Cooper MD, Pancer Z (December 2005). «Diversity and function of adaptive immune receptors in a jawless vertebrate». Science. 310 (5756): 1970–73. Bibcode:2005Sci…310.1970A. doi:10.1126/science.1119420. PMID 16373579.
- ^ a b Finlay BB, McFadden G (February 2006). «Anti-immunology: evasion of the host immune system by bacterial and viral pathogens». Cell. 124 (4): 767–82. doi:10.1016/j.cell.2006.01.034. PMID 16497587. S2CID 15418509.
- ^ Cianciotto NP (December 2005). «Type II secretion: a protein secretion system for all seasons». Trends in Microbiology. 13 (12): 581–88. doi:10.1016/j.tim.2005.09.005. PMID 16216510.
- ^ Winstanley C, Hart CA (February 2001). «Type III secretion systems and pathogenicity islands». Journal of Medical Microbiology. 50 (2): 116–26. doi:10.1099/0022-1317-50-2-116. PMID 11211218.
- ^ Finlay BB, Falkow S (June 1997). «Common themes in microbial pathogenicity revisited». Microbiology and Molecular Biology Reviews. 61 (2): 136–69. doi:10.1128/mmbr.61.2.136-169.1997. PMC 232605. PMID 9184008.
- ^ Kobayashi H (2005). «Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections». Treatments in Respiratory Medicine. 4 (4): 241–53. doi:10.2165/00151829-200504040-00003. PMID 16086598. S2CID 31788349.
- ^ Housden NG, Harrison S, Roberts SE, Beckingham JA, Graille M, Stura E, Gore MG (June 2003). «Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus» (PDF). Biochemical Society Transactions. 31 (Pt 3): 716–18. doi:10.1042/BST0310716. PMID 12773190. S2CID 10322322. Archived from the original (PDF) on 2 March 2019.
- ^ Burton DR, Stanfield RL, Wilson IA (October 2005). «Antibody vs. HIV in a clash of evolutionary titans». Proceedings of the National Academy of Sciences of the United States of America. 102 (42): 14943–48. Bibcode:2005PNAS..10214943B. doi:10.1073/pnas.0505126102. PMC 1257708. PMID 16219699.
- ^ Taylor JE, Rudenko G (November 2006). «Switching trypanosome coats: what’s in the wardrobe?». Trends in Genetics. 22 (11): 614–20. doi:10.1016/j.tig.2006.08.003. PMID 16908087.
- ^ Cantin R, Méthot S, Tremblay MJ (June 2005). «Plunder and stowaways: incorporation of cellular proteins by enveloped viruses». Journal of Virology. 79 (11): 6577–87. doi:10.1128/JVI.79.11.6577-6587.2005. PMC 1112128. PMID 15890896.
- ^ a b «The Nobel Prize in Physiology or Medicine 1908». The Nobel Prize. Retrieved 8 January 2007.
- ^ Retief FP, Cilliers L (January 1998). «The epidemic of Athens, 430–426 BC». South African Medical Journal = Suid-Afrikaanse Tydskrif vir Geneeskunde. 88 (1): 50–53. PMID 9539938.
- ^ Ostoya P (1954). «Maupertuis et la biologie». Revue d’histoire des sciences et de leurs applications. 7 (1): 60–78. doi:10.3406/rhs.1954.3379.
- ^ Doherty M, Robertson MJ (December 2004). «Some early Trends in Immunology». Trends in Immunology. 25 (12): 623–31. doi:10.1016/j.it.2004.10.008. PMID 15530829.
- ^ Silverstein 1989, p. 6.
- ^ Silverstein 1989, p. 7.
- ^ Plotkin SA (April 2005). «Vaccines: past, present and future». Nature Medicine. 11 (4 Suppl): S5–11. doi:10.1038/nm1209. PMC 7095920. PMID 15812490.
- ^ The Nobel Prize in Physiology or Medicine 1905 Archived 10 December 2006 at the Wayback Machine Nobelprize.org Retrieved on 8 January 2009.
- ^ Major Walter Reed, Medical Corps, U.S. Army Walter Reed Army Medical Center. Retrieved on 8 January 2007.
- ^ Metchnikoff E (1905). Immunity in Infective Diseases (Full Text Version: Internet Archive). Translated by Binnie FG. Cambridge University Press. LCCN 68025143.
history of humoral immunity.
- ^ «Niels K. Jerne». The Nobel Prize. Retrieved 27 November 2020.
- ^ Yewdell J (4 October 2003). «He put the Id in Idiotype». EMBO Reports (Book review). 4 (10): 931. doi:10.1038/sj.embor.embor951. PMC 1326409.
General bibliography[edit]
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. ISBN 978-0-8153-3218-3.
- Bertok L, Chow D (2005). Bertok L, Chow D (eds.). Natural Immunity. Vol. 5 (1st ed.). ISBN 978-0-44451-755-5.
- Iriti M (2019). Plant Innate Immunity 2.0. Basel: MDPI. doi:10.3390/books978-3-03897-581-6. ISBN 978-3-03897-580-9. OCLC 1105775088.
- Ciccone CD (2015). Pharmacology in Rehabilitation (Contemporary Perspectives in Rehabilitation) (5th ed.). F.A. Davis Company. ISBN 978-0-80364-029-0.
- Janeway CA, Travers P, Walport M (2001). Immunobiology (5th ed.). Garland Science.
- Janeway CA (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4.
- Krishnaswamy G, Ajitawi O, Chi DS (2006). «The human mast cell: an overview». Mast Cells. Methods in Molecular Biology. Vol. 315. pp. 13–34. doi:10.1385/1-59259-967-2:013. ISBN 1-59259-967-2. PMID 16110146.
- Murphy K, Weaver C (2016). Immunobiology (9 ed.). Garland Science. ISBN 978-0-8153-4505-3.
- Rajalingam R (2012). Immunogenetics. Methods in Molecular Biology. Vol. 882. pp. 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- Reece J (2011). Campbell biology. Frenchs Forest, N.S.W: Pearson Australia. ISBN 978-1-4425-3176-5. OCLC 712136178.
- Silverstein AM (1989). A History of Immunology. Academic Press. ISBN 978-0-08-092583-7.
- Sompayrac L (2019). How the immune system works. Hoboken, NJ: Wiley-Blackwell. ISBN 978-1-119-54212-4. OCLC 1083261548.
- Stvrtinová V, Jakubovský J, Hulín I (1995). Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press.
- Wira CR, Crane-Godreau M, Grant K (2004). Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.). Mucosal Immunology. San Francisco: Elsevier. ISBN 0-12-491543-4.
Further reading[edit]
- Dettmer P (2021). Immune: A Journey into the Mysterious System that Keeps You Alive. Philip Laibacher (illustrations). New York: Random House. ISBN 9780593241318. OCLC 1263845194. Archived from the original on 24 November 2021. Retrieved 4 January 2022. (The book’s sources are only online.) A popular science explanation of the immune system.
External links[edit]
- Microbiology and Immunology On-Line Textbook – from the University of South Carolina School of Medicine (undergraduate level)
| В Википедии есть статья «иммунная система». |
Содержание
- 1 Русский
- 1.1 Тип и синтаксические свойства сочетания
- 1.2 Произношение
- 1.3 Семантические свойства
- 1.3.1 Значение
- 1.3.2 Синонимы
- 1.3.3 Антонимы
- 1.3.4 Гиперонимы
- 1.3.5 Гипонимы
- 1.4 Этимология
- 1.5 Перевод
Русский[править]
Тип и синтаксические свойства сочетания[править]
им—му́н—на·я сис—те́—ма
Устойчивое сочетание (термин). Используется в качестве именной группы.
Произношение[править]
- МФА: [ɪˈm(ː)unːəɪ̯ə sʲɪˈsʲtʲemə]
Семантические свойства[править]
Значение[править]
- анат. совокупность органов, тканей и клеток, организованных и взаимодействующих особым образом с целью защиты организма от болезней посредством уничтожения внешних и внутренних чужеродных для организма веществ ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Этимология[править]
Перевод[править]
| Список переводов | |
|
|
|
Статья нуждается в доработке.
Это незаконченная статья. Вы можете помочь проекту, исправив и дополнив её.
(См. Общепринятые правила). |
Имму́нная систе́ма — система органов, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознаёт множество разнообразных возбудителей — от вирусов до паразитических червей — и отличает их от биомолекул собственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
В иммунной системе развитых организмов существует множество способов обнаружения и удаления чужеродных агентов: этот процесс называется иммунным ответом. Все формы иммунного ответа можно разделить на врождённые и приобретённые реакции. Основное различие между ними в том, что приобретённый иммунитет высокоспецифичен по отношению к конкретному типу антигенов и позволяет быстрее и эффективнее уничтожать их при повторном столкновении. Антигенами называют молекулы, воспринимаемые как чужеродные агенты и вызывающие специфические реакции организма. Например, у перенёсших ветрянку, корь, дифтерию людей часто возникает пожизненный иммунитет к этим заболеваниям. В случае аутоиммунных реакций антигеном может служить молекула, произведённая самим организмом.
Некоторые вещества, вырабатываемые иммунной системой, активно влияют на работу центральной нервной системы[1].
Содержание
- 1 Эволюция иммунных механизмов
- 2 Морфология иммунной системы
- 3 Многоэтапность иммунной защиты
- 4 Поверхностные барьеры
- 5 Врождённый иммунитет
- 5.1 Гуморальные и биохимические факторы
- 5.1.1 Воспаление
- 5.1.2 Система комплемента
- 5.2 Клеточные факторы врождённого иммунитета
- 5.2.1 Фагоциты
- 5.2.2 Вспомогательные клетки
- 5.1 Гуморальные и биохимические факторы
- 6 Приобретённый иммунитет
- 6.1 Лимфоциты
- 6.1.1 T-киллеры
- 6.1.2 T-хелперы
- 6.1.3 Гамма-дельта T-клетки
- 6.1.4 B-лимфоциты и антитела
- 6.2 Антигенпрезентирующие клетки
- 6.1 Лимфоциты
- 7 Иммунологическая память
- 8 Иммунологические расстройства у человека
- 8.1 Иммунодефициты
- 8.2 Аутоиммунные процессы
- 8.3 Гиперчувствительность
- 9 Другие защитные механизмы макроорганизма
- 10 Иммунология опухолей
- 11 Управление иммунной системой
- 11.1 Физиологические механизмы
- 11.2 Применяемые в медицине методы воздействия
- 11.2.1 Иммуносупрессия
- 11.3 Иммуностимуляция
- 11.4 Механизмы обхода иммунитета возбудителями
- 12 История развития представлений об иммунной системе
- 13 См. также
- 14 Примечания
- 15 Ссылки
Эволюция иммунных механизмов[править | править код]
Защитные механизмы, направленные на распознавание и обезвреживание возбудителей, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые предотвращают заражение бактерии вирусом. Другие базовые иммунные механизмы развились в процессе эволюции у древних эукариот и сохранились у их современных потомков, в том числе у растений и животных. К таким механизмам относятся антимикробные пептиды, дефензины, рецепторы распознавания специфических последовательностей и система комплемента.
Короткие фрагменты РНК, которые избирательно синтезируются только в клетках половых органов (открыты в 2000-х годах), способны подавлять активность транспозонов (могут вызывать мутации при перемещении по геному) и передаются по материнской линии потомству. Потомство дрозофил получает в комплекте с ДНК такой молекулярный переключатель, который подавляет активность вредных генетических элементов[2].
Более сложные механизмы развились относительно недавно, в ходе эволюции позвоночных[3].
Иммунная система у позвоночных (например, у человека) состоит из множества видов белков, клеток, органов и тканей, взаимодействия между которыми сложны и динамичны. Благодаря такой усовершенствованной иммунной реакции система позвоночных со временем приспосабливается, и распознавание конкретных чужеродных веществ или клеток становится более эффективным. В процессе адаптации создаётся иммунологическая память, которая позволяет ещё более эффективно защищать организм при следующей встрече с этими возбудителями. Такой вид приобретённого иммунитета лежит в основе методик вакцинации.
У теплокровных сохранение гомеостаза уже обеспечивается двумя иммунными механизмами (разными по времени эволюционного появления): температура (общее воздействие) и антитела (избирательное воздействие).
Морфология иммунной системы[править | править код]
Иммунная система человека и других позвоночных представляет собой комплекс органов и клеток, способных выполнять иммунологические функции. Прежде всего иммунный ответ осуществляют лейкоциты. Бо́льшая часть клеток иммунной системы происходит из кроветворных тканей. У взрослых людей развитие этих клеток начинается в костном мозге. Лишь T-лимфоциты дифференцируются внутри тимуса (вилочковой железы). Зрелые клетки расселяются в лимфоидных органах и на границах с окружающей средой, около кожи или на слизистых оболочках.
Организм животных, обладающих механизмами приобретённого иммунитета, производит множество разновидностей специфических иммунных клеток, каждая из которых отвечает за какой-то определённый антиген. Наличие большого количества разновидностей иммунных клеток необходимо для того, чтобы отражать атаки микроорганизмов, способных мутировать и изменять свой антигенный состав. Значительная часть этих клеток завершает свой жизненный цикл, так и не приняв участие в защите организма, например, не встретив подходящих антигенов.
Многоэтапность иммунной защиты[править | править код]
Иммунная система защищает организм от инфекции в несколько этапов, при этом с каждым этапом повышается специфичность защиты. Самая простая линия защиты представляет собой физические барьеры, которые предотвращают попадание возбудителей инфекции — бактерий и вирусов — в организм. Если возбудитель проникает через эти барьеры, промежуточную неспецифическую реакцию на него осуществляет врождённая иммунная система. Врождённая иммунная система обнаруживается у всех растений и животных[4]. На случай, когда возбудители успешно преодолевают воздействие врождённых иммунных механизмов, у позвоночных существует третий уровень защиты — приобретённая иммунная защита. Эта часть иммунной системы адаптирует свою реакцию во время инфекционного процесса, чтобы улучшить распознавание чужеродного биологического материала. Такой улучшенный ответ сохраняется после уничтожения возбудителя в виде иммунологической памяти. Она позволяет механизмам приобретённого иммунитета развивать более быструю и более сильную ответную реакцию при каждом появлении такого же возбудителя[5].
| Врождённый иммунитет | Приобретённый иммунитет |
|---|---|
| Реакция неспецифична | Специфическая реакция, привязанная к чужеродному антигену |
| Столкновение с инфекцией приводит к немедленной максимальной реакции | Между контактом с инфекцией и максимальным ответом латентный период |
| Клеточные и гуморальные звенья | Клеточные и гуморальные звенья |
| Не обладает иммунологической памятью | Столкновение с чужеродным агентом приводит к иммунологической памяти |
| Обнаруживается практически у всех форм жизни | Обнаружена только у некоторых организмов |
Как врождённый, так и приобретённый иммунитет зависят от способности иммунной системы отличать свои молекулы от чужих. В иммунологии под своими молекулами понимают те компоненты организма, которые иммунная система способна отличить от чужеродных[6]. Напротив, чужими называют молекулы, которые распознаются как чужеродные. Один из классов «чужих» молекул называют антигенами (термин произошёл от сокращения англ. antibody generators — «вызывающие антитела») и определяют как вещества, связываемые со специфическими иммунными рецепторами и вызывающие иммунный ответ[7].
Поверхностные барьеры[править | править код]
Организмы защищены от инфекций рядом механических, химических и биологических барьеров. Примерами механических барьеров, служащих первым этапом защиты от инфекции, могут служить восковое покрытие многих листьев растений, экзоскелет членистоногих, скорлупа яиц и кожа[8]. Однако организм не может быть полностью отграничен от внешней среды, поэтому существуют и другие системы, защищающие внешние сообщения организма — дыхательную, пищеварительную и мочеполовую системы. Эти системы можно разделить на постоянно действующие и включающиеся в ответ на вторжение. Пример постоянно действующей системы — крохотные волоски на стенках трахеи, называемые ресничками, которые совершают быстрые движения, направленные вверх, удаляя частицы пыли, пыльцу растений или другие мелкие инородные объекты, чтобы они не могли попасть в лёгкие. Аналогичным образом, изгнание микроорганизмов осуществляется при помощи промывного действия слёз и мочи. Слизь, секретируемая в дыхательную и пищеварительную систему, служит для связывания и обездвиживания микроорганизмов[9].
Если постоянно действующих механизмов оказывается недостаточно, то включаются «аварийные» механизмы очистки организма, такие как кашель, чихание, рвота и диарея.
Помимо этого, существуют химические защитные барьеры. Кожа и дыхательные пути выделяют антимикробные пептиды, например бета-дефензины[10]. Такие ферменты, как лизоцим и фосфолипаза A, содержатся в слюне, слезах и грудном молоке, и также обладают антимикробным действием[11][12]. Выделения из влагалища служат химическим барьером после начала менструаций, когда они становятся слабокислыми. Сперма содержит дефензины и цинк для уничтожения возбудителей[13][14]. В желудке соляная кислота и протеолитические ферменты служат мощными химическими защитными факторами в отношении попавших с пищей микроорганизмов.
В мочеполовом и желудочно-кишечном трактах существуют биологические барьеры, представленные дружественными микроорганизмами — комменсалами. Приспособившаяся к обитанию в этих условиях неболезнетворная микрофлора конкурирует с патогенными бактериями за пищу и пространство, и, в ряде случаев, изменяя условия обитания, в частности pH или содержание железа[15]. Это снижает вероятность достижения болезнетворными микробами достаточных для возникновения патологии количеств. Поскольку большая часть антибиотиков неспецифически воздействует на бактерии, и, зачастую, не затрагивает грибы, антибактериальная терапия может приводить к чрезмерному «разрастанию» грибковых микроорганизмов, что вызывает такие заболевания, как молочница (кандидоз)[16]. Есть убедительные сведения, подтверждающие, что введение пробиотической флоры, например чистых культур лактобацилл, которые содержатся, в частности, в йогурте и других кисломолочных продуктах, помогает восстановить нужный баланс микробных популяций при кишечных инфекциях у детей. Также существуют обнадёживающие данные в исследованиях применения пробиотиков при бактериальном гастроэнтерите, воспалительных заболеваниях кишечника, инфекциях мочевыводящих путей и послеоперационных инфекциях[17][18][19].
Врождённый иммунитет[править | править код]
Если микроорганизму удаётся проникнуть через первичные барьеры, он сталкивается с клетками и механизмами системы врождённого иммунитета. Врождённая иммунная защита неспецифична, то есть её звенья распознают и реагируют на чужеродные тела независимо от их особенностей[8]. Эта система не создаёт длительной невосприимчивости к конкретной инфекции. Система врождённого иммунитета осуществляет основную защиту у большинства живых многоклеточных организмов[4]. С рождения у людей иммунитет одинаковый, но он меняется в процессе роста.
Гуморальные и биохимические факторы[править | править код]
Воспаление[править | править код]
Воспаление — одна из наиболее ранних реакций иммунной системы на инфекцию[20]. К симптомам воспаления относятся покраснение и отёк, что свидетельствует об усилении притока крови к вовлечённым в процесс тканям. В развитии воспалительной реакции важную роль играют эйкозаноиды и цитокины, высвобождаемые повреждёнными или инфицированными клетками. К эйкозаноидам относятся простагландины, вызывающие повышение температуры и расширение кровеносных сосудов, и лейкотриены, которые привлекают определённые виды белых кровяных телец (лейкоцитов)[21][22]. К наиболее распространённым цитокинам относятся интерлейкины, отвечающие за взаимодействие между лейкоцитами, хемокины, стимулирующие хемотаксис, и интерфероны, обладающие противовирусными свойствами, в частности способностью угнетать синтез белка в клетках макроорганизма[23]. Кроме того, могут играть роль выделяемые факторы роста и цитотоксические факторы. Эти цитокины и другие биоорганические соединения привлекают клетки иммунной системы к очагу инфекции и способствуют заживлению повреждённых тканей путём уничтожения возбудителей[24].
Система комплемента[править | править код]
Система комплемента представляет собой биохимический каскад, который атакует мембрану чужеродных клеток. В него входят более 20 различных белков. Комплемент является основным гуморальным компонентом врождённого иммунного ответа[25][26]. Система комплемента имеется у многих видов, в том числе у ряда беспозвоночных[27].
У человека этот механизм активируется путём связывания белков комплемента с углеводами на поверхности микробных клеток, либо путём связывания комплемента с антителами, которые прикрепились к этим микробам (второй способ отражает взаимосвязь механизмов врождённого и приобретённого иммунитета). Сигнал в виде прикреплённого к мембране клетки комплемента запускает быстрые реакции, направленные на разрушение такой клетки[28]. Скорость этих реакций обусловлена усилением, возникающим вследствие последовательной протеолитической активации молекул комплемента, которые сами по себе являются протеазами. После того, как белки комплемента прикрепились к микроорганизму, запускается их протеолитическое действие, что, в свою очередь, активирует другие протеазы системы комплемента, и так далее. Таким образом возникает каскадная реакция, усиливающая исходный сигнал при помощи управляемой положительной обратной связи[29]. В результате каскада образуются пептиды, привлекающие иммунные клетки, усиливающие проницаемость сосудов и опсонизирующие поверхность клетки, помечая её «к уничтожению». Кроме того, отложение факторов комплемента на поверхности клетки может напрямую разрушать её посредством разрушения цитоплазматической мембраны[25].
Существуют три пути активации комплемента: классический, лектиновый и альтернативный. За неспецифическую реакцию врождённого иммунитета без участия антител отвечают лектиновый и альтернативный пути активации комплемента. У позвоночных комплемент также участвует в реакциях специфического иммунитета, при этом его активация обычно происходит по классическому пути[7].
Клеточные факторы врождённого иммунитета[править | править код]
Лейкоциты (белые кровяные тельца) часто ведут себя подобно независимым одноклеточным организмам, и представляют собой главное клеточное звено врождённого (гранулоциты и макрофаги) и приобретённого (в первую очередь лимфоциты, но их действия тесно связаны с клетками врождённой системы) иммунитета. К клеткам, воплощающим неспецифическую («врождённую») иммунную реакцию, относятся фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, базофилы, эозинофилы и естественные киллеры. Эти клетки распознают и уничтожают чужеродные частицы путём фагоцитоза (заглатывания и последующего внутриклеточного переваривания) либо, в случае крупных чужеродных тел (например, паразитов или крупных опухолевых клеток), путём выделения разрушительных частиц при непосредственном контакте[27]. Кроме того, осуществляющие неспецифический иммунитет клетки являются важными посредниками в процессе активации механизмов приобретённого иммунитета[5].
Фагоциты[править | править код]
Активация NK-клетки отсутствием комплекса ГКГС-I на инфицированной клетке.
Фагоцитоз представляет собой важную особенность клеточного звена врождённого иммунитета, которую осуществляют клетки, называемые фагоцитами, которые «переваривают» чужеродные микроорганизмы или частицы. Фагоциты обычно циркулируют по организму в поисках чужеродных материалов, но могут быть призваны в определённое место при помощи цитокинов[8]. После поглощения чужеродного микроорганизма фагоцитом он оказывается в ловушке внутриклеточного пузырька, который называется фагосомой. Фагосома сливается с другим пузырьком — лизосомой, в результате чего формируется фаголизосома. Микроорганизм погибает под воздействием пищеварительных ферментов, либо в результате дыхательного взрыва, при котором в фаголизосому высвобождаются свободные радикалы[30][31]. Фагоцитоз эволюционировал из способа получения захвата питательных веществ, но эта роль у фагоцитов была расширена, став защитным механизмом, направленным на разрушение патогенных возбудителей[32]. Фагоцитоз, вероятно, представляет собой наиболее старую форму защиты макроорганизма, поскольку фагоциты обнаруживаются как у позвоночных, так и у беспозвоночных животных[33].
К фагоцитам относятся такие клетки, как мононуклеарные фагоциты (в частности — моноциты и макрофаги), дендритные клетки и нейтрофилы. Фагоциты способны связывать микроорганизмы и антигены на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врождённого иммунитета. С появлением специфического иммунного ответа мононуклеарные фагоциты играют важную роль в его механизмах путём представления антигенов T-лимфоцитам. Для эффективного уничтожения микробов фагоцитам требуется активация.
Нейтрофилы и макрофаги представляют собой фагоциты, которые путешествуют по организму в поисках проникших сквозь первичные барьеры чужеродных микроорганизмов[34]. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50—60 % общего количества циркулирующих лейкоцитов[35]. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1[36]. Кроме того, макрофаги выполняют функцию уборщиков, избавляя организм от изношенных клеток и другого мусора, а также функцию антиген-презентирующих клеток, активирующих звенья приобретённого иммунитета[5].
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, то есть расположены они, главным образом, в коже, носу, лёгких, желудке и кишечнике[37]. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врождённым и приобретённым иммунитетом, поскольку они представляют антиген T-клеткам, одному из ключевых типов клеток приобретённого иммунитета[37].
Вспомогательные клетки[править | править код]
Вспомогательными клетками считаются тучные клетки, базофилы, эозинофилы, тромбоциты. Также в иммунной защите участвуют соматические клетки различных тканей организма. Тучные клетки находятся в соединительной ткани и слизистых оболочках и участвуют в регуляции воспалительной реакции[38]. Они очень часто связаны с аллергией и анафилаксией[35]. Они во многом напоминают базофилы — одну из малочисленных подгрупп зернистых лейкоцитов. Базофилы и эозинофилы родственны нейтрофилам. Эозинофилы секретируют биохимические медиаторы, которые участвуют в защите от крупных многоклеточных паразитов, а также играют роль в аллергических реакциях, например при бронхиальной астме[39]. Естественные киллеры (или натуральные, или нормальные, от англ. Natural killer) представляют собой лейкоциты группы лимфоцитов, которые атакуют и уничтожают опухолевые клетки, или инфицированные вирусами клетки[40].
Приобретённый иммунитет[править | править код]
Система приобретённого иммунитета появилась в ходе эволюции низших позвоночных. Она обеспечивает более интенсивный иммунный ответ, а также иммунологическую память, благодаря которой каждый чужеродный микроорганизм «запоминается» по уникальным для него антигенам[41]. Система приобретённого иммунитета антигенспецифична и требует распознавания специфических чужих («не своих») антигенов в процессе, называемом презентацией антигена. Специфичность антигена позволяет осуществлять реакции, которые предназначены конкретным микроорганизмам или инфицированным ими клеткам. Способность к осуществлению таких узконаправленных реакций поддерживается в организме «клетками памяти». Если макроорганизм инфицируется микроорганизмом более одного раза, эти специфические клетки памяти используются для быстрого уничтожения такого микроорганизма.
Лимфоциты[править | править код]
Клетки иммунной системы, на которые возложены ключевые функции по осуществлению приобретённого иммунитета, относятся к лимфоцитам, которые являются подтипом лейкоцитов. Большая часть лимфоцитов отвечает за специфический приобретённый иммунитет, так как могут распознавать возбудителей инфекции внутри или вне клеток, в тканях или в крови.
Основными типами лимфоцитов являются B-клетки и T-клетки, которые происходят из плюрипотентных гемопоэтических стволовых клеток; у взрослого человека они образуются в костном мозге[27], а T-лимфоциты дополнительно проходят часть этапов дифференцировки в тимусе. B-клетки отвечают за гуморальное звено приобретённого иммунитета, то есть вырабатывают антитела, в то время как T-клетки представляют собой основу клеточного звена специфического иммунного ответа.
В организме предшественники лимфоцитов непрерывно продуцируются в ходе дифференциации стволовых кроветворных клеток, при этом вследствие мутаций генов, кодирующих вариабельные цепи антител, возникает множество клеток, чувствительных к множеству потенциально существующих антигенов. На этапе развития лимфоциты проходят отбор: остаются только значимые с точки зрения защиты организма, а также те, которые не несут угрозы собственным тканям организма. Параллельно с этим процессом лимфоциты разделяются на группы, способные выполнять ту или иную функцию защиты. Существуют разные виды лимфоцитов. В частности, по морфологическим признакам их разделяют на малые лимфоциты и большие гранулярные лимфоциты (БГЛ). По структуре внешних рецепторов среди лимфоцитов выделяют, в частности, B-лимфоциты и T-лимфоциты.
Как B-, так и T-клетки несут на своей поверхности рецепторные молекулы, которые распознают специфические мишени. Рецепторы представляют собой как бы «зеркальный отпечаток» определённой части чужеродной молекулы, способный присоединяться к ней. При этом одна клетка может содержать рецепторы только для одного вида антигенов.
T-клетки распознают чужеродные («не-свои») мишени, такие как патогенные микроорганизмы, только после того, как антигены (специфические молекулы чужеродного тела) будут обработаны и презентированы в сочетании с собственной («своей») биомолекулой, которая называется молекулой главного комплекса гистосовместимости (англ. major histocompatibility complex, MHC). Среди T-клеток различают ряд подтипов, в частности, Т-киллеры, Т-хелперы и регуляторные Т-клетки.
T-киллеры распознают только антигены, которые объединены с молекулами главного комплекса гистосовместимости I класса, в то время как T-хелперы распознают только антигены, расположенные на поверхности клеток в сочетании с молекулами главного комплекса гистосовместимости II класса. Это различие в презентации антигена отражает разные роли указанных двух типов T-клеток. Другим, менее распространённым подтипом T-клеток, являются γδ T-клетки, которые распознают неизменённые антигены, не связанные с рецепторами главного комплекса гистосовместимости[42].
У T-лимфоцитов круг задач весьма широк. Часть из них — регуляция приобретённого иммунитета с помощью специальных белков (в частности, цитокинов), активация B-лимфоцитов для образования антител, а также регуляция активации фагоцитов для более эффективного разрушения микроорганизмов. Эту задачу выполняет группа T-хелперов. За разрушение собственных клеток организма путём выделения цитотоксичных факторов при непосредственном контакте отвечают T-киллеры, которые действуют специфически.
В отличие от T-клеток, B-клетки не нуждаются в обработке антигена и экспрессии его на поверхности клетки. Их рецепторы к антигену представляют собой фиксированные на поверхности B-клетки антителоподобные белки. Каждая прошедшая дифференцировку линия B-клеток экспрессирует уникальное только для неё антитело, и никакое другое. Таким образом, полный набор антигенных рецепторов всех B-клеток организма представляет все антитела, которые организм может вырабатывать[27]. Функция B-лимфоцитов заключается прежде всего в выработке антител — гуморального субстрата специфического иммунитета, — действие которых направлено прежде всего против внеклеточно расположенных возбудителей.
Кроме того, существуют лимфоциты, неспецифически проявляющие цитотоксичность — естественные киллеры.
T-киллеры[править | править код]
Цитотоксическая Т-клетка распознает антиген, представленный комплексом ГКГС-I инфицированной клетки.
Т-киллеры представляют собой подгруппу T-клеток, функцией которых является разрушение собственных клеток организма, инфицированных вирусами или другими патогенными внутриклеточными микроорганизмами[43], либо клеток, которые повреждены или неверно функционируют (например, опухолевые клетки). Как и B-клетки, каждая конкретная линия T-клеток распознает только один антиген. T-киллеры активируются при соединении своим T-клеточным рецептором (ТКР) со специфическим антигеном в комплексе с рецептором главного комплекса гистосовместимости I класса другой клетки. Распознавание этого комплекса рецептора гистосовместимости с антигеном осуществляется при участии расположенного на поверхности T-клетки вспомогательного рецептора CD8. В лабораторных условиях T-клетки обычно выявляют именно по экспрессии CD8. После активации T-клетка перемещается по организму в поисках клеток, на которых белок I класса главного комплекса гистосовместимости содержит последовательность нужного антигена. При контакте активированного T-киллера с такими клетками он выделяет токсины, образующие отверстия в цитоплазматической мембране клеток-мишеней, в результате ионы, вода и токсин свободно перемещаются в клетку-мишень и из неё: клетка-мишень погибает[44]. Разрушение собственных клеток T-киллерами важно, в частности, для предотвращения размножения вирусов. Активация T-киллеров жёстко управляется и обычно требует очень сильного сигнала активации от комплекса белка гистосовместимости с антигеном, либо дополнительной активации факторами T-хелперов[44].
T-хелперы[править | править код]
Т-хелперы регулируют реакции как врождённого, так и приобретённого иммунитета, и позволяют определять тип ответа, который организм окажет на конкретный чужеродный материал[45][46]. Эти клетки не проявляют цитотоксичности и не участвуют в уничтожении инфицированных клеток или непосредственно возбудителей. Вместо этого они управляют иммунным ответом, направляя другие клетки на выполнение этих задач.
Активация иммунного ответа.
T-хелперы экспрессируют T-клеточные рецепторы (ТКР), которые распознают антигены, связанные с молекулами II класса главного комплекса гистосовместимости. Комплекс молекулы главного комплекса гистосовместимости с антигеном также распознается корецептором клеток-хелперов CD4, который привлекает внутриклеточные молекулы T-клетки (например, Lck), ответственные за активацию T-клетки. T-хелперы обладают меньшей чувствительностью к комплексу молекулы главного комплекса гистосовместимости и антигена, чем T-киллеры, то есть для активации T-хелпера требуется связывание гораздо большего количества его рецепторов (около 200—300) с комплексом молекулы гистосовместимости и антигена, в то время как T-киллеры могут быть активированы после связывания с одним таким комплексом. Активация T-хелпера также требует более продолжительного контакта с антиген-презентирующей клеткой[47]. Активация неактивного T-хелпера приводит к высвобождению им цитокинов, которые оказывают влияние на активность многих видов клеток. Цитокиновые сигналы, создаваемые T-хелперами, усиливают бактерицидную функцию макрофагов и активность T-киллеров[8]. Кроме того, активация T-хелперов вызывает изменения в экспрессии молекул на поверхности T-клетки, в частности лиганда CD40 (также известного под обозначением CD154), что создаёт дополнительные стимулирующие сигналы, обычно требуемые для активации вырабатывающих антитела B-клеток[48].
Гамма-дельта T-клетки[править | править код]
5—10 % T-клеток несут на своей поверхности гамма-дельта-ТКР и обозначаются как γδ T-клетки.
B-лимфоциты и антитела[править | править код]
Дифференциация В-клетки в плазматическую клетку
В-клетки составляют 5—15 % циркулирующих лимфоцитов и характеризуются поверхностными иммуноглобулинами, встроенными в клеточную мембрану и выполняющими функцию специфического антигенного рецептора. Этот рецептор, специфичный лишь для определённого антигена, называется антителом. Антиген, связываясь с соответствующим антителом на поверхности В-клетки, индуцирует пролиферацию и дифференцировку В-клетки до плазматических клеток и клеток памяти, специфичность которых такая же, как и специфичность исходной В-клетки.
Плазматические клетки секретируют большое количество антител в виде растворимых молекул, распознающих исходный антиген. Секретируемые антитела имеют ту же специфичность, что и соответствующий В-клеточный рецептор.
Антигенпрезентирующие клетки[править | править код]
См. Дендритные клетки
Иммунологическая память[править | править код]
Иммунологическая память — это способность иммунной системы отвечать более быстро и эффективно на антиген (патоген), с которым у организма был предварительный контакт.
Такая память обеспечивается предсуществующими антигенспецифическими клонами как В-клеток, так и Т-клеток, которые функционально более активны в результате прошедшей первичной адаптации к определённому антигену.
Пока неясно, устанавливается ли память в результате формирования долгоживущих специализированных клеток памяти или же память отражает собой процесс рестимуляции лимфоцитов постоянно присутствующим антигеном, попавшим в организм при первичной иммунизации.
Иммунологические расстройства у человека[править | править код]
Иммунодефициты[править | править код]
Иммунодефициты (ИДС) — это нарушения иммунологической реактивности, которые обусловлены выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов.
Аутоиммунные процессы[править | править код]
Аутоиммунные процессы — это в значительной степени хронические явления, которые приводят к долговременному повреждению тканей. Это связано в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Гиперчувствительность[править | править код]
Гиперчувствительность — это термин, используемый для обозначения иммунного ответа, который протекает в аггравированной и неадекватной форме, в результате чего происходит повреждение тканей.
Другие защитные механизмы макроорганизма[править | править код]
Иммунология опухолей[править | править код]
К аспектам иммунологии опухолей относятся три основных направления исследований:
- Использование методов иммунологии для диагностики опухолей, определения прогноза и выработки тактики лечения заболевания;
- Осуществление иммунотерапии в качестве дополнения к другим видам лечения и для иммунокоррекции — восстановления деятельности иммунной системы;
- Определение роли иммунологического наблюдения за опухолями у человека.
Управление иммунной системой[править | править код]
Физиологические механизмы[править | править код]
Применяемые в медицине методы воздействия[править | править код]
Существует несколько методов влияния на иммунный ответ для подавления нежелательных эффектов, вызываемых аутоиммунными заболеваниями, аллергиями, пересадкой органов, либо для стимулирования защитного ответа против определенных патогенов (иммунизация при помощи вакцин[49]) или отдельных видов опухолей.
Иммуносупрессия[править | править код]
Иммуносупрессия (иммунодепрессия) — угнетение иммунитета с помощью лекарственных препаратов (иммуносупрессоров) при аутоиммунных заболеваниях или воспалениях, при которых происходит
избыточное повреждение тканей. Длительная постоянная иммуносупрессия необходима после пересадки органов для предотвращения отторжения органа[50][51].
Противовоспалительные лекарственные средства часто применяются для управления эффектами воспаления. Наиболее сильное действие среди них оказывают Глюкокортикоиды, однако они часто имеют нежелательные побочные эффекты, и их применение требует контроля.[52] В малых дозах противовоспалительные средства применяются вместе с цитотоксинами или иммуносупрессорами (например, Метотрексат или Азатиоприн).
Цитотоксические препараты, применяемые в химиотерапии, подавляют иммунный ответ, препятствуя размножению определенных видов клеток, в частности, активированных T-лимфоцитов. Такие препараты воздействуют на все активно делящиеся клетки и органы, их содержащие, что вызывает серьезные побочные эффекты.[51] Некоторые иммуносупрессоры, например Циклоспорин, действует на Т-лимфоциты, подавляя некоторые пути передачи сигнала.[53]
Иммуностимуляция[править | править код]
Существует несколько видов иммунотерапии опухолей, при которой стимулируется атака иммунной системы против новообразований.
Вакцинация позволяет выработать иммунитет к ряду инфекционных заболеваний[49].
Механизмы обхода иммунитета возбудителями[править | править код]
История развития представлений об иммунной системе[править | править код]
В 1796 году английский учёный Эдвард Дженнер (1749—1823) разработал способ искусственной иммунизации против оспы путём заражения человека коровьей оспой[54].
Открытие Луи Пастера (1880) дало начало иммунологии как самостоятельной науке. Пастер обнаружил, что иммунизация кур старой холерной культурой создаёт у них устойчивость к заражению высоковирулентным возбудителем куриной холеры и сформулировал основной принцип создания вакцин, а также получил вакцины против сибирской язвы и против бешенства[54].
Илья Ильич Мечников открыл феномен фагоцитоза (1887) и создал клеточную или фагоцитарную теорию иммунитета[54].
Немецкий учёный Пауль Эрлих выдвинул гуморальную теорию иммунитета. С 1898 по 1899 год бельгийский учёный Жюль Борде и русский учёный Н. Н. Чистович обнаружили образование антител в ответ на введение чужеродных эритроцитов и сывороточных белков. Данное открытие положило начало неинфекционной иммунологии[54].
В 1900 году австрийский иммунолог Карл Ландштейнер сделал открытие групп крови человека. Он создал основу учения о тканевых изоантигенах[54].
См. также[править | править код]
- Психонейроиммунология
- Иммунотерапия рака
- Поведенческая иммунная система
Примечания[править | править код]
- ↑ Джонатан Кипнис. Седьмое чувство // В мире науки. — 2018. — № 10. — С. 4-12.
- ↑ Биологи изменили классические представления о наследственности
- ↑ Beck, Gregory; Gail S. Habicht (November 1996). “Immunity and the Invertebrates” (PDF). Scientific American: 60–66. Дата обращения 2007-01-01.
- ↑ 1 2 Litman G, Cannon J, Dishaw L (2005). “Reconstructing immune phylogeny: new perspectives”. Nat Rev Immunol. 5 (11): 866–79. PMID 16261174.
- ↑ 1 2 3 Mayer, Gene Immunology — Chapter One: Innate (non-specific) Immunity. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Дата обращения 1 января 2007. Архивировано 23 августа 2011 года.
- ↑ Smith A.D. (Ed) Oxford dictionary of biochemistry and molecular biology. (1997) Oxford University Press. ISBN 0-19-854768-4
- ↑ 1 2 Ройт, Иммунология. 2000. ISBN 5-03-003305-X
- ↑ 1 2 3 4 Alberts, Bruce. Molecular Biology of the Cell; Fourth Edition. — New York and London : Garland Science, 2002. — ISBN ISBN 0-8153-3218-1.
- ↑ Boyton R, Openshaw P. “Pulmonary defences to acute respiratory infection”. Br Med Bull. 61: 1—12. PMID 11997295.
- ↑ Agerberth B, Gudmundsson G. “Host antimicrobial defence peptides in human disease”. Curr Top Microbiol Immunol. 306: 67—90. PMID 16909918.
- ↑ Moreau J, Girgis D, Hume E, Dajcs J, Austin M, O’Callaghan R (2001). “Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus”. Invest Ophthalmol Vis Sci. 42 (10): 2347—54. PMID 11527949.
- ↑ Hankiewicz J, Swierczek E (1974). “Lysozyme in human body fluids”. Clin Chim Acta. 57 (3): 205—9. PMID 4434640.
- ↑ Fair W, Couch J, Wehner N (1976). “Prostatic antibacterial factor. Identity and significance”. Urology. 7 (2): 169—77. PMID 54972.
- ↑ Yenugu S, Hamil K, Birse C, Ruben S, French F, Hall S (2003). “Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli”. Biochem J. 372 (Pt 2): 473—83. PMID 12628001.
- ↑ Gorbach S (1990). “Lactic acid bacteria and human health”. Ann Med. 22 (1): 37—41. PMID 2109988.
- ↑ Hill L, Embil J (1986). “Vaginitis: current microbiologic and clinical concepts”. CMAJ. 134 (4): 321—31. PMID 3510698.
- ↑ Reid G, Bruce A (2003). “Urogenital infections in women: can probiotics help?”. Postgrad Med J. 79 (934): 428—32. PMID 12954951.
- ↑ Salminen S, Gueimonde M, Isolauri E (2005). “Probiotics that modify disease risk”. J Nutr. 135 (5): 1294—8. PMID 15867327.
- ↑ Reid G, Jass J, Sebulsky M, McCormick J (2003). “Potential uses of probiotics in clinical practice”. Clin Microbiol Rev. 16 (4): 658—72. PMID 14557292.
- ↑ Kawai T, Akira S (2006). “Innate immune recognition of viral infection”. Nat Immunol. 7 (2): 131–7. PMID 16424890.
- ↑ Miller, SB (2006). “Prostaglandins in Health and Disease: An Overview”. Seminars in Arthritis and Rheumatism. 36 (1): 37–49. PMID 16887467.
- ↑ Ogawa Y, Calhoun WJ. (2006). “The role of leukotrienes in airway inflammation”. J Allergy Clin Immunol. 118 (4): 789–98. PMID 17030228.
- ↑ Le Y, Zhou Y, Iribarren P, Wang J (2004). “Chemokines and chemokine receptors: their manifold roles in homeostasis and disease” (PDF). Cell Mol Immunol. 1 (2): 95–104. PMID 16212895.
- ↑ Martin P, Leibovich S (2005). “Inflammatory cells during wound repair: the good, the bad and the ugly”. Trends Cell Biol. 15 (11): 599–607. PMID 16202600.
- ↑ 1 2 Rus H, Cudrici C, Niculescu F (2005). “The role of the complement system in innate immunity”. Immunol Res. 33 (2): 103–12. PMID 16234578.
- ↑ Mayer, Gene Immunology — Chapter Two: Complement. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Дата обращения 1 января 2007. Архивировано 23 августа 2011 года.
- ↑ 1 2 3 4 Janeway CA, Jr. et al. Immunobiology.. — 6th ed. — Garland Science, 2005. — ISBN ISBN 0-443-07310-4.
- ↑ Liszewski M, Farries T, Lublin D, Rooney I, Atkinson J. “Control of the complement system”. Adv Immunol. 61: 201–83. PMID 8834497.
- ↑ Sim R, Tsiftsoglou S (2004). “Proteases of the complement system” (PDF). Biochem Soc Trans. 32 (Pt 1): 21–7. PMID 14748705.
- ↑ Ryter A (1985). “Relationship between ultrastructure and specific functions of macrophages”. Comp Immunol Microbiol Infect Dis. 8 (2): 119–33. PMID 3910340.
- ↑ Langermans J, Hazenbos W, van Furth R (1994). “Antimicrobial functions of mononuclear phagocytes”. J Immunol Methods. 174 (1–2): 185–94. PMID 8083520.
- ↑ May R, Machesky L (2001). “Phagocytosis and the actin cytoskeleton”. J Cell Sci. 114 (Pt 6): 1061–77. PMID 11228151.
- ↑ Salzet M, Tasiemski A, Cooper E (2006). “Innate immunity in lophotrochozoans: the annelids”. Curr Pharm Des. 12 (24): 3043–50. PMID 16918433.
- ↑ Zen K, Parkos C (2003). “Leukocyte-epithelial interactions”. Curr Opin Cell Biol. 15 (5): 557–64. PMID 14519390.
- ↑ 1 2 Stvrtinová, Viera. Inflammation and Fever from Pathophysiology: Principles of Disease. — Computing Centre, Slovak Academy of Sciences : Academic Electronic Press, 1995. Архивная копия от 11 июля 2001 на Wayback Machine
- ↑ Bowers, William Immunology -Chapter Thirteen: Immunoregulation. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Дата обращения 4 января 2007. Архивировано 23 августа 2011 года.
- ↑ 1 2 Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S. “Antigen presentation and T cell stimulation by dendritic cells”. Annu Rev Immunol. 20: 621–67. PMID 11861614.
- ↑ Krishnaswamy G, Ajitawi O, Chi D. “The human mast cell: an overview”. Methods Mol Biol. 315: 13–34. PMID 16110146.
- ↑ Kariyawasam H, Robinson D (2006). “The eosinophil: the cell and its weapons, the cytokines, its locations”. Semin Respir Crit Care Med. 27 (2): 117–27. PMID 16612762.
- ↑ Middleton D, Curran M, Maxwell L (2002). “Natural killer cells and their receptors”. Transpl Immunol. 10 (2–3): 147–64. PMID 12216946.
- ↑ Pancer Z, Cooper M. “The evolution of adaptive immunity”. Annu Rev Immunol. 24: 497–518. PMID 16551257.
- ↑ Holtmeier W, Kabelitz D. “gammadelta T cells link innate and adaptive immune responses”. Chem Immunol Allergy. 86: 151–83. PMID 15976493.
- ↑ Harty J, Tvinnereim A, White D. “CD8+ T cell effector mechanisms in resistance to infection”. Annu Rev Immunol. 18: 275–308. PMID 10837060.
- ↑ 1 2 Radoja S, Frey A, Vukmanovic S (2006). “T-cell receptor signaling events triggering granule exocytosis”. Crit Rev Immunol. 26 (3): 265–90. PMID 16928189.
- ↑ Abbas A, Murphy K, Sher A (1996). “Functional diversity of helper T lymphocytes”. Nature. 383 (6603): 787–93. PMID 8893001.
- ↑ McHeyzer-Williams L, Malherbe L, McHeyzer-Williams M. “Helper T cell-regulated B cell immunity”. Curr Top Microbiol Immunol. 311: 59—83. PMID 17048705.
- ↑ Kovacs B, Maus M, Riley J, Derimanov G, Koretzky G, June C, Finkel T (2002). “Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation”. Proc Natl Acad Sci U S A. 99 (23): 15006–11. PMID 12419850.
- ↑ Grewal I, Flavell R. “CD40 and CD154 in cell-mediated immunity”. Annu Rev Immunol. 16: 111–35. PMID 9597126.
- ↑ 1 2 ВОЗ | Иммунизация
- ↑ Janeway CA, Jr. Immunobiology. — 6th. — Garland Science, 2005. — ISBN 0-443-07310-4.
- ↑ 1 2 Taylor AL, Watson CJ, Bradley JA (Oct 2005). “Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy”. Critical Reviews in Oncology/Hematology. 56 (1): 23—46. DOI:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ↑ Barnes PJ (Mar 2006). “Corticosteroids: the drugs to beat”. European Journal of Pharmacology. 533 (1–3): 2—14. DOI:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ↑ Masri MA (Jul 2003). “The mosaic of immunosuppressive drugs”. Molecular Immunology. 39 (17–18): 1073—7. DOI:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ↑ 1 2 3 4 5 Иммунология — статья из Большой советской энциклопедии.
Ссылки[править | править код]
| Иммунная система на Викискладе |
Биологическая система, которая защищает организм против болезни 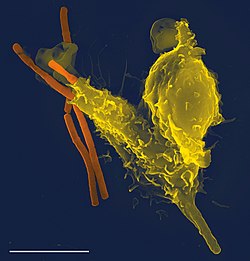
иммунная система представляет собой систему защиты хозяина, содержащую множество биологических структур и процессов внутри организма, который защищает от заболевания. Для правильного функционирования иммунная система должна обнаруживать широкий спектр агентов, известных как патогены, от вирусов до паразитических червей и различать их из собственной здоровой ткани. У многих видов есть две основные подсистемы иммунной системы: врожденная иммунная система и адаптивная иммунная система. Обе подсистемы используют гуморальный иммунитет и клеточно-опосредованный иммунитет для выполнения своих функций. У людей гематоэнцефалический барьер, гематоэнцефалический барьер и аналогичные жидкостно-мозговые барьеры отделяют периферическую иммунную систему от нейроиммунной системы, которая защищает мозг.
Патогены могут быстро развиваться и адаптироваться, тем самым избегая обнаружения и нейтрализации иммунной системой; тем не менее, для распознавания и нейтрализации патогенов также развились множественные защитные механизмы. Даже простые одноклеточные организмы, такие как бактерии, обладают рудиментарной иммунной системой в виде ферментов, которые защищают от бактериофаговых инфекций. Другие основные иммунные механизмы развились у древних эукариот и остались у их современных потомков, таких как растения и беспозвоночные. Эти механизмы включают фагоцитоз, антимикробные пептиды, называемые дефенсинами, и систему комплемента. Челюстные позвоночные, в том числе люди, обладают еще более сложными защитными механизмами, включая способность со временем адаптироваться для более эффективного распознавания конкретных патогенов. Адаптивный (или приобретенный) иммунитет создает иммунологическую память после первоначального ответа на конкретный патоген, что приводит к усиленному ответу на последующие встречи с тем же патогеном. Этот процесс приобретенного иммунитета является основой вакцинации.
Нарушения иммунной системы могут приводить к аутоиммунным заболеваниям, воспалительным заболеваниям и раку. Иммунодефицит возникает, когда иммунная система менее активна, чем обычно, что приводит к повторяющимся и опасным для жизни инфекциям. У людей иммунодефицит может быть результатом генетического заболевания, такого как тяжелый комбинированный иммунодефицит, приобретенных состояний, таких как ВИЧ / СПИД или использование иммунодепрессантов. Напротив, аутоиммунитет возникает в результате гиперактивной иммунной системы, атакующей нормальные ткани, как если бы они были чужеродными организмами. Общие аутоиммунные заболевания включают тиреоидит Хашимото, ревматоидный артрит, сахарный диабет 1 типа и системную красную волчанку. Иммунология охватывает изучение всех аспектов иммунной системы.
Содержание
- 1 Многослойная защита
- 2 Врожденная иммунная система
- 2.1 Распознавание образов клетками
- 2.1.1 Толл-подобные рецепторы
- 2.1.2 Цитозольные рецепторы
- 2.1.3 Инфламмасомы
- 2.2 Поверхностные барьеры
- 2.3 Клеточные компоненты
- 2.3.1 Фагоциты
- 2.3.2 Дендритные клетки
- 2.3.3 Гранулоциты
- 2.3.4 Врожденные лимфоидные клетки
- 2.4 Воспаление
- 2.5 Система комплемента
- 2.1 Распознавание образов клетками
- 3 Адаптивная иммунная система
- 3.1 Распознавание антигена
- 3.2 Презентация антигена Т-лимфоцитам
- 3.3 Клеточный иммунитет
- 3.3.1 Т-киллеры
- 3.3.2 Хелперные Т-клетки
- 3.3.3 Гамма-дельта Т-клетки
- 3.4 Гуморальный иммунный ответ
- 3.5 Иммунологическая память
- 4 Физиологическая регуляция
- 4.1 Гормоны
- 4.2 Витамин D
- 4.3 Сон и отдых
- 4.4 Питание и диета
- 4.5 Восстановление и регенерация
- 5 Нарушения иммунитета человека
- 5.1 Иммунодефицит
- 5.2 Аутоиммунитет
- 5.3 Гиперчувствительность
- 5.4 Идиопатическое воспаление
- 6 Манипуляции при медицина
- 6,1 Im муносупрессия
- 6.2 Иммуностимуляция
- 6.3 Вакцинация
- 6.4 Иммунология опухоли
- 6.5 Прогнозирование иммуногенности
- 7 Эволюция и другие механизмы
- 7.1 Эволюция иммунной системы
- 7.2 Альтернативная адаптивная иммунная система
- 7.3 Манипулирование патогенами
- 8 История иммунологии
- 8.1 Теоретические подходы к иммунной системе
- 9 Органы
- 10 См. Также
- 11 Ссылки
- 12 Внешние ссылки
Многослойная защита
Иммунная система защищает своего хозяина от инфекции с помощью многоуровневой защиты с возрастающей специфичностью. Проще говоря, физические барьеры предотвращают проникновение в организм патогенов, таких как бактерии и вирусы. Если патоген преодолевает эти барьеры, врожденная иммунная система обеспечивает немедленный, но неспецифический ответ. Врожденные иммунные системы обнаружены у всех растений и животных. Если патогены успешно уклоняются от врожденного ответа, позвоночные животные обладают вторым уровнем защиты, адаптивной иммунной системой, которая активируется врожденной реакцией. Здесь иммунная система адаптирует свой ответ во время инфекции, чтобы улучшить распознавание патогена. Этот улучшенный ответ затем сохраняется после устранения патогена в форме иммунологической памяти и позволяет адаптивной иммунной системе наращивать более быстрые и более сильные атаки каждый раз, когда встречается этот патоген.
| Врожденная иммунная система | Адаптивная иммунная система |
|---|---|
| Ответ неспецифический | Патоген и антиген специфический ответ |
| Состоит из лейкоцитов | Состоит из антигенов, В-клеток, Т-клеток |
| Воздействие приводит к немедленному максимальному ответу | Время задержки между воздействием и максимальным ответом |
| Клеточно-опосредованное и гуморальное компоненты | Клеточно-опосредованные и гуморальные компоненты |
| Отсутствие иммунологической памяти | Воздействие приводит к иммунологической памяти |
| Встречается почти во всех формах жизни | Обнаружен только у челюстных позвоночных |
Врожденный и адаптивный иммунитет зависит от способности иммунной системы различать собственный и чужой молекулы es. В иммунологии собственные молекулы — это те компоненты организма, которые иммунная система может отличить от чужеродных веществ. И наоборот, чужеродные молекулы распознаются как чужеродные молекулы. Один класс чужеродных молекул называется антигенами (сокращенно от генераторов антител) и определяется как вещества, которые связываются со специфическими иммунными рецепторами и вызывают иммунный ответ.
Новорожденные младенцы. ранее не контактировали с микробами и особенно уязвимы для инфекций. Мать обеспечивает несколько уровней пассивной защиты. Во время беременности особый тип антител, называемый IgG, транспортируется от матери к ребенку непосредственно через плаценту, поэтому человеческие дети имеют высокий уровень антител даже при рождении, с тем же диапазоном антигенной специфичности, что и их мать. Грудное молоко или молозиво также содержит антитела, которые переносятся в кишечник младенца и защищают от бактериальных инфекций до самого новорожденного может синтезировать собственные антитела. Это пассивный иммунитет, потому что плод на самом деле не производит никаких клеток памяти или антител — он только их заимствует. Этот пассивный иммунитет обычно кратковременный, от нескольких дней до нескольких месяцев. В медицине защитный пассивный иммунитет также может быть искусственно передан от одного человека к другому через богатую антителами сыворотку.
Врожденная иммунная система
Микроорганизмы или токсины, которые успешно попадают в организм столкнуться с клетками и механизмами врожденной иммунной системы. Врожденная реакция обычно запускается, когда микробы идентифицируются рецепторами распознавания образов, которые распознают компоненты, которые сохраняются среди широких групп микроорганизмов, или когда поврежденные, поврежденные или подвергнутые стрессу клетки посылают сигналы тревоги, многие из которых ( но не все) распознаются теми же рецепторами, что и те, которые распознают патогены. Врожденная иммунная защита неспецифична, то есть эти системы реагируют на патогены обычным образом. Эта система не обеспечивает длительного иммунитета против патогена. Врожденная иммунная система является доминирующей системой защиты хозяина у большинства организмов.
Распознавание образов клетками
Клетки врожденной иммунной системы используют рецепторы распознавания образов (PRR) распознавать молекулярные структуры, которые производятся микробными патогенами. PRR — это кодируемые зародышевой линией сенсоры хозяина, которые обнаруживают молекулы, типичные для патогенов. Это белки, экспрессируемые, в основном, клетками врожденной иммунной системы, такими как дендритные клетки, макрофаги, моноциты, нейтрофилы и эпителиальные клетки, для идентификации двух классов молекул: патоген-ассоциированные молекулярные паттерны (PAMP), которые связаны с микробными патогенами, и ассоциированные с повреждениями молекулярные паттерны (DAMP), которые связаны с компонентами клеток-хозяев которые высвобождаются во время повреждения или гибели клеток.
Толл-подобные рецепторы
Распознавание внеклеточных или эндосомных патоген-ассоциированных молекулярных паттернов (PAMP) опосредуется трансмембранными белками, известными как толл-подобные рецепторы (TLR). TLR имеют типичный структурный мотив, лейцин-богатые повторы (LRR), которые придают им их специфический внешний вид, а также отвечают за функциональность TLR. Toll-подобные рецепторы были впервые обнаружены у Drosophila и запускают синтез и секрецию цитокинов и активацию других программ защиты хозяина, которые необходимы как для врожденного, так и для адаптивного иммунного ответа. На сегодняшний день у человека описано десять функциональных членов семейства TLR.
Цитозольные рецепторы
Клетки врожденной иммунной системы имеют рецепторы распознавания образов, которые обнаруживают инфекцию или повреждение клеток в цитозоле. Три основных класса этих цитозольных рецепторов: NOD-подобные рецепторы, RIG (индуцируемый ретиноевой кислотой ген) -подобные рецепторы и цитозольные ДНК-сенсоры.
Инфламмасомы
Инфламмасомы представляют собой мультибелковые комплексы (состоящие из NLR, адапторного белка ASC и эффекторной молекулы прокаспазы-1), которые образуются в ответ на цитозольные PAMP и DAMP, функция которых заключается в генерировании активных форм воспалительного цитокины IL-1β и IL-18.
Поверхностные барьеры
Некоторые барьеры защищают организмы от инфекции, включая механические, химические и биологические барьеры. Восковая кутикула большинства листьев, экзоскелет насекомых, панцири и мембраны отложенных извне яйца и кожа являются примерами механических барьеров, которые являются первой линией защиты от инфекции. Однако, поскольку организмы не могут быть полностью изолированы от окружающей среды, другие системы действуют для защиты отверстий тела, таких как легкие, кишечник и мочеполовые пути. В легких кашель и чихание механически выбрасывают патогены и другие раздражители из дыхательных путей. Промывающее действие слез и мочи также механически удаляет болезнетворные микроорганизмы, в то время как слизь, выделяемая респираторным и желудочно-кишечным трактом, служит для улавливания и запутывания микроорганизмы.
Химические барьеры также защищают от инфекции. Кожа и дыхательные пути выделяют антимикробные пептиды, такие как β- дефенсины. Ферменты, такие как лизоцим и фосфолипаза A2 в слюне, слезы и грудное молоко также являются антибактериальными средствами. Влагалищные выделения служат химическим барьером после менархе, когда они становятся слегка кислыми, тогда как сперма содержит дефензины и цинк для уничтожения патогенов. В желудке желудочная кислота служит мощной химической защитой от проглоченных патогенов.
В мочеполовых и желудочно-кишечных трактах комменсал Флора служит биологическим барьером, конкурируя с патогенными бактериями за пищу и пространство, и, в некоторых случаях, изменяя условия в их окружающей среде, такие как pH или доступное железо. В результате симбиотических отношений между комменсалами и иммунной системой вероятность того, что патогены достигнут достаточного количества, чтобы вызвать болезнь, снижается. Однако, поскольку большинство антибиотиков неспецифически нацелены на бактерии и не влияют на грибки, пероральные антибиотики могут привести к «чрезмерному росту» грибов и вызвать такие состояния, как вагинальный кандидоз (грибковая инфекция). Имеются убедительные доказательства того, что повторное введение пробиотической флоры, такой как чистые культуры лактобацилл, обычно присутствующие в непастеризованном йогурте, помогает восстановить здоровый баланс микробов. популяции кишечных инфекций у детей и обнадеживающие предварительные данные исследований бактериального гастроэнтерита, воспалительных заболеваний кишечника, инфекции мочевыводящих путей и послеоперационных инфекций.
Клеточные компоненты

Лейкоциты (белые кровяные тельца) действуют как независимые одноклеточные организмы и являются вторым звеном врожденной иммунной системы. Врожденные лейкоциты включают фагоциты (макрофаги, нейтрофилы и дендритные клетки ), врожденные лимфоидные клетки, тучные клетки, эозинофилы, базофилы и естественные клетки-киллеры. Эти клетки идентифицируют и устраняют патогены, либо атакуя более крупные патогены через контакт, либо поглощая, а затем убивая микроорганизмы. Врожденные клетки также являются важными медиаторами в развитии лимфоидных органов и активации адаптивной иммунной системы.
Фагоцитоз — важная особенность клеточного врожденного иммунитета, осуществляемого клетками, называемыми фагоцитами, которые поглощают или поедают патогены или частицы. Фагоциты обычно патрулируют тело в поисках патогенов, но цитокины могут вызывать их в определенные места. После того, как патоген был поглощен фагоцитом, он попадает в ловушку внутриклеточной везикулы, называемой фагосомой, которая впоследствии сливается с другой везикулой, называемой лизосомой, с образованием фаголизосома. Патоген уничтожается под действием пищеварительных ферментов или после респираторного выброса, который высвобождает свободные радикалы в фаголизосому. Фагоцитоз развился как средство приобретения питательных веществ, но эта роль была расширена в фагоцитах, чтобы включить поглощение патогенов в качестве защитного механизма. Фагоцитоз, вероятно, представляет собой старейшую форму защиты хозяина, поскольку фагоциты были идентифицированы как у позвоночных, так и у беспозвоночных животных.
Фагоциты
Нейтрофилы и макрофаги являются фагоцитами, которые путешествуют по телу в поисках патогенных микроорганизмов. Нейтрофилы обычно находятся в кровотоке и представляют собой наиболее распространенный тип фагоцитов, обычно составляющий от 50% до 60% от общего количества циркулирующих лейкоцитов и состоящий из субпопуляций нейтрофилов-киллеров и нейтрофилов-клеток . Во время острой фазы воспаления, особенно в результате бактериальной инфекции, нейтрофилы мигрируют к месту воспаления в процессе, называемом хемотаксисом, и обычно являются первыми клетками, попадающими на место инфекции. Макрофаги — это универсальные клетки, которые находятся в тканях и производят широкий спектр химических веществ, включая ферменты, белки комплемента и цитокины, а также они могут действовать как мусорщики, которые очищают организм от изношенных клеток и другого мусора. и как антигенпрезентирующие клетки, которые активируют адаптивную иммунную систему.
Дендритные клетки
Дендритные клетки (DC) — это фагоциты в тканях, которые находятся в контакте с внешней средой ; следовательно, они расположены главным образом в коже, носу, легких, желудке и кишечнике. Они названы из-за их сходства с нейронами дендритами, поскольку оба имеют много шиповидных выступов, но дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между тканями организма и врожденной и адаптивной иммунными системами, поскольку они представляют антигены к Т-клеткам, одному из ключевых типов клеток адаптивной иммунной системы.
Гранулоциты
Гранулоциты — это лейкоциты, в цитоплазме которых есть гранулы. К этой категории относятся нейтрофилы, тучные клетки, базофилы и эозинофилы. Тучные клетки находятся в соединительной ткани и слизистых оболочках и регулируют воспалительную реакцию. Чаще всего они связаны с аллергией и анафилаксией. Базофилы и эозинофилы связаны с нейтрофилами. Они выделяют химические медиаторы, которые участвуют в защите от паразитов и играют роль в аллергических реакциях, таких как астма.
Врожденные лимфоидные клетки
Врожденные лимфоидные клетки (ILC): группа клеток врожденного иммунитета, которые происходят от общего лимфоидного предшественника (CLP) и принадлежат к лимфоидной линии. Эти клетки характеризуются отсутствием антиген-специфического B или Т-клеточного рецептора из-за отсутствия гена активации рекомбинации (RAG). ILC не экспрессируют маркеры миелоидных или дендритных клеток.
Естественные клетки-киллеры, один из членов ILC, являются лимфоцитами и компонентом врожденной иммунной системы, которая не атакует напрямую вторгающихся микробов. Скорее, NK-клетки разрушают скомпрометированные клетки-хозяева, такие как опухолевые клетки или инфицированные вирусом клетки, распознавая такие клетки по состоянию, известному как «отсутствие себя». Этот термин описывает клетки с низким уровнем маркера клеточной поверхности, называемого MHC I (главный комплекс гистосовместимости ), — ситуацию, которая может возникнуть при вирусных инфекциях клеток-хозяев. Их назвали «естественными убийцами» из-за первоначального представления о том, что им не нужна активация, чтобы убивать клетки, которые «теряют себя». В течение многих лет было неясно, как NK-клетки распознают опухолевые клетки и инфицированные клетки. Теперь известно, что состав MHC на поверхности этих клеток изменяется, и NK-клетки активируются благодаря распознаванию «отсутствующего я». Нормальные клетки организма не распознаются и не атакуются NK-клетками, потому что они экспрессируют интактные собственные антигены MHC. Эти антигены MHC распознаются рецепторами иммуноглобулинов клеток-киллеров (KIR), которые по существу тормозят действие NK-клеток.
Воспаление
Воспаление является одним из первых ответов иммунной системы на инфекцию. Симптомами воспаления являются покраснение, отек, жар и боль, которые вызваны усиленным притоком крови в ткани. Воспаление вызывается эйкозаноидами и цитокинами, которые выделяются поврежденными или инфицированными клетками. Эйкозаноиды включают простагландины, вызывающие лихорадку и расширение кровеносных сосудов, связанных с воспалением, и лейкотриены, которые привлекают определенные белые кровяные тельца (лейкоциты). Общие цитокины включают интерлейкины, которые отвечают за связь между лейкоцитами; хемокины, которые способствуют хемотаксису ; и интерфероны, которые обладают антивирусными эффектами, такими как прекращение синтеза белка в клетке-хозяине. Факторы роста и цитотоксические факторы могут также будет выпущен. Эти цитокины и другие химические вещества привлекают иммунные клетки к месту инфекции и способствуют заживлению любой поврежденной ткани после удаления патогенов.
Система комплемента
Система комплемента — это биохимический каскад атакует поверхности чужеродных клеток. Он содержит более 20 различных белков и назван так за его способность «дополнять» уничтожение патогенов антителами. Комплемент — главный гуморальный компонент врожденного иммунного ответа. Многие виды имеют системы комплемента, в том числе не млекопитающие, такие как растения, рыбы и некоторые беспозвоночные.
У людей этот ответ активируется связыванием комплемента с антителами, которые прикрепились к этим микробам или связывание белков комплемента с углеводами на поверхности микробов. Этот сигнал распознавания вызывает быстрое уничтожение. Скорость ответа является результатом усиления сигнала, которое происходит после последовательной протеолитической активации молекул комплемента, которые также являются протеазами. После того, как белки комплемента первоначально связываются с микробом, они активируют свою протеазную активность, которая, в свою очередь, активирует другие протеазы комплемента и так далее. Это создает каталитический каскад, который усиливает начальный сигнал посредством контролируемой положительной обратной связи. Каскад приводит к продукции пептидов, которые привлекают иммунные клетки, увеличивают сосудистую проницаемость и опсонизируют (покрывают) поверхность патогена, отмечая его для разрушения. Это отложение комплемента также может убивать клетки напрямую, разрушая их плазматическую мембрану.
Адаптивную иммунную систему
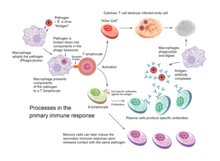
Адаптивная иммунная система развивалась у ранних позвоночных и позволяет более сильный иммунный ответ, а также иммунологическая память, где каждый патоген «запоминается» сигнатурным антигеном. Адаптивный иммунный ответ является антиген-специфическим и требует распознавания специфических «чужих» антигенов в процессе, называемом презентацией антигена. Антигенная специфичность позволяет генерировать ответы, адаптированные к конкретным патогенам или инфицированным патогеном клеткам. Способность формировать эти индивидуальные ответы поддерживается в организме «клетками памяти». Если патоген заразит организм более одного раза, эти специфические клетки памяти используются для его быстрого устранения.
Распознавание антигена
Клетки адаптивной иммунной системы представляют собой особые типы лейкоцитов, называемые лимфоцитами. В-клетки и Т-клетки являются основными типами лимфоцитов и происходят из гемопоэтических стволовых клеток в костном мозге. В-клетки участвуют в гуморальном иммунном ответе, тогда как Т-клетки участвуют в клеточно-опосредованном иммунном ответе.
Т-киллеры распознают только антигены, связанные с MHC класса I молекулы, в то время как хелперные Т-клетки и регуляторные Т-клетки распознают только антигены, связанные с молекулами MHC класса II. Эти два механизма презентации антигена отражают разные роли двух типов Т-клеток. Третий, второстепенный подтип — это γδ Т-клетки, которые распознают интактные антигены, которые не связаны с рецепторами MHC. Двойные положительные Т-клетки подвергаются воздействию широкого спектра аутоантигенов в тимусе, в котором йод необходим для его развития и активности тимуса.
Напротив, В-клеточный антиген-специфический рецептор представляет собой молекулу антитела на поверхности В-клетки и распознает целые патогены без какой-либо необходимости в процессинге антигена. Каждая линия B-клеток экспрессирует разные антитела, поэтому полный набор рецепторов B-клеточных антигенов представляет все антитела, которые может продуцировать организм.
Презентация антигена Т-лимфоцитам
И B-клетки, и Т-клетки несут рецепторные молекулы, распознающие определенные мишени. Т-клетки распознают «чужую» мишень, такую как патоген, только после того, как антигены (небольшие фрагменты патогена) были обработаны и представлены в комбинации с «собственным» рецептором, называемым молекулой главного комплекса гистосовместимости (MHC).
Клеточно-опосредованный иммунитет
Существует два основных подтипа Т-клеток: Т-киллерные Т-клетки и хелперные Т-клетки. Кроме того, существуют регуляторные Т-клетки, которые играют роль в модуляции иммунного ответа.
Т-клетки-киллеры
Т-клетки-киллеры представляют собой подгруппу Т-клеток, которые убивают клетки, инфицированные вирусами (и другими патогенами), или иным образом поврежденные или нефункциональные. Как и в случае с В-клетками, каждый тип Т-клеток распознает свой антиген. Киллерные Т-клетки активируются, когда их Т-клеточный рецептор (TCR) связывается с этим специфическим антигеном в комплексе с рецептором MHC Class I другой клетки. Распознаванию этого комплекса MHC: антиген помогает корецептор на Т-клетке, называемый CD8. Затем Т-клетка путешествует по телу в поисках клеток, в которых рецепторы MHC I несут этот антиген. Когда активированная Т-клетка контактирует с такими клетками, она выделяет цитотоксины, такие как перфорин, которые образуют поры в плазматической мембране клетки-мишени, позволяя ионам , вода и токсины для попадания. Попадание другого токсина, называемого гранулизин (протеаза), вызывает у клетки-мишени апоптоз. Убийство Т-клеток клеток-хозяев особенно важно для предотвращения репликации вирусов. Активация Т-клеток строго контролируется и обычно требует очень сильного сигнала активации MHC / антигена или дополнительных сигналов активации, обеспечиваемых «хелперными» Т-клетками (см. Ниже).
Хелперные Т-клетки

Хелперные Т-клетки регулируют как врожденные, так и адаптивные иммунные ответы и помогают определить, какие иммунные ответы организм выдает на конкретный патоген. Эти клетки не обладают цитотоксической активностью и не убивают инфицированные клетки и не уничтожают патогены напрямую. Вместо этого они контролируют иммунный ответ, заставляя другие клетки выполнять эти задачи.
Хелперные Т-клетки экспрессируют Т-клеточные рецепторы (TCR), которые распознают антиген, связанный с молекулами MHC класса II. Комплекс MHC: антиген также распознается корецептором CD4 вспомогательной клетки, который рекрутирует молекулы внутри Т-клетки (например, Lck ), которые отвечают за активацию Т-клетки. Т-хелперные Т-клетки имеют более слабую связь с комплексом МНС: антиген, чем наблюдаемые для Т-клеток-киллеров, что означает, что многие рецепторы (около 200–300) на хелперных Т-клетках должны быть связаны антигеном МНС:, чтобы активировать хелперные клетки, в то время как Т-клетки-киллеры могут быть активированы путем задействования одной молекулы MHC: антигена. Активация хелперных Т-клеток также требует более длительного взаимодействия с антигенпрезентирующей клеткой. Активация покоящихся хелперных Т-клеток заставляет их выделять цитокины, которые влияют на активность многих типов клеток. Сигналы цитокинов, продуцируемые Т-хелперами, усиливают микробицидную функцию макрофагов и активность Т-клеток-киллеров. Кроме того, активация хелперных Т-клеток вызывает повышенную регуляцию молекул, экспрессируемых на поверхности Т-клеток, таких как лиганд CD40 (также называемый CD154 ), которые обеспечивают дополнительные стимулирующие сигналы, обычно необходимые для активации продуцирующих антитела В-клеток.
Гамма-дельта-Т-клетки
Гамма-дельта-Т-клетки (γδ Т-клетки) обладают альтернативным Т-клеточным рецептором (TCR) в отличие от CD4 + и CD8 + (αβ) Т-клетки и имеют общие характеристики хелперных Т-клеток, цитотоксических Т-клеток и NK-клеток. Условия, которые вызывают ответ γδ Т-клеток, полностью не изучены. Подобно другим «нетрадиционным» подмножествам Т-клеток, несущим инвариантные TCR, такие как CD1d -ограниченные Т-клетки естественных киллеров, γδ Т-клетки находятся на границе между врожденным и адаптивным иммунитетом. С одной стороны, γδ Т-клетки являются компонентом адаптивного иммунитета, поскольку они реорганизуют гены TCR для обеспечения разнообразия рецепторов, а также могут развить фенотип памяти. С другой стороны, различные подмножества также являются частью врожденной иммунной системы, поскольку ограниченные рецепторы TCR или NK могут использоваться в качестве рецепторов распознавания образов. Например, большое количество человеческих Т-клеток Vγ9 / Vδ2 в течение нескольких часов реагирует на обычные молекулы, продуцируемые микробами, а сильно ограниченные Т-клетки Vδ1 + в эпителии отвечают на стрессовые эпителиальные клетки.

Гуморальный иммунный ответ
A В-клетка идентифицирует патогены, когда антитела на своей поверхности связываются со специфическим чужеродным антигеном. Этот комплекс антиген / антитело захватывается В-клеткой и процессируется протеолизом в пептиды. Затем В-клетка отображает эти антигенные пептиды на своих поверхностных молекулах MHC класса II. Эта комбинация MHC и антигена привлекает соответствующую хелперную Т-клетку, которая высвобождает лимфокины и активирует В-клетку. Когда активированная В-клетка затем начинает делиться, ее потомство (плазматические клетки ) секретирует миллионы копий антитела, которое распознает этот антиген. Эти антитела циркулируют в плазме крови и лимфе, связываются с патогенами, экспрессирующими антиген, и маркируют их для разрушения посредством активации комплемента или для поглощения и разрушения фагоцитами. Антитела также могут нейтрализовать заражение напрямую, связываясь с бактериальными токсинами или вмешиваясь в рецепторы, которые вирусы и бактерии используют для заражения клеток.
Иммунологическая память
Когда В-клетки и Т-клетки активированы и начинают размножаться, некоторые из их потомков становятся долгоживущими клетками памяти. На протяжении всей жизни животного эти клетки памяти запоминают каждый встреченный патоген и могут дать сильный ответ, если патоген обнаружен снова. Это «адаптивный», потому что он происходит в течение жизни человека как адаптация к инфекции этим патогеном и подготавливает иммунную систему к будущим вызовам. Иммунологическая память может иметь форму пассивной кратковременной памяти или активной долговременной памяти.

Физиологическая регуляция
Иммунная система участвует во многих аспектах физиологической регуляции в организме. Иммунная система тесно взаимодействует с другими системами, такими как эндокринная и нервная системы. Иммунная система также играет решающую роль в эмбриогенезе (развитии эмбриона), а также в репарации тканей и регенерации.
Гормоны
Гормоны могут действовать как иммуномодуляторы, изменяя чувствительность иммунной системы. Например, женские половые гормоны являются известными иммуностимуляторами как адаптивного, так и врожденного иммунных ответов. Некоторые аутоиммунные заболевания, такие как красная волчанка, поражают преимущественно женщин, и их начало часто совпадает с половым созреванием. Напротив, мужские половые гормоны, такие как тестостерон, кажутся иммунодепрессивными. Другие гормоны, по-видимому, также регулируют иммунную систему, в первую очередь пролактин, гормон роста и витамин D.
витамин D
Когда T- клетка встречает чужеродный патоген, она удлиняет рецептор витамина D. По сути, это сигнальное устройство, которое позволяет Т-клетке связываться с активной формой витамина D, стероидного гормона кальцитриола. Т-клетки имеют симбиотические отношения с витамином D. Т-лимфоциты не только расширяют рецептор витамина D, по сути, требуя связываться со стероидным гормональным вариантом витамина D, кальцитриолом, но и Т-клетка экспрессирует ген CYP27B1, который является геном, ответственным за преобразование предгормональной версии витамина D, кальцидиола, в версию стероидного гормона, кальцитриол. Только после связывания с кальцитриолом Т-клетки могут выполнять свои функции. Другими клетками иммунной системы, которые, как известно, экспрессируют CYP27B1 и, таким образом, активируют кальцидиол витамина D, являются дендритные клетки, кератиноциты и макрофаги.
. предположили, что прогрессирующее снижение уровня гормонов с возрастом частично отвечает за ослабленные иммунные реакции у стареющих людей. И наоборот, некоторые гормоны регулируются иммунной системой, в частности, активностью гормона щитовидной железы. Возрастное снижение иммунной функции также связано со снижением уровня витамина D у пожилых людей. С возрастом происходят две вещи, которые негативно влияют на уровень витамина D. Во-первых, они больше остаются дома из-за снижения уровня активности. Это означает, что они получают меньше солнца и, следовательно, вырабатывают меньше холекальциферола за счет УФВ-излучения. Во-вторых, с возрастом кожа становится менее способной вырабатывать витамин D.
Сон и отдых
На иммунную систему влияют сон и отдых, и лишение сна пагубно влияет на иммунную функцию. Сложные петли обратной связи с участием цитокинов, таких как интерлейкин-1 и фактор некроза опухоли-α, образующиеся в ответ на инфекцию, по-видимому, также играют роль в регуляции небыстрого движения глаз (REM ) сна. Таким образом, иммунный ответ на инфекцию может привести к изменениям в цикле сна, включая увеличение медленного сна по сравнению с быстрым сном.
При недосыпании активные иммунизации могут иметь ослабленный эффект и может привести к более низкой продукции антител и более низкому иммунному ответу, чем было бы отмечено у хорошо отдохнувшего человека. Кроме того, белки, такие как NFIL3, которые, как было показано, тесно переплетены с обеими дифференцированными Т-клетками ион и наши циркадные ритмы, могут быть затронуты нарушением циклов естественного освещения и темноты в результате недосыпания, сменной работы и т. д. В результате эти нарушения могут привести к увеличению хронических состояний, таких как сердечные заболевания, хроническая боль., и астма.
Было показано, что помимо негативных последствий недосыпания, сон и взаимосвязанная циркадная система оказывают сильное регулирующее воздействие на иммунологические функции, влияющие как на врожденный, так и на адаптивный иммунитет. Во-первых, во время ранней стадии медленного сна внезапное падение уровней кортизола, адреналина и норадреналина в крови вызывает повышение уровня гормонов в крови. лептин, гормон роста гипофиза и пролактин. Эти сигналы вызывают провоспалительное состояние за счет производства провоспалительных цитокинов интерлейкина-1, интерлейкина-12, TNF-альфа и IFN-гамма. Эти цитокины затем стимулируют иммунные функции, такие как активация, пролиферация и дифференцировка иммунных клеток. Именно в это время недифференцированные или менее дифференцированные, такие как наивные Т-клетки и Т-клетки центральной памяти, достигают пика (т.е. во время медленно развивающегося адаптивного иммунного ответа). В дополнение к этим эффектам среда гормонов, вырабатываемых в это время (лептин, гормон роста гипофиза и пролактин), поддерживает взаимодействия между APC и Т-клетками, сдвиг цитокинового баланса Th1 / T h2 в сторону тот, который поддерживает T h 1, увеличение общей пролиферации T h клеток и наивную миграцию Т-клеток в лимфатические узлы. Считается также, что эта среда поддерживает формирование прочной иммунной памяти за счет инициирования иммунных ответов Th1.
Напротив, во время бодрствования дифференцированные эффекторные клетки, такие как цитотоксические естественные клетки-киллеры и CTL (цитотоксические T лимфоциты), пик, чтобы вызвать эффективный ответ против любых вторгшихся патогенов. Также во время бодрствования достигают пика противовоспалительные молекулы, такие как кортизол и катехоламины. Есть две теории относительно того, почему провоспалительное состояние ограничивается временем сна. Во-первых, воспаление могло бы вызвать серьезные когнитивные и физические нарушения, если бы оно произошло во время бодрствования. Во-вторых, воспаление может возникнуть во время сна из-за присутствия мелатонина. Воспаление вызывает сильную оксидативный стресс, и присутствие мелатонина во время сна может активно противодействовать выработке свободных радикалов в это время.
Питание и диета
Переедание связано с с такими заболеваниями, как диабет и ожирение, которые, как известно, влияют на иммунную функцию. Более умеренное недоедание, а также дефицит определенных микроэлементов и питательных веществ также могут поставить под угрозу иммунный ответ.
Продукты, богатые определенными жирными кислотами, могут способствовать укреплению здоровой иммунной системы. Точно так же недостаточное питание плода может вызвать пожизненное нарушение иммунной системы.
Восстановление и регенерация
Иммунная система, особенно врожденный компонент, играет решающую роль в восстановление тканей после травмы. Ключевые участники включают макрофаги и нейтрофилы, но и другие клеточные субъекты, включая γδ Т-клетки, врожденные лимфоидные клетки (ILC) и регуляторные Т-клетки (Tregs), тоже важны. Пластичность иммунных клеток и баланс между провоспалительными и противовоспалительными сигналами являются ключевыми аспектами эффективного восстановления тканей. Иммунные компоненты и пути также участвуют в регенерации, например, у амфибий. Согласно одной из гипотез, организмы, которые могут регенерировать, могут быть менее иммунокомпетентными, чем организмы, которые не могут регенерировать.
Нарушения иммунитета человека
Иммунная система — это чрезвычайно эффективная структура, которая включает в себя специфичность, индуцируемость и адаптацию. Однако сбои в защите хозяина все же случаются и делятся на три большие категории: иммунодефицит, аутоиммунитет и гиперчувствительность.
Иммунодефициты
Иммунодефициты возникают, когда один или несколько компонентов иммунной системы неактивны. Способность иммунной системы реагировать на патогены снижается как у молодых, так и у пожилых, при этом иммунные ответы начинают снижаться примерно в возрасте 50 лет из-за старения иммунной системы. В развитых странах, ожирение, алкоголизм и употребление наркотиков являются частыми причинами плохой иммунной функции, а недоедание является наиболее частой причиной иммунодефицита в развивающихся странах. Рацион с недостаточным содержанием белка связан с нарушением клеточного иммунитета, активности комплемента, функции фагоцитов, концентраций антител IgA и продукции цитокинов. Кроме того, потеря тимуса в раннем возрасте в результате генетической мутации или хирургического удаления приводит к тяжелому иммунодефициту и высокой восприимчивости к инфекции.
Также могут быть иммунодефициты. унаследованный или «приобретенный». Хроническая гранулематозная болезнь, при которой фагоциты имеют пониженную способность уничтожать патогены, является примером унаследованного или врожденного, иммунодефицит. СПИД и некоторые типы рака вызывают приобретенный иммунодефицит.
Аутоиммунитет
Сверхактивные иммунные ответы формируют противоположную сторону иммунной дисфункции, особенно аутоиммунные расстройства. Здесь иммунная система не может правильно различать «я» и «чужое» и атакует часть тела. В нормальных условиях многие Т-клетки и антитела реагируют с «собственными» пептидами. Одна из функций специализированных клеток (расположенных в тимусе и костном мозге ) заключается в представлении молодых лимфоцитов аутоантигенам, продуцируемым по всему телу, и устранению тех клеток, которые распознают аутоантигены., предотвращая аутоиммунитет.
Гиперчувствительность
Гиперчувствительность — это иммунный ответ, который повреждает собственные ткани организма. Они делятся на четыре класса (Тип I — IV) в зависимости от задействованных механизмов и динамики гиперчувствительной реакции. Гиперчувствительность I типа — это немедленная или анафилактическая реакция, часто связанная с аллергией. Симптомы могут варьироваться от легкого дискомфорта до смерти. Гиперчувствительность I типа опосредуется IgE, который запускает дегрануляцию тучных клеток и базофилов при перекрестном связывании антигеном. Гиперчувствительность II типа возникает, когда антитела связываются с антигенами на собственных клетках пациента, маркируя их для разрушения. Это также называется антителозависимой (или цитотоксической) гиперчувствительностью и опосредуется антителами IgG и IgM. Иммунные комплексы (скопления антигенов, белков комплемента, и антитела IgG и IgM), депонированные в различных тканях, вызывают реакции гиперчувствительности III типа. Гиперчувствительность IV типа (также известная как клеточно-опосредованная гиперчувствительность или гиперчувствительность замедленного типа) обычно развивается от двух до трех дней. Реакции типа IV участвуют во многих аутоиммунных и инфекционных заболеваниях, но могут также включать контактный дерматит (ядовитый плющ ). Эти реакции опосредуются Т-клетками, моноцитами и макрофагами.
Идиопатическим воспалением
Воспаление является одним из первых ответов иммунной системы на инфекция, но она может появиться без известной причины.
Воспаление вызывается эйкозаноидами и цитокинами, которые выделяются поврежденными или инфицированными клетками. Эйкозаноиды включают простагландины, вызывающие лихорадку и расширение кровеносных сосудов, связанных с воспалением, и лейкотриены, которые привлекают определенные белые кровяные тельца (лейкоциты). Общие цитокины включают интерлейкины, которые отвечают за связь между лейкоцитами; хемокины, которые способствуют хемотаксису ; и интерфероны, которые обладают антивирусными эффектами, такими как прекращение синтеза белка в клетке-хозяине. Факторы роста и цитотоксические факторы могут также будет выпущен. Эти цитокины и другие химические вещества привлекают иммунные клетки к месту инфекции и способствуют заживлению любой поврежденной ткани после удаления патогенов.
Манипуляции в медицине

Иммунным ответом можно управлять для подавления нежелательных реакций, возникающих в результате аутоиммунитета, аллергии и отторжения трансплантата, а также для стимуляции защитных реакций против патогенов, которые в значительной степени ускользают от иммунной системы (см. иммунизация) или рак.
Иммуносупрессия
Иммунодепрессанты используются для контроля аутоиммунных заболеваний или воспаления при чрезмерном повреждении тканей, а также для предотвращения отторжения трансплантата после трансплантация органов.
Противовоспалительные препараты часто используются для борьбы с эффектами воспаления. Глюкокортикоиды — самые сильные из этих препаратов; однако эти препараты могут иметь много нежелательных побочных эффектов, таких как центральное ожирение, гипергликемия, остеопороз, и их применение должно строго ограничиваться. контролируется. Более низкие дозы противовоспалительных препаратов часто используются в сочетании с цитотоксическими или иммуносупрессивными препаратами, такими как метотрексат или азатиоприн. Цитотоксические препараты подавляют иммунный ответ, убивая делящиеся клетки, такие как активированные Т-клетки. Однако убийство носит неизбирательный характер, и другие постоянно делящиеся клетки и их органы поражаются, что вызывает токсические побочные эффекты. Иммунодепрессанты, такие как циклоспорин, не позволяют Т-клеткам правильно реагировать на сигналы, ингибируя сигнальные пути.
Иммуностимуляция
Иммунотерапия рака охватывает медицинские пути чтобы стимулировать иммунную систему атаковать раковые опухоли.
Вакцинация
Долгосрочная активная память приобретается после инфицирования путем активации B- и T-клеток. Активный иммунитет также можно создать искусственно с помощью вакцинации. Принцип вакцинации (также называемой иммунизацией ) заключается во введении антигена от патогена с целью стимулирования иммунной системы и развития специфического иммунитета против этого конкретного патогена. не вызывая заболевания, связанного с этим организмом. Эта преднамеренная индукция иммунного ответа является успешной, потому что она использует естественную специфичность иммунной системы, а также ее индуцируемость. Поскольку инфекционные заболевания остаются одной из основных причин смерти в человеческой популяции, вакцинация представляет собой наиболее эффективное средство манипулирования иммунной системой, которое разработало человечество.
Большинство вирусных вакцин основаны на живых аттенуированных вирусов, в то время как многие бактериальные вакцины основаны на бесклеточных компонентах микроорганизмов, включая безвредные токсин компоненты. Поскольку многие антигены, полученные из бесклеточных вакцин, не вызывают в значительной степени адаптивного ответа, большинство бактериальных вакцин снабжены дополнительными адъювантами, которые активируют антигенпрезентирующие клетки врожденной иммунной системы. и максимизировать иммуногенность.
Иммунология опухоли

Еще одна важная роль иммунной системы заключается в выявлении и устранении опухолей. Это называется иммунным надзором . Трансформированные клетки опухолей экспрессируют антигены, которые не обнаруживаются в нормальных клетках. Для иммунной системы эти антигены кажутся чужеродными, и их присутствие заставляет иммунные клетки атаковать трансформированные опухолевые клетки. Антигены, экспрессируемые опухолями, имеют несколько источников; некоторые происходят от онкогенных вирусов, таких как вирус папилломы человека, который вызывает рак шейки матки, вульвы, влагалища, пенис, анус, рот и горло, в то время как другие представляют собой собственные белки организма, которые присутствуют на низких уровнях в нормальных клетках, но достигают высоких уровней в опухолевых клетках.. Одним из примеров является фермент под названием тирозиназа, который при высокой экспрессии превращает определенные клетки кожи (например, меланоциты ) в опухоли, называемые меланомами. Третьим возможным источником опухолевых антигенов являются белки, обычно важные для регуляции роста клеток и выживания, которые обычно мутируют в вызывающие рак молекулы, называемые онкогенами.
. Основной ответ иммунной системы на опухоли заключается в уничтожить аномальные клетки с помощью Т-киллеров, иногда с помощью Т-хелперов. Опухолевые антигены представлены на молекулах MHC класса I аналогично вирусным антигенам. Это позволяет Т-клеткам-киллерам распознавать опухолевую клетку как аномальную. NK-клетки также убивают опухолевые клетки аналогичным образом, особенно если на поверхности опухолевых клеток меньше молекул MHC класса I, чем обычно; это обычное явление для опухолей. Иногда антитела вырабатываются против опухолевых клеток, что делает возможным их разрушение системой комплемента .
Очевидно, что некоторые опухоли ускользают от иммунной системы и переходят в раковые образования. Опухолевые клетки часто имеют меньшее количество молекул MHC класса I на своей поверхности, что позволяет избежать обнаружения Т-клетками-киллерами. Некоторые опухолевые клетки также выделяют продукты, подавляющие иммунный ответ; например, путем секреции цитокина TGF-β, который подавляет активность макрофагов и лимфоцитов. Кроме того, иммунологическая толерантность может развиваться против опухолевых антигенов, поэтому иммунная система больше не атакует опухолевые клетки.
Парадоксально, но макрофаги могут способствовать росту опухоли, когда опухолевые клетки посылают цитокины, привлекающие макрофаги., которые затем генерируют цитокины и факторы роста, такие как фактор некроза опухоли альфа, которые способствуют развитию опухоли или способствуют пластичности, подобной стволовым клеткам. Кроме того, комбинация гипоксии опухоли и цитокина, продуцируемого макрофагами, побуждает опухолевые клетки снижать выработку белка, который блокирует метастаз и тем самым способствует распространению раковых клеток. Противоопухолевые макрофаги M1 привлекаются на ранних этапах развития опухоли, но постепенно дифференцируются в M2 с проопухолевым эффектом, переключением иммуносупрессора. Гипоксия снижает выработку цитокинов для противоопухолевого ответа, и макрофаги постепенно приобретают проопухолевые функции M2, управляемые микроокружением опухоли, включая IL-4 и IL-10.
Прогнозирование иммуногенности
Более крупные препараты (>500 Да ) могут спровоцировать нейтрализующий иммунный ответ, что означает, что иммунная система производит нейтрализующие антитела, которые противодействуют действие лекарств, особенно если лекарства вводятся повторно или в больших дозах. Это ограничивает эффективность лекарств на основе более крупных пептидов и белков (которые обычно имеют размер более 6000 Да). В некоторых случаях лекарство само по себе не является иммуногенным, но его можно вводить совместно с иммуногенным соединением, как иногда бывает в случае Таксола. Вычислительные методы были разработаны для прогнозирования иммуногенности пептидов и белков, которые особенно полезны при разработке терапевтических антител, оценке вероятной вирулентности мутаций в частицах вирусной оболочки и валидации предлагаемых лекарственных препаратов на основе пептидов. Ранние методы основывались в основном на наблюдении, что гидрофильные аминокислоты чрезмерно представлены в областях эпитопа, чем гидрофобные аминокислоты; однако более поздние разработки опираются на методы машинного обучения с использованием баз данных существующих известных эпитопов, обычно хорошо изученных вирусных белков, в качестве обучающего набора. Была создана общедоступная база данных для каталогизации эпитопов патогенов, которые, как известно, распознаются В-клетками. Новая область исследований иммуногенности на основе биоинформатики называется иммуноинформатикой. Иммунопротеомика — это изучение больших наборов белков (протеомика ) участвует в иммунном ответе.
Эволюция и другие механизмы
Эволюция иммунной системы
Вероятно, что многокомпонентная адаптивная иммунная система возникла у первых позвоночных, поскольку беспозвоночные не генерируют лимфоциты или гуморальный ответ на основе антител. Однако многие виды используют механизмы, которые, по-видимому, являются предшественниками этих аспектов иммунитета позвоночных. Иммунные системы появляются даже у простейших по структуре форм жизни, когда бактерии используют уникальный защитный механизм, называемый системой рестрикционной модификации, для защиты от вирусных патогенов, называемых бактериофагами. Прокариоты также обладают приобретенным иммунитетом благодаря системе, которая использует последовательности CRISPR для сохранения фрагментов геномов фага, с которыми они вступали в контакт в прошлом, что позволяет им блокировать репликацию вируса с помощью формы РНК-интерференция. Прокариоты также обладают другими защитными механизмами. Атакующие элементы иммунной системы также присутствуют у одноклеточных эукариот, но исследования их роли в защите немногочисленны.
Рецепторы распознавания образов представляют собой белки, используемые почти всеми организмами для идентификации молекул, связанных с патогены. Противомикробные пептиды, называемые дефенсинами, являются эволюционно консервативным компонентом врожденного иммунного ответа, обнаруженного у всех животных и растений, и представляют собой основную форму беспозвоночных системного иммунитета. система комплемента и фагоцитарные клетки также используются большинством форм жизни беспозвоночных. Рибонуклеазы и путь РНК-интерференции консервативны у всех эукариот и, как считается, играют роль в иммунном ответе на вирусы.
В отличие от животных, растения лишены фагоцитарных клеток, но многие иммунные реакции растений включают системные химические сигналы, которые передаются через растение. Отдельные клетки растений отвечают на молекулы, связанные с патогенами, известные как молекулярные структуры, связанные с патогенами, или PAMP. Когда часть растения заражается, растение вырабатывает локализованный гиперчувствительный ответ, при котором клетки в месте заражения подвергаются быстрому апоптозу, чтобы предотвратить распространение болезни на другие части растение. Системная приобретенная устойчивость (SAR) — это тип защитной реакции, используемой растениями, которая делает все растение устойчивым к конкретному инфекционному агенту. Механизмы подавления РНК особенно важны важны в этом системном ответе, поскольку они могут блокировать репликацию вируса.
Альтернативная адаптивная иммунная система
Эволюция адаптивной иммунной системы произошла у предков челюстных позвоночных. Многие из классических молекул адаптивной иммунной системы (например, иммуноглобулины и рецепторы Т-клеток ) существуют только у челюстных позвоночных. Однако у примитивных бесчелюстных позвоночных, таких как минога и миксина, была обнаружена отдельная молекула, производная от лимфоцитов. Эти животные обладают большим набором молекул, называемых вариабельными рецепторами лимфоцитов (VLR), которые, как и рецепторы антигена челюстных позвоночных, производятся лишь небольшим количеством (одним или двумя) из генов. Считается, что эти молекулы связывают патогенные антигены таким же образом, как и антитела, и с такой же степенью специфичности.
Манипуляции патогенами
Успех любого Патоген зависит от его способности избегать иммунных ответов хозяина. Таким образом, патогены разработали несколько методов, которые позволяют им успешно инфицировать хозяина, избегая обнаружения или уничтожения иммунной системой. Бактерии часто преодолевают физические барьеры, секретируя ферменты, которые переваривают барьер, например, используя систему секреции типа II. В качестве альтернативы, используя систему секреции типа III, они могут вставить полую трубку в клетку-хозяин, обеспечивая прямой путь для белков от патогена к хозяину. Эти белки часто используются для отключения защиты хозяина.
Стратегия уклонения, используемая некоторыми патогенами для избежания врожденной иммунной системы, заключается в том, чтобы спрятаться внутри клеток своего хозяина (также называемого внутриклеточным патогенез ). Здесь патоген проводит большую часть своего жизненного цикла внутри клеток-хозяев, где он защищен от прямого контакта с иммунными клетками, антителами и комплементом. Некоторые примеры внутриклеточных патогенов включают вирусы, пищевые отравления бактерии Salmonella и эукариотические паразиты, вызывающие малярию (Plasmodium falciparum ) и лейшманиоз (Leishmania spp.). Другие бактерии, такие как Mycobacterium tuberculosis, живут внутри защитной капсулы, предотвращающей лизис комплементом. Многие патогены выделяют соединения, которые снижают иммунный ответ хозяина или неверно направляют его. Некоторые бактерии образуют биопленку, чтобы защитить себя от клеток и белков иммунной системы. Такие биопленки присутствуют при многих успешных инфекциях, например, при хронических инфекциях Pseudomonas aeruginosa и Burkholderia cenocepacia, характерных для кистозного фиброза. Другие бактерии производят поверхностные белки, которые связываются с антителами, что делает их неэффективными; примеры включают Streptococcus (протеин G), Staphylococcus aureus (протеин A) и Peptostreptococcus magnus (протеин L).
Используемые механизмы уклониться от адаптивной иммунной системы сложнее. Самый простой подход заключается в быстром изменении несущественных эпитопов (аминокислот и / или сахаров) на поверхности патогена, при этом основные эпитопы остаются скрытыми. Это называется антигенной вариацией. Примером является ВИЧ, который быстро мутирует, поэтому белки на его вирусной оболочке, которые необходимы для проникновения в его клетку-мишень, постоянно меняются. Эти частые изменения антигенов могут объяснить неудачи вакцин, направленных против этого вируса. Паразит Trypanosoma brucei использует аналогичную стратегию, постоянно меняя один тип поверхностного белка на другой, что позволяет ему оставаться на шаг впереди ответа антител. Маскирование антигенов молекулами хозяина — еще одна распространенная стратегия, позволяющая избежать обнаружения иммунной системой. В ВИЧ оболочка, покрывающая вирион , образована самой внешней мембраной клетки-хозяина; такие «самокрытые» вирусы затрудняют идентификацию иммунной системой их как «чужих» структур.
История иммунологии
Иммунология — это наука, изучающая структуру и функции иммунной системы. Он берет свое начало из медицины и ранних исследований причин иммунитета к болезням. Самое раннее известное упоминание об иммунитете было во время чумы в Афинах в 430 году до нашей эры. Фукидид отмечал, что люди, выздоровевшие после предыдущего приступа болезни, могли ухаживать за больными, не заразившись им во второй раз. В 18 веке Пьер-Луи Моро де Мопертюи провел эксперименты с ядом скорпиона и обнаружил, что некоторые собаки и мыши были невосприимчивы к этому яду. В X веке персидский врач ар-Рази (также известный как Разес) написал первую зарегистрированную теорию приобретенного иммунитета, отметив, что оспа защитила выживших от будущих инфекций. Хотя он объяснил иммунитет как «избыточную влагу», которая выводится из крови, что предотвращает повторение болезни во второй раз, эта теория объясняла многие наблюдения об оспе, известные в то время.
Эти и другие наблюдения приобретенного иммунитета были позже использованы Луи Пастером в его разработке вакцинации и его предложенной микробной теории болезни. Теория Пастера прямо противоположна современным теориям болезней, таким как теория миазмов. Только Роберт Кох 1891 доказал, за которые он был удостоен Нобелевской премии в 1905 году, микроорганизмы были подтверждены. как причина инфекционного заболевания. Вирусы были подтверждены как патогенные микроорганизмы человека в 1901 году, когда Уолтером Ридом.
был открыт вирус желтой лихорадки ..
Иммунология сделала большой шаг вперед к концу XIX века благодаря быстрому развитию исследование гуморального иммунитета и клеточного иммунитета. Особенно важна была работа Пола Эрлиха, который предложил теорию боковой цепи для объяснения специфичности реакции антиген-антитело ; его вклад в понимание гуморального иммунитета был отмечен Нобелевской премией 1908 года, которая была присуждена основателю клеточной иммунологии Эли Мечникову.
Теоретические подходы к иммунной системе
Иммунология является строго экспериментальной в повседневной практике, но также характеризуется постоянным теоретическим подходом. Многие теории были предложены в иммунологии с конца девятнадцатого века до настоящего времени. В конце XIX — начале XX века развернулась битва между «клеточной» и «гуморальной» теориями иммунитета. Согласно клеточной теории иммунитета, представленной, в частности, Эли Мечников, именно клетки — точнее, фагоциты — ответственны за иммунные ответы. Напротив, гуморальная теория иммунитета, которую придерживались, среди прочего, Роберт Кох и Эмиль фон Беринг, утверждала, что активные иммунные агенты представляют собой растворимые компоненты (молекулы), обнаруженные в организме. «Юмор», а не его клетки.
В середине 1950-х годов Фрэнк Бернет, вдохновленный предложением Нильса Джерна, сформулировал клональный теория отбора (CST) иммунитета. На основе CST Бернет разработал теорию того, как иммунный ответ запускается в соответствии с различием «я» / «чужой»: составляющие «я» (составляющие тела) не вызывают деструктивных иммунных ответов, в то время как «чужие» сущности (патогены, аллотрансплантат) вызывают деструктивный иммунный ответ. Позднее теория была изменена, чтобы отразить новые открытия, касающиеся гистосовместимости или сложной «двухсигнальной» активации Т-клеток. Теория иммунитета «я / не-я» и словарь «я / не-я» подвергались критике, но остаются очень влиятельными.
В последнее время в иммунологии было предложено несколько теоретических основ, включая «аутопоэтический » взгляды, «когнитивные иммунные» взгляды, «модель опасности » (или «теория опасности») и теория «прерывности». Модель опасности, предложенная Полли Матцингер и коллегами, оказала большое влияние, вызвала множество комментариев и дискуссий.
Органы
Следующие органы и части тела играют роль в иммунной системе.
- Лимфатические сосуды
- Лимфатические узлы
- Тимус
- Селезенка
- Костный мозг
- Аппендикс
- Миндалины
- Аденоид
- Пейеровы пятна
См. Также
- Катафилаксия
- Клональный отбор
- Fc-рецептор
- Hapten
- Физиология человека
- Теория иммунных сетей
- Рецепторы иммунной системы
- ImmunoGrid, проект по моделированию иммунной системы млекопитающих, в особенности человека. система с использованием Grid-технологий
- Иммунопротеомика
- Иммуностимулятор
- Исходный антигенный грех
- Устойчивость к болезням растений
- Поликлональный ответ
- Опухолевые антигены
- Наивные вакцины
- Иммунология слизистой оболочки
Ссылки
Внешние ссылки
- иммунной системой — из Университета Хартфорда (средняя школа / уровень бакалавриата)
- Онлайн-учебник по микробиологии и иммунологии — из Университета Южной Каролины Медицинский факультет (уровень бакалавриата))
- Иммунобиология; Пятое издание — онлайн-версия учебника Чарльза Джейнуэя (продвинутый уровень бакалавриата / магистратуры)
- Доклад Стэнли Фалькоу: «Взаимодействие хозяина-патогена и болезни человека»
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА

Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
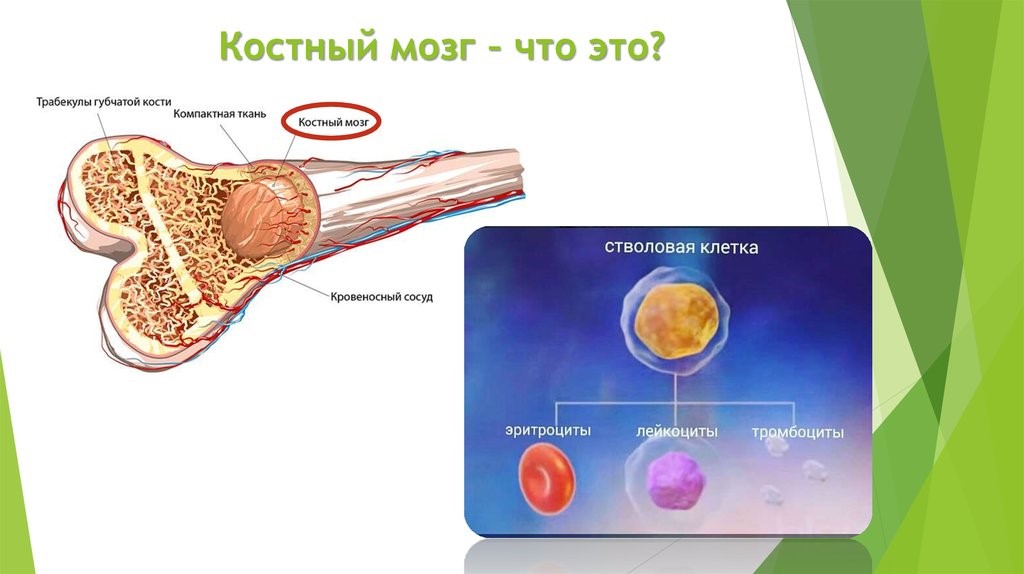
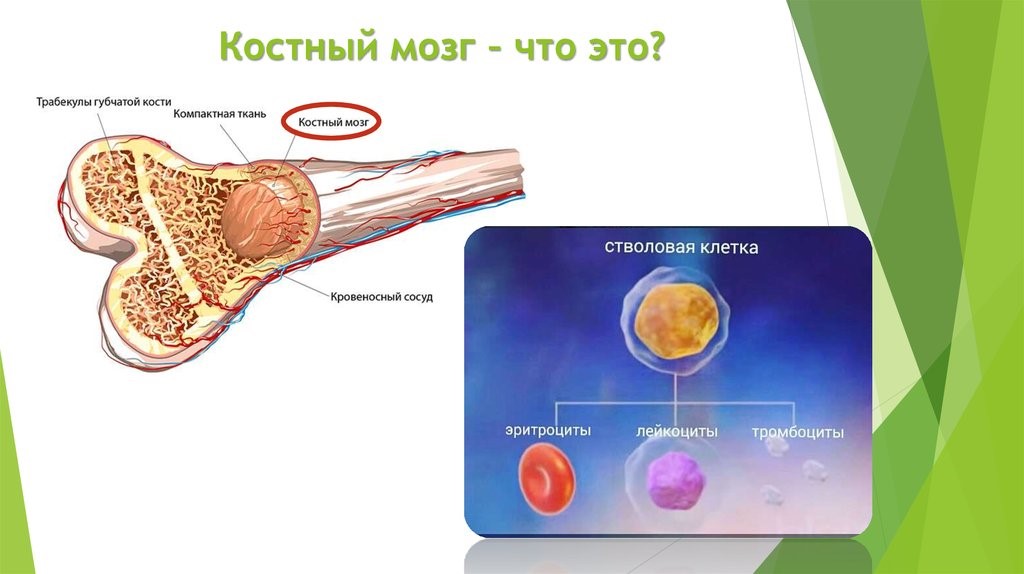
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
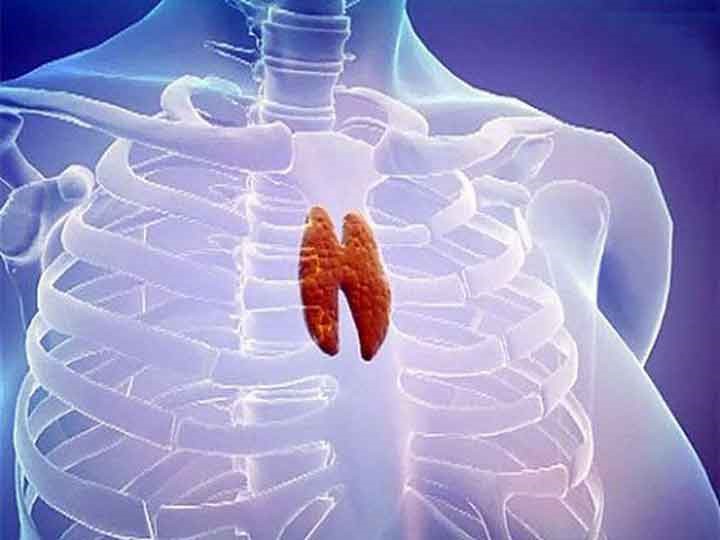
Рис.2. Тимус
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
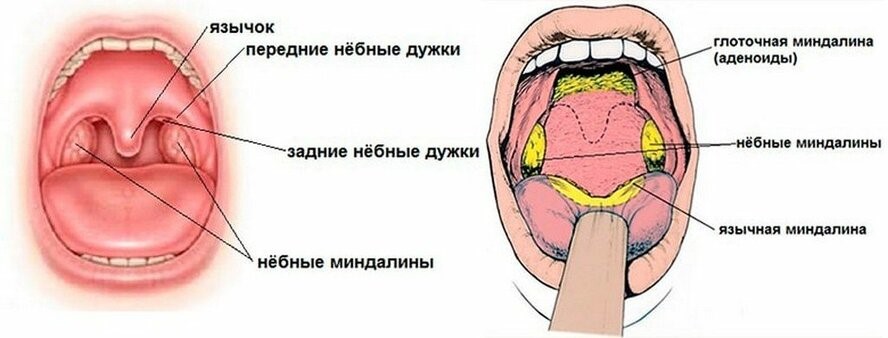
Рис. 3. Небные миндалины
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
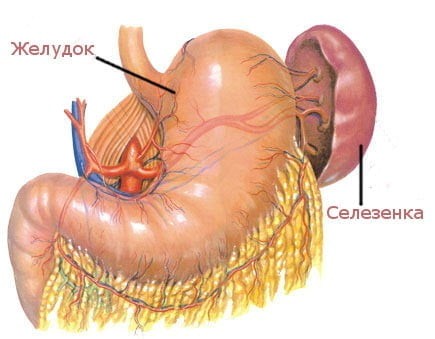
Рис. 4. Селезенка
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
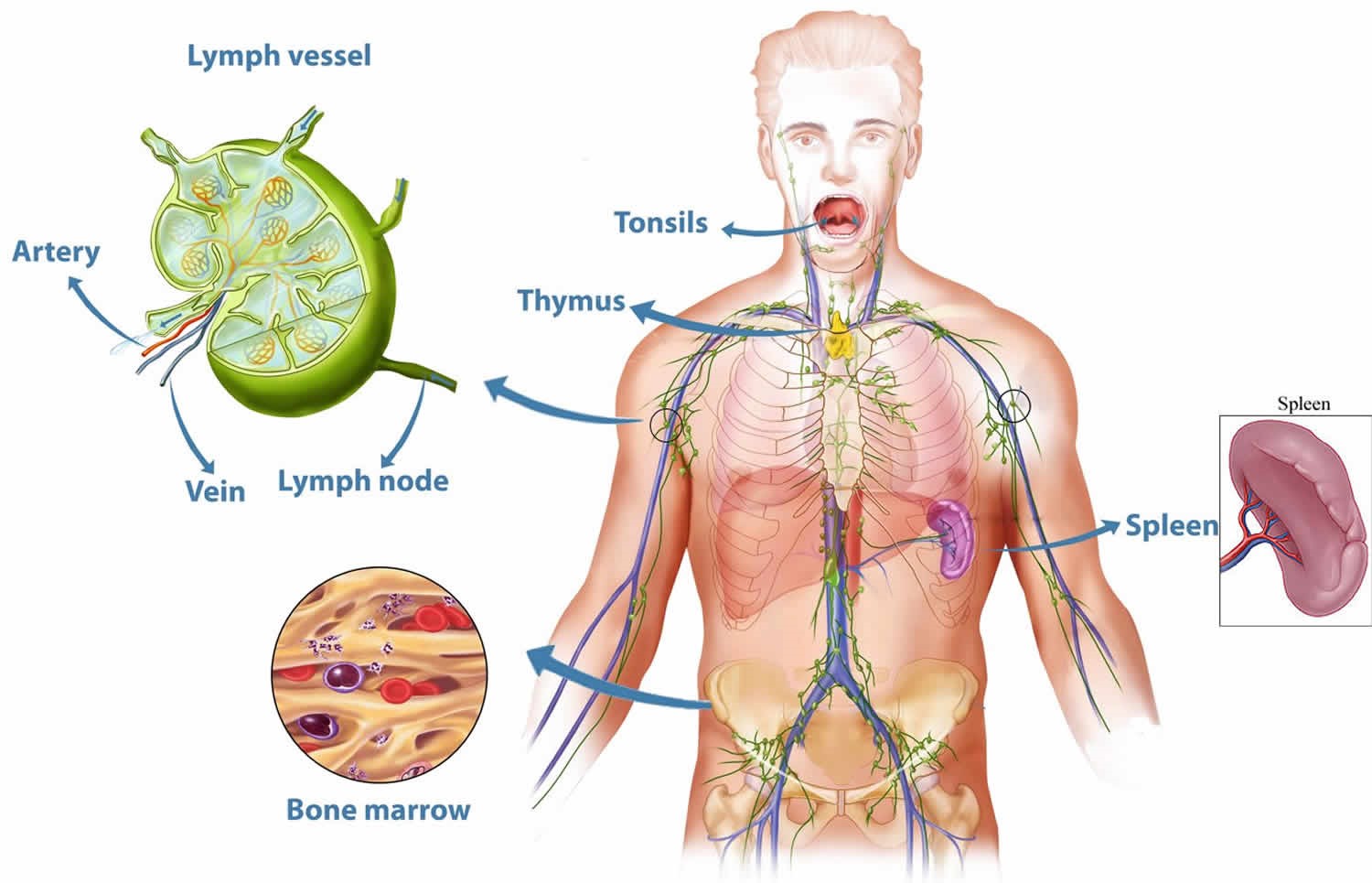
Рис. 5. Лимфоузел
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!

Врожденный иммунитет на клеточном уровне представляют:
- моноциты – предшественники макрофагов (клетки, пожирающие чужеродные частицы). Образуются в костном мозге, затем поступают в кровь, но быстро ее покидают, превращаясь в тканевые макрофаги и дендритные клетки (рис. 7);
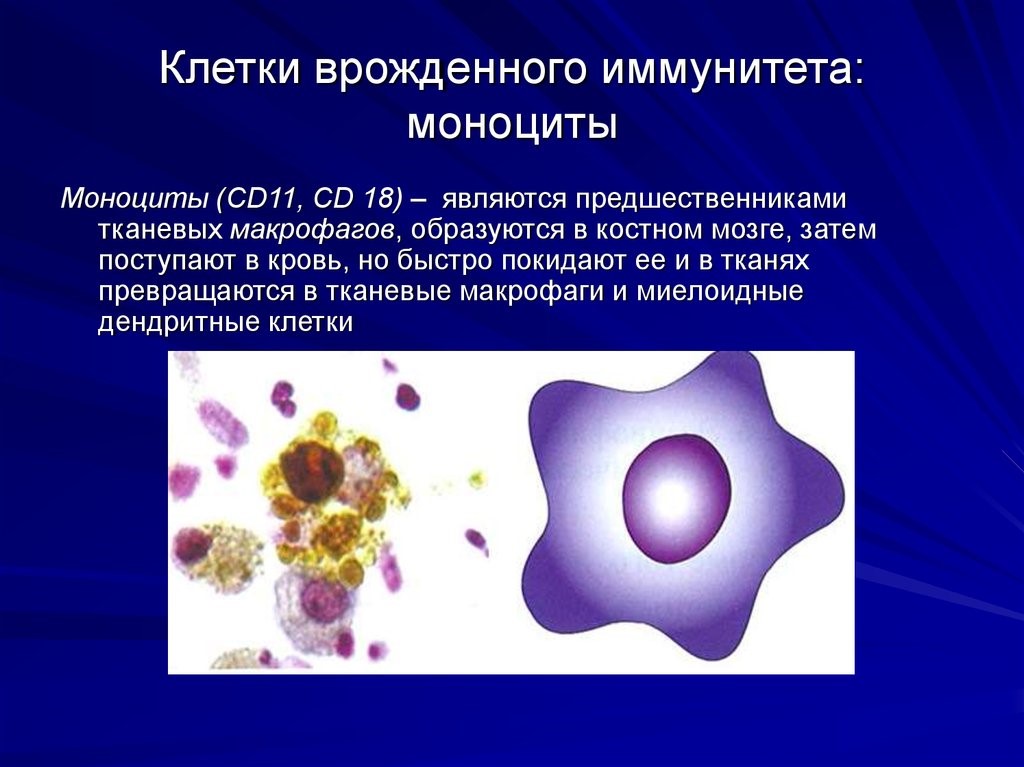
Рис.7. Моноцит
- макрофаги и дендритные клетки расположены в коже, слизистых. Обладают подвижностью, переносятся с током крови и лимфы. Они поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Дендритные клетки ветвятся подобно дереву. Благодаря ветвям-антеннам они работают связистами между врожденным и приобретенным видами иммунитета(рис.8);
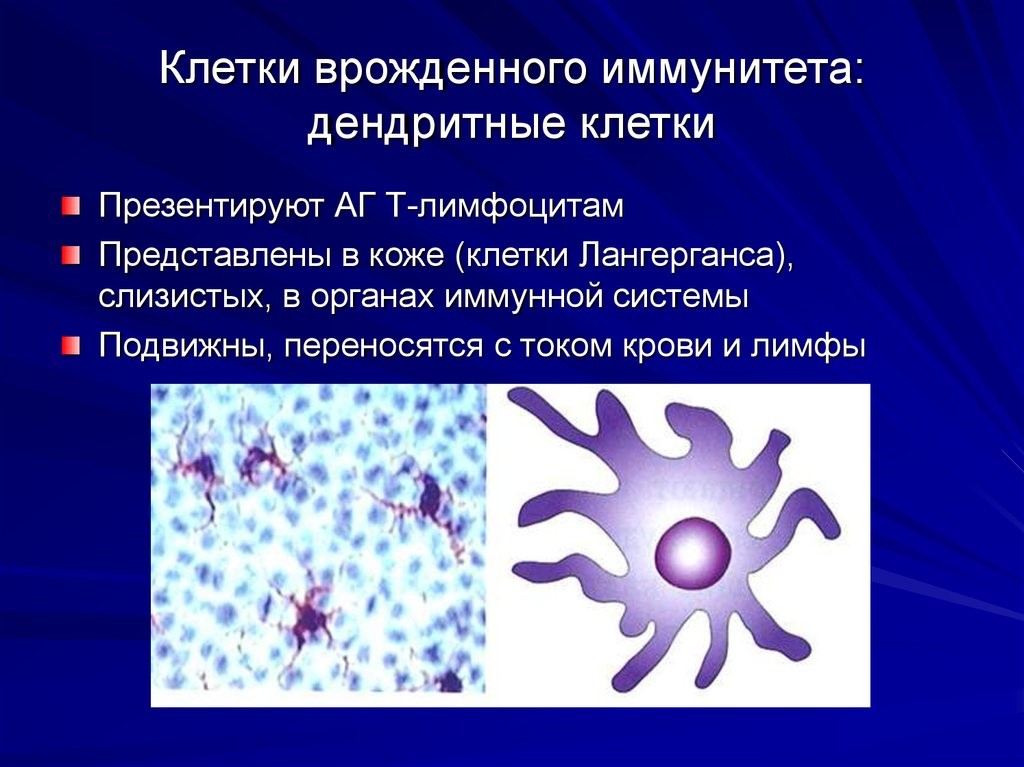
Рис.8. Дендритная клетка и
и макрофаг
- клетки крови, содержащие в цитоплазме гранулы (гранулоциты): нейтрофилы, эозинофилы и базофилы (рис.9);
Рис.9. Гранулоциты
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
- натуральные (естественные) киллеры или NK-клетки (англ. Natural killer cells, NK cells) – тип цитотоксических лимфоцитов, участвующий в функционировании врождённого иммунитета. Они на высокой скорости уничтожают клетки, инфицированные бактериями и вирусами, а также опухолевые клетки.
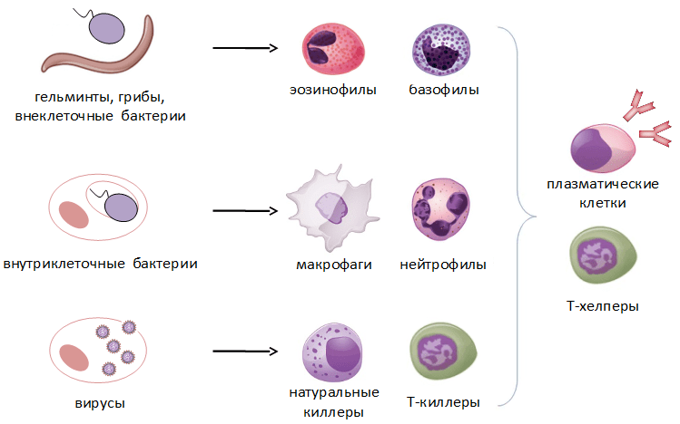
Рис.10. Натуральный киллер
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
- белки, связывающие ионы металлов (железа, цинка), необходимых для жизнедеятельности и размножения патогенов – лактоферрин, кальпротектин, мембранный белок и другие;
- ферменты, генерирующие окислители – кислород и оксид азота:
- ферменты, способные расщеплять клеточную мембрану патогенов – лизоцим, хитиназа, фосфолипаза А2;
- белки и пептиды, нарушающие целостность клеточной оболочки микроорганизма – комплемент, эозинофильный протеин, дефензины и другие.
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Рис.16. Адаптивный
иммунитет
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
Адаптивный иммунитет основывается на трех главных процессах:
- распознавание антигенов (как правило чужеродных для организма) с помощью рецепторов;
- удаление (элиминация) распознанных чужеродных агентов (рис. 17);
- формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять этот антиген при повторном его распознавании.
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.

С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
|
Обозначение кластера |
Клетки |
|
CD 10, CD34 |
Лимфоидная стволовая клетка |
|
CD3 |
Т-лимфоцит |
|
CD4 |
Т-хелпер |
|
CD8 |
Т-киллер |
|
CD19, CD72, CD79 и др. |
В-лимфоцит |
|
CD16/ CD56 |
NK-клетки |
|
CD14, CD64 |
Моноцит/макрофаг |
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
- Т-киллеры (их еще называют CD8+ Т-лимфоциты), которые подобно NK-клетке (натуральному киллеру), выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени;
- Т-хелперы (от английского helper – помощник). Они еще обозначаются как Th-клетки, CD4+ T-лимфоциты. Активированные Т-хелперы продуцируют хемокины и цитокины, участвующие в иммунном процессе (рис.19);
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
- Т-супрессоры (Ts) подавляют (супрессируют) реакции В-лимфоцитов и блокируют Т-хелперы. Притом эти клетки вовсе не устраивают саботаж иммунным процессам и не вредят здоровью. Они просто регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители (тушить пожар, а не костер);
- Т-регуляторные клетки (Tr1) влияют на образование зернистых лейкоцитов (гранулоцитов), которых мы уже представляли в качестве макрофагов.
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
|
Результат молекулярного исследования |
Тест на антитела |
Интерпретация |
|
|
IgM |
IgG |
||
|
Положительный |
Отрицательный |
Отрицательный |
Острая инфекция |
|
Положительный |
Положительный |
Отрицательный |
Острая инфекция |
|
Положительный |
Положительный |
Положительный |
Инфицированный пациент |
|
Положительный |
Отрицательный |
Положительный |
Инфицированный или повторно инфицированный пациент |
|
Отрицательный |
Положительный |
Отрицательный |
Ранние стадии инфекции. Требуется дополнительное исследование |
|
Отрицательный |
Положительный |
Положительный |
Инфекция. Требуется дополнительное исследование |
|
Отрицательный |
Отрицательный |
Положительный |
Постинфекционный период |
|
Отрицательный |
Отрицательный |
Отрицательный |
Неинфицированный пациент |
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
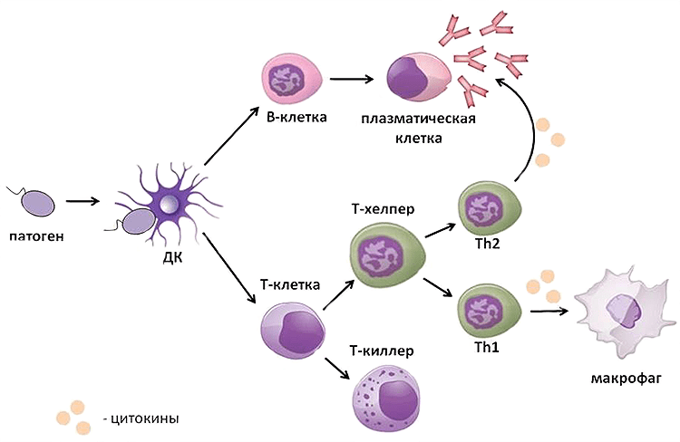
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
- симптомов, которые могут быть признаками первичных иммунодефицитов:
- 4 и более случаев отита в течение года;
- 2 и более синусита в течение года;
- низкая эффективность антибиотиков в течение двух и более месяцев приема;
- 2 и более случаев пневмонии в течение года;
- невозможность ребенка набирать вес и нормально расти;
- частые и глубокие абсцессы кожи и внутренних органов
- постоянный кандидоз полости рта и кожи;
- необходимость внутривенного введения антибиотиков для разрешения инфекции;
- две и более системных инфекции, включая сепсис;
- наследственная предрасположенность.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
- 1-я группа – преимущественно гуморальные, или В-клеточные ПИД;
- 2-я группа – комбинированные ПИД (при всех Т-клеточных иммунодефицитах есть нарушение функции В-клеток);
- 3-я группа – ПИД, обусловленные дефектами фагоцитоза;
- 4-я группа – ПИД, обусловленные дефектами в системе комплемента.
Таблица 3. Некоторые первичные иммунодефициты
|
Патология |
Симптомы |
Диагностика |
Лечение |
|
Дефекты антителообразования |
|||
|
Агаммаглобулинемия |
Частые бактериальные инфекции |
Дефицит или полное отсутствие В-лимфоцитов |
Антибиотики, пожизненное введение IgG |
|
Общая вариабельная иммунная недостаточность |
Частые респираторные инфекции, отиты |
Дефекты Т- и В- лимфоцитов |
Антибиотики, пожизненное введение IgG |
|
Комбинированные ПИД |
|||
|
Атаксия-телеангиоэкстазия (синдром Луи-Бар) |
Аномалия двигательной функции, слабость мышц, нарушение речи |
Дефицит Т- и В- лимфоцитов |
Симптоматическое |
|
ПИД, обусловленные дефектами фагоцитоза |
|||
|
Хроническая гранулёматозная болезнь |
Частые пневмонии, гнойные инфекции |
Генетический дефект |
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма |
|
ПИД, обусловленные дефектами в системе комплемента |
|||
|
Наследственный ангионевротический отек |
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни |
Низкая концентрация ингибитора эстеразы С1 |
Введение концентрата ингибитора эстеразы С1 |
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
|
Возраст, лет |
Виды поддержки |
|||
|
семьи |
врача |
психолога |
общества |
|
|
0-14 |
+++ |
+ |
+ |
+++ |
|
14-18 |
+++ |
+ |
+++ |
+++ |
|
18-65 |
+ |
++ |
+ |
+++ |
|
Старше 65 |
+ |
++ |
++ |
+++ |
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
- аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги;
- мишенями для антител могут стать рецепторы на поверхности клетки.
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
- аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
- гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток;
- гиперчувствительность II типа характеризуется присутствием антител, распознающих его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и M (IgM);
- гиперчувствительность III типа обусловлена иммунными комплексами, состоящими из антигенов, белков комплемента, IgG и IgM;
- гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2-3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги.
Эффективные методы воздействия на иммунитет:
- регулярная вакцинация по скорости и качеству реакции превышает естественный процесс формирования иммунитета на конкретную инфекцию;
- сбалансированное питание, обеспечивающее поддержание нормального обмена веществ;
- регулярные физические нагрузки, обеспечивающие физиологическое функционирование всех систем организма, поддержание оптимальных показателей массы тела;
- отказ от вредных привычек, приводящих к зависимостям (алкогольной, никотиновой, наркотической, токсической, компьютерной);
- режим дня, особенно влияние циркадных ритмов (смена дня и ночи): во время бодрствования пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины; во время сна достигает своего пика формирование Т-клеток памяти.
Спекулятивные методы вокруг иммунитета:
- прием иммуностимуляторов клинически не оправдан. Если постоянно стимулировать выработку лейкоцитов лекарственными средствами, иммунная система начнет утрачивать свои непосредственные функции. Вот тогда и наступает момент начала серьезных проблем с иммунитетом. Совершенно не влияют на иммунную систему природные адаптогены: лимонник китайский, женьшень, элеутерококк, радиола розовая. Они воздействуют, как усилители синтеза РНК и белков (основу человеческих клеток), активизируют ферменты обмена и работу эндокринной и вегетативной систем;
- прием витаминов явно переоценен. Положительное влияние на иммунную систему оказывает витамин D, который стимулирует образование Т-киллеров. Все остальные группы витаминов прямого участия в функционировании иммунной системы не принимают;
- банные процедуры и сауна на иммунную систему не влияют;
- народные средства, такие как мед и чеснок обладают легким бактерицидным, но не иммуногенным действием.
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.