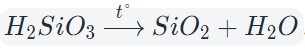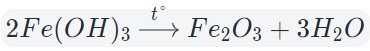.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1

формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» —
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице «растворимости…«.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.
рис.2

окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
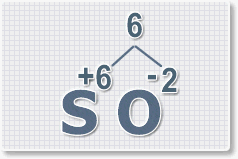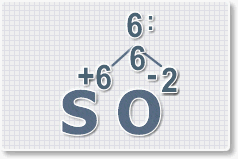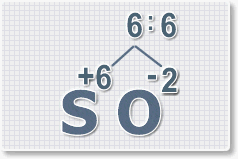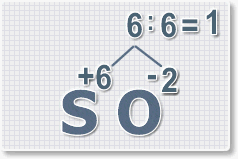
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
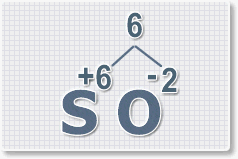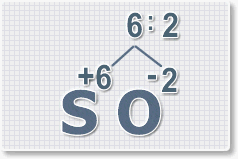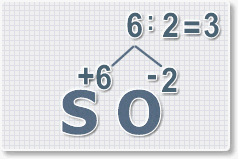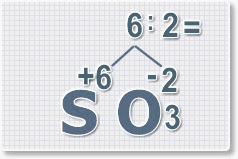
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
Рис.3
6 : 2 = 3
это индекс для кислорода
Рис.4
В результате получим
формулу оксида серы (VI):
* * *
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
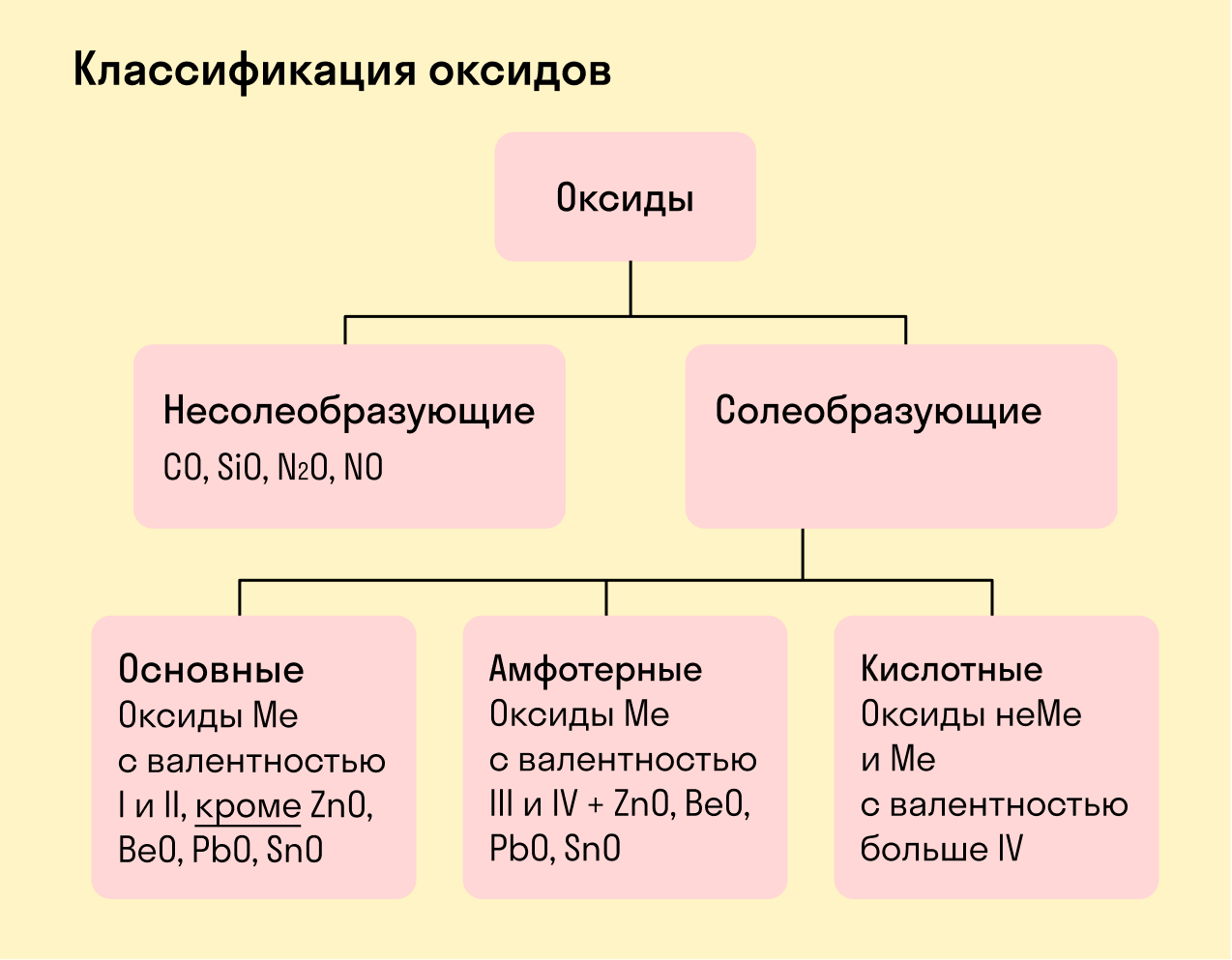
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
-
CrO (оксид хрома (II)) — проявляет основные свойства;
-
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
-
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
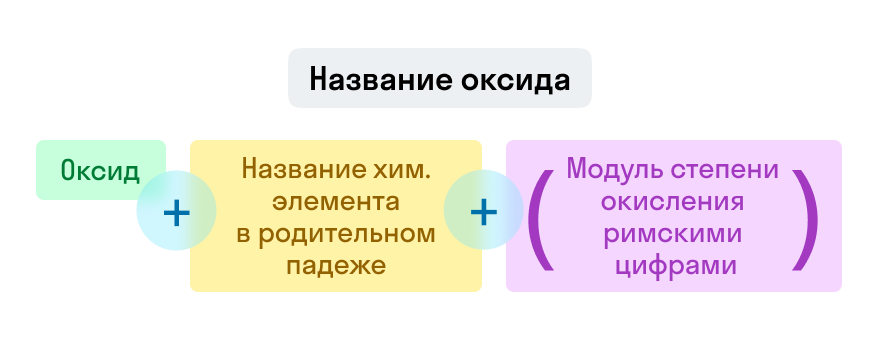
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
-
Fe2O3 — оксид железа (III). Читается: феррум два о три.
-
Na2O — оксид натрия. Читается: натрия два о.
-
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
|
Химическая формула оксида |
Бытовое (тривиальное название) |
Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
|
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
|
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
|---|
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
|
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
|
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
|
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
|
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Кислотный оксид + амфотерный оксид = соль + вода Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
|
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
|
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
|
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
|
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Как писать формулу оксидов?
0:012:48Рекомендуемый клип · 54 сек.составляем формулы оксидов — YouTubeYouTubeНачало рекомендуемого клипаКонец рекомендуемого клипа
Как составить формулу оксида натрия?
Окси́д на́трия (окись натрия) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Na2O.
Как записать формулу оксида азота?
- N2O. Основная статья: Оксид азота(I)
- NO. Основная статья: Оксид азота(II)
- N2O3 Основная статья: Оксид азота(III)
- NO2 Основные статьи: Оксид азота(IV) и Тетраоксид диазота
- N2O5(V) Основная статья: Оксид азота(V)
Как составить формулу оксида фосфора?
Пентаоксид фосфора, также оксид фосфора(V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулой P4O10….Оксид фосфора(V)
| Оксид фосфора(V) | |
|---|---|
| Хим. формула | P2O5 |
| Рац. формула | P2O5 |
| Физические свойства | |
| Состояние | белый порошок |
Какая формула кислотных оксидов?
Основные свойства кислотных оксидов
| Название кислотного оксида | Формула кислотного оксида |
|---|---|
| Оксид углерода (IV) | CO2 |
| Оксид кремния (IV) | SiO2 |
| Оксид фосфора (V) | P2 O5 |
| Оксид азота (V) | N2 O5 |
Как правильно составить формулы солей?
Учимся называть правильно
| Формула кислоты | Название кислоты | Кислотный остаток (формула) |
|---|---|---|
| HBr | бромоводородная | Br — |
| H 2 SO 3 | сернистая | SO 3 2- |
| H 2 SO 4 | серная | SO 4 2- |
| HClO | хлорноватистая | ClO — |
•4 дек. 2021 г.
Как составить формулу оксида железа?
Оксиды железа
- FeO — оксид железа(II) (минерал вюстит);
- Fe2O3 — оксид железа(III) (минералы гематит и маггемит в альфа- и гамма-модификациях, соответственно);
- Fe3O4 — оксид железа(II,III), сложный оксид, одновременно содержащий ионы железа(II) и железа(III) (минерал магнетит).
Какая формула у оксида?
Оксиды – сложные вещества, состоящие из атомов двух химических элементов, одним из которых является кислород в степени окисления -2. Общая формула оксидов: ЭхОу, где Э – атомы химического элемента; О – атомы кислорода; х, у – индексы, указывающие число атомов элементов, образующих оксид.
Как пишется оксид азота 2?
Оксид азота(II)
| Оксид азота(II) | |
|---|---|
| Хим. формула | NO |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 30,0061 г/моль |
Как выглядит формула оксида фосфора?
Оксид фосфора(III) — бинарное неорганическое соединение, оксид фосфора с формулой P2O3, белые хлопья или кристаллы с неприятным запахом, реагирует с водой, ядовит.
Как образуется оксид фосфора 5?
Оксид фосфора(V) P 2 O 5 образуется при сгорании фосфора: 4P 0 + 5O 2 0 = t 2 P 2 + 5 O 5 − 2 . P 2 O 5 — белое кристаллическое вещество с молекулярным строением. Оксид фосфора(V) очень гигроскопичен.
Как образуются оксиды?
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: +1 или +2. Примеры основных оксидов: оксид натрия Na 2 O , оксид меди(II) CuO .
Как образовывать соли?
- Основные соли образуются при взаимодействии щелочей с растворимыми в воде солями. …
- Основные соли образуются при взаимодействии избытка основания с кислотой. …
- Гидроксокарбонат меди(II), свинца(II), цинка и некоторых других металлов образуется при взаимодействии растворов солей этих металлов с растворами карбонатов.
Как составлять названия солей?
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 8-6.
Как получается оксид железа?
Получают косвенным путём при восстановлении Fe 2О 3 или при разложении оксалата FeC 2O 4·2Н 2О в атмосфере азота. ); γ-Fe 2О 3 (минерал оксимагнетит) получают окислением железа или Fe 3О 4 при темп-ре ниже 200 °С; δ-Fe 2О 3 образуется при окислении солей железа(II) в щелочной среде.
Как пишется оксид?
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия.
Как определить оксид или нет?
Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка. Ответ: MgO – основный оксид. Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
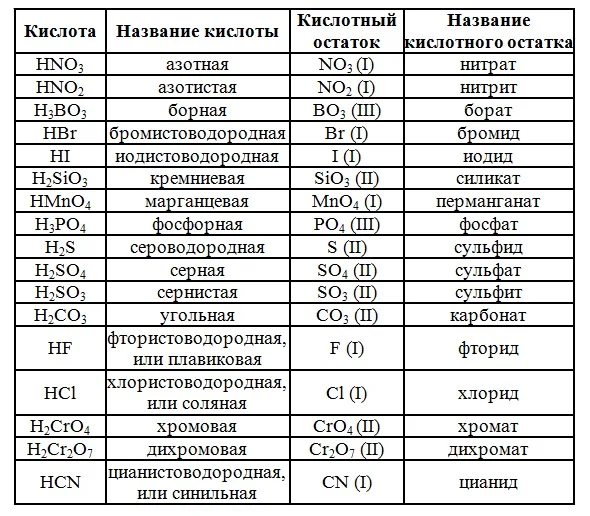
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы — ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
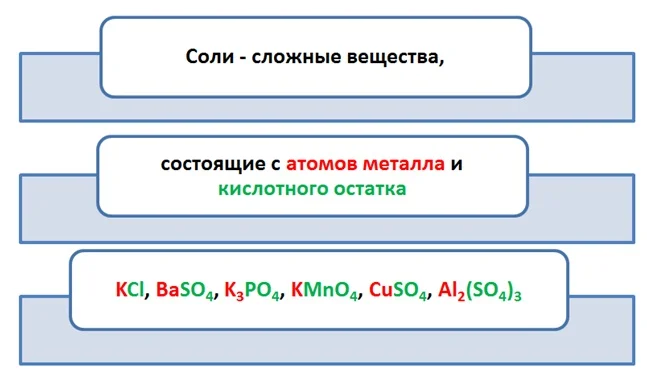
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
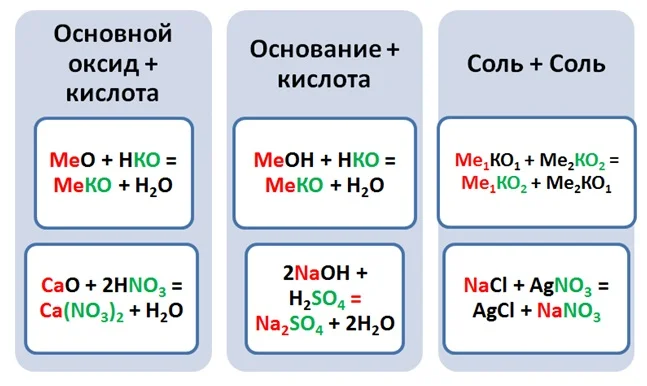
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Источник
Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
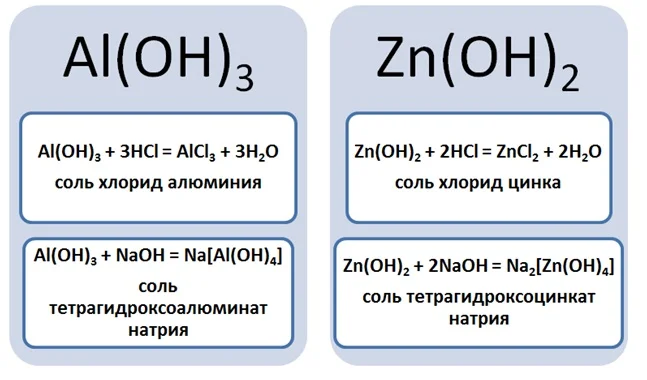
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
Как составить формулы оксидов
Оксиды – это сложные химические вещества, которые состоят из двух элементов. Одним из них является кислород. Оксиды в большинстве случаев бывают кислотными и основными. Как легко понять из названия, кислотные оксиды реагируют с основаниями, образуя соль, то есть, проявляя свойства кислоты. Как составлять формулы оксидов?

Инструкция
Многие из оксидов способны реагировать с водой, образуя кислоту. Например:
SO3 + H2O = H2SO4 (образуется серная кислота).
SiO2 + 2KOH = K2SiO3 + H2O (нерастворимый в воде оксид кремния вступает в реакцию с гидроксидом калия.
Основные оксиды, напротив, вступают в реакции с кислотами, также образуя соль и воду. Те же из них, которые растворимы в воде, реагируют с ней, образуя основание. Характерные примеры:
ZnO + 2HCl = ZnCl2 + H2O (нерастворимый в воде оксид цинка реагирует с соляной кислотой).
Na2O + H2O = 2NaOH
Следует запомнить, что валентность кислорода в оксиде всегда равняется 2. Исходя из этого, при составлении формулы надо лишь знать валентность второго элемента. Например: щелочные металлы первой группы – одновалентные. Поэтому общая формула оксидов будет выглядеть так: Эл2О. Т.е., Li2O, Na2O, K2O, Rb2O. (Эл – «Элемент»).
Щелочноземельные металлы второй группы – двухвалентные. Общая формула оксидов – ЭлО. И выглядеть она будет: ВеО, MgO, СаО, SrO.
Амфотерные элементы третьей группы, соответственно, трехвалентные. Общая формула оксидов – Эл2О3. Характерный пример – уже упоминавшийся оксид алюминия Al2O3.
Элементы четвертой группы проявляют или больше кислотных свойств (углерод, кремний), или больше основных (германий, олово, свинец). В любом случае, общая формула – ЭлО2 (СО2, SiO2).
Общая формула пятой группы – Эл2О5. Пример – высший оксид азота, N2O5, из которого получают азотную кислоту. Или высший оксид ванадия, V2О5 (хотя ванадий – металл, его высший оксид проявляет кислотные свойства).
Соответственно, формула шестой группы, где находится сам кислород – ЭлО3. Высшие оксиды – SO3, СrO3, WO3. Обратите внимание, что хоть хром и вольфрам – металлы, их высшие оксиды по аналогии с оксидом ванадия также проявляют кислотные свойства.
Следует уточнить, что указывались лишь высшие оксиды элементов. Так, например, помимо оксида хрома CrО3, где хром шестивалентен, есть оксид Cr2O3, где этот элемент имеет валентность, равную 3. Помимо оксида азота N2O5, существуют оксиды N2O, NO, NO2. Подобных примеров очень много. Поэтому, при написании формулы оксида, проверяйте, какую валентность имеет в этом соединении элемент, соединенный с кислородом!
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.