Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Ацетилсалициловая кислота
- Химическое название
- Брутто формула
- Фармакологическая группа вещества Ацетилсалициловая кислота
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Ацетилсалициловая кислота
- Противопоказания
- Ограничения к применению
- Применение при беременности и кормлении грудью
- Побочные действия вещества Ацетилсалициловая кислота
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Ацетилсалициловая кислота
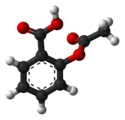
Структурная формула
Русское название
Ацетилсалициловая кислота
Английское название
Acetylsalicylic acid
Латинское название вещества Ацетилсалициловая кислота
Acidum acetylsalicylicum (род. Acidi acetylsalicylici)
Химическое название
2-(Ацетилокси)бензойная кислота
Фармакологическая группа вещества Ацетилсалициловая кислота
Нозологическая классификация
Список кодов МКБ-10
- I49.8 Другие уточненные нарушения сердечного ритма
- I34.0 Митральная (клапанная) недостаточность
- M79.2 Невралгия и неврит неуточненные
- G54.3 Поражения грудных корешков, не классифицированные в других рубриках
- I34.1 Пролапс [пролабирование] митрального клапана
- I80 Флебит и тромбофлебит
- M54.4 Люмбаго с ишиасом
- N94.6 Дисменорея неуточненная
- I74.9 Эмболия и тромбоз неуточненных артерий
- I24.1 Синдром Дресслера
- R51 Головная боль
- I25 Хроническая ишемическая болезнь сердца
- I20.0 Нестабильная стенокардия
- I77.6 Артериит неуточненный
- I25.8 Другие формы хронической ишемической болезни сердца
- R50 Лихорадка неясного происхождения
- G43 Мигрень
- K08.8.0* Боль зубная
- I21.9 Острый инфаркт миокарда неуточненный
- M79.1 Миалгия
- I63 Инфаркт мозга
- I25.5 Ишемическая кардиомиопатия
- Z100* КЛАСС XXII Хирургическая практика
- I26.9 Легочная эмболия без упоминания об остром легочном сердце
- M25.5 Боль в суставе
Фармакологическое действие
—
анальгезирующее, антиагрегационное, жаропонижающее, противовоспалительное.
Характеристика
Белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха или со слабым запахом, слабокислого вкуса. Мало растворим в воде при комнатной температуре, растворим в горячей воде, легко растворим в этаноле, растворах едких и углекислых щелочей.
Фармакология
Ингибирует циклооксигеназу (ЦОГ-1 и ЦОГ-2) и необратимо тормозит циклооксигеназный путь метаболизма арахидоновой кислоты, блокирует синтез ПГ (ПГA2, ПГD2, ПГF2aльфа, ПГE1, ПГE2 и др.) и тромбоксана. Уменьшает гиперемию, экссудацию, проницаемость капилляров, активность гиалуронидазы, ограничивает энергетическое обеспечение воспалительного процесса путем угнетения продукции АТФ. Влияет на подкорковые центры терморегуляции и болевой чувствительности. Снижение содержания ПГ (преимущественно ПГЕ1 ) в центре терморегуляции приводит к понижению температуры тела вследствие расширения сосудов кожи и увеличения потоотделения. Обезболивающий эффект обусловлен влиянием на центры болевой чувствительности, а также периферическим противовоспалительным действием и способностью салицилатов снижать альгогенное действие брадикинина. Уменьшение содержания тромбоксана А2 в тромбоцитах приводит к необратимому подавлению агрегации, несколько расширяет сосуды. Антиагрегантное действие сохраняется в течение 7 суток после однократного приема. В ходе ряда клинических исследований показано, что существенное ингибирование склеиваемости кровяных пластинок достигается при дозах до 30 мг. Увеличивает фибринолитическую активность плазмы и снижает концентрацию витамин K-зависимых факторов свертывания (II, VII, IX, X). Стимулирует выведение мочевой кислоты, поскольку нарушается ее реабсорбция в канальцах почек.
После приема внутрь достаточно полно всасывается. При наличии кишечнорастворимой оболочки (устойчива к действию желудочного сока и не допускает всасывания ацетилсалициловой кислоты в желудке) абсорбируется в верхнем отделе тонкого кишечника. Во время абсорбции подвергается пресистемной элиминации в стенке кишечника и в печени (деацетилируется). Абсорбированная часть очень быстро гидролизуется специальными эстеразами, поэтому T1/2 ацетилсалициловой кислоты составляет не более 15–20 мин. В организме циркулирует (на 75–90% в связи с альбумином) и распределяется в тканях в виде аниона салициловой кислоты. Cmax достигается примерно через 2 ч. C белками плазмы крови ацетилсалициловая кислота практически не связывается. При биотрансформации в печени образуются метаболиты, обнаруживаемые во многих тканях и моче. Экскреция салицилатов осуществляется преимущественно путем активной секреции в канальцах почек в неизмененной форме и в виде метаболитов. Выведение неизмененного вещества и метаболитов зависят от pH мочи (при подщелачивании мочи возрастает ионизирование салицилатов, ухудшается их реабсорбция и значительно увеличивается экскреция).
Применение вещества Ацетилсалициловая кислота
ИБС, наличие нескольких факторов риска ИБС, безболевая ишемия миокарда, нестабильная стенокардия, инфаркт миокарда (для снижения риска повторного инфаркта миокарда и смерти после инфаркта миокарда), повторная преходящая ишемия мозга и ишемический инсульт у мужчин, протезирование клапанов сердца (профилактика и лечение тромбоэмболий), баллонная коронарная ангиопластика и установка стента (снижение риска повторного стеноза и лечение вторичного расслоения коронарной артерии), а также при неатеросклеротических поражениях коронарных артерий (болезнь Кавасаки), аортоартериит (болезнь Такаясу), клапанные митральные пороки сердца и мерцательная аритмия, пролапс митрального клапана (профилактика тромбоэмболии), рецидивирующие тромбоэмболии легочной артерии, синдром Дресслера, инфаркт легкого, острый тромбофлебит. Лихорадка при инфекционно-воспалительных заболеваниях. Болевой синдром слабой и средней интенсивности различного генеза, в т.ч. грудной корешковый синдром, люмбаго, мигрень, головная боль, невралгия, зубная боль, миалгия, артралгия, альгодисменорея. В клинической иммунологии и аллергологии используется в постепенно нарастающих дозах для продолжительной «аспириновой» десенситизации и формирования стойкой толерантности к НПВС у больных с «аспириновой» астмой и «аспириновой» триадой.
По показаниям ревматизм, ревматическая хорея, ревматоидный артрит, инфекционно-аллергический миокардит, перикардит — в настоящее время применяется очень редко.
Противопоказания
Гиперчувствительность, в т.ч. «аспириновая» триада, «аспириновая» астма; геморрагический диатез (гемофилия, болезнь Виллебранда, телеангиоэктазия), расслаивающая аневризма аорты, сердечная недостаточность, острые и рецидивирующие эрозивно-язвенные заболевания ЖКТ, желудочно-кишечное кровотечение, острая почечная или печеночная недостаточность, исходная гипопротромбинемия, дефицит витамина К, тромбоцитопения, тромботическая тромбоцитопеническая пурпура, дефицит глюкозо-6-фосфатдегидрогеназы, беременность (I и III триместр), грудное вскармливание, детский и подростковый возраст до 15 лет при применении в качестве жаропонижающего средства (риск развития синдрома Рейе у детей с лихорадкой на фоне вирусных заболеваний).
Ограничения к применению
Гиперурикемия, нефролитиаз, подагра, язвенная болезнь желудка и двенадцатиперстной кишки (в анамнезе), тяжелые нарушения функции печени и почек, бронхиальная астма, ХОБЛ, полипоз носа, неконтролируемая артериальная гипертензия.
Применение при беременности и кормлении грудью
Применение больших доз салицилатов в I триместре беременности ассоциируется с повышенной частотой дефектов развития плода (расщепление неба, пороки сердца). Во II триместре беременности салицилаты можно назначать только с учетом оценки риска и пользы. Назначение салицилатов в III триместре беременности противопоказано.
Салицилаты и их метаболиты в небольших количествах проникают в грудное молоко. Случайный прием салицилатов в период лактации не сопровождается развитием побочных реакций у ребенка и не требует прекращения грудного вскармливания. Однако при длительном применении или назначении в высоких дозах кормление грудью следует прекратить.
Побочные действия вещества Ацетилсалициловая кислота
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): тромбоцитопения, анемия, лейкопения.
Со стороны органов ЖКТ: НПВС-гастропатия (диспепсия, боль в эпигастральной области, изжога, тошнота и рвота, тяжелые кровотечения в ЖКТ), снижение аппетита.
Аллергические реакции: реакции гиперчувствительности (бронхоспазм, отек гортани и крапивница), формирование на основе гаптенового механизма «аспириновой» бронхиальной астмы и «аспириновой» триады (эозинофильный ринит, рецидивирующий полипоз носа, гиперпластический синусит).
Прочие: нарушение функции печени и/или почек, синдром Рейе у детей (энцефалопатия и острая жировая дистрофия печени с быстрым развитием печеночной недостаточности).
При длительном применении — головокружение, головная боль, шум в ушах, снижение остроты слуха, нарушение зрения, интерстициальный нефрит, преренальная азотемия с повышением уровня креатинина крови и гиперкальциемией, папиллярный некроз, острая почечная недостаточность, нефротический синдром, заболевания крови, асептический менингит, усиление симптомов застойной сердечной недостаточности, отеки, повышение уровня аминотрансфераз в крови.
Взаимодействие
Усиливает токсичность метотрексата, снижая его почечный клиренс, эффекты наркотических анальгетиков (кодеин), пероральных противодиабетических препаратов, гепарина, непрямых антикоагулянтов, тромболитиков и ингибиторов агрегации тромбоцитов, снижает эффект урикозурических ЛС (бензбромарон, сульфинпиразон), гипотензивных средств, диуретиков (спиронолактон, фуросемид). Парацетамол, кофеин повышают риск развития побочных явлений. Глюкокортикоиды, этанол и этанолсодержащие ЛС усиливают негативное воздействие на слизистую оболочку ЖКТ и увеличивают клиренс. Повышает концентрацию дигоксина, барбитуратов, солей лития в плазме. Антациды, содержащие магний и/или алюминий, замедляют и ухудшают всасывание ацетилсалициловой кислоты. Миелотоксические ЛС усиливают проявления гематотоксичности ацетилсалициловой кислоты.
Передозировка
Может возникать после однократного приема большой дозы или при длительном употреблении. Если однократная доза меньше 150 мг/кг, острое отравление считают легким, 150–300 мг/кг — умеренным, при употреблении более высоких доз — тяжелым.
Симптомы: синдром салицилизма (тошнота, рвота, шум в ушах, нарушение зрения, головокружение, сильная головная боль, общее недомогание, лихорадка — плохой прогностический признак у взрослых). Более тяжелое отравление — ступор, судороги и кома, некардиогенный отек легких, резкая дегидратация, нарушения КЩС (вначале — респираторный алкалоз, затем — метаболический ацидоз), почечная недостаточность и шок.
При хронической передозировке концентрация, определяемая в плазме, плохо коррелирует со степенью тяжести интоксикации. Наибольший риск развития хронической интоксикации отмечается у людей пожилого возраста при приеме в течение нескольких суток более 100 мг/кг/сут. У детей и пациентов пожилого возраста начальные признаки салицилизма не всегда заметны, поэтому целесообразно периодически определять концентрацию салицилатов в крови. Уровень выше 70 мг% свидетельствует об умеренном или тяжелом отравлении; выше 100 мг% — о крайне тяжелом, прогностически неблагоприятном. При отравлении средней тяжести необходима госпитализация по крайней мере на 24 ч.
Лечение: провокация рвоты, назначение активированного угля и слабительных, мониторирование КЩС и электролитного баланса; в зависимости от состояния обмена веществ — введение натрия гидрокарбоната, раствора натрия цитрата или натрия лактата. Повышение резервной щелочности усиливает выведение ацетилсалициловой кислоты за счет ощелачивания мочи. Ощелачивание мочи показано при уровне салицилатов выше 40 мг%, обеспечивается в/в инфузией гидрокарбоната натрия — 88 мэкв в 1 л 5% раствора глюкозы, со скоростью 10–15 мл/кг/ч. Восстановление ОЦК и индукция диуреза (достигается введением гидрокарбоната в той же дозе и разведении, повторяют 2–3 раза); следует иметь в виду, что интенсивная инфузия жидкости пожилым больным может привести к отеку легких. Не рекомендуется применение ацетазоламида для ощелачивания мочи (может вызывать ацидемию и усиливать токсическое действие салицилатов). Гемодиализ показан при уровне салицилатов более 100–130 мг%, а у больных с хроническим отравлением — 40 мг% и ниже при наличии показаний (рефрактерный ацидоз, прогрессирующее ухудшение состояния, тяжелое поражение ЦНС, отек легких и почечная недостаточность). При отеке легких — ИВЛ смесью, обогащенной кислородом, в режиме положительного давления в конце выдоха; для лечения отека мозга применяют гипервентиляцию и осмотический диурез.
Способ применения и дозы
Внутрь, режим дозирования зависит от показаний к применению. Обычные дозы для взрослых при использовании в качестве жаропонижающего и анальгезирующего средства — 500–1000 мг/сут (до 3 г), разделенных на 3 приема.
При инфаркте миокарда, а также для вторичной профилактики у больных, перенесших инфаркт миокарда — 40–325 мг 1 раз в сутки (чаще 160 мг). В качестве ингибитора агрегации тромбоцитов — в дозе 300–325 мг/сут, длительно. При динамических нарушениях кровообращения у мужчин, церебральных тромбоэмболиях, в т.ч. для профилактики рецидивов — 325 мг/сут с постепенным увеличением максимально до 1 г/сут. Для профилактики тромбоза или окклюзии аортального шунта — по 325 мг каждые 7 ч через интраназально установленный желудочный зонд, затем — через рот по 325 мг 3 раза в сутки (обычно в сочетании с дипиридамолом, который отменяют через 1 нед, продолжая длительное лечение ацетилсалициловой кислотой).
Меры предосторожности
Нежелательно совместное применение с другими НПВС и глюкокортикоидами. За 5–7 суток до хирургического вмешательства необходимо отменить прием (для уменьшения кровоточивости в ходе операции и в послеоперационном периоде).
Вероятность развития НПВС-гастропатии снижается при назначении после еды, использовании таблеток с буферными добавками или покрытых специальной кишечнорастворимой оболочкой. Риск геморрагических осложнений считается наименьшим при применении в дозах <100 мг/сут.
Следует учитывать, что у предрасположенных пациентов ацетилсалициловая кислота (даже в небольших дозах) уменьшает выведение мочевой кислоты из организма и может стать причиной развития острого приступа подагры.
Во время длительной терапии рекомендуется регулярно производить анализ крови и исследовать кал на скрытую кровь. В связи с наблюдавшимися случаями гепатогенной энцефалопатии не рекомендуется для купирования лихорадочного синдрома у детей.
Торговые названия с действующим веществом Ацетилсалициловая кислота
| Торговое название | Цена за упаковку, руб. |
|---|---|
| АСК-кардио |
от 54.00 до 166.00 |
| Аспикор® |
от 39.90 до 163.00 |
| Аспирин® |
393.00 |
| Аспирин® Кардио |
от 78.00 до 318.00 |
| Аспирин® Экспресс |
от 325.00 до 334.00 |
| Ацекардол® |
от 23.00 до 28.00 |
| Ацетилсалициловая кислота |
от 7.00 до 29.00 |
| Ацетилсалициловая кислота Кардио |
от 52.00 до 91.00 |
| Ацетилсалициловая кислота Медисорб |
от 16.00 до 38.00 |
| Ацетилсалициловая кислота Реневал |
137.00 |
| Ацетилсалициловая кислота-УБФ |
от 15.00 до 15.00 |
| КардиАСК® |
от 44.00 до 117.00 |
| САНОВАСК® |
от 77.00 до 84.00 |
| Тромбопол® |
от 40.80 до 44.00 |
| Тромбостен |
от 148.00 до 148.00 |
| Упсарин УПСА® |
от 195.00 до 266.00 |
Ацетилсалициловая кислота
Ацетилсалициловая кислота (Acetylsalicylic acid)
💊 Состав препарата Ацетилсалициловая кислота
✅ Применение препарата Ацетилсалициловая кислота
Описание активных компонентов препарата
Ацетилсалициловая кислота
(Acetylsalicylic acid)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2021.06.11
Владелец регистрационного удостоверения:
Код ATX:
N02BA01
(Ацетилсалициловая кислота)
Лекарственная форма
| Ацетилсалициловая кислота |
Таб. 500 мг: 10, 20, 30 или 40 шт. рег. №: ЛС-001533 |
Форма выпуска, упаковка и состав
препарата Ацетилсалициловая кислота
10 шт. — упаковки ячейковые контурные.
10 шт. — упаковки безъячейковые контурные.
10 шт. — упаковки ячейковые контурные (1) — пачки картонные.
20 шт. — упаковки ячейковые контурные (1) — пачки картонные.
30 шт. — упаковки ячейковые контурные (1) — пачки картонные.
40 шт. — банки полимерные (1) — пачки картонные.
Клинико-фармакологическая группа:
НПВС
Фармако-терапевтическая группа:
НПВП
Фармакологическое действие
НПВС. Оказывает противовоспалительное, анальгезирующее и жаропонижающее действие, а также угнетает агрегацию тромбоцитов. Механизм действия связан с угнетением активности ЦОГ — основного фермента метаболизма арахидоновой кислоты, являющейся предшественником простагландинов, которые играют главную роль в патогенезе воспаления, боли и лихорадки. Снижение содержания простагландинов (преимущественно Е1) в центре терморегуляции приводит к снижению температуры тела вследствие расширения сосудов кожи и возрастания потоотделения. Анальгезирующий эффект обусловлен как центральным, так и периферическим действием. Уменьшает агрегацию, адгезию тромбоцитов и тромбообразование за счет подавления синтеза тромбоксана А2 в тромбоцитах.
В суточной дозе 6 г и более подавляет синтез протромбина в печени и увеличивает протромбиновое время. Повышает фибринолитическую активность плазмы и снижает концентрацию витамин K-зависимых факторов свертывания (II, VII, IX, X). Учащает геморрагические осложнения при проведении хирургических вмешательств, увеличивает риск развития кровотечения на фоне терапии антикоагулянтами. В высоких дозах стимулирует выведение мочевой кислоты (нарушает ее реабсорбцию в почечных канальцах). Блокада ЦОГ-1 в слизистой оболочке желудка приводит к торможению гастропротекторных простагландинов, что может вызвать эрозивно-язвенное поражение слизистой оболочки и последующее кровотечение.
Фармакокинетика
При приеме внутрь быстро абсорбируется преимущественно из проксимального отдела тонкой кишки и в меньшей степени из желудка. Присутствие пищи в желудке значительно изменяет всасывание ацетилсалициловой кислоты.
Метаболизируется в печени путем гидролиза с образованием салициловой кислоты с последующей конъюгацией с глицином или глюкуронидом. Концентрация салицилатов в плазме крови вариабельна.
Около 80% салициловой кислоты связывается с белками плазмы крови. Салицилаты легко проникают во многие ткани и жидкости организма, в т.ч. в спинномозговую, перитонеальную и синовиальную жидкости. В небольших количествах салицилаты обнаруживаются в мозговой ткани, следы — в желчи, поте, кале. Быстро проникает через плацентарный барьер, в небольших количествах выделяется с грудным молоком.
У новорожденных салицилаты могут вытеснять билирубин из связи с альбумином и способствовать развитию билирубиновой энцефалопатии.
Проникновение в полость сустава ускоряется при наличии гиперемии и отека и замедляется в пролиферативной фазе воспаления.
При возникновении ацидоза большая часть салицилата превращается в неионизированную кислоту, хорошо проникающую в ткани, в т.ч. в мозг.
Выводится преимущественно путем активной секреции в канальцах почек в неизмененном виде (60%) и в виде метаболитов. Выведение неизмененного салицилата зависит от pH мочи (при подщелачивании мочи возрастает ионизирование салицилатов, ухудшается их реабсорбция и значительно увеличивается выведение). T1/2 ацетилсалициловой кислоты составляет приблизительно 15 мин. T1/2 салицилата при приеме в невысоких дозах составляет 2-3 ч, с увеличением дозы может возрастать до 15-30 ч.
Показания активных веществ препарата
Ацетилсалициловая кислота
Лихорадка при инфекционно-воспалительных заболеваниях; болевой синдром слабой и средней интенсивности различного генеза (в т.ч. невралгия, миалгия, головная боль), альгодисменорея.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Индивидуальный. Разовая доза — от 250 мг до 1 г, суточная — от 250 мг до 3 г; кратность применения — 2-6 раз/сут.
Побочное действие
Со стороны пищеварительной системы: тошнота, рвота, анорексия, боли в эпигастрии, диарея; редко — возникновение эрозивно-язвенных поражений, кровотечений из ЖКТ, нарушение функции печени.
Со стороны нервной системы: при длительном применении возможны головокружение, головная боль, обратимые нарушения зрения, шум в ушах, асептический менингит.
Со стороны системы кроветворения: редко — тромбоцитопения, анемия.
Со стороны системы свертывания крови: редко — геморрагический синдром, удлинение времени кровотечения.
Со стороны мочевыделительной системы: редко — нарушение функции почек; при длительном применении — острая почечная недостаточность, нефротический синдром.
Аллергические реакции: редко — кожная сыпь, отек Квинке, бронхоспазм, «аспириновая триада» (сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты и лекарственных средств пиразолонового ряда).
Прочие: в отдельных случаях — синдром Рейе; при длительном применении — усиление симптомов хронической сердечной недостаточности.
Противопоказания к применению
Эрозивно-язвенные поражения ЖКТ в фазе обострения, желудочно-кишечное кровотечение, воспалительные заболевания кишечника в фазе обострения (язвенный колит, болезнь Крона), «аспириновая триада», наличие в анамнезе указаний на крапивницу, ринит, вызванные приемом ацетилсалициловой кислоты и других НПВС, кровотечения, гемофилия, геморрагический диатез, гипопротромбинемия, расслаивающая аневризма аорты, печеночная недостаточность тяжелой степени, активное заболевание печени, портальная гипертензия, тяжелая почечная недостаточность (КК <30 мл/мин), дефицит витамина К, сочетанное применение метотрексата в дозе ≥15 мг/нед., одновременное применение пероральных антикоагулянтов и ацетилсалициловой кислоты в дозе >3 г/сут, синдром Рейе, детский возраст до 15 лет (риск развития синдрома Рейе у детей с гипертермией на фоне вирусных заболеваний), беременность, период грудного вскармливания, повышенная чувствительность к ацетилсалициловой кислоте и другим салицилатам.
С осторожностью
Подагра, гиперурикемия, печеночная недостаточность легкой и средней степени тяжести, почечная недостаточность средней степени тяжести (КК 30-60 мл/мин), при бронхиальной астме, эрозивно-язвенных поражениях и кровотечениях из ЖКТ в анамнезе, при повышенной кровоточивости или при одновременном проведении противосвертывающей терапии, декомпенсированной хронической сердечной недостаточности, ХОБЛ, сенная лихорадка, полипоз носа, лекарственная аллергия, одновременное применение пероральных антикоагулянтов и ацетилсалициловой кислоты в дозе <3 г/сут, прием метотрексата в дозе менее 15 мг/нед., ациклические маточные кровотечения, гиперменоррагия.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
С осторожностью применяют у пациентов с заболеваниями печени.
Противопоказано применение при тяжелой почечной недостаточности, активном заболевании печени, при портальной гипертензии.
Применение при нарушениях функции почек
С осторожностью применяют у пациентов с заболеваниями почек.
Противопоказано применение при тяжелой почечной недостаточности (КК<30 мл/мин).
Применение у детей
Противопоказание: детский возраст (до 15 лет — риск развития синдрома Рейе у детей с гипертермией на фоне вирусных заболеваний).
Применение у пожилых пациентов
Применять с осторожностью во избежание риска обострения хронических заболеваний.
Особые указания
Ацетилсалициловая кислота даже в небольших дозах уменьшает выведение мочевой кислоты из организма, что может стать причиной острого приступа подагры у предрасположенных пациентов. При проведении длительной терапии и/или применении ацетилсалициловой кислоты в высоких дозах требуется наблюдение врача и регулярный контроль уровня гемоглобина.
Применение ацетилсалициловой кислоты в качестве противовоспалительного средства в суточной дозе 5-8 г ограничено в связи с высокой вероятностью развития побочных эффектов со стороны ЖКТ.
Перед хирургическим вмешательством, для уменьшения кровоточивости в ходе операции и в послеоперационном периоде следует отменить прием салицилатов за 5-7 дней.
Во время продолжительной терапии необходимо проводить общий анализ крови и исследование кала на скрытую кровь.
Применение ацетилсалициловой кислоты в педиатрии противопоказано, поскольку в случае вирусной инфекции у детей под влиянием ацетилсалициловой кислоты повышается риск развития синдрома Рейе. Симптомами синдрома Рейе являются длительная рвота, острая энцефалопатия, увеличение печени.
Длительность лечения (без консультации с врачом) не должна превышать 7 дней при назначении в качестве анальгезирующего средства и более 3 дней в качестве жаропонижающего.
В период лечения пациент должен воздерживаться от употребления алкоголя.
Лекарственное взаимодействие
При одновременном применении антациды, содержащие магния и/или алюминия гидроксид, замедляют и уменьшают всасывание ацетилсалициловой кислоты.
При одновременном применении блокаторов кальциевых каналов, средств, ограничивающих поступление кальция или увеличивающих выведение кальция из организма, повышается риск развития кровотечений.
При одновременном применении с ацетилсалициловой кислотой усиливается действие гепарина и непрямых антикоагулянтов, гипогликемических средств производных сульфонилмочевины, инсулинов, метотрексата, фенитоина, вальпроевой кислоты.
При одновременном применении с ГКС повышается риск ульцерогенного действия и возникновения желудочно-кишечных кровотечений.
При одновременном применении снижается эффективность диуретиков (спиронолактона, фуросемида).
При одновременном применении других НПВС повышается риск развития побочных эффектов. Ацетилсалициловая кислота может уменьшать концентрации в плазме крови индометацина, пироксикама.
При одновременном применении с препаратами золота ацетилсалициловая кислота может индуцировать повреждение печени.
При одновременном применении снижается эффективность урикозурических средств (в т.ч. пробенецида, сульфинпиразона, бензбромарона).
При одновременном применении ацетилсалициловой кислоты и алендроната натрия возможно развитие тяжелого эзофагита.
При одновременном применении гризеофульвина возможно нарушение абсорбции ацетилсалициловой кислоты.
Описан случай спонтанного кровоизлияния в радужную оболочку при приеме экстракта гинкго билоба на фоне длительного применения ацетилсалициловой кислоты в дозе 325 мг/сут. Полагают, что это может быть обусловлено аддитивным ингибирующим действием на агрегацию тромбоцитов.
При одновременном применении дипиридамола возможно увеличение Сmax салицилата в плазме крови и AUC.
При одновременном применении с ацетилсалициловой кислотой повышаются концентрации дигоксина, барбитуратов и солей лития в плазме крови.
При одновременном применении салицилатов в высоких дозах с ингибиторами карбоангидразы возможна интоксикация салицилатами.
Ацетилсалициловая кислота в дозах менее 300 мг/сут оказывает незначительное влияние на эффективность каптоприла и эналаприла. При применении ацетилсалициловой кислоты в высоких дозах возможно уменьшение эффективности каптоприла и эналаприла.
При одновременном применении кофеин повышает скорость всасывания, концентрацию в плазме крови и биодоступность ацетилсалициловой кислоты.
При одновременном применении метопролол может повышать Сmax салицилата в плазме крови.
При применении пентазоцина на фоне длительного приема ацетилсалициловой кислоты в высоких дозах имеется риск развития тяжелых побочных реакций со стороны почек.
При одновременном применении фенилбутазон уменьшает урикозурию, вызванную ацетилсалициловой кислотой.
При одновременном применении этанол может усиливать действие ацетилсалициловой кислоты на ЖКТ.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Аспинат®
(ВАЛЕНТА ФАРМАЦЕВТИКА, Россия)
Аспирин®
(БАЙЕР, Россия)
Аспирин® Экспресс
(BAYER CONSUMER CARE, Швейцария)
Ацетилсалициловая ки…
(ОБНОВЛЕНИЕ, Россия)
Ацетилсалициловая ки…
(ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, Россия)
Ацетилсалициловая ки…
(ИРБИТСКИЙ ХФЗ, Россия)
Ацетилсалициловая ки…
(ТАТХИМФАРМПРЕПАРАТЫ, Россия)
Ацетилсалициловая ки…
(ДАЛЬХИМФАРМ, Россия)
Ацетилсалициловая ки…
(ФАРМСТАНДАРТ-ТОМСКХИМФАРМ, Россия)
Ацетилсалициловая ки…
(АТОЛЛ, Россия)
Все аналоги
 |
|
 |
|
| Clinical data | |
|---|---|
| Pronunciation | acetylsalicylic acid |
| Trade names | Bayer Aspirin, others |
| Other names |
|
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a682878 |
| License data |
|
| Pregnancy category |
|
| Routes of administration |
By mouth, rectal |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Bioavailability | 80–100%[4] |
| Protein binding | 80–90%[5] |
| Metabolism | Liver (CYP2C19 and possibly CYP3A), some is also hydrolysed to salicylate in the gut wall.[5] |
| Elimination half-life | Dose-dependent; 2–3 h for low doses (100 mg or less), 15–30 h for large doses.[5] |
| Excretion | Urine (80–100%), sweat, saliva, feces[4] |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| IUPHAR/BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| PDB ligand |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.000.059 |
| Chemical and physical data | |
| Formula | C9H8O4 |
| Molar mass | 180.159 g·mol−1 |
| 3D model (JSmol) |
|
| Density | 1.40 g/cm3 |
| Melting point | 136 °C (277 °F) [7] |
| Boiling point | 140 °C (284 °F) (decomposes) |
| Solubility in water | 3 g/L |
|
SMILES
|
|
|
InChI
|
|
| (verify) |
Aspirin, also known as acetylsalicylic acid (ASA), is a nonsteroidal anti-inflammatory drug (NSAID) used to reduce pain, fever, and/or inflammation, and as an antithrombotic.[8] Specific inflammatory conditions which aspirin is used to treat include Kawasaki disease, pericarditis, and rheumatic fever.[8]
Aspirin is also used long-term to help prevent further heart attacks, ischaemic strokes, and blood clots in people at high risk.[8] For pain or fever, effects typically begin within 30 minutes.[8] Aspirin works similarly to other NSAIDs but also suppresses the normal functioning of platelets.[8]
One common adverse effect is an upset stomach.[8] More significant side effects include stomach ulcers, stomach bleeding, and worsening asthma.[8] Bleeding risk is greater among those who are older, drink alcohol, take other NSAIDs, or are on other blood thinners.[8] Aspirin is not recommended in the last part of pregnancy.[8] It is not generally recommended in children with infections because of the risk of Reye syndrome.[8] High doses may result in ringing in the ears.[8]
A precursor to aspirin found in the bark of the willow tree (genus Salix) has been used for its health effects for at least 2,400 years.[9][10] In 1853, chemist Charles Frédéric Gerhardt treated the medicine sodium salicylate with acetyl chloride to produce acetylsalicylic acid for the first time.[11] Over the next 50 years, other chemists established the chemical structure and devised more efficient production methods.[11]: 69–75
Aspirin is available without medical prescription as a proprietary or generic medication[8] in most jurisdictions. It is one of the most widely used medications globally, with an estimated 40,000 tonnes (44,000 tons) (50 to 120 billion pills)[clarification needed] consumed each year,[9][12] and is on the World Health Organization’s List of Essential Medicines.[13] In 2020, it was the 36th most commonly prescribed medication in the United States, with more than 17 million prescriptions.[14][15]
Brand vs. generic name[edit]
In 1897, scientists at the Bayer company began studying acetylsalicylic acid as a less-irritating replacement medication for common salicylate medicines.[11]: 69–75 [16] By 1899, Bayer had named it «Aspirin» and sold it around the world.[17]
Aspirin’s popularity grew over the first half of the 20th century, leading to competition between many brands and formulations.[18] The word Aspirin was Bayer’s brand name; however, their rights to the trademark were lost or sold in many countries.[18] The name is ultimately a blend of the prefix a(cetyl) + spir Spiraea, the meadowsweet plant genus from which the acetylsalicylic acid was originally derived at Bayer + -in, the common chemical suffix.
Chemical properties[edit]
Aspirin decomposes rapidly in solutions of ammonium acetate or the acetates, carbonates, citrates, or hydroxides of the alkali metals. It is stable in dry air, but gradually hydrolyses in contact with moisture to acetic and salicylic acids. In solution with alkalis, the hydrolysis proceeds rapidly and the clear solutions formed may consist entirely of acetate and salicylate.[19]
Like flour mills, factories producing aspirin tablets must control the amount of the powder that becomes airborne inside the building, because the powder-air mixture can be explosive. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit in the United States of 5 mg/m3 (time-weighted average).[20] In 1989, the Occupational Safety and Health Administration (OSHA) set a legal permissible exposure limit for aspirin of 5 mg/m3, but this was vacated by the AFL-CIO v. OSHA decision in 1993.[21]
Synthesis[edit]
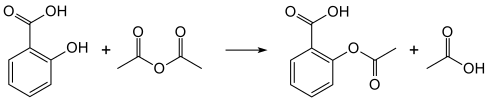
The synthesis of aspirin is classified as an esterification reaction. Salicylic acid is treated with acetic anhydride, an acid derivative, causing a chemical reaction that turns salicylic acid’s hydroxyl group into an ester group (R-OH → R-OCOCH3). This process yields aspirin and acetic acid, which is considered a byproduct of this reaction. Small amounts of sulfuric acid (and occasionally phosphoric acid) are almost always used as a catalyst. This method is commonly demonstrated in undergraduate teaching labs.[22]
Reaction between acetic acid and salicylic acid can also form aspirin but this esterification reaction is reversible and the presence of water can lead to hydrolysis of the aspirin. So, an anhydrous reagent is preferred.[23]
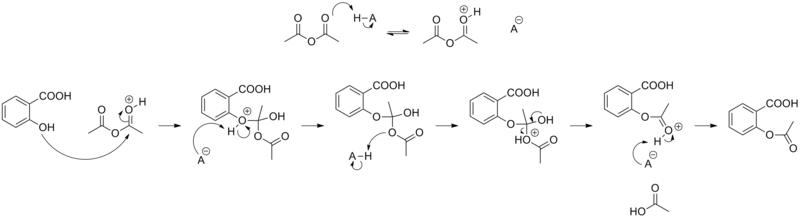
- Reaction mechanism
Acetylation of salicylic acid, mechanism
Formulations containing high concentrations of aspirin often smell like vinegar[24] because aspirin can decompose through hydrolysis in moist conditions, yielding salicylic and acetic acids.[25]
Physical properties[edit]
Aspirin, an acetyl derivative of salicylic acid, is a white, crystalline, weakly acidic substance, which melts at 136 °C (277 °F),[7] and decomposes around 140 °C (284 °F).[26] Its acid dissociation constant (pKa) is 3.5 at 25 °C (77 °F).[27]
Polymorphism[edit]
Polymorphism, or the ability of a substance to form more than one crystal structure, is important in the development of pharmaceutical ingredients. Many drugs receive regulatory approval for only a single crystal form or polymorph. For a long time, only one crystal structure for aspirin was known. That aspirin might have a second crystalline form was suspected since the 1960s. The elusive second polymorph was first discovered by Vishweshwar and coworkers in 2005,[28] and fine structural details were given by Bond et al.[29] A new crystal type was found during experiments after co-crystallization of aspirin and levetiracetam from hot acetonitrile. The form II is only stable at 100 K and reverts to form I at ambient temperature. In the (unambiguous) form I, two salicylic molecules form centrosymmetric dimers through the acetyl groups with the (acidic) methyl proton to carbonyl hydrogen bonds, and in the newly claimed form II, each salicylic molecule forms the same hydrogen bonds with two neighboring molecules instead of one. With respect to the hydrogen bonds formed by the carboxylic acid groups, both polymorphs form identical dimer structures.[28]
Mechanism of action[edit]
Discovery of the mechanism[edit]
In 1971, British pharmacologist John Robert Vane, then employed by the Royal College of Surgeons in London, showed aspirin suppressed the production of prostaglandins and thromboxanes.[30][31] For this discovery he was awarded the 1982 Nobel Prize in Physiology or Medicine, jointly with Sune Bergström and Bengt Ingemar Samuelsson.[32]
Prostaglandins and thromboxanes[edit]
Aspirin’s ability to suppress the production of prostaglandins and thromboxanes is due to its irreversible inactivation of the cyclooxygenase (COX; officially known as prostaglandin-endoperoxide synthase, PTGS) enzyme required for prostaglandin and thromboxane synthesis. Aspirin acts as an acetylating agent where an acetyl group is covalently attached to a serine residue in the active site of the PTGS enzyme (Suicide inhibition). This makes aspirin different from other NSAIDs (such as diclofenac and ibuprofen), which are reversible inhibitors.
Low-dose aspirin use irreversibly blocks the formation of thromboxane A2 in platelets, producing an inhibitory effect on platelet aggregation during the lifetime of the affected platelet (8–9 days). This antithrombotic property makes aspirin useful for reducing the incidence of heart attacks in people who have had a heart attack, unstable angina, ischemic stroke or transient ischemic attack.[33] 40 mg of aspirin a day is able to inhibit a large proportion of maximum thromboxane A2 release provoked acutely, with the prostaglandin I2 synthesis being little affected; however, higher doses of aspirin are required to attain further inhibition.[34]
Prostaglandins, local hormones produced in the body, have diverse effects, including the transmission of pain information to the brain, modulation of the hypothalamic thermostat, and inflammation. Thromboxanes are responsible for the aggregation of platelets that form blood clots. Heart attacks are caused primarily by blood clots, and low doses of aspirin are seen as an effective medical intervention to prevent a second acute myocardial infarction.[35]
COX-1 and COX-2 inhibition[edit]
At least two different types of cyclooxygenases, COX-1 and COX-2, are acted on by aspirin. Aspirin irreversibly inhibits COX-1 and modifies the enzymatic activity of COX-2. COX-2 normally produces prostanoids, most of which are proinflammatory. Aspirin-modified PTGS2 (prostaglandin-endoperoxide synthase 2) produces lipoxins, most of which are anti-inflammatory.[36][verification needed] Newer NSAID drugs, COX-2 inhibitors (coxibs), have been developed to inhibit only PTGS2, with the intent to reduce the incidence of gastrointestinal side effects.[12]
Several COX-2 inhibitors, such as rofecoxib (Vioxx), have been withdrawn from the market, after evidence emerged that PTGS2 inhibitors increase the risk of heart attack and stroke.[37][38] Endothelial cells lining the microvasculature in the body are proposed to express PTGS2, and, by selectively inhibiting PTGS2, prostaglandin production (specifically, PGI2; prostacyclin) is downregulated with respect to thromboxane levels, as PTGS1 in platelets is unaffected. Thus, the protective anticoagulative effect of PGI2 is removed, increasing the risk of thrombus and associated heart attacks and other circulatory problems. Since platelets have no DNA, they are unable to synthesize new PTGS once aspirin has irreversibly inhibited the enzyme, an important difference as compared with reversible inhibitors.
Furthermore, aspirin, while inhibiting the ability of COX-2 to form pro-inflammatory products such as the prostaglandins, converts this enzyme’s activity from a prostaglandin-forming cyclooxygenase to a lipoxygenase-like enzyme: aspirin-treated COX-2 metabolizes a variety of polyunsaturated fatty acids to hydroperoxy products which are then further metabolized to specialized proresolving mediators such as the aspirin-triggered lipoxins, aspirin-triggered resolvins, and aspirin-triggered maresins. These mediators possess potent anti-inflammatory activity. It is proposed that this aspirin-triggered transition of COX-2 from cyclooxygenase to lipoxygenase activity and the consequential formation of specialized proresolving mediators contributes to the anti-inflammatory effects of aspirin.[39][40][41]
Additional mechanisms[edit]
Aspirin has been shown to have at least three additional modes of action. It uncouples oxidative phosphorylation in cartilaginous (and hepatic) mitochondria, by diffusing from the inner membrane space as a proton carrier back into the mitochondrial matrix, where it ionizes once again to release protons.[42] Aspirin buffers and transports the protons. When high doses are given, it may actually cause fever, owing to the heat released from the electron transport chain, as opposed to the antipyretic action of aspirin seen with lower doses. In addition, aspirin induces the formation of NO-radicals in the body, which have been shown in mice to have an independent mechanism of reducing inflammation. This reduced leukocyte adhesion is an important step in the immune response to infection; however, evidence is insufficient to show aspirin helps to fight infection.[43] More recent data also suggest salicylic acid and its derivatives modulate signalling through NF-κB.[44] NF-κB, a transcription factor complex, plays a central role in many biological processes, including inflammation.[45][46][47]
Aspirin is readily broken down in the body to salicylic acid, which itself has anti-inflammatory, antipyretic, and analgesic effects. In 2012, salicylic acid was found to activate AMP-activated protein kinase, which has been suggested as a possible explanation for some of the effects of both salicylic acid and aspirin.[48][49] The acetyl portion of the aspirin molecule has its own targets. Acetylation of cellular proteins is a well-established phenomenon in the regulation of protein function at the post-translational level. Aspirin is able to acetylate several other targets in addition to COX isoenzymes.[50][51] These acetylation reactions may explain many hitherto unexplained effects of aspirin.[52]
Formulations[edit]
|
This section needs expansion. You can help by adding to it. (January 2023) |
Aspirin is produced in many formulations, with some differences in effect. In particular, aspirin can cause gastrointestinal bleeding, and formulations are sought which deliver the benefits of aspirin while mitigating harmful bleeding. Formulations may be combined (e.g., buffered + vitamin C).
- Tablets, typically of about 75-100mg and 300-320mg of immediate-release aspirin (IR-ASA).
- Dispersible tablets.
- Enteric-coated tablets.
- Buffered formulations containing aspirin with one of many buffering agents.
- Formulations of aspirin with vitamin C (ASA-VitC)
- A phospholipid-aspirin complex liquid formulation, PL-ASA. As of 2023 the phospholipid coating was being trialled to determine if it caused less gastrointestinal damage.[53]
Pharmacokinetics[edit]
Acetylsalicylic acid is a weak acid, and very little of it is ionized in the stomach after oral administration. Acetylsalicylic acid is quickly absorbed through the cell membrane in the acidic conditions of the stomach. The increased pH and larger surface area of the small intestine causes aspirin to be absorbed more slowly there, as more of it is ionized. Owing to the formation of concretions, aspirin is absorbed much more slowly during overdose, and plasma concentrations can continue to rise for up to 24 hours after ingestion.[54][55][56]
About 50–80% of salicylate in the blood is bound to human serum albumin, while the rest remains in the active, ionized state; protein binding is concentration-dependent. Saturation of binding sites leads to more free salicylate and increased toxicity. The volume of distribution is 0.1–0.2 L/kg. Acidosis increases the volume of distribution because of enhancement of tissue penetration of salicylates.[56]
As much as 80% of therapeutic doses of salicylic acid is metabolized in the liver. Conjugation with glycine forms salicyluric acid, and with glucuronic acid to form two different glucuronide esters. The conjugate with the acetyl group intact is referred to as the acyl glucuronide; the deacetylated conjugate is the phenolic glucuronide. These metabolic pathways have only a limited capacity. Small amounts of salicylic acid are also hydroxylated to gentisic acid. With large salicylate doses, the kinetics switch from first-order to zero-order, as metabolic pathways become saturated and renal excretion becomes increasingly important.[56]
Salicylates are excreted mainly by the kidneys as salicyluric acid (75%), free salicylic acid (10%), salicylic phenol (10%), and acyl glucuronides (5%), gentisic acid (< 1%), and 2,3-dihydroxybenzoic acid.[57] When small doses (less than 250 mg in an adult) are ingested, all pathways proceed by first-order kinetics, with an elimination half-life of about 2.0 h to 4.5 h.[58][59] When higher doses of salicylate are ingested (more than 4 g), the half-life becomes much longer (15 h to 30 h),[60] because the biotransformation pathways concerned with the formation of salicyluric acid and salicyl phenolic glucuronide become saturated.[61] Renal excretion of salicylic acid becomes increasingly important as the metabolic pathways become saturated, because it is extremely sensitive to changes in urinary pH. A 10- to 20-fold increase in renal clearance occurs when urine pH is increased from 5 to 8. The use of urinary alkalinization exploits this particular aspect of salicylate elimination.[62] It was found that short-term aspirin use in therapeutic doses might precipitate reversible acute kidney injury when the patient was ill with glomerulonephritis or cirrhosis.[63] Aspirin for some patients with chronic kidney disease and some children with congestive heart failure was contraindicated.[63]
History[edit]
Medicines made from willow and other salicylate-rich plants appear in clay tablets from ancient Sumer as well as the Ebers Papyrus from ancient Egypt.[11]: 8–13 [18] Hippocrates referred to the use of salicylic tea to reduce fevers around 400 BC, and willow bark preparations were part of the pharmacopoeia of Western medicine in classical antiquity and the Middle Ages.[18] Willow bark extract became recognized for its specific effects on fever, pain, and inflammation in the mid-eighteenth century.[64] By the nineteenth century, pharmacists were experimenting with and prescribing a variety of chemicals related to salicylic acid, the active component of willow extract.[11]: 46–55
Old package. «Export from Germany is prohibited»
In 1853, chemist Charles Frédéric Gerhardt treated sodium salicylate with acetyl chloride to produce acetylsalicylic acid for the first time;[11]: 46–48 in the second half of the 19th century, other academic chemists established the compound’s chemical structure and devised more efficient methods of synthesis. In 1897, scientists at the drug and dye firm Bayer began investigating acetylsalicylic acid as a less-irritating replacement for standard common salicylate medicines, and identified a new way to synthesize it.[11]: 69–75 By 1899, Bayer had dubbed this drug Aspirin and was selling it globally.[17]: 27 The word Aspirin was Bayer’s brand name, rather than the generic name of the drug; however, Bayer’s rights to the trademark were lost or sold in many countries. Aspirin’s popularity grew over the first half of the 20th century leading to fierce competition with the proliferation of aspirin brands and products.[18]
Aspirin’s popularity declined after the development of acetaminophen/paracetamol in 1956 and ibuprofen in 1962. In the 1960s and 1970s, John Vane and others discovered the basic mechanism of aspirin’s effects,[11]: 226–231 while clinical trials and other studies from the 1960s to the 1980s established aspirin’s efficacy as an anti-clotting agent that reduces the risk of clotting diseases.[11]: 247–257 The initial large studies on the use of low-dose aspirin to prevent heart attacks that were published in the 1970s and 1980s helped spur reform in clinical research ethics and guidelines for human subject research and US federal law, and are often cited as examples of clinical trials that included only men, but from which people drew general conclusions that did not hold true for women.[65][66][67]
Aspirin sales revived considerably in the last decades of the 20th century, and remain strong in the 21st century with widespread use as a preventive treatment for heart attacks and strokes.[11]: 267–269
Trademark[edit]
In Canada and many other countries, «Aspirin» remains a trademark, so generic aspirin is sold as «ASA» (acetylsalicylic acid).
In the US., «aspirin» is a generic name.
Bayer lost its trademark for Aspirin in the United States in actions taken between 1918 and 1921 because it had failed to use the name for its own product correctly and had for years allowed the use of «Aspirin» by other manufacturers without defending the intellectual property rights.[68] Today, aspirin is a generic trademark in many countries.[69][70] Aspirin, with a capital «A», remains a registered trademark of Bayer in Germany, Canada, Mexico, and in over 80 other countries, for acetylsalicylic acid in all markets, but using different packaging and physical aspects for each.[71][72]
Compendial status[edit]
- United States Pharmacopeia[73]
- British Pharmacopoeia[74]
Medical use[edit]
Aspirin is used in the treatment of a number of conditions, including fever, pain, rheumatic fever, and inflammatory conditions, such as rheumatoid arthritis, pericarditis, and Kawasaki disease.[8] Lower doses of aspirin have also been shown to reduce the risk of death from a heart attack, or the risk of stroke in people who are at high risk or who have cardiovascular disease, but not in elderly people who are otherwise healthy.[75][76][77][78][79] There is some evidence that aspirin is effective at preventing colorectal cancer, though the mechanisms of this effect are unclear.[80] In the United States, the selective initiation of low-dose aspirin, based on an individualised assessment, has been deemed reasonable for the primary prevention of cardiovascular disease in people aged between 40 and 59 who have a 10% or greater risk of developing cardiovascular disease over the next 10 years and are not at an increased risk of bleeding.[81]
Pain[edit]
Aspirin is an effective analgesic for acute pain, although it is generally considered inferior to ibuprofen because aspirin is more likely to cause gastrointestinal bleeding.[82] Aspirin is generally ineffective for those pains caused by muscle cramps, bloating, gastric distension, or acute skin irritation.[83] As with other NSAIDs, combinations of aspirin and caffeine provide slightly greater pain relief than aspirin alone.[84] Effervescent formulations of aspirin relieve pain faster than aspirin in tablets,[85] which makes them useful for the treatment of migraines.[86] Topical aspirin may be effective for treating some types of neuropathic pain.[87]
Aspirin, either by itself or in a combined formulation, effectively treats certain types of a headache, but its efficacy may be questionable for others. Secondary headaches, meaning those caused by another disorder or trauma, should be promptly treated by a medical provider. Among primary headaches, the International Classification of Headache Disorders distinguishes between tension headache (the most common), migraine, and cluster headache. Aspirin or other over-the-counter analgesics are widely recognized as effective for the treatment of tension headaches.[88] Aspirin, especially as a component of an aspirin/paracetamol/caffeine combination, is considered a first-line therapy in the treatment of migraine, and comparable to lower doses of sumatriptan. It is most effective at stopping migraines when they are first beginning.[89]
Fever[edit]
Like its ability to control pain, aspirin’s ability to control fever is due to its action on the prostaglandin system through its irreversible inhibition of COX.[90] Although aspirin’s use as an antipyretic in adults is well established, many medical societies and regulatory agencies, including the American Academy of Family Physicians, the American Academy of Pediatrics, and the Food and Drug Administration, strongly advise against using aspirin for the treatment of fever in children because of the risk of Reye’s syndrome, a rare but often fatal illness associated with the use of aspirin or other salicylates in children during episodes of viral or bacterial infection.[91][92][93] Because of the risk of Reye’s syndrome in children, in 1986, the US Food and Drug Administration (FDA) required labeling on all aspirin-containing medications advising against its use in children and teenagers.[94]
Inflammation[edit]
Aspirin is used as an anti-inflammatory agent for both acute and long-term inflammation,[95] as well as for the treatment of inflammatory diseases, such as rheumatoid arthritis.[8]
Heart attacks and strokes[edit]
Aspirin is an important part of the treatment of those who have had a heart attack.[96] It is generally not recommended for routine use by people with no other health problems, including those over the age of 70.[97]
The 2009 Antithrombotic Trialists’ Collaboration published in Lancet evaluated the efficacy and safety of low dose aspirin in secondary prevention. In those with prior ischaemic stroke or acute myocardial infarction, daily low dose aspirin was associated with a 19% relative risk reduction of serious cardiovascular events (non-fatal myocardial infarction, non-fatal stroke, or vascular death). This did come at the expense of a 0.19% absolute risk increase in gastrointestinal bleeding; however, the benefits outweigh the hazard risk in this case.[98] Data from early trials of aspirin in primary prevention suggested low dose aspirin is more beneficial for people <70 kg and high dose aspirin is more beneficial for those ≥70 kg.[99] However, more recent trials have suggested lower dose aspirin is not more efficacious in people with a low body weight and more evidence is required to determine the effect of higher dose aspirin in people with a high body weight.[100][101][102]
After percutaneous coronary interventions (PCIs), such as the placement of a coronary artery stent, a U.S. Agency for Healthcare Research and Quality guideline recommends that aspirin be taken indefinitely.[103] Frequently, aspirin is combined with an ADP receptor inhibitor, such as clopidogrel, prasugrel, or ticagrelor to prevent blood clots. This is called dual antiplatelet therapy (DAPT). Duration of DAPT was advised in the United States and European Union guidelines after the CURE [104] and PRODIGY [105] studies . In 2020, the systematic review and network meta-analysis from Khan et al.[106] showed promising benefits of short-term (< 6 months) DAPT followed by P2Y12 inhibitors in selected patients, as well as the benefits of extended-term (> 12 months) DAPT in high risk patients. In conclusion, the optimal duration of DAPT after PCIs should be personalized after outweighing each patient’s risks of ischemic events and risks of bleeding events with consideration of multiple patient-related and procedure-related factors. Moreover, aspirin should be continued indefinitely after DAPT is complete.[107][108][109]
The status of the use of aspirin for the primary prevention in cardiovascular disease is conflicting and inconsistent, with recent changes from previously recommending it widely decades ago, and that some referenced newer trials in clinical guidelines show less of benefit of adding aspirin alongside other anti-hypertensive and cholesterol lowering therapies.[97][110] The ASCEND study demonstrated that in high-bleeding risk diabetics with no prior cardiovascular disease, there is no overall clinical benefit (12% decrease in risk of ischaemic events v/s 29% increase in GI bleeding) of low dose aspirin in preventing the serious vascular events over a period of 7.4 years. Similarly, the results of the ARRIVE study also showed no benefit of same dose of aspirin in reducing the time to first cardiovascular outcome in patients with moderate risk of cardiovascular disease over a period of five years. Aspirin has also been suggested as a component of a polypill for prevention of cardiovascular disease.[111][112] Complicating the use of aspirin for prevention is the phenomenon of aspirin resistance.[113][114] For people who are resistant, aspirin’s efficacy is reduced.[115] Some authors have suggested testing regimens to identify people who are resistant to aspirin.[116]
As of April 2022, the United States Preventive Services Task Force (USPSTF) determined that there was a «small net benefit» for patients aged 40-59 with a 10% or greater 10-year cardiovascular disease (CVD) risk, and «no net benefit» for patients aged over 60.[117][118][119] Determining the net benefit was based on balancing the risk reduction of taking aspirin for heart attacks and ischaemic strokes, with the increased risk of gastrointestinal bleeding, intracranial bleeding, and hemorrhagic strokes. Their recommendations state that age changes the risk of the medicine, with the magnitude of the benefit of aspirin coming from starting at a younger age, while the risk of bleeding, while small, increases with age, particular for adults over 60, and can be compounded by other risk factors such as diabetes and a history of gastrointestinal bleeding. As a result, the USPSTF suggests that «people ages 40 to 59 who are at higher risk for CVD should decide with their clinician whether to start taking aspirin; people 60 or older should not start taking aspirin to prevent a first heart attack or stroke.» Primary prevention guidelines from September 2019 made by the American College of Cardiology and the American Heart Association state they might consider aspirin for patients aged 40-69 with a higher risk of atherosclerotic CVD, without an increased bleeding risk, while stating they would not recommend aspirin for patients aged over 70 or adults of any age with an increased bleeding risk.[97] They state a CVD risk estimation and a risk discussion should be done before starting on aspirin, while stating aspirin should be used «infrequently in the routine primary prevention of (atherosclerotic CVD) because of lack of net benefit». As of August 2021, the European Society of Cardiology made similar recommendations; considering aspirin specifically to patients aged less than 70 at high or very high CVD risk, without any clear contraindications, on a case-by-case basis considering both ischemic risk and bleeding risk.[110]
Cancer prevention[edit]
Aspirin may reduce the overall risk of both getting cancer and dying from cancer.[120] There is substantial evidence for lowering the risk of colorectal cancer (CRC),[80][121][122][123] but aspirin must be taken for at least 10–20 years to see this benefit.[124] It may also slightly reduce the risk of endometrial cancer,[125] breast cancer, and prostate cancer.[126]
Some conclude the benefits are greater than the risks due to bleeding in those at average risk.[120] Others are unclear if the benefits are greater than the risk.[127][128] Given this uncertainty, the 2007 United States Preventive Services Task Force (USPSTF) guidelines on this topic recommended against the use of aspirin for prevention of CRC in people with average risk.[129] Nine years later however, the USPSTF issued a grade B recommendation for the use of low-dose aspirin (75 to 100 mg/day) «for the primary prevention of CVD [cardiovascular disease] and CRC in adults 50 to 59 years of age who have a 10% or greater 10-year CVD risk, are not at increased risk for bleeding, have a life expectancy of at least 10 years, and are willing to take low-dose aspirin daily for at least 10 years».[130]
A meta-analysis through 2019 said that there was an association between taking aspirin and lower risk of cancer of the colorectum, esophagus, and stomach.[131]
In 2021, the U.S. Preventive services Task Force raised questions about the use of aspirin in cancer prevention. It notes the results of the 2018 ASPREE (Aspirin in Reducing Events in the Elderly) Trial, in which the risk of cancer-related death was higher in the aspirin-treated group than in the placebo group.[132]
Psychiatry[edit]
Bipolar disorder[edit]
Aspirin, along with several other agents with anti-inflammatory properties, has been repurposed as an add-on treatment for depressive episodes in subjects with bipolar disorder in light of the possible role of inflammation in the pathogenesis of severe mental disorders.[133] However, meta-analytic evidence is based on very few studies and does not suggest any efficacy of aspirin in the treatment of bipolar depression.[133] Thus, notwithstanding the biological rationale, the clinical perspectives of aspirin and anti-inflammatory agents in the treatment of bipolar depression remain uncertain.[133]
Dementia[edit]
Although cohort and longitudinal studies have shown low-dose aspirin has a greater likelihood of reducing the incidence of dementia, numerous randomized controlled trials have not validated this.[134][135]
Schizophrenia[edit]
Some researchers have speculated the anti-inflammatory effects of aspirin may be beneficial for schizophrenia. Small trials have been conducted but evidence remains lacking.[136]
Other uses[edit]
Aspirin is a first-line treatment for the fever and joint-pain symptoms of acute rheumatic fever. The therapy often lasts for one to two weeks, and is rarely indicated for longer periods. After fever and pain have subsided, the aspirin is no longer necessary, since it does not decrease the incidence of heart complications and residual rheumatic heart disease.[137][138] Naproxen has been shown to be as effective as aspirin and less toxic, but due to the limited clinical experience, naproxen is recommended only as a second-line treatment.[137][139]
Along with rheumatic fever, Kawasaki disease remains one of the few indications for aspirin use in children[140] in spite of a lack of high quality evidence for its effectiveness.[141]
Low-dose aspirin supplementation has moderate benefits when used for prevention of pre-eclampsia.[142][143] This benefit is greater when started in early pregnancy.[144]
Aspirin has also demonstrated anti-tumoral effects, via inhibition of the PTTG1 gene, which is often overexpressed in tumors.[145]
Resistance[edit]
For some people, aspirin does not have as strong an effect on platelets as for others, an effect known as aspirin-resistance or insensitivity. One study has suggested women are more likely to be resistant than men,[146] and a different, aggregate study of 2,930 people found 28% were resistant.[147]
A study in 100 Italian people found, of the apparent 31% aspirin-resistant subjects, only 5% were truly resistant, and the others were noncompliant.[148]
Another study of 400 healthy volunteers found no subjects who were truly resistant, but some had «pseudoresistance, reflecting delayed and reduced drug absorption».
[149]
Meta-analysis and systematic reviews have concluded that laboratory confirmed aspirin resistance confers increased rates of poorer outcomes in cardiovascular and neurovascular diseases.[150][147][151][152][153][154] Although the majority of research conducted has surrounded cardiovascular and neurovascular, there is emerging research into the risk of aspirin resistance after orthopaedic surgery where aspirin is used for venous thromboembolism prophylaxis.[155] Aspirin resistance in orthopaedic surgery, specifically after total hip and knee arthroplasties, is of interest as risk factors for aspirin resistance are also risk factors for venous thromboembolisms and osteoarthritis; the sequalae of requiring a total hip or knee arthroplasty. Some of these risk factors include obesity, advancing age, diabetes mellitus, dyslipidaemia and inflammatory diseases.[155]
Dosages[edit]
Adult aspirin tablets are produced in standardised sizes, which vary slightly from country to country, for example 300 mg in Britain and 325 mg (or 5 grains) in the United States. Smaller doses are based on these standards, e.g., 75 mg and 81 mg tablets. The 81-milligram (1+1⁄4-grain) tablets are commonly called «baby aspirin» or «baby-strength», because they were originally – but no longer – intended to be administered to infants and children.[156] No medical significance occurs due to the slight difference in dosage between the 75 mg and the 81 mg tablets. The dose required for benefit appears to depend on a person’s weight.[99] For those weighing less than 70 kilograms (154 lb), low dose is effective for preventing cardiovascular disease; for patients above this weight, higher doses are required.[99]
In general, for adults, doses are taken four times a day for fever or arthritis,[157] with doses near the maximal daily dose used historically for the treatment of rheumatic fever.[158] For the prevention of myocardial infarction (MI) in someone with documented or suspected coronary artery disease, much lower doses are taken once daily.[157]
March 2009 recommendations from the USPSTF on the use of aspirin for the primary prevention of coronary heart disease encourage men aged 45–79 and women aged 55–79 to use aspirin when the potential benefit of a reduction in MI for men or stroke for women outweighs the potential harm of an increase in gastrointestinal hemorrhage.[159][160][needs update] The WHI study of postmenopausal women found that aspirin resulted in a 25% lower risk of death from cardiovascular disease and a 14% lower risk of death from any cause, though there was no significant difference between 81 mg and 325 mg aspirin doses.[161] The 2021 ADAPTABLE study also showed no significant difference in cardiovascular events or major bleeding between 81 mg and 325 mg doses of aspirin in patients (both men and women) with established cardiovascular disease.[162]
Low-dose aspirin use was also associated with a trend toward lower risk of cardiovascular events, and lower aspirin doses (75 or 81 mg/day) may optimize efficacy and safety for people requiring aspirin for long-term prevention.[160]
In children with Kawasaki disease, aspirin is taken at dosages based on body weight, initially four times a day for up to two weeks and then at a lower dose once daily for a further six to eight weeks.[163]
Adverse effects[edit]
In October 2020, the US Food and Drug Administration (FDA) required the drug label to be updated for all nonsteroidal anti-inflammatory medications to describe the risk of kidney problems in unborn babies that result in low amniotic fluid.[164][165] They recommend avoiding NSAIDs in pregnant women at 20 weeks or later in pregnancy.[164][165] One exception to the recommendation is the use of low-dose 81 mg aspirin at any point in pregnancy under the direction of a health care professional.[165]
Contraindications[edit]
Aspirin should not be taken by people who are allergic to ibuprofen or naproxen,[166][167] or who have salicylate intolerance[168][169] or a more generalized drug intolerance to NSAIDs, and caution should be exercised in those with asthma or NSAID-precipitated bronchospasm. Owing to its effect on the stomach lining, manufacturers recommend people with peptic ulcers, mild diabetes, or gastritis seek medical advice before using aspirin.[166][170] Even if none of these conditions is present, the risk of stomach bleeding is still increased when aspirin is taken with alcohol or warfarin.[166][167] People with hemophilia or other bleeding tendencies should not take aspirin or other salicylates.[166][170] Aspirin is known to cause hemolytic anemia in people who have the genetic disease glucose-6-phosphate dehydrogenase deficiency, particularly in large doses and depending on the severity of the disease.[171] Use of aspirin during dengue fever is not recommended owing to increased bleeding tendency.[172] People with kidney disease, hyperuricemia, or gout should not take aspirin because it inhibits the kidneys’ ability to excrete uric acid, thus may exacerbate these conditions. Aspirin should not be given to children or adolescents under the age of 16 to control cold or influenza symptoms, as this has been linked with Reye’s syndrome.[173]
Gastrointestinal[edit]
Aspirin use has been shown to increase the risk of gastrointestinal bleeding.[174] Although some enteric-coated formulations of aspirin are advertised as being «gentle to the stomach», in one study, enteric coating did not seem to reduce this risk;[174] the Mayo Clinic agree with this, and report that coated aspirin may also not be as effective at reducing blood clot risk.[175]
Combining aspirin with other NSAIDs has been shown to further increase the risk of gastrointestinal bleeding.[174] Using aspirin in combination with clopidogrel or warfarin also increases the risk of upper gastrointestinal bleeding.[176]
Blockade of COX-1 by aspirin apparently results in the upregulation of COX-2 as part of a gastric defense.[177] Several trials suggest that the simultaneous use of a COX-2 inhibitor with aspirin may increase the risk of gastrointestinal injury.[178][179] However, currently available evidence has been unable to prove that this effect is consistently repeatable in everyday clinical practice.[180] More dedicated research is required to provide greater clarity on the subject.[180] Therefore, caution should be exercised if combining aspirin with any «natural» supplements with COX-2-inhibiting properties, such as garlic extracts, curcumin, bilberry, pine bark, ginkgo, fish oil, resveratrol, genistein, quercetin, resorcinol, and others.[citation needed]
«Buffering» is an additional method that is used with the intention of mitigating gastrointestinal bleeding. Buffering agents are intended to work by preventing the aspirin from concentrating in the walls of the stomach, although the benefits of buffered aspirin are disputed.[citation needed] Almost any buffering agent used in antacids can be used; Bufferin, for example, uses magnesium oxide. Other preparations use calcium carbonate.[181] Gas-forming agents in effervescent tablet and powder formulations can also double as a buffering agent, one example being sodium bicarbonate, used in Alka-Seltzer.[182]
Taking vitamin C with aspirin has been investigated as a method of protecting the stomach lining. In trials vitamin C-releasing aspirin (ASA-VitC) or a buffered aspirin formulation containing vitamin C was found to cause less stomach damage than aspirin alone.[183][184]
Retinal vein occlusion[edit]
It is a widespread habit among eye specialists (ophthalmologists) to prescribe aspirin as an add-on medication for patients with retinal vein occlusion (RVO), such as central retinal vein occlusion (CRVO) and branch retinal vein occlusion (BRVO). The reason of this widespread use is the evidence of its proven effectiveness in major systemic venous thrombotic disorders, and it has been assumed that may be similarly beneficial in various types of retinal vein occlusion.
However, a large-scale investigation based on data of nearly 700 patients showed «that aspirin or other antiplatelet aggregating agents or anticoagulants adversely influence the visual outcome in patients with CRVO and hemi-CRVO, without any evidence of protective or beneficial effect».[185] Several expert groups, including the Royal College of Ophthalmologists, recommended against the use of antithrombotic drugs (incl. aspirin) for patients with RVO.[186]
Central effects[edit]
Large doses of salicylate, a metabolite of aspirin, cause temporary tinnitus (ringing in the ears) based on experiments in rats, via the action on arachidonic acid and NMDA receptors cascade.[187]
Reye’s syndrome[edit]
Reye’s syndrome, a rare but severe illness characterized by acute encephalopathy and fatty liver, can occur when children or adolescents are given aspirin for a fever or other illness or infection. From 1981 to 1997, 1207 cases of Reye’s syndrome in people younger than 18 were reported to the US Centers for Disease Control and Prevention (CDC). Of these, 93% reported being ill in the three weeks preceding the onset of Reye’s syndrome, most commonly with a respiratory infection, chickenpox, or diarrhea. Salicylates were detectable in 81.9% of children for whom test results were reported.[188] After the association between Reye’s syndrome and aspirin was reported, and safety measures to prevent it (including a Surgeon General’s warning, and changes to the labeling of aspirin-containing drugs) were implemented, aspirin taken by children declined considerably in the United States, as did the number of reported cases of Reye’s syndrome; a similar decline was found in the United Kingdom after warnings against pediatric aspirin use were issued.[188] The US Food and Drug Administration recommends aspirin (or aspirin-containing products) should not be given to anyone under the age of 12 who has a fever,[173] and the UK National Health Service recommends children who are under 16 years of age should not take aspirin, unless it is on the advice of a doctor.[189]
Skin[edit]
For a small number of people, taking aspirin can result in symptoms including hives, swelling, and headache.[190] Aspirin can exacerbate symptoms among those with chronic hives, or create acute symptoms of hives.[191] These responses can be due to allergic reactions to aspirin, or more often due to its effect of inhibiting the COX-1 enzyme.[191][192] Skin reactions may also tie to systemic contraindications, seen with NSAID-precipitated bronchospasm,[191][192] or those with atopy.[193]
Aspirin and other NSAIDs, such as ibuprofen, may delay the healing of skin wounds.[194] Earlier findings from two small, low-quality trials suggested a benefit with aspirin (alongside compression therapy) on venous leg ulcer healing time and leg ulcer size,[195][196][197] however larger, more recent studies of higher quality have been unable to corroborate these outcomes.[198][199] As such, further research is required to clarify the role of aspirin in this context.
Other adverse effects[edit]
Aspirin can induce swelling of skin tissues in some people. In one study, angioedema appeared one to six hours after ingesting aspirin in some of the people. However, when the aspirin was taken alone, it did not cause angioedema in these people; the aspirin had been taken in combination with another NSAID-induced drug when angioedema appeared.[200]
Aspirin causes an increased risk of cerebral microbleeds having the appearance on MRI scans of 5 to 10 mm or smaller, hypointense (dark holes) patches.[201][202]
A study of a group with a mean dosage of aspirin of 270 mg per day estimated an average absolute risk increase in intracerebral hemorrhage (ICH) of 12 events per 10,000 persons.[203] In comparison, the estimated absolute risk reduction in myocardial infarction was 137 events per 10,000 persons, and a reduction of 39 events per 10,000 persons in ischemic stroke.[203] In cases where ICH already has occurred, aspirin use results in higher mortality, with a dose of about 250 mg per day resulting in a relative risk of death within three months after the ICH around 2.5 (95% confidence interval 1.3 to 4.6).[204]
Aspirin and other NSAIDs can cause abnormally high blood levels of potassium by inducing a hyporeninemic hypoaldosteronic state via inhibition of prostaglandin synthesis; however, these agents do not typically cause hyperkalemia by themselves in the setting of normal renal function and euvolemic state.[205]
Use of low-dose aspirin before a surgical procedure has been associated with an increased risk of bleeding events in some patients, however, ceasing aspirin prior to surgery has also been associated with an increase in major adverse cardiac events. An analysis of multiple studies found a three-fold increase in adverse events such as myocardial infarction in patients who ceased aspirin prior to surgery. The analysis found that the risk is dependent on the type of surgery being performed and the patient indication for aspirin use.[206]
On 9 July 2015, the US Food and Drug Administration (FDA) toughened warnings of increased heart attack and stroke risk associated with nonsteroidal anti-inflammatory drugs (NSAID).[207] Aspirin is an NSAID but is not affected by the new warnings.[207]
Overdose[edit]
Aspirin overdose can be acute or chronic. In acute poisoning, a single large dose is taken; in chronic poisoning, higher than normal doses are taken over a period of time. Acute overdose has a mortality rate of 2%. Chronic overdose is more commonly lethal, with a mortality rate of 25%;[208] chronic overdose may be especially severe in children.[209] Toxicity is managed with a number of potential treatments, including activated charcoal, intravenous dextrose and normal saline, sodium bicarbonate, and dialysis.[210] The diagnosis of poisoning usually involves measurement of plasma salicylate, the active metabolite of aspirin, by automated spectrophotometric methods. Plasma salicylate levels in general range from 30 to 100 mg/L after usual therapeutic doses, 50–300 mg/L in people taking high doses and 700–1400 mg/L following acute overdose. Salicylate is also produced as a result of exposure to bismuth subsalicylate, methyl salicylate, and sodium salicylate.[211][212]
Interactions[edit]
Aspirin is known to interact with other drugs. For example, acetazolamide and ammonium chloride are known to enhance the intoxicating effect of salicylates, and alcohol also increases the gastrointestinal bleeding associated with these types of drugs.[166][167] Aspirin is known to displace a number of drugs from protein-binding sites in the blood, including the antidiabetic drugs tolbutamide and chlorpropamide, warfarin, methotrexate, phenytoin, probenecid, valproic acid (as well as interfering with beta oxidation, an important part of valproate metabolism), and other NSAIDs. Corticosteroids may also reduce the concentration of aspirin. Other NSAIDs, such as ibuprofen and naproxen, may reduce the antiplatelet effect of aspirin.[213][214] Although limited evidence suggests this may not result in a reduced cardioprotective effect of aspirin.[213] Analgesic doses of aspirin decrease sodium loss induced by spironolactone in the urine, however this does not reduce the antihypertensive effects of spironolactone.[215] Furthermore, antiplatelet doses of aspirin are deemed too small to produce an interaction with spironolactone.[216] Aspirin is known to compete with penicillin G for renal tubular secretion.[217] Aspirin may also inhibit the absorption of vitamin C.[218][219][unreliable medical source?][220]
Research[edit]
The ISIS-2 trial demonstrated that aspirin at doses of 160 mg daily for one month, decreased the mortality by 21% of participants with a suspected myocardial infarction in the first five weeks.[221] A single daily dose of 324 mg of aspirin for 12 weeks has a highly protective effect against acute myocardial infarction and death in men with unstable angina.[222]
Bipolar disorder[edit]
Aspirin has been repurposed as an add-on treatment for depressive episodes in subjects with bipolar disorder.[133] However, meta-analytic evidence is based on very few studies and does not suggest any efficacy of aspirin in the treatment of bipolar depression.[133] Thus, notwithstanding the biological rationale, the clinical perspectives of aspirin and anti-inflammatory agents in the treatment of bipolar depression remain uncertain.[133]
Infectious diseases[edit]
Several studies investigated the anti-infective properties of aspirin for bacterial, viral and parasitic infections. Aspirin was demonstrated to limit platelet activation induced by Staphylococcus aureus and Enterococcus faecalis and to reduce streptococcal adhesion to heart valves. In patients with tuberculous meningitis, the addition of aspirin reduced the risk of new cerebral infarction [RR = 0.52 (0.29-0.92)]. A role of aspirin on bacterial and fungal biofilm is also being supported by growing evidence.[223]
Cancer prevention[edit]
Aspirin might weakly reduce the risk of breast cancer per a 2020 meta-analysis.[224]
In gardening[edit]
There are a many anecdotal reportings that aspirin can improve plant’s growth and resistance[225][226] though most research involved salicylic acid instead of aspirin.[227]
Veterinary medicine[edit]
Aspirin is sometimes used in veterinary medicine as an anticoagulant or to relieve pain associated with musculoskeletal inflammation or osteoarthritis. Aspirin should only be given to animals under the direct supervision of a veterinarian, as adverse effects—including gastrointestinal issues—are common. An aspirin overdose in any species may result in salicylate poisoning, characterized by hemorrhaging, seizures, coma, and even death.[228]
Dogs are better able to tolerate aspirin than cats are.[229] Cats metabolize aspirin slowly because they lack the glucuronide conjugates that aid in the excretion of aspirin, making it potentially toxic if dosing is not spaced out properly.[228][230] No clinical signs of toxicosis occurred when cats were given 25 mg/kg of aspirin every 48 hours for 4 weeks,[229] but the recommended dose for relief of pain and fever and for treating blood clotting diseases in cats is 10 mg/kg every 48 hours to allow for metabolization.[228][231]
See also[edit]
- Fluoroaspirin
References[edit]
- ^ «Aspirin Use During Pregnancy». Drugs.com. 2 April 2018. Retrieved 29 December 2019.
- ^ https://www.tga.gov.au/resources/publication/publications/otc-medicine-monograph-aspirin-tablets-oral-use
- ^ «Poisons Standard October 2022». Australian Government Federal Register of Legislation. Retrieved 9 January 2023.
- ^ a b «Zorprin, Bayer Buffered Aspirin (aspirin) dosing, indications, interactions, adverse effects, and more». Medscape Reference. WebMD. Archived from the original on 7 April 2014. Retrieved 3 April 2014.
- ^ a b c Brayfield A, ed. (14 January 2014). «Aspirin». Martindale: The Complete Drug Reference. Pharmaceutical Press. Retrieved 3 April 2014.
- ^ CID 2244 from PubChem
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 3.8. ISBN 1-4398-5511-0.
- ^ a b c d e f g h i j k l m n «Aspirin». American Society of Health-System Pharmacists. 29 November 2021. Archived from the original on 25 April 2017 – via Drugs.com.
- ^ a b Jones A (2015). Chemistry: An Introduction for Medical and Health Sciences. John Wiley & Sons. pp. 5–6. ISBN 978-0-470-09290-3.
- ^ Ravina E (2011). The Evolution of Drug Discovery: From Traditional Medicines to Modern Drugs. John Wiley & Sons. p. 24. ISBN 978-3-527-32669-3.
- ^ a b c d e f g h i j Jeffreys D (2008). Aspirin the remarkable story of a wonder drug. Bloomsbury Publishing USA. ISBN 978-1-59691-816-0. Archived from the original on 8 September 2017.: 46–48
- ^ a b Warner TD, Mitchell JA (October 2002). «Cyclooxygenase-3 (COX-3): filling in the gaps toward a COX continuum?». Proceedings of the National Academy of Sciences of the United States of America. 99 (21): 13371–3. Bibcode:2002PNAS…9913371W. doi:10.1073/pnas.222543099. PMC 129677. PMID 12374850.
- ^ World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. 2021. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ «The Top 300 of 2020». US Government. Retrieved 7 October 2022 – via ClinCalc.
- ^ «Aspirin — Drug Usage Statistics, US 2013-2020». ClinCalc. Retrieved 7 October 2022.
- ^ Dick B (2018). «Hard Work and Happenstance». Distillations. Vol. 4, no. 1. Science History Institute. pp. 44–45.
- ^ a b Mann CC, Plummer ML (1991). The aspirin wars: money, medicine, and 100 years of rampant competition (1st ed.). New York: Knopf. p. 27. ISBN 978-0-394-57894-1.
- ^ a b c d e «Aspirin». Chemical & Engineering News. Vol. 83, no. 25. 20 June 2005.
- ^ Reynolds EF, ed. (1982). «Aspirin and similar analgesic and anti-inflammatory agents». Martindale: the extra pharmacopoeia (28th ed.). Rittenhouse Book Distributors. pp. 234–82. ISBN 978-0-85369-160-0.
- ^ «Acetylsalicylic acid». NIOSH Pocket Guide to Chemical Hazards. U.S. National Institute for Occupational Safety and Health (NIOSH). 11 April 2016. Archived from the original on 11 May 2017.
- ^ «Appendix G: 1989 Air contaminants update project – Exposure limits NOT in effect». NIOSH pocket guide to chemical hazards. National Institute for Occupational Safety and Health. 13 February 2015. Archived from the original on 18 June 2017.
- ^ Palleros DR (2000). Experimental organic chemistry. New York: John Wiley & Sons. p. 494. ISBN 978-0-471-28250-1.
- ^ «Chemical of the Week — Acetic Acid and Acetic Anhydride». www.eng.uwaterloo.ca.
- ^ Barrans R (18 May 2008). «Aspirin aging». Newton BBS. Archived from the original on 18 May 2008.
- ^ Carstensen JT, Attarchi F (April 1988). «Decomposition of aspirin in the solid state in the presence of limited amounts of moisture III: Effect of temperature and a possible mechanism». Journal of Pharmaceutical Sciences. 77 (4): 318–21. doi:10.1002/jps.2600770407. PMID 3379589.
- ^ Myers RL (2007). The 100 most important chemical compounds: a reference guide. ABC-CLIO. p. 10. ISBN 978-0-313-33758-1. Archived from the original on 10 June 2013.
- ^ «Acetylsalicylic acid». Jinno Laboratory, School of Materials Science, Toyohashi University of Technology. 4 March 1996. Archived from the original on 20 January 2012. Retrieved 12 April 2014.
- ^ a b Vishweshwar P, McMahon JA, Oliveira M, Peterson ML, Zaworotko MJ (December 2005). «The predictably elusive form II of aspirin». Journal of the American Chemical Society. 127 (48): 16802–3. doi:10.1021/ja056455b. PMID 16316223.
- ^ Bond AD, Boese R, Desiraju GR (2007). «On the polymorphism of aspirin: crystalline aspirin as intergrowths of two «polymorphic» domains». Angewandte Chemie. 46 (4): 618–22. doi:10.1002/anie.200603373. PMID 17139692.
- ^ Vane JR (June 1971). «Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs». Nature. 231 (25): 232–5. doi:10.1038/newbio231232a0. PMID 5284360.
- ^ Vane JR, Botting RM (June 2003). «The mechanism of action of aspirin». Thrombosis Research. 110 (5–6): 255–8. doi:10.1016/s0049-3848(03)00379-7. PMID 14592543.
- ^ «The Nobel Prize in Physiology or Medicine 1982». Nobelprize.org. Archived from the original on 27 June 2017.
- ^ «Aspirin in heart attack and stroke prevention». American Heart Association. Archived from the original on 31 March 2008. Retrieved 8 May 2008.
- ^ Tohgi H, Konno S, Tamura K, Kimura B, Kawano K (October 1992). «Effects of low-to-high doses of aspirin on platelet aggregability and metabolites of thromboxane A2 and prostacyclin». Stroke. 23 (10): 1400–3. doi:10.1161/01.STR.23.10.1400. PMID 1412574.
- ^ Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, et al. (May 2009). «Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials». Lancet. 373 (9678): 1849–60. doi:10.1016/S0140-6736(09)60503-1. PMC 2715005. PMID 19482214.
- ^ Goel A, Aggarwal S, Partap S, Saurabh A, Choudhary (2012). «Pharmacokinetic solubility and dissolution profile of antiarrythmic drugs». Int J Pharma Prof Res. 3 (1): 592–601.
- ^ Martínez-González J, Badimon L (2007). «Mechanisms underlying the cardiovascular effects of COX-inhibition: benefits and risks». Current Pharmaceutical Design. 13 (22): 2215–27. doi:10.2174/138161207781368774. PMID 17691994.
- ^ Funk CD, FitzGerald GA (November 2007). «COX-2 inhibitors and cardiovascular risk». Journal of Cardiovascular Pharmacology. 50 (5): 470–9. doi:10.1097/FJC.0b013e318157f72d. PMID 18030055. S2CID 39103383.
- ^ Romano M, Cianci E, Simiele F, Recchiuti A (August 2015). «Lipoxins and aspirin-triggered lipoxins in resolution of inflammation». European Journal of Pharmacology. 760: 49–63. doi:10.1016/j.ejphar.2015.03.083. PMID 25895638.
- ^ Serhan CN, Chiang N (August 2013). «Resolution phase lipid mediators of inflammation: agonists of resolution». Current Opinion in Pharmacology. 13 (4): 632–40. doi:10.1016/j.coph.2013.05.012. PMC 3732499. PMID 23747022.
- ^ Weylandt KH (August 2016). «Docosapentaenoic acid derived metabolites and mediators — The new world of lipid mediator medicine in a nutshell». European Journal of Pharmacology. 785: 108–115. doi:10.1016/j.ejphar.2015.11.002. PMID 26546723.
- ^
- ^ Paul-Clark MJ, Van Cao T, Moradi-Bidhendi N, Cooper D, Gilroy DW (July 2004). «15-epi-lipoxin A4-mediated induction of nitric oxide explains how aspirin inhibits acute inflammation». The Journal of Experimental Medicine. 200 (1): 69–78. doi:10.1084/jem.20040566. PMC 2213311. PMID 15238606.
- ^ McCarty MF, Block KI (September 2006). «Preadministration of high-dose salicylates, suppressors of NF-kappaB activation, may increase the chemosensitivity of many cancers: an example of proapoptotic signal modulation therapy». Integrative Cancer Therapies. 5 (3): 252–68. doi:10.1177/1534735406291499. PMID 16880431.
- ^ Silva Caldas AP, Chaves LO, Linhares Da Silva L, De Castro Morais D, Gonçalves Alfenas RD (29 December 2017). «Mechanisms involved in the cardioprotective effect of avocado consumption: A systematic review». International Journal of Food Properties. 20 (sup2): 1675–1685. doi:10.1080/10942912.2017.1352601. ISSN 1094-2912.
…there was postprandial reduction on the plasma concentration of IL-6 and IkBα preservation, followed by the lower activation of NFκB, considered the main transcription factor capable of inducing inflammatory response by stimulating the expression of proinflammatory cytokines, chemokines, and adhesion molecules.
- ^ Chen L, Deng H, Cui H, Fang J, Zuo Z, Deng J, et al. (January 2018). «Inflammatory responses and inflammation-associated diseases in organs». Oncotarget. 9 (6): 7204–7218. doi:10.18632/oncotarget.23208. PMC 5805548. PMID 29467962.
- ^ Lawrence T (December 2009). «The nuclear factor NF-kappaB pathway in inflammation». Cold Spring Harbor Perspectives in Biology. 1 (6): a001651. doi:10.1101/cshperspect.a001651. PMC 2882124. PMID 20457564.
- ^ Hawley SA, Fullerton MD, Ross FA, Schertzer JD, Chevtzoff C, Walker KJ, et al. (May 2012). «The ancient drug salicylate directly activates AMP-activated protein kinase». Science. 336 (6083): 918–22. Bibcode:2012Sci…336..918H. doi:10.1126/science.1215327. PMC 3399766. PMID 22517326.
- ^ «Clues to aspirin’s anti-cancer effects revealed». New Scientist. 214 (2862): 16. 28 April 2012. doi:10.1016/S0262-4079(12)61073-2.
- ^ Alfonso LF, Srivenugopal KS, Arumugam TV, Abbruscato TJ, Weidanz JA, Bhat GJ (March 2009). «Aspirin inhibits camptothecin-induced p21CIP1 levels and potentiates apoptosis in human breast cancer cells». International Journal of Oncology. 34 (3): 597–608. doi:10.3892/ijo_00000185. PMID 19212664.
- ^ Alfonso LF, Srivenugopal KS, Bhat GJ (2009). «Does aspirin acetylate multiple cellular proteins? (Review)». Molecular Medicine Reports (review). 2 (4): 533–7. doi:10.3892/mmr_00000132. PMID 21475861.
- ^ Alfonso LF, Srivenugopal KS, Bhat GJ (4 June 2009). «Does aspirin acetylate multiple cellular proteins? (Review)». Molecular Medicine Reports. 2 (4): 533–537. doi:10.3892/mmr_00000132. PMID 21475861.
- ^ Franchi F, Schneider D, Prats J, Fan W, Rollini F, Been L, et al. (2021). «TCT-320 Pharmacokinetic and Pharmacodynamic Profile of PL-ASA, a Novel Phospholipid-Aspirin Complex Liquid Formulation, Compared to Enteric-Coated Aspirin at an 81-mg Dose – Results From a Prospective, Randomized, Crossover Study». Journal of the American College of Cardiology. Elsevier BV. 78 (19): B131. doi:10.1016/j.jacc.2021.09.1173. ISSN 0735-1097.
- ^ Ferguson RK, Boutros AR (August 1970). «Death following self-poisoning with aspirin». JAMA. 213 (7): 1186–8. doi:10.1001/jama.213.7.1186. PMID 5468267.
- ^ Kaufman FL, Dubansky AS (April 1972). «Darvon poisoning with delayed salicylism: a case report». Pediatrics. 49 (4): 610–1. doi:10.1542/peds.49.4.610. PMID 5013423. S2CID 29427204.
- ^ a b c Levy G, Tsuchiya T (August 1972). «Salicylate accumulation kinetics in man». The New England Journal of Medicine. 287 (9): 430–2. doi:10.1056/NEJM197208312870903. PMID 5044917.
- ^ Grootveld M, Halliwell B (January 1988). «2,3-Dihydroxybenzoic acid is a product of human aspirin metabolism». Biochemical Pharmacology. 37 (2): 271–80. doi:10.1016/0006-2952(88)90729-0. PMID 3342084.
- ^ Hartwig-Otto H (November 1983). «Pharmacokinetic considerations of common analgesics and antipyretics». The American Journal of Medicine. 75 (5A): 30–7. doi:10.1016/0002-9343(83)90230-9. PMID 6606362.
- ^ Done AK (November 1960). «Salicylate intoxication. Significance of measurements of salicylate in blood in cases of acute ingestion». Pediatrics. 26: 800–7. doi:10.1542/peds.26.5.800. PMID 13723722. S2CID 245036862.
- ^ Chyka PA, Erdman AR, Christianson G, Wax PM, Booze LL, Manoguerra AS, et al. (2007). «Salicylate poisoning: an evidence-based consensus guideline for out-of-hospital management». Clinical Toxicology. 45 (2): 95–131. doi:10.1080/15563650600907140. PMID 17364628.
- ^ Prescott LF, Balali-Mood M, Critchley JA, Johnstone AF, Proudfoot AT (November 1982). «Diuresis or urinary alkalinisation for salicylate poisoning?». British Medical Journal. 285 (6352): 1383–6. doi:10.1136/bmj.285.6352.1383. PMC 1500395. PMID 6291695.
- ^ Dargan PI, Wallace CI, Jones AL (May 2002). «An evidence based flowchart to guide the management of acute salicylate (aspirin) overdose». Emergency Medicine Journal. 19 (3): 206–9. doi:10.1136/emj.19.3.206. PMC 1725844. PMID 11971828.
- ^ a b D’Agati V (July 1996). «Does aspirin cause acute or chronic renal failure in experimental animals and in humans?». American Journal of Kidney Diseases. 28 (1 Suppl 1): S24-9. doi:10.1016/s0272-6386(96)90565-x. PMID 8669425.
- ^ Goldberg DR (Summer 2009). «Aspirin: Turn of the Century Miracle Drug». Chemical Heritage. Vol. 27, no. 2. pp. 26–30.
- ^ Schiebinger L (October 2003). «Women’s health and clinical trials». The Journal of Clinical Investigation. 112 (7): 973–7. doi:10.1172/JCI19993. PMC 198535. PMID 14523031.
- ^ «Regular aspirin intake and acute myocardial infarction». British Medical Journal. 1 (5905): 440–3. March 1974. doi:10.1136/bmj.1.5905.440. PMC 1633212. PMID 4816857.
- ^ Elwood PC, Cochrane AL, Burr ML, Sweetnam PM, Williams G, Welsby E, et al. (March 1974). «A randomized controlled trial of acetyl salicylic acid in the secondary prevention of mortality from myocardial infarction». British Medical Journal. 1 (5905): 436–40. doi:10.1136/bmj.1.5905.436. PMC 1633246. PMID 4593555.
- ^ Bayer Co. v. United Drug Co., 272 F. 505, p.512 (S.D.N.Y 1921).
- ^ «Has aspirin become a generic trademark?». genericides.org. 25 March 2020. Archived from the original on 5 March 2021. Retrieved 17 February 2021.
- ^ Huth EJ, et al. (CBE Style Manual Committee) (1994). Scientific style and format: the CBE manual for authors, editors, and publishers. Cambridge University Press. p. 164. Bibcode:1994ssfc.book…..S. ISBN 978-0-521-47154-1. Archived from the original on 15 October 2015.
- ^ «Aspirin: the versatile drug». CBC News. 28 May 2009. Archived from the original on 6 November 2016.
- ^ Cheng TO (2007). «The history of aspirin». Texas Heart Institute Journal. 34 (3): 392–3. PMC 1995051. PMID 17948100.
- ^ «Aspirin». Sigma Aldrich. Retrieved 24 January 2022.
- ^ «Index BP 2009» (PDF). British Pharmacopoeia. Archived from the original (PDF) on 11 April 2009. Retrieved 13 July 2009.
- ^
This article incorporates text from this source, which is in the public domain: «Aspirin for reducing your risk of heart attack and stroke: know the facts». U.S. Food and Drug Administration (FDA). Archived from the original on 14 August 2012. Retrieved 26 July 2012.
- ^
This article incorporates text from this source, which is in the public domain: «Aspirin for the prevention of cardiovascular disease». U.S. Preventive Services Task Force. Archived from the original on 11 July 2012. Retrieved 26 July 2012.
- ^ Seshasai SR, Wijesuriya S, Sivakumaran R, Nethercott S, Erqou S, Sattar N, et al. (February 2012). «Effect of aspirin on vascular and nonvascular outcomes: meta-analysis of randomized controlled trials». Archives of Internal Medicine. 172 (3): 209–16. doi:10.1001/archinternmed.2011.628. hdl:10044/1/34287. PMID 22231610.
- ^ McNeil JJ, Woods RL, Nelson MR, Reid CM, Kirpach B, Wolfe R, et al. (October 2018). «Effect of Aspirin on Disability-free Survival in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1499–1508. doi:10.1056/NEJMoa1800722. hdl:1885/154654. PMC 6426126. PMID 30221596.
- ^ McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR, et al. (October 2018). «Effect of Aspirin on Cardiovascular Events and Bleeding in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1509–1518. doi:10.1056/NEJMoa1805819. PMC 6289056. PMID 30221597.
- ^ a b Algra AM, Rothwell PM (May 2012). «Effects of regular aspirin on long-term cancer incidence and metastasis: a systematic comparison of evidence from observational studies versus randomised trials». The Lancet. Oncology. 13 (5): 518–27. doi:10.1016/S1470-2045(12)70112-2. PMID 22440112.
- ^ Davidson KW, Barry MJ, Mangione CM, Cabana M, Chelmow D, Coker TR, et al. (April 2022). «Aspirin Use to Prevent Cardiovascular Disease: US Preventive Services Task Force Recommendation Statement». JAMA. 327 (16): 1577–1584. doi:10.1001/jama.2022.4983. PMID 35471505. S2CID 248390304.
- ^ Sachs CJ (March 2005). «Oral analgesics for acute nonspecific pain». American Family Physician. 71 (5): 913–8. PMID 15768621.
- ^ Gaciong Z (June 2003). «The real dimension of analgesic activity of aspirin». Thrombosis Research. 110 (5–6): 361–4. doi:10.1016/j.thromres.2003.08.009. PMID 14592563.
- ^ Derry CJ, Derry S, Moore RA (December 2014). «Caffeine as an analgesic adjuvant for acute pain in adults». The Cochrane Database of Systematic Reviews. 2014 (12): CD009281. doi:10.1002/14651858.CD009281.pub3. PMC 6485702. PMID 25502052.
- ^ Hersh EV, Moore PA, Ross GL (May 2000). «Over-the-counter analgesics and antipyretics: a critical assessment». Clinical Therapeutics. 22 (5): 500–48. doi:10.1016/S0149-2918(00)80043-0. PMID 10868553.
- ^ Mett A, Tfelt-Hansen P (June 2008). «Acute migraine therapy: recent evidence from randomized comparative trials». Current Opinion in Neurology. 21 (3): 331–7. doi:10.1097/WCO.0b013e3282fee843. PMID 18451718. S2CID 44459366.
- ^ Kingery WS (November 1997). «A critical review of controlled clinical trials for peripheral neuropathic pain and complex regional pain syndromes». Pain. 73 (2): 123–139. doi:10.1016/S0304-3959(97)00049-3. PMID 9415498. S2CID 10418793.
- ^ Loder E, Rizzoli P (January 2008). «Tension-type headache». BMJ. 336 (7635): 88–92. doi:10.1136/bmj.39412.705868.AD. PMC 2190284. PMID 18187725.
- ^ Gilmore B, Michael M (February 2011). «Treatment of acute migraine headache». American Family Physician. 83 (3): 271–80. PMID 21302868.
- ^ Bartfai T, Conti B (March 2010). «Fever». TheScientificWorldJournal. 10: 490–503. doi:10.1100/tsw.2010.50. PMC 2850202. PMID 20305990.
- ^ Pugliese A, Beltramo T, Torre D (October 2008). «Reye’s and Reye’s-like syndromes». Cell Biochemistry and Function. 26 (7): 741–6. doi:10.1002/cbf.1465. PMID 18711704. S2CID 22361194.
- ^ Beutler AI, Chesnut GT, Mattingly JC, Jamieson B (December 2009). «FPIN’s Clinical Inquiries. Aspirin use in children for fever or viral syndromes». American Family Physician. 80 (12): 1472. PMID 20000310.
- ^ «Medications Used to Treat Fever». American Academy of Pediatrics. Archived from the original on 18 February 2013. Retrieved 25 November 2012.
- ^ «51 FR 8180» (PDF). United States Federal Register. 51 (45). 7 March 1986. Archived from the original (PDF) on 19 August 2011.
- ^ Morris T, Stables M, Hobbs A, de Souza P, Colville-Nash P, Warner T, et al. (August 2009). «Effects of low-dose aspirin on acute inflammatory responses in humans». Journal of Immunology. 183 (3): 2089–96. doi:10.4049/jimmunol.0900477. PMID 19597002.
- ^ National Clinical Guideline Centre (UK) (July 2013). «Myocardial infarction with ST-segment elevation: the acute management of myocardial infarction with ST-segment elevation [Internet]». NICE Clinical Guidelines (167). 17.2 Aspirin. PMID 25340241. Archived from the original on 31 December 2015.
- ^ a b c Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. (September 2019). «2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines». Journal of the American College of Cardiology. 74 (10): e177–e232. doi:10.1016/j.jacc.2019.03.010. PMC 7685565. PMID 30894318.
- ^ Smith RJ, Bryant RG (October 1975). «Metal substitutions incarbonic anhydrase: a halide ion probe study». Biochemical and Biophysical Research Communications. 66 (4): 1281–1286. doi:10.1016/0006-291x(75)90498-2. ISSN 0006-291X. PMC 9650581. PMID 3.
- ^ a b c Rothwell PM, Cook NR, Gaziano JM, Price JF, Belch JF, Roncaglioni MC, et al. (August 2018). «Effects of aspirin on risks of vascular events and cancer according to bodyweight and dose: analysis of individual patient data from randomised trials». Lancet. 392 (10145): 387–399. doi:10.1016/S0140-6736(18)31133-4. PMC 6083400. PMID 30017552.
- ^ Bowman L, Mafham M, Wallendszus K, Stevens W, Buck G, Barton J, et al. (October 2018). «Effects of Aspirin for Primary Prevention in Persons with Diabetes Mellitus». The New England Journal of Medicine. 379 (16): 1529–1539. doi:10.1056/NEJMoa1804988. PMID 30146931.
- ^ McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR, et al. (October 2018). «Effect of Aspirin on Cardiovascular Events and Bleeding in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1509–1518. doi:10.1056/NEJMoa1805819. PMC 6289056. PMID 30221597.
- ^ Woods RL, Polekhina G, Wolfe R, Nelson MR, Ernst ME, Reid CM, et al. (March 2020). «No Modulation of the Effect of Aspirin by Body Weight in Healthy Older Men and Women». Circulation. 141 (13): 1110–1112. doi:10.1161/CIRCULATIONAHA.119.044142. PMC 7286412. PMID 32223674.
- ^ National Guideline Clearinghouse (NGC). «2011 ACCF/AHA/SCAI guideline for percutaneous coronary artery intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions». United States Agency for Healthcare Research and Quality (AHRQ). Archived from the original on 13 August 2012. Retrieved 28 August 2012.
- ^ Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK (August 2001). «Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation» (PDF). The New England Journal of Medicine. 345 (7): 494–502. doi:10.1056/nejmoa010746. PMID 11519503.
- ^ Costa F, Vranckx P, Leonardi S, Moscarella E, Ando G, Calabro P, et al. (May 2015). «Impact of clinical presentation on ischaemic and bleeding outcomes in patients receiving 6- or 24-month duration of dual-antiplatelet therapy after stent implantation: a pre-specified analysis from the PRODIGY (Prolonging Dual-Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia) trial». European Heart Journal. 36 (20): 1242–51. doi:10.1016/s0735-1097(15)61590-x. PMID 25718355.
- ^ Khan SU, Singh M, Valavoor S, Khan MU, Lone AN, Khan MZ, et al. (October 2020). «Dual Antiplatelet Therapy After Percutaneous Coronary Intervention and Drug-Eluting Stents: A Systematic Review and Network Meta-Analysis». Circulation. 142 (15): 1425–1436. doi:10.1161/CIRCULATIONAHA.120.046308. PMC 7547897. PMID 32795096.
- ^ Capodanno D, Alfonso F, Levine GN, Valgimigli M, Angiolillo DJ (December 2018). «ACC/AHA Versus ESC Guidelines on Dual Antiplatelet Therapy: JACC Guideline Comparison». Journal of the American College of Cardiology. 72 (23 Pt A): 2915–2931. doi:10.1016/j.jacc.2018.09.057. PMID 30522654.
- ^ Levine GN, Bates ER, Bittl JA, Brindis RG, Fihn SD, Fleisher LA, et al. (September 2016). «2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines». Journal of the American College of Cardiology. 68 (10): 1082–115. doi:10.1016/j.jacc.2016.03.513. PMID 27036918.
- ^ Valgimigli M, Bueno H, Byrne RA, Collet JP, Costa F, Jeppsson A, et al. (January 2018). «2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS)». European Heart Journal. 39 (3): 213–260. doi:10.1093/eurheartj/ehx419. PMID 28886622.
- ^ a b Visseren FL, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. (September 2021). «2021 ESC Guidelines on cardiovascular disease prevention in clinical practice». European Heart Journal. 42 (34): 3227–3337. doi:10.1093/eurheartj/ehab484. PMID 34458905.
- ^ Norris JW (September 2005). «Antiplatelet agents in secondary prevention of stroke: a perspective». Stroke. 36 (9): 2034–6. doi:10.1161/01.STR.0000177887.14339.46. PMID 16100022.
- ^ Sleight P, Pouleur H, Zannad F (July 2006). «Benefits, challenges, and registerability of the polypill». European Heart Journal. 27 (14): 1651–6. doi:10.1093/eurheartj/ehi841. PMID 16603580.
- ^ Wang TH, Bhatt DL, Topol EJ (March 2006). «Aspirin and clopidogrel resistance: an emerging clinical entity». European Heart Journal. 27 (6): 647–54. doi:10.1093/eurheartj/ehi684. PMID 16364973.
- ^ Oliveira DC, Silva RF, Silva DJ, Lima VC (September 2010). «Aspirin resistance: fact or fiction?». Arquivos Brasileiros de Cardiologia. 95 (3): e91-4. doi:10.1590/S0066-782X2010001300024. PMID 20944898.
- ^ Topçuoglu MA, Arsava EM, Ay H (February 2011). «Antiplatelet resistance in stroke». Expert Review of Neurotherapeutics. 11 (2): 251–63. doi:10.1586/ern.10.203. PMC 3086673. PMID 21306212.
- ^ Ben-Dor I, Kleiman NS, Lev E (July 2009). «Assessment, mechanisms, and clinical implication of variability in platelet response to aspirin and clopidogrel therapy». The American Journal of Cardiology. 104 (2): 227–33. doi:10.1016/j.amjcard.2009.03.022. PMID 19576352.
- ^
This article incorporates text from this source, which is in the public domain: «Recommendation: Aspirin Use to Prevent Cardiovascular Disease: Preventive Medication». United States Preventive Services Taskforce. 23 November 2020. Retrieved 5 May 2022.
- ^ Davidson KW, Barry MJ, Mangione CM, Cabana M, Chelmow D, Coker TR, et al. (April 2022). «Aspirin Use to Prevent Cardiovascular Disease: US Preventive Services Task Force Recommendation Statement». JAMA. 327 (16): 1577–1584. doi:10.1001/jama.2022.4983. PMID 35471505.
- ^ Allison Aubrey; Will Stone (26 April 2022). «Older adults shouldn’t start a routine of daily aspirin, task force says». NPR.
- ^ a b Cuzick J, Thorat MA, Bosetti C, Brown PH, Burn J, Cook NR, et al. (January 2015). «Estimates of benefits and harms of prophylactic use of aspirin in the general population». Annals of Oncology. 26 (1): 47–57. doi:10.1093/annonc/mdu225. PMC 4269341. PMID 25096604.
- ^ Manzano A, Pérez-Segura P (29 April 2012). «Colorectal cancer chemoprevention: is this the future of colorectal cancer prevention?». TheScientificWorldJournal. 2012: 327341. doi:10.1100/2012/327341. PMC 3353298. PMID 22649288.
- ^ Chan AT, Arber N, Burn J, Chia WK, Elwood P, Hull MA, et al. (February 2012). «Aspirin in the chemoprevention of colorectal neoplasia: an overview». Cancer Prevention Research. 5 (2): 164–78. doi:10.1158/1940-6207.CAPR-11-0391. PMC 3273592. PMID 22084361.
- ^ Thun MJ, Jacobs EJ, Patrono C (April 2012). «The role of aspirin in cancer prevention». Nature Reviews. Clinical Oncology. 9 (5): 259–67. doi:10.1038/nrclinonc.2011.199. PMID 22473097. S2CID 3332999.
- ^ Richman IB, Owens DK (July 2017). «Aspirin for Primary Prevention». The Medical Clinics of North America (Review). 101 (4): 713–724. doi:10.1016/j.mcna.2017.03.004. PMID 28577622.
- ^ Verdoodt F, Friis S, Dehlendorff C, Albieri V, Kjaer SK (February 2016). «Non-steroidal anti-inflammatory drug use and risk of endometrial cancer: A systematic review and meta-analysis of observational studies». Gynecologic Oncology. 140 (2): 352–8. doi:10.1016/j.ygyno.2015.12.009. PMID 26701413.
- ^ Bosetti C, Rosato V, Gallus S, Cuzick J, La Vecchia C (June 2012). «Aspirin and cancer risk: a quantitative review to 2011». Annals of Oncology. 23 (6): 1403–15. doi:10.1093/annonc/mds113. PMID 22517822.
- ^ Sutcliffe P, Connock M, Gurung T, Freeman K, Johnson S, Kandala NB, et al. (September 2013). «Aspirin for prophylactic use in the primary prevention of cardiovascular disease and cancer: a systematic review and overview of reviews». Health Technology Assessment. 17 (43): 1–253. doi:10.3310/hta17430. PMC 4781046. PMID 24074752.
- ^ Kim SE (2014). «The benefit-risk consideration in long-term use of alternate-day, low dose aspirin: focus on colorectal cancer prevention». Annals of Gastroenterology. 27 (1): 87–88. PMC 3959543. PMID 24714632.
- ^ U.S. Preventive Services Task Force (March 2007). «Routine aspirin or nonsteroidal anti-inflammatory drugs for the primary prevention of colorectal cancer: U.S. Preventive Services Task Force recommendation statement». Annals of Internal Medicine. 146 (5): 361–4. doi:10.7326/0003-4819-146-5-200703060-00008. PMID 17339621.
- ^ Bibbins-Domingo K (June 2016). «Aspirin Use for the Primary Prevention of Cardiovascular Disease and Colorectal Cancer: U.S. Preventive Services Task Force Recommendation Statement». Annals of Internal Medicine. 164 (12): 836–45. doi:10.7326/m16-0577. PMID 27064677.
- Lay summary in: «Who developed these recommendations?». Annals of Internal Medicine. 21 June 2016.
- ^ Bosetti C, Santucci C, Gallus S, Martinetti M, La Vecchia C (May 2020). «Aspirin and the risk of colorectal and other digestive tract cancers: an updated meta-analysis through 2019». Annals of Oncology. 31 (5): 558–568. doi:10.1016/j.annonc.2020.02.012. PMID 32272209.
The present comprehensive meta-analysis supports and further quantifies the inverse association between regular aspirin use and the risk of colorectal and other digestive tract cancers, including some rare ones. The favorable effect of aspirin increases with longer duration of use, and, for colorectal cancer, with increasing dose.
- ^ McNeil JJ, Nelson MR, Woods RL, Lockery JE, Wolfe R, Reid CM, et al. (October 2018). «Effect of Aspirin on All-Cause Mortality in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1519–1528. doi:10.1056/NEJMoa1803955. PMC 6433466. PMID 30221595.
- ^ a b c d e f Bartoli F, Cavaleri D, Bachi B, Moretti F, Riboldi I, Crocamo C, et al. (September 2021). «Repurposed drugs as adjunctive treatments for mania and bipolar depression: A meta-review and critical appraisal of meta-analyses of randomized placebo-controlled trials». Journal of Psychiatric Research. 143: 230–238. doi:10.1016/j.jpsychires.2021.09.018. PMID 34509090. S2CID 237485915.
- ^ Li H, Li W, Zhang X, Ma XC, Zhang RW (4 February 2021). «Aspirin Use on Incident Dementia and Mild Cognitive Decline: A Systematic Review and Meta-Analysis». Frontiers in Aging Neuroscience. 12: 578071. doi:10.3389/fnagi.2020.578071. PMC 7890199. PMID 33613260.
- ^ Veronese N, Stubbs B, Maggi S, Thompson T, Schofield P, Muller C, et al. (August 2017). «Low-Dose Aspirin Use and Cognitive Function in Older Age: A Systematic Review and Meta-analysis». Journal of the American Geriatrics Society. 65 (8): 1763–1768. doi:10.1111/jgs.14883. PMC 6810633. PMID 28425093.
- ^ Schmidt L, Phelps E, Friedel J, Shokraneh F (August 2019). «Acetylsalicylic acid (aspirin) for schizophrenia». The Cochrane Database of Systematic Reviews. 2019 (8): CD012116. doi:10.1002/14651858.CD012116.pub2. PMC 6699651. PMID 31425623.
- ^ a b National Heart Foundation of Australia (RF/RHD guideline development working group) and the Cardiac Society of Australia and New Zealand (2006). «Diagnosis and management of acute rheumatic fever and rheumatic heart disease in Australia. An evidence-based review» (PDF). National Heart Foundation of Australia. pp. 33–37. Archived from the original (PDF) on 26 July 2008.
- ^ Saxena A, Kumar RK, Gera RP, Radhakrishnan S, Mishra S, Ahmed Z (July 2008). «Consensus guidelines on pediatric acute rheumatic fever and rheumatic heart disease». Indian Pediatrics. 45 (7): 565–73. PMID 18695275.
- ^ Hashkes PJ, Tauber T, Somekh E, Brik R, Barash J, Mukamel M, et al. (September 2003). «Naproxen as an alternative to aspirin for the treatment of arthritis of rheumatic fever: a randomized trial». The Journal of Pediatrics. 143 (3): 399–401. doi:10.1067/S0022-3476(03)00388-3. PMID 14517527.
- ^ Rowley AH, Shulman ST (February 2010). «Pathogenesis and management of Kawasaki disease». Expert Review of Anti-Infective Therapy. 8 (2): 197–203. doi:10.1586/eri.09.109. PMC 2845298. PMID 20109049.
- ^ Baumer JH, Love SJ, Gupta A, Haines LC, Maconochie I, Dua JS (October 2006). «Salicylate for the treatment of Kawasaki disease in children». The Cochrane Database of Systematic Reviews. 2010 (4): CD004175. doi:10.1002/14651858.CD004175.pub2. PMC 8765111. PMID 17054199.
- ^ Duley L, Meher S, Hunter KE, Seidler AL, Askie LM (October 2019). «Antiplatelet agents for preventing pre-eclampsia and its complications». The Cochrane Database of Systematic Reviews. 2019 (10). doi:10.1002/14651858.CD004659.pub3. PMC 6820858. PMID 31684684.
- ^ Roberge S, Villa P, Nicolaides K, Giguère Y, Vainio M, Bakthi A, et al. (2012). «Early administration of low-dose aspirin for the prevention of preterm and term preeclampsia: a systematic review and meta-analysis». Fetal Diagnosis and Therapy. 31 (3): 141–6. doi:10.1159/000336662. PMID 22441437. S2CID 26372982.
- ^ Roberge S, Nicolaides K, Demers S, Hyett J, Chaillet N, Bujold E (February 2017). «The role of aspirin dose on the prevention of preeclampsia and fetal growth restriction: systematic review and meta-analysis». American Journal of Obstetrics and Gynecology. 216 (2): 110–120.e6. doi:10.1016/j.ajog.2016.09.076. PMID 27640943. S2CID 3079979.
- ^ Szabó B, Németh K, Mészáros K, Krokker L, Likó I, Saskői E, et al. (5 September 2022). «Aspirin Mediates Its Antitumoral Effect Through Inhibiting PTTG1 in Pituitary Adenoma». The Journal of Clinical Endocrinology and Metabolism. 107 (11): 3066–3079. doi:10.1210/clinem/dgac496. PMC 9681612. PMID 36059148.
- ^ Dorsch MP, Lee JS, Lynch DR, Dunn SP, Rodgers JE, Schwartz T, et al. (May 2007). «Aspirin resistance in patients with stable coronary artery disease with and without a history of myocardial infarction». The Annals of Pharmacotherapy. 41 (5): 737–41. doi:10.1345/aph.1H621. PMID 17456544. S2CID 22245507.
- ^ a b Krasopoulos G, Brister SJ, Beattie WS, Buchanan MR (January 2008). «Aspirin «resistance» and risk of cardiovascular morbidity: systematic review and meta-analysis». BMJ. 336 (7637): 195–8. doi:10.1136/bmj.39430.529549.BE. PMC 2213873. PMID 18202034.
- ^ Pignatelli P, Di Santo S, Barillà F, Gaudio C, Violi F (October 2008). «Multiple anti-atherosclerotic treatments impair aspirin compliance: effects on aspirin resistance». Journal of Thrombosis and Haemostasis. 6 (10): 1832–4. doi:10.1111/j.1538-7836.2008.03122.x. PMID 18680540. S2CID 1776526.
- ^ Grosser T, Fries S, Lawson JA, Kapoor SC, Grant GR, FitzGerald GA (January 2013). «Drug resistance and pseudoresistance: an unintended consequence of enteric coating aspirin». Circulation. 127 (3): 377–85. doi:10.1161/CIRCULATIONAHA.112.117283. PMC 3552520. PMID 23212718.
- Lay summary in: Thomas K (4 December 2012). «Study Raises Questions on Coating of Aspirin». The New York Times.
- ^ Li J, Song M, Jian Z, Guo W, Chen G, Jiang G, et al. (2014). «Laboratory aspirin resistance and the risk of major adverse cardiovascular events in patients with coronary heart disease on confirmed aspirin adherence». Journal of Atherosclerosis and Thrombosis. 21 (3): 239–47. doi:10.5551/jat.19521. PMID 24201035.
- ^ Sofi F, Marcucci R, Gori AM, Abbate R, Gensini GF (August 2008). «Residual platelet reactivity on aspirin therapy and recurrent cardiovascular events—a meta-analysis». International Journal of Cardiology. 128 (2): 166–71. doi:10.1016/j.ijcard.2007.12.010. hdl:2158/323452. PMID 18242733.
- ^ Shim EJ, Ryu CW, Park S, Lee HN, Shin HS, Kim SB (October 2018). «Relationship between adverse events and antiplatelet drug resistance in neurovascular intervention: a meta-analysis». Journal of NeuroInterventional Surgery. 10 (10): 942–948. doi:10.1136/neurintsurg-2017-013632. PMID 29352056. S2CID 38147668.
- ^ Fiolaki A, Katsanos AH, Kyritsis AP, Papadaki S, Kosmidou M, Moschonas IC, et al. (May 2017). «High on treatment platelet reactivity to aspirin and clopidogrel in ischemic stroke: A systematic review and meta-analysis». Journal of the Neurological Sciences. 376: 112–116. doi:10.1016/j.jns.2017.03.010. PMID 28431593. S2CID 3485236.
- ^ Snoep JD, Hovens MM, Eikenboom JC, van der Bom JG, Huisman MV (13 August 2007). «Association of laboratory-defined aspirin resistance with a higher risk of recurrent cardiovascular events: a systematic review and meta-analysis». Archives of Internal Medicine. 167 (15): 1593–9. doi:10.1001/archinte.167.15.1593. PMID 17698681.
- ^ a b van Oosterom N, Barras M, Bird R, Nusem I, Cottrell N (December 2020). «A Narrative Review of Aspirin Resistance in VTE Prophylaxis for Orthopaedic Surgery». Drugs. 80 (18): 1889–1899. doi:10.1007/s40265-020-01413-w. PMID 33037568. S2CID 222234431.
- ^ «Invention of the safety cap». digitaldukemed.mc.duke.edu. Archived from the original on 4 March 2016. Retrieved 4 September 2015.
- ^ a b British National Formulary (45 ed.). British Medical Journal and Royal Pharmaceutical Society of Great Britain. 2003.
- ^ «Aspirin monograph: dosages, etc». Medscape.com. Retrieved 11 May 2011.
- ^ US Preventive Services Task Force (March 2009). «Aspirin for the prevention of cardiovascular disease: U.S. Preventive Services Task Force recommendation statement». Annals of Internal Medicine. 150 (6): 396–404. doi:10.7326/0003-4819-150-6-200903170-00008. PMID 19293072.
- ^ a b «Aspirin: more evidence that low dose is all that is needed». Medscape. Medscape CME. Retrieved 11 May 2011.
- ^ Berger JS, Brown DL, Burke GL, Oberman A, Kostis JB, Langer RD, et al. (March 2009). «Aspirin Use, Dose, and Clinical Outcomes in Postmenopausal Women With Stable Cardiovascular Disease». Circulation: Cardiovascular Quality and Outcomes. 2 (2): 78–87. doi:10.1161/circoutcomes.108.791269. ISSN 1941-7713. PMC 2801891. PMID 20031819.
- ^ Sacristán JA (August 2021). «Aspirin Dosing in Cardiovascular Disease». New England Journal of Medicine. 385 (8): 764–765. doi:10.1056/nejmc2110476. ISSN 0028-4793. PMID 34407352.
- ^ British National Formulary for Children. British Medical Journal and Royal Pharmaceutical Society. 2006.
- ^ a b
This article incorporates text from this source, which is in the public domain: «FDA Warns that Using a Type of Pain and Fever Medication in Second Half of Pregnancy Could Lead to Complications». U.S. Food and Drug Administration (FDA) (Press release). 15 October 2020. Retrieved 15 October 2020.
- ^ a b c
This article incorporates text from this source, which is in the public domain: «NSAIDs may cause rare kidney problems in unborn babies». U.S. Food and Drug Administration. 21 July 2017. Retrieved 15 October 2020.
- ^ a b c d e «Aspirin information from Drugs.com». Drugs.com. Archived from the original on 9 May 2008. Retrieved 8 May 2008.
- ^ a b c «Oral Aspirin information». First DataBank. Archived from the original on 18 September 2000. Retrieved 8 May 2008.
- ^ Raithel M, Baenkler HW, Naegel A, Buchwald F, Schultis HW, Backhaus B, et al. (September 2005). «Significance of salicylate intolerance in diseases of the lower gastrointestinal tract» (PDF). Journal of Physiology and Pharmacology. 56 (Suppl 5): 89–102. PMID 16247191. Archived (PDF) from the original on 9 April 2011.
- ^ Senna GE, Andri G, Dama AR, Mezzelani P, Andri L (1995). «Tolerability of imidazole salycilate in aspirin-sensitive patients». Allergy Proceedings. 16 (5): 251–4. doi:10.2500/108854195778702675. PMID 8566739.
- ^ a b «PDR guide to over the counter (OTC) drugs». Archived from the original on 10 April 2008. Retrieved 28 April 2008.
- ^ Livingstone FB (1985). Frequencies of hemoglobin variants: thalassemia, the glucose-6-phosphate dehydrogenase deficiency, G6PD variants, and ovalocytosis in human populations. Oxford University Press. ISBN 978-0-19-503634-3.
- ^ «Dengue and dengue hemorrhagic fever: information for health care practitioners». Archived from the original on 17 March 2008. Retrieved 28 April 2008.
- ^ a b Macdonald S (November 2002). «Aspirin use to be banned in under 16 year olds». BMJ. 325 (7371): 988c–988. doi:10.1136/bmj.325.7371.988/c. PMC 1169585. PMID 12411346.
- ^ a b c Sørensen HT, Mellemkjaer L, Blot WJ, Nielsen GL, Steffensen FH, McLaughlin JK, et al. (September 2000). «Risk of upper gastrointestinal bleeding associated with use of low-dose aspirin». The American Journal of Gastroenterology. 95 (9): 2218–24. doi:10.1111/j.1572-0241.2000.02248.x. PMID 11007221. S2CID 33742424.
- ^ Torborg L (4 December 2018). «Mayo Clinic Q and A: Coated aspirin may not be as effective at reducing blood clot risk». Mayo Clinic News Network.
- ^ Delaney JA, Opatrny L, Brophy JM, Suissa S (August 2007). «Drug drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding». CMAJ. 177 (4): 347–51. doi:10.1503/cmaj.070186. PMC 1942107. PMID 17698822.
- ^ Wallace JL (October 2008). «Prostaglandins, NSAIDs, and gastric mucosal protection: why doesn’t the stomach digest itself?». Physiological Reviews. 88 (4): 1547–65. doi:10.1152/physrev.00004.2008. PMID 18923189. S2CID 448875.
- ^ Laine L, Maller ES, Yu C, Quan H, Simon T (August 2004). «Ulcer formation with low-dose enteric-coated aspirin and the effect of COX-2 selective inhibition: a double-blind trial». Gastroenterology. 127 (2): 395–402. doi:10.1053/j.gastro.2004.05.001. PMID 15300570.
- ^ Fiorucci S, Santucci L, Wallace JL, Sardina M, Romano M, del Soldato P, et al. (September 2003). «Interaction of a selective cyclooxygenase-2 inhibitor with aspirin and NO-releasing aspirin in the human gastric mucosa». Proceedings of the National Academy of Sciences of the United States of America. 100 (19): 10937–41. Bibcode:2003PNAS..10010937F. doi:10.1073/pnas.1933204100. PMC 196906. PMID 12960371.
- ^ a b Rostom A, Muir K, Dubé C, Jolicoeur E, Boucher M, Joyce J, et al. (July 2007). «Gastrointestinal safety of cyclooxygenase-2 inhibitors: a Cochrane Collaboration systematic review». Clinical Gastroenterology and Hepatology. 5 (7): 818–28, 828.e1-5, quiz 768. doi:10.1016/j.cgh.2007.03.011. PMID 17556027.
- ^ «General chemistry online: FAQ: Acids and bases: What is the buffer system in buffered aspirin?». Antoine.frostburg.edu. Archived from the original on 14 April 2011. Retrieved 11 May 2011.
- ^ Davison C, Smith BW, Smith PK (August 1962). «Effects of buffered and unbuffered acetylsalicylic acid upon the gastric acidity of normal human subjects». Journal of Pharmaceutical Sciences. 51 (8): 759–763. doi:10.1002/jps.2600510813. PMID 13883982.
- ^ Dammann HG, Saleki M, Torz M, Schulz HU, Krupp S, Schürer M, et al. (February 2004). «Effects of buffered and plain acetylsalicylic acid formulations with and without ascorbic acid on gastric mucosa in healthy subjects». Alimentary Pharmacology & Therapeutics. 19 (3): 367–74. doi:10.1111/j.1365-2036.2004.01742.x. PMID 14984384. S2CID 22688422.
- ^ Konturek PC, Kania J, Hahn EG, Konturek JW (November 2006). «Ascorbic acid attenuates aspirin-induced gastric damage: role of inducible nitric oxide synthase». Journal of Physiology and Pharmacology. 57 (Suppl 5): 125–36. PMID 17218764.
- ^ Hayreh SS (July 2014). «Ocular vascular occlusive disorders: natural history of visual outcome». Progress in Retinal and Eye Research. 41: 1–25. doi:10.1016/j.preteyeres.2014.04.001. PMC 4073304. PMID 24769221.
- ^ Ageno W, Beyer-Westendorf J, Garcia DA, Lazo-Langner A, McBane RD, Paciaroni M (January 2016). «Guidance for the management of venous thrombosis in unusual sites». Journal of Thrombosis and Thrombolysis. 41 (1): 129–43. doi:10.1007/s11239-015-1308-1. PMC 4715841. PMID 26780742.
- ^ Guitton MJ, Caston J, Ruel J, Johnson RM, Pujol R, Puel JL (May 2003). «Salicylate induces tinnitus through activation of cochlear NMDA receptors». The Journal of Neuroscience. 23 (9): 3944–52. doi:10.1523/JNEUROSCI.23-09-03944.2003. PMC 6742173. PMID 12736364.
- ^ a b Belay ED, Bresee JS, Holman RC, Khan AS, Shahriari A, Schonberger LB (May 1999). «Reye’s syndrome in the United States from 1981 through 1997». The New England Journal of Medicine. 340 (18): 1377–82. doi:10.1056/NEJM199905063401801. PMID 10228187.
- ^ «Reye’s syndrome». NHS Choices. National Health Service. 12 January 2016.
- ^ «Are You Sensitive to Aspirin? Here are Some Reasons Why». Health Essentials from Cleveland Clinic. 5 February 2015. Archived from the original on 25 October 2020. Retrieved 5 March 2020.
- ^ a b c Doña I, Barrionuevo E, Salas M, Laguna JJ, Agúndez J, García-Martín E, et al. (November 2018). «NSAIDs-hypersensitivity often induces a blended reaction pattern involving multiple organs». Scientific Reports. 8 (1): 16710. Bibcode:2018NatSR…816710D. doi:10.1038/s41598-018-34668-1. PMC 6232098. PMID 30420763.
- ^ a b Kowalski ML, Agache I, Bavbek S, Bakirtas A, Blanca M, Bochenek G, et al. (January 2019). «Diagnosis and management of NSAID-Exacerbated Respiratory Disease (N-ERD)-a EAACI position paper». Allergy. 74 (1): 28–39. doi:10.1111/all.13599. PMID 30216468. S2CID 52276808.
- ^ Sánchez-Borges M, Capriles-Hulett A (January 2000). «Atopy is a risk factor for non-steroidal anti-inflammatory drug sensitivity». Annals of Allergy, Asthma & Immunology. 84 (1): 101–6. doi:10.1016/S1081-1206(10)62748-2. PMID 10674573.
- ^ Stadelmann WK, Digenis AG, Tobin GR (August 1998). «Impediments to wound healing». American Journal of Surgery. 176 (2A Suppl): 39S–47S. doi:10.1016/S0002-9610(98)00184-6. PMID 9777971.
- ^ Layton AM, Ibbotson SH, Davies JA, Goodfield MJ (July 1994). «Randomised trial of oral aspirin for chronic venous leg ulcers». Lancet. 344 (8916): 164–5. doi:10.1016/s0140-6736(94)92759-6. PMID 7912767. S2CID 912169.
- ^ del Río Solá ML, Antonio J, Fajardo G, Vaquero Puerta C (July 2012). «Influence of aspirin therapy in the ulcer associated with chronic venous insufficiency». Annals of Vascular Surgery. 26 (5): 620–9. doi:10.1016/j.avsg.2011.02.051. hdl:10324/2904. PMID 22437068.
- ^ de Oliveira Carvalho PE, Magolbo NG, De Aquino RF, Weller CD, et al. (Cochrane Wounds Group) (February 2016). «Oral aspirin for treating venous leg ulcers». The Cochrane Database of Systematic Reviews. 2016 (2): CD009432. doi:10.1002/14651858.CD009432.pub2. PMC 8627253. PMID 26889740.
- ^ Jull A, Wadham A, Bullen C, Parag V, Kerse N, Waters J (November 2017). «Low dose aspirin as adjuvant treatment for venous leg ulceration: pragmatic, randomised, double blind, placebo controlled trial (Aspirin4VLU)». BMJ. 359: j5157. doi:10.1136/bmj.j5157. PMC 5701114. PMID 29175902.
- ^ Tilbrook H, Clark L, Cook L, Bland M, Buckley H, Chetter I, et al. (October 2018). «AVURT: aspirin versus placebo for the treatment of venous leg ulcers — a Phase II pilot randomised controlled trial». Health Technology Assessment. 22 (55): 1–138. doi:10.3310/hta22550. PMC 6204573. PMID 30325305.
- ^ Berges-Gimeno MP, Stevenson DD (June 2004). «Nonsteroidal anti-inflammatory drug-induced reactions and desensitization». The Journal of Asthma. 41 (4): 375–84. doi:10.1081/JAS-120037650. PMID 15281324. S2CID 29909460.
- ^ Vernooij MW, Haag MD, van der Lugt A, Hofman A, Krestin GP, Stricker BH, et al. (June 2009). «Use of antithrombotic drugs and the presence of cerebral microbleeds: the Rotterdam Scan Study». Archives of Neurology. 66 (6): 714–20. doi:10.1001/archneurol.2009.42. PMID 19364926.
- ^ Gorelick PB (June 2009). «Cerebral microbleeds: evidence of heightened risk associated with aspirin use». Archives of Neurology. 66 (6): 691–3. doi:10.1001/archneurol.2009.85. PMID 19506128.
- ^ a b He J, Whelton PK, Vu B, Klag MJ (December 1998). «Aspirin and risk of hemorrhagic stroke: a meta-analysis of randomized controlled trials». JAMA. 280 (22): 1930–5. doi:10.1001/jama.280.22.1930. PMID 9851479. S2CID 22997730.
- ^ Saloheimo P, Ahonen M, Juvela S, Pyhtinen J, Savolainen ER, Hillbom M (January 2006). «Regular aspirin-use preceding the onset of primary intracerebral hemorrhage is an independent predictor for death». Stroke. 37 (1): 129–33. doi:10.1161/01.STR.0000196991.03618.31. PMID 16322483.
- ^ Medical knowledge self-assessment program for students 4, By American College of Physicians, Clerkship Directors in Internal Medicine, Nephrology 227, Item 29
- ^ Giuseppe G.L. Biondi-Zoccai; Marzia Lotrionte; Pierfrancesco Agostoni; Antonio Abbate; Massimiliano Fusaro; Francesco Burzotta; Luca Testa; Imad Sheiban; Giuseppe Sangiorgi (November 2006). «A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50,279 patients at risk for coronary artery disease». European Heart Journal. 27 (22): 2667–2674. doi:10.1093/eurheartj/ehl334. ISSN 0195-668X. PMID 17053008.
- ^ a b «FDA strengthens warning of heart attack and stroke risk for non-steroidal anti-inflammatory drugs». U.S. Food and Drug Administration (FDA). 9 July 2015. Archived from the original on 11 July 2015. Retrieved 9 July 2015.
- ^ Kreplick LW (2001). «Salicylate toxicity in emergency medicine». Medscape. Archived from the original on 31 August 2012.
- ^ Gaudreault P, Temple AR, Lovejoy FH (October 1982). «The relative severity of acute versus chronic salicylate poisoning in children: a clinical comparison». Pediatrics. 70 (4): 566–9. doi:10.1542/peds.70.4.566. PMID 7122154. S2CID 12738659. (primary source)
- ^ Marx J (2006). Rosen’s emergency medicine: concepts and clinical practice. Mosby/Elsevier. p. 2242. ISBN 978-0-323-02845-5.
- ^ Morra P, Bartle WR, Walker SE, Lee SN, Bowles SK, Reeves RA (September 1996). «Serum concentrations of salicylic acid following topically applied salicylate derivatives». The Annals of Pharmacotherapy. 30 (9): 935–40. doi:10.1177/106002809603000903. PMID 8876850. S2CID 9843820.
- ^ Baselt R (2011). Disposition of toxic drugs and chemicals in man (9th ed.). Seal Beach, California: Biomedical Publications. pp. 20–23. ISBN 978-0-9626523-8-7.
- ^ a b Alqahtani Z, Jamali F (2018). «Clinical Outcomes of Aspirin Interaction with Other Non-Steroidal Anti-Inflammatory Drugs: A Systematic Review». Journal of Pharmacy & Pharmaceutical Sciences. 21 (1s): 48s–73s. doi:10.18433/jpps29854. PMID 29891025. S2CID 48361086.
- ^ Gladding PA, Webster MW, Farrell HB, Zeng IS, Park R, Ruijne N (April 2008). «The antiplatelet effect of six non-steroidal anti-inflammatory drugs and their pharmacodynamic interaction with aspirin in healthy volunteers». The American Journal of Cardiology. 101 (7): 1060–1063. doi:10.1016/j.amjcard.2007.11.054. PMID 18359332.
- ^ Baxter K, Preston CL (eds.). «Aspirin and Spironolactone». MedicinesComplete: Stockley’s Drug Interactions. Royal Pharmaceutical Society.
- ^ Hollifield JW (August 1976). «Failure of aspirin to antagonize the antihypertensive effect of spironolactone in low-renin hypertension». Southern Medical Journal. 69 (8): 1034–6. doi:10.1097/00007611-197608000-00022. PMID 785608.
- ^ Katzung BG (1998). Basic and clinical pharmacology. McGraw-Hill. p. 584. ISBN 978-0-8385-0565-6.
- ^ Loh HS, Watters K, Wilson CW (1 November 1973). «The effects of aspirin on the metabolic availability of ascorbic acid in human beings». Journal of Clinical Pharmacology. 13 (11): 480–486. doi:10.1002/j.1552-4604.1973.tb00203.x. PMID 4490672.
- ^ Basu TK (1982). «Vitamin C-aspirin interactions». International Journal for Vitamin and Nutrition Research. Supplement. 23: 83–90. PMID 6811490.
- ^ Ioannides C, Stone AN, Breacker PJ, Basu TK (December 1982). «Impairment of absorption of ascorbic acid following ingestion of aspirin in guinea pigs». Biochemical Pharmacology. 31 (24): 4035–4038. doi:10.1016/0006-2952(82)90652-9. PMID 6818974.
- ^ «Randomised Trial of Intravenous Streptokinase, Oral Aspirin, Both, or Neither Among 17,187 Cases of Suspected Acute Myocardial Infarction: Isis-2». The Lancet. 332 (8607): 349–360. August 1988. doi:10.1016/s0140-6736(88)92833-4. ISSN 0140-6736. PMID 2899772. S2CID 21071664.
- ^ Lewis HD, Davis JW, Archibald DG, Steinke WE, Smitherman TC, Doherty JE, et al. (August 1983). «Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study». New England Journal of Medicine. 309 (7): 396–403. doi:10.1056/NEJM198308183090703. ISSN 0028-4793. PMID 6135989.
- ^ Di Bella S, Luzzati R, Principe L, Zerbato V, Meroni E, Giuffrè M, et al. (25 January 2022). «Aspirin and Infection: A Narrative Review». Biomedicines. 10 (2): 263. doi:10.3390/biomedicines10020263. ISSN 2227-9059. PMC 8868581. PMID 35203473.
- ^ Cao Y, Tan A (September 2020). «Aspirin might reduce the incidence of breast cancer: An updated meta-analysis of 38 observational studies». Medicine. Baltimore. 99 (38): e21917. doi:10.1097/MD.0000000000021917. PMC 7505405. PMID 32957311.
- ^ «Aspirin Water Helps Plants». cybercemetery.unt.edu.
- ^ «Gardens: drug therapy for plants | Gardening advice». The Guardian.
- ^ «Priming Plant Defenses with Aspirin-like Compound : USDA ARS». www.ars.usda.gov.
- ^ a b c Edwards SH. «Nonsteroidal Anti-inflammatory Drugs: Aspirin». Merck Veterinary Manual. Archived from the original on 18 December 2016. Retrieved 20 January 2018.
- ^ a b «Analgesics (toxicity)». Merck. Archived from the original on 11 April 2015. Retrieved 19 January 2018.
- ^ Lappin MR, ed. (2001). Feline internal medicine secrets. Philadelphia: Hanley & Belfus. p. 160. ISBN 978-1-56053-461-7.
- ^ «Plants poisonous to livestock». Cornell University Department of Animal Science. Archived from the original on 16 August 2015. Retrieved 3 March 2016.
Further reading[edit]
- Desborough, Michael J. R.; Keeling, David M., «The aspirin story – from willow to wonder drug», British Journal of Haematology, 20 January 2017, pp.674-683
- McTavish, Jan R. (Fall 1987). «What’s in a name? Aspirin and the American Medical Association». Bulletin of the History of Medicine. 61.3: 343–366. JSTOR 44442097. On loss of patent in the US in 1917.
External links[edit]
Wikimedia Commons has media related to Aspirin.
- «Aspirin». Drug Information Portal. U.S. National Library of Medicine.
- Ling G (2005). «Aspirin». How Products Are Made. Vol. 1. Thomson Gale.
 |
|
 |
|
| Clinical data | |
|---|---|
| Pronunciation | acetylsalicylic acid |
| Trade names | Bayer Aspirin, others |
| Other names |
|
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a682878 |
| License data |
|
| Pregnancy category |
|
| Routes of administration |
By mouth, rectal |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Bioavailability | 80–100%[4] |
| Protein binding | 80–90%[5] |
| Metabolism | Liver (CYP2C19 and possibly CYP3A), some is also hydrolysed to salicylate in the gut wall.[5] |
| Elimination half-life | Dose-dependent; 2–3 h for low doses (100 mg or less), 15–30 h for large doses.[5] |
| Excretion | Urine (80–100%), sweat, saliva, feces[4] |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| IUPHAR/BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| PDB ligand |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.000.059 |
| Chemical and physical data | |
| Formula | C9H8O4 |
| Molar mass | 180.159 g·mol−1 |
| 3D model (JSmol) |
|
| Density | 1.40 g/cm3 |
| Melting point | 136 °C (277 °F) [7] |
| Boiling point | 140 °C (284 °F) (decomposes) |
| Solubility in water | 3 g/L |
|
SMILES
|
|
|
InChI
|
|
| (verify) |
Aspirin, also known as acetylsalicylic acid (ASA), is a nonsteroidal anti-inflammatory drug (NSAID) used to reduce pain, fever, and/or inflammation, and as an antithrombotic.[8] Specific inflammatory conditions which aspirin is used to treat include Kawasaki disease, pericarditis, and rheumatic fever.[8]
Aspirin is also used long-term to help prevent further heart attacks, ischaemic strokes, and blood clots in people at high risk.[8] For pain or fever, effects typically begin within 30 minutes.[8] Aspirin works similarly to other NSAIDs but also suppresses the normal functioning of platelets.[8]
One common adverse effect is an upset stomach.[8] More significant side effects include stomach ulcers, stomach bleeding, and worsening asthma.[8] Bleeding risk is greater among those who are older, drink alcohol, take other NSAIDs, or are on other blood thinners.[8] Aspirin is not recommended in the last part of pregnancy.[8] It is not generally recommended in children with infections because of the risk of Reye syndrome.[8] High doses may result in ringing in the ears.[8]
A precursor to aspirin found in the bark of the willow tree (genus Salix) has been used for its health effects for at least 2,400 years.[9][10] In 1853, chemist Charles Frédéric Gerhardt treated the medicine sodium salicylate with acetyl chloride to produce acetylsalicylic acid for the first time.[11] Over the next 50 years, other chemists established the chemical structure and devised more efficient production methods.[11]: 69–75
Aspirin is available without medical prescription as a proprietary or generic medication[8] in most jurisdictions. It is one of the most widely used medications globally, with an estimated 40,000 tonnes (44,000 tons) (50 to 120 billion pills)[clarification needed] consumed each year,[9][12] and is on the World Health Organization’s List of Essential Medicines.[13] In 2020, it was the 36th most commonly prescribed medication in the United States, with more than 17 million prescriptions.[14][15]
Brand vs. generic name[edit]
In 1897, scientists at the Bayer company began studying acetylsalicylic acid as a less-irritating replacement medication for common salicylate medicines.[11]: 69–75 [16] By 1899, Bayer had named it «Aspirin» and sold it around the world.[17]
Aspirin’s popularity grew over the first half of the 20th century, leading to competition between many brands and formulations.[18] The word Aspirin was Bayer’s brand name; however, their rights to the trademark were lost or sold in many countries.[18] The name is ultimately a blend of the prefix a(cetyl) + spir Spiraea, the meadowsweet plant genus from which the acetylsalicylic acid was originally derived at Bayer + -in, the common chemical suffix.
Chemical properties[edit]
Aspirin decomposes rapidly in solutions of ammonium acetate or the acetates, carbonates, citrates, or hydroxides of the alkali metals. It is stable in dry air, but gradually hydrolyses in contact with moisture to acetic and salicylic acids. In solution with alkalis, the hydrolysis proceeds rapidly and the clear solutions formed may consist entirely of acetate and salicylate.[19]
Like flour mills, factories producing aspirin tablets must control the amount of the powder that becomes airborne inside the building, because the powder-air mixture can be explosive. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit in the United States of 5 mg/m3 (time-weighted average).[20] In 1989, the Occupational Safety and Health Administration (OSHA) set a legal permissible exposure limit for aspirin of 5 mg/m3, but this was vacated by the AFL-CIO v. OSHA decision in 1993.[21]
Synthesis[edit]
The synthesis of aspirin is classified as an esterification reaction. Salicylic acid is treated with acetic anhydride, an acid derivative, causing a chemical reaction that turns salicylic acid’s hydroxyl group into an ester group (R-OH → R-OCOCH3). This process yields aspirin and acetic acid, which is considered a byproduct of this reaction. Small amounts of sulfuric acid (and occasionally phosphoric acid) are almost always used as a catalyst. This method is commonly demonstrated in undergraduate teaching labs.[22]
Reaction between acetic acid and salicylic acid can also form aspirin but this esterification reaction is reversible and the presence of water can lead to hydrolysis of the aspirin. So, an anhydrous reagent is preferred.[23]
- Reaction mechanism
Acetylation of salicylic acid, mechanism
Formulations containing high concentrations of aspirin often smell like vinegar[24] because aspirin can decompose through hydrolysis in moist conditions, yielding salicylic and acetic acids.[25]
Physical properties[edit]
Aspirin, an acetyl derivative of salicylic acid, is a white, crystalline, weakly acidic substance, which melts at 136 °C (277 °F),[7] and decomposes around 140 °C (284 °F).[26] Its acid dissociation constant (pKa) is 3.5 at 25 °C (77 °F).[27]
Polymorphism[edit]
Polymorphism, or the ability of a substance to form more than one crystal structure, is important in the development of pharmaceutical ingredients. Many drugs receive regulatory approval for only a single crystal form or polymorph. For a long time, only one crystal structure for aspirin was known. That aspirin might have a second crystalline form was suspected since the 1960s. The elusive second polymorph was first discovered by Vishweshwar and coworkers in 2005,[28] and fine structural details were given by Bond et al.[29] A new crystal type was found during experiments after co-crystallization of aspirin and levetiracetam from hot acetonitrile. The form II is only stable at 100 K and reverts to form I at ambient temperature. In the (unambiguous) form I, two salicylic molecules form centrosymmetric dimers through the acetyl groups with the (acidic) methyl proton to carbonyl hydrogen bonds, and in the newly claimed form II, each salicylic molecule forms the same hydrogen bonds with two neighboring molecules instead of one. With respect to the hydrogen bonds formed by the carboxylic acid groups, both polymorphs form identical dimer structures.[28]
Mechanism of action[edit]
Discovery of the mechanism[edit]
In 1971, British pharmacologist John Robert Vane, then employed by the Royal College of Surgeons in London, showed aspirin suppressed the production of prostaglandins and thromboxanes.[30][31] For this discovery he was awarded the 1982 Nobel Prize in Physiology or Medicine, jointly with Sune Bergström and Bengt Ingemar Samuelsson.[32]
Prostaglandins and thromboxanes[edit]
Aspirin’s ability to suppress the production of prostaglandins and thromboxanes is due to its irreversible inactivation of the cyclooxygenase (COX; officially known as prostaglandin-endoperoxide synthase, PTGS) enzyme required for prostaglandin and thromboxane synthesis. Aspirin acts as an acetylating agent where an acetyl group is covalently attached to a serine residue in the active site of the PTGS enzyme (Suicide inhibition). This makes aspirin different from other NSAIDs (such as diclofenac and ibuprofen), which are reversible inhibitors.
Low-dose aspirin use irreversibly blocks the formation of thromboxane A2 in platelets, producing an inhibitory effect on platelet aggregation during the lifetime of the affected platelet (8–9 days). This antithrombotic property makes aspirin useful for reducing the incidence of heart attacks in people who have had a heart attack, unstable angina, ischemic stroke or transient ischemic attack.[33] 40 mg of aspirin a day is able to inhibit a large proportion of maximum thromboxane A2 release provoked acutely, with the prostaglandin I2 synthesis being little affected; however, higher doses of aspirin are required to attain further inhibition.[34]
Prostaglandins, local hormones produced in the body, have diverse effects, including the transmission of pain information to the brain, modulation of the hypothalamic thermostat, and inflammation. Thromboxanes are responsible for the aggregation of platelets that form blood clots. Heart attacks are caused primarily by blood clots, and low doses of aspirin are seen as an effective medical intervention to prevent a second acute myocardial infarction.[35]
COX-1 and COX-2 inhibition[edit]
At least two different types of cyclooxygenases, COX-1 and COX-2, are acted on by aspirin. Aspirin irreversibly inhibits COX-1 and modifies the enzymatic activity of COX-2. COX-2 normally produces prostanoids, most of which are proinflammatory. Aspirin-modified PTGS2 (prostaglandin-endoperoxide synthase 2) produces lipoxins, most of which are anti-inflammatory.[36][verification needed] Newer NSAID drugs, COX-2 inhibitors (coxibs), have been developed to inhibit only PTGS2, with the intent to reduce the incidence of gastrointestinal side effects.[12]
Several COX-2 inhibitors, such as rofecoxib (Vioxx), have been withdrawn from the market, after evidence emerged that PTGS2 inhibitors increase the risk of heart attack and stroke.[37][38] Endothelial cells lining the microvasculature in the body are proposed to express PTGS2, and, by selectively inhibiting PTGS2, prostaglandin production (specifically, PGI2; prostacyclin) is downregulated with respect to thromboxane levels, as PTGS1 in platelets is unaffected. Thus, the protective anticoagulative effect of PGI2 is removed, increasing the risk of thrombus and associated heart attacks and other circulatory problems. Since platelets have no DNA, they are unable to synthesize new PTGS once aspirin has irreversibly inhibited the enzyme, an important difference as compared with reversible inhibitors.
Furthermore, aspirin, while inhibiting the ability of COX-2 to form pro-inflammatory products such as the prostaglandins, converts this enzyme’s activity from a prostaglandin-forming cyclooxygenase to a lipoxygenase-like enzyme: aspirin-treated COX-2 metabolizes a variety of polyunsaturated fatty acids to hydroperoxy products which are then further metabolized to specialized proresolving mediators such as the aspirin-triggered lipoxins, aspirin-triggered resolvins, and aspirin-triggered maresins. These mediators possess potent anti-inflammatory activity. It is proposed that this aspirin-triggered transition of COX-2 from cyclooxygenase to lipoxygenase activity and the consequential formation of specialized proresolving mediators contributes to the anti-inflammatory effects of aspirin.[39][40][41]
Additional mechanisms[edit]
Aspirin has been shown to have at least three additional modes of action. It uncouples oxidative phosphorylation in cartilaginous (and hepatic) mitochondria, by diffusing from the inner membrane space as a proton carrier back into the mitochondrial matrix, where it ionizes once again to release protons.[42] Aspirin buffers and transports the protons. When high doses are given, it may actually cause fever, owing to the heat released from the electron transport chain, as opposed to the antipyretic action of aspirin seen with lower doses. In addition, aspirin induces the formation of NO-radicals in the body, which have been shown in mice to have an independent mechanism of reducing inflammation. This reduced leukocyte adhesion is an important step in the immune response to infection; however, evidence is insufficient to show aspirin helps to fight infection.[43] More recent data also suggest salicylic acid and its derivatives modulate signalling through NF-κB.[44] NF-κB, a transcription factor complex, plays a central role in many biological processes, including inflammation.[45][46][47]
Aspirin is readily broken down in the body to salicylic acid, which itself has anti-inflammatory, antipyretic, and analgesic effects. In 2012, salicylic acid was found to activate AMP-activated protein kinase, which has been suggested as a possible explanation for some of the effects of both salicylic acid and aspirin.[48][49] The acetyl portion of the aspirin molecule has its own targets. Acetylation of cellular proteins is a well-established phenomenon in the regulation of protein function at the post-translational level. Aspirin is able to acetylate several other targets in addition to COX isoenzymes.[50][51] These acetylation reactions may explain many hitherto unexplained effects of aspirin.[52]
Formulations[edit]
|
This section needs expansion. You can help by adding to it. (January 2023) |
Aspirin is produced in many formulations, with some differences in effect. In particular, aspirin can cause gastrointestinal bleeding, and formulations are sought which deliver the benefits of aspirin while mitigating harmful bleeding. Formulations may be combined (e.g., buffered + vitamin C).
- Tablets, typically of about 75-100mg and 300-320mg of immediate-release aspirin (IR-ASA).
- Dispersible tablets.
- Enteric-coated tablets.
- Buffered formulations containing aspirin with one of many buffering agents.
- Formulations of aspirin with vitamin C (ASA-VitC)
- A phospholipid-aspirin complex liquid formulation, PL-ASA. As of 2023 the phospholipid coating was being trialled to determine if it caused less gastrointestinal damage.[53]
Pharmacokinetics[edit]
Acetylsalicylic acid is a weak acid, and very little of it is ionized in the stomach after oral administration. Acetylsalicylic acid is quickly absorbed through the cell membrane in the acidic conditions of the stomach. The increased pH and larger surface area of the small intestine causes aspirin to be absorbed more slowly there, as more of it is ionized. Owing to the formation of concretions, aspirin is absorbed much more slowly during overdose, and plasma concentrations can continue to rise for up to 24 hours after ingestion.[54][55][56]
About 50–80% of salicylate in the blood is bound to human serum albumin, while the rest remains in the active, ionized state; protein binding is concentration-dependent. Saturation of binding sites leads to more free salicylate and increased toxicity. The volume of distribution is 0.1–0.2 L/kg. Acidosis increases the volume of distribution because of enhancement of tissue penetration of salicylates.[56]
As much as 80% of therapeutic doses of salicylic acid is metabolized in the liver. Conjugation with glycine forms salicyluric acid, and with glucuronic acid to form two different glucuronide esters. The conjugate with the acetyl group intact is referred to as the acyl glucuronide; the deacetylated conjugate is the phenolic glucuronide. These metabolic pathways have only a limited capacity. Small amounts of salicylic acid are also hydroxylated to gentisic acid. With large salicylate doses, the kinetics switch from first-order to zero-order, as metabolic pathways become saturated and renal excretion becomes increasingly important.[56]
Salicylates are excreted mainly by the kidneys as salicyluric acid (75%), free salicylic acid (10%), salicylic phenol (10%), and acyl glucuronides (5%), gentisic acid (< 1%), and 2,3-dihydroxybenzoic acid.[57] When small doses (less than 250 mg in an adult) are ingested, all pathways proceed by first-order kinetics, with an elimination half-life of about 2.0 h to 4.5 h.[58][59] When higher doses of salicylate are ingested (more than 4 g), the half-life becomes much longer (15 h to 30 h),[60] because the biotransformation pathways concerned with the formation of salicyluric acid and salicyl phenolic glucuronide become saturated.[61] Renal excretion of salicylic acid becomes increasingly important as the metabolic pathways become saturated, because it is extremely sensitive to changes in urinary pH. A 10- to 20-fold increase in renal clearance occurs when urine pH is increased from 5 to 8. The use of urinary alkalinization exploits this particular aspect of salicylate elimination.[62] It was found that short-term aspirin use in therapeutic doses might precipitate reversible acute kidney injury when the patient was ill with glomerulonephritis or cirrhosis.[63] Aspirin for some patients with chronic kidney disease and some children with congestive heart failure was contraindicated.[63]
History[edit]
Medicines made from willow and other salicylate-rich plants appear in clay tablets from ancient Sumer as well as the Ebers Papyrus from ancient Egypt.[11]: 8–13 [18] Hippocrates referred to the use of salicylic tea to reduce fevers around 400 BC, and willow bark preparations were part of the pharmacopoeia of Western medicine in classical antiquity and the Middle Ages.[18] Willow bark extract became recognized for its specific effects on fever, pain, and inflammation in the mid-eighteenth century.[64] By the nineteenth century, pharmacists were experimenting with and prescribing a variety of chemicals related to salicylic acid, the active component of willow extract.[11]: 46–55
Old package. «Export from Germany is prohibited»
In 1853, chemist Charles Frédéric Gerhardt treated sodium salicylate with acetyl chloride to produce acetylsalicylic acid for the first time;[11]: 46–48 in the second half of the 19th century, other academic chemists established the compound’s chemical structure and devised more efficient methods of synthesis. In 1897, scientists at the drug and dye firm Bayer began investigating acetylsalicylic acid as a less-irritating replacement for standard common salicylate medicines, and identified a new way to synthesize it.[11]: 69–75 By 1899, Bayer had dubbed this drug Aspirin and was selling it globally.[17]: 27 The word Aspirin was Bayer’s brand name, rather than the generic name of the drug; however, Bayer’s rights to the trademark were lost or sold in many countries. Aspirin’s popularity grew over the first half of the 20th century leading to fierce competition with the proliferation of aspirin brands and products.[18]
Aspirin’s popularity declined after the development of acetaminophen/paracetamol in 1956 and ibuprofen in 1962. In the 1960s and 1970s, John Vane and others discovered the basic mechanism of aspirin’s effects,[11]: 226–231 while clinical trials and other studies from the 1960s to the 1980s established aspirin’s efficacy as an anti-clotting agent that reduces the risk of clotting diseases.[11]: 247–257 The initial large studies on the use of low-dose aspirin to prevent heart attacks that were published in the 1970s and 1980s helped spur reform in clinical research ethics and guidelines for human subject research and US federal law, and are often cited as examples of clinical trials that included only men, but from which people drew general conclusions that did not hold true for women.[65][66][67]
Aspirin sales revived considerably in the last decades of the 20th century, and remain strong in the 21st century with widespread use as a preventive treatment for heart attacks and strokes.[11]: 267–269
Trademark[edit]
In Canada and many other countries, «Aspirin» remains a trademark, so generic aspirin is sold as «ASA» (acetylsalicylic acid).
In the US., «aspirin» is a generic name.
Bayer lost its trademark for Aspirin in the United States in actions taken between 1918 and 1921 because it had failed to use the name for its own product correctly and had for years allowed the use of «Aspirin» by other manufacturers without defending the intellectual property rights.[68] Today, aspirin is a generic trademark in many countries.[69][70] Aspirin, with a capital «A», remains a registered trademark of Bayer in Germany, Canada, Mexico, and in over 80 other countries, for acetylsalicylic acid in all markets, but using different packaging and physical aspects for each.[71][72]
Compendial status[edit]
- United States Pharmacopeia[73]
- British Pharmacopoeia[74]
Medical use[edit]
Aspirin is used in the treatment of a number of conditions, including fever, pain, rheumatic fever, and inflammatory conditions, such as rheumatoid arthritis, pericarditis, and Kawasaki disease.[8] Lower doses of aspirin have also been shown to reduce the risk of death from a heart attack, or the risk of stroke in people who are at high risk or who have cardiovascular disease, but not in elderly people who are otherwise healthy.[75][76][77][78][79] There is some evidence that aspirin is effective at preventing colorectal cancer, though the mechanisms of this effect are unclear.[80] In the United States, the selective initiation of low-dose aspirin, based on an individualised assessment, has been deemed reasonable for the primary prevention of cardiovascular disease in people aged between 40 and 59 who have a 10% or greater risk of developing cardiovascular disease over the next 10 years and are not at an increased risk of bleeding.[81]
Pain[edit]
Aspirin is an effective analgesic for acute pain, although it is generally considered inferior to ibuprofen because aspirin is more likely to cause gastrointestinal bleeding.[82] Aspirin is generally ineffective for those pains caused by muscle cramps, bloating, gastric distension, or acute skin irritation.[83] As with other NSAIDs, combinations of aspirin and caffeine provide slightly greater pain relief than aspirin alone.[84] Effervescent formulations of aspirin relieve pain faster than aspirin in tablets,[85] which makes them useful for the treatment of migraines.[86] Topical aspirin may be effective for treating some types of neuropathic pain.[87]
Aspirin, either by itself or in a combined formulation, effectively treats certain types of a headache, but its efficacy may be questionable for others. Secondary headaches, meaning those caused by another disorder or trauma, should be promptly treated by a medical provider. Among primary headaches, the International Classification of Headache Disorders distinguishes between tension headache (the most common), migraine, and cluster headache. Aspirin or other over-the-counter analgesics are widely recognized as effective for the treatment of tension headaches.[88] Aspirin, especially as a component of an aspirin/paracetamol/caffeine combination, is considered a first-line therapy in the treatment of migraine, and comparable to lower doses of sumatriptan. It is most effective at stopping migraines when they are first beginning.[89]
Fever[edit]
Like its ability to control pain, aspirin’s ability to control fever is due to its action on the prostaglandin system through its irreversible inhibition of COX.[90] Although aspirin’s use as an antipyretic in adults is well established, many medical societies and regulatory agencies, including the American Academy of Family Physicians, the American Academy of Pediatrics, and the Food and Drug Administration, strongly advise against using aspirin for the treatment of fever in children because of the risk of Reye’s syndrome, a rare but often fatal illness associated with the use of aspirin or other salicylates in children during episodes of viral or bacterial infection.[91][92][93] Because of the risk of Reye’s syndrome in children, in 1986, the US Food and Drug Administration (FDA) required labeling on all aspirin-containing medications advising against its use in children and teenagers.[94]
Inflammation[edit]
Aspirin is used as an anti-inflammatory agent for both acute and long-term inflammation,[95] as well as for the treatment of inflammatory diseases, such as rheumatoid arthritis.[8]
Heart attacks and strokes[edit]
Aspirin is an important part of the treatment of those who have had a heart attack.[96] It is generally not recommended for routine use by people with no other health problems, including those over the age of 70.[97]
The 2009 Antithrombotic Trialists’ Collaboration published in Lancet evaluated the efficacy and safety of low dose aspirin in secondary prevention. In those with prior ischaemic stroke or acute myocardial infarction, daily low dose aspirin was associated with a 19% relative risk reduction of serious cardiovascular events (non-fatal myocardial infarction, non-fatal stroke, or vascular death). This did come at the expense of a 0.19% absolute risk increase in gastrointestinal bleeding; however, the benefits outweigh the hazard risk in this case.[98] Data from early trials of aspirin in primary prevention suggested low dose aspirin is more beneficial for people <70 kg and high dose aspirin is more beneficial for those ≥70 kg.[99] However, more recent trials have suggested lower dose aspirin is not more efficacious in people with a low body weight and more evidence is required to determine the effect of higher dose aspirin in people with a high body weight.[100][101][102]
After percutaneous coronary interventions (PCIs), such as the placement of a coronary artery stent, a U.S. Agency for Healthcare Research and Quality guideline recommends that aspirin be taken indefinitely.[103] Frequently, aspirin is combined with an ADP receptor inhibitor, such as clopidogrel, prasugrel, or ticagrelor to prevent blood clots. This is called dual antiplatelet therapy (DAPT). Duration of DAPT was advised in the United States and European Union guidelines after the CURE [104] and PRODIGY [105] studies . In 2020, the systematic review and network meta-analysis from Khan et al.[106] showed promising benefits of short-term (< 6 months) DAPT followed by P2Y12 inhibitors in selected patients, as well as the benefits of extended-term (> 12 months) DAPT in high risk patients. In conclusion, the optimal duration of DAPT after PCIs should be personalized after outweighing each patient’s risks of ischemic events and risks of bleeding events with consideration of multiple patient-related and procedure-related factors. Moreover, aspirin should be continued indefinitely after DAPT is complete.[107][108][109]
The status of the use of aspirin for the primary prevention in cardiovascular disease is conflicting and inconsistent, with recent changes from previously recommending it widely decades ago, and that some referenced newer trials in clinical guidelines show less of benefit of adding aspirin alongside other anti-hypertensive and cholesterol lowering therapies.[97][110] The ASCEND study demonstrated that in high-bleeding risk diabetics with no prior cardiovascular disease, there is no overall clinical benefit (12% decrease in risk of ischaemic events v/s 29% increase in GI bleeding) of low dose aspirin in preventing the serious vascular events over a period of 7.4 years. Similarly, the results of the ARRIVE study also showed no benefit of same dose of aspirin in reducing the time to first cardiovascular outcome in patients with moderate risk of cardiovascular disease over a period of five years. Aspirin has also been suggested as a component of a polypill for prevention of cardiovascular disease.[111][112] Complicating the use of aspirin for prevention is the phenomenon of aspirin resistance.[113][114] For people who are resistant, aspirin’s efficacy is reduced.[115] Some authors have suggested testing regimens to identify people who are resistant to aspirin.[116]
As of April 2022, the United States Preventive Services Task Force (USPSTF) determined that there was a «small net benefit» for patients aged 40-59 with a 10% or greater 10-year cardiovascular disease (CVD) risk, and «no net benefit» for patients aged over 60.[117][118][119] Determining the net benefit was based on balancing the risk reduction of taking aspirin for heart attacks and ischaemic strokes, with the increased risk of gastrointestinal bleeding, intracranial bleeding, and hemorrhagic strokes. Their recommendations state that age changes the risk of the medicine, with the magnitude of the benefit of aspirin coming from starting at a younger age, while the risk of bleeding, while small, increases with age, particular for adults over 60, and can be compounded by other risk factors such as diabetes and a history of gastrointestinal bleeding. As a result, the USPSTF suggests that «people ages 40 to 59 who are at higher risk for CVD should decide with their clinician whether to start taking aspirin; people 60 or older should not start taking aspirin to prevent a first heart attack or stroke.» Primary prevention guidelines from September 2019 made by the American College of Cardiology and the American Heart Association state they might consider aspirin for patients aged 40-69 with a higher risk of atherosclerotic CVD, without an increased bleeding risk, while stating they would not recommend aspirin for patients aged over 70 or adults of any age with an increased bleeding risk.[97] They state a CVD risk estimation and a risk discussion should be done before starting on aspirin, while stating aspirin should be used «infrequently in the routine primary prevention of (atherosclerotic CVD) because of lack of net benefit». As of August 2021, the European Society of Cardiology made similar recommendations; considering aspirin specifically to patients aged less than 70 at high or very high CVD risk, without any clear contraindications, on a case-by-case basis considering both ischemic risk and bleeding risk.[110]
Cancer prevention[edit]
Aspirin may reduce the overall risk of both getting cancer and dying from cancer.[120] There is substantial evidence for lowering the risk of colorectal cancer (CRC),[80][121][122][123] but aspirin must be taken for at least 10–20 years to see this benefit.[124] It may also slightly reduce the risk of endometrial cancer,[125] breast cancer, and prostate cancer.[126]
Some conclude the benefits are greater than the risks due to bleeding in those at average risk.[120] Others are unclear if the benefits are greater than the risk.[127][128] Given this uncertainty, the 2007 United States Preventive Services Task Force (USPSTF) guidelines on this topic recommended against the use of aspirin for prevention of CRC in people with average risk.[129] Nine years later however, the USPSTF issued a grade B recommendation for the use of low-dose aspirin (75 to 100 mg/day) «for the primary prevention of CVD [cardiovascular disease] and CRC in adults 50 to 59 years of age who have a 10% or greater 10-year CVD risk, are not at increased risk for bleeding, have a life expectancy of at least 10 years, and are willing to take low-dose aspirin daily for at least 10 years».[130]
A meta-analysis through 2019 said that there was an association between taking aspirin and lower risk of cancer of the colorectum, esophagus, and stomach.[131]
In 2021, the U.S. Preventive services Task Force raised questions about the use of aspirin in cancer prevention. It notes the results of the 2018 ASPREE (Aspirin in Reducing Events in the Elderly) Trial, in which the risk of cancer-related death was higher in the aspirin-treated group than in the placebo group.[132]
Psychiatry[edit]
Bipolar disorder[edit]
Aspirin, along with several other agents with anti-inflammatory properties, has been repurposed as an add-on treatment for depressive episodes in subjects with bipolar disorder in light of the possible role of inflammation in the pathogenesis of severe mental disorders.[133] However, meta-analytic evidence is based on very few studies and does not suggest any efficacy of aspirin in the treatment of bipolar depression.[133] Thus, notwithstanding the biological rationale, the clinical perspectives of aspirin and anti-inflammatory agents in the treatment of bipolar depression remain uncertain.[133]
Dementia[edit]
Although cohort and longitudinal studies have shown low-dose aspirin has a greater likelihood of reducing the incidence of dementia, numerous randomized controlled trials have not validated this.[134][135]
Schizophrenia[edit]
Some researchers have speculated the anti-inflammatory effects of aspirin may be beneficial for schizophrenia. Small trials have been conducted but evidence remains lacking.[136]
Other uses[edit]
Aspirin is a first-line treatment for the fever and joint-pain symptoms of acute rheumatic fever. The therapy often lasts for one to two weeks, and is rarely indicated for longer periods. After fever and pain have subsided, the aspirin is no longer necessary, since it does not decrease the incidence of heart complications and residual rheumatic heart disease.[137][138] Naproxen has been shown to be as effective as aspirin and less toxic, but due to the limited clinical experience, naproxen is recommended only as a second-line treatment.[137][139]
Along with rheumatic fever, Kawasaki disease remains one of the few indications for aspirin use in children[140] in spite of a lack of high quality evidence for its effectiveness.[141]
Low-dose aspirin supplementation has moderate benefits when used for prevention of pre-eclampsia.[142][143] This benefit is greater when started in early pregnancy.[144]
Aspirin has also demonstrated anti-tumoral effects, via inhibition of the PTTG1 gene, which is often overexpressed in tumors.[145]
Resistance[edit]
For some people, aspirin does not have as strong an effect on platelets as for others, an effect known as aspirin-resistance or insensitivity. One study has suggested women are more likely to be resistant than men,[146] and a different, aggregate study of 2,930 people found 28% were resistant.[147]
A study in 100 Italian people found, of the apparent 31% aspirin-resistant subjects, only 5% were truly resistant, and the others were noncompliant.[148]
Another study of 400 healthy volunteers found no subjects who were truly resistant, but some had «pseudoresistance, reflecting delayed and reduced drug absorption».
[149]
Meta-analysis and systematic reviews have concluded that laboratory confirmed aspirin resistance confers increased rates of poorer outcomes in cardiovascular and neurovascular diseases.[150][147][151][152][153][154] Although the majority of research conducted has surrounded cardiovascular and neurovascular, there is emerging research into the risk of aspirin resistance after orthopaedic surgery where aspirin is used for venous thromboembolism prophylaxis.[155] Aspirin resistance in orthopaedic surgery, specifically after total hip and knee arthroplasties, is of interest as risk factors for aspirin resistance are also risk factors for venous thromboembolisms and osteoarthritis; the sequalae of requiring a total hip or knee arthroplasty. Some of these risk factors include obesity, advancing age, diabetes mellitus, dyslipidaemia and inflammatory diseases.[155]
Dosages[edit]
Adult aspirin tablets are produced in standardised sizes, which vary slightly from country to country, for example 300 mg in Britain and 325 mg (or 5 grains) in the United States. Smaller doses are based on these standards, e.g., 75 mg and 81 mg tablets. The 81-milligram (1+1⁄4-grain) tablets are commonly called «baby aspirin» or «baby-strength», because they were originally – but no longer – intended to be administered to infants and children.[156] No medical significance occurs due to the slight difference in dosage between the 75 mg and the 81 mg tablets. The dose required for benefit appears to depend on a person’s weight.[99] For those weighing less than 70 kilograms (154 lb), low dose is effective for preventing cardiovascular disease; for patients above this weight, higher doses are required.[99]
In general, for adults, doses are taken four times a day for fever or arthritis,[157] with doses near the maximal daily dose used historically for the treatment of rheumatic fever.[158] For the prevention of myocardial infarction (MI) in someone with documented or suspected coronary artery disease, much lower doses are taken once daily.[157]
March 2009 recommendations from the USPSTF on the use of aspirin for the primary prevention of coronary heart disease encourage men aged 45–79 and women aged 55–79 to use aspirin when the potential benefit of a reduction in MI for men or stroke for women outweighs the potential harm of an increase in gastrointestinal hemorrhage.[159][160][needs update] The WHI study of postmenopausal women found that aspirin resulted in a 25% lower risk of death from cardiovascular disease and a 14% lower risk of death from any cause, though there was no significant difference between 81 mg and 325 mg aspirin doses.[161] The 2021 ADAPTABLE study also showed no significant difference in cardiovascular events or major bleeding between 81 mg and 325 mg doses of aspirin in patients (both men and women) with established cardiovascular disease.[162]
Low-dose aspirin use was also associated with a trend toward lower risk of cardiovascular events, and lower aspirin doses (75 or 81 mg/day) may optimize efficacy and safety for people requiring aspirin for long-term prevention.[160]
In children with Kawasaki disease, aspirin is taken at dosages based on body weight, initially four times a day for up to two weeks and then at a lower dose once daily for a further six to eight weeks.[163]
Adverse effects[edit]
In October 2020, the US Food and Drug Administration (FDA) required the drug label to be updated for all nonsteroidal anti-inflammatory medications to describe the risk of kidney problems in unborn babies that result in low amniotic fluid.[164][165] They recommend avoiding NSAIDs in pregnant women at 20 weeks or later in pregnancy.[164][165] One exception to the recommendation is the use of low-dose 81 mg aspirin at any point in pregnancy under the direction of a health care professional.[165]
Contraindications[edit]
Aspirin should not be taken by people who are allergic to ibuprofen or naproxen,[166][167] or who have salicylate intolerance[168][169] or a more generalized drug intolerance to NSAIDs, and caution should be exercised in those with asthma or NSAID-precipitated bronchospasm. Owing to its effect on the stomach lining, manufacturers recommend people with peptic ulcers, mild diabetes, or gastritis seek medical advice before using aspirin.[166][170] Even if none of these conditions is present, the risk of stomach bleeding is still increased when aspirin is taken with alcohol or warfarin.[166][167] People with hemophilia or other bleeding tendencies should not take aspirin or other salicylates.[166][170] Aspirin is known to cause hemolytic anemia in people who have the genetic disease glucose-6-phosphate dehydrogenase deficiency, particularly in large doses and depending on the severity of the disease.[171] Use of aspirin during dengue fever is not recommended owing to increased bleeding tendency.[172] People with kidney disease, hyperuricemia, or gout should not take aspirin because it inhibits the kidneys’ ability to excrete uric acid, thus may exacerbate these conditions. Aspirin should not be given to children or adolescents under the age of 16 to control cold or influenza symptoms, as this has been linked with Reye’s syndrome.[173]
Gastrointestinal[edit]
Aspirin use has been shown to increase the risk of gastrointestinal bleeding.[174] Although some enteric-coated formulations of aspirin are advertised as being «gentle to the stomach», in one study, enteric coating did not seem to reduce this risk;[174] the Mayo Clinic agree with this, and report that coated aspirin may also not be as effective at reducing blood clot risk.[175]
Combining aspirin with other NSAIDs has been shown to further increase the risk of gastrointestinal bleeding.[174] Using aspirin in combination with clopidogrel or warfarin also increases the risk of upper gastrointestinal bleeding.[176]
Blockade of COX-1 by aspirin apparently results in the upregulation of COX-2 as part of a gastric defense.[177] Several trials suggest that the simultaneous use of a COX-2 inhibitor with aspirin may increase the risk of gastrointestinal injury.[178][179] However, currently available evidence has been unable to prove that this effect is consistently repeatable in everyday clinical practice.[180] More dedicated research is required to provide greater clarity on the subject.[180] Therefore, caution should be exercised if combining aspirin with any «natural» supplements with COX-2-inhibiting properties, such as garlic extracts, curcumin, bilberry, pine bark, ginkgo, fish oil, resveratrol, genistein, quercetin, resorcinol, and others.[citation needed]
«Buffering» is an additional method that is used with the intention of mitigating gastrointestinal bleeding. Buffering agents are intended to work by preventing the aspirin from concentrating in the walls of the stomach, although the benefits of buffered aspirin are disputed.[citation needed] Almost any buffering agent used in antacids can be used; Bufferin, for example, uses magnesium oxide. Other preparations use calcium carbonate.[181] Gas-forming agents in effervescent tablet and powder formulations can also double as a buffering agent, one example being sodium bicarbonate, used in Alka-Seltzer.[182]
Taking vitamin C with aspirin has been investigated as a method of protecting the stomach lining. In trials vitamin C-releasing aspirin (ASA-VitC) or a buffered aspirin formulation containing vitamin C was found to cause less stomach damage than aspirin alone.[183][184]
Retinal vein occlusion[edit]
It is a widespread habit among eye specialists (ophthalmologists) to prescribe aspirin as an add-on medication for patients with retinal vein occlusion (RVO), such as central retinal vein occlusion (CRVO) and branch retinal vein occlusion (BRVO). The reason of this widespread use is the evidence of its proven effectiveness in major systemic venous thrombotic disorders, and it has been assumed that may be similarly beneficial in various types of retinal vein occlusion.
However, a large-scale investigation based on data of nearly 700 patients showed «that aspirin or other antiplatelet aggregating agents or anticoagulants adversely influence the visual outcome in patients with CRVO and hemi-CRVO, without any evidence of protective or beneficial effect».[185] Several expert groups, including the Royal College of Ophthalmologists, recommended against the use of antithrombotic drugs (incl. aspirin) for patients with RVO.[186]
Central effects[edit]
Large doses of salicylate, a metabolite of aspirin, cause temporary tinnitus (ringing in the ears) based on experiments in rats, via the action on arachidonic acid and NMDA receptors cascade.[187]
Reye’s syndrome[edit]
Reye’s syndrome, a rare but severe illness characterized by acute encephalopathy and fatty liver, can occur when children or adolescents are given aspirin for a fever or other illness or infection. From 1981 to 1997, 1207 cases of Reye’s syndrome in people younger than 18 were reported to the US Centers for Disease Control and Prevention (CDC). Of these, 93% reported being ill in the three weeks preceding the onset of Reye’s syndrome, most commonly with a respiratory infection, chickenpox, or diarrhea. Salicylates were detectable in 81.9% of children for whom test results were reported.[188] After the association between Reye’s syndrome and aspirin was reported, and safety measures to prevent it (including a Surgeon General’s warning, and changes to the labeling of aspirin-containing drugs) were implemented, aspirin taken by children declined considerably in the United States, as did the number of reported cases of Reye’s syndrome; a similar decline was found in the United Kingdom after warnings against pediatric aspirin use were issued.[188] The US Food and Drug Administration recommends aspirin (or aspirin-containing products) should not be given to anyone under the age of 12 who has a fever,[173] and the UK National Health Service recommends children who are under 16 years of age should not take aspirin, unless it is on the advice of a doctor.[189]
Skin[edit]
For a small number of people, taking aspirin can result in symptoms including hives, swelling, and headache.[190] Aspirin can exacerbate symptoms among those with chronic hives, or create acute symptoms of hives.[191] These responses can be due to allergic reactions to aspirin, or more often due to its effect of inhibiting the COX-1 enzyme.[191][192] Skin reactions may also tie to systemic contraindications, seen with NSAID-precipitated bronchospasm,[191][192] or those with atopy.[193]
Aspirin and other NSAIDs, such as ibuprofen, may delay the healing of skin wounds.[194] Earlier findings from two small, low-quality trials suggested a benefit with aspirin (alongside compression therapy) on venous leg ulcer healing time and leg ulcer size,[195][196][197] however larger, more recent studies of higher quality have been unable to corroborate these outcomes.[198][199] As such, further research is required to clarify the role of aspirin in this context.
Other adverse effects[edit]
Aspirin can induce swelling of skin tissues in some people. In one study, angioedema appeared one to six hours after ingesting aspirin in some of the people. However, when the aspirin was taken alone, it did not cause angioedema in these people; the aspirin had been taken in combination with another NSAID-induced drug when angioedema appeared.[200]
Aspirin causes an increased risk of cerebral microbleeds having the appearance on MRI scans of 5 to 10 mm or smaller, hypointense (dark holes) patches.[201][202]
A study of a group with a mean dosage of aspirin of 270 mg per day estimated an average absolute risk increase in intracerebral hemorrhage (ICH) of 12 events per 10,000 persons.[203] In comparison, the estimated absolute risk reduction in myocardial infarction was 137 events per 10,000 persons, and a reduction of 39 events per 10,000 persons in ischemic stroke.[203] In cases where ICH already has occurred, aspirin use results in higher mortality, with a dose of about 250 mg per day resulting in a relative risk of death within three months after the ICH around 2.5 (95% confidence interval 1.3 to 4.6).[204]
Aspirin and other NSAIDs can cause abnormally high blood levels of potassium by inducing a hyporeninemic hypoaldosteronic state via inhibition of prostaglandin synthesis; however, these agents do not typically cause hyperkalemia by themselves in the setting of normal renal function and euvolemic state.[205]
Use of low-dose aspirin before a surgical procedure has been associated with an increased risk of bleeding events in some patients, however, ceasing aspirin prior to surgery has also been associated with an increase in major adverse cardiac events. An analysis of multiple studies found a three-fold increase in adverse events such as myocardial infarction in patients who ceased aspirin prior to surgery. The analysis found that the risk is dependent on the type of surgery being performed and the patient indication for aspirin use.[206]
On 9 July 2015, the US Food and Drug Administration (FDA) toughened warnings of increased heart attack and stroke risk associated with nonsteroidal anti-inflammatory drugs (NSAID).[207] Aspirin is an NSAID but is not affected by the new warnings.[207]
Overdose[edit]
Aspirin overdose can be acute or chronic. In acute poisoning, a single large dose is taken; in chronic poisoning, higher than normal doses are taken over a period of time. Acute overdose has a mortality rate of 2%. Chronic overdose is more commonly lethal, with a mortality rate of 25%;[208] chronic overdose may be especially severe in children.[209] Toxicity is managed with a number of potential treatments, including activated charcoal, intravenous dextrose and normal saline, sodium bicarbonate, and dialysis.[210] The diagnosis of poisoning usually involves measurement of plasma salicylate, the active metabolite of aspirin, by automated spectrophotometric methods. Plasma salicylate levels in general range from 30 to 100 mg/L after usual therapeutic doses, 50–300 mg/L in people taking high doses and 700–1400 mg/L following acute overdose. Salicylate is also produced as a result of exposure to bismuth subsalicylate, methyl salicylate, and sodium salicylate.[211][212]
Interactions[edit]
Aspirin is known to interact with other drugs. For example, acetazolamide and ammonium chloride are known to enhance the intoxicating effect of salicylates, and alcohol also increases the gastrointestinal bleeding associated with these types of drugs.[166][167] Aspirin is known to displace a number of drugs from protein-binding sites in the blood, including the antidiabetic drugs tolbutamide and chlorpropamide, warfarin, methotrexate, phenytoin, probenecid, valproic acid (as well as interfering with beta oxidation, an important part of valproate metabolism), and other NSAIDs. Corticosteroids may also reduce the concentration of aspirin. Other NSAIDs, such as ibuprofen and naproxen, may reduce the antiplatelet effect of aspirin.[213][214] Although limited evidence suggests this may not result in a reduced cardioprotective effect of aspirin.[213] Analgesic doses of aspirin decrease sodium loss induced by spironolactone in the urine, however this does not reduce the antihypertensive effects of spironolactone.[215] Furthermore, antiplatelet doses of aspirin are deemed too small to produce an interaction with spironolactone.[216] Aspirin is known to compete with penicillin G for renal tubular secretion.[217] Aspirin may also inhibit the absorption of vitamin C.[218][219][unreliable medical source?][220]
Research[edit]
The ISIS-2 trial demonstrated that aspirin at doses of 160 mg daily for one month, decreased the mortality by 21% of participants with a suspected myocardial infarction in the first five weeks.[221] A single daily dose of 324 mg of aspirin for 12 weeks has a highly protective effect against acute myocardial infarction and death in men with unstable angina.[222]
Bipolar disorder[edit]
Aspirin has been repurposed as an add-on treatment for depressive episodes in subjects with bipolar disorder.[133] However, meta-analytic evidence is based on very few studies and does not suggest any efficacy of aspirin in the treatment of bipolar depression.[133] Thus, notwithstanding the biological rationale, the clinical perspectives of aspirin and anti-inflammatory agents in the treatment of bipolar depression remain uncertain.[133]
Infectious diseases[edit]
Several studies investigated the anti-infective properties of aspirin for bacterial, viral and parasitic infections. Aspirin was demonstrated to limit platelet activation induced by Staphylococcus aureus and Enterococcus faecalis and to reduce streptococcal adhesion to heart valves. In patients with tuberculous meningitis, the addition of aspirin reduced the risk of new cerebral infarction [RR = 0.52 (0.29-0.92)]. A role of aspirin on bacterial and fungal biofilm is also being supported by growing evidence.[223]
Cancer prevention[edit]
Aspirin might weakly reduce the risk of breast cancer per a 2020 meta-analysis.[224]
In gardening[edit]
There are a many anecdotal reportings that aspirin can improve plant’s growth and resistance[225][226] though most research involved salicylic acid instead of aspirin.[227]
Veterinary medicine[edit]
Aspirin is sometimes used in veterinary medicine as an anticoagulant or to relieve pain associated with musculoskeletal inflammation or osteoarthritis. Aspirin should only be given to animals under the direct supervision of a veterinarian, as adverse effects—including gastrointestinal issues—are common. An aspirin overdose in any species may result in salicylate poisoning, characterized by hemorrhaging, seizures, coma, and even death.[228]
Dogs are better able to tolerate aspirin than cats are.[229] Cats metabolize aspirin slowly because they lack the glucuronide conjugates that aid in the excretion of aspirin, making it potentially toxic if dosing is not spaced out properly.[228][230] No clinical signs of toxicosis occurred when cats were given 25 mg/kg of aspirin every 48 hours for 4 weeks,[229] but the recommended dose for relief of pain and fever and for treating blood clotting diseases in cats is 10 mg/kg every 48 hours to allow for metabolization.[228][231]
See also[edit]
- Fluoroaspirin
References[edit]
- ^ «Aspirin Use During Pregnancy». Drugs.com. 2 April 2018. Retrieved 29 December 2019.
- ^ https://www.tga.gov.au/resources/publication/publications/otc-medicine-monograph-aspirin-tablets-oral-use
- ^ «Poisons Standard October 2022». Australian Government Federal Register of Legislation. Retrieved 9 January 2023.
- ^ a b «Zorprin, Bayer Buffered Aspirin (aspirin) dosing, indications, interactions, adverse effects, and more». Medscape Reference. WebMD. Archived from the original on 7 April 2014. Retrieved 3 April 2014.
- ^ a b c Brayfield A, ed. (14 January 2014). «Aspirin». Martindale: The Complete Drug Reference. Pharmaceutical Press. Retrieved 3 April 2014.
- ^ CID 2244 from PubChem
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 3.8. ISBN 1-4398-5511-0.
- ^ a b c d e f g h i j k l m n «Aspirin». American Society of Health-System Pharmacists. 29 November 2021. Archived from the original on 25 April 2017 – via Drugs.com.
- ^ a b Jones A (2015). Chemistry: An Introduction for Medical and Health Sciences. John Wiley & Sons. pp. 5–6. ISBN 978-0-470-09290-3.
- ^ Ravina E (2011). The Evolution of Drug Discovery: From Traditional Medicines to Modern Drugs. John Wiley & Sons. p. 24. ISBN 978-3-527-32669-3.
- ^ a b c d e f g h i j Jeffreys D (2008). Aspirin the remarkable story of a wonder drug. Bloomsbury Publishing USA. ISBN 978-1-59691-816-0. Archived from the original on 8 September 2017.: 46–48
- ^ a b Warner TD, Mitchell JA (October 2002). «Cyclooxygenase-3 (COX-3): filling in the gaps toward a COX continuum?». Proceedings of the National Academy of Sciences of the United States of America. 99 (21): 13371–3. Bibcode:2002PNAS…9913371W. doi:10.1073/pnas.222543099. PMC 129677. PMID 12374850.
- ^ World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. 2021. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ «The Top 300 of 2020». US Government. Retrieved 7 October 2022 – via ClinCalc.
- ^ «Aspirin — Drug Usage Statistics, US 2013-2020». ClinCalc. Retrieved 7 October 2022.
- ^ Dick B (2018). «Hard Work and Happenstance». Distillations. Vol. 4, no. 1. Science History Institute. pp. 44–45.
- ^ a b Mann CC, Plummer ML (1991). The aspirin wars: money, medicine, and 100 years of rampant competition (1st ed.). New York: Knopf. p. 27. ISBN 978-0-394-57894-1.
- ^ a b c d e «Aspirin». Chemical & Engineering News. Vol. 83, no. 25. 20 June 2005.
- ^ Reynolds EF, ed. (1982). «Aspirin and similar analgesic and anti-inflammatory agents». Martindale: the extra pharmacopoeia (28th ed.). Rittenhouse Book Distributors. pp. 234–82. ISBN 978-0-85369-160-0.
- ^ «Acetylsalicylic acid». NIOSH Pocket Guide to Chemical Hazards. U.S. National Institute for Occupational Safety and Health (NIOSH). 11 April 2016. Archived from the original on 11 May 2017.
- ^ «Appendix G: 1989 Air contaminants update project – Exposure limits NOT in effect». NIOSH pocket guide to chemical hazards. National Institute for Occupational Safety and Health. 13 February 2015. Archived from the original on 18 June 2017.
- ^ Palleros DR (2000). Experimental organic chemistry. New York: John Wiley & Sons. p. 494. ISBN 978-0-471-28250-1.
- ^ «Chemical of the Week — Acetic Acid and Acetic Anhydride». www.eng.uwaterloo.ca.
- ^ Barrans R (18 May 2008). «Aspirin aging». Newton BBS. Archived from the original on 18 May 2008.
- ^ Carstensen JT, Attarchi F (April 1988). «Decomposition of aspirin in the solid state in the presence of limited amounts of moisture III: Effect of temperature and a possible mechanism». Journal of Pharmaceutical Sciences. 77 (4): 318–21. doi:10.1002/jps.2600770407. PMID 3379589.
- ^ Myers RL (2007). The 100 most important chemical compounds: a reference guide. ABC-CLIO. p. 10. ISBN 978-0-313-33758-1. Archived from the original on 10 June 2013.
- ^ «Acetylsalicylic acid». Jinno Laboratory, School of Materials Science, Toyohashi University of Technology. 4 March 1996. Archived from the original on 20 January 2012. Retrieved 12 April 2014.
- ^ a b Vishweshwar P, McMahon JA, Oliveira M, Peterson ML, Zaworotko MJ (December 2005). «The predictably elusive form II of aspirin». Journal of the American Chemical Society. 127 (48): 16802–3. doi:10.1021/ja056455b. PMID 16316223.
- ^ Bond AD, Boese R, Desiraju GR (2007). «On the polymorphism of aspirin: crystalline aspirin as intergrowths of two «polymorphic» domains». Angewandte Chemie. 46 (4): 618–22. doi:10.1002/anie.200603373. PMID 17139692.
- ^ Vane JR (June 1971). «Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs». Nature. 231 (25): 232–5. doi:10.1038/newbio231232a0. PMID 5284360.
- ^ Vane JR, Botting RM (June 2003). «The mechanism of action of aspirin». Thrombosis Research. 110 (5–6): 255–8. doi:10.1016/s0049-3848(03)00379-7. PMID 14592543.
- ^ «The Nobel Prize in Physiology or Medicine 1982». Nobelprize.org. Archived from the original on 27 June 2017.
- ^ «Aspirin in heart attack and stroke prevention». American Heart Association. Archived from the original on 31 March 2008. Retrieved 8 May 2008.
- ^ Tohgi H, Konno S, Tamura K, Kimura B, Kawano K (October 1992). «Effects of low-to-high doses of aspirin on platelet aggregability and metabolites of thromboxane A2 and prostacyclin». Stroke. 23 (10): 1400–3. doi:10.1161/01.STR.23.10.1400. PMID 1412574.
- ^ Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, et al. (May 2009). «Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials». Lancet. 373 (9678): 1849–60. doi:10.1016/S0140-6736(09)60503-1. PMC 2715005. PMID 19482214.
- ^ Goel A, Aggarwal S, Partap S, Saurabh A, Choudhary (2012). «Pharmacokinetic solubility and dissolution profile of antiarrythmic drugs». Int J Pharma Prof Res. 3 (1): 592–601.
- ^ Martínez-González J, Badimon L (2007). «Mechanisms underlying the cardiovascular effects of COX-inhibition: benefits and risks». Current Pharmaceutical Design. 13 (22): 2215–27. doi:10.2174/138161207781368774. PMID 17691994.
- ^ Funk CD, FitzGerald GA (November 2007). «COX-2 inhibitors and cardiovascular risk». Journal of Cardiovascular Pharmacology. 50 (5): 470–9. doi:10.1097/FJC.0b013e318157f72d. PMID 18030055. S2CID 39103383.
- ^ Romano M, Cianci E, Simiele F, Recchiuti A (August 2015). «Lipoxins and aspirin-triggered lipoxins in resolution of inflammation». European Journal of Pharmacology. 760: 49–63. doi:10.1016/j.ejphar.2015.03.083. PMID 25895638.
- ^ Serhan CN, Chiang N (August 2013). «Resolution phase lipid mediators of inflammation: agonists of resolution». Current Opinion in Pharmacology. 13 (4): 632–40. doi:10.1016/j.coph.2013.05.012. PMC 3732499. PMID 23747022.
- ^ Weylandt KH (August 2016). «Docosapentaenoic acid derived metabolites and mediators — The new world of lipid mediator medicine in a nutshell». European Journal of Pharmacology. 785: 108–115. doi:10.1016/j.ejphar.2015.11.002. PMID 26546723.
- ^
- ^ Paul-Clark MJ, Van Cao T, Moradi-Bidhendi N, Cooper D, Gilroy DW (July 2004). «15-epi-lipoxin A4-mediated induction of nitric oxide explains how aspirin inhibits acute inflammation». The Journal of Experimental Medicine. 200 (1): 69–78. doi:10.1084/jem.20040566. PMC 2213311. PMID 15238606.
- ^ McCarty MF, Block KI (September 2006). «Preadministration of high-dose salicylates, suppressors of NF-kappaB activation, may increase the chemosensitivity of many cancers: an example of proapoptotic signal modulation therapy». Integrative Cancer Therapies. 5 (3): 252–68. doi:10.1177/1534735406291499. PMID 16880431.
- ^ Silva Caldas AP, Chaves LO, Linhares Da Silva L, De Castro Morais D, Gonçalves Alfenas RD (29 December 2017). «Mechanisms involved in the cardioprotective effect of avocado consumption: A systematic review». International Journal of Food Properties. 20 (sup2): 1675–1685. doi:10.1080/10942912.2017.1352601. ISSN 1094-2912.
…there was postprandial reduction on the plasma concentration of IL-6 and IkBα preservation, followed by the lower activation of NFκB, considered the main transcription factor capable of inducing inflammatory response by stimulating the expression of proinflammatory cytokines, chemokines, and adhesion molecules.
- ^ Chen L, Deng H, Cui H, Fang J, Zuo Z, Deng J, et al. (January 2018). «Inflammatory responses and inflammation-associated diseases in organs». Oncotarget. 9 (6): 7204–7218. doi:10.18632/oncotarget.23208. PMC 5805548. PMID 29467962.
- ^ Lawrence T (December 2009). «The nuclear factor NF-kappaB pathway in inflammation». Cold Spring Harbor Perspectives in Biology. 1 (6): a001651. doi:10.1101/cshperspect.a001651. PMC 2882124. PMID 20457564.
- ^ Hawley SA, Fullerton MD, Ross FA, Schertzer JD, Chevtzoff C, Walker KJ, et al. (May 2012). «The ancient drug salicylate directly activates AMP-activated protein kinase». Science. 336 (6083): 918–22. Bibcode:2012Sci…336..918H. doi:10.1126/science.1215327. PMC 3399766. PMID 22517326.
- ^ «Clues to aspirin’s anti-cancer effects revealed». New Scientist. 214 (2862): 16. 28 April 2012. doi:10.1016/S0262-4079(12)61073-2.
- ^ Alfonso LF, Srivenugopal KS, Arumugam TV, Abbruscato TJ, Weidanz JA, Bhat GJ (March 2009). «Aspirin inhibits camptothecin-induced p21CIP1 levels and potentiates apoptosis in human breast cancer cells». International Journal of Oncology. 34 (3): 597–608. doi:10.3892/ijo_00000185. PMID 19212664.
- ^ Alfonso LF, Srivenugopal KS, Bhat GJ (2009). «Does aspirin acetylate multiple cellular proteins? (Review)». Molecular Medicine Reports (review). 2 (4): 533–7. doi:10.3892/mmr_00000132. PMID 21475861.
- ^ Alfonso LF, Srivenugopal KS, Bhat GJ (4 June 2009). «Does aspirin acetylate multiple cellular proteins? (Review)». Molecular Medicine Reports. 2 (4): 533–537. doi:10.3892/mmr_00000132. PMID 21475861.
- ^ Franchi F, Schneider D, Prats J, Fan W, Rollini F, Been L, et al. (2021). «TCT-320 Pharmacokinetic and Pharmacodynamic Profile of PL-ASA, a Novel Phospholipid-Aspirin Complex Liquid Formulation, Compared to Enteric-Coated Aspirin at an 81-mg Dose – Results From a Prospective, Randomized, Crossover Study». Journal of the American College of Cardiology. Elsevier BV. 78 (19): B131. doi:10.1016/j.jacc.2021.09.1173. ISSN 0735-1097.
- ^ Ferguson RK, Boutros AR (August 1970). «Death following self-poisoning with aspirin». JAMA. 213 (7): 1186–8. doi:10.1001/jama.213.7.1186. PMID 5468267.
- ^ Kaufman FL, Dubansky AS (April 1972). «Darvon poisoning with delayed salicylism: a case report». Pediatrics. 49 (4): 610–1. doi:10.1542/peds.49.4.610. PMID 5013423. S2CID 29427204.
- ^ a b c Levy G, Tsuchiya T (August 1972). «Salicylate accumulation kinetics in man». The New England Journal of Medicine. 287 (9): 430–2. doi:10.1056/NEJM197208312870903. PMID 5044917.
- ^ Grootveld M, Halliwell B (January 1988). «2,3-Dihydroxybenzoic acid is a product of human aspirin metabolism». Biochemical Pharmacology. 37 (2): 271–80. doi:10.1016/0006-2952(88)90729-0. PMID 3342084.
- ^ Hartwig-Otto H (November 1983). «Pharmacokinetic considerations of common analgesics and antipyretics». The American Journal of Medicine. 75 (5A): 30–7. doi:10.1016/0002-9343(83)90230-9. PMID 6606362.
- ^ Done AK (November 1960). «Salicylate intoxication. Significance of measurements of salicylate in blood in cases of acute ingestion». Pediatrics. 26: 800–7. doi:10.1542/peds.26.5.800. PMID 13723722. S2CID 245036862.
- ^ Chyka PA, Erdman AR, Christianson G, Wax PM, Booze LL, Manoguerra AS, et al. (2007). «Salicylate poisoning: an evidence-based consensus guideline for out-of-hospital management». Clinical Toxicology. 45 (2): 95–131. doi:10.1080/15563650600907140. PMID 17364628.
- ^ Prescott LF, Balali-Mood M, Critchley JA, Johnstone AF, Proudfoot AT (November 1982). «Diuresis or urinary alkalinisation for salicylate poisoning?». British Medical Journal. 285 (6352): 1383–6. doi:10.1136/bmj.285.6352.1383. PMC 1500395. PMID 6291695.
- ^ Dargan PI, Wallace CI, Jones AL (May 2002). «An evidence based flowchart to guide the management of acute salicylate (aspirin) overdose». Emergency Medicine Journal. 19 (3): 206–9. doi:10.1136/emj.19.3.206. PMC 1725844. PMID 11971828.
- ^ a b D’Agati V (July 1996). «Does aspirin cause acute or chronic renal failure in experimental animals and in humans?». American Journal of Kidney Diseases. 28 (1 Suppl 1): S24-9. doi:10.1016/s0272-6386(96)90565-x. PMID 8669425.
- ^ Goldberg DR (Summer 2009). «Aspirin: Turn of the Century Miracle Drug». Chemical Heritage. Vol. 27, no. 2. pp. 26–30.
- ^ Schiebinger L (October 2003). «Women’s health and clinical trials». The Journal of Clinical Investigation. 112 (7): 973–7. doi:10.1172/JCI19993. PMC 198535. PMID 14523031.
- ^ «Regular aspirin intake and acute myocardial infarction». British Medical Journal. 1 (5905): 440–3. March 1974. doi:10.1136/bmj.1.5905.440. PMC 1633212. PMID 4816857.
- ^ Elwood PC, Cochrane AL, Burr ML, Sweetnam PM, Williams G, Welsby E, et al. (March 1974). «A randomized controlled trial of acetyl salicylic acid in the secondary prevention of mortality from myocardial infarction». British Medical Journal. 1 (5905): 436–40. doi:10.1136/bmj.1.5905.436. PMC 1633246. PMID 4593555.
- ^ Bayer Co. v. United Drug Co., 272 F. 505, p.512 (S.D.N.Y 1921).
- ^ «Has aspirin become a generic trademark?». genericides.org. 25 March 2020. Archived from the original on 5 March 2021. Retrieved 17 February 2021.
- ^ Huth EJ, et al. (CBE Style Manual Committee) (1994). Scientific style and format: the CBE manual for authors, editors, and publishers. Cambridge University Press. p. 164. Bibcode:1994ssfc.book…..S. ISBN 978-0-521-47154-1. Archived from the original on 15 October 2015.
- ^ «Aspirin: the versatile drug». CBC News. 28 May 2009. Archived from the original on 6 November 2016.
- ^ Cheng TO (2007). «The history of aspirin». Texas Heart Institute Journal. 34 (3): 392–3. PMC 1995051. PMID 17948100.
- ^ «Aspirin». Sigma Aldrich. Retrieved 24 January 2022.
- ^ «Index BP 2009» (PDF). British Pharmacopoeia. Archived from the original (PDF) on 11 April 2009. Retrieved 13 July 2009.
- ^
This article incorporates text from this source, which is in the public domain: «Aspirin for reducing your risk of heart attack and stroke: know the facts». U.S. Food and Drug Administration (FDA). Archived from the original on 14 August 2012. Retrieved 26 July 2012.
- ^
This article incorporates text from this source, which is in the public domain: «Aspirin for the prevention of cardiovascular disease». U.S. Preventive Services Task Force. Archived from the original on 11 July 2012. Retrieved 26 July 2012.
- ^ Seshasai SR, Wijesuriya S, Sivakumaran R, Nethercott S, Erqou S, Sattar N, et al. (February 2012). «Effect of aspirin on vascular and nonvascular outcomes: meta-analysis of randomized controlled trials». Archives of Internal Medicine. 172 (3): 209–16. doi:10.1001/archinternmed.2011.628. hdl:10044/1/34287. PMID 22231610.
- ^ McNeil JJ, Woods RL, Nelson MR, Reid CM, Kirpach B, Wolfe R, et al. (October 2018). «Effect of Aspirin on Disability-free Survival in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1499–1508. doi:10.1056/NEJMoa1800722. hdl:1885/154654. PMC 6426126. PMID 30221596.
- ^ McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR, et al. (October 2018). «Effect of Aspirin on Cardiovascular Events and Bleeding in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1509–1518. doi:10.1056/NEJMoa1805819. PMC 6289056. PMID 30221597.
- ^ a b Algra AM, Rothwell PM (May 2012). «Effects of regular aspirin on long-term cancer incidence and metastasis: a systematic comparison of evidence from observational studies versus randomised trials». The Lancet. Oncology. 13 (5): 518–27. doi:10.1016/S1470-2045(12)70112-2. PMID 22440112.
- ^ Davidson KW, Barry MJ, Mangione CM, Cabana M, Chelmow D, Coker TR, et al. (April 2022). «Aspirin Use to Prevent Cardiovascular Disease: US Preventive Services Task Force Recommendation Statement». JAMA. 327 (16): 1577–1584. doi:10.1001/jama.2022.4983. PMID 35471505. S2CID 248390304.
- ^ Sachs CJ (March 2005). «Oral analgesics for acute nonspecific pain». American Family Physician. 71 (5): 913–8. PMID 15768621.
- ^ Gaciong Z (June 2003). «The real dimension of analgesic activity of aspirin». Thrombosis Research. 110 (5–6): 361–4. doi:10.1016/j.thromres.2003.08.009. PMID 14592563.
- ^ Derry CJ, Derry S, Moore RA (December 2014). «Caffeine as an analgesic adjuvant for acute pain in adults». The Cochrane Database of Systematic Reviews. 2014 (12): CD009281. doi:10.1002/14651858.CD009281.pub3. PMC 6485702. PMID 25502052.
- ^ Hersh EV, Moore PA, Ross GL (May 2000). «Over-the-counter analgesics and antipyretics: a critical assessment». Clinical Therapeutics. 22 (5): 500–48. doi:10.1016/S0149-2918(00)80043-0. PMID 10868553.
- ^ Mett A, Tfelt-Hansen P (June 2008). «Acute migraine therapy: recent evidence from randomized comparative trials». Current Opinion in Neurology. 21 (3): 331–7. doi:10.1097/WCO.0b013e3282fee843. PMID 18451718. S2CID 44459366.
- ^ Kingery WS (November 1997). «A critical review of controlled clinical trials for peripheral neuropathic pain and complex regional pain syndromes». Pain. 73 (2): 123–139. doi:10.1016/S0304-3959(97)00049-3. PMID 9415498. S2CID 10418793.
- ^ Loder E, Rizzoli P (January 2008). «Tension-type headache». BMJ. 336 (7635): 88–92. doi:10.1136/bmj.39412.705868.AD. PMC 2190284. PMID 18187725.
- ^ Gilmore B, Michael M (February 2011). «Treatment of acute migraine headache». American Family Physician. 83 (3): 271–80. PMID 21302868.
- ^ Bartfai T, Conti B (March 2010). «Fever». TheScientificWorldJournal. 10: 490–503. doi:10.1100/tsw.2010.50. PMC 2850202. PMID 20305990.
- ^ Pugliese A, Beltramo T, Torre D (October 2008). «Reye’s and Reye’s-like syndromes». Cell Biochemistry and Function. 26 (7): 741–6. doi:10.1002/cbf.1465. PMID 18711704. S2CID 22361194.
- ^ Beutler AI, Chesnut GT, Mattingly JC, Jamieson B (December 2009). «FPIN’s Clinical Inquiries. Aspirin use in children for fever or viral syndromes». American Family Physician. 80 (12): 1472. PMID 20000310.
- ^ «Medications Used to Treat Fever». American Academy of Pediatrics. Archived from the original on 18 February 2013. Retrieved 25 November 2012.
- ^ «51 FR 8180» (PDF). United States Federal Register. 51 (45). 7 March 1986. Archived from the original (PDF) on 19 August 2011.
- ^ Morris T, Stables M, Hobbs A, de Souza P, Colville-Nash P, Warner T, et al. (August 2009). «Effects of low-dose aspirin on acute inflammatory responses in humans». Journal of Immunology. 183 (3): 2089–96. doi:10.4049/jimmunol.0900477. PMID 19597002.
- ^ National Clinical Guideline Centre (UK) (July 2013). «Myocardial infarction with ST-segment elevation: the acute management of myocardial infarction with ST-segment elevation [Internet]». NICE Clinical Guidelines (167). 17.2 Aspirin. PMID 25340241. Archived from the original on 31 December 2015.
- ^ a b c Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. (September 2019). «2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines». Journal of the American College of Cardiology. 74 (10): e177–e232. doi:10.1016/j.jacc.2019.03.010. PMC 7685565. PMID 30894318.
- ^ Smith RJ, Bryant RG (October 1975). «Metal substitutions incarbonic anhydrase: a halide ion probe study». Biochemical and Biophysical Research Communications. 66 (4): 1281–1286. doi:10.1016/0006-291x(75)90498-2. ISSN 0006-291X. PMC 9650581. PMID 3.
- ^ a b c Rothwell PM, Cook NR, Gaziano JM, Price JF, Belch JF, Roncaglioni MC, et al. (August 2018). «Effects of aspirin on risks of vascular events and cancer according to bodyweight and dose: analysis of individual patient data from randomised trials». Lancet. 392 (10145): 387–399. doi:10.1016/S0140-6736(18)31133-4. PMC 6083400. PMID 30017552.
- ^ Bowman L, Mafham M, Wallendszus K, Stevens W, Buck G, Barton J, et al. (October 2018). «Effects of Aspirin for Primary Prevention in Persons with Diabetes Mellitus». The New England Journal of Medicine. 379 (16): 1529–1539. doi:10.1056/NEJMoa1804988. PMID 30146931.
- ^ McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR, et al. (October 2018). «Effect of Aspirin on Cardiovascular Events and Bleeding in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1509–1518. doi:10.1056/NEJMoa1805819. PMC 6289056. PMID 30221597.
- ^ Woods RL, Polekhina G, Wolfe R, Nelson MR, Ernst ME, Reid CM, et al. (March 2020). «No Modulation of the Effect of Aspirin by Body Weight in Healthy Older Men and Women». Circulation. 141 (13): 1110–1112. doi:10.1161/CIRCULATIONAHA.119.044142. PMC 7286412. PMID 32223674.
- ^ National Guideline Clearinghouse (NGC). «2011 ACCF/AHA/SCAI guideline for percutaneous coronary artery intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions». United States Agency for Healthcare Research and Quality (AHRQ). Archived from the original on 13 August 2012. Retrieved 28 August 2012.
- ^ Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK (August 2001). «Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation» (PDF). The New England Journal of Medicine. 345 (7): 494–502. doi:10.1056/nejmoa010746. PMID 11519503.
- ^ Costa F, Vranckx P, Leonardi S, Moscarella E, Ando G, Calabro P, et al. (May 2015). «Impact of clinical presentation on ischaemic and bleeding outcomes in patients receiving 6- or 24-month duration of dual-antiplatelet therapy after stent implantation: a pre-specified analysis from the PRODIGY (Prolonging Dual-Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia) trial». European Heart Journal. 36 (20): 1242–51. doi:10.1016/s0735-1097(15)61590-x. PMID 25718355.
- ^ Khan SU, Singh M, Valavoor S, Khan MU, Lone AN, Khan MZ, et al. (October 2020). «Dual Antiplatelet Therapy After Percutaneous Coronary Intervention and Drug-Eluting Stents: A Systematic Review and Network Meta-Analysis». Circulation. 142 (15): 1425–1436. doi:10.1161/CIRCULATIONAHA.120.046308. PMC 7547897. PMID 32795096.
- ^ Capodanno D, Alfonso F, Levine GN, Valgimigli M, Angiolillo DJ (December 2018). «ACC/AHA Versus ESC Guidelines on Dual Antiplatelet Therapy: JACC Guideline Comparison». Journal of the American College of Cardiology. 72 (23 Pt A): 2915–2931. doi:10.1016/j.jacc.2018.09.057. PMID 30522654.
- ^ Levine GN, Bates ER, Bittl JA, Brindis RG, Fihn SD, Fleisher LA, et al. (September 2016). «2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines». Journal of the American College of Cardiology. 68 (10): 1082–115. doi:10.1016/j.jacc.2016.03.513. PMID 27036918.
- ^ Valgimigli M, Bueno H, Byrne RA, Collet JP, Costa F, Jeppsson A, et al. (January 2018). «2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS)». European Heart Journal. 39 (3): 213–260. doi:10.1093/eurheartj/ehx419. PMID 28886622.
- ^ a b Visseren FL, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. (September 2021). «2021 ESC Guidelines on cardiovascular disease prevention in clinical practice». European Heart Journal. 42 (34): 3227–3337. doi:10.1093/eurheartj/ehab484. PMID 34458905.
- ^ Norris JW (September 2005). «Antiplatelet agents in secondary prevention of stroke: a perspective». Stroke. 36 (9): 2034–6. doi:10.1161/01.STR.0000177887.14339.46. PMID 16100022.
- ^ Sleight P, Pouleur H, Zannad F (July 2006). «Benefits, challenges, and registerability of the polypill». European Heart Journal. 27 (14): 1651–6. doi:10.1093/eurheartj/ehi841. PMID 16603580.
- ^ Wang TH, Bhatt DL, Topol EJ (March 2006). «Aspirin and clopidogrel resistance: an emerging clinical entity». European Heart Journal. 27 (6): 647–54. doi:10.1093/eurheartj/ehi684. PMID 16364973.
- ^ Oliveira DC, Silva RF, Silva DJ, Lima VC (September 2010). «Aspirin resistance: fact or fiction?». Arquivos Brasileiros de Cardiologia. 95 (3): e91-4. doi:10.1590/S0066-782X2010001300024. PMID 20944898.
- ^ Topçuoglu MA, Arsava EM, Ay H (February 2011). «Antiplatelet resistance in stroke». Expert Review of Neurotherapeutics. 11 (2): 251–63. doi:10.1586/ern.10.203. PMC 3086673. PMID 21306212.
- ^ Ben-Dor I, Kleiman NS, Lev E (July 2009). «Assessment, mechanisms, and clinical implication of variability in platelet response to aspirin and clopidogrel therapy». The American Journal of Cardiology. 104 (2): 227–33. doi:10.1016/j.amjcard.2009.03.022. PMID 19576352.
- ^
This article incorporates text from this source, which is in the public domain: «Recommendation: Aspirin Use to Prevent Cardiovascular Disease: Preventive Medication». United States Preventive Services Taskforce. 23 November 2020. Retrieved 5 May 2022.
- ^ Davidson KW, Barry MJ, Mangione CM, Cabana M, Chelmow D, Coker TR, et al. (April 2022). «Aspirin Use to Prevent Cardiovascular Disease: US Preventive Services Task Force Recommendation Statement». JAMA. 327 (16): 1577–1584. doi:10.1001/jama.2022.4983. PMID 35471505.
- ^ Allison Aubrey; Will Stone (26 April 2022). «Older adults shouldn’t start a routine of daily aspirin, task force says». NPR.
- ^ a b Cuzick J, Thorat MA, Bosetti C, Brown PH, Burn J, Cook NR, et al. (January 2015). «Estimates of benefits and harms of prophylactic use of aspirin in the general population». Annals of Oncology. 26 (1): 47–57. doi:10.1093/annonc/mdu225. PMC 4269341. PMID 25096604.
- ^ Manzano A, Pérez-Segura P (29 April 2012). «Colorectal cancer chemoprevention: is this the future of colorectal cancer prevention?». TheScientificWorldJournal. 2012: 327341. doi:10.1100/2012/327341. PMC 3353298. PMID 22649288.
- ^ Chan AT, Arber N, Burn J, Chia WK, Elwood P, Hull MA, et al. (February 2012). «Aspirin in the chemoprevention of colorectal neoplasia: an overview». Cancer Prevention Research. 5 (2): 164–78. doi:10.1158/1940-6207.CAPR-11-0391. PMC 3273592. PMID 22084361.
- ^ Thun MJ, Jacobs EJ, Patrono C (April 2012). «The role of aspirin in cancer prevention». Nature Reviews. Clinical Oncology. 9 (5): 259–67. doi:10.1038/nrclinonc.2011.199. PMID 22473097. S2CID 3332999.
- ^ Richman IB, Owens DK (July 2017). «Aspirin for Primary Prevention». The Medical Clinics of North America (Review). 101 (4): 713–724. doi:10.1016/j.mcna.2017.03.004. PMID 28577622.
- ^ Verdoodt F, Friis S, Dehlendorff C, Albieri V, Kjaer SK (February 2016). «Non-steroidal anti-inflammatory drug use and risk of endometrial cancer: A systematic review and meta-analysis of observational studies». Gynecologic Oncology. 140 (2): 352–8. doi:10.1016/j.ygyno.2015.12.009. PMID 26701413.
- ^ Bosetti C, Rosato V, Gallus S, Cuzick J, La Vecchia C (June 2012). «Aspirin and cancer risk: a quantitative review to 2011». Annals of Oncology. 23 (6): 1403–15. doi:10.1093/annonc/mds113. PMID 22517822.
- ^ Sutcliffe P, Connock M, Gurung T, Freeman K, Johnson S, Kandala NB, et al. (September 2013). «Aspirin for prophylactic use in the primary prevention of cardiovascular disease and cancer: a systematic review and overview of reviews». Health Technology Assessment. 17 (43): 1–253. doi:10.3310/hta17430. PMC 4781046. PMID 24074752.
- ^ Kim SE (2014). «The benefit-risk consideration in long-term use of alternate-day, low dose aspirin: focus on colorectal cancer prevention». Annals of Gastroenterology. 27 (1): 87–88. PMC 3959543. PMID 24714632.
- ^ U.S. Preventive Services Task Force (March 2007). «Routine aspirin or nonsteroidal anti-inflammatory drugs for the primary prevention of colorectal cancer: U.S. Preventive Services Task Force recommendation statement». Annals of Internal Medicine. 146 (5): 361–4. doi:10.7326/0003-4819-146-5-200703060-00008. PMID 17339621.
- ^ Bibbins-Domingo K (June 2016). «Aspirin Use for the Primary Prevention of Cardiovascular Disease and Colorectal Cancer: U.S. Preventive Services Task Force Recommendation Statement». Annals of Internal Medicine. 164 (12): 836–45. doi:10.7326/m16-0577. PMID 27064677.
- Lay summary in: «Who developed these recommendations?». Annals of Internal Medicine. 21 June 2016.
- ^ Bosetti C, Santucci C, Gallus S, Martinetti M, La Vecchia C (May 2020). «Aspirin and the risk of colorectal and other digestive tract cancers: an updated meta-analysis through 2019». Annals of Oncology. 31 (5): 558–568. doi:10.1016/j.annonc.2020.02.012. PMID 32272209.
The present comprehensive meta-analysis supports and further quantifies the inverse association between regular aspirin use and the risk of colorectal and other digestive tract cancers, including some rare ones. The favorable effect of aspirin increases with longer duration of use, and, for colorectal cancer, with increasing dose.
- ^ McNeil JJ, Nelson MR, Woods RL, Lockery JE, Wolfe R, Reid CM, et al. (October 2018). «Effect of Aspirin on All-Cause Mortality in the Healthy Elderly». The New England Journal of Medicine. 379 (16): 1519–1528. doi:10.1056/NEJMoa1803955. PMC 6433466. PMID 30221595.
- ^ a b c d e f Bartoli F, Cavaleri D, Bachi B, Moretti F, Riboldi I, Crocamo C, et al. (September 2021). «Repurposed drugs as adjunctive treatments for mania and bipolar depression: A meta-review and critical appraisal of meta-analyses of randomized placebo-controlled trials». Journal of Psychiatric Research. 143: 230–238. doi:10.1016/j.jpsychires.2021.09.018. PMID 34509090. S2CID 237485915.
- ^ Li H, Li W, Zhang X, Ma XC, Zhang RW (4 February 2021). «Aspirin Use on Incident Dementia and Mild Cognitive Decline: A Systematic Review and Meta-Analysis». Frontiers in Aging Neuroscience. 12: 578071. doi:10.3389/fnagi.2020.578071. PMC 7890199. PMID 33613260.
- ^ Veronese N, Stubbs B, Maggi S, Thompson T, Schofield P, Muller C, et al. (August 2017). «Low-Dose Aspirin Use and Cognitive Function in Older Age: A Systematic Review and Meta-analysis». Journal of the American Geriatrics Society. 65 (8): 1763–1768. doi:10.1111/jgs.14883. PMC 6810633. PMID 28425093.
- ^ Schmidt L, Phelps E, Friedel J, Shokraneh F (August 2019). «Acetylsalicylic acid (aspirin) for schizophrenia». The Cochrane Database of Systematic Reviews. 2019 (8): CD012116. doi:10.1002/14651858.CD012116.pub2. PMC 6699651. PMID 31425623.
- ^ a b National Heart Foundation of Australia (RF/RHD guideline development working group) and the Cardiac Society of Australia and New Zealand (2006). «Diagnosis and management of acute rheumatic fever and rheumatic heart disease in Australia. An evidence-based review» (PDF). National Heart Foundation of Australia. pp. 33–37. Archived from the original (PDF) on 26 July 2008.
- ^ Saxena A, Kumar RK, Gera RP, Radhakrishnan S, Mishra S, Ahmed Z (July 2008). «Consensus guidelines on pediatric acute rheumatic fever and rheumatic heart disease». Indian Pediatrics. 45 (7): 565–73. PMID 18695275.
- ^ Hashkes PJ, Tauber T, Somekh E, Brik R, Barash J, Mukamel M, et al. (September 2003). «Naproxen as an alternative to aspirin for the treatment of arthritis of rheumatic fever: a randomized trial». The Journal of Pediatrics. 143 (3): 399–401. doi:10.1067/S0022-3476(03)00388-3. PMID 14517527.
- ^ Rowley AH, Shulman ST (February 2010). «Pathogenesis and management of Kawasaki disease». Expert Review of Anti-Infective Therapy. 8 (2): 197–203. doi:10.1586/eri.09.109. PMC 2845298. PMID 20109049.
- ^ Baumer JH, Love SJ, Gupta A, Haines LC, Maconochie I, Dua JS (October 2006). «Salicylate for the treatment of Kawasaki disease in children». The Cochrane Database of Systematic Reviews. 2010 (4): CD004175. doi:10.1002/14651858.CD004175.pub2. PMC 8765111. PMID 17054199.
- ^ Duley L, Meher S, Hunter KE, Seidler AL, Askie LM (October 2019). «Antiplatelet agents for preventing pre-eclampsia and its complications». The Cochrane Database of Systematic Reviews. 2019 (10). doi:10.1002/14651858.CD004659.pub3. PMC 6820858. PMID 31684684.
- ^ Roberge S, Villa P, Nicolaides K, Giguère Y, Vainio M, Bakthi A, et al. (2012). «Early administration of low-dose aspirin for the prevention of preterm and term preeclampsia: a systematic review and meta-analysis». Fetal Diagnosis and Therapy. 31 (3): 141–6. doi:10.1159/000336662. PMID 22441437. S2CID 26372982.
- ^ Roberge S, Nicolaides K, Demers S, Hyett J, Chaillet N, Bujold E (February 2017). «The role of aspirin dose on the prevention of preeclampsia and fetal growth restriction: systematic review and meta-analysis». American Journal of Obstetrics and Gynecology. 216 (2): 110–120.e6. doi:10.1016/j.ajog.2016.09.076. PMID 27640943. S2CID 3079979.
- ^ Szabó B, Németh K, Mészáros K, Krokker L, Likó I, Saskői E, et al. (5 September 2022). «Aspirin Mediates Its Antitumoral Effect Through Inhibiting PTTG1 in Pituitary Adenoma». The Journal of Clinical Endocrinology and Metabolism. 107 (11): 3066–3079. doi:10.1210/clinem/dgac496. PMC 9681612. PMID 36059148.
- ^ Dorsch MP, Lee JS, Lynch DR, Dunn SP, Rodgers JE, Schwartz T, et al. (May 2007). «Aspirin resistance in patients with stable coronary artery disease with and without a history of myocardial infarction». The Annals of Pharmacotherapy. 41 (5): 737–41. doi:10.1345/aph.1H621. PMID 17456544. S2CID 22245507.
- ^ a b Krasopoulos G, Brister SJ, Beattie WS, Buchanan MR (January 2008). «Aspirin «resistance» and risk of cardiovascular morbidity: systematic review and meta-analysis». BMJ. 336 (7637): 195–8. doi:10.1136/bmj.39430.529549.BE. PMC 2213873. PMID 18202034.
- ^ Pignatelli P, Di Santo S, Barillà F, Gaudio C, Violi F (October 2008). «Multiple anti-atherosclerotic treatments impair aspirin compliance: effects on aspirin resistance». Journal of Thrombosis and Haemostasis. 6 (10): 1832–4. doi:10.1111/j.1538-7836.2008.03122.x. PMID 18680540. S2CID 1776526.
- ^ Grosser T, Fries S, Lawson JA, Kapoor SC, Grant GR, FitzGerald GA (January 2013). «Drug resistance and pseudoresistance: an unintended consequence of enteric coating aspirin». Circulation. 127 (3): 377–85. doi:10.1161/CIRCULATIONAHA.112.117283. PMC 3552520. PMID 23212718.
- Lay summary in: Thomas K (4 December 2012). «Study Raises Questions on Coating of Aspirin». The New York Times.
- ^ Li J, Song M, Jian Z, Guo W, Chen G, Jiang G, et al. (2014). «Laboratory aspirin resistance and the risk of major adverse cardiovascular events in patients with coronary heart disease on confirmed aspirin adherence». Journal of Atherosclerosis and Thrombosis. 21 (3): 239–47. doi:10.5551/jat.19521. PMID 24201035.
- ^ Sofi F, Marcucci R, Gori AM, Abbate R, Gensini GF (August 2008). «Residual platelet reactivity on aspirin therapy and recurrent cardiovascular events—a meta-analysis». International Journal of Cardiology. 128 (2): 166–71. doi:10.1016/j.ijcard.2007.12.010. hdl:2158/323452. PMID 18242733.
- ^ Shim EJ, Ryu CW, Park S, Lee HN, Shin HS, Kim SB (October 2018). «Relationship between adverse events and antiplatelet drug resistance in neurovascular intervention: a meta-analysis». Journal of NeuroInterventional Surgery. 10 (10): 942–948. doi:10.1136/neurintsurg-2017-013632. PMID 29352056. S2CID 38147668.
- ^ Fiolaki A, Katsanos AH, Kyritsis AP, Papadaki S, Kosmidou M, Moschonas IC, et al. (May 2017). «High on treatment platelet reactivity to aspirin and clopidogrel in ischemic stroke: A systematic review and meta-analysis». Journal of the Neurological Sciences. 376: 112–116. doi:10.1016/j.jns.2017.03.010. PMID 28431593. S2CID 3485236.
- ^ Snoep JD, Hovens MM, Eikenboom JC, van der Bom JG, Huisman MV (13 August 2007). «Association of laboratory-defined aspirin resistance with a higher risk of recurrent cardiovascular events: a systematic review and meta-analysis». Archives of Internal Medicine. 167 (15): 1593–9. doi:10.1001/archinte.167.15.1593. PMID 17698681.
- ^ a b van Oosterom N, Barras M, Bird R, Nusem I, Cottrell N (December 2020). «A Narrative Review of Aspirin Resistance in VTE Prophylaxis for Orthopaedic Surgery». Drugs. 80 (18): 1889–1899. doi:10.1007/s40265-020-01413-w. PMID 33037568. S2CID 222234431.
- ^ «Invention of the safety cap». digitaldukemed.mc.duke.edu. Archived from the original on 4 March 2016. Retrieved 4 September 2015.
- ^ a b British National Formulary (45 ed.). British Medical Journal and Royal Pharmaceutical Society of Great Britain. 2003.
- ^ «Aspirin monograph: dosages, etc». Medscape.com. Retrieved 11 May 2011.
- ^ US Preventive Services Task Force (March 2009). «Aspirin for the prevention of cardiovascular disease: U.S. Preventive Services Task Force recommendation statement». Annals of Internal Medicine. 150 (6): 396–404. doi:10.7326/0003-4819-150-6-200903170-00008. PMID 19293072.
- ^ a b «Aspirin: more evidence that low dose is all that is needed». Medscape. Medscape CME. Retrieved 11 May 2011.
- ^ Berger JS, Brown DL, Burke GL, Oberman A, Kostis JB, Langer RD, et al. (March 2009). «Aspirin Use, Dose, and Clinical Outcomes in Postmenopausal Women With Stable Cardiovascular Disease». Circulation: Cardiovascular Quality and Outcomes. 2 (2): 78–87. doi:10.1161/circoutcomes.108.791269. ISSN 1941-7713. PMC 2801891. PMID 20031819.
- ^ Sacristán JA (August 2021). «Aspirin Dosing in Cardiovascular Disease». New England Journal of Medicine. 385 (8): 764–765. doi:10.1056/nejmc2110476. ISSN 0028-4793. PMID 34407352.
- ^ British National Formulary for Children. British Medical Journal and Royal Pharmaceutical Society. 2006.
- ^ a b
This article incorporates text from this source, which is in the public domain: «FDA Warns that Using a Type of Pain and Fever Medication in Second Half of Pregnancy Could Lead to Complications». U.S. Food and Drug Administration (FDA) (Press release). 15 October 2020. Retrieved 15 October 2020.
- ^ a b c
This article incorporates text from this source, which is in the public domain: «NSAIDs may cause rare kidney problems in unborn babies». U.S. Food and Drug Administration. 21 July 2017. Retrieved 15 October 2020.
- ^ a b c d e «Aspirin information from Drugs.com». Drugs.com. Archived from the original on 9 May 2008. Retrieved 8 May 2008.
- ^ a b c «Oral Aspirin information». First DataBank. Archived from the original on 18 September 2000. Retrieved 8 May 2008.
- ^ Raithel M, Baenkler HW, Naegel A, Buchwald F, Schultis HW, Backhaus B, et al. (September 2005). «Significance of salicylate intolerance in diseases of the lower gastrointestinal tract» (PDF). Journal of Physiology and Pharmacology. 56 (Suppl 5): 89–102. PMID 16247191. Archived (PDF) from the original on 9 April 2011.
- ^ Senna GE, Andri G, Dama AR, Mezzelani P, Andri L (1995). «Tolerability of imidazole salycilate in aspirin-sensitive patients». Allergy Proceedings. 16 (5): 251–4. doi:10.2500/108854195778702675. PMID 8566739.
- ^ a b «PDR guide to over the counter (OTC) drugs». Archived from the original on 10 April 2008. Retrieved 28 April 2008.
- ^ Livingstone FB (1985). Frequencies of hemoglobin variants: thalassemia, the glucose-6-phosphate dehydrogenase deficiency, G6PD variants, and ovalocytosis in human populations. Oxford University Press. ISBN 978-0-19-503634-3.
- ^ «Dengue and dengue hemorrhagic fever: information for health care practitioners». Archived from the original on 17 March 2008. Retrieved 28 April 2008.
- ^ a b Macdonald S (November 2002). «Aspirin use to be banned in under 16 year olds». BMJ. 325 (7371): 988c–988. doi:10.1136/bmj.325.7371.988/c. PMC 1169585. PMID 12411346.
- ^ a b c Sørensen HT, Mellemkjaer L, Blot WJ, Nielsen GL, Steffensen FH, McLaughlin JK, et al. (September 2000). «Risk of upper gastrointestinal bleeding associated with use of low-dose aspirin». The American Journal of Gastroenterology. 95 (9): 2218–24. doi:10.1111/j.1572-0241.2000.02248.x. PMID 11007221. S2CID 33742424.
- ^ Torborg L (4 December 2018). «Mayo Clinic Q and A: Coated aspirin may not be as effective at reducing blood clot risk». Mayo Clinic News Network.
- ^ Delaney JA, Opatrny L, Brophy JM, Suissa S (August 2007). «Drug drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding». CMAJ. 177 (4): 347–51. doi:10.1503/cmaj.070186. PMC 1942107. PMID 17698822.
- ^ Wallace JL (October 2008). «Prostaglandins, NSAIDs, and gastric mucosal protection: why doesn’t the stomach digest itself?». Physiological Reviews. 88 (4): 1547–65. doi:10.1152/physrev.00004.2008. PMID 18923189. S2CID 448875.
- ^ Laine L, Maller ES, Yu C, Quan H, Simon T (August 2004). «Ulcer formation with low-dose enteric-coated aspirin and the effect of COX-2 selective inhibition: a double-blind trial». Gastroenterology. 127 (2): 395–402. doi:10.1053/j.gastro.2004.05.001. PMID 15300570.
- ^ Fiorucci S, Santucci L, Wallace JL, Sardina M, Romano M, del Soldato P, et al. (September 2003). «Interaction of a selective cyclooxygenase-2 inhibitor with aspirin and NO-releasing aspirin in the human gastric mucosa». Proceedings of the National Academy of Sciences of the United States of America. 100 (19): 10937–41. Bibcode:2003PNAS..10010937F. doi:10.1073/pnas.1933204100. PMC 196906. PMID 12960371.
- ^ a b Rostom A, Muir K, Dubé C, Jolicoeur E, Boucher M, Joyce J, et al. (July 2007). «Gastrointestinal safety of cyclooxygenase-2 inhibitors: a Cochrane Collaboration systematic review». Clinical Gastroenterology and Hepatology. 5 (7): 818–28, 828.e1-5, quiz 768. doi:10.1016/j.cgh.2007.03.011. PMID 17556027.
- ^ «General chemistry online: FAQ: Acids and bases: What is the buffer system in buffered aspirin?». Antoine.frostburg.edu. Archived from the original on 14 April 2011. Retrieved 11 May 2011.
- ^ Davison C, Smith BW, Smith PK (August 1962). «Effects of buffered and unbuffered acetylsalicylic acid upon the gastric acidity of normal human subjects». Journal of Pharmaceutical Sciences. 51 (8): 759–763. doi:10.1002/jps.2600510813. PMID 13883982.
- ^ Dammann HG, Saleki M, Torz M, Schulz HU, Krupp S, Schürer M, et al. (February 2004). «Effects of buffered and plain acetylsalicylic acid formulations with and without ascorbic acid on gastric mucosa in healthy subjects». Alimentary Pharmacology & Therapeutics. 19 (3): 367–74. doi:10.1111/j.1365-2036.2004.01742.x. PMID 14984384. S2CID 22688422.
- ^ Konturek PC, Kania J, Hahn EG, Konturek JW (November 2006). «Ascorbic acid attenuates aspirin-induced gastric damage: role of inducible nitric oxide synthase». Journal of Physiology and Pharmacology. 57 (Suppl 5): 125–36. PMID 17218764.
- ^ Hayreh SS (July 2014). «Ocular vascular occlusive disorders: natural history of visual outcome». Progress in Retinal and Eye Research. 41: 1–25. doi:10.1016/j.preteyeres.2014.04.001. PMC 4073304. PMID 24769221.
- ^ Ageno W, Beyer-Westendorf J, Garcia DA, Lazo-Langner A, McBane RD, Paciaroni M (January 2016). «Guidance for the management of venous thrombosis in unusual sites». Journal of Thrombosis and Thrombolysis. 41 (1): 129–43. doi:10.1007/s11239-015-1308-1. PMC 4715841. PMID 26780742.
- ^ Guitton MJ, Caston J, Ruel J, Johnson RM, Pujol R, Puel JL (May 2003). «Salicylate induces tinnitus through activation of cochlear NMDA receptors». The Journal of Neuroscience. 23 (9): 3944–52. doi:10.1523/JNEUROSCI.23-09-03944.2003. PMC 6742173. PMID 12736364.
- ^ a b Belay ED, Bresee JS, Holman RC, Khan AS, Shahriari A, Schonberger LB (May 1999). «Reye’s syndrome in the United States from 1981 through 1997». The New England Journal of Medicine. 340 (18): 1377–82. doi:10.1056/NEJM199905063401801. PMID 10228187.
- ^ «Reye’s syndrome». NHS Choices. National Health Service. 12 January 2016.
- ^ «Are You Sensitive to Aspirin? Here are Some Reasons Why». Health Essentials from Cleveland Clinic. 5 February 2015. Archived from the original on 25 October 2020. Retrieved 5 March 2020.
- ^ a b c Doña I, Barrionuevo E, Salas M, Laguna JJ, Agúndez J, García-Martín E, et al. (November 2018). «NSAIDs-hypersensitivity often induces a blended reaction pattern involving multiple organs». Scientific Reports. 8 (1): 16710. Bibcode:2018NatSR…816710D. doi:10.1038/s41598-018-34668-1. PMC 6232098. PMID 30420763.
- ^ a b Kowalski ML, Agache I, Bavbek S, Bakirtas A, Blanca M, Bochenek G, et al. (January 2019). «Diagnosis and management of NSAID-Exacerbated Respiratory Disease (N-ERD)-a EAACI position paper». Allergy. 74 (1): 28–39. doi:10.1111/all.13599. PMID 30216468. S2CID 52276808.
- ^ Sánchez-Borges M, Capriles-Hulett A (January 2000). «Atopy is a risk factor for non-steroidal anti-inflammatory drug sensitivity». Annals of Allergy, Asthma & Immunology. 84 (1): 101–6. doi:10.1016/S1081-1206(10)62748-2. PMID 10674573.
- ^ Stadelmann WK, Digenis AG, Tobin GR (August 1998). «Impediments to wound healing». American Journal of Surgery. 176 (2A Suppl): 39S–47S. doi:10.1016/S0002-9610(98)00184-6. PMID 9777971.
- ^ Layton AM, Ibbotson SH, Davies JA, Goodfield MJ (July 1994). «Randomised trial of oral aspirin for chronic venous leg ulcers». Lancet. 344 (8916): 164–5. doi:10.1016/s0140-6736(94)92759-6. PMID 7912767. S2CID 912169.
- ^ del Río Solá ML, Antonio J, Fajardo G, Vaquero Puerta C (July 2012). «Influence of aspirin therapy in the ulcer associated with chronic venous insufficiency». Annals of Vascular Surgery. 26 (5): 620–9. doi:10.1016/j.avsg.2011.02.051. hdl:10324/2904. PMID 22437068.
- ^ de Oliveira Carvalho PE, Magolbo NG, De Aquino RF, Weller CD, et al. (Cochrane Wounds Group) (February 2016). «Oral aspirin for treating venous leg ulcers». The Cochrane Database of Systematic Reviews. 2016 (2): CD009432. doi:10.1002/14651858.CD009432.pub2. PMC 8627253. PMID 26889740.
- ^ Jull A, Wadham A, Bullen C, Parag V, Kerse N, Waters J (November 2017). «Low dose aspirin as adjuvant treatment for venous leg ulceration: pragmatic, randomised, double blind, placebo controlled trial (Aspirin4VLU)». BMJ. 359: j5157. doi:10.1136/bmj.j5157. PMC 5701114. PMID 29175902.
- ^ Tilbrook H, Clark L, Cook L, Bland M, Buckley H, Chetter I, et al. (October 2018). «AVURT: aspirin versus placebo for the treatment of venous leg ulcers — a Phase II pilot randomised controlled trial». Health Technology Assessment. 22 (55): 1–138. doi:10.3310/hta22550. PMC 6204573. PMID 30325305.
- ^ Berges-Gimeno MP, Stevenson DD (June 2004). «Nonsteroidal anti-inflammatory drug-induced reactions and desensitization». The Journal of Asthma. 41 (4): 375–84. doi:10.1081/JAS-120037650. PMID 15281324. S2CID 29909460.
- ^ Vernooij MW, Haag MD, van der Lugt A, Hofman A, Krestin GP, Stricker BH, et al. (June 2009). «Use of antithrombotic drugs and the presence of cerebral microbleeds: the Rotterdam Scan Study». Archives of Neurology. 66 (6): 714–20. doi:10.1001/archneurol.2009.42. PMID 19364926.
- ^ Gorelick PB (June 2009). «Cerebral microbleeds: evidence of heightened risk associated with aspirin use». Archives of Neurology. 66 (6): 691–3. doi:10.1001/archneurol.2009.85. PMID 19506128.
- ^ a b He J, Whelton PK, Vu B, Klag MJ (December 1998). «Aspirin and risk of hemorrhagic stroke: a meta-analysis of randomized controlled trials». JAMA. 280 (22): 1930–5. doi:10.1001/jama.280.22.1930. PMID 9851479. S2CID 22997730.
- ^ Saloheimo P, Ahonen M, Juvela S, Pyhtinen J, Savolainen ER, Hillbom M (January 2006). «Regular aspirin-use preceding the onset of primary intracerebral hemorrhage is an independent predictor for death». Stroke. 37 (1): 129–33. doi:10.1161/01.STR.0000196991.03618.31. PMID 16322483.
- ^ Medical knowledge self-assessment program for students 4, By American College of Physicians, Clerkship Directors in Internal Medicine, Nephrology 227, Item 29
- ^ Giuseppe G.L. Biondi-Zoccai; Marzia Lotrionte; Pierfrancesco Agostoni; Antonio Abbate; Massimiliano Fusaro; Francesco Burzotta; Luca Testa; Imad Sheiban; Giuseppe Sangiorgi (November 2006). «A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50,279 patients at risk for coronary artery disease». European Heart Journal. 27 (22): 2667–2674. doi:10.1093/eurheartj/ehl334. ISSN 0195-668X. PMID 17053008.
- ^ a b «FDA strengthens warning of heart attack and stroke risk for non-steroidal anti-inflammatory drugs». U.S. Food and Drug Administration (FDA). 9 July 2015. Archived from the original on 11 July 2015. Retrieved 9 July 2015.
- ^ Kreplick LW (2001). «Salicylate toxicity in emergency medicine». Medscape. Archived from the original on 31 August 2012.
- ^ Gaudreault P, Temple AR, Lovejoy FH (October 1982). «The relative severity of acute versus chronic salicylate poisoning in children: a clinical comparison». Pediatrics. 70 (4): 566–9. doi:10.1542/peds.70.4.566. PMID 7122154. S2CID 12738659. (primary source)
- ^ Marx J (2006). Rosen’s emergency medicine: concepts and clinical practice. Mosby/Elsevier. p. 2242. ISBN 978-0-323-02845-5.
- ^ Morra P, Bartle WR, Walker SE, Lee SN, Bowles SK, Reeves RA (September 1996). «Serum concentrations of salicylic acid following topically applied salicylate derivatives». The Annals of Pharmacotherapy. 30 (9): 935–40. doi:10.1177/106002809603000903. PMID 8876850. S2CID 9843820.
- ^ Baselt R (2011). Disposition of toxic drugs and chemicals in man (9th ed.). Seal Beach, California: Biomedical Publications. pp. 20–23. ISBN 978-0-9626523-8-7.
- ^ a b Alqahtani Z, Jamali F (2018). «Clinical Outcomes of Aspirin Interaction with Other Non-Steroidal Anti-Inflammatory Drugs: A Systematic Review». Journal of Pharmacy & Pharmaceutical Sciences. 21 (1s): 48s–73s. doi:10.18433/jpps29854. PMID 29891025. S2CID 48361086.
- ^ Gladding PA, Webster MW, Farrell HB, Zeng IS, Park R, Ruijne N (April 2008). «The antiplatelet effect of six non-steroidal anti-inflammatory drugs and their pharmacodynamic interaction with aspirin in healthy volunteers». The American Journal of Cardiology. 101 (7): 1060–1063. doi:10.1016/j.amjcard.2007.11.054. PMID 18359332.
- ^ Baxter K, Preston CL (eds.). «Aspirin and Spironolactone». MedicinesComplete: Stockley’s Drug Interactions. Royal Pharmaceutical Society.
- ^ Hollifield JW (August 1976). «Failure of aspirin to antagonize the antihypertensive effect of spironolactone in low-renin hypertension». Southern Medical Journal. 69 (8): 1034–6. doi:10.1097/00007611-197608000-00022. PMID 785608.
- ^ Katzung BG (1998). Basic and clinical pharmacology. McGraw-Hill. p. 584. ISBN 978-0-8385-0565-6.
- ^ Loh HS, Watters K, Wilson CW (1 November 1973). «The effects of aspirin on the metabolic availability of ascorbic acid in human beings». Journal of Clinical Pharmacology. 13 (11): 480–486. doi:10.1002/j.1552-4604.1973.tb00203.x. PMID 4490672.
- ^ Basu TK (1982). «Vitamin C-aspirin interactions». International Journal for Vitamin and Nutrition Research. Supplement. 23: 83–90. PMID 6811490.
- ^ Ioannides C, Stone AN, Breacker PJ, Basu TK (December 1982). «Impairment of absorption of ascorbic acid following ingestion of aspirin in guinea pigs». Biochemical Pharmacology. 31 (24): 4035–4038. doi:10.1016/0006-2952(82)90652-9. PMID 6818974.
- ^ «Randomised Trial of Intravenous Streptokinase, Oral Aspirin, Both, or Neither Among 17,187 Cases of Suspected Acute Myocardial Infarction: Isis-2». The Lancet. 332 (8607): 349–360. August 1988. doi:10.1016/s0140-6736(88)92833-4. ISSN 0140-6736. PMID 2899772. S2CID 21071664.
- ^ Lewis HD, Davis JW, Archibald DG, Steinke WE, Smitherman TC, Doherty JE, et al. (August 1983). «Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study». New England Journal of Medicine. 309 (7): 396–403. doi:10.1056/NEJM198308183090703. ISSN 0028-4793. PMID 6135989.
- ^ Di Bella S, Luzzati R, Principe L, Zerbato V, Meroni E, Giuffrè M, et al. (25 January 2022). «Aspirin and Infection: A Narrative Review». Biomedicines. 10 (2): 263. doi:10.3390/biomedicines10020263. ISSN 2227-9059. PMC 8868581. PMID 35203473.
- ^ Cao Y, Tan A (September 2020). «Aspirin might reduce the incidence of breast cancer: An updated meta-analysis of 38 observational studies». Medicine. Baltimore. 99 (38): e21917. doi:10.1097/MD.0000000000021917. PMC 7505405. PMID 32957311.
- ^ «Aspirin Water Helps Plants». cybercemetery.unt.edu.
- ^ «Gardens: drug therapy for plants | Gardening advice». The Guardian.
- ^ «Priming Plant Defenses with Aspirin-like Compound : USDA ARS». www.ars.usda.gov.
- ^ a b c Edwards SH. «Nonsteroidal Anti-inflammatory Drugs: Aspirin». Merck Veterinary Manual. Archived from the original on 18 December 2016. Retrieved 20 January 2018.
- ^ a b «Analgesics (toxicity)». Merck. Archived from the original on 11 April 2015. Retrieved 19 January 2018.
- ^ Lappin MR, ed. (2001). Feline internal medicine secrets. Philadelphia: Hanley & Belfus. p. 160. ISBN 978-1-56053-461-7.
- ^ «Plants poisonous to livestock». Cornell University Department of Animal Science. Archived from the original on 16 August 2015. Retrieved 3 March 2016.
Further reading[edit]
- Desborough, Michael J. R.; Keeling, David M., «The aspirin story – from willow to wonder drug», British Journal of Haematology, 20 January 2017, pp.674-683
- McTavish, Jan R. (Fall 1987). «What’s in a name? Aspirin and the American Medical Association». Bulletin of the History of Medicine. 61.3: 343–366. JSTOR 44442097. On loss of patent in the US in 1917.
External links[edit]
Wikimedia Commons has media related to Aspirin.
- «Aspirin». Drug Information Portal. U.S. National Library of Medicine.
- Ling G (2005). «Aspirin». How Products Are Made. Vol. 1. Thomson Gale.
Таблетки белого цвета, слегка мраморные, плоскоцилиндрические, с риской и фаской.
На одну таблетку:
действующее вещество: ацетилсалициловая кислота – 500,0 мг;
вспомогательные вещества: тальк, кальция стеарат, лимонной кислоты моногидрат, кремния диоксид коллоидный безводный, крахмал картофельный.
Прочие анальгетики и антипиретики. Салициловая кислота и ее производные.
Код АТС: N02ВА01.
Ацетилсалициловая кислота принадлежит к группе кислотных НПВС с обезболивающим, жаропонижающим и противовоспалительным свойствами. Механизм ее действия основан на необратимом ингибировании циклооксигеназ I и II типа – ферментов, участвующих в синтезе простагландинов. В дозах от 0,3 г до 1,0 г используется для лечения легкой и умеренной боли и при повышенной температуре, например, при простуде или гриппе, для снижения температуры и лечения суставной и мышечной боли. Ацетилсалициловая кислота также угнетает агрегацию тромбоцитов, блокируя синтез тромбоксана А2 в тромбоцитах. По этой причине она применяется при некоторых сердечно-сосудистых заболеваниях, в дозах 75-300 мг в сутки.
— лихорадка;
— болевой синдром слабой и умеренной интенсивности различного генеза.
Для уменьшения раздражающего действия на желудочно-кишечный тракт лекарственное средство следует принимать после еды, запивая водой, молоком или щелочной минеральной водой. При болевом синдроме слабой и средней интенсивности и лихорадочных состояниях для детей старше 15 лет и пожилых людей разовая доза составляет 500 мг (1 таблетка), для взрослых – 1000 мг (2 таблетки). При необходимости лекарственное средство можно принимать 3 раза в сутки с интервалом не менее 4 часов. Максимальная суточная доза для детей старше 15 лет – 1500 мг (3 таблетки), для взрослых – 3000 мг (6 таблеток). Не следует принимать лекарственное средство более 5 дней как обезболивающее средство и более 3 дней как жаропонижающее средство без назначения врача.
При оценке частоты побочных реакций используется следующая градация:
Очень часто: ≥ 1/10;
Часто: < 1/10, ≥ 1/100;
Нечасто: < 1/100, ≥ 1/1000;
Редко: < 1/1000, ≥ 1/10000;
Очень редко: < 1/10000;
Неизвестно: частота не может быть оценена в связи с отсутствием данных.
Со стороны крови и лимфатической системы:
Редко и очень редко – серьезные кровотечения, такие как церебральное кровоизлияние, особенно у пациентов с неконтролируемой артериальной гипертензией и/или при одновременной терапии антикоагулянтами, которые в отдельных случаях могут представлять угрозу для жизни.
Гемолиз и гемолитическая анемия у пациентов с серьезным дефицитом глюкозо-6-фосфатдегидрогеназы.
Носовое кровотечение, кровоточивость десен, кожное кровотечение или кровотечения из урогенитального тракта с возможным удлинением времени кровотечения.
Данные эффекты сохраняются на протяжении 4-8 дней с момента прекращения приема препарата.
Со стороны желудочно-кишечного тракта:
Редко – изжога, тошнота, рвота, боли в эпигастрии; эрозивно-язвенные поражения (в редких случаях могут привести к перфорации), желудочно-кишечные кровотечения, которые могут привести к железодефицитной анемии, воспалительные состояния желудочно-кишечного тракта.
Со стороны центральной нервной системы:
Головокружение, головная боль, шум в ушах, ослабление слуха, спутанность сознания (обычно является признаком передозировки).
Со стороны кожи и подкожной клетчатки:
Нечасто: реакции гиперчувствительности кожи, такие как кожные высыпания.
Редко: тяжелые реакции гиперчувствительности кожи (до развития многоформной экссудативной эритемы).
Со стороны иммунной системы:
Редко: реакции гиперчувствительности со стороны дыхательных путей, желудочно-кишечного тракта и сердечно-сосудистой системы, прежде всего у пациентов с астмой. Могут наблюдаться следующие симптомы: артериальная гипотензия, приступы удушья, ринит, заложенность носа, анафилактический шок или отек Квинке.
Нарушения со стороны печени и желчевыводящих путей:
Очень редко: повышение уровня печеночных ферментов.
Нарушение со стороны почек и мочевыводящих путей:
Сообщалось о нарушениях почек и острой почечной недостаточности.
Гиперчувствительность к веществам, входящим в состав лекарственного средства; эрозивно-язвенные поражения ЖКТ (в фазе обострения); желудочно-кишечное кровотечение; “аспириновая” триада; геморрагические диатезы (гемофилии, болезнь Виллибранда, телеангиоэктазии, гипопротромбинемия, тромбоцитопения, тромбоцитопеническая пурпура); бронхиальная астма, индуцированная приемом салицилатов и др. НПВС; расслаивающая аневризма аорты; тяжелая сердечная недостаточность; портальная гипертензия; дефицит витамина К; прием метотрексата в дозе 15 мг в неделю и более; печеночная/почечная недостаточность; дефицит глюкозо-6-фосфатдегидрогеназы; детский возраст (до 15 лет – риск развития синдрома Рейе у детей с гипертермией на фоне вирусных заболеваний); I и III триместры беременности и период лактации.
Передозировка у пожилых людей и детей требует особого внимания, поскольку в этих группах пациентов терапевтическая передозировка или случайные отравления могут привести к летальному исходу.
Симптомы
Передозировка средней тяжести: звон в ушах, нарушение слуха, потливость, тошнота, рвота, головная боль, головокружение. Симптомы проходят при уменьшении дозировки.
Тяжелая передозировка: высокая температура, гипервентиляция, кетоз, респираторный алкалоз, метаболический ацидоз, кома, сердечно-сосудистая недостаточность, дыхательная недостаточность, тяжелая гипогликемия.
Действия в случае передозировки
Пациента необходимо немедленно привезти в больницу.
Лечение
— промывание желудка, применение активированного угля, мониторинг кислотно-щелочного баланса;
— форсированный щелочной диурез следует проводить при концентрации салицилатов в плазме 500 мг/л (3,6 ммоль/л) у взрослых и 300 мг/л (2,2 ммоль/л) у детей. При тяжелых отравлениях показан гемодиализ. Необходима компенсация потери воды;
— симптоматическое лечение.
Следует соблюдать осторожность в следующих случаях:
— при повышенной чувствительности к другим анальгетикам, противовоспалительным и противоревматическим препаратам, при наличии других видов гиперчувствительности;
— при наличии аллергии в анамнезе (например, кожных реакций, зуда, крапивницы), астмы, сенной лихорадки, полипоза носа, или хронических респираторных заболеваний;
— при одновременном лечении антикоагулянтами;
— при язвенной болезни желудка и/или двенадцатиперстной кишки, эрозивном гастрите и склонности к желудочно-кишечным кровотечениям;
— у пациентов с нарушениями функции печени;
— у пациентов с нарушениями функции почек и сердечно-сосудистой системы (сосудистые заболевания почек, хроническая сердечная недостаточность, дегидратация, сепсис или тяжелые кровотечения), так как ацетилсалициловая кислота может увеличить риск почечной дисфункции и острой почечной недостаточности;
— перед операциями (даже перед такими незначительными, как удаление зубов), это может увеличить риск кровотечений;
— у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы ацетилсалициловая кислота может вызвать гемолиз или гемолитическую анемию. Гемолиз может быть спровоцирован высокими дозами, лихорадкой или острыми инфекциями.
При постоянном применении болеутоляющих препаратов могут возникать головные боли, которые приводят к повторному приему лекарственных средств и, в свою очередь, могут продлять головную боль.
Постоянное применение обезболивающих лекарственных средств может привести к необратимому повреждению почек с риском почечной недостаточности (анальгетическая нефропатия). Риск увеличивается при приеме комбинации различных обезболивающих препаратов.
Ацетилсалициловая кислота даже в небольших дозах уменьшает выведение мочевой кислоты из организма, что может стать причиной развития острого приступа подагры у предрасположенных пациентов.
Ацетилсалициловая кислота должна использоваться у детей и подростков с лихорадочным состоянием только по медицинским показаниям и только в том случае, если другие меры не эффективны. Возникновение длительной рвоты при применении ацетилсалициловой кислоты может быть одним из признаков жизнеугрожающего состояния – синдрома Рейе, который требует незамедлительного лечения.
Противопоказано применение в I и III триместре беременности, в период лактации.
Обладает тератогенным влиянием: при применении в I триместре приводит к развитию расщепления верхнего неба; в III триместре вызывает торможение родовой деятельности (ингибирование синтеза РG), преждевременное закрытие артериального протока у плода, гиперплазию легочных сосудов и гипертензию в «малом» круге кровообращения. Во II триместре беременности допускается эпизодическое применение ацетилсалициловой кислоты. Выделяется с грудным молоком, что повышает риск возникновения кровотечений у ребенка вследствие нарушения функции тромбоцитов. На время лечения кормление грудью следует прекратить.
В период лечения необходимо соблюдать осторожность при вождении транспорта и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Усиливают действие с повышением риска побочных эффектов
— Антикоагулянты/тромболитики: аспирин может увеличить риск кровотечения при приеме перед тромболитической терапией. Особое внимание следует обратить на признаки внешнего или внутреннего кровотечения у пациентов, прошедших тромболитическую терапию;
— Антитромбоцитарные препараты, такие как тиклопидин, клопидогрел, повышают риск кровотечений;
— Другие нестероидные анальгетики/противовоспалителъные препараты (ацетилсалициловая кислота в дозах 3 г в день и более) повышают риск желудочно-кишечных язв и кровотечений;
— Системные глюкокортикоиды (кроме гидрокортизона в качестве заместительной терапии при болезни Аддисона) повышают риск желудочно-кишечных побочных эффектов;
— Алкоголь повышает риск желудочно-кишечных язв и кровотечений;
— Дигоксин повышает концентрацию в плазме из-за снижения почечной экскреции;
— Противодиабетические препараты снижают уровень сахара в крови;
— Метотрексат снижает экскрецию и вытесняет салицилаты из связывания с белками плазмы, вследствие чего повышается токсичность;
— Вальпроевая кислота вытесняет салицилаты из связывания с белками плазмы, вследствие чего повышается токсичность;
— Селективные ингибиторы обратного захвата серотонина (СИОЗС) повышают риск желудочно-кишечных кровотечений из-за синергетических эффектов.
Снижают эффект
— Диуретики (при одновременном применении с ацетилсалициловой кислотой в дозе 3 г в день и более);
— Ингибиторы АПФ (ацетилсалициловая кислота в дозе 3 г в день и более);
— Урикозурические препараты (например, пробенецид, бензбромарон).
В защищенном от влаги и света месте при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
2 года.
Не применять по истечении срока годности, указанного на упаковке.
По 10 таблеток в контурной ячейковой упаковке.
По одной, две или три контурные ячейковые упаковки вместе с инструкцией по применению в пачке из картона.
Без рецепта.
Производитель:
РУП «Белмедпрепараты», Республика Беларусь, 220007, г. Минск,
ул. Фабрициуса, 30, т./ф.: (+375 17)22037 16,
е-mail: medic@belmedpreparaty.com
Ацетилсалициловая кислота известна прежде всего как средство от лихорадки при простуде и других инфекционно-воспалительных заболеваниях. Кроме того, она устраняет боль средней или слабой интенсивности, например, головную.
Относится к фармакологической группе нестероидных противовоспалительных средств (НПВС), но действует менее активно, чем Ибупрофен, поэтому реже применяется при суставной и спинной боли.
Содержание
- Основные показания к применению
- Ацетилсалициловая кислота — инструкция
- Ацетилсалициловая кислота — сколько принимать?
- Можно ли пить ацетилсалициловую кислоту детям?
- Кому нельзя принимать ацетилсалициловую кислоту?
- Нужно проявлять осторожность в следующих случаях
- Какие препараты не сочетаются с ацетилсалициловой кислотой?
- Можно ли пить алкогольные напитки при лечении ацетилсалициловой кислотой?
- Применение при беременности и кормлении грудью
- Нежелательные действия ацетилсалициловой кислоты
- Можно ли применять аспирин при коронавирусе?
- Как возникает и проявляется передозировка аспирином?
- Аналоги
Определимся, что ацетилсалициловая кислота — это аспирин. И хотя само торговое название принадлежит компании Bayer, их бренд уже давно используют для обозначения любых видов “ацетилки”. Так часто бывает с препаратами с богатой историей, ведь ацетилсалициловая кислота была открыта еще в 1897 году. Впрочем, Bayer закрепили за собой наименование, и даже известная фирма Упса сменили свой Аспирин на Упсарин Упса, а состав у них одинаковый.
Теперь выясним, чем хороша ацетилсалициловая кислота? В виде растворимых таблеток аспирин быстро дает облегчение при простуде, ОРЗ, боли в горле и мышцах. И выбирать нужно именно шипучие таблетки, поскольку у них лучше переносимость.
Основные показания к применению
- жар при инфекционно-воспалительных заболеваниях;
- головная боль, при похмельном синдроме включительно;
- боли в периферических нервах (невралгия);
- мигрень;
- зубная боль;
- боль в суставах или мышцах;
- боль при менструациях;
- корешковый синдром (устранение боли в грудном отделе позвоночника).
Ацетилсалициловая кислота — инструкция
В настоящее время врачи не назначают ацетилсалициловую кислоту от температуры в виде обычных таблеток, поэтому в нашей статье мы сделаем акцент на растворимой форме.
Ацетилсалициловая кислота — сколько принимать?
Растворяется таблетка в стакане воды объемом 200 мл. Температура должна быть комнатной или слегка теплой, поскольку горячий раствор плохо влияет на биодоступность. Принимать после еды.
Аспирин — инструкция для дозировки 400 мг у взрослых и детей старше 15 лет.
При болях различного типа и жаре — 1-2 табл. на прием, разовая доза максимально — 2 табл., в сутки не более 6 табл. Промежуток между приемом Аспирина должен составлять 4 часа или дольше. Без совета доктора в качестве анальгетика Аспирин пьют не более 7 дней. От температуры препарат дают не более 3 дней.
Если дозировка растворимой таблетки 500 мг, то схема имеет небольшое отличие.
Для пожилых людей уменьшена суточная доза — можно не более 4 табл. в сутки. Анальгезирующая терапия проводится не больше 5 дней.
Ацетилсалициловая кислота — инструкция по применению для 250 мг.
Взрослым и детям старше 15 лет. Таблетку принимают внутрь после еды, запивая достаточным количеством воды. Разовая доза 250 мг, в сутки можно принять от 2 до 6 таблеток, но как мы уже сказали, лучше выбрать безопасную растворимую форму. Шипучие таблетки образуют в воде буферный раствор, который не позволяет осаждаться вредным веществам, повреждающим желудок.
Имеются противопоказания. Необходима консультация специалиста.
Можно ли пить ацетилсалициловую кислоту детям?
Есть целый побочных эффектов, который не позволяет лечиться данным средством детям. Для любых дозировок и форм указано противопоказание «детям до 15 лет запрещено».
Кому нельзя принимать ацетилсалициловую кислоту?
Приведем несколько главных свойств аспирина, ограничивающих его применение. Прежде всего надо учитывать его агрессивное воздействие на слизистую желудка и всего ЖКТ. Данный побочный эффект выражен сильнее, чем у других жаропонижающих средств. Наличие любых кровотечений или склонность к ним — это важное противопоказание, так как ацетилсалициловая кислота уменьшает свертываемость крови. По этой же причине аспирин нельзя принимать людям, которые регулярно получают терапию антикоагулянтами, а это большая группа пациентов (сердечно-сосудистые патологии или тяжелая коронавирусная инфекция). Не разрешен аспирин кормящим и беременным.
Перечислим подробнее:
- эрозивно-язвенные заболевания пищеварительного тракта в период обострения, кровотечения в ЖКТ;
- аллергия на аспирин, астма, вызванная приемом противовоспалительных (парацетамолом, ибупрофеном, салицилатами), в комбинации с полипами носа;
- одновременное применение метотрексата;
- заболевания печени и почек, выраженная форма;
- нарушения свертываемости крови;
- тромбоцитопения;
- недостаточность выработки глюкозо-6-фосфатдегидрогеназы;
- I и III триместры беременности;
- повышенная чувствительность к ацетилсалициловой кислоте;
- период лактации у женщин;
- дети до 15 лет.
Нужно проявлять осторожность в следующих случаях
- прием препаратов, снижающих свертываемость крови (антикоагулянты);
- подагра;
- эрозия в желудке, гастрит;
- склонность к отекам;
- заболевания щитовидной железы;
- повышенное артериальное давление;
- недостаточность витамина К;
- нарушения работы сердца;
- риск кровотечения в организме, например, оперативное вмешательство.
Какие препараты не сочетаются с ацетилсалициловой кислотой?
- другие противовоспалительные средства, а это широкая группа: Парацетамол, Ибупрофен, Напроксен, Мелоксикам, Диклофенак и др. НПВС, практически все лекарства для устранения симптомов простуды и гриппа;
- антацидные средства замедляют всасывание аспирина;
- одновременный прием запрещен с дигоксином, барбитуратами и литием;
- спирт и содержащие его лекарства увеличивают токсичность аспирина, вызывая кровотечения из ЖКТ;
- не разрешен прием с глюкокортикостероидами, урикозурическими средствами (бензбромарон, сульфинпиразон);
- снижается действие гипотензивных и мочегонных препаратов;
- нельзя совмещать по причине увеличения токсичности: с гепарином, различными антикоагулянтами, с обезболивающими из группы опиатов, с метотрексатом, с препаратами, снижающими уровень сахара, с сульфаниламидами.
Можно ли пить алкогольные напитки при лечении ацетилсалициловой кислотой?
Повторимся, сочетать аспирин с этанолом противопоказано.
Применение при беременности и кормлении грудью
Нельзя принимать в I и III триместре. Во втором по совету врача возможен однократной прием разовой дозы, но только если польза для матери превышает риск для будущего ребенка. Следует отменить кормление грудью на фоне приема аспирина, так как лекарство проникает в грудное молоко и негативно влияет на здоровье младенца.
Нежелательные действия ацетилсалициловой кислоты
- может нарушаться работа печени;
- скрытые кровотечения в желудке, кишечнике или заметные (рвота с кровью, черный стул), анемия, эрозивные заболевания пищеварительного тракта; боли в брюшной полости, тошнота;
- патологии почек (риск образования камней);
- аллергия, спазм бронхов, анафилаксия, сыпь на коже;
- кровотечения;
- головокружение.
Можно ли применять аспирин при коронавирусе?
Официального запрета нет, но врачи его не назначают. Еще до пандемии специалисты при вирусных инфекциях отдавали предпочтения Парацетамолу и Ибупрофену для борьбы с жаром. Причина в том, что у аспирина повышен риск кровотечений. При ковиде ацетилку не рекомендовано принимать, так как многим больным назначают антикоагулянты, а их сочетание с аспирином опасно. Таким образом, лучше выбирать обычные порошки от простуды ( Фервекс, Терафлю, Максиколд, Антигриппин и др.) или лекарства на основе ибупрофена.
Как возникает и проявляется передозировка аспирином?
Человек может случайно принять большую дозу препарата, сочетать его с алкоголем или с другими НПВС. В этих ситуациях могут проявиться признаки отравления ацетилсалициловой кислотой: возбужденное нервное состояние, боль в голове, ухудшение слуха и зрения, частое дыхание, рвота. Далее при отсутствии терапии может развиться кома. Лечение проводят в стационаре, обращаются в скорую помощь.
Известные бренды с ацетилсалициловой кислотой: Аспирин, Аспирин Экспресс, Упсарин Упса, (Ацетилсалициловая кислота — УБФ, Авексима, Йорк, Реневал,) а также производства компаний: Фармстандарт, Обновление, Дальхимфарм, Асфарма, Ирбитский ХФЗ и многие других.
Аналоги
Для устранения жара при гриппе или коронавирусе следует подыскать замену аспирину. Лучше всего с этой задачей справятся препараты на основе парацетамола или ибупрофена. Эти средства работают мягче, разрешены в детской практике. К примеру, Нурофен сироп можно использовать с 3 мес, а Панадол для младенцев даже раньше. Названные лекарства имеют множество торговых наименований, включая недорогие российские. Они идеально подходят для устранения симптомов ОРВИ детям до 15 лет.
Взрослым пациентам, у которых есть проблемы с желудком, можно заменить аспирин при простуде любыми порошками, содержащими парацетамол (Колдрекс, Терафлю, Фервекс, Максиколд, Антигриппин).
Для замены взрослым подойдет парацетамол в виде таблеток, их производят очень многие российские фирмы, а также зарубежные, например, растворимый Эффералган или Панадол для взрослых.
Ибупрофен также отлично помогает при ОРВИ, простуде и боли. Самый известный из них — это оригинальный Нурофен в разной форме и дозировках, а также наши аналоги: Миг, Ибуфен. Экономичный вариант — российский ибупрофен одноименный, который представлен очень широко.
Когда названные лекарства по отдельности не помогают, можно купить в аптеке комбинированные, например: Ибуклин, Некст, Парацитолгин, Нуролгон, Нурофен Интенсив.
Ацетилсалициловая кислота входит в состав препаратов для устранения похмельного синдрома, в сочетании с лимонной кислотой и натрия гидрокарбонатом. Очень хорошо известен у нас Алка-Зельтцер, здесь аспирин убирает общее недомогание и головную боль.
В данной статье нам следует упомянуть и другое важное свойство ацетилсалициловой кислоты. Она широко используется, как антиагрегантное средство для профилактики тромбоза при сосудистой патологии, назначение касается таких проблем, как: инфаркт миокарда повторный, ИБС, ишемический инсульт, профилактика образования тромбов после операций на сосудах, включая стентирование, ангиопластику и прочее. Вот известные бренды: Аспирин Кардио, Ацекардол, Ацетилсалициловая кислота — Кардио, Карди-АСК, Тромбо АСС. Однако, эти лекарства не принимают без назначения врача. Дозировка аспирина здесь значительно меньше — 100 мг, но курс приема длительный.
Заключение
Парацетамол и ацетилсалициловая кислота относятся к одним из лидеров продаж нашего аптечного рынка. В чем же преимущество аспирина и что лучше выбрать? В общем случае человек полагается на свой опыт. Ацетилсалициловая кислота отлично снимает повышенную температуру, действует быстро и наверняка, известна на рынке очень долгое время. С этим фактом связана ее популярность. Если принимать ее правильно, она не вызовет побочных эффектов. Люди, имеющие здоровый ЖКТ и другие системы организма отдают предпочтение аспирину, тем более в большинстве случаев это разовый прием. Ацетилсалициловая кислота хорошо устраняет головную боль — это простое и надежное средство устраивает многих. Курсом ее не пьют, поэтому нежелательные реакции не проявляются.
Источники
- Михайлова И.Е., Перепеч Н.Б. // Ацетилсалициловая кислота: сфера клинического применения и доказательства эффективности // РМЖ // 2007;
- Терещенко С.Н., Джаиани Н.А. // Антитромботическая терапия как основа профилактики сердечно-сосудистых осложнений. Фокус на ацетилсалициловую кислоту // Трудный пациент // 2008;
- Кропачева Е.С. // Аспирин как безопасная основа антитромботической терапии // Атмосфера // Новости кардиологии // 2008.
Информация представлена в ознакомительных целях и не является медицинской консультацией или руководством к лечению со стороны uteka.ru.
Средний рейтинг 3 из 5 на основе 2 голосов
Состав
Ацетилсалициловая кислота (лат. Acidum acetylsalicylicum).
Формула: C9H8O4
Графическая формула:
Фармакологическая группа
Ненаркотические анальгетики/антиагреганты, нестероидные противовоспалительные средства (НПВС), производные салициловой кислоты.
Фармакологическое действие
- Противовоспалительное действие лекарственного вещества обусловлено его влиянием на протекающие в очаге воспаления процессы.
- Жаропонижающий эффект основан на влиянии ацетилсалициловой кислоты на центр терморегуляции гипоталамуса.
- Анальгезирующие свойства связаны с эффективным воздействием на центр болевой чувствительности в ЦНС.
- Ацетилсалициловая кислота тормозит активность фермента циклооксигеназы, который регулирует синтез простагландина в организме, отвечающего за образование отеков и гиперальгезии.
- Уменьшает агрегацию, адгезию тромбоцитов и тромбообразование за счет угнетения синтеза тромбоксана А2 в тромбоцитах. Антиагрегантный эффект сберегается на протяжении 7 суток в последствии единоразового приема (больше выражен у мужчин, чем у женщин).
- Снижает летальность и риск развития инфаркта миокарда при нестабильной стенокардии. Эффективен при первичной профилактике заболеваний сердечно-сосудистой системы, особенно инфаркта миокарда у мужчин старше 40 лет, и при вторичной профилактике инфаркта миокарда.
- В суточной дозе 6 г и более подавляет синтез протромбина в печени и увеличивает протромбиновое время. Повышает фибринолитическую активность плазмы и снижает концентрацию витамин K-зависимых факторов свертывания (II, VII, IX, X).
- Учащает геморрагические осложнения при проведении хирургических вмешательств, увеличивает риск развития кровотечения на фоне терапии антикоагулянтами.
- Стимулирует выведение мочевой кислоты (нарушает ее реабсорбцию в почечных канальцах), но в больших дозах.
- Блокада ЦОГ1 в слизистой оболочке желудка приводит к торможению гастропротекторных простагландинов, что может обусловить изъязвление слизистой оболочки и в последствиидующее кровотечение. Меньшим раздражающим действием на слизистую оболочку ЖКТ обладают лекарственные формы, содержащие буферные вещества, кишечнорастворимую оболочку, также специальные шипучие формы таблеток.
Фармакокинетика
При приеме внутрь быстро абсорбируется преимущественно из проксимального отдела тонкой кишки и в меньшей степени из желудка. Присутствие пищи в желудке значительно изменяет всасывание ацетилсалициловой кислоты.
Метаболизируется в печени путем гидролиза с образованием салициловой кислоты с последующей конъюгацией с глицином или глюкуронидом. Концентрация салицилатов в плазме крови вариабельна.
Около 80% салициловой кислоты связывается с белками плазмы крови. Салицилаты легко проникают во многие ткани и жидкости организма, в т.ч. в спинномозговую, перитонеальную и синовиальную жидкости. В небольших количествах салицилаты обнаруживаются в мозговой ткани, следы — в желчи, поте, кале. Быстро проникает через плацентарный барьер, в небольших количествах выделяется с грудным молоком.
У новорожденных салицилаты могут вытеснять билирубин из связи с альбумином и способствовать развитию билирубиновой энцефалопатии.
Проникновение в полость сустава ускоряется при наличии гиперемии и отека и замедляется в пролиферативной фазе воспаления.
При возникновении ацидоза большая часть салицилата превращается в неионизированную кислоту, хорошо проникающую в ткани, в т.ч. в мозг.
Выводится преимущественно путем активной секреции в канальцах почек в неизмененном виде (60%) и в виде метаболитов. Выведение неизмененного салицилата зависит от pH мочи (при подщелачивании мочи возрастает ионизирование салицилатов, ухудшается их реабсорбция и значительно увеличивается выведение). T1/2 ацетилсалициловой кислоты составляет приблизительно 15 мин. T1/2 салицилата при приеме в невысоких дозах составляет 2-3 ч, с увеличением дозы может возрастать до 15-30 ч. У новорожденных элиминация салицилата значительно более медленная, чем у взрослых.
Способ применения и дозировка
Ацетилсалициловую кислоту принимают внутрь, желательно после еды, запив достаточным количеством воды, дозировки индивидуальны и зависят от заболевания.
Применять взрослым ацетилсалициловую кислоту инструкция рекомендует 3-4 раза в сутки по 1-2 таблетки (500-1000 мг), при этом максимальная суточная доза – 6 таблеток (3 г). Максимальная продолжительность применения ацетилсалициловой кислоты – 14 дней.
С целью улучшения реологических свойств крови, а также в качестве ингибитора склеивания тромбоцитов назначают по ½ таблетки ацетилсалициловой кислоты в сутки на протяжении нескольких месяцев. При инфаркте миокарда и для профилактики вторичного инфаркта миокарда инструкция к ацетилсалициловой кислоте рекомендует принимать 250 мг в сутки. Динамические нарушения мозгового кровообращения и церебральные тромбоэмболии предполагают прием ½ таблетки ацетилсалициловой кислоты с постепенным доведением дозы до 2 таблеток в сутки.
Ацетилсалициловая кислота детям назначается в следующих разовых дозах: старше 2 лет – 100 мг, 3-го года жизни – 150 мг, четырехлетним – 200 мг, старше 5 лет – 250 мг. Принимать ацетилсалициловую кислоту детям рекомендуется 3-4 раза в сутки.
Показания
Ацетилсалициловая кислота назначается при:
- острой ревматической лихорадке, перикардите (воспаление серозной оболочки сердца), ревматоидном артрите (поражение соединительной ткани и мелких сосудов), ревматической хореи (проявляется непроизвольными мышечными сокращениями), синдроме Дресслера (сочетание перикардита с воспалением плевры или пневмонией);
- болевом синдроме слабой и умеренной интенсивности: мигрень, головная боль, зубная боль, боли при менструации, остеоартрозе, невралгии, боль в суставах, мышцах;
- заболеваниях позвоночника, сопровождающихся болевым синдромом: ишиас, люмбаго, остеохондроз;
- лихорадочном синдроме;
- необходимости формирования толерантности к противовоспалительным препаратам у пациентов с «аспириновой триадой» (совокупность бронхиальной астмы, полипов носа и непереносимости ацетилсалициловой кислоты) или «аспириновой» астмой;
- профилактике развития инфаркта миокарда при ишемической болезни сердца или при профилактике рецидива;
- наличии факторов риска безболевой ишемии миокарда, ишемической болезни сердца, нестабильной стенокардии;
- профилактике тромбоэмболии (закупорка сосуда тромбом), клапанных митральных пороках сердца, пролапсе (нарушение функции) митрального клапана, мерцательной аритмии (потеря мышечными волокнами предсердий способности работать синхронно);
- остром тромбофлебите (воспаление стенки вены и образование тромба, закрывающего в ней просвет), инфаркте легкого (закупорка тромбом сосуда, питающего легкое), рецидивирующей тромбоэмболии легочной артерии.
Противопоказания
Гиперчувствительность (в том числе «аспириновая» астма, «аспириновая» триада), геморрагические диатезы (болезнь Виллебранда, гемофилия, телеангиоэктазия), сердечная недостаточность, аневризма аорты (расслаивающая), эрозивно-язвенные острые и рецидивирующие заболевания желудочно-кишечного тракта, острая печеночная или почечная недостаточность, желудочно-кишечное кровотечение, гипопротромбинемия (до начала лечения), тромбоцитопения, дефицит витамина К, дефицит глюкозо-6-фосфатдегидрогеназы, тромботическая тромбоцитопеническая пурпура, грудное вскармливание, беременность (I и III триместр), возраст до 15 лет при применении как жаропонижающее средство. Ограничить прием ацетилсалициловой кислоты при гиперурикемии, нефролитиазе, подагре, язвенной болезни, тяжелых нарушений работы почек и печени, бронхиальной астме, ХОБЛ, полипозе носа, неконтролируемой артериальной гипертензии.
Побочное действие
Со стороны пищеварительной системы: тошнота, рвота, анорексия, боли в эпигастрии, диарея; редко – возникновение эрозивно-язвенных поражений, кровотечений из ЖКТ, нарушение функции печени.
Со стороны ЦНС: при длительном применении возможны головокружение, головная боль, обратимые нарушения зрения, шум в ушах, асептический менингит.
Со стороны системы кроветворения: редко – тромбоцитопения, анемия.
Со стороны системы свертывания крови: редко – геморрагический синдром, удлинение времени кровотечения.
Со стороны мочевыделительной системы: редко – нарушение функции почек; при длительном применении – острая почечная недостаточность, нефротический синдром.
Аллергические реакции: редко – кожная сыпь, отек Квинке, бронхоспазм, “аспириновая триада” (сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты и лекарственных средств пиразолонового ряда).
Прочие: в отдельных случаях – синдром Рейе; при длительном применении – усиление симптомов хронической сердечной недостаточности.
Передозировка
Симптомы. При легкой форме интоксикации препаратом возможны тошнота, рвота, боль в животе, головокружение, шум в ушах, головная боль. В тяжелых случаях – спутанность сознания, тремор, удушье, метаболический ацидоз, кома, коллапс. Возможны летальные дозы: для взрослых -выше 10 г, для детей – выше 3 г.
Лечение. Коррекция кислотно-щелочного баланса, водно-электролитнного баланса, инфузия растворов натрия гидрокарбоната, натрия лактата.
Лекарственное взаимодействие
- При одновременном применении антациды, содержащие магния и/или алюминия гидроксид, замедляют и уменьшают всасывание ацетилсалициловой кислоты.
- При одновременном применении блокаторов кальциевых каналов, средств, ограничивающих поступление кальция или увеличивающих выведение кальция из организма, повышается риск развития кровотечений.
- При одновременном применении с ацетилсалициловой кислотой усиливается действие гепарина и непрямых антикоагулянтов, гипогликемических средств производных сульфонилмочевины, инсулинов, метотрексата, фенитоина, вальпроевой кислоты.
- При одновременном применении с ГКС повышается риск ульцерогенного действия и возникновения желудочно-кишечных кровотечений.
- При одновременном применении снижается эффективность диуретиков (спиронолактона, фуросемида).
- При одновременном применении других НПВС повышается риск развития побочных эффектов. Ацетилсалициловая кислота может уменьшать концентрации в плазме крови индометацина, пироксикама.
- При одновременном применении с препаратами золота ацетилсалициловая кислота может индуцировать повреждение печени.
- При одновременном применении снижается эффективность урикозурических средств (в т.ч. пробенецида, сульфинпиразона, бензбромарона).
- При одновременном применении ацетилсалициловой кислоты и алендроната натрия возможно развитие тяжелого эзофагита.
- При одновременном применении гризеофульвина возможно нарушение абсорбции ацетилсалициловой кислоты.
- Описан случай спонтанного кровоизлияния в радужную оболочку при приеме экстракта гинкго билоба на фоне длительного применения ацетилсалициловой кислоты в дозе 325 мг/сут. Полагают, что это может быть обусловлено аддитивным ингибирующим действием на агрегацию тромбоцитов.
- При одновременном применении дипиридамола возможно увеличение Сmax салицилата в плазме крови и AUC.
- При одновременном применении с ацетилсалициловой кислотой повышаются концентрации дигоксина, барбитуратов и солей лития в плазме крови.
- При одновременном применении салицилатов в высоких дозах с ингибиторами карбоангидразы возможна интоксикация салицилатами
- Ацетилсалициловая кислота в дозах менее 300 мг/сут оказывает незначительное влияние на эффективность каптоприла и эналаприла. При применении ацетилсалициловой кислоты в высоких дозах возможно уменьшение эффективности каптоприла и эналаприла.
- При одновременном применении кофеин повышает скорость всасывания, концентрацию в плазме крови и биодоступность ацетилсалициловой кислоты.
- При одновременном применении метопролол может повышать Сmax салицилата в плазме крови.
- При применении пентазоцина на фоне длительного приема ацетилсалициловой кислоты в высоких дозах имеется риск развития тяжелых побочных реакций со стороны почек.
- При одновременном применении фенилбутазон уменьшает урикозурию, вызванную ацетилсалициловой кислотой.
- При одновременном применении этанол может усиливать действие ацетилсалициловой кислоты на ЖКТ.
Беременность и лактация
Применение салицилатов в I триместре беременности в больших дозах связано с повышенной частотой дефектов развития плода (пороки сердца, расщепление неба). Салицилаты можно назначать во II триместре беременности, но только учитывая оценки пользы и риска. В III триместре беременности применение салицилатов противопоказано. Салицилаты и метаболиты их проникают в грудное молоко в небольших количествах. Случайный прием салицилатов во время грудного кормления обычно не сопровождается побочными реакциями у ребенка и не требует остановки грудного вскармливания. Однако если долго или в больших дозах принимать салицилаты, то грудное вскармливание стоит прекратить.
Особые указания
С осторожностью применяют у пациентов с заболеваниями печени и почек, при бронхиальной астме, эрозивно-язвенных поражениях и кровотечениях из ЖКТ в анамнезе, при повышенной кровоточивости или при одновременном проведении противосвертывающей терапии, декомпенсированной хронической сердечной недостаточности.
Ацетилсалициловая кислота даже в небольших дозах уменьшает выведение мочевой кислоты из организма, что может стать причиной острого приступа подагры у предрасположенных пациентов. При проведении длительной терапии и/или применении ацетилсалициловой кислоты в высоких дозах требуется наблюдение врача и регулярный контроль уровня гемоглобина.
Применение ацетилсалициловой кислоты в качестве противовоспалительного средства в суточной дозе 5-8 г ограничено в связи с высокой вероятностью развития побочных эффектов со стороны ЖКТ.
Перед хирургическим вмешательством, для уменьшения кровоточивости в ходе операции и в послеоперационном периоде следует отменить прием салицилатов за 5-7 дней.
Во время продолжительной терапии необходимо проводить общий анализ крови и исследование кала на скрытую кровь.
Применение ацетилсалициловой кислоты в педиатрии противопоказано, поскольку в случае вирусной инфекции у детей под влиянием ацетилсалициловой кислоты повышается риск развития синдрома Рейе. Симптомами синдрома Рейе являются длительная рвота, острая энцефалопатия, увеличение печени.
Длительность лечения (без консультации с врачом) не должна превышать 7 дней при назначении в качестве анальгезирующего средства и более 3 дней в качестве жаропонижающего.
В период лечения пациент должен воздерживаться от употребления алкоголя.
Условия и срок хранения
Согласно инструкции, ацетилсалициловую кислоту нельзя хранить в месте, где температура воздуха может подняться выше 25°С. В сухом месте и при комнатной температуре препарат будет годным в течение 4 лет.