1. сокр. к детский церебральный паралич
Все значения слова «ДЦП»
-
ДЦП может быть выявлен сразу после рождения ребёнка, а может проявляться постепенно в грудном возрасте.
-
Нарушения мелкой моторики могут проявляться в виде нарушений приёма или передачи сигнала при органических поражениях головного мозга, травмах головы, ДЦП, травмах конечностей и других заболеваниях.
-
Для медицинского работника – это последствия пре-, пери- или постнатального поражения мозга: от лёгких, типа минимальной мозговой дисфункции (ММД), до самых тяжёлых, типа детского церебрального паралича (ДЦП) или генетической патологии.
- (все предложения)
А Б В Г Д Е Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
ДЦП, [дэцепэ́], нескл., м. (сокр.: детский церебральный паралич)
Рядом по алфавиту:
дуэ́ль , -и
дуэ́льный
дуэля́нт , -а
дуэ́нья , -и, р. мн. -ний
дуэ́т , -а
дуэ́тец , -тца, тв. -тцем, р. мн. -тцев
дуэ́тик , -а
дуэ́тный
дуэтти́но , нескл., м. и с.
ду́ющий(ся)
дха́рма , -ы
дхарми́ческий
дхол , -а и доо́л, -а (муз. инструмент)
дхо́ти , нескл., с.
дхья́на , -ы
ДЦП , [дэцепэ́], нескл., м. (сокр.: детский церебральный паралич)
дщерь , -и
ды́ба , -ы
ды́бить(ся) , ды́блю, ды́бит(ся)
дыбки́ , : на дыбки́
ды́бом , нареч.
дыбы́ , : на дыбы́
ды́бящий(ся)
ды́лда , -ы, м. и ж. (сниж.)
ды́лдистый
ды́лдушка , -и, р. мн. -шек, м. и ж.
дым , -а и -у, предл. в дыму́, мн. -ы́, -о́в
дымаппарату́ра , -ы
дыма́рь , -аря́
дымзаве́са , -ы
дыми́на , -ы, м. (густой дым)
Взрослому человеку при ДЦП тяжело двигаться из-за веса. В результате взрослому человеку приходится перемещаться в инвалидном кресле. При ДЦП у взрослого (в МКБ-10 под кодом G80) нарушается моторика конечностей. Из-за этого тяжело двигаться и совершать резкие движения, поэтому трудно о себе заботиться. Даже приготовление пищи вызывает много сложностей.
Особенности
Таким людям невозможно работать, тем более физическим трудом. У взрослых людей с ДЦП присутствует отсталость в развитии или отклонения в психике из-за поврежденных структур мозга, отвечающих за рассудок. Таким людям тяжело разговаривать, так как нарушается работа мышц. В результате, возникают сложности с приемом еды и появляется на лице неестественная мимика.
У взрослого больного чаще начинает развиваться эпилепсия. Наблюдается ненормальное восприятие окружающего мира, опять же, связанное с повреждением мозга больного. К тому же, часто у человека с этим диагнозом начинает быстро снижаться зрение и слух.
Помимо физических последствий, у взрослого пациента появляются психологические последствия. У больного начинает развиваться психическое расстройство. Это невроз или депрессия. Также меняется в худшую сторону сознание.
При ДЦП во взрослом возрасте у женщин не возникает сложностей с беременностью и родами. Больные беременные женщины вынашивают ребенка, без каких-либо затруднений. Беременным с ДЦП врачи часто советуют делать кесарево сечение, но так делается только при тяжелой форме. Больным беременным требуется пристальное наблюдение у гинеколога. Женщины с ДЦП могут родить двойню или тройню без осложнений. ДЦП от взрослых родителей не передается детям. У взрослых людей почти всегда рождаются здоровые малыши.
Симптомы
Характерно плавное течение ДЦП у взрослых людей. С годами детское заболевание перерастает, врожденные или приобретенные патологии сопровождают больного на протяжении жизни. При незначительных повреждениях головного мозга и своевременном диагностировании с последующим симптоматическим лечением, возможно снижение когнитивных и двигательных нарушений. Симптомы ДЦП у взрослых:
- Общая мышечная слабость. Зачастую встречается у больных, сопровождается болью, вызываемой деформацией костей.
- Артроз и артрит. Возникающие еще в детском возрасте, нарушения двигательной системы, сопровождающиеся неправильным взаимодействием суставов, начинают доставлять неудобства с течением времени.
- Болевые ощущения. Внезапно возникающая, боль острого или хронического характера беспокоит больного. Чаще всего, поражаемыми областями становятся колени, верх или низ спины. Страдающий от этих болей, человек не может самостоятельно определить их силу и очаг распространения.
- Преждевременное старение. Признаки, сопутствующие этому симптому, начинают проявляться при достижении больным возраста 40 лет. Причиной этому служит вынужденная работа ослабленных, плохо развитых органов в полную силу наравне с полностью здоровыми для поддержания организма больного. В связи с чем наступает ранний износ некоторых систем (сердечно-сосудистой, дыхательной).
Последствия
Последствия ДЦП у взрослых:
- В основном, при ДЦП пациент не в состоянии нормально передвигаться на своих ногах. Из-за нарушения координации ему, помимо трудностей при ходьбе, еще сложнее сохранять равновесие, поэтому пациенту нужна постоянная помощь близких людей.
- У больного пропадает способность осуществлять некоторые виды моторики, из-за этого он не в силах сам о себе позаботиться, а о работе, тем более физической, и речи идти не может.
- У многих пациентов повреждается структура, отвечающая за умственное состояние, поэтому они отстают в развитии или имеют психологические отклонения.
- У больного ухудшается речь, так как возникает нарушение в сокращениях лицевых мышц. Также появляются сложности с приемом пищи и неестественная мимика.
- Часто у пациента начинает развиваться эпилепсия.
- Иногда возникает ненормальное восприятие окружающего мира из-за повреждения мозга.
- У пациента начинает быстро снижаться слух и зрение.
- Появляются психологические расстройства. Это выражается, в свою очередь, в фобиях или депрессии.
- Пациенту тяжело общаться с другими людьми из-за замкнутого образа жизни.
Хирургия
Хирургическое лечение ДЦП непременно предусматривает проведение комплексной медицинской диагностики состояния здоровья пациента. В комплекс входят:
- электромиография;
- ЭНГ и др.
Помимо перечисленного комплекса диагностики, пациент проходит консультации у офтальмолога, ортопеда, эпилептолога, психиатра, в исключительных случаях даже логопеда, а также других специалистов, каждый из которых должен предоставить свое медицинское разрешение на хирургическое лечение патологии пациента в анатомической области, касающейся своей специализации.
Нейрохирургия при лечении взрослых- инвалидов с ДЦП является серьезным и радикальным методом терапии. Поэтому использовать его необходимо, все тщательно взвесив, и получить консультации у разных специалистов. Когда адаптивное лечение не дает ожидаемых и видимых улучшений лечения, при этом переходит в судороги или гиперкинезы, которые все сильнее сковывают человека, а движения вызывают боль — поможет нейрохирургия. Иначе ухудшение здоровья неизбежно.
Развитие обширного паралича мускулатуры постепенно переходит в воспаление эпидуральной клетчатки, которая, в свою очередь, влияет на кровообращение и метаболические процессы в организме. Эти нарушения неизбежно приводят к сбою оттока венозной крови из шейного отдела позвоночника, что может привести к нарушению работы спинного мозга.
Как возможность решения проблемы, можно использовать не менее 2 блокад ботулотоксина, а когда и они не дадут эффекта, то вариантов больше не существует.
Занятия ЛФК
Общее предписание для всех упражнений ЛФК:
- Систематичность.
- Регулярность.
- Целеустремленность.
- Индивидуальность (прямолинейно зависящие от возраста, диагноза, состояния и психики реабилитируемого пациента).
- Постепенное увеличение физической нагрузки.
Виды упражнений
Основные виды упражнения лфк при ДЦП:
- Занятия на растяжку, направленные на снижение и снятие чрезмерного мышечного тонуса.
- Упражнения на развитие чувствительности и силы мускулатуры, в том числе позволяющие скорректировать отдельную группу мышц.
- Занятия, направленные на восстановление функционального состояния мышечной ткани методом восстановления и развития восприимчивости нервных окончаний.
- Упражнения, направленные на развитие ведущей и антагонистической мускулатуры.
- Нагрузки на выносливость для улучшения работы органов.
- Упражнения, снимающие судороги и спазмы мускулатуры.
- Ходьба, направленная на развитие походки и осанки.
- Упражнения на развитие органов восприятия окружающего мира (визуальных и тактильных).
- Упражнения, развивающие вестибулярный аппарат.
Зачастую пациентам с заболеванием ДЦП предписывают развитие мускулатуры тела, выполняя ряд упражнений с постепенно нарастающей интенсивностью и нагрузкой. В случае, если не будет применяться то через определенный временной промежуток опорно-двигательные функции могут быть не реализованы и угнетены. В связи с чем для взрослых людей, страдающих последствиями ДЦП, немаловажным является занятие лфк при том, что с возрастом для приведения мускулатуры в желаемый тонус необходимо гораздо больше времени, чем детям.
Массаж
Поглаживания при массаже обладают расслабляющим эффектом. Движения рук массажиста должны быть медленными и мягкими. При растирании и разминании специалист помогает расслабиться, эти приемы лучше делать нежно, мягко и медленнее, чем обычно.
Потряхивание — специальный и эффективный прием, который можно использовать для снижения тонуса мышц конечностей.
Разминка
В первую очередь, разминаются мышцы спины:
- Движения рук следуют от поясничной области к шее (паравертебральные области тщательно массируют с помощью сегментарного и точечного массажа).
- Подготовительный массаж (растирания, поглаживание, неглубокое массирование проблемных областей мускулатуры).
- Массаж, проецирующий слабые болевые ощущения на удаленные от очага боли области тела.
- Поглаживания завершают процедуру массажа мышц спины. Затем следует обработка мускулатуры ног и ягодиц.
Массаж верхнего плечевого пояса
Следующий этап. Массаж верхнего плечевого пояса, мускулатуры грудного и брюшного отдела. При массировании мышц грудной клетки помогают приемы для активизации дыхания. В процессе следует применить комплекс упражнений на растяжение мышц.
При ДЦП категорически запрещено использовать приемы выжимания, рубления, поколачивания. Длительность сеанса должна составлять не более 20 минут. Среднее количество процедур массажа при ДЦП составляет примерно 2-3 раза каждые полгода.
Медикаментозное лечение
Медикаментозное лечение ДЦП у взрослых позволяет поддержать и восстановить моторные и сенсорные функции. Лекарствами полностью победить болезнь невозможно, но можно сделать жизнь больного нормальной и радостной для него. Применяется медикаментозное лечение часто при сильном поражении структуры мозга.
Для лечения судорожных припадков взрослым, больным ДЦП, применяют два вида препарата. Различные антиконвульсанты используются для борьбы с судорогами. Они отличаются механизмом воздействия на человеческий организм.
Бензодиазепины применяют только в крайних случаях для остановки частых припадков у больного. Они действуют на внутриклеточные процессы в человеческом мозге.
Что врачи назначают?
«Диазепам». Этот препарат применяется против частых судорог. Дозировку назначает лечащий врач, исходя из результата ЭЭГ и типа судорог. Нет общего препарата для всех видов припадков. Иногда врачам приходится назначать комплексную лекарственную терапию.
Для релаксанта используется «Лиорезал» и «Диазепам». Они вместе способны заблокировать сигналы от мозга, направленные на сокращение мышц.
Препарат «Дантролен» применяется для улучшения контроля над сокращениями мышц. Эти средства позволяют снизить мышечный тонус на период лечения.
Для длительного закрепления результата нужно применять физиотерапию. У препаратов есть и побочные действия. Они могут вызывать у взрослого человека сонливость и аллергическую сыпь.
Также больным взрослым людям врачи выписывают дегидратирующий лекарственный препарат. Он направлен на усиление диуреза и снижения продуктов ликвора. Больным ДЦП необходимо принимать и препараты, направленные на улучшение циркуляции крови в мозгу. Такие лекарства позволяют улучшить свойство крови. К таким препаратам относится «Эмоксипин».
С диагнозом ДЦП (детский церебральный паралич) я живу с рождения. Точнее — с годовалого возраста (примерно тогда врачи наконец-то определили, как называется то, что со мной происходит). Я окончила спецшколу для детей с ДЦП, а через 11 лет пришла туда работать. С тех пор прошло уже 20 лет… По самым скромным подсчетам, я знаю, более или менее близко, больше полутысячи ДЦПшников. Думаю, этого достаточно для того, чтобы развеять мифы, которым склонны верить те, кто столкнулся с этим диагнозом впервые.
Миф первый: ДЦП — тяжелое заболевание
Не секрет, что многие родители, услышав от врача этот диагноз, испытывают шок. Особенно в последние годы, когда СМИ все чаще и чаще рассказывают о людях с тяжелой формой ДЦП — о колясочниках с поражением рук и ног, невнятной речью и постоянными насильственными движениями (гиперкинезами). Им и невдомек, что многие люди с ДЦП нормально говорят и уверенно ходят, а при легких формах вообще не выделяются среди здоровых. Откуда же берется этот миф?
Как и многие другие заболевания, ДЦП варьируется от легкой до тяжелой степени. По сути, это даже не болезнь, а общая причина целого ряда расстройств. Ее суть — в том, что во время беременности или родов у младенца оказываются поражены отдельные участки коры головного мозга, в основном те, которые отвечают за двигательные функции и координацию движений. Это и вызывает ДЦП – нарушение правильной работы отдельных мышц вплоть до полной невозможности управлять ими. Медики насчитывают более 1000 факторов, которые могут запустить этот процесс. Очевидно, что разные факторы вызывают разные последствия.
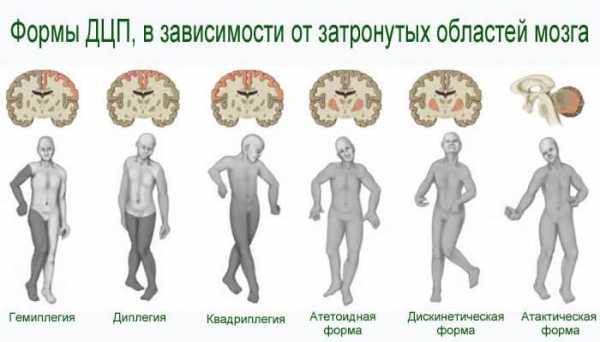
Традиционно выделяются 5 основных форм ДЦП, плюс смешанные формы:
Спастическая тетраплегия
– самая тяжелая форма, когда больной из-за чрезмерного напряжения мышц не в состоянии управлять ни руками, ни ногами и нередко испытывает сильные боли. Ею страдает только 2% людей с ДЦП (здесь и далее статистика взята из Интернета), но именно о них чаще всего рассказывают в СМИ.
Спастическая диплегия
– форма, при которой сильно поражены либо верхние, либо нижние конечности. Чаще страдают ноги – человек ходит с полусогнутыми коленями. Для болезни Литтля, наоборот, характерно сильное поражение рук и речи при относительно здоровых ногах. Последствия спастической диплегии имеют 40% ДЦПшников.
При гемиплегической форме
поражены двигательные функции руки и ноги с одной стороны тела. Ее признаки есть у 32%.
У 10 % людей с ДЦП основная форма – дискинетическая или гиперкинетическая
. Для нее характерны сильные непроизвольные движения – гиперкинезы – во всех конечностях, а также в мышцах лица и шеи. Гиперкинезы часто встречаются и при других формах ДЦП.
Для атаксической формы
характерен пониженный тонус мышц, вялые замедленные движения, сильное нарушение равновесия. Она наблюдается у 15% больных.
Итак, малыш родился с одной из форм ДЦП. А дальше включаются другие факторы — факторы жизни, которая, как известно, у каждого — своя. Поэтому то, что происходит с ним после года, правильнее называть последствиями ДЦП. Они могут быть совершенно разными даже в рамках одной формы. Знаю человека со спастической диплегией ног и довольно сильными гиперкинезами, который окончил мехмат МГУ, преподает в институте и ходит в турпоходы со здоровыми людьми.
С ДЦП рождается, по разным данным, 3-8 младенцев из 1000. Большинство (до 85 %) имеет легкую и среднюю тяжесть заболевания. Это значит, что многие люди просто не связывают особенности их походки или речи со «страшным» диагнозом и считают, что в их окружении ДЦПшников нет. Поэтому единственный источник сведений для них — публикации в СМИ, которые отнюдь не стремятся к объективности…
Миф второй: ДЦП излечим
Для большинства родителей детей с ДЦП этот миф крайне привлекателен. Не задумываясь о том, что нарушения в работе мозга сегодня не исправляются никакими средствами, они пренебрегают «неэффективными» советами рядовых врачей, тратя все сбережения и собирая огромные суммы с помощью благотворительных фондов, чтобы оплатить дорогостоящий курс в очередном популярном центре. Между тем, секрет облегчения последствий ДЦП отнюдь не столько в модных процедурах, сколько в постоянной работе с малышом начиная с первых недель жизни. Ванны, обычные массажи, игры с распрямлением ножек и ручек, поворотами головы и выработкой точности движений, общение — вот та база, которая в большинстве случаев помогает организму ребенка частично компенсировать нарушения. Ведь главная задача раннего лечения последствий ДЦП — не исправление самого дефекта, а предупреждение неправильного развития мышц и суставов. А этого можно достичь только ежедневным трудом.
Миф третий: ДЦП не прогрессирует
Так утешают себя те, кто столкнулся с нетяжелыми последствиями заболевания. Формально это верно – состояние мозга действительно не меняется. Однако даже легкая форма гемиплегии, практически не заметная окружающим, уже к 18 годам неизбежно вызывает искривление позвоночника, которое, если им не заниматься, — прямой путь к раннему остеохондрозу или межпозвонковым грыжам. А это – сильные боли и ограничение подвижности вплоть до невозможности ходить. Подобные типичные последствия есть у каждой формы ДЦП. Беда лишь в том, что в России эти данные практически не обобщаются, а потому растущих ДЦПшников и их родных никто не предупреждает об опасностях, подстерегающих в будущем.
Гораздо лучше известно родителям, что пораженные участки мозга становятся чувствительными к общему состоянию организма. Временное усиление спастики или гиперкинезов могут вызвать даже банальный грипп или скачок давления. В редких случаях нервное потрясение или серьезное заболевание вызывают резкое длительное усиление всех последствий ДЦП и даже появление новых.
Разумеется, это не значит, что людей с ДЦП надо содержать в тепличных условиях. Наоборот: чем крепче организм человека, тем легче он адаптируется к неблагоприятным факторам. Однако если процедура или физическое упражнение регулярно вызывают, к примеру, усиление спастики, от них нужно отказаться. Ни в коем случае нельзя делать что-либо через «не могу»!
Особое внимание должны проявлять родители к состоянию ребенка с 12 до 18 лет. В это время даже здоровые дети испытывают серьезные перегрузки из-за особенностей перестройки организма. (Одна из проблем этого возраста – рост скелета, опережающий развитие мышечных тканей.) Знаю несколько случаев, когда ходячие дети из-за проблем с коленными и тазобедренными суставами в этом возрасте садились на коляску, причем навсегда. Именно поэтому западные врачи не рекомендуют ставить на ноги ДЦПшников 12-18 лет, если до этого они не ходили.
Миф четвертый: всё от ДЦП
Последствия ДЦП бывают самые разные, и все же их перечень ограничен. Однако близкие людей с этим диагнозом порой считают ДЦП причиной не только нарушения двигательных функций, а также зрения и слуха, но и таких явлений как аутизм или синдром гиперактивности. А главное – считают: стоит вылечить ДЦП – и все остальные проблемы решатся сами собой. Между тем, даже если причиной болезни действительно стал ДЦП, лечить надо не только его, но и конкретное заболевание.
В процессе родов у СильвестраСталлоне были частично повреждены нервные окончания лица — часть щеки, губ и языка актера так и остались парализованными, впрочем невнятная речь, ухмылка и большие грустные глаза стали в дальнейшем визитной карточкой.
Особенно забавно фраза «У вас же ДЦП, чего вы хотите!» звучит в устах врачей. Не раз и не два я слышала ее от докторов разных специальностей. В этом случае приходится терпеливо и настойчиво объяснять, что хочу я того же, что и любой другой человек, – облегчения собственного состояния. Как правило, врач сдается и назначает те процедуры, которые мне необходимы. В крайнем случае, помогает поход к заведующему. Но в любом случае, сталкиваясь с тем или иным заболеванием, человеку с ДЦП приходится быть особенно внимательным к себе и порой подсказывать врачам нужное лечение, чтобы свести к минимуму негативное воздействие процедур.
Миф пятый: с ДЦП никуда не берут
Здесь утверждать что-либо с опорой на статистику крайне сложно, ибо надежных данных попросту нет. Однако, если судить по выпускникам массовых классов спецшколы-интерната № 17 г. Москвы, где я работаю, лишь единицы после школы остаются сидеть дома. Примерно половина поступает в специализированные колледжи или отделения вузов, треть — в обычные вузы и колледжи, кое-кто сразу идет работать. В дальнейшем трудоустраивается не менее половины выпускников. Иногда девушки после окончания школы быстро выходят замуж и начинают «работать» мамой. С выпускниками классов для детей с умственной отсталостью ситуация сложнее, однако и там около половины выпускников продолжает учебу в специализированных колледжах.
Этот миф распространяют в основном те, кто не в состоянии трезво оценить свои способности и хочет учиться или работать там, где ему вряд ли удастся соответствовать предъявляемым требованиям. Получая отказ, такие люди и их родители нередко обращаются в СМИ, стремясь силой добиться своего. Если же человек умеет соизмерять желания с возможностями, он находит свой путь без разборок и скандалов.
Показательный пример – наша выпускница Екатерина К., девушка с тяжелой формой болезни Литтля. Катя ходит, но может работать на компьютере всего одним пальцем левой руки, а ее речь понимают только очень близкие люди. Первая попытка поступить в вуз на психолога не удалась – посмотрев на необычную абитуриентку, несколько преподавателей заявили, что отказываются ее учить. Через год девушка поступила в Академию печати на редакторский факультет, где была дистанционная форма обучения. Учеба пошла настолько успешно, что Катя стала подрабатывать сдачей тестов за своих однокашников. Устроиться после окончания вуза на постоянную работу ей не удалось (одна из причин – отсутствие трудовой рекомендации МСЭ). Однако время от времени она работает модератором учебных сайтов в ряде вузов столицы (трудовой договор оформляется на другого человека). А в свободное время пишет стихи и прозу, выкладывая произведения на собственный сайт.
Сухой остаток
Что же я могу посоветовать родителям, которые узнали, что у их малыша ДЦП?
Прежде всего – успокоиться и постараться уделять ему как можно больше внимания, окружая его (особенно в раннем возрасте!) только положительными эмоциями. При этом постарайтесь жить так, будто в вашей семье растет обычный ребенок – гуляйте с ним во дворе, копайтесь в песочнице, помогая своему малышу наладить контакт со сверстниками. Не нужно лишний раз напоминать ему о болезни – ребенок должен сам прийти к пониманию своих особенностей.
Второе – не уповайте на то, что рано или поздно ваш ребенок будет здоровым. Примите его таким, какой он есть. Не следует думать, что в первые годы жизни все силы надо бросить на лечение, оставив развитие интеллекта «на потом». Развитие ума, души и тела взаимосвязаны. Очень многое в преодолении последствий ДЦП зависит от желания ребенка их преодолеть, а без развития интеллекта оно просто не возникнет. Если же малыш не понимает, зачем нужно терпеть дискомфорт и трудности, связанные с лечением, пользы от таких процедур будет немного.
Третье – будьте снисходительны к тем, кто задает нетактичные вопросы и дает «глупые» советы. Помните: недавно вы сами знали о ДЦП не больше, чем они. Постарайтесь спокойно вести такие разговоры, ведь от того, как вы будете общаться с окружающими, зависит их отношение к вашему ребенку.
А главное – верьте: у вашего ребенка всё будет хорошо, если он вырастет открытым и доброжелательным человеком.
код для сайта или блога
No related articles yet.
Анастасия
Прочитала статью. Моя тема:)
32 года, правосторонний гемипарез (лёгкая форма ДЦП). Обычный детский сад, обычная школа, ВУЗ, самостоятельные поиски работы (на ней, собственно, сейчас и нахожусь), путешествия, друзья,обычная жизнь….
И через «хромоногую» прошла, и через «косолапую», и через бог весть что. И многое ещё будет, я уверенна!
НО! Главное это позитивный настрой и сила характера, оптимизм!!
Нана
А действительно с возрастом следует ждать ухудшений? У меня легкая степень, спастика в ногах
Анжела
А меня отношение людей, не благоприятные условия жизни сломали. В 36 лет у меня не ни образования, ни работы, ни семьи хотя легкая форма (правосторонний гемипарез).
Наташа
После прививок появилось много «дцп». Хотя детки и вовсе и не дцп. Там ничего врожденного и внутриутробного нет. Но приписывают к дцп и соответственно неправильно «залечивают». В результате — действительно разновидность паралича получают.
Часто причина «врожденного» дцп вовсе и не травма, а внутриутробная инфекция.
Елена
Замечательная статья, поднимающая огромную проблему — как «с этим» жить. Хорошо показано, что одинаково плохо и не учитывать наличие связанных с заболеванием ограничений и придавать им избыточное значение. Не стоит фокусировать внимание на том, чего ты не можешь, а нужно сосредоточиться на том, что доступно.
И действительно очень важно уделять внимание интеллектуальному развитию. Мы даже Цереброкурин кололи, он нам дал огромный толчок в развитии, всё-таки эмбриональные нейропептиды действительно помогают использовать имеющиеся возможности мозга. Моё мнение, что не нужно ждать чуда, но и опускать руки тоже нельзя.
Автор прав: «этого можно достичь только ежедневным трудом» самих родителей и чем раньше они эти займутся, тем продуктивнее. Начинать «предупреждение неправильного развития мышц и суставов» после полуторагодовалого возраста поздно — «паровоз ушел». Знаю на личном опыте и на опыте других родителей.
Екатерина, всего Вам хорошего.
* Кинесте́зия (др.-греч. κινέω — «двигаю, прикасаюсь» + αἴσθησις — «чувство, ощущение») — так называемое «мышечное чувство», чувство положения и перемещения как отдельных членов, так и всего человеческого тела. (Википедиия)
Ольга
не согласна абсолютно с автором. во-первых, почему при рассмотрении форм дцп ничего не сказали про двойную гемиплегию? она отличается от обычной гемиплегии и от спастического тетрапареза. во-вторых, дцп действительно излечим. если подразумевать развитие компенсаторных возможностей мозга и улучшение состояния пациента. в-третьих, автор в глаза тяжелых детей видела??? таких, о которых и речи нет вынести поиграться в песочницу. когда чуть не так посмотри на ребенка и его трясет от судорог. и крик не прекращается. и он выгибается дугой так, что синяки на руках у мамы, когда она пытается его держать. когда не только сидеть — лежать ребенок не может. в-четвертых. форма дцп — это вообще ни о чем. главное — тяжесть заболевания. я видела спастическую диплегию у двоих детей — один почти не отличается от сверстников, другой — весь скрюченный и с судорогами, разумеется, даже ровно сидеть в коляске не может. а диагноз один.
Елена
не совсем согласна со статьей как мама ребенка с ДЦП-спастическая диплегия, средней степени тяжести. Как маме мне легче жить и бороться думая, что это если и неизлечимо, то поправимо-возможно максимально приблизить ребенка к «норм.» социальной жизни. за 5 лет успели наслушаться что сына лучше в интернат сдать, а самим родить здорового…и это-от двух разных врачей-ортопедов! сказано было при ребенке, у которого сохраненный интеллект и он все слышал…конечно замкнулся, стал сторониться чужих….но у нас огромный скачок-сын ходит сам, правда плохо с равновесием и колени согнуты…но мы боремся.начали довольно поздно-с 10мес, до этого лечили другие последствия преждевременных родов и пофигизма врачей…
Детский церебральный паралич (ДЦП) – общий медицинский термин, который используют для обозначения группы двигательных нарушений, прогрессирующих у грудничка вследствие травматизации различных зон мозга в околородовом периоде. Первые симптомы ДЦП иногда можно выявить уже после рождения ребёнка. Но обычно признаки недуга проявляются у младенцев в грудном возрасте (до 1 года).
Этиология
Детский церебральный паралич у ребёнка прогрессирует из-за того, что определённые участки его ЦНС были повреждены непосредственно во внутриутробном периоде развития, во время процесса рождения либо же в первые месяцы его жизни (обычно до 1 года). На самом деле причины ДЦП довольно разнообразны. Но все они приводят к одному – некоторые зоны мозга начинают неполноценно функционировать или же полностью погибают.
Причины возникновения ДЦП у ребёнка во внутриутробном периоде:
- токсикоз;
- несвоевременная отслойка «детского места» (плаценты);
- угроза выкидыша;
- нефропатия беременных;
- травматизация во время вынашивания ребёнка;
- гипоксия плода;
- фетоплацентарная недостаточность;
- наличие соматических недугов у матери ребёнка;
- резус-конфликт. Данное патологическое состояние развивается из-за того, что у матери и ребёнка различные резус-факторы, поэтому её организм отторгает плод;
- недуги инфекционной природы, которые перенесла будущая мать во время вынашивания плода. К самым потенциально опасным патологиям относят , ;
- гипоксия плода.
Причины, провоцирующие ДЦП в процессе родовой деятельности:
- узкий таз (травма головы ребёнка во время прохождения его по родовым путям матери);
- родовая травма;
- нарушение родовой активности;
- роды ранее установленного срока;
- большой вес новорождённого;
- стремительные роды – представляют наибольшую опасность для младенца;
- ягодичное предлежание ребёнка.
Причины прогрессирования недуга в первые месяцы жизни новорождённого:
- дефекты развития элементов дыхательной системы;
- асфиксия новорождённых;
- аспирация околоплодными водами;
- гемолитическая болезнь.
Разновидности
Выделяют 5 форм ДЦП, которые различаются между собой зоной поражения мозга:
- спастическая диплегия.
Эта форма ДЦП диагностируется у новорождённых чаще остальных. Основная причина её прогрессирования – травматизация зон мозга, которые являются «ответственными» за двигательную активность конечностей. Характерный признак развития недуга у ребёнка до года – частичный или полный паралич ног и рук; - атонически-астатическая форма ДЦП.
В этом случае наблюдается поражение мозжечка. Признаки ДЦП этого типа – больной не может держать равновесие, координация нарушена, мышечная атония. Все эти симптомы проявляются у малыша в возрасте до года; - гемипаретическая форма.
Участки-«мишени» мозга – подкорковые и корковые структуры одного из полушарий, отвечающие за двигательную активность; - двойная гемиплегия.
В этом случае поражаются сразу два полушария. Данная форма церебрального паралича является самой тяжёлой; - гиперкинетическая форма ДЦП.
В большей части клинических ситуаций она сочетается со спастической диплегией. Развивается из-за поражения подкорковых центров. Характерный симптом гиперкинетической формы ДЦП – совершение непроизвольных и неконтролируемых движений. Примечательно то, что такая патологическая активность может возрастать, если ребёнок до года или старше волнуется или устал.
Классификация, основывающаяся на возрасте ребёнка:
- ранняя форма.
В этом случае симптомы ДЦП отмечаются у новорождённого в период от рождения до полугода; - начальная остаточная форма.
Период её проявления – от 6 месяцев и до 2 лет; - поздняя остаточная
– от 24 месяцев.
Симптоматика
Детский церебральный паралич имеет множество проявлений. Симптомы недуга напрямую зависят от степени поражения структур мозга, а также от места локализации очага в данном органе. Заметить прогрессирование церебрального паралича можно заметить уже после рождения, но чаще его выявляют через пару месяцев, когда становится явно видно, что новорождённый отстаёт в развитии.
Признаки детского церебрального паралича у новорождённого:
- малыша совершенно не интересуют игрушки;
- новорождённый долгое время не переворачивается самостоятельно и не держит голову;
- если попробовать поставить малыша, то он будет становиться не на стопу, а только на носочки;
- движения конечностями носят хаотичный характер.
Симптомы ДЦП:
- парезы. Обычно только половина тела, но иногда они распространяются на ноги и руки. Поражённые конечности изменяются – они укорачиваются и становятся тоньше. Характерные деформации скелета при детском церебральном параличе – , деформация грудины;
- нарушение тонуса мышечных структур. У больного ребёнка наблюдается либо спастическое напряжение, либо же полная гипотония. Если имеет место гипертонус, то конечности принимают неестественное для них положение. При гипотонии ребёнок слабый, наблюдается тремор, он может часто падать, так как мышечные структуры ног не поддерживают его тело;
- выраженный болевой синдром. При детском церебральном параличе он развивается вследствие различных деформаций костей. Боль имеет чёткую локализацию. Чаще он возникает в плечах, спине и шее;
- нарушение физиологического процесса глотания еды. Этот признак детского церебрального паралича можно выявить сразу после рождения. Младенцы не могут полноценно сосать материнскую грудь, а груднички не пьют из бутылочки. Этот симптом возникает из-за пареза мышечных структур глотки. Также из-за этого возникает слюнотечение;
- нарушение речевой функции. Возникает из-за пареза голосовых связок, горла, губ. Иногда эти элементы поражаются одновременно;
- судорожный синдром. Судороги проявляются в любое время и в любом возрасте;
- хаотичные патологически движения. Ребёнок совершает резкие движения, может гримасничать, принимать определённые позы и прочее;
- контрактуры суставных сочленений;
- значительное или умеренное снижение слуховой функции;
- задержка развития. Данный симптом детского церебрального паралича встречается не у всех больных детей;
- снижение зрительной функции. Чаще возникает и косоглазие;
- сбой работы органов ЖКТ;
- больной непроизвольно выделяет экскременты и урину;
- прогрессирование эндокринных недугов. У детей с таким диагнозом часто диагностируют , дистрофию, задержку роста, .
Осложнения
ДЦП является хроническим недугом, но со временем он не прогрессирует. Состояние пациента может усугубиться, если возникнут вторичные патологии, такие как , кровоизлияния, соматические недуги.
Осложнения ДЦП:
- инвалидизация;
- нарушение адаптации в социуме;
- возникновение мышечных контрактур;
- нарушение потребления еды, так как парез поразил мышцы глотки.
Диагностические мероприятия
Диагностикой недуга занимается невролог. Стандартный план диагностики включает в себя такие методы обследования:
- тщательный осмотр. Медицинский специалист оценивает рефлексы, остроту зрения и слуха, мышечные функции;
- электроэнцефалография;
- электронейрография;
- электромиография;
Дополнительно больного могут направить на консультации к узким специалистам:
- логопед;
- офтальмолог;
- психиатр;
- эпилептолог.
Лечебные мероприятия
Сразу стоит сказать, что такую патологию полностью излечить невозможно. Поэтому лечение ДЦП в первую очередь направлено на уменьшение проявления симптомов. Специальные реабилитационные комплексы дают возможность постепенно развить речь, интеллектуальные и двигательные навыки.
Реабилитационная терапия состоит из таких мероприятий:
- занятия с логопедом. Необходимы, чтобы у больного ребёнка нормализовалась речевая функция;
- ЛФК. Комплекс упражнений разрабатывает только специалист строго индивидуально для каждого пациента. Их необходимо выполнять ежедневно, чтобы они оказали необходимый эффект;
- массаж при ДЦП является очень эффективным методом реабилитации. Врачи прибегают к сегментарному, точечному и классическому видам. Массаж при ДЦП должен проводить только высококвалифицированный специалист;
- использование технических средств. К таковым относят костыли, специальные вставки, помещаемые в обувь, ходунки и прочее.
Физиотерапевтические методы и анималотерапию также активно применяют в лечении ДЦП:
- водолечение;
- оксигенобаротерапия;
- лечение грязями;
- электростимуляция;
- прогревание тела;
- электрофорез с фармацевтическими препаратами;
- дельфинотерапия;
- иппотерапия. Это современный метод лечения, основанный на общении больного с лошадьми.
Медикаментозная терапия:
- если у ребёнка отмечаются эпилептические припадки различной степени интенсивности, то ему обязательно назначают противосудорожные препараты, чтобы купировать приступы;
- ноотропные фармацевтические средства. Основная цель их назначения – нормализация обращения крови в мозге;
- миорелаксанты. Данные фармацевтические средства пациентам назначают, если у них наблюдается гипертонус мышечных структур;
- метаболические средства;
- противопаркинсонические лекарственные средства;
- антидепрессанты;
- нейролептики;
- спазмолитики. Эти препараты больному назначают при сильном болевом синдроме;
- анальгетики;
- транквилизаторы.
К операбельному лечению детского церебрального паралича медицинские специалисты прибегают только в тяжёлых клинических ситуациях, когда консервативная терапия не оказывает желаемого эффекта. Прибегают к таким видам вмешательств:
- операции на мозге. Врачи осуществляют деструкцию структур, которые являются причиной прогрессирования неврологических нарушений;
- спинальная ризотомия. К данному операбельному вмешательству врачи прибегают в случае сильного мышечного гипертонуса и выраженного болевого синдрома. Её суть заключается в прерывании патологической импульсации, которая исходит из спинного мозга;
- тенотомия. Суть операции состоит в создании опорного положения поражённой конечности. Её назначают, если у пациента формируются контрактуры;
- иногда специалисты осуществляют пересадку сухожилий или костей, чтобы хоть немного стабилизовать скелет.
О таком заболевании, как детский церебральный паралич, каждый слышал хотя бы раз, хотя, возможно, и не сталкивался. Что такое ДЦП в общем плане? Понятие объединяет группу хронических двигательных расстройств, которые возникают вследствие повреждения мозговых структур, и происходит это до появления на свет, в предродовой период. Нарушения, наблюдаемые при параличе, могут быть разные.
Болезнь ДЦП – что это такое?
Церебральный паралич – заболевание нервной системы, возникающее в результате поражения головного мозга: ствола, коры, подкорковых областей, капсул. Патология нервной системы ДЦП у новорожденных не является наследственной, но некоторые генетические факторы в ее развитии участвуют (максимум в 15% случаев). Зная, что такое ДЦП у детей, врачи умеют вовремя его диагностировать и предотвращать развитие болезни в перинатальный период.
Патология включает различные расстройства: параличи и парезы, гиперкинезы, изменения мышечного тонуса, нарушения речи и координации движений, отставание в моторном и психическом развитии. Традиционно принято разделять болезнь ДЦП на формы. Основных пять (плюс неутонченная и смешанная):
- Спастическая диплегия
– самый распространенный тип патологии (40% случаев), при котором нарушены функции мышц верхних или нижних конечностей, позвоночник и суставы деформированы. - Спастическая тетраплегия
, частичная или полная парализация конечностей – одна из самых тяжелых форм, выраженная в чрезмерном напряжении мышц. Человек не в состоянии управлять ногами и руками, страдает от болей. - Гемиплегическая форма
характеризуется ослаблением мышц лишь одной половины тела. Рука на пораженной стороне страдает больше, чем нога. Распространенность – 32%. - Дискинетическая (гиперкинетическая) форма
иногда встречается при других видах ДЦП. Выражается в появлении непроизвольных движений в руках и ногах, мышцах лица и шеи. - Атаксическая
– форма церебрального паралича, проявляющаяся в пониженном мышечном тонусе, атаксии (несогласованности действий). Движения заторможенные, равновесие сильно нарушено.
Детский церебральный паралич – причины возникновения
Если развивается одна из форм ДЦП, причины возникновения могут быть разными. Они оказывают влияние на развитие плода в период беременности и первый месяц жизни малыша. Серьезный фактор риска – . Но главную причину не всегда можно определить. Основные процессы, приводящие к тому, что такое заболевание, как ДЦП развивается:
- и ишемические поражения. От недостатка кислорода страдают те участки мозга, которые отвечают на обеспечение двигательных механизмов.
- Нарушение развития мозговых структур.
- с развитием гемолитической желтухи новорожденных.
- Патологии беременности ( , ). Иногда, если развивается ДЦП, причины кроются в перенесенных заболеваниях матери: сахарном диабете, пороках сердца, гипертензии и др.
- вирусные, например, герпес.
- Врачебная ошибка во время ведения родов.
- Инфекционные и токсические поражения мозга в младенчестве.
ДЦП – симптомы
Когда возникает вопрос: что такое ДЦП, сразу приходит на ум патология с нарушениями двигательной активности и речи. На самом деле почти у трети детей с данным диагнозом развиваются другие генетические заболевания, которые похожи на церебральный паралич лишь внешне. Первые признаки ДЦП можно выявить сразу после рождения. Основные симптомы, проявляющиеся в первые 30 дней:
- отсутствие поясничного изгиба и складок под ягодицами;
- видимая асимметрия туловища;
- тонус мышц или их ослабление;
- неестественные, замедленные движения малыша;
- подергивания мышц с частичной парализацией;
- потеря аппетита, тревожность.
Впоследствии, когда ребенок начинает активно развиваться, патология проявляет себя отсутствием необходимых рефлексов и реакций. Младенец не держит головку, остро реагирует на прикосновения и не реагирует на шум, совершает однотипные движения и принимает неестественные позы, с трудом сосет грудь, проявляет чрезмерную раздражительность или вялость. До трехмесячного возраста поставить диагноз реально, если внимательно следить за развитием малыша.
Стадии ДЦП
Чем раньше диагностируют патологию, тем больше шансов на полное излечение. Заболевание не прогрессирует, но все зависит от степени поражения мозга. Стадии ДЦП у детей делятся на:
- раннюю, симптомы которой проявляются у грудничков до 3 месяцев;
- начальную резидуальную (остаточную), соотносящуюся с возрастом от 4 месяцев до трех лет, когда складывается, но не зафиксированы патологически двигательный и речевой стереотипы;
- позднюю резидуальную, для которой характерен набор проявлений, не выявляемых в более раннем возрасте.
Не всегда диагноз ДЦП гарантирует инвалидность и несостоятельность, но комплексную терапию важно начать вовремя. У мозга грудничка больше возможностей для восстановления его функций. Основная задача лечения в детском возрасте – развитие по максимуму всех умений и навыков. На раннем этапе сюда входит коррекция двигательных расстройств, гимнастика и массаж, стимуляция рефлексов. Усилия врачей направлены на купирование патологий, могут назначаться:
- препараты для снижения ;
- стимулирующие лекарства для развития ЦСН;
- витаминотерапия;
- физиотерапия.
Можно ли вылечить ДЦП?
Главный вопрос, волнующий родителей больного малыша: можно ли вылечить ДЦП у ребенка полностью? Нельзя однозначно это заявить, особенно когда изменения произошли в структурах мозга, но болезнь поддается коррекции. В возрасте до 3-х лет в 60-70% случаев удается восстановить нормальную работу мозга и особенно двигательных функций. Со стороны родителей важно не пропустить первые симптомы, не игнорировать проявление отклонений во время беременности и родов.
Основная задача врачей, занимающихся ребенком с ДЦП – не столько излечить, сколько адаптировать пациента. Малыш должен реализовать свои возможности в полной мере. Лечение подразумевает медикаментозную и другие виды терапии, а также обучение: развитие эмоциональной сферы, совершенствование слуха и речи, социальную адаптацию. При диагнозе детский церебральный паралич лечение не может быть однозначным. Все зависит от сложности и локализации поражения.
Массаж при детском церебральном параличе
Понимая, что такое ДЦП и как важно своевременно начать реабилитацию, родители малыша должны регулярно проходить с ним курсы лечебного массажа и ЛФК. Ежедневные процедуры не только при посещении врача, но и на дому – залог успеха. Больные ДЦП получают от массажа огромную пользу: лимфоток и кровоток улучшаются, активируется обмен веществ, поврежденные мышцы расслабляются или стимулируются (в зависимости проблемы). Массаж должен проводиться на определенных группах мышц и сочетается с дыхательными движениями. Классическая техника для расслабления:
- Поверхностные и легкие движения массажиста, поглаживание кожи.
- Катание плечевых мышц и тазобедренного сустава.
- Валяние больших мышечных групп.
- Растирание, в том числе сильное, всего тела, спины, ягодиц.
Особенности детей с ДЦП
Родителям бывает трудно принять диагноз, который поставлен их ребенку, однако здесь важно не опускать руки и направить все силы на реабилитацию и адаптацию малыша. При получении должного ухода и лечения люди с ДЦП чувствуют себя полноценными членами общества. Но важно понимать, что у каждого патология проявляется в индивидуальном порядке, это и определяет характер терапии, ее длительность и прогноз (положительный или не очень). Особенности развития детей с параличом обусловлены возникающими при координировании движений трудностями. Это проявляется в следующем:
- Замедленность движений, которая формирует дисбаланс развития мышления.
Возникают проблемы с освоением математики, так как деткам трудно считать. - Эмоциональные нарушения
– повышенная ранимость, впечатлительность, привязанность к родителям. - Измененная работоспособность ума.
Даже в случаях, когда интеллект развивается нормально и страдают только мышцы, ребенок не может переварить всю поступающую информацию так же быстро, как сверстники.
Уход за ребенком с ДЦП
Что важно учитывать и как ухаживать за ребенком с ДЦП в психическом и физическом плане? Последнее подразумевает соблюдение всех рекомендаций врача, занятие физкультурой, обеспечение полноценного сна, регулярные прогулки, игры, купания, занятия. Важно, чтобы ежедневные рутинные действия ребенок воспринимал, как дополнительное упражнение для закрепления образцов движений. В эмоциональном плане от родителей зависит будущее ребенка. Если проявлять жалость и чрезмерную опеку, малыш может замкнуться в себе, стремясь к развитию.
Правила такие:
- Не делать акцентов на особенностях поведения, которые вызваны болезнью.
- Проявления активности, напротив, поощрять.
- Формировать правильную самооценку.
- Побуждать к новым шагам к развитию.
Если ДЦП у новорожденных может никак не проявлять себя, то в более позднем возрасте различия заметны. Малышу трудно сохранять устойчивую позу лежа, сидя, координация движений нарушена. Опору подвижную и нет он может получить с помощью специального приспособления. Реабилитация детей с ДЦП (в т. ч. младенцев) подразумевает использование таких устройств:
- Клин
– треугольник из плотного материала, который располагают под грудью малыша для удобства лежания. Верхняя часть туловища приподнимается, ребенку проще контролировать положение головы, двигать руками и ногами. - Угловая доска
подразумевает фиксирование положения тела на боку. Предназначена для детей с тяжелыми нарушениями. - Стендер
наклонный необходим для освоения позы стоя. Ребенок находится под определенным углом наклона (он регулируется). - Стояк
– похож на стендер, но предназначен для детей, которые умеют удерживать положение туловища, но не способны стоять без поддержки. - Подвесные гамаки
, с помощью которых младенец способен удерживать таз и плечи на одном уровне, голову на средней линии. Пресекает попытки выгибания спинки. - Приспособления для игры
– мягкие валики, мячи надувные.
Развитие детей с ДЦП
Чтобы улучшить прогноз, необходимо помимо прохождения терапии практиковать развивающие занятия с детьми, ДЦП требует ежедневных упражнений: логопедических, подвижных, водных и т.д. С малышами полезно играть в игры, совершенствуя тактильные, слуховые, зрительные ощущения, развивая концентрацию. Фигурки животных и мячи – самые доступные и полезные игрушки. Но не меньше покупных изделий ребенка привлекают простые предметы:
- пуговицы;
- обрезки ткани;
- бумага;
- посуда;
- песок;
- вода и т.д.
ДЦП – прогноз
Если поставлен диагноз ДЦП, прогноз для жизни, как правило, благоприятный. Больные могут стать нормальными родителями и доживают до глубокой старости, хотя продолжительность жизни может быть снижена из-за психического недоразвития, развитием вторичного недуга – эпилепсии, и отсутствии социальной адаптации в обществе. Если вовремя начать лечение, можно добиться почти полного выздоровления.
Что такое ДЦП? Неприятная, но не смертельная патология, с которой есть шанс жить полноценной жизнью. По статистике, 2-6 из 1000 новорожденных страдают церебральным параличом и вынуждены проходить пожизненную реабилитацию. Развитие осложнено, но большинство пациентов (до 85%) имеют легкую и среднюю форму недуга и ведут полноценный образ жизни. Гарантия успеха: поставленный в детском возрасте диагноз и прохождение полного комплекса мероприятий – медикаментозной и физиотерапии, регулярных занятий дома.
Диагноз, который пугает всех и каждого — детский церебральный паралич. Причины, формы ДЦП — эти вопросы волнуют любого современного родителя, если во время вынашивания ребенка доктор говорит о высокой вероятности такого отклонения либо если пришлось столкнуться с ним уже после рождения.
О чем идет речь?
ДЦП — термин собирательный, его применяют к нескольким типам и видам состояний, при которых страдают опорная система человека и возможности двигаться. Причина врожденного ДЦП — повреждение мозговых центров, ответственных за возможность совершения различных произвольных передвижений. Состояние больного неумолимо регрессирует, рано или поздно патология становится причиной мозговой дегенерации. Первичные нарушения происходят еще во время развития плода в материнском организме, несколько реже ДЦП объясняется особенностями родов. Есть риск, что причиной ДЦП окажутся некоторые события, произошедшие с ребенком вскоре после рождения и негативно повлиявшие на здоровье головного мозга. Оказать такое воздействие могут внешние факторы только в ранний период после рождения.
Уже сегодня докторам известно огромное количество факторов, способных спровоцировать ДЦП. Причины разнообразны, а защитить от них свое чадо не всегда легко. Впрочем, из медицинской статистики видно, что чаще всего диагноз ставят недоношенным детишкам. До половины всех случаев с ДЦП — малыши, рожденные раньше срока. Эта причина считается самой значимой.
Факторы и риски
Раньше из причин, почему дети рождаются с ДЦП, первой и самой главной считали травму, полученную в момент появления на свет. Спровоцировать ее могут:
- слишком быстрое рождение;
- технологии, методы, применяемые акушерами;
- зауженный материнский таз;
- неправильная тазовая анатомия матери.
В настоящее время врачам доподлинно известно, что родовые травмы приводят к ДЦП лишь в крайне малом проценте случаев. Преимущественная доля — это специфика развития ребенка во время нахождения в материнской утробе. Считавшаяся ранее основной причиной возникновения ДЦП проблема родов (к примеру, затяжных, очень тяжелых) сейчас классифицируется как последствие нарушений, произошедших во время вынашивания ребенка.
Рассмотрим это подробнее. Современные врачи, выясняя с ДЦП, проанализировали статистику влияния аутоиммунных механизмов. Как удалось выявить, некоторые факторы оказывают значимое воздействие на формирование тканей на этапе появления эмбриона. Современная медицина считает, что это — одна из причин, объясняющих немалый процент случаев отклонений здоровья. Аутоиммунные нарушения влияют не только во время нахождения в материнском организме, но и воздействуют на ребенка после родов.
Вскоре после рождения прежде здоровый ребенок может стать жертвой ДЦП в силу инфицирования, на фоне которого развился энцефалит. Спровоцировать беду могут:
- корь;
- ветряная оспа;
- грипп.
Известно, что к основным причинам ДЦП относится гемолитическая болезнь, проявляющаяся себя желтухой в силу недостаточности функционирования печени. Иногда у ребенка выявляется резус-конфликт, который также может спровоцировать ДЦП.
Далеко не всегда удается определить причину, почему дети рождаются с ДЦП. Отзывы врачей неутешительны: даже МРТ и КТ (самые эффективные и точные методы исследования) не всегда могут предоставить достаточно данных для формирования цельной картины.
Сложность вопроса
Если человек отличается от окружающих, он привлекает к себе внимание — этот факт ни у кого не вызывает сомнений. Дети, больные ДЦП — это всегда объект интереса окружающих, от обывателей до профессионалов. Особенная сложность заболевания — в его влиянии на весь организм. При ДЦП страдает возможность контролировать собственное тело, так как нарушается функциональность ЦНС. Конечности, мышцы лица не подчиняются больному, и это сразу бросается в глаза. При ДЦП у половины всех пациентов также отмечаются задержки развития:
- речи;
- интеллекта;
- эмоционального фона.
Нередко ДЦП сопровождается эпилепсией, судорожностью, тремором, неправильно сформированным телом, непропорциональными органами — пораженные участки растут и развиваются значительно медленнее здоровых элементов организма. У некоторых больных нарушается зрительная система, у других ДЦП — причина психических, слуховых, глотательных нарушений. Возможен неадекватный мышечный тонус или проблемы с мочеиспусканием, дефекацией. Сила проявлений определяется масштабностью нарушения мозговой функциональности.
Важные нюансы
Известны такие случаи, когда больные успешно адаптировались к социуму. Им доступна нормальная человеческая жизнь, полноценная, наполненная событиями, радостями. Возможен и другой вариант развития событий: если при ДЦП пострадали довольно большие участки головного мозга, это станет причиной присвоения статуса инвалида. Такие дети полностью зависят от окружающих, по мере взросления зависимость не становится слабее.
В некоторой степени будущее ребенка зависит от его родителей. Известны некоторые подходы, методы, технологии, позволяющие стабилизировать и улучшить состояние больного. В то же время не стоит рассчитывать на чудо: причина ДЦП — поражение ЦНС, то есть излечению болезнь не поддается.
Со временем у некоторых детей симптоматика ДЦП становится все шире. Врачи расходятся во мнении, можно ли считать это прогрессом болезни. С одной стороны, первопричина не меняется, но ребенок со временем пытается освоить новые умения, зачастую сталкиваясь с неудачей на этом пути. Встретившись с ребенком с ДЦП, не стоит его опасаться: болезнь не передается от человека к человеку, не наследуется, поэтому фактически единственная ее жертва — это сам пациент.
Как заметить? Основные симптомы ДЦП
Причина возникновения нарушения — сбой в работе ЦНС, приводящий к дисфункции двигательных мозговых центров. Впервые симптоматику можно заметить у малыша в трехмесячном возрасте. Такой ребенок:
- развивается с задержкой;
- ощутимо отстает от сверстников;
- страдает судорожностью;
- совершает странные, несвойственные малышам движения.
Отличительная особенность столь раннего возраста — повышенные мозговые компенсаторные возможности, поэтому терапевтический курс будет в большей степени эффективен, если получится поставить диагноз рано. Чем позднее выявят болезнь, тем хуже прогноз.
Причины и дискуссии
Причина возникновения основных симптомов ДЦП — нарушение в работе мозговых центров. Спровоцировать это могут разнообразные повреждения, сформировавшиеся под влиянием широкого спектра факторов. Некоторые появляются еще во время развития в материнском организме, другие — при рождении и вскоре после. Как правило, ДЦП развивается лишь на первом году жизни, но не позднее. В большинстве случаев выявляется дисфункция следующих мозговых участков:
- кора;
- область под корой;
- мозговой ствол;
- капсулы.
Есть мнение, что при ДЦП страдает функциональность спинного мозга, но подтверждения в настоящий момент нет. Травмы спинного мозга установлены лишь у 1 % больных, поэтому нет возможности провести достоверные исследования.
Дефекты и патологии
Одна из самых часто встречающихся причин диагноза ДЦП — дефекты, полученные в период внутриутробного развития. Современные врачи знают следующие ситуации, при которых высока вероятность отклонений:
- миелинизация медленнее нормы;
- неправильное деление клеток нервной системы;
- нарушение связей между нейронами;
- ошибки формирования сосудов;
- отравляющее воздействие непрямого билирубина, приведшее к повреждению тканей (наблюдается при конфликте резус-факторов);
- инфицирование;
- рубцы;
- новообразования.
В среднем у восьми детей из десяти больных причина возникновения ДЦП — одна из указанных.
Особенно опасными инфекциями считаются токсоплазмоз, грипп, краснуха.
Известно, что ребенок с ДЦП может родиться у женщины, страдающей следующими болезнями:
- сахарный диабет;
- сифилис;
- патологии сердца;
- сосудистые заболевания.
И инфекционные, и хронические патологические процессы в материнском организме — возможные причины возникновения ДЦП у ребенка.
Материнский организм и плод могут обладать конфликтующими антигенами, резус-факторами: это приводит к тяжелым нарушениям здоровья ребенка, включая ДЦП.
Повышены риски, если во время беременности женщина принимает лекарства, способные отрицательно влиять на плод. Аналогичные опасности связаны с употреблением спиртного и куренем. Выясняя, что является причиной ДЦП, врачи установили, что чаще такие дети рождаются у женщин, если роды перенесены в возрасте до совершеннолетнего или старше сорокалетнего. В то же время нельзя говорить о том, что перечисленные причины гарантированно спровоцируют ДЦП. Все они лишь повышают риск отклонений, являются признанными закономерностями, учитывать которые нужно, планируя ребенка и вынашивая плод.
Нечем дышать!
Гипоксия — часто встречающаяся причина возникновения ДЦП у детей. Лечение патологии, если она спровоцирована именно нехваткой кислорода, ничем не отличается от прочих причин. Как такового выздоровления со временем не будет, но при раннем обнаружении признаков можно начать адекватный курс реабилитации пациента.
Гипоксия возможна и при вынашивании плода, и при родах. Если вес ребенка меньше нормы, есть все основания предполагать, что гипоксия сопровождала определенный этап беременности. Спровоцировать состояние могут болезни сердца, сосудов, эндокринных органов, заражение вирусом, почечные нарушения. Иногда гипоксия провоцируется токсикозом в тяжелой форме или на поздних сроках. Одна из причин ДЦП у детей — нарушение кровотока в малом тазу матери во время вынашивания чада.
Перечисленные факторы отрицательно влияют на снабжение плаценты кровью, из которой клетки эмбриона получают питательные компоненты и кислород, жизненно важные для правильного развития. При нарушении кровотока метаболизм ослабевает, эмбрион развивается медленно, есть вероятность малого веса или роста, нарушения функциональности разных систем и органов, включая ЦНС. Говорят о недостаточности веса, если новорожденный весит 2,5 кг и меньше. Существует классификация:
- рожденные до 37 недели гестации дети с адекватным для своего возраста весом;
- недоношенные детишки с маленькой массой;
- рожденные вовремя или позднее срока дети с малым весом.
О гипоксии, задержке развития говорят только применительно к двум последним группам. Первая считается нормой. Для недоношенных, рожденных вовремя и позднее срока детей с недостатком массы риск развития ДЦП оценивается достаточно высоким.
Здоровье ребенка зависит от матери
Преимущественно причины ДЦП у детей обусловлены периодом развития в материнском организме. Аномалии у плода возможны под влиянием разных факторов, но чаще всего причиной становятся:
- развитие диабета (нарушения в среднем — у трех детей из ста рожденных у матерей, страдавших гестационным диабетом);
- нарушения в работе сердца и сосудов (инфаркт, резкие изменения уровня давления);
- инфекционный агент;
- физическая травма;
- отравление в острой форме;
- стресс.
Один из факторов опасности — многоплодная беременность. Эта причина ДЦП у новорожденных имеет следующее объяснение: при вынашивании нескольких эмбрионов сразу материнский организм сталкивается с повышенными показателями нагрузки, а значит, существенно выше вероятность рождения детей раньше срока, с малым весом.
Появление на свет: не все так просто
Распространенная причина ДЦП у новорожденных — родовая травма. Несмотря на стереотипы, гласящие, что это возможно лишь в случае ошибки акушера, на практике травмы гораздо чаще объясняются особенностями материнского или детского организма. К примеру, у роженицы может быть очень узкий таз. Возможна и другая причина: ребенок очень крупный. Во время появления на свет организм чада может пострадать, нанесенный ему вред становится причиной разнообразных болезней. Нередко наблюдаются клинические проявления ДЦП у новорожденных детей по причинам:
- неправильное положение эмбриона в матке;
- помещение головы в таз по неправильной оси;
- слишком быстрые или очень продолжительные роды;
- использование неподходящих принадлежностей;
- ошибки акушера;
- асфиксия по разным причинам.
В настоящее время одним из наиболее безопасных вариантов рождения считается кесарево сечение, но даже такой подход не может гарантировать отсутствия родовой травмы. В частности, есть вероятность повреждения позвонков шеи или груди. Если при рождении прибегали к кесареву сечению, необходимо вскоре после родов показать младенца остеопату для проверки адекватности состояния позвоночника.
В среднем ДЦП встречается у двух девочек из тысячи, а для мальчиков частота немногим выше — три случая на тысячу младенцев. Бытует мнение, что такая разница объясняется большим размером тела мальчиков, а значит, риск получения травмы выше.
В настоящее время от ДЦП застраховаться невозможно, как нет стопроцентной гарантии его предусмотреть, предупредить. Во внушительном проценте случаев причины приобретенного ДЦП, врожденного удается установить уже постфактум, когда аномалии проявляют себя в развитии ребенка. В некоторых случаях уже во время беременности есть признаки, указывающие на вероятность ДЦП, но в своей основной массе они не поддаются коррекции либо устраняются лишь с большим трудом. И все же отчаиваться не стоит: с ДЦП можно жить, можно развиваться, быть счастливым. В современном обществе довольно активно продвигается реабилитационная программа для таких детишек, совершенствуется оборудование, а значит, отрицательное воздействие болезни смягчается.
Актуальность вопроса
Статистические исследования показывают, что в среднем в возрасте до года ДЦП диагностируют с частотой до 7 из тысячи детей. В нашей стране средние статистические показатели — до 6 на тысячу. Среди недоношенных частота встречаемости приблизительно в десять раз больше относительно средней по миру. Врачи считают, что ДЦП — первая беда среди хронических болезней, поражающих детишек. В некоторой степени болезнь связана с ухудшением экологии; определенным фактором признается неонатология, поскольку даже дети, чей вес — всего лишь 500 г, в больничных условиях могут выжить. Безусловно, это настоящий прогресс науки и техники, но вот частота ДЦП среди таких детей, к сожалению, существенно выше среднего, поэтому важно не просто научиться выхаживать весящих столь мало детей, но и разработать способы обеспечения им полноценной, здоровой жизни.
Особенности болезни
Выделяют пять типов ДЦП. Чаще всего встречается спастическая диплегия. Разные специалисты оценивают частоту таких случаев в 40-80% от общего количества диагнозов. Такой тип ДЦП устанавливают, если поражения мозговых центров становятся причиной парезов, от которых в первую очередь страдают нижние конечности.
Одна из форм ДЦП — поражение двигательных центров в одной половине мозга. Это позволяет установить гемипаретический тип. Парезы свойственны только одной половине тела, противоположной тому мозговому полушарию, которое пострадало от агрессивных факторов.
До четверти всех случаев — это гиперкинетический ДЦП, обусловленный нарушением деятельности подкорки головного мозга. Симптоматика болезни — непроизвольные движения, активизирующиеся, если больной устал или взволнован.
Если нарушения сконцентрированы в мозжечке, диагноз звучит как «атонически-астатический ДЦП». Болезнь выражена статическими нарушениями, атонией мышц, невозможностью координации движений. В среднем такой тип ДЦП выявляют у одного больного из десяти пациентов.
Самый сложный случай — двойная гемиплегия. ДЦП обусловлен абсолютным нарушением функциональности полушарий мозга, в силу чего мышцы ригидны. Такие дети не могут сидеть, стоять, держать головку.
В некоторых случаях ДЦП развивается по комбинированному сценарию, когда одновременно появляется симптоматика разных форм. Чаще всего сочетаются гиперкинетический тип и спастическая диплегия.
Все индивидуально
Степень выраженности отклонений при ДЦП различна, а клинические проявления зависят не только от локализации больных мозговых областей, но и от глубины нарушений. Известны такие случаи, когда уже в первые часы жизни видны проблемы здоровья малыша, но в большинстве случаев можно поставить диагноз лишь спустя несколько месяцев после рождения, когда заметно отставание в развитии.
Заподозрить ДЦП можно, если ребенок не успевает в двигательном развитии за сверстниками. Довольно долго малыш не может обучиться держать головку (в некоторых случаях этого так и не происходит). Ему неинтересны игрушки, он не пытается перевернуться, осознанно шевелить конечностями. При попытке дать ему игрушку ребенок не пытается ее удержать. Если поставить чадо на ноги, оно не сможет встать на стопу полностью, а попытается подняться на цыпочки.
Возможны парезы отдельной конечности или одной стороны, могут пострадать все конечности сразу. Органы, ответственные за речь, недостаточно качественно иннервированы, а значит, произношение дается с трудом. Иногда при ДЦП диагностируется дисфагия, то есть невозможность проглатывать пищу. Это возможно, если парезы локализованы в глотке, гортани.
При значительной мышечной спастичности пораженные конечности могут быть абсолютно неподвижными. Такие части тела отстают в развитии. Это приводит к видоизменению скелета — деформируется грудная клетка, искривляется позвоночник. При ДЦП в пораженных конечностях выявляют контрактуры суставов, а значит, нарушения, связанные с попытками движения, становятся еще более существенными. Большинство детей с ДЦП страдают достаточно сильными болями, объясняющимися нарушениями скелета. Наиболее выражен синдром в шее, плечах, ступнях, спине.
Проявления и симптомы
На гиперкинетическую форму указывают внезапные движения, которые пациент не может контролировать. Некоторые поворачивают голову, кивают, гримасничают или подергиваются, принимают вычурные позы, совершают странные движения.
При атонической астатической форме больной не может координировать движения, при попытке ходьбы неустойчив, часто падает, не может поддерживать равновесие стоя. Такие люди чаще страдают треморами, а мышцы очень слабые.
ДЦП часто сопровождается косоглазием, желудочно-кишечными нарушениями, дыхательной дисфункцией и недержанием мочи. До 40 % больных страдают эпилепсией, а у 60 % ослаблено зрение. Некоторые плохо слышат, другие вовсе не воспринимают звуки. До половины всех больных имеют нарушения в работе эндокринной системы, выраженные сбоем гормонального фона, излишками веса, задержкой роста. Нередко при ДЦП выявляют олигофрению, замедленное психическое развитие, снижение возможности обучаться. Для многих пациентов характерны поведенческие отклонения и расстройства восприятия. До 35% больных отличаются нормальным уровнем интеллекта, а у каждого третьего умственные нарушения оцениваются как легкая степень.
Болезнь хроническая, вне зависимости от формы. Когда больной становится взрослее, постепенно проявляются скрытые ранее патологические нарушения, что воспринимается ложным прогрессом. Нередко ухудшение состояния объясняется вторичными сложностями со здоровьем, поскольку при ДЦП часты:
- инсульты;
- соматические болезни;
- эпилепсия.
Нередко диагностируют кровоизлияния.
Как обнаружить?
Пока не удалось разработать таких тестов и программ, которые бы позволили доподлинно установить ДЦП. Некоторые типичные проявления болезни привлекают внимание врачей, благодаря чему болезнь удается выявить на раннем этапе жизни. Предположить ДЦП можно по низкому баллу по шкале Апгар, по нарушениям тонуса мышц и двигательной активности, отставанию, отсутствию контакта с ближайшим родственником — больные не реагируют на мать. Все эти проявления — повод для детального обследования.
Значения аббревиатуры
ИКСИ РАН
- Институт комплексных социальных исследований Российской академии наук
Значения аббревиатуры
медучасток
- медицинский участок
Значения аббревиатуры
КСИВ
- «Краткие сообщения Института востоковедения»
Значения аббревиатуры
ТТЭС
- Ташкентская тепловая электростанция
- технико-технологический экспертный совет
Значения аббревиатуры
КСМБ
- Коммунистический Союз Молодёжи Белоруссии
Значения аббревиатуры
СДПБ
- Объединённая социал-демократическая партия благосостояния
Значения аббревиатуры
ПМК-10
- «Передвижная механизированная колонна № 10»
Значения аббревиатуры
райпромсовет
- районный совет промысловой кооперации
Значения аббревиатуры
КЛЕН
- Кировский лицей естественных наук
- «клянусь любить его (её) навек»
- «кого люблю — ебать не стану»
- Лицей естественных наук города Кирова
Значения аббревиатуры
МОЛГН
- межобластная лаборатория государственного надзора за стандартами и измерительной техникой
Значения аббревиатуры
УФСС
- Украинская федерация спорта с собаками
Значения аббревиатуры
инстр.
- инструктор
- инструкция
- инструмент
- инструментальный
Значения аббревиатуры
ОУНТ
- однослойная углеродная нанотрубка
- одностенная углеродная нанотрубка
Значения аббревиатуры
МОУП
- международная организация уголовной полиции
- Международный открытый университет Поволжья
- минское областное унитарное предприятие
Случайная аббревиатура
Значения аббревиатуры ОСКИ
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры идиот
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры ГИОХИН АН СССР
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры УНИА
Всего значений: 2
Случайная аббревиатура
Значения аббревиатуры НИЧ МТУСИ
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры Инфотранс
Всего значений: 2
Случайная аббревиатура
Значения аббревиатуры ЦГАОО
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры АПГНТМ
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры УП
Всего значений: 41
(показано 5)
Случайная аббревиатура
Значения аббревиатуры УЗВС
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры ЗРАДн
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры МАВИАЛ
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры ширик
Всего значений: 1
Случайная аббревиатура
Значения аббревиатуры КФ
Всего значений: 38
(показано 5)
Случайная аббревиатура
Значения аббревиатуры Главширпотреб
Всего значений: 1
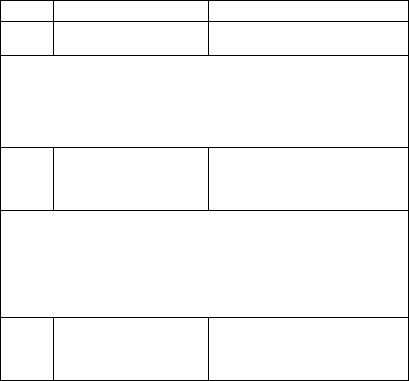
Справочник по формулированию клинического диагноза болезней нервной системы (Шток, Левин, 2006)
Глава 20. Заболевания мышц и нервно-мышечной передачи
Примечание. В данной подрубрике может кодироваться рабдомиолиз, иди опатический или вторичный (осложнение полиомиелита, дерматомиозита, лекарственной миопатии, метаболических миопатии, полимиозита)
|
G73.7* |
Миопатия при других болез |
ОФД. Вторичная миопатия (мио- |
|
нях, классифицированных в |
патический синдром) с указанием |
|
|
других рубриках |
основного заболевания |
|
Примечание. В данной подрубрике может кодироваться миопатия при амилоидозе (Е85.- +), карциноидном синдроме (Е34.0+), алиментарной недо статочности (Е40-Е64+), остеомаляции (М83.- +), дефиците витамина D (Е55.- +), травме и ишемии (Т79.6+)
|
G72.9 |
Миопатия неуточненная |
Код для статистического учета не |
|
уточненных случаев миопатии |
||
(лава 21 Детский церебральный паралич
Детский церебральный паралич (ДЦП) — заболевание, характеризу ющееся непрогрессирующим поражением головного мозга, возни кающим до родов, во время родов либо сразу после них и преимуще ственно проявляющимся двигательными нарушениями (параличами, нарушением координации, непроизвольными движениями).
Д Ц П может возникать под влиянием различных экзогенных и эндогенных факторов, которые могут взаимодействовать между собой. Таким образом, Д Ц П можно рассматривать как мультифакториальное заболевание. Причиной Д Ц П могут быть внутриутробные инфекции, внутриутробная гипоксия (например, вследствие нару шения плацентарного кровообращения), несовместимость матери и плода по резус-фактору с развитием ядерной желтухи, преждевре менные роды и родовая травма, гипоксия и асфиксия во время удли ненных или осложненных родов, травмы, сосудистые повреждения, инфекции в послеродовом периоде. У большинства больных реша ющее значение имеет не родовая травма, а пренатальные факторы, действующие во внутриутробном периоде и нередко повышающие чувствительность плода к действию неблагоприятных факторов во
Глава 21. Детский церебральный паралич
время родов. У значительной части больных причина развития Д Ц П остается неизвестной.
Наряду с двигательными нарушениями (параличи, насильствен ные движения, нарушение координации движений, задержка мо торного развития с персистированием примитивных рефлексов и формированием патологических позных установок) часто отмеча ется задержка психического развития с формированием умственной отсталости, аутизм, эпилептические припадки, глазодвигательные нарушения (косоглазие, нистагм, паралич взора). Клинические про явления полиморфны и зависят от характера и степени нарушения развития и патологических изменений мозга.
Выделяют шесть основных форм Д Ц П :
1.Спастическая диплегия (болезнь Литтла).
2.Гемиплегическая форма.
3.Двойная гемиплегия.
4.Гиперкинетическая форма.
5.Атактическая форма.
6.Атонически-астатическая форма.
ДЦ П кодируется в рубрике G80. В подрубриках G80.0-G80.9 представлены разные клинические формы Д Ц П . В развернутом ди агнозе дополнительно указываются названия клинических форм, перечисленные в подрубриках. Помимо двигательных нарушений, при решении вопросов оценки инвалидизации, социальной адапта ции и перспектив реабилитации большое значение имеет состояние когнитивных функций и интеллекта. Поэтому при наличии таких расстройств их особенности должны быть отражены в диагнозе (на пример, задержка умственного развития, выраженные когнитивные нарушения с указанием степени обучаемости).
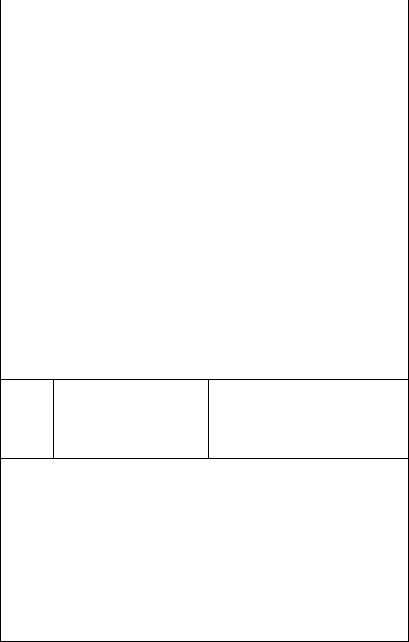
|
МКБ-10 |
Предлагаемые общая формулировка |
||
|
диагноза (ОФД) и примеры |
|||
|
Код |
|||
|
Название болезни |
развернутой формулировки диагноза |
||
|
рубрик |
(ПРФД) |
||
|
1 |
2 |
3 |
|
|
G80.0 |
Спастический церебральный |
ОФД. Та же, что и в МКБ-10 |
|
|
паралич |
ПРФД. Детский церебральный па |
||
|
ралич выраженным спастическим |
|||
Справочник по формулированию диагноза болезней нервной системы
Врожденный спастический тетрапарезом (двойная гемиплегия) паралич (церебральный) с формированием сгибательной контрактуры нижних конечностей, глубокой умственной отсталостью, частыми вторично-генерализован ными эпилептическими припад
ками
Примечание. В данной подрубрике по определению кодируются все случаи ДЦП с преобладанием спастического паралича, за исключением диплегической и гемиплегической форм (см. ниже). Таким образом, чаще всего эта рубрика используется по отношению к двойной гемиплегии.
Двойная гемиплегия — одна из самых тяжелых форм ДЦП, обычно свя занная с обширным повреждением головного мозга (вследствие внутрутробной инфекции, тяжелой родовой асфиксии и т. д.). Руки и ноги при этой форме поражаются примерно в равной степени, хотя у части больных функция рук страдает в большей степени, чем функция ног. Сразу по сле рождения отмечается диффузная мышечная гипотония, но в течение первого года жизни происходит повышение тонуса в мышцах туловища и конечностей. У большинства этих больных не удается добиться развития двигательных навыков, интеллекта, речи
|
G80.1 |
Спастическая диплегия |
ОФД. ДЦП, диплегическая форма |
|
ПРФД. ДЦП, диплегическая форма |
||
|
с выраженным нарушением функ |
||
|
ции нижних конечностей и легким |
||
|
нарушением функции верхних ко |
||
|
нечностей, умеренная дизартрия, |
||
|
умеренная задержка психомотор |
||
|
ного развития |
||
Примечание. Спастическая диплегия (болезнь Литтла) — наиболее распро страненная форма ДЦП, особенно часто встречающаяся у недоношенных детей, нередко связана с геморрагическим или ишемическим поражением околожелудочкового белого вещества и может сочетаться с гидроцефали ей. Проявляется спастическим тетрапарезом, при котором верхние конеч ности поражаются в значительно меньшей степени, чем нижние. Степень поражения рук различна — от выраженных парезов до легкой неловкости. Ребенок может научиться писать, обслуживать себя, может овладеть рядом трудовых навыков. У большинства больных обнаруживаются нарушения речи в виде задержки ее развития, дизартрии. У большинства больных детей задержку психического развития при рано начатом, систематиче ском лечении и обучении можно преодолеть, и ребенок способен пойти в обычную или специализированную школу
Глава 21. Детский церебральный паралич
|
1 |
2 |
3 |
|
G80.2 |
Детская гемиплегия |
ОФД. ДЦП, гемиплегическая фор |
|
ма |
||
|
ПРФД. ДЦП, гемиплегическая |
||
|
форма с умеренным нарушением |
||
|
функции правой кисти и легким |
||
|
нарушением функции правой ноги, |
||
|
умеренная дизартрия, легкие ког |
||
|
нитивные нарушения |
||
Примечание. Гемиплегическая форма — наиболее частая форма ДЦП у до ношенных детей, но встречается и у недоношенных детей; может быть вызвана пороком развития головного мозга или инсультом. Наиболее вы раженной обычно бывает слабость в кисти — в ноге обычно отмечается легкий или умеренный парез. Ребенок обычно в состоянии научиться хо дить, но это происходит позднее, чем в норме. Возможны нарушения речи, трудности при обучении, задержка психического развития, но у большин ства больных формируются нормальные речь и интеллект
| G80.3 |
Дискинетический цере |
ОФД. ДЦП, гиперкинетическая |
|
бральный паралич |
форма (двойной атетоз) |
|
|
Атетоидный церебральный |
ПРФД. ДЦП вследствие перенесен |
|
|
паралич |
ной ядерной желтухи, гиперкинети |
|
|
ческая форма в виде генерализован |
||
|
ного дистонического гиперкинеза, |
||
|
грубая дизартрия, интеллектуаль |
||
|
ное развитие в пределах нормы |
||
Примечание. Гиперкинетическая форма обычно возникает вследствие тя желой гипоксии или ядерной желтухи, вызывающих преимущественное повреждение базальных ганглиев. В клинической картине доминируют гиперкинезы различного типа (чаще всего хореоатетоз, мышечная дис тония или их комбинация). Соответственно выделяют преимущественно хореоатетоидный или дистонический варианты. У 90% больных наблюда ются речевые нарушения, однако интеллект у подавляющего большинства больных не страдает. Прогностически это вполне благоприятная форма для обучения. Однако из-за грубого, не поддающегося коррекции гипер кинеза и выраженной дизартрии социальная адаптация затруднена
|
G80.4 |
Атактический церебральный |
ОФД. ДЦП, атактическая форма |
|
паралич |
ПРФД. ДЦП, атактическая форма |
|
|
с умеренным нарушением стато- |
||
|
локомоторной функции, легкой |
||
|
дизартрией, умеренной дискоор- |
||
|
динацией движений и выраженной |
||
|
мышечной гипотонией в верхних |
||
Справочник по формулированию диагноза болезней нервной системы
конечностях, нормальное интел лектуальное развитие
Примечание. Атактическая (мозжечковая) форма — редкая форма ДЦП, возникающая при поражении мозжечка и связанных с ним стволовых структур. Интеллект обычно нормальный, но приобретение двигательных навыков затруднено. Больные ходят, шатаясь, широко расставляя ноги. При осмотре часто выявляются нистагм, нарушение координации дви жений в конечностях, снижение мышечного тонуса
G80.8 Другой вид детского цере ОФД. ДЦП, атонически-астатиче
брального паралича ская, смешанная и другие формы Смешанные синдромы це ребрального паралича
Примечание. В подрубрике кодируются нередко встречаемые смешанные (спастико-атакстическая, спастико-гиперкинетическая) формы, а также атонически-астатическая форма. Атонически-астатическая форма про является невозможностью удерживать вертикальную позу; в отличие от других форм заболевание характеризуется низким тонусом мышц, дви гательные навыки (сидение, стояние, ходьба) не развиваются. Помимо гипотонии могут выявляться мозжечковые нарушения, дизартрия
G80.9 Детский церебральный па Код для статистического учета не ралич неуточненный уточненных случаев ДЦП Церебральный паралич БДУ
Глава 22 Аномалии развития
центральной нервной системы
1.Врожденные аномалии нервной системы
2.Факоматозы (нейрокожные синдромы)
Пороки развития нервной системы обычно возникают вследствие нарушения процессов эмбриогенеза в разные сроки внутриутроб ного периода. Их причиной могут быть наследственные факторы, внешние воздействия во время беременности (например, гипоксия, инфекции, действие лекарственных средств, облучение и т. д.) или их сочетание.
В МКБ-10 врожденные пороки развития нервной системы пред ставлены в рубриках:
Q00—Q07 («Врожденные аномалии нервной системы»). Q65—Q79 («Врожденные аномалии и деформации мышечно-
скелетной системы»).
Q80—Q89 («Другие врожденные аномалии»).
Q90—Q99 («Хромосомные аномалии, не классифицируемые в других рубриках»).
Справочник по формулированию диагноза болезней нервной системы
Врожденные аномалии сосудистой системы головного мозга — см. гл. 1 «Сосудистые заболевания головного и спинного мозга».
В данной главе рассматриваются и факоматозы, которые также связаны с нарушением процессов развития.
1. Врожденные аномалии нервной системы
|
МКБ-10 |
Предлагаемые общая формулировка |
||
|
диагноза (ОФД) и примеры |
|||
|
Код |
|||
|
Название болезни |
развернутой формулировки диагноза |
||
|
рубрик |
|||
|
(ПРФД) |
|||
|
1 |
2 |
3 |
|
|
Q00 |
Анэнцефалия и подобные пороки развития |
||
|
Q00.0 |
Анэнцефалия |
ОФД. Та же, что и в МКБ-10 |
|
|
Ацефалия |
|||
|
Акрания |
|||
|
Амиелэнцефалия |
|||
|
Гемианэнцефалия |
|||
|
Гемицефалия |
|||
Примечание. Аненцефалия — отсутствие головного мозга, обычно сопро вождающееся дефектами черепа, мозговых оболочек, скальпа
|
Q00.1 |
Краниорахишизис |
ОФД. Та же, что и в МКБ-10 |
Примечание. Красниорахишизис — незаращение черепа и позвоночного канала
|
Q00.2 |
Иниэнцефалия |
ОФД. Та же, что и в МКБ-10 |
Примечание. Иниэнцефалия — закидывание головы кзади вследствие по рока развития шейного отдела позвоночника; часто сочетается с анэнце фалией и энцефалоцеле
Q01 Энцефалоцеле
Примечание. Энцефалоцеле — выпячивание вещества головного мозга через врожденный дефект черепа, черепно-мозговая грыжа. В зависимости от локализации грыжа может быть передняя, задняя, базальная, сагитталь ная. Передние грыжи в зависимости от расположения костного дефекта подразделяют на носолобные, носорешетчатые и носоглазничные. При наличии 2-3 дефектов могут развиться двусторонние смешанные перед ние грыжи. Задние грыжи в зависимости от расположения по отношению к затылочнуму бугру делят на верхние и нижние
|
Q01.0 |
Лобное энцефалоцеле |
ОФД. Та же, что и в МКБ-10 |
Глава 22. Аномалии развития центральной нервной системы
|
1 |
2 |
3 |
|
Q01.1 |
Носолобное энцефалоцеле |
ОФД. Та же, что и в МКБ-10 |
|
Q01.2 |
Затылочное энцефалоцеле |
ОФД. Та же, что и в МКБ-10 |
|
Q01.8 |
Энцефалоцеле другой лока |
ОФД — см. примечание |
|
лизации |
||
Примечание. В подрубрике кодируется теменное, носоглоточное, височ ное, глазничное энцефалоцеле. В развернутом диагнозе, кроме указания типа энцефалоцеле, отмечают особенности физического и психического развития, неврологический синдром
|
Q01.9 |
Энцефалоцеле неуточнен- |
Код для статистического учета не |
|
ное |
уточненных случаев энцефалоцеле |
|
|
Q02 |
Микроцефалия |
ОФД. Та же, что и в МКБ-10 |
|
Q03 |
Врожденная гидроцефалия |
|
|
Включена: гидроцефалия у новорожденного |
||
|
Исключены: синдром Арнольда—Киари (Q07.0), гидроцефалия |
||
|
приобретенная (G91.-), вследствие врожденного токсоплазмоза, |
||
|
сопровождающаяся spina bifida (Q05.0-Q05.4) |
||
|
Q03.0 |
Врожденный порок сильвие |
ОФД. Та же, что и в МКБ-10 |
|
ва водопровода |
||
|
Аномалия |
||
|
Непроходимость |
||
|
Стеноз |
||
Примечание. В подрубрике кодируются врожденная обструкция, стеноз и другие аномалии сильвиева водопровода
Q03.1 Атрезия отверстий МажанОФД. Та же, что и в МКБ-10
ди и Люшка
Синдром Денди—Уокера
Примечание. Синдром Денди—Уокера — врожденный порок развития чет вертого желудочка головного мозга с нарушением формирования его сре динного выходного отверстия, что приводит к кистозному расширению желудочка, гидроцефалии, недоразвитию мозжечка. Клинически прояв ляется симптомами повышения внутричерепного давления, поражения черепных нервов, атаксией. Возможно развитие умственной отсталости в связи с сопутствующей агенезией мозолистого тела и нарушением мигра ции нейронов в процессе созревания больших полушарий. Нередко соче тается с пороками развития сердечно-сосудистой и мочеполовой системы
Q03.8 Другая врожденная гидро ОФД — см. примечание
цефалия
Справочник по формулированию диагноза болезней нервной системы
|
1 |
2 |
3 |
|
Примеча |
ние. В данной рубрике могут кодироваться случаи врожденной |
|
|
гидроцег^ |
эалии при аномалиях, классифицируемых в других рубриках |
|
|
Q03.9 |
Врожденная гидроцефалия |
Код для статистического учета не |
|
неуточненная |
уточненных случаев врожденной |
|
|
гидроцефалии |
||
|
Q04 |
Другие врожденные аномалии головного мозга |
|
|
Исключены: циклопия (Q87.0), макроцефалия (Q75.3) |
||
|
Q04.0 |
Врожденные мальформации |
ОФД — см. примечание |
|
мозолистого тела |
||
Примечание. Агенезия (недоразвитие) мозолистого тела может проявляться психическими нарушениями, эпилептическими припадками, вегетатив ными пароксизмами. Часто сопровождается гидроцефалией. В рубрике кодируются тотальная и парциальная агенезия мозолистого тела, агенезия мозолистого тела с липомой, другие врожденные аномалии мозолистого тела. Агенезия мозолистого тела может быть изолированной аномалией либо сочетаться с голопрозэнцефалией, микро- и макроцефалией
|
Q04.2 |
Аринэнцефалия |
ОФД. Та же, что и в МКБ-10 |
Примечание. Аринэнцефалия — отсутствие обонятельных луковиц, трактов и бугорков, которое часто сочетается с голопрозэнцефалией и перегоро- дочно-зрительной дисплазией, но может сопровождать агенезию мозоли стого тела или встречаться как изолированная аномалия
Q04.3 Другие формы недоразвития ОФД — см. примечание
головного мозга
Исключена: врожденная аномалия мозолистого тела (Q04.0)
Примечание. В данной подрубрике кодируются агирия (лиссэнцефалия), микрогирия, пахигирия, агенезия (аплазия, гипоплазия) отдельных частей мозга.
Агирия (лиссэнцефалия) — недоразвитие извилин коры головного мозга, вызванное нарушением миграции нейронов на поверхность больших по лушарий в эмбриогенезе.
Микрогирия (полимикрогирия) — уменьшение размеров мозговых извилин со значительным увеличением их численности.
Пахигирия — патологическое утолщение и уплотнение извилин головного мозга.
Основное клиническое проявление указанных аномалий головного моз га — умственная отсталость
studfiles.net
Что такое ДЦП
Все слышали аббревиатуру ДЦП, но не многие знают, что она означает. Что такое ДЦП? Что это за заболевание и чем оно опасно? Необходимо разобраться во всем по порядку.
Общая характеристика ДЦП
ДЦП — одно из тяжелых заболеваний, которое ведет к инвалидности. Но данная болезнь не имеет склонности к прогрессированию, при надлежащем лечении возможно значительное улучшение состояния. Это связано с тем, что поражение мозга при ДЦП (детский церебральный паралич) у детей остается на одном уровне и в течение длительного времени не меняется.
В настоящее время болезнь делится на клинические формы ДЦП. К общепринятым формам относятся:
- Спастическая форма. Тяжелое повреждение головного мозга, которое развивается внутриутробно или во время родов из-за кислородного голодания.
- Дискинетическая форма. Возникает у малышей с гемолитическим заболеванием.
- Атактическая форма характеризуется пониженным мышечным тонусом и сильным сухожильным рефлексом.
- Смешанные формы сочетают в себе несколько вариаций заболевания.
- Неуточненная форма.
Причины и угроза развития детского церебрального паралича
Чаще всего болезнь развивается внутриутробно. Причиной этого могут быть гипоксические, метаболические и токсические воздействия. В связи с развитием внутриутробной нейроинфекции плода возникают отклонения в его развитии. При родах на этом фоне может возникнуть травматическое или гипоксическое поражение головного мозга ребенка. Врачебная ошибка тоже занимает место в ряде причин развития ДЦП, но, как показывает практика, такие случаи встречаются очень редко. Назвать точную причину развития заболевания не представляется возможным, при многих случаях при ДЦП причина так и не выявлена.
Можно выделить ряд факторов, которые прямо или косвенно влияют на внутриутробное поражение головного мозга ребенка:
- Наличие хронической гипоксии плода.
- Злоупотребление курением во время беременности.
- Внутриутробные инфекции.
- Пониженный гемоглобин у матери во время беременности.
- Тяжелые гестозы.
- Рождение недоношенных детей.
- Стремительные роды.
- Асфиксия плода при родах.
- Переохлаждение ребенка после родов.
- После рождения ребенка наличие инфекций нервной системы в первый год жизни.
ДЦП не является наследственным заболеванием, поэтому люди с таким диагнозом могут родить здорового малыша.
Как проявляется ДЦП?
Ребенок не может держать туловище или сохранять нормальную позу, выполнять активные движения. Может быть нарушен слух, зрение, психическое состояние, речь. ДЦП может протекать как в легкой степени, так и в тяжелой. Это зависит от повреждения мозга и того, какие его отделы наиболее затронуты.
Очень часто при поражении тела ребенка его умственные способности не страдают. При задержке речи и двигательных способностей ребенок может все понимать и чувствовать.
После рождения малыша не всегда удается поставить правильный диагноз, лишь ко второму месяцу жизни появляются признаки ДЦП. Это отсутствие мышечной активности конечностей ребенка. Может наблюдаться расслабленность мышц и неспособность ими пошевелить либо конечность может находиться в одном напряженном положении.
Помимо этого наблюдаются трофические нарушения. Если паралич в вялом состоянии, то у ребенка за счет неиспользованной энергии начинают откладываться жиры. При гиперкинезах ребенок интенсивно двигается, при этом вес может быть значительно снижен. А это влечет различного рода нарушения, отставание в физическом развитии, нехватку кальция, позднее наступление менструального цикла у девочек. Характерной особенностью такого паралича может быть маленькая голова по отношению к телу. Дети бывают анемичными.
Так как при ДЦП происходит спазм мышц речевого аппарата, речь ребенка нарушается, появляются заикания, нечленораздельная речь. Этому может способствовать также плохой слух.
Умственная отсталость — не редкость при диагнозе детский церебральный паралич, как и наличие судорог. Умственная отсталость может выражаться в разной степени, от легкой, когда выявить ее можно с помощью специальных тестов, до тяжелых случаев олигофрении. Судороги у таких детей не реагируют на противосудорожное лечение.
Детский церебральный паралич: лечение
Лечение проводится врачом-неврологом после диагностирования заболевания. Порой бывает достаточным осмотр больного ребенка и беседа с родителями. Часто наряду с этим врач может потребовать следующие результаты исследований:
- Электроэнцефалографию, чтобы узнать, насколько правильно работает головной мозг больного.
- Электронейромиографию. Она определяет мышечную работу человека.
- Компьютерную томографию, чтобы убедиться, что головной мозг поражен не раковой опухолью.
Диагностика должна проводиться и для того, чтобы исключить похожие заболевания, например, такие как рак головного мозга, хромосомные болезни, заболевания нервной системы хронического течения.
В отличие от них, ДЦП не склонен к прогрессированию.
Сразу, как будет поставлен диагноз ДЦП, следует приступать к лечению. Оно направлено в первую очередь на устранение двигательных нарушений, речевого дефекта и нормализацию психического состояния больного. Для того чтобы двигательная активность нормализовалась, имеются специальные корректоры для выправления осанки и т.д.
На сегодняшний день нет определенной схемы лечения больных ДЦП. Каждый случай индивидуален. Но неплохие результаты дают следующие виды терапии:
- ЛФК.
- Массаж.
- Лекарственные средства, направленные на поддержание мышечного тонуса.
Разработано множество методик лечения больных, также имеются оснащения для облегчения жизни детей с данным диагнозом. Вот некоторые из них:
- Методика Войта.
- Бобат-терапия.
- Нагрузочные костюмы, получившие название «Адель» и «Гравистат».
- Пневмокостюм «Атлант».
- Методики, разработанные логопедами.
- Вспомогательные аппараты, такие как ходунки, тренажеры, коляски, вертикализаторы, велосипеды и т.д.
Если эти методы не дают нужного результата, то может быть назначена операция, которая предусматривает пластику сухожилий и мышц, после чего нормализуется форма и структура скелета. Операция может проводиться с целью удаления контрактуры или это может быть нейрохирургия.
Неплохой результат дает санаторное лечение. Часто применяется анималотерапия, т.е. лечение с помощью животных, например, лошадей.
Врач может назначить больному с ДЦП препараты, улучшающие мозговое кровообращение. Наряду с этим могут приниматься антиоксиданты, БАДы, препараты, влияющие на сосудистый тонус и даже стволовые клетки. Но полная эффективность этого лечения не доказана.
С первых дней, как болезнь была диагностирована, нужно начинать лечение, иначе в дальнейшем с ростом костей и их укреплением будет все тяжелее справиться с заболеванием.
К тому же с возрастом из-за неправильного положения тела начнут проявляться ортопедические патологии — сколиоз, плоскостопие, дисплазия бедренного сустава и т.д.
Таким образом, можно составить примерную схему лечения ДЦП у детей:
- Нормализация речи. Она проводится логопедом. Основная терапия должна быть направлена на контроль мышц во рту при произнесении слов, прожевывании пищи и издавании звуков.
- Физиотерапия и терапия трудом. Она направлена на то, чтобы человек в дальнейшем мог приспособиться к самостоятельной жизни, чтобы освоил хотя бы простейшие навыки самообслуживания.
- Медикаментозное лечение предусмотрено для снятия судорог, мышечных спазмов, боли.
- Применение ортопедических приспособлений.
- При тяжелых случаях возникает необходимость в инвалидном кресле.
- Хирургическое лечение проводится для того, чтобы откорректировать анатомические деформации и снять напряжение мышц.
- Применение новейших технологий для лечения таких пациентов, например, компьютеры и речевые синтезаторы.
При халатном отношении к лечению у такого ребенка могут быть последствия ДЦП в виде тяжелых пролежней, если его не поднимают и не поворачивают, может быть упущено время, когда можно было ребенку помочь, другие нарушения в работе организма.
Уход за ребенком с церебральным параличом
Всем известно, как тяжело ухаживать за ребенком с такой проблемой, помимо физических усилий очень важна эмоциональная устойчивость. Так как часто родители бывают вынуждены работать, чтобы предоставить ребенку должные условия для лечения и жизни, они нанимают няню для ухода за больным. Важно, чтобы этот человек мог дарить тепло и ласку такому малышу, для которого это очень важно. Помимо этого человек, ухаживающий за ребенком, должен быть готов к постоянным походам по врачам, логопедам, массажистам и т.д. Профилактика ДЦП включает в себя охрану здоровья будущей матери, отказ ее от вредных привычек и постоянное наблюдение у врача во время беременности.
nervzdorov.ru
Что такое ДЦП? Типы, причины ДЦП, лечение и реабилитация
«Ребенок-ангел» — так иногда называют детей, которым поставлен звучащий, как приговор, страшный диагноз – ДЦП. Детский церебральный паралич. Да, эти малыши никогда не станут такими, как их сверстники. Они не будут весело прыгать через лужи, носиться сломя голову на велосипеде и задавать бесконечные «почему?». Но ведь от этого они не станут менее родными и любимыми для своих родителей! Что может быть страшнее для них, чем страдания своей кровиночки? Но опускать руки и впадать в уныние и депрессию нельзя! Ведь именно от родителей и близких зависит, насколько такой ребенок сможет адаптироваться к жизни в социуме и насколько успешным будет развитие малыша – физическое и психическое. Только благодаря усилиям близких людей появится надежда на снижение болевого синдрома и развитие моторных функций. А чтобы бороться с врагом, нужно знать его в лицо.
Итак, что же это такое — «детский церебральный паралич»? Почему «детский» — ведь страдают им и взрослые? Какие могут быть типы церебрального паралича? Насколько распространен этот диагноз? Каковы причины ДЦП и его последствия? Возможно ли предотвратить появление ДЦП? Передается ли детский церебральный паралич по наследству? Можно ли заразиться этим недугом? На что стоит обращать внимание, чтобы не пропустить первые проявления ДЦП?
Какие дети относятся к «группе риска»? И, конечно же, больше всего волнуют родителей вопросы – излечим ли ДЦП и что можно сделать, чтобы помочь больному ребенку и облегчить его состояние? Обо всем этом вы узнаете, прочитав статью. И, самое главное, вам станет понятно, в каком направлении необходимо двигаться и что делать, чтобы ребенок начал ползать, ходить, слышать вас и говорить. Ведь даже в самых тяжелых случаях возможен прогресс сенсорной и двигательной функций, что значительно улучшает развитие ребенка и качество его жизни.
Термин церебральный паралич употребляется для характеристики группы хронических состояний, при которых поражается двигательная и мышечная активность с нарушением координации движений.
Причина церебрального паралича — поражение одного или более отделов мозга либо в процессе внутриутробного развития, либо во время (или сразу после) родов, либо в грудном/младенческом возрасте. Обычно это происходит во время осложненной беременности, которая является предвестницей преждевременных родов.
Слово «церебральный» означает «мозговой» (от латинского слова «cerebrum» — «мозг”), а слово «паралич» (от греческого «paralysis» — «расслабление”) определяет недостаточную (низкую) физическую активность. Сам по себе церебральный паралич не прогрессирует, т.к. не дает рецидивов. Тем не менее, в процессе лечения может наступить улучшение, ухудшение состояния пациента, либо оно остается без изменений.
Церебральный паралич — не наследственное заболевание. Им никогда нельзя заразиться или заболеть. Хотя ДЦП не излечивается (не является “курабельным” в общепринятом смысле), постоянный тренинг и терапия могут привести к улучшению состояния.
История
В 1860г. английский хирург Уильям Литтл впервые опубликовал результаты своих наблюдений над детьми, у которых после перенесенной родовой травмы развивались параличи конечностей. Состояние детей не улучшалось и не ухудшалось по мере их роста: оставались проблемы с хватательным рефлексом, ползанием и ходьбой. Признаки таких поражений у детей долгое время называли “болезнью Литтла”, сейчас они известны как “спастическая диплегия”. Литтл предположил, что эти поражения вызваны кислородным голоданием (гипоксией) при родах. Однако в 1897г., знаменитый психиатр Зигмунд Фрейд, заметив, что дети с церебральными параличами часто страдали задержкой психического развития, расстройством визуального восприятия и припадками по типу эпилептических, предположил, что причина таких более глубоких поражений мозга коренится в патологии развития мозга младенца в более ранний период жизни — в период развития плода еще в утробе матери.
Несмотря на это предположение Фрейда, вплоть до 1960-х годов нашего века среди врачей и ученых широко было распространено мнение, что основной причиной ДЦП являются осложнения в процессе родов. Но в 1980г., проанализировав данные национальных исследований по более, чем 35000 случаев новорожденных с признаками ДЦП, ученые были поражены, что осложнения вследствие родовой травмы составили менее 10%. В большинстве случаев причины развития ДЦП не были выявлены. И с этих пор начались обширные исследования перинатального периода жизни: с 28-й недели внутриутробной жизни плода по 7-е сутки жизни новорожденного.
Последствия ДЦП
Характерными особенностями церебрального паралича являются нарушения двигательной активности, особенно подвергается поражению мышечная сфера — происходит нарушение координации движений. В зависимости от степени и расположения участков поражения мозга, могут иметь место одна или несколько форм мышечной патологии^
- напряженность мышц или спастика;
- непроизвольные движения;
- нарушение походки и степени мобильности.
Так же могут встречаться следующие патологические явления:
- аномальность ощущения и восприятия;
- снижение зрения, слуха и ухудшение речи;
- эпилепсия;
- задержка психического развития.
Другие проблемы: трудности при приеме пищи, ослабление контроля мочеиспускания и работы кишечника, проблемы с дыханием из-за нарушения положения тела, пролежни и трудности с обучением.
Причины возникновения церебрального паралича
ДЦП может быть вызван большинством факторов, нарушающих развитие мозга. Основной причиной является недостаточность снабжения кислородом мозга — гипоксия (внутриутробная или у новорожденного). Снабжение кислородом может быть прервано преждевременным отделением плаценты от стенок матки, неправильным предлежанием плода, затяжными или стремительными родами, нарушением циркуляции в пуповине.
Преждевременные роды, недоношенность, низкий вес при рождении, RH-фактор или групповая несовместимость крови плода и матери по системе А-В-О, инфицирование матери коревой краснухой или другими вирусными заболеваниями в период ранней беременности — и микроорганизмы атакуют центральную нервную систему плода — все это тоже факторы риска.
В США, в частности, все исследования направлены на изучение двух основных причин ДЦП: коревой краснухи и несовместимости крови плода и матери.
Итак, основные причины ДЦП связаны с процессами развития беременности и родовым актом, а эти состояния не передаются по наследству: и такой паралич часто называют врожденным ДЦП (связанный с внутриутробной патологией или с процессом родоразрешения). Менее распространенный тип — приобретенный ДЦП, обычно развивается до двухлетнего возраста (черепно-мозговые травмы в результате несчастных случаев или инфекции мозга).
Типы церебрального паралича
Существуют три основных типа церебрального паралича:
- Спастический (spastic) — у больного большая скованность и затруднения движения: 70-80% пациентов;
- Атетоидный (athetoid), или дискинетический — наличие непроизвольных, неконтролируемых движений (гиперкинезы): 10-20% пациентов;
- Атаксический (ataxic) — нарушение равновесия, наличие глубинных умственных отклонений: 5-10% пациентов.
Возможен смешанный тип (из вышеуказанных). Существуют и другие типы церебрального паралича, хотя они встречаются редко.
Можно ли предотвратить церебральный паралич?
Да. В настоящее время увеличились шансы, которые дают возможность предотвратить появление церебрального паралича: тестирование и контроль за здоровьем матери во время беременности. Прежде всего — определение RH — фактора. Если резус отрицательный, необходимо провести иммунизацию в течение 72 часов после рождения (или по окончании беременности), что позволит предотвратить неблагоприятные последствия несовместимости крови в последующей беременности. Если женщина не была иммунизирована, то последствия несовместимости крови у новорожденного можно предотвратить обменным переливанием крови у ребенка.
Если у новорожденного выявлена желтуха, то его подвергают светотерапии в отделении для вскармливания грудных детей. Существуют и другие методы профилактики преждевременных родов. Эти мероприятия снижают степень вероятности возникновения вирусных заболеваний и других вирусных инфекций у беременных. На появление на свет больных детей большое влияние оказывает повышенная радиация, употребление беременными женщинами наркотиков и других медикаментов.
Для предупреждения возможного рождения больного ребенка необходим контроль за больными сахарным диабетом, анемией (малокровием), нужен контроль за рациональным питанием беременных женщин. Огромное значение должно уделяться созданию благоприятных условий для рождения здорового ребенка. Необходима помощь высококвалифицированных специалистов в предродовый период, а также следует оберегать новорожденных отнесчастных случаев и травм.
Излечим ли церебральный паралич?
В данном случае лучше говорить о “заботе” или “бережном отношении” к инвалиду, “умении оказывать помощь”, чем о “лечении”; это значит — создать условия для максимальной реализации ребенком своих потенциальных возможностей по мере его роста и развития. И нужно начинать как можно раньше — с ранней диагностики младенца с признаками задержки (или расстройства) развития, т.к. выявление заболевание на ранних периодах жизни позволяет улучшить здоровье ребенка. Восстановительные программы должны начинаться как можно раньше.
Такие программы включает в себя различные занятия ребенка^
- его обучение;
- занятия по развитию речи и слуха;
- проведение занятий, направленных на социальную адаптацию ребенка;
- занятий по развитию эмоциональной сферы.
Программы такого «менеджмента» должны включать в себя контроль за движениями ребенка, его обучением, речью, слухом, социальным и эмоциональным развитием. В соответствии с различными программами физиотерапевты, терапевты, учителя, медсестры, социальные работники и другие профессионалы помогают как семье, так и ребенку. (С использованием соответствующих медикаментов, оперативного вмешательства, ортопедических аппаратов и т.д., способствующих улучшению нервно-мышечной координации и устранению, либо предотвращению дисфункции).
Когда инвалиды становятся взрослыми, они нуждаются в поддержке таких служб, как:
- служба персональной помощи,
- длительная терапия,
- профессиональное и специальное обучение,
- службы независимой жизни,
- консультирование,
- транспортировка,
- реализация программ организации досуга и отдыха,
- службы трудоустройства — все, что необходимо для развития.
Люди с ДЦП могут ходить в школу, иметь работу, жениться, поддерживать семью и жить в собственном доме . Большинству людей с церебральным параличом помощь необходима для того, чтобы, прежде всего, обрести самостоятельность и возможность принимать активное участие в жизни общества.
Сколько больных ДЦП?
Немного статистики:
ДЦП является самой распространенной причиной детской инвалидности, среди которых на первом месте — заболевания нервной системы. Церебральный паралич является вторым из наиболее распространенных неврологических нарушений в детстве; первым является задержка психического развития у детей. На третьем месте — врожденные аномалии.
Последние публикации в международном научно-исследовательском журнале:
Эволюционная медицина и детская неврология и Научно-исследовательского Фонда Ассоциаций больных церебральным параличом (UCPA, США) дают представление о статистике рождения детей, страдающих ДЦП.
Среди детей с нормальным весом при рождении, ставшими инвалидами в связи с ДЦП:
- примерно 70% стали инвалидами вследствие факторов, имевших место до рождения (пренатальный период),
- около 20% — благодаря факторам, проявившимся либо во время родов (перинатальный период), либо сразу после рождения (первые четыре недели жизни),
- 10% — вследствие факторов, проявившихся в течение первых двух лет жизни (постнатальный период)
Среди детей с низким весом при рождении (или недоношенных), у которых ДЦП стал причиной инвалидности:
частота появления примерно 0,7 на 1000 живых рожденных детей;
до сих пор нет определенности относительно того, когда происходило поражение мозга:
- происходили ли церебральные поражения в период эмбрионального развития?
- или вследствие применения неонатологических методик сохранения младенца?
- происходили ли церебральные поражения во время или после родов у младенцев с «ранимым» («легко травмируемым») мозгом?
По данным Научно-исследовательского Фонда Ассоциаций больных церебральным параличом (UCPA), в США насчитывается приблизительно 550 тысяч больных этим заболеванием и у 9750 детей и новорожденных ежегодно ставится этот диагноз. Из них 1,2-1,5 тысячи — дети дошкольного возраста.
Количество рождений больных с признаками ДЦП в США за десять лет возросло на 25%: от 1,5 — 1,8 . на 1000 младенцев родившихся живыми приходилось в 1990г. до 2,0 — 2,5 младенцев с этой патологией в 2000. На данный момент в США насчитывается от 550 до 760 тысяч инвалидов с ДЦП, что составляет 2,8 человека на 1000 населения.
В Москве, по данным профессора Е.Г. Сологубова, отмечается рост заболеваемости ДЦП:
за 20 лет (c 1967 по 1987гг.) количество рождений на 1000 детей возрасла с 1,71 до 1,88
в 1992 году в России было 62 тысячи, а по территории бывшего СССР — 122 тысячи пациентов с ДЦП (учитывались больные до 15 лет).
частотность появления в 2001 году составила (по разным данным) 5,0-6,0 на 1000 новорожденных
Нужно отметить, что статистические данные по численности больных с церебральным параличом в СССР были недоступны, и даже немногочисленные статистические данные имели тенденцию к занижению.
В Москве примерно 10 тыс. инвалидов с последствиями ДЦП, половину из них составляют дети. В Московской области — около 5 тыс.человек. Исходя из частотности рождения детей с признаками ДЦП (5,0-6,0 на 1000), можно предположить, что в России не менее 1,5 миллионов таких инвалидов. Точных данных о количестве инвалидов с последствиями ДЦП в России нет.
Что касается степени поражения, то одним из самых распространенных поражений, которое сейчас связывают с новыми взглядами на ДЦП, является спастичность одной или более конечностей.
Оказывается, что мышечная спастичность конечностей при рождении младенца с нормальным весом вызывается поражениями, доминирующими в пренатальном периоде; а при рождении недоношенных детей и детей с низким весом, спастичность конечностей вызвана поражениями, которые доминируют в перинатальном (начиная с 28-й недели внутриутробной жизни плода по 7-е сутки жизни новорожденного) и неонатальном периодах новорожденности.
Комментарии
Это исследование подтверждается аналогичными данными в США, Германии, России. Ясно, что особое внимание требуется обратить на то, когда происходит поражение мозга, каковы факторы риска, подвергающие здоровье младенца опасности и каковы наиболее распространенные последствия ДЦП. Поскольку из-за увеличения количества выживающих недоношенных младенцев растет и вероятность церебральных нарушений, то приоритетным направлением в исследованиях становится изучение причин низкого веса при рождении и преждевременных родов.
ДЦП — как с ним бороться?
Это заболевание может возникать по разным причинам, из которых основная — это болезни матери, например, сахарный диабет, пороки сердца, эндокринной системы — гипертиреозы, гиперандрогения. Всю беременность, которая часто бывает патологической или недоношенной, такие женщины «сидят» на гормонах.
Кстати, недоношенность — тоже фактор риска. Очень часто встречается ДЦП у детей из двоен, причем один малыш рождается здоровым, а у другого со временем развивается ДЦП. Причиной развития этого заболевания могут быть и аборты у мамы, которые приводят к низкой плацентации (креплению плаценты) и, как следствие, хронической внутриутробной гипоксии плода. Иногда определенную роль играет слишком юный или, наоборот, слишком зрелый возраст беременной.
ДЦП может развиваться, если мама во время беременности была инфицирована токсоплазмозом, энтеровирусной инфекцией, гепатитом, герпесом, цитомегаловирусом, хламидиозом и т.п.
Как известно, у развития ребенка есть свои нормы:
- в 3 месяца малыш должен уметь держать голову,
- в 4—5 месяцев — переворачиваться со спины на живот и обратно,
- в 6 месяцев — садиться,
- в 8—9 месяцев (но не позднее года и трех месяцев) — ходить у опоры,
- в год — говорить 8—10 слов («мама», «папа»),
- в полтора года — говорить 20—30 слов,
- в два года должна появляться фразовая речь («Мама дай»).
- Маме стоит поволноваться, если ребенок «не дотягивает» до нормы. Любая задержка моторного развития — тоже фактор риска развития заболевания.
Не всегда диагноз «ДЦП» ставится сразу после рождения. Заболевание может протекать под разными «масками» — синдромов мышечного гипертонуса, дистонии, гипотонии, повышенной нервно-рефлекторной возбудимости. Детям с такими заболеваниями нужно регулярно проходить медосмотры, причем как у ортопеда, так и у логопеда. ДЦП необходимо лечить в момент формирования патологии. И, главное, его не пропустить.
Основные методы лечения ДЦП — лечебная физкультура, медикаменты и массаж. Желательно, чтобы массаж делал специалист. Самим родителям его делать не следует. Схема процедуры подбирается индивидуально. При этом стараются восстановить баланс между мышцами — сгибателями и разгибателями, несогласованность в работе которых приводит к задержке развития, неправильным позам.
Начинать массаж желательно не раньше, чем в 1,5 месяца, так как в более раннем возрасте причина патологии не совсем ясна.
Существует много видов массажа: классический, сегментарный, точечный, по Манакову, криомассаж.
В комплекс лечения входят также пробежки по беговой дорожке, перед которой висит зеркало, что позволяет ребенку видеть себя и корректировать свои движения. Малыши катаются на специальном велосипеде, с фиксацией рук, ног и спины. Для тех, кто плохо передвигается, существуют специальные ходилки. А развивать вестибулярный аппарат помогают батуты.
Такие дети с удовольствием плескаются в бассейне. Эта процедура называется бальнеотерапией. В воде у них изменяется масса тела, и они не боятся сделать шаг. Парадоксально, но некоторые малыши сначала учатся плавать, а потом уже ходить. Те, кто еще не умеет ходить, попадают в бассейн с помощью подъемника. Купание дополняется очень эффективным и приятным гидромассажем.
Многим малышам, страдающим ДЦП, назначают грязелечение. Грязь оказывает общерефлекторное химическое воздействие, стимулирует нервные окончания. Теплая грязь — хорошее средство при гипертонусе. Снять спастику (напряжение) мышц при ДЦП помогают электрофорезы, а для улучшения сосудистой регуляции используется магнитотерапия. Неотъемлемая часть лечения — физиотерапия и парафинотерапия.
А теперь — очень важная деталь, о которой обязательно должны знать родители. Ребенка с ДЦП нужно показать логопеду. Задержка двигательного развития часто сопровождается замедлением развития психического и речевого. При гипертонусе даже язык малыша бывает в тонусе. Это мешает ребенку разговаривать, поэтому может потребоваться логопедический массаж и курс медикаментозной терапии.
Курс лечения проводится раз в полгода и длится в среднем 35—40 занятий.
Поскольку ДЦП — неврологическая патология, он лечится также с помощью ноотропных препаратов, стимулирующих психическую активность, которые назначаются лечащим врачом.
Один из синдромов ДЦП — повышенное внутричерепное давление, уменьшить которое помогает массаж, магнитотерапия и электрофорез. Для улучшения кровотока врачом назначаются специальные сосудистые препараты.
Если ДЦП вовремя не лечить, помимо мышечной, может появиться и ортопедическая деформация — кифозы и кифосколиозы позвоночника, дисплазия тазобедренного сустава, плоскостопие. При лечении таких заболеваний приходится накладывать ортопедические шины и распорки, надевать ортопедические лангеты и тутора, обязательно ношение ортопедической обуви. Для распрямления позвоночника применяется реклинатор. При дисплазии часто возникают вывихи и подвывихи, что требует оперативного вмешательства. Операция необходима и при стойких ортопедических деформациях.
Логопеды-дефектологи в Алматы
Как мы можем помочь? В нашем Логоцентре Алматы наши специалисты дефектолог,и проводят занятия на регулярной основе с детьми с особыми потребностями.
Обращайтесь, будем рады вам помочь!
psilogos.kz
Ответы@Mail.Ru: Что такое дцп?
Детские церебральные параличи — термин, объединяющий группу хронических непрогрессирующих симптомокомплексов двигательных нарушений, вторичных по отношению к поражениям или аномалиям головного мозга, возникающим в перинатальном (околородовом) периоде. Отмечается ложное прогрессирование по мере роста ребёнка. Примерно у 30-50 % людей с ДЦП наблюдается нарушение интеллекта. Затруднения в мышлении и умственной деятельности более распространены среди пациентов со спастической квадриплегией чем среди страдающих от других видов церебрального паралича. Повреждение мозга может повлиять также на освоение родного языка и речи. ДЦП не является наследственным заболеванием. Но при этом показано, что некоторые генетические факторы участвуют в развитии заболевания (примерно в 14 % случаев). Кроме того определённую сложность представляет существование множества ДЦП-подобных заболеваний.
Причина любых церебральных параличей — патология в коре, подкорковых областях, в капсулах или стволе головного мозга. Заболеваемость оценивается в размере 2 случаев на 1000 новорожденных. Принципиальное отличие ДЦП от других параличей — во времени возникновения и связанном с этим нарушении редукции позотонических рефлексов, характерных для новорождённых.
Подробнее тут <a rel=»nofollow» href=»https://ru.wikipedia.org/wiki/Детский_церебральный_паралич» target=»_blank»>https://ru.wikipedia.org/wiki/Детский_церебральный_паралич</a>
Детский церебральный паралич.
Детский церебральный паралич (ДЦП) — на сегодняшний день одно из часто встречающихся заболеваний детей. В России только по официальной статистике более 120 000 человек имеют диагноз детский церебральный паралич.
Откуда этот диагноз? Наследственный или приобретенный? Приговор на всю жизнь или все можно исправить? Почему детский? Ведь страдают им не только дети? И вообще, что такое ДЦП?
ДЦП — это заболевание центральной нервной системы, при котором происходит поражение одного (или нескольких) отделов головного мозга, в результате чего развиваются не прогрессирующие нарушения двигательной и мышечной активности, координации движений, функций зрения, слуха, а также речи и психики.
Причина церебрального паралича — поражение головного мозга ребенка. Слово «церебральный» (от латинского слова «cerebrum» — «мозг») означает «мозговой», а слово «паралич» (от греческого «paralysis» — «расслабление») определяет недостаточную (низкую) физическую активность.
Чёткого и полного комплекса данных о причинах этого заболевания нет. Церебральным параличом нельзя заразиться и заболеть. Врачи сходятся на том, что основные возможные причины развития церебрального паралича следующие:
острая гипоксия — недостаточность поступления кислорода в головной мозг ребенка, что ведет к гибели клеток головного мозга, кровоизлияниям;
родовая травма;
инфекции;
травмы в период первого года жизни.
Основные факторы риска возникновения ДЦП:
недоношенные дети, низкий вес при рождении;
преждевременная отслойка плаценты;
роды крупного плода;
неправильное предлежание плода;
анатомически и клинически узкий таз;
стремительные роды;
родовозбуждение и родостимуляция;
резус-фактор или групповая несовместимость плода и матери.
Итак, основные причины ДЦП связаны с процессами развития беременности и родовым актом, а эти состояния не передаются по наследству, поэтому такой паралич часто называют врожденным ДЦП. Менее распространенный тип — приобретенный ДЦП (черепно-мозговые травмы в результате несчастных случаев или инфекции мозга). В результате, получив такое состояние сразу после рождения, человек вынужден жить и бороться с ним подчас всю свою жизнь.
Форму ДЦП и степень тяжести заболевания устанавливает врач — невропатолог. При легкой степени ребенок обучаем, способен самостоятельно передвигаться, владеет навыками самообслуживания. Средняя степень требует дополнительной помощи со стороны взрослых. Дети с тяжелым течением ДЦП полностью зависят от окружающих, интеллектуальное развитие колеблется между умеренной и тяжелой степенью умственной отсталости.
В связи с тем, что церебральный паралич — нарушение или порок развития мозга, другие симптомы, которые связаны с мозговой дисфункцией, могут появиться у детей с церебральным параличом. Например, сниженная способность к обучению, косоглазие, нарушения слуха, плохая речь, нарушение глотания, слюнотечение и нарушение моторной координации. Примерно, у трети всех пациентов с церебральным параличом бывают припадки. Дети с церебральным параличом часто с трудом набирают вес и растут. Зачастую появляется целый комплекс других проблемных состояний, не связанных непосредственно с мозгом, но очень осложняющих жизнь человеку: проблемы с дыханием, остеопорозом и другие.
Конечно, в одиночку семье будет очень трудно справиться с выпавшим на ее долю испытанием, и успех реабилитации во многом зависит от слаженности и согласованности работы разных специалистов. Однако они занимают позицию консультантов и помощников, а ведущая роль этом трудоемком и продолжительном процессе все же отводится самым близким и родным для малыша людям. Победить последствия ДЦП можно, и чем раньше начато лечение, тем больше шансов достичь успеха. Нужно помнить, что при должной реабилитации ребенок может забыть об инвалидности, стать самостоятельным человеком и полноценным членом о
может полезную информацию о ДЦП найдете здесь <a rel=»nofollow» href=»http://www.izmedic.ru/pediatriya/lechenie-dczp-v-izraile.html» target=»_blank»>http://www.izmedic.ru/pediatriya/lechenie-dczp-v-izraile.html</a>
Детский церебральный паралич.
Ребят Эту болезнь вылечет легко берёте писюн и начинаете дрюнькать
touch.otvet.mail.ru
Детский церебральный паралич. Типы ДЦП
Известно несколько типов детского церебрального паралича (ДЦП), характеризующихся различной степенью нарушения функции конечностей. Рассмотрим три основных типа церебрального паралича и роль физиотерапии при ДЦП.
ДЦП — это нарушение движений и положения тела, обусловленное поражением мозга. Состояние не прогрессирует, хотя симптомы становятся более выраженными по мере развития ребенка.
Типы ДЦП
- Спастический церебральный паралич,
- атаксический церебральный паралич, ацетоидный (дискинетический),
- церебральный паралич.
Спастический церебральный паралич – на него приходится около 70% всех случаев заболевания. Заболевание нельзя назвать редким.
Наиболее часто встречающиеся формы спастического церебрального паралича.
Дети с врожденным этой формой церебрального паралича могут страдать гипотонией и кажутся обмякшими. Мышцы конечностей (сгибатели суставов) становятся ригидными, часто сокращаются, вызывая затруднения в движениях и, в конечном итоге, теряют способность выпрямляться.
Спастический церебральный паралич подразделяется на три подтипа:
- темипарез,
- диплегия,
- тетраплегия.
Темипарез – поражение мышц одной половины тела (чаще всего затронута или нога или рука). Примерно месяцев с 4-х близкие замечают, что их ребенок пользуется одной рукой чаще, чем другой, потому что другая рука сжата в кулак, согнута в локте и ненормально вывернута.
Диплегия – поражение конечностей. При заболевании этим подтипом дети не способны ходить, а если ходят, то при помощи специальных устройств.
Тетраплегия – встречается у 1 из 10 больных спастическим церебральным параличом. Диагностируется чаще всего после перенесенной родовой травмы, асфиксии или осложненных родов. У больных этим подтипом паралича необычное строение лица, снижен мышечный тонус, в результате чего все четыре конечности сведены судорогой: руки ненормально согнуты, кисти сжаты в кулак, ноги скрещены.
Редкие формы церебрального паралича — атаксический гипотонический паралич и атетоидный/дискинетический паралич.
- Атаксический церебральный паралич – форма ДЦП, которой страдает 1 ребенок из 10. Дети с этой формой ДЦП сначала страдают гипотонией, а затем атаксией – общей неустойчивостью к ходьбе. Причина – структурная патология в той части головного мозга (мозжечке), которая отвечает за координацию движений.
- Ацетоидный (дискинетический) церебральный паралич – составляет 10% случаев заболевания ДЦП. Эта форма ДЦП характеризуется неустойчивостью мышечного тонуса, непроизвольными движениями (например, гримасничанье, неконтролируемые медленные извивающиеся движения), невнятной речью. Но при этом заболевании интеллектуальные способности ребенка не нарушены.
Роль физиотерапии
Задача физиотерапии — улучшить мышечный тонус и обучить ребенка правильным движениям. Физиотерапевты используют для предотвращения тяжелых деформаций суставов и контрактур три основных метода: техника Бобат (специальный комплекс упражнений), проприоцептивная техника (всевозможные виды стимуляции одних групп мышц и сокращения других), техника Пето (множественное выполнение отдельных элементов для воспроизведения всех действий целиком).
Очень эффективен метод иппотерапии (от греческого «hippos» – конь) – метод лечения, основанный на взаимодействии ребенка с лошадью. Иппотерапия уникальна тем, что нагрузка одних мышц и расслабление других идет одновременно.Противопоказаний для прохождения реабилитации методом иппотерапии практически нет.
it-apharm.ru
риски ДЦП при родах и при беременности
Детский церебральный паралич (ДЦП) – это тяжелейшее заболевание нервной системы, связанное с аномалиями или повреждением головного мозга и сопровождающееся стойкими, но не прогрессирующими двигательными, координационными и в некоторых клинических случаях интеллектуальными расстройствами. Выраженность патологических проявлений при ДЦП у разных больных отличается: одни детки становятся полностью неподвижными и беспомощными, другие вполне могут научиться передвигаться, самостоятельно себя обслуживать, учиться и даже работать.
Оглавление: 1. Причины ДЦП 2. Особенности течения беременности и ДЦП - Интранатальные причины развития ДЦП - Преждевременные роды и ДЦП - Что может спровоцировать ДЦП после родов? 3. Механизмы развития ДЦП 4. Формы ДЦП
Причины ДЦП
Причины ДЦП в зависимости от времени воздействия на ребенка делят на три группы:
- Внутриутробные факторы.
- Интранатальные факторы (различные проблемы в родах).
- Постнатальные факторы (патологические состояния, возникающие в период новорожденности – в первые недели жизни).
В большинстве случаев, изучая анамнез маленького пациента, врачи обнаруживают не одну, а несколько причин, которые могли вызвать ДЦП. Но встречаются также ситуации, когда выяснить, какие именно факторы спровоцировали ДЦП, так и не удается. Поэтому исследователи предполагают, что определенную роль в развитии рассматриваемого заболевания играет наследственная предрасположенность и мутация генов.
Особенности течения беременности и ДЦП
Головной мозг плода является наиболее уязвимым органом во всем маленьком тельце. Особенную опасность для нервных клеток представляет кислородное голодание (гипоксия), инфекции, токсические вещества, радиоактивное облучение.
Гипоксия плода может возникнуть в следующих ситуациях:
- При угрозе прерывания беременности, когда отслаивается плацента и возникает кровотечение.
- При тяжелом токсикозе и гестозе. Эти осложнения беременности появляются, потому что организм мамы не может свыкнуться с новым состояние, и в нем происходят различные патологические изменения, в том числе негативно влияющие на кровообращение между маткой и плацентой.
- При плацентарной недостаточности – дисфункции, которая приводит к нарушению газообмена между кровью мамы и плода.
- При заболеваниях мамы, сопровождающихся сужением сосудов и пониженной концентрацией кислорода в крови женщины. К таким недугам относят сахарный диабет, артериальную гипертензию, системные аутоиммунные патологии, анемию, пороки сердца, хронические болезни легких.
Серьезные повреждения и аномалии развития головного мозга могут возникнуть вследствие воздействия на плод инфекционных агентов. Наибольшую опасность в этом плане представляют:
Все эти инфекции могут навредить плоду, если организм женщины сталкивается с ними впервые именно во время беременности, то есть это должно быть первичное заражение или же серьезное обострение (например, генитального герпеса, цитомегаловирусной инфекции). Если же женщина когда-то давно болела, и у нее определяются антитела к этим возбудителям, риск возникновения пороков ЦНС у плода минимален.
Причиной развития ДЦП, как уже говорилось выше, может также стать влияние на плод токсических веществ. К ним относят лекарства, обладающие тератогенным действием (способностью вызывать пороки развития у ребенка), наркотики, алкоголь.
Интранатальные причины развития ДЦП
В родах у ребенка может развиться острая гипоксия, повреждающая головной мозг. Приводит к этому:
- Преждевременная отслойка плаценты. Плацента теряет связь с маточным кровообращением, поэтому кровь, поступающая к ребенку, перестает насыщаться кислородом.
- Тяжелые затяжные роды.
- Тугое обвитие пуповиной или выпадение петлей пуповины, при котором нарушается кровообращение между плодом и плацентой.
- Тазовое предлежание плода. Когда головка выходит из родовых путей последней, она пережимает пуповину, поэтому если врачи замешкаются и не помогут ребенку родиться как можно быстрее, может развиться тяжелая гипоксия.

Фактором риска в плане развития ДЦП является также наложение акушерских щипцов (именно по причине возможности повреждения головного мозга этот метод родовспоможения сейчас практически не применяется), а также выдавливание плода из живота мамы.
Преждевременные роды и ДЦП
Наиболее опасными для ребенка в плане развития ДЦП считаются преждевременные роды, поскольку недоношенные детки более всего подвержены таким поражениям головного мозга, как кровоизлияния и перивентрикулярная лейкомаляция. Причем чем меньше малыш, тем риск развития у него послеродовых осложнений (в частности ДЦП) больше. По этой причине во многих развитых странах, где научились успешно выхаживать деток с критически низкой массой тела, частота возникновения ДЦП у новорожденных находится на высоком уровне.
Что может спровоцировать ДЦП после родов?
В периоде новорожденности головной мозг малыша остается очень уязвимым. Вызвать необратимые изменения в ЦНС могут следующие причины:
Важно: прививки в эту группу причин медики не относят, поскольку нет подтвержденных данных о связи между вакцинацией и развитием ДЦП.
Механизмы развития ДЦП
Принципиальным отличием ДЦП от других параличей является время возникновения – это перинатальный период (период от 22 недели беременности до седьмого дня жизни ребенка). Патологические влияние на головной мозг, произошедшее в этом промежутке времени, приводят к нарушению угасания характерных для новорожденных позотонических рефлексов – изменений мышечного тонуса и позы при смене положения тела.
С точки зрения физиологии взаимодействие ЦНС и мышц выглядит следующим образом: в ответ на какие-либо раздражения и изменение положения тела головной мозг потенцирует и направляет по нервным волокнам к мышцам сигналы, вызывающие сокращение либо расслабление мышечных волокон. При этом все проходит слаженно – одна группа мышц сокращается, а другая (антагонисты) расслабляется или наоборот. Только благодаря такому четкому взаимодействию человек нормально двигается. При ДЦП связи между ЦНС и мышцами нарушаются, поэтому больные не могут полноценно управлять свои телом.
Помимо двигательной активности и координации при ДЦП страдает речь ребенка. Если поражаются ядра черепно-мозговых нервов, у больных возникают проблемы с глотанием, зрением, мимикой. В самых тяжелых случаях повреждения головного мозга, вызывающие развитие ДЦП, становятся еще и причиной нарушений интеллекта.
Формы ДЦП
Рекомендуем прочитать:- Признаки, диагностика и лечение ДЦП - Реабилитация детей с ДЦП
Выделяют пять форм детского церебрального паралича:
- Болезнь Литтла (спастическая тетраплегия). Это самая часто встречающаяся форма заболевания, особенно среди недоношенных деток. При ней неподвижными становятся нижние конечности ребенка, а вот руки поражаются редко. Нарушение движений в ногах обуславливается спастикой (стойким сокращением мышц), из-за которой конечности не сгибаются и не разгибаются вообще. С ростом ребенка возникают деформации суставов и позвоночника, но это не означает, что патология прогрессирует.
- Гемиплегическая форма. Для нее характерна неподвижность одной половины тела и спастика, как и при первой форме ДЦП.
- Атактическая форма. Ее развитие связано с поражением лобных долей головного мозга и мозжечка. У таких больных отмечают дискоординацию движений разных групп мышц, нарушение координации, тремор, расстройства речи и интеллекта.
- Дискинетическая форма. Чаще всего возникает вследствие тяжелой гемолитической болезни новорожденных. Основные признаки – непроизвольные движения, резкое изменение тонуса мышц и положения тела, нарушение мимики. Интеллект у таких больных, как правило, не страдает.
- Спастическая тетраплегия – самая тяжелая форма заболевания, при которой практически полный паралич конечностей сопровождается постоянными судорожными приступами, нарушением интеллекта и речи. У некоторых больных диагностируют микроцефалию.
Отдельно выделяют смешанную форму ДЦП, при которой у больных обнаруживаются признаки сразу нескольких форм заболевания. Задача врачей в таких случаях – выявить ведущий синдром и направить все усилия на его коррекцию.
Зубкова Ольга Сергеевна, медицинский обозреватель, врач-эпидемиолог
8,826 просмотров всего, 8 просмотров сегодня
Загрузка…
okeydoc.ru
ДЦП
- ДЦП
-
ДЦП
детский церебральный паралич
Словарь: С. Фадеев. Словарь сокращений современного русского языка. — С.-Пб.: Политехника, 1997. — 527 с.
ДЦП
дискретно-цифровой преобразователь
Словарь: С. Фадеев. Словарь сокращений современного русского языка. — С.-Пб.: Политехника, 1997. — 527 с.
ДЦП
долгосрочная целевая программа
Источник: http://news.specialsoft.ru/read.php?id=268316
Словарь сокращений и аббревиатур.
.
2015.
Смотреть что такое «ДЦП» в других словарях:
-
ДЦП — Детский паралич группа детских заболеваний, обусловленных поражением нервной системы и сопровождающихся отсутствием или ограничением произвольных движений. К детскому параличу относят вялый паралич, возникающий после острого инфекционного… … Википедия
-
ДЦП — см. Детский церебральный паралич … Педагогический терминологический словарь
-
ДЦП — детский церебральный паралич дискретно цифровой преобразователь … Словарь сокращений русского языка
-
ДЦП — см. детский церебральный паралич … Дефектология. Словарь-справочник
-
ДЕТСКИЙ ЦЕРЕБРАЛЬНЫЙ ПАРАЛИЧ (ДЦП) — (англ. child cerebral palsy) полиэтиологическое заболевание, чаще всего начинающееся внутриутробно и продолжающее развиваться в первые годы жизни. Термин «ДЦП» был предложен З. Фрейдом (1893) для объединения всех форм спастических параличей… … Большая психологическая энциклопедия
-
Жизнь с ДЦП. Проблемы и решения — Специализация: медицина,реабилитация,абилитация Периодичность: раз в квартал Язык: русский Издатель: Издательский дом «Кодекс» Страна … Википедия
-
Детский церебральный паралич (ДЦП) — Под словосочетанием «детский церебральный паралич» (ДЦП) понимают группу нарушений двигательных функций мозга, появившихся в следствии его повреждения в младенческом возрасте. Эти расстройства не прогрессирующие, т.е. обнаруживаются с самого… … Справочник по болезням
-
Стимулирующая АФК при ДЦП — Для улучшения этой статьи желательно?: Дополнить статью (статья слишком короткая либо содержит лишь словарное определение). Проставить интервики в рамках проекта Интервики. Основная статья: Адаптивная физическая культура Стимулирующая… … Википедия
-
Детский церебральный паралич (ДЦП) — полиэтиологическое неврологическое заболевание, возникающее вследствие раннего органического поражения центральной нервной системы. Распространённость ДЦП в разных регионах страны составляет 1,7 2,9 чел. на 1000 детей. При ДЦП нарушения… … Педагогический терминологический словарь
-
ДЕТСКИЙ ЦЕРЕБРАЛЬНЫЙ ПАРАЛИЧ (ДЦП) — объединенное название различных клинических синдромов, которые возникают в результате аномалий развития и разных патологических процессов, развивающихся в мозге перинатально или в раннем детском возрасте. ДЦП разделяется на группы с… … Психомоторика: cловарь-справочник
| Cerebral palsy | |
|---|---|
 |
|
| A child with cerebral palsy being assessed by a physician | |
| Specialty |
|
| Symptoms |
|
| Complications |
|
| Usual onset | Prenatal to early childhood[1] |
| Duration | Lifelong[1] |
| Causes | Often unknown[1] or brain injury |
| Risk factors |
|
| Diagnostic method | Based on child’s development[1] |
| Treatment |
|
| Medication |
|
| Frequency | 2.1 per 1,000[2] |
Cerebral palsy (CP) is a group of movement disorders that appear in early childhood.[1] Signs and symptoms vary among people and over time,[1][3] but include poor coordination, stiff muscles, weak muscles, and tremors.[1] There may be problems with sensation, vision, hearing, and speaking.[1] Often, babies with cerebral palsy do not roll over, sit, crawl or walk as early as other children of their age.[1] Other symptoms include seizures and problems with thinking or reasoning, each of which occur in about one-third of people with CP.[1] While symptoms may get more noticeable over the first few years of life, underlying problems do not worsen over time.[1]
Cerebral palsy is caused by abnormal development or damage to the parts of the brain that control movement, balance, and posture.[1][4] Most often, the problems occur during pregnancy, but they may also occur during childbirth or shortly after birth.[1] Often, the cause is unknown.[1] Risk factors include preterm birth, being a twin, certain infections during pregnancy, such as toxoplasmosis or rubella, exposure to methylmercury during pregnancy, a difficult delivery, and head trauma during the first few years of life, among others.[1] About 2% of cases are believed to be due to an inherited genetic cause.[5] A number of sub-types are classified, based on the specific problems present.[1] For example, those with stiff muscles have spastic cerebral palsy, those with poor coordination in locomotion have ataxic cerebral palsy, and those with writhing movements have dyskinetic cerebral palsy.[6] Diagnosis is based on the child’s development over time.[1] Blood tests and medical imaging may be used to rule out other possible causes.[1]
Some of the causes of CP are preventable through immunization of the mother, and through efforts to prevent head injuries in children such as through improved safety.[1] There is no known cure for CP, but supportive treatments, medication and surgery may help many individuals.[1] This may include physical therapy, occupational therapy and speech therapy.[1] Medications such as diazepam, baclofen and botulinum toxin may help relax stiff muscles.[1][7][8] Surgery may include lengthening muscles and cutting overly active nerves.[1] Often, external braces and Lycra splints and other assistive technology are helpful with mobility.[9][1] Some affected children can achieve near normal adult lives with appropriate treatment.[1] While alternative medicines are frequently used, there is no evidence to support their use.[1]
Cerebral palsy is the most common movement disorder in children.[10] It occurs in about 2.1 per 1,000 live births.[2] Cerebral palsy has been documented throughout history, with the first known descriptions occurring in the work of Hippocrates in the 5th century BCE.[11] Extensive study of the condition began in the 19th century by William John Little, after whom spastic diplegia was called «Little’s disease».[11] William Osler first named it «cerebral palsy» from the German zerebrale Kinderlähmung (cerebral child-paralysis).[12] A number of potential treatments are being examined, including stem cell therapy.[1] However, more research is required to determine if it is effective and safe.[1]
Signs and symptoms[edit]
Cerebral palsy is defined as «a group of permanent disorders of the development of movement and posture, causing activity limitation, that are attributed to non-progressive disturbances that occurred in the developing fetal or infant brain.»[13] While movement problems are the central feature of CP, difficulties with thinking, learning, feeling, communication and behavior often co-occur,[13] with 28% having epilepsy, 58% having difficulties with communication, at least 42% having problems with their vision, and 23–56% having learning disabilities.[14] Muscle contractions in people with cerebral palsy are commonly thought to arise from overactivation.[15]
Cerebral palsy is characterized by abnormal muscle tone, reflexes, or motor development and coordination. The neurological lesion is primary and permanent while orthopedic manifestations are secondary and progressive. In cerebral palsy unequal growth between muscle-tendon units and bone eventually leads to bone and joint deformities. At first, deformities are dynamic. Over time, deformities tend to become static, and joint contractures develop. Deformities in general and static deformities in specific (joint contractures) cause increasing gait difficulties in the form of tip-toeing gait, due to tightness of the Achilles tendon, and scissoring gait, due to tightness of the hip adductors. These gait patterns are among the most common gait abnormalities in children with cerebral palsy. However, orthopaedic manifestations of cerebral palsy are diverse.[16][17] Additionally, crouch gait (also described as knee flexion gait)[18] is prevalent among children who possess the ability to walk.[19] The effects of cerebral palsy fall on a continuum of motor dysfunction, which may range from slight clumsiness at the mild end of the spectrum to impairments so severe that they render coordinated movement virtually impossible at the other end of the spectrum.[20] Although most people with CP have problems with increased muscle tone, some have normal or low muscle tone. High muscle tone can either be due to spasticity or dystonia.[21]
Babies born with severe cerebral palsy often have irregular posture; their bodies may be either very floppy or very stiff. Birth defects, such as spinal curvature, a small jawbone, or a small head sometimes occur along with CP. Symptoms may appear or change as a child gets older. Babies born with cerebral palsy do not immediately present with symptoms.[22] Classically, CP becomes evident when the baby reaches the developmental stage at 6 to 9 months and is starting to mobilise, where preferential use of limbs, asymmetry, or gross motor developmental delay is seen.[17]
Drooling is common among children with cerebral palsy, which can have a variety of impacts including social rejection, impaired speaking, damage to clothing and books, and mouth infections.[23] It can additionally cause choking.[24]
An average of 55.5% of people with cerebral palsy experience lower urinary tract symptoms, more commonly excessive storage issues than voiding issues. Those with voiding issues and pelvic floor overactivity can deteriorate as adults and experience upper urinary tract dysfunction.[25]
Children with CP may also have sensory processing issues.[26] Adults with cerebral palsy have a higher risk of respiratory failure.[27]
Skeleton[edit]
For bones to attain their normal shape and size, they require the stresses from normal musculature.[28] People with cerebral palsy are at risk of low bone mineral density.[29] The shafts of the bones are often thin (gracile),[28] and become thinner during growth. When compared to these thin shafts (diaphyses), the centres (metaphyses) often appear quite enlarged (ballooning).[citation needed] Due to more than normal joint compression caused by muscular imbalances, articular cartilage may atrophy,[30]: 46 leading to narrowed joint spaces. Depending on the degree of spasticity, a person with CP may exhibit a variety of angular joint deformities. Because vertebral bodies need vertical gravitational loading forces to develop properly, spasticity and an abnormal gait can hinder proper or full bone and skeletal development. People with CP tend to be shorter in height than the average person because their bones are not allowed to grow to their full potential. Sometimes bones grow to different lengths, so the person may have one leg longer than the other.[31]
Children with CP are prone to low trauma fractures, particularly children with higher Gross Motor Function Classification System (GMFCS) levels who cannot walk. This further affects a child’s mobility, strength, and experience of pain, and can lead to missed schooling or child abuse suspicions.[28] These children generally have fractures in the legs, whereas non-affected children mostly fracture their arms in the context of sporting activities.[32]
Hip dislocation and ankle equinus or plantar flexion deformity are the two most common deformities among children with cerebral palsy. Additionally, flexion deformity of the hip and knee can occur. Torsional deformities of long bones such as the femur and tibia are also encountered, among others.[16][33] Children may develop scoliosis before the age of 10 – estimated prevalence of scoliosis in children with CP is between 21% and 64%.[34] Higher levels of impairment on the GMFCS are associated with scoliosis and hip dislocation.[16][35] Scoliosis can be corrected with surgery, but CP makes surgical complications more likely, even with improved techniques.[34] Hip migration can be managed by soft tissue procedures such as adductor musculature release. Advanced degrees of hip migration or dislocation can be managed by more extensive procedures such as femoral and pelvic corrective osteotomies. Both soft tissue and bony procedures aim at prevention of hip dislocation in the early phases or aim at hip containment and restoration of anatomy in the late phases of disease.[16] Equinus deformity is managed by conservative methods especially when dynamic. If fixed/static deformity ensues surgery may become mandatory.[33]
Growth spurts during puberty can make walking more difficult for people with CP.[36]
Eating[edit]
Due to sensory and motor impairments, those with CP may have difficulty preparing food, holding utensils, or chewing and swallowing. An infant with CP may not be able to suck, swallow or chew.[37] Gastro-oesophageal reflux is common in children with CP.[24] Children with CP may have too little or too much sensitivity around and in the mouth.[37] Poor balance when sitting, lack of control of the head, mouth, and trunk, not being able to bend the hips enough to allow the arms to stretch forward to reach and grasp food or utensils, and lack of hand-eye coordination can make self-feeding difficult.[38] Feeding difficulties are related to higher GMFCS levels.[24] Dental problems can also contribute to difficulties with eating.[38] Pneumonia is also common where eating difficulties exist, caused by undetected aspiration of food or liquids.[24] Fine finger dexterity, like that needed for picking up a utensil, is more frequently impaired than gross manual dexterity, like that needed for spooning food onto a plate.[39][non-primary source needed] Grip strength impairments are less common.[39][non-primary source needed]
Children with severe cerebral palsy, particularly with oropharyngeal issues, are at risk of undernutrition.[40] Triceps skin fold tests have been found to be a very reliable indicator of malnutrition in children with cerebral palsy.[38]
Language[edit]
Speech and language disorders are common in people with cerebral palsy. The incidence of dysarthria is estimated to range from 31% to 88%,[41] and around a quarter of people with CP are non-verbal.[42] Speech problems are associated with poor respiratory control, laryngeal and velopharyngeal dysfunction, and oral articulation disorders that are due to restricted movement in the oral-facial muscles. There are three major types of dysarthria in cerebral palsy: spastic, dyskinetic (athetotic), and ataxic.[43]
Early use of augmentative and alternative communication systems may assist the child in developing spoken language skills.[42] Overall language delay is associated with problems of cognition, deafness, and learned helplessness.[44] Children with cerebral palsy are at risk of learned helplessness and becoming passive communicators, initiating little communication.[44][45] Early intervention with this clientele, and their parents, often targets situations in which children communicate with others so that they learn that they can control people and objects in their environment through this communication, including making choices, decisions, and mistakes.[44]
Pain and sleep[edit]
Pain is common and may result from the inherent deficits associated with the condition, along with the numerous procedures children typically face.[46] When children with cerebral palsy are in pain, they experience worse muscle spasms.[47] Pain is associated with tight or shortened muscles, abnormal posture, stiff joints, unsuitable orthosis, etc. Hip migration or dislocation is a recognizable source of pain in CP children and especially in the adolescent population. Nevertheless, the adequate scoring and scaling of pain in CP children remains challenging.[16] Pain in CP has a number of different causes, and different pains respond to different treatments.[48]
There is also a high likelihood of chronic sleep disorders secondary to both physical and environmental factors.[49] Children with cerebral palsy have significantly higher rates of sleep disturbance than typically developing children.[50] Babies with cerebral palsy who have stiffness issues might cry more and be harder to put to sleep than non-disabled babies, or «floppy» babies might be lethargic.[51] Chronic pain is under-recognized in children with cerebral palsy,[52] even though three out of four children with cerebral palsy experience pain.[53] Adults with CP also experience more pain than the general population.[54]
Associated disorders[edit]
Associated disorders include intellectual disabilities, seizures, muscle contractures, abnormal gait, osteoporosis, communication disorders, malnutrition, sleep disorders, and mental health disorders, such as depression and anxiety.[55] In addition to these, functional gastrointestinal abnormalities contributing to bowel obstruction, vomiting, and constipation may also arise. Adults with cerebral palsy may have ischemic heart disease, cerebrovascular disease, cancer, and trauma more often.[56] Obesity in people with cerebral palsy or a more severe Gross Motor Function Classification System assessment in particular are considered risk factors for multimorbidity.[57] Other medical issues can be mistaken for being symptoms of cerebral palsy, and so may not be treated correctly.[58]
Related conditions can include apraxia, sensory impairments, urinary incontinence, fecal incontinence, or behavioural disorders.[citation needed]
Seizure management is more difficult in people with CP as seizures often last longer.[59] Epilepsy and asthma are common co-occurring diseases in adults with CP.[60] The associated disorders that co-occur with cerebral palsy may be more disabling than the motor function problems.[24]
Causes[edit]
Cerebral palsy is due to abnormal development or damage occurring to the developing brain.[61] This damage can occur during pregnancy, delivery, the first month of life, or less commonly in early childhood.[61] Structural problems in the brain are seen in 80% of cases, most commonly within the white matter.[61]
More than three-quarters of cases are believed to result from issues that occur during pregnancy.[61] Most children who are born with cerebral palsy have more than one risk factor associated with CP.[62]
While in certain cases there is no identifiable cause, typical causes include problems in intrauterine development (e.g. exposure to radiation, infection, fetal growth restriction), hypoxia of the brain (thrombotic events, placental insufficiency, umbilical cord prolapse), birth trauma during labor and delivery, and complications around birth or during childhood.[44][63][64]
In Africa birth asphyxia, high bilirubin levels, and infections in newborns of the central nervous system are main cause. Many cases of CP in Africa could be prevented with better resources available.[65]
Preterm birth[edit]
Between 40% and 50% of all children who develop cerebral palsy were born prematurely.[66] Most of these cases (75–90%) are believed to be due to issues that occur around the time of birth, often just after birth.[61] Multiple-birth infants are also more likely than single-birth infants to have CP.[67] They are also more likely to be born with a low birth weight.[citation needed]
In those who are born with a weight between 1 kg and 1.5 kg CP occurs in 6%.[2] Among those born before 28 weeks of gestation it occurs in 8%.[68][a] Genetic factors are believed to play an important role in prematurity and cerebral palsy generally.[69] In those who are born between 34 and 37 weeks the risk is 0.4% (three times normal).[70]
Term infants[edit]
In babies who are born at term risk factors include problems with the placenta, birth defects, low birth weight, breathing meconium into the lungs, a delivery requiring either the use of instruments or an emergency Caesarean section, birth asphyxia, seizures just after birth, respiratory distress syndrome, low blood sugar, and infections in the baby.[71]
As of 2013, it was unclear how much of a role birth asphyxia plays as a cause.[72] It is unclear if the size of the placenta plays a role.[73] As of 2015 it is evident that in advanced countries, most cases of cerebral palsy in term or near-term neonates have explanations other than asphyxia.[64]
Genetics[edit]
Autosomal recessive inheritance pattern
Cerebral palsy is not commonly considered a genetic disease. About 2% of all CP cases are expected to be inherited, with glutamate decarboxylase-1 being one of the possible enzymes involved.[5] Most inherited cases are autosomal recessive.[5] However, the vast majority of CP cases are connected to brain damage during birth and in infancy. There is a small percentage of CP cases caused by brain damage that stemmed from the prenatal period, which is estimated to be less than 5% of CP cases overall.[74] Moreover, there is no one reason why some CP cases come from prenatal brain damage, and it’s not known if those cases have a genetic basis.[74]
Cerebellar hypoplasia is sometimes genetic[75] and can cause ataxic cerebral palsy.[76]
Early childhood[edit]
After birth, other causes include toxins, severe jaundice,[77] lead poisoning, physical brain injury, stroke,[78] abusive head trauma, incidents involving hypoxia to the brain (such as near drowning), and encephalitis or meningitis.[77]
Others[edit]
Infections in the mother, even those not easily detected, can triple the risk of the child developing cerebral palsy.[79] Infection of the fetal membranes known as chorioamnionitis increases the risk.[80]
Intrauterine and neonatal insults (many of which are infectious) increase the risk.[81]
Rh blood type incompatibility can cause the mother’s immune system to attack the baby’s red blood cells.[1]
It has been hypothesised that some cases of cerebral palsy are caused by the death in very early pregnancy of an identical twin.[82]
Diagnosis[edit]
The diagnosis of cerebral palsy has historically rested on the person’s history and physical examination and is generally assessed at a young age. A general movements assessment, which involves measuring movements that occur spontaneously among those less than four months of age, appears most accurate.[83][84] Children who are more severely affected are more likely to be noticed and diagnosed earlier. Abnormal muscle tone, delayed motor development and persistence of primitive reflexes are the main early symptoms of CP.[38] Symptoms and diagnosis typically occur by the age of two,[85] although depending on factors like malformations and congenital issues,[86] persons with milder forms of cerebral palsy may be over the age of five, if not in adulthood, when finally diagnosed.[87] Cognitive assessments and medical observations are also useful to help confirm a diagnosis. Additionally, evaluations of the child’s mobility, speech and language, hearing, vision, gait, feeding and digestion are also useful to determine the extent of the disorder.[86] Early diagnosis and intervention are seen as being a key part of managing cerebral palsy.[88] Machine learning algorithms facilitate automatic early diagnosis, with methods such as deep neural network[89] and geometric feature fusion[90] producing high accuracy in predicting cerebral palsy from short videos. It is a developmental disability.[83]
Once a person is diagnosed with cerebral palsy, further diagnostic tests are optional. Neuroimaging with CT or MRI is warranted when the cause of a person’s cerebral palsy has not been established. An MRI is preferred over CT, due to diagnostic yield and safety. When abnormal, the neuroimaging study can suggest the timing of the initial damage. The CT or MRI is also capable of revealing treatable conditions, such as hydrocephalus, porencephaly, arteriovenous malformation, subdural hematomas and hygromas, and a vermian tumour[91] (which a few studies suggest are present 5–22% of the time). Furthermore, an abnormal neuroimaging study indicates a high likelihood of associated conditions, such as epilepsy and intellectual disability.[92] There is a small risk associated with sedating children to facilitate a clear MRI.[87]
The age when CP is diagnosed is important, but medical professionals disagree over the best age to make the diagnosis.[84] The earlier CP is diagnosed correctly, the better the opportunities are to provide the child with physical and educational help, but there might be a greater chance of confusing CP with another problem, especially if the child is 18 months of age or younger.[84] Infants may have temporary problems with muscle tone or control that can be confused with CP, which is permanent.[84] A metabolism disorder or tumors in the nervous system may appear to be CP; metabolic disorders, in particular, can produce brain problems that look like CP on an MRI.[1] Disorders that deteriorate the white matter in the brain and problems that cause spasms and weakness in the legs, may be mistaken for CP if they first appear early in life.[84] However, these disorders get worse over time, and CP does not[84] (although it may change in character).[1] In infancy it may not be possible to tell the difference between them.[84] In the UK, not being able to sit independently by the age of 8 months is regarded as a clinical sign for further monitoring.[87] Fragile X syndrome (a cause of autism and intellectual disability) and general intellectual disability must also be ruled out.[84] Cerebral palsy specialist John McLaughlin recommends waiting until the child is 36 months of age before making a diagnosis because, by that age, motor capacity is easier to assess.[84]
Classification[edit]
CP is classified by the types of motor impairment of the limbs or organs, and by restrictions to the activities an affected person may perform.[93] The Gross Motor Function Classification System-Expanded and Revised and the Manual Ability Classification System are used to describe mobility and manual dexterity in people with cerebral palsy, and recently the Communication Function Classification System, and the Eating and Drinking Ability Classification System have been proposed to describe those functions.[94] There are three main CP classifications by motor impairment: spastic, ataxic, and dyskinetic. Additionally, there is a mixed type that shows a combination of features of the other types. These classifications reflect the areas of the brain that are damaged.[95]
Cerebral palsy is also classified according to the topographic distribution of muscle spasticity.[96] This method classifies children as diplegic, (bilateral involvement with leg involvement greater than arm involvement), hemiplegic (unilateral involvement), or quadriplegic (bilateral involvement with arm involvement equal to or greater than leg involvement).[97][96]
Spastic[edit]
Spastic cerebral palsy is the type of cerebral palsy characterized by spasticity or high muscle tone often resulting in stiff, jerky movements.[98] Itself an umbrella term encompassing spastic hemiplegia, spastic diplegia, spastic quadriplegia and – where solely one limb or one specific area of the body is affected – spastic monoplegia. Spastic cerebral palsy affects the motor cortex[98] of the brain, a specific portion of the cerebral cortex responsible for the planning and completion of voluntary movement.[99] Spastic CP is the most common type of overall cerebral palsy, representing about 80% of cases.[100] Botulinum toxin is effective in decreasing spasticity.[7] It can help increase range of motion which could help mitigate CPs effects on the growing bones of children.[7] There may be an improvement in motor functions in the children and ability to walk. however, the main benefit derived from botulinum toxin A comes from its ability to reduce muscle tone and spasticity and thus prevent or delay the development of fixed muscle contractures.[7][101]
Ataxic[edit]
Ataxic cerebral palsy is observed in approximately 5–10% of all cases of cerebral palsy, making it the least frequent form of cerebral palsy.[102] Ataxic cerebral palsy is caused by damage to cerebellar structures.[103] Because of the damage to the cerebellum, which is essential for coordinating muscle movements and balance, patients with ataxic cerebral palsy experience problems in coordination, specifically in their arms, legs, and trunk. Ataxic cerebral palsy is known to decrease muscle tone.[104] The most common manifestation of ataxic cerebral palsy is intention (action) tremor, which is especially apparent when carrying out precise movements, such as tying shoe laces or writing with a pencil. This symptom gets progressively worse as the movement persists, making the hand shake. As the hand gets closer to accomplishing the intended task, the trembling intensifies, which makes it even more difficult to complete.[97]
Dyskinetic[edit]
Dyskinetic cerebral palsy (sometimes abbreviated DCP) is primarily associated with damage to the basal ganglia and the substantia nigra in the form of lesions that occur during brain development due to bilirubin encephalopathy and hypoxic-ischemic brain injury.[105] DCP is characterized by both hypertonia and hypotonia, due to the affected individual’s inability to control muscle tone.[97] Clinical diagnosis of DCP typically occurs within 18 months of birth and is primarily based upon motor function and neuroimaging techniques.[106][107]
Dyskinetic cerebral palsy is an extrapyramidal form of cerebral palsy.[108] Dyskinetic cerebral palsy can be divided into two different groups; choreoathetosis and dystonia.[97] Choreo-athetotic CP is characterized by involuntary movements, whereas dystonic CP is characterized by slow, strong contractions, which may occur locally or encompass the whole body.[96]
Mixed[edit]
Mixed cerebral palsy has symptoms of dyskinetic, ataxic and spastic CP appearing simultaneously, each to varying degrees, and both with and without symptoms of each. Mixed CP is the most difficult to treat as it is extremely heterogeneous and sometimes unpredictable in its symptoms and development over the lifespan.[citation needed]
Gait Classification[edit]
The Amsterdam Gait Classification facilitates the assessment of the gait pattern in CP patients. It helps to facilitate communication in the interdisciplinary team between those affected, doctors, physiotherapists and orthotists.
In patients with spastic hemiplegia or diplegia, various gait patterns can be observed, the exact form of which can only be described with the help of complex gait analysis systems. In order to facilitate interdisciplinary communication in the interdisciplinary team between those affected, doctors, physiotherapists and orthotists, a simple description of the gait pattern is useful. J. Rodda and H. K. Graham already described in 2001 how gait patterns of CP patients can be more easily recognized and defined gait types which they compared in a classification. They also described that gait patterns can vary with age.[109] Building on this, the Amsterdam Gait Classification was developed at the free university in Amsterdam, the VU medisch centrum. A special feature of this classification is that it makes different gait patterns very easy to recognize and can be used in CP patients in whom only one leg and both legs are affected. According to the Amsterdam Gait Classification, five gait types are described. To assess the gait pattern, the patient is viewed visually or via a video recording from the side of the leg to be assessed. At the point in time at which the leg to be viewed is in mid stance and the leg not to be viewed is in mid swing, the knee angle and the contact of the foot with the ground are assessed on the one hand.[110]
Classification of the gait pattern according to the Amsterdam Gait Classification: In gait type 1, the knee angle is normal and the foot contact is complete. In gait type 2, the knee angle is hyperextended and the foot contact is complete. In gait type 3, the knee angle is hyperextended and foot contact is incomplete (only on the forefoot). In gait type 4, the knee angle is bent and foot contact is incomplete (only on the forefoot). With gait type 5, the knee angle is bent and the foot contact is complete.[110]
Gait types 5 is also known as crouch gait.[111]
Prevention[edit]
Because the causes of CP are varied, a broad range of preventive interventions have been investigated.[112]
Electronic fetal monitoring has not helped to prevent CP, and in 2014 the American College of Obstetricians and Gynecologists, the Royal Australian and New Zealand College of Obstetricians and Gynaecologists, and the Society of Obstetricians and Gynaecologists of Canada have acknowledged that there are no long-term benefits of electronic fetal monitoring.[64] Before this, electronic fetal monitoring was widely used to prop up obstetric litigation.[113]
In those at risk of an early delivery, magnesium sulphate appears to decrease the risk of cerebral palsy.[114] It is unclear if it helps those who are born at term.[115] In those at high risk of preterm labor a review found that moderate to severe CP was reduced by the administration of magnesium sulphate, and that adverse effects on the babies from the magnesium sulphate were not significant. Mothers who received magnesium sulphate could experience side effects such as respiratory depression and nausea.[116] However, guidelines for the use of magnesium sulfate in mothers at risk of preterm labour are not strongly adhered to.[117] Caffeine is used to treat apnea of prematurity and reduces the risk of cerebral palsy in premature babies, but there are also concerns of long term negative effects.[118] A moderate quality level of evidence indicates that giving women antibiotics during preterm labor before her membranes have ruptured (water is not yet not broken) may increase the risk of cerebral palsy for the child.[119] Additionally, for preterm babies for whom there is a chance of fetal compromise, allowing the birth to proceed rather than trying to delay the birth may lead to an increased risk of cerebral palsy in the child.[119] Corticosteroids are sometimes taken by pregnant women expecting a preterm birth to provide neuroprotection to their baby.[120] Taking corticosteroids during pregnancy is shown to have no significant correlation with developing cerebral palsy in preterm births.[119]
Cooling high-risk full-term babies shortly after birth may reduce disability,[121] but this may only be useful for some forms of the brain damage that causes CP.[85]
Management[edit]
Researchers are developing an electrical stimulation device specifically for children with cerebral palsy, who have foot drop, which causes tripping when walking.
Over time, the approach to CP management has shifted away from narrow attempts to fix individual physical problems – such as spasticity in a particular limb – to making such treatments part of a larger goal of maximizing the person’s independence and community engagement.[122]: 886 However, the evidence base for the effectiveness of intervention programs reflecting the philosophy of independence has not yet caught up: effective interventions for body structures and functions have a strong evidence base, but evidence is lacking for effective interventions targeted toward participation, environment, or personal factors.[122] There is also no good evidence to show that an intervention that is effective at the body-specific level will result in an improvement at the activity level or vice versa.[122] Although such cross-over benefit might happen, not enough high-quality studies have been done to demonstrate it.[122]
Because cerebral palsy has «varying severity and complexity» across the lifespan,[94] it can be considered a collection of conditions for management purposes.[85] A multidisciplinary approach for cerebral palsy management is recommended,[94] focusing on «maximising individual function, choice and independence» in line with the International Classification of Functioning, Disability and Health’s goals.[87] The team may include a paediatrician, a health visitor, a social worker, a physiotherapist, an orthotist, a speech and language therapist, an occupational therapist, a teacher specialising in helping children with visual impairment, an educational psychologist, an orthopaedic surgeon, a neurologist and a neurosurgeon.[123]
Various forms of therapy are available to people living with cerebral palsy as well as caregivers and parents. Treatment may include one or more of the following: physical therapy; occupational therapy; speech therapy; water therapy; drugs to control seizures, alleviate pain, or relax muscle spasms (e.g. benzodiazepines); surgery to correct anatomical abnormalities or release tight muscles; braces and other orthotic devices; rolling walkers; and communication aids such as computers with attached voice synthesisers.[citation needed]
Surgical intervention in CP children may include various orthopaedic or neurological surgeries to improve quality of life, such as tendon releases, hip rotation, spinal fusion, (selective dorsal rhizotomy) or placement of an intrathecal baclofen pump.[19][122][124]
A Cochrane review published in 2004 found a trend toward the benefit of speech and language therapy for children with cerebral palsy but noted the need for high-quality research.[125] A 2013 systematic review found that many of the therapies used to treat CP have no good evidence base; the treatments with the best evidence are medications (anticonvulsants, botulinum toxin, bisphosphonates, diazepam), therapy (bimanual training, casting, constraint-induced movement therapy, context-focused therapy, fitness training, goal-directed training, hip surveillance, home programmes, occupational therapy after botulinum toxin, pressure care) and surgery. There is also research on whether the sleeping position might improve hip migration, but there are not yet high-quality evidence studies to support that theory.[126] Research papers also call for an agreed consensus on outcome measures which will allow researchers to cross-reference research. Also, the terminology used to describe orthoses[127] needs to be standardised to ensure studies can be reproduced and readily compared and evaluated.
Orthotics in the concept of therapy[edit]
Child with cerebral palsy and orthotics with adjustable functional elements to improve safety when standing and walking.
To improve the gait pattern, orthotics can be included in the therapy concept. An orthosis can support physiotherapeutic treatment in setting the right motor impulses in order to create new cerebral connections.[128] The orthosis must meet the requirements of the medical prescription. In addition, the orthosis must be designed by the orthotist in such a way that it achieves the effectiveness of the necessary levers, matching the gait pattern, in order to support the proprioceptive approaches of physiotherapy. The characteristics of the stiffness of the orthosis shells and the adjustable dynamics in the ankle joint are important elements of the orthosis to be considered.[129] Due to these requirements, the development of orthoses has changed significantly in recent years, especially since around 2010. At about the same time, care concepts were developed that deal intensively with the orthotic treatment of the lower extremities in cerebral palsy.[130] Modern materials and new functional elements enable the rigidity to be specifically adapted to the requirements that fits to the gait pattern of the CP patient.[131] The adjustment of the stiffness has a decisive influence on the gait pattern and on the energy cost of walking.[132][133][134] It is of great advantage if the stiffness of the orthosis can be adjusted separately from one another via resistances of the two functional elements in the two directions of movement, dorsiflexion and plantar flexion.[135]
Prognosis[edit]
CP is not a progressive disorder (meaning the brain damage does not worsen), but the symptoms can become more severe over time. A person with the disorder may improve somewhat during childhood if he or she receives extensive care, but once bones and musculature become more established, orthopedic surgery may be required. People with CP can have varying degrees of cognitive impairment or none whatsoever. The full intellectual potential of a child born with CP is often not known until the child starts school. People with CP are more likely to have learning disorders but have normal intelligence. Intellectual level among people with CP varies from genius to intellectually disabled, as it does in the general population, and experts have stated that it is important not to underestimate the capabilities of a person with CP and to give them every opportunity to learn.[136]
The ability to live independently with CP varies widely, depending partly on the severity of each person’s impairment and partly on the capability of each person to self-manage the logistics of life. Some individuals with CP require personal assistant services for all activities of daily living. Others only need assistance with certain activities, and still others do not require any physical assistance. But regardless of the severity of a person’s physical impairment, a person’s ability to live independently often depends primarily on the person’s capacity to manage the physical realities of his or her life autonomously. In some cases, people with CP recruit, hire, and manage a staff of personal care assistants (PCAs). PCAs facilitate the independence of their employers by assisting them with their daily personal needs in a way that allows them to maintain control over their lives.[citation needed]
Puberty in young adults with cerebral palsy may be precocious or delayed. Delayed puberty is thought to be a consequence of nutritional deficiencies.[137] There is currently no evidence that CP affects fertility, although some of the secondary symptoms have been shown to affect sexual desire and performance.[138] Adults with CP were less likely to get routine reproductive health screening as of 2005. Gynecological examinations may have to be performed under anesthesia due to spasticity, and equipment is often not accessible. Breast self-examination may be difficult, so partners or carers may have to perform it. Women with CP reported higher levels of spasticity and urinary incontinence during menstruation in a study. Men with CP have higher levels of cryptorchidism at the age of 21.[137]
CP can significantly reduce a person’s life expectancy, depending on the severity of their condition and the quality of care they receive.[61][139] 5–10% of children with CP die in childhood, particularly where seizures and intellectual disability also affect the child.[94] The ability to ambulate, roll, and self-feed has been associated with increased life expectancy.[140] While there is a lot of variation in how CP affects people, it has been found that «independent gross motor functional ability is a very strong determinant of life expectancy».[141] According to the Australian Bureau of Statistics, in 2014, 104 Australians died of cerebral palsy.[142] The most common causes of death in CP are related to respiratory causes, but in middle age cardiovascular issues and neoplastic disorders become more prominent.[143]
Self-care[edit]
For many children with CP, parents are heavily involved in self-care activities. Self-care activities, such as bathing, dressing, and grooming, can be difficult for children with CP, as self-care depends primarily on the use of the upper limbs.[144] For those living with CP, impaired upper limb function affects almost 50% of children and is considered the main factor contributing to decreased activity and participation.[145] As the hands are used for many self-care tasks, sensory and motor impairments of the hands make daily self-care more difficult.[39][non-primary source needed][146] Motor impairments cause more problems than sensory impairments.[39] The most common impairment is that of finger dexterity, which is the ability to manipulate small objects with the fingers.[39] Compared to other disabilities, people with cerebral palsy generally need more help in performing daily tasks.[147] Occupational therapists are healthcare professionals that help individuals with disabilities gain or regain their independence through the use of meaningful activities.[148]
Productivity[edit]
The effects of sensory, motor, and cognitive impairments affect self-care occupations in children with CP and productivity occupations. Productivity can include but is not limited to, school, work, household chores, or contributing to the community.[149]
Play is included as a productive occupation as it is often the primary activity for children.[150] If play becomes difficult due to a disability, like CP, this can cause problems for the child.[151] These difficulties can affect a child’s self-esteem.[151] In addition, the sensory and motor problems experienced by children with CP affect how the child interacts with their surroundings, including the environment and other people.[151] Not only do physical limitations affect a child’s ability to play, the limitations perceived by the child’s caregivers and playmates also affect the child’s play activities.[152] Some children with disabilities spend more time playing by themselves.[153] When a disability prevents a child from playing, there may be social, emotional and psychological problems,[154] which can lead to increased dependence on others, less motivation, and poor social skills.[155]
In school, students are asked to complete many tasks and activities, many of which involve handwriting. Many children with CP have the capacity to learn and write in the school environment.[156] However, students with CP may find it difficult to keep up with the handwriting demands of school and their writing may be difficult to read.[156] In addition, writing may take longer and require greater effort on the student’s part.[156] Factors linked to handwriting include postural stability, sensory and perceptual abilities of the hand, and writing tool pressure.[156]
Speech impairments may be seen in children with CP depending on the severity of brain damage.[157] Communication in a school setting is important because communicating with peers and teachers is very much a part of the «school experience» and enhances social interaction. Problems with language or motor dysfunction can lead to underestimating a student’s intelligence.[158] In summary, children with CP may experience difficulties in school, such as difficulty with handwriting, carrying out school activities, communicating verbally, and interacting socially.[citation needed]
Leisure[edit]
Leisure activities can have several positive effects on physical health, mental health, life satisfaction, and psychological growth for people with physical disabilities like CP.[159] Common benefits identified are stress reduction, development of coping skills, companionship, enjoyment, relaxation and a positive effect on life satisfaction.[160] In addition, for children with CP, leisure appears to enhance adjustment to living with a disability.[160]
Leisure can be divided into structured (formal) and unstructured (informal) activities.[161] Children and teens with CP engage in less habitual physical activity than their peers.[162] Children with CP primarily engage in physical activity through therapies aimed at managing their CP, or through organized sport for people with disabilities.[163] It is difficult to sustain behavioural change in terms of increasing physical activity of children with CP.[164] Gender, manual dexterity, the child’s preferences, cognitive impairment and epilepsy were found to affect children’s leisure activities, with manual dexterity associated with more leisure activity.[165] Although leisure is important for children with CP, they may have difficulties carrying out leisure activities due to social and physical barriers.[citation needed]
Children with cerebral palsy may face challenges when it comes to participating in sports. This comes with being discouraged from physical activity because of these perceived limitations imposed by their medical condition.[166]
Participation and barriers[edit]
Participation is involvement in life situations and everyday activities.[167] Participation includes self-care, productivity, and leisure. In fact, communication, mobility, education, home life, leisure, and social relationships require participation, and indicate the extent to which children function in their environment.[167] Barriers can exist on three levels: micro, meso, and macro.[168] First, the barriers at the micro level involve the person.[168] Barriers at the micro level include the child’s physical limitations (motor, sensory and cognitive impairments) or their subjective feelings regarding their ability to participate.[169] For example, the child may not participate in group activities due to lack of confidence. Second, barriers at the meso level include the family and community.[168] These may include negative attitudes of people toward disability or lack of support within the family or in the community.[170] One of the main reasons for this limited support appears to be the result of a lack of awareness and knowledge regarding the child’s ability to engage in activities despite his or her disability.[170] Third, barriers at the macro level incorporate the systems and policies that are not in place or hinder children with CP. These may be environmental barriers to participation such as architectural barriers, lack of relevant assistive technology, and transportation difficulties due to limited wheelchair access or public transit that can accommodate children with CP.[170] For example, a building without an elevator can prevent the child from accessing higher floors.[citation needed]
A 2013 review stated that outcomes for adults with cerebral palsy without intellectual disability in the 2000s were that «60–80% completed high school, 14–25% completed college, up to 61% were living independently in the community, 25–55% were competitively employed, and 14–28% were involved in long term relationships with partners or had established families».[171] Adults with cerebral palsy may not seek physical therapy due to transport issues, financial restrictions and practitioners not feeling like they know enough about cerebral palsy to take people with CP on as clients.[172]
A study in young adults (18–34) on transitioning to adulthood found that their concerns were physical health care and understanding their bodies, being able to navigate and use services and supports successfully, and dealing with prejudices. A feeling of being «thrust into adulthood» was common in the study.[173]
Aging[edit]
Children with CP may not successfully transition into using adult services because they are not referred to one upon turning 18, and may decrease their use of services.[143] Quality of life outcomes tend to decline for adults with cerebral palsy.[174] Because children with cerebral palsy are often told that it is a non-progressive disease, they may be unprepared for the greater effects of the aging process as they head into their 30s.[175] Young adults with cerebral palsy experience problems with aging that non-disabled adults experience «much later in life».[30]: 42 25% or more adults with cerebral palsy who can walk experience increasing difficulties walking with age.[176] Hand function does not seem to have similar declines.[60] Chronic disease risk, such as obesity, is also higher among adults with cerebral palsy than the general population.[177] Common problems include increased pain, reduced flexibility, increased spasms and contractures, post-impairment syndrome[178] and increasing problems with balance.[41] Increased fatigue is also a problem.[179] When adulthood and cerebral palsy is discussed, as of 2011, it is not discussed in terms of the different stages of adulthood.[179]
Like they did in childhood, adults with cerebral palsy experience psychosocial issues related to their CP, chiefly the need for social support, self-acceptance, and acceptance by others. Workplace accommodations may be needed to enhance continued employment for adults with CP as they age. Rehabilitation or social programs that include salutogenesis may improve the coping potential of adults with CP as they age.[180]
Epidemiology[edit]
Cerebral palsy occurs in about 2.1 per 1000 live births.[2] In those born at term rates are lower at 1 per 1000 live births.[61] Within a population it may occur more often in poorer people.[181] The rate is higher in males than in females; in Europe it is 1.3 times more common in males.[182]
There was a «moderate, but significant» rise in the prevalence of CP between the 1970s and 1990s. This is thought to be due to a rise in low birth weight of infants and the increased survival rate of these infants. The increased survival rate of infants with CP in the 1970s and 80s may be indirectly due to the disability rights movement challenging perspectives around the worth of infants with a disability, as well as the Baby Doe Law.[183]
As of 2005, advances in the care of pregnant mothers and their babies have not resulted in a noticeable decrease in CP. This is generally attributed to medical advances in areas related to the care of premature babies (which results in a greater survival rate). Only the introduction of quality medical care to locations with less-than-adequate medical care has shown any decreases. The incidence of CP increases with premature or very low-weight babies regardless of the quality of care.[184] As of 2016, there is a suggestion that both incidence and severity are slightly decreasing – more research is needed to find out if this is significant, and if so, which interventions are effective.[112] It has been found that high-income countries have lower rates of children born with cerebral palsy than low or middle-income countries.[185]
Prevalence of cerebral palsy is best calculated around the school entry age of about six years; the prevalence in the U.S. is estimated to be 2.4 out of 1000 children.[186]
History[edit]
Cerebral palsy has affected humans since antiquity. A decorated grave marker dating from around the 15th to 14th century BCE shows a figure with one small leg and using a crutch, possibly due to cerebral palsy. The oldest likely physical evidence of the condition comes from the mummy of Siptah, an Egyptian Pharaoh who ruled from about 1196 to 1190 BCE and died at about 20 years of age. The presence of cerebral palsy has been suspected due to his deformed foot and hands.[11]
The medical literature of the ancient Greeks discusses paralysis and weakness of the arms and legs; the modern word palsy comes from the Ancient Greek words παράλυση or πάρεση, meaning paralysis or paresis respectively. The works of the school of Hippocrates (460–c. 370 BCE), and the manuscript On the Sacred Disease in particular, describe a group of problems that matches up very well with the modern understanding of cerebral palsy. The Roman Emperor Claudius (10 BCE–54 CE) is suspected of having CP, as historical records describe him as having several physical problems in line with the condition. Medical historians have begun to suspect and find depictions of CP in much later art. Several paintings from the 16th century and later show individuals with problems consistent with it, such as Jusepe de Ribera’s 1642 painting The Clubfoot.[11]
The modern understanding of CP as resulting from problems within the brain began in the early decades of the 1800s with a number of publications on brain abnormalities by Johann Christian Reil, Claude François Lallemand and Philippe Pinel. Later physicians used this research to connect problems in the brain with specific symptoms. The English surgeon William John Little (1810–1894) was the first person to study CP extensively. In his doctoral thesis he stated that CP was a result of a problem around the time of birth. He later identified a difficult delivery, a preterm birth and perinatal asphyxia in particular as risk factors. The spastic diplegia form of CP came to be known as Little’s disease.[11] At around this time, a German surgeon was also working on cerebral palsy, and distinguished it from polio.[187] In the 1880s British neurologist William Gowers built on Little’s work by linking paralysis in newborns to difficult births. He named the problem «birth palsy» and classified birth palsies into two types: peripheral and cerebral.[11]
Working in the US in the 1880s, Canadian-born physician William Osler (1849–1919) reviewed dozens of CP cases to further classify the disorders by the site of the problems on the body and by the underlying cause. Osler made further observations tying problems around the time of delivery with CP, and concluded that problems causing bleeding inside the brain were likely the root cause. Osler also suspected polioencephalitis as an infectious cause. Through the 1890s, scientists commonly confused CP with polio.[11]
Before moving to psychiatry, Austrian neurologist Sigmund Freud (1856–1939) made further refinements to the classification of the disorder. He produced the system still being used today. Freud’s system divides the causes of the disorder into problems present at birth, problems that develop during birth, and problems after birth. Freud also made a rough correlation between the location of the problem inside the brain and the location of the affected limbs on the body and documented the many kinds of movement disorders.[11]
In the early 20th century, the attention of the medical community generally turned away from CP until orthopedic surgeon Winthrop Phelps became the first physician to treat the disorder. He viewed CP from a musculoskeletal perspective instead of a neurological one. Phelps developed surgical techniques for operating on the muscles to address issues such as spasticity and muscle rigidity. Hungarian physical rehabilitation practitioner András Pető developed a system to teach children with CP how to walk and perform other basic movements. Pető’s system became the foundation for conductive education, widely used for children with CP today. Through the remaining decades, physical therapy for CP has evolved, and has become a core component of the CP management program.[11]
In 1997, Robert Palisano et al. introduced the Gross Motor Function Classification System (GMFCS) as an improvement over the previous rough assessment of limitation as either mild, moderate, or severe.[93] The GMFCS grades limitation based on observed proficiency in specific basic mobility skills such as sitting, standing, and walking, and takes into account the level of dependency on aids such as wheelchairs or walkers. The GMFCS was further revised and expanded in 2007.[93]
Society and culture[edit]
Economic impact[edit]
It is difficult to directly compare the cost and cost-effectiveness of interventions to prevent cerebral palsy or the cost of interventions to manage CP.[117] Access Economics has released a report on the economic impact of cerebral palsy in Australia. The report found that, in 2007, the financial cost of cerebral palsy (CP) in Australia was A$1.47 billion or 0.14% of GDP.[188] Of this:
- A$1.03 billion (69.9%) was productivity lost due to lower employment, absenteeism, and premature death of Australians with CP
- A$141 million (9.6%) was the DWL from transfers including welfare payments and taxation forgone
- A$131 million (9.0%) was other indirect costs such as direct program services, aides and home modifications, and the bringing-forward of funeral costs
- A$129 million (8.8%) was the value of the informal care for people with CP
- A$40 million (2.8%) was direct health system expenditure
The value of lost well-being (disability and premature death) was a further A$2.4 billion.[citation needed]
In per capita terms, this amounts to a financial cost of A$43,431 per person with CP per annum. Including the value of lost well-being, the cost is over $115,000 per person per annum.[citation needed]
Individuals with CP bear 37% of the financial costs, and their families and friends bear a further 6%. The federal government bears around one-third (33%) of the financial costs (mainly through taxation revenues forgone and welfare payments). State governments bear under 1% of the costs, while employers bear 5% and the rest of society bears the remaining 19%. If the burden of disease (lost well-being) is included, individuals bear 76% of the costs.[citation needed]
The average lifetime cost for people with CP in the US is US$921,000 per individual, including lost income.[189]
In the United States, many states allow Medicaid beneficiaries to use their Medicaid funds to hire their own PCAs, instead of forcing them to use institutional or managed care.[190]
In India, the government-sponsored program called «NIRAMAYA» for the medical care of children with neurological and muscular deformities has proved to be an ameliorating economic measure for persons with such disabilities.[191] It has shown that persons with mental or physically debilitating congenital disabilities can lead better lives if they have financial independence.[192]
Use of the term[edit]
«Cerebral» means «of, or pertaining to, the cerebrum or the brain»[193] and «palsy» means «paralysis, generally partial, whereby a local body area is incapable of voluntary movement».[194] It has been proposed to change the name to «cerebral palsy spectrum disorder» to reflect the diversity of presentations of CP.[195]
Many people would rather be referred to as a person with a disability (people-first language) instead of as «handicapped».[citation needed] «Cerebral Palsy: A Guide for Care» at the University of Delaware offers the following guidelines:
Impairment is the correct term to use to define a deviation from normal, such as not being able to make a muscle move or not being able to control an unwanted movement. Disability is the term used to define a restriction in the ability to perform a normal activity of daily living which someone of the same age can perform. For example, a three-year-old child who is not able to walk has a disability because a normal three-year-old can walk independently. A handicapped child or adult is one who, because of the disability, is unable to achieve the normal role in society commensurate with his age and socio-cultural milieu. As an example, a sixteen-year-old who is unable to prepare his own meal or care for his own toilet or hygiene needs is handicapped. On the other hand, a sixteen-year-old who can walk only with the assistance of crutches but who attends a regular school and is fully independent in activities of daily living is disabled but not handicapped. All disabled people are impaired, and all handicapped people are disabled, but a person can be impaired and not necessarily be disabled, and a person can be disabled without being handicapped.[196]
The term «spastic» denotes the attribute of spasticity in types of spastic CP. In 1952 a UK charity called The Spastics Society was formed.[197] The term «spastics» was used by the charity as a term for people with CP. The word «spastic» has since been used extensively as a general insult to disabled people, which some see as extremely offensive. They are also frequently used to insult non-disabled people when they seem overly uncoordinated, anxious, or unskilled in sports. The charity changed its name to Scope in 1994.[197] In the United States the word spaz has the same usage as an insult but is not generally associated with CP.[198]
Media[edit]
Maverick documentary filmmaker Kazuo Hara criticises the mores and customs of Japanese society in an unsentimental portrait of adults with cerebral palsy in his 1972 film Goodbye CP (Sayonara CP). Focusing on how people with cerebral palsy are generally ignored or disregarded in Japan, Hara challenges his society’s taboos about physical handicaps. Using a deliberately harsh style, with grainy black-and-white photography and out-of-sync sound, Hara brings a stark realism to his subject.[199]
Spandan (2012), a film by Vegitha Reddy and Aman Tripathi, delves into the dilemma of parents whose child has cerebral palsy. While films made with children with special needs as central characters have been attempted before, the predicament of parents dealing with the stigma associated with the condition and beyond is dealt in Spandan. In one of the songs of Spandan «Chal chaal chaal tu bala» more than 50 CP kids have acted. The famous classical singer Devaki Pandit has given her voice to the song penned by Prof. Jayant Dhupkar and composed by National Film Awards winner Isaac Thomas Kottukapally.[200][201][202][203]
My Left Foot (1989) is a drama film directed by Jim Sheridan and starring Daniel Day-Lewis. It tells the true story of Christy Brown, an Irishman born with cerebral palsy, who could control only his left foot. Christy Brown grew up in a poor, working-class family, and became a writer and artist. It won the Academy Award for Best Actor (Daniel Day-Lewis) and Best Actress in a Supporting Role (Brenda Fricker). It was also nominated for Best Director, Best Picture and Best Writing, Screenplay Based on Material from Another Medium. It also won the New York Film Critics Circle Award for Best Film for 1989.[204]
Call the Midwife (2012–) has featured two episodes with actor Colin Young, who himself has cerebral palsy, playing a character with the same disability. His storylines have focused on the segregation of those with disabilities in the UK in the 1950s, and also romantic relationships between people with disabilities.[205]
Micah Fowler, an American actor with CP, stars in the ABC sitcom Speechless (2016–19), which explores both the serious and humorous challenges a family faces with a teenager with CP.[206]
9-1-1 (2018–) is a procedural drama series on Fox. From season 2 onwards, it features Gavin McHugh (who himself has cerebral palsy) in the recurring role as Christopher Diaz – a young child who has cerebral palsy.
Special (2019) is a comedy series that premiered on Netflix on 12 April 2019. It was written, produced and stars Ryan O’Connell as a young gay man with mild cerebral palsy. It is based on O’Connell’s book I’m Special: And Other Lies We Tell Ourselves.[207]
Australian drama serial The Heights (2019–) features a character with mild cerebral palsy, teenage girl Sabine Rosso, depicted by an actor who herself has mild cerebral palsy, Bridie McKim.[208]
Notable cases[edit]
- Christy Brown was the basis for the Academy Award-winning film, My Left Foot.
- Two sons of Canadian rock musician Neil Young, Zeke and Ben.[209] In 1986, Young helped found the Bridge School, an educational organization for children with severe verbal and physical disabilities, and its annual supporting Bridge School Benefit concerts, together with his wife Pegi.[210][211]
- Nicolas Hamilton, a British racing driver competing in BTCC. He is the half-brother of Formula 1 driver Lewis Hamilton.[212]
- Geri Jewell, who had a regular role in the prime-time series The Facts of Life.[213]
- Josh Blue, winner of the fourth season of NBC’s Last Comic Standing, whose act revolves around his CP.[214] Blue was also on the 2004 U.S. Paralympic soccer team.[215]
- Jason Benetti, play-by-play broadcaster for ESPN, Fox Sports, Westwood One, and Time Warner covering football, baseball, lacrosse, hockey, and basketball. Since 2016, he is also the television play-by-play announcer for Chicago White Sox home games.[216]
- Jack Carroll, British comedian and runner-up in the seventh season of Britain’s Got Talent.[217]
- Abbey Curran, an American beauty queen who represented Iowa at Miss USA 2008 and was the first contestant with a disability to compete.[218]
- Robert Griswold, swimmer
- Francesca Martinez, British stand-up comedian and actress.[219]
- Evan O’Hanlon, Australian Paralympian, the fastest athlete with cerebral palsy in the world.[220]
- Arun Shourie’s son Aditya, about whom he has written a book Does He Know a Mother’s Heart[221]
- Maysoon Zayid, the self-described «Palestinian Muslim virgin with cerebral palsy, from New Jersey», who is an actress, stand-up comedian, and activist.[222] Zayid has been a resident of Cliffside Park, New Jersey.[223] She is considered one of America’s first Muslim women comedians and the first person ever to perform standup in Palestine and Jordan.[224]
- RJ Mitte, an American actor best known for his role as Walter White Jr. in Breaking Bad. He is also a celebrity ambassador for United Cerebral Palsy.[225]
- Zach Anner, an American comedian, actor, and writer. He had a television series on Oprah Winfrey’s OWN called Rollin’ With Zach and is the author of If at Birth You Don’t Succeed.[226]
- Kaine, a member of the American hip-hop duo The Ying Yang Twins, has a mild form of cerebral palsy that causes him to limp.[227][unreliable source?]
- Hannah Cockroft, is a British wheelchair athlete specialising in sprint distances in the T34 classification. She holds the Paralympic and world records for the 100 metres, 200 metres and 400 metres in her classification.[228][229][230]
- Keah Brown, American disability rights activist, author and journalist.[231]
- Kuli Kohli, Indian-British writer, poet, activist.[232]
- Simon James Stevens, a British disability issues consultant and activist, who starred in I’m Spazticus and founded Wheelies virtual nightclub [233]
- The Roman Emperor Claudius is hypothesized to have had cerebral palsy on the basis of his reported symptoms.[234]
- Rosie Jones, a British comedian and actress, is incorporating her cerebral palsy into her comedic style.
- Christopher Nolan, an Irish Poet and Author, he wrote Damn-Burst of Dreams, The Banyan Tree, and Under The Eye Of The Clock. He passed away in 2009.
Litigation[edit]
Because of the false perception that cerebral palsy is mostly caused by trauma during birth, as of 2005, 60% of obstetric litigation was about cerebral palsy, which Alastair MacLennan, Professor of Obstetrics and Gynaecology at the University of Adelaide, regards as causing an exodus from the profession.[235] In the latter half of the 20th century, obstetric litigation about the cause of cerebral palsy became more common, leading to the practice of defensive medicine.[113]
See also[edit]
- Cerebral palsy sport classification – describes the disability sport classification for cerebral palsy.
- Inclusive recreation
- World Cerebral Palsy Day
Notes[edit]
- ^ Incorrectly stated as 11% in 2013 [2]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj «Cerebral Palsy: Hope Through Research». National Institute of Neurological Disorders and Stroke. July 2013. Archived from the original on 21 February 2017. Retrieved 21 February 2017.
- ^ a b c d e Oskoui M, Coutinho F, Dykeman J, Jetté N, Pringsheim T (June 2013). «An update on the prevalence of cerebral palsy: a systematic review and meta-analysis». Developmental Medicine and Child Neurology. 55 (6): 509–519. doi:10.1111/dmcn.12080. PMID 23346889. S2CID 22053074.
- ^ Haak P, Lenski M, Hidecker MJ, Li M, Paneth N (October 2009). «Cerebral palsy and aging». Developmental Medicine and Child Neurology. 51 (4): 16–23. doi:10.1111/j.1469-8749.2009.03428.x. PMC 4183123. PMID 19740206.
- ^ «Cerebral Palsy: Overview». National Institutes of Health. Archived from the original on 15 February 2017. Retrieved 21 February 2017.
- ^ a b c «CEREBRAL PALSY, SPASTIC QUADRIPLEGIC, 1; CPSQ1». Online Mendelian Inheritance in Man. 28 June 2016. Retrieved 26 January 2018.
- ^ Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109: 8–14. doi:10.1111/j.1469-8749.2007.tb12610.x. PMID 17370477. S2CID 24504486.
- ^ a b c d Farag SM, Mohammed MO, El-Sobky TA, ElKadery NA, ElZohiery AK (March 2020). «Botulinum Toxin A Injection in Treatment of Upper Limb Spasticity in Children with Cerebral Palsy: A Systematic Review of Randomized Controlled Trials». JBJS Reviews. 8 (3): e0119. doi:10.2106/JBJS.RVW.19.00119. PMC 7161716. PMID 32224633.
- ^ Blumetti FC, Belloti JC, Tamaoki MJ, Pinto JA (October 2019). «Botulinum toxin type A in the treatment of lower limb spasticity in children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2019 (10): CD001408. doi:10.1002/14651858.CD001408.pub2. PMC 6779591. PMID 31591703.
- ^ Elliott, Catherine M.; Reid, Siobhan L.; Alderson, Jacqueline A.; Elliott, Bruce C. (1 February 2011). «Lycra arm splints in conjunction with goal-directed training can improve movement in children with cerebral palsy». NeuroRehabilitation. 28 (1): 47–54. doi:10.3233/nre-2011-0631. ISSN 1878-6448. PMID 21335677.
- ^ «How many people are affected?». National Institutes of Health. 5 September 2014. Archived from the original on 2 April 2015. Retrieved 4 March 2015.
- ^ a b c d e f g h i Panteliadis C, Panteliadis P, Vassilyadi F (April 2013). «Hallmarks in the history of cerebral palsy: from antiquity to mid-20th century». Brain & Development. 35 (4): 285–292. doi:10.1016/j.braindev.2012.05.003. PMID 22658818. S2CID 11851579.
- ^ «What is cerebral palsy?». The Cerebral Palsied Association of the Philippines Inc. Archived from the original on 20 December 2016. Retrieved 4 December 2016.
- ^ a b Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109 (s109): 8–14. doi:10.1111/j.1469-8749.2007.tb12610.x. PMID 17370477. S2CID 24504486.; Corrected in Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109 (6): 8–14. doi:10.1111/j.1469-8749.2007.00480.x. PMID 17370477. S2CID 221647898.
- ^ Kent R (2013). «Chapter 38: Cerebral Palsy». In Barnes MP, Good DC (eds.). Handbook of Clinical Neurology. 3. Vol. 110. Elsevier. pp. 443–459. ISBN 978-0444529015.
- ^ Mathewson MA, Lieber RL (February 2015). «Pathophysiology of muscle contractures in cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 26 (1): 57–67. doi:10.1016/j.pmr.2014.09.005. PMC 4258234. PMID 25479779.
- ^ a b c d e El-Sobky TA, Fayyad TA, Kotb AM, Kaldas B (May 2018). «Bony reconstruction of hip in cerebral palsy children Gross Motor Function Classification System levels III to V: a systematic review». Journal of Pediatric Orthopedics. Part B. 27 (3): 221–230. doi:10.1097/BPB.0000000000000503. PMID 28953164. S2CID 4204446.
- ^ a b Agarwal A, Verma I (December 2012). «Cerebral palsy in children: An overview». Journal of Clinical Orthopaedics and Trauma. 3 (2): 77–81. doi:10.1016/j.jcot.2012.09.001. PMC 3872805. PMID 26403442.
- ^ «Volume 1997. No. 20 October 31, 1997». Clin-Alert. 35 (1): 153–160. January 1997. doi:10.1177/006947709703500120. ISSN 0069-4770. S2CID 208256249.
- ^ a b Amen J, ElGebeily M, El-Mikkawy DM, Yousry AH, El-Sobky TA (2018). «Single-event multilevel surgery for crouching cerebral palsy children: Correlations with quality of life and functional mobility». Journal of Musculoskeletal Surgery and Research. 2 (4): 148. doi:10.4103/jmsr.jmsr_48_18. S2CID 81725776.
- ^ Singh A (8 March 2021). Children With Diverse Needs (1st ed.). Psycho Information Technologies. pp. 159–165. ISBN 9788193922774. Retrieved 21 March 2021.
- ^ Smith M, Kurian MA (September 2016). «The medical management of cerebral palsy». Paediatrics and Child Health. 26 (9): 378–382. doi:10.1016/j.paed.2016.04.013.
- ^ «Symptoms of Cerebral palsy». NHS Choices. NHS Gov.UK. 15 March 2017. Archived from the original on 7 April 2017. Retrieved 6 April 2017.
- ^ Walshe M, Smith M, Pennington L (November 2012). Walshe M (ed.). «Interventions for drooling in children with cerebral palsy». The Cochrane Database of Systematic Reviews. 11: CD008624. doi:10.1002/14651858.CD008624.pub3. PMID 23152263.
- ^ a b c d e Sewell MD, Eastwood DM, Wimalasundera N (September 2014). «Managing common symptoms of cerebral palsy in children». BMJ. 349 (sep25 7): g5474. doi:10.1136/bmj.g5474. PMID 25255910. S2CID 45300547.
- ^ Samijn B, Van Laecke E, Renson C, Hoebeke P, Plasschaert F, Vande Walle J, Van den Broeck C (March 2017). «Lower urinary tract symptoms and urodynamic findings in children and adults with cerebral palsy: A systematic review». Neurourology and Urodynamics (Submitted manuscript). 36 (3): 541–549. doi:10.1002/nau.22982. PMID 26894322. S2CID 34807855.
- ^ Hinchcliffe A, Rogers C (2007). «Sensory integration problems in children with cerebral palsy». Children with Cerebral Palsy: a manual for therapists, parents and community workers (2nd ed., rev. ed.). New Delhi: SAGE Publications. ISBN 9788178299655.
- ^ Alliance (UK), National Guideline (2019). Rationale and impact. National Institute for Health and Care Excellence (UK).
- ^ a b c Mughal MZ (September 2014). «Fractures in children with cerebral palsy». Current Osteoporosis Reports. 12 (3): 313–318. doi:10.1007/s11914-014-0224-1. PMID 24964775. S2CID 32791951.
- ^ Ozel S, Switzer L, Macintosh A, Fehlings D (September 2016). «Informing evidence-based clinical practice guidelines for children with cerebral palsy at risk of osteoporosis: an update». Developmental Medicine and Child Neurology. 58 (9): 918–923. doi:10.1111/dmcn.13196. PMID 27435427.
- ^ a b Kerkovich, D, & Aisen, M 2009, ‘Chapter 4: Cerebral Palsy’, Medical Management of Adults with Neurologic Disabilities pp. 41–53 n.p.: Demos Medical Publishing, LLC. ISBN 9781933864457
- ^ Riad J, Finnbogason T, Broström E (December 2010). «Leg length discrepancy in spastic hemiplegic cerebral palsy: a magnetic resonance imaging study». Journal of Pediatric Orthopedics. 30 (8): 846–850. doi:10.1097/BPO.0b013e3181fc35dd. hdl:10616/40477. PMID 21102211. S2CID 46608602.
- ^ Veilleux LN, Rauch F (October 2017). «Muscle-Bone Interactions in Pediatric Bone Diseases». Current Osteoporosis Reports. 15 (5): 425–432. doi:10.1007/s11914-017-0396-6. PMID 28856575. S2CID 39445049.
- ^ a b Shore BJ, White N, Kerr Graham H (August 2010). «Surgical correction of equinus deformity in children with cerebral palsy: a systematic review». Journal of Children’s Orthopaedics. 4 (4): 277–290. doi:10.1007/s11832-010-0268-4. PMC 2908346. PMID 21804889.
- ^ a b Cloake T, Gardner A (December 2016). «The management of scoliosis in children with cerebral palsy: a review». Journal of Spine Surgery. 2 (4): 299–309. doi:10.21037/jss.2016.09.05. PMC 5233861. PMID 28097247.
- ^ Rutz E, Brunner R (November 2013). «Management of spinal deformity in cerebral palsy: conservative treatment». Journal of Children’s Orthopaedics. 7 (5): 415–418. doi:10.1007/s11832-013-0516-5. PMC 3838520. PMID 24432104.
- ^ Roberts A (September 2012). «The surgical treatment of cerebral palsy». Paediatrics and Child Health. 22 (9): 377–383. doi:10.1016/j.paed.2012.03.004.
- ^ a b Klingels K, De Cock P, Molenaers G, Desloovere K, Huenaerts C, Jaspers E, Feys H (2010). «Upper limb motor and sensory impairments in children with hemiplegic cerebral palsy. Can they be measured reliably?». Disability and Rehabilitation. 32 (5): 409–416. doi:10.3109/09638280903171469. PMID 20095955. S2CID 19704908.
- ^ a b c d Meyers RC, Bachrach SJ, Stallings VA (2017). «Cerebral Palsy». In Ekvall SW, Ekvall VK (eds.). Pediatric and Adult Nutrition in Chronic Diseases, Developmental Disabilities, and Hereditary Metabolic Disorders: Prevention, Assessment, and Treatment. Oxford Scholarship Online. pp. 86–90. doi:10.1093/acprof:oso/9780199398911.003.0009. ISBN 9780199398911.
- ^ a b c d e Donkervoort M, Roebroeck M, Wiegerink D, van der Heijden-Maessen H, Stam H (March 2007). «Determinants of functioning of adolescents and young adults with cerebral palsy». Disability and Rehabilitation. 29 (6): 453–463. doi:10.1080/09638280600836018. PMID 17364800. S2CID 20066607.
- ^ Bell KL, Samson-Fang L (December 2013). «Nutritional management of children with cerebral palsy». European Journal of Clinical Nutrition. 67 (Suppl 2): S13–S16. doi:10.1038/ejcn.2013.225. PMID 24301003.
- ^ a b Hirsh AT, Gallegos JC, Gertz KJ, Engel JM, Jensen MP (2010). «Symptom burden in individuals with cerebral palsy». Journal of Rehabilitation Research and Development. 47 (9): 863–876. doi:10.1682/jrrd.2010.03.0024. PMC 3158669. PMID 21174251.
- ^ a b Myrden A, Schudlo L, Weyand S, Zeyl T, Chau T (August 2014). «Trends in communicative access solutions for children with cerebral palsy». Journal of Child Neurology. 29 (8): 1108–1118. doi:10.1177/0883073814534320. PMID 24820337. S2CID 28508184.
- ^ Love RJ, Webb WG (2013). Neurology for the Speech-Language Pathologist (2nd ed.). Butterworth-Heinemann. p. 250. ISBN 9781483141992.
- ^ a b c d Beukelman DR, Mirenda P (1999). Augmentative and Alternative Communication: Management of severe communication disorders in children and adults (2nd ed.). Baltimore: Paul H Brookes Publishing Co. pp. 246–249. doi:10.1080/07434619912331278735. ISBN 978-1-55766-333-7.
- ^ Pennington, Lindsay (1 September 2008). «Cerebral palsy and communication». Paediatrics and Child Health. 18 (9): 405–409. doi:10.1016/j.paed.2008.05.013. ISSN 1751-7222.
- ^ McKearnan KA, Kieckhefer GM, Engel JM, Jensen MP, Labyak S (October 2004). «Pain in children with cerebral palsy: a review». The Journal of Neuroscience Nursing. 36 (5): 252–259. doi:10.1097/01376517-200410000-00004. PMID 15524243. S2CID 33568994.
- ^ Hauer J, Houtrow AJ (June 2017). «Pain Assessment and Treatment in Children With Significant Impairment of the Central Nervous System». Pediatrics. 139 (6): e20171002. doi:10.1542/peds.2017-1002. PMID 28562301.
- ^ Blackman JA, Svensson CI, Marchand S (September 2018). «Pathophysiology of chronic pain in cerebral palsy: implications for pharmacological treatment and research». Developmental Medicine and Child Neurology. 60 (9): 861–865. doi:10.1111/dmcn.13930. PMID 29882358.
- ^ Newman CJ, O’Regan M, Hensey O (July 2006). «Sleep disorders in children with cerebral palsy». Developmental Medicine and Child Neurology. 48 (7): 564–568. doi:10.1017/S0012162206001198. PMID 16780625.
- ^ Dutt R, Roduta-Roberts M, Brown CA (February 2015). «Sleep and Children with Cerebral Palsy: A Review of Current Evidence and Environmental Non-Pharmacological Interventions». Children. 2 (1): 78–88. doi:10.3390/children2010078. PMC 4928749. PMID 27417351.
- ^ Stanton M (2012). «Special Considerations». Understanding cerebral palsy : a guide for parents and professionals. London: Jessica Kingsley Publishers. p. 70. ISBN 9781849050609.
- ^ Kingsnorth S, Orava T, Provvidenza C, Adler E, Ami N, Gresley-Jones T, et al. (October 2015). «Chronic Pain Assessment Tools for Cerebral Palsy: A Systematic Review». Pediatrics. 136 (4): e947–e960. doi:10.1542/peds.2015-0273. PMID 26416940.
- ^ Novak I, Hines M, Goldsmith S, Barclay R (November 2012). «Clinical prognostic messages from a systematic review on cerebral palsy». Pediatrics. 130 (5): e1285–e1312. doi:10.1542/peds.2012-0924. PMID 23045562.
- ^ van der Slot WM, Benner JL, Brunton L, Engel JM, Gallien P, Hilberink SR, et al. (May 2021). «Pain in adults with cerebral palsy: A systematic review and meta-analysis of individual participant data». Annals of Physical and Rehabilitation Medicine. 64 (3): 101359. doi:10.1016/j.rehab.2019.12.011. hdl:10852/83636. PMID 32061920. S2CID 211134380.
- ^ Jones KB, Wilson B, Weedon D, Bilder D (December 2015). «Care of Adults With Intellectual and Developmental Disabilities: Cerebral Palsy». FP Essentials. 439: 26–30. PMID 26669212.
- ^ Krigger KW (January 2006). «Cerebral palsy: an overview». American Family Physician. 73 (1): 91–100. PMID 16417071.
- ^ Cremer N, Hurvitz EA, Peterson MD (June 2017). «Multimorbidity in Middle-Aged Adults with Cerebral Palsy». The American Journal of Medicine. 130 (6): 744.e9–744.e15. doi:10.1016/j.amjmed.2016.11.044. PMC 5502778. PMID 28065772.
- ^ «Women’s Health Initiative – Cerebral Palsy Foundation». Cerebral Palsy Foundation. 10 July 2015. Archived from the original on 24 December 2016. Retrieved 23 December 2016.
- ^ Wimalasundera N, Stevenson VL (June 2016). «Cerebral palsy». Practical Neurology. 16 (3): 184–194. doi:10.1136/practneurol-2015-001184. PMID 26837375. S2CID 4488035.
- ^ a b van Gorp M, Hilberink SR, Noten S, Benner JL, Stam HJ, van der Slot WM, Roebroeck ME (June 2020). «Epidemiology of Cerebral Palsy in Adulthood: A Systematic Review and Meta-analysis of the Most Frequently Studied Outcomes». Archives of Physical Medicine and Rehabilitation. 101 (6): 1041–1052. doi:10.1016/j.apmr.2020.01.009. hdl:1765/126053. PMID 32059945. S2CID 211122403.
- ^ a b c d e f g Yarnell J (2013). Epidemiology and Disease Prevention: A Global Approach (2nd ed.). Oxford University Press. p. 190. ISBN 9780199660537.
- ^ Eunson P (September 2016). «Aetiology and epidemiology of cerebral palsy». Paediatrics and Child Health. 26 (9): 367–372. doi:10.1016/j.paed.2016.04.011.
- ^ Sayed Ahmed WA, Hamdy MA (21 August 2018). «Optimal management of umbilical cord prolapse». International Journal of Women’s Health. 10: 459–465. doi:10.2147/IJWH.S130879. PMC 6109652. PMID 30174462.
- ^ a b c Nelson KB, Blair E (September 2015). «Prenatal Factors in Singletons with Cerebral Palsy Born at or near Term». The New England Journal of Medicine. 373 (10): 946–953. doi:10.1056/NEJMra1505261. PMID 26332549.
- ^ Burton A (September 2015). «Fighting cerebral palsy in Africa». The Lancet. Neurology. 14 (9): 876–877. doi:10.1016/S1474-4422(15)00189-1. PMID 26293560.
- ^ William B. Carey, ed. (2009). Developmental-behavioral pediatrics (4th ed.). Philadelphia, PA: Saunders/Elsevier. p. 264. ISBN 9781416033707.
- ^ Saunders NR, Hellmann J, Farine D (October 2011). «Cerebral palsy and assisted conception». Journal of Obstetrics and Gynaecology Canada. 33 (10): 1038–1043. doi:10.1016/s1701-2163(16)35053-8. PMID 22014781.
- ^ «Erratum». Developmental Medicine and Child Neurology. 58 (3): 316. March 2016. doi:10.1111/dmcn.12662. PMID 26890023. S2CID 221682193.
- ^ Hallman M (April 2012). «Premature birth and diseases in premature infants: common genetic background?». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (Suppl 1): 21–24. doi:10.3109/14767058.2012.667600. PMID 22385349. S2CID 43101375.
- ^ Poets CF, Wallwiener D, Vetter K (October 2012). «Risks associated with delivering infants 2 to 6 weeks before term—a review of recent data». Deutsches Ärzteblatt International. 109 (43): 721–726. doi:10.3238/arztebl.2012.0721. PMC 3498472. PMID 23181136.
- ^ McIntyre S, Taitz D, Keogh J, Goldsmith S, Badawi N, Blair E (June 2013). «A systematic review of risk factors for cerebral palsy in children born at term in developed countries». Developmental Medicine and Child Neurology. 55 (6): 499–508. doi:10.1111/dmcn.12017. PMID 23181910. S2CID 3302180.
- ^ Ellenberg JH, Nelson KB (March 2013). «The association of cerebral palsy with birth asphyxia: a definitional quagmire». Developmental Medicine and Child Neurology. 55 (3): 210–216. doi:10.1111/dmcn.12016. PMID 23121164. S2CID 27475345.
- ^ Teng J, Chang T, Reyes C, Nelson KB (October 2012). «Placental weight and neurologic outcome in the infant: a review». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (10): 2082–2087. doi:10.3109/14767058.2012.671871. PMID 22394270. S2CID 26933806.
- ^ a b «Causes and Risk Factors of Cerebral Palsy | CDC». 15 December 2020.
- ^ Parolin Schnekenberg R, Perkins EM, Miller JW, Davies WI, D’Adamo MC, Pessia M, et al. (July 2015). «De novo point mutations in patients diagnosed with ataxic cerebral palsy». Brain. 138 (Pt 7): 1817–1832. doi:10.1093/brain/awv117. PMC 4572487. PMID 25981959.
[…]a putative new gene had been found in Case 7, which is currently under investigation and will be presented elsewhere.
- ^ Parolin Schnekenberg R, Perkins EM, Miller JW, Davies WI, D’Adamo MC, Pessia M, et al. (July 2015). «De novo point mutations in patients diagnosed with ataxic cerebral palsy». Brain. 138 (Pt 7): 1817–1832. doi:10.1093/brain/awv117. PMC 4572487. PMID 25981959.
Case 6 had cerebellar vermis hypoplasia and Case 7 had global cerebellar hypoplasia (vermis and cerebellar hemispheres), both these cases were clinically stable.
- ^ a b «Cerebral Palsy | NCBDDD | CDC». Cerebral Palsy Home | NCBDDD | CDC. Archived from the original on 21 April 2017. Retrieved 20 April 2017.
- ^ Kieffer S. «Cerebral Palsy». Johns Hopkins Pediatric Neurosurgery. Archived from the original on 30 September 2015. Retrieved 18 September 2015.
- ^ «Infection in the Newborn as a Cause of Cerebral Palsy, 12/2004». United Cerebral Palsy Research and Education Foundation (U.S.). Archived from the original on 29 July 2007. Retrieved 5 July 2007.
- ^ Bersani I, Thomas W, Speer CP (April 2012). «Chorioamnionitis—the good or the evil for neonatal outcome?». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (Suppl 1): 12–16. doi:10.3109/14767058.2012.663161. PMID 22309119. S2CID 11109172.
- ^ Mwaniki MK, Atieno M, Lawn JE, Newton CR (February 2012). «Long-term neurodevelopmental outcomes after intrauterine and neonatal insults: a systematic review». Lancet. 379 (9814): 445–452. doi:10.1016/s0140-6736(11)61577-8. PMC 3273721. PMID 22244654.
- ^ Pharoah PO (December 2005). «Causal hypothesis for some congenital anomalies». Twin Research and Human Genetics. 8 (6): 543–550. doi:10.1375/183242705774860141. PMID 16354495.
- ^ a b McIntyre S, Morgan C, Walker K, Novak I (November 2011). «Cerebral palsy—don’t delay». Developmental Disabilities Research Reviews. 17 (2): 114–129. doi:10.1002/ddrr.1106. PMID 23362031.
- ^ a b c d e f g h i Bosanquet M, Copeland L, Ware R, Boyd R (May 2013). «A systematic review of tests to predict cerebral palsy in young children». Developmental Medicine and Child Neurology. 55 (5): 418–426. doi:10.1111/dmcn.12140. PMID 23574478. S2CID 205066858.
- ^ a b c Lungu C, Hirtz D, Damiano D, Gross P, Mink JW (September 2016). «Report of a workshop on research gaps in the treatment of cerebral palsy». Neurology. 87 (12): 1293–1298. doi:10.1212/WNL.0000000000003116. PMC 5035982. PMID 27558377.
- ^ a b «Cerebral Palsy from Birth Injury». Birth Injury Guide. Retrieved 4 January 2022.
- ^ a b c d National Guideline Alliance (UK) (January 2017). Cerebral Palsy in Under 25s: Assessment and Management (PDF). London: National Institute for Health and Care Excellence (UK). ISBN 978-1-4731-2272-7. Archived (PDF) from the original on 10 September 2017. Retrieved 5 February 2017.
- ^ Graham D, Paget SP, Wimalasundera N (February 2019). «Current thinking in the health care management of children with cerebral palsy». The Medical Journal of Australia. 210 (3): 129–135. doi:10.5694/mja2.12106. PMID 30739332. S2CID 73424991.
- ^ McCay KD, Ho ES, Shum HP, Fehringer G, Marcroft C, Embleton ND (2020). «Unifying Person and Vehicle Re-identification». IEEE Access. 8 (1): 2169-3536. doi:10.1109/ACCESS.2020.2980269. S2CID 214623895.
- ^ McCay KD, Hu P, Shum HP, Woo WL, Marcroft C, Embleton ND, et al. (2022). «A Pose-Based Feature Fusion and Classification Framework for the Early Prediction of Cerebral Palsy in Infants». IEEE Transactions on Neural Systems and Rehabilitation Engineering. 30: 8–19. doi:10.1109/TNSRE.2021.3138185. PMID 34941512. S2CID 245457921.
- ^ Kolawole TM, Patel PJ, Mahdi AH (1989). «Computed tomographic (CT) scans in cerebral palsy (CP)». Pediatric Radiology. 20 (1–2): 23–27. doi:10.1007/BF02010628. PMID 2602010. S2CID 23604047.
- ^ Ashwal S, Russman BS, Blasco PA, Miller G, Sandler A, Shevell M, Stevenson R, et al. (Quality Standards Subcommittee of the American Academy of Neurology; Practice Committee of the Child Neurology Society) (March 2004). «Practice parameter: diagnostic assessment of the child with cerebral palsy: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society». Neurology. 62 (6): 851–863. doi:10.1212/01.WNL.0000117981.35364.1B. PMID 15037681.
- ^ a b c Rethlefsen SA, Ryan DD, Kay RM (October 2010). «Classification systems in cerebral palsy». The Orthopedic Clinics of North America. 41 (4): 457–467. doi:10.1016/j.ocl.2010.06.005. PMID 20868878.
- ^ a b c d Trabacca A, Vespino T, Di Liddo A, Russo L (September 2016). «Multidisciplinary rehabilitation for patients with cerebral palsy: improving long-term care». Journal of Multidisciplinary Healthcare. 9: 455–462. doi:10.2147/JMDH.S88782. PMC 5036581. PMID 27703369.
- ^ Ogoke C (2018). Clinical Classification of Cerebral Palsy. Retrieved 21 March 2021.
- ^ a b c Becher JG (2002). «Pediatric rehabilitation in children with cerebral palsy: general management, classification of motor disorders». Journal of Prosthetics and Orthotics. 14 (4): 143–149. doi:10.1097/00008526-200212000-00004. S2CID 71684103. Archived from the original on 2 February 2017. Retrieved 29 January 2017.
- ^ a b c d O’Shea TM (December 2008). «Diagnosis, treatment, and prevention of cerebral palsy». Clinical Obstetrics and Gynecology. 51 (4): 816–828. doi:10.1097/GRF.0b013e3181870ba7. PMC 3051278. PMID 18981805.
- ^ a b «Spastic cerebral palsy». Cerebral Palsy Alliance. 18 November 2015. Retrieved 4 March 2020.
- ^ Knierim J (2020). «Chapter 3: The motor cortex». Neuroscience online: An electronic textbook of the neurosciences from the University of Texas at Houston. Archived from the original on 17 December 2019. Retrieved 4 March 2020.
- ^ CDC (18 April 2018). «What is Cerebral Palsy? | CDC». Centers for Disease Control and Prevention. Retrieved 5 March 2020.
- ^ Nolan KW, Cole LL, Liptak GS (April 2006). «Use of botulinum toxin type A in children with cerebral palsy». Physical Therapy. 86 (4): 573–584. doi:10.1093/ptj/86.4.573. PMID 16579673.
- ^ McHale DP, Jackson AP, Levene MI, Corry P, Woods CG, Lench NJ, et al. (April 2000). «A gene for ataxic cerebral palsy maps to chromosome 9p12-q12». European Journal of Human Genetics. 8 (4): 267–272. doi:10.1038/sj.ejhg.5200445. PMID 10854109.
- ^ Cheney PD (1997). «Pathophysiology of the corticospinal system and basal ganglia in cerebral palsy». Mental Retardation and Developmental Disabilities Research Reviews. 3 (2): 153–167. doi:10.1002/(SICI)1098-2779(1997)3:2<153::AID-MRDD7>3.0.CO;2-S.
- ^ Straub K, Obrzut JE (2009). «Effects of cerebral palsy on neurophsyological function». Journal of Developmental and Physical Disabilities. 21 (2): 153–167. doi:10.1007/s10882-009-9130-3. S2CID 144152618.
- ^ Hou M, Zhao J, Yu R (2006). «Recent advances in dyskinetic cerebral palsy» (PDF). World J Pediatr. 2 (1): 23–28. Archived (PDF) from the original on 4 March 2016.
- ^ «Athetoid Dyskinetic». Swope, Rodante P.A. Archived from the original on 2 July 2013. Retrieved 31 October 2012.
- ^ Krägeloh-Mann I, Horber V (February 2007). «The role of magnetic resonance imaging in elucidating the pathogenesis of cerebral palsy: a systematic review». Developmental Medicine and Child Neurology. 49 (2): 144–151. doi:10.1111/j.1469-8749.2007.00144.x. PMID 17254004. S2CID 6967370.
- ^ Jones MW, Morgan E, Shelton JE, Thorogood C (2007). «Cerebral palsy: introduction and diagnosis (part I)». Journal of Pediatric Health Care. 21 (3): 146–152. doi:10.1016/j.pedhc.2006.06.007. PMID 17478303.
- ^ Rodda J, Graham HK (November 2001). «Classification of gait patterns in spastic hemiplegia and spastic diplegia: a basis for a management algorithm». European Journal of Neurology. 8 (Suppl 5): 98–108. doi:10.1046/j.1468-1331.2001.00042.x. PMID 11851738. S2CID 45860264.
- ^ a b Grunt S. «Geh-Orthesen bei Kindern mit Cerebralparese». Pediatrica. 18: 30–34.
- ^ Armand, Stephan (December 2016). «Gait analysis in children with cerebral palsy». Paediatrics and Child Health. 18 (9): 405–409. doi:10.1016/j.paed.2008.05.013. ISSN 1751-7222. PMC 5489760. PMID 28698802.
- ^ a b Shepherd E, Salam RA, Middleton P, Han S, Makrides M, McIntyre S, et al. (June 2018). «Neonatal interventions for preventing cerebral palsy: an overview of Cochrane Systematic Reviews». The Cochrane Database of Systematic Reviews. 6 (6): CD012409. doi:10.1002/14651858.CD012409. PMC 6457912. PMID 29926474.
- ^ a b Sartwelle TP, Johnston JC (June 2015). «Cerebral palsy litigation: change course or abandon ship». Journal of Child Neurology. 30 (7): 828–841. doi:10.1177/0883073814543306. PMC 4431995. PMID 25183322.
- ^ Crowther CA, Middleton PF, Voysey M, Askie L, Duley L, Pryde PG, et al. (October 2017). «Assessing the neuroprotective benefits for babies of antenatal magnesium sulphate: An individual participant data meta-analysis». PLOS Medicine. 14 (10): e1002398. doi:10.1371/journal.pmed.1002398. PMC 5627896. PMID 28976987.
- ^ Nguyen TM, Crowther CA, Wilkinson D, Bain E (February 2013). «Magnesium sulphate for women at term for neuroprotection of the fetus». The Cochrane Database of Systematic Reviews. 2 (2): CD009395. doi:10.1002/14651858.cd009395.pub2. PMID 23450601.
- ^ Zeng X, Xue Y, Tian Q, Sun R, An R (January 2016). «Effects and Safety of Magnesium Sulfate on Neuroprotection: A Meta-analysis Based on PRISMA Guidelines». Medicine. 95 (1): e2451. doi:10.1097/MD.0000000000002451. PMC 4706271. PMID 26735551.
- ^ a b Shih ST, Tonmukayakul U, Imms C, Reddihough D, Graham HK, Cox L, Carter R (June 2018). «Economic evaluation and cost of interventions for cerebral palsy: a systematic review». Developmental Medicine and Child Neurology. 60 (6): 543–558. doi:10.1111/dmcn.13653. PMID 29319155.
- ^ Atik A, Harding R, De Matteo R, Kondos-Devcic D, Cheong J, Doyle LW, Tolcos M (January 2017). «Caffeine for apnea of prematurity: Effects on the developing brain». Neurotoxicology. 58: 94–102. doi:10.1016/j.neuro.2016.11.012. PMID 27899304. S2CID 46761491.
- ^ a b c Shepherd E, Salam RA, Middleton P, Makrides M, McIntyre S, Badawi N, Crowther CA (August 2017). «Antenatal and intrapartum interventions for preventing cerebral palsy: an overview of Cochrane systematic reviews». The Cochrane Database of Systematic Reviews. 2017 (8): CD012077. doi:10.1002/14651858.CD012077.pub2. PMC 6483544. PMID 28786098.
- ^ Chang E (January 2015). «Preterm birth and the role of neuroprotection». BMJ. 350: g6661. doi:10.1136/bmj.g6661. PMID 25646630. S2CID 46429378.
- ^ Jacobs SE, Berg M, Hunt R, Tarnow-Mordi WO, Inder TE, Davis PG (January 2013). «Cooling for newborns with hypoxic ischaemic encephalopathy». The Cochrane Database of Systematic Reviews. 2013 (1): CD003311. doi:10.1002/14651858.CD003311.pub3. PMC 7003568. PMID 23440789.
- ^ a b c d e Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. (October 2013). «A systematic review of interventions for children with cerebral palsy: state of the evidence». Developmental Medicine and Child Neurology. 55 (10): 885–910. doi:10.1111/dmcn.12246. PMID 23962350. S2CID 1658072.
- ^ «Cerebral palsy – Treatment». www.nhs.uk. NHS Choices. Archived from the original on 6 February 2017. Retrieved 6 February 2017.
- ^ Hallman-Cooper JL, Rocha Cabrero F. Cerebral Palsy. [Updated 2022 Oct 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK538147/
- ^ Pennington L, Goldbart J, Marshall J (2004). «Speech and language therapy to improve the communication skills of children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2004 (2): CD003466. doi:10.1002/14651858.CD003466.pub2. PMC 8407241. PMID 15106204.
- ^ Blake SF, Logan S, Humphreys G, Matthews J, Rogers M, Thompson-Coon J, et al. (2015). «Sleep positioning systems for children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2015 (11): CD009257. doi:10.1002/14651858.CD009257.pub2. PMC 8761500. PMID 26524348.
- ^ Eddison N, Mulholland M, Chockalingam N (August 2017). «Do research papers provide enough information on design and material used in ankle foot orthoses for children with cerebral palsy? A systematic review». Journal of Children’s Orthopaedics. 11 (4): 263–271. doi:10.1302/1863-2548.11.160256. PMC 5584494. PMID 28904631.
- ^ Horst R (2005). Motorisches Strategietraining und PNF. Renata Horst. ISBN 978-3-13-151351-9.
- ^ Novacheck TF (2008). Orthoses for cerebral palsy. AAOS Atlas of Orthoses and Assistive Devices. Philadelphia: John D. Hsu, John W. Michael, John R. Fisk. pp. 487–500. ISBN 978-0-323-03931-4.
- ^ Muñoz S (2018). «The new generation of AFOs». The O&P EDGE. 11. Archived from the original on 6 June 2021. Retrieved 16 July 2021.
- ^ Kerkum YL, Harlaar J, Buizer AI, van den Noort JC, Becher JG, Brehm MA (May 2016). «An individual approach for optimizing ankle-foot orthoses to improve mobility in children with spastic cerebral palsy walking with excessive knee flexion». Gait & Posture. 46: 104–111. doi:10.1016/j.gaitpost.2016.03.001. PMID 27131186.
- ^ Kerkum YL (2016). «The effect of ankle foot orthosis stiffness on trunk movement and walking energy cost in cerebral palsy». Gait & Posture. 49: 2. doi:10.1016/j.gaitpost.2016.07.070. ISSN 0966-6362.
- ^ Meyns P, Kerkum YL, Brehm MA, Becher JG, Buizer AI, Harlaar J (May 2020). «Ankle foot orthoses in cerebral palsy: Effects of ankle stiffness on trunk kinematics, gait stability and energy cost of walking». European Journal of Paediatric Neurology. 26: 68–74. doi:10.1016/j.ejpn.2020.02.009. PMID 32147412. S2CID 212641072.
- ^ Waterval NF, Nollet F, Harlaar J, Brehm MA (October 2019). «Modifying ankle foot orthosis stiffness in patients with calf muscle weakness: gait responses on group and individual level». Journal of Neuroengineering and Rehabilitation. 16 (1): 120. doi:10.1186/s12984-019-0600-2. PMC 6798503. PMID 31623670.
- ^ Ploeger HE, Waterval NF, Nollet F, Bus SA, Brehm MA (2019). «Stiffness modification of two ankle-foot orthosis types to optimize gait in individuals with non-spastic calf muscle weakness — a proof-of-concept study». Journal of Foot and Ankle Research (in German). 12: 41. doi:10.1186/s13047-019-0348-8. PMC 6686412. PMID 31406508.
- ^ Jenks KM, de Moor J, van Lieshout EC, Maathuis KG, Keus I, Gorter JW (2007). «The effect of cerebral palsy on arithmetic accuracy is mediated by working memory, intelligence, early numeracy, and instruction time». Developmental Neuropsychology. 32 (3): 861–879. doi:10.1080/87565640701539758. hdl:1871/34092. PMID 17956186. S2CID 17795628.
- ^ a b Zaffuto-Sforza CD (February 2005). «Aging with cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 16 (1): 235–249. doi:10.1016/j.pmr.2004.06.014. PMID 15561553.
- ^ Wiegerink D, Roebroeck M, Bender J, Stam H, Cohen-Kettenis P (June 2011). «Sexuality of Young Adults with Cerebral Palsy: Experienced Limitations and Needs». Sexuality and Disability. 29 (2): 119–128. doi:10.1007/s11195-010-9180-6. PMC 3093545. PMID 21660090.
- ^ Hutton JL (June 2006). «Cerebral palsy life expectancy». Clinics in Perinatology. 33 (2): 545–555. doi:10.1016/j.clp.2006.03.016. PMID 16765736.
- ^ Strauss D, Brooks J, Rosenbloom L, Shavelle R (July 2008). «Life expectancy in cerebral palsy: an update». Developmental Medicine and Child Neurology. 50 (7): 487–493. doi:10.1111/j.1469-8749.2008.03000.x. PMID 18611196. S2CID 18315945.
- ^ Day SM, Reynolds RJ, Kush SJ (December 2015). «Extrapolating published survival curves to obtain evidence-based estimates of life expectancy in cerebral palsy». Developmental Medicine and Child Neurology. 57 (12): 1105–1118. doi:10.1111/dmcn.12849. PMID 26174088. S2CID 8895402.
- ^ «Australian Bureau of Statistics 2014, 3303.0 — Causes of Death, Australia — 1. Underlying causes of death (Australia), 2014, data cube: Excel spreadsheet». abs.gov.au/AUSSTATS. Archived from the original on 12 September 2016. Retrieved 14 August 2016.
- ^ a b Kent RM (2012). «Cerebral palsy». In Barnes M, Good D (eds.). Neurological Rehabilitation Handbook of Clinical Neurology. Oxford: Elsevier Science. pp. 443–459. ISBN 9780444595843.
- ^ Van Zelst BR, Miller MD, Russo R, Murchland S, Crotty M (September 2006). «Activities of daily living in children with hemiplegic cerebral palsy: a cross-sectional evaluation using the Assessment of Motor and Process Skills». Developmental Medicine and Child Neurology. 48 (9): 723–727. doi:10.1017/S0012162206001551. PMID 16904017.
- ^ Nieuwenhuijsen C, Donkervoort M, Nieuwstraten W, Stam HJ, Roebroeck ME (November 2009). «Experienced problems of young adults with cerebral palsy: targets for rehabilitation care». Archives of Physical Medicine and Rehabilitation. 90 (11): 1891–1897. doi:10.1016/j.apmr.2009.06.014. PMID 19887214.
- ^ Arnould C, Penta M, Thonnard JL (November 2007). «Hand impairments and their relationship with manual ability in children with cerebral palsy». Journal of Rehabilitation Medicine. 39 (9): 708–714. doi:10.2340/16501977-0111. PMID 17999009.
- ^ «Therapy and equipment needs of people with cerebral palsy and like disabilities in Australia». Australian Institute of Health and Welfare AIHW. 2006. Archived from the original on 30 March 2015. Disability Series. Cat. no. DIS 49. Canberra: AIHW.
- ^ «Patients & Clients: Learn About Occupational Therapy». The American Occupational Therapy Association, Inc. Retrieved 3 September 2019.
- ^ Fedrizzi E, Pagliano E, Andreucci E, Oleari G (February 2003). «Hand function in children with hemiplegic cerebral palsy: prospective follow-up and functional outcome in adolescence». Developmental Medicine and Child Neurology. 45 (2): 85–91. doi:10.1017/s0012162203000173. PMID 12578233.
- ^ Blesedell CE, Cohn ES, Schell AB. Willard and Spackman’s occupational therapy. Philadelphia, PA: Lippincott Williams & Wilkins; 2003. p. 705-709.
- ^ a b c Townsend E, Stanton S, Law M. Enabling occupation: An occupational therapy perspective. Canadian Association of Occupational Therapists Ottawa, ON, Canada; 1997/2002. p. 34.
- ^ Parham LD, Primeau LA (2008). «Play and occupational therapy». In Parham LD, Fazio LS (eds.). Play in occupational therapy for children (2nd ed.). St. Louis, Mo.: Mosby Elsevier. ISBN 978-0-323-02954-4. Archived from the original on 15 April 2015.
- ^ Miller S, Reid D (December 2003). «Doing play: competency, control, and expression». Cyberpsychology & Behavior. 6 (6): 623–632. doi:10.1089/109493103322725397. PMID 14756927.
- ^ Okimoto AM, Bundy A, Hanzlik J (2000). «Playfulness in children with and without disability: measurement and intervention». The American Journal of Occupational Therapy. 54 (1): 73–82. doi:10.5014/ajot.54.1.73. PMID 10686630.
- ^ Hestenes LL, Carroll DE (2000). «The play interactions of young children with and without disabilities: Individual and environmental influences». Early Childhood Research Quarterly. 15 (2): 229–246. doi:10.1016/s0885-2006(00)00052-1.
- ^ a b c d Missiuna C, Pollock N (October 1991). «Play deprivation in children with physical disabilities: the role of the occupational therapist in preventing secondary disability». The American Journal of Occupational Therapy. 45 (10): 882–888. doi:10.5014/ajot.45.10.882. PMID 1835302.
- ^ Howard L (December 1996). «A Comparison of Leisure-Time Activities between Able-Bodied Children and Children with Physical Disabilities». British Journal of Occupational Therapy. 59 (12): 570–574. doi:10.1177/030802269605901208. S2CID 147128197.
- ^ Rigby P, Schwellnus H (January 1999). «Occupational Therapy Decision Making Guidelines for Problems in Written Productivity». Physical & Occupational Therapy in Pediatrics. 19 (1): 5–27. doi:10.1080/J006v19n01_02.
- ^ Smith M, Sandberg AD, Larsson M (2009). «Reading and spelling in children with severe speech and physical impairments: a comparative study». International Journal of Language & Communication Disorders. 44 (6): 864–882. doi:10.1080/13682820802389873. PMID 19105069.
- ^ a b Pruitt DW, Tsai T (August 2009). «Common medical comorbidities associated with cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 20 (3): 453–467. doi:10.1016/j.pmr.2009.06.002. PMID 19643347.
- ^ Cassidy T (March 1996). «All work and no play: A focus on leisure time as a means for promoting health». Counselling Psychology Quarterly. 9 (1): 77–90. doi:10.1080/09515079608256354.
- ^ Carlon SL, Taylor NF, Dodd KJ, Shields N (April 2013). «Differences in habitual physical activity levels of young people with cerebral palsy and their typically developing peers: a systematic review». Disability and Rehabilitation. 35 (8): 647–655. doi:10.3109/09638288.2012.715721. PMID 23072296. S2CID 14115837.
- ^ Verschuren O, Peterson MD, Balemans AC, Hurvitz EA (August 2016). «Exercise and physical activity recommendations for people with cerebral palsy». Developmental Medicine and Child Neurology. 58 (8): 798–808. doi:10.1111/dmcn.13053. PMC 4942358. PMID 26853808.
- ^ Bloemen M, Van Wely L, Mollema J, Dallmeijer A, de Groot J (October 2017). «Evidence for increasing physical activity in children with physical disabilities: a systematic review». Developmental Medicine and Child Neurology. 59 (10): 1004–1010. doi:10.1111/dmcn.13422. PMID 28374442.
- ^ Bult MK, Verschuren O, Jongmans MJ, Lindeman E, Ketelaar M (September 2011). «What influences participation in leisure activities of children and youth with physical disabilities? A systematic review». Research in Developmental Disabilities. 32 (5): 1521–1529. doi:10.1016/j.ridd.2011.01.045. PMID 21388783.
- ^ Coleman N, Nemeth BA, LeBlanc CM (December 2018). «Increasing Wellness Through Physical Activity in Children With Chronic Disease and Disability». Current Sports Medicine Reports. 17 (12): 425–432. doi:10.1249/JSR.0000000000000548. PMID 30531459. S2CID 54473147.
- ^ a b King G, Law M, King S, Rosenbaum P, Kertoy MK, Young NL (2003). «A conceptual model of the factors affecting the recreation and leisure participation of children with disabilities». Physical & Occupational Therapy in Pediatrics. 23 (1): 63–90. doi:10.1080/J006v23n01_05. PMID 12703385. S2CID 25399342.
- ^ a b c Aitchison C (December 2003). «From leisure and disability to disability leisure: developing data, definitions and discourses». Disability & Society. 18 (7): 955–969. doi:10.1080/0968759032000127353. S2CID 145317559.
- ^ Imms C (2008). «Children with cerebral palsy participate: a review of the literature». Disability and Rehabilitation. 30 (24): 1867–1884. doi:10.1080/09638280701673542. PMID 19037780. S2CID 20859782.
- ^ a b c Specht J, King G, Brown E, Foris C (2002). «The importance of leisure in the lives of persons with congenital physical disabilities». The American Journal of Occupational Therapy. 56 (4): 436–445. doi:10.5014/ajot.56.4.436. PMID 12125833.
- ^ Frisch D, Msall ME (August 2013). «Health, functioning, and participation of adolescents and adults with cerebral palsy: a review of outcomes research». Developmental Disabilities Research Reviews. 18 (1): 84–94. doi:10.1002/ddrr.1131. PMID 23949832.
- ^ Lawrence H, Hills S, Kline N, Weems K, Doty A (November 2016). «Effectiveness of Exercise on Functional Mobility in Adults with Cerebral Palsy: A Systematic Review». Physiotherapy Canada. Physiotherapie Canada. 68 (4): 398–407. doi:10.3138/ptc.2015-38LHC. PMC 5125497. PMID 27904240.
- ^ Bagatell N, Chan D, Rauch KK, Thorpe D (January 2017). ««Thrust into adulthood»: Transition experiences of young adults with cerebral palsy». Disability and Health Journal. 10 (1): 80–86. doi:10.1016/j.dhjo.2016.09.008. PMID 27756560.
- ^ Alves-Nogueira AC, Silva N, McConachie H, Carona C (January 2020). «A systematic review on quality of life assessment in adults with cerebral palsy: Challenging issues and a call for research». Research in Developmental Disabilities. 96: 103514. doi:10.1016/j.ridd.2019.103514. PMID 31706133. S2CID 207936522.
- ^ Turk MA, Overeynder JC, Janicki MP, eds. (1995). Uncertain Future – Aging and Cerebral Palsy: Clinical Concerns (PDF) (Report). Albany: New York State Developmental Disabilities Planning Council. Archived from the original (PDF) on 3 August 2016.
- ^ Morgan P, McGinley J (17 April 2013). «Gait function and decline in adults with cerebral palsy: a systematic review». Disability and Rehabilitation. 36 (1): 1–9. doi:10.3109/09638288.2013.775359. PMID 23594053. S2CID 9709075.
- ^ Peterson MD, Gordon PM, Hurvitz EA (February 2013). «Chronic disease risk among adults with cerebral palsy: the role of premature sarcopoenia, obesity and sedentary behaviour». Obesity Reviews. 14 (2): 171–182. doi:10.1111/j.1467-789X.2012.01052.x. hdl:2027.42/96337. PMID 23094988. S2CID 26998110.
- ^ «CP and ageing». Scope. Archived from the original on 6 May 2016. Retrieved 24 December 2016.
- ^ a b Kembhavi G, Darrah J, Payne K, Plesuk D (July 2011). «Adults with a diagnosis of cerebral palsy: a mapping review of long-term outcomes». Developmental Medicine and Child Neurology. 53 (7): 610–614. doi:10.1111/j.1469-8749.2011.03914.x. PMID 21418196. S2CID 36859403.
- ^ Horsman M, Suto M, Dudgeon B, Harris SR (May 2010). «Ageing with cerebral palsy: psychosocial issues». Age and Ageing. 39 (3): 294–299. doi:10.1093/ageing/afq018. PMID 20178997.
- ^ Odding E, Roebroeck ME, Stam HJ (February 2006). «The epidemiology of cerebral palsy: incidence, impairments and risk factors». Disability and Rehabilitation. 28 (4): 183–191. doi:10.1080/09638280500158422. PMID 16467053. S2CID 45640254.
- ^ Johnson, Ann (September 2002). «Prevalence and characteristics of children with cerebral palsy in Europe». Developmental Medicine and Child Neurology. 44 (9): 633–640. doi:10.1111/j.1469-8749.2002.tb00848.x. PMID 12227618. S2CID 221649047.
- ^ Dalembert G, Brosco JP (June 2013). «Do politics affect prevalence? An overview and the case of cerebral palsy». Journal of Developmental and Behavioral Pediatrics. 34 (5): 369–374. doi:10.1097/DBP.0b013e31829455d8. PMID 23751888. S2CID 41883040.
- ^ «Proposed definition and classification of cerebral palsy, April 2005». Developmental Medicine & Child Neurology. 47 (8): 571. 2007. doi:10.1111/j.1469-8749.2005.tb01195.x. S2CID 221650919.[dead link]
- ^ McIntyre S, Goldsmith S, Webb A, Ehlinger V, Hollung SJ, McConnell K, et al. (December 2022). «Global prevalence of cerebral palsy: A systematic analysis». Developmental Medicine and Child Neurology. 64 (12): 1494–1506. doi:10.1111/dmcn.15346. PMC 9804547. PMID 35952356. S2CID 251516376.
- ^ Hirtz D, Thurman DJ, Gwinn-Hardy K, Mohamed M, Chaudhuri AR, Zalutsky R (January 2007). «How common are the «common» neurologic disorders?». Neurology. 68 (5): 326–337. doi:10.1212/01.wnl.0000252807.38124.a3. PMID 17261678. S2CID 208246679.
- ^ «The Definition and Classification of Cerebral Palsy». Developmental Medicine & Child Neurology. 49: 1–44. 28 June 2008. doi:10.1111/j.1469-8749.2007.00201.x. S2CID 221645066.
- ^ «Access Economics (2008) The Economic Impact of Cerebral Palsy in Australia in 2007. Access Economics, Canberra, ACT». Archived from the original on 21 November 2008.
- ^ Centers for Disease Control Prevention (CDC) (January 2004). «Economic costs associated with mental retardation, cerebral palsy, hearing loss, and vision impairment—United States, 2003». MMWR. Morbidity and Mortality Weekly Report. 53 (3): 57–59. PMID 14749614. Archived from the original on 19 September 2007. Retrieved 12 August 2007.
- ^ «Medicaid.gov: Self Directed Services». Medicaid. Archived from the original on 19 June 2017. Retrieved 19 June 2017.
- ^ «NIRAMAYA Ministry of Social Justice and Empowerment (MSJE)». thenationaltrust.gov.in. Archived from the original on 27 February 2017. Retrieved 27 February 2017.
- ^ Siva M, Nalinakanthi V (29 November 2015). «The Big Story. Financially able». The Hindu Business Line.
- ^ «Definition of Cerebral». 2021.
- ^ «Bell’s Palsy & Other Facial Nerve Problems». 2020.
- ^ Shevell M (December 2018). «Cerebral palsy to cerebral palsy spectrum disorder: Time for a name change?». Neurology: 10.1212/WNL.0000000000006747. doi:10.1212/WNL.0000000000006747. PMID 30568002. S2CID 58605985.
- ^ «Cerebral Palsy: a Guide for Care». Archived from the original on 17 July 2007. Retrieved 29 July 2007.
- ^ a b Brindle D (22 May 2002). «A very telling tale». The Guardian. London. Archived from the original on 29 July 2016. Retrieved 6 December 2016.
- ^ Zimmer B (5 February 2007). «A brief history of «spaz»«. Language Log. University of Pennsylvania. Archived from the original on 9 August 2007. Retrieved 29 July 2007.
- ^ Erickson G (22 May 2007). «DVD Savant Review: Goodbye CP». DVDtalk. Archived from the original on 30 April 2011.
- ^ Borah P (28 June 2011). «Movie with a twist». The Hindu. Chennai, India. Archived from the original on 27 September 2013.
- ^ Alawadhi N (26 March 2011). «Charting unexplored territory in Indian cinema». The Hindu. Chennai, India. Archived from the original on 27 September 2013.
- ^ Rai A (3 January 2012). «spandan» «Review of Marathi Film «SPANDAN»«. The Newsleak.in.[dead link]
- ^ «Vegitha, carving a niche for herself». The Deccan Chronicle. 7 June 2011. Archived from the original on 9 June 2011.
- ^ Champlin C (21 December 1989). «My Left Foot». Los Angeles Times.
- ^ «Being on Call the Midwife gave me the sense of being an actor in my own right». 16 February 2014. Archived from the original on 5 September 2015. Retrieved 12 August 2015.
- ^ Rovenstine D (20 September 2016). «Micah Fowler is the breakout star of Speechless». EntertainmentWeekly. Archived from the original on 24 September 2016. Retrieved 3 October 2016.
- ^ Kacala A (12 April 2019). «‘Special’: Groundbreaking new Netflix series stars gay man with cerebral palsy». NBC News. Retrieved 22 April 2019.
- ^ Houston M (12 February 2019). «‘I don’t think I’ve ever seen a disabled character written like that before’«. Sydney Morning Herald. Archived from the original on 16 October 2020. Retrieved 17 October 2020.
- ^ «Neil Young». Biography. Retrieved 17 October 2019.
- ^ «Neil Young Files for Divorce From Pegi Young». Rolling Stone. 26 August 2014. Retrieved 17 October 2019.
- ^ Michaels S (27 August 2014). «Neil Young files for divorce from Pegi, his wife of 36 years». The Guardian. ISSN 0261-3077. Retrieved 17 October 2019.
- ^ «The Driver — Nicolas Hamilton». nicolashamilton. Archived from the original on 3 June 2020. Retrieved 3 June 2020.
- ^ «Comedian Geri Jewell headlines diversity event». WMU News. 16 May 2002. Archived from the original on 7 March 2012. Retrieved 6 December 2010.
- ^ «Josh Blue wins «Last Comic Standing»«. Archived from the original on 28 June 2010. Retrieved 6 December 2010.
- ^ ««Last Comic Standing» biography». Archived from the original on 13 September 2010. Retrieved 6 December 2010.
- ^ «Jason Benetti Is Voice of Hope in Face of Cerebral Palsy». Archived from the original on 17 March 2013.
- ^ «Britain’s Got Talent: Jack Carroll to coin it with TV show, DVD and book deals». The Mirror. 8 June 2013. Archived from the original on 2 August 2013. Retrieved 1 August 2013.
- ^ «Pageant Is Her Crowning Achievement: Miss Iowa, In Las Vegas For Miss USA Pageant, Was Born With Cerebral Palsy». Las Vegas: CBS. 10 April 2008. Archived from the original on 6 November 2008. Retrieved 5 June 2010.
- ^ Lewis T (7 August 2011). «Comedian Francesca Martinez: «Surely I can’t be more unfunny than Patsy Palmer»«. The Guardian. London. Archived from the original on 3 February 2013.
- ^ «O’Hanlon heads to Melbourne in career-best form». Athletics Australia. 1 March 2012. Archived from the original on 24 April 2012. Retrieved 18 April 2012.
- ^ «HarperCollins Publishers India Ltd». Archived from the original on 11 June 2011.
- ^ Franks T (7 July 2008). «Jerusalem Diary: Monday 7 July». BBC News. Archived from the original on 11 May 2009.
- ^ Heydarpour R (21 November 2006). «The Comic Is Palestinian, the Jokes Bawdy». The New York Times. Archived from the original on 21 November 2012. Retrieved 22 March 2011.
Ms. Zayid, who has a home in Cliffside Park, N.J., recently returned from Hollywood, where she lived while working on developing her one-woman show.
- ^ IMEU (18 October 2013). «Maysoon Zayid: Actor and Comedian». Institute for Middle East Understanding. Archived from the original on 23 December 2016. Retrieved 8 December 2016.
- ^ «Celebrity Ambassadors». Archived from the original on 9 June 2015. Retrieved 18 June 2015.
- ^ «REVIEW: Zach Anner’s If at Birth You Don’t Succeed Is an Inspiring, Hilarious Memoir About One Man’s Life with Cerebral Palsy». People. 11 March 2016. Retrieved 6 December 2016.
- ^ ABS Staff (4 June 2014). «10 Celebrities With Physical Deformities You May Have Never Noticed». Atlanta Black Star. Archived from the original on 21 December 2016. Retrieved 8 December 2016.
- ^ «IPC Athletics Records». www.paralympic.org. Archived from the original on 10 September 2012. Retrieved 10 September 2012.
- ^ «Paralympics 2012: Cockroft wins first GB track gold». BBC Sport. 31 August 2012. Archived from the original on 1 September 2012. Retrieved 1 September 2012.
- ^ «Paralympics 2012: Hannah Cockroft wins second sprint gold». BBC Sport. 6 September 2012. Archived from the original on 8 September 2012. Retrieved 6 September 2012.
- ^ «Perspectives on Disability». Library Journal. Retrieved 29 April 2020.
- ^ «‘They wanted to drown me at birth — now I’m a poet’«. BBC News. 29 August 2020. Retrieved 4 November 2020.
- ^ «Lord of Glencoe Simon Stevens». simonstevens.com. Archived from the original on 19 May 2001. Retrieved 1 July 2021.
- ^ Leon, E.F. (1948). «The Imbecillitas of the Emperor Claudius», Transactions and Proceedings of the American Philological Association, 79 79–86.JSTOR 283354
- ^ «Cerebral Palsy Litigation». Radio National. 10 October 2005. Archived from the original on 22 February 2017. Retrieved 21 February 2017.
External links[edit]
- Cerebral palsy at Curlie
- Cerebral Palsy Information Page at NINDS
| Cerebral palsy | |
|---|---|
 |
|
| A child with cerebral palsy being assessed by a physician | |
| Specialty |
|
| Symptoms |
|
| Complications |
|
| Usual onset | Prenatal to early childhood[1] |
| Duration | Lifelong[1] |
| Causes | Often unknown[1] or brain injury |
| Risk factors |
|
| Diagnostic method | Based on child’s development[1] |
| Treatment |
|
| Medication |
|
| Frequency | 2.1 per 1,000[2] |
Cerebral palsy (CP) is a group of movement disorders that appear in early childhood.[1] Signs and symptoms vary among people and over time,[1][3] but include poor coordination, stiff muscles, weak muscles, and tremors.[1] There may be problems with sensation, vision, hearing, and speaking.[1] Often, babies with cerebral palsy do not roll over, sit, crawl or walk as early as other children of their age.[1] Other symptoms include seizures and problems with thinking or reasoning, each of which occur in about one-third of people with CP.[1] While symptoms may get more noticeable over the first few years of life, underlying problems do not worsen over time.[1]
Cerebral palsy is caused by abnormal development or damage to the parts of the brain that control movement, balance, and posture.[1][4] Most often, the problems occur during pregnancy, but they may also occur during childbirth or shortly after birth.[1] Often, the cause is unknown.[1] Risk factors include preterm birth, being a twin, certain infections during pregnancy, such as toxoplasmosis or rubella, exposure to methylmercury during pregnancy, a difficult delivery, and head trauma during the first few years of life, among others.[1] About 2% of cases are believed to be due to an inherited genetic cause.[5] A number of sub-types are classified, based on the specific problems present.[1] For example, those with stiff muscles have spastic cerebral palsy, those with poor coordination in locomotion have ataxic cerebral palsy, and those with writhing movements have dyskinetic cerebral palsy.[6] Diagnosis is based on the child’s development over time.[1] Blood tests and medical imaging may be used to rule out other possible causes.[1]
Some of the causes of CP are preventable through immunization of the mother, and through efforts to prevent head injuries in children such as through improved safety.[1] There is no known cure for CP, but supportive treatments, medication and surgery may help many individuals.[1] This may include physical therapy, occupational therapy and speech therapy.[1] Medications such as diazepam, baclofen and botulinum toxin may help relax stiff muscles.[1][7][8] Surgery may include lengthening muscles and cutting overly active nerves.[1] Often, external braces and Lycra splints and other assistive technology are helpful with mobility.[9][1] Some affected children can achieve near normal adult lives with appropriate treatment.[1] While alternative medicines are frequently used, there is no evidence to support their use.[1]
Cerebral palsy is the most common movement disorder in children.[10] It occurs in about 2.1 per 1,000 live births.[2] Cerebral palsy has been documented throughout history, with the first known descriptions occurring in the work of Hippocrates in the 5th century BCE.[11] Extensive study of the condition began in the 19th century by William John Little, after whom spastic diplegia was called «Little’s disease».[11] William Osler first named it «cerebral palsy» from the German zerebrale Kinderlähmung (cerebral child-paralysis).[12] A number of potential treatments are being examined, including stem cell therapy.[1] However, more research is required to determine if it is effective and safe.[1]
Signs and symptoms[edit]
Cerebral palsy is defined as «a group of permanent disorders of the development of movement and posture, causing activity limitation, that are attributed to non-progressive disturbances that occurred in the developing fetal or infant brain.»[13] While movement problems are the central feature of CP, difficulties with thinking, learning, feeling, communication and behavior often co-occur,[13] with 28% having epilepsy, 58% having difficulties with communication, at least 42% having problems with their vision, and 23–56% having learning disabilities.[14] Muscle contractions in people with cerebral palsy are commonly thought to arise from overactivation.[15]
Cerebral palsy is characterized by abnormal muscle tone, reflexes, or motor development and coordination. The neurological lesion is primary and permanent while orthopedic manifestations are secondary and progressive. In cerebral palsy unequal growth between muscle-tendon units and bone eventually leads to bone and joint deformities. At first, deformities are dynamic. Over time, deformities tend to become static, and joint contractures develop. Deformities in general and static deformities in specific (joint contractures) cause increasing gait difficulties in the form of tip-toeing gait, due to tightness of the Achilles tendon, and scissoring gait, due to tightness of the hip adductors. These gait patterns are among the most common gait abnormalities in children with cerebral palsy. However, orthopaedic manifestations of cerebral palsy are diverse.[16][17] Additionally, crouch gait (also described as knee flexion gait)[18] is prevalent among children who possess the ability to walk.[19] The effects of cerebral palsy fall on a continuum of motor dysfunction, which may range from slight clumsiness at the mild end of the spectrum to impairments so severe that they render coordinated movement virtually impossible at the other end of the spectrum.[20] Although most people with CP have problems with increased muscle tone, some have normal or low muscle tone. High muscle tone can either be due to spasticity or dystonia.[21]
Babies born with severe cerebral palsy often have irregular posture; their bodies may be either very floppy or very stiff. Birth defects, such as spinal curvature, a small jawbone, or a small head sometimes occur along with CP. Symptoms may appear or change as a child gets older. Babies born with cerebral palsy do not immediately present with symptoms.[22] Classically, CP becomes evident when the baby reaches the developmental stage at 6 to 9 months and is starting to mobilise, where preferential use of limbs, asymmetry, or gross motor developmental delay is seen.[17]
Drooling is common among children with cerebral palsy, which can have a variety of impacts including social rejection, impaired speaking, damage to clothing and books, and mouth infections.[23] It can additionally cause choking.[24]
An average of 55.5% of people with cerebral palsy experience lower urinary tract symptoms, more commonly excessive storage issues than voiding issues. Those with voiding issues and pelvic floor overactivity can deteriorate as adults and experience upper urinary tract dysfunction.[25]
Children with CP may also have sensory processing issues.[26] Adults with cerebral palsy have a higher risk of respiratory failure.[27]
Skeleton[edit]
For bones to attain their normal shape and size, they require the stresses from normal musculature.[28] People with cerebral palsy are at risk of low bone mineral density.[29] The shafts of the bones are often thin (gracile),[28] and become thinner during growth. When compared to these thin shafts (diaphyses), the centres (metaphyses) often appear quite enlarged (ballooning).[citation needed] Due to more than normal joint compression caused by muscular imbalances, articular cartilage may atrophy,[30]: 46 leading to narrowed joint spaces. Depending on the degree of spasticity, a person with CP may exhibit a variety of angular joint deformities. Because vertebral bodies need vertical gravitational loading forces to develop properly, spasticity and an abnormal gait can hinder proper or full bone and skeletal development. People with CP tend to be shorter in height than the average person because their bones are not allowed to grow to their full potential. Sometimes bones grow to different lengths, so the person may have one leg longer than the other.[31]
Children with CP are prone to low trauma fractures, particularly children with higher Gross Motor Function Classification System (GMFCS) levels who cannot walk. This further affects a child’s mobility, strength, and experience of pain, and can lead to missed schooling or child abuse suspicions.[28] These children generally have fractures in the legs, whereas non-affected children mostly fracture their arms in the context of sporting activities.[32]
Hip dislocation and ankle equinus or plantar flexion deformity are the two most common deformities among children with cerebral palsy. Additionally, flexion deformity of the hip and knee can occur. Torsional deformities of long bones such as the femur and tibia are also encountered, among others.[16][33] Children may develop scoliosis before the age of 10 – estimated prevalence of scoliosis in children with CP is between 21% and 64%.[34] Higher levels of impairment on the GMFCS are associated with scoliosis and hip dislocation.[16][35] Scoliosis can be corrected with surgery, but CP makes surgical complications more likely, even with improved techniques.[34] Hip migration can be managed by soft tissue procedures such as adductor musculature release. Advanced degrees of hip migration or dislocation can be managed by more extensive procedures such as femoral and pelvic corrective osteotomies. Both soft tissue and bony procedures aim at prevention of hip dislocation in the early phases or aim at hip containment and restoration of anatomy in the late phases of disease.[16] Equinus deformity is managed by conservative methods especially when dynamic. If fixed/static deformity ensues surgery may become mandatory.[33]
Growth spurts during puberty can make walking more difficult for people with CP.[36]
Eating[edit]
Due to sensory and motor impairments, those with CP may have difficulty preparing food, holding utensils, or chewing and swallowing. An infant with CP may not be able to suck, swallow or chew.[37] Gastro-oesophageal reflux is common in children with CP.[24] Children with CP may have too little or too much sensitivity around and in the mouth.[37] Poor balance when sitting, lack of control of the head, mouth, and trunk, not being able to bend the hips enough to allow the arms to stretch forward to reach and grasp food or utensils, and lack of hand-eye coordination can make self-feeding difficult.[38] Feeding difficulties are related to higher GMFCS levels.[24] Dental problems can also contribute to difficulties with eating.[38] Pneumonia is also common where eating difficulties exist, caused by undetected aspiration of food or liquids.[24] Fine finger dexterity, like that needed for picking up a utensil, is more frequently impaired than gross manual dexterity, like that needed for spooning food onto a plate.[39][non-primary source needed] Grip strength impairments are less common.[39][non-primary source needed]
Children with severe cerebral palsy, particularly with oropharyngeal issues, are at risk of undernutrition.[40] Triceps skin fold tests have been found to be a very reliable indicator of malnutrition in children with cerebral palsy.[38]
Language[edit]
Speech and language disorders are common in people with cerebral palsy. The incidence of dysarthria is estimated to range from 31% to 88%,[41] and around a quarter of people with CP are non-verbal.[42] Speech problems are associated with poor respiratory control, laryngeal and velopharyngeal dysfunction, and oral articulation disorders that are due to restricted movement in the oral-facial muscles. There are three major types of dysarthria in cerebral palsy: spastic, dyskinetic (athetotic), and ataxic.[43]
Early use of augmentative and alternative communication systems may assist the child in developing spoken language skills.[42] Overall language delay is associated with problems of cognition, deafness, and learned helplessness.[44] Children with cerebral palsy are at risk of learned helplessness and becoming passive communicators, initiating little communication.[44][45] Early intervention with this clientele, and their parents, often targets situations in which children communicate with others so that they learn that they can control people and objects in their environment through this communication, including making choices, decisions, and mistakes.[44]
Pain and sleep[edit]
Pain is common and may result from the inherent deficits associated with the condition, along with the numerous procedures children typically face.[46] When children with cerebral palsy are in pain, they experience worse muscle spasms.[47] Pain is associated with tight or shortened muscles, abnormal posture, stiff joints, unsuitable orthosis, etc. Hip migration or dislocation is a recognizable source of pain in CP children and especially in the adolescent population. Nevertheless, the adequate scoring and scaling of pain in CP children remains challenging.[16] Pain in CP has a number of different causes, and different pains respond to different treatments.[48]
There is also a high likelihood of chronic sleep disorders secondary to both physical and environmental factors.[49] Children with cerebral palsy have significantly higher rates of sleep disturbance than typically developing children.[50] Babies with cerebral palsy who have stiffness issues might cry more and be harder to put to sleep than non-disabled babies, or «floppy» babies might be lethargic.[51] Chronic pain is under-recognized in children with cerebral palsy,[52] even though three out of four children with cerebral palsy experience pain.[53] Adults with CP also experience more pain than the general population.[54]
Associated disorders[edit]
Associated disorders include intellectual disabilities, seizures, muscle contractures, abnormal gait, osteoporosis, communication disorders, malnutrition, sleep disorders, and mental health disorders, such as depression and anxiety.[55] In addition to these, functional gastrointestinal abnormalities contributing to bowel obstruction, vomiting, and constipation may also arise. Adults with cerebral palsy may have ischemic heart disease, cerebrovascular disease, cancer, and trauma more often.[56] Obesity in people with cerebral palsy or a more severe Gross Motor Function Classification System assessment in particular are considered risk factors for multimorbidity.[57] Other medical issues can be mistaken for being symptoms of cerebral palsy, and so may not be treated correctly.[58]
Related conditions can include apraxia, sensory impairments, urinary incontinence, fecal incontinence, or behavioural disorders.[citation needed]
Seizure management is more difficult in people with CP as seizures often last longer.[59] Epilepsy and asthma are common co-occurring diseases in adults with CP.[60] The associated disorders that co-occur with cerebral palsy may be more disabling than the motor function problems.[24]
Causes[edit]
Cerebral palsy is due to abnormal development or damage occurring to the developing brain.[61] This damage can occur during pregnancy, delivery, the first month of life, or less commonly in early childhood.[61] Structural problems in the brain are seen in 80% of cases, most commonly within the white matter.[61]
More than three-quarters of cases are believed to result from issues that occur during pregnancy.[61] Most children who are born with cerebral palsy have more than one risk factor associated with CP.[62]
While in certain cases there is no identifiable cause, typical causes include problems in intrauterine development (e.g. exposure to radiation, infection, fetal growth restriction), hypoxia of the brain (thrombotic events, placental insufficiency, umbilical cord prolapse), birth trauma during labor and delivery, and complications around birth or during childhood.[44][63][64]
In Africa birth asphyxia, high bilirubin levels, and infections in newborns of the central nervous system are main cause. Many cases of CP in Africa could be prevented with better resources available.[65]
Preterm birth[edit]
Between 40% and 50% of all children who develop cerebral palsy were born prematurely.[66] Most of these cases (75–90%) are believed to be due to issues that occur around the time of birth, often just after birth.[61] Multiple-birth infants are also more likely than single-birth infants to have CP.[67] They are also more likely to be born with a low birth weight.[citation needed]
In those who are born with a weight between 1 kg and 1.5 kg CP occurs in 6%.[2] Among those born before 28 weeks of gestation it occurs in 8%.[68][a] Genetic factors are believed to play an important role in prematurity and cerebral palsy generally.[69] In those who are born between 34 and 37 weeks the risk is 0.4% (three times normal).[70]
Term infants[edit]
In babies who are born at term risk factors include problems with the placenta, birth defects, low birth weight, breathing meconium into the lungs, a delivery requiring either the use of instruments or an emergency Caesarean section, birth asphyxia, seizures just after birth, respiratory distress syndrome, low blood sugar, and infections in the baby.[71]
As of 2013, it was unclear how much of a role birth asphyxia plays as a cause.[72] It is unclear if the size of the placenta plays a role.[73] As of 2015 it is evident that in advanced countries, most cases of cerebral palsy in term or near-term neonates have explanations other than asphyxia.[64]
Genetics[edit]
Autosomal recessive inheritance pattern
Cerebral palsy is not commonly considered a genetic disease. About 2% of all CP cases are expected to be inherited, with glutamate decarboxylase-1 being one of the possible enzymes involved.[5] Most inherited cases are autosomal recessive.[5] However, the vast majority of CP cases are connected to brain damage during birth and in infancy. There is a small percentage of CP cases caused by brain damage that stemmed from the prenatal period, which is estimated to be less than 5% of CP cases overall.[74] Moreover, there is no one reason why some CP cases come from prenatal brain damage, and it’s not known if those cases have a genetic basis.[74]
Cerebellar hypoplasia is sometimes genetic[75] and can cause ataxic cerebral palsy.[76]
Early childhood[edit]
After birth, other causes include toxins, severe jaundice,[77] lead poisoning, physical brain injury, stroke,[78] abusive head trauma, incidents involving hypoxia to the brain (such as near drowning), and encephalitis or meningitis.[77]
Others[edit]
Infections in the mother, even those not easily detected, can triple the risk of the child developing cerebral palsy.[79] Infection of the fetal membranes known as chorioamnionitis increases the risk.[80]
Intrauterine and neonatal insults (many of which are infectious) increase the risk.[81]
Rh blood type incompatibility can cause the mother’s immune system to attack the baby’s red blood cells.[1]
It has been hypothesised that some cases of cerebral palsy are caused by the death in very early pregnancy of an identical twin.[82]
Diagnosis[edit]
The diagnosis of cerebral palsy has historically rested on the person’s history and physical examination and is generally assessed at a young age. A general movements assessment, which involves measuring movements that occur spontaneously among those less than four months of age, appears most accurate.[83][84] Children who are more severely affected are more likely to be noticed and diagnosed earlier. Abnormal muscle tone, delayed motor development and persistence of primitive reflexes are the main early symptoms of CP.[38] Symptoms and diagnosis typically occur by the age of two,[85] although depending on factors like malformations and congenital issues,[86] persons with milder forms of cerebral palsy may be over the age of five, if not in adulthood, when finally diagnosed.[87] Cognitive assessments and medical observations are also useful to help confirm a diagnosis. Additionally, evaluations of the child’s mobility, speech and language, hearing, vision, gait, feeding and digestion are also useful to determine the extent of the disorder.[86] Early diagnosis and intervention are seen as being a key part of managing cerebral palsy.[88] Machine learning algorithms facilitate automatic early diagnosis, with methods such as deep neural network[89] and geometric feature fusion[90] producing high accuracy in predicting cerebral palsy from short videos. It is a developmental disability.[83]
Once a person is diagnosed with cerebral palsy, further diagnostic tests are optional. Neuroimaging with CT or MRI is warranted when the cause of a person’s cerebral palsy has not been established. An MRI is preferred over CT, due to diagnostic yield and safety. When abnormal, the neuroimaging study can suggest the timing of the initial damage. The CT or MRI is also capable of revealing treatable conditions, such as hydrocephalus, porencephaly, arteriovenous malformation, subdural hematomas and hygromas, and a vermian tumour[91] (which a few studies suggest are present 5–22% of the time). Furthermore, an abnormal neuroimaging study indicates a high likelihood of associated conditions, such as epilepsy and intellectual disability.[92] There is a small risk associated with sedating children to facilitate a clear MRI.[87]
The age when CP is diagnosed is important, but medical professionals disagree over the best age to make the diagnosis.[84] The earlier CP is diagnosed correctly, the better the opportunities are to provide the child with physical and educational help, but there might be a greater chance of confusing CP with another problem, especially if the child is 18 months of age or younger.[84] Infants may have temporary problems with muscle tone or control that can be confused with CP, which is permanent.[84] A metabolism disorder or tumors in the nervous system may appear to be CP; metabolic disorders, in particular, can produce brain problems that look like CP on an MRI.[1] Disorders that deteriorate the white matter in the brain and problems that cause spasms and weakness in the legs, may be mistaken for CP if they first appear early in life.[84] However, these disorders get worse over time, and CP does not[84] (although it may change in character).[1] In infancy it may not be possible to tell the difference between them.[84] In the UK, not being able to sit independently by the age of 8 months is regarded as a clinical sign for further monitoring.[87] Fragile X syndrome (a cause of autism and intellectual disability) and general intellectual disability must also be ruled out.[84] Cerebral palsy specialist John McLaughlin recommends waiting until the child is 36 months of age before making a diagnosis because, by that age, motor capacity is easier to assess.[84]
Classification[edit]
CP is classified by the types of motor impairment of the limbs or organs, and by restrictions to the activities an affected person may perform.[93] The Gross Motor Function Classification System-Expanded and Revised and the Manual Ability Classification System are used to describe mobility and manual dexterity in people with cerebral palsy, and recently the Communication Function Classification System, and the Eating and Drinking Ability Classification System have been proposed to describe those functions.[94] There are three main CP classifications by motor impairment: spastic, ataxic, and dyskinetic. Additionally, there is a mixed type that shows a combination of features of the other types. These classifications reflect the areas of the brain that are damaged.[95]
Cerebral palsy is also classified according to the topographic distribution of muscle spasticity.[96] This method classifies children as diplegic, (bilateral involvement with leg involvement greater than arm involvement), hemiplegic (unilateral involvement), or quadriplegic (bilateral involvement with arm involvement equal to or greater than leg involvement).[97][96]
Spastic[edit]
Spastic cerebral palsy is the type of cerebral palsy characterized by spasticity or high muscle tone often resulting in stiff, jerky movements.[98] Itself an umbrella term encompassing spastic hemiplegia, spastic diplegia, spastic quadriplegia and – where solely one limb or one specific area of the body is affected – spastic monoplegia. Spastic cerebral palsy affects the motor cortex[98] of the brain, a specific portion of the cerebral cortex responsible for the planning and completion of voluntary movement.[99] Spastic CP is the most common type of overall cerebral palsy, representing about 80% of cases.[100] Botulinum toxin is effective in decreasing spasticity.[7] It can help increase range of motion which could help mitigate CPs effects on the growing bones of children.[7] There may be an improvement in motor functions in the children and ability to walk. however, the main benefit derived from botulinum toxin A comes from its ability to reduce muscle tone and spasticity and thus prevent or delay the development of fixed muscle contractures.[7][101]
Ataxic[edit]
Ataxic cerebral palsy is observed in approximately 5–10% of all cases of cerebral palsy, making it the least frequent form of cerebral palsy.[102] Ataxic cerebral palsy is caused by damage to cerebellar structures.[103] Because of the damage to the cerebellum, which is essential for coordinating muscle movements and balance, patients with ataxic cerebral palsy experience problems in coordination, specifically in their arms, legs, and trunk. Ataxic cerebral palsy is known to decrease muscle tone.[104] The most common manifestation of ataxic cerebral palsy is intention (action) tremor, which is especially apparent when carrying out precise movements, such as tying shoe laces or writing with a pencil. This symptom gets progressively worse as the movement persists, making the hand shake. As the hand gets closer to accomplishing the intended task, the trembling intensifies, which makes it even more difficult to complete.[97]
Dyskinetic[edit]
Dyskinetic cerebral palsy (sometimes abbreviated DCP) is primarily associated with damage to the basal ganglia and the substantia nigra in the form of lesions that occur during brain development due to bilirubin encephalopathy and hypoxic-ischemic brain injury.[105] DCP is characterized by both hypertonia and hypotonia, due to the affected individual’s inability to control muscle tone.[97] Clinical diagnosis of DCP typically occurs within 18 months of birth and is primarily based upon motor function and neuroimaging techniques.[106][107]
Dyskinetic cerebral palsy is an extrapyramidal form of cerebral palsy.[108] Dyskinetic cerebral palsy can be divided into two different groups; choreoathetosis and dystonia.[97] Choreo-athetotic CP is characterized by involuntary movements, whereas dystonic CP is characterized by slow, strong contractions, which may occur locally or encompass the whole body.[96]
Mixed[edit]
Mixed cerebral palsy has symptoms of dyskinetic, ataxic and spastic CP appearing simultaneously, each to varying degrees, and both with and without symptoms of each. Mixed CP is the most difficult to treat as it is extremely heterogeneous and sometimes unpredictable in its symptoms and development over the lifespan.[citation needed]
Gait Classification[edit]
The Amsterdam Gait Classification facilitates the assessment of the gait pattern in CP patients. It helps to facilitate communication in the interdisciplinary team between those affected, doctors, physiotherapists and orthotists.
In patients with spastic hemiplegia or diplegia, various gait patterns can be observed, the exact form of which can only be described with the help of complex gait analysis systems. In order to facilitate interdisciplinary communication in the interdisciplinary team between those affected, doctors, physiotherapists and orthotists, a simple description of the gait pattern is useful. J. Rodda and H. K. Graham already described in 2001 how gait patterns of CP patients can be more easily recognized and defined gait types which they compared in a classification. They also described that gait patterns can vary with age.[109] Building on this, the Amsterdam Gait Classification was developed at the free university in Amsterdam, the VU medisch centrum. A special feature of this classification is that it makes different gait patterns very easy to recognize and can be used in CP patients in whom only one leg and both legs are affected. According to the Amsterdam Gait Classification, five gait types are described. To assess the gait pattern, the patient is viewed visually or via a video recording from the side of the leg to be assessed. At the point in time at which the leg to be viewed is in mid stance and the leg not to be viewed is in mid swing, the knee angle and the contact of the foot with the ground are assessed on the one hand.[110]
Classification of the gait pattern according to the Amsterdam Gait Classification: In gait type 1, the knee angle is normal and the foot contact is complete. In gait type 2, the knee angle is hyperextended and the foot contact is complete. In gait type 3, the knee angle is hyperextended and foot contact is incomplete (only on the forefoot). In gait type 4, the knee angle is bent and foot contact is incomplete (only on the forefoot). With gait type 5, the knee angle is bent and the foot contact is complete.[110]
Gait types 5 is also known as crouch gait.[111]
Prevention[edit]
Because the causes of CP are varied, a broad range of preventive interventions have been investigated.[112]
Electronic fetal monitoring has not helped to prevent CP, and in 2014 the American College of Obstetricians and Gynecologists, the Royal Australian and New Zealand College of Obstetricians and Gynaecologists, and the Society of Obstetricians and Gynaecologists of Canada have acknowledged that there are no long-term benefits of electronic fetal monitoring.[64] Before this, electronic fetal monitoring was widely used to prop up obstetric litigation.[113]
In those at risk of an early delivery, magnesium sulphate appears to decrease the risk of cerebral palsy.[114] It is unclear if it helps those who are born at term.[115] In those at high risk of preterm labor a review found that moderate to severe CP was reduced by the administration of magnesium sulphate, and that adverse effects on the babies from the magnesium sulphate were not significant. Mothers who received magnesium sulphate could experience side effects such as respiratory depression and nausea.[116] However, guidelines for the use of magnesium sulfate in mothers at risk of preterm labour are not strongly adhered to.[117] Caffeine is used to treat apnea of prematurity and reduces the risk of cerebral palsy in premature babies, but there are also concerns of long term negative effects.[118] A moderate quality level of evidence indicates that giving women antibiotics during preterm labor before her membranes have ruptured (water is not yet not broken) may increase the risk of cerebral palsy for the child.[119] Additionally, for preterm babies for whom there is a chance of fetal compromise, allowing the birth to proceed rather than trying to delay the birth may lead to an increased risk of cerebral palsy in the child.[119] Corticosteroids are sometimes taken by pregnant women expecting a preterm birth to provide neuroprotection to their baby.[120] Taking corticosteroids during pregnancy is shown to have no significant correlation with developing cerebral palsy in preterm births.[119]
Cooling high-risk full-term babies shortly after birth may reduce disability,[121] but this may only be useful for some forms of the brain damage that causes CP.[85]
Management[edit]
Researchers are developing an electrical stimulation device specifically for children with cerebral palsy, who have foot drop, which causes tripping when walking.
Over time, the approach to CP management has shifted away from narrow attempts to fix individual physical problems – such as spasticity in a particular limb – to making such treatments part of a larger goal of maximizing the person’s independence and community engagement.[122]: 886 However, the evidence base for the effectiveness of intervention programs reflecting the philosophy of independence has not yet caught up: effective interventions for body structures and functions have a strong evidence base, but evidence is lacking for effective interventions targeted toward participation, environment, or personal factors.[122] There is also no good evidence to show that an intervention that is effective at the body-specific level will result in an improvement at the activity level or vice versa.[122] Although such cross-over benefit might happen, not enough high-quality studies have been done to demonstrate it.[122]
Because cerebral palsy has «varying severity and complexity» across the lifespan,[94] it can be considered a collection of conditions for management purposes.[85] A multidisciplinary approach for cerebral palsy management is recommended,[94] focusing on «maximising individual function, choice and independence» in line with the International Classification of Functioning, Disability and Health’s goals.[87] The team may include a paediatrician, a health visitor, a social worker, a physiotherapist, an orthotist, a speech and language therapist, an occupational therapist, a teacher specialising in helping children with visual impairment, an educational psychologist, an orthopaedic surgeon, a neurologist and a neurosurgeon.[123]
Various forms of therapy are available to people living with cerebral palsy as well as caregivers and parents. Treatment may include one or more of the following: physical therapy; occupational therapy; speech therapy; water therapy; drugs to control seizures, alleviate pain, or relax muscle spasms (e.g. benzodiazepines); surgery to correct anatomical abnormalities or release tight muscles; braces and other orthotic devices; rolling walkers; and communication aids such as computers with attached voice synthesisers.[citation needed]
Surgical intervention in CP children may include various orthopaedic or neurological surgeries to improve quality of life, such as tendon releases, hip rotation, spinal fusion, (selective dorsal rhizotomy) or placement of an intrathecal baclofen pump.[19][122][124]
A Cochrane review published in 2004 found a trend toward the benefit of speech and language therapy for children with cerebral palsy but noted the need for high-quality research.[125] A 2013 systematic review found that many of the therapies used to treat CP have no good evidence base; the treatments with the best evidence are medications (anticonvulsants, botulinum toxin, bisphosphonates, diazepam), therapy (bimanual training, casting, constraint-induced movement therapy, context-focused therapy, fitness training, goal-directed training, hip surveillance, home programmes, occupational therapy after botulinum toxin, pressure care) and surgery. There is also research on whether the sleeping position might improve hip migration, but there are not yet high-quality evidence studies to support that theory.[126] Research papers also call for an agreed consensus on outcome measures which will allow researchers to cross-reference research. Also, the terminology used to describe orthoses[127] needs to be standardised to ensure studies can be reproduced and readily compared and evaluated.
Orthotics in the concept of therapy[edit]
Child with cerebral palsy and orthotics with adjustable functional elements to improve safety when standing and walking.
To improve the gait pattern, orthotics can be included in the therapy concept. An orthosis can support physiotherapeutic treatment in setting the right motor impulses in order to create new cerebral connections.[128] The orthosis must meet the requirements of the medical prescription. In addition, the orthosis must be designed by the orthotist in such a way that it achieves the effectiveness of the necessary levers, matching the gait pattern, in order to support the proprioceptive approaches of physiotherapy. The characteristics of the stiffness of the orthosis shells and the adjustable dynamics in the ankle joint are important elements of the orthosis to be considered.[129] Due to these requirements, the development of orthoses has changed significantly in recent years, especially since around 2010. At about the same time, care concepts were developed that deal intensively with the orthotic treatment of the lower extremities in cerebral palsy.[130] Modern materials and new functional elements enable the rigidity to be specifically adapted to the requirements that fits to the gait pattern of the CP patient.[131] The adjustment of the stiffness has a decisive influence on the gait pattern and on the energy cost of walking.[132][133][134] It is of great advantage if the stiffness of the orthosis can be adjusted separately from one another via resistances of the two functional elements in the two directions of movement, dorsiflexion and plantar flexion.[135]
Prognosis[edit]
CP is not a progressive disorder (meaning the brain damage does not worsen), but the symptoms can become more severe over time. A person with the disorder may improve somewhat during childhood if he or she receives extensive care, but once bones and musculature become more established, orthopedic surgery may be required. People with CP can have varying degrees of cognitive impairment or none whatsoever. The full intellectual potential of a child born with CP is often not known until the child starts school. People with CP are more likely to have learning disorders but have normal intelligence. Intellectual level among people with CP varies from genius to intellectually disabled, as it does in the general population, and experts have stated that it is important not to underestimate the capabilities of a person with CP and to give them every opportunity to learn.[136]
The ability to live independently with CP varies widely, depending partly on the severity of each person’s impairment and partly on the capability of each person to self-manage the logistics of life. Some individuals with CP require personal assistant services for all activities of daily living. Others only need assistance with certain activities, and still others do not require any physical assistance. But regardless of the severity of a person’s physical impairment, a person’s ability to live independently often depends primarily on the person’s capacity to manage the physical realities of his or her life autonomously. In some cases, people with CP recruit, hire, and manage a staff of personal care assistants (PCAs). PCAs facilitate the independence of their employers by assisting them with their daily personal needs in a way that allows them to maintain control over their lives.[citation needed]
Puberty in young adults with cerebral palsy may be precocious or delayed. Delayed puberty is thought to be a consequence of nutritional deficiencies.[137] There is currently no evidence that CP affects fertility, although some of the secondary symptoms have been shown to affect sexual desire and performance.[138] Adults with CP were less likely to get routine reproductive health screening as of 2005. Gynecological examinations may have to be performed under anesthesia due to spasticity, and equipment is often not accessible. Breast self-examination may be difficult, so partners or carers may have to perform it. Women with CP reported higher levels of spasticity and urinary incontinence during menstruation in a study. Men with CP have higher levels of cryptorchidism at the age of 21.[137]
CP can significantly reduce a person’s life expectancy, depending on the severity of their condition and the quality of care they receive.[61][139] 5–10% of children with CP die in childhood, particularly where seizures and intellectual disability also affect the child.[94] The ability to ambulate, roll, and self-feed has been associated with increased life expectancy.[140] While there is a lot of variation in how CP affects people, it has been found that «independent gross motor functional ability is a very strong determinant of life expectancy».[141] According to the Australian Bureau of Statistics, in 2014, 104 Australians died of cerebral palsy.[142] The most common causes of death in CP are related to respiratory causes, but in middle age cardiovascular issues and neoplastic disorders become more prominent.[143]
Self-care[edit]
For many children with CP, parents are heavily involved in self-care activities. Self-care activities, such as bathing, dressing, and grooming, can be difficult for children with CP, as self-care depends primarily on the use of the upper limbs.[144] For those living with CP, impaired upper limb function affects almost 50% of children and is considered the main factor contributing to decreased activity and participation.[145] As the hands are used for many self-care tasks, sensory and motor impairments of the hands make daily self-care more difficult.[39][non-primary source needed][146] Motor impairments cause more problems than sensory impairments.[39] The most common impairment is that of finger dexterity, which is the ability to manipulate small objects with the fingers.[39] Compared to other disabilities, people with cerebral palsy generally need more help in performing daily tasks.[147] Occupational therapists are healthcare professionals that help individuals with disabilities gain or regain their independence through the use of meaningful activities.[148]
Productivity[edit]
The effects of sensory, motor, and cognitive impairments affect self-care occupations in children with CP and productivity occupations. Productivity can include but is not limited to, school, work, household chores, or contributing to the community.[149]
Play is included as a productive occupation as it is often the primary activity for children.[150] If play becomes difficult due to a disability, like CP, this can cause problems for the child.[151] These difficulties can affect a child’s self-esteem.[151] In addition, the sensory and motor problems experienced by children with CP affect how the child interacts with their surroundings, including the environment and other people.[151] Not only do physical limitations affect a child’s ability to play, the limitations perceived by the child’s caregivers and playmates also affect the child’s play activities.[152] Some children with disabilities spend more time playing by themselves.[153] When a disability prevents a child from playing, there may be social, emotional and psychological problems,[154] which can lead to increased dependence on others, less motivation, and poor social skills.[155]
In school, students are asked to complete many tasks and activities, many of which involve handwriting. Many children with CP have the capacity to learn and write in the school environment.[156] However, students with CP may find it difficult to keep up with the handwriting demands of school and their writing may be difficult to read.[156] In addition, writing may take longer and require greater effort on the student’s part.[156] Factors linked to handwriting include postural stability, sensory and perceptual abilities of the hand, and writing tool pressure.[156]
Speech impairments may be seen in children with CP depending on the severity of brain damage.[157] Communication in a school setting is important because communicating with peers and teachers is very much a part of the «school experience» and enhances social interaction. Problems with language or motor dysfunction can lead to underestimating a student’s intelligence.[158] In summary, children with CP may experience difficulties in school, such as difficulty with handwriting, carrying out school activities, communicating verbally, and interacting socially.[citation needed]
Leisure[edit]
Leisure activities can have several positive effects on physical health, mental health, life satisfaction, and psychological growth for people with physical disabilities like CP.[159] Common benefits identified are stress reduction, development of coping skills, companionship, enjoyment, relaxation and a positive effect on life satisfaction.[160] In addition, for children with CP, leisure appears to enhance adjustment to living with a disability.[160]
Leisure can be divided into structured (formal) and unstructured (informal) activities.[161] Children and teens with CP engage in less habitual physical activity than their peers.[162] Children with CP primarily engage in physical activity through therapies aimed at managing their CP, or through organized sport for people with disabilities.[163] It is difficult to sustain behavioural change in terms of increasing physical activity of children with CP.[164] Gender, manual dexterity, the child’s preferences, cognitive impairment and epilepsy were found to affect children’s leisure activities, with manual dexterity associated with more leisure activity.[165] Although leisure is important for children with CP, they may have difficulties carrying out leisure activities due to social and physical barriers.[citation needed]
Children with cerebral palsy may face challenges when it comes to participating in sports. This comes with being discouraged from physical activity because of these perceived limitations imposed by their medical condition.[166]
Participation and barriers[edit]
Participation is involvement in life situations and everyday activities.[167] Participation includes self-care, productivity, and leisure. In fact, communication, mobility, education, home life, leisure, and social relationships require participation, and indicate the extent to which children function in their environment.[167] Barriers can exist on three levels: micro, meso, and macro.[168] First, the barriers at the micro level involve the person.[168] Barriers at the micro level include the child’s physical limitations (motor, sensory and cognitive impairments) or their subjective feelings regarding their ability to participate.[169] For example, the child may not participate in group activities due to lack of confidence. Second, barriers at the meso level include the family and community.[168] These may include negative attitudes of people toward disability or lack of support within the family or in the community.[170] One of the main reasons for this limited support appears to be the result of a lack of awareness and knowledge regarding the child’s ability to engage in activities despite his or her disability.[170] Third, barriers at the macro level incorporate the systems and policies that are not in place or hinder children with CP. These may be environmental barriers to participation such as architectural barriers, lack of relevant assistive technology, and transportation difficulties due to limited wheelchair access or public transit that can accommodate children with CP.[170] For example, a building without an elevator can prevent the child from accessing higher floors.[citation needed]
A 2013 review stated that outcomes for adults with cerebral palsy without intellectual disability in the 2000s were that «60–80% completed high school, 14–25% completed college, up to 61% were living independently in the community, 25–55% were competitively employed, and 14–28% were involved in long term relationships with partners or had established families».[171] Adults with cerebral palsy may not seek physical therapy due to transport issues, financial restrictions and practitioners not feeling like they know enough about cerebral palsy to take people with CP on as clients.[172]
A study in young adults (18–34) on transitioning to adulthood found that their concerns were physical health care and understanding their bodies, being able to navigate and use services and supports successfully, and dealing with prejudices. A feeling of being «thrust into adulthood» was common in the study.[173]
Aging[edit]
Children with CP may not successfully transition into using adult services because they are not referred to one upon turning 18, and may decrease their use of services.[143] Quality of life outcomes tend to decline for adults with cerebral palsy.[174] Because children with cerebral palsy are often told that it is a non-progressive disease, they may be unprepared for the greater effects of the aging process as they head into their 30s.[175] Young adults with cerebral palsy experience problems with aging that non-disabled adults experience «much later in life».[30]: 42 25% or more adults with cerebral palsy who can walk experience increasing difficulties walking with age.[176] Hand function does not seem to have similar declines.[60] Chronic disease risk, such as obesity, is also higher among adults with cerebral palsy than the general population.[177] Common problems include increased pain, reduced flexibility, increased spasms and contractures, post-impairment syndrome[178] and increasing problems with balance.[41] Increased fatigue is also a problem.[179] When adulthood and cerebral palsy is discussed, as of 2011, it is not discussed in terms of the different stages of adulthood.[179]
Like they did in childhood, adults with cerebral palsy experience psychosocial issues related to their CP, chiefly the need for social support, self-acceptance, and acceptance by others. Workplace accommodations may be needed to enhance continued employment for adults with CP as they age. Rehabilitation or social programs that include salutogenesis may improve the coping potential of adults with CP as they age.[180]
Epidemiology[edit]
Cerebral palsy occurs in about 2.1 per 1000 live births.[2] In those born at term rates are lower at 1 per 1000 live births.[61] Within a population it may occur more often in poorer people.[181] The rate is higher in males than in females; in Europe it is 1.3 times more common in males.[182]
There was a «moderate, but significant» rise in the prevalence of CP between the 1970s and 1990s. This is thought to be due to a rise in low birth weight of infants and the increased survival rate of these infants. The increased survival rate of infants with CP in the 1970s and 80s may be indirectly due to the disability rights movement challenging perspectives around the worth of infants with a disability, as well as the Baby Doe Law.[183]
As of 2005, advances in the care of pregnant mothers and their babies have not resulted in a noticeable decrease in CP. This is generally attributed to medical advances in areas related to the care of premature babies (which results in a greater survival rate). Only the introduction of quality medical care to locations with less-than-adequate medical care has shown any decreases. The incidence of CP increases with premature or very low-weight babies regardless of the quality of care.[184] As of 2016, there is a suggestion that both incidence and severity are slightly decreasing – more research is needed to find out if this is significant, and if so, which interventions are effective.[112] It has been found that high-income countries have lower rates of children born with cerebral palsy than low or middle-income countries.[185]
Prevalence of cerebral palsy is best calculated around the school entry age of about six years; the prevalence in the U.S. is estimated to be 2.4 out of 1000 children.[186]
History[edit]
Cerebral palsy has affected humans since antiquity. A decorated grave marker dating from around the 15th to 14th century BCE shows a figure with one small leg and using a crutch, possibly due to cerebral palsy. The oldest likely physical evidence of the condition comes from the mummy of Siptah, an Egyptian Pharaoh who ruled from about 1196 to 1190 BCE and died at about 20 years of age. The presence of cerebral palsy has been suspected due to his deformed foot and hands.[11]
The medical literature of the ancient Greeks discusses paralysis and weakness of the arms and legs; the modern word palsy comes from the Ancient Greek words παράλυση or πάρεση, meaning paralysis or paresis respectively. The works of the school of Hippocrates (460–c. 370 BCE), and the manuscript On the Sacred Disease in particular, describe a group of problems that matches up very well with the modern understanding of cerebral palsy. The Roman Emperor Claudius (10 BCE–54 CE) is suspected of having CP, as historical records describe him as having several physical problems in line with the condition. Medical historians have begun to suspect and find depictions of CP in much later art. Several paintings from the 16th century and later show individuals with problems consistent with it, such as Jusepe de Ribera’s 1642 painting The Clubfoot.[11]
The modern understanding of CP as resulting from problems within the brain began in the early decades of the 1800s with a number of publications on brain abnormalities by Johann Christian Reil, Claude François Lallemand and Philippe Pinel. Later physicians used this research to connect problems in the brain with specific symptoms. The English surgeon William John Little (1810–1894) was the first person to study CP extensively. In his doctoral thesis he stated that CP was a result of a problem around the time of birth. He later identified a difficult delivery, a preterm birth and perinatal asphyxia in particular as risk factors. The spastic diplegia form of CP came to be known as Little’s disease.[11] At around this time, a German surgeon was also working on cerebral palsy, and distinguished it from polio.[187] In the 1880s British neurologist William Gowers built on Little’s work by linking paralysis in newborns to difficult births. He named the problem «birth palsy» and classified birth palsies into two types: peripheral and cerebral.[11]
Working in the US in the 1880s, Canadian-born physician William Osler (1849–1919) reviewed dozens of CP cases to further classify the disorders by the site of the problems on the body and by the underlying cause. Osler made further observations tying problems around the time of delivery with CP, and concluded that problems causing bleeding inside the brain were likely the root cause. Osler also suspected polioencephalitis as an infectious cause. Through the 1890s, scientists commonly confused CP with polio.[11]
Before moving to psychiatry, Austrian neurologist Sigmund Freud (1856–1939) made further refinements to the classification of the disorder. He produced the system still being used today. Freud’s system divides the causes of the disorder into problems present at birth, problems that develop during birth, and problems after birth. Freud also made a rough correlation between the location of the problem inside the brain and the location of the affected limbs on the body and documented the many kinds of movement disorders.[11]
In the early 20th century, the attention of the medical community generally turned away from CP until orthopedic surgeon Winthrop Phelps became the first physician to treat the disorder. He viewed CP from a musculoskeletal perspective instead of a neurological one. Phelps developed surgical techniques for operating on the muscles to address issues such as spasticity and muscle rigidity. Hungarian physical rehabilitation practitioner András Pető developed a system to teach children with CP how to walk and perform other basic movements. Pető’s system became the foundation for conductive education, widely used for children with CP today. Through the remaining decades, physical therapy for CP has evolved, and has become a core component of the CP management program.[11]
In 1997, Robert Palisano et al. introduced the Gross Motor Function Classification System (GMFCS) as an improvement over the previous rough assessment of limitation as either mild, moderate, or severe.[93] The GMFCS grades limitation based on observed proficiency in specific basic mobility skills such as sitting, standing, and walking, and takes into account the level of dependency on aids such as wheelchairs or walkers. The GMFCS was further revised and expanded in 2007.[93]
Society and culture[edit]
Economic impact[edit]
It is difficult to directly compare the cost and cost-effectiveness of interventions to prevent cerebral palsy or the cost of interventions to manage CP.[117] Access Economics has released a report on the economic impact of cerebral palsy in Australia. The report found that, in 2007, the financial cost of cerebral palsy (CP) in Australia was A$1.47 billion or 0.14% of GDP.[188] Of this:
- A$1.03 billion (69.9%) was productivity lost due to lower employment, absenteeism, and premature death of Australians with CP
- A$141 million (9.6%) was the DWL from transfers including welfare payments and taxation forgone
- A$131 million (9.0%) was other indirect costs such as direct program services, aides and home modifications, and the bringing-forward of funeral costs
- A$129 million (8.8%) was the value of the informal care for people with CP
- A$40 million (2.8%) was direct health system expenditure
The value of lost well-being (disability and premature death) was a further A$2.4 billion.[citation needed]
In per capita terms, this amounts to a financial cost of A$43,431 per person with CP per annum. Including the value of lost well-being, the cost is over $115,000 per person per annum.[citation needed]
Individuals with CP bear 37% of the financial costs, and their families and friends bear a further 6%. The federal government bears around one-third (33%) of the financial costs (mainly through taxation revenues forgone and welfare payments). State governments bear under 1% of the costs, while employers bear 5% and the rest of society bears the remaining 19%. If the burden of disease (lost well-being) is included, individuals bear 76% of the costs.[citation needed]
The average lifetime cost for people with CP in the US is US$921,000 per individual, including lost income.[189]
In the United States, many states allow Medicaid beneficiaries to use their Medicaid funds to hire their own PCAs, instead of forcing them to use institutional or managed care.[190]
In India, the government-sponsored program called «NIRAMAYA» for the medical care of children with neurological and muscular deformities has proved to be an ameliorating economic measure for persons with such disabilities.[191] It has shown that persons with mental or physically debilitating congenital disabilities can lead better lives if they have financial independence.[192]
Use of the term[edit]
«Cerebral» means «of, or pertaining to, the cerebrum or the brain»[193] and «palsy» means «paralysis, generally partial, whereby a local body area is incapable of voluntary movement».[194] It has been proposed to change the name to «cerebral palsy spectrum disorder» to reflect the diversity of presentations of CP.[195]
Many people would rather be referred to as a person with a disability (people-first language) instead of as «handicapped».[citation needed] «Cerebral Palsy: A Guide for Care» at the University of Delaware offers the following guidelines:
Impairment is the correct term to use to define a deviation from normal, such as not being able to make a muscle move or not being able to control an unwanted movement. Disability is the term used to define a restriction in the ability to perform a normal activity of daily living which someone of the same age can perform. For example, a three-year-old child who is not able to walk has a disability because a normal three-year-old can walk independently. A handicapped child or adult is one who, because of the disability, is unable to achieve the normal role in society commensurate with his age and socio-cultural milieu. As an example, a sixteen-year-old who is unable to prepare his own meal or care for his own toilet or hygiene needs is handicapped. On the other hand, a sixteen-year-old who can walk only with the assistance of crutches but who attends a regular school and is fully independent in activities of daily living is disabled but not handicapped. All disabled people are impaired, and all handicapped people are disabled, but a person can be impaired and not necessarily be disabled, and a person can be disabled without being handicapped.[196]
The term «spastic» denotes the attribute of spasticity in types of spastic CP. In 1952 a UK charity called The Spastics Society was formed.[197] The term «spastics» was used by the charity as a term for people with CP. The word «spastic» has since been used extensively as a general insult to disabled people, which some see as extremely offensive. They are also frequently used to insult non-disabled people when they seem overly uncoordinated, anxious, or unskilled in sports. The charity changed its name to Scope in 1994.[197] In the United States the word spaz has the same usage as an insult but is not generally associated with CP.[198]
Media[edit]
Maverick documentary filmmaker Kazuo Hara criticises the mores and customs of Japanese society in an unsentimental portrait of adults with cerebral palsy in his 1972 film Goodbye CP (Sayonara CP). Focusing on how people with cerebral palsy are generally ignored or disregarded in Japan, Hara challenges his society’s taboos about physical handicaps. Using a deliberately harsh style, with grainy black-and-white photography and out-of-sync sound, Hara brings a stark realism to his subject.[199]
Spandan (2012), a film by Vegitha Reddy and Aman Tripathi, delves into the dilemma of parents whose child has cerebral palsy. While films made with children with special needs as central characters have been attempted before, the predicament of parents dealing with the stigma associated with the condition and beyond is dealt in Spandan. In one of the songs of Spandan «Chal chaal chaal tu bala» more than 50 CP kids have acted. The famous classical singer Devaki Pandit has given her voice to the song penned by Prof. Jayant Dhupkar and composed by National Film Awards winner Isaac Thomas Kottukapally.[200][201][202][203]
My Left Foot (1989) is a drama film directed by Jim Sheridan and starring Daniel Day-Lewis. It tells the true story of Christy Brown, an Irishman born with cerebral palsy, who could control only his left foot. Christy Brown grew up in a poor, working-class family, and became a writer and artist. It won the Academy Award for Best Actor (Daniel Day-Lewis) and Best Actress in a Supporting Role (Brenda Fricker). It was also nominated for Best Director, Best Picture and Best Writing, Screenplay Based on Material from Another Medium. It also won the New York Film Critics Circle Award for Best Film for 1989.[204]
Call the Midwife (2012–) has featured two episodes with actor Colin Young, who himself has cerebral palsy, playing a character with the same disability. His storylines have focused on the segregation of those with disabilities in the UK in the 1950s, and also romantic relationships between people with disabilities.[205]
Micah Fowler, an American actor with CP, stars in the ABC sitcom Speechless (2016–19), which explores both the serious and humorous challenges a family faces with a teenager with CP.[206]
9-1-1 (2018–) is a procedural drama series on Fox. From season 2 onwards, it features Gavin McHugh (who himself has cerebral palsy) in the recurring role as Christopher Diaz – a young child who has cerebral palsy.
Special (2019) is a comedy series that premiered on Netflix on 12 April 2019. It was written, produced and stars Ryan O’Connell as a young gay man with mild cerebral palsy. It is based on O’Connell’s book I’m Special: And Other Lies We Tell Ourselves.[207]
Australian drama serial The Heights (2019–) features a character with mild cerebral palsy, teenage girl Sabine Rosso, depicted by an actor who herself has mild cerebral palsy, Bridie McKim.[208]
Notable cases[edit]
- Christy Brown was the basis for the Academy Award-winning film, My Left Foot.
- Two sons of Canadian rock musician Neil Young, Zeke and Ben.[209] In 1986, Young helped found the Bridge School, an educational organization for children with severe verbal and physical disabilities, and its annual supporting Bridge School Benefit concerts, together with his wife Pegi.[210][211]
- Nicolas Hamilton, a British racing driver competing in BTCC. He is the half-brother of Formula 1 driver Lewis Hamilton.[212]
- Geri Jewell, who had a regular role in the prime-time series The Facts of Life.[213]
- Josh Blue, winner of the fourth season of NBC’s Last Comic Standing, whose act revolves around his CP.[214] Blue was also on the 2004 U.S. Paralympic soccer team.[215]
- Jason Benetti, play-by-play broadcaster for ESPN, Fox Sports, Westwood One, and Time Warner covering football, baseball, lacrosse, hockey, and basketball. Since 2016, he is also the television play-by-play announcer for Chicago White Sox home games.[216]
- Jack Carroll, British comedian and runner-up in the seventh season of Britain’s Got Talent.[217]
- Abbey Curran, an American beauty queen who represented Iowa at Miss USA 2008 and was the first contestant with a disability to compete.[218]
- Robert Griswold, swimmer
- Francesca Martinez, British stand-up comedian and actress.[219]
- Evan O’Hanlon, Australian Paralympian, the fastest athlete with cerebral palsy in the world.[220]
- Arun Shourie’s son Aditya, about whom he has written a book Does He Know a Mother’s Heart[221]
- Maysoon Zayid, the self-described «Palestinian Muslim virgin with cerebral palsy, from New Jersey», who is an actress, stand-up comedian, and activist.[222] Zayid has been a resident of Cliffside Park, New Jersey.[223] She is considered one of America’s first Muslim women comedians and the first person ever to perform standup in Palestine and Jordan.[224]
- RJ Mitte, an American actor best known for his role as Walter White Jr. in Breaking Bad. He is also a celebrity ambassador for United Cerebral Palsy.[225]
- Zach Anner, an American comedian, actor, and writer. He had a television series on Oprah Winfrey’s OWN called Rollin’ With Zach and is the author of If at Birth You Don’t Succeed.[226]
- Kaine, a member of the American hip-hop duo The Ying Yang Twins, has a mild form of cerebral palsy that causes him to limp.[227][unreliable source?]
- Hannah Cockroft, is a British wheelchair athlete specialising in sprint distances in the T34 classification. She holds the Paralympic and world records for the 100 metres, 200 metres and 400 metres in her classification.[228][229][230]
- Keah Brown, American disability rights activist, author and journalist.[231]
- Kuli Kohli, Indian-British writer, poet, activist.[232]
- Simon James Stevens, a British disability issues consultant and activist, who starred in I’m Spazticus and founded Wheelies virtual nightclub [233]
- The Roman Emperor Claudius is hypothesized to have had cerebral palsy on the basis of his reported symptoms.[234]
- Rosie Jones, a British comedian and actress, is incorporating her cerebral palsy into her comedic style.
- Christopher Nolan, an Irish Poet and Author, he wrote Damn-Burst of Dreams, The Banyan Tree, and Under The Eye Of The Clock. He passed away in 2009.
Litigation[edit]
Because of the false perception that cerebral palsy is mostly caused by trauma during birth, as of 2005, 60% of obstetric litigation was about cerebral palsy, which Alastair MacLennan, Professor of Obstetrics and Gynaecology at the University of Adelaide, regards as causing an exodus from the profession.[235] In the latter half of the 20th century, obstetric litigation about the cause of cerebral palsy became more common, leading to the practice of defensive medicine.[113]
See also[edit]
- Cerebral palsy sport classification – describes the disability sport classification for cerebral palsy.
- Inclusive recreation
- World Cerebral Palsy Day
Notes[edit]
- ^ Incorrectly stated as 11% in 2013 [2]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj «Cerebral Palsy: Hope Through Research». National Institute of Neurological Disorders and Stroke. July 2013. Archived from the original on 21 February 2017. Retrieved 21 February 2017.
- ^ a b c d e Oskoui M, Coutinho F, Dykeman J, Jetté N, Pringsheim T (June 2013). «An update on the prevalence of cerebral palsy: a systematic review and meta-analysis». Developmental Medicine and Child Neurology. 55 (6): 509–519. doi:10.1111/dmcn.12080. PMID 23346889. S2CID 22053074.
- ^ Haak P, Lenski M, Hidecker MJ, Li M, Paneth N (October 2009). «Cerebral palsy and aging». Developmental Medicine and Child Neurology. 51 (4): 16–23. doi:10.1111/j.1469-8749.2009.03428.x. PMC 4183123. PMID 19740206.
- ^ «Cerebral Palsy: Overview». National Institutes of Health. Archived from the original on 15 February 2017. Retrieved 21 February 2017.
- ^ a b c «CEREBRAL PALSY, SPASTIC QUADRIPLEGIC, 1; CPSQ1». Online Mendelian Inheritance in Man. 28 June 2016. Retrieved 26 January 2018.
- ^ Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109: 8–14. doi:10.1111/j.1469-8749.2007.tb12610.x. PMID 17370477. S2CID 24504486.
- ^ a b c d Farag SM, Mohammed MO, El-Sobky TA, ElKadery NA, ElZohiery AK (March 2020). «Botulinum Toxin A Injection in Treatment of Upper Limb Spasticity in Children with Cerebral Palsy: A Systematic Review of Randomized Controlled Trials». JBJS Reviews. 8 (3): e0119. doi:10.2106/JBJS.RVW.19.00119. PMC 7161716. PMID 32224633.
- ^ Blumetti FC, Belloti JC, Tamaoki MJ, Pinto JA (October 2019). «Botulinum toxin type A in the treatment of lower limb spasticity in children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2019 (10): CD001408. doi:10.1002/14651858.CD001408.pub2. PMC 6779591. PMID 31591703.
- ^ Elliott, Catherine M.; Reid, Siobhan L.; Alderson, Jacqueline A.; Elliott, Bruce C. (1 February 2011). «Lycra arm splints in conjunction with goal-directed training can improve movement in children with cerebral palsy». NeuroRehabilitation. 28 (1): 47–54. doi:10.3233/nre-2011-0631. ISSN 1878-6448. PMID 21335677.
- ^ «How many people are affected?». National Institutes of Health. 5 September 2014. Archived from the original on 2 April 2015. Retrieved 4 March 2015.
- ^ a b c d e f g h i Panteliadis C, Panteliadis P, Vassilyadi F (April 2013). «Hallmarks in the history of cerebral palsy: from antiquity to mid-20th century». Brain & Development. 35 (4): 285–292. doi:10.1016/j.braindev.2012.05.003. PMID 22658818. S2CID 11851579.
- ^ «What is cerebral palsy?». The Cerebral Palsied Association of the Philippines Inc. Archived from the original on 20 December 2016. Retrieved 4 December 2016.
- ^ a b Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109 (s109): 8–14. doi:10.1111/j.1469-8749.2007.tb12610.x. PMID 17370477. S2CID 24504486.; Corrected in Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109 (6): 8–14. doi:10.1111/j.1469-8749.2007.00480.x. PMID 17370477. S2CID 221647898.
- ^ Kent R (2013). «Chapter 38: Cerebral Palsy». In Barnes MP, Good DC (eds.). Handbook of Clinical Neurology. 3. Vol. 110. Elsevier. pp. 443–459. ISBN 978-0444529015.
- ^ Mathewson MA, Lieber RL (February 2015). «Pathophysiology of muscle contractures in cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 26 (1): 57–67. doi:10.1016/j.pmr.2014.09.005. PMC 4258234. PMID 25479779.
- ^ a b c d e El-Sobky TA, Fayyad TA, Kotb AM, Kaldas B (May 2018). «Bony reconstruction of hip in cerebral palsy children Gross Motor Function Classification System levels III to V: a systematic review». Journal of Pediatric Orthopedics. Part B. 27 (3): 221–230. doi:10.1097/BPB.0000000000000503. PMID 28953164. S2CID 4204446.
- ^ a b Agarwal A, Verma I (December 2012). «Cerebral palsy in children: An overview». Journal of Clinical Orthopaedics and Trauma. 3 (2): 77–81. doi:10.1016/j.jcot.2012.09.001. PMC 3872805. PMID 26403442.
- ^ «Volume 1997. No. 20 October 31, 1997». Clin-Alert. 35 (1): 153–160. January 1997. doi:10.1177/006947709703500120. ISSN 0069-4770. S2CID 208256249.
- ^ a b Amen J, ElGebeily M, El-Mikkawy DM, Yousry AH, El-Sobky TA (2018). «Single-event multilevel surgery for crouching cerebral palsy children: Correlations with quality of life and functional mobility». Journal of Musculoskeletal Surgery and Research. 2 (4): 148. doi:10.4103/jmsr.jmsr_48_18. S2CID 81725776.
- ^ Singh A (8 March 2021). Children With Diverse Needs (1st ed.). Psycho Information Technologies. pp. 159–165. ISBN 9788193922774. Retrieved 21 March 2021.
- ^ Smith M, Kurian MA (September 2016). «The medical management of cerebral palsy». Paediatrics and Child Health. 26 (9): 378–382. doi:10.1016/j.paed.2016.04.013.
- ^ «Symptoms of Cerebral palsy». NHS Choices. NHS Gov.UK. 15 March 2017. Archived from the original on 7 April 2017. Retrieved 6 April 2017.
- ^ Walshe M, Smith M, Pennington L (November 2012). Walshe M (ed.). «Interventions for drooling in children with cerebral palsy». The Cochrane Database of Systematic Reviews. 11: CD008624. doi:10.1002/14651858.CD008624.pub3. PMID 23152263.
- ^ a b c d e Sewell MD, Eastwood DM, Wimalasundera N (September 2014). «Managing common symptoms of cerebral palsy in children». BMJ. 349 (sep25 7): g5474. doi:10.1136/bmj.g5474. PMID 25255910. S2CID 45300547.
- ^ Samijn B, Van Laecke E, Renson C, Hoebeke P, Plasschaert F, Vande Walle J, Van den Broeck C (March 2017). «Lower urinary tract symptoms and urodynamic findings in children and adults with cerebral palsy: A systematic review». Neurourology and Urodynamics (Submitted manuscript). 36 (3): 541–549. doi:10.1002/nau.22982. PMID 26894322. S2CID 34807855.
- ^ Hinchcliffe A, Rogers C (2007). «Sensory integration problems in children with cerebral palsy». Children with Cerebral Palsy: a manual for therapists, parents and community workers (2nd ed., rev. ed.). New Delhi: SAGE Publications. ISBN 9788178299655.
- ^ Alliance (UK), National Guideline (2019). Rationale and impact. National Institute for Health and Care Excellence (UK).
- ^ a b c Mughal MZ (September 2014). «Fractures in children with cerebral palsy». Current Osteoporosis Reports. 12 (3): 313–318. doi:10.1007/s11914-014-0224-1. PMID 24964775. S2CID 32791951.
- ^ Ozel S, Switzer L, Macintosh A, Fehlings D (September 2016). «Informing evidence-based clinical practice guidelines for children with cerebral palsy at risk of osteoporosis: an update». Developmental Medicine and Child Neurology. 58 (9): 918–923. doi:10.1111/dmcn.13196. PMID 27435427.
- ^ a b Kerkovich, D, & Aisen, M 2009, ‘Chapter 4: Cerebral Palsy’, Medical Management of Adults with Neurologic Disabilities pp. 41–53 n.p.: Demos Medical Publishing, LLC. ISBN 9781933864457
- ^ Riad J, Finnbogason T, Broström E (December 2010). «Leg length discrepancy in spastic hemiplegic cerebral palsy: a magnetic resonance imaging study». Journal of Pediatric Orthopedics. 30 (8): 846–850. doi:10.1097/BPO.0b013e3181fc35dd. hdl:10616/40477. PMID 21102211. S2CID 46608602.
- ^ Veilleux LN, Rauch F (October 2017). «Muscle-Bone Interactions in Pediatric Bone Diseases». Current Osteoporosis Reports. 15 (5): 425–432. doi:10.1007/s11914-017-0396-6. PMID 28856575. S2CID 39445049.
- ^ a b Shore BJ, White N, Kerr Graham H (August 2010). «Surgical correction of equinus deformity in children with cerebral palsy: a systematic review». Journal of Children’s Orthopaedics. 4 (4): 277–290. doi:10.1007/s11832-010-0268-4. PMC 2908346. PMID 21804889.
- ^ a b Cloake T, Gardner A (December 2016). «The management of scoliosis in children with cerebral palsy: a review». Journal of Spine Surgery. 2 (4): 299–309. doi:10.21037/jss.2016.09.05. PMC 5233861. PMID 28097247.
- ^ Rutz E, Brunner R (November 2013). «Management of spinal deformity in cerebral palsy: conservative treatment». Journal of Children’s Orthopaedics. 7 (5): 415–418. doi:10.1007/s11832-013-0516-5. PMC 3838520. PMID 24432104.
- ^ Roberts A (September 2012). «The surgical treatment of cerebral palsy». Paediatrics and Child Health. 22 (9): 377–383. doi:10.1016/j.paed.2012.03.004.
- ^ a b Klingels K, De Cock P, Molenaers G, Desloovere K, Huenaerts C, Jaspers E, Feys H (2010). «Upper limb motor and sensory impairments in children with hemiplegic cerebral palsy. Can they be measured reliably?». Disability and Rehabilitation. 32 (5): 409–416. doi:10.3109/09638280903171469. PMID 20095955. S2CID 19704908.
- ^ a b c d Meyers RC, Bachrach SJ, Stallings VA (2017). «Cerebral Palsy». In Ekvall SW, Ekvall VK (eds.). Pediatric and Adult Nutrition in Chronic Diseases, Developmental Disabilities, and Hereditary Metabolic Disorders: Prevention, Assessment, and Treatment. Oxford Scholarship Online. pp. 86–90. doi:10.1093/acprof:oso/9780199398911.003.0009. ISBN 9780199398911.
- ^ a b c d e Donkervoort M, Roebroeck M, Wiegerink D, van der Heijden-Maessen H, Stam H (March 2007). «Determinants of functioning of adolescents and young adults with cerebral palsy». Disability and Rehabilitation. 29 (6): 453–463. doi:10.1080/09638280600836018. PMID 17364800. S2CID 20066607.
- ^ Bell KL, Samson-Fang L (December 2013). «Nutritional management of children with cerebral palsy». European Journal of Clinical Nutrition. 67 (Suppl 2): S13–S16. doi:10.1038/ejcn.2013.225. PMID 24301003.
- ^ a b Hirsh AT, Gallegos JC, Gertz KJ, Engel JM, Jensen MP (2010). «Symptom burden in individuals with cerebral palsy». Journal of Rehabilitation Research and Development. 47 (9): 863–876. doi:10.1682/jrrd.2010.03.0024. PMC 3158669. PMID 21174251.
- ^ a b Myrden A, Schudlo L, Weyand S, Zeyl T, Chau T (August 2014). «Trends in communicative access solutions for children with cerebral palsy». Journal of Child Neurology. 29 (8): 1108–1118. doi:10.1177/0883073814534320. PMID 24820337. S2CID 28508184.
- ^ Love RJ, Webb WG (2013). Neurology for the Speech-Language Pathologist (2nd ed.). Butterworth-Heinemann. p. 250. ISBN 9781483141992.
- ^ a b c d Beukelman DR, Mirenda P (1999). Augmentative and Alternative Communication: Management of severe communication disorders in children and adults (2nd ed.). Baltimore: Paul H Brookes Publishing Co. pp. 246–249. doi:10.1080/07434619912331278735. ISBN 978-1-55766-333-7.
- ^ Pennington, Lindsay (1 September 2008). «Cerebral palsy and communication». Paediatrics and Child Health. 18 (9): 405–409. doi:10.1016/j.paed.2008.05.013. ISSN 1751-7222.
- ^ McKearnan KA, Kieckhefer GM, Engel JM, Jensen MP, Labyak S (October 2004). «Pain in children with cerebral palsy: a review». The Journal of Neuroscience Nursing. 36 (5): 252–259. doi:10.1097/01376517-200410000-00004. PMID 15524243. S2CID 33568994.
- ^ Hauer J, Houtrow AJ (June 2017). «Pain Assessment and Treatment in Children With Significant Impairment of the Central Nervous System». Pediatrics. 139 (6): e20171002. doi:10.1542/peds.2017-1002. PMID 28562301.
- ^ Blackman JA, Svensson CI, Marchand S (September 2018). «Pathophysiology of chronic pain in cerebral palsy: implications for pharmacological treatment and research». Developmental Medicine and Child Neurology. 60 (9): 861–865. doi:10.1111/dmcn.13930. PMID 29882358.
- ^ Newman CJ, O’Regan M, Hensey O (July 2006). «Sleep disorders in children with cerebral palsy». Developmental Medicine and Child Neurology. 48 (7): 564–568. doi:10.1017/S0012162206001198. PMID 16780625.
- ^ Dutt R, Roduta-Roberts M, Brown CA (February 2015). «Sleep and Children with Cerebral Palsy: A Review of Current Evidence and Environmental Non-Pharmacological Interventions». Children. 2 (1): 78–88. doi:10.3390/children2010078. PMC 4928749. PMID 27417351.
- ^ Stanton M (2012). «Special Considerations». Understanding cerebral palsy : a guide for parents and professionals. London: Jessica Kingsley Publishers. p. 70. ISBN 9781849050609.
- ^ Kingsnorth S, Orava T, Provvidenza C, Adler E, Ami N, Gresley-Jones T, et al. (October 2015). «Chronic Pain Assessment Tools for Cerebral Palsy: A Systematic Review». Pediatrics. 136 (4): e947–e960. doi:10.1542/peds.2015-0273. PMID 26416940.
- ^ Novak I, Hines M, Goldsmith S, Barclay R (November 2012). «Clinical prognostic messages from a systematic review on cerebral palsy». Pediatrics. 130 (5): e1285–e1312. doi:10.1542/peds.2012-0924. PMID 23045562.
- ^ van der Slot WM, Benner JL, Brunton L, Engel JM, Gallien P, Hilberink SR, et al. (May 2021). «Pain in adults with cerebral palsy: A systematic review and meta-analysis of individual participant data». Annals of Physical and Rehabilitation Medicine. 64 (3): 101359. doi:10.1016/j.rehab.2019.12.011. hdl:10852/83636. PMID 32061920. S2CID 211134380.
- ^ Jones KB, Wilson B, Weedon D, Bilder D (December 2015). «Care of Adults With Intellectual and Developmental Disabilities: Cerebral Palsy». FP Essentials. 439: 26–30. PMID 26669212.
- ^ Krigger KW (January 2006). «Cerebral palsy: an overview». American Family Physician. 73 (1): 91–100. PMID 16417071.
- ^ Cremer N, Hurvitz EA, Peterson MD (June 2017). «Multimorbidity in Middle-Aged Adults with Cerebral Palsy». The American Journal of Medicine. 130 (6): 744.e9–744.e15. doi:10.1016/j.amjmed.2016.11.044. PMC 5502778. PMID 28065772.
- ^ «Women’s Health Initiative – Cerebral Palsy Foundation». Cerebral Palsy Foundation. 10 July 2015. Archived from the original on 24 December 2016. Retrieved 23 December 2016.
- ^ Wimalasundera N, Stevenson VL (June 2016). «Cerebral palsy». Practical Neurology. 16 (3): 184–194. doi:10.1136/practneurol-2015-001184. PMID 26837375. S2CID 4488035.
- ^ a b van Gorp M, Hilberink SR, Noten S, Benner JL, Stam HJ, van der Slot WM, Roebroeck ME (June 2020). «Epidemiology of Cerebral Palsy in Adulthood: A Systematic Review and Meta-analysis of the Most Frequently Studied Outcomes». Archives of Physical Medicine and Rehabilitation. 101 (6): 1041–1052. doi:10.1016/j.apmr.2020.01.009. hdl:1765/126053. PMID 32059945. S2CID 211122403.
- ^ a b c d e f g Yarnell J (2013). Epidemiology and Disease Prevention: A Global Approach (2nd ed.). Oxford University Press. p. 190. ISBN 9780199660537.
- ^ Eunson P (September 2016). «Aetiology and epidemiology of cerebral palsy». Paediatrics and Child Health. 26 (9): 367–372. doi:10.1016/j.paed.2016.04.011.
- ^ Sayed Ahmed WA, Hamdy MA (21 August 2018). «Optimal management of umbilical cord prolapse». International Journal of Women’s Health. 10: 459–465. doi:10.2147/IJWH.S130879. PMC 6109652. PMID 30174462.
- ^ a b c Nelson KB, Blair E (September 2015). «Prenatal Factors in Singletons with Cerebral Palsy Born at or near Term». The New England Journal of Medicine. 373 (10): 946–953. doi:10.1056/NEJMra1505261. PMID 26332549.
- ^ Burton A (September 2015). «Fighting cerebral palsy in Africa». The Lancet. Neurology. 14 (9): 876–877. doi:10.1016/S1474-4422(15)00189-1. PMID 26293560.
- ^ William B. Carey, ed. (2009). Developmental-behavioral pediatrics (4th ed.). Philadelphia, PA: Saunders/Elsevier. p. 264. ISBN 9781416033707.
- ^ Saunders NR, Hellmann J, Farine D (October 2011). «Cerebral palsy and assisted conception». Journal of Obstetrics and Gynaecology Canada. 33 (10): 1038–1043. doi:10.1016/s1701-2163(16)35053-8. PMID 22014781.
- ^ «Erratum». Developmental Medicine and Child Neurology. 58 (3): 316. March 2016. doi:10.1111/dmcn.12662. PMID 26890023. S2CID 221682193.
- ^ Hallman M (April 2012). «Premature birth and diseases in premature infants: common genetic background?». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (Suppl 1): 21–24. doi:10.3109/14767058.2012.667600. PMID 22385349. S2CID 43101375.
- ^ Poets CF, Wallwiener D, Vetter K (October 2012). «Risks associated with delivering infants 2 to 6 weeks before term—a review of recent data». Deutsches Ärzteblatt International. 109 (43): 721–726. doi:10.3238/arztebl.2012.0721. PMC 3498472. PMID 23181136.
- ^ McIntyre S, Taitz D, Keogh J, Goldsmith S, Badawi N, Blair E (June 2013). «A systematic review of risk factors for cerebral palsy in children born at term in developed countries». Developmental Medicine and Child Neurology. 55 (6): 499–508. doi:10.1111/dmcn.12017. PMID 23181910. S2CID 3302180.
- ^ Ellenberg JH, Nelson KB (March 2013). «The association of cerebral palsy with birth asphyxia: a definitional quagmire». Developmental Medicine and Child Neurology. 55 (3): 210–216. doi:10.1111/dmcn.12016. PMID 23121164. S2CID 27475345.
- ^ Teng J, Chang T, Reyes C, Nelson KB (October 2012). «Placental weight and neurologic outcome in the infant: a review». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (10): 2082–2087. doi:10.3109/14767058.2012.671871. PMID 22394270. S2CID 26933806.
- ^ a b «Causes and Risk Factors of Cerebral Palsy | CDC». 15 December 2020.
- ^ Parolin Schnekenberg R, Perkins EM, Miller JW, Davies WI, D’Adamo MC, Pessia M, et al. (July 2015). «De novo point mutations in patients diagnosed with ataxic cerebral palsy». Brain. 138 (Pt 7): 1817–1832. doi:10.1093/brain/awv117. PMC 4572487. PMID 25981959.
[…]a putative new gene had been found in Case 7, which is currently under investigation and will be presented elsewhere.
- ^ Parolin Schnekenberg R, Perkins EM, Miller JW, Davies WI, D’Adamo MC, Pessia M, et al. (July 2015). «De novo point mutations in patients diagnosed with ataxic cerebral palsy». Brain. 138 (Pt 7): 1817–1832. doi:10.1093/brain/awv117. PMC 4572487. PMID 25981959.
Case 6 had cerebellar vermis hypoplasia and Case 7 had global cerebellar hypoplasia (vermis and cerebellar hemispheres), both these cases were clinically stable.
- ^ a b «Cerebral Palsy | NCBDDD | CDC». Cerebral Palsy Home | NCBDDD | CDC. Archived from the original on 21 April 2017. Retrieved 20 April 2017.
- ^ Kieffer S. «Cerebral Palsy». Johns Hopkins Pediatric Neurosurgery. Archived from the original on 30 September 2015. Retrieved 18 September 2015.
- ^ «Infection in the Newborn as a Cause of Cerebral Palsy, 12/2004». United Cerebral Palsy Research and Education Foundation (U.S.). Archived from the original on 29 July 2007. Retrieved 5 July 2007.
- ^ Bersani I, Thomas W, Speer CP (April 2012). «Chorioamnionitis—the good or the evil for neonatal outcome?». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (Suppl 1): 12–16. doi:10.3109/14767058.2012.663161. PMID 22309119. S2CID 11109172.
- ^ Mwaniki MK, Atieno M, Lawn JE, Newton CR (February 2012). «Long-term neurodevelopmental outcomes after intrauterine and neonatal insults: a systematic review». Lancet. 379 (9814): 445–452. doi:10.1016/s0140-6736(11)61577-8. PMC 3273721. PMID 22244654.
- ^ Pharoah PO (December 2005). «Causal hypothesis for some congenital anomalies». Twin Research and Human Genetics. 8 (6): 543–550. doi:10.1375/183242705774860141. PMID 16354495.
- ^ a b McIntyre S, Morgan C, Walker K, Novak I (November 2011). «Cerebral palsy—don’t delay». Developmental Disabilities Research Reviews. 17 (2): 114–129. doi:10.1002/ddrr.1106. PMID 23362031.
- ^ a b c d e f g h i Bosanquet M, Copeland L, Ware R, Boyd R (May 2013). «A systematic review of tests to predict cerebral palsy in young children». Developmental Medicine and Child Neurology. 55 (5): 418–426. doi:10.1111/dmcn.12140. PMID 23574478. S2CID 205066858.
- ^ a b c Lungu C, Hirtz D, Damiano D, Gross P, Mink JW (September 2016). «Report of a workshop on research gaps in the treatment of cerebral palsy». Neurology. 87 (12): 1293–1298. doi:10.1212/WNL.0000000000003116. PMC 5035982. PMID 27558377.
- ^ a b «Cerebral Palsy from Birth Injury». Birth Injury Guide. Retrieved 4 January 2022.
- ^ a b c d National Guideline Alliance (UK) (January 2017). Cerebral Palsy in Under 25s: Assessment and Management (PDF). London: National Institute for Health and Care Excellence (UK). ISBN 978-1-4731-2272-7. Archived (PDF) from the original on 10 September 2017. Retrieved 5 February 2017.
- ^ Graham D, Paget SP, Wimalasundera N (February 2019). «Current thinking in the health care management of children with cerebral palsy». The Medical Journal of Australia. 210 (3): 129–135. doi:10.5694/mja2.12106. PMID 30739332. S2CID 73424991.
- ^ McCay KD, Ho ES, Shum HP, Fehringer G, Marcroft C, Embleton ND (2020). «Unifying Person and Vehicle Re-identification». IEEE Access. 8 (1): 2169-3536. doi:10.1109/ACCESS.2020.2980269. S2CID 214623895.
- ^ McCay KD, Hu P, Shum HP, Woo WL, Marcroft C, Embleton ND, et al. (2022). «A Pose-Based Feature Fusion and Classification Framework for the Early Prediction of Cerebral Palsy in Infants». IEEE Transactions on Neural Systems and Rehabilitation Engineering. 30: 8–19. doi:10.1109/TNSRE.2021.3138185. PMID 34941512. S2CID 245457921.
- ^ Kolawole TM, Patel PJ, Mahdi AH (1989). «Computed tomographic (CT) scans in cerebral palsy (CP)». Pediatric Radiology. 20 (1–2): 23–27. doi:10.1007/BF02010628. PMID 2602010. S2CID 23604047.
- ^ Ashwal S, Russman BS, Blasco PA, Miller G, Sandler A, Shevell M, Stevenson R, et al. (Quality Standards Subcommittee of the American Academy of Neurology; Practice Committee of the Child Neurology Society) (March 2004). «Practice parameter: diagnostic assessment of the child with cerebral palsy: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society». Neurology. 62 (6): 851–863. doi:10.1212/01.WNL.0000117981.35364.1B. PMID 15037681.
- ^ a b c Rethlefsen SA, Ryan DD, Kay RM (October 2010). «Classification systems in cerebral palsy». The Orthopedic Clinics of North America. 41 (4): 457–467. doi:10.1016/j.ocl.2010.06.005. PMID 20868878.
- ^ a b c d Trabacca A, Vespino T, Di Liddo A, Russo L (September 2016). «Multidisciplinary rehabilitation for patients with cerebral palsy: improving long-term care». Journal of Multidisciplinary Healthcare. 9: 455–462. doi:10.2147/JMDH.S88782. PMC 5036581. PMID 27703369.
- ^ Ogoke C (2018). Clinical Classification of Cerebral Palsy. Retrieved 21 March 2021.
- ^ a b c Becher JG (2002). «Pediatric rehabilitation in children with cerebral palsy: general management, classification of motor disorders». Journal of Prosthetics and Orthotics. 14 (4): 143–149. doi:10.1097/00008526-200212000-00004. S2CID 71684103. Archived from the original on 2 February 2017. Retrieved 29 January 2017.
- ^ a b c d O’Shea TM (December 2008). «Diagnosis, treatment, and prevention of cerebral palsy». Clinical Obstetrics and Gynecology. 51 (4): 816–828. doi:10.1097/GRF.0b013e3181870ba7. PMC 3051278. PMID 18981805.
- ^ a b «Spastic cerebral palsy». Cerebral Palsy Alliance. 18 November 2015. Retrieved 4 March 2020.
- ^ Knierim J (2020). «Chapter 3: The motor cortex». Neuroscience online: An electronic textbook of the neurosciences from the University of Texas at Houston. Archived from the original on 17 December 2019. Retrieved 4 March 2020.
- ^ CDC (18 April 2018). «What is Cerebral Palsy? | CDC». Centers for Disease Control and Prevention. Retrieved 5 March 2020.
- ^ Nolan KW, Cole LL, Liptak GS (April 2006). «Use of botulinum toxin type A in children with cerebral palsy». Physical Therapy. 86 (4): 573–584. doi:10.1093/ptj/86.4.573. PMID 16579673.
- ^ McHale DP, Jackson AP, Levene MI, Corry P, Woods CG, Lench NJ, et al. (April 2000). «A gene for ataxic cerebral palsy maps to chromosome 9p12-q12». European Journal of Human Genetics. 8 (4): 267–272. doi:10.1038/sj.ejhg.5200445. PMID 10854109.
- ^ Cheney PD (1997). «Pathophysiology of the corticospinal system and basal ganglia in cerebral palsy». Mental Retardation and Developmental Disabilities Research Reviews. 3 (2): 153–167. doi:10.1002/(SICI)1098-2779(1997)3:2<153::AID-MRDD7>3.0.CO;2-S.
- ^ Straub K, Obrzut JE (2009). «Effects of cerebral palsy on neurophsyological function». Journal of Developmental and Physical Disabilities. 21 (2): 153–167. doi:10.1007/s10882-009-9130-3. S2CID 144152618.
- ^ Hou M, Zhao J, Yu R (2006). «Recent advances in dyskinetic cerebral palsy» (PDF). World J Pediatr. 2 (1): 23–28. Archived (PDF) from the original on 4 March 2016.
- ^ «Athetoid Dyskinetic». Swope, Rodante P.A. Archived from the original on 2 July 2013. Retrieved 31 October 2012.
- ^ Krägeloh-Mann I, Horber V (February 2007). «The role of magnetic resonance imaging in elucidating the pathogenesis of cerebral palsy: a systematic review». Developmental Medicine and Child Neurology. 49 (2): 144–151. doi:10.1111/j.1469-8749.2007.00144.x. PMID 17254004. S2CID 6967370.
- ^ Jones MW, Morgan E, Shelton JE, Thorogood C (2007). «Cerebral palsy: introduction and diagnosis (part I)». Journal of Pediatric Health Care. 21 (3): 146–152. doi:10.1016/j.pedhc.2006.06.007. PMID 17478303.
- ^ Rodda J, Graham HK (November 2001). «Classification of gait patterns in spastic hemiplegia and spastic diplegia: a basis for a management algorithm». European Journal of Neurology. 8 (Suppl 5): 98–108. doi:10.1046/j.1468-1331.2001.00042.x. PMID 11851738. S2CID 45860264.
- ^ a b Grunt S. «Geh-Orthesen bei Kindern mit Cerebralparese». Pediatrica. 18: 30–34.
- ^ Armand, Stephan (December 2016). «Gait analysis in children with cerebral palsy». Paediatrics and Child Health. 18 (9): 405–409. doi:10.1016/j.paed.2008.05.013. ISSN 1751-7222. PMC 5489760. PMID 28698802.
- ^ a b Shepherd E, Salam RA, Middleton P, Han S, Makrides M, McIntyre S, et al. (June 2018). «Neonatal interventions for preventing cerebral palsy: an overview of Cochrane Systematic Reviews». The Cochrane Database of Systematic Reviews. 6 (6): CD012409. doi:10.1002/14651858.CD012409. PMC 6457912. PMID 29926474.
- ^ a b Sartwelle TP, Johnston JC (June 2015). «Cerebral palsy litigation: change course or abandon ship». Journal of Child Neurology. 30 (7): 828–841. doi:10.1177/0883073814543306. PMC 4431995. PMID 25183322.
- ^ Crowther CA, Middleton PF, Voysey M, Askie L, Duley L, Pryde PG, et al. (October 2017). «Assessing the neuroprotective benefits for babies of antenatal magnesium sulphate: An individual participant data meta-analysis». PLOS Medicine. 14 (10): e1002398. doi:10.1371/journal.pmed.1002398. PMC 5627896. PMID 28976987.
- ^ Nguyen TM, Crowther CA, Wilkinson D, Bain E (February 2013). «Magnesium sulphate for women at term for neuroprotection of the fetus». The Cochrane Database of Systematic Reviews. 2 (2): CD009395. doi:10.1002/14651858.cd009395.pub2. PMID 23450601.
- ^ Zeng X, Xue Y, Tian Q, Sun R, An R (January 2016). «Effects and Safety of Magnesium Sulfate on Neuroprotection: A Meta-analysis Based on PRISMA Guidelines». Medicine. 95 (1): e2451. doi:10.1097/MD.0000000000002451. PMC 4706271. PMID 26735551.
- ^ a b Shih ST, Tonmukayakul U, Imms C, Reddihough D, Graham HK, Cox L, Carter R (June 2018). «Economic evaluation and cost of interventions for cerebral palsy: a systematic review». Developmental Medicine and Child Neurology. 60 (6): 543–558. doi:10.1111/dmcn.13653. PMID 29319155.
- ^ Atik A, Harding R, De Matteo R, Kondos-Devcic D, Cheong J, Doyle LW, Tolcos M (January 2017). «Caffeine for apnea of prematurity: Effects on the developing brain». Neurotoxicology. 58: 94–102. doi:10.1016/j.neuro.2016.11.012. PMID 27899304. S2CID 46761491.
- ^ a b c Shepherd E, Salam RA, Middleton P, Makrides M, McIntyre S, Badawi N, Crowther CA (August 2017). «Antenatal and intrapartum interventions for preventing cerebral palsy: an overview of Cochrane systematic reviews». The Cochrane Database of Systematic Reviews. 2017 (8): CD012077. doi:10.1002/14651858.CD012077.pub2. PMC 6483544. PMID 28786098.
- ^ Chang E (January 2015). «Preterm birth and the role of neuroprotection». BMJ. 350: g6661. doi:10.1136/bmj.g6661. PMID 25646630. S2CID 46429378.
- ^ Jacobs SE, Berg M, Hunt R, Tarnow-Mordi WO, Inder TE, Davis PG (January 2013). «Cooling for newborns with hypoxic ischaemic encephalopathy». The Cochrane Database of Systematic Reviews. 2013 (1): CD003311. doi:10.1002/14651858.CD003311.pub3. PMC 7003568. PMID 23440789.
- ^ a b c d e Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. (October 2013). «A systematic review of interventions for children with cerebral palsy: state of the evidence». Developmental Medicine and Child Neurology. 55 (10): 885–910. doi:10.1111/dmcn.12246. PMID 23962350. S2CID 1658072.
- ^ «Cerebral palsy – Treatment». www.nhs.uk. NHS Choices. Archived from the original on 6 February 2017. Retrieved 6 February 2017.
- ^ Hallman-Cooper JL, Rocha Cabrero F. Cerebral Palsy. [Updated 2022 Oct 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK538147/
- ^ Pennington L, Goldbart J, Marshall J (2004). «Speech and language therapy to improve the communication skills of children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2004 (2): CD003466. doi:10.1002/14651858.CD003466.pub2. PMC 8407241. PMID 15106204.
- ^ Blake SF, Logan S, Humphreys G, Matthews J, Rogers M, Thompson-Coon J, et al. (2015). «Sleep positioning systems for children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2015 (11): CD009257. doi:10.1002/14651858.CD009257.pub2. PMC 8761500. PMID 26524348.
- ^ Eddison N, Mulholland M, Chockalingam N (August 2017). «Do research papers provide enough information on design and material used in ankle foot orthoses for children with cerebral palsy? A systematic review». Journal of Children’s Orthopaedics. 11 (4): 263–271. doi:10.1302/1863-2548.11.160256. PMC 5584494. PMID 28904631.
- ^ Horst R (2005). Motorisches Strategietraining und PNF. Renata Horst. ISBN 978-3-13-151351-9.
- ^ Novacheck TF (2008). Orthoses for cerebral palsy. AAOS Atlas of Orthoses and Assistive Devices. Philadelphia: John D. Hsu, John W. Michael, John R. Fisk. pp. 487–500. ISBN 978-0-323-03931-4.
- ^ Muñoz S (2018). «The new generation of AFOs». The O&P EDGE. 11. Archived from the original on 6 June 2021. Retrieved 16 July 2021.
- ^ Kerkum YL, Harlaar J, Buizer AI, van den Noort JC, Becher JG, Brehm MA (May 2016). «An individual approach for optimizing ankle-foot orthoses to improve mobility in children with spastic cerebral palsy walking with excessive knee flexion». Gait & Posture. 46: 104–111. doi:10.1016/j.gaitpost.2016.03.001. PMID 27131186.
- ^ Kerkum YL (2016). «The effect of ankle foot orthosis stiffness on trunk movement and walking energy cost in cerebral palsy». Gait & Posture. 49: 2. doi:10.1016/j.gaitpost.2016.07.070. ISSN 0966-6362.
- ^ Meyns P, Kerkum YL, Brehm MA, Becher JG, Buizer AI, Harlaar J (May 2020). «Ankle foot orthoses in cerebral palsy: Effects of ankle stiffness on trunk kinematics, gait stability and energy cost of walking». European Journal of Paediatric Neurology. 26: 68–74. doi:10.1016/j.ejpn.2020.02.009. PMID 32147412. S2CID 212641072.
- ^ Waterval NF, Nollet F, Harlaar J, Brehm MA (October 2019). «Modifying ankle foot orthosis stiffness in patients with calf muscle weakness: gait responses on group and individual level». Journal of Neuroengineering and Rehabilitation. 16 (1): 120. doi:10.1186/s12984-019-0600-2. PMC 6798503. PMID 31623670.
- ^ Ploeger HE, Waterval NF, Nollet F, Bus SA, Brehm MA (2019). «Stiffness modification of two ankle-foot orthosis types to optimize gait in individuals with non-spastic calf muscle weakness — a proof-of-concept study». Journal of Foot and Ankle Research (in German). 12: 41. doi:10.1186/s13047-019-0348-8. PMC 6686412. PMID 31406508.
- ^ Jenks KM, de Moor J, van Lieshout EC, Maathuis KG, Keus I, Gorter JW (2007). «The effect of cerebral palsy on arithmetic accuracy is mediated by working memory, intelligence, early numeracy, and instruction time». Developmental Neuropsychology. 32 (3): 861–879. doi:10.1080/87565640701539758. hdl:1871/34092. PMID 17956186. S2CID 17795628.
- ^ a b Zaffuto-Sforza CD (February 2005). «Aging with cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 16 (1): 235–249. doi:10.1016/j.pmr.2004.06.014. PMID 15561553.
- ^ Wiegerink D, Roebroeck M, Bender J, Stam H, Cohen-Kettenis P (June 2011). «Sexuality of Young Adults with Cerebral Palsy: Experienced Limitations and Needs». Sexuality and Disability. 29 (2): 119–128. doi:10.1007/s11195-010-9180-6. PMC 3093545. PMID 21660090.
- ^ Hutton JL (June 2006). «Cerebral palsy life expectancy». Clinics in Perinatology. 33 (2): 545–555. doi:10.1016/j.clp.2006.03.016. PMID 16765736.
- ^ Strauss D, Brooks J, Rosenbloom L, Shavelle R (July 2008). «Life expectancy in cerebral palsy: an update». Developmental Medicine and Child Neurology. 50 (7): 487–493. doi:10.1111/j.1469-8749.2008.03000.x. PMID 18611196. S2CID 18315945.
- ^ Day SM, Reynolds RJ, Kush SJ (December 2015). «Extrapolating published survival curves to obtain evidence-based estimates of life expectancy in cerebral palsy». Developmental Medicine and Child Neurology. 57 (12): 1105–1118. doi:10.1111/dmcn.12849. PMID 26174088. S2CID 8895402.
- ^ «Australian Bureau of Statistics 2014, 3303.0 — Causes of Death, Australia — 1. Underlying causes of death (Australia), 2014, data cube: Excel spreadsheet». abs.gov.au/AUSSTATS. Archived from the original on 12 September 2016. Retrieved 14 August 2016.
- ^ a b Kent RM (2012). «Cerebral palsy». In Barnes M, Good D (eds.). Neurological Rehabilitation Handbook of Clinical Neurology. Oxford: Elsevier Science. pp. 443–459. ISBN 9780444595843.
- ^ Van Zelst BR, Miller MD, Russo R, Murchland S, Crotty M (September 2006). «Activities of daily living in children with hemiplegic cerebral palsy: a cross-sectional evaluation using the Assessment of Motor and Process Skills». Developmental Medicine and Child Neurology. 48 (9): 723–727. doi:10.1017/S0012162206001551. PMID 16904017.
- ^ Nieuwenhuijsen C, Donkervoort M, Nieuwstraten W, Stam HJ, Roebroeck ME (November 2009). «Experienced problems of young adults with cerebral palsy: targets for rehabilitation care». Archives of Physical Medicine and Rehabilitation. 90 (11): 1891–1897. doi:10.1016/j.apmr.2009.06.014. PMID 19887214.
- ^ Arnould C, Penta M, Thonnard JL (November 2007). «Hand impairments and their relationship with manual ability in children with cerebral palsy». Journal of Rehabilitation Medicine. 39 (9): 708–714. doi:10.2340/16501977-0111. PMID 17999009.
- ^ «Therapy and equipment needs of people with cerebral palsy and like disabilities in Australia». Australian Institute of Health and Welfare AIHW. 2006. Archived from the original on 30 March 2015. Disability Series. Cat. no. DIS 49. Canberra: AIHW.
- ^ «Patients & Clients: Learn About Occupational Therapy». The American Occupational Therapy Association, Inc. Retrieved 3 September 2019.
- ^ Fedrizzi E, Pagliano E, Andreucci E, Oleari G (February 2003). «Hand function in children with hemiplegic cerebral palsy: prospective follow-up and functional outcome in adolescence». Developmental Medicine and Child Neurology. 45 (2): 85–91. doi:10.1017/s0012162203000173. PMID 12578233.
- ^ Blesedell CE, Cohn ES, Schell AB. Willard and Spackman’s occupational therapy. Philadelphia, PA: Lippincott Williams & Wilkins; 2003. p. 705-709.
- ^ a b c Townsend E, Stanton S, Law M. Enabling occupation: An occupational therapy perspective. Canadian Association of Occupational Therapists Ottawa, ON, Canada; 1997/2002. p. 34.
- ^ Parham LD, Primeau LA (2008). «Play and occupational therapy». In Parham LD, Fazio LS (eds.). Play in occupational therapy for children (2nd ed.). St. Louis, Mo.: Mosby Elsevier. ISBN 978-0-323-02954-4. Archived from the original on 15 April 2015.
- ^ Miller S, Reid D (December 2003). «Doing play: competency, control, and expression». Cyberpsychology & Behavior. 6 (6): 623–632. doi:10.1089/109493103322725397. PMID 14756927.
- ^ Okimoto AM, Bundy A, Hanzlik J (2000). «Playfulness in children with and without disability: measurement and intervention». The American Journal of Occupational Therapy. 54 (1): 73–82. doi:10.5014/ajot.54.1.73. PMID 10686630.
- ^ Hestenes LL, Carroll DE (2000). «The play interactions of young children with and without disabilities: Individual and environmental influences». Early Childhood Research Quarterly. 15 (2): 229–246. doi:10.1016/s0885-2006(00)00052-1.
- ^ a b c d Missiuna C, Pollock N (October 1991). «Play deprivation in children with physical disabilities: the role of the occupational therapist in preventing secondary disability». The American Journal of Occupational Therapy. 45 (10): 882–888. doi:10.5014/ajot.45.10.882. PMID 1835302.
- ^ Howard L (December 1996). «A Comparison of Leisure-Time Activities between Able-Bodied Children and Children with Physical Disabilities». British Journal of Occupational Therapy. 59 (12): 570–574. doi:10.1177/030802269605901208. S2CID 147128197.
- ^ Rigby P, Schwellnus H (January 1999). «Occupational Therapy Decision Making Guidelines for Problems in Written Productivity». Physical & Occupational Therapy in Pediatrics. 19 (1): 5–27. doi:10.1080/J006v19n01_02.
- ^ Smith M, Sandberg AD, Larsson M (2009). «Reading and spelling in children with severe speech and physical impairments: a comparative study». International Journal of Language & Communication Disorders. 44 (6): 864–882. doi:10.1080/13682820802389873. PMID 19105069.
- ^ a b Pruitt DW, Tsai T (August 2009). «Common medical comorbidities associated with cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 20 (3): 453–467. doi:10.1016/j.pmr.2009.06.002. PMID 19643347.
- ^ Cassidy T (March 1996). «All work and no play: A focus on leisure time as a means for promoting health». Counselling Psychology Quarterly. 9 (1): 77–90. doi:10.1080/09515079608256354.
- ^ Carlon SL, Taylor NF, Dodd KJ, Shields N (April 2013). «Differences in habitual physical activity levels of young people with cerebral palsy and their typically developing peers: a systematic review». Disability and Rehabilitation. 35 (8): 647–655. doi:10.3109/09638288.2012.715721. PMID 23072296. S2CID 14115837.
- ^ Verschuren O, Peterson MD, Balemans AC, Hurvitz EA (August 2016). «Exercise and physical activity recommendations for people with cerebral palsy». Developmental Medicine and Child Neurology. 58 (8): 798–808. doi:10.1111/dmcn.13053. PMC 4942358. PMID 26853808.
- ^ Bloemen M, Van Wely L, Mollema J, Dallmeijer A, de Groot J (October 2017). «Evidence for increasing physical activity in children with physical disabilities: a systematic review». Developmental Medicine and Child Neurology. 59 (10): 1004–1010. doi:10.1111/dmcn.13422. PMID 28374442.
- ^ Bult MK, Verschuren O, Jongmans MJ, Lindeman E, Ketelaar M (September 2011). «What influences participation in leisure activities of children and youth with physical disabilities? A systematic review». Research in Developmental Disabilities. 32 (5): 1521–1529. doi:10.1016/j.ridd.2011.01.045. PMID 21388783.
- ^ Coleman N, Nemeth BA, LeBlanc CM (December 2018). «Increasing Wellness Through Physical Activity in Children With Chronic Disease and Disability». Current Sports Medicine Reports. 17 (12): 425–432. doi:10.1249/JSR.0000000000000548. PMID 30531459. S2CID 54473147.
- ^ a b King G, Law M, King S, Rosenbaum P, Kertoy MK, Young NL (2003). «A conceptual model of the factors affecting the recreation and leisure participation of children with disabilities». Physical & Occupational Therapy in Pediatrics. 23 (1): 63–90. doi:10.1080/J006v23n01_05. PMID 12703385. S2CID 25399342.
- ^ a b c Aitchison C (December 2003). «From leisure and disability to disability leisure: developing data, definitions and discourses». Disability & Society. 18 (7): 955–969. doi:10.1080/0968759032000127353. S2CID 145317559.
- ^ Imms C (2008). «Children with cerebral palsy participate: a review of the literature». Disability and Rehabilitation. 30 (24): 1867–1884. doi:10.1080/09638280701673542. PMID 19037780. S2CID 20859782.
- ^ a b c Specht J, King G, Brown E, Foris C (2002). «The importance of leisure in the lives of persons with congenital physical disabilities». The American Journal of Occupational Therapy. 56 (4): 436–445. doi:10.5014/ajot.56.4.436. PMID 12125833.
- ^ Frisch D, Msall ME (August 2013). «Health, functioning, and participation of adolescents and adults with cerebral palsy: a review of outcomes research». Developmental Disabilities Research Reviews. 18 (1): 84–94. doi:10.1002/ddrr.1131. PMID 23949832.
- ^ Lawrence H, Hills S, Kline N, Weems K, Doty A (November 2016). «Effectiveness of Exercise on Functional Mobility in Adults with Cerebral Palsy: A Systematic Review». Physiotherapy Canada. Physiotherapie Canada. 68 (4): 398–407. doi:10.3138/ptc.2015-38LHC. PMC 5125497. PMID 27904240.
- ^ Bagatell N, Chan D, Rauch KK, Thorpe D (January 2017). ««Thrust into adulthood»: Transition experiences of young adults with cerebral palsy». Disability and Health Journal. 10 (1): 80–86. doi:10.1016/j.dhjo.2016.09.008. PMID 27756560.
- ^ Alves-Nogueira AC, Silva N, McConachie H, Carona C (January 2020). «A systematic review on quality of life assessment in adults with cerebral palsy: Challenging issues and a call for research». Research in Developmental Disabilities. 96: 103514. doi:10.1016/j.ridd.2019.103514. PMID 31706133. S2CID 207936522.
- ^ Turk MA, Overeynder JC, Janicki MP, eds. (1995). Uncertain Future – Aging and Cerebral Palsy: Clinical Concerns (PDF) (Report). Albany: New York State Developmental Disabilities Planning Council. Archived from the original (PDF) on 3 August 2016.
- ^ Morgan P, McGinley J (17 April 2013). «Gait function and decline in adults with cerebral palsy: a systematic review». Disability and Rehabilitation. 36 (1): 1–9. doi:10.3109/09638288.2013.775359. PMID 23594053. S2CID 9709075.
- ^ Peterson MD, Gordon PM, Hurvitz EA (February 2013). «Chronic disease risk among adults with cerebral palsy: the role of premature sarcopoenia, obesity and sedentary behaviour». Obesity Reviews. 14 (2): 171–182. doi:10.1111/j.1467-789X.2012.01052.x. hdl:2027.42/96337. PMID 23094988. S2CID 26998110.
- ^ «CP and ageing». Scope. Archived from the original on 6 May 2016. Retrieved 24 December 2016.
- ^ a b Kembhavi G, Darrah J, Payne K, Plesuk D (July 2011). «Adults with a diagnosis of cerebral palsy: a mapping review of long-term outcomes». Developmental Medicine and Child Neurology. 53 (7): 610–614. doi:10.1111/j.1469-8749.2011.03914.x. PMID 21418196. S2CID 36859403.
- ^ Horsman M, Suto M, Dudgeon B, Harris SR (May 2010). «Ageing with cerebral palsy: psychosocial issues». Age and Ageing. 39 (3): 294–299. doi:10.1093/ageing/afq018. PMID 20178997.
- ^ Odding E, Roebroeck ME, Stam HJ (February 2006). «The epidemiology of cerebral palsy: incidence, impairments and risk factors». Disability and Rehabilitation. 28 (4): 183–191. doi:10.1080/09638280500158422. PMID 16467053. S2CID 45640254.
- ^ Johnson, Ann (September 2002). «Prevalence and characteristics of children with cerebral palsy in Europe». Developmental Medicine and Child Neurology. 44 (9): 633–640. doi:10.1111/j.1469-8749.2002.tb00848.x. PMID 12227618. S2CID 221649047.
- ^ Dalembert G, Brosco JP (June 2013). «Do politics affect prevalence? An overview and the case of cerebral palsy». Journal of Developmental and Behavioral Pediatrics. 34 (5): 369–374. doi:10.1097/DBP.0b013e31829455d8. PMID 23751888. S2CID 41883040.
- ^ «Proposed definition and classification of cerebral palsy, April 2005». Developmental Medicine & Child Neurology. 47 (8): 571. 2007. doi:10.1111/j.1469-8749.2005.tb01195.x. S2CID 221650919.[dead link]
- ^ McIntyre S, Goldsmith S, Webb A, Ehlinger V, Hollung SJ, McConnell K, et al. (December 2022). «Global prevalence of cerebral palsy: A systematic analysis». Developmental Medicine and Child Neurology. 64 (12): 1494–1506. doi:10.1111/dmcn.15346. PMC 9804547. PMID 35952356. S2CID 251516376.
- ^ Hirtz D, Thurman DJ, Gwinn-Hardy K, Mohamed M, Chaudhuri AR, Zalutsky R (January 2007). «How common are the «common» neurologic disorders?». Neurology. 68 (5): 326–337. doi:10.1212/01.wnl.0000252807.38124.a3. PMID 17261678. S2CID 208246679.
- ^ «The Definition and Classification of Cerebral Palsy». Developmental Medicine & Child Neurology. 49: 1–44. 28 June 2008. doi:10.1111/j.1469-8749.2007.00201.x. S2CID 221645066.
- ^ «Access Economics (2008) The Economic Impact of Cerebral Palsy in Australia in 2007. Access Economics, Canberra, ACT». Archived from the original on 21 November 2008.
- ^ Centers for Disease Control Prevention (CDC) (January 2004). «Economic costs associated with mental retardation, cerebral palsy, hearing loss, and vision impairment—United States, 2003». MMWR. Morbidity and Mortality Weekly Report. 53 (3): 57–59. PMID 14749614. Archived from the original on 19 September 2007. Retrieved 12 August 2007.
- ^ «Medicaid.gov: Self Directed Services». Medicaid. Archived from the original on 19 June 2017. Retrieved 19 June 2017.
- ^ «NIRAMAYA Ministry of Social Justice and Empowerment (MSJE)». thenationaltrust.gov.in. Archived from the original on 27 February 2017. Retrieved 27 February 2017.
- ^ Siva M, Nalinakanthi V (29 November 2015). «The Big Story. Financially able». The Hindu Business Line.
- ^ «Definition of Cerebral». 2021.
- ^ «Bell’s Palsy & Other Facial Nerve Problems». 2020.
- ^ Shevell M (December 2018). «Cerebral palsy to cerebral palsy spectrum disorder: Time for a name change?». Neurology: 10.1212/WNL.0000000000006747. doi:10.1212/WNL.0000000000006747. PMID 30568002. S2CID 58605985.
- ^ «Cerebral Palsy: a Guide for Care». Archived from the original on 17 July 2007. Retrieved 29 July 2007.
- ^ a b Brindle D (22 May 2002). «A very telling tale». The Guardian. London. Archived from the original on 29 July 2016. Retrieved 6 December 2016.
- ^ Zimmer B (5 February 2007). «A brief history of «spaz»«. Language Log. University of Pennsylvania. Archived from the original on 9 August 2007. Retrieved 29 July 2007.
- ^ Erickson G (22 May 2007). «DVD Savant Review: Goodbye CP». DVDtalk. Archived from the original on 30 April 2011.
- ^ Borah P (28 June 2011). «Movie with a twist». The Hindu. Chennai, India. Archived from the original on 27 September 2013.
- ^ Alawadhi N (26 March 2011). «Charting unexplored territory in Indian cinema». The Hindu. Chennai, India. Archived from the original on 27 September 2013.
- ^ Rai A (3 January 2012). «spandan» «Review of Marathi Film «SPANDAN»«. The Newsleak.in.[dead link]
- ^ «Vegitha, carving a niche for herself». The Deccan Chronicle. 7 June 2011. Archived from the original on 9 June 2011.
- ^ Champlin C (21 December 1989). «My Left Foot». Los Angeles Times.
- ^ «Being on Call the Midwife gave me the sense of being an actor in my own right». 16 February 2014. Archived from the original on 5 September 2015. Retrieved 12 August 2015.
- ^ Rovenstine D (20 September 2016). «Micah Fowler is the breakout star of Speechless». EntertainmentWeekly. Archived from the original on 24 September 2016. Retrieved 3 October 2016.
- ^ Kacala A (12 April 2019). «‘Special’: Groundbreaking new Netflix series stars gay man with cerebral palsy». NBC News. Retrieved 22 April 2019.
- ^ Houston M (12 February 2019). «‘I don’t think I’ve ever seen a disabled character written like that before’«. Sydney Morning Herald. Archived from the original on 16 October 2020. Retrieved 17 October 2020.
- ^ «Neil Young». Biography. Retrieved 17 October 2019.
- ^ «Neil Young Files for Divorce From Pegi Young». Rolling Stone. 26 August 2014. Retrieved 17 October 2019.
- ^ Michaels S (27 August 2014). «Neil Young files for divorce from Pegi, his wife of 36 years». The Guardian. ISSN 0261-3077. Retrieved 17 October 2019.
- ^ «The Driver — Nicolas Hamilton». nicolashamilton. Archived from the original on 3 June 2020. Retrieved 3 June 2020.
- ^ «Comedian Geri Jewell headlines diversity event». WMU News. 16 May 2002. Archived from the original on 7 March 2012. Retrieved 6 December 2010.
- ^ «Josh Blue wins «Last Comic Standing»«. Archived from the original on 28 June 2010. Retrieved 6 December 2010.
- ^ ««Last Comic Standing» biography». Archived from the original on 13 September 2010. Retrieved 6 December 2010.
- ^ «Jason Benetti Is Voice of Hope in Face of Cerebral Palsy». Archived from the original on 17 March 2013.
- ^ «Britain’s Got Talent: Jack Carroll to coin it with TV show, DVD and book deals». The Mirror. 8 June 2013. Archived from the original on 2 August 2013. Retrieved 1 August 2013.
- ^ «Pageant Is Her Crowning Achievement: Miss Iowa, In Las Vegas For Miss USA Pageant, Was Born With Cerebral Palsy». Las Vegas: CBS. 10 April 2008. Archived from the original on 6 November 2008. Retrieved 5 June 2010.
- ^ Lewis T (7 August 2011). «Comedian Francesca Martinez: «Surely I can’t be more unfunny than Patsy Palmer»«. The Guardian. London. Archived from the original on 3 February 2013.
- ^ «O’Hanlon heads to Melbourne in career-best form». Athletics Australia. 1 March 2012. Archived from the original on 24 April 2012. Retrieved 18 April 2012.
- ^ «HarperCollins Publishers India Ltd». Archived from the original on 11 June 2011.
- ^ Franks T (7 July 2008). «Jerusalem Diary: Monday 7 July». BBC News. Archived from the original on 11 May 2009.
- ^ Heydarpour R (21 November 2006). «The Comic Is Palestinian, the Jokes Bawdy». The New York Times. Archived from the original on 21 November 2012. Retrieved 22 March 2011.
Ms. Zayid, who has a home in Cliffside Park, N.J., recently returned from Hollywood, where she lived while working on developing her one-woman show.
- ^ IMEU (18 October 2013). «Maysoon Zayid: Actor and Comedian». Institute for Middle East Understanding. Archived from the original on 23 December 2016. Retrieved 8 December 2016.
- ^ «Celebrity Ambassadors». Archived from the original on 9 June 2015. Retrieved 18 June 2015.
- ^ «REVIEW: Zach Anner’s If at Birth You Don’t Succeed Is an Inspiring, Hilarious Memoir About One Man’s Life with Cerebral Palsy». People. 11 March 2016. Retrieved 6 December 2016.
- ^ ABS Staff (4 June 2014). «10 Celebrities With Physical Deformities You May Have Never Noticed». Atlanta Black Star. Archived from the original on 21 December 2016. Retrieved 8 December 2016.
- ^ «IPC Athletics Records». www.paralympic.org. Archived from the original on 10 September 2012. Retrieved 10 September 2012.
- ^ «Paralympics 2012: Cockroft wins first GB track gold». BBC Sport. 31 August 2012. Archived from the original on 1 September 2012. Retrieved 1 September 2012.
- ^ «Paralympics 2012: Hannah Cockroft wins second sprint gold». BBC Sport. 6 September 2012. Archived from the original on 8 September 2012. Retrieved 6 September 2012.
- ^ «Perspectives on Disability». Library Journal. Retrieved 29 April 2020.
- ^ «‘They wanted to drown me at birth — now I’m a poet’«. BBC News. 29 August 2020. Retrieved 4 November 2020.
- ^ «Lord of Glencoe Simon Stevens». simonstevens.com. Archived from the original on 19 May 2001. Retrieved 1 July 2021.
- ^ Leon, E.F. (1948). «The Imbecillitas of the Emperor Claudius», Transactions and Proceedings of the American Philological Association, 79 79–86.JSTOR 283354
- ^ «Cerebral Palsy Litigation». Radio National. 10 October 2005. Archived from the original on 22 February 2017. Retrieved 21 February 2017.
External links[edit]
- Cerebral palsy at Curlie
- Cerebral Palsy Information Page at NINDS
Детский церебральный паралич (ДЦП) — это понятие, объединяющее группу двигательных расстройств, возникающих вследствие повреждения различных мозговых структур в перинатальном периоде. Детский церебральный паралич может включать моно-, геми-, пара-, тетра- параличи и парезы, патологические изменения мышечного тонуса, гиперкинезы, нарушения речи, шаткость походки, расстройства координации движений, частые падения, отставание ребенка в моторном и психическом развитии. При ДЦП могут наблюдаться нарушения интеллекта, психические расстройства, эпилепсия, нарушения слуха и зрения. Диагностируется детский церебральный паралич преимущественно по клиническим и анамнестическим данным. Алгоритм обследования ребенка с ДЦП направлен на выявление сопутствующей патологии и исключение другой врожденной или послеродовой патологии. Люди, имеющие детский церебральный паралич, должны пожизненно проходить реабилитационную терапию, по мере необходимости получать медикаментозное, хирургическое и физиотерапевтическое лечение.
Общие сведения
Согласно мировой статистике детский церебральный паралич встречается с частотой 1,7-7 случаев на 1000 детей до года. В России этот показатель по различным данным составляет 2,5-6 случаев на 1000 детей. Среди недоношенных детей заболеваемость ДЦП в 10 раз выше среднестатистической. По данным последних исследований около 40-50% детей с ДЦП появились на свет в результате преждевременных родов.
Если говорить о хронических заболеваниях детского возраста, то в современной педиатрии детский церебральный паралич является одной из ведущих проблем. Среди причин увеличения числа больных ДЦП совершенно справедливо называют не только ухудшение экологии, но и прогрессивное развитие неонатологии, позволяющее сейчас выхаживать младенцев с различной патологией, в том числе и недоношенных новорожденных с весом от 500г.
Детский церебральный паралич (ДЦП)
Причины возникновения ДЦП
Согласно современным представлениям детский церебральный паралич возникает в результате воздействия на ЦНС ребенка различных повреждающих факторов, обуславливающих неправильное развитие или гибель отдельных участков головного мозга. Причем действие этих факторов происходит в перинатальном периоде, т. е. до, во время и непосредственно после рождения ребенка (первые 4 недели жизни). Основное патогенетическое звено в формировании детского церебрального паралича — это гипоксия, к развитию которой и приводят различные причинные факторы ДЦП. В первую очередь при гипоксии страдают те участки головного мозга, которые отвечают за поддержание равновесия и обеспечение двигательных рефлекторных механизмов. В результате возникают типичные для ДЦП расстройства мышечного тонуса, парезы и параличи, патологические двигательные акты.
Этиологическим фактором ДЦП, действующим в период внутриутробного развития, является различная патология беременности:
- фетоплацентарная недостаточность
- преждевременная отслойка плаценты
- токсикозы
- нефропатия беременных
- резус-конфликт
- угроза прерывания беременности
а также инфекции:
- цитомегаловирус
- краснуха
- токсоплазмоз
- герпес
- сифилис.
Соматические заболевания матери (сахарный диабет, гипотиреоз, врожденные и приобретенные пороки сердца, артериальная гипертензия) и перенесенные женщиной в период беременности травмы также могут обусловить развитие детского церебрального паралича.
Факторы риска
К факторам риска развития ДЦП, влияющим на ребенка в период родов, относятся:
- тазовое предлежание плода
- стремительные роды
- преждевременные роды
- узкий таз
- крупный плод
- чрезмерно сильная родовая деятельность
- затяжные роды
- дискоординированная родовая деятельность
- длительный безводный период перед родами.
Лишь в некоторых случаях родовая травма является единственной причиной возникновения детского церебрального паралича. Зачастую тяжелые роды, приводящие к возникновению ДЦП, становятся следствием уже имеющейся внутриутробной патологии.
Основными факторами риска появления ДЦП в послеродовом периоде являются асфиксия и гемолитическая болезнь новорожденного. Приводящая к ДЦП асфиксия новорожденного может быть связана с аспирацией околоплодных вод, различными пороками развития легких, патологией беременности. Более частая послеродовая причина возникновения ДЦП состоит в токсическом поражении мозга при гемолитической болезни, развивающейся в результате несовместимости крови или иммунологического конфликта плода и матери.
Классификация ДЦП
В соответствии с местонахождением пораженного участка головного мозга в неврологии ДЦП классифицируют на 5 видов. Самой распространенной формой ДЦП является спастическая диплегия. По различным данным детский церебральный паралич этой формы составляет от 40 до 80% от общего числа случаев ДЦП. В основе этой формы ДЦП лежит поражение двигательных центров, ведущее к развитию парезов, в большей степени выраженных в ногах. При повреждении двигательных центров только одного полушария возникает гемипаретическая форма ДЦП, проявляющаяся парезом руки и ноги на стороне, противоположной пораженному полушарию.
Примерно в четверти случаев детский церебральный паралич имеет гиперкинетическую форму, связанную с повреждением подкорковых структур. Клинически данная форма ДЦП проявляется непроизвольными движениями — гиперкинезами, усиливающимися при волнении или усталости ребенка. При нарушениях в области мозжечка развивается атонически-астатическая форма детского церебрального паралича. Эта форма ДЦП проявляется нарушениями статики и координации, мышечной атонией. На ее долю приходится около 10% случаев ДЦП.
Наиболее тяжелая форма ДЦП носит название двойная гемиплегия. В этом варианте детский церебральный паралич является следствием тотального поражения обоих полушарий мозга, приводящего к мышечной ригидности, из-за которой дети не в состоянии не только стоять и сидеть, а даже самостоятельно держать голову. Встречаются также смешанные варианты детского церебрального паралича, включающие клинические симптомы, характерные для разных форм ДЦП. Например, часто наблюдается сочетание гиперкинетической формы ДЦП со спастической диплегией.
Симптомы ДЦП
Детский церебральный паралич может иметь разнообразные проявления с различной степенью выраженности. Клиническая картина ДЦП и его тяжесть зависят от локализации и глубины поражения мозговых структур. В отдельных случаях детский церебральный паралич заметен уже в первые часы жизни ребенка. Но чаще симптомы ДЦП становятся очевидными спустя несколько месяцев, когда ребенок начинает существенно отставать в нервно-психическом развитии от принятых в педиатрии норм. Первым симптомом ДЦП может быть задержка в формировании двигательных навыков. Ребенок с детским церебральным параличом долго не держит голову, не переворачивается, не интересуется игрушками, не может осознанно двигать конечностями, не удерживает игрушки. При попытке поставить ребенка с ДЦП на ноги он не ставит ногу на полную стопу, а встает на цыпочки.
Парезы при детском церебральном параличе могут быть только в одной конечности, иметь односторонний характер (рука и нога на стороне, противоположной пораженному участку мозга), охватывать все конечности. Недостаточность иннервации речевого аппарата обусловливает нарушение произносительной стороны речи (дизартрию) у ребенка с ДЦП. Если ДЦП сопровождается парезом мышц глотки и гортани, то возникают проблемы с глотанием (дисфагия). Зачастую детский церебральный паралич сопровождается значительным повышением мышечного тонуса. Выраженная спастика при ДЦП может приводить к полной обездвиженности конечности.
В дальнейшем у детей, имеющих детский церебральный паралич, происходит отставание паретичных конечностей в физическом развитии, в результате чего они становится тоньше и короче здоровых. В следствие этого формируются типичные для ДЦП деформации скелета (сколиоз, деформации грудной клетки). Кроме того, детский церебральный паралич протекает с развитием контрактур суставов в паретичных конечностях, что усугубляет двигательные нарушения. Расстройства моторики и деформации скелета у детей с ДЦП приводят к появлению хронического болевого синдрома с локализацией болей в плечах, шее, спине и ступнях.
Детский церебральный паралич гиперкинетической формы проявляется внезапно возникающими непроизвольными двигательными актами: поворотами или кивками головой, подергиваниями, появлением гримас на лице, вычурными позами или движениями. Для атонически-астатической формы ДЦП характерны дискоординированные движения, неустойчивость при ходьбе и в положении стоя, частые падения, мышечная слабость и тремор.
При детском церебральном параличе может наблюдаться косоглазие, функциональные нарушения ЖКТ, расстройства дыхательной функции, недержание мочи. Примерно в 20-40% случаев детский церебральный паралич протекает с эпилепсией. До 60% детей с ДЦП имеют проблемы со зрением. Возможна тугоухость или полная глухота. В половине случаев детский церебральный паралич сочетается с эндокринной патологией (ожирением, гипотиреозом, задержкой роста и др.).
Часто детский церебральный паралич сопровождается различной степенью олигофрении, задержкой психического развития, расстройством восприятия, нарушениями способности к обучению, отклонениями в поведении и т. п. Однако до 35% детей с ДЦП имеют нормальный интеллект, а в 33% случаев ДЦП нарушения интеллекта выражены в легкой степени.
Детский церебральный паралич является хроническим, но не прогрессирующим заболеванием. По мере роста ребенка и развития его ЦНС могут выявляться ранее скрытые патологические проявления, которые создают ощущение так называемой «ложной прогрессии» заболевания. Ухудшение состояния ребенка с ДЦП также может быть обусловлено вторичными осложнениями: эпилепсией, инсультом, кровоизлиянием, применением наркоза или тяжелым соматическим заболеванием.
Диагностика ДЦП
Пока не существует специальных диагностических критериев детского церебрального паралича. Однако некоторые типичные для ДЦП симптомы сразу обращают на себя внимание педиатра. К ним относятся: низкий бал, выставляемый по шкале Апгар сразу же после рождения ребенка, аномальная двигательная активность, нарушения мышечного тонуса, отставание ребенка в психофизическом развитии, отсутствие контакта с матерью. Подобные признаки всегда настораживают врачей в отношении ДЦП и являются показанием к обязательной консультации ребенка детским неврологом.
При подозрении на детский церебральный паралич необходим тщательный неврологический осмотр ребенка. В диагностике ДЦП также используются электрофизиологические методы обследования:
- электроэнцефалография
- электромиография и электронейрография
- исследование вызванных потенциалов
- транскраниальная магнитная стимуляция.
Они помогают дифференцировать ДЦП от наследственных неврологических заболеваний, проявляющихся на 1-ом году жизни (врожденной миопатии, атаксии Фредрейха, синдрома Луи-Бар и др). Использование в диагностике ДЦП нейросонографии и МРТ головного мозга позволяют выявить сопутствующие ДЦП органические изменения (например, атрофию зрительных нервов, очаги кровоизлияний или ишемии, перивентрикулярную лейкомаляцию) и диагностировать пороки развития головного мозга (микроцефалию, врожденную гидроцефалию и пр.).
Полная диагностика ДЦП может потребовать участия детского офтальмолога, детского отоларинголога, эпилептолога, детского ортопеда, логопеда и психиатра. При необходимости дифференцировать ДЦП от различных наследственных и обменных заболеваний применяются соответствующие генетические исследования и биохимические анализы.
Реабилитационное лечение ДЦП
К сожалению, пока детский церебральный паралич относится к неизлечимой патологии. Однако своевременно начатые, комплексно и беспрерывно проводимые реабилитационные мероприятия могут значительно развить доступные ребенку с ДЦП моторные, интеллектуальные и речевые навыки. Благодаря реабилитационному лечению можно максимально компенсировать имеющийся при ДЦП неврологический дефицит, уменьшить вероятность появления контрактур и скелетных деформаций, научить ребенка навыкам самообслуживания и улучшить его адаптацию. Наиболее активно развитие мозга, познавательный процесс, приобретение навыков и обучение происходят в возрасте до 8 лет. Именно в этот период при ДЦП необходимо прилагать максимальные усилия по реабилитации.
Программа комплексной реабилитационной терапии разрабатывается индивидуально для каждого больного ДЦП. Она учитывает локализацию и тяжесть поражения мозга; наличие сопутствующих ДЦП нарушений слуха и зрения, расстройств интеллекта, эпилептических припадков; индивидуальные возможности и проблемы больного ДЦП ребенка. Наиболее затруднительно проведение реабилитационных мероприятий при сочетании ДЦП с нарушениями познавательной деятельности (в том числе в следствие слепоты или глухоты) и интеллекта. Для таких случаев ДЦП разработаны специальные методики, позволяющие инструктору наладить контакт с ребенком. Дополнительные сложности в лечении ДЦП возникают у пациентов с эпилепсией, при которой активная стимулирующая терапия ДЦП может вызывать развитие осложнений. По этой причине дети с ДЦП и эпилепсией должны проходить реабилитацию с применением специальных «мягких» методов.
Основу реабилитационного лечения при детском церебральном параличе составляют ЛФК и массаж. Важно, чтобы детям с ДЦП они проводились ежедневно. По этой причине родителям ребенка с детским церебральным параличом следует овладеть навыками массажа и проведения ЛФК. В таком случае они смогут самостоятельно заниматься с ребенком в период между курсами профессиональной реабилитации ДЦП.
Для более эффективных занятий ЛФК и механотерапии с детьми, страдающими детским церебральным параличом, в соответствующих реабилитационных центрах имеются специальные аппараты и приспособления. Из последних разработок в этой области в лечении ДЦП нашли применение пневмокомбинизоны, фиксирующие суставы и обеспечивающие растяжение мышц, а также специальные костюмы, позволяющие при некоторых формах ДЦП выработать правильный двигательный стереотип и уменьшить спастику мышц. Подобные средства помогают максимально задействовать компенсаторные механизмы нервной системы, что зачастую приводит к освоению больным ДЦП ребенком новых, ранее не доступных для него, движений.
К реабилитационным мероприятиям при ДЦП относятся также так называемые технические средства реабилитации: ортодезы, вставки в обувь, костыли, ходунки, инвалидные коляски и т. п. Они позволяют компенсировать имеющиеся при ДЦП двигательные нарушения, укорочения конечностей и деформации скелета. Важное значение имеет индивидуальный подбор таких средств и обучение ребенка, имеющего детский церебральный паралич, навыкам их использования.
В рамках реабилитационного лечения детского церебрального паралича ребенку с дизартрией требуются логопедические занятия по коррекции ФФН или ОНР.
Медикаментозное и хирургическое лечение ДЦП
Лечение ДЦП при помощи лекарственных препаратов является в основном симптоматическим и направлено на купирование конкретного симптома ДЦП или возникших осложнений. Так, при сочетании ДЦП с эпилептическими припадками назначаются антиконвульсанты, при повышении мышечного тонуса — антиспастические препараты, при ДЦП с хроническим болевым синдромом — обезболивающие и спазмолитические средства. В медикаментозную терапию ДЦП могут входить ноотропы, метаболические препараты (АТФ, аминокислоты, глицин), неостигмин, антидепрессанты, транквилизаторы, нейролептики, сосудистые препараты.
Показанием к хирургическому лечению детского церебрального паралича являются контрактуры, образовавшиеся в результате длительной спастичности мышц и ограничивающие двигательную активность больного. Чаще всего при ДЦП применяются тенотомии, направленные на создание опорного положения парализованной конечности. Для стабилизации скелета при детском церебральном параличе может применяться удлинение костей, пересадка сухожилий и др. операции. Если детский церебральный паралич проявляется грубой симметричной мышечной спастичностью, ведущей к развитию контрактур и болевого синдрома, то для прерывания исходящей из спинного мозга патологической импульсации пациенту с ДЦП может быть проведена спинальная ризотомия.
Физиотерапевтическое лечение и анималотерапия ДЦП
Применяемые в лечении детского церебрального паралича методы физиотерапевтического воздействия прекрасно сочетаются с ЛФК и массажем. Хорошо зарекомендовали себя при ДЦП
- оксигенобаротерапия
- электростимуляция нервов и мышц
- лекарственный электрофорез
- грязелечение
- тепловые процедуры
- водолечение.
Применение при детском церебральном параличе общих ванн с теплой водой уменьшает выраженность гиперкинезов и снижает мышечный тонус при спастике. Из водных процедур при ДЦП назначаются хвойные, кислородные, радоновые, скипидарные и йодобромные ванны, фитованны с валерианой.
Относительно новым способом терапии детского церебрального паралича является анималотерапия — лечение посредством общения больного с животным. К наиболее распространенным методикам анималотерапии ДЦП на сегодняшний день относятся иппотерапия ДЦП (лечение с использованием лошадей) и дельфинотерапия ДЦП. Во время проведения подобных лечебных сеансов с имеющим детский церебральный паралич ребенком одновременно работают инструктор и психотерапевт. В основе терапевтического воздействия указанных методик лежат:
- благоприятная эмоциональная атмосфера
- установление особого контакта между больным ДЦП и животным
- стимуляция мозговых структур через насыщенные тактильные ощущения
- постепенное расширение речевых и двигательных навыков.
Социальная адаптация при ДЦП
Не смотря на значительные двигательные нарушения, многие имеющие детский церебральный паралич дети могут быть успешно адаптированы в обществе. Огромную роль в этом играют родители и родные ребенка с ДЦП. Но для эффективного решения этой задачи им необходима помощь специалистов: реабилитологов, психологов и коррекционных педагогов, непосредственно занимающихся детьми с ДЦП. Они работают над тем, чтобы ребенок с ДЦП максимально освоил доступные для него навыки самообслуживания, приобрел соответствующие его возможностям знания и умения, постоянно получал психологическую поддержку.
Социальной адаптации при диагнозе детский церебральный паралич в большой степени способствует занятия в специализированных детсадах и школах, а в дальнейшем в специально созданных обществах. Их посещение расширяют познавательные возможности, дают ребенку и взрослому с ДЦП возможность общаться и вести активную жизнь. При отсутствии нарушений, значительно ограничивающих двигательную активность и интеллектуальные возможности, взрослые люди с ДЦП могут вести самостоятельную жизнь. Такие пациенты с ДЦП успешно трудятся и могут создать свою семью.
Прогноз и профилактика ДЦП
Прогноз в отношении детского церебрального паралича прямо зависит от формы ДЦП, своевременности и беспрерывности проводимого реабилитационного лечения. В некоторых случаях ДЦП приводит к глубокой инвалидности. Но чаще стараниями медиков и родителей ребенка с ДЦП удается до определенной степени компенсировать имеющиеся нарушения, поскольку растущий и развивающийся головной мозг детей, в том числе и ребенка с ДЦП, обладает значительным потенциалом и гибкостью, благодаря которым здоровые участки мозговой ткани могут брать на себя функции поврежденных структур.
Профилактика ДЦП в дородовом периоде состоит в корректном ведении беременности, позволяющем вовремя диагностировать угрожающие плоду состояния и предупредить развитие гипоксии плода. В последующем важное значение для профилактики ДЦП имеет выбор оптимального способа родоразрешения и правильное ведение родов.
Детский церебральный паралич на разных языках пишется и называется по разному. Давайте посмотрим, этот диагноз называется на разных языках мира.
| На каком языке | Перевод |
| Русский | детский церебральный паралич |
| Украинский | дитячий церебральний параліч |
| Белорусский | дзіцячы цэрэбральны параліч |
| Казахский | церебралды шалдығу |
| Английский | cerebral palsy |
| Французский | paralysie cérébrale |
| Немецкий | Zerebralparese |
| Турецкий | serebral palsi |
| Греческий | εγκεφαλική παράλυση |
| Иврит | שיתוק מוחין |
| Испанский | parálisis cerebral |
| Итальянский | paralisi cerebrale |
| Латинский | cerebri paralyticus |
| Шведский | cerebral parese |
И всегда помните, ДЦП — это не приговор. Этот диагноз преодолим и на своем сайте мы рассказываем о людях, победивших ДЦП.